Замещенные индазол-о-глюкозиды
Номер патента: 10655
Опубликовано: 30.10.2008
Авторы: Чжан Сяоянь, Пател Мона, Рибжински Филип, Урбански Мод
Формула / Реферат
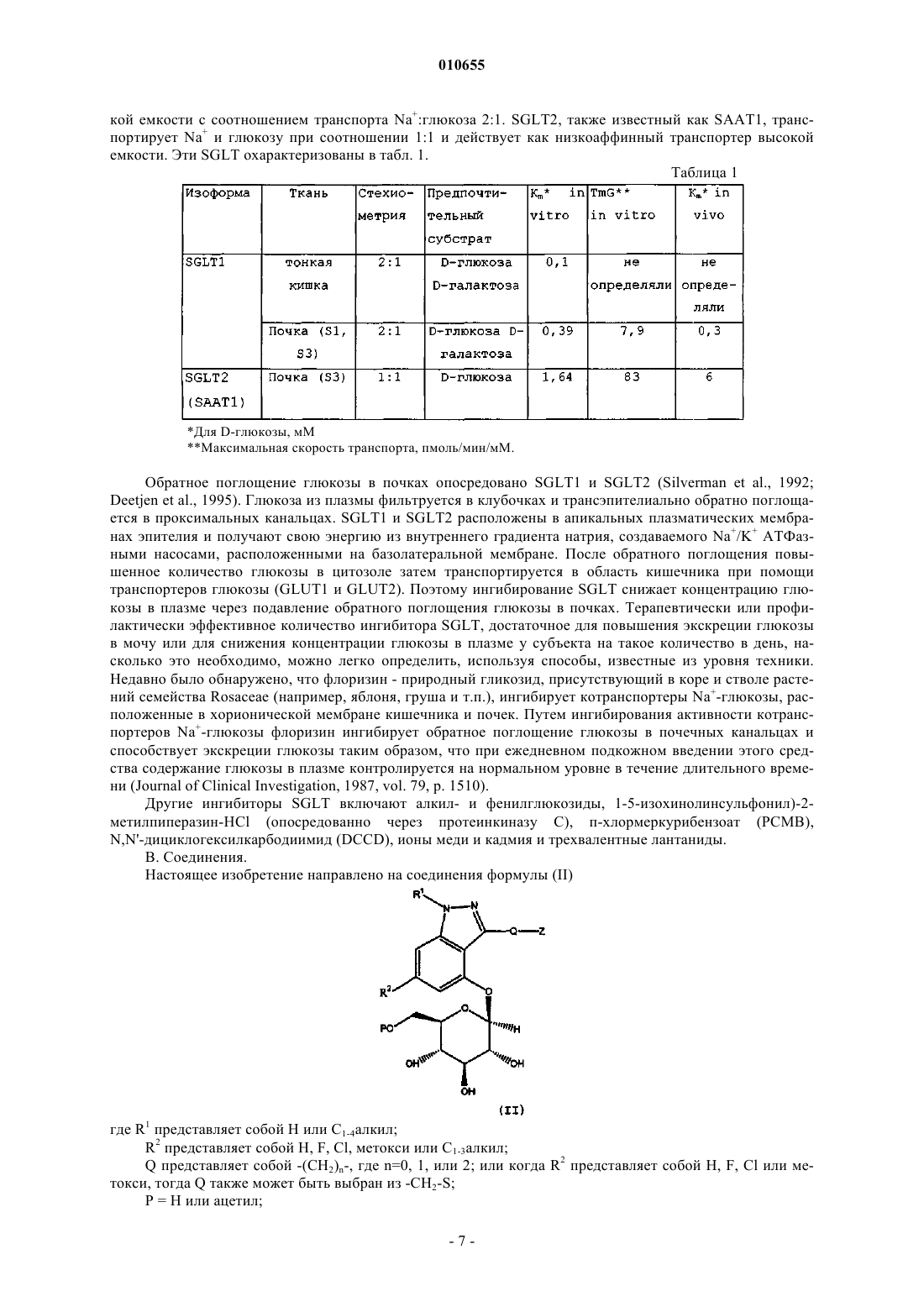
1. Соединение формулы (II)
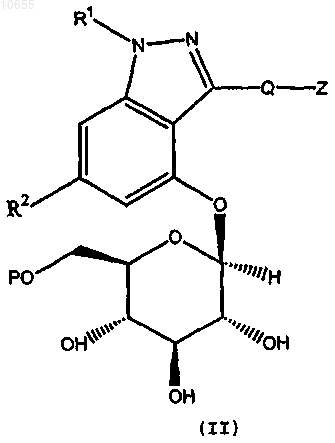
где R1 представляет собой Н или C1-4алкил;
R2 представляет собой Н, F, Cl, метокси или C1-3алкил;
Q представляет собой -(CH2)n-, где n=0, 1, или 2; или когда R2 представляет собой Н, F, Cl или метокси, тогда Q может быть также выбран из -CH2-S;
Z является замещенным или незамещенным и выбран из C3-7циклоалкила, фенила, бензгидрила,
5- или 6-членного гетероарила, содержащего 1 или 2 гетероатома, независимо выбранных из N, О и S, биарила и 9- или 10-членного конденсированного бициклила и конденсированного гетеробициклила, где указанный конденсированный гетеробициклил содержит от 1 до 4 гетероатомов, независимо выбранных из N, О и S;
Р = Н или ацетил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R1 представляет собой Н.
3. Соединение по п.1, где R2 представляет собой Н, метил или этил.
4. Соединение по п.1, где Q представляет собой -(СН2)n- и n представляет собой 1 или 2.
5. Соединение по п.1, где Z независимо замещен 1-3 заместителями, независимо выбранными из C1-4алкокси, C1-4алкила, C3-6циклоалкила, галогена, гидрокси, циано, амино, C1-4алкилтио, C1-4аминоалкила, моно- или ди(С1-4алкил)амино, фенила, 5-6-членного гетероциклила, содержащего от 1 до 3 гетероатомов, независимо выбранных из N, S и О; и где заместитель (заместители) у Z могут быть дополнительно независимо замещены 1-3 заместителями, независимо выбранными из C1-4алкокси, C1-4алкила, галогена, гидрокси, циано, амино, C1-4алкилтио, фенокси, -CONRaRb, -NHSO2Ra и -SO2NRaRb, где каждый Ra и Rb независимо выбран из Н и C1-4алкила.
6. Соединение по п.1, где Z представляет собой фенил, циклопентил, циклогексил, 4-замещенный циклогексил, 2- или 3-замещенный циклопентил, 4-замещенный фенил, 3,4-дизамещенный фенил, замещенный тиофенил, тиофенил, биарил, бензофуранил, дигидробензофуранил, 4-замещенный пиридил, бензо[b]тиенил, бензотиофенил, инданил, нафтил, 5,6,7,8-тетрагидронафтил, 1,2,3,4-тетрагидронафтил или бензо[1,4]диоксан.
7. Соединение по п.5, где Z является незамещенным или замещен 1-2 заместителями, независимо выбранными из метокси, этокси, фтора, хлора, метила, этила, пропила, изопропила, циклопропила и фенила.
8. Соединение по п.1, где Z представляет собой бифенил, 4-этилфенил, (4-пропил)фенил, 4-метоксифенил, 4-этоксифенил, 4-метилтиофенил, бензофуран-5-ил, дигидробензофуран-5-ил, нафтил или дигидробензофуран-6-ил или (5-этилтио)фенил.
9. Соединение по п.1, где R1 представляет собой Н и R2 представляет собой Н, метил, этил, пропил или изопропил.
10. Соединение по п.1, где Q представляет собой -(CH2)n-; n представляет собой 1 или 2 и R2 представляет собой Н, метил или этил.
11. Соединение по п.10, где R1 представляет собой метил.
12. Соединение по п.2, где R2 представляет собой Н, метил или этил; где Q представляет собой -(СН2)n- и n представляет собой 1 или 2; Z представляет собой фенил, циклопентил, циклогексил, 4-замещенный циклогексил, 2- или 3-замещенный циклопентил, 4-замещенный фенил, 3,4-дизамещенный фенил, замещенный тиофен, тиофенил, биарил, бензофуранил, дигидробензофуранил, 4-замещенный пиридил, бензо[b]тиенил, бензотиофенил, инданил, нафтил, 5,6,7,8-тетрагидронафтил, 1,2,3,4-тетрагидронафтил или бензо[1,4]диоксан; и где Z является незамещенным или замещен 1-2 заместителями, независимо выбранными из метокси, этокси, фтора, хлора, метила, этила, пропила, изопропила, циклопропила, фенила.
13. Соединение по п.1, где R2 представляет собой Н, метил или этил; где Q представляет собой -(CH2)n-; n представляет собой 1 или 2 и Z представляет собой бифенил, 4-этилфенил, (4-пропил)фенил, 4-метоксифенил, 4-этоксифенил, 4-метилтиофенил, бензофуран-5-ил, дигидробензофуран-5-ил, нафтил или дигидробензофуран-6-ил или (5-этилтио)фенил.
14. Соединение по п.1, выбранное из
2-{3-[2-(2,3-дигидробензофуран-5-ил)этил]-6-метил-1Н-индазол-4-илокси}-b-D-глюкопиранозида;
2-[3-(2-бензофуран-5-илэтил)-6-метил-1Н-индазол-4-илокси]-b-D-глюкопиранозида;
2-{3-[2-(2,3-дигидробензофуран-5-ил)этил]-1,6-диметил-1Н-индазол-4-илокси}-b-D-глюкопиранозида;
2-{3-[2-(2,3-дигидробензофуран-5-ил)этил]-6-этил-1Н-индазол-4-илокси}-b-D-глюкопиранозида и
2-[3-(4-метоксибензил)-6-метил-1Н-индазол-илокси]-b-D-глюкопиранозида.
15. Соединение по п.1, выбранное из
2-[3-(2-бензофуран-5-илэтил)-1Н-индазол-4-илокси]-b-D-глюкопиранозида;
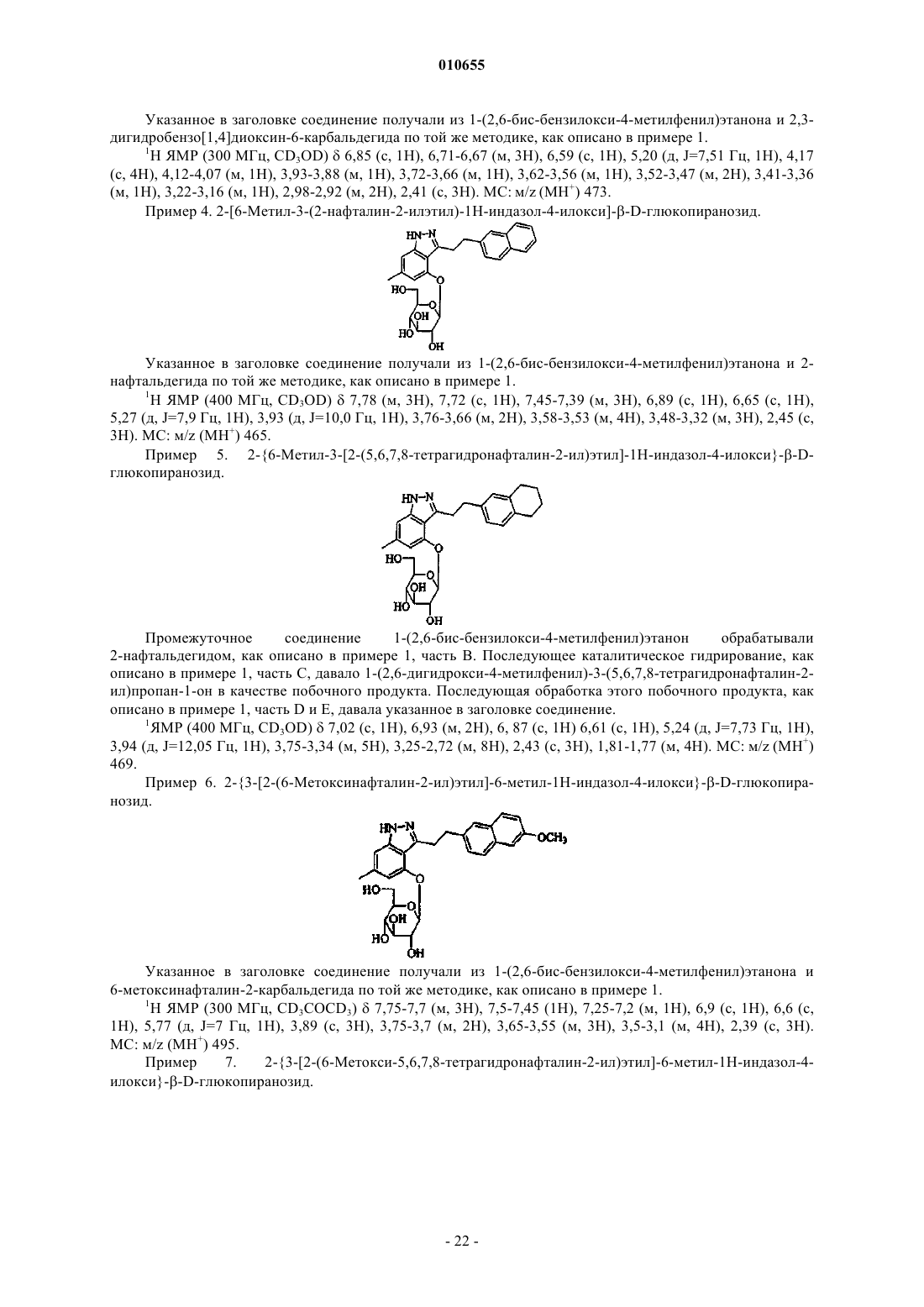
2-{3-[2-(6-метоксинафталин-2-ил)этил]-6-метил-1Н-индазол-4-илокси}-b-D-глюкопиранозида;
2-{3-[2-(2,3-дигидробензо[1,4]диоксин-6-ил)этил]-6-метил-1Н-индазол-4-илокси}-b-D-глюкопиранозида;
2-{3-[2-(4-этоксифенил)этил]-6-метил-1Н-индазол-4-илокси}-b-D-глюкопиранозида;
2-{6-метил-3-[2-(5,6,7,8-тетрагидронафталин-2-ил)этил]-1Н-индазол-4-илокси}-b-D-глюкопиранозида;
2-[6-метил-3-(2-нафталин-2-илэтил)-1Н-индазол-4-илокси]-b-D-глюкопиранозида;
2-{3-[2-(4-метоксифенил)этил]-6-метил-1Н-индазол-4-илокси}-b-D-глюкопиранозида;
2-{3-[2-(6-метокси-5,6,7,8-тетрагидронафталин-2-ил)этил]-6-метил-1Н-индазол-4-илокси}-b-D-глюкопиранозида и
2-[3-(2-бензофуран-5-илэтил)-6-метил-1Н-индазол-4-илокси]-6-O-ацетил-b-D-глюкопиранозида.
16. Соединение по п.1, выбранное из
2-{3-[2-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)этил]-6-метил-1Н-индазол-4-илокси}-b-D-глюкопиранозида;
2-{3-[2-(4-хлорфенил)этил]-6-метил-1Н-индазол-4-илокси}-b-D-глюкопиранозида;
2-[3-(4-метоксифенилсульфанилметил)-1Н-индазол-4-илокси]-b-D-глюкопиранозида;
2-[3-(2-циклогексилэтил)-6-метил-1Н-индазол-4-илокси]-b-D-глюкопиранозида;
2-[3-(2,3-дигидробензофуран-5-илметил)-6-метил-1Н-индазол-4-илокси]-b-D-глюкопиранозида;
2-{3-[2-(4-трифторметилфенил)этил]-6-метил-1Н-индазол-4-илокси}-b-D-глюкопиранозида;
2-{3-[2-(4-метансульфониламинофенил)этил]-6-метил-1Н-индазол-4-илокси}-b-D-глюкопиранозида и
2-{3-[2-(2,3-дигидробензофуран-5-ил)этил]-6-метил-1Н-индазол-4-илокси}-6-O-ацетил-b-D-глюкопиранозида.
17. Соединение по п.1, выбранное из
2-[3-(4-этилбензил)-6-метил-1Н-индазол-4-илокси]-b-D-глюкопиранозида;
2-[6-метил-3-(4-пропилбензил)-1Н-индазол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-метилсульфанилбензил)-6-метил-1Н-индазол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-бифенил)-6-метил-1Н-индазол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-циклопропилбензил)-6-метил-1Н-индазол-4-илокси]-b-D-глюкопиранозида и
2-[3-(5-этилтиофен-2-илметил)-6-метил-1Н-индазол-4-илокси]-b-D-глюкопиранозида.
18. Соединение по п.1, выбранное из
2-{3-[2-(2,3-дигидробензофуран-5-ил)этил]-6-метил-1Н-индазол-4-илокси}-b-D-глюкопиранозида;
2-[3-(2-бензофуран-5-илэтил)-6-метил-1Н-индазол-4-илокси]-b-D-глюкопиранозида;
2-[3-(4-этилбензил)-6-метил-1Н-индазол-4-илокси]-b-D-глюкопиранозида и
2-[3-(5-этилтиофен-2-илметил)-6-метил-1Н-индазол-4-илокси]-b-D-глюкопиранозида.
19. Фармацевтическая композиция, включающая соединение по пп.1, 5, 6, 11, 12, 14-17 или 18, и фармацевтически приемлемый носитель.
20. Фармацевтическая композиция, включающая соединение по п.14.
21. Способ лечения диабета у млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении, эффективного количества фармацевтической композиции по п.19.
22. Способ по п.21, где указанный диабет представляет собой диабет типа II.
23. Способ снижения содержания глюкозы в сыворотке млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении, эффективного количества фармацевтической композиции по п.19.
24. Способ лечения пониженной толерантности к глюкозе у млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении, эффективного количества фармацевтической композиции по п.19.
25. Способ лечения или ингибирования пониженной толерантности к глюкозе у млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении, эффективного количества фармацевтической композиции по п.19.
26. Способ снижения индекса массы тела, массы тела или процентного содержания жира в организме млекопитающего, включающий введение млекопитающему, нуждающемуся в лечении, эффективного количества фармацевтической композиции по п.19.
27. Способ по п.26, где указанное снижение индекса массы тела представляет собой способ лечения ожирения или состояния избыточной массы тела.
28. Способ ингибирования транспортера натрия-глюкозы в клетке путем воздействия на указанную клетку соединения по п.1 или его метаболита.
29. Способ лечения диабета, или синдрома X, или связанных с ними симптомов или осложнений у субъекта, включающий:
(a) введение указанному субъекту совместно эффективного количества соединения формулы (II) по п.1; и
(b) введение указанному субъекту совместно эффективного количества второго антидиабетического средства,
при этом указанное совместное введение осуществляют в любом порядке, и совместно эффективные количества обеспечивают желаемый терапевтический эффект.
30. Способ по п.29, где диабет, или синдром X, или связанные с ними симптомы или осложнения выбраны из IDDM, NIDDM, IGT, IFG, ожирения, нефропатии, невропатии, ретинопатии, атеросклероза, синдрома поликистоза яичников, гипертензии, ишемии, удара, заболевания сердца, синдрома раздраженной толстой кишки, воспаления и катаракты.
31. Способ по п.29, где диабет, или синдром X, или связанные с ними симптомы или осложнения представляют собой IDDM.
32. Способ по п.29, где диабет, или синдром X, или связанные с ними симптомы или осложнения представляют собой NIDDM.
33. Способ по п.29, где диабет, или синдром X, или связанные с ними симптомы или осложнения представляют собой IGT или IFG.
34. Способ по п.29, дополнительно включающий введение указанному субъекту совместно эффективного количества третьего антидиабетического средства.
35. Способ по п.34, где третье антидиабетическое средство выбрано из
(аа) инсулинов,
(bb) аналогов инсулина;
(cc) модуляторов секреции инсулина и
(dd) средств, усиливающих секрецию инсулина.
36. Способ по п.29, где соединение формулы (II) представляет собой ингибитор SGLT.
37. Способ по п.36, где соединение формулы (II) представляет собой ингибитор SGLT1.
38. Способ по п.36, где соединение формулы (II) представляет собой ингибитор SGLT2.
39. Способ по п.36, где соединение формулы (II) представляет собой оптический изомер, энантиомер, диастереомер, рацемат или рацемическую смесь, сложный эфир, пролекарственную форму или фармацевтически приемлемую соль соединения формулы (II).
40. Способ по п.36, где совместно эффективное количество ингибитора SGLT составляет от около 10 до 1000 мг.
41. Способ по п.36, где совместно эффективное количество ингибитора SGLT представляет собой количество, достаточное для снижения содержания глюкозы в плазме после приема пищи.
42. Способ ингибирования начала развития диабета, или синдрома X, или связанных с ними симптомов или осложнений у субъекта, включающий:
(a) введение указанному субъекту совместно эффективного количества соединения формулы (II) по п.1; и
(b) введение указанному субъекту совместно эффективного количества второго антидиабетического средства,
при этом указанное совместное введение осуществляют в любом порядке, и совместно эффективные количества обеспечивают желаемый профилактический эффект.
43. Способ по п.42, где указанное начало развития представляет собой состояние от преддиабетического до NIDDM.
44. Фармацевтическая композиция, включающая соединение формулы (II) по п.1, второе антидиабетическое средство и фармацевтически приемлемый носитель.
45. Способ получения фармацевтической композиции, включающий объединение в одной композиции соединения формулы (II) по п.1, второго антидиабетического средства и фармацевтически приемлемого носителя.
46. Способ получения фармацевтической композиции, включающий смешивание одного или нескольких соединений формулы (II) по п.1 в сочетании со вторым антидиабетическим средством для получения лекарственного средства для лечения состояния, выбранного из IDDM, NIDDM, IGT, IFG, ожирения, нефропатии, невропатии, ретинопатии, атеросклероза, синдрома поликистоза яичников, гипертензии, ишемии, удара, заболевания сердца, синдрома раздраженной толстой кишки, воспаления и катаракты.
47. Способ ингибирования развития преддиабетического состояния у субъекта до диабетического состояния, включающий:
(a) введение указанному субъекту совместно эффективного количества соединения формулы (II) по п.1; и
(b) введение указанному субъекту совместно эффективного количества антидиабетического средства,
при этом указанное совместное введение осуществляют в любом порядке, и совместно эффективные количества обеспечивают желаемый эффект ингибирования.
48. Способ по п.47, где указанное состояние представляет собой IGT или IFG.
49. Способ по п.47, где указанное ингибирование развития преддиабетического состояния представляет собой предотвращение развития преддиабетического состояния до диабетического состояния.
50. Способ по п.47, где соединение формулы (II) представляет собой ингибитор SGLT.
51. Способ по п.47, где соединение формулы (II) необязательно содержит одну или несколько гидроксил- или диолзащитных групп или представляет собой оптический изомер, энантиомер, диастереомер, рацемат или рацемическую смесь, сложный эфир, пролекарственную форму или фармацевтически приемлемую соль соединения формулы (II).
Текст
010655 Область техники Настоящее изобретение относится к замещенным индазол-O-глюкозидам, к содержащим их композициям и к способам их применения, например, для лечения или профилактики диабета и cиндрома X. Уровень техники Диабет является хроническим расстройством, влияющим на углеводный, жировой и белковый обмен в организме животного. Сахарный диабет типа I, составляющий примерно 10% от всех случаев диабета, раньше называли инсулинзависимым сахарным диабетом ("IDDM") или юношеским диабетом. Это заболевание характеризуется прогрессивной утратой функции секреции инсулина бета-клетками поджелудочной железы. Такая характеристика также относится и к неидиопатическому, или "вторичному", диабету, первопричиной которого является заболевание поджелудочной железы. Сахарный диабет типа I ассоциируется со следующими клиническими признаками или симптомами: постоянно повышенная концентрация глюкозы в плазме или гипергликемия; полиурия; полидипсия и/или гиперфагия; хронические микрососудистые осложнения, такие как ретинопатия, нефропатия и невропатия; и макрососудистые осложнения, такие как гиперлипидемия и гипертензия, которые могут привести к потере зрения, терминальной стадии почечной недостаточности, ампутации конечностей и инфаркту миокарда. Сахарный диабет типа II (инсулиннезависимый сахарный диабет, или NIDDM) является метаболическим расстройством, характеризующимся нарушением глюкозного метаболизма и пониженной чувствительностью к инсулину. Сахарный диабет типа II обычно развивается в период полового созревания и связан с неспособностью организма утилизировать или секретировать достаточное количество инсулина. Помимо резистентности к инсулину, наблюдаемой в определенных тканях, пациенты, страдающие сахарным диабетом типа II, имеют относительную инсулиновую недостаточность - т.е. пациенты имеют более низкие уровни инсулина, чем должны быть для данной концентрации глюкозы в плазме. Сахарный диабет типа II характеризуется следующими клиническими признаками или симптомами: постоянно повышенная концентрация глюкозы в плазме или гипергликемия; полиурия; полидипсия и/или гиперфагия; хронические микрососудистые осложнения, такие как ретинопатия, нефропатия и невропатия; и макрососудистые осложнения, такие как гиперлипидемия и гипертензия, которые могут привести к потере зрения, терминальной стадии почечной недостаточности, ампутации конечностей и инфаркту миокарда. Синдром X, который также называют синдромом резистентности к инсулину (IRS), метаболическим синдромом или метаболическим синдромом X, определяют примерно в 2% случаев диагностической коронарной катетеризации. Он часто приводит к потере трудоспособности и включает симптомы или факторы риска развития сахарного диабета типа II и сердечно-сосудистых заболеваний, включая пониженную толерантность к глюкозе (IGT), пониженные уровни глюкозы натощак (IFG), гиперинсулинемию, резистентность к инсулину, дислипидемию (например, повышенный уровень триглицеридов, пониженный уровень HDL), гипертензию и ожирение. Методы терапевтического лечения пациентов с IDDM постоянно были сфокусированы на введении экзогенного инсулина, который можно получить из различных источников (например, человеческий,бычий, свиной инсулин). Использование веществ, полученных из гетерологичных видов, приводит к образованию антител против инсулина, которые обладают эффектом ограничения его активности и приводят к все большей потребности в больших дозах для достижения желаемого гипогликемического эффекта. Типичное лечение сахарного диабета типа II сфокусировано на поддержании уровня глюкозы в крови по возможности более близкого к нормальному путем изменения образа жизни, что связано с диетой и физическими упражнениями, и при необходимости, применения лечения антидиабетическими средствами, инсулином или их сочетанием. NIDDM, который нельзя контролировать при помощи диеты,лечат при помощи пероральных антидиабетических средств. Хотя резистентность к инсулину лечат не всегда и не у всех пациентов с синдромом X, тех пациентов, у которых обнаружено преддиабетическое состояние (например, IGT, IFG), когда уровни глюкозы натощак могут быть выше, чем нормальные, но еще не достигшие того критерия, когда ставится диагноз"диабет", в некоторых странах (например, в Германии) лечат метформином для профилактики диабета. Антидиабетические средства можно объединять с фармакологическими средствами для лечения сопутствующих заболеваний (например, гипотензивные средства от гипертензии, гиполипидемические средства от липидемии). Первоочередная терапия типично включает метформин и средства на основе сульфонилмочевины, а также тиазолидиндионы. Монотерапия, включающая применение метформина, является первоочередным выбором, особенно для лечения сахарного диабета типа II у пациентов, также страдающих ожирением и/или дислипидемией. Когда отсутствует соответствующая ответная реакция на метформин, часто проводят лечение метформином в сочетании с сульфонилмочевинными препаратами, тиазолидиндионами или инсулином. Монотерапия сульфонилмочевинными препаратами (включая все поколения лекарственных средств) также является традиционным вариантом лечения, который выбирают в первую очередь. Другим первоочередным вариантом лечения могут быть тиазолидиндионы. Ингибиторы альфаглюкозидазы также используют в качестве первоочередной и второстепенной терапии. Когда отсутствует-1 010655 соответствующая ответная реакция на пероральную антидиабетическую монотерапию, пациентам вводят комбинации указанных выше лекарственных средств. Когда гликемический контроль нельзя поддерживать при помощи только пероральных антидиабетических средств, применяют инсулиновую терапию,либо в виде монотерапии, либо в сочетании с пероральными антидиабетическими средствами. Одна из последних разработок в области лечения гипергликемии сфокусирована на экскреции избыточного количества глюкозы непосредственно в мочу. Было показано, что специфические ингибиторыSGLT повышают экскрецию глюкозы в мочу и снижают кровяное давление в моделях IDDM и NIDDM у грызунов. Сущность изобретения Один аспект настоящего изобретения направлен на соединения, способы и композиции для лечения или профилактики диабета, синдрома X или связанных с ними симптомов или осложнений. Более конкретно, настоящее изобретение направлено на способ лечения диабета, или синдрома X, или связанных с ними симптомов или осложнений, у субъекта, у которого обнаружено такое состояние, при этом указанный способ включает стадию введения одного или нескольких ингибиторов обратного поглощения глюкозы, раскрываемых в настоящем изобретении. В соответствии с одним аспектом настоящего изобретения указанный способ лечения может, кроме того, включать стадию введения одного или нескольких дополнительных антидиабетических средств, например, второго антидиабетического средства или второго и третьего антидиабетического средства. Другой аспект настоящего изобретения направлен на соединения формулы (II)Q представляет собой -(СН 2)n-, где n=0, 1, или 2; или когда R2 представляет собой Н, F, Cl или метокси, тогда Q может быть также выбран из -CH2-S;Z является замещенным или незамещенным и выбран из С 3-7 циклоалкила, фенила, бензгидрила,5- или 6-членного гетероарила, содержащего 1 или 2 гетероатома, независимо выбранных из N, О, и S,биарила и 9- или 10-членного конденсированного бициклила (такого как нафтил) и конденсированного гетеробициклила, где указанный конденсированный гетеробициклил содержит от 1 до 4 гетероатомов (и предпочтительно от 1 до 3 или от 1 до 2 гетероатомов), независимо выбранных из N, О и S; Р = Н или ацетил; или их фармацевтически приемлемые соли, амиды или сложные эфиры. Один аспект настоящего изобретения направлен на фармацевтическую композицию, включающую ингибитор обратного поглощения глюкозы, по меньшей мере одно дополнительное антидиабетическое средство (например, одно, два, три дополнительных антидиабетических средства) и фармацевтически приемлемый носитель. Настоящее изобретение также обеспечивает способ получения фармацевтической композиции, включающий объединение в одну композицию ингибитора обратного поглощения глюкозы,второго антидиабетического средства и фармацевтически приемлемого носителя. Способ воплощения настоящего изобретения представляет собой способ лечения диабета, или синдрома X, или связанных с ними симптомов или осложнений у субъекта, при этом указанный способ включает введение указанному субъекту совместно эффективного количества ингибитора обратного поглощения глюкозы и введение указанному субъекту совместно эффективного количества второго антидиабетического средства, при этом указанное совместное введение обеспечивает желаемый терапевтический эффект. Другой способ воплощения настоящего изобретения представляет собой способ ингибирования развития диабета, или синдрома X, или связанных с ними симптомов или осложнений у субъекта, при этом указанный способ включает введение указанному субъекту совместно эффективной дозы ингибитора обратного поглощения глюкозы и введение указанному субъекту совместно эффективного количества второго антидиабетического средства, при этом указанное совместное введение обеспечивает желаемый-2 010655 профилактический эффект. В раскрываемых способах диабет, или синдром X, или связанные с ними симптомы или осложнения выбраны из IDDM, NIDDM, IGT, IFG, ожирения, нефропатии, невропатии, ретинопатии, атеросклероза, синдрома поликистоза яичников, гипертензии, ишемии, удара, заболевания сердца, синдрома раздраженной толстой кишки, воспаления и катаракты. Настоящее изобретение также включает использование одного или нескольких ингибиторов обратного поглощения глюкозы в сочетании с одним или несколькими антидиабетическими средствами для получения лекарственного средства для лечения состояния, выбранного из IDDM, NIDDM, IGT, IFG,ожирения, нефропатии, невропатии, ретинопатии, атеросклероза, синдрома поликистоза яичников, гипертензии, ишемии, удара, заболевания сердца, синдрома раздраженной толстой кишки, воспаления и катаракты. Подробное описание изобретения У всех диабетиков, независимо от генетических предпосылок этого заболевания или предпосылок,связанных с окружающей средой, имеется общая особенность - очевидный недостаток инсулина или недостаточная функция инсулина. Поскольку транспорт глюкозы из крови в мышцы и жировую ткань является инсулинозависимым, у диабетиков отсутствует способность к адекватной утилизации глюкозы,что приводит к нежелаемому накоплению глюкозы в крови (гипергликемия). Хроническая гипергликемия приводит к снижению секреции инсулина и способствует повышенной резистентности к инсулину и,как результат, концентрация глюкозы в крови повышается так, что диабет сам по себе обостряетсяinsulin resistance: implications for the management diabetes". Vol. 28, p. 119); Diabetes Cares, 1990. Vol. 13,No. 6, "Glucose Toxicity", p. 610-630). Поэтому при лечении гипергликемии указанный выше самообостряющийся цикл прерывается таким образом, что становится возможной профилактика или лечение диабета. Патент США 6153632 на имя R. Rieveley раскрывает способ и композицию, предназначенную,как это заявлено, для лечения сахарного диабета (типа I, пониженной толерантности к глюкозе ["IGT"] и типа II), которая включает терапевтическое количество одного или нескольких инсулинсенсибилизирующих средств вместе с одним или несколькими средствами, включающими инсулин для перорального приема, инсулин для инъекций, сульфонилмочевину, бигуанид или ингибитор альфа-глюкозидазы, для лечения сахарного диабета. В соответствии с одним аспектом настоящее изобретение направлено на комбинацию модулятораPPAR, предпочтительно агониста PPARи ингибитора SGLT, предпочтительно ингибитора SGLT 2 или селективного ингибитора SGLT 2. А. Термины. Некоторые термины определены ниже и путем их использования в настоящем описании. Если не указано иное, "алкил" и "алкокси", как использовано в настоящем описании, отдельно или как часть группы заместителя, включают линейный, циклический и разветвленный алкил, содержащий 1-8 атомов углерода или любое количество в указанных пределах. Например, алкильные радикалы включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, 2-бутенил,2-бутинил, н-пентил, 3-(2-метил)бутил, 2-пентил, 2-метилбутил, неопентил, н-гексил, 2-гексил и 2-метилпентил. Алкокси радикалы представляют собой простые эфиры, образованные из описанных выше линейных или разветвленных алкильных групп. Алкильные и алкоксигруппы могут быть независимо замещены одной-пятью, предпочтительно одной-тремя группами, выбранными из галогена (F, Cl,Br, I), оксо, ОН, амино, карбоксила и алкокси. Алкильные и алкоксигруппы также могут быть независимо связаны с одним или несколькими радикалами PEG (полиэтиленгликоль). Термин "ацил", как он использован в настоящем описании, отдельно или как часть группы заместителя, означает органический радикал, содержащий карбонильную группу, связанную с гидрокарбильной группой, содержащей 1-7 атомов углерода (с разветвленной или линейной цепью или циклической группой, полученной из органической кислоты путем удаления гидроксильной группы. Например, С 4 ацил может включать (CO)CH2CH2CH2CH3 и (СО)(СН 2(СН)(СН 3)2; аналогичным образом, C6 ацил включает как (СО)(C6H13), так и (CO)(C6H5). Термин "Ас", как он использован в настоящем описании, отдельно или как часть группы заместителя, означает ацетил."Арил" представляет собой карбоциклический ароматический радикал, включающий, но не ограничивающийся этим, фенил, 1-или 2-нафтил и т.п. Карбоциклический ароматический радикал может быть замещен, путем независимой замены 1-3 атомов водорода этого радикала, галогеном, ОН, CN, меркапто,нитро, амино, циано, необязательно замещенным C1-C8 алкилом, необязательно замещенным алкокси,алкилтио, алкилсульфинилом, алкилсульфонилом, алкиламино, ди(C1-C8 алкил)амино, формилом, карбоксилом, алкоксикарбонилом, алкоксикарбонилокси, алканоилокси, фенилом, карбамоилом, карбоксамидом, ди-низшим алкилкарбамоилокси, феноксикарбонилоксигруппой, низшим алкилендиокси, бензоилокси, алкил-СО-O-, алкил-O-СО, -CONH2, алкил-О-СО-O- или алкил-CO-NH-. Примеры арильных радикалов включают, например, фенил, нафтил, бифенил, инден фторфенил, 010655 дифторфенил, бензил, бензоилоксифенил, карбоэтоксифенил, ацетилфенил, этоксифенил, феноксифенил,гидроксифенил, карбоксифенил, трифторметилфенил, метоксиэтилфенил, ацетамидофенил, толил, ксилил, диметилкарбамилфенил и т.п. Ph или РН означают фенил. Термин "гетероарил", как он использован в настоящем описании, представляет стабильную пятиили шестичленную моноциклическую или бициклическую ароматическую кольцевую систему, которая состоит из атомов углерода и одного-трех гетероатомов, выбранных из N, О и S. Гетероарильная группа может быть присоединена по любому гетероатому или атому углерода, в результате чего получают стабильную структуру. Примеры гетероарильных групп включают, но не ограничиваются этим, бензофуранил, бензотиофенил, пиридинил, пиразинил, пиридазинил, пиримидинил, тиофенил, фуранил, имидазолил, изоксазолил, оксазолил, пиразолил, пирролил, тиазолил, тиадиазолил, триазолил, бензимидазолил,бензофуранил, бензотиенил, бензизоксазолил, бензоксазолил, бензопиразолил, индолил, бензотиазолил,бензотиадиазолил, бензотриазолил или хинолинил. Предпочтительные гетероарильные группы включают пиридинил, тиофенил, фуранил и хинолинил. Когда гетероарильная группа является замещенной,такая гетероарильная группа может содержать от одного до трех заместителей, независимо выбранных из галогена, ОН, CN, меркапто, нитро, амино, циано, необязательно замещенного C1-C8 алкила,необязательно замещенного алкокси, алкилтио, алкилсульфинила, алкилсульфонила, алкиламино,ди(C1-C8 алкил)амино, формила, карбоксила, алкоксикарбонила, алкоксикарбонилокси, алканоилокси,фенила, карбамоила, карбоксамида, ди-низшего алкилкарбамоилокси, феноксикарбонилоксигруппы,низшего алкилендиокси, бензоилокси, алкил-СО-O-, алкил-O-CO-, -CONH2, алкил-О-СО-O- или алкил-CO-NH-. Термины "гетероцикл", "гетероциклический" и "гетероциклил" относятся к необязательно замещенной, полностью или частично насыщенной, ароматической или неароматической циклической группе, которая представляет собой, например, 4-7-членную моноциклическую, 7-11-членную (или 9-10-членную) бициклическую (гетеробициклил) или 10-15-членную трициклическую кольцевую систему, содержащую по меньшей мере один гетероатом по меньшей мере в содержащем один атом углерода кольце. Каждое кольцо гетероциклической группы, содержащей гетероатом, может содержать 1, 2, или 3 гетероатома, выбранных из атомов азота, атомов кислорода и атомов серы, где гетероатомы азота и серы могут также, необязательно, быть окисленными. Атомы азота могут, необязательно, быть кватернизированы. Гетероциклическая группа может быть присоединена по любому гетероатому или атому углерода. Примеры моноциклических гетероциклических групп включают пирролидинил; оксетанил; пиразолинил; имидазолинил; имидазолидинил; оксазолил; оксазолидинил; изоксазолинил; тиазолидинил; изотиазолидинил; тетрагидрофурил; пиперидинил; пиперазинил; 2-оксопиперазинил; 2-оксопиперидинил; 2-оксопирролидинил; 4-пиперидонил; тетрагидропиранил; тетрагидротиопиранил; тетрагидротиопиранилсульфон; морфолинил; тиоморфолинил; тиоморфолинил сульфоксид; тиоморфолинилсульфон; 1,3-диоксолан; диоксанил; тиетанил; тииранил и т.п. Примеры гетероциклических групп включают хинуклидинил; тетрагидроизохинолинил; дигидроизоиндолил; дигидрохиназолинил (такой как 3,4-дигидро-4-оксохиназолинил); дигидробензофурил; дигидробензотиенил; дигидробензотиопиранил; дигидробензотиопиранилсульфон; дигидробензопиранил; индолинил; изохроманил; изоиндолинил; пиперонил; тетрагидрохинолинил; бензимидазолил; бензтиазолил; и т.п. Когда гетероарильная группа является замещенной, гетероциклил может быть независимо замещен одной-пятью, предпочтительно одной-тремя группами, выбранными из галогена, ОН, CN, меркапто, нитро, амино, циано, необязательно замещенного C1-C8 алкила, необязательно замещенного алкокси, алкилтио, алкилсульфинила, алкилсульфонила, алкиламино, ди(С 1-С 8 алкил)амино, формила, карбоксила, алкоксикарбонила, алкоксикарбонилокси, алканоилокси, фенила, карбамоила, карбоксамида, ди-низшего алкилкарбамоилокси, феноксикарбонилоксигруппы, низшего алкилендиокси, бензоилокси, алкил-СО-O-, алкил-O-СО-, -CONH2,алкил-О-СО-O- или алкил-CO-NH-. Термин "биарил" включает гетероарил, связанный с фенилом, фенил,связанный с гетероарилом (таким как фуран, пиридин или тиофен), и фенил, связанный с фенилом. Примеры групп фенилфенил, гетероарилфенил, замещенный гетероарилфенил и фенилгетероарил, соответственно, включают Термин "композиция" охватывает продукт, включающий указанные ингредиенты в указанных количествах, а также любой продукт, являющийся прямым или косвенным результатом сочетаний указанных ингредиентов в указанных количествах. Термин "совместное введение" включает совместное введение, где 1) два или более средств вводят субъекту, по существу, в одно и то же время и 2) два или более средств вводят субъекту в разное время, с независимыми интервалами, которые могут пересекаться или совпадать, но могут и не пересекаться и не-4 010655 совпадать. Термин "субъект", как он использован в настоящем описании, относится к животному, предпочтительно к млекопитающему, наиболее предпочтительно к человеку, являющемуся объектом лечения, наблюдения или эксперимента. Термин "модулятор RXR", как он использован в настоящем описании, относится к агонистам, частичным агонистам или антагонистам ретиноидных-Х рецепторов. Предпочтительно такой модулятор повышает чувствительность к инсулину. В соответствии с одним аспектом модулятор представляет собой агонист RXR. Диабет, синдром X и связанные с ними симптомы или осложнения включают такие состояния, какIDDM, NIDDM, IGT, IFG, ожирение, нефропатия, невропатия, ретинопатия, атеросклероз, синдром поликистоза яичников, гипертензия, ишемия, удар, заболевание сердца, синдром раздраженной толстой кишки, воспаление и катаракта. Примеры преддиабетических состояний включают IGT и IFG. Из уровня техники известны способы определения эффективных доз для терапевтических и профилактических целей для раскрываемых фармацевтических композиций или раскрываемых комбинаций лекарственных средств, независимо от того, объединены они в одну композицию или нет. Для терапевтических целей термин "совместно эффективное количество", как он использован в настоящем изобретениии, означает такое количество каждого активного соединения или фармацевтического средства, отдельно или в сочетании, которое вызывает биологический или медицинский ответ в системе ткани, у животного или человека, которого добивается исследователь, ветеринар, врач или другой клиницист, включающий ослабление симптомов заболевания или расстройства, подлежащего лечению. Для профилактических целей (т.е. подавления начала или развития расстройства) термин "совместно эффективное количество" относится к такому количеству каждого активного соединения или фармацевтического средства,отдельно или в сочетании, которое ингибирует у субъекта начало или развитие расстройства, как этого добивается исследователь, ветеринар, врач или другой клиницист, и задержка развития такого расстройства опосредована активностью модулирования обратного поглощения глюкозы или другой антидиабетической активностью, или и тем, и другим. Таким образом, настоящее изобретение обеспечивает комбинации двух или более лекарственных средств, где, например, (а) каждое лекарственное средство независимо вводят в терапевтически или профилактически эффективном количестве; (b) по меньшей мере одно лекарственное средство в такой комбинации вводят в количестве, которое является субтерапевтическим или суб-профилактическим при его отдельном введении, но является терапевтическим или профилактическим при введении в сочетании со вторым или дополнительным лекарственными средствами в соответствии с настоящим изобретением; или (с) оба лекарственных средства вводят в количестве, которое является суб-терапевтическим или суб-профилактическим при введении отдельно, но эти количества являются терапевтическими или профилактическими при совместном введении. Термин "защитные группы" относится к таким известным из уровня техники группам, которые используют для защиты функциональных групп; защитные группы можно удалить в процессе последующих синтетических преобразований или путем метаболических или других процессов при введении invivo. В ходе любого из способов получения соединений по настоящему изобретению может быть необходимо и/или желательно защитить чувствительные или реакционноспособные группы в любой из молекул, которые представляют интерес. Это достигается при помощи традиционно используемых защитных групп, таких как группы, описанные в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, PlenumWileySons, 1999. Защитные группы можно удалить на удобной для этого последующей стадии, используя способы, известные из уровня техники. Примеры защитных групп для гидроксила и диола представлены ниже. Защита для гидроксильной группы включает метиловые эфиры, замещенные метиловые эфиры, замещенные этиловые эфиры, замещенные бензиловые эфиры и силиловые эфиры. Замещенные метиловые эфиры. Примеры замещенных метиловых эфиров включают метилоксиметил, метилтиометил,трет-бутилтиометил, (фенилдиметилсилил)метоксиметил, бензилоксиметил, п-метоксибензилоксиметил,(4-метоксифенокси)метил, гваяколметил, трет-бутоксиметил, 4-пентенилоксиметил, силоксиметил,2-метоксиэтоксиметил, 2,2,2-трихлорэтоксиметил, бис-(2-хлорэтокси)метил, 2-(триметилсилил)этоксиметил, тетрагидропиранил, 3-бромтетрагидропиранил, тетрагидротиопиранил, 1-метоксициклогексил,4-метокситетрагидропиранил, 4-метокситетрагидротиопиранил, 4-метокситетрагидротиопиранил S,Sдиоксидо, 1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин-4-ил, 1,4-диоксан-2-ил, тетрагидрофуранил,тетрагидротиофуранил и 2,3,3 а,4,5,6,7,7 а-октагидро-7,8,8-триметил-4,7-метанобензофуран-2-ил. Замещенные этиловые эфиры. Примеры замещенных этиловых эфиров включают 1-этоксиэтил, 1-(2-хлорэтокси)этил,1-метил-1-метоксиэтил, 1-метил-1-бензилоксиэтил, 1-метил-1-бензилокси-2-фторэтил, 2,2,2-трихлорэтил,2-триметилсилилэтил, 2-(фенилселенил)этил, трет-бутил, аллил, п-хлорфенил, п-метоксифенил,2,4-динитрофенил, бензил и эфиры полиэтиленгликоля.-5 010655 Замещенные бензиловые эфиры. Примеры замещенных бензиловых эфиров включают п-метоксибензил, 3,4-диметоксибензил,о-нитротолуол, п-нитробензил, п-галогенбензил, 2,6-дихлорбензил, п-цианобензил, п-фенилбензил,2- и 4-пиколил, 3-метил-2-пиколил N-оксидо, дифенилметил, п,п'-динитробензгидрил, 5-дибензосуберил,трифенилметил,-нафтилдифенилметил,п-метоксифенилдифенилметил,ди(п-метоксифенил)фенилметил, три(п-метоксифенил)метил, 4-(4'-бромфенацилокси)фенилдифенилметил, 4,4',4"-трис-(4,5 дихлорфталимидофенил)метил, 4,4',4-трис-(левулиноилоксифенил)метил, 4,4',4"-трис-(бензоилоксифенил)метил, 3-(имидазол-1-илметил)-бис-(4',4"-диметоксифенил)метил, 1,1-бис-(4-метоксифенил)-1'пиренилметил, 9-антрил, 9-(9-фенил)ксантенил, 9-(9-фенил-10-оксо)антрил, 1,3-бензодитиолан-2-ил и бензизотиазолил S,S-диоксидо. Силиловые эфиры. Примеры силиловых эфиров включают триметилсилил, триэтилсилил, триизопропилсилил,диметилизопропилсилил, диэтилизопропилсилил, диметилгексилсилил, трет-бутилдиметилсилил,трет-бутилдифенилсилил, трибензилсилил, три-п-ксилилсилил, трифенилсилил, дифенилметилсилил и трет-бутилметоксифенилсилил. Сложные эфиры. Помимо простых эфиров, гидроксильная группа может быть защищена в виде сложного эфира. Примеры сложных эфиров включают формиат, бензоилформиат, ацетат, хлорацетат, дихлорацетат,трихлорацетат,трифторацетат,метоксиацетат,трифенилметоксиацетат,феноксиацетат,п-хлорфеноксиацетат,п-Р-фенилацетат,3-фенилпропионат,4-оксопентаноат(левулинат),4,4-(этилендитио)пентаноат, пивалоат, адамантоат, кротоноат, 4-метоксикротоноат, бензоат,п-фенилбензоат, 2,4,6-триметилбензоат(мезитоат) и сложные эфиры полиэтиленгликоля. Карбонаты. Примеры карбонатов включают метил, 9-флуоренилметил, этил, 2,2,2-трихлорэтил, 2-(триметилсилил)этил,2-(фенилсульфонил)этил,2-(трифенилфосфонио)этил,изобутил,винил,аллил,п-нитрофенил, бензил, п-метоксибензил, 3,4-диметоксибензил, о-нитробензил, п-нитробензил,S-бензилтиокарбонат, 4-этокси-1-нафтил, метилдитиокарбонат и полиэтиленгликолькарбонаты. Группы, способствующие отщеплению. Примеры групп, способствующих отщеплению, включают 2-иодбензоат, 4-азидобутират, 4-нитро-4 метилпентаноат,о-(дибромметил)бензоат, 2-формилбензолсульфонат, 2-(метилтиометокси)этилкарбонат, 4-(метилтиометокси)бутират и 2-(метилтиометоксиметил)бензоат. Разные сложные эфиры. Примеры разных сложных эфиров включают 2,6-дихлор-4-метилфеноксиацетат, 2,6-дихлор-4(1,1,3,3-тетраметилбутил)феноксиацетат, 2,4-бис-(1,1-диметилпропил)феноксиацетат, хлордифенилацетат, изобутират, моносукциноат, (Е)-2-метил-2-бутеноат(тиглоат), о-(метоксикарбонил) бензоат,п-Р-бензоат, -нафтоат, нитрат, алкил N,N,N',N'-тетраметилфосфородиамидат, N-фенилкарбамат, борат,диметилфосфинотиоил и 2,4-динитрофенилсульфенат. Сульфонаты. Примеры сульфонатов включают сульфат, метансульфонат(мезилат), бензилсульфонат и тозилат. Защита для 1,2- и 1,3-диолов. Циклические ацетали и кетали. Примеры циклических ацеталей и кеталей включают метилен, этилиден, 1-трет-бутилэтилиден,1-фенилэтилиден, (4-метоксифенил)этилиден, 2,2,2-трихлорэтилиден, ацетонид (изопропилиден), циклопентилиден, циклогексилиден, циклогептилиден, бензилиден, п-метоксибензилиден, 2,4-диметоксибензилиден, 3,4-диметоксибензилиден и 2-нитробензилиден. Циклические ортоэфиры. Примеры циклических ортоэфиров включают метоксиметилен, этоксиметилен, диметоксиметилен,1-метоксиэтилиден,1-этоксиэтилиден,1,2-диметоксиэтилиден,-метоксибензилиден,1-(N,N-диметиламино)этилиденовое производное, -N,N-диметиламино)бензилиденовое производное и 2-оксациклопентилиден. Производные силила. Примеры производных силила включают ди-трет-бутилсилиленовую группу и 1,3-(1,1,3,3 тетраизопропилдисилоксанилиден)овое производное. Ингибиторы обратного поглощения глюкозы. Один способ лечения гипергликемии включает экскрецию избыточного количества глюкозы непосредственно в мочу так, чтобы нормализовалась концентрация глюкозы в крови. Например,котранспортеры натрия-глюкозы (SGLTs), в основном присутствующие в хорионической мембране кишечника и почек, представляют собой семейство белков, активно участвующих в нормальном процессе поглощения глюкозы. Из них SGLT1 присутствует в эпителиальных клетках кишечника и почек (Lee etal., 1994), тогда как SGLT2 обнаружен в эпителии почек (You et al., 1995, MacKenzie et al., 1994). Поглощение глюкозы в кишечнике, прежде всего, опосредовано SGLT1, высокоаффинным транспортером низ-6 010655 кой емкости с соотношением транспорта Na+:глюкоза 2:1. SGLT2, также известный как SAAT1, транспортирует Na+ и глюкозу при соотношении 1:1 и действует как низкоаффинный транспортер высокой емкости. Эти SGLT охарактеризованы в табл. 1. Таблица 1 Для D-глюкозы, мМ Максимальная скорость транспорта, пмоль/мин/мМ. Обратное поглощение глюкозы в почках опосредовано SGLT1 и SGLT2 (Silverman et al., 1992;Deetjen et al., 1995). Глюкоза из плазмы фильтруется в клубочках и трансэпителиально обратно поглощается в проксимальных канальцах. SGLT1 и SGLT2 расположены в апикальных плазматических мембранах эпителия и получают свою энергию из внутреннего градиента натрия, создаваемого Na+/K+ АТФазными насосами, расположенными на базолатеральной мембране. После обратного поглощения повышенное количество глюкозы в цитозоле затем транспортируется в область кишечника при помощи транспортеров глюкозы (GLUT1 и GLUT2). Поэтому ингибирование SGLT снижает концентрацию глюкозы в плазме через подавление обратного поглощения глюкозы в почках. Терапевтически или профилактически эффективное количество ингибитора SGLT, достаточное для повышения экскреции глюкозы в мочу или для снижения концентрации глюкозы в плазме у субъекта на такое количество в день, насколько это необходимо, можно легко определить, используя способы, известные из уровня техники. Недавно было обнаружено, что флоризин - природный гликозид, присутствующий в коре и стволе растений семейства Rosaceae (например, яблоня, груша и т.п.), ингибирует котранспортеры Na+-глюкозы, расположенные в хорионической мембране кишечника и почек. Путем ингибирования активности котранспортеров Na+-глюкозы флоризин ингибирует обратное поглощение глюкозы в почечных канальцах и способствует экскреции глюкозы таким образом, что при ежедневном подкожном введении этого средства содержание глюкозы в плазме контролируется на нормальном уровне в течение длительного времени (Journal of Clinical Investigation, 1987, vol. 79, p. 1510). Другие ингибиторы SGLT включают алкил- и фенилглюкозиды, 1-5-изохинолинсульфонил)-2 метилпиперазин-НСl (опосредованно через протеинкиназу С), п-хлормеркурибензоат (РСМВ),N,N'-дициклогексилкарбодиимид (DCCD), ионы меди и кадмия и трехвалентные лантаниды. В. Соединения. Настоящее изобретение направлено на соединения формулы (II)Q представляет собой -(СН 2)n-, где n=0, 1, или 2; или когда R2 представляет собой Н, F, Cl или метокси, тогда Q также может быть выбран из -CH2-S; Р = Н или ацетил;Z является замещенным или незамещенным и выбран из С 3-7 циклоалкила, фенила, бензгидрила,5- или 6-членного гетероарила, содержащего 1 или 2 гетероатома, независимо выбранных из N, О и S,биарила, 9- или 10-членного конденсированного бициклила или конденсированного гетеробициклила,где конденсированный гетеробициклил содержит от 1 до 4 гетероатомов (и предпочтительно от 1 до 2 гетероатомов), независимо выбранных из N, О и S. Примеры соединений формулы (II) включают такие соединения, где (a) R1 представляет собой Н; 2(b) R представляет собой Н, метил или этил; (с) Q представляет собой -(СН 2)n- и n представляет собой 1 или 2; (d) Z является независимо замещенным 1-3 заместителями, независимо выбранными из C1-4 алкокси, C1-4 алкила, С 3-6 циклоалкила, галогена, гидрокси, циано, амино, C1-4 алкилтио, C1-4 аминоалкила, моноили диалкиламино, фенила, 5-6-членного гетероциклила, содержащего от 1 до 3 гетероатомов, независимо выбранных из N, S и О; и где заместитель(заместители) у Z могут быть дополнительно независимо замещены 1-3 заместителями, независимо выбранными из C1-4 алкокси, C1-4 алкила, галогена, гидрокси,циано, амино, C1-4 алкилтио, фенокси, -CONRaRb, -NHSO2Ra и -SO2NRaRb; (e) Z представляет собой фенил, циклопентил, циклогексил, 4-замещенный циклогексил, 2- или 3-замещенный циклопентил,4-замещенный фенил, 3,4-дизамещенный фенил, замещенный тиофен, тиофенил, бензофуранил, дигидробензофуранил, 4-замещенный пиридил, бензо[b]тиенил, хроманил, бензотиофенил, инданил, нафтил,5,6,7,8-тетрагидронафтил, 1,2,3,4-тетрагидронафтил или бензо[1,4]диоксан; (f) ограничения для (е), где Z является незамещенным или замещен 1-2 заместителями, независимо выбранными из метокси, этокси,фтора, хлора, метила, этила, пропила, изопропила, изопропила, циклопропила и фенила; (g) Z представляет собой бифенил,(4-этил)фенил,(4-пропил)фенил,4-метоксифенил,4-этоксифенил,4-метилтиофенил, бензофуран-5-ил, дигидробензофуран-5-ил, нафтил или дигидробензофуран-6-ил или 5-(этилтио)фенил; (h) R1 представляет собой Н; и R2 представляет собой Н, метил, этил, пропил или изопропил; (i) Q представляет собой -(СН 2)n-; n представляет собой 1 или 2; и R2 представляет собой Н, метил или этил; (i) ограничение для (i), где R1 представляет собой метил; (j) ограничение для (а), где R2 представляет собой Н, метил или этил; и Q представляет собой -(СН 2)n- и n представляет собой 1 или 2; Z представляет собой фенил, циклопентил, циклогексил, 4-замещенный циклогексил, 2- или 3-замещенный циклопентил, 4-замещенный фенил, 3,4-дизамещенный фенил, замещенный тиофен, тиофенил, биарил,бензофуранил, дигидробензофуранил, 4-замещенный пиридил, бензо[b]тиенил, бензотиофенил, инданил,нафтил, 5,6,7,8-тетрагидронафтил, 1,2,3,4-тетрагидронафтил или бензо[1,4]диоксан; и где Z является незамещенным или замещен 1-2 заместителями, независимо выбранными из метокси, этокси, фтора, хлора,метила, этила, пропила, изопропила, циклопропила, фенила; (k) R2 представляет собой Н, метил или этил; Q представляет собой -(СН 2)n-; n представляет собой 1 или 2; и Z представляет собой бифенил,4-этилфенил, (4-пропил)фенил, 4-метоксифенил, 4-этоксифенил, 4-метилтиофенил, бензофуран-5-ил,дигидробензофуран-5-ил, нафтил или дигидробензофуран-6-ил или (5-этилтио)фенил; (l) и сочетания указанных выше значений. Примеры предпочтительных соединений включают 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-6-метил-1 Н-индазол-4-илоксиO-глюкопиранозид; 2-[3-(2-бензофуран-5-илэтил)-6-мет 1 Н-индазол-4-илокси]D-глюкопиранозид; 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-1,6-диметил-1 Н-индазол-4-илоксиD-глюкопиранозид; 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-6-этил-1 Н-индазол-4-илоксиD-глюкопиранозид и 2-[3-(4-метокибензил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид. Дополнительные предпочтительные соединения включают 2-[3-(2-бензофуран-5-илэтил)-1 Н-индазол-4-илокси]D-глюкопиранозид; 2-3-[2-(6-метоксинафталин-2-ил)этил]-6-метил-1 Н-индазо[-4-илоксиD-глюкопиранозид; 2-3-[2-(2,3-дигидробензо[1,4]диоксин-6-ил)этил)-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид; 2-3-[2-(4-этоксифенил)этил]-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид; 2-6-метил-3-[2-(5,6,7,8-тетрагидронафталин-2-ил)этил]-1 Н-индазол-4-илоксиD-глюкопиранозид; 2-[6-метил-3-(2-нафталин-2-илэтил)-1 Н-индазол-4-илокси]D-глюкопиранозид; 2-3-[2-(4-метоксифенил)этил]-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид; 2-3-[2-(6-метокси-5,6,7,8-тетрагидронафталин-2-ил)этил]-6-метил-1 Н-индазол-4-илоксиDглюкопиранозид и 2-[3-(2-бензофуран-5-илэтил)-6-метил-1 Н-индазол-4-илокси]-6-О-ацетилD-глюкопиранозид. Дополнительные предпочтительные соединения включают 2-3-[2-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)этил]-6-метил-1 Н-индазол-4-илоксиDглюкопиранозид; 2-3-[2-(4-хлорфенил)этил]-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид; 2-[3-(4-метоксифенилсульфанилметил)-1 Н-индазол-4-илокси]D-глюкопиранозид;-8 010655 2-[3-(2-циклогексилэтил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид; 2-[3-(2,3-дигидробензофуран-5-илметил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид; 2-3-[2-(4-трифторметилфенил)этил]-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид; 2-3-[2-(4-метансульфониламинофенил)этил]-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид и 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-6-метил-1 Н-индазол-4-илокси-6-O-ацетилDглюкопиранозид. Дополнительные предпочтительные соединения включают 2-[3-(4-этилбензил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид; 2-[6-метил-3-(4-пропилбензил)-1 Н-индазол-4-илокси]D-глюкопиранозид; 2-[3-(4-метилсульфанилбензил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид; 2-[3-(4-бифенил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид; 2-[3-(4-циклопропилбензил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид и 2-[3-(5-этилтиофен-2-илметил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид. Наиболее предпочтительными соединениями являются 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид; 2-[3-(2-бензофуран-5-илэтил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид; 2-[3-(4-этилбензил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид и 2-[3-(5-этилтиофен-2-илметил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид. С. Способы синтеза. Один аспект настоящего изобретения представляет замещенные индазолы формулы (II). Эти соединения можно получить в соответствии с традиционными методами синтеза, используемыми в органической химии, или в соответствии с комбинаторными методами синтеза или методами матричного синтеза. Следующие три схемы, их описание и химические примеры 1-22 представляют общее руководство. Схема 1 Соединения по настоящему изобретению, где R2 определен в формуле (II) и Z представляет собой ароматическое или циклоалкильное кольцо, можно получить, как в общем виде представлено на схемах 1 и 3. Как представлено на схеме 1, соединения формулы 1 либо являются коммерчески доступными (гдеR2 представляет собой Н, метил или метокси), либо их можно получить способами, описанными в литературе [когда R2 представляет собой хлор, этил, пропил, изопропил; Tsujihara et al. J. Med. Chem. 1999 42,5311-5324; когда R2 представляет собой фтор; Brooks et al. J. Org. Chem. 1999, 64, 9719-9721], из коммерчески доступных веществ. Соединения формулы 2, где n имеет значение 0 или 1, можно получить из соединений 1 путем реакции ацилирования Фриделя-Крафтса (Friedel-Crafts) при помощи хлорангидрида арилкарбоновой кислоты или арилуксусной кислоты, с использованием кислоты Льюиса (Lewis), такой-9 010655 как диэтилэфират трифторида бора, без использования растворителя. Соединения формулы 3, где P1 представляет собой бензил (Bn) или метоксиметил (MOM), можно получить из соединений формулы 1 способами, описанными в литературе [Tsujihara et al. J. Med. Chem. 1999, 42, 5311-5324]. Соединения формулы 2, где n имеет значение 2, можно получить из соединений формулы 3 либо в две, либо в три стадии. Альдольная конденсация с арилальдегидом в щелочных условиях, например с использованием гидроксида калия в спиртовом растворителе, таком как этанол, при температуре от 20 С до температуры кипения растворителя, с последующим каталитическим гидрированием полученного алкена в таких условиях, как Pd на активированном угле, в спиртовом растворителе,таком как этанол, при давлении водорода 1-3 атмосферы. Когда P1 представляет собой бензил, такие группы отщепляют в процессе гидрирования с непосредственным получением соединений формулы 2. Когда P1 представляет собой MOM, промежуточное соединение, полученное в результате каталитического гидрирования, обрабатывают минеральной кислотой, такой как хлористо-водородная кислота, в комбинации растворителей, таких как диоксан и изопропиловый спирт. Альтернативно, соединения формулы 3, где P1 представляет собой бензил, можно обработать сильным основанием, таким как диизопропиламид лития, при -78 С, с последующим добавлением циклоалкилкарбоксальдегида при -30 С. Продукт затем гидрируют для одновременного восстановления двойных связей и удаления фенолзащитной группы, с получением соединений формулы 2, где n имеет значение 2,и Z представляет собой циклоалкил. Соединения формулы 4, где R1 представляет собой Н или метил, можно получить циклизацией соединений формулы 2 при помощи гидразина или метилгидразина в спиртовом растворителе, таком как этиленгликоль, при температуре в пределах от 140 до 160 С. Альтернативно, соединение формулы 4, гдеR1 представляет собой алкил, можно получить в три стадии из соединения формулы 4, где R1 представляет собой Н. Фенольную группу в соединении формулы 4, где R1 представляет собой Н, можно селективно алкилировать при помощи бензилбромида в полярном растворителе, таком как ацетон, в присутствии основания, такого как карбонат калия. Полученный индазол можно алкилировать при помощи алкилиодида, такого как этилиодид, и основания, такого как карбонат цезия, в ДМФА или каком-либо другом полярном органическом растворителе. Удаление защиты у фенольной группы в условиях гидрирования,таких как палладий на активированном угле и газообразный водород при давлении в пределах от 1 до 3 атм., в растворителе, таком как метанол, этанол, этилацетат и т.п., обеспечивает соединения формулы 4, где R1 представляет собой алкильную группу, такую как этил. Схема 2 Соединения по настоящему изобретению, где R2 определен в формуле (II) и Z представляет собой ароматическое кольцо, можно получить, как в общем виде представлено на схемах 2 и 3. Соединения формулы 5 можно получить из коммерческих источников, или их можно получить способами, описан- 10010655 ными в литературе [Tsujihara et al. J. Med. Chem. 1999 42, 5311-5324]. Соединение формулы 6 можно получить из соединения формулы 5 циклизацией с использованием гидразина в спиртовом растворителе,таком как этиленгликоль, при температуре в пределах от 140 до 160 С. Постадийная защита соединения формулы 6 дает соединение формулы 7. Защиту фенола можно осуществить при помощи эфиробразующего реагента, такого как трет-бутилдиметилсилилхлорид, и амин, такой как имидазол, в полярном растворителе, таком как ДМФА, при температуре в пределах от 0 до 80 С. Защита азота индазола при помощи реагента, такого как ди-трет-бутилдикарбонат, в растворителе, таком как ТГФ, дает соединение формулы 7, где P1 представляет собой трет-бутилдиметилсилил и Р 2 представляет собой трет-бутоксикарбонил (ВОС). Азот индазола также можно защитить ацилирующим агентом, таким как уксусный ангидрид, с использованием катализатора, такого как DMAP, или без катализатора, в неполярном растворителе, таком как метиленхлорид, с получением соединения формулы 7, где Р 2 представляет собой ацетил (Ас). Последующее бромирование при помощи реагента, такого как N-бромсукцинимид(NBS), в присутствии каталитического количества бензоилпероксида или 2,2'-азо-бис-изобутиронитрила(AIBN) в растворителе, таком как тетрахлорид углерода, может обеспечить соединения формулы 8. Соединение формулы 9 затем можно получить взаимодействием подходящим образом замещенного тиофенола с использованием основания, такого как триэтиламин, в неполярном растворителе, таком как дихлорметан, при температуре в пределах от 0 до 50 С. Защитные группы P1 (TBDMS) и Р 2 (ВОС) в соединении формулы 9 можно удалить одновременно в кислотных условиях, таких как водный растворHBr в полярном растворителе, таком как ДМФА, с использованием фторида калия при комнатной температуре, с получением соединения формулы 10. Ацетильную (Ас) группу Р 2 соединения формулы 11 можно удалить после гликозилирования, как описано на схеме 3. Схема 3 Соединения формулы 12, где R1 определен в формуле II, можно получить из соединений формулы 4, 10 и 11, полученных на схемах 1 и 2, путем гликозилирования фенольной группы 2,3,4,6-тетра-ОацетилD-глюкопиранозилбромидом в подходящем растворителе, таком как ацетон, ацетонитрил или ДМФА, в щелочных условиях, таких как карбонат калия или карбонат лития, с последующим удалением защитных ацетильных групп в спиртовом растворителе, таком как метанол, используя слабо-щелочные условия, такие как карбонат калия или метоксид натрия, при комнатной температуре. Соединение формулы 13 может быть выделено в виде побочного продукта на стадии удаления защиты.D. Дополнительные антидиабетические средства. Антидиабетические средства, которые можно использовать в соответствии с настоящим изобретением в качестве второго или третьего антидиабетического средства в составе фармацевтической композиции, препарата или комбинированного способа лечения (режим), включают, но не ограничиваются этим, средства, указанные в табл. 2. Таблица 2 Комбинированная терапия с использованием ингибиторов SGLT Е. Комбинации. Настоящее изобретение направлено на комбинированную терапию, включающую введение ингибитора обратного поглощения глюкозы, такого как ингибитор SGLT, и одного или нескольких антидиабетических средств для лечения диабета, или синдрома X, или связанных с ними симптомов или осложнений. Продемонстрированная эффективность ингибиторов SGLT в различных моделях NIDDM является подтверждением применимости настоящего лекарственного средства отдельно для лечения NIDDM у человека. Поскольку ингибиторы обратного поглощения глюкозы имеют механизм действия, который отличается от механизма действия модуляторов RXR, раскрываемая комбинация с модуляторами RXR может обладать преимуществом снижения количества любого лекарственного средства, необходимого для достижения совместной терапевтической или фармацевтической эффективности, по сравнению с использованием такого средства отдельно, снижая, таким образом, один или более побочных эффектов,- 17010655 которые часто включают увеличение веса, отек, гипертрофию сердца, гепатогипертрофию, гипогликемию или гепатотоксичность, или любое их сочетание. Настоящее изобретение обеспечивает способ лечения диабета, или синдрома X, или их осложнений у субъекта, при этом указанный способ включает введение указанному субъекту совместно эффективного количества ингибитора обратного поглощения глюкозы в сочетании с совместно эффективным количеством антидиабетического средства. В одном аспекте настоящего изобретения антидиабетическое средство представляет собой агонист или антагонист RXR, который повышает чувствительность к инсулину у субъекта. Способы определения активности средства, направленной на повышение чувствительности к инсулину, хорошо известны из уровня техники. Например, инсулин-сенсибилизирующее средство может повышать толерантность к глюкозе у субъекта в пероральном тесте переносимости глюкозы. В частности, диабет, или синдром X, или связанные с ними симптомы или осложнения, выбраны изIDDM, NIDDM, IGT и IFG. Настоящее изобретение также обеспечивает фармацевтическую композицию, включающую один или несколько ингибиторов обратного поглощения глюкозы, один или несколько модуляторов RXR и фармацевтически приемлемый носитель. В одном аспекте настоящего изобретения модулятор RXR представляет собой агонист RXR, который повышает чувствительность к инсулину у субъекта. В другом аспекте настоящего изобретения модулятор RXR представляет собой антагонист RXR, который повышает чувствительность к инсулину у субъекта. В частности, ингибитор обратного поглощения глюкозы представляет собой ингибитор SGLT1 и/или SGLT2. Для медицинского применения соль или соли соединений формулы II или V относятся к нетоксичной "фармацевтически приемлемой соли или солям". Однако можно использовать другие соли для получения соединений в соответствии с настоящим изобретением или их фармацевтически приемлемых солей. Примеры органических или неорганических кислот включают, но не ограничиваются этим, хлористо-водородную, бромисто-водородную, иодисто-водородную, перхлорную, серную, азотную, фосфорную, уксусную, пропионовую, гликолевую, молочную, янтарную, малеиновую, фумаровую, яблочную,винную, лимонную, бензойную, миндальную, метансульфоновую, гидроксиэтансульфоновую, бензолсульфоновую, щавелевую, памовую, 2-нафталинсульфоновую, п-толуолсульфоновую, циклогексансульфаминовую, салициловую, сахариновую или трифторуксусную кислоту. Примеры основных/катионных солей включают, но не ограничиваются этим, соли бензатина, хлорпрокаина, холина, диэтаноламина,этилендиамина, меглумина, прокаина, алюминия, кальция, лития, магния, калия, натрия или цинка. Соединения формулы II или их фармацевтически приемлемые соли могут включать их внутримолекулярные соли или их сольваты или гидраты.F. Введение, составление композиций и дозы. Применимость раскрываемых соединений, композиций и комбинаций для лечения расстройств глюкозного и липидного метаболизма можно определить в соответствии с процедурами, хорошо известными из уровня техники (см. ссылочные документы, указанные ниже), а также процедурами, описанными в патентах США 5424406, 5731292, 5767094, 5830873, 6048842, WO 01/16122 и WO 01/16123, которые включены в настоящее описание посредством ссылки. Соединение можно вводить пациенту любым традиционным путем введения, включая, но не ограничиваясь этим, внутривенный, пероральный,подкожный, внутримышечный, внутрикожный и парентеральный пути введения. Предпочтительно композиции предназначены для перорального введения. Настоящее изобретение также обеспечивает фармацевтические композиции, включающие один или несколько ингибиторов обратного поглощения глюкозы по настоящему изобретению и одно или несколько антидиабетических средств, в сочетании с фармацевтически приемлемым носителем. Суточная доза продуктов может варьировать в широких пределах, от 1 до 1000 мг на взрослого человека в день. Для перорального введения композиции предпочтительно обеспечивают в форме таблеток, содержащих 0,01, 0,05, 0,1, 0,5, 1,0, 2,5, 5,0, 10,0, 15,0, 25,0, 50,0, 100, 150, 200, 250 или 500 мг активного ингредиента, для симптоматического регулирования дозы для пациента, подлежащего лечению. Соединения можно вводить по схеме от 1 до 2 раз в день. Однако дозы могут варьировать в зависимости от потребностей пациентов, тяжести состояния, подлежащего лечению, и от используемого соединения. Можно использовать либо ежедневное введение, либо пост-периодическое дозирование. Предпочтительно, такие композиции обеспечивают в стандартных лекарственных формах, таких как таблетки, пилюли,капсулы, порошки, гранулы, стерильные парентеральные растворы или суспензии, дозируемые аэрозоли или жидкие спреи, капли, ампулы, автоматические инжекторные устройства или суппозитории; для перорального, парентерального, интраназального, подъязычного или ректального введения, или для введения путем ингаляции или инсуффляции. Альтернативно, композиция может быть представлена в форме,подходящей для введения раз в неделю или раз в месяц; например, нерастворимая соль активного соединения, такая деканоат, может быть приспособлена для получения депо препарата для внутримышечной инъекции. Для получения твердых композиций, таких как таблетки, активный ингредиент или ингредиенты смешивают с фармацевтическим носителем, например, традиционно используемыми при таблетировании ингредиентами, такими как кукурузный крахмал, лактоза, сахароза, сорбит, тальк, стеариновая- 18010655 кислота, стеарат магния, дикальцийфосфат или смолы и другие фармацевтические разбавители, например вода, с получением твердой предварительной композиции, содержащей гомогенную смесь одного или нескольких ингибиторов обратного поглощения глюкозы и одного или нескольких антидиабетических средств или их фармацевтически приемлемых солей. Когда указано, что такие предварительные композиции являются гомогенными, это значит, что активный ингредиент или ингредиенты диспергированы равномерно в композиции так, чтобы композицию можно было легко разделить на равно эффективные лекарственные формы, такие как таблетки, пилюли и капсулы. Такую твердую предварительную композицию затем подразделяют на стандартные лекарственные формы типа, описанного выше, содержащие от 0,1 до около 500 мг активного ингредиента или ингредиентов по настоящему изобретению. На таблетки или пилюли новой композиции можно нанести покрытие или их можно каким-либо иным образом скомпаундировать для получения лекарственной формы, обладающей таким преимуществом, как пролонгированное действие. Например, таблетка или пилюля может содержать внутренний и внешний компоненты дозы, причем последний имеет форму оболочки, заключающей в себе первый. Эти два компонента могут быть разделены энтеросолюбильным слоем, который служит для предотвращения разложения в желудке и позволяет внутреннему компоненту проходить интактным в двенадцатиперстную кишку или задерживает его высвобождение. Для таких энтеросолюбильных слоев или покрытий можно использовать различные вещества, при этом такие вещества включают различные полимерные кислоты с такими веществами, как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы, в которые могут быть включены новые композиции по настоящему изобретению для введения перорально или путем инъекции, включают водные растворы, содержащие подходящие отдушки сиропы, водные или масляные суспензии и эмульсии с отдушками, которые включают пищевые масла, такие как масло семян хлопчатника, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и подобные фармацевтические наполнители. Подходящие диспергаторы или суспендирующие вещества для водных суспензий включают синтетические и природные смолы, такие как трагакант, аравийская камедь, альгинат, декстран, натрий карбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин. Жидкие формы суспендирующих веществ или диспергаторов, содержащих подходящие отдушки, могут также включать синтетические и природные смолы, например, трагакант, аравийскую камедь, метилцеллюлозу и т.п. Для парентерального введения желательны стерильные суспензии и растворы. Изотонические препараты, как правило, содержащие подходящие консерванты,используют, когда желательно внутривенное введение. Обеспечивается такое преимущество, что комбинации одного или нескольких ингибиторов обратного поглощения глюкозы по настоящему изобретению можно вводить, отдельно или в сочетании с одним или несколькими антидиабетическими средствами, в виде одной суточной дозы или общее количество суточной дозы можно вводить в виде раздельных доз два, три или четыре раза в день. Более того,один или несколько ингибиторов обратного поглощения глюкозы и/или одно или несколько антидиабетических средств по настоящему изобретению можно вводить в интраназальной лекарственной форме путем местного применения подходящих интраназальных носителей или с использованием наносимых на кожу пластырей для чрескожного введения, хорошо известных специалистам средней квалификации. В случае использования чрескожной системы доставки для введения лекарственного средства, введение дозы, конечно, должно быть непрерывным, а не прерывистым, на протяжении всего режима введения. Например, для перорального введения в форме таблетки или капсулы активный лекарственный компонент может быть объединен с пероральным нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и т.п. Более того, когда это желательно или необходимо, в смесь также могут быть включены подходящие связующие; смазывающие вещества, разрыхлители и красители. Подходящие связующие включают, без ограничения, крахмал, желатин, природные сахара,такие как глюкоза или бета-лактоза, сахаристые вещества из кукурузы, природные и синтетические смолы, такие как аравийская камедь, трагакант или олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Разрыхлители включают, без ограничения, крахмал, метилцеллюлозу, агар, бентонит, ксантановую смолу и т.п. Когда настоящее изобретение направлено на введение комбинации, совместное введение соединений может быть одновременным, последовательным или в одной фармацевтической композиции. Когда соединения вводят отдельно, количество доз каждого соединения, вводимых в день, необязательно должно быть одинаковым, например, у одного соединения продолжительность действия может быть больше и поэтому его нужно вводить реже. Оптимальные дозы для введения могут быть легко определены специалистом в данной области, и они будут варьировать в зависимости от конкретного используемого соединения, активности препарата,способа введения и стадии заболевания. Кроме того, факторы, связанные с конкретным пациентом, которого лечат, включающие возраст, вес, режим питания пациента и время введения, влияют на необходимость коррекции доз. Новые композиции по настоящему изобретению также можно вводить в форме липосомных систем доставки, таких как малые однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы можно получить из различных липидов, включая, но не ограничиваясь этим, амфипа- 19010655 тические липиды, так как фосфатидилхолины, сфингомиелины, фосфатидилэтаноламины, фофатидилхолины, кардиолипины, фосфатидилсерины, фосфатидилглицерины, фосфатидиновые кислоты, фосфатидилинозиты, диацилтриметиламмонийпропаны, диацилдиметиламмонийпропаны и стеариламин, нейтральные липиды, такие как триглицериды, и их сочетания. Они могут содержать холестерин либо могут не содержать холестерина. Из формулы (II) и других раскрываемых формул следует, что некоторые соединения в композициях по настоящему изобретению могут содержать один или несколько асимметричных атомов углерода в своей структуре. Предполагается, что настоящее изобретение охватывает стереохимически чистые изомерные формы соединений, а также их рацематы. Стереохимически чистые изомерные формы можно получить с применением правил, известных из уровня техники. Диастереоизомеры можно разделить при помощи способов физического разделения, таких как фракционная кристаллизация и хроматографическое разделение, а энантиомеры можно отделись друг от друга путем селективной кристаллизации диастереомерных солей с использованием оптически активных кислот или оснований или путем хиральной хроматографии. Чистые стереоизомеры также могут быть получены синтетически из подходящих стереохимически чистых исходных веществ или при помощи стереоспецифических реакций. Некоторые соединения в композициях по настоящему изобретению могут содержать различные индивидуальные изомеры, такие как транс и цис, и различные альфа и бета присоединения (ниже и выше плоскости схемы). Кроме того, когда способы получения соединений по настоящему изобретению приводят к получению смеси стереоизомеров, такие изомеры можно разделить традиционными методами,такими как препаративная хроматография. Соединения могут быть получены в виде отдельного стереоизомера или в рацемической форме в виде смеси некоторых возможных стереоизомеров. Нерацемические формы можно получить либо путем синтеза, либо разделением. Соединения, например, можно разделить на составляющие их энантиомеры стандартными методами, такими как образование диастереомерных пар путем солеобразования. Соединения также можно разделить путем ковалентного связывания с хиральным вспомогательным агентом с последующим хроматографическим разделением и/или кристаллографическим разделением и удалением хирального вспомогательного агента. Альтернативно, соединения можно разделить, используя хиральную хроматографию. Если не указано иное, предполагается, что настоящее изобретение охватывает все такие изомеры или стереоизомеры per se, а также смеси цис и транс изомеров, смеси диастереомеров и рацемические смеси энантиомеров (оптические изомеры). Терапевтический эффект ингибитора обратного поглощения глюкозы, вводимого отдельно или в сочетании с одним или несколькими антидиабетическими средствами при лечении диабета, синдрома X или связанных с ними симптомов или осложнений, может быть продемонстрирован при помощи способов, известных из уровня техники. Представленные ниже примеры комбинированного лечения при помощи ингибиторов SGLT и антидиабетических средств предназначены для иллюстрации настоящего изобретения, а не для его ограничения.G. Примеры химического синтеза. Настоящее изобретение направлено на замещенные индазолы формулы (II), как описано выше в разделе "Краткое описание изобретения", в описании и прилагаемой формуле изобретения. Такие раскрываемые соединения могут быть получены в соответствии с традиционными способами синтеза, принятыми в органической химии, или в соответствии со способами матричной или комбинаторной химии. Приведенные ниже схемы и примеры обеспечивают общее руководство. Спектры 1H ЯМР получали на спектрометре Brucker AC-300 (300 МГц), используя тетраметилсилан А. 1-(2,6-бис-Бензилокси-4-метилфенил)этанон. Смесь 1-(2,6-дигидрокси-4-метилфенил)этанона (0,83 г, 5,0 ммоль, Tsujihara et al. Med. Chem. 1999,42, 5311), бензилбромида (3,42 г, 20 ммоль) и карбоната калия (6,9 г, 50 ммоль) в ДМФА (15 мл) перемешивали при 80 С в течение 3 ч. Смесь фильтровали и фильтрат разбавляли этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток кристаллизовали из эфира/гексана с получением указанного в заголовке соединения (1,56 г, 90%) в виде не совсем белого твердого вещества.B. 1-(2,6-бис-Бензилокси-4-метилфенил)-3-(2,3-дигидробензофуран-5-ил)пропенон. К суспензии продукта части А (1,56 г, 4,5 ммоль) в 20 мл этанола добавляли порошкообразный гид- 20010655 роксид калия (0,5 г, 9 ммоль) и смесь перемешивали при комнатной температуре в течение 10 мин. Добавляли 2,3-дигидробензофуран-5-карбальдегид (1,66 г, 11 ммоль) и смесь перемешивали при комнатной температуре. Когда анализ ТСХ показал отсутствие какого-либо количества кетона (48 ч), добавляли воду для гашения реакции. Осажденное твердое вещество собирали фильтрованием, промывали водой, сушили и перекристаллизовывали из этанола/эфира с получением указанного в заголовке соединенияC. 3-(2,3-Дигидробензофуран-5-ил)-1-(2,6-дигидрокси-4-метилфенил)пропан-1-он. Раствор продукта части С (1,80 г, 3,78 ммоль) в этаноле (20 мл) и этилацетате (20 мл) гидрировали над 10% Pd-C (0,5 г) в атмосфере Н 2 (40 ф/кв.дюйм) в течение 4 ч. Катализатор удаляли фильтрованием и фильтрат концентрировали в вакууме. Остаток кристаллизовали из эфира/гексана с получением указанного в заголовке соединения (1,11 г, 98%) в виде белого твердого вещества.D. 3-[2-(2,3-Дигидробензофуран-5-ил)этил]-6-метил-1 Н-индазол-4-ол. К раствору продукта части С (0,30 г, 1 ммоль) в этиленгликоле (2 мл) добавляли гидразин (0,064 г,2 ммоль). Реакционную смесь перемешивали в течение 20 мин при комнатной температуре, затем нагревали до 160 С в течение 2 ч. Раствору давали охладиться до комнатной температуры и выливали в воду(10 мл). рН доводили до рН 7 добавлением уксусной кислоты и смесь экстрагировали этилацетатом. Органические экстракты промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток кристаллизовали из эфира/гексана с получением указанного в заголовке соединения (0,19 г, 65%) в виде не совсем белого твердого вещества. Е. 2-3-[2-(2,3-Дигидробензофуран-5-ил)этил]-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид и 2-3-[2-(2,3-дигидробензофуран-5-ил)этил]-6-метил-1 Н-индазол-4-илокси-6-O-ацетилD-глюкопиранозид. К раствору продукта части D (0,15 г, 0,5 ммоль) в ацетоне (1 мл) добавляли карбонат калия (0,35 г,2,5 ммоль) с последующим добавлением 2,3,4,6-тетра-О-ацетилD-глюкопиранозилбромида (0,41 г,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Затем твердые частицы фильтровали и промывали этилацетатом. Этилацетатный раствор промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток растворяли в метаноле (2 мл) и хлороформе (0,5 мл) с последующим добавлением избыточного количества карбоната калия. Полученную смесь перемешивали при комнатной температуре в течение ночи. Затем твердые частицы фильтровали и промывали этилацетатом. Этилацетатный раствор промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Продукт очищали хроматографией на силикагеле: при элюировании смесью метанол/хлороформ (5:100) получали указанное в заголовке соединение (0,010 г, выход: 4%, побочный продукт) в виде не совсем белого твердого вещества; при элюировании смесью метанол/хлороформ (10:100) получали указанное в заголовке соединение (0,096 г, выход 42%) в виде белого твердого вещества. 1 Н ЯМР (300 МГц, CD3OD)7,11 (с, 1 Н), 6,95 (д, J=8,23 Гц, 1 Н), 6,86 (с, 1 Н), 6,61-6,58 (м, 2 Н), 5,22 Указанное в заголовке соединение выделяли в виде побочного продукта в примере 1, часть Е. ЯМР (300 МГц, CD3OD)7,08 (с, 1 Н), 6,95-6,92 (м, 1 Н), 6,87 (с, 1 Н), 6,58 (д, J=6,67 Гц, 2 Н), 5,19- 21010655 Указанное в заголовке соединение получали из 1-(2,6-бис-бензилокси-4-метилфенил)этанона и 2,3 дигидробензо[1,4]диоксин-6-карбальдегида по той же методике, как описано в примере 1. 1 Н ЯМР (300 МГц, CD3OD)6,85 (с, 1 Н), 6,71-6,67 (м, 3H), 6,59 (с, 1 Н), 5,20 (д, J=7,51 Гц, 1 Н), 4,17 Указанное в заголовке соединение получали из 1-(2,6-бис-бензилокси-4-метилфенил)этанона и 2 нафтальдегида по той же методике, как описано в примере 1. 1 Н ЯМР (400 МГц, CD3OD)7,78 (м, 3H), 7,72 (с, 1 Н), 7,45-7,39 (м, 3H), 6,89 (с, 1 Н), 6,65 (с, 1 Н),5,27 (д, J=7,9 Гц, 1 Н), 3,93 (д, J=10,0 Гц, 1 Н), 3,76-3,66 (м, 2 Н), 3,58-3,53 (м, 4 Н), 3,48-3,32 (м, 3H), 2,45 (с,3H). МС: м/z (МН+) 465. Пример 5. 2-6-Метил-3-[2-(5,6,7,8-тетрагидронафталин-2-ил)этил]-1 Н-индазол-4-илоксиDглюкопиранозид. Промежуточное соединение 1-(2,6-бис-бензилокси-4-метилфенил)этанон обрабатывали 2-нафтальдегидом, как описано в примере 1, часть В. Последующее каталитическое гидрирование, как описано в примере 1, часть С, давало 1-(2,6-дигидрокси-4-метилфенил)-3-(5,6,7,8-тетрагидронафталин-2 ил)пропан-1-он в качестве побочного продукта. Последующая обработка этого побочного продукта, как описано в примере 1, часть D и Е, давала указанное в заголовке соединение. 1 ЯМР (400 МГц, CD3OD)7,02 (с, 1 Н), 6,93 (м, 2 Н), 6, 87 (с, 1 Н) 6,61 (с, 1 Н), 5,24 (д, J=7,73 Гц, 1 Н),3,94 (д, J=12,05 Гц, 1 Н), 3,75-3,34 (м, 5H), 3,25-2,72 (м, 8 Н), 2,43 (с, 3H), 1,81-1,77 (м, 4 Н). MC: м/z (MH+) 469. Пример 6. 2-3-[2-(6-Метоксинафталин-2-ил)этил]-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид. Указанное в заголовке соединение получали из 1-(2,6-бис-бензилокси-4-метилфенил)этанона и 6-метоксинафталин-2-карбальдегида по той же методике, как описано в примере 1. 1 Н ЯМР (300 МГц, CD3COCD3)7,75-7,7 (м, 3H), 7,5-7,45 (1 Н), 7,25-7,2 (м, 1 Н), 6,9 (с, 1 Н), 6,6 (с,1 Н), 5,77 (д, J=7 Гц, 1 Н), 3,89 (с, 3H), 3,75-3,7 (м, 2 Н), 3,65-3,55 (м, 3H), 3,5-3,1 (м, 4 Н), 2,39 (с, 3H). МС: м/z (МН+) 495. Пример 7. 2-3-[2-(6-Метокси-5,6,7,8-тетрагидронафталин-2-ил)этил]-6-метил-1 Н-индазол-4 илоксиD-глюкопиранозид. Промежуточное соединение 1-(2,6-бис-бензилокси-4-метилфенил)этанон обрабатывали 6-метоксинафталин-2-карбальдегидом, как описано в примере 1, часть В. Последующее каталитическое гидрирование, как описано в примере 1, часть С, давало 1-(2,6-дигидрокси-4-метилфенил)-3-(6-метокси 5,6,7,8-тетрагидронафталин-2-ил)пропан-1-он в качестве побочного продукта. Последующая обработка этого побочного продукта, как описано в примере 1, части D и Е, давала указанное в заголовке соединение. 1 Н ЯМР (300 МГц, CD3COCD3)7,2-7,0 (м, 2 Н), 6,95-6,35 (м, 3H), 6,6 (с, 1 Н), 5,6 (с, 1 Н), 5,27 (д,J=7 Гц, 1 Н), 3,95-3,85 (м, 1 Н), 3,75-3,55 (м, 6 Н), 3,37 (с, 3H), 3,3-3,2 (м, 1 Н), 3,1-2,6 (м, 8 Н), 2,05 (с, 3H). МС: м/z (МН+) 499. Пример 8. 2-3-[2-(6-Метокси-1,2,3,4-тетрагидронафталин-2-ил)этил]-6-метил-1 Н-индазол-4 илоксиD-глюкопиранозид. Промежуточное соединение 1-(2,6-бис-бензилокси-4-метилфенил)этанон обрабатывали 6-метоксинафталин-2-карбальдегидом, как описано в части В примера 1. Последующее каталитическое гидрирование, как описано в части С примера 1, давало 1-(2,6-дигидрокси-4-метилфенил)-3-(6-метокси-1,2,3,4-тетрагидронафталин-2-ил)пропан-1-он в качестве побочного продукта. Последующая обработка этого побочного продукта, как описано в примере 1, части Указанное в заголовке соединение получали из 1-(2,6-бис-бензилокси-4-метилфенил)этанона и 4-метоксибензальдегида по той же методике, как описано в примере 1. 1 Н ЯMР (300 МГц, CD3OD)7,18 (с, 1 Н), 7,15 (с, 1 Н), 6,86 (с, 1 Н), 6,82 (с, 1 Н), 6,80 (с, 1 Н), 6,61 (с,1 Н), 5,23 (д, J=7,78 Гц, 1 Н), 3,92 (дд, J=1,79, 10,04 Гц, 1 Н), 3,75 (с, 3H), 3,72-3,35 (м, 6 Н), 3,25-3,15 (м,1 Н), 3,10-2,94 (м, 2 Н), 2,43 (с, 3H). MC: м/z (MH+) 445. Пример 10. 2-3-[2-(4-Этоксифенил)этил]-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид. Указанное в заголовке соединение получали из 1-(2,6-бис-бензилокси-4-метилфенил)этанона и- 23010655 4-этоксибензальдегида по той же методике, как описано в примере 1. 1 Н ЯМР (300 МГц, CD3OD)7,16 (с. 1 Н), 7,14 (с, 1 Н) 6,86 (с, 1 Н), 6,81 (с, 1 Н), 6,78 (с, 1 Н), 6,61 (с,1 Н), 5,23 (д, J=7,67 Гц, 1 Н), 3,99 (кв, J=7,10, 7,01 Гц, 2 Н), 3,95-3,90 (м, 1 Н), 3,72 (дд, J=5,62, 6,42 Гц, 1 Н),3,65-3,35 (м, 7 Н), 3,25-3,15 (м, 1 Н), 3,10-2,96 (м, 2 Н), 2,53 (с, 3H), 1,36 (т, J=6,96 Гц, 3H). МС: м/z (МН+) 459. Пример 11. 2-3-[2-(4-Хлорфенил)этил]-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид. Указанное в заголовке соединение получали из 1-(2,6-бис-бензилокси-4-метилфенилэтанона и 4-хлорбензальдегида по той же методике, как описано в примере 1. 1 Н ЯМР (300 МГц, CD3OD)7,22 (с, 4 Н), 6,86 (с, 1 Н), 6,62 (с, 1 Н), 5,23 (д, J=7,48 Гц, 1 Н), 3,93 (дд,J=l,95, 10,16 Гц, 1 Н), 3,72 (дд, J=5,69, 6,40 Гц, 1 Н), 3,64-3,35 (м, 6 Н), 3,26-3,03 (м, 3H), 2,43 (с, 3H). МС: м/z (МН+) 449. Пример 12. 2-3-[2-(4-Трифторметилфенил)этил]-6-метил-1 Н-индазол-4-илоксиD-глюкопиранозид. Указанное в заголовке соединение получали из 1-(2,6-бис-бензилокси-4-метилфенилэтанона и 4-трифторметилбензальдегида по той же методике, как описано в примере 1. 1 Н ЯМР (400 МГц, CD3OD)7,56 (д, J=8,09 Гц, 2 Н), 7,45 (д, J=8,09 Гц, 2 Н), 6,90 (с, 1 Н), 6,66 (с, 1 Н),5,26 (д, J=7,7 Гц, 1 Н), 3,95 (д, J=10,09 Гц, 1 Н), 3,75 (м, 1 Н), 3,63-3,45 (м, 5 Н), 3,31-3,20 (м, 3H), 2,44 (с,3H). МС: м/z (МН+) 483. Пример 13. 2-[3-(2-Бензофуран-5-илэтил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид.(17,5 г, 140 ммоль) и карбоната калия (48 г, 350 ммоль) в ацетонитриле (280 мл) перемешивали при комнатной температуре в течение ночи. Смесь фильтровали и фильтрат разбавляли этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали хроматографией или сикагелем,элюируя смесью этилацетат/гексан (10:100), с получением указанного в заголовке соединения (13,1 г,выход: 89%) в виде желтого масла.B. 3-Бензофуран-5-ил-1-(2-гидрокси-6-метоксиметокси-4-метилфенил)пропан-1-он. 50% водный раствор гидроксида калия (6 мл) добавляли к раствору продукта части А (1,26 г,6 ммоль) в этаноле (30 мл) и смесь перемешивали при комнатной температуре в течение 10 мин. Затем добавляли 5-бензофуранкарбоксальдегид (0,95 г, 6,5 ммоль, Humphrey, Guy R., Патент США 5149838,1992) и смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси, содержащей активированный уголь, добавляли 4-(диметиламино)пиридин (0,73 г, 6 ммоль) и смесь гидрировали над 10% Pd-C (0,35 г) при 30 ф/кв.дюйм в течение 4 ч. Катализаторы удаляли фильтрованием,фильтрат нейтрализовали при помощи 10% водного раствора HCl и экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток кристаллизовали из этанола с получением указанного в- 24010655 заголовке соединения (1,23 г, 60%) в виде белого твердого вещества.C. 3-Бензофуран-5-ил-1-(2,6-дигидрокси-4-метилфенил)пропан-1-он. К раствору продукта части В (1,23 г, 3,6 ммоль) в диоксане (12 мл) и изопропаноле (6 мл) добавляли по каплям концентрированную HCl (1,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, гасили водой и экстрагировали этилацетатом. Органические экстракты промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле, элюируя смесью этилацетат/гексан(50:50), с получением указанного в заголовке соединения (0,46 г, выход 46%) в виде желтого твердого вещества.D. 2-[3-(2-Бензофуран-5-илэтил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид. Указанные в заголовке соединения получали из продукта части С по той же методике, как описано в примере 1, части D и Е. 1 Н ЯМР (300 МГц, CD3OD)7,69 (д, J=1,98 Гц, 1 Н), 7,51 (с, 1 Н), 7,37 (д, J=8,62 Гц, 1 Н), 7,22 (дд,J=1,23, 8,35 Гц, 1 Н), 6,89 (с, 1 Н), 6,79-6,78 (м, 1 Н), 6,65 (с, 1 Н), 5,26 (д, J=7,67 Гц, 1 Н), 3,97-3,93 (м, 1 Н),3,76-3,64 (м, 2 Н), 3,62-3,52 (м, 3H), 3,50-3,43 (м, 2 Н), 3,27-3,17 (м, 2 Н), 2,46 (с, 3H). MC: м/z (MH+) 455. Пример 14. 2-[3-2-Бензофуран-5-илэтил)-6-метил-1 Н-индазол-4-илокси]-6-O-ацетилD-глюкопиранозид. Указанное в заголовке соединение выделяли в виде побочного продукта в примере 13, часть D. Н ЯМР (300 МГц, CD3OD)7,66 (д, J=2,38 Гц, 1 Н), 7,48 (с, 1 Н), 7,37 (д, J=8,28 Гц, 1 Н), 7,20 (д,J=8,45 Гц, 1 Н), 6,90 (с, 1 Н), 6,77-6,75 (м, 1 Н), 6,60 (с, 1 Н), 5,23 (д, J=7,76 Гц, 1 Н), 4,45-4,40 (м, 1 Н), 4,254,19 (м, 1 Н), 3,75-3,63 (м, 2 Н), 3,59-3,42 (м, 3H), 3,25-3,15 (м, 3H), 2,45 (с, 3H), 1,93 (с, 3H). МС: м/z (MH+) 497. Пример 15. 2-3-[2-(2,3-Дигидробензофуран-5-ил)этил]-1,6-диметил-1 Н-индазол-4-илокси]Dглюкопиранозид. 1A. 3-[2-(2,3-Дигидробензофуран-5-ил)этил]-1,6-диметил-1 Н-индазол-4-ол. К раствору 3-(2,3-дигидробензофуран-5-ил)-1-(2,6-дигидрокси-4-метилфенил)пропан-1-она (0,30 г,1 ммоль, полученного по той же методике, как описано в примере 1, часть С) в этиленгликоле 2 мл) добавляли метилгидразин (0,092 г, 2 ммоль). Реакционную смесь перемешивали в течение 20 мин при комнатной температуре, затем нагревали до 160 С в течение 2 ч. Раствору давали охладиться до комнатной температуры и выливали в воду (50 мл). рН доводили до 7 добавлением уксусной кислоты и смесь экстрагировали этилацетатом. Органические экстракты промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток кристаллизовали из эфира/гексана с получением указанного в заголовке соединения (0,12 г, 40%) в виде не совсем белого твердого вещества.B. 2-3-[2-(2,3-Дигидробензофуран-5-ил)этил]-1,6-диметил-1 Н-индазол-4-илоксиD-глюкопиранозид. Указанное в заголовке соединение получали из продукта части D по той же методике, как описано в примере 1, часть Е. 1 Н ЯМР (300 МГц, CD3OD)7,10 (с, 1 Н), 6,94 (д, J=8,09 Гц, 1 Н), 6,85 (с, 1 Н), 6,85-6,61 (м, 1 Н), 6,58A. 3-(4-Аминофенил)-1-(2,6-бис-бензилокси-4-метилфенил)пропенон. Смесь 1-(2,6-бис-бензилокси-4-метилфенил)этанона (1,2 г, 3,5 ммоль), полученного, как описано в части А примера 1, 4-аминобензальдегида и порошкообразного гидроксида калия (0,4 г, 6,9 ммоль) в этаноле (20 мл) обрабатывали, как описано в части В примера 1 с получением продукта в виде твердого вещества. Твердые частицы (1,1 г, 2,24 ммоль) суспендировали в метаноле (25 мл) и обрабатывали концентрированной хлористо-водородной кислотой (1,5 мл). Смесь перемешивали при температуре кипения с обратным холодильником в течение 40 мин, охлаждали до комнатной температуры (КТ) и медленно добавляли насыщенный раствор бикарбоната натрия. Метанол удаляли при пониженном давлении и водную смесь экстрагировали этилацетатом (260 мл). Объединенные этилацетатные экстракты промывали насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде полутвердого вещества (0,892 г, 89%).B. N-4-[3-(2,6-бис-Бензилокси-4-метилфенил)-3-оксопропенил]фенилметансульфонамид. Метансульфонилхлорид (0,16 мл, 2,1 ммоль) добавляли по каплям к охлажденной (0 С) смеси соединения, полученного в части А, и триэтиламина (0,69 мл, 5 ммоль) в метиленхлориде (30 мл). Полученную гомогенную смесь перемешивали при 0 С в течение 1 ч, затем нагревали до КТ. После выдерживания смеси еще в течение 30 мин при КТ добавляли ледяную воду (30 мл) и слои разделяли. Органический экстракт промывали раствором 0,5 М HCl (130 мл), затем H2O (130 мл) и сушили над MgSO4. Смесь фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения (0,98 г, 94%). С. 2-3-[2-(4-Метансульфониламинофенил)этил]-6-метил-1 Н-индазол-4-илокси)D-глюкопиранозид. Соединение, полученное в части В, обрабатывали, как описано в примере 1, части С, D и Е, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества. 1 Н ЯМР (300 МГц, CD3OD)7,23 (д, J=8,48 Гц, 2 Н), 7,13 (д, J=8,36 Гц, 2 Н), 6,86 (с, 1 Н), 6,61 (с, 1 Н),7,20 (д, J=7,51 Гц, 1 Н), 3,95-3,91 (м, 1 Н), 3,74-3,37 (м, 5 Н), 3,26-3,05 (м, 4 Н), 2,90 (с, 3H), 2,43 (с, 3H). МС: м/z (МН+) 508. Пример 17. 2-[3-(2-Циклогексилэтил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид.(1,5 мл,1,5 ммоль,2 М раствор в смеси гептан/тетрагидрофуран/этилбензол) медленно добавляли к охлажденному (-78 С) раствору 1-(2,6-бисбензилокси-4-метилфенил)этанона, полученному в части А примера 1, в безводном ТГФ (10 мл). Смесь перемешивали при -78 С при медленном нагревании до 0 С в течение 60 мин, затем снова охлаждали до-30 С и добавляли по каплям 1-циклогексен-1-карбоксальдегид (256 мг, 2,3 ммоль). После выдерживания в течение 3 ч при комнатной температуре смесь охлаждали на ледяной бане и гасили насыщенным раствором хлорида аммония (5 мл). Добавляли воду (50 мл) и смесь экстрагировали этилацетатом (260 мл). Объединенные этилацетатные экстракты промывали насыщенным солевым раствором, сушили надMgSO4, фильтровали, упаривали в вакууме и очищали колоночной хроматографией с получением указанного в заголовке соединения (0,166 г, 51% в расчете на выделенное исходное вещество).B. 3-Циклогексил-1-(2,6-дигидрокси-4-метилфенил)пропан-1-он. Раствор соединения (0,16 г, 0,37 ммоль), полученного в части А, в смеси этанола и этилацетата (1:1) гидрировали над каталитическим количеством 10% Pd-C в аппарате Парра (Parr) при давлении водорода 15 ф/кв.дюйм в течение 24 ч. Смесь фильтровали через CELITE и упаривали в вакууме с получением указанного в заголовке соединения (0,093 г, 97%).C. 2-[3-(2-Циклогексилэтил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид. Соединение, полученное в части В, обрабатывали, как описано в примере 1, части D и Е, с получением указанного в заголовке соединения в виде не совсем белого твердого вещества. 1 Указанное в заголовке соединение получали из 1-(2,6-дигидроксифенил)этанона и 5-бензофуранкарбоксальдегида по той же методике, как описано в примере 13. 1 Н ЯМР (300 МГц, CD3OD)7,67 (д, J=2,2 Гц, 1 Н), 7,49 (с, 1 Н), 7,37 (д, J=8,42 Гц, 1 Н), 7,29 (д,J=8,11 Гц, 1 Н), 7,25-7,19 (м, 1 Н), 7,08 (д, J=8,3 Гц, 1 Н), 6,78-6,75 (м, 2 Н), 5,26 (д, J= 7,71 Гц, 1 Н), 3,92 (дд,J=11,79, 1,88 Гц, 1 Н), 3,75-3,63 (м, 1 Н), 3,62-3,54 (м, 3H), 3,53-3,45 (м, 3H), 3,26-3,18 (м, 2 Н). MC: m/z А. 1-(2,6-Дигидрокси-4-этилфенил)этанон. Раствор 1,3-диацетоксиацетофенона (3,2 г, 13,5 ммоль) в уксусной кислоте (30 мл) гидрировали над 10% Pd-C (3,0 г) в атмосфере Н 2 (50 ф/кв.дюйм) в течение ночи. Катализатор удаляли фильтрованием и фильтрат концентрировали в вакууме. Полученный неочищенный продукт (1,3-диацетокси-5 этилбензол) непосредственно использовали на следующей стадии. К суспензии AlCl3 (5,4 г, 40,6 ммоль) в хлорбензоле (15 мл) добавляли по каплям раствор 1,3-диацетокси-5-этилбензола (3,0 г, 13,5 ммоль) при 90 С в течение 30 мин. Реакционную смесь перемешивали при 90 С в течение 1 ч и затем выливали в смесь лед-10% HCl (50 мл, следует уточнить). Водный слой экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток кристаллизовали из эфира/гексана с получением указанного в заголовке соединения (1,5 г, 62%) в виде белого твердого вещества. В. 2-3-[2-(2,3-Дигидробензофуран-5-ил)этил]-6-этил-1 Н-индазол-4-илоксиD-глюкопиранозид. Указанное в заголовке соединение получали из продукта части А и 2,3-дигидробензофуран-5 карбальдегида по той же методике, как описано в примере 1. 1 Н ЯМР (300 МГц, CD3OD)7,10 (с, 1 Н), 6,95 (д, J=7,90 Гц, 1 Н), 6,88 (с, 1 Н), 6,64 (с, 1 Н), 6,60 (д,J=8,11 Гц, 1 Н), 5,24 (д, J=7,38 Гц, 1 Н), 4,48 (т, J=8,69 Гц, 2 Н), 3,93 (дд, J=1,92, 9,97 Гц, 1 Н), 3,72 (дд,J=5,75, 6,58 Гц, 1 Н), 3,66-3,35 (м, 6 Н), 3,25-3,19 (м, 1 Н), 3,15 (т, J=8,62 Гц, 2 Н), 3,08-2,92 (м, 2 Н), 2,72 (кв,J=7,54, 7,57 Гц, 2 Н), 1,29 (т, J=7,47 Гц, 3H). MC: M/Z (MH+) 471. Пример 20. 2-[3-(4-Метоксифенилсульфанилметил)-1 Н-индазол-4-илокси]D-глюкопиранозид. А. 1-[4-(трет-Бутилдиметилсиланилокси)-3-метилиндазол-1-ил]этанон. К раствору 4-(трет-бутилдиметилсиланилокси)-3-метил-1 Н-индазола (200 мг, 0,76 ммоль), полученного, как описано Boehm et al. J. Med. Chem., 2000, 43, 2664-2674, в ДМФА (3 мл) при комнатной температуре добавляли карбонат калия (516 мг, 3,80 ммоль) с последующим добавлением уксусного ангидрида (143 мл, 1,52 ммоль) и полученную смесь оставляли для перемешивания при комнатной темпе- 27010655 ратуре в течение 2 ч. Реакционную смесь выливали на воду и экстрагировали этилацетатом. Объединенные этилацетатные экстракты сушили над безводным сульфатом натрия и концентрировали в вакууме. Хроматография (SiO2, элюент 20% этилацетат-гексан) давала 200 мг желаемого продукта в виде не совсем белого твердого вещества. (231 мг, выход 87%).B. 1-[3-Бромметил-4-(трет-бутилдиметилсиланилокси)индазол-1-ил]этанон. К раствору ацетильного соединения, полученного на предыдущей стадии (1,9 г, 6,25 ммоль), в тетрахлориде углерода при комнатной температуре добавляли AIBN (205 мг, 1,25 ммоль) и NBS (1,45 г,8,13 ммоль). Полученную реакционную смесь оставляли для перемешивания при температуре кипения с обратным холодильником в течение 1 ч, затем охлаждали до комнатной температуры и перемешивали еще в течение 18 ч. Реакционную смесь концентрировали в вакууме. Хроматография (SiO2, элюент 5% этилацетат-гексан) давала желаемый бромид в виде масла темно-красного цвета с количественным выходом.C. 1-[4-(трет-Бутилдиметилсиланилокси)-3-(4-метоксифенилсульфанилметил)индазол-1-ил]этанон. К раствору бромида, полученного на предыдущей стадии (0,2 г, 0,522 ммоль), в метиленхлориде при комнатной температуре добавляли триэтиламин (0,055 г, 0,548 ммоль) и 4-метоксибензолтиол(0,077 г, 0,548 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь разбавляли метиленхлоридом и промывали водой, насыщенным солевым раствором,сушили над сульфатом магния, фильтровали и концентрировали в вакууме. Хроматография (SiO2, элюент 5% этилацетат: гексан) давала 0,2 г желаемого продукта в виде не совсем белого твердого веществаD. 1-[4-Гидрокси-3-(4-метоксифенилсульфанилметил)индазол-1-ил]этанон. К раствору соединения, полученного в части С (0,2 г, 0,452 ммоль), в ДМФА при комнатной температуре добавляли фторид калия (0,053 г, 0,905 ммоль) и 48% водный раствор бромистого водорода(0,03 мл, 0,136 ммоль) и полученную смесь оставляли для перемешивания при комнатной температуре в течение 5 дней. Реакционный раствор выливали в насыщенный раствор бикарбоната натрия и экстрагировали смесью этилацетат/гексан (3:1). Объединенные этилацетатные экстракты промывали водой, насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме. Хроматография (SiO2, элюент 10% этилацетат:гексан) давала указанное в заголовке соединение (0,076 г, 50%) в виде не совсем белого твердого вещества. Е. 2-[1-Ацетил-3-(4-метоксифенилсульфанилметил)-1 Н-индазол-4-илокси]D-глюкопиранозид. К раствору гидроксильного соединения, полученного в части D (0,076 г, 0,244 ммоль), в ацетоне при комнатной температуре добавляли карбонат калия (0,085 г, 0,61 ммоль) и 2,3,4,6-тетра-О-ацетил-D-глюкопиранозилбромид (0,15 г, 0,366 ммоль) и полученную смесь оставляли для перемешивания при комнатной температуре 24 ч. Реакционную смесь разбавляли водой, ацетон удаляли и продукт экстрагировали этилацетатом. Объединенные этилацетатные экстракты промывали насыщенным солевым раствором, сушили над MgSO4, фильтровали и концентрировали в вакууме. Хроматография (SiO2, элюент 25% этилацетат:гексан) давала ацетилированное промежуточное соединение (0,065 г, 40%) в виде не совсем белого твердого вещества. К раствору этого промежуточного соединения (0,065 г, 0,099 ммоль) в метаноле при комнатной температуре добавляли метоксид натрия в метаноле (0,1 мл, 0,463 ммоль) и полученную реакционную смесь оставляли для перемешивания при комнатной температуре в течение 1 ч. Реакционную смесь разбавляли водой, метанол удаляли и продукт экстрагировали этилацетатом. Объединенные этилацетатные экстракты промывали насыщенным солевым раствором, сушили над MgSO4,фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения (0,036 г,80%) в виде не совсем белого твердого вещества. 1A. 1-(2,6-Дигидрокси-4-метилфенил)-2-(4-метоксифенил)этанон (NB18926-186). К смеси 5-метилбензол-1,3-диола (0,37 г, 3 ммоль) и (4-метоксифенил)уксусной кислоты (0,55 г, 3 ммоль) добавляли по каплям диэтилэтерат трифторида бора (1,5 мл, 12 ммоль). Реакционную смесь нагревали до 100 С и перемешивали в течение 2 ч. После охлаждения до комнатной температуры смесь выливали в водный раствор ацетата натрия и перемешивали в течение 5 мин, затем экстрагировали этил- 28010655 ацетатом. Органические экстракты промывали насыщенным солевым раствором, сушили над безводнымNa2SO4 и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле: элюирование смесью ацетон/этилацетат/гексан (12:4:100) давало указанное в заголовке соединение(0,24 г, 29%) в виде желтого твердого вещества; элюирование смесью ацетон/этилацетат/гексан(15:5:100) давало 1-(2,4-дигидрокси-6-метилфенил)-2-(4-метоксифенил)этанон (0,48 г, 59%) в виде желтого твердого вещества.B. 2-[3-(4-Метокибензил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид. Указанное в заголовке соединение получали из продукта части А по той же методике, как описано в примере 1, часть D и часть Е. 1 Н ЯМР (300 МГц, CD3OD)7,22 (д, J=8,69 Гц, 1H), 6,87 (с, 1 Н), 6,78 (д, J=8,57 Гц, 2 Н), 6,58 (с, 1 Н),5,12 (д, J=7,64 Гц, 1 Н), 4,49 (д, J=15,12 Гц, 1 Н), 4,24 (д, J=15,06 Гц, 1 Н), 3,89 (дд, J=2,07, 12,06 Гц, 1 Н),3,73 (с, 3H), 3,70-3,62 (м, 2 Н), 3,58-3,45 (м, 2 Н), 3,39 (д, J=8,71 Гц, 1 Н), 2,41 (с, 3H). МС: м/z (МН+) 431. Пример 22. 2-[3-(2,3-Дигидробензофуран-5-илметил)-6-метил-1 Н-индазол-4-илокси]D-глюкопиранозид. Указанное в заголовке соединение получали из 5-метилбензол-1,3-диола и (2,3-дигидробензофуран 5-ил)уксусной кислоты по той же методике, как описано в примере 16. 1 Н ЯМР (300 МГц, CD3OD)7,16 (с, 1 Н), 7,03 (д, J=7,80 Гц, 1 Н), 6,86 (с, 1 Н), 6,59-6,56 (м, 2 Н), 5,12(д, J=7,47 Гц, 1 Н), 4,48-4,43 (м, 3H), 4,23 (д, J=15,07 Гц, 1 Н), 3,90 (дд, J=1,63, 12,03 Гц, 1 Н), 3,70-3,59 (м,2 Н), 2,57-3,51 (м, 2 Н), 3,48-3,35 (м, 1 Н), 3,11 (д, J=8,73 Гц, 2 Н), 2,41 (с, 3H). МС: м/z (МН+) 443. Н. Биологические примеры. Пример 1. Материалы и методы. Клонирование кДНК SGLT1 человека и кДНК SGLT2 человека и конструкция вектора экспрессии млекопитающего: кДНК SGLT1 человека (Genbank M24847) клонировали из тонкого кишечника человека. кДНК SGLT2 человека (Genbank M95549) клонировали из почки человека. Обе полноразмерные кДНК были субклонированы в пкДНК и секвенированы для подтверждения целостности конструкции. Генерация клеток CHO-K1, стабильно экспрессирующих человеческий SGLT1 или человеческийSGLT2. Трансфекцию клеток CHO-K1 осуществляли при помощи реагента DMRIE-C (Life Technologies,Gaithersburg, MD). Трансфектанты затем отбирали в присутствии антибиотика G418 (Gibco-BRL, GrandIsland, NY) при концентрации 400 мкг/мл. Отдельные клоны затем идентифицировали при помощи функционального анализа, описанного ниже. Клеточный анализ на натрийзависимый транспорт глюкозы. Клеточные линии, стабильно экспрессирующие SGLT1 или SGLT2 человека, затем использовали для функционального анализаNa+-зависимого поглощения глюкозы. Вкратце, клетки высевали в 96-луночный планшет при плотности 65000 клеток на лунку и давали им расти в течение 48 ч. Клетки затем промывали один раз бефером для анализа (50 мМ HEPES рН 7,4, 20 мМ Трис, 5 мМ KCl, 1 мМ MgCl2, 1 мМ CaCl2 и 137 мМ NaCl) и обрабатывали соединением в отсутствие или в присутствии NaCl в течение 15 мин. Затем клетки метили 14 Сметилглюкопиранозидом (AMG, Sigma, St. Louis, МО), неметаболизируемым аналогом глюкозы,специфическим в отношении натрийзависимых транспортеров глюкозы, как было описано ранее (Peng,H. and Lever J.E. Post-transcriptional regulation of Na+/glucose cotransporter (SGLT1) gene expression inLLC-PK1 cells. J Biol Chem 1995;270:20536-20542.). Через 2 ч меченые клетки промывали три раза ледяным PBS. После аспирации клетки солюбилизировали, используя Microscint 20 (Packard, Meriden, CT) и определяли количество поглощенного Na-зависимого 14C-AMG путем измерения радиоактивности. Планшеты считывали при помощи TopCount (Packard, Meriden, CT). Результаты представляли как % ингибирования или в виде значений ИК 50, полученные из соответствующего эксперимента. Расхождение для функционального анализа было в пределах 20%. Пример 2. In Vivo анализ эффективности. Самцов диабетических крыс Zucker (ZDF) (7-8 недель), страдающих ожирением, получали отCharles River. Животных выдерживали в помещении с контролируемой температурой и 12-часовым циклом свет/темнота. Животным обеспечивали неограниченный доступ к пище (стандартный корм для грызунов Purina 5008) и воде. Животные голодали в течение 12 ч перед началом эксперимента. Утром в день эксперимента животным перорально вводили носитель (0,5% метилцеллюлоза) или соединение (1 мл/кг). Через 1 ч животные получали сахарную нагрузку путем перорального введения (4 мл/кг 50% раствор), и- 29010655 их сразу же помещали в клетки для наблюдения за метаболизмом. Животным обеспечивали свободный доступ к воде и собирали мочу в течение 4 ч. Определяли количество глюкозы в моче, используя реагентTrinder (Sigma). Пример 3. Действие на содержание глюкозы в плазме, содержание инсулина в плазме, содержание триглицеридов в плазме, содержание свободных жирных кислот в плазме, массу печени и массу тела. Для исследования эффекта ингибитора SGLT в сочетании с агонистом RXR, самок мышей db/dbSGLT. Мышам (n=8 животных/группа) перорально вводили соединения или носитель в объеме 10 мл/кг массы тела. Массу тела определяли в день 1 перед введением доз и в дни 4, 8 и 11. Через 18 ч после введения последней дозы мышей взвешивали и анестезировали CO2/O2 (70:30). Затем у мышей брали кровь путем пункции в ретро-орбитальный синус, собирая кровь в 2-мл гепаринизированные полипропиленовые пробирки на льду. Образцы плазмы затем анализировали на содержание глюкозы, инсулина, триглицеридов и свободных жирных кислот. Печень мышей вырезали, взвешивали и замораживали. Ингибиторы SGLT и агонисты RXR имеют разный механизм действия. Улучшенный гликемический контроль, определенный как снижение содержания глюкозы в плазме, содержания инсулина в плазме, содержания свободных жирных кислот в плазме или содержания триглицеридов в плазме или их сочетание, можно наблюдать при более низких концентрациях агониста RXR при введении в сочетании с ингибитором SGLT. Поэтому может быть явный сдвиг влево кривой доза-ответ для эффекта агонистаRXR на указанные выше параметры. Кроме того, прибавка в весе, наблюдаемая после лечения агонистами RXR, является менее выраженной при введении с ингибитором SGLT, поскольку то, что ингибиторыSGLT способствуют экскреции глюкозы в мочу и потере калорий организмом, демонстрируется путем снижения веса или прибавки в весе. Также, поскольку ингибиторы SGLT способствуют слабому диурезу,отек (и прибавка в весе за счет отеков), обычно наблюдаемый после лечения агонистами RXR, может быть менее выраженным или отсутствовать. Уменьшение количества агониста RXR, которое необходимо для достижения эффективности, в свою очередь, улучшает профиль побочных эффектов. Уменьшенные побочные эффекты включают такие состояния, как ожирение печени, увеличенная масса печени, увеличение массы тела, увеличение массы сердца, отек, гипертрофию сердца, гапатогипертрофию, гипогликемию и гепатотоксичность или любое их сочетание. Пример 4. Действие на содержание глюкозы в плазме, HbA1c, гематокритное число, содержание инсулина в плазме, содержание триглицеридов в плазме, содержание свободных жирных кислот в плазме, общий холестерин, HDL, уровни лекарственных средств в плазме, массу печени, массу сердца, содержание жиров и массу тела. Для исследования эффекта ингибитора SGLT в сочетании с агонистом RXR самцов крыс ZDF (возраст 6 недель/GMI) обрабатывали ежедневно в течение 28 дней носителем (0,5% метилцеллюлоза), агонистом RXR (0,1-10 мг/кг), ингибитором SGLT (3-100 мг/кг) или агонистом RXR плюс ингибитор SGLT. Крысам (n=8 животных/группа) перорально вводили испытываемые соединения или носитель в объеме 2 мл/кг массы тела. Массу тела определяли в день 1 перед началом введения доз и два раза в неделю в течение всего периода исследования. В день перед введением конечной дозы животные голодали в течение ночи. Через час после введения последней дозы крыс взвешивали и анестезировали СО 2/О 2 (70:30). Затем у крыс брали кровь путем пункции в ретроорбитальный синус, собирая кровь в 2-мл гепаринизированные полипропиленовые пробирки на льду. Затем крысы получали сахарную нагрузку (2 мл/кг п.о.),и их помещали в клетки для наблюдения за метаболизмоми для сбора мочи (4 ч). Животных затем умерщвляли и скопление жировой ткани в эпидидимисе, печень и сердце животных вырезали, взвешивали и замораживали для гистологического исследования. Затем образцы плазмы анализировали на содержание глюкозы, HbA1c, инсулина, гематокритное число, уровни содержания в плазме лекарственных средств,общий холестерин, HDL, содержание свободных жирных кислот и содержание триглицеридов в плазме. Определяли объем мочи и содержание в моче глюкозы, белка, осмолярность, содержание электролитов(Na, K, Cl), BUN и креатинина. Ингибиторы SGLT и другие антидиабетические средства, такие как агонисты RXR, имеют разный механизм действия. Улучшенный гликемический контроль, определенный как снижение содержания глюкозы в плазме, HbA1c, содержания инсулина в плазме, или содержания триглицеридов в плазме, или их сочетание, можно наблюдать при более низких концентрациях агониста RXR при введении в сочетании с ингибитором SGLT. Поэтому может быть явный сдвиг влево кривой доза-ответ для эффекта агониста RXR на указанные выше параметры. Кроме того, прибавка в весе, наблюдаемая после лечения агонистами RXR, является менее выраженной при введении с ингибитором SGLT, поскольку то, что ингибиторы SGLT способствуют экскреции глюкозы в мочу и потере калорий организмом, демонстрируется путем снижения веса или прибавки в весе. Также, поскольку ингибиторы SGLT способствуют слабому диурезу, отек (и прибавка в весе за счет отеков), обычно наблюдаемый после лечения агонистами RXR,может быть менее выраженным или отсутствовать. Это может быть продемонстрировано путем снижения индуцированного агонистом RXR увеличения массы сердца. Уменьшение количества агониста RXR,которое необходимо для достижения эффективности, в свою очередь, улучшает профиль побочных эф- 30
МПК / Метки
МПК: C07D 401/04
Метки: замещенные, индазол-о-глюкозиды
Код ссылки
<a href="https://eas.patents.su/30-10655-zameshhennye-indazol-o-glyukozidy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные индазол-о-глюкозиды</a>
Предыдущий патент: Вмонтированная в стену распределительная коробка водоснабжения
Следующий патент: Тетрагидрохинолиноны и их применение в качестве антагонистов метаботропных глутаматных рецепторов
Случайный патент: Рекомбинантный вирус сендай с ослабленной способностью к репликации, предназначенный для использования в качестве вакцин