Производное n,n’ -дифенилмочевины, фармацевтическая композиция (варианты) и способ лечения и предупреждения заболеваний и состояний с его использованием (варианты)
Номер патента: 10485
Опубликовано: 30.10.2008
Авторы: Уилхелм Скотт, Бойер Стивен, Дюма Жак, Ридль Бернд
Формула / Реферат
1. Производное N,N'-дифенилмочевины формулы (I)
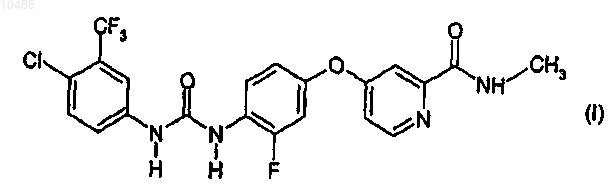
его соль, или 1-оксопиридинпроизводное, или стереоизомер.
2. Производное по п.1, отличающееся тем, что его соль представляет собой основную соль органической или неорганической кислоты, выбранной из группы: хлористо-водородная, бромисто-водородная, серная, фосфорная, метансульфоновая, трифторметансульфоновая, бензолсульфоновая, п-толуолсульфоновая, 1-нафталинсульфоновая, 2-нафталинсульфоновая, уксусная, трифторуксусная, яблочная, винная, лимонная, молочная, щавелевая, янтарная, фумаровая, малеиновая, бензойная, салициловая, фенилуксусная или миндальная кислота, или кислотную соль органического или неорганического основания, содержащую катион, выбранный из группы: катион щелочного или щелочно-земельного металла, аммония, алифатически или ароматически замещенного аммония.
3. Производное N,N'-дифенилмочевины, представляющее собой гидрохлорид, бензолсульфонат или метансульфонат N-(4-хлор-3-(трифторметил)фенил)-N'-2-фтор-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевины.
4. Фармацевтическая композиция, отличающаяся тем, что она содержит производное по п.1 и физиологически приемлемый носитель.
5. Фармацевтическая композиция для лечения у человека или другого млекопитающего регулируемого протеинкиназой заболевания, ассоциированного с аберрацией пути сигнальной трансдукции протеинкиназы, отличающаяся тем, что она содержит производное по п.1 и физиологически приемлемый носитель.
6. Фармацевтическая композиция для лечения гиперпролиферативного нарушения, отличающаяся тем, что она содержит производное по п.1 и физиологически приемлемый носитель.
7. Фармацевтическая композиция для подавления роста раковых клеток, отличающаяся тем, что она содержит производное по п.1 и физиологически приемлемый носитель.
8. Фармацевтическая композиция, отличающаяся тем, что она содержит фармацевтически приемлемую соль N-(4-хлор-3-(трифторметил)фенил)-N'-2-фтор-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевины и физиологически приемлемый носитель.
9. Способ регуляции сигнальной трансдукции тирозинкиназы, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1.
10. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое регулируется тирозинкиназой и ассоциировано с аберрацией пути сигнальной трансдукции тирозинкиназы, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1.
11. Способ лечения или предупреждения у человека и/или другого млекопитающего заболевания, которое представляет собой VEGFR-2-опосредованное нарушение, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1.
12. Способ лечения или предупреждения у человека и/или другого млекопитающего заболевания, которое представляет собой PDGFR-опосредованное нарушение, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1.
13. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое представляет собой raf-опосредованное нарушение, отличающийся тем, что человеку или другому производное по п.1.
14. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое представляет собой р38-опосредованное нарушение, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1.
15. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое представляет собой VEGF-опосредованное нарушение, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1.
16. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое представляет собой гиперпролиферативное, воспалительное нарушение и/или нарушение ангиогенеза, заключающийся в том, что человеку или другому млекопитающему вводят производное по п.1.
17. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое представляет собой гиперпролиферативное нарушение, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1.
18. Способ по п.17, отличающийся тем, что гиперпролиферативное нарушение представляет собой рак.
19. Способ по п.18, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1 в комбинации с одним или несколькими дополнительными противораковыми агентами.
20. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, характеризующегося патологическими процессами ангиогенеза или гиперпроницаемости, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1.
21. Способ по п.20, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1 одновременно с другим агентом против ангиогенеза в виде одного или раздельных препаратов.
22. Способ лечения или предупреждения у человека и/или других млекопитающих по меньшей мере одного из состояний, выбранных из группы: рост опухоли, ретинопатия, ишемическая закупорка вены сетчатки, ретинопатия преждевременного развития, старческая макулярная дегенерация, ревматоидный артрит, псориаз, буллезное нарушение, ассоциированное с образованием субэпидермальных волдырей, включая буллезный пемфигоид, мультиформная эритема или герпетиформный дерматит, ревматоидный артрит, остеоартрит, септический артрит, метастазы опухоли, заболевание периодонта, изъязвление роговицы, протеинурия и тромбоз коронарных артерий вследствие атеросклеротической бляшки, аневризматическая аорта, контроль рождаемости, дистрофобный буллезный эпидермолиз, дегенеративная потеря хряща после травматического повреждения сустава, остеопороз, опосредованный активностью ММР, заболевание височно-нижнечелюстного сустава или демиелинизирующее заболевание нервной системы, заключающийся в том, что человеку или другому млекопитающему вводят производное по п.1.
23. Способ лечения или предупреждения у человека и/или других млекопитающих по меньшей мере одного из состояний, выбранных из группы: рост опухоли, ретинопатия, ишемическая закупорка вены сетчатки, ретинопатия преждевременного развития, старческая макулярная дегенерация, ревматоидный артрит, псориаз, буллезное нарушение, ассоциированное с образованием субэпидермальных волдырей, включая буллезный пемфигоид, мультиформная эритема или герпетиформный дерматит, в комбинации с другим состоянием, выбранным из группы: ревматическая атака, резорбция костей, постменструальный остеопороз, сепсис, сепсис, вызываемый грамотрицательными микроорганизмами, септический шок, эндотоксический шок, синдром токсического шока, синдром системного воспалительного ответа, воспалительная болезнь кишки (болезнь Крона и язвенный колит), реакция Jarisch-Herxheimer, астма, респираторный дистресс-синдром взрослых, острое легочное фибротическое заболевание, легочный саркоидоз, аллергическое респираторное заболевание, силикоз, пневмокониоз шахтеров, альвеолярное повреждение, печеночная недостаточность, болезнь печени во время острого воспаления, тяжелый алкогольный гепатит, малярия (малярия, вызываемая Plasmodium falciparum, и церебральная малярия), инсулиннезависимый сахарный диабет (NIDDM), застойная сердечная недостаточность, повреждение вследствие сердечного заболевания, атеросклероз, болезнь Альцгеймера, острый энцефалит, повреждение головного мозга, рассеянный склероз (демиелинизация и утрата олигодендроцитов при рассеянном склерозе), запущенный рак, злокачественные заболевания лимфоидной природы, панкреатит, нарушение заживания ран при инфекции, воспалении и раке, миелодиспластические синдромы, системная красная волчанка, билиарный цирроз печени, некроз кишки, повреждение при облучении/токсичности после введения моноклональных антител, реакция хозяина против трансплантата (ишемическое реперфузионное повреждение и отторжение аллотрансплантатов почки, печени, сердца и кожи), отторжение аллотрансплантата легкого (облитерирующий бронхит) или осложнение вследствие общхую эндопротезирования тазобедренного сустава, заключающийся в том, что человеку или другому млекопитающему вводят производное по п.1.
24. Способ лечения или предупреждения у человека и/или других млекопитающих по меньшей мере одного из состояний, выбранных из группы: рост опухоли, ретинопатия, диабетическая ретинопатия, ишемическая закупорка вены сетчатки, ретинопатия преждевременного развития, старческая макулярная дегенерация, ревматоидный артрит, псориаз, буллезное нарушение, ассоциированное с образованием субэпидермальных волдырей, включая буллезный пемфигоид, мультиформная эритема или герпетиформный дерматит, в комбинации с инфекционным заболеванием, выбранным из группы: туберкулез, инфекция Helicobacter pylori при заболевании пептической язвой, болезнь Шага, возникающая в результате инфекции Trypanosomacruzi, эффекты шига-подобного токсина, возникающие в результате инфекции Е. coli, эффекты энтеротоксина А, возникающие в результате инфекции Staphylococcus, менингококковая инфекция и инфекция Borrelia burgdorferi, Treponema pallidum, цитомегаловируса, вируса гриппа, вируса энцефаломиелита и вируса иммунодефицита человека (ВИЧ), заключающийся в том, что человеку или другому млекопитающему вводят производное по п.1.
25. Способ по п.19, отличающийся тем, что дополнительный противораковый агент выбран из группы, включающей аспарагиназу, блеомицин, карбоплатину, кармустин, хлорамбуцил, цисплатину, коласпазу, циклофосфамид, цитарабин, дакарбазин, дактиномицин, даунорубицин, доксорубицин (адриамицин), эпирубицин, этопозид, 5-фторурацил, гексаметилмеламин, гидроксимочевину, ифосфамид, иринотекан, лейковорин, ломустин, мехлорэтамин, 6-меркаптопурин, месну, метотрексат, митомицин С, митоксантрон, преднизолон, преднизон, прокарбазин, ралоксифен, стрептозоцин, тамоксифен, тиогуанин, топотекан, винбластин, винкристин, виндезин, аминоглутетимид, L-аспарагиназу, азатиоприн, 5-азацитидин, кладрибин, бисульфан, диэтилстилбестрол, 2',2'-дифтордезоксицитидин, доцетаксел, эритрогидроксинониладенин, этинилэстрадиол, 5-фтордезоксиуридин, 5-фтордезоксиуридин монофосфат, флударабинфосфат, флуоксиместрон, флутамид, гидроксипрогестеронкапроат, идарубицин, интерферон, медроксипогестеронацетат, мегестролацетат, мелфалан, митотан, паклитаксел, пентостатин, N-фосфоноацетил-L-аспартат (PALA), пликамицин, семустин, тенипозид, тестостеронпропионат, тиотепу, триметилмеламин, уридин и винорелбин, оксалиплатину, гемцитабин, капецитабин, эпотилон и их природные или синтетические производные, тоситумомаб, трабедектин и темозоломид, трастуцумаб, цетуксимаб, бевацицумаб, пертуцумаб, ZD-1839 (Iressa), OSI-774 (Tarceva), CI-1033, GW-2016, CP-724, 714, HKI-272, EKB-569, STI-571 (Gleevec), PTK-787, SU-11248, ZD-6474, AG-13736, KRN-951, CP-547, 632, CP-673,451, CHIR-258, MLN-518, AZD-2171, PD-325901, ARRY-142886, субероиланилидгидроксамовую кислоту (SAHA), LAQ-824, LBH-589, MS-275, FR-901228, бортецомиб и CCI-779.
26. Способ по п.19, отличающийся тем, что дополнительный противораковый агент представляет собой цитотоксический агент, выбранный из группы, включающей ингибиторы ДНК-топоизомеразы I и II, интеркаляторы ДНК, алкилирующие агенты, антиметаболиты, блокаторы клеточного цикла, агенты, разрушающие микротрубочки и ингибиторы Eg5.
27. Способ по п.19, отличающийся тем, что дополнительный противораковый агент выбран из группы, включающей ингибиторы передач сигнала рецептора фактора роста, ингибиторы гистондезацетилазы, ингибиторы пути PKB, ингибиторы пути Raf/MEK/ERK, ингибиторы пути mTOR и ингибиторы протеасом.
28. Способ лечения или предупреждения у человека и/или других млекопитающих по меньшей мере одного из состояний, выбранных из группы: ревматическая атака, резорбция костей, постменструальный остеопороз, сепсис, сепсис, вызываемый грамотрицательными микроорганизмами, септический шок, эндотоксический шок, синдром токсического шока, синдром системного воспалительного ответа, воспалительная болезнь кишки (болезнь Крона и язвенный колит), реакция Jarisch-Herxheimer, астма, респираторный дистресс-синдром взрослых, острое легочное фибротическое заболевание, легочный саркоидоз, аллергическое респираторное заболевание, силикоз, пневмокониоз шахтеров, альвеолярное повреждение, печеночная недостаточность, болезнь печени во время острого воспаления, тяжелый алкогольный гепатит, малярия (малярия, вызываемая Plasmodium falciparum, и церебральная малярия), инсулиннезависимый сахарный диабет (NIDDM), застойная сердечная недостаточность, повреждение вследствие сердечного заболевания, атеросклероз, болезнь Альцгеймера, острый энцефалит, повреждение головного мозга, рассеянный склероз (демиелинизация и утрата олигодендроцитов при рассеянном склерозе), запущенный рак, злокачественные заболевания лимфоидной природы, панкреатит, нарушение заживания ран при инфекции, воспалении и раке, миелодиспластические синдромы, системная красная волчанка, билиарный цирроз печени, некроз кишки, псориаз, повреждение при облучении/токсичности после введения моноклональных антител, реакция хозяина против трансплантата (ишемическое реперфузионное повреждение и отторжение аллотрансплантатов почки, печени, сердца и кожи), отторжение аллотрансплантата легкого (облитерирующий бронхит) или осложнение вследствие общего эндопротезирования тазобедренного сустава, заключающийся в том, что человеку или другому млекопитающему вводят производное по п.1.
29. Способ лечения или предупреждения у человека и/или других млекопитающих по меньшей мере одного из состояний, выбранных из группы: туберкулез, инфекция Helicobacter pylori при заболевании пептической язвой, болезнь Шага, возникающая в результате инфекции Trypanosoma cruzi, эффекты шига-подобного токсина, возникающие в результате инфекции Е. coli, эффекты энтеротоксина А, возникающие в результате инфекции Staphylococcus, менингококковая инфекция и инфекция Borrelia burgdorferi, Treponema pallidum, цитомегаловируса, вируса гриппа, вируса энцефаломиелита Тейлера и вируса иммунодефицита человека (ВИЧ), заключающийся в том, что человеку или другому млекопитающему вводят производное по п.1.
30. Способ лечения или предупреждения у человека и/или другого млекопитающего остеопороза, воспаления и нарушений ангиогенеза, за исключением рака, заключающийся в том, что человеку или другому млекопитающему вводят производное по п.1.
31. Способ лечения и/или предупреждения заболевания и/или состояния у нуждающегося в этом субъекта, заключающийся в том, что ему вводят эффективное количество производного по п.1 или 2.
32. Способ по п.31, отличающийся тем, что он включает опухолевую регрессию у субъекта или в полученных от него клетках.
33. Способ по п.31, отличающийся тем, что он включает ингибирование лимфангиогенеза.
34. Способ по п.31, отличающийся тем, что он включает ингибирование ангиогенеза.
35. Способ по п.31, отличающийся тем, что он включает ингибирование лимфангиогенеза и ангиогенеза.
36. Способ по п.31, отличающийся тем, что он включает стимуляцию пролиферации гемопоэтических клеток-предшественников.
37. Способ по п.31, отличающийся тем, что он включает лечение нарушения у млекопитающего, опосредованного raf, VEGFR-2, VEGFR-3, PDGFR-b, р38 и/или flt-3.
38. Способ по п.31, отличающийся тем, что он включает определение возможности модулирования состояния производным по п.1 или 2 измерением экспрессии или активности raf, VEGFR-2, VEGFR-3, PDGFR-b, p38 и/или flt-3 в образце, полученном от субъекта и содержащем клетки или клеточный экстракт, или в клетке, находящейся в указанном состоянии; и его модулирование указанным производным, когда указанная экспрессии или активность отличаются от контроля, представляющего норму.
39. Способ по п.38, отличающийся тем, что он дополнительно включает сравнение экспрессии в указанном образце с указанным контролем.
40. Способ по п.31, отличающийся тем, что он включает оценку эффективности указанного производного в отношении нарушения, заключающуюся в его введении, измерении экспрессии или активности raf, VEGFR-2, VEGFR-3, PDGFR-b, p38 и/или flt-3 и определении эффекта на указанную экспрессию или активность.
41. Способ по п.31, отличающийся тем, что он включает определение присутствия raf, VEGFR-2, VEGFR-3, PDGFR-b, p38 и/или flt-3 в образце биологического материала, контактирование последнего с указанным производным и определение их связывания.
42. Способ по п.31, отличающийся тем, что он включает лечение опухоли у нуждающегося в этом субъекта введением эффективного количества указанного производного для ингибирования пролиферации опухолевых клеток и неоваскуляризации.
43. Способ по п.16, отличающийся тем, что воспалительное нарушение выбрано из ревматоидного артрита, COPD, болезни Крона и псориаза.
44. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое представляет собой flt-3-опосредованное нарушение, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1.
Текст
010485 Область техники, к которой относится изобретение Данное изобретение относится к органической химии, фармакологии и медицине, конкретно к новому производному N,N'-дифенилмочевины, относящемуся к классу омега-карбоксиларилдифенилмочевин, а именно к метиламиду 4-4-[3-(4-хлор-3-трифторметилфенил)уреидо]-3-фторфеноксипиридин-2 карбоновой кислоты (т.е. к N-(4-хлор-3-(трифторметил)фенил)-N'-2-фтор-(4-(2-(N-метилкарбамоил)-4 пиридилокси)фенил)мочевине), его солям, метаболитам и стереоизомерам, обладающим уникальной комбинацией свойств в отношении ряда ключевых киназных мишеней, таких как raf, p38, PDGFR иVEGFR, композициям, содержащим данные соединения, и использованию этих соединений или композиций для лечения заболеваний и состояний, опосредованных патологической передачей сигнала киназыVEGFR (рецептора фактора роста сосудистого эндотелия), PDGFR (рецептора тромбоцитарного фактора роста), raf, p38 и/или flt-3, либо в виде монокомпонента, либо в комбинации с другими фармацевтическими агентами. Сведения о предшествующем уровне техники Активация пути сигнальной трансдукции ras указывает на каскад событий, которые имеют сильное влияние на пролиферацию, дифференцировку и трансформацию клеток. Киназу raf, расположенный ниже по ходу процесса эффектор ras, считают ключевым медиатором данных сигналов от рецепторов клеточной поверхности к ядру клетки (см. статьи Lowy D.R., Willumsen B.M., Ann. Rev. Biochem. 1993, 62,851; Bos J.L., Cancer Res. 1989, 49, 4682). Показано, что ингибирование эффекта активного ras посредством ингибирования пути передачи сигнала киназы raf введением дезактивирующих антител к киназе raf или путем коэкспрессии доминантной отрицательной киназы raf или доминантного отрицательного MEK, субстрата киназы raf, приводит к реверсии трансформированных клеток к нормальному фенотипу роста (см. статьи Daum et al., Trends Biochem.Sci. 1994, 19, 474-80; Fridman et al., J. Biol. Chem. 1994, 269, 30105-8). Кроме того, Kolch et al. (Nature 1991, 349, 426-28) показали, что ингибирование экспрессии raf антисмысловой РНК блокирует пролиферацию клеток в ассоциированных с мембраной онкогенах. Аналогично ингибирование киназы raf (антисмысловыми олигодезоксинуклеотидами) коррелировало in vitro и in vivo с ингибированием роста множества типов человеческих опухолей (см. статью Monia et al., Nat. Med. 1996, 2, 668-75). Считают, что для поддержки прогрессирующего роста опухоли свыше размера 1-2 мм 3 опухолевым клеткам требуется функциональная строма, поддерживающая структура, состоящая из фибробластов,клеток гладкой мускулатуры, эндотелиальных клеток, белков экстрацеллюларного матрикса и растворимых факторов (см. статью Folkman J., Semin. Oncol. 2002, 29 (6 Suppl. 16), 15-8). Опухоли индуцируют образование стромальных тканей посредством секреции растворимых факторов роста, таких как PDGF и трансформирующий фактор роста- (TGF-), которые, в свою очередь, стимулируют секрецию клетками-хозяевами комплементарных факторов, таких как фактор роста фибробластов (FGF), эпидермальный фактор роста (EGF) и фактор роста сосудистого эндотелия (VEGF). Данные стимулирующие факторы индуцируют формирование новых кровеносных сосудов или ангиогенез, который снабжает опухоль кислородом и питательными веществами, и позволяет ей расти, и создает путь для метастазов. Считают, что некоторые терапевтические препараты, направленные на ингибирование формирования стромы, будут ингибировать рост эпителиальных опухолей из широкого круга гистологических типов, (см. статьи George D., Semin. Oncol. 2001, 28 (5 Suppl. 17), 27-33; Shaheen R.M. et al., Cancer Res. 2001, 61 (4), 1464-8; Shaheen R.M. et al., Cancer Res. 1999, 59 (21), 5412-6). Однако, вследствие сложной природы и множества факторов роста, участвующих в процессе ангиогенеза и развитии опухоли, агент, направленный на один путь, может иметь ограниченную эффективность. Требуется разработать лечение, направленное против ряда ключевых путей передачи сигнала, используемых опухолями для индукции ангиогенеза в строме хозяина. Они включают PDGF, сильный стимулятор формирования стромы (см. статью Ostman А. и С.Н.Heldin, Adv. Cancer Res. 2001, 80, 1-38), FGF (фактор роста фибробластов), хемоаттрактант и митоген для фибробластов и эндотелиальных клеток, и VEGF, сильный регулятор васкуляризации.PDGF представляет собой ключевой регулятор формирования стромы, который секретируется многими опухолями паракринным образом и, как полагают, стимулирует рост фибробластов, клеток гладкой мускулатуры и эндотелиальных клеток, способствуя формированию стромы и ангиогенезу.PDGF исходно идентифицирован как продукт онкогена v-sis вируса саркомы обезьян (см. статьюHeldin С.Н. et al., J. Cell. Sci. Suppl. 1985, 3, 65-76). Фактор роста состоит из двух пептидных цепей, названных цепями А и В, которые имеют 60% гомологию со своими первичными аминокислотными последовательностями. Цепи перекрестно связаны дисульфидными мостиками с образованием зрелого белка молекулярной массы 30 кД, состоящего из гомо- или гетеродимеров АА, ВВ или АВ. Высокие уровни PDGF обнаружены в тромбоцитах, и он экспрессируется эндотелиальными клетками и клетками гладкой мускулатуры сосудов. Кроме того, продукция PDGF стимулируется в условиях с низким содержанием кислорода, такими как обнаружены в слабо васкуляризированной опухолевой ткани (см. статью Kourembanas S. et al., Kidney Int. 1997, 51 (2), 438-43). PDGF связывается с высокой аффинностью с рецептором PDGF, рецептором трансмембранной тирозинкиназы из 1106 аминокислотPDGFR обнаружен в виде гомо- или гетеродимерных цепей, которые имеют 30% гомологию последовательности аминокислот, в целом, и 64% гомологию между своими киназными доменами (см. статьюHeldin C.H. et al., Embo J., 1988, 7 (5), 1387-93). PDGFR является членом семейства рецепторов тирозинкиназ с расщепленными киназными доменами, которое включает VEGFR-2 (kr), VEGFR-3 (flt-4), c-kit иflt-3. Рецептор PDGF экспрессируется, в основном, на фибробластах, клетках гладкой мускулатуры и перицитах и в меньшей степени на нейронах, мезангиальных клетках почки, клетках Лейдига и шванновских клетках центральной нервной системы. При связывании с рецептором PDGF индуцирует димеризацию рецептора и проходит авто- и трансфосфорилирование остатков тирозина, которое повышает киназную активность рецепторов и способствует рекрутированию идущих ниже по ходу процесса эффекторов посредством активации связывающих доменов белка SH2. Ряд сигнальных молекул образует комплексы с активированным PDGFR, включая киназу PI-3, фосфолипазу С-, src и GAP (белок, активирующий ГТФазу для p21-ras) (см. статью Soskic V. et al., Biochemistry 1999, 38 (6), 1757-64). Посредством активации киназы PI-3 PDGF активирует путь передачи сигнала Rho, индуцирующий подвижность и миграцию клеток, и через активацию GAP индуцирует митогенез посредством активации p21-ras и пути передачи сигнала MAPK. У взрослых, как считают, основная функция PDGF состоит в том, чтобы облегчать и повышать скорость заживления ран и поддерживать гомеостаз кровеносных сосудов (см. статьи Baker E.А. и D.J. Leaper,Wound Repair Regen. 2000, 8 (5), 392-8 и Yu J., A. Moon и H.R. Kim, Biochem. Biophys. Res. Commun. 2001, 282 (3), 697-700). PDGF обнаружен в высоких концентрациях в тромбоцитах и представляет собой сильный хемоаттрактант для фибробластов, клеток гладкой мускулатуры, нейтрофилов и макрофагов. Кроме его роли в заживлении ран, известно, что PDGF помогает поддерживать сосудистый гомеостаз. Во время развития новых кровеносных сосудов PDGF рекрутирует перициты и клетки гладкой мускулатуры, которые необходимы для структурной целостности сосудов. Полагают, что PDGF играет аналогичную роль в процессе неоваскуляризации опухолей. В качестве части своей роли в ангиогенезеPDGF контролирует давление интерстициальной жидкости, регулируя проницаемость сосудов посредством регуляции взаимодействия между клетками соединительной ткани и экстрацеллюларным матриксом. Ингибирование активности PDGFR может понизить интерстициальное давление и облегчить приток цитотоксинов в опухоли, повышая противоопухолевую эффективность данных агентов (см. статьиPDGF может способствовать росту опухоли посредством либо паракринной, либо аутокринной стимуляции рецепторов PDGFR на клетках стромы или непосредственно на клетках опухоли или посредством увеличения числа рецепторов или активации рецептора путем рекомбинации. Сверхэкспресирующийся PDGF может трансформировать клетки меланомы и кератиноциты человека (см. статьи Forsberg K. et al., Proc. Natl. Acad. Sci. USA, 1993, 90 (2), 393-7; Skobe M. и N.E. Fusenig,Proc. Natl. Acad. Sci. USA, 1998, 95 (3), 1050-5), два типа клеток, которые не экспрессируют рецепторыPDGF, по-видимому, путем прямого воздействия PDGF на формирование стромы и индукцию ангиогенеза. Данную паракриную стимуляцию опухолевой стромы наблюдают также в карциномах толстой кишки,легкого, молочной железы и простаты (см. статьи Bhardwaj В. et al., Clin. Cancer Res. 1996, 2 (4), 773-82;Lindmark G. et al., Lab. Invest. 1993, 69 (6), 682-9; Vignaud J.M. et al., Cancer Res. 1994, 54 (20), 5455-63), где опухоли экспрессируют PDGF, но не рецептор. Аутокринная стимуляция роста опухолевых клеток, где большая часть проанализированных опухолей экспрессирует как лиганд PDGF, так и рецептор, описана для глиобластом (см. статью Fleming Т.P. et al., Cancer Res. 1992, 52 (16), 4550-3), сарком мягких тканей(9), 3942-6). Лиганд-независимая активация рецептора обнаружена в меньшей степени, но показана для хронического миеломоноцитарного лейкоза (CMML), при котором событие хромосомной транслокации приводит к формированию слитого белка из Ets-подобного фактора транскрипции TEL и рецептора PDGF. Кроме того, активирующие мутации в PDGFR обнаружены в опухолях желудочно-кишечной стромы, в которые не включена активация c-kit (см. статью Heinrich M.C. et al., Science 2003, 9, 9). Другим основным регулятором ангиогенеза и васкулогенеза как при эмбриональном развитии, так и при ряде зависимых от ангиогенеза заболеваний является фактор роста сосудистого эндотелия (VEGF,называемый также фактор проницаемости сосудов, VPF).VEGF представляет семейство изоформ митогенов, существующих в гомодимерных формах вследствие альтернативного сплайсинга РНК. Изоформы VEGF являются высокоспецифическими для клеток сосудистого эндотелия (в качестве обзора см. статьи Farrara et al., Endocr. Rev. 1992, 13, 18; Neufield et al.,FASEB J., 1999, 13, 9).-2 010485 Экспрессия VEGF индуцируется гипоксией (см. статью Shweiki et al., Nature 1992, 359, 843), а также рядом цитокинов и факторов роста, таких как интерлейкин-1, интерлейкин-6, эпидермальный фактор роста и трансформирующий фактор роста. В настоящее время описано, что VEGF и члены семейства VEGF связываются с одной или более из трех трансмембранных рецепторных тирозинкиназ (см. статью Mustonen et al., J. Cell Biol. 1995, 129,895), рецептором-1 VEGF (известным также как fit-1 (fins-подобная тирозинкиназа-1, VEGFR-2 (известным также как домен инсерта киназы, содержащий рецептор (KDR); мышиный аналог VEGFR-2 известен как эмбриональная киназа печени 1 (flk-1 и VEGFR-3 (известный также как flt-4). VEGFR-2 и flt-1,как показано, имеют различные свойства сигнальной трансдукции (см. статьи Waltenberger et al., J. Biol.Chem. 1994, 269, 26988; Park et al. Oncogene 1995, 10, 135). Таким образом VEGFR-2 подвергается сильному лиганд-зависимому тирозин-фосфорилированию в интактных клетках, тогда как flt-1 демонстрирует слабый ответ. Таким образом, как полагают, связывание с VEGFR-2 является важным требованием для индукции полного спектра VEGF-опосредованных биологических ответов.In vivo VEGF играет центральную роль в васкулогенезе и индуцирует ангиогенез и проницаемость кровеносных сосудов. Нерегулируемая экспрессия VEGF способствует развитию ряда заболеваний, которые характеризуются процессами патологического ангиогенеза и/или гиперпроницаемости. Считают,что регуляция VEGF-опосредованного каскада сигнальной трансдукции некоторыми агентами может обеспечить эффективный контроль процессов патологического ангиогенеза и/или гиперпроницаемости. Онкогенные клетки в гипоксических областях опухолей отвечают стимуляцией продукции VEGF, который инициирует активацию покоящихся эндотелиальных клеток в плане стимуляции формирования новых кровеносных сосудов, (см. статью Shweiki et al., Proc. Natl. Acad. Sci. 1995, 92, 768). Кроме того, продукция VEGF в областях опухолей, в которых отсутствует ангиогенез, может происходить через путь сигнальной трансдукции ras (см. статьи Grugel et al., J. Biol. Chem. 1995, 270, 25915;Rak et al., Cancer Res. 1995, 55, 4575). Исследования гибридизации in situ продемонстрировали, что mPHKVEGF в значительной мере стимулируется в широком круге опухолей человека, включая карциномы легкого (см. статью Mattern et al.,Br. J. Cancer 1996, 73, 931), щитовидной железы (см. статью Viglietto et al., Oncogene 1995, 11, 1569), молочной железы (см. статью Brown et al., Human Pathol. 1995, 26, 86), желудочно-кишечного тракта (см. статьи Brown et al., Cancer Res. 1993, 53, 4727; Suzuki et al., Cancer Res. 1996, 56, 3004), почки и мочевого пузыря (см. статью Brown et al., Am. J. Pathol. 1993, 1431, 1255), яичников (см. статью Olson et al., CancerInvest. 1993, 91, 153). Показано, что нейтрализующие моноклональные антитела к VEGFR-2 эффективны в плане блокирования опухолевого ангиогенеза (см. статьи Kim et al., Nature 1993, 362, 841; Rockwell et al., Mol. Cell.Differ. 1995, 3, 315). Сверхэкспрессия VEGF, например, в условиях крайне высокой гипоксии может привести к внутриглазному ангиогенезу, дающему в результате гиперпролиферацию кровеносных сосудов, ведущую в конечном счете к потере зрения. Данный каскад событий отмечают для ряда ретинопатий, включая диабетическую ретинопатию, ишемическую закупорку вен сетчатки, ретинопатию преждевременного развития(см. статьи Aiello et al., New Engl. J. Med. 1994, 331, 1480; Peer et al., Lab. Invest. 1995, 72, 638) и старческую макулярную дегенерацию (AMD; см. статью Lopez et al., Invest. Opthalmol. Vis. Sci. 1996, 37, 855). При ревматоидном артрите (RA) врастание сосудистого паннуса может быть опосредовано продукцией ангиогенных факторов. Уровни иммунореактивного VEGF являются высокими в синовиальной жидкости пациентов с RA, тогда как уровни VEGF были низкими в синовиальной жидкости пациентов с другими формами артрита или с дегенеративными заболеваниями суставов (см. статью Koch et al., J. Immunol. 1994, 152, 4149). Показано, что ингибитор ангиогенеза AGM-170 препятствует неоваскуляризации сустава на модели коллагенового артрита у крыс (см. статью Peacock et al., J. Exper. Med. 1992, 175, 1135). Повышенная экспрессия VEGF показана, кроме того, в псориазной коже, а также при буллезных нарушениях, ассоциированных с образованием субэпидермальных волдырей, таких как буллезный пемфигоид, мультиформная эритема и герпетиформный дерматит (см. статью Brown et al., J. Invest. Dermatol. 1995, 104, 744). Факторы роста сосудистого эндотелия (VEGF, VEGF-C, VEGF-D) и их рецепторы (VEGFR-2,VEGFR-3) являются не только ключевыми регуляторами опухолевого ангиогенеза, но также лимфангиогенеза.VEGF, VEGF-C и VEGF-D экспрессируются в большинстве опухолей, в основном, в периоды роста опухоли и часто на значительно повышенных уровнях. Экспрессию VEGF стимулируют гипоксия, цитокины, онкогены, такие как ras, или инактивация генов супрессоров опухоли (см. статьи McMahon G., Oncologist 2000, 5 (Suppl. 1), 3-10; McDonald N.Q.,-3 010485Hendrickson W.A., Cell 1993, 73, 421-424). Биологические активности VEGF опосредуются через их рецепторы.VEGFR-3 (называемый также flt-4), в основном, экспрессируется на лимфатическом эндотелии в нормальных зрелых тканях. Функция VEGFR-3 необходима для образования новых лимфатических сосудов, но не для поддержания ранее существовавших лимфатических сосудов. VEGFR-3 также стимулируется на эндотелии кровеносных сосудов в опухолях. Недавно VEGF-C и VEGF-D, лиганды для VEGFR-3, были идентифицированы как регуляторы лимфангиогенеза у млекопитающих. Лимфангиогенез, индуцированный опухоль-ассоциированными лимфангиогенными факторами, мог бы способствовать прорастанию новых сосудов в опухоль, обеспечивая доступ опухолевых клеток к кровообращению большого круга. Клетки, которые проникают в лимфатическую систему, могли найти путь в кровоток через грудной проток. Исследования опухолевой экспрессии позволили провести прямое сравнение экспрессии VEGF-C, VEGF-D и VEGFR-3 с клинико-патологическими факторами, которые относятся непосредственно к способности первичных опухолей к распространению (например, вовлечению в процесс лимфатических узлов, лимфатической инвазии и выживанию при отсутствии заболевания). Во многих случаях данные исследования демонстрируют статистическую корреляцию между уровнем экспрессии лимфангиогенных факторов и способностью первичной солидной опухоли к образованию метастазов (см. статьи Skobe M. et al., Nature Med. 2001, 7 (2), 192-198; Stacker S.A. et al., Nature Med. 2001, 7 (2), 186-191; Makinen T. et al., Nature Med. 2001, 7 (2), 199-205; Mandriota S.J. et al., EMBO J. 2001,20 (4), 672- 82; Karpanen T. et al., Cancer Res. 2001, 61 (5), 1786-90; Kubo H. et al., Blood 2000, 96 (2), 546-53). Гипоксия, по-видимому, является важным стимулом для продукции VEGF в злокачественных клетках. Для индукции VEGF опухолевыми клетками в ответ на гипоксию требуется активация киназы р 38 МАР (см. статьи Blaschke F. et al., Biochem. Biophys. Res. Commun. 2002, 296, 890-896; Shemirani B. et al.,Oral Oncology 2002, 38, 251-257). Кроме участия в ангиогенезе посредством регуляции секреции VEGF киназа р 38 MAP способствует инвазии злокачественных клеток и миграции различных типов опухолей путем регуляции активности коллагеназы и экспрессии урокиназного активатора плазминогена (см. статьи Laferriere J. et al., J. Biol. Chem. 2001, 276, 33762-33772; Westermarck J. et al., Cancer Res. 2000, 60,7156-7162; Huang S. et al., J. Biol. Chem. 2000, 275, 12266, 12272; Simon С. et al., Exp. Cell Res. 2001, 271,344-355). Показано, что ингибирование митоген-активируемой протеинкиназы (MAPK) р 38 подавляет оба процесса, продукцию цитокинов (например, ФНО (фактор некроза опухолей), ИЛ-1, ИЛ-6, ИЛ-8) и продукцию протеолитических ферментов (например, ММР-1, ММР-3) in vitro и/или in vivo. Митоген-активируемая протеин- (MAP) киназа р 38 участвует в путях передачи сигнала ИЛ-1 и ФНО (см. статьи Lee J.C., Laydon J.T., McDonnell Р.С., Gallagher T.F., Kumar S., Green D., McNulty D.,Blumenthal M.J., Heys J.R., Landvatter S.W., Strieker J.E., McLaughlin M.M., Siemens I.R., Fisher S.M., Livi G.P.,White J.R., Adams J.L, Yound P.R., Nature 1994, 372, 739). Клинические исследования показали связь продукции и/или передачи сигнала фактора некроза опухолей (ФНО) с рядом заболеваний, включая ревматоидный артрит (см. статью Maini, J. Royal Coll. Physicians London 1996, 30, 344). Кроме того, избыточные уровни ФНО участвуют в широком круге воспалительных и/или иммуномодуляторных заболеваний, включая острую ревматическую атаку (см. статьюMetabol. 1997, 82, 29), постменструальный остеопороз (см. статью Pacifici et al., J. Bone Mineral Res. 1996,11, 1043), сепсис (см. статью Blackwell et al., Br. J. Anaesth. 1996, 77, 110), сепсис, вызываемый грамотрицательными организмами (см. статью Debets et al., Prog. Clin. Biol. Res. 1989, 308, 463), септический шокUSA 1991, 88, 10535), синдром токсического шока (см. статьи Saha et al., J. Immunol. 1996, 157, 3869; Unaet al., FEMS Immunol. Med. Microbiol. 1996, 13, 81), синдром системной воспалительной реакции (см.Anon. Crit. Care Med. 1992, 20, 864), воспалительные болезни кишки (см. статью Stokkers et al., J. Inflamm. 1995-6, 47, 97), включая болезнь Крона (см. статьи van Deventer et al., Aliment. Pharmacol.Fekade et al., New England J. Med. 1996, 335, 311), астму (см. статью Amrani et al., Rev. Malad. Respir. 1996, 13, 539), респираторный дистресс-синдром взрослых (см. статьи Roten et al., Am. Rev. Respir. Dis. 1991, 143, 590; Suter et al., Am. Rev. Respir. Dis. 1992, 145, 1016), острые легочные фибротические заболевания (см. статью Pan et al., Pathol. Int. 1996, 46, 91), саркоидоз легких (см. статью Ishioka et al., SarcoidosisVasculitis Diffuse Lung Dis. 1996, 13, 139), аллергические респираторные заболевания (см. статью CasaleTherap. 1997, 280, 53), заболевание печени во время острого воспаления (см. статью Kim et al., J. Biol.Chem. 1997, 272, 1402), тяжелый алкогольный гепатит (см. статью Bird et al., Ann. Intern. Med. 1990, 112,917), малярию (см. статьи Grau et al., Immunol. Rev. 1989, 112, 49; Taverne et al., Parasitol. Today 1996, 12,290), включая малярию, вызываемую Plasmodium falciparum (см. статью Perlmann et al., Infect. Immunit. 1997, 65, 116) и церебральную малярию (см. статью Rudin et al., Am. J. Pathol. 1997, 150, 257), инсулиннезависимый сахарный диабет (NIDDM; см. статьи Stephens et al., J. Biol. Chem. 1997, 272, 971; Ofei et al.,Diabetes 1996, 45, 881), застойную сердечную недостаточность (см. статьи Doyarna et al., Int. J. Cardiol. 1996, 54, 217; McMurray et al., Br. Heart J. 1991, 66, 356), повреждение вследствие сердечного заболеванияet al., Gerontology 1997, 43, 143), острый энцефалит (см. статью Ichiyama et al., J. Neurol. 1996, 243, 457),повреждение головного мозга (см. статьи Cannon et al., Crit. Care Med. 1992, 20, 1414; Hansbrough et al.,Surg. Clin. N. Am. 1987, 67, 69; Marano et al., Surg. Gynecol. Obstet. 1990, 170, 32), рассеянный склероз (см. статьи М.S. Coyle., Adv. Neuroimmunol. 1996, 6, 143; Matusevicius et al., J. Neuroimmunol. 1996, 66, 115),включая демиелинизацию и утрату олигодендроцитов при рассеянном склерозе (см. статью Brosnan et al.,Brain Pathol. 1996, 6, 243), запущенный рак (см. статью MucWierzgon et al., J. Biol. Regulators HomeostaticAgents 1996, 10, 25), злокачественные заболевания лимфоидной природы (см. статью Levy et al., Crit.Rev. Immunol. 1996, 16, 31), панкреатит (см. статью Exley et al., Gut 1992, 33, 1126), включая системные осложнения при остром панкреатите (см. статью McKay et al., Br. J. Surg. 1996, 83, 919), нарушение заживания ран при инфекции и раке (см. статью Buck et al., Am. J. Pathol. 1996, 149, 195), миелодиспластические синдромы (см. статью Raza et al., Int. J. Hematol. 1996, 63, 265), системную красную волчанку (см. статью Maury et al., Arthritis Rheum. 1989, 32, 146), билиарный цирроз печени (см. статью Miller et al.,Am. J. Gasteroenterolog. 1992, 87, 465), некроз кишки (см. статью Sun et al., J. Clin. Invest. 1988, 81, 1328),псориаз (см. статью Christophers, Austr. J. Dermatol. 1996, 37, S4), повреждение при облучении (см. статью Redlich et al., J. Immunol. 1996, 157, 1705) и токсичность после введения моноклональных антител,таких как OKT3 (см. статью Brod et al., Neurology 1996, 46, 1633). Уровни ФНО также могут быть связаны с реакциями хозяин против трансплантата (см. статьюPiguet et al., Immunol. Ser. 1992, 56, 409), включая ишемическое реперфузионное повреждение (см. статьюColletti et al., J. Clin. Invest. 1989, 85, 1333) и отторжения аллотрансплантатов, включающие отторжение почки (см. статью Maury et al., J. Exp. Med. 1987, 166, 1132), печени (см. статью Imagawa et al., Transplantation 1990, 50, 219), сердца (см. статью Boiling et al., Transplantation 1992, 53, 283) и кожи (см. статью Stevens etal., Transplant. Proc. 1990, 22, 1924), отторжение аллотрансплантата легкого (см. статью Grossman et al.,Immunol. Allergy Clin. N. Am. 1989, 9, 153), включая хроническое отторжение аллотрансплантата (облитерирующий бронхит; см. статью LoCicero et al., J Thorac. Cardiovasc. Surg. 1990, 99, 1059), а также осложнения вследствие общего эндопротезирования тазобедренного сустава (см. статью Cirino et al., LifeSci. 1996, 59, 86). ФНО связан также с инфекционными болезнями (см. обзоры Beutler et al., Crit. CareMalad. Infect. 1996, 26, 904), инфекцию Helicobacter pylori при пептической язвенной болезни (см. статьюGoldfield et al., Proc. Nat'l. Acad. Sci. USA 1989, 87, 1490), вируса энцефаломиелита Тейлера (см. статьюSierra et al., Immunology 1993, 78, 399) и вируса иммунодефицита человека (ВИЧ; см. статьи Poli. Proc.Nat'l. Acad. Sci. USA 1990, 87, 782; Vyakaram et al., A. LDS 1990, 4, 21; Badley et al., J. Exp. Med. 1997,185, 55). Полагают, что ряд заболеваний опосредован избытком нежелательной активности разрушающей матрикс металлопротеазы (ММР) или дисбалансом соотношения ММР и тканевых ингибиторов металлопротениз (TIMP). Они включают остеоартрит (см. статью Woessner et al., J. Biol. Chem. 1984, 259,3633), ревматоидный артрит (см. статьи Mullins et al., Biochim. Biophys. Acta 1983, 695, 117; Woolley etet al., Invest. Opthalmol. Vis. Sci. 1989,30, 1569), протеинурию (см. статью Baricos et al., Biochem. J. 1988,254, 609), тромбоз коронарных сосудов вследствие разрушения атеросклеротических бляшек (см. статьюHenney et al., Proc. Nat'l. Acad. Sci., USA 1991, 88, 8154), аневризматическое заболевание аорты (см. статью Vine et al., Clin. Sci. 1991, 81, 233), контроль рождаемости (см. статью Woessner et al., Steroids 1989,-5 010485 54, 491), дистрофобный буллезный эпидермолиз (см. статью Kronberger et al., J. Invest. Dermatol. 1982, 79,208), дегенеративную потерю хряща после травматического повреждения сустава, остеопороз, опосредованный активностью ММР, заболевание височно-нижнечелюстного сустава и демиелинизирующие заболевания нервной системы (см. статью Chantry et al., J. Neurochem. 1988, 50, 688). Поскольку ингибирование р 38 приводит к ингибированию продукции ФНО и продукции ММР, полагают, что ингибирование фермента митоген-активируемой протеинкиназы (MAP) p38 может создать подход к лечению вышеперечисленных заболеваний, включая остеопороз и воспалительные нарушения,такие как ревматоидный артрит и COPD (хроническое обструктивное заболевание легких) (см. статьиBadger A.M., Bradbeer J.N., Votta В., Lee J.С., Adams J.L., Griswold D.E., J. Pharm. Exper. Ther. 1996, 279,1453). Гипоксия, по-видимому, является важным стимулом для продукции VEGF в злокачественных клетках. Активация киназы р 38 требуется для индукции VEGF опухолевыми клетками в ответ на гипоксиюOncology 2002, 38, 251-257). Кроме участия в ангиогенезе посредством регуляции секреции VEGF киназа р 38 способствует инвазии злокачественных клеток и миграции различных типов опухолей путем регуляции активности коллагеназы и экспрессии урокиназного активатора плазминогена (см. статьи Laferriere J.S. et al., J. Biol. Chem. 2000, 275, 12266-12272; Simon C. et al., Exp. Cell Res. 2001, 271, 344-355). Вследствие этого также ожидается, что ингибирование киназы р 38 воздействует на рост опухоли посредством нарушения каскадов передачи сигнала, ассоциированных как с ангиогенезом, так и с инвазией злокачественных клеток. Описан ряд мочевин, как обладающих активностью ингибиторов серин-треонинкиназ и/или тирозинкиназ. В частности, продемонстрировано применение ряда мочевин в качестве активного ингредиента фармацевтических композиций для лечения рака, нарушений ангиогенеза, воспалительных нарушений. Относительно рака и ангиогенеза см.Branger J. et al., Blood 2003, 101, 4446-4448. Омега-карбоксиарилдифенилмочевины описаны в WO 00/42012, опубликованной 20 июля 2000 г.,WO 00/41698, опубликованной 20 июля 2000 г., последующих опубликованных патентных заявках США:US2002-0165394-A1, опубликованной 7 ноября 2002 г., US2001-003447-A1, опубликованной 25 октября 2001 г., US2001-0016659-A1, опубликованной 23 августа 2001 г., US2002-013774-A1, опубликованной 26 сентября 2002 г., и находящихся одновременно на рассмотрении заявках США 09/758547, поданной 12 января 2001 г., 09/889227, поданной 12 июля 2001 г., 09/993647, поданной 27 ноября 2001 г., 10/042203, поданной 11 января 2002 г., и 10/071248, поданной 11 февраля 2002 г. Однако по-прежнему актуальной задачей является поиск химических соединений или агентов, направленный не на один путь, а, напротив, на ряд ключевых путей развития заболеваний. Сущность изобретения Было открыто, что производное N,N'-дифенилмочевины (омега-карбоксиарилдифенилмочевины) формулы I, представленное ниже, которое имеет 2-фтор-4-(2-(N-метилкарбамоил)-4-пиридилокси)фениленовую группу, связанную с мочевиной, является сильным ингибитором киназы raf, киназы VEGFR,-6 010485 киназы р 38 и киназы PDGFR, все из которых являются молекулярными мишенями, представляющими интерес в плане лечения и предупреждения остеопороза, воспалительных нарушений, гиперпролиферативных нарушений и нарушений ангиогенеза, включая рак. Таким образом, изобретение относится к новому указанному выше соединению, фармацевтическим композициям на его основе и способам лечения и профилактики заболеваний и нарушений с его использованием. Сведения, подтверждающие возможность осуществления изобретения Новые соединения Настоящее изобретение представляет, например, (i) новое производное N,N'-дифенилмочевины формулы (I), его соли, метаболиты, (ii) фармацевтические композиции, содержащие данное производное,и (iii) применение данного производного или композиций для лечения заболеваний и состояний, опосредованных raf, VEGFR, PDGFR, flt-3 и р 38, либо в виде монокомпонента, либо в комбинации с цитотоксическими терапевтическими препаратами. Производное N,N'-дифенилмочевины формулы I, представленной ниже, его соли и метаболиты в совокупности называют "соединениями, соответствующими изобретению". Формула I представляет собой следующее: Метаболиты соединения, соответствующего данному изобретению, включают окисленные производные, в которых атом азота пиридина находится в форме N-оксида (например, несет гидроксильный заместитель), приводя к тем структурам, которые в области техники называют 1-оксопиридином и 1-гидроксипиридином. Когда в данном контексте используют слова "соединения", "соли" и т.п. во множественном числе,это принимают также за обозначение соединения, соли и т.п. в единственном числе. Применение производного N,N'-дифенилмочевины формулы I и его фармацевтически приемлемых солей и вышеназванных метаболитов также входит в объем изобретения. Термин "фармацевтически приемлемая соль" относится к относительно нетоксичной неорганической или органической кислотно-аддитивной соли соединения, соответствующего данному изобретению. Например, см. статью S.M. Berge et al., "Pharmaceutical Salts", J. Pharm. Sci. 1977, 66, 1-19. Репрезентативные соли соединения, соответствующего данному изобретению, включают известные нетоксичные соли, например неорганических или органических кислот, определенным образом хорошо известных в области техники. Например, данные кислотно-аддитивные соли включают ацетат, адипат, альгинат, аскорбат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, цитрат, камфорат, камфорсульфонат, циннамат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, итаконат, лактат, малеат, манделат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, пивалат, пропионат, сукцинат,сульфонат, тартрат, тиоцианат, тозилат и ундеканоат. Соли и пролекарственные формы соединения формулы I могут содержать один или более асимметричных центров. Асимметричные атомы углерода могут присутствовать в (R)- или (S)-конфигурации либо (R,S)-конфигурации. Заместители на цикле могут также присутствовать либо в цис-, либо транс-форме. Предполагается, что все данные конфигурации (включая энантиомеры и диастереомеры) входят в объем настоящего изобретения. Предпочтительными изомерами являются те, которые имеют конфигурацию, которая дает более желательную биологическую активность. Разделенные, чистые или частично очищенные изомеры или рацемические смеси соединений, соответствующих данному соединению, также включены в объем настоящего изобретения. Очистку указанных изомеров и разделение указанных изомерных смесей можно осуществить стандартными методиками, известными в области техники. Конкретный способ, применяемый для получения соединения, используемого в данном варианте осуществления изобретения, описан в примере 1. Солевые формы соединения формулы (I) описаны в примерах 2, 3 и 4. Способы применения Настоящее изобретение представляет соединения, которые способны модулировать один или более путей сигнальной трансдукции, включающие киназы raf, VEGFR, PDGFR, р 38 и/или flt-3.Raf представляет собой важную сигнальную молекулу, участвующую в регуляции ряда ключевых-7 010485 клеточных процессов, включая рост клетки, жизнеспособность клетки и инвазию. Она является членом пути Ras/raf/MEK/ERK. Данный путь имеется в большинстве опухолевых клеток. VEGFR, PDGFR и flt-3 представляют собой трансмембранные рецепторные молекулы, которые при стимуляции соответствующим лигандом включают путь передачи клеточного сигнала Ras/raf/MEK/ERK, приводя к каскаду клеточных событий. Каждая из этих рецепторных молекул имеет тирозинкиназную активность. Рецепторы VEGFR стимулируются факторами роста сосудистого эндотелия (VEGF) и являются важными контрольными точками в регуляции развития и функции эндотелиальных клеток. Рецептор PDGF- регулирует пролиферацию и жизнеспособность клетки в ряде типов клеток, включая мезенхимные клетки. Flt-3 представляет собой рецептор для лиганда FL. Он структурно близок c-kit и модулирует рост плюрипотентных гемопоэтических клеток, влияя на развитие Т-клеток, В-клеток и дендритных клеток. Любой ген или изоформу raf, VEGFR, PDGFR, р 38 и/или flt-3 можно модулировать в соответствии с настоящим изобретением, включая обе формы, дикого типа и мутантную. Киназа raf или raf-1 представлят собой семейство серин/треонинкиназ, которые содержат по меньшей мере три члена семейства, a-raf, b-raf и c-raf или raf-1. См., например, статью Dhillon и Kolch, Arch.Biochem. Bioplays. 2002, 404, 3-9. C-raf и b-raf представляют собой предпочтительные мишени для соединений, соответствующих настоящему изобретению. Мутации, активирующие b-raf (например, мутантV599E), идентифицированы при различных формах рака, включая меланому, и соединения, описанные в данном контексте, могут быть использованы для ингибирования их активности. Термином "модулирует" обозначают, что функциональная активность пути (или его компонента) изменяется по сравнению с его нормальной активностью в отсутствие соединения. Данный эффект включает любое качество или степень модуляции, в том числе повышение, агонистическое действие, подъем, усиление, способствование,стимуляцию, снижение, блокирование, ингибирование, уменьшение, сокращение, антагонистическое действие и т.п. Соединения, соответствующие настоящему изобретению, могут также модулировать один или более из следующих процессов, включая, но без ограничения перечисленным, например, рост клеток (в том числе, например, дифференцировку, выживаемость клеток и/или пролиферацию), рост опухолевых клеток (в том числе, например, дифференцировку, выживаемость клеток и/или пролиферацию), регрессию опухоли, рост эндотелиальных клеток (в том числе, например, дифференцировку, выживаемость клеток и/или пролиферацию), ангиогенез (рост кровеносных сосудов), лимфангиогенез (рост лимфатических сосудов) и/или гематопоэз (например, развитие Т- и В-клеток, развитие дендритных клеток и т.п.). Помимо желания быть связанными какой-либо теорией механизма действия было обнаружено, что соединения, соответствующие настоящему изобретению, обладают способностью модулировать киназную активность. Однако способы, соответствующие настоящему изобретению, не ограничены какимлибо определенным механизмом или тем, как соединения достигают своего терапевтического эффекта. Под термином "киназная активность " имеют в виду каталитическую активность, вследствие которой -фосфат из аденозинтрифосфата (АТФ) переносится на остаток аминокислоты (например, серина,треонина или тирозина) в белковом субстрате. Соединение может модулировать активность киназы, например, ингибируя ее путем прямой конкуренции с АТФ за АТФ-связывающий карман киназы, посредством образования конформационного изменения в структуре фермента, которое влияет на его активность (например, посредством разрушения биологически активной трехмерной структуры) и т.п. Активность киназы можно определить с помощью рутинно используемых принятых методов анализа. Анализы киназы, как правило, содержат фермент киназу, субстраты, буферы и компоненты системы детекции. Типичный анализ киназы включает реакцию протеинкиназы с пептидным субстратом и АТФ,такой как 32 Р-АТФ, для получения фосфорилированного конечного продукта (например, фосфопротеина, когда используют пептидный субстрат). Полученный в результате конечный продукт можно определить, используя любой приемлемый способ. Когда используют радиоактивную АТФ, фосфопротеин с радиоактивной меткой можно отделить от непрореагировавшей -32 Р-АТФ при использовании аффинной мембраны или гель-электрофореза, а затем визуализировать на геле с использованием авторадиографии или провести детекцию с помощью сцинтилляционного счетчика. Можно также использовать нерадиоактивные способы. В способах можно использовать антитело,которое распознает фосфорилированный субстрат, например антитело против фосфотирозина. Например, фермент киназу можно инкубировать с субстратом в присутствии АТФ и киназного буфера в условиях, которые эффективны для того, чтобы фермент фосфорилировал субстрат. Реакционную смесь можно разделить, например, электрофоретически, а затем фосфорилирование субстрата можно измерить,например, посредством вестерн-блоттинга при использовании антитела против фосфотирозина. Антитело может быть помечено определяемой меткой, например ферментом, таким как HRP (пероксидаза хрена), авидином или биотином, хемолюминесцентными реагентами и т.п. В других способах можно использовать форматы ELISA (твердофазного иммуноферментного анализа), разделение с помощью аф-8 010485 финных мембран, анализы на основе поляризации флуоресценции, люминесцентные анализы и т.п. Альтернативой радиоактивному формату является перенос резонансной энергии флуоресценции с разрешением во времени (TR-FRET). Данный способ соответствует стандартной реакции киназы, в которой субстрат, например биотинилированный поли(GluTyr), фосфорилируют протеинкиназой в присутствии АТФ. Конечный продукт затем можно определить с помощью фосфоспецифического антитела к хелату европия (против фосфотирозина и/или фосфосерин/треонина) и стрептавидина-АРС, который связывает биотинилированный субстрат. Данные два компонента пространственно сближаются друг с другом при связывании, и перенос энергии от фосфоспецифического антитела к акцептору (SA-APC) дает флуоресцентное показание в гомогенном формате. Соединения, соответствующие настоящему изобретению, могут быть использованы для лечения и/или предупреждения любого заболевания или состояния, опосредованного одним или более путей сигнальной трансдукции raf, VEGFR, PDGFR, р 38 и/или flt-3 киназ. Термин "лечение" используют принятым образом, например терапия или уход за субъектом с целью борьбы, ослабления, уменьшения, облегчения, улучшения состояния и т.п. заболевания или нарушения. Соединения могут быть также описаны как используемые для предупреждения и/или лечения заболеваний и/или состояния, опосредованного сигнальными молекулами. Термин "опосредованный" указывает,например, на то, что сигнальная молекула представляет собой часть пути, которая является патологической или нарушена при заболевании и/или состоянии. Заболевания и состояния, которые можно лечить, включают любые из выше- и нижеперечисленных, а такжеPDGFRассоциированные заболевания включают, например, заболевания или состояния, характеризующиеся пролиферацией клеток, продукцией клеточного матрикса, движением клеток и/или продукцией экстрацеллюларного матрикса. Конкретные примеры включают, например, опухоли, злокачественные заболевания, рак, метастазы, хронический миелоидный лейкоз, воспаление, заболевание почек, диабетическую нефропатию, мезангиальный пролиферативный гломерулонефрит, фибротические состояния, атеросклероз, рестеноз, артериосклероз, связанный с гипертензией, артериосклероз вследствие шунтирования вен, склеродерму, интерстициальные легочные заболевания, синовиальные нарушения, артрит, лейкозы, лимфомы и т.п.;Flt-3-ассоциированные заболевания включают, например, иммунные нарушения, нарушения клеток крови, состояния, включающие развитие гемопоэтических клеток (например, Т-клеток, В-клеток, дендритных клеток, рака, анемии, ВИЧ, синдрома приобретенного иммунодефицита и т.п.); р 38-ассоциированные заболевания включают воспалительные нарушения, иммуномодулирующие нарушения и другие нарушения, которые связаны с патологической продукцией цитокинов, в особенности ФНО-, или патологической активностью ММР. Данные нарушения включают, но без ограничения перечисленным, ревматоидный артрит, COPD, остеопороз, болезнь Крона и псориаз. Кроме того, соединения, соответствующие настоящему изобретению, могут быть использованы для лечения состояний и нарушений, описанных в патенте США 6316479, например гломерулярного склероза, интерстициального нефрита, интерстициального фиброза легких, атеросклероза, рубцевания ран и склеродермы. Соединения, соответствующие данному изобретению, имеют также широкую терапевтическую активность в плане лечения или предупреждения развития широкого круга заболеваний, таких как воспалительные состояния, коронарный рестеноз, опухоль-ассоциированный ангиогенез, атеросклероз, аутоиммунные заболевания, воспаление, ряд заболеваний почек, ассоциированных с пролиферацией клубочковых или мезангиальных клеток, и глазные болезни, ассоциированные пролиферацией сосудов сетчатки, псориаз, цирроз печени, диабет, атеросклероз, рестеноз, рестеноз сосудистого трансплантата, стеноз внутри стента, ангиогенез, глазные болезни, фиброз легких, облитерирующий бронхиолит, гломерулярнй нефрит, ревматоидный артрит. Настоящее изобретение представляет также лечение, предупреждение, модуляцию и т.п. одного или более следующих состояний человека и/или других млекопитающих животных: ретинопатии, включая диабетическую ретинопатию, ишемической закупорки вены сетчатки, ретинопатии преждевременного развития и старческой макулярной дегенерации; ревматоидного артрита, псориаза или буллезного нарушения, ассоциированного с образованием субэпидермальных волдырей, включая буллезный пемфигоид,-9 010485 мультиформную эритему или герпетиформный дерматит; ревматической атаки, резорбции костей, постменструального остеопороза, сепсиса, сепсиса, вызываемого грамотрицательными микроорганизмами,септического шока, эндотоксического шока, синдрома токсического шока, синдрома системного воспалительного ответа, воспалительной болезни кишки (болезни Крона и язвенного колита), реакции JarischHerxheimer, астмы, респираторного дистресс-синдрома взрослых, острого легочного фибротического заболевания, легочного саркоидоза, аллергического респираторного заболевания, силикоза, пневмокониоза шахтеров, альвеолярного повреждения, печеночной недостаточности, болезни печени во время острого воспаления, тяжелого алкогольного гепатита, малярии (малярии, вызываемой Plasmodium falciparum,и церебральной малярии), инсулиннезависимого сахарного диабета (NIDDM), застойной сердечной недостаточности, повреждения вследствие сердечного заболевания, атеросклероза), болезни Альцгеймера,острого энцефалита, повреждения головного мозга, рассеянного склероза (демиелинизации и утраты олигодендроцитов при рассеянном склерозе), запущенного рака, злокачественных заболеваний лимфоидной природы, панкреатита, нарушения заживания ран при инфекции, воспалении и раке, миелодиспластических синдромов, системной красной волчанки, билиарного цирроза печени, некроза кишки, повреждения при облучении/токсичности после введения моноклональных антител, реакции хозяин против трансплантата (ишемического реперфузионного повреждения и отторжения аллотрансплантатов почки,печени, сердца и кожи, отторжения аллотрансплантата легкого (облитерирующего бронхита) или осложнений вследствие общего эндопротезирования тазобедренного сустава и инфекционного заболевания,выбранного из туберкулеза, инфекции Helicobacter pylori при заболевании пептической язвой, болезни Шага, возникающей в результате инфекции Trypanosoma cruzi, эффектов шига-подобного токсина, возникающих в результате инфекции Е. coli, эффектов энтеротоксина А, возникающих в результате инфекции Staphylococcus, менингококковой инфекции и инфекций Borrelia burgdorferi, Treponema pallidum,цитомегаловируса, вируса гриппа, вируса энцефаломиелита Тейлера и вируса иммунодефицита человека(ВИЧ), папилломы, бластоглиомы, саркомы Капоши, меланомы, рака легкого, рака яичников, рака простаты, карциному сквамозных клеток, астроцитомы, рака головы, рака шеи, рака мочевого пузыря, рака молочной железы, колоректального рака, рака щитовидной железы, рака поджелудочной железы, рака желудка, гепатоцеллюларной карциномы, лейкоза, лимфомы, болезни Ходжкина, болезни Буркитта, артрита, ревматоидного артрита, диабетической ретинопатии, ангиогенеза, рестеноза, рестеноза внутри стента, рестеноза сосудистого трансплантата, фиброза легких, цирроза печени, атеросклероза, гломерулонефрита, диабетической нефропатии, синдромов тромботической микоангиопатии, отторжения трансплантата, псориаза, диабета, заживления ран, воспаления и нейродегенеративных заболеваний, гипериммунных нарушений, гемангиомы, миокардиального ангиогенеза, коронарной и церебральной коллатеральной васкуляризации, ишемии, заболевания роговицы, покраснения радужки, неоваскулярной глаукомы, макулярной дегенерации, ретинопатии преждевременного развития, заживления ран, язвенных заболеваний, связанных с Helicobacter, переломов, эндометриоза, диабетического состояния, лихорадки кошачьих царапин, гиперплазии щитовидной железы, астмы или отека вследствие ожогов, травмы, хронического легочного заболевания, инсульта, полипов, кисты, синовита, хронического и аллергического воспаления, синдрома гиперстимуляции матки, легочного и церебрального отека, келоида, фиброза, цирроза, кистевого туннельного синдрома, респираторного дистресс-синдрома взрослых, асцитов, глазного состояния, сердечно-сосудистого состояния, болезни Кроу-Фукаса (POEMS), болезни Крона, гломерулонефрита, остеоартрита, рассеянного склероза, отторжения трансплантата, лаймской болезни, сепсиса,болезни фон Хиппел-Линдау, пемфигоида, болезни Паджета, поликистозной болезни почек, саркоидоза,тиреоидита, синдрома гипервязкости, болезни Ослер-Вебер-Рендтфа, хронической окклюзивной легочной болезни, облучения, гипоксии, преэклампсии, менометроррагии, эндометриоза, инфекции простого герпеса, ишемической ретинопатии, ангиогенеза роговицы, опоясывающего лишая, вируса иммунодефицита человека, парапоксвируса, протозойных инфекций, токсоплазмоза и ассоциированных с опухолями истечения и отека. Соединения, соответствующие данному изобретению, обладают более чем одной из упомянутых активностей и, вследствие этого, могут быть направлены на множество путей сигнальной трансдукции. Таким образом, данные соединения могут достигать терапевтических и профилактических эффектов, которые в норме получают только при использовании комбинации различных соединений. Например, способность ингибировать как формирование новых сосудов (например, ассоциированное с функцией VEGFR-2 и VEGFR-3) (например, крови и/или лимфы), так и пролиферацию клеток (например, ассоциированную с функцией raf и PDGFR-) при использовании одного соединения особенно благоприятно при лечении рака и других нарушений пролиферации клеток, которым способствует неоваскуляризация. Таким образом, настоящее изобретение относится, в частности, к соединениям, которые обладают,по меньшей мере, активностью против пролиферации клеток и антиангиогенной (т.е. ингибируют ангиогенез) активностью. Любое нарушение или состояние, при котором было бы благоприятным ингибирование роста сосудов и пролиферации клеток, можно лечить согласно настоящему изобретению. Использование одного соединения также дает преимущество, поскольку круг его активностей мо- 10010485 жет быть более точно определен. Как указано выше, настоящее изобретение относится к способам лечения и/или предупреждения заболеваний и состояний и/или модуляции одного или более путей, полипептидов, генов, заболеваний,состояний и т.п., ассоциированных с raf, VEGFR, PDGFR, р 38 и/или flt-3. Данные способы, в основном,включают введение эффективных количеств соединений, соответствующих настоящему изобретению,где эффективное количество соединения представляет собой количество соединения, которое используют для достижения требующегося результата. Соединения можно вводить в любой эффективной форме любым эффективным путем, как более подробно обсуждается ниже. Способы включают модуляцию пролиферации опухолевых клеток, в том числе ингибирование пролиферации клеток. Последнее показывает, что рост и/или дифференцировка опухолевых клеток уменьшается, снижается, ослабляется, замедляется и т.п. Термин "пролиферация" включает любой процесс, который относится к росту и делению клеток, и включает дифференцировку и апоптоз. Как обсуждалось выше, киназы raf играют ключевую роль в активации цитоплазматического сигнального каскада, включенного в пролиферацию, дифференцировку и апоптоз клеток. Например, исследования показали, что ингибирование c-raf посредством антисмысловых олигонуклеотидов могут блокировать клеточную пролиферацию (см. выше). Любое количество ингибирования считают терапевтическим. В способы, соответствующие настоящему изобретению, включен способ применения вышеописанного соединения (соединения формулы I), включая его соли, пролекарственные формы, метаболиты(окисленные производные) и композиции, для лечения гиперпролиферативных нарушений у млекопитающих, заключающийся во введении млекопитающему, включая нуждающегося в этом человека, количества соединения, соответствующего данному изобретению, его фармацевтически приемлемой соли,пролекарственной формы, метаболита (окисленного производного) и композиции, которое эффективно для лечения нарушения. Гиперпролиферативные нарушения включают, но без ограничения перечисленным, солидные опухоли, такие как рак молочной железы, дыхательных путей, головного мозга, репродуктивных органов,пищеварительного тракта, мочевых путей, глаза, печени, кожи головы и шеи, щитовидной железы, паращитовидной железы и их отдаленных метастазов. Данные нарушения также включают лимфомы, саркомы и лейкозы. Можно лечить любую опухоль или рак, включая, но без ограничения перечисленным, формы рака,имеющие одну или более мутаций в raf, ras и/или flt-3, а также в любом расположенном выше или ниже элементе путей передачи сигнала, частью которых они являются. Как обсуждалось ранее, рак можно лечить соединением, соответствующим настоящему изобретению, независимо от механизма, который является ответственным за него. Можно лечить рак любого органа, включая, но без ограничения перечисленным, рак, например, толстой кишки, поджелудочной железы, молочной железы, простаты, костей,печени, почки, легкого, яичка, кожи, желудка, колоректальный рак, карциному клеток почки, гепатоцеллюларную карциному, меланому и т.п. Примеры форм рака молочной железы включают, но без ограничения перечисленным, инвазивную карциному протоков, инвазивную лобулярную карциному, карциному протоков in situ и лобулярную карциному in situ. Примеры форм рака дыхательных путей включают, но без ограничения перечисленным, мелкоклеточную и немелкоклеточную карциному легкого, а также бронхиальную аденому и плевропульмонарную бластому. Примеры форм рака головного мозга включают, но без ограничения перечисленным, глиому ствола головного мозга и гипоталамическую глиому, астроцитому мозжечка и коры головного мозга, медуллобластому, эпендимому, а также нейроэктодермальную и пинеальную опухоль. Опухоли мужских половых органов включают, но без ограничения перечисленным, рак простаты и яичка. Опухоли женских половых органов включают, но без ограничения перечисленным, рак эндометрия, шейки матки, яичников,вагины и вульвы, а также саркому матки. Опухоли пищеварительного тракта включают, но без ограничения перечисленным, анальный рак,рак толстой кишки, колоректальный рак, рак пищевода, желчного пузыря, желудка, поджелудочной железы, толстой кишки, тонкой кишки и слюнных желез. Опухоли мочевых путей включают, но без ограничения перечисленным, рак мочевого пузыря, мужского полового члена, почки, почечной лоханки, мочеточника и уретры. Формы рака глаза включают, но без ограничения перечисленным, внутриглазную меланому и ретинобластому. Примеры рака печени включают, но без ограничения перечисленным, гепатоцеллюларную карциному (карциномы клеток печени с или без фиброламеллярного варианта), холангиокарциному (карциному внутрипеченочных желчных протоков) и смешанную гепатоцеллюларную холангиокарциному. Формы рака кожи включают, но без ограничения перечисленным, карциному сквамозных клеток,саркому Капоши, злокачественную меланому, рак кожных клеток Меркеля и немеланомный рак кожи. Формы рака головы и шеи включают, но без ограничения перечисленным, рак гортани, гортанной части глотки (гипофаринкса), носоглотки и/или лимфому центральной нервной системы.- 11010485 Саркомы включают, но без ограничения перечисленным, саркому мягкой ткани, остеосаркому, злокачественную фиброзную гистиоцитому, лимфосаркому и рабдомиосаркому. Лейкозы включают, но без ограничения перечисленным, острый миелоидный лейкоз, хронический лимфоцитарный лейкоз, хронический миелогенный лейкоз и лейкоз волосковых клеток. Кроме ингибирования пролиферации опухолевых клеток, соединения, соответствующие настоящему изобретению, могут также вызывать регрессию опухоли, например уменьшение размера опухоли или распространения рака в организме. Настоящее изобретение также относится к способам модуляции ангиогенеза и/или лимфангиогенеза в системе, содержащей клетки, заключающимся во введении в систему эффективного количества соединения, описанного в данном контексте. Система, содержащая клетки, может представлять собой систему in vivo, такую как опухоль в организме пациента, выделенные органы, ткани или клетки, системы анализа in vitro (CAM, BCE и т.п.), модели на животных (например, подкожные модели рака in vivo), хозяев, нуждающихся в лечении (например, хозяев, страдающих от заболеваний, имеющих ангиогенный и/или лимфангиогенный компонент,таких как рак), и т.п. Несоответствующая и эктопическая экспрессия ангиогенеза может быть вредной для организма. Ряд патологических состояний ассоциируется с ростом посторонних кровеносных сосудов. Они включают, например, диабетическую ретинопатию, неоваскулярную глаукому, псориаз, ретролентальную фиброплазию, ангиофиброму, воспаление и т.п. Кроме того, повышенное кровоснабжение, связанное с раковой тканью или тканью новообразования, способствует росту, приводя к быстрому увеличению опухоли и метастазам. Более того, рост новых кровеносных и лимфатических сосудов в опухоль представляет способ выхода для измененных клеток, способствуя образованию метастазов и последующему распространению рака. Эффективные системы измерения ангиогенеза и/или лимфангиогенеза и их ингибирования включают, например, неоваскуляризацию опухолевых эксплантатов (см., например, патенты США 5192744, 6024688), анализ с использованием куриной хориоаллантоисной оболочки (CAM) (например, см. статьи Taylor и Follcman, Nature 1982, 297, 307-312; Eliceiri et al., J. Cell Biol. 1998, 140, 1255-1263), анализ с использованием капиллярных эндотелиальных клеток (BCE) (например, см. патент США 6024688; статью Polverini P.J. et al., Methods Enzymol. 1991, 198, 440-450), анализы миграции и анализ ингибирования роста HUVEC (пуповинных клеток сосудистого эндотелия человека) (например, см. патент США 6060449) и использование модели с кроличьим ухом (см., например, статью Szuba et al., FASEB J. 2002, 16 (14),1985-7). Модуляцию ангиогенеза можно определить любым другим способом. Например, степень васкуляризации ткани, как правило, определяют путем оценки числа и плотности сосудов, присутствующих в данном образце. Например, плотность микрососудов (MVD) может быть оценена подсчетом числа эндотелиальных кластеров в поле микроскопа с большим увеличением или посредством детекции маркера,специфического для микрососудистого эндотелия, или других маркеров растущих или сформированных кровеносных сосудов, таких как CD31 (известный также как молекула адгезии тромбоцитов-эндотелиальных клеток или РЕСАМ). Антитело к CD31 можно использовать в принятых иммуногистологических способах для иммуноокрашивания срезов тканей, как описано, например, в патенте США 6017949; статье Delias et al., Gyn. Oncol. 1997, 67, 27-33 и др. Другие маркеры ангиогенеза включают, например,Vezfl (см., например, статью Xiang et al., Dev. Bio. 1999, 206, 123-141), ангиопоэтин, Tie-1 и Tie-2 (см.,например, статью Sato et al., Nature 1995, 376, 70-74). Кроме того, настоящее изобретение относится к способам скрининга пациентов с целью определения их чувствительности к соединениям, соответствующим настоящему изобретению. Например, изобретение относится к способам определения, может ли состояние модулироваться соединением, описанным в данном контексте, предусматривающим измерение экспрессии или активности raf, VEGFR-2,VEGFR-3, PDGFR-, р 38 и/или flt-3 в образце, содержащем клетки или клеточный экстракт, где указанный образец получен из клетки или субъекта с указанным состоянием. Когда результаты определения показывают, что один или более из упомянутых генов (и/или полипептидов, которые они кодируют) отличается от нормального состояния, это идентифицирует состояние как излечимое соединением, соответствующим настоящему изобретению, т.е. в соответствии с этим указанное нарушение или состояние могут модулироваться соединением, где указанная экспрессия или активность повышаются при данном состоянии по сравнению с нормальным контролем. Далее способ может включать стадию сравнения экспрессии в образце с нормальным контролем или экспрессии в образце, полученном из нормальной или непораженной ткани. Сравнение может быть проведено вручную относительно стандарта или в электронной форме (например, относительно базы данных) и т.п. Нормальный контроль может быть образцом стандарта, который представляется вместе с анализом; он может быть получен из соседней, но непораженной ткани, полученной от того же самого пациента, или он может представлять собой ранее определенные величины и т.п. Можно определить экспрессию гена, экспрессию белка (например, избыток в клетке), активность белка (например, активность киназы) и т.п. Например, биоптат, полученный от онкологического пациента, может быть оценен на при- 12010485 сутствие, количество и/или активность raf, VEGFR-2, VEGFR-3, PDGFR-, р 38 и/или flt-3. Повышенная экспрессия или активность одной или более из них показывает, что рак может быть мишенью для лечения соединения, соответствующего настоящему изобретению. Например, как описано в нижеприведенных примерах, активность raf можно мониторировать по ее способности инициировать каскад, приводящий к фосфорилированию ERK (т.е. raf/MEK/ERK), дающий в результате фосфо-ERK. Повышенные уровни фосфо-ERK в онкологическом образце показывают, что активность raf в нем повышена, предполагая применение соединений, соответствующих настоящему изобретению, для его лечения. Измерение экспрессии включает определение или детекцию количества полипептида, присутствующего в клетке или выделяемого ей, а также измерение лежащей в его основе мРНК, где количество присутствующей мРНК рассматривают как отражающее количество полипептида, образуемого клеткой. Более того, гены raf, VEGFR-2, VEGFR-3, PDGFR-, p38 и/или Flt-3 можно проанализировать, чтобы определить, имеется ли дефект гена, ответственного за аберрантную экспрессию активности полипептида. Детекцию полипептида можно осуществить любым имеющимся способом, например вестерн-блоттингом, ELISA, дот-блоттингом, иммунопреципитацией, RIA (радиоиммуноанализом), иммуногистохимическим способом и т.п. Например, можно приготовить и пометить специфическим антителом срез ткани (непрямым или прямым способом и визуализировать под микроскопом). Количество полипептида можно определить без визуализации, например путем получения лизата образца, представляющего интерес, и последующего определения с помощью ELISA или вестерн-анализа количества полипептида/количества ткани. Можно использовать антитела и другие специфические связывающие агенты. Не имеется ограничений относительно того, как проводить детекцию. Могут быть использованы анализы, которые обеспечивают количественное определение и/или детекцию присутствия/отсутствия нуклеиновой кислоты-мишени (например, генов, мРНК и т.п. raf,VEGFR, PDGFR, р 38 и/или flt-3) в образце. Анализы можно проводить на уровне одной клетки или в образце, содержащем много клеток, где анализ дает среднюю величину экспрессии относительно всего состава клеток и ткани, присутствующих в образце. Может быть использован любой приемлемый формат анализа, включая, но без ограничения перечисленным, например, анализ посредством саузерн-блоттинга,анализ посредством нозерн-блоттинга, полимеразно-цепную реакцию (ПЦР) (см., например, статью SaikiA Guide to Methods and Applications (Протоколы ПЦР: руководство по способам и применению), под ред.Innis et al., Academic Press, New York, 1990), полимеразно-цепную реакцию с участием обратной транкриптазы (ОТ-ПЦР), иммобилизованную ПЦР, ускоренную амплификацию концов кДНК ("RACE") (см.,например, Schaefer в сборнике Gene Cloning and Analysis: Current Innovations, Pages 99-115, 1997), лигазно-цепную реакцию (ЛЦР) (см. ЕР 320308), одностороннюю ПЦР (см. статью Ohara et al., Proc. Natl.Weissman, Proc. Natl. Acad. Sci., 93: 659-663 и патенты США 6010850 и 5712126; статью Welsh et al.,Nucleic Acid Res., 20: 4965-4970, 1992 и патент США 5487985) и другие методики фингерпринтинга РНК, амплификацию на основе последовательности нуклеиновой кислоты ("NASBA") и другие системы амплификации на основе транскрипции (см., например, патенты США 5409818 и 5554527; WO 88/10315), полинуклеотидные чипы (см., например, патенты США 5143854, 5424186, 5700637,5874219 и 6054270; РСТ WO 92/10092; РСТ WO 90/15070), репликазу Q (см. PCT/US87/00880), амплификацию с замещением нити ("SDA"), реакцию репарации цепи ("RCR"), анализы нуклеазной защиты,способы на основе вычитания, ускоренное сканирование и т.п. Дополнительные эффективные способы включают, но без ограничения перечисленным, например, способы амплификации на основе матрицы,конкурентную ПЦР (см., например, патент США 5747251), анализы на основе окислительно-восстановительных реакций (см., например, патент США 5871918), анализы на основе Taqman (см., например,статью Holland et al., Proc. Natl. Acad. Sci. 1991, 88, 7276-7280; патенты США 5210015 и 5994063),мониторирование на основе флуоресценции в режиме реального времени (см., например, патент США 5928907), молекулярные метки переноса энергии (см., например, патенты США 5348853,5532129, 5565322, 6030787 и 6117635; статью Tyagi и Kramer, Nature Biotech., 14: 303-309, 1996). Может быть использован любой способ, пригодный для анализа на уровне одной клетки экспрессии гена или белка, включая гибридизацию in situ, иммуногистохимический способ, MACS, FACS (сортинг клеток по интенсивности флуоресценции), проточную цитометрию и т.п. Для анализов на уровне одной клетки продукты экспрессии можно измерить при использовании антител, ПЦР или других типов амплификации нуклеиновых кислот (см., например, статьи Brady et al., Methods Mol.Cell. Biol. 1990, 2, 17-25;Eberwine et al., Proc. Natl. Acad. Sci. 1992, 89, 3010-3014; патент США 5723290). Данные и другие способы можно осуществить принятым образом, например, как описано в упомянутых публикациях. Активность raf, VEGFR-2, VEGFR-3, PDGFR-, р 38 и/или flt-3 может быть оценена рутинным образом, например, как описано в нижеприведенных примерах, или при использовании стандартных анализов активности киназы. Настоящее изобретение представляет также способы оценки эффективности соеди- 13010485 нения, соответствующего настоящему изобретению, при лечении нарушения, предусматривающие одну или более следующих стадий в любом эффективном порядке, например введение количества соединения,измерение экспрессии или активности raf, VEGFR-2, VEGFR-3, PDGFR-, p38 и/или flt-3 (см. выше), установление эффекта указанного соединения на указанную экспрессию или активность. Например, у пациентов, которых лечили соединением, соответствующим настоящему изобретению, могут быть взяты образцы биоптатов, а затем проанализированы на присутствие и/или активность упомянутых сигнальных молекул. Аналогично, как обсуждалось выше, снижение уровней фосфо-ERK в раковой ткани (например,по сравнению с нормальной тканью или уровнем до лечения) показывает, что соединение обладает эффективностью и терапевтическим эффектом in vivo. Способ может быть использован для определения соответствующих дозировок и схемы дозирования, например сколько вводить соединения и с какой частотой его вводить. Мониторированием его эффекта на сигнальные молекулы в ткани лечащий врач может определить подходящий протокол лечения и достигается ли при этом необходимый эффект, например, в отношении модуляции или ингибирования пути сигнальной трансдукции. Соединения, соответствующие настоящему изобретению, можно также использовать в качестве маркеров для определения присутствия и количества raf, VEGFR-2, VEGFR-3, PDGFR-, р 38 и/или flt- 3 в образце, содержащем биологический материал. Это включает одну или более из следующих стадий в любом эффективном порядке:(i) контактирование указанного образца, содержащего биологический материал, с соединением, соответствующим настоящему изобретению, и (ii) определение, связывается ли указанное соединение с указанным материалом. Соединение может быть помечено, или оно может быть использовано как конкурент меченого соединения, такого как меченый АТФ. Изобретение представляет также способы лечения, предупреждения, модуляции и т.п. заболеваний и состояний у млекопитающих, включающие введение соединения, соответствующего данному изобретению, с другим модулятором пути сигнальной трансдукции, включающим, но без ограничения перечисленным, raf, VEGFR, PDGFR, р 38 и/или flt-3. Они могут находиться в одной и той же композиции или в раздельных препаратах или унифицированных дозах. Введение может быть осуществлено одним и тем же или различными способами и может быть одновременным или последовательным. Следующие публикации относятся к модуляции VEGFR-3 и включены в данном контексте вследствие описания в них болезненных состояний, опосредованных VEGFR-3, и анализов для определения данной активности:WO02/081520 Boesen и др. Следующие публикации относятся к модуляции VEGFR-2 и включены в данном контексте вследствие описания в них болезненных состояний, опосредованных VEGFR-2, и анализов для определения данной активности: ЕР 0882799 Hanai и др.; ЕР 11673 84 Ferraram и др.; ЕР 1086705 Sato и др.; ЕР 11300032 Tesar и др.; ЕР 1166798 Haberey и др.; ЕР 1166799 Haberey и др.; ЕР 1170017 Maini и др.; ЕР 1203827 Smith;WO02/083850 Rosen и др. Следующие публикации относятся к модуляции flt-3 и включены в данном контексте вследствие описания в них болезненных состояний, опосредованных flt-3, и анализов для определения данной активности:WO9426891 Birnbaum и др. Следующие публикации относятся к модуляции PDGF/PDGFR и включены в данном контексте вследствие описания в них болезненных состояний, опосредованных PDGFR-, и анализов для опреде- 14010485 ления данной активности:PDGFR-. ЕР 1000617 Lammers и др.; ЕР 0869177 Matsui и др.; ЕР 0811685 Escobedo и др. Фармацевтические композиции на основе соединений, соответствующих настоящему изобретению Данное изобретение относится также к фармацевтическим композициям, содержащим соединение,соответствующее настоящему изобретению, и его фармацевтически приемлемые соли. Данные композиции могут быть использованы для достижения необходимого фармакологического эффекта путем введения нуждающемуся в этом пациенту. В целях данного изобретения пациент представляет собой млекопитающее, включая человека, нуждающееся в лечении определенного состояния или заболевания. Вследствие этого настоящее изобретение включает фармацевтические композиции, которые содержат фармацевтически приемлемый носитель и фармацевтически эффективное количество соединения или его соли, соответствующих настоящему изобретению. Термин "фармацевтически приемлемый носитель" означает любой носитель, который относительно нетоксичен и безвреден для пациента в концентрациях,согласующихся с эффективной активностью активного ингредиента, при этом любые побочные эффекты, присущие носителю, не нарушают положительные эффекты активного ингредиента. Фармацевтически эффективное количество соединения представляет собой количество, которое дает результат или оказывает воздействие на определенное состояние, подлежащее лечению. Соединения, соответствующие настоящему изобретению, можно вводить с фармацевтически приемлемыми носителями, хорошо известными в области техники при использовании любых эффективных принятых унифицированных дозированных форм, включая препараты с немедленным, замедленным и рассчитанным по времени высвобождением, перорально, парентерально, наружно, назально, офтальмическим путем, через органы зрения,подъязычно, ректально, вагинально и т.п. Для перорального введения соединение может быть приготовлено в виде твердых или жидких препаратов, таких как капсулы, пилюли, таблетки, пастилки, лепешки, леденцы, порошки, растворы, суспензии или эмульсии, и могут быть получены согласно способам, известным в области техники для изготовления фармацевтических композиций. Твердые унифицированные дозированные формы могут представлять собой капсулу, которая может иметь обычную твердую или мягкую желатиновую оболочку, содержащую, например, поверхностно-активные вещества, смазывающие компоненты и инертные наполнители, такие как лактоза, сахароза, фосфат кальция и кукурузный крахмал. В другом варианте осуществления соединения, соответствующие данному изобретению, могут быть таблетированы с использованием обычных основ для таблеток, таких как лактоза, сахароза и кукурузный крахмал, в комбинации со связующими агентами, такими как акация, кукурузный крахмал или желатин,разрыхлителями, предназначенными для облегчения разрушения и растворения таблетки после приема,такими как картофельный крахмал, альгиновая кислота, кукурузный крахмал и гуаровая камедь, камедь трагаканта, акация, смазывающими агентами, предназначенными для улучшения сыпучести гранулята таблеток и предотвращения прилипания материала таблеток к поверхностям таблеточных матриц и форм, например тальком, стеариновой кислотой или стеаратом магния, кальция или цинка, красителями,окрашивающими агентами и вкусовыми добавками, такими как перечная мята, масло зимолюбки или вишневая вкусовая добавка, предназначенными для повышения эстетических качеств таблеток и для того, чтобы сделать их более приемлемыми для пациента. Подходящие наполнители для применения в пероральных жидких дозированных формах включают дикальцийфосфат и разбавители, такие как вода и спирты, например этанол, бензиловый спирт и полиэтиленгликоли, либо с добавлением, либо без добавления фармацевтически приемлемого поверхностно-активного вещества, суспендирующего агента или эмульгатора. Различные другие материалы могут присутствовать в качестве покрытий или иным образом модифицировать физическую форму унифицированной дозы. Например, таблетки, пилюли или капсулы могут быть покрыты шеллаком, сахаром или обоими компонентами. Диспергирующиеся порошки и гранулы пригодны для получения водной суспензии. Они представляют собой активный ингредиент в смеси в диспергирующим или смачивающим агентом, суспендирующим агентом и одним или более консервантов. Подходящие диспергирующие или смачивающие и суспендирующие агенты уже проиллюстрированы вышеуказанными агентами. Дополнительные наполнители,например вышеописанные подсластители, вкусовые добавки и красители, также могут присутствовать. Фармацевтические композиции, соответствующие данному изобретению, также могут быть в форме суспензий типа масло в воде. Масляная фаза может представлять собой растительное масло, такое как жидкий парафин или смесь растительных масел. Подходящие эмульгаторы могут представлять собой (1) природные камеди, такие как камедь акации и камедь трагаканта, (2) природные фосфатиды, такие как соя и лецитин, (3) сложные эфиры или частичные сложные эфиры, полученные из жирных кислот и гекситоловых ангидридов, например сорбитмоноолеат, (4) продукты конденсации указанных частичных эфиров с этиленоксидом, например полиоксиэтилен сорбитмоноолеат. Эмульсии могут также содержать подсластители и вкусовые добавки.- 16010485 Масляные суспензии могут быть приготовлены суспендированием активного ингредиента в растительном масле, таком как, например, арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать сгуститель, такой как, например, пчелиный воск, твердый парафин или цетиловый спирт. Суспензии могут также содержать один или более консервантов, например этил- или н-пропил-п-гидроксибензоат; один или более красителей; одну или более вкусовых добавок и один или более подсластителей, таких как сахароза или сахарин. Сиропы и эликсиры могут быть приготовлены с подсластителями, такими как, например, глицерин,пропиленгликоль, сорбит или сахароза. Данные составы могут также содержать смягчитель и консервант, такой как метил- и пропилпарабены, и вкусовые добавки и красители. Соединения, соответствующие данному изобретению, могут быть также введены парентерально,т.е. подкожно, внутривенно, внутриглазно, внутрисуставно, внутримышечно или внутрибрюшинно в виде инъекционных доз соединения в физиологически приемлемом растворителе с фармацевтическим носителем, который может представлять собой стерильную жидкость или смесь жидкостей, таких как вода,солевой раствор, водный раствор декстрозы и растворы подобных сахаров, спирт, такой как этанол, изопропанол или гексадециловый спирт, гликоли, такие как пропиленгликоль или полиэтиленгликоль, кетали глицерина, такие как 2,2-диметил-1,1-диоксалан-4-метанол, простые эфиры, такие как полиэтиленгликоль 400, масло, жирную кислоты, сложный эфир жирной кислоты или глицерид жирной кислоты или глицерид ацетилированной жирной кислоты с добавлением или без добавления фармацевтически приемлемого поверхностно-активного вещества, такого как мыло или детергент, суспендирующего агента, такого как пектин, карбомеры, метилцеллюлоза, гидроксипропилметилцеллюлоза или карбоксиметилцеллюлоза, или эмульгатора и других фармацевтических вспомогательных агентов. Примерами масел, которые могут быть использованы в парентеральных препаратах, соответствующих данному изобретению, являются те, которые представлены маслами нефтяной, животной, растительной или синтетической природы, например арахисовым маслом, соевым маслом, кунжутным маслом, хлопковым маслом, кукурузным маслом, оливковым маслом, вазелином и минеральным маслом. Подходящие жирные кислоты включают олеиновую кислоту, стеариновую кислоту, изостеариновую кислоту и миристиновую кислоту. Подходящие сложные эфиры жирных кислот представляют собой, например, этилолеат и изопропилмиристат. Подходящие мыла включают соли жирных кислот щелочных металлов, аммония и триэтанолхлорида, и подходящие детергенты включают катионные детергенты,например галиды диметилдиалкиламмония, галиды алкилпиридиния и ацетаты алкиламина; анионные детергенты, например алкил-, арил- и олефинсульфонаты, алкил-, олефин-, эфир- и моноглицеридсульфаты и сульфосуцкинаты; неионные детергенты, например оксиды жирных аминов, алканоламины жирных кислот и поли(оксиэтилен-оксипропилены) или сополимеры этиленоксида или пропиленоксида, и амфотерные детергенты, например алкиламинопропионаты и соли четвертичного аммония 2-алкилимидазолина, а также смеси. Парентеральные композиции, соответствующие данному изобретению, как правило, будут содержать от приблизительно 0,5 до приблизительно 25 мас.% активного ингредиента в растворе. Консерванты и буферы также могут быть эффективно использованы. Для минимизации или устранения раздражения в области инъекции данные композиции могут содержать неионогенное поверхностно-активное вещество, имеющее гидрофильно-липофильное равновесие (HLB) от приблизительно 12 до приблизительно 17. Количество поверхностно-активного вещества в данном препарате лежит в интервале от приблизительно 5 до приблизительно 15 мас.%. Поверхностно-активное вещество может быть одним компонентом, имеющим вышеуказанное HLB, или может быть смесью двух или более компонентов, имеющих желательное HLB. Иллюстративными поверхностно-активными веществами, используемыми в парентеральных препаратах, является класс эфиров жирных кислот полиэтиленсорбита, например сорбитмоноолеат, и высокомолекулярные аддукты этиленоксида с гидрофобным основанием, образованные конденсацией пропиленоксида с пропиленгликолем. Фармацевтические композиции могут быть в форме стерильных инъекционных водных суспензий. Данные суспензии можно приготовить согласно известным способам при использовании подходящих диспергирующих или смачивающих и суспендирующих агентов, таких как, например, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, камедь трагаканта и камедь акации; диспергирующих или смачивающих агентов, которые могут представлять собой природный фосфатид, такой как лецитин, продукт конденсации алкиленоксида с жирной кислотой, например полиоксиэтиленстеарат, продукт конденсации этиленоксида с алифатическим спиртом с длинной цепью, например гептадекаэтиленоксиэтанол, продукт конденсации этиленоксида с частичным сложным эфиром, полученным из жирной кислоты и гекситола, такой как полиоксиэтиленсорбитмоноолеат, или продукт конденсации этиленоксида с частичным сложным эфиром, полученным из жирной кислоты и гекситолового ангидрида, например полиоксиэтиленсорбитмоноолеат. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе. Разба- 17010485 вители или растворители, которые могут быть использованы, представляют собой, например, воду, раствор Рингера, изотонические растворы хлорида натрия и изотонические растворы глюкозы. Кроме того,стерильные жирные масла обычно используют в качестве растворителей или суспендирующих сред. Для этой цели можно использовать любое успокаивающее жирное масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, могут быть использованы при получении инъекционных препаратов. Композиция, соответствующая изобретению, может быть также введена в форме суппозиториев для ректального введения лекарственного препарата. Данные композиции могут быть получены смешиванием лекарственного препарата с подходящим не вызывающим раздражения наполнителем, который является твердым при обычных температурах, но жидким при ректальной температуре и будет, вследствие этого, плавиться в прямой кишке, высвобождая лекарственный препарат. Данный материал представляет собой, например, масло какао и полиэтиленгликоль. Для другого препарата, применяемого в способах, соответствующих настоящему изобретению, используют устройства для чрескожной доставки ("пластыри"). Данные чрескожные пластыри могут быть использованы для обеспечения непрерывной или прерывающейся инфузии соединений, соответствующих настоящему изобретению, в контролируемых количествах. Конструкция и применение чрескожных пластырей для доставки фармацевтических агентов хорошо известна в области техники (см., например,патент США 5023252, выданный 11 июня 1991 г., включенный в данном контексте в виде ссылки). Данные пластыри могут быть сконструированы для непрерывной, пульсовой доставки или доставки по необходимости фармацевтических агентов. Препараты с контролируемым высвобождением для парентерального введения включают липосомальные препараты, препараты на основе полимерных микросфер и полимерных гелей, которые хорошо известны в области техники. Может быть желательным или необходимым ввести пациенту фармацевтическую композицию с помощью механического доставляющего устройства. Конструкция и применение механических доставляющих устройств для доставки фармацевтических агентов хорошо известны в области техники. Прямые методики, например, введения лекарственного препарата непосредственно в головной мозг, как правило,включают помещение катетера для доставки лекарственного препарата в вентрикулярную систему пациента для того, чтобы обойти гематоэнцефалический барьер. Одна из таких имплантируемых систем доставки, используемых для транспорта агентов в специфические анатомические области тела, описана в патенте США 5011472, выданном 30 апреля 1991 г. Композиции, соответствующие изобретению, могут также содержать другие принятые фармацевтически приемлемые составляющие ингредиенты, в основном, называемые носителями или разбавителями,как необходимо или желательно. Могут быть использованы принятые способы получения данных композиций в соответствующих дозированных формах. Данные ингредиенты и способы включают те, которые описаны в следующих ссылках, каждая из которых включена в данном контексте в виде ссылки:Powell M.F. et al., "Compendium of Excipients for Parenteral Formulations" (Справочник по наполнителям для парентеральных препаратов), PDA Journal of Pharmaceutical ScienceTechnology 1998, 52 (5), 238311; Strickley R.G., "Parenteral Formulations of Small Molecule Therapeutics Marketed in the United States(1999)-Part-1" (Парентеральные препараты терапевтических агентов групп маленьких молекул, имеющиеся на рынке в Соединенных Штатах Америки (1999), часть 1), PDA Journal of Pharmaceutical ScienceTechnology 1999, 53 (6), 324-349 и Nema S. et al., "Excipients and Their Use in Injectable Products" (Наполнители и их применение в инъекционных продуктах), PDA Journal of Pharmaceutical ScienceTechnology 1997, 51 (4), 166-171. Обычно применяемые фармацевтические ингредиенты, которые могут быть использованы соответствующим образом с целью получения композиции для предназначенного для нее способа введения,включают подкисляющие агенты (примеры включают, но без ограничения перечисленным, уксусную кислоту,лимонную кислоту, фумаровую кислоту, хлористо-водородную кислоту, азотную кислоту); защелачивающие агенты (примеры включают, но без ограничения перечисленным, раствор аммиака, карбонат аммония, диэтаноламин, моноэтаноламин, гидроксид калия, борат натрия, карбонат натрия,гидроксид натрия, триэтаноламин, троламин); адсорбенты (примеры включают, но без ограничения перечисленным, целлюлозу в виде порошка и активированный уголь); аэрозольные пропелленты (примеры включают, но без ограничения перечисленным, диоксид углерода, CCl2F2, F2ClC-CClF2 и CClF3); агенты, замещающие воздух (примеры включают, но без ограничения перечисленным, азот и аргон); противогрибковые консерванты (примеры включают, но без ограничения перечисленным, бензойную кислоту, бутилпарабен, этилпарабен, метилпарабен, пропилпарабен, бензоат натрия); антимикробные консерванты (примеры включают, но без ограничения перечисленным, хлорид бензалкония, хлорид бензетония, бензиловый спирт, хлорид цетилпиридиния, хлорбутанол, фенол, фенетиловый спирт, фенилртутьнитрат и тимеросал);- 18010485 антиоксиданты (примеры включают, но без ограничения перечисленным, аскорбиновую кислоту, аскорбилпальмитат, бутилированный гидрокситолуол, гипофосфорную кислоту, монотиоглицерин, пропилгаллат, аскорбат натрия, бисульфит натрия, формальдегидсульфоксилат натрия, метабисульфит натрия); связующие материалы (примеры включают, но без ограничения перечисленным, блок-полимеры,природный и синтетический каучук, полиакрилаты, полиуретаны, силиконы, полисилоксаны и стиролбутадиеновые сополимеры); забуферивающие агенты (примеры включают, но без ограничения перечисленным, метафосфат калия, фосфат динатрия, ацетат натрия, безводный цитрат натрия и цитрат натрия дигидрат); агенты-носители (примеры включают, но без ограничения перечисленным, сироп акации, ароматический сироп, ароматический эликсир, вишневый сироп, сироп какао, апельсиновый сироп, сироп, кукурузное масло, минеральное масло, арахисовое масло, кунжутное масло, бактериостатический раствор хлорида натрия для инъекций и бактериостатическую воду для инъекций); хелатирующие агенты (примеры включают, но без ограничения перечисленным, эдетат динатрия и эдетовую кислоту); красители (примеры включают, но без ограничения перечисленным, FDC красный 3, FDC красный 20, FDC желтый 6, FDC синий 2, DC зеленый 5, DC оранжевый 5, DC красный 8, карамель и оксид железа красный); осветляющие агенты (примеры включают, но без ограничения перечисленным, бентонит); эмульгаторы (примеры включают, но без ограничения перечисленным, акацию, цетомакрогол, цетиловый спирт, глицерил моностеарат, лецитин, сорбитмоноолеат, полиоксиэтилен 50 моностеарат); инкапсулирующие агенты (примеры включают, но без ограничения перечисленным, желатин и ацетатфталат целлюлозы); ароматизирующие вещества (примеры включают, но без ограничения перечисленным, анисовое масло, коричное масло, какао, ментол, апельсиновое масло, масло перечной мяты и ванилин); увлажнители (примеры включают, но без ограничения перечисленным, глицерин, пропиленгликоль и сорбит); отмучивающие агенты (примеры включают, но без ограничения перечисленным, минеральное масло и глицерин); масла (примеры включают, но без ограничения перечисленным, масло земляного ореха, минеральное масло, оливковое масло, ореховое масло, кунжутное масло и растительное масло); мазевые основы (примеры включают, но без ограничения перечисленным, ланолин, гидрофильную мазь, мазь на основе полиэтиленгликоля, вазелин, гидрофильный вазелин, белую мазь, желтую мазь и мазь на основе розовой воды); агенты, усиливающие проницаемость (для чрескожной доставки) (примеры включают, но без ограничения перечисленным, моногидрокси- или полигидроксиспирты, одно- или многоатомные спирты,насыщенные или ненасыщенные жирные спирты, насыщенные или ненасыщенные жирные сложные эфиры, насыщенные или ненасыщенные дикарбоновые кислоты, эфирные масла, фосфатидиловые производные, кефалин, терпены, амиды, эфиры, кетоны и мочевины); пластификаторы (примеры включают, но без ограничения перечисленным, диэтилфталат и глицерин); растворители (примеры включают, но без ограничения перечисленным, этанол, кукурузное масло,хлопковое масло, глицерин, изопропанол, минеральное масло, олеиновую кислоту, арахисовое масло,очищенную воду, воду для инъекций, стерильную воду для инъекций и стерильную воду для орошения); сгустители (примеры включают, но без ограничения перечисленным, цетиловый спирт, воск цетиловых эфиров, микрокристаллический воск, парафин, стеариловый спирт, белый воск и желтый воск); основы для суппозиториев (примеры включают, но без ограничения перечисленным, масло какао и полиэтиленгиколи (смеси; поверхностно-активные вещества (примеры включают, но без ограничения перечисленным, хлорид бензалкония, ноноксинол 10, окстоксинол 9, полисорбат 80, лаурилсульфат натрия и сорбитан монопальмитат); суспендирующие агенты (примеры включают, но без ограничения перечисленным, агар, бентонит,карбомеры, карбоксиметилцеллюлозу натрия, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, каолин, метилцеллюлозу, трагакант и камедь); подсластители (примеры включают, но без ограничения перечисленным, аспартам, декстрозу, глицерин, маннит, пропиленгликоль, сахарин натрия и сахарозу); агенты против прилипания для таблеток (примеры включают, но без ограничения перечисленным,стеарат магния и тальк); связующие агенты для таблеток (примеры включают, но без ограничения перечисленным, акацию,альгиновую кислоту, карбоксиметилцеллюлозу натрия, прессующийся сахар, этилцеллюлозу, желатин,жидкую глюкозу, метилцеллюлозу и крахмал до желирования); разбавители для таблеток и капсул (примеры включают, но без ограничения перечисленным, дикальцийортофосфат, каолин, лактозу, маннит, микрокристаллическую целлюлозу, целлюлозу в порошке,осажденный карбонат кальция, карбонат натрия, фосфат натрия, сорбит и крахмал);- 19010485 агенты для покрытия таблеток (примеры включают, но без ограничения перечисленным, жидкую глюкозу, гидроксиэтилцеллюлозу, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, метилцеллюлозу, этилцеллюлозу, ацетатфталат целлюлозы и шеллак); наполнители для прямого прессования таблеток (примеры включают, но без ограничения перечисленным, дикальцийортофосфат); разрыхлители таблеток (примеры включают, но без ограничения перечисленным, альгиновую кислоты, карбоксиметилцеллюлозу кальция, микрокристаллическую целлюлозу, полакриллин калия, альгинат натрия, гликолят крахмала натрия и крахмал); скользящие вещества для таблеток (примеры включают, но без ограничения перечисленным, коллоидный оксид кремния, кукурузный крахмал и тальк); смазывающие компоненты для таблеток (примеры включают, но без ограничения перечисленным,стеарат кальция, стеарат магния, минеральное масло, стеариновую кислоту и стеарат цинка); компоненты, делающие непрозрачными таблетку/капсулу (примеры включают, но без ограничения перечисленным, диоксид титана); агенты для полировки таблеток (примеры включают, но без ограничения перечисленным, карнаубский воск и белый воск); сгустители (примеры включают, но без ограничения перечисленным, пчелиный воск, цетиловый спирт и парафин); агенты тоничности (примеры включают, но без ограничения перечисленным, декстрозу и хлорид натрия); агенты, повышающие вязкость (примеры включают, но без ограничения перечисленным, альгиновую кислоту, бентонит, карбомеры, карбоксиметилцеллюлозу натрия, метилцеллюлозу, альгинат натрия и трагакант); и смачивающие агенты (примеры включают, но без ограничения перечисленным, гептадекаэтилен оксиэтанол, лецитин, сорбитмоноолеат, полиоксиэтиленсорбитмоноолеат и полиоксиэтиленстеарат). Фармацевтические композиции, соответствующие настоящему изобретению, можно проиллюстрировать следующим образом. Стерильный внутривенный раствор. 5 мг/мл раствора соединения, соответствующего данному изобретению, получают, используя стерильную воду для инъекций, и подводят значение рН при необходимости. Раствор разбавляют для введения до концентрации 1-2 мг/мл стерильной 5% декстрозой и вводят как внутривенную инфузию в течение более 60 мин. Лиофилизированный порошок для внутривенного введения. Стерильный препарат можно приготовить с использованием (i) 100-1000 мг соединения, соответствующего данному изобретению, в виде лиофилизированного порошка, (ii) 32-327 мг/мл цитрата натрия и(iii) 300-3000 мг декстрана 40. Препарат восстанавливают стерильным солевым раствором для инъекций или 5% декстрозой до концентрации 1,0-20 мг/мл, который далее разводят солевым раствором или 5% декстрозой до 0,2-0,4 мг/мл и вводят либо в виде внутривенного болюса, либо внутривенной инфузией в течение 15-60 мин. Внутримышечная суспензия. Можно приготовить следующий раствор или суспензию для внутримышечной инъекции: 50 мг/мл нерастворимого в воде соединения, соответствующего данному изобретению,5 мг/мл карбоксиметилцеллюлозы натрия,4 мг/мл Твин 80,9 мг/мл хлорида натрия,9 мг/мл бензилового спирта. Капсулы с твердой оболочкой. Большое число унифицированных капсул получают наполнением стандартных состоящих из двух частей твердых желатиновых капсул, каждая из которых содержит 100 мг активного ингредиента в виде порошка, 150 мг лактозы, 50 мг целлюлозы и 6 мг стеарата магния. Мягкие желатиновые капсулы. Готовят смесь активного ингредиента в усвояемом масле, таком как соевое масло, хлопковое масло или оливковое масло, и впрыскивают с помощью поршневого насоса в расплавленный желатин для формирования мягких желатиновых капсул, содержащих 100 мг активного ингредиента. Капсулы промывают и сушат. Активный ингредиент может быть растворен в смеси полиэтиленгликоля, глицерина и сорбита для получения не смешивающейся с водой лекарственной смеси. Таблетки. Большое количество таблеток готовят с помощью обычных способов, причем унифицированная доза содержит 100 мг активного ингредиента, 0,2 мг коллоидного диоксида кремния, 5 мг стеарата магния,275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98,8 мг лактозы. Могут быть нанесены соответствующие водные и неводные покрытия для повышения приятного ощущения, улучшения элегантного вида и стабильности или задержки всасывания.- 20010485 Таблетки/капсулы с немедленным высвобождением. Они представляют собой твердые пероральные дозированные формы, полученные известными и новыми способами. Данные формы принимают перорально без воды для немедленного растворения и доставки лекарственного препарата. Активный ингредиент перемешивают в жидкости, содержащей такой ингредиент, как сахар, желатин, пектин и подсластители. Данные жидкости отверждают с образованием твердых таблеток или лепешек с помощью сублимационной сушки и методик твердофазной экстракции. Лекарственные соединения можно формовать с вязкоэластичными и термоэластичными сахарами и полимерами или шипучими компонентами для получения пористых матриц, предназначенных для немедленного высвобождения, не требующих воды. Дозировка фармацевтических композиций, соответствующих настоящему изобретению Основываясь на стандартных лабораторных методиках, которые, как известно, служат для оценки соединений, эффективных для лечения любого из вышеупомянутых нарушений, посредством стандартных тестов на токсичность и стандартных фармакологических анализов для определения лечения состояний, идентифицированных ранее у млекопитающих, и посредством сравнения данных результатов с результатами, полученными с известными лекарственными средствами, которые используют для лечения данных состояний, можно легко определить эффективную дозировку соединений, соответствующих данному изобретению, для лечения каждого желательного показания. Количество активного ингредиента,которое следует вводить при лечении одного их этих состояний, может варьировать в соответствии с такими соображениями, как конкретное соединение и используемая унифицированная доза, способ введения, период лечения, возраст и пол пациента, проходящего лечение, а также природа и степень развития состояния, которое лечат. Общее количество активного ингредиента, предназначенного для введения, может лежать в интервале от приблизительно 0,001 до приблизительно 200 мг/кг и предпочтительно от приблизительно 0,1 до приблизительно 50 мг/кг массы тела/день. Унифицированная доза может предпочтительно содержать от приблизительно 5 до приблизительно 4000 мг активного ингредиента и может вводиться 1 и больше раз в день. Суточная доза для перорального введения будет предпочтительно составлять от 0,1 до 50 мг/кг общей массы тела. Суточная доза для введения путем инъекции, включая внутривенные, внутримышечные,подкожные и парентеральные инъекции и применения инфузионных методик, будет предпочтительно составлять от 0,1 до 10 мг/кг общей массы тела. Схема введения суточной ректальной дозы будет предпочтительно составлять от 0,1 до 50 мг/кг общей массы тела. Схема введения суточной вагинальной дозы будет предпочтительно составлять от 0,1 до 50 мг/кг общей массы тела. Схема введения суточной наружной дозы будет предпочтительно составлять от 0,1 до 10 мг/кг, которую наносят от 1 до 4 раз в сутки. Чрескожная концентрация предпочтительно будет такой, как требуется для поддержания суточной дозы от 0,1 до 10 мг/кг. Схема введения суточной ингаляционной дозы будет предпочтительно составлять от 0,1 до 10 мг/кг общей массы тела. Другие дозы и количества можно подобрать рутинным путем. Конкретная схема введения исходной и последующих доз для каждого пациента будет варьировать с соответствии с природой и тяжестью состояния, как определяет лечащий врач, активностью используемого специфического соединения, возрастом и общим состоянием пациента, временем введения, способом введения, скоростью выведения лекарственного препарата, комбинациями лекарственных препаратов и т.п. Желательный способ лечения и число доз соединения, соответствующего настоящему изобретению,или его фармацевтически приемлемой соли или сложного эфира либо композиции может быть установлена компетентными специалистами в области техники при использовании принятых тестов лечения. Комбинация соединений и композиций, соответствующих настоящему изобретению,с дополнительными активными ингредиентами Соединения, соответствующие данному изобретению, могут быть введены в виде единственного фармацевтического агента или в комбинации с одним или более других фармацевтических агентов, причем комбинация не вызывает неприемлемых вредных эффектов. Это может иметь определенное значение при лечении гиперпролиферативных заболеваний, таких как рак. В данном случае соединение, соответствующее данному изобретению, можно сочетать с известными цитотоксическими агентами, ингибиторами сигнальной трансдукции или с другими противораковыми агентами, а также с их смесями и комбинациями. В одном варианте осуществления соединения, соответствующие настоящему изобретению, могут быть скомбинированы с цитотоксическими противораковыми агентами. Примеры данных агентов можно найти в 11-ом издании Merck Index (Каталога Merck) (1996). Данные агенты включают, но без ограничения перечисленным, аспарагиназу, блеомицин, карбоплатин, кармустин, хлорамбуцил, цисплатин, коласпазу, циклофосфамид, цитарабин, дакарбазин, дактиномицин, даунорубицин, доксорубицин (адриамицин), эпирубицин, этопозид, 5-фторурацил, гексаметилмеламин, гидроксимочевину, ифосфамид, иринотекан, лейковорин, ломустин, мехлорэтамин, 6-меркаптопурин, месну, метотрексат, митомицин С, митоксантрон, преднизолон, преднизон, прокарбазин, ралоксифен, стрептозоцин, тамоксифен, тиогуанин,топотекан, винбластин, винкристин и виндезин. Другие цитотоксические лекарственные препараты, пригодные для применения с соединениями,- 21010485 соответствующими изобретению, включают, но без ограничения перечисленным, те соединения, которые признаны как применяемые при лечении заболеваний, связанных с новообразованиями, в справочникеGoodman и Gilman The Pharmacological Basis of Therapeutics (Фармакологическая основа для терапевтических препаратов) (9 изд., 1996, McGraw-Hill). Данные агенты включают, но без ограничения перечисленным, аминоглутетимид, L-аспарагиназу, азатиоприн, 5-азацитидин, кладрибин, бисульфан, диэтистилбестрол, 2',2'-дифтордезоксицитидин, доцетаксел, эритрогидроксинониладенин, этинилэстрадиол, 5 фтордезоксиуридин, 5-фтордезоксиуридин монофосфат, флударабинфосфат, флуоксиместрон, флутамид,гидроксипрогестеронкапроат, идарубицин, интерферон, медроксипогестеронацетат, мегестролацетат,мелфалан, митотан, паклитаксел, пентостатин, N-фосфоноацетил-L-аспартат (PALA), пликамицин, семустин, тенипозид, тестостеронпропионат, тиотепу, триметилмеламин, уридин и винорелбин. Другие цитотоксические противораковые агенты, пригодные для применения в комбинации с соединениями, соответствующими изобретению, включают недавно полученные цитотоксические препараты, такие как оксалиплатин, гемцитабин, капецитабин, эпотилон и их природные или синтетические производные, темозоломид (см. статью Quinn et al., J. Clin. Oncology 2003, 21 (4), 646-651), тоситумомаба(Bexxar), трабедектин (см. статью Vidal et al., Proceedings of the American Society for Clinical Oncology 2004, 23, тезисы 3181) и ингибиторы белка веретена кинезина Eg5 (см. статью Wood et al., Curr. Opin.Pharmacol. 2001, 1, 370-377). В другом варианте осуществления соединения, соответствующие настоящему изобретению, можно комбинировать с другими ингибиторами сигнальной трансдукции. Особенный интерес представляют ингибиторы сигнальной трансдукции, которые направлены на семейство EGFR, например EGFR, HER-2 и HER-4 (см. статьи Raymond et al., Drugs 2000, 60 (Suppl. 1), 15-23; Harari et al., Oncogene 2000, 19 (53),6102-6114), и их соответствующие лиганды. Примеры данных агентов включают, но без ограничения перечисленным, терапевтические препараты на основе антител, такие как герцептин (трастузумаб), эрбитукс (цетуксимаб) и пертузумаб. Примеры данных терапевтических препаратов включают также, но без ограничения перечисленным, ингибиторы киназы в форме маленьких молекул, такие как ZD-1839/IressaGreenberger et al., 11th NCI-EORTC-AACR Symposium on New Drugs in Cancer Therapy, Amsterdam,November 7-10, 2000, тезисы 388). В другом варианте осуществления соединения, соответствующие настоящему изобретению, можно комбинировать с другими ингибиторами сигнальной трансдукции, направленными на рецепторные киназы семейств домен-расщепляющих киназ (VEGFR, FGFR, PDGFR, flt-3, c-kit, c-fins и т.п.) и их соответствующих лигандов. Данные агенты включают, но без ограничения перечисленным, антитела, такие как авастин (бевацизумаб). Данные агенты включают также, но без ограничения перечисленным, маленькие молекулы-ингибиторы, такие как STI-571/Gleevec (см. статью Zvelebil, Curr. Opin. Oncol., Endocr. Metab. Invest. Drugs 2000,2 (1), 74-82), PTK-787 (см. статью Wood et al., Cancer Res. 2000, 60 (8), 2178-2189), SU-11248 (см. статью(см. Hennequin et al., Proceedings of the American Association of Cancer Research 2004, 45, тезисы 4539). В другом варианте осуществления соединения, соответствующие настоящему изобретению, можно комбинировать с ингибиторами пути трансдукции Raf/MEK/ERK (см. статью Avruch et al., Recent Prog.Horm. Res. 2001, 56, 127-155) или пути PKB (akt) (см. статью Lawlor et al., J. Cell Sci. 2001, 114, 2903-2910). Они включают, но без ограничения перечисленным, PD-325901 (см. Sebolt-Leopold et al., Proceedings ofthe American Association of Cancer Research 2004, 45, тезисы 4003), и ARRY-142886 (см. Wallace et al.,Proceedings of the American Association of Cancer Research 2004, 45, тезисы 3891). В другом варианте осуществления соединения, соответствующие настоящему изобретению, можно комбинировать с ингибиторами гистон деацетилазы. Примеры данных агентов включают, но без ограничения перечисленным, субероиланилид гидроксамовой кислоты (SAHA), LAQ-824 (см. Ottmann et al.,Proceedings of the American Society for Clinical Oncology 2004, 23, тезисы 3024), LBH-589 (см. Beck et al.,Proceedings of the American Society for Clinical Oncology 2004, 23, тезисы 3025), MS-275 (см. Ryan et al.,Proceedings of the American Association of Cancer Research 2004, 45, тезисы 2452) и FR-901228 (см. Piekarzet al., Proceedings of the American Society for Clinical Oncology 2004, 23, тезисы 3028). В другом варианте осуществления соединения, соответствующие настоящему изобретению, можно- 22010485 комбинировать с другими противораковыми агентами, такими как ингибиторы протеасом и ингибиторыm-TOR. Они включают, но без ограничения перечисленным, бортезомиб (см. Mackay et al., Proceedings ofthe American Association of Cancer Research 2004, 45, тезисы 3849). Как правило, использование цитотоксического и/или цитостатического противоракового агента в комбинации с соединением или композицией, соответствующей настоящему изобретению, для лечения рака будет служить для того, чтобы:(1) получить повышенную эффективность в плане снижения роста опухоли или даже устранения опухоли по сравнению с введением любого из агентов в виде монотерапии,(2) предусмотреть введение уменьшенных количеств вводимых химиотерапевтических агентов,(3) предусмотреть химиотерапевтическое лечение, которое хорошо переносится пациентом при меньших вредных фармакологических осложнениях, чем наблюдают при химиотерапии одним агентом и ряде других комбинированных способов терапии,(4) предусмотреть лечение более широкого спектра различных типов рака у млекопитающих, в особенности человека,(5) предусмотреть более высокий уровень ответа у пациентов, проходящих лечение,(6) предусмотреть более длительный период выживания у пациентов по сравнению со стандартными способами химиотерапии,(7) предусмотреть более длительный период развития опухоли и/или(8) получить результаты по эффективности и переносимости, по меньшей мере, такие же высокие,как полученные для агентов, используемых в виде монотерапии, по сравнению с известными случаями,когда другие комбинации противораковых агентов дают антагонистические эффекты. Примеры В данном описании используют следующие сокращения: ЖХВД - жидкостная хроматография высокого давления; МС - масс-спектрометрия; ЭС - электроспрей; ДМСО - диметилсульфоксид; ТП - температура плавления; ЯМР - спектроскопия ядерного резонанса; ТСХ - тонкослойная хроматография; КТ - комнатная температура. Пример 1. Получение метиламида 44-[3-(4-хлор-3-трифторметилфенил)уреидо]-3-фторфенокси пиридин-2-карбоновой кислоты. А. Получение 4-амино-3-фторфенола. В сухую колбу после продувания аргоном добавляют 10% Pd/C (80 мг), а затем 3-фтор-4-нитрофенол(1,2 г, 7,64 ммоль) в виде раствора в этилацетате (40 мл). Смесь перемешивают в атмосфере Н 2 в течение 4 ч. Смесь фильтруют через слой целита и выпаривают растворитель при пониженном давлении для получения целевого продукта в виде твердого вещества желто-коричневого цвета (940 мг, 7,39 ммоль; выход 97%); Данные 1 Н-ЯМР-спектроскопии (ДМСО-d6) 4,38 (s, 2H), 6,29-6,35 (m, 1 Н), 6,41 (dd, J=2,5, 12,7,1 Н), 6,52-6,62 (m, 1H), 8,76 (s, 1H). В. Получение метиламида 4-(4-амино-3-фторфенокси)пиридин-2-карбоновой кислоты. Раствор 4-амино-3-фторфенола (500 мг, 3,9 ммоль) в N,N-диметилацетамиде (6 мл) охлаждают до 0 С трет-бутоксидом калия (441 мг, 3,9 ммоль) и дают коричневому раствору перемешиваться при 0 С в течение 25 мин. К смеси добавляют 4-хлор-N-метил-2-пиридинкарбоксамид (516 мг, 3,0 ммоль) в виде раствора в диметилацетамиде (4 мл). Реакцию проводят при нагревании при 100 С в течение 16 ч. Смесь охлаждают до комнатной температуры, быстро охлаждают H2O (20 мл) и экстрагируют этилацетатом(440 мл). Объединенные органические фракции промывают H2O (230 мл), сушат (MgSO4) и выпаривают с получением красно-коричневого масла. Данные 1 Н-ЯМР-спектроскопии указывают на присутствие остатка диметилацетамида, поэтому масло обрабатывают диэтиловым эфиром (50 мл) и далее промыва- 23010485 ют солевым раствором (530 мл). Органический слой сушат (MgSO4) и концентрируют, получая 950 мг целевого продукта в виде твердого вещества красно-коричневого цвета, которое используют на следующей стадии без очистки. Способ получения 4-хлор-N-метил-2-пиридинкарбоксамида описан в статье Bankston et al., Org. К раствору метиламида 4-(4-амино-3-фторфенокси)пиридин-2-карбоновой кислоты (177 мг, 0,68 ммоль) в толуоле (3 мл) добавляют 4-хлор-3-(трифторметил)фенилизоцианат (150 мг, 0,68 ммоль). Смесь перемешивают при КТ в течение 72 ч. Продукты реакции концентрируют при пониженном давлении и остаток растирают с диэтиловым эфиром. Осадок фильтруют и сушат под вакуумом в течение 4 ч, получая целевое соединение (155 мг, 0,32 ммоль; выход 47%) Данные 1 Н-ЯМР-спектроскопии (ДМСО-d6) 2,78 (d,J=4,9, 3 Н), 7,03-7,08 (m, 1 Н), 7,16 (dd, J=2,6, 5,6, 1 Н), 7,32 (dd, J=2,7, 11,6, 1H), 7,39 (d, J=2,5, 1H), 7,60 (s,2H), 8,07-8,18 (m, 2H), 8,50 (d, J=5,7, 1H), 8,72 (s, 1H), 8,74-8,80 (m, 1H), 9,50 (s, 1H); MC (ЖХВД/ES) 483,06 m/z=(M+1). Пример 2. Получение гидрохлорида метиламида 44-[3-(4-хлор-3-трифторметилфенил)уреидо]-3 фторфеноксипиридин-2-карбоновой кислоты. Соединение, соответствующее примеру 1, в виде свободного основания (2,0 г) растворяют в безводном тетрагидрофуране (15 мл) и добавляют 4 М HCl/диоксан (в избытке). Затем раствор концентрируют в вакууме, получая 2,32 г вещества грязно-белого цвета. Неочищенную соль растворяют в горячем этаноле (125 мл), добавляют активированный уголь и нагревают смесь с обратным холодильником в течение 15 мин. Горячую суспензию фильтруют через слой целита и дают охладиться до комнатной температуры. Колбу помещают в морозильную камеру на ночь. Кристаллические вещества отделяют всасывающей фильтрацией, промывают этанолом, затем гексаном и сушат на воздухе. Маточные растворы концентрируют и дают им кристаллизоваться (в морозильной камере) в течение ночи. Собирают вторую порцию твердых веществ и смешивают с первой порцией. Бесцветную соль сушат в вакуум-сушильном шкафу при 60 С в течение 2 дней. Выход полученной хлористоводородной соли составляет 1,72 г (79%). Температура плавления: 215 С. Данные элементного анализа: Пример 3. Получение мезилата метиламида 44-[3-(4-хлор-3-трифторметилфенил)уреидо]-3-фторфеноксипиридин-2-карбоновой кислоты. Соединение, соответствующее примеру 1, в виде свободного основания (2,25 г) растворяют в этаноле (100 мл) и добавляют маточный раствор метансульфоновой кислоты (избыток). Затем раствор концентрируют в вакууме для получения масла желтого цвета. Добавляют этанол и повторяют концентрирование, получая 2,41 г твердых веществ грязно-белого цвета. Затем неочищенную соль растворяют в горячем этаноле (125 мл), медленно охлаждают для кристаллизации. После достижения комнатной температуры колбу помещают в морозильную камеру в течение ночи. Бесцветный кристаллический материал отделяют всасывающей фильтрацией; осадок на фильтре промывают этанолом, затем гексаном и сушат на воздухе, получая 2,05 г продукта, который сушат в вакуум-сушильном шкафу при 60 С в течение ночи. Температура плавления: 231 С. Данные элементного анализа: Пример 4. Получение фенилсульфоната метиламида 44-[3-(4-хлор-3-трифторметилфенил)уреидо]3-фторфеноксипиридин-2-карбоновой кислоты. Соединение, соответствующее примеру 1, в виде свободного основания (2,25 г) суспендируют в этаноле (50 мл) и после чего добавляют бензолсулфоновую кислоту (0,737 г) в этаноле (50 мл). Смесь нагревают при сильном перемешивании. Весь твердый продукт растворяется с образованием раствора красноватого цвета. Раствору дают охладиться до комнатной температуры и царапают колбу для инициации кристаллообразования. Несколько затравочных кристаллов добавляют в раствор и помещают колбу с раствором в морозильную камеру на ночь. В колбе образуются серовато-коричневатые твердые вещества; материал размельчают и собирают всасывающей фильтрацией. Твердые вещества промывают этанолом, затем гексаном и сушат на воздухе. Получают целевой продукт: 2,05 г, выход 69%. Температура плавления: 213 С. Данные элементного анализа: Пример 5. Биохимический анализ c-raf (raf-1). Биохимический анализ c-raf проводят с использованием фермента c-raf, который активируют (фосфорилируют) киназой Lck. Lck-активированную c-raf (Lck/c-raf) получают в клетках насекомых Sf9 путем коинфекции клеток бакуловирусами, экспрессирующимися под контролем полиэдринового промотора GST-c-raf (от аминокислоты 302 до аминокислоты 648) и Lck (полной длины). Оба бакуловируса используют при размножении инфекции 2,5 и клетки собирают через 48 ч после инфекции. Белок MEK-1 получают в клетках насекомых Sf9 путем инфекции клеток бакуловирусом, экспрессирующим слитый белок GST-MEK-1 (полной длины), при размножении инфекции 5 и собирают клетки через 48 ч после инфекции. Аналогичный способ очистки используют для GST-c-raf 302-648 и GST-MEK-1. Трансфицированные клетки суспендируют в концентрации 100 мг сырой биомассы клеток/мл в буфере, содержащем 10 мМ фосфат натрия, 140 мМ хлорид натрия, рН 7,3, 0,5% Тритон Х-100 и смесь ингибиторов протеазы. Клетки разрушают с использованием гомогенизатора Polytron и центрифугируют при 30000 g в течение 30 мин. Супернатант, полученный при 30000 g, наносят на GSH-Сефарозу. Смолу промывают буфером, содержащим 50 мМ Трис, рН 8,0, 150 мМ NaCl и 0,01% Тритон Х-100. Белки, слитые с GST, элюируют раствором, содержащим 100 мМ глутатион, 50 мМ Трис, рН 8,0, 150 мМ NaCl и 0,01% Тритон Х-100. Очищенные белки диализуют в буфер, содержащий 20 мМ Tris, рН 7,5, 150 мМNaCl и 20% глицерин. Тест-соединения серийно разводят в ДМСО, используя трехкратные разведения исходных концентраций, лежащие в интервале, как правило, от 50 мкМ до 20 нМ (конечные концентрации в анализируемом интервале составляют от 1 мкМ до 0,4 нМ). Биохимический анализ c-Raf проводят как радиоактивный анализ на плоском фильтре в 96-луночных пролипропиленовых планшетах Costar (Costar 3365). Планшеты нагружают 75 мкл раствора, содержащего 50 мМ HEPES рН 7,5, 70 мМ NaCl, 80 нг Lck/c-raf и- 25010485 1 мкг MEK-1. Затем в реакцию добавляют 2 мкл серийно разведенных отдельных соединений перед добавлением АТФ. Реакцию инициируют 25 мкл раствора АТФ, содержащего 5 мкМ АТФ 0,3 мкКи [33 Р]АТФ. Планшеты запечатывают и инкубируют при 32 С в течение 1 ч. Реакцию останавливают добавлением 50 мкл 4% фосфорной кислоты и собирают на плоские фильтры Р 30 (PerkinElmer), используя устройство для сбора Wallac Tomtec Harvester. Плоские фильтры промывают 1% фосфорной кислотой и затем деионизированной Н 2 О. Фильтры сушат в микроволновой печи, пропитывают сцинтилляционной жидкостью и считают с помощью счетчика Wallac 1205 Betaplate Counter (Wallac Inc., Atlanta, GA,U.S.A.). Результаты выражают как процент ингибирования.Ti=(число импульсов/минуту без добавления ингибитора)-(фоновое значение). Соединение, соответствующее настоящему изобретению, проявляет сильное ингибирование киназыMMK-6 для получения высокой специфической активности. Используя формат микротитрования, все реакции проводят в объемах 100 мкл с реагентами, разведенными до получения количества 0,05 мкг/лунку активированной р 38 2 и 10 нг/лунку основного белка миелина в буфере для анализа (25 мМ HEPES 7,4, 20 мМ MgCl2, 150 мМ NaCl). Готовят тест-соединения (5 мкл 10% раствора ДМСО в воде) и разводят, чтобы анализ покрывал интервал конечных концентраций от 5 нМ до 2,5 мкМ. Анализ киназы инициируют добавлением 25 мкл коктейля АТФ, что дает конечную концентрацию 10 мкМ нерадиоактивной АТФ и 0,2 мкКи [-33 Р] АТФ/лунку (200-400 распадов в мин/пмоль АТФ). Планшет инкубируют при 32 С в течение 35 мин и реакцию останавливают 7 мкл 1 Н водным раствора HCl. Образцы собирают на плоский фильтр Р 30 Filtermat (Wallac, Inc.), используя устройство для сбора TomTec 1295 Harvester (Wallac,Inc.), и подсчитывают с помощью сцинтилляционного счетчика LKB 1205 Betaplate Liquid ScintillationCounter (Wallac, Inc.). Отрицательные контроли включают только субстрат и АТФ. Анализ на клетках(сыворотка телячьих эмбрионов)/лунку) в 96-луночные планшеты и инкубируют в течение ночи. После замены среды клетки обрабатывают тест-соединениями в течение 1 ч при 37 С, в течение данного периода времени добавляют человеческий ИЛ-1 (интерлейкин-1) (1 нг/мл, Endogen, Woburn, WA) и рекомбинантный человеческий ФНО (10 нг/мл). Культуры инкубируют в течение 48 ч при 37 С, затем количества ИЛ-6 определяют с помощью ELISA (твердофазного иммуноферментного анализа). Соединение,соответствующее данному изобретению, демонстрирует существенное ингибирование киназы р 38. Пример 7. Иммуноанализ Bio-Plex фосфо-ERK 1/2. Иммуноанализ pERK в 96-луночных планшетах при использовании платформы для лазерной проточной цитометрии (Bio-Rad) осуществляют для измерения ингибирования базового pERK в клеточной линии рака молочной железы. Клетки MDA-MB-231 помещают в количестве 50000 клеток/лунку в 96-луночные планшеты для микротитрования в полной среде для роста. Для изучения эффектов тестсоединений на ингибирование базового pERK1/2 на следующий день после помещения клетки MDAMB-231 переносят в DMEM с добавлением 0,1% BSA (бычьего сывороточного альбумина) и инкубируют с тест-соединениями, разведенными 1:3 до конечной концентрации 3 мкМ-12 нМ в 0,1% ДМСО. Клетки инкубируют с тест-соединениями в течение 2 ч, промывают и лизируют в буфере А для лизиса целых клеток Bio-Plex. Образцы разводят в буфере В 1:1 (об./об.) и непосредственно переносят в планшет для анализов или замораживают при -80 С до обработки. 50 мкл разбавленных лизатов клеток MDA-MB-231 инкубируют с приблизительно 2000 бусин размером 5 мкм Bio-Plex, конъюгированных с антителом против ERK1/2, в течение ночи на качалке при комнатной температуре. На следующий день проводят сэндвичевый иммуноанализ биотинилированного фосфо-EPK1/2, бусы трижды промывают во время каждого инкубирования, а затем используют 50 мкл РЕ-стрептавидина в качестве проявляющего реагента. Единицы относительной флуоресценции pERK1/2 определяют подсчетом 25 бусин с помощью зонда для потока клеток Bio-Plex в режиме высокой чувствительности. IC50 (50% ингибирующую концентрацию) рассчитывают, принимая необработанные клетки за максимум и отсутствие клеток (только бусы) за фоновое значение при использовании программы на основе крупноформатной таблицы в Excel. Соединение, соответствующее данному изобретению, демонстрирует существенное ингибирование в данном анализе. Пример 8. Биохимический анализ Flk-1 (мышиная VEGFR-2). Данный анализ проводят в 96-луночных непрозрачных планшетах (Costar 3915) в формате TRFRET. Используют следующие условия реакции: 10 мкМ АТФ, 25 нМ полиГТ-биотин, 2 нМ меченное Eu фосфо-Tyr Ab (антитело), 10 нМ АРС, 7 нМ Flk-1 (домен киназы), 1% ДМСО, 50 мМ HEPES рН 7,5, 10 мМMgCl2, 0,1 мМ ЭДТА (этилендиаминтетрауксусная кислота), 0,015% BRIJ, 0,1 мг/мл BSA, 0,1% меркаптоэтанол). Реакцию инициируют добавлением фермента. Конечный объем реакции в каждой лунке составляет 100 мкл. Планшеты читают при длине волны как 615, так и 665 нМ с использованием счетчика- 26010485 для множества меток Perkin Elmer Victor V Multilabel counter через приблизительно 1,5-2,0 ч после инициации реакции. Сигнал вычисляют как соотношение (665 нм/615 нм)10000 для каждой лунки. Соединение, соответствующее данному изобретению, демонстрирует существенное ингибирование киназы VEGFR2. Пример 9. Биохимический анализ FRET мышиного PDGFR. Данный анализ проводят в формате 96-луночного черного планшета (Costar 3915). Используют следующие реагенты: меченное европием антифосфотирозиновое антитело pY20 (Perand), стрептавидинАРС; полиГТ-биотин и мышиный PDGFR. Используют следующие условия реакции: 1 нМ мышиногоPDGFR смешивают с 20 мкМ АТФ, 7 нМ полиГТ-биотином, 1 нМ антителом pY20, 5 нМ стрептавидинАРС и 1% ДМСО в буфере для анализов (50 мМ HEPES рН 7,5, 10 мМ MgCl2, 0,1 мМ ЭДТА, 0,015%BRIJ 35, 0,1 мг/мл BSA, 0,1% меркаптоэтанола). Реакцию инициируют добавлением фермента. Конечный объем реакции в каждой лунке составляет 100 мкл. Через 90 мин реакцию останавливают добавлением 10 мкл/лунку 5 мкМ стауроспорина. Планшеты читают при длине волны как 615, так и 665 нМ с использованием счетчика для множества меток Perkin Elmer Victor V Multilabel counter через приблизительно 1 ч после остановки реакции. Сигнал вычисляют как соотношение (665 нм/615 нм)10000 для каждой лунки. Соединение, соответствующее данному изобретению, демонстрирует существенное ингибирование киназы PDGFR. Для измерения IC50 как для PDGFR, так и для Flk-1 соединения добавляют перед инициацией фермента. Делают 50-кратный маточный планшет с соединениями, серийно разведенными 1:3 в растворе 50% ДМСО/50% дист. H2O. Добавление 2 мкл маточного раствора в анализ дает конечные концентрации соединения, лежащие в интервале 10 мкМ-4,56 нМ в 1% ДМСО. Данные выражают как процент ингибирования: % ингибирования=100-сигнал с добавлением ингибитора-фоновое значение)/(сигнал без добавления ингибитора-фоновое значение 100. Пример 10. Анализ пролиферации MDA-MB231. Человеческие клетки карциномы молочной железы (MDA MB-231, NCl) культивируют в стандартной среде для роста (DMEM) с добавлением 10% инактивированной нагреванием FBS при 37 С в 5% СО 2 (об./об.) в термостате с увлажнением. Клетки помещают при густоте 3000 клеток/лунку в 90 мкл среды для роста в 96-луночную чашку для культивирования. Для определения значения T0h CTG через 24 ч после помещения 100 мкл люминесцентного реагента CellTiter-Glo Luminescent Reagent (Promega) добавляют в каждую лунку при комнатной температуре на 30 мин. Люминесценцию регистрируют с помощью прибора Wallac Victor II. Реагент CellTiter-Glo дает в результате лизис клеток и генерацию люминесцентного сигнала, пропорционального количеству присутствующей АТФ, которое, в свою очередь, прямо пропорционально числу имеющихся клеток. Тест-соединения растворяют в 100% ДМСО для получения 10 мМ маточных растворов. Маточные растворы далее разводят 1:400 в среде для роста, чтобы получить рабочие маточные растворы с концентрацией 25 мкМ тест-соединения в 0,25% ДМСО. Тест-соединения серийно разводят в среде для роста,содержащей 0,25% ДМСО для поддержания постоянных концентраций ДМСО во всех лунках. 60 мкл разведенного тест-соединения добавляют в каждую лунку с культурой, чтобы получить конечный объем 180 мкл. Клетки с добавлением или без добавления отдельных тест-соединений инкубируют в течение 72 ч,в течение данного периода измеряют АТФ-зависимую люминесценцию, как описано выше, получая значения T72h. Необязательно могут быть определены значения IC50 с помощью программы анализа наименьших квадратов при использовании концентрации соединения относительно процента ингибирования.T0h=АТФ-зависимая люминесценция во время 0. Соединение, соответствующее данному изобретению, демонстрирует существенное ингибирование пролиферации при использовании данного анализа. Пример 11. Сэндвичевый ELISA pPDGFR- в клетках AoSMC.SMC (клетки гладкой мускулатуры) аорты 100K Р 3-Р 6 помещают в каждую лунку 12-луночной платы в 1000 мкл объема/лунку SGM-2 при использовании стандартных методик культивирования клеток. На следующий день клетки однократно промывают 1000 мкл D-PBS, затем помещают в условия сывороточного голодания в 500 мкл SBM (основной среды для клеток гладкой мускулатуры) с добавлением 0,1% BSA на сутки. Соединения разбавляют в интервале доз от 10 мкМ до 1 нМ в серии 10-кратных разведений в ДМСО. Конечная концентрация ДМСО составляет 0,1%. Старую среду удаляют быстрым переворачиванием над сливом, затем добавляют 100 мкл каждого разведения в соответствующую лунку с клетками на 1 ч при 37 С. Затем клетки стимулируют 10 нг/мл лиганда PDGF-BB в течение 7 мин при 37 С. Среду декантируют и добавляют 150 мкл изотонического лизирующего буфера с таблеткой ингибитора протеазы (полный, не содержащий ЭДТА) и 0,2 мМ ванадата Na. Клетки лизируют в течение 15 мин при 4 С на качалке в холодном помещении. Лизаты помещают в пробирки Эппендорфа, в которые добавлено 15 мкл конъюгированного с агарозой антитела против PDGFR-, и инкубируют при 4 С в тече- 27010485 ние суток. На следующий день бусы трижды промывают 50 объемами PBS и кипятят в буфере для 1 образцов LDS в течение 5 мин. Образцы проводят через 3-8% градиентные Трис-ацетатные гели и переносят на нитроцеллюлозу. Мембраны блокируют в 1% BSA/TBS-Т в течение 1 ч перед инкубированием с антителом против фосфо-PDGFR- (Tyr-857) в блокирующем буфере (разведение 1:1000) в течение 1 ч. После трех промываний в TBS-T мембраны инкубируют в козьем IgG HRP против кролика (разведение 1:25000) в течение 1 ч. Перед добавлением субстрата ECL проводят еще три промывания. Мембраны подвергают воздействию Hyperfilm-ECL. Затем мембраны разрезают на полоски и повторно анализируют с антителом против PDGFR- для определения общего PDGFR-. Табл. 1 иллюстрирует результаты биохимических анализов киназы in vitro для киназы р 38, киназыPDGFR и киназы VEGFR2. Все данные три киназы-мишени участвуют в активации стромы и пролиферации эндотелиальных клеток, ведущих к ангиогенезу и обеспечивающих кровоснабжение опухолевой ткани. Таблица 1 Табл. 2 иллюстрирует результаты двух клеточных анализов активности киназы raf, которые представляют собой (i) ингибирование pERK в клетках MDA-MB231, приборные показания активности киназы raf и (ii) анализ пролиферации клеток MDA-MB231, функциональный анализ активности киназы raf. Кроме того, табл. 2 иллюстрирует результаты направляемого PDGFR фосфорилирования PDGFR- в клетках гладкой мускулатуры аорты, которые представляют собой приборные показания ингибирования киназы PDGFR. Таблица 2 В целом, соединения, соответствующие настоящему изобретению, обеспечивают уникальную комбинацию ингибирования ангиогенеза и пролиферации опухолевых клеток. Они также обладают улучшенным профилем ингибирования в отношении ряда ключевых киназных мишеней, таких как raf, p38,PDGFR и VEGFR-2, все из которых являются молекулярными мишенями, представляющими интерес в плане лечения остеопороза, воспалительных заболеваний и гиперпролиферативных заболеваний, включая рак. Считают, что компетентный специалист в области техники, используя вышеприведенную информацию и информацию, имеющуюся в области техники, может использовать настоящее изобретение в самой полной мере. Обычному специалисту в области техники было бы очевидно, что в данном изобретении могут быть сделаны изменения и модификации, не выходящие из сущности или объема изобретения, в том виде, как оно представлено в данном контексте. Все выше- и нижеприведенные публикации,заявки и патенты включены в данном контексте в виде ссылки. Вышеприведенные ссылки означают указание, где можно найти определенную информацию, но не рассматриваются как единственный источник, где может быть найдена информация по данной теме. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное N,N'-дифенилмочевины формулы (I)- 28010485 2. Производное по п.1, отличающееся тем, что его соль представляет собой основную соль органической или неорганической кислоты, выбранной из группы: хлористо-водородная, бромисто-водородная,серная, фосфорная, метансульфоновая, трифторметансульфоновая, бензолсульфоновая, п-толуолсульфоновая, 1-нафталинсульфоновая, 2-нафталинсульфоновая, уксусная, трифторуксусная, яблочная, винная,лимонная, молочная, щавелевая, янтарная, фумаровая, малеиновая, бензойная, салициловая, фенилуксусная или миндальная кислота, или кислотную соль органического или неорганического основания, содержащую катион, выбранный из группы: катион щелочного или щелочно-земельного металла, аммония,алифатически или ароматически замещенного аммония. 3. Производное N,N'-дифенилмочевины, представляющее собой гидрохлорид, бензолсульфонат или метансульфонат N-(4-хлор-3-(трифторметил)фенил)-N'-2-фтор-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевины. 4. Фармацевтическая композиция, отличающаяся тем, что она содержит производное по п.1 и физиологически приемлемый носитель. 5. Фармацевтическая композиция для лечения у человека или другого млекопитающего регулируемого протеинкиназой заболевания, ассоциированного с аберрацией пути сигнальной трансдукции протеинкиназы, отличающаяся тем, что она содержит производное по п.1 и физиологически приемлемый носитель. 6. Фармацевтическая композиция для лечения гиперпролиферативного нарушения, отличающаяся тем, что она содержит производное по п.1 и физиологически приемлемый носитель. 7. Фармацевтическая композиция для подавления роста раковых клеток, отличающаяся тем, что она содержит производное по п.1 и физиологически приемлемый носитель. 8. Фармацевтическая композиция, отличающаяся тем, что она содержит фармацевтически приемлемую соль N-(4-хлор-3-(трифторметил)фенил)-N'-2-фтор-(4-(2-(N-метилкарбамоил)-4-пиридилокси)фенил)мочевины и физиологически приемлемый носитель. 9. Способ регуляции сигнальной трансдукции тирозинкиназы, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1. 10. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое регулируется тирозинкиназой и ассоциировано с аберрацией пути сигнальной трансдукции тирозинкиназы, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1. 11. Способ лечения или предупреждения у человека и/или другого млекопитающего заболевания,которое представляет собой VEGFR-2-опосредованное нарушение, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1. 12. Способ лечения или предупреждения у человека и/или другого млекопитающего заболевания,которое представляет собой PDGFR-опосредованное нарушение, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1. 13. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое представляет собой raf-опосредованное нарушение, отличающийся тем, что человеку или другому производное по п.1. 14. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое представляет собой р 38-опосредованное нарушение, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1. 15. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое представляет собой VEGF-опосредованное нарушение, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1. 16. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое представляет собой гиперпролиферативное, воспалительное нарушение и/или нарушение ангиогенеза, заключающийся в том, что человеку или другому млекопитающему вводят производное по п.1. 17. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, которое представляет собой гиперпролиферативное нарушение, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1. 18. Способ по п.17, отличающийся тем, что гиперпролиферативное нарушение представляет собой рак. 19. Способ по п.18, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1 в комбинации с одним или несколькими дополнительными противораковыми агентами. 20. Способ лечения или предупреждения у человека или другого млекопитающего заболевания, характеризующегося патологическими процессами ангиогенеза или гиперпроницаемости, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1. 21. Способ по п.20, отличающийся тем, что человеку или другому млекопитающему вводят производное по п.1 одновременно с другим агентом против ангиогенеза в виде одного или раздельных препаратов. 22. Способ лечения или предупреждения у человека и/или других млекопитающих по меньшей мере одного из состояний, выбранных из группы: рост опухоли, ретинопатия, ишемическая закупорка вены сетчатки, ретинопатия преждевременного развития, старческая макулярная дегенерация, ревматоидный артрит, псориаз, буллезное нарушение, ассоциированное с образованием субэпидермальных волдырей,включая буллезный пемфигоид, мультиформная эритема или герпетиформный дерматит, ревматоидный- 29010485 артрит, остеоартрит, септический артрит, метастазы опухоли, заболевание периодонта, изъязвление роговицы, протеинурия и тромбоз коронарных артерий вследствие атеросклеротической бляшки, аневризматическая аорта, контроль рождаемости, дистрофобный буллезный эпидермолиз, дегенеративная потеря хряща после травматического повреждения сустава, остеопороз, опосредованный активностью ММР,заболевание височно-нижнечелюстного сустава или демиелинизирующее заболевание нервной системы,заключающийся в том, что человеку или другому млекопитающему вводят производное по п.1. 23. Способ лечения или предупреждения у человека и/или других млекопитающих по меньшей мере одного из состояний, выбранных из группы: рост опухоли, ретинопатия, ишемическая закупорка вены сетчатки, ретинопатия преждевременного развития, старческая макулярная дегенерация, ревматоидный артрит, псориаз, буллезное нарушение, ассоциированное с образованием субэпидермальных волдырей,включая буллезный пемфигоид, мультиформная эритема или герпетиформный дерматит, в комбинации с другим состоянием, выбранным из группы: ревматическая атака, резорбция костей, постменструальный остеопороз, сепсис, сепсис, вызываемый грамотрицательными микроорганизмами, септический шок,эндотоксический шок, синдром токсического шока, синдром системного воспалительного ответа, воспалительная болезнь кишки (болезнь Крона и язвенный колит), реакция Jarisch-Herxheimer, астма, респираторный дистресс-синдром взрослых, острое легочное фибротическое заболевание, легочный саркоидоз,аллергическое респираторное заболевание, силикоз, пневмокониоз шахтеров, альвеолярное повреждение,печеночная недостаточность, болезнь печени во время острого воспаления, тяжелый алкогольный гепатит, малярия (малярия, вызываемая Plasmodium falciparum, и церебральная малярия), инсулиннезависимый сахарный диабет (NIDDM), застойная сердечная недостаточность, повреждение вследствие сердечного заболевания, атеросклероз, болезнь Альцгеймера, острый энцефалит, повреждение головного мозга,рассеянный склероз (демиелинизация и утрата олигодендроцитов при рассеянном склерозе), запущенный рак, злокачественные заболевания лимфоидной природы, панкреатит, нарушение заживания ран при инфекции, воспалении и раке, миелодиспластические синдромы, системная красная волчанка, билиарный цирроз печени, некроз кишки, повреждение при облучении/токсичности после введения моноклональных антител, реакция хозяина против трансплантата (ишемическое реперфузионное повреждение и отторжение аллотрансплантатов почки, печени, сердца и кожи), отторжение аллотрансплантата легкого (облитерирующий бронхит) или осложнение вследствие общего эндопротезирования тазобедренного сустава,заключающийся в том, что человеку или другому млекопитающему вводят производное по п.1. 24. Способ лечения или предупреждения у человека и/или других млекопитающих по меньшей мере одного из состояний, выбранных из группы: рост опухоли, ретинопатия, диабетическая ретинопатия,ишемическая закупорка вены сетчатки, ретинопатия преждевременного развития, старческая макулярная дегенерация, ревматоидный артрит, псориаз, буллезное нарушение, ассоциированное с образованием субэпидермальных волдырей, включая буллезный пемфигоид, мультиформная эритема или герпетиформный дерматит, в комбинации с инфекционным заболеванием, выбранным из группы: туберкулез,инфекция Helicobacter pylori при заболевании пептической язвой, болезнь Шага, возникающая в результате инфекции Trypanosomacruzi, эффекты шига-подобного токсина, возникающие в результате инфекции Е. coli, эффекты энтеротоксина А, возникающие в результате инфекции Staphylococcus, менингококковая инфекция и инфекция Borrelia burgdorferi, Treponema pallidum, цитомегаловируса, вируса гриппа,вируса энцефаломиелита и вируса иммунодефицита человека (ВИЧ), заключающийся в том, что человеку или другому млекопитающему вводят производное по п.1. 25. Способ по п.19, отличающийся тем, что дополнительный противораковый агент выбран из группы, включающей аспарагиназу, блеомицин, карбоплатину, кармустин, хлорамбуцил, цисплатину, коласпазу, циклофосфамид, цитарабин, дакарбазин, дактиномицин, даунорубицин, доксорубицин (адриамицин), эпирубицин, этопозид, 5-фторурацил, гексаметилмеламин, гидроксимочевину, ифосфамид, иринотекан, лейковорин, ломустин, мехлорэтамин, 6-меркаптопурин, месну, метотрексат, митомицин С, митоксантрон, преднизолон, преднизон, прокарбазин, ралоксифен, стрептозоцин, тамоксифен, тиогуанин,топотекан, винбластин, винкристин, виндезин, аминоглутетимид, L-аспарагиназу, азатиоприн, 5-азацитидин, кладрибин, бисульфан, диэтилстилбестрол, 2',2'-дифтордезоксицитидин, доцетаксел, эритрогидроксинониладенин, этинилэстрадиол, 5-фтордезоксиуридин, 5-фтордезоксиуридин монофосфат, флударабинфосфат, флуоксиместрон, флутамид, гидроксипрогестеронкапроат, идарубицин, интерферон, медроксипогестеронацетат, мегестролацетат, мелфалан, митотан, паклитаксел, пентостатин, N-фосфоноацетилL-аспартат (PALA), пликамицин, семустин, тенипозид, тестостеронпропионат, тиотепу, триметилмеламин, уридин и винорелбин, оксалиплатину, гемцитабин, капецитабин, эпотилон и их природные или синтетические производные, тоситумомаб, трабедектин и темозоломид, трастуцумаб, цетуксимаб, бевацицумаб, пертуцумаб, ZD-1839 (Iressa), OSI-774 (Tarceva), CI-1033, GW-2016, CP-724, 714, HKI-272, EKB-569,STI-571 (Gleevec), PTK-787, SU-11248, ZD-6474, AG-13736, KRN-951, CP-547, 632, CP-673,451, CHIR258, MLN-518, AZD-2171, PD-325901, ARRY-142886, субероиланилидгидроксамовую кислоту (SAHA),LAQ-824, LBH-589, MS-275, FR-901228, бортецомиб и CCI-779. 26. Способ по п.19, отличающийся тем, что дополнительный противораковый агент представляет собой цитотоксический агент, выбранный из группы, включающей ингибиторы ДНК-топоизомеразы I и
МПК / Метки
МПК: A61K 31/44, C07D 213/81, A61P 35/00
Метки: заболеваний, использованием, лечения, дифенилмочевины, производное, состояний, варианты, способ, предупреждения, фармацевтическая, композиция
Код ссылки
<a href="https://eas.patents.su/30-10485-proizvodnoe-nn-difenilmocheviny-farmacevticheskaya-kompoziciya-varianty-i-sposob-lecheniya-i-preduprezhdeniya-zabolevanijj-i-sostoyanijj-s-ego-ispolzovaniem-varianty.html" rel="bookmark" title="База патентов Евразийского Союза">Производное n,n’ -дифенилмочевины, фармацевтическая композиция (варианты) и способ лечения и предупреждения заболеваний и состояний с его использованием (варианты)</a>
Предыдущий патент: Новые соединения, фармацевтические композиции, содержащие их, и способы их использования
Следующий патент: Замещенные оксиндолсульфонамидные ингибиторы вич-протеазы широкого спектра действия
Случайный патент: Катушка зажигания


































