Связывающиеся с эмиттером пептиды, которые вызывают изменение спектральных характеристик эмиссии эмиттера
Номер патента: 10289
Опубликовано: 29.08.2008
Авторы: Ханель Корнелия, Ширнер Михаэль, Менрад Андреас, Лиха Кай, Брокс Бодо, Урлингер Штефания
Формула / Реферат
1. Связывающееся с эмиттером антитело или фрагмент антитела, отличающиеся тем, что они вызывают изменение спектральных характеристик эмиссии эмиттера при взаимодействии его антигенсвязывающего "кармана" с эмиттером, где эмиттер содержит краситель, который имеет, по меньшей мере, максимум абсорбции и/или максимум флуоресценции в спектральном диапазоне от 700 до 1000 нм, предпочтительно, по меньшей мере, максимум абсорбции и/или максимум флуоресценции в спектральном диапазоне от 750 до 900 нм и где краситель выбран из группы полиметиновых красителей, таких как дикарбоцианин, трикарбоцианин, индотрикарбоцианин, мероцианин, стирил, скварилиум, и оксоноловых красителей, и включают одну из пар доменов VH/VL, входящих в одну из следующих пар последовательностей: SEQ ID NO: 1+2; SEQ ID NO: 5+6; SEQ ID NO: 9+10; SEQ ID NO: 13+14; SEQ ID NO: 5+17; SEQ ID NO: 5+19; SEQ ID NO: 5+37; SEQ ID NO: 9+21; SEQ ID NO: 9+23; SEQ ID NO: 9+25; SEQ ID NO: 9+27; SEQ ID NO: 9+29; SEQ ID NO: 9+31; SEQ ID NO: 9+33; SEQ ID NO: 9+39 и SEQ ID NO: 13+35.
2. Связывающееся с эмиттером антитело или фрагмент антитела по п.1, выбранное из антител или фрагментов антител, таких, например, как Fab-фрагменты, scFv-фрагменты, scTCR-цепи, одноцепочечные антитела и их смеси.
3. Связывающееся с эмиттером антитело или фрагмент антитела по одному из пп.1-2, у которого аффинность связывания с эмиттером составляет менее 50 нм и предпочтительно менее 10 нм.
4. Связывающееся с эмиттером антитело или фрагмент антитела по одному из пп.1-3, где изменение свойств эмиссии эмиттера выбрано из ряда, включающего изменение плоскости поляризации, интенсивности флуоресценции, фосфоресценции, прежде всего, интенсивности фосфоресценции, продолжительности флуоресценции и батохромного сдвига максимума абсорбции и/или максимума флуоресценции.
5. Связывающееся с эмиттером антитело или фрагмент антитела по одному из пп.1-4, где величина сдвига максимума абсорбции и/или максимума флуоресценции в сторону более длинных волн после взаимодействия с агентом, предназначенным для обнаружения эмиттера, составляет более 15 нм, предпочтительно более 25 нм и наиболее предпочтительно составляет примерно 30 нм.
6. Связывающееся с эмиттером антитело или фрагмент антитела по одному из пп.1-5, где краситель представляет собой цианиновый краситель общей формулы (I)
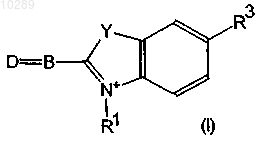
в которой D обозначает радикал (II) или (III)
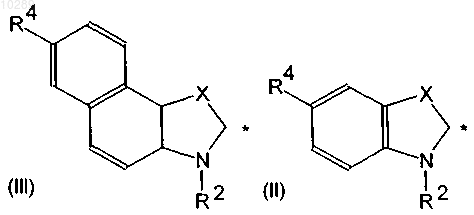
в которых положение, отмеченное звездочкой, обозначает сайт связывания с радикалом В и может обозначать группу (IV), (V), (VI), (VII) или (VIII)
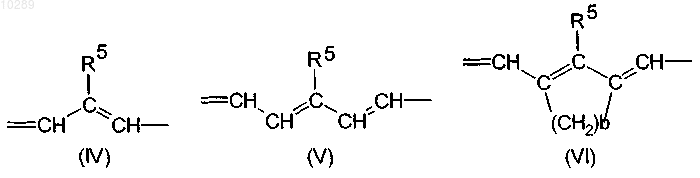
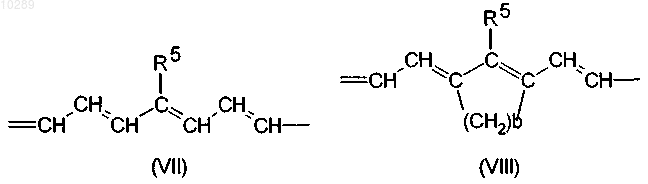
в которых R1 и R2, каждый независимо друг от друга, обозначает С1-С4сульфоалкильную цепь, насыщенную или ненасыщенную разветвленную или прямую С1-С50алкильную цепь, которая необязательно несет 0-15 атомов кислорода и/или 0-3 карбонильные группы и/или может быть замещена 0-5 гидроксигруппами;
R3 и R4, каждый независимо друг от друга, обозначают группу -СООЕ1, -CONE1E2, -NHCOE1,
-NHCONHE1, -NE1E2, -OE1, -OSO3E1, -SO3E1, -SO2NHE1 или -Е1, где Е1 и Е2, каждая независимо друг от друга, обозначают атом водорода, С1-С4сульфоалкильную цепь, насыщенную или ненасыщенную разветвленную или прямую С1-С50алкильную цепь, которая необязательно несет 0-15 атомов кислорода и/или 0-3 карбонильные группы и/или может быть замещена 0-5 гидроксигруппами, R5 обозначает атом водорода или атом фтора, хлора, брома или йода, Me, Et или Prop,
b обозначает число 2 или 3, и
X и Y независимо друг от друга обозначают О, S, =С(СН3)2 или -(СН=СН)-, а также соли и сольваты указанных соединений.
7. Полинуклеотид, прежде всего ДНК, РНК или ПНК, содержащий последовательность, кодирующую связывающееся с эмиттером антитело или фрагмент антитела по одному из пп.1-6, или его функциональные варианты.
8. Векторная молекула ДНК или РНК, которая содержит по меньшей мере один или несколько полинуклеотидов по п.7 и которая может экспрессироваться в клетках.
9. Клетка-хозяин, которая содержит полинуклеотид по п.7 или векторную молекулу по п.8.
10. Антитела, прежде всего поликлональные или моноклональные антитела, человеческие или гуманизированные антитела, синтетические или рекомбинантные антитела, содержащие по меньшей мере один связывающийся с эмиттером пептид по одному из пп.1-6.
11. Способ получения связывающегося с эмиттером антитела или фрагмента антитела по одному из пп.1-6, заключающийся в том, что осуществляют иммунизацию пригодного организма эмиттером, представляющим собой краситель, который выбран из группы, включающей полиметиновые красители, такие как дикарбоцианин, трикарбоцианин, индотрикарбоцианин, мероцианин, стирил, скварилиум и оксоноловые красители.
12. Способ получения связывающегося с эмиттером антитела или фрагмента антитела по одному из пп.1-6, заключающийся в том, что получают рекомбинантным и/или синтетическим путем антитело или фрагмент антитела.
13. Применение связывающегося с эмиттером антитела или фрагмента антитела по одному из пп.1-6, нуклеиновой кислоты по п.7 или 8, клетки-хозяина по п.9 или антитела по п.10 в качестве диагностического агента для диагностики in vitro.
14. Диагностический набор для диагностики in vitro, содержащий по меньшей мере один агент, выбранный из связывающегося с эмиттером антитела или фрагмента антитела по одному из пп.1-6, нуклеиновой кислоты по п.7 или 8, клетки-хозяина по п.9 или антитела по п.10 необязательно в сочетании с другими адъювантами и/или инструкциями, которые находятся в одном или раздельных контейнерах.
15. Способ количественного определения in vitro антигена, содержащегося в образце, заключающийся в том, что осуществляют следующие стадии:
а) приводят в контакт связывающееся с эмиттером антитело или фрагмент антитела по одному из пп.1-6 с эмиттером, где при взаимодействии эмиттера, входящего в состав конъюгата, со связывающимся с эмиттером антителом или фрагментом антитела происходит изменение спектральных характеристик эмиссии эмиттера, и
б) измеряют изменение спектральных характеристик эмиттера.
16. Способ непосредственного определения in vitro антигена, который содержится в образце, или агента для обнаружения антигена, присутствующего в образце, по п.15, кроме того, заключающийся в том, что
г) осуществляют количественную оценку антигена, содержащегося в образце путем измерения изменения характеристик эмиссии эмиттера.
17. Способ по п.15 или 16, в котором изменение спектральных характеристик эмиссии компонента эмиттера выбрано из изменения плоскости поляризации, фосфоресценции, прежде всего интенсивности фосфоресценции, продолжительности флуоресценции и батохромного сдвига максимума абсорбции и/или максимума флуоресценции.
18. Способ по одному из пп.15-17, в котором связывающиеся с эмиттером фрагменты антитела, Fab-фрагменты, scFv-фрагменты, scTCR-цепи, одноцепочечные антитела и их смеси приводят в контакт с образцом.
19. Способ по одному из пп.15-18, в котором связывающееся с эмиттером антитело или фрагмент антитела обладает аффинностью к связыванию с эмиттером, составляющей менее 50 нм и предпочтительно менее 10 нм.
Текст
010289 Настоящее изобретение относится к связывающимся с эмиттером пептидам, которые вызывают изменение спектральных характеристик эмиссии эмиттера при взаимодействии его антигенсвязывающего кармана с эмиттером. Связывающиеся с эмиттером пептиды, предлагаемые в изобретении, представляют собой, в частности, компоненты антител и фрагменты антител. Предпосылки создания изобретения Во многих случаях для диагностического обнаружения субстанций и определения их концентрации в настоящее время используют методы диагностического измерения in vitro, которые основаны на применении биологических молекул, таких, например, как пептиды, белки, антитела или олигонуклеотиды,обладающие высокой аффинностью к подлежащей определению субстанции. Для этой цели предпочтительно применяют белки и пептиды, наиболее предпочтительно используют антитела и фрагменты антител. Некоторые методы диагностики in vitro, такие, например, как электрохемолюминесценция, основаны на применении комбинации различных антител к подлежащей определению субстанции, где одно антитело используют для сепарации подлежащей определению субстанции от исследуемого образца, а другое антитело несет выявляемую диагностическим методом сигнальную молекулу. В случае диагностического метода, основанного на электрохемолюминесценции, меченое антитело обнаруживают оптически [Grayeski M.L., Anal. Chem., 59, 1987, с. 1243]. При определении оптических характеристик в диагностических методах измерения в качестве оптических свойств молекул можно применять помимо электролюминесценции также индуцируемую светом фосфоресценцию и флуоресценцию. Прежде всего, касательно оптических свойств молекул, флуоресценция по сравнению с электролюминесценцией и фосфоресценцией, обладает преимуществом, заключающимся в высокой чувствительности обнаружения и высокой линейности сигнала в широком динамическом диапазоне. Для обнаружения флуоресценции флуорофора разработаны различные методы измерения, которые основаны на различных свойствах процессов флуоресценции. В применяемых методах измерения используется, например, ослабление поляризированного света (флуоресцентная поляризация (ФП, измерение времени жизни фотона (измерение продолжительности флуоресценции ПФ), отбеливающие свойства (восстановление флуоресцентного фотоотбеливания (ВФФ и перенос энергии между различными флуорофорами (флуоресцентный резонансный перенос энергии (ФРПЭ [Williams А.Т. и др., MethodsImmunol. Anal., 1, 1993, с. 466; Youn H. J. и др., Anal. Biochem., 1995, Oswald В. и др., Anal. Biochem., 280,2000, с. 272; Szollosi J. и др., Cytometry, 34, 1998, с. 159]. Другие методы обнаружения основаны на изменении плоскости поляризации или обнаружении фосфоресценции. В вышеуказанных методах применяемые антитела к субстанции служат для различных целей. С одной стороны, их применяют для сепарации подлежащей определению субстанции от образца, но, с другой стороны, они служат также для цели локализации или позиционирования различных источников сигналов, которые применяют на подлежащей изучению субстанции. Для обнаружения, например, антитела в образце применяют в основном оптические и радиоактивные методы, однако, известны также акустические (см., например, Cooper M.А. и др. Direct and Sensitive Detection of a Human Virus by Rupture EventScanning. Nat Biotechnol. 19(9), сентябрь 2001, cc. 833-837) и магнитные методы измерения. Наибольшее распространение получили оптические методы измерения [Immunoassays: Clinical Laboratory TechniquesEssential Data, под ред. Edwards R., изд-во Wiley Europe, 1996]. В большинстве используемых в настоящее время методов антитело к субстанции метят с помощью флуорофора. Такое мечение осуществляют с помощью специфического и неспецифического химического связывания. Меченое антитело добавляют в избыточном количестве к изучаемому образцу. Это необходимо для того, чтобы осуществить связывание со всеми молекулами подлежащей изучению субстанции. Кроме того, этот метод, как правило, применяют в качестве основы метода, в котором используют одно антитело к субстанции, которое применяют для сепарации подлежащей изучению субстанции, и второе антитело к субстанции, меченое с помощью сигнальной молекулы, которое позволяет производить обнаружение изучаемой субстанции путем связывания с другим сайтом. Тем самым можно избегать искажения результатов измерений, обусловленных несвязанным, подающим сигнал антителом. Однако этот метод связан с повышенными методическими и техническими трудностями и более высокими затратами, обусловленными стадией сепарации. При этом наиболее неблагоприятным фактором являются большие технические трудности, препятствующие применению этого процесса для высокоскоростной диагностики. В настоящее время уже известны антитела и пептиды к молекулам с низкой молекулярной массой. К ним относятся также антитела и пептиды к молекулам красителя. У Simeonov А. и др., в Science, 290,2000, сс. 307-313 описаны антитела к стильбенам ("антитела с голубой флуоресценцией"). Такие антитела катализируют специфические фотохимические процессы изомеризации и вызывают сдвиг абсорбции в красную область спектра и характеризуются максимумом флуоресценции в спектральном диапазоне УФВЧС (ультрафиолетовый диапазон - видимая часть спектра (максимум сдвига абсорбции 12 нм, сдвиг-1 010289 флуоресценции 22 нм). Однако у Simeonov А. и др., не приведено никаких данных о том, что сдвиг в красную область спектра в случае цианиновых красителей сохраняет количественный выход флуоресценции в диапазоне длин волн 600-1200 нм. У Watt R.М. и др. (Immunochemistry, 1977, 14, сс. 533-541) описаны спектральные свойства уже известных конструкций антител к флуоресцеину. После связывания с флуоресцеином антитело вызывает сдвиг максимума абсорбции и флуоресценции в видимом диапазоне спектра, но только на 12 или 5 нм. Кроме того, происходит сильное уменьшение количественного выхода флуоресценции (примерно на 90%). У Rozinov М.N. и др. (Chem. Biol. 5, 1998, сс. 713-728) описано выделение из фаговых библиотек 12-мерных пептидов, которые связываются с красителями Texas Red, Rhodamine Red, Oregon Green 514 и флуоресцеином. В случае красителя Texas Red наблюдали сдвиг абсорбции и флуоресценции в красную область спектра, однако, он составлял только 2,8 или 1,4 нм. Кроме того, в продажу уже поступают антитела к различным красителям, например, к флуоресцеину, тетраметилродамину, Texas Red, Alexa fluorine 488, BODIPY FL, Lucifer Yellow и Cascade Blue, Oregon Green (фирма Molecular Probes Company, Inc., США). Однако они представляют собой предназначенные для целей биологического анализа поликлональные антитела в виде IgG, обладающие перекрестной реактивностью, которая является в определенной степени неконтролируемой, и их не производят путем строгой селекции. Таким образом, все еще существует необходимость в обладающих улучшенными свойствами связывающихся с эмиттером пептидах и, прежде всего, специфических антителах, более пригодных для указанных выше методов измерения. С этой точки зрения предпочтительными являются связывающиеся с эмиттером пептиды, которые вызывают сдвиг в красную область спектра и при этом сохраняют количественный выход флуоресценции цианиновых красителей в диапазоне длин волн 600-1200 нм. Эта цель достигается согласно изобретению с помощью связывающегося с эмиттером пептида, который отличается тем, что он вызывает изменение спектральных характеристик эмиттера при взаимодействии его антигенсвязывающего кармана с эмиттером, способа получения связывающегося с эмиттером пептида, предлагаемого в изобретении, который заключается в том, что проводят иммунизацию пригодного организма с помощью эмиттера, содержащего краситель, выбранный из ряда, включающего полиметиновые красители, такие как дикарбоцианин, трикарбоцианин, индотрикарбоцианин, мероцианин,стирил, скварилий и оксонол, и родаминовые красители, феноксазиновые или фенотиазиновые красители, и соответствующего применения связывающегося с эмиттером пептида, нуклеиновой кислоты, клетки-хозяина или антитела или конъюгата, предлагаемых в изобретении в качестве диагностического агента для осуществления диагностики in vitro. Соответствующие варианты осуществления изобретения указаны в прилагаемой формуле изобретения. Таким образом, первым объектом настоящего изобретения является связывающийся с эмиттером пептид, отличающийся тем, что он вызывает изменение спектральных характеристик эмиссии эмиттера при взаимодействии его антигенсвязывающего кармана с эмиттером. Предпочтительным является связывающийся с эмиттером пептид, предлагаемый в изобретении, где эмиттер содержит краситель, обладающий максимумом абсорбции и/или максимумом флуоресценции,по меньшей мере, в спектральном диапазоне от 700 до 1000 нм, предпочтительно максимумом абсорбции и максимумом флуоресценции, по меньшей мере, в спектральном диапазоне от 750 до 900 нм. Другим предпочтительным пептидом является связывающийся с эмиттером пептид, предлагаемый в изобретении, вызывающий изменение характеристик эмиссии части эмиттера, которое выбрано из ряда, включающего изменение плоскости поляризации, интенсивности флуоресценции, интенсивности фосфоресценции, продолжительности флуоресценции и батохромного сдвига максимума абсорбции и/или максимума флуоресценции. Изобретение не ограничено указанными конкретными явлениями, напротив понятие "изменение характеристик эмиссии" в контексте настоящего изобретения включает все физические явления или эффекты, в результате которых изменяются характеристики излучения высокой энергии, и при этом указанное изменение количественно зависит от связывания/не связывания конъюгата субстанция-эмиттер или конъюгата субстанция-агент для обнаружения-эмиттер с его связывающимся с эмиттером компонентом и субстанцией. В одном из вариантов осуществления изобретения субстанция представляет собой, например, пептид, белок, олигонуклеотид и прежде всего антитело или фрагмент антитела. В контексте настоящего изобретения фрагменты антитела представляют собой, по меньшей мере, антигенсвязывающие области, которые содержат "гипервариабельные участки" ("CDR"). В этом случае антигенсвязывающие области наиболее предпочтительно содержат цепи полных вариабельных областей VL и VH. В наиболее предпочтительном варианте осуществления изобретения связывающийся с эмиттером пептид, предлагаемый в изобретении, антитело или фрагмент антитела выбирают из поликлональных или моноклональных антител, гуманизированных антител, Fab-фрагментов, прежде всего мономерныхFab-фрагментов, scFv-фрагментов, синтетических или рекомбинантных антител, scTCR-цепей и их смесей. Среди синтетических и рекомбинантных антител или фрагментов антител наиболее предпочтитель-2 010289 ными являются те, которые получены из библиотеки HuCAL (WO 97/08320; Knappik, J. Mol. Biol. 296,2000, cc. 57-86; Krebs и др. J. Immunol. Methods., 254(1-2), 1 августа 2001, cc. 67-84). Они могут представлять собой либо полные иммуноглобулины или антитела в одном из встречающихся в естественных условиях форматах (IgA, IgD, IgE, IgG, IgM), либо фрагменты антитела, причем фрагменты антитела содержат, по меньшей мере, аминокислоты, находящиеся в положениях от 4 до 103 в VL и от 5 до 109 вVH, предпочтительно аминокислоты, находящиеся в положениях от 3 до 107 в VL и от 4 до 111 в VH, и наиболее предпочтительно полные вариабельные области легкой и тяжелой цепей (VL и VH) (аминокислоты в положениях от 1 до 109 в VL и от 1 до 113 в VH) (нумерация согласно WO 97/08320). В предпочтительном варианте осуществления изобретения антитело или фрагмент антитела содержит в этом случае по меньшей мере один из CDR, имеющих последовательности SEQ-ID NO: 1, 2, 5, 6, 9,10, 13, 14, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37 и 39 (VL: CDR1 положения 24-34, CDR2 положения 5056, CDR3 положения 89-96; VH: CDR1 положения 26-35, CDR2 положения 50-65, CDR3 положения 95102), прежде всего CDR3 VL или CDR3 VH. Наиболее предпочтительным в этом случае является антитело, которое содержит одну из вариабельных областей легкой цепи (VL), которые имеют последовательности SEQ ID NO: 2, 6, 10, 14, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37 и 39 или вариабельной области легкой цепи (VL), которая имеет одну из последовательностей SEQ ID NO: 1, 5, 9 и 13 (или фрагмент такого антитела). Наиболее предпочтительным является антитело, которое содержит пару VH/VL, имеющую следующие пары последовательностей: SEQ ID NO: 1+2; SEQ ID NO: 5+6; SEQ ID NO: 9+10; SEQ ID NO: 13+14; SEQ ID NO: 5+17; SEQ ID NO: 5+19; SEQ ID NO: 5+37; SEQ ID NO: 9+21; SEQ ID NO: 9+23; SEQID NO: 9+25; SEQ ID NO: 9+27; SEQ ID NO: 9+29; SEQ ID NO: 9+31; SEQ ID NO: 9+33; SEQ ID NO: 9+39; SEQ ID NO: 13+35 (или фрагмент такого антитела). Наиболее предпочтительными в этом случае являются Fab-фрагменты MOR02628, MOR02965, MOR02977, MOR02969, MOR03263, MOR03325,MOR03285, MOR03201, MOR03267, MOR03268, MOR03292, MOR03294, MOR03295, MOR03309,MOR03293 и MOR03291. На основе описания указанных антител специалистам в данной области должны быть очевидны различные возможности получения новых модифицированных антител, также обладающих свойствами антител, предлагаемых в изобретении. Специалисту в данной области известно, что прежде всего CDR-участки как тяжелой, так и легкой цепи обусловливают аффинность, а также селективность и специфичность. В этом случае играют роль прежде всего CDR3 VH и CDR3 VL, а также CDR2 VH и CDR1 VL, при этом CDR1 VH и CDR2 VL в большинстве случаев играют второстепенную роль. Таким образом, для оптимизации аффинности, а также селективности и специфичности антител предложено использовать прежде всего CDR (см. также,например, Schier и др., J. Mol. Biol., 263, 1996, с. 551). В этом случае можно, например, целенаправленно заменять один или несколько CDR, например, на CDR других антител, в отношении которых известно,что они уже обладают свойствами, предлагаемыми в изобретении, или на библиотеки соответствующих последовательностей CDR (см. метод оптимизации для этой цели в примере 1), которые или вызывают полностью случайные вариации, либо характеризуются более или менее выраженным предпочтением(тенденцией) в отношении определенных аминокислот или их комбинаций. Кроме того, специалист в данной области способен полностью заменять таким же образом вариабельные цепи на соответствующие цепи других определенных антител или на другие библиотеки таких цепей. Кроме того, специалисту в данной области известны методы замены путем мутагенеза одного или нескольких конкретных аминокислотных радикалов в CDR. Выявление таких заменяющих аминокислотных радикалов осуществляют,например, на основе сравнения последовательностей различных антител и идентификации консервативных или, по меньшей мере, обладающих высокой степенью гомологии радикалов в соответствующих положениях. Касательно изменений CDR специалисту в данной области известны также так называемые"канонические структуры " (Al-Lazikani и др., J. Mol. Biol., 295, 2000, с. 979); Knappik и др. J. Mol. Biol.,296, 2000, с. 57), которые оказывают влияние на трехмерное строение CDR, и можно рассматривать стратегии оптимизации соответствующей конструкции. Кроме того, специалисту в данной области хорошо известны также методы изменения каркасных областей антител или фрагментов антител с целью получения более стабильных или характеризующихся большим уровнем экспрессии молекул (WO 92/01787; Nieba и др., Protein Eng. 10, 1997, с. 435; Ewert и др., Biochemistry 42, 2003, с. 1517). Помимо этих уже описанных стратегий модификации антител или фрагментов антител специалист в данной области на основе сведений об антителах, предлагаемых в изобретении, и методов измерений,представленных в настоящем описании, может осуществлять также дополнительные изменения аминокислотной последовательности или композиции указанных антител и определять с помощью описанного метода анализа и метода измерения, обладают ли полученные модифицированные антитела свойствами,характерными для антител, предлагаемых в изобретении. Следующим объектом настоящего изобретения являются молекулы нуклеиновых кислот, кодирующие антитела или фрагмент антитела, предлагаемого в изобретении. В предпочтительном варианте осуществления изобретения в этом случае они представляют собой молекулы нуклеиновых кислот, кодирующие одну из вариабельных областей легкой цепи (VL), которые имеют последовательности SEQID NO: 2, 6, 10, 14, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37 или 39, или вариабельную область тяжелой це-3 010289 пи (VH), которая имеет последовательность SEQ ID NO: 1, 5, 9 или 13. В этом случае наиболее предпочтительными являются последовательности, представленные в SEQ ID NO: 3, 4, 7, 8, 11, 12, 15, 16, 18, 20,22, 24, 26, 28, 30, 32, 34, 36, 38 и 40. В оптимальном варианте связывающийся с эмиттером пептид, предлагаемый в настоящем изобретении, обладает аффинностью к связыванию менее 50 нм и предпочтительно менее 10 нм. Другим объектом изобретения является связывающийся с эмиттером пептид, предлагаемый в настоящем изобретении, где эмиттер содержит краситель, характеризующийся, по меньшей мере, максимумом абсорбции и/или максимумом флуоресценции в спектральном диапазоне от 700 до 1000 нм, предпочтительно, по меньшей мере, максимумом абсорбции и/или максимумом флуоресценции в спектральном диапазоне от 750 до 900 нм. Батохромный сдвиг красителя выбирают таким образом, чтобы сдвиг максимума абсорбции и/или максимума флуоресценции в сторону больших длин волн, происходящий после взаимодействия с агентом для обнаружения эмиттера, составлял величину, превышающую 15 нм,предпочтительно превышающую 25 нм, и наиболее предпочтительно составлял примерно 30 нм. В этом случае сдвиг не обязательно следует рассматривать как свойство красителя. Как правило, сдвиг следует измерять как изменение величины эмиссии применительно к красителю, т.е. при определенной единственной длине волны. Для этой цели имеются пригодные для измерений оптические агенты, известные специалисту в данной области. Это относится также к измерению изменения плоскости поляризации,интенсивности флуоресценции, интенсивности фосфоресценции, продолжительности флуоресценции и батохромного сдвига максимума абсорбции и/или максимума флуоресценции. Для связывающихся с эмиттером пептидов, предлагаемых в изобретении, предпочтительно, чтобы используемый эмиттер содержал краситель, выбранный из ряда, включающего полиметиновые красители, такие как дикарбоцианин, трикарбоцианин, индотрикарбоцианин, мероцианин, стирил, скварилиум, и оксоноловые красители, и родаминовые красители, феноксазиновые или фенотиазиновые красители. В целом эмиттер, входящий в состав конъюгата субстанция-эмиттер, предлагаемого в изобретении, может содержать цианиновый краситель общей формулы (I) где положение, отмеченное звездочкой, обозначает сайт связывания с радикалом В и может обозначать группу (IV), (V), (VI), (VII) или (VIII) в которых R1 и R2, каждый независимо друг от друга, обозначают C1-С 4 сульфоалкильную цепь, насыщенную или ненасыщенную С 1-С 50 алкильную прямую или разветвленную цепь, которая необязательно несет 0-15 атомов кислорода и/или 0-3 карбонильные группы и/или может быть замещена 0-5 гидрокси-4 010289 группами; R3 и R4 независимо друг от друга обозначают группу -СООЕ 1, -CONE1E2, -NHCOE1,-NHCONHE1, -NE1E2, -OE1, -OSO3E1, -SO3E1, -SO2NHE1 или -Е 1, где Е 1 и Е 2, каждая независимо друг от друга, обозначают атом водорода, С 1-С 4 сульфоалкильную цепь, насыщенную или ненасыщенную разветвленную или прямую С 1-С 50 алкильную цепь, которая необязательно несет 0-15 атомов кислорода и/или 0-3 карбонильные группы и/или замещена 0-5 гидроксигруппами, R5 обозначает атом водорода,метильную, этильную или пропильную группу или атом фтора, хлора, брома или йода, b обозначает число 2 или 3 и X и Y независимо друг от друга обозначают О, S, =С(СН 3)2 или -(СН=СН)-, а также соли и сольваты указанных соединений. При создании изобретения неожиданно было обнаружено, что благодаря высокоаффинному связыванию антитела с цианиновым красителем, характеризующимся абсорбцией и флуоресценцией в ближнем инфракрасном спектральном диапазоне (750 нм), достигается сдвиг максимума абсорбции и максимума флуоресценции в сторону больших длин волн, составляющий примерно 30 нм (батохромный сдвиг). На основе этого оказывается возможным, например, в большом диапазоне концентраций обнаруживать непосредственно и спектрально выделять сигнал из образца цельной крови, при этом сигнал обладает линейной зависимостью от концентрации, подлежащей определению субстанции. Эмиттер может образовывать конъюгаты с субстанциями. Согласно настоящему изобретению в качестве конъюгатов субстанция-эмиттер применяют конъюгаты общей формулы S-E, в которой S обозначает субстанцию, подлежащую изучению, и Е обозначает эмиттер, содержащий фрагмент, который при взаимодействии с агентом, предназначенным для обнаружения эмиттера, вызывает изменение характеристик эмиссии. В качестве структурных компонентов конъюгатов, предлагаемых в изобретении, можно применять среди прочего красители, которые имеют, по меньшей мере, максимум абсорбции и максимум флуоресценции в спектральном диапазоне от 600 до 1200 нм. В этом случае предпочтительными являются красители, обладающие максимумом абсорбции и максимумом флуоресценции в спектральном диапазоне от 700 до 1000 нм. Красителями, удовлетворяющими этим критериям, могут служить, например,красители из следующих классов: полиметиновые красители, такие как дикарбоцианин, трикарбоцианин,мероцианин, и оксоноловые красители, родаминовые красители, феноксазиновые или фенотиазиновые красители, тетрапирроловые красители, прежде всего бензопорфирины, хлорины, бактериохлорины,феофорбиды, бактериофеофорбиды, пурпурины и фталоцианины. Предпочтительными красителями являются цианиновые красители с максимумом абсорбции между 750 и 900 нм и наиболее предпочтительными являются индотрикарбоцианины. Структурные компоненты конъюгатов, предлагаемых в изобретении, представляют собой субстанции, определение концентрации которых также можно осуществлять с помощью способа, предлагаемого в изобретении. Их выбирают, например, из антигенов, таких как белки, пептиды, нуклеиновые кислоты, олигонуклеотиды, компоненты крови, компоненты сыворотки, липиды, фармацевтические агенты и низкомолекулярные соединения, прежде всего сахара, красители или другие соединения с молекулярной массой меньше 500 Да. Предпочтительными красителями являются цианиновые красители, имеющие максимум абсорбции в диапазоне от 750 до 900 нм, наиболее предпочтительными являются индотрикарбоцианины. Красители содержат структурные элементы, посредством которых они ковалентно связываются со структурами субстанции. К ним относятся, например, линкеры, несущие карбоксигруппы, аминогруппы и гидроксигруппы. Если речь идет об оптическом измерении, то его можно осуществлять различными методами, которые в основном ориентированы на характеристический тип изменения спектральных свойств эмиттера(например, флуорофора). Как правило, предпочтительным является обнаружение сдвига длины волны абсорбции и длины волны эмиссии или измерение интенсивности абсорбции и/или флуоресценции, что позволяет в большинстве случаев обнаруживать фрагмент эмиттера, связанный с антителом. В зависимости от изменения спектральных характеристик флуорофора, связанного с антителом, для оптических измерений можно использовать также другие свойства, такие, например, как время жизни фотона, поляризацию и характеристики отбеливания. Особое преимущество применения флуорофоров в спектральном диапазоне ближнего инфракрасного света заключается в низкой степени экранирования компонентами крови. При этом оказывается возможным осуществлять глубокое проникновение без того, чтобы подлежащий определению сигнал претерпевал сколько-нибудь значительное относительное изменение. Кроме того, специалисту в данной области уже известны антитела к флуорофорам, которые обладают способностью изменять их спектральные характеристики в УФ-диапазоне после связывания с флуорофором. Путем связывания флуорофора с антигенсвязывающим карманом антитела можно изменять, прежде всего, интенсивность флуоресценции, максимум абсорбции, максимум эмиссии и время жизни фотона [Simeonov А. и др., Science, 2000, сс. 307-313]. Однако такие известные антитела направлены к эмиттерам (флуорофорам), которые характеризуются своей абсорбцией и эмиссией флуоресценции в видимом и УФ-диапазоне света. Следующим объектом настоящего изобретения является применение связывающегося с эмиттером пептида, предлагаемого в изобретении, для диагностики in vitro.-5 010289 Для этой цели связывающийся с эмиттером пептид, предлагаемый в изобретении, может находиться также в составе диагностического набора необязательно в сочетании с другими адъювантами. Кроме того, все такие наборы, предлагаемые в изобретении, могут содержать специальные инструкции и документы (например, калибровочные кривые, указания по количественной оценке и т.д.). Ниже изобретение более подробно описано на примерах и приложенных чертежах, которые не ограничивают его объем. На чертежах показано на фиг. 1 - вектор pMORPH23, полученный с помощью метода скрининга CysDisplay (векторная карта и последовательность),на фиг. 2 - экспрессионный вектор pMORPHX9 MS (векторная карта и последовательность),на фиг. 3 - спектр абсорбции (слева) и спектр флуоресценции красителя из примера 2 в присутствии антитела MOR02965 в ЗФР и без него. Примеры Пример 1. Селекция, получение и определение характеристик связывающихся с эмиттером антител. Селекция Fab-фрагментов антитела HuCAL GOLD к цианиновому красителю Fuji 6-4 (ZK203468)[тринатрий-3,3-диметил-2-4-метил-7-[3,3-диметил-5-сульфонато-1-(2-сульфонатоэтил)-3H-индолиум-2 ил]гепта-2,4,6-триен-1-илиден-1-(2-сульфонатоэтил)-2,3-дигидро-1 Н-индол-5-сульфонат,внутренняя соль]. Библиотека антител HuCAL GOLD. Библиотека антител HuCAL GOLD: HuCAL GOLD представляет собой полностью синтетическую модульную библиотеку человеческих антител в формате Fab-фрагмента антитела. HuCAL GOLD основана на консенсусных генах антител HuCAL, которые описаны для библиотеки HuCAL-scFv1 (WO 97/08320; Knappik, J. Mol. Biol. 296, 2000, cc. 57-86; Krebs и др., J. Immunol Methods., 254(1-2), август 2001, cc. 67-84). В HuCAL GOLD все шесть CDR модифицированы с помощью так называемого тринуклеотидного мутагенеза (Virneks и др., Nucleic Acids Res., 22(25), 25 декабря 1994, cc. 5600-5607) в соответствии со структурой этих участков в человеческих антителах, в то время как в более ранних библиотекахHuCAL (HuCAL-scFv1 и HuCAL-Fab1), только CDR3 в VH и VL были модифицированы в соответствии со встречающейся в естественных условиях структурой (см. Knappik и др., 2000). Кроме того, дляHuCAL GOLD был использован также модифицированный процесс скрининга, так называемый CysDisplay (WO 01/05950). Вектор pMORPH23, который применяли для процесса скрининга, представлен на фиг. 1. Положения 1 и 2 V. Создавали исходную библиотеку основных генов (мастер-генов) HuCAL,имеющих аутентичные N-концы: VL1: QS (CAGAGC), VL2: QS (CAGAGC) и VL3: SY (AGCTAT). Эти последовательности описаны в WO 97/08320. При создании библиотеки HuCAL-scFv1 указанные два аминокислотных радикала были изменены в "DI" для облегчения клонирования (сайт EcoRI). Указанные радикалы были сохранены при создании HuCAL-Fab1 и HuCAL GOLD. Таким образом, все библиотекиHuCAL каппа (основные гены и все гены в библиотеках) во всех случаях содержат DI на 5'-конце, поскольку они являются аутентичными N-концам (WO 97/08320). Положение 1 VH. Создавали исходную библиотеку основных генов HuCAL, имеющих аутентичныеN-концы: VH1A, VH1B, VH2, VH4 и VH6, несущие в качестве первого аминокислотного радикала Q(CAG), а также VH3 и VH5, несущие Е (GAA). Соответствующие последовательности описаны в WO 97/08320. При клонировании библиотеки HuCAL-Fab1, а также HuCAL GOLD, аминокислоту Q (CAG) встраивали в указанном положении 1 во все гены VH. Получение фагмид. Получали и концентрировали большие количества фагмид путем заражения линии клеток Е. coli ТОР 10F' с помощью фагов-хелперов библиотекой антител HuCAL GOLD или зрелыми библиотеками. Для этой цели библиотеку HuCAL GOLD или зрелые библиотеки (в клетках ТОР 10F') культивировали в 2YT-среде в присутствии 34 мкг/мл хлорамфеникола/10 мкг/мл тетрациклина/1% глюкозы при 37 С до достижения ОП 600 0,5. Затем осуществляли заражение с помощью фагов-хелперов VCSM13 при 37 С. Получали дебрис зараженных клеток и ресуспендировали в 2YT-среде/34 мкг/мл хлорамфеникола/10 мкг/мл тетрациклина/50 мкг/мл канамицина/0,25 ммоля ИПТГ (изопропилгалактозид) и культивировали в течение ночи при 22 С. Фаги осаждали дважды из супернатанта с помощью ПЭГ и собирали путем центрифугирования (Ausubel, Current Protocols in Molecular Biology, изд-во John Wiley Sons, Inc., NewYork, USA, 1998). Фаги ресуспендировали в смеси ЗФР/20% глицерина и помещали на хранение при-80 С. Амплификацию фагмид между отдельными циклами селекции осуществляли следующим образом. Клетки Е. coli TG1 на логарифмической стадии роста заражали выбранными фагами и выкладывали ровным слоем на LB-агаровые планшеты, содержащие 1% глюкозы/34 мкг/мл хлорамфеникола. После инкубации в течение ночи колонии бактерий соскабливали, снова культивировали и заражали с использова-6 010289 нием фагов-хелперов VCSM13. Первичная селекция антител к красителю Fuji 6-4 (ZK203468). В стандартном процессе селекции применяли очищенные и концентрированные фагмиды из библиотеки антител HuCAL GOLD. В качестве антигенов использовали связанное либо с БСА, либо с трансферрином ZK203468. Антигены помещали в ЗФР и наносили в концентрации 50 мкг/мл на титрационные микропланшеты типа Maxisorp F96 (фирма Nunc). Планшеты Maxisorp инкубировали в течение ночи при 4 С ("сенсибилизация"). Затем планшеты Maxisorp блокировали с помощью 5% раствора сухого молока в ЗФР, добавляли примерно 210+13 фагов HuCAL GOLD в содержащие антиген разблокированные лунки и инкубировали в течение ночи или в течение 2 ч при комнатной температуре. После нескольких стадий промывки с использованием все более строгих условий для каждого последующего цикла селекции связанные фаги элюировали с помощью 20 ммоль ДТТ (дитиотреитол) DTT или 100 мкмоль неконъюгированного ZK203468. Осуществляли всего три последовательные цикла селекции, при этом между каждыми циклами селекции проводили амплификацию фага согласно описанному выше методу. Субклонирование выделенных Fab-фрагментов для экспрессии. После селекции антитела, которая состояла из трех циклов, кодирующие Fab-вставки выделенных клонов HuCAL субклонировали в экспрессионном векторе pMORPHX9MS (см. фиг. 2) для облегчения последующей экспрессии Fab-фрагментов. Для этой цели очищенную плазмидную ДНК отобранных Fabклонов HuCAL расщепляли рестриктазами XbaI и EcoRI. Кодирующую Fab-вставку очищали и встраивали путем лигирования в соответствующим образом расщепленный вектор pMORPHX9MS. В результате этой стадии клонирования получали экспрессирующий Fab вектор pMORPHX9FabMS. Fab-фрагменты,экспрессируемые этим вектором, несут две С-концевые метки (Мус tag и Strep tag II) для цели очистки и обнаружения. Скрининг и изучение свойств связывающихся с ZK203468 Fab-фрагментов. После селекции и субклонирования было выделено несколько тысяч клонов, их тестировали с помощью ELISA в 384-луночном формате в отношении специфического обнаружения антигеновZK203468-BCA и -трансферрина с помощью пэннинга. Идентифицированные при этом клоны изучали путем анализа ингибирования методом ELISA с точки зрения эффективности связывания с неконъюгированным красителем. Это позволило выявить исходные Fab-фрагменты MOR02628 (белковые последовательности SEQNO: 4 (VL-CL, MOR02965 (белковые последовательности SEQ-ID NO: 5 (VH-CH) и SEQ-ID NO: 6 (VLCL); последовательности ДНК SEQ-ID NO: 7 (VH-CH) и SEQ-ID NO: 8 (VL-CL, и MOR02977 (белковые последовательности SEQ-ID NO: 9 (VH-CH) и SEQ-ID NO: 10 (VL-CL); последовательности ДНК SEQID NO: 11 (VH-CH) и SEQ-ID NO: 12 (VL-CL, и MOR02969 (белковые последовательности SEQ-ID NO: 13 (VH-CH) и SEQ-ID NO: 14 (VL-CL); последовательности ДНК SEQ-ID NO:15 (VH-CH) и SEQ-ID NO: 16 (VL-CL, которые эффективно связываются с неконъюгированным красителем ZK203468. Пример 2. Оптимизация исходных фрагментов антитела путем замены LCDR3-участка. Клонирование библиотек LCDR3. Плазмидную ДНК четырех исходных клонов MOR02628, MOR02965, MOR02969 и MOR02977 расщепляли с помощью рестриктаз EcoRI и XbaI и затем полную Fab-вставку из полученного экспрессионного вектора pMORPHX9MS субклонировали в соответствующим образом расщепленном дисплейном (презентирующем) векторе pMORPH23. Эта стадия необходима для получения geneIII, который участвует в презентации Fab-фрагмента на поверхности фага. На следующей стадии четыре исходных клона(находящиеся теперь в pMORPH23) расщепляли с помощью BpiI и SphI. Для этого LCDR3-участок и константную область Clambda удаляли из каркаса вектора. Соответствующий фрагмент векторной ДНК выделяли и очищали. Параллельно этому из библиотеки HuCAL-Fab 2 выделяли комплементарныйBpiI/SphI-фрагмент, который содержит модифицированный LCDR3-участок (со степенью вариабельности примерно 310+8) плюс константную область Clambda (ДНК-вставка). Несколько мкг векторной ДНК и совместимой ДНК-вставки сшивали в молярном соотношении 1:2 с помощью ДНК-лигазы фага Т 4 и встраивали в электрокомпетентные клетки ТОР 10F' после стадии очистки. В этом случае размеры библиотек составляли от 510+8 до примерно 110+9 клонов на одно исходное антитело. Объединяли библиотеки, на основе которых создавали клоны MOR02628, MOR02969 и MOR02977("Pool"). Библиотеку MOR02965 обрабатывали отдельно ("Lead"). Как уже было описано выше, соответствующие фагмиды получали путем заражения с помощью фагов-хелперов VCSM13 с использованием этих созревших библиотек ТОР 10F'. Селекция антител на титрационных микропланшетах типа Maxisorp. Очищенные и концентрированные фагмиды из библиотек "lead" и "pool" использовали для процесса созревания-селекции в строгих условиях (продолжительные периоды промывки, замена на очищенные белки исходных Fab-фрагментов). В качестве антигенов использовали связанный либо с БСА, либо с трансферрином ZK203468. Указанные антигены наносили в виде раствора в ЗФР в малых концентрациях,-7 010289 составляющих 100-250 нг/мл на титрационные микропланшеты типа Maxisorp F96 (фирма Nunc). Maxisorp-планшеты инкубировали в течение ночи при 4 С ("сенсибилизация"). Затем планшеты Maxisorp блокировали с помощью 5% раствора сухого молока в ЗФР, добавляли примерно 210+13 фагов HuCALGOLD в содержащие антиген разблокированные лунки и инкубировали в течение ночи или в течение 2 ч при комнатной температуре. Для повышения строгости в процессе этой инкубации добавляли еще 100 или 500 нМ очищенных Fab-фрагментов исходных клонов. После нескольких интенсивных стадий промывки связанные фаги элюировали с помощью 20 ммоль ДТТ. Помимо этого между стадиями селекции осуществляли два последовательных цикла селекции, при этом осуществляли амплификацию фага согласно описанному выше методу. Селекции антител на неутавидиновых полосках. Очищенные и концентрированные фагмиды из библиотек "lead" и "pool" дополнительно использовали для процесса созревания-селекции в строгих условиях (продолжительные периоды промывки, замена на очищенные, исходные белки Fab-фрагментов или на чистый краситель). В качестве антигенов использовали конъюгированный с биотином ZK203468 (либо с помощью алкильных линкеров, либо линкеров в виде простого эфира). Эти антигены растворяли в ЗФР и смешивали в низких концентрациях, составляющих 60 или 12 нг/мл, с примерно 210+11 фагов. Растворы, содержащие конструкцию антигенфаг, инкубировали в течение ночи или в течение 2 ч при комнатной температуре. Для повышения строгости в процессе этой инкубации добавляли еще 0,5 мкг/мл очищенных Fab-фрагментов исходного клона или 40 нМ/мл ZK203468. Затем растворы, содержащие связанные с антигеном фаги, наносили на блокированные неутавидиновые полоски и инкубировали в течение 30 мин для осуществления связывания с твердой фазой через биотиновый радикал антигена. После нескольких стадий промывки связанные фаги элюировали с помощью 20 ммоль ДТТ. Помимо этого между стадиями селекции осуществляли два последовательных цикла селекции, при этом осуществляли амплификацию фага согласно описанному выше методу. Субклонирование выбранных Fab-фрагментов для экспрессии. После селекции ("созревание") вставки, кодирующие Fab-фрагменты выделенных клонов HuCAL,субклонировали в экспрессионном векторе pMORPHX9MS для осуществления последующей экспрессии. Для этой цели очищенную плазмидную ДНК отобранных Fab-клонов HuCAL расщепляли рестриктазами XbaI и EcoRI. Кодирующую Fab-вставку очищали и встраивали путем лигирования в соответствующим образом расщепленный вектор pMORPHX9MS. В результате этой стадии клонирования получали экспрессирующий Fab-фрагмент вектор pMORPHX9FabMS. Fab-фрагменты, которые экспрессируются указанным вектором, несут две С-концевые метки (Мус tag и Strep tag II), для цели очистки и обнаружения. Идентификация оптимизированных фрагментов антитела. Для идентификации антител, обладающих повышенной аффинностью к красителю Fuji 6-4, клоны выделяли путем селекции и подвергали скринингу с помощью ELISA в 384-луночном формате. Для этой цели на титрационные микропланшеты для ELISA наносили ZK203468-БСА. Подлежащие изучениюFab-фрагменты добавляли в виде неочищенных бактериальных лизатов. Наряду с изучением связывания конъюгатом антигена изучали связывание со свободным красителем на идентичных планшетах для скрининга, содержащих бактериальный лизат, для чего добавляли дополнительный свободный краситель в двух различных концентрациях. Ингибирование связывания Fab-фрагмента с твердой фазой, обусловленное в этом случае присутствием неконъюгированного красителя, позволяет выявлять антитела, которые не могут специфически обнаруживать конъюгат с красителем, а обнаруживают только свободный краситель. Для этой цели выделенные клоны характеризовали строго с помощью тестов ингибирования в растворе в формате ELISA и с использованием устройства типа Luminex и определяли их аффинности кFuji 6-4. У следующих клонов обнаружена более высокая аффинность по сравнению с исходными антителами: В целом аффинность исходного MOR02977 по сравнению с MOR03267 можно увеличивать в 140 раз. Для всех других идентифицированных клонов аффинность увеличивалась 2-70 раз по сравнению с аффинностью соответствующего исходного Fab-фрагмента. Пример 3. Фотофизическое изучение свойств комплексов краситель-антитело и определение спектральных сдвигов/количественных уровней флуоресценции. Проводили изучение комплексов краситель-антитело, представляющих собой антитела, связанные с индотрикарбоцианиновым красителем, представляющим собой внутреннюю соль тринатрий-3,3 диметил-2-4-метил-7-[3,3-диметил-5-сульфонато-1-(2-сульфонатоэтил)-3H-индолиум-2-ил]гепта-2,4,6 триен-1-илиден-1-(2-сульфонатоэтил)-2,3-дигидро-1 Н-индол-5-сульфонат (см. примеры 1 и 2). Получали растворы с концентрацией 1 мкмоль/л вышеуказанного красителя и 2,4 мкмоль/л соответствующего антитела в ЗФР и инкубировали в течение 2 ч при комнатной температуре. Максимумы абсорбции определяли с помощью спектрального фотометра (фирма Perkin-Elmer, тип Lambda2). Максимумы флуоресценции и уровень флуоресценции определяли с помощью флуорометра типа SPEX (зависящая от длины волны чувствительность была откалибрована с использованием лампы и детектора) относительно индоцианина зеленого (Q = 0,13 в ДМСО, J. Chem. Eng. Data, 22, 1977, с. 379, Bioconjugate Chem., 12, 2001, с. 44). С использованием данных о максимумах абсорбции и флуоресценции рассчитывали спектральные сдвиги по отношению к максимумам соответствующих характеристик растворов указанных выше красителей в ЗФР без антител (1 мкмоль/л) (максимум абсорбции при 754 нм, максимум флуоресценции при 783 нм, уровень флуоресценции 10%). Пример 4. Конструирование экспрессионных векторов для экспрессии иммуноглобулинов HuCAL. Клонирование тяжелой цепи: "множественный сайт клонирования" в векторе pCDNA3.1+ (фирмаInvitrogen) удаляли (NheI/ApaI) и использовали плэйсхолдер (вставка), совместимый с границами раздела сайтов рестрикции конструкции HuCAL, для встраивания путем лигирования лидерной последовательности (NheI/EcoRI), VH-доменов Fab-фрагмента (MunI/) и константных областей иммуноглобулина(Kozak, 1987). Константные области человеческого IgG (PIR J00228), IgG4 (EMBL K01316) и комплекса сыворотка-IgA1 (EMBL J00220) разделяли на перекрывающиеся олигонуклеотиды длиной, например, 70 оснований. Интродуцировали "молчащие мутации" для устранения реакционноспособных границ раздела, не совместимых с конструкцией HuCAL. Олигонуклеотиды сшивали с помощью "перекрывающей удлиняющей ПНР". В процессе субклонирования Fab-фрагментов в молекуле IgG тяжелую цепь Fab-фрагмента вырезали с помощью MfeI/BlpI и встраивали путем лигирования в вектор, который расщепляли с помощьюEcoRI/BlpI. EcoRI (g/aattc) и MfeI (c/aattg) имеют два совместимых липких конца (aatt) и последовательность исходной границы раздела сайта рестрикции MfeI в Fab-фрагментах заменяли с c/aattg наg/aattg для встраивания путем лигирования в экспрессионный вектор IgG, с помощью которого, с одной стороны, устраняли границу раздела как в сайте рестрикции MfeI, так и в сайте рестрикции EcoRI, и, с другой стороны, осуществляли аминокислотную замену Q (кодон: саа) на Е (кодон: gaa). Клонирование легкой цепи. "Множественный сайт клонирования" pCDNA3.1/Zeo+ (фирма Invitrogen) заменяли двумя различными плэйсхолдерами. k-плэйсхолдер содержал границы раздела сайтов рестрикции для встраивания k-лидерной последовательности (NheI/EcoRV), Fab-фрагменты Vk HuCAL(EcoRV/BsiWI) и константную область k-цепи (BsiWI/ApaI). Соответствующие границы раздела в 1 плэйсхолдере представляли собой NheI/EcoRV (l-лидер), EcoRV/HpaI (V1-домены) и HpaI/ApaI (константная область l-цепи). k-лидер (EMBL Z00022), а также l-лидер (EMBL J00241) оба содержали последовательности Козака (Kozak). Константные области человеческих k-(EMBL L00241) и l-цепей (EMBLM18645) соединяли с помощью "перекрывающейся удлиняющей ПЦР" как описано выше. Получение экспрессирующих IgG клеток СНО. Клетки СНО-K1 подвергали совместной трансфекции эквимолярной смесью экспрессионных векторов тяжелой и легкой цепей IgG. Обладающие двойной устойчивостью трансфектанты отбирали с использованием 600 мг/мл G418 и 300 мг/мл зеоцина (фирмаInvitrogen), после чего осуществляли конечное разведение. Супернатанты индивидуальных клонов проверяли в отношении экспрессии IgG с помощью "захватывающего ELISA." Позитивные клоны культивировали в среде RPMI-1640, дополненной 10% "ультранизким IgG-FCS" (фирма Life Technologies). После этого значение рН супернатанта доводили до 8,0 и после стерилизации путем фильтрации раствор подвергали стандартной хроматографии на протеин А-колонке (Poros 20 А, фирма РЕ Biosystems).
МПК / Метки
МПК: C12N 15/13, C12N 5/10, C07K 16/44
Метки: эмиссии, пептиды, вызывают, которые, эмиттером, связывающиеся, эмиттера, характеристик, изменение, спектральных
Код ссылки
<a href="https://eas.patents.su/30-10289-svyazyvayushhiesya-s-emitterom-peptidy-kotorye-vyzyvayut-izmenenie-spektralnyh-harakteristik-emissii-emittera.html" rel="bookmark" title="База патентов Евразийского Союза">Связывающиеся с эмиттером пептиды, которые вызывают изменение спектральных характеристик эмиссии эмиттера</a>
Предыдущий патент: Фармацевтическая композиция, содержащая амлодипина бесилат и лизиноприла дигидрат, и способ её получения
Следующий патент: Таблетки циталопрама гидробромида
Случайный патент: Резьбовой дюбель с конической головкой для крепления рельсов












