Трициклические соединения для лечения воспалительных и аллергических нарушений, способы их приготовления и содержащие их фармацевтические составы
Номер патента: 10408
Опубликовано: 29.08.2008
Авторы: Баласубраманиан Гопалан, Гхарат Лаксмикант Атмарам, Лакдавала Афтаб Давудбхай, Анупинди Рагху Рам
Формула / Реферат
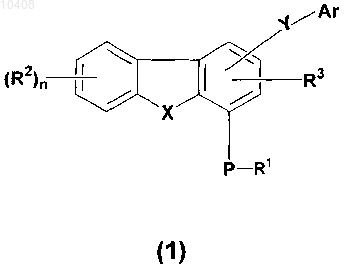
1. Соединение общей формулы (1)
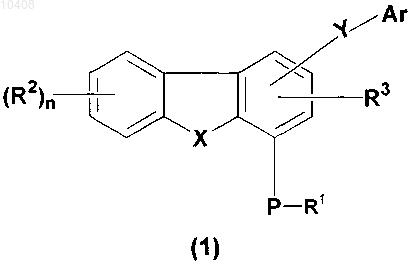
где R1 представляет собой водород, С1-С8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил), (С6-С14 арил)(С1-С8 алкил) или защитную группу, где С1-С8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил) и (C6-C14 арил)(С1-С8 алкил) возможно имеют от 1 до 3 заместителей, выбранных из группы, включающей С1-С8 алкил, галоген, -ORx, оксо- и -COORx;
R2 представляет собой водород, С1-С8 алкил, С3-С15 гетероциклическое кольцо, содержащее от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу; S(O)mNRaRa, нитро, циано, амино или галоген, где С1-С8 алкил и С3-С15 гетероциклическое кольцо возможно имеют от 1 до 3 заместителей, выбранных из группы, включающей С1-С8 алкил, галоген, -ORx, оксо и -COORx;
R3 представляет собой водород;
Р представляет собой кислород или серу;
n принимает значения 0 или 1;
Ar представляет собой С6-C14 арил, (С6-С14 арил)(С1-С8 алкил) или С3-С15 гетероарильное кольцо, содержащее от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу, где С6-С14 арил, (C6-C14 арил)(С1-С8 алкил) и С3-С15 гетероарильное кольцо возможно имеют от 1 до 3 заместителей, выбранных из группы, включающей С1-С8 алкил, галоген, -ORx, оксо и -COORx;
X представляет собой кислород, S(O)m или NR5;
R5 представляет собой водород, C1-C8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(C1-С8 алкил), (С6-С14 арил)(С1-С8 алкил), -C(O)-R1 или защитную группу, где C1-C8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил) и (С6-C14 арил)(С1-С8 алкил) возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
m принимает значение 0 или 2;
Y представляет собой -C(O)NR4, -SO2NR4 или -NR4C(O);
R4 представляет собой водород, C1-C8 алкил, возможно замещенный 1-3 радикалами, выбранными из группы, состоящей из C1-C8 алкила, галогена, -ORx, оксо и -COORx;
при наличии Ra независимо представляет собой C1-C8 алкил; и
при наличии Rx независимо представляет собой водород или C1-C8 алкил;
а также их таутомеры, стереоизомеры, энантиомеры, диастереомеры, N-оксиды, их фармацевтически приемлемые соли или их фармацевтически приемлемые сольваты.
2. Соединение по п.1, отличающееся тем, что указанные заместители могут быть одинаковыми или различными.
3. Соединение по п.1 или 2, отличающееся тем, что R1 представляет собой замещенный алкил.
4. Соединение по п.3, отличающееся тем, что R1 представляет собой CHF2.
5. Соединение по п.1 или 2, отличающееся тем, что R1 представляет собой незамещенный алкил.
6. Соединение по п.5, отличающееся тем, что R1 представляет собой метил.
7. Соединение по любому из пп.1-6, отличающееся тем, что Р представляет собой О или S.
8. Соединение по п.7, отличающееся тем, что Р представляет собой О.
9. Соединение по любому из пп.1-8, отличающееся тем, что R2 выбран из группы: замещенный алкил, галоген, циано, нитро, амино, замещенная гетероциклическая группа и SO2NR1R1, а n=1.
10. Соединение по п.9, отличающееся тем, что R2 представляет собой хлор.
11. Соединение по п.9, отличающееся тем, что R2 представляет собой замещенный алкил.
12. Соединение по п.11, отличающееся тем, что R2 представляет собой CF3.
13. Соединение по п.9, отличающееся тем, что R2 представляет собой -NH2.
14. Соединение по п.9, отличающееся тем, что R2 представляет собой -SO2NR1R1.
15. Соединение по п.14, отличающееся тем, что R2 представляет собой SO2N(CH3)2.
16. Соединение по любому из пп.1-15, отличающееся тем, что Y представляет собой -C(O)NH-.
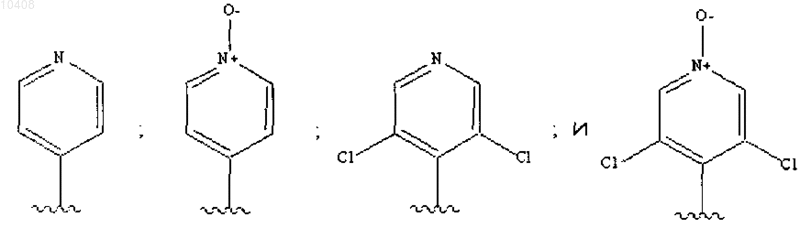
17. Соединение по любому из пп.1-16, отличающееся тем, что Ar выбран из группы: замещенный или незамещенный 4-пиридил; замещенный или незамещенный 4-пиридил-N-оксид; замещенный или незамещенный 3 пиридил; замещенный или незамещенный 3 пиридил-N-оксид; замещенный или незамещенный 2 пиридил и замещенный или незамещенный 2-пиридил- N-оксид.
18. Соединение по п.17, отличающееся тем, что Ar в качестве заместителя имеет галоген.
19. Соединение по п.18, отличающееся тем, что вышеуказанный галоген представляет собой хлор.
20. Соединение по п.17, отличающееся тем, что Ar выбран из группы:
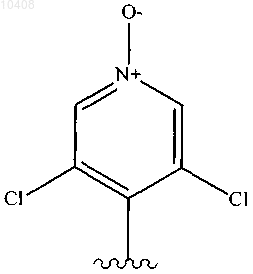
21. Соединение по п.20, отличающееся тем, что Ar представляет собой
22. Соединение по п.1, отличающееся тем, что соединение представляет собой
N-(3,5-дихлоропирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид,
N-(пирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид,
N-(пирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид,
N-(3,5-дихлоропирид-4-ил)-4-метокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-метокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид-N1-оксид,
N-(пирид-4-ил)-4-метокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-дифторметокси-8-трифторметилдибензо[b,d]-фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-дифторметокси-8-трифторметилдибензо[b,d]-фуран-1-карбоксамид-N1-оксид,
N-(пирид-4-ил)-4-дифторметокси-8-трифторметилдибензо[b,d]-фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-дифторметоксидибензо[b,d]фуран-1-карбоксамид,
N-(пирид-4-ил)-4-дифторметоксидибензо[b,d]фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-метокси-8-нитродибензо[b,d]фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-метокси-8-хлордибензо[b,d]фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-метокси-8-бромдибензо[b,d]фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-метокси-8-иоддибензо[b,d]фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-метокси-8-аминодибензо[b,d]фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-дифторметоксидибензо[b,d]фуран-1-карбоксамид-N-оксид,
N-4-(3,5-дихлоро-4-пиридил)-9-бензил-6-хлор-1-метокси-9Н-4-карбазолкарбоксамид,
N-4-(3,5-дихлоро-4-пиридил)-6-хлор-9-циклогексилметил-1-метокси-9Н-4-карбазолкарбоксамид,
N-4-(3,5-дихлоро-4-пиридил)-6-хлор-9-(4-фторбензил)-1-метокси-9Н-4-карбазолкарбоксамид,
N-4-(3,5-дихлоро-4-пиридил)-6-хлор-9-(4-метоксибензил)-1-метокси-9Н-4-карбазолкарбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-метокси-8-циандибензо[b,d]фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-дифторметокси-8-нитродибензо[b,d]фуран-1-карбоксамид,
N-(3,5-дихлоропирид-4-ил)-4-дифторметокси-8-аминодибензо[b,d]фуран-1-карбоксамид.
23. Соединение по п.1, отличающееся тем, что соединение представляет собой
N-(3,5-дихлорпирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(пирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид;
N-(пирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(2-хлорпирид-3-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид;
N-(4-фторфенил)-4-метоксидибензо[b,d]фуран-1-карбоксамид;
N-(пирид-3-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид,
N-(пирид-3-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(3,5-дихлорпирид-4-ил)-4-метокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-метокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(пирид-4-ил)-4-метокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-дифторметокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпиридил-4-ил)-4-дифторметокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(пирид-4-ил)-4-дифторметокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид;
N-(пирид-4-ил)-4-дифторметокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(пирид-3-ил)-4-дифторметокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид;
N-(пирид-3-ил)-4-дифторметокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(пирид-2-ил)-4-дифторметокси-8-трифторметилдибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-дифторметоксидибензо[b,d]фуран-1-карбоксамид и
N-(пирид-4-ил)-4-дифторметокси дибензо[b,d]фуран-1-карбоксамид.
24. Соединение по п.1, отличающееся тем, что соединение представляет собой
N-(пирид-4-ил)-4-дифторметоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(пирид-3-ил)-4-дифторметоксидибензо[b,d]фуран-1-карбоксамид;
N-(пирид-3-ил)-4-дифторметоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(5-хлорпирид-2-ил)-4-дифторметоксидибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-циклопропилметоксидибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-циклопропилметоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(пирид-4-ил)-4-циклопропилметоксидибензо[b,d]фуран-1-карбоксамид;
N-(пирид-4-ил)-4-циклопропилметоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(пирид-3-ил)-4-циклопропилметоксидибензо[b,d]фуран-1-карбоксамид;
N-(пирид-3-ил)-4-циклопропилметоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(3,5-дихлорпирид-4-ил)-4-изопропилоксидибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-изопропилоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(пирид-4-ил)-4-изопропилоксидибензо[b,d]фуран-1-карбоксамид;
N-(пирид-4-ил)-4-изопропилоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(пирид-3-ил)-4-изопропилоксидибензо[b,d]фуран-1-карбоксамид;
N-(пирид-3-ил)-4-изопропилоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид;
N-(3,5-дихлорпирид-4-ил)-4-бензилоксидибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-метокси-8-нитродибензо[b,d]фуран-1-карбоксамид;
N-(пирид-4-ил)-4-метокси-8-нитродибензо[b,d]фуран-1-карбоксамид и
N-(пирид-3-ил)-4-метокси-8-нитродибензо[b,d]фуран-1-карбоксамид.
25. Соединение по п.1, отличающееся тем, что соединение представляет собой
N-(3,5-дихлорпирид-4-ил)-4-метокси-8-хлордибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-метокси-8-бромдибензо[b,d]фуран-1-карбоксамид;
N-(пирид-4-ил)-4-метокси-8-бромдибензо[b,d]фуран-1-карбоксамид;
N-(пирид-3-ил)-4-метокси-8-бромдибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-метокси-8-иоддибензо[b,d]фуран-1-карбоксамид;
N-(пирид-4-ил)-4-метокси-8-иоддибензо[b,d]фуран-1-карбоксамид;
N-(пирид-3-ил)-4-метокси-8-иоддибензо[b,d]фуран-1-карбоксамид;
N-(4-метилпиримид-2-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид;
N-(2,5-дихлорфенил)-4-метоксидибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-этоксикарбометоксидибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-гидроксикарбометоксидибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-метоксидибензо[b,d]фуран-2-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-метоксидибензо[b,d]фуран-3-карбоксамид;
N4-(4-метоксидибензо[b,d]фуран-1-ил)изоникотинамид;
N-(3,5-дихлорпирид-4-ил)-4-метоксидибензо[b,d]фуран-1-сульфонамид;
N-(3,5-дихлорпирид-4-ил)-4-метокси-8-аминодибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-дифторометоксидибензо[b,d]фуран-1-карбоксамид-N-оксид;
N-(3,5-дихлорпирид-4-ил)-4-метокси-8-циандибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-дифторометокси-8-нитродибензо[b,d]фуран-1-карбоксамид;
N-(3,5-дихлорпирид-4-ил)-4-дифторометокси-8-аминодибензо[b,d]фуран-1-карбоксамид;
3,5-дихлор-4-(4-этоксидибензо[b,d]фуран-1-илкарбоксамидо)пиридин и
N1-бензил-4-циклопентилоксидибензо[b,d]фуран-1-карбоксамид.
26. Соединение по п.1, отличающееся тем, что соединение представляет собой
4-(4-циклопентилоксидибензо[b,d]фуран-1-илкарбоксамид)пиридин;
3,5-дихлор-4-(4-циклопентилоксидибензо[b,d]фуран-1-илкарбоксамид)пиридин;
4-(4-метилсульфанилдибензо[b,d]фуран-1-илкарбоксамид)пиридин;
N3-(4-метоксидибензо[b,d]фуран-1-ил)никотинамид;
N1-бензил-4-метоксидибензо[b,d]фуран-1-сульфонамид;
4-(4-метоксидибензо[b,d]фуран-1-илсульфонамид)пиридин;
3,5-дихлор-4-(4-этоксидибензо[b,d]фуран-1-илкарбоксамид)пиридин-N-оксид;
3,5-дихлор-4-(4-циклопентилоксидибензо[b,d]фуран-1-илкарбоксамид)пиридин-N-оксид;
N-формил-1-метокси-4-[4-метоксифениламиносульфонил]-9Н-карбазол;
1-метокси-4-[4-метоксифениламиносульфонил]-9Н-карбазол;
N-формил-1-метокси-4-[4-метилфениламиносульфонил]-9Н-карбазол;
1-метокси-4-[4- метилфениламиносульфонил]-9Н-карбазол;
1-метокси-4-[4-метилфениламиносульфонил-N'-метил]-9Н-карбазол;
1-метокси-4-[4-метилфениламиносульфонил-N'-метил]-9-метилкарбазол;
1-метокси-4-[4-пиридиниламиносульфонил]-9Н-карбазол;
N4-(2,6-дихлорфенил)-1-метокси-9Н-4-карбазолсульфониламид;
N4-(2,6-дихлорфенил)-9-формил-1-метокси-9H-4-карбазолсульфониламид;
N4-(4-пиридил)-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил)-1-метокси-9Н-4-карбазолкарбоксамид и
N4-(3,5-дихлор-4-пиридил)-6-хлор-1-метокси-9Н-4-карбазолкарбоксамид.
27. Соединение по п.1, отличающееся тем, что соединение представляет собой
N4-(3,5-дихлор-4-пиридил)-9-бензил-6-хлор-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил)-6-хлор-9-циклогексилметил-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил)-6-хлор-9-(4-фторбензил)-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил)-6-хлор-9-(4-метоксибензил)-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил)-9-(4-фторбензил)-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(4-пиридил)-9-(4-фторбензил)-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил)-9-бензил-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил)-9-бензил-1-этокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил)-9-бензил-6-хлор-1-этокси-9Н-4-карбазолкарбоксамид;
N4-(4-пиридил)-9-бензил-1-этокси-9Н-4-карбазолкарбоксамид;
N4-(3-пиридил)-6-хлор-9-(4-фторбензил)-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(4-пиридил)-6-хлор-9-(4-фторбензил)-1-метокси-9H-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил) 8-хлор-9-циклогексилметил-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил)-8-хлор-9-(4-фторбензил)-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил)-6-хлор-1-метокси-9-метил-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил-N-оксид)-6-хлор-9-(4-фторбензил)-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил-N-оксид)-6-хлор-9-(4-метоксибензил)-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил-N-оксид)-6-хлор-9-циклогексилметил-1-метокси-9Н-4-карбазолкарбоксамид;
N4-(3,5-дихлор-4-пиридил)-9-метил-1-метокси-9Н-4-карбазолкарбоксамид и
3,5-дихлор-4-(4-метоксидибензо[b,d]-тиофен-1-илкарбоксамид)пиридин.
28. Соединение по п.1, отличающееся тем, что соединение представляет собой
3,5-дихлор-4-(4-циклопентилоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин;
N1-(4-метоксифенил)-4-метоксидибензо[b,d]тиофен-1-карбоксамид;
N1-(4-метоксифенил)-4-метоксидибензо[b,d]тиофен-1-карбоксамид-5,5-диоксид;
N1-(4-хлорфенил)-4-метоксидибензо[b,d]тиофен-1-карбоксамид;
4-(4-метоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин;
4-(4-циклопентилоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин;
3,5-дихлор-4-(4-циклопентилоксидибензо[b,d]тиофен-5,5-диоксид-1-илкарбоксамидопиридин)-N-оксид;
3,5-дихлор-4-(4-метоксидибензо[b,d]тиофен-5,5-диоксид-1-илкарбоксамид)пиридин-N-оксид;
3,5-дихлор-4-(4-метоксидибензо[b,d]тиофен-5,5-диоксид-1-илкарбоксамид)пиридин;
3,5-дихлор-4-(4-дифторметоксидибензо[b,d]-тиофен-1-илкарбоксамид)пиридин;
N1-(4-метоксифенил)-4-метоксидибензо[b,d]тиофен-1-сульфонамид;
2-(4-метоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин;
4-(4-этоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин;
N1-(4-метоксифенил)-N8,8-диметил-4-метоксидибензо[b,d]тиофен-8,1-дисульфонамид;
3-(4-метоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин;
3,5-дихлор-4-(6-этил-4-метоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин;
3,5-дихлор-4-(4-этоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин;
3-(4-метоксидибензо[b,d]тиофен-5,5-диоксид-1-илкарбоксамид)пиридин;
3,5-дихлор-4-(4-бензилоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин и
N-(3,5-дихлорпирид-4-ил)-4-дифторметокси-8-(пирролидин-2-он-1-ил)дибензо[b,d]фуран-1-карбоксамид.
29. Соединение формулы
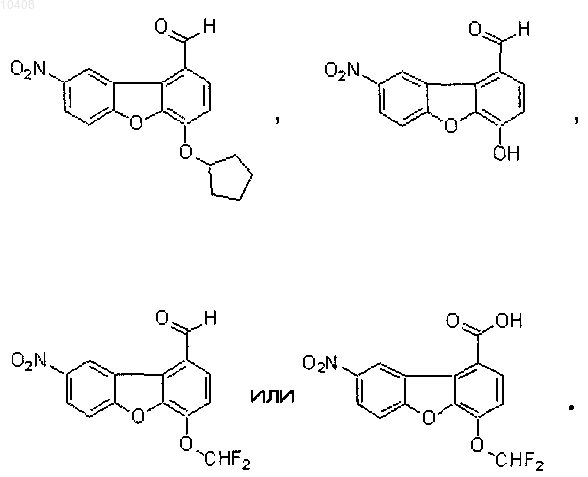
30. Фармацевтический состав, который содержит одно или несколько соединений по любому из пп.1-28, их фармацевтически допустимые соли или сольваты и один или несколько фармацевтически допустимых разбавителей или носителей.
31. Способ лечения воспалительного или иммунного заболевания у субъекта, который в этом нуждается, который включает назначение указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-28.
32. Способ по п.31, отличающийся тем, что указанное воспалительное или иммунное заболевание представляет собой астму, бронхиальную астму, хроническое обструктивное легочное заболевание, аллергический ринит, эозинофильную гранулему, нефрит, ревматоидный артрит, кистозный фиброз, хронический бронхит, рассеянный склероз, болезнь Крона, псориаз, крапивную лихорадку, весенний конъюнктивит у взрослых, синдром респираторного заболевания, ревматоидный спондилит, остеоартрит, подагрический артрит, увеит, аллергический конъюнктивит, воспалительные заболевания кишечника, язвенный колит, экзему, атопический дерматит и хроническое воспаление.
33. Способ по п.32, отличающийся тем, что указанное воспалительное состояние представляет собой аллергическое воспалительное состояние.
34. Способ по п.33, отличающийся тем, что указанные воспалительные состояния и иммунные расстройства выбраны из группы: воспалительные состояния и иммунные расстройства легких, суставов, глаз, кишечника, кожи и сердца.
35. Способ по п.34, отличающийся тем, что указанное воспалительное состояние выбрано из группы: бронхиальная астма, нефрит и аллергический ринит.
36. Способ уменьшения воспаления в пораженном органе или ткани, заключающийся в доставке в указанный орган или ткань терапевтически эффективного количества соединения по любому из пп.1-28.
37. Способ лечения заболеваний центральной нервной системы у субъектов, нуждающихся в подобном лечении, заключающийся во введении в организм указанного субъекта терапевтически эффективного количества соединения по любому из пп.1-28.
38. Способ по п.37, отличающийся тем, что указанные заболевания центральной нервной системы выбраны из группы: депрессия, амнезия, слабоумие, болезнь Альцгеймера, сердечная недостаточность, шок и цереброваскулярное заболевание.
39. Способ лечения инсулин-резистентного диабета у субъекта, нуждающегося в подобном лечении, заключающийся во введении в организм указанного субъекта терапевтически эффективного количества соединения по любому из пп.1-28.
40. Способ получения соединений общей формулы (1)
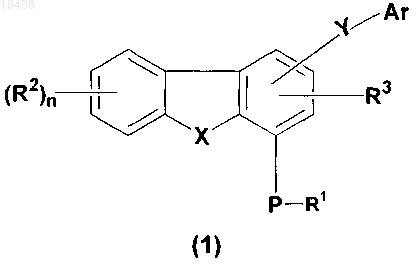
где R1 представляет собой водород, C1-C8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил), (С6-С14 арил)(С1-С8 алкил) или защитную группу, где С1-С8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил) и (С6-С14 арил)(С1-С8 алкил) возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
R2 представляет собой водород, С1-С8 алкил, C3-C15 гетероциклическое кольцо, содержащее от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу; S(O)mNRaRa, нитро, циано, амино или галоген, где С1-С8 алкил и С3-С15 гетероциклическое кольцо возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
R3 представляет собой водород;
Р представляет собой кислород или серу;
n принимает значение 0 или 1;
Ar представляет собой С6-С14 арил, (С6-С14 и арил)(С1-С8 алкил) или С3-C15 гетероарильное кольцо, содержащее от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу, где С6-С14 арил, (С6-С14 арил)(С1-С8 алкил) и С3-С15 гетероарильное кольцо возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
X представляет собой кислород, S(O)m или NR5;
R5 представляет собой водород, С1-С8 алкил, C3-C12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил), (C6-C14 арил)(С1-С8 алкил), -С(О)-R1, или защитную группу, где C1-C8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил) и (С6-С14 арил)(С1-С8 алкил) возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
m принимает значения 0 или 2;
Y представляет собой -C(O)NR4,-SO2NR4 или -NR4C(O);
R4 представляет собой водород, C1-C8 алкил, возможно замещенный 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
при наличии Ra независимо представляет сосющ C1-C8 алкил и
при наличии Rx независимо представляет собой водород или С1-С8 алкил;
включающий следующие этапы:
(а) приведение во взаимодействие соединения общей формулы (28) с амином формулы ArNHR4 с получением новых соединений формулы (1)
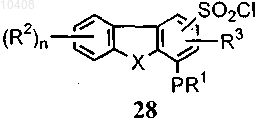
и (б) возможно преобразование соединений формулы (1) в соответствующие N-оксиды.
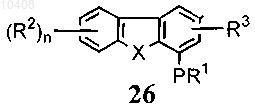
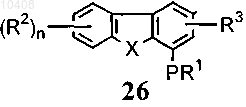
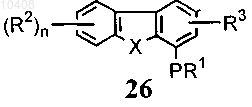
41. Способ по п.40, отличающийся тем, что соединение формулы (28) получают путем взаимодействия с хлорсульфоновой кислотой с получением соединений общей формулы (26)
42. Способ получения соединений общей формулы (1)
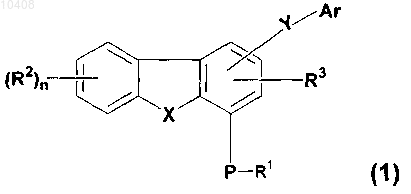
где R1 представляет собой водород, C1-C8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил), (C6-C14 арил)(С1-С8 алкил) или защитную группу, где C1-C8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил) и (C6-C14 арил)(С1-С8 алкил) возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
R2 представляет собой водород, C1-C8 алкил, С3-С15 гетероциклическое кольцо, содержащее от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу; S(O)mNRaRa, нитро, циано, амино или галоген, где C1-C8 алкил и С3-С15 гетероциклическое кольцо возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
R3 представляет собой водород;
Р представляет собой кислород или серу;
n принимает значение 0 или 1;
Ar представляет собой C6-C14 арил, (C6-C14 арил)(С1-С8 алкил) или С3-C15 гетероарильное кольцо, содержащее от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу, где С6-С14 арил, (С6-С14 арил)(С1-С8 алкил) и С3-С15 гетероарильное кольцо возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
X представляет собой кислород, S(O)m или NR5;
R5 представляет собой водород, C1-C8 алкил, С3-С12 циклоалкил, (C3-C12 циклоалкил)(С1-С8 алкил), (С6-С14 арил)(С1-С8 алкил), -C(O)-R1 или защитную группу, где C1-C8 алкил, С3-С12 циклоалкил, (C3-C12 циклоалкил)(С1-С8 алкил) и (С6-С14 арил)(С1-С8 алкил) возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
m принимает значения 0 или 2;
Y представляет собой -C(O)NR4, -SO2NR4 или -NR4C(O);
R4 представляет собой водород, C1-C8 алкил, возможно замещенный 1-3 радикалами, выбранными из группы, состоящей из C1-C8 алкила, галогена, -ORx, оксо и -COORx;
при наличии Ra независимо представляет собой С1-С8 алкил и
при наличии Rx независимо представляет собой водород или С1-С8 алкил;
включающий следующие этапы:
(а) алкилирование соединения общей формулы (31)

посредством взаимодействия с алкилирующим агентом в присутствии основания с получением соединения общей формулы (1)
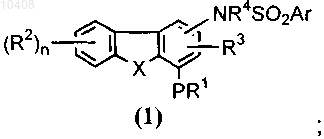
и (б) возможно преобразование соединения формулы (1) в соответствующий N-оксид.
43. Способ по п.42, отличающийся тем, что соединение формулы (31) получают в результате
(а) взаимодействия соединения формулы (26) с азотной кислотой
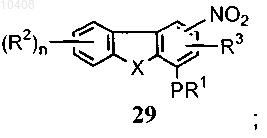
с получением нитрата формулы (29)
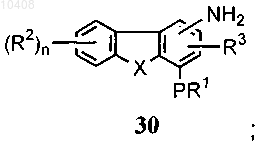
(b) взаимодействия соединения формулы (29) с восстанавливающим агентом с получением амина формулы (30)
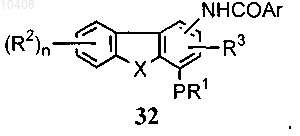
(с) взаимодействия амина формулы (30) и ArSO2Cl с получением соединения формулы (31)
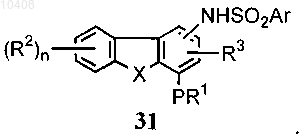
44. Способ получения соединений общей формулы (1)
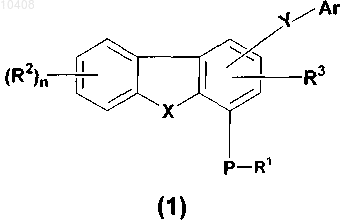
где R1 представляет собой водород, C1-C8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил), (С6-С14 арил)(С1-С8 алкил) или защитную группу, где C1-C8 алкил, C3-C12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил) и (С6-С14 арил)(С1-С8 алкил) возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
R2 представляет собой водород, С1-С8 алкил или С3-С15 гетероциклическое кольцо, содержащее от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу; S(O)mNRaRa, нитро, циано, амино или галоген, где С1-С8 алкил и С3-С15 гетероциклическое кольцо возможно замещены 1-3 радикалами, выбранными из группы, состоящей из C1-C8 алкила, галогена, -ORx, оксо и -COORx;
R3 представляет собой водород;
Р представляет собой кислород или серу;
n принимает значение 0 или 1;
Ar представляет собой С6-С14 и арил, (С6-С14 арил)(С1-С8 алкил) или С3-C15 гетероарильное кольцо, содержащее от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу, где С6-С14 арил, (С6-С14 арил)(С1-С8 алкил) и C3-C15 гетероарильное кольцо возможно замещены 1-3 радикалами, выбранными из группы, состоящей из C1-C8 алкила, галогена, -ORx, оксо и -COORx;
X представляет собой кислород, S(O)m или NR5;
R5 представляет собой водород, С1-С8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С6 алкил), (С6-С14 арил)(С1-С8 алкил), -C(O)-R1 или защитную группу, где С1-С8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил) и (С6-С14 арил)(С1-С8 алкил) возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
m принимает значения 0 или 2;
Y представляет собой -C(O)NR4, -SO2NR4 или -NR4C(O);
R4 представляет собой водород, C1-C8 алкил, возможно замещенный 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
при наличии Ra независимо представляет собой С1-С8 алкил и
при наличии Rx независимо представляет собой водород или С1-С8 алкил;
включающий следующие этапы:
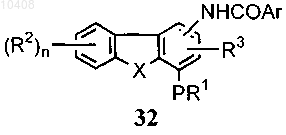
(а) алкилирование соединения общей формулы (32)
посредством взаимодействия с алкилирующим агентом в присутствии основания с получением соединения общей формулы (1)
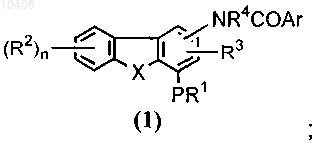
(б) возможно преобразование соединения формулы (1) в соответствующий N-оксид.
45. Способ по п.44, отличающийся тем, что соединение формулы (32) получают в результате
(а) взаимодействия соединения формулы (26) с азотной кислотой
с получением нитрата формулы (29)
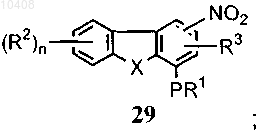
(b) взаимодействия соединения формулы (29) с восстанавливающим агентом с получением амина формулы (30)

(с) взаимодействия амина формулы (30) и ArCOCl или смешанного ангидрида формулы ArCOOCOR5, где R5 представляет собой замещенный или незамещенный алкил, циклоалкил, арил, гетероциклическое кольцо, гетероарил с получением соединения формулы (32)
46. Способ получения соединений общей формулы (1)
где R1 представляет собой водород, C1-C8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил), (С6-С14 арил)(С1-С8 алкил) или защитную группу, где С1-С8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил) и (C6-C14 арил)(С1-С8 алкил) возможно замещены 1-3 радикалами, выбранными из группы, состоящей из C1-C8 алкила, галогена, -ORx, оксо и -COORx;
R2 представляет собой водород, С1-С8 алкил, С3-С15 гетероциклическое кольцо, содержащее от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу; S(O)mNRaRa, нитро, циано, амино или галоген, где С1-С8 алкил и С3-С15 гетероциклическое кольцо возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
R3 представляет собой водород;
Р представляет собой кислород или серу;
n принимает значение 0 или 1;
Ar представляет собой С6-С14 арил, (С6-С14 арил)(С1-С8 алкил) или С3-С15 гетероарильное кольцо, содержащее от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу, где С6-С14 арил, (С6-С14 и арил)(С1-С8 алкил) и С3-С15 гетероарильное кольцо возможно замещены 1-3 радикалами, выбранными из группы, состоящей из С1-С8 алкила, галогена, -ORx, оксо и -COORx;
X представляет собой кислород, S(O)m или NR5;
R5 представляет собой водород, C1-C8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил), (С6-С14 арил)(С1-С8 алкил), -C(O)-R1 или защитную группу, где C1-C8 алкил, С3-С12 циклоалкил, (С3-С12 циклоалкил)(С1-С8 алкил) и (С6-C14 арил)(С1-С8 алкил) возможно замещены 1-3 радикалами, выбранными из группы, состоящей из C1-C8 алкила, галогена, -ORx, оксо и -COORx
m принимает значения 0 или 2;
Y представляет собой -C(O)NR4, -SO2NR4 или -NR4C(O);
R4 представляет собой водород, C1-C8 алкил, возможно замещенный 1-3 радикалами, выбранными из группы, состоящей из C1-C8 алкила, галогена, -ORx, оксо и -COORx;
при наличии Ra независимо представляет собой С1-С8 алкил и
при наличии Rx независимо представляет собой водород или С1-С8 алкил;
включающий следующие этапы:
(а) приведение во взаимодействие соединения формулы (11)
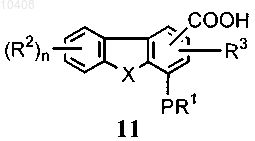
с амином формулы ArNHR4 с получением соединения формулы (1)
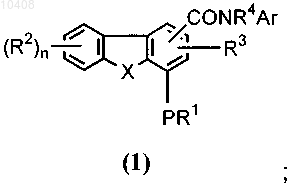
и (б) возможно, преобразование соединения формулы (1) в соответствующий N-оксид.
47. Способ по п.46, отличающийся тем, что соединение формулы (11) получают
(а) путем преобразования соединения общей формулы (10)
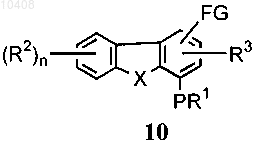
в соединение общей формулы (11), где FG представляет собой замещенный или незамещенный алкил, формил, цианогруппу, галоген, нитро-, аминогруппу или карбоксильную группу.
48. Способ по п.47, отличающийся тем, что соединение формулы (10) получают посредством:
(i) приведения во взаимодействие соединения формулы (13.а) с соединением формулы (23) в щелочных условиях
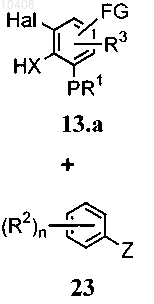
где Z представляет собой галоген; FG представляет собой замещенный или незамещенный алкил, формил, циано, галоген, нитро или амино; и Hal представляет собой галоген, с получением соединения формулы (24)
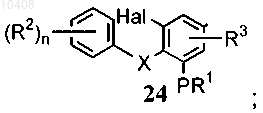
(ii) циклизации соединения общей формулы (24) в условиях образования связи при катализе палладием с получением трициклического соединения общей формулы (10).
49. Способ по п.47, отличающийся тем, что соединение формулы (10) получают посредством
(i) приведения во взаимодействие соединения общей формулы (25) с электрофильным соединением
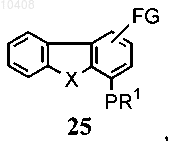
где FG представляет собой алкил, формил, циано, галоген, нитро или амино, с получением соединения формулы (10).
50. Способ по п.47, отличающийся тем, что соединение формулы (10) получают посредством
(i) приведения во взаимодействие соединения общей формулы (13) с соединением, имеющим формулу (20) в щелочной среде
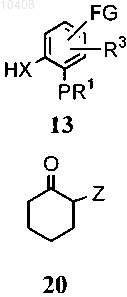
с получением соединения общей формулы (21)
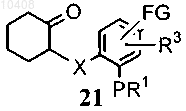
где FG представляет собой алкил, формил, циано, галоген, нитро или амино; и Z представляет собой галоген; и
(ii) циклизации соединения общей формулы (21) в кислой среде и последующим окислением с получением соединения общей формулы (10).
51. Способ по п.47, отличающийся тем, что соединение формулы (10) получают посредством
(i) приведения во взаимодействие соединения формулы (16) с соединением, имеющим формулу (17)
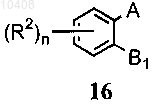
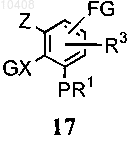
где А представляет собой галоген, -OMs, -OTs или -В(ОН)2; Ms представляет собой группу метансульфонила; Ts представляет собой группу п-толуолсульфонила; B1 представляет собой галоген; G представляет собой защитную группу, которую выбирают из группы бензилоксикарбонила, трет-бутилоксикарбонила, изопропила, циклопентила, аллила, ацетила и бензила, FG представляет собой алкил, формил, циано, галоген, нитро или амино, с получением соединения формулы (18)
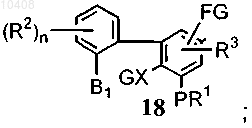
(ii) удаления защитных групп с соединения формулы (18) с получением соединения формулы (19)
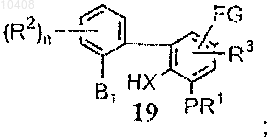
и (iii) циклизации интермедиата формулы (19) в щелочной среде с получением трициклического соединения формулы (10).
52. Способ по п.47, отличающийся тем, что соединение формулы (10) получают посредством
(i) приведения во взаимодействие соединения формулы (12), где Z представляет собой галоген

с ароматической группой формулы (13)
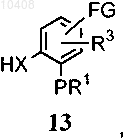
где FG представляет собой алкил, формил, циано, галоген, нитро или амино, в щелочной среде, с получением соединения формулы (14)
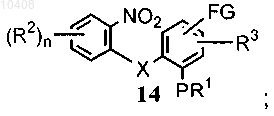
(ii) восстановления соединения формулы (14) с получением соединения формулы (15)
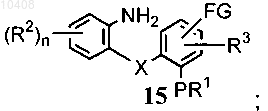
(iii) циклизации соединения формулы (15) с получением трициклического соединения формулы (10).
53. Способ по п.47, отличающийся тем, что (i) FG представляет собой метил и этап (а) включает окисление соединения формулы (10) реагентом на основе марганца или хрома с получением соединения формулы (11), (ii) FG представляет собой циан и этап (а) включает гидролиз соединения формулы (10) с получением соединения формулы (11) или (iii) FG представляет собой бром и этап (а) включает взаимодействие соединения формулы (10) с литием с последующей обработкой диоксидом углерода с получением соединения формулы (11).
54. Способ по п.46, отличающийся тем, что соединение формулы (11) получают посредством
(а) формилирования соединения формулы (26)
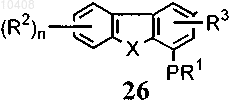
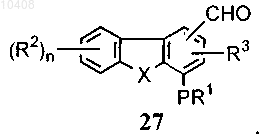
с последующим окислением альдегидной группы в получившемся соединении, которое имеет формулу (27)
Текст
010408 Область техники Настоящее изобретение относится к новым трициклическим соединениям, а также к их аналогам,таутомерам, региоизомерам, стереоизомерам, энантиомерам, диастереомерам, полиморфным модификациям, фармацевтически приемлемым солям, N-оксидам, фармацевтически приемлемым сольватам и содержащим их фармацевтически приемлемым составам. В частности, настоящее относится к новым ингибиторам фосфодиэстеразы типа 4 (PDE4) формулы (1 А), а также к их аналогам, таутомерам, региоизомерам, стереоизомерам, энантиомерам, диастереомерам, полиморфным модификациям, фармацевтически приемлемым солям, N-оксидам, фармацевтически приемлемым сольватам и содержащим их фармацевтически приемлемым составам. Общая формула новых трициклических соединений (1 А) где R1, R2 и R3 могут быть одинаковыми или различными, и независимо выбраны из групп: водород,замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный арил,замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарил, замешенная или незамещенная гетероциклическая группа, замещенный или незамещенный гетероциклилалкил, замещенный или незамещенный гетероарилалкил, -C(O)-R1, -C(O)O-R1, -C(O)NR1R1, -S(O)m-R1, -S(O)m-NR1R1,нитро, -ОН, циано, амино, формил, ацетил, галоген,-OR1, -SR1, защитные группы или структуры, где дваR2 заместителя находятся в орто-положении друг к другу, могут быть связаны с образованием насыщенного или ненасыщенного цикла, который может включать до двух гетероатомов, выбранных из группы О, NR1 или S; где Р представляет собой кислород или серу; n принимает значения 0-4;Ar представляет собой замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенное или незамещенное гетероциклическое кольцо или замещенное или незамещенное гетероариловое кольцо;Ar предпочтительно представляет собой Ar предпочтительно представляет собой возможно замещенный фенил, возможно замещенный бензил, возможно замещенный пирамидин, возможно замещенный пиридил, выбранный из группы: 4-пиридил, 3-пиридил и 2-пиридил, или возможно замещенный пиридил-N-оксид, выбранный из группы: 4-пиридил-N-оксид, 3-пиридил- N-оксид, и 2-пиридил- N-оксид, в которых возможные заместители (один или более) могут быть одинаковыми или различными и независимо выбраны из групп: водород, гидроксил, галоген, циано, нитро, карбоксил, трифторалкил, замещенный или незамещенный алкил, замещенный или незамещенный алкоксил, замещенный или незамещенный алкоксикарбонил, замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкилкарбонилоксил, замещенный или незамещенный амин или одно- или двузамещенный алкиламин, X представляет собой кислород, S(O)m или NR5;R5 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил,замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарил, замещенная или незамещенная гетероциклическая группа, замещенный или незамещенный гетероциклилалкил, замещенный или незамещенный гетероарилалкил, -C(O)-R1, -C(O)O-R1,-C(O)NR1R1, -S(O)m-R1, -S(O)m-NR1R1, нитро, -ОН, циано, амино, формил, ацетил, галоген,-OR1, - SR1 и защитные группы,m принимает значения 0, 1 или 2;R4 представляет собой водород, замещенный или незамещенный алкил, гидроксил, -OR1, -COOR1,замещенный или незамещенный арил, замещенное или незамещенное гетероциклическое кольцо, а также их аналоги, таутомеры, региоизомеры, стереоизомеры, энантиомеры, диастереомеры, полиморфные модификации, фармацевтически приемлемые соли, N-оксиды, фармацевтически приемлемые сольваты и содержащие их, или же их фармацевтически приемлемые соли, фармацевтические составы. В частности, настоящее изобретение предлагает соединение формулы (1) где R1, R2 и R3 могут быть одинаковыми или различными, и независимо выбраны из групп: водород,замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный арил,замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарил, замещенная или незамещенная гетероциклическая группа, замещенный или незамещенный гетероциклилалкил, замещенный или незамещенный гетероарилалкил, -C(O)-R1, -C(O)O-R1, -C(O)NR1R1, -S(O)m-R1, -S(O)m-NR1R1,нитро, -ОН, циано, амино, формил, ацетил, галоген, -OR1, -SR1, защитные группы или структуры, где дваR2 заместителя находятся в орто-положении друг к другу, могут быть связаны с образованием насыщенного или ненасыщенного цикла, который может включать до двух гетероатомов, выбранных из группы О, NR1 или S; где Р представляет собой кислород или серу; n принимает значения 0-4;Ar представляет собой замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенное или незамещенное гетероциклическое кольцо или замещенное или незамещенное гетероариловое кольцо;Ar предпочтительно представляет собой Ar предпочтительно представляет собой возможно замещенный фенил, возможно замещенный бензил, возможно замещенный пирамидин, возможно замещенный пиридил, выбранный из группы: 4-пиридил, 3-пиридил и 2-пиридил, или возможно замещенный пиридил-N-оксид, выбранный из группы: 4-пиридил-N-оксид, 3-пиридил- N-оксид и 2-пиридил-N-оксид, в которых возможные заместители (один или более) могут быть одинаковыми или различными и независимо выбраны из групп: водород, гидроксил, галоген, циано, нитро, карбоксил, трифторалкил, замещенный или незамещенный алкил, замещенный или незамещенный алкоксил, замещенный или незамещенный алкоксикарбонил, замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкилкарбонилоксил, замещенный или незамещенный амин или одно- или двузамещенный алкиламин,X представляет собой кислород, S(O)m или NR5;R5 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил,замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарил, замещенная или незамещенная гетероциклическая группа, замещенный или незамещенный гетероциклилалкил, замещенный или незамещенный гетероарилалкил, -C(O)-R1, -C(O)O-R1,-C(O)NR1R1, -S(O)m-R1, -S(O)m-NR1R1, нитро, -ОН, циано, амино, формил, ацетил, галоген, -OR1, - SR1 и защитные группы, m принимает значения 0, 1 или 2; Y представляет собой -C(O)NR4 , -NR4SO2, -SO2NR4 или -NR4C(O);R4 представляет собой водород, замещенный или незамещенный алкил, гидроксил, -OR1, -COOR1,замещенный или незамещенный арил, замещенное или незамещенное гетероциклическое кольцо, а также их аналоги, таутомеры, региоизомеры, стереоизомеры, энантиомеры, диастереомеры, полиморфные модификации, фармацевтически приемлемые соли, N-оксиды, фармацевтически приемлемые сольваты и содержащие их, или же их фармацевтически приемлемые соли, фармацевтические составы. Настоящее изобретение относится также к процессу получения указанных новых гетероциклических соединений формулы 1, описанных выше. Соединения общей формулы (1), в частности, уменьшают или ингибируют выработку TNF-, являющихся ингибиторами PDE4, вследствие чего применимыми при лечении различных аллергических и воспалительных заболеваний, включая астму, хронический бронхит,атопический дерматит, крапивную лихорадку, аллергический ринит, аллергический конъюнктивит, весенний конъюнктивит, эозинофильная гранулема, псориаз, ревматоидный артирт, септический шок, язвенный колит, болезнь Крона, реперфузное поражение миокарда и реперфузное поражение мозга, хронический гломерулонефрит, эндотоксический шок и синдром респираторного заболевания у взрослых. Соединения по настоящему изобретению особенно полезны при лечении астмы. Уровень техники Воспалением дыхательных путей сопровождаются многие тяжелые легочные заболевания, такие как астма и хроническое обструктивное легочное заболевание (COPD). Причины, приводящие к обструкции дыхательных путей, включают: отек стенок дыхательных путей, инфильтрацию клеток воспалительного очага в легкое, присутствие различных медиаторов, вырабатываемых при воспалении и повышенную выработку слизи. Дыхательные пути у пациентов-астматиков инфильтрированы лейкоцитами воспаления, самым значительным компонентом которых являются эозинофилы. Степень проявления астма-2 010408 тических реакций прямо зависит от количества эозинофилов в легких. Количество эозинофилов в легких пациентов-астматиков чрезвычайно велико, в то время как в легких здорового человека их совсем немного. Они способны разлагать и активировать клетки, разрушая ткани. Активированные клетки синтезируют и выделяют воспалительные цитокины, такие как IL-1, IL-3,TNF- и медиаторы воспаления, такие как PAF, LTD4 и соответствующие кислородсодержащие структуры, способные вызывать отек и бронхостеноз. Известно, что фактор некроза опухолей (TNF-) участвует в процессе патогенеза ряда аутоиммунных и воспалительных заболеваний. Следовательно, манипулирование цитокиновыми сигналами или биосинтетическое воздействие на эти протеины может обеспечить терапевтическую пользу при лечении состояний, возникающих при этих заболеваниях. Убедительно показано, что продукция TNF- в клетках воспаления ослабевает при повышении внутриклеточного циклического аденозин 3',5'-монофосфата (сАМР). Этот вторичный мессенджер регулируется семейством энзимов фосфодиэстеразы (PDE). Энзимы фосфодиэстеразы играют существенную роль в клеточных сигнальных механизмах через гидролизацию с AMP и cGP в их неактивные 5'формы. Таким образом,ингибирование энзимов PDE проявляется в снижении уровня сАМР и /или cGP и изменяет внутриклеточную реакцию (внутриклеточный ответ) на внеклеточные сигналы, оказывая влияние на процессы, где медиаторами являются циклические нуклеотиды. Поскольку считается, что эозинофилы представляют собой основную провоспалительную мишень при астме, идентификация экспрессии семейства геновPDE4 в эозинофилах привела к идентификации PDE4 в качестве потенциальной терапевтической мишени при лечении астмы [Rogers, D.F., Giembycz, M.A., Trends Pharmacol Sci., 19, 160-164(1998); Barnes,P.J., Trends Pharmacol. Sci., 19,415-423 (1998) включено во всей полноте через ссылку]. Фосфодиэстеразы циклических нуклеотидов млекопитающих (PDEs) подразделяются на десять семейств по последовательностям аминокислот и/или последовательности ДНК, субстратной специфичности и чувствительности к воздействию фармакологических агентов. [Soderling, S.H., Bayuga, S.J., andBeavo, J.A., Proc. Natl. Acad. Sci., USA, 96, 7071-7076 (1999); Fujishige, K, Kotera, J., Michibata, H., Yuasa,K., Takebayashi, Si, Okamura, K. and Omori, K., J. Biol. Chem., 274, 18438-18445 (1999) включено во всей полноте через ссылку]. Многие типы клеток проявляют экспрессию более чем одной PDE, причем распределение изоферментов в клетках варьирует значительно. Поэтому разработка высокоселективных изоферментных PDE-ингибиторов предоставляет уникальную возможность для выборочного воздействия на различные патофизиологические процессы. Фосфодиэстераза типа 4 (PDE4) представляет собой фермент, регулирующий активность клеток,приводящую к воспалению легких. PDE4, сАМР-специфичный и Са+2-независимый фермент, является ключевым ферментом в процессе гидролиза сАМР в мастоцитах, базофилах, эозинофилах, моноцитах и лимфоцитах. Связь между увеличением количества сАМР в клетках очага воспаления и расслаблением гладкой мускулатуры дыхательных путей и ингибированием выработки медиатора привела к возникновению общей заинтересованности в разработке ингибиторов PDE4. [Trophy, T.J., Am. J. RespUK. Crit.Care Med., 157, 351-370 (1998) включено во всей полноте через ссылку]. Следствием избыточной или нерегулируемой продукции TNF- является осложнение некоторых нежелательных физиологических состояний, а именно ряда заболеваний, включая остеоартрит и другие артритные состояния, септический шок, синдром респираторного заболевания и болезни, связанные с резорбцией кости; поскольку TNF- играет определенную роль в возникновении и прогрессировании аутоиммунных заболеваний, ингибиторы PDE4 могут найти применение в качестве терапевтических агентов при ревматоидном артрите, рассеянном склерозе и болезни Крона. [Nature Medicine, 1, 211-214(1995) and ibid., 244-248, полностью включено в настоящее описание посредством ссылки]. Сильный интерес к препаратам, способных к селективному ингибированию PDE4, возник по нескольким причинам. Распределение в тканях позволяет предположить, что патологии, связанные с центральной нервной и иммунной системой, можно воздействовать с помощью селективных ингибиторовPDE4 . Кроме того, повышение внутриклеточной концентрации cAMP, очевидного биохимического последствия ингибирования PDE4, характерно для иммунокомпетентных клеток, где оно служит сигналом деактивации. Недавно семейство PDE4 расширилось за счет появления четырех подтипов - от PDE4A до PDE4D,каждый из них кодируется отдельным геном [British Journal of Pharmacology; 1999; v.128; p.1393-1398,полностью включено в настоящее описание посредством ссылки]. Показано, что повышение уровня сАМР в таких клетках проявляется в подавлении клеточной активации, которая в свою очередь ингибирует продукцию и выделение провоспалительных цитокинов, таких как TNF-. Поскольку считают, что эозинофилы представляют собой важнейшую противовоспалительную мишень при астме, идентификация экспрессии семейства генов PDE4 в эозинофилах, выявилаPDE4 как потенциальную терапевтическую мишень при лечении астмы. Применение нескольких ингибиторов PDE4, к сожалению, ограничено из-за ряда нежелательных побочных эффектов, таких как тошнота и рвота (из-за воздействия PDE4 на центральную нервную систему) и повышения желудочной кислотной секреции из-за воздействия PDE4 на париетальные клетки кишечника. (Barnette, M.S., Grous, M., Cieslinsky, L.B., Burman, M., Christensen, S.B., Trophy, T J., J. Phar-3 010408macol. Exp. Ther., 273,1396-1402 (1995), полностью включено в настоящее описание посредством ссылки). Один из первых препаратов - ингибиторов PDE4 , Rolipram, был снят с клинических испытаний изза того, что вызвал ряд неприемлемых тяжелых побочных эффектов. (Zeller E. et. al., Pharmacopsychiatr.,17, 188-190 (1984), полностью включено в настоящее описание посредством ссылки). Причина возникновения тяжелых побочных эффектов воздействия молекул ингибитора PDE4 в ходе клинических испытаний на человеческом организме выяснилась недавно. У PDE4 млекопитающих существует два сайта связывания, в которых молекулы ингибитора могут образовывать связь. Кроме того, PDE4 существует в двух различных формах, представляющих разные конформации. Их обозначают как сайты связывания препарата Rolipram высокого сродства - PDE 4H и сайт связывания препарата Rolipram низкого сродства PDE 4L [Jacobitz, S., McLaughlin, M.M., Livi, G.P.,Burman, M, Trophy, T.J., Mol. Pharmaco, 50, 891-899 (1996); полностью включено в настоящее описание посредством ссылки]. Показано, что некоторые нежелательные побочные эффекты (тошнота и желудочная кислотная секреция) связаны с PDE 4 Н-ингибированием, в то время как некоторый благоприятный эффект ассоциировали с PDE-4L ингибированием. Было обнаружено, что человеческий рекомбинантSci., 17, 294-298 (1996), полностью включено в настоящее описание посредством ссылки]. Соответственно обнаружено, что соединения, проявляющие большую изоферментную PDE-4D селективность, вызывают меньше побочных эффектов, чем Rolipram [Hughes. В et.al., Br. J. Pharmacol. 1996, 118, 1183-1191,включено во всей полноте через ссылку]. Поэтому селективные ингибиторы изоферментов PDE-4 могут иметь терапевтический эффект при лечении воспалительных заболеваний, таких как астма и другие респираторные заболевания. Несмотря на то, что по всему миру работает несколько групп исследователей, занимающихся поиском высоко селективных ингибиторов изоферментов PDE-4, до сих пор им удалось добиться лишь ограниченного успеха. Ингибируещее воздействие на PDE-4 проявляют многие соединения. Соединение "Ariflo" SmithKline Beecham формулы A, Roflumilast Byk Gulden формулы D и Bay-198004 от Bayer формулы Е далеко продвинулись в клинических испытаниях на человеческом организме. Среди других соединений, проявивших выраженное PDE-4 ингибирующее действие Celltech's CDP-840 формулы В, Schering Plough's D-4418 формулы С, Pfizer's 5 СР-220,629 формулы F, Parke Davis's PD168787 формулы G и Wyeth's Filaminast формулы Н. Однако недавно из-за проблем, связанных с эффективностью и побочными эффектами, Ariflo, CDP840 и Bay-19-8004 в качестве средств лечения астмы были сняты с клинических испытаний. Другие соединения С и F в настоящее время проходят первую фазу клинических испытаний. Патент США 4933351 описывает бензофуран-2-карбоксиамиды, применимые в качестве ингибиторов биосинтеза лейкориена, соединение формулы 1 и фармацевтически приемлемый носитель:-N(R13)-N(R13)2, где R13 независимо представляет собой водород, R8, R9, Ar1 или Het:-O(CH2)nNR8R9, где N принимает значения от 2 до 4;-(СН 2)nAr1, где п принимает значения от 0 до 3;-(СН 2)nCOOR6, где n принимает значения от 0 до 6;C1-С 20 алкил; Ar1; Het; (CH2)nNR8R9,где n принимает значения от 1 до 3; или Het;a R1, R3 R4, Т и V независимо выбраны из группы: 1. водород 2. алкил, содержащий от 1 до 6 атомов углерода; 3. алкенил, содержащий от 2 до 6 атомов углерода; 4. -(CH2)nM, где n принимает значения от 0 до 6, за исключением случаев, где X представляет собойS, а М является OR5, в котором n принимает значения от 1 до 6, а М представляет собойu) -CN или же любую пару из R3, R4, T и V возможно связанные с образованием насыщенного кольца, содержащего от 5 до 6 кольцевых атомов, причем названные кольцевые атомы включают 0, 1 или 2 атома,выбранных из кислорода и серы, остальные кольцевые атомы представляют собой атомы углерода; каждый R5 независимо представляет собой Н, C1-C6 алкил, бензол, Ar1, перфтор-C1-С 4 алкил, CH2R11 представляет собой C1-С 5 алкилдиметиламин, гидрокси-С 2-С 5 алкил, CH2COOR6 или CH2CO-R7; каждый R6 независимо представляет собой Н, или C1-С 6 алкил; каждый R7 независимо представляет собой C1-С 6 алкил, бензил, Ar1, NR8R9, NHAr1 или O-C1-C4 алкил; каждый R8 и R9 независимо представляет собой Н или C1-C4 алкил; или же R8 и R9 могут соединяться через N, с которым они связаны, образуя гетероциклоалкильное кольцо, содержащее от 5 до 8 кольцевых атомов; каждый Het независимо представляет собой ароматическое гетероциклическое кольцо, содержащее от 5 до 6 кольцевых атомов, один или более из которых выбраны из N, О и S; каждый Ar1 независимо представляет собой 1- или 2-нафтил, фенил или моно- или двузамещенный фенил, заместители при фениле независимо выбраны из группы: C1-C3 алкил, I Br, Cl, F, COOR6,(CH2)nNR8R9, где n принимает значения от 0 до 2, метилендиокси, C1-C3 алкокси, ОН, CN, NO2, CF3, C1 до С 4 ацил, NR8R9, S-C1-С 6 алкил, SO-C1-С 6 алкил, и SO2-C1-С алкил; a R14 и R15 каждый независимо представляет собой Н, C1-С 6 алкил; или их фармацевтически приемлемые соли.WO 94/08995 описывает производные гетероциклической конденсированной бензойной кислоты как антагонисты 5-НТ 4 рецепторов, формулы (1) или их фармацевтически приемлемые соли где А представляет простую связь,-СН 2- или СО или А представляет собой (СН 2)a-Е-(СН 2)b,где один из индексов а и b принимает нулевое значение, а другой равняется 0 или 1, а Е представляет собой O, S или NH;R4 является водородом или C1-6 алкилом. где X представляет собой О или S; А представляет простую связь, -СН 2- или СО или А представляет собой (СН 2)а-Е-(СН 2)b где один из индексов а и b принимает нулевое значение, а другой равняется 0 или 1, а Е представляет собой O, S или NH;f и g оба представляют собой водород или же вместе обозначают связь;R4 является водородом или С 1-6 алкилом.R41 и R411 независимо представляют собой водород или C1-6 алкил. В формулах с (I-1) по (I-4) включительно: Y представляет собой О или NH; Z имеет субформулу (а),(b) или (с):R5 представляет собой водород, C1-12 алкил, аралкил или R5 является (CH2)z-R10, в котором z равняется 2 или 3, a R10 выбран из группы: циан, гидроксил, С 1-6 алкокси, фенокси, C(O)C1-6 алкил, СОС 6 Н 5, CONR11R12, NR11COR12, SO2NR11R12 и NR11SO2R12, где R11 и R12 обозначают водород или С 1-6 алкил; иR6, R7 и R8 независимо представляют собой водород или С 1-6 алкил; аR9 представляет собой водород или С 1-10 алкил; или соединение формулы (I), в котором CO-Y связь заменена гетероциклическим биоизостереомером;WO 01/58895-А 1 описывает новые соединения формулы (i): в которых R1 представляет собой C1-3 алкил, возможно замещенный одним или несколькими атомами фтора;R2 представляет собой СН 2 ОСН 3 или 2 или 3-тетрагидрофуранил;R4 представляет собой C1-3 алкил; а каждый из R5 и R6, которые могут быть одинаковыми или различными, представляет собой С 1-3 и алкил, галоген, CF3 или CN; патент США 4769387 описывает соединения формулы: где R представляет собой (1) водород, (2) C1-С 4 алкил, (3) С 2-С 4 алкенил или (4) NR2R3, где R2 и R3 независимо выбраны из группы: водород, C1-С 4 алкил или гидроксил, однако R2 и R3 одновременно не являются гидроксильными группами;X (1) кислород, (2) сера, (3) SO2, или (4) NR4 где R4 представляет собой (1) водород, (2) C1-С 6 алкил,(3) C1-С 6 алкоил, или(4) ароил; А выбран из C1-С 6 алкиленов и С 2-С 6 алкениленов; Y в каждом случае независимо выбран из группы: (1) водород, (2) галоген, (3) гидроксил (4) циано (5) галозамещенный алкил,(6) C1-С 12 алкил, (7) С 2-С 12 алкенил, (8) C1-С 12 алкокси, (9) С 3-С 8 циклоалкил, (10) арил, (11) арилокси, (12) ароил, (13) C1-С 12 арилалкил, (14) С 2-C12 арилалкенил, (15) C1-С 12 арилалкокси, (16) C1-C12 арилтиоалкилокси, и замещенные производные (17) арил, (18) арилокси, (19) ароил, (20) C1-C12 арилалкил, (21) С 2-С 12 арилалкенил, (22) C1-С 12 арилалкокси или (23) C1-С 12 арилтиоалкокси, где заместители выбраны из группы: галоген, нитро, циано, С 1-С 12 алкил, алкокси, и галозамещенный алкил; n принимает значения 0-4; группа(ы) Y могут иметь заместителей в любом положении на арильном кольце; а М представляет собой водород, фармацевтически приемлемый катион, ароил, или C1-С 12 алкоил. Патент США 3897453 описывает производные дибензофурана и дибензотиофена общей формулы I В которых Z обозначает где R1 представляет собой СООН, СНО, или СН 2 ОН, а также их функциональные производные; R2 представляет собой Н или алкил, содержащий 1-4 атома углерода; R3 представляет собой Н, алкил, алкокси, алканоил, моноалкиламино, диалкиламино или ациламиногруппу, каждая из которых содержит до 4 атомов углерода, F, Cl, Br, I, ОН, NH2, NO2, CN, или CF3; a Y представляет собой О или S, при условии,что по меньшей мере один из R2 и R3 не является Н; и их физиологически приемлемые соли. WO 98/09934 описывает соединения формулы I где M является производным природной (L) альфа-аминокислоты, имеющей структуруRQ представляет собой водород, C1-С 6 алкил или -С 1-С 6 алкил-фенил; R является боковой цепью природной альфа-аминокислоты;R2 и R4 независимо представляют собой водород, -С 1-С 5 алкил, фенил-NO2, галоген, -OR5, -CN,-CO2R5, -SO3R5, -СНО, -COR5, -CONR5R6, -(CH2)nNR5R6, -CF3, или -NHCOR5; каждый R5 и R6 независимо представляют собой водород, -С 1-С 5 алкил; а n принимает значения от 0 до 2, а также фармацевтически приемлемые соли, сложные эфиры, амиды и пролекарства названных соединений. Краткое описание изобретения Таким образом, настоящее изобретение предлагает новые гетероциклические соединения общей формулы (1)R1, R2 и R3 могут быть одинаковыми или различными, и независимо выбраны из групп: водород,-8 010408 замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный арил,замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарил, замещенная или незамещенная гетероциклическая группа, замещенный или незамещенный гетероциклилалкил, замещенный или незамещенный гетероарилалкил, -C(O)-Ra, -C(O)O-Ra, -C(O)NR1Ra, -S(O)m-Ra, -S(O)m-NRaRa,нитро, -ОН, циано, амино, формил, ацетил, галоген,-ORa, -SRa, защитные группы или структуры, где дваR2 заместителя находятся в орто-положении друг к другу, могут быть связаны с образованием насыщенного или ненасыщенного цикла, который может включать до двух гетероатомов, выбранных из группы О, NR1 или S; гдеRa независимо представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарил, содержащий от одного до пяти гетороатомов, выбранных из группы,включающей азот, фосфор, кислород и серу, замещенное или незамещенное гетероциклическое кольцо,содержащее от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу, замещенный или незамещенный гетероциклилалкил, где гетероциклическое кольцо содержит от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу, замещенный или незамещенный гетероарилалкил, где гетероарильное кольцо содержит от одного до пяти гетероатомов, выбранных из группы, включающей азот, фосфор, кислород и серу,где Р представляет собой кислород или серу, предпочтительно О;Ar представляет собой замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенное или незамещенное гетероциклическое кольцо или замещенное или незамещенное гетероарильное кольцо;Ar предпочтительно представляет собой Ar, предпочтительно представляет собой возможно замещенный фенил, возможно замещенный бензил, возможно замещенный пирамидин, возможно замещенный пиридил, выбранный из группы: 4-пиридил, 3-пиридил и 2-пиридил, или возможно замещенный пиридил-N-оксид, выбранный из группы: 4-пиридил-N-оксид, 3-пиридил-N-оксид, и 2-пиридил-N-оксид, в которых возможные заместители (один или более) могут быть одинаковыми или различными и независимо выбраны из групп: водород, гидроксил, галоген, циано, нитро, карбоксил, трифторалкил, замещенный или незамещенный алкил, замещенный или незамещенный алкоксил, замещенный или незамещенный алкоксикарбонил, замещенный или незамещенный алкилкарбонил, замещенный или незамещенный алкилкарбонилоксил, замещенный или незамещенный амин или одно- или двузамещенный алкиламин. Далее предпочтительно Ar выбирают из группы: замещенный или незамещенный 4-пиридил; замещенный или незамещенный 4-пиридил-N-оксид; замещенный или незамещенный 3-пиридил, замещенный или незамещенный 3-пиридил-N-оксид; замещенный или незамещенный 2-пиридил, замещенный или незамещенный 2-пиридил-N-оксид. Далее, предпочтительно выбирать Ar из группы:R5 представляет собой водород, замещенный или незамещенный алкил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный циклоалкил,замещенный или незамещенный циклоалкилалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный гетероарил, замещенная или незамещенная гетероциклическая группа, замещенный или незамещенный гетероциклилалкил, замещенный или незамещенный гетероарилалкил, -C(O)-R1, -C(O)O-R1,-C(O)NR1R1, -S(O)m-R1, -S(O)m-NR1R1, нитро, -ОН, циано, амино, формил, ацетил, галоген,-OR1, - SR1 и защитные группы, m принимает значения 0, 1 или 2;R4 представляет собой водород, замещенный или незамещенный алкил, гидроксил, -OR1, -COOR1,замещенный или незамещенный арил, замещенное или незамещенное гетероциклическое кольцо, а также их аналоги, таутомеры, региоизомеры, стереоизомеры, энантиомеры, диастереомеры, полиморфные модификации, фармацевтически приемлемые соли, N-оксиды, фармацевтически приемлемые сольваты и содержащие их, или же их фармацевтически приемлемые соли, фармацевтические составы. Заместители в замещенном алкиле, замещенном алкоксиле, замещенном алкениле, замещенном алкиниле, замещенном циклоалкиле, замещенном циклоалкилалкиле, замещенном циклоалкениле, замещенном арилалкиле, замещенном ариле, замещенном гетероциклическом кольце, замещенном амине,замещенном алкоксикарбониле, замещенном циклическом кольце, замещенном алкилкарбониле, замещенном алкилкарбонилоксиле могут быть одинаковыми или различными, причем один или несколько заместителей выбрано из группы: водород, гидроксил, галоген, карбоксил, циано, нитро, оксо(=O), тио(=S), замещенный или незамещенный алкил, замещенный или незамещенный алкоксил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил,замещенный или незамещенный арилалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный амин, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенное гетероциклилалкильное кольцо с замещенным или незамещенным гетероалкилом, замещенное или незамещенное гетероциклическое кольцо, замещенный или незамещенный гуанидин, -COORx, -C(O)Rx, -C(S)Rx, -C(O)NRxRy, -C(O)ONRxRy,-NRxCONRyRz, -N(Rx)SORy, -N(Rx)SO2Ry, -(=N-N(Rx)Ry), -NRxC(O)ORy, -NRxRy, -NRxC(O)Ry-,-NRxC(S)Ry, -NRxC(S)NRyRz, -SONRxRy-, -SO2NRxRy-, -ORx, -ORxC(O)NRyRz, -ORxC(O)ORy-, -OC(O)Rx,-OC(O)NRxRy, -RxNRyC(O)Rz, -RxORy, -RxC(O)ORy, -RxC(O)NRyRz, -RxC(O)Rx, -RxOC(O)Ry, -SRx, -SORx,-SO2Rx, -ONO2, где Rx, Ry и Rz в каждой из вышеупомянутых групп может представлять собой атом водорода, замещенный или незамещенный алкил, замещенный или незамещенный алкоксил, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил,замещенный или незамещенный арилалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный амин, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенное гетероциклилалкильное кольцо с замещенным или незамещенным гетероалкилом, замещенное или незамещенное гетероциклическое кольцо. Далее, R1 предпочтительно представляет собой замещенный алкил. В качестве R наиболее предпочтителен CHF2. Далее предпочтительный R1 представляет собой незамещенный алкил, наиболее предпочтительно метил. R2 предпочтительно представляет собой алкил, галоген, циано, нитро, аминогруппу, замещенный гетероцикл и SO2NR1R1, при этом n=1, в качестве R2 наиболее предпочтителен хлор. Далее в качестве R2 предпочтителен замещенный алкил, наиболее предпочтителен CHF2. Далее в качестве R2 предпочтителен -NH2. Далее в качестве R2 предпочтителен SO2NR1R2. Наиболее предпочтительным R2 является SO2N(СН 3)2. Краткое описание рисунков График 1. Воздействие соединения по примеру 1 на выделение TNF-альфа, индуцированное липополисахарилами (LPS) у самцов мышей Balb/C. График 2. Воздействие соединения по примеру 1 на отек ушной раковины, индуцированный арахидоновой кислотой, у мышей. Подробное описание изобретения Термин алкил относится к углеводородным радикалам, содержащим прямую или разветвленную углеводородную цепь, состоящую исключительно из атомов углерода и водорода, полностью насыщенным; содержащим от одного до восьми атомов углерода, связанным с остальной молекулой простой связью. Примеры: метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил, 1,1-диметилэтил(трет-бутил), и т.п. Термин алкенил относится к алифатическим углеводородным группам, содержащим двойную связь углерод-углерод; углеродная цепь может быть прямой или разветвленной, или иметь ответвление,содержащее от 2 до 10 атомов углерода. Примеры: этенил, 1-пропенил, 2-пропенил (аллил), изопропенил,2-метил-1-пропенил, 1-бутенил, 2-бутенил и т.п. Термин алкинил относится к углеводородным радикалам с прямой или разветвленной цепью, содержащим по меньшей одну тройную связь углерод-углерод, с количеством атомов углерода от 2 до 12(радикалы с количеством атомов углерода от 2 до 10 в данном случае предпочтительны). Примеры: этинил, пропинил, бутинил и т. п. Термин алкоксил обозначает описанную выше алкильную группу, присоединенную к остальной молекуле через кислородную связь. Репрезентативные примеры подобных групп: -ОСН 3, -ОС 2 Н 5 и т.п. Термин алкилкарбонил обозначает описанную выше алкильную группу, присоединенную к остальной молекуле через карбонильную связь. Репрезентативные примеры подобных групп: -С(О)СН 3,-С(О)С 2 Н 5 и т.п. Термин алкоксикарбонил обозначает описанную выше алкоксильную группу, присоединенную к остальной молекуле через карбонильную связь. Репрезентативные примеры подобных групп: С(О)- 10010408 ОСН 3, -C(O)-OC2H5 и т.п. Термин алкилкарбонилокси обозначает описанную выше алкилкарбонильную группу, присоединенную к остальной молекуле через кислородную связь. Репрезентативные примеры подобных групп: ОС(О)СН 3, -О-С(О)С 2 Н 5 и т.п. Термин алкиламино обозначает описанную выше алкильную группу, присоединенную к остальной молекуле через аминную связь. Репрезентативные примеры подобных групп: -NH2CH3, -NH(CH3)2,-N(СН 3)3 и т.п. Термин циклоалкил обозначает неароматическую моно- или мультициклическую кольцевую систему, содержащую приблизительно от 3 до 12 атомов углерода, например: циклопропил, циклобутил,циклопентил, циклогексил; примеры мультициклических циклоалкильных групп, включают пергидронафтил-, адамантил- и норборниловые группы, циклические группы, содержащие мостик, или спиробициклические группы, например спиро(4,4)-нон-2-ил. Термин циклоалкилалкил относится к циклическим радикалам, содержащим кольца, в состав которых входит приблизительно от 3 до 8 атомов углерода, прямо связанных с алкильной группой, в свою очередь связанной с основной структурой через любой атом углерода алкильной группы, с образованием в результате стабильной структуры, такой как циклопропилметил, циклобутилэтил, циклопентилэтил и т.п. Термин циклоалкенил к циклическим радикалам, содержащим кольца, в состав которых входит приблизительно от 3 до 8 атомов углерода, по меньшей мере с одной двойной углерод-углеродной связью, такие как циклопропенил, циклобутенил, циклопентенил и т.п. Термин арил относится к ароматическим радикалам, в состав которых входит приблизительно от 6 до 14 атомов углерода, таким как фенил, нафтил, тетрагидронафтил, инданил, бифенил и т.п. Термин арилалкил относится к описанной выше арильной группе, прямо связанной с алкильной группой, описанной выше. Примеры: -СН 2 С 6 Н 5, -C2H5C6H5 и т.п. Термин гетероциклическое кольцо относится к стабильному 3-15-членному кольцевому радикалу, состоящему из атомов углерода и от одного до пяти гетероатомов, выбранных из группы: азот, фосфор, кислород или сера. В рамках задач настоящего изобретения гетероциклический кольцевой радикал может пердставлять собой моноциклическую, бициклическую или трициклическую кольцевую систему,которая может включать конденсированную, содержащую мостик, или спирокольцевую систему, а входящие в гетероциклический кольцевой радикал атомы азота, фосфора, углерода, кислорода или серы,возможно окислены до различных степеней окисления. Кроме того, атом азота может быть четвертичным; а кольцевой радикал может быть частично или полностью насыщенным (например, гетероароматическим или гетероариловым ароматическим). Примеры подобных гетероциклических кольцевых радикалов включают без ограничения: азетинидил, акринидил, бензодиоксолил, бензодиоксанил, бензофуран,карбазолил, циннолинил, диоксоланил,индолизинил, нафтиридинил, пергидроазепинил, феназинил, фенотиазинил, феноксазинил, фталазинил, пиридил, птеридинил, пуринил, хиназолинил, хинооксалинил,хинолинил, изохинолинил, тетразоил, имидазолил, тетрагидроизохинолил, пиперидинил, пиперазинил, 2 оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазепинил, азепинил, пирролил, 4 пиперидонил, пирролидинил, пиразинил, пиримидинил, пиридазинил, оксазолил, оксазолинил, оксазолидинил, триазолил, инданил, изоксазолил, изоксазолидинил, морфолинил, тиазолил, тиазолинил, тиазолидинил, изотиазолил, хинуклидинил, изотиазолидинил, индолил, изоиндолил, индолинил, изоиндолинил,октагидроиндолил, октагидроизоиндолил, хинолил, изохинолил, декагидроизохинолил, бензимидазолил,тиадиазолил, бензопиранил, бензотиазолил, бензоксазолил, фурил, тетрагидрофуртил, тетрагидропиранил, тиенил, бензотиенил, тиаморфолинил, тиаморфолинил сульфоксид, тиаморфолинил сульфон, диоксафосфоланил, оксадиазолил, хроманил, изохроманил и т.п. Термин гетероарил относится к описанным выше гетероциклическим кольцевым радикалам. Гетероариловый кольцевой радикал может быть связан с основной структурой через любой из гетероатомов или через атом углерода, в результате чего образуется стабильная структура. Гетероциклический кольцевой радикал может быть связан с основной структурой через любой из гетероатомов или через атом углерода, в результате чего образуется стабильная структура. Термин гетероарилалкил относится к описанному выше гетероариловому кольцевому радикалу,прямо связанному с алкильной группой. Гетероарилалкильный радикал может быть связан с основной структурой через любой из атомов углерода алкильной группы, в результате чего образуется стабильная структура. Термин гетероциклил относится к описанному выше гетероциклическому кольцевому радикалу. Гетероциклический кольцевой радикал может быть связан с основной структурой через любой из гетероатомов или атомов углерода, в результате чего образуется стабильная структура. Термин гетероциклилалкил относится к описанному выше гетероциклическому кольцевому радикалу, прямо связанному с алкильной группой. Гетероциклилалкильный радикал может быть связан с основной структурой через атом углерода алкильной группы, в результате чего образуется стабильная структура. Термин циклическое кольцо относится к циклической группе, содержащей 3-10 атомов углерода.- 11010408 Термин защитная группа относится к карбобензилокси (CBZ) или трет-бутилокси карбонилу(ВОС) и т.п. Термин галоген относится к фтор-, хлор-, бром- и иод-радикалам. Частью настоящего изобретения являются фармацевтически приемлемые соли неорганических оснований, таких как Li, Na, K, Ca, Mg, Fe, Cu, Zn, Mn; органических оснований, таких как N,N'диацетилэтилендиамин, глюкамин, триэтиламин, холин, гидроксид, дициклогесиламин, метформин, бензиламин, триалкиламин, тиамин и т.п.; хиральные основания, такие как алкилфениламин, глицинол, фенил глицинол и т.п., соли природных аминокислот, таких как глицин, аланин, валин, лейцин, изолейцин,норлейцин, тирозин, цистин, цистеин, метионин, пролин, гидроксипролин, гистидин, омитин, лизин, аргинин, серин и т.п.; четвертичные соли аммония соединений по настоящему изобретению и алкилгалидов, алкилсульфаты, такие как MeI, (Me)2SO4 и т. п. Неприродные аминокислоты, такие как D-изомеры или замещенные аминокислоты; гуанидин, замещенный гуанидин, в котором заместители выбраны из группы: нитро, амино, алкил, алкенил, алкинил, аммоний или замещенные соли аммония и соли алюминия. Там, где это возможно, соли могут представлять соли присоединения, например: сульфаты, нитраты,фосфаты, перхлораты, бораты, гидрогалиды, ацетаты, тартраты, малеаты, цитраты, сукцинаты, пальмоаты, метансульфонаты, бензоаты, салицилаты, бензосульфонаты, аскорбаты, глицерофосфаты, кетоглутараты и т.п. Фармацевтически приемлемые сольваты могут представлять собой гидраты; или содержать молекулы других растворителей, например спиртов. Еще одним объектом изобретения является способ лечения воспалительных заболеваний и состояний, которые характеризуются или ассоциируются с нежелательными иммунными воспалительными реакциями, а также всех заболеваний и состояний, вызванных избыточной секрецией TNF- и PDE-4,или связанных с ней, включающий введение в организм субъекта терапевтически эффективного количества соединения формулы 1. Еще одним объектом настоящего изобретения является способ лечения воспалительных состояний и иммунных нарушений у субъекта, нуждающегося в лечении, включающий введение в организм названного субъекта терапевтически эффективного количества соединения по формуле 1. Воспалительные заболевания и иммунные нарушения предпочтительно выбирают из группы: астма,бронхиальная астма, хроническое обструктивное легочное заболевание, аллергический ринит, эозинофильная гранулема, нефрит, ревматоидный артрит, кистозный фиброз, хронический бронхит, рассеянный склероз, болезнь Крона, псориаз, крапивная лихорадка, весенний конъюнктивит у взрослых, синдром респироаторного заболевания, ревматоидный спондилит, остеоартрит, подагрический артрит, uteltis, аллергический конъюнктивит, воспалительные заболевания кишечника, язвенный колит, экзема, атопический дерматит и хроническое воспаление. Далее, предпочтительными являются воспалительные состояния аллергической природы. Кроме того, предпочтительными явялются воспалительные состояния и иммунные нарушения, выбранные из группы: воспалительные состояния и иммунные расстройства легких, суставов, глаз, кишечника, кожи и сердца. Далее, предпочтительным является воспалительное состояние выбранное из группы: бронхиальная астма, нефрит и аллергический ринит. Еще одним объектом настоящего изобретения является способ уменьшения воспаления в поврежденном органе или ткани, включающий доставку к названному органу или ткани терапевтически эффективного количества соединения, представленного соединением формулы 1. Еще одним объектом настоящего изобретения является способ лечения заболеваний центральной нервной системы у субъекта, нуждающегося в лечении, включающий введение в организм названного субъекта терапевтически эффективного количества соединения формулы 1. Заболевания центральной нервной системы предпочтительно выбраны из группы: депрессия, амнезия, слабоумие, болезнь Альцгеймера, сердечная недостаточность, шок и цереброваскулярное заболевание. Еще одним объектом изобретения является способ лечения инсулин-резистентного диабета у субъекта, нуждающегося в лечении, включающий введение в организм названного субъекта терапевтически эффективного количества соединения по формуле 1. Термин лечение состояния включает:(1) предотвращение или замедление проявления клинических симптомов положения, нарушения или состояния, развивающихся в организме млекопитающего, возможно находящегося или предрасположенного к нарушению или состоянию, в стадии, когда еще не проявились клинические или субклинические симптомы положения, нарушения или состояния,(2) облегчение положения, нарушения или состояния, т.е. предотвращение или замедление развития заболевания или по меньшей мере одного из его клинических или субклинических симптомов, или(3) облегчение течения заболевания, т.е. появление регрессии положения, нарушения или состояния, или по меньшей мере одного из его клинических и субклинических симптомов. Польза для субъекта, получающего лечение, либо оценивалась статистически как значительная или,- 12010408 по меньшей мере, признавалась таковой пациентом или лечащим врачом. Термин терапевтически эффективное количество обозначает достаточное количество соединения,которое, будучи введенным в организм млекопитающего для лечения положения, нарушения или состояния, поддерживает данное лечение. Терапевтически эффективное количество варьирует в зависимости от соединения, заболевания и его тяжести, а также возраста, веса, физического состояния и реакции организма млекопитающего, получающего лечение. Четырьмя классическими симптомами острого воспаления являются покраснение, повышенная температура, отек и боль в пораженной области, а также нарушение функционирования пораженного органа. Симптомы и признаки воспаления, связанного с определенными состояниями включают: ревматоидный артрит - боль, отечность, повышенная температура и чувствительность в пораженных суставах; общая или утренняя ригидность; инсулинзависимый диабет - mellitus-insulitis; это состояние может приводить к множеству осложнений с воспалительной составляющей, включая: ретинопатию, невропатию, нефропатию; заболевание коронарной артерии, периферическое васкулярное заболевание и цереброваскулярное заболевание; аутоиммунный тироидит - слабость, запор, одышка, отечность лица, рук и ступней, периферический отек, брадикардия; рассеянный склероз - спастичность, нечеткое зрение, головокружение, слабость в конечностях, парестезия; увеальный ретинит - ухудшение ночного зрения, потеря периферического зрения; красная волчанка - боль в суставах, сыпь, светочувствительность, лихорадка, боль в мышцах, отечность рук и ступней, расстройства мочевыделения (гематурия, цилиндурия, протеинурия), гломерулонефрит, когнитивное расстройство, тромбоз сосудов, перикардит; склеродерма - болезнь Райнауда (Raynaud's disease); припухлость кистей рук, верхних и нижних конечностей и лица; утолщение кожи; боль, отеки и припухлость пальцев и коленей, желудочно-кишечное расстройство, рестриктивный легочный процесс; перикардит; почечная недостаточность; другие артритные состояния с воспалительной составляющей, например, ревматоидный спондилит,остеоартрит, септический артрит и полиартрит - лихорадка, боль, отечность, чувствительность; другие воспалительные заболевания мозга, такие как менингит, болезнь Альцгеймера, синдром ассоциированной со СПИД деменции-фотофобии (AIDS dementia encephalitis- photophobia), когнитивное расстройство, потеря памяти; другие воспалительные заболевания глаз, например ретинит - снижение остроты зрения; воспалительные кожные нарушения, например экзема, другие дерматиты (напр., атопический, контактный), псориаз, ожоги от ультрафиолетового излучения (солнечные лучи и другие источники УФизлучения) - эритема, боль, шелушение, отек, чувствительность; воспалительные заболевания кишечника, такие как болезнь Крона, язвенный колит-боль, диаррея,запор, аноректальное кровотечение, лихорадка, артрит; астма - одышка, свистящее дыхание; другие аллергические расстройства, такие как аллергический ринит - чихание, зуд, насморк состояния, связанные с острой травмой, такие как повреждения мозга вследствие ушиба - сенсорные нарушения, моторные нарушения, потеря сознания; повреждение сердечной ткани вследствие миокардиальной ишемии - боль, одышка; поражения легких, подобные возникающим при синдроме респираторного заболевания у взрослых одышка, гипервентиляция, снижение оксигенации, легочные инфильтраты; воспаление, сопровождающее инфекцию, такую как сепсис, септический шок, синдром токсического шока - лихорадка, респираторная недостаточность, тахикардия, гипотензия, лейкоцитоз; другие воспалительные состояния в отдельных органах или тканях, такие как нефрит (напр., гломерулонефрит) - олигурия, нарушение мочевыделения; воспаление аппендикса - лихорадка, боль, чувствительность, лейкоцитоз; подагра - боль, чувствительность, припухлость и покраснение вокруг пораженного сустава, повышение количества сыворотки и/или мочевой кислоты в моче; воспаление желчного пузыря - боль и чувствительность в области живота, тошнота, лихорадка, лейкоцитоз; хроническое обструктивное легочное заболевание - одышка, свистящее дыхание; застойная сердечная недостаточность - одышка, влажные хрипы, периферический отек; диабет II типа - приводит в конце концов к осложнениям во внутренних органах, включая возникновение кардиоваскулярных, глазных, почечных и периферических васкулярных заболеваний; легочный фиброз - гипервентиляция, одышка, снижение оксигенации; васкулярные заболевания, такие как атеросклероз и рестеноз - боль, утрата чувствительности, ослабление пульса, нарушение функции; и аллоиммунитет, приводящий к отторжению трансплантанта - боль, чувствительность, лихорадка. Субклинические симптомы включают без ограничения диагностические маркеры воспаления, появление которых может предшествовать манифестации клинических симтомов. Один класс субклиниче- 13010408 ских симптомов представляют иммунологические симптомы, такие как инвазия или аккумуляция в органе или ткани провоспалительных лимфоидных клеток, или местное или периферическое присутствие активированных провоспалительных лимфоидных клеток, распознающих патоген или антиген специфичный для органа или ткани. Активацию клеток можно измерить способами, известными специалистам в данной области. Доставка терапевтически эффективного количества активного ингредиента в определенное место организма пациента означает создание терапевтически эффективной концентрации активного ингредиента в крови пациента в указанном месте. Этого можно достичь, например, путем местного или системного введения активного ингредиента в организм пациента. Субъект или пациент - термины, относящиеся к млекопитающим животным, предпочтительно к человеку. Некоторые репрезентативные соединения по настоящему изобретению перечислены ниже, но этот список не ограничивает настоящего изобретения: 1) N-(3,5-дихлорпирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид; 2) N-(3,5-дихлорпирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид; 3) N-(пирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид; 4) N-(пирид-4-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид; 5) N-(2-хлорпирид-3-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид; 6) N-(4-фторфенил)-4-метоксидибензо[b,d]фуран-1-карбоксамид; 7) N-(пирид-3-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид; 8) N-(пирид-3-ил)-4-метоксидибензо[b,d]фуран-1-карбоксамид-N1-оксид; 9) N-(3,5-дихлорпирид-4-ил)-4-метокси-8-трифторметиддибензо[b,d]фуран-1-карбоксамид; 10)- 15010408 106) 4-(4-метоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин; 107) 4-(4-циклопентилоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин; 108) 3,5-дихлор-4-(4-циклопентилоксидибензо[b,d]-тиофен-5,5-диоксид-1-илкарбоксамид)пиридинN-оксид; 109) 3,5-дихлор-4-(4-метоксидибензо[b,d]-тиофен-5,5-диоксид-1-илкарбоксамид)пиридин-N-оксид; 110) 3,5-дихлор-4-(4-метоксидибензо[b,d]-тиофен-5,5-диоксид-1-илкарбоксамид) пиридин; 111) 3,5-дихлор-4-(4-дифторметоксидибензо[b,d]-тиофен-1-илкарбоксамид)пиридин; 112) N1-(4-метоксифенил)-4-метоксидибензо[b,d]тиофен-1-сульфонамид; 113) 2-(4-метоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин; 114) 4-(4-этоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин; 115) N1-(4-метоксифенил)-N8,8-диметил-4-метоксидибензо[b,d]тиофен-8,1-дисульфонамид; 116) 3-(4-метоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин; 117) 3,5-дихлор-4-(6-этил-4-метоксидибензо[b,d]-тиофен-1-илкарбоксамид)пиридин; 118) 3,5-дихлор-4-(4-этоксидибензо[b,d]тиофен-1-илкарбоксамид)пиридин; 119) 3-(4-метоксидибензо[b,d]тиофен-5,5-диоксид-1-илкарбоксамид)пиридин. 120) 3,5-дихлор-4-(4-бензилоксидибензо[b,d]-тиофен-1-илкарбоксамид)пиридин. 121) N-(3,5-дихлорпирид-4-ил)-4-дифторметокси-8-(пирролидин-2-он-1-ил)-дибензо[b,d]фуран-1 карбоксамид. Соединения по настоящему изобретению можно получить по следующей методике. Символы Р, Ar,X, Y, R1, R2, R3, R4 и R5, используемые в представленных ниже формулах, представляют группы, описанные выше в пояснении к формуле (1), если не указано иное. Настоящее изобретение описывает способ получения соединений общей формулы (1) В одном из примеров реализации соединения формулы 1, где Y представляет собой -CONR4, можно получить, приведя во взаимодействие кислотный галид или смешанный ангидрид общего промежуточного продукта (полупродукта) формулы 10 (где FG представляет собой СООН) или формулы 11 (полученного из соединения формулы 10, где FG представляет собой алкил, формил, циано, галоген, нитро,амино и т.п. традиционными способами) с соответствующим амином формулы ArNHR4 при стандартных условиях, описанных в литературе. Общий полупродукт формулы 10 и/или формулы 11 можно синтезировать любым способом, описанным в схемах синтеза с I по IV. Полученные целевые содинения формулы 1 впоследствие превращают в их соли и/или N-оксиды, и затем, по желанию, полученные соли соединений формулы 1, преобразуют в свободные соединения. Общая схема синтеза 1 По вышеописанной схеме 1, где Р, X, R1, R2 и R3 имеют описанные выше значения, полупродукт 14- 16010408 можно синтезировать путем приведения во взаимодействие соответствующего замещенного нитробензола формулы 12 (где Z обозначает галоген) с соответствующей замещенной или незамещенной ароматической группой формулы 13 (где FG представляет собой алкил, формил, циано, галоген, нитро, амино,функциональную группу карбоновой кислоты и т.п.) в основной среде. Полупродукт 14 можно восстановить по стандартной схеме восстановления (никель Ранея / гидразин, железо / хлорид аммония, гидрогенизация в присутствии Pd/C, и тому подобное) до аминосоединения формулы 15. Полупродукт 15 можно циклизировать в трициклический полупродукт формулы 10 путем диазосочетания с последующим связыванием по стандартной методике (оксид меди в 0.1N серной кислоте, медь в ДМСО) (диметилсулъфоксид). Если функциональная группа FG в соединении формулы 13 отлична от карбоксильной группы,ее можно преобразовать в карбоновую кислоту на любой стадии процесса синтеза, там где позволяет химизм процесса синтеза. Если в полупродукте формулы 10 FG представляет собой алкил, формил, циано, галоген, нитро, амино, то полупродукт 10 можно превратить в полупродукт формулы 11 традиционными способами, описанными в литературе (например, если FG представляет собой метил, то метальную группу можно окислить до группы карбоновой кислоты с применением магниевых и хромовых реагентов; если FG представляет собой цианогруппу, то цианогруппу можно гидролизовать до карбоновой кислоты; если FG представляет собой бром, его можно преобразовать в карбоновую кислоту путем литиирования, с последующей обработкой двуокисью углерода). Другой способ синтеза полупродукта формулы (10) и/или формулы (11) описан схемой II. Схема II По представленной выше схеме II, где где Р, X, R1, R2 и R3 имеют описанные выше значения, где А представляет собой галоген или -OMs или -OTs (Ms = метансульфониловую группу; Ts = ртолуолсульфониловую группу) или -В(ОН)2, B1 предсталяет собой галоген, G - соответствующую защитную группу (бензилокси карбонил, t-бутилоксикарбонил, изопропил, циклопентил, аллил, ацетил, бензил и т.п.), FG представляет собой алкил, формил, циано, галоген, нитро, амино, группу карбоновой кислоты и т. п., a Z обозначает галоген, предпочтительно бром или иод, полупродукт 18 возможно синтезировать путем связывания ариловой группы формулы 1 с соответствующей замещенной ариловой группой формулы 17 при помощи стандартных методов, изложенных в литературе (ацетат палладия в ДМФ или ледяной уксусной кислоте, никелевый катализатор в пиридине или ДМФ, тетракис-трифенилфосфинпалладий в ДМФ и т.п.). От полупродукта 18 можно убрать защитную группу для получения полупродукта 19, затем циклизировать его в основной среде (соли калия в ДМФ или ДМСО, NaH в DMF илиDMSO и т.п.) до образования трициклического полупродукта формулы 10. Если функциональная группаFG в формуле 17 отлична от карбоксильной группы, ее можно преобразовать в карбоновую кислоту на любой стадии процесса синтеза, там где позволяет химизм процесса синтеза. Если в полупродукте формулы 10 FG представляет собой алкил, формил, циано, галоген, нитро, амино, то полупродукт 10 можно превратить в полупродукт формулы 11 традиционными способами, описанными в литературе (например,если FG представляет собой метил, то метальную группу можно окислить до группы карбоновой кислоты с применением магниевых и хромовых реагентов; если FG представляет собой цианогруппу, то циано-группу можно гидролизовать до карбоновой кислоты; если FG представляет собой бром, его можно преобразовать в карбоновую кислоту путем литиирования, с последующей обработкой двуокисью углерода). Другой способ синтеза полупродукта формулы (10) и/или формулы (11) описан схемой III. Схема III- 17010408 По представленной выше схеме III, где Р, X, R1, R2 и R3 имеют описанные выше значения, где Z обозначает галоген, FG представляет собой алкил, формил, циано, галоген, нитро, амино, карбокисльную группу и т.п., полупродукт 21 можно синтезировать путем взаимодействия галогенциклогексанона формулы 20 с соответствующей замещенной арильной группой формулы 13 в основной среде (соли калия в ДМФ или ДМСО, NaH в ДМФ или ДМСО и т.п.). Полупродукт 21 можно циклизировать в кислой среде(полифосфорная кислота или метансульфоновая кислота) и окислить (Pd/C в дифениловом эфире или дихлорбензоле, DDQ и т.п.) до дибензофурана - полупродукта формулы 3. Заместители R2 можно вводить путем стандартной реакции электрофильного замещения, описанной в литературе, в полупродукт 22 для получения полупродукта формулы 10. Если функциональная группа FG в формуле 13 отлична от карбоксильной группы, ее можно преобразовать в карбоновую кислоту на любой стадии процесса синтеза, там где позволяет химизм процесса синтеза. Если в полупродукте формулы 10 FG представляет собой алкил, формил, циано, галоген, нитро,амино, то полупродукт 10 можно превратить в полупродукт формулы 11 традиционными способами,описанными в литературе (например, если FG представляет собой метил, то метальную группу можно окислить до группы карбоновой кислоты с применением магниевых и хромовых реагентов; если FG представляет собой цианогруппу, то цианогруппу можно гидролизовать до карбоновой кислоты; если FG представляет собой бром, его можно преобразовать в карбоновую кислоту путем литиирования, с последующей обработкой двуокисью углерода). Другой способ синтеза полупродукта формулы (10) и/или формулы (11) описан схемой IV. Схема IV По представленной выше схеме IV, где Р, X, R1, R2 и R3 имеют описанные выше значения, где Z обозначает галоген, FG представляет собой алкил, формил, циано, галоген, нитро, амино, группу карбоновой кислоты и т.п., полупродукт 24 можно синтезировать путем взаимодействия замещенной арильной группы формулы А с соответствующей замещенной арильной группой формулы (13.а) в стандартной основной среде (соли калия в ДМФ или ДМСО, NaH в ДМФ или ДМСО и т.п.). Полупродукт 24 можно циклизировать путем сочетания при стандартных условиях в присутствии палладиевого катализатора(ацетат палладия в ДМФ или ледяной уксусной кислоте, никелевый катализатор в пиридине или ДМФ,тетракис(трифенилфосфин)палладий в ДМФ и т.п.) с дибензофураном, полупродуктом формулы 10. Если функциональная группа FG в формуле 13 отлична от карбоксильной группы, ее можно преобразовать в карбоновую кислоту на любой стадии процесса синтеза, там где позволяет химизм процесса синтеза. Если в полупродукте формулы 10 FG представляет собой алкил, формил, циано, галоген, нитро, амино, то полупродукт 10 можно превратить в полупродукт формулы 11 традиционными способами, описанными в литературе (например, если FG представляет собой метил, то метальную группу можно окислить до группы карбоновой кислоты с применением магниевых и хромовых реагентов; если FG представляет собой цианогруппу, то цианогруппу можно гидролизовать до карбоновой кислоты; если FG представляет собой бром, его можно преобразовать в карбоновую кислоту посредством литиирования, с последующей обработкой двуокисью углерода). Другой способ синтеза полупродукта формулы (10) и/или формулы (11) описан схемой V. Схема V По представленной выше схеме V, где Р, X, R1, R2 и R3 имеют описанные выше значения, FG представляет собой алкил, формил, циано, галоген, нитро, амино, группу карбоновой кислоты и т. п., заместители R2 и/или R3 можно вводить путем стандартной реакции электрофильного замещения на трициклическом полупродукте формулы 25, который можно синтезировать любым из вышеописанных способов- 18010408 по схемам I, II, III или IV для получения желательных обычнх полупродуктов формулы 10 и/или формулы 11. Другой способ синтеза полупродукта формулы (10) и/или формулы (11) описан схемой VI. Схема VI По представленной выше схеме VI, где Р, X, R1, R2 и R3 имеют описанные выше значения, общий полупродукт 11 можно синтезировать формилированием полупродукта 26 стандартным способом формилирования (дихлорметилметиловый сложный эфир в присутствии хлорида олова или хлорида титана,POCl3 в ДМФ, гексаметилентетрамин в TFA и т.п.) с последующим окислением (реактивы магния и хрома, хлорит натрия, перманганат калия и т.п.) альдегидной группы формулы 27 до группы карбоновой кислоты традиционным способом, известным в литературе. Общий полупродукт 11 можно также синтезировать прямо из соединения формулы 26 стандартными способами карбоксилирования (например, последовательным бромированием, литиированием с последующей обработкой диоксидом углерода). В другом примере реализации соединения формулы (1), где Y представляет собой -SO2NR4, можно синтезировать способом, представленным на схеме VII. Схема VII По представленной выше схеме VII, где Р, X, R1, R2 и R3 имеют описанные выше значения, желательные соединения формулы 1 можно получить хлорсульфонированием соединения формулы 26 с использованием хлорсульфоновой кислоты для получения полупродукта формулы 28 с последующим синтезом сульфонамида путем взаимодействиея полупродукта 28 с амином формулы ArNHR4 традиционными способами, например, с применением пиридина или диизопропилэтиламина в THF или дихлорметане и т.п. Полученные желательные соединения формулы (1) затем преобразуют в их соли и/или N-оксиды и,по желанию, полученные соли соединений формулы (1) затем преобразуют в свободные соединения. В еще одном примере реализации соединения формулы (1), где Y представляет собой NR4SO2 можно синтезировать способом, представленным на схеме VIII. Схема VIII По представленной выше схеме VIII, где Р, X, R1, R2, R3 и R4 имеют описанные выше значения, желательные соединения формулы 1 можно получить нитрованием соединения формулы 26 для получения полупродукта формулы 29 с последующим восстановлением (никель Ранея/гидразин, железо/хлорид аммония, гидрогенизирование в присутствии Pd/C и т.п.) нитрогруппы до аминогруппы для получения полупродукта 30 традиционными способами. Полупродукт 30 может взаимодействовать с соответствующим сульфонилхлоридом ArSO2Cl для получения сульфонамида 31, который можно алкилировать с получением делательных соединений формулы 1 традиционными способами (гидрид натрия или карбонат- 19010408 калия в THF (тетрагидрофуран) или ДМФ и т.п.). Сульфонамид 31 является также одним из желательных соединений, где R4 представляет собой водород. Полученные желательные соединения формулы 1 затем преобразуют в их соли и/или N-оксиды и,по желанию, полученные соли соединений формулы 1 далее преобразуют в свободные соединения. В еще одном примере реализации соединения формулы (1), где Y представляет собой -NR4CO,можно синтезировать способом, представленным на схеме IX. Схема IX По представленной выше схеме IX, где Р, X, R1, R2 , R3 и R4 имеют описанные выше значения, желательные соединения формулы 1 можно получить нитрованием соединения формулы 26 азотной кислотой в серной кислоте, нитратом калия в серной кислоте и т.п., до получения полупродукта формулы 29, с последующим восстановлением (никель Ранея/гидразин, железо/хлорид аммония, гидрогенизирование в присутствии Pd/C и т.п.) нитрогруппы до аминогруппы для получения полупродукта 30 традиционными способами. Полупродукт 30 может взаимодействовать с соответствующим кислым хлоридом формулыArCOCl или соответствующим смешанным ангидридом формулы ArCOOCOR5 (R5 представляет собой алкил, циклоалкил, арил, гетероарил, гетероциклил) для получения амида 32, который алкилируют традиционными способами, при этом образуются желательные соединения формулы (1). Амид 32 является также одним из желательных соединений, в котором R4 представляет собой водород. Полученные желательные соединения формулы (1) затем преобразуют в их соли и/или N-оксиды и,по желанию, полученные соли соединений формулы (1) далее преобразуют в свободные соединения. Процесс N-оксидации проводят по методике, знакомой любому специалисту в данной области, например при помощи м-хлорпероксибензойной кислоты в дихлорметане при комнатной температуре. Любому специалисту в данной области известны реакционные условия, необходимые для преведения данного синтеза. Вещества, являющиеся предметом настоящего изобретения, выделяют и очищают способом, известным по сути, например, отгонкой растворителя под вакуумом и перекристаллизацией полученного осадка из соответствующего растворителя; или с помощью традиционных методов очистки, таких как колоночная хроматография с использованием подходящего наполнителя колонки. Соли получают растворением свободного соединения в подходящем растворителе, напр., в хлорированном углеводороде, таком как метиленхлорид или хлороформ, или в алифатическом углеводороде с небольшим молекулярным весом (этанол, изопропанол), содержащим подходящую кислоту или основание, или к которому желательную кислоту или основание добавляют впоследствие. Соли выделяют фильтрованием, перекристаллизовывают, осаждают в среде, которая не является растворителем для соли присоединения или отгоняют растворитель. Полученные соли можно преобразовать путем добавления основания или кислоты в свободные соединения, которые, в свою очередь, можно преобразовать в соли. В общем, эфирные растворители, применяемые в вышеописанных способах приготовления соединений формулы (1), выбраны из группы: диэтиловый эфир, 1,2-диметоксиэтан, тетрагидрофуран, диизопропиловый эфир, 1,4-диоксан и т.п. Хлорсодержащий растворитель, который можно применять в ходе синтеза, выбран из дихлорметана, 1,2-дихлорэтана, хлороформа, четыреххлористого углевода и т.п. Ароматические растворители, которые можно применять, можно выбирать из бензола и толуола. Спиртовые растворители, которые можно применять, можно выбирать из метанола, этанола, н-пропанола,изопропанола, трет-бутанола и т.п. Апротонные растворители которые можно применять, можно выбирать из N,N-диметилформамида, диметилсульфоксида и т.п. В общем, соединения, приготовленные описанными выше способами, получены в чистом виде с применением хорошо известных методик, таких как кристаллизация из таких растворителей как пентан,диэтиловый эфир, изопропиловый эфир, хлороформ, дихлорметан, этилацетет, ацетон, метанол, этанол,изопропанол, вода или их комбинации; или методом колоночной хроматографии на алюмогеле или силикагеле, используя в качестве элюанта такие растворители, как гексан, петролейный эфир, хлороформ,этилацетат, ацетон, метанол или их комбинации. Различные полиморфные модификации соединений общей формулы (1), составляющие часть данного изобретения, можно приготовить путем кристаллизации соединений формулы (1) в различных условиях, например применяя различные растворители, или их смеси, традиционно используемые для пе- 20010408 рекристаллизации; кристаллизация при различных температурах, различные способы охлаждения: от очень быстрого до очень медленного охлаждения в процессе кристаллизации. Полиморфные модификации можно также получить нагреванием или плавлением соединения с последующим постепенным или быстрым охлаждением. Наличие полиморфных модификаций определяют ЯМР-спектроскопией твердого образца, ИК-спектроскопией, методом дифференциальной сканирующей калориметрии, методом дифракции рентгеновских лучей на порошке и другими способами. Настоящее изобретение предлагает новые гетероциклические соединения, их аналоги, таутомеры,региоизомеры, стереоизомеры, энантиомеры, диастереомеры, полиморфные модификации, фармацевтически приемлемые соли, соответствующие N-оксиды и фармацевтически приемлемые сольваты. Настоящее изобретение предлагает также фармацевтические составы, содержащие описанные выше соединения общей формулы (1), их производные, аналоги, таутомерные формы, стереоизомеры, полиморфные модификации, энантиомеры, диастереомеры, фармацевтически приемлемые соли или сольваты вместе с традиционно применямыми в фармацевтике носителями, разбавителями и т.п. Фармацевтические составы по настоящему изобретению применимы для лечения аллергических нарушений. Желательно, чтобы некоторые из описанных выше соединений общей формулы (1) по настоящему изобретению, содержали один или несколько асимметричных замещенных атомов углерода. Наличие одного или нескольких асимметричных центров в соединениях общей формулы (1) делает возможным образование стереоизомеров, включая энантиомеры и диастереоизомеры, а также их смеси, включая рацемические смеси. Соединения по настоящему изобретению могут содержать также геометрические изомеры Е и Z, там где это возможно в соединениях общей формулы (1), включающей единичный изомер или смесь обоих изомеров. Фармацевтические составы могут представлять собой традиционные лекарственные формы, такие как таблетки, капсулы, порошки, сиропы, растворы, суспензии и т.п., возможно, ароматизаторы, подсластители и т.д. вместе с приемлемыми твердыми или жидкими носителями или растворителями, или же стерильные растворы или суспензии, пригодные для инъекций. Активные соединения формулы (1) присутствуют в подобных фармацевтических составах в количествах, достаточных для обеспечения введения желательной дозы в описанных выше формах. Так например, при пероральном введении, соединения формулы (1) можно комбинировать с приемлемыми твердыми или жидкими носителями и разбавителями при изготовлении капсул, таблеток, порошков, сиропов, растворов, суспензий и т.п. Фармацевтические составы могут содержать, по желанию, дополнительные компоненты, такие как ароматизаторы, подсластители, наполнители и т.п. В составах для парентерального введения, соединения формулы (1) можно комбинировать со стерильной водной или органической средой; так изготавливают растворы и суспензии, пригодные для инъекций. Например, растворы на кунжутном или арахисовом масле, водном пропиленгликоле и т.п. используют наряду с водными растворами водорастворимых фармацевтически приемлемых кислых солей или солей, содержащих основания, соединений формулы (1). Приготовленные таким образом растворы для инъекций можно вводить внутривенно, внутрибрюшинно, подкожно или внутримышечно, внутримышечное введение предпочтительно для человека. Соединения также можно вводить в организм путем ингаляции, в случае, если необходимо воздействие на респираторные пути. При респираторной ингаляции особенно важен состав препарата, соединение формулы 1 необходимо вводить в организм в виде аэрозоля под давлением. Предпочтительно диспергировать соединение формулы 1 после гомогенизации, например, в лактозе, глюкозе, высших жирных кислотах, натриевой соли диоктилсульфоянтарной кислоты или, наиболее предпочтительно, в карбоксиметилцеллюлозе, для того, чтобы получить состав, где большинство микрочастиц имеет размеры 5 :m и менее. Для изготовления препарата для ингаляции аэрозоль можно смешать с газом или жидкостью для распыления активного вещества. Можно применять ингалятор, пульверизатор или распылитель. Устройства такого рода известны. См., напр., Newman et al., Thorax, 1985, 4061-676; Berenberg, M., J. AsthmaUSA, 1985, 22:87-92; полностью включено в данное описание посредством ссылки. Можно также применять распылитель Берда (BИKd nebulizer). См. также патенты США 6402733; 6273086; и 6228346, полностью включенные в данное описание посредством ссылки. Соединения структуры 1 для ингаляции предпочтительно получают в виде сухого порошка с тонкоизмельченными частицами. Соединения по настоящему изобретению можно вводить в организм с помощью дозирующего аэрозольного ингалятора способами, изложенными в патенте США 6131566, который полностью включен в данное описание посредством ссылки. Вместе с соединениями формулы (1) фармацевтические составы по настоящему изобретению могут также содержать или вводиться в организм вместе с одним или несколькими лекарствами, выбранными из других терапевтических агентов, применяемых в клинике. Изобретение изложено подробно в примерах, представленных далее; они представляют собой лишь иллюстрации и ни в коей мере не ограничивают настоящего изобретения. При синтезе некоторых типичных представителей соединений согласно настоящему изобретению использовали следующие промежуточные соединения (полупродукты). Полупродукт 1. 3-(2-Нитрофенокси)-4-метоксибензальдегид. К суспензии фторида калия (5,71 г, 0,0985 моль) в безводном ДМСО (20 мл) при перемешивании- 21010408 добавили раствор изованилина (10,0 г, 0,0657 моль) в ДМСО (20 мл). Смесь реагентов нагревали при 140 С в течение 10 мин. Раствор 2-фторнитробензола (9,27 г, 0,0657 моль) в ДМСО (10 мл) добавили к вышеуказанной суспензии и реакционную смесь перемешивали при при 140 С в течение 3,5 ч. Реакционную смесь охладили до комнатной температуры, содержимое вылили в воду (200 мл) и проэкстрагировали этилацетатом (100 мл 3). Органические экстракты объединили и промыли 1 N раствором гидроксида натрия (50 мл 2), водой и солевым раствором, высушили над безводным сульфатом натрия. Осушенный органический слой сконцентрировали под вакуумом до получения продукта в виде бледножелтого твердого вещества (13,6 г). ИК (KBr) 2940, 2842, 2748, 1690, 1602, 1578, 1523, 1509, 1432, 1345, 1285, 1117, 1017, 815, 737 см-1. 1 Н ЯМР (300 МГц, CDCl3)3.91 (s, 3 Н), 6.9 (d, 1H, J= 9.0 Гц), 7.11 (d, 1H, J= 9.0 Гц), 7.2 (t, 1H, J= 7.8 Гц), 7.48 (t, 1H, J= 7.8 Гц), 7.51 (s, 1H), 7.71(dd, 1H, J= 7.8 Гц, 1.8 Гц), 7.95 (d, 1H, J= 7.8 Гц), 9.82 (s, 1H). Полупродукт 2. 3-(2-Нитрофенокси)-4-метоксифенилкарбоновая кислота. К раствору полупродукта 1 (10 г, 0,036 моль) в смеси ацетон-вода в соотношении 4:1 (75 мл) добавили сульфаминовую кислоту (5,32 г, 0,054 моль) при перемешивании при 0 С. Раствор 80% хлорита натрия (3,4 г, 0,045 моль) в воде (15,0 мл) добавляли по каплям к вышеписанной реакционной смеси в течение 10 мин, затем перемешивали дополнительно в течение 30 мин при 0 С. Полученный осадок отфильтровали, промыли водой и высушили на воздухе; при этом получили 12 мг продукта в виде белого твердого вещества. 1 Н ЯМР (300 МГц, CDCl3)3.8 (s, 3 Н), 6.9 (d, 1H, J = 9.0 Гц), 7.28 (t, 1H, J = 9.0 Гц), 7.30 (d, 1H, J= 9.0 Гц), 7.56 (s, 1H), 7.6 (t, 1H, J= 7.2 Гц), 7.85 (d, 1H, J= 8.4 Гц,), 8.02 (d, 1 Н,J=8.4 Гц). Полупродукт 3. 3-(2-Аминофенокси)-4-метоксифенилкарбоновая кислота. К суспензии поупродукта 2 (10 г) в дихлорметане (500 мл) добавили 5% Pd/C (10% вес./вес.) и смесь гидрогенизировали при 2.72 атм (40 фунтах на фут) в течение 3 ч в атмосфере водорода. Катализатор профильтровали на целите. Целитную подложку промыли метанолом. Объединенный фильтрат сконцентрировали под вакуумом до выделения желательного продукта в виде бледно-желтого твердого вещества (8,5 г). ИК (KBr) 3450, 3368, 2925, 1683, 1601, 1578, 1501, 1438, 1307, 1276, 1217, 1017, 788, 761 см-1. 1 Н ЯМР (300 МГц, CDCl3)3.93 (s, 3 Н), 6.63-6.68 (br m, 1 Н), 6.75 (m, 3 Н), 6.91-7.0 (br m, 3H), 7.53(s, 1 H), 7.80 (d, 1H, J= 8.4 Гц). Полупродукт 4. 4-Метоксидибензо[b,d]фуран-1-карбоновая кислота. Суспензию полупродукта 3 (2 г, 0,0077 моль) в смеси концентрированная соляная кислота : вода(1:1) (20 мл) нагрели до 45 С в течение 10 мин, затем охладили до -5 С. По каплям добавили раствор нитрита натрия (630 мг, 0,0092 моль) в воде (5 мл) к вышеописанной суспензии при -5 С. Реакционную смесь перемешивали в течение 30 мин, затем к вышеописанной реакционной смеси добавили раствор фторбората натрия (1,26 мг, 0,0115 моль) и перемешивали в течение 30 мин при -5 С. Фторборатную соль (2,3 мг), полученную в результате, отфильтровали и промыли холодным 5% раствором фторбората натрия, затем высушили на воздухе. Сухую фторборатную соль добавили при перемешивании к суспензии оксида меди (1,76 г, 0,0077 моль) в 0,1 N серной кислоте (600 мл) при 35 С и перемешивали в течение 10 мин. Образовавшийся осадок (2,0 г) отфильтровали, промыли водой, высушили на воздухе и пропустили через хроматографическую колонку с силикагелем с использованием 20% этилацетата в хлороформе в качестве элюента; в результате получили желательный продукт в виде белого твердого вещества(200 мг); т.пл.: 280 С ИК (KBr) 2925, 2853, 1688, 1607, 1512, 1490, 1437, 1277, 1221, 1023 см-1. 1 Н ЯМР (300 МГц, ДМСО)4.05 (s, 3 Н), 7.26 (d,1H,J= 8.7 Гц), 7.40 (t, 1H, J= 7.2 Гц), 7.50 (t, 1H, J= 7.2 Гц), 7.74 (d, 1H, J= 8.1 Гц), 8.01 (d, 1H, J= 8.4 Гц), (8.85 (d, 1H, J= 7.8 Гц). Полупродукт 5. 3-(2-Нитро-4-трифторметилфенокси)-4-метоксибензальдегид. К суспензии фторида калия (457 мг, 7,8 мл) в безводном ДМСО (20 мл) при перемешивании добавили раствор изованилина (1,0 г, 6,57 ммоль) в безводном ДМСО (20 мл). Смесь реагентов нагревали при 140 С в течение 10 мин. Раствор 4-фтор-3-нитробензотрифторида (1,37 г, 6,57 ммоль) в безводном ДМСО (10 мл) добавили к вышеописанной суспензии, затем реакционную смесь перемешивали при 140 С в течение 4 ч. Реакционную смесь охладили до комнатной температуры, затем вылили в воду (200 мл) и проэкстрагировали этилацетатом (100 мл 3). Органические экстракты объединили и промыли 1 N раствором гидроксида натрия (50 мл 2), водой и солевым раствором и высушили над безводным сульфатом натрия. Органический слой сконцентрировали под вакуумом, в результате получили 3-(2-нитро-4 трифторметилфенокси)-4-метоксибензальдегид в виде бледно-желтого твердого вещества (2,0 г). ИК (KBr) 3098, 3031, 2953, 2745, 2649, 1694, 1629, 1606, 1540, 1509, 1439, 1333, 1275, 1158, 1118,1095, 1015, 912, 820 см-1. 1 Н ЯМР (300 МГц, CDCl3)3.86 (s, 3 Н), 7.05 (d, 1H, J= 8.7 Гц), 7.44 (d, 1H, J= 8.7 Гц), 7.77 (s, 1H),7.92 (d, 2H, J= 8.4 Гц), 8.45 (s, 1H), 9.87 (s, 1H). Полупродукт 6. 3-(2-Нитро-4-трифторметилфенокси)-4-метоксифенил карбоновая кислота.- 22010408 К раствору полупродукта 5 (10 г, 0,036 моль) в смеси ацетон-вода в соотношении 4:1 (75 мл) добавили сульфаминовую кислоту (5,32 г, 0,054 моль) при перемешивании при 0 С. Раствор 80% хлорита натрия (3,4 г, 0,045 моль) в воде (15,0 мл) добавляли по каплям к вышеописанной реакционной смеси в течение 10 мин, затем перемешивали дополнительно в течение 30 мин при 0 С. Полученный осадок отфильтровали, промыли водой и высушили на воздухе; при этом получили 12 г продукта в виде белого твердого вещества. ИК (KBr) 3445, 2944, 2568, 1694, 1629, 1609, 1542, 1517, 1442, 1334, 1289, 1133, 1016, 766 см-1. 1= 8.7 Гц, 1.8 Гц), 7.88 (d, 1H, J= 1.8 Гц), 8.04 (dd, 1H, J= 8.4, 1.8 Гц), 8.25 (d, 1H,J=1.8 Гц). Полупродукт 7. 3-(2-Амино-4-трифторметилфенокси)-4-метоксифенил карбоновая кислота. К суспензии полупродукта 6 (10 г) в дихлорметане (500 мл) добавили 5% Pd/C (10 % вес/вес) и смесь гидрогенизировали при 2,72 атм (40 psi) в течение 3 ч в атмосфере водорода. Катализатор профильтровали на целите. Целитную подложку промыли метанолом. Объединенный фильтрат сконцентрировали под вакуумом; в результате получили продукт в виде бледно-желтого твердого вещества (8,5 мг). ИК (KBr) 3452, 3367, 3063, 3006, 2937, 2842, 2545, 1692, 1625, 1611, 1514, 1444, 1334, 1278, 1211,1116, 1023 см-1. 1H ЯМР (300 МГц, ДМСО)3.85 (s, 3 Н), 5.5 (s, 2 Н), 6.6 (d, 1H), 6.8 (d, 1 Н), 7.1 (s, 1H), 7.3 (d, 1H),7.4 (d, 1H), 7.8 (s, 1H). Полупродукт 8. 4-Метокси-8-трифторметилдибензо[b,d]фуран-1-карбоновая кислота. Суспензию полупродукта 7 (2 г, 0,0077 моль) в смеси концентрированная соляная кислота : вода(1:1) (20 мл) нагрели до 45 С за 10 мин, затем охладили до -5 С. Раствор нитрита натрия (630 мг, 0,0092 моль) в воде (5 мл) добавили по каплям к вышеописанной суспензии при -5 С. Реакционную смесь перемешивали в течение 30 мин, затем к вышеописанной реакционной смеси добавили охлажденный раствор фторбората натрия (1,26 г, 0,0115 моль) и перемешивали 30 мин при -5 С. Фторборатную соль (2,3 г),полученную в результате, отфильтровали и промыли холодным 5% раствором фторбората натрия, затем высушили на воздухе. Сухую фторборатную соль добавили при перемешивании к суспензии оксида меди(1,76 г, 0,0077 моль) в 0.1 N серной кислоте (600 мл) при 35 С и перемешивали в течение 10 мин. Образовавшийся осадок (2,0 г) отфильтровали, промыли водой, высушили на воздухе и пропустили через хроматографическую колонку с силикагелем, в качестве элюента использовали 20% раствор этилацетата в хлороформе; в результате: получили желательный продукт в виде белого твердого вещества; синтез проводили по методике, описанной в этапе 4 примера 1 из 3-(2-амино-4-трифторметилфенокси)-4 метоксифенилкарбоновой кислоты. ИК (KBr) 3132, 3024, 2975, 2941, 2916, 2844, 2648, 2546, 1693, 1592, 1575, 1421, 1328, 1278, 1154,1105, 912, 824 см-1. 1H ЯМР (300 МГц, ДМСО)4.1 (s, 3 Н), 7.4 (d, 1H,J= 8.4 Гц), 7.9 (d, 1H, J= 8.7 Гц), 8.0 (d, 1H, J= 8.7 Гц), 8.08 (d, 1H, J= 8.7 Гц), 9.29 (s, 1H). Полупродукт 9. 3-(2-Нитро-4-трифторметилфенокси)-4-дифторметокси бензальдегид. Раствор 4-дифторметокси-3-гидроксибензальдегида (2.0 г, 10.63 ммоль) в ДМСО (5 мл) добавили при перемешивании к суспензии фторида калия (0,740 г, 12,76 ммоль) в безводном ДМСО (10 мл). Раствор 4-фтор-3-нитробензотрифторида (3,22 г, 10,63 ммоль) в ДМСО (5 мл) добавили к вышеописанной суспензии, затем реакционную смесь перемешивали при 160 С в течение 18 ч. Реакционную смесь охладили до комнатной температуры, затем вылили в воду (100 мл) и экстрагировали этилацетатом (25 мл 3). Органические экстракты объединили и промыли 1N раствором гидроксида натрия (25 мл 2), водой и солевым раствором и высушили над безводным сульфатом натрия. Обезвоженный органический слой сконцентрировали под вакуумом; в результате получили продукт в виде бледно-желтого твердого вещества (2,2 г). ИК (KBr) 3092, 2878, 1697, 1629, 1537, 1352, 1331, 1280, 1158, 1134, 1075, 827 см-1. 1H ЯМР (300 ГцМГц, DMSO)7.23 (d, 1H, J= 8.7 Гц), 7.35 (t, 1H, J= 72.6 Гц), 7.63 (d, 1H, J= 8.1 Гц),7.86 (d, 1H, J= 2.1 Гц), 7.93 (dd, 1H, J= 8.4 Гц, 1.8 Гц), 7.99 (dd, 1H, J = 8.7 Гц, 2.4 Гц), 8.48 (d, 1H, J= 2.4 Гц), 9.94 (s, 1H). Полупродукт 10. 3-(2-Нитро-4-трифторметилфенокси)-4-дифторметоксифенил карбоновая кислота. К раствору полупродукта 9 (10 г, 0,036 моль) в смеси ацетон-вода в соотношении 4:1 (75 мл) добавили сульфаминовую кислоту (5,32 г, 0,054 моль) при перемешивании при 0 С. Раствор 80% хлорита натрия (3,4 г, 0,045 моль) в воде (15,0 мл) добавляли по каплям к вышеписанной реакционной смеси в течение 10 мин, затем перемешивали дополнительно в течение 30 мин при 0 С. Полученный осадок отфильтровали, промыли водой и высушили на воздухе; в результате получили 12 г продукта в виде белого твердого вещества. ИК (KBr) 3436, 3095, 2997, 2889, 2665, 2566, 1695, 1633, 1545, 1447, 1379, 1355, 1284, 1270, 1155,1120, 1099, 1063, 917, 765 см-1. 1 Н ЯМР (300 МГц, DMSO)6.60 (t, 1H, J= 72.6 Гц), 6.96 (d, 1H, J= 8.7 Гц), 7.44 (d, 1H, J= 8.7 Гц),7.55 (dd, 1H, J = 9.0 Гц, 1.8 Гц), 7.86 (d, 1H, J= 2.1 Гц), 8.04 (dd, 1H, J= 8.4 Гц, 2.4 Гц), 8.27 (d, 1H, J= 1.8- 23010408 Гц). Полупродукт 11. 3-(2-Aмино-4-трифторметилфенокси)-4-дифторметоксифенил карбоновая кислота. К суспензии полупродукта 10 (10 г) в дихлорметане (500 мл) добавили 5% Pd/C (10% вес./вес.) и смесь гидрогенизировали при 2.72 атм в течение 3 ч в атмосфере водорода. Катализатор профильтровали на целите. Целитную подложку промыли метанолом. Объединенный фильтрат сконцентрировали под вакуумом; в результате получили продукт в виде бледно-желтого твердого вещества (8,5 г). ИК (KBr) 3377, 2926, 1702, 1627, 1582, 1515, 1447, 1419, 1335, 1276, 1198, 1116, 1064, 813, 786 см-1. Полупродукт 12. 4-Дифторметокси-8-трифторметилдибензо[b,d]фуран-1-карбоновая кислота. Суспензию полупродукта 11 (2 г, 0,0077 моль) в смеси концентрированная соляная кислота : вода(1:1) (20 мл) нагрели до 45 С за 10 мин, затем охладили до -5 С. Раствор нитрита натрия (630 мг, 0,0092 моль) в воде (5 мл) добавили по каплям к вышеописанной суспензии при -5 С. Реакционную смесь перемешивали в течение 30 мин, затем к вышеописанной реакционной смеси добавили охлажденный раствор фторбората натрия (1,26 г, 0,0115 моль) и перемешивали 30 мин при -5 С. Фторборатную соль (2,3 г),полученную в результате, отфильтровали и промыли холодным 5% раствором фторбората натрия, затем высушили на воздухе. Сухую фторборатную соль добавили при перемешивании к суспензии оксида меди(1,76 г, 0,0077 моль) в 0.1 N серной кислоте (600 мл) при 35 С и перемешивали в течение 10 мин. Образовавшийся осадок (2,0 г) отфильтровали, промыли водой, высушили на воздухе и пропустили через хроматографическую колонку с силикагелем, в качестве элюента использовали 20% раствор этилацетата в хлороформе; в результате получили целевой продукт в виде белого твердого вещества (200 мг); т.пл.: 280 С. ИК (KBr) 3020, 2928, 2855, 1698, 1513, 1422, 1326, 1273, 1215, 1066, 757, 669 см-1. 1 Н ЯМР (300 МГц, ДМСО)6.57 (t, 1H, J= 72.6 Гц) 7.03 (d, 1H,J= 8.4 Гц), 7.58 (d, 1H, J = 8.7 Гц),7.93 (dd, 1H, J= 8.4 Гц, 2.1 Гц), 8.18 (d, 1 Н, J= 8.4 Гц), 9.25 (s, 1H). Полупродукт 13. 3-(2-Нитрофенокси)-4-дифторметоксибензальдегид. К суспензии фторида калия (372 мг, 6,4 ммоль) в безводном ДМСО (10 мл) добавили раствор 3 гидрокси-4-дифторметоксибензальдегида (1,0 г, 5,3 ммоль) в ДМСО (10 мл). Смесь реагентов нагревали в течение 10 мин при температуре 140 С. К вышеописанной суспензии добавили раствор 2 фторнитробензола (747 мг, 5,3 ммоль) в ДМСО (5 мл), затем реакционную смесь перемешивали при 140 С в течение 3,5 ч. Реакционную смесь охладили до комнатной температуры, затем вылили в воду(100 мл) и проэкстрагировали этилацетатом (25 мл 3). Органические экстракты объединили и промыли 1 N раствором гидроксида натрия (25 мл 2), водой и солевым раствором и высушили над безводным сульфатом натрия. Обезвоженный органический слой сконцентрировали под вакуумом; в результате получили 3-(2-нитрофенокси)-4-дифторметокси бензальдегид в виде бледно-желтого твердого вещества(1,4 г). ИК (KBr) 2916, 1692, 1616, 1530, 1446, 1350, 1283, 1112, 1063, 845, 737 см-1. Полупродукт 14. 3-(2-Нитрофенокси)-4-дифторметоксифенилкарбоновая кислота. К раствору полупродукта 13 (10 г, 0,036 моль) в смеси ацетон-вода в соотношении 4:1 (75 мл) добавили сульфаминовую кислоту (5,32 г, 0,054 моль) при перемешивании при 0 С. Раствор 80% хлорита натрия (3,4 г, 0,045 моль) в воде (15,0 мл) добавляли по каплям к вышеписанной реакционной смеси в течение 10 мин, затем перемешивали дополнительно в течение 30 мин при 0 С. Полученный осадок отфильтровали, промыли водой и высушили на воздухе; в результате получили 12 г продукта в виде белого твердого вещества. 1(d, 1H, J= 9.0 Гц), 7.55 (t, 1H, J= 7.2 Гц), 7.65 (d, 1H, J=1.8 Гц), 7.90 (d, 1H, J= 9.0 Гц,), 8.01 (d, 1H, J= 8.1 Гц). Полупродукт 15. 3-(2-Ааминофенокси)-4-дифторметоксифенил карбоновая кислота. К суспензии полупродукта 14 (10 г) в дихлорметане (500 мл) добавили 5% Pd/C (10% вес./вес.) и смесь гидрогенизировали при 2,72 атм в течение 3 ч в атмосфере водорода. Катализатор профильтровали на целите. Целитную подложку промыли метанолом. Объединенный фильтрат сконцентрировали под вакуумом; в результате получили желательный продукт. ИК (KBr) 3367, 2925, 1624, 1579, 1501, 1481, 1384, 1272, 1196, 1170, 1052, 785 см-1. Полупродукт 16. 4-Дифторметокси дибензо[b,d]фуран-1-карбоновая кислота. Суспензию полупродукта 15 (2 г, 0,0077 моль) в смеси концентрированная соляная кислота : вода(1:1) (20 мл) нагрели до 45 С за 10 мин, затем охладили до -5 С. Раствор нитрита натрия (630 мг, 0,0092 моль) в воде (5 мл) добавили по каплям к вышеописанной суспензии при -5 С. Реакционную смесь перемешивали в течение 30 мин, затем к вышеописанной реакционной смеси добавили охлажденный раствор фторбората натрия (1,26 г, 0,0115 моль) и перемешивали 30 мин при -5 С. Фторборатную соль (2,3 г),полученную в результате, отфильтровали и промыли холодным 5% раствором фторбората натрия, затем высушили на воздухе. Сухую фторборатную соль добавили при перемешивании к суспензии оксида меди(1,76 г, 0,0077 моль) в 0,1 N серной кислоте (600 мл) при 35 С и перемешивали в течение 10 мин. Образовавшийся осадок (2,0 г) отфильтровали, промыли водой, высушили на воздухе и пропустили через- 24010408 хроматографическую колонку с силикагелем, в качестве элюента использовали 20% раствор этилацетата в хлороформе; в результате получили желательный продукт. 1H ЯМР (300 МГц, CDCl3)1.57-1.72 (m, 2H), 1.84-1.89 (m, 2H), 1.93-2.04 (m, 4H), 5.01 (квинтет, 1 Н), 6.97 (d, J= 8.1 Гц, 1H), 7.22 (t, J= 7.9 Гц, 1H), 7.30 (t, J= 8.1 Гц, 1H), 7.45 (t, J=8.1 Гц, 1H), 7.51 (d, J= 7.8 Гц, 1H), 7.60 (d, J = 8.2 Гц, 1H), 7.89 (d, J= 8.1 Гц, 1H). Полупродукт 18. 4-Циклопентокси дибензо[b,d]фуран-1-карбальдегид. При взаимодействии 4-циклопентилоксидибензо[b,d]фурана (1,0 г, 3,96 ммоль) с дихлорметилметиловым сложным эфиром (456 мг, 3,96 ммоль) в присутствии хлорида олова(IV) (1,55 г, 5,95 ммоль) образовалось 350 мг (31,5%) продукта в виде белого твердого вещества, т.пл. С; ИК (KBr): 2960, 2730, 1686, 1565, 1276, 1099 см-1. 1 Н ЯМР (300 МГц, CDCl3)1.64-1.75 (m, 2H), 1.85-1.98 (m, 2H), 2.03-2.09 (m, 4H), 5.11 (квинтет,1 Н), 7.07 (d, J= 8.2 Гц, 1H), 7.38 (t, J= 7.9 Гц, 1H), 7.52 (t, J= 7.8 Гц, 1H), 7.63 (d, J= 8.4 Гц, 1H), 7.77 (d, J= 8.2 Гц, 1H), 8.95 (d, J= 8.4 Гц, 1H), 10.17 (s, 1H). Полупродукт 19. 4-Гидроксидибензо[b,d]фуран-1-карбальдегид. Полупродукт 18 нагревали в HBr (30-33%) в ледяной уксусной кислоте (25 мл) при 50 С в течение 7-8 ч. Реакционную смесь вылили в ледяную воду и проэкстрагировали этилацетатом. Органический слой промыли насыщенным раствором бикарбоната натрия, проэкстрагировали 10% раствором гидроксида натрия (325 мл). Водный слой подкислили конц. HCl; в результате образовался белый осадок,который отфильтровали и высушили на воздухе; был получен неочищенный продукт (3,2 г) в виде белого твердого вещества. Полупродукт 20. 4-Циклопропилметоксидибензо[b,d]фуран-1-карбальдегид. Полупродукт 19 (500 мг, 2,358 ммоль) растворили в безводном ДМФ (5 мл). Безводный карбонат калия (650 мг, 4,716 ммоль) добавили к вышеописанному раствору и перемешивали в течение 10 мин при 80 С. Далее добавили циклопропилметилбромид (500 мг, 3,537 ммоль) и реакционную смесь перемешивали в течение 1 ч. Реакционную смесь охладили до комнатной температуры, разбавили водой (100 мл) и проэкстрагировали этилацетатом (350 мл). Органический экстракт промыли водой (50 мл) и солевым раствором (25 мл); высушили над безводным сульфатом натрия. После удаления растворителя получили продукт в виде белого твердого вещества (550 мг). ИК (KBr) 3110, 2890, 2865, 1642, 1567, 1478, 1444, 1358, 1278, 1267, 1206, 1038, 842, 657 см-1 1(d, 1H, J= 8.4 Гц),7.44 (t, 1H, J=7.2 Гц),7.62 (t,1H, J= 8.1 Гц),7.83 (d, 1H, J= 8.4 Гц), 68.1 (d, 1H, J= 8.4 Гц),8.8.(d, 1H, J= 7.2 Гц),10.15 (s, 1H). Полупродукт 21. 4-Циклопропилметоксидибензо[b,d]фуран-1-карбоновая кислота. К раствору полупродукта 20 (500 мг, 1,879 ммоль) в смеси ацетон-вода в соотношении 2:1 (20 мл) добавили сульфаминовую кислоту (280 мг, 2,818 ммоль) при перемешивании при 0 С. Раствор 80% хлорита натрия (200 мг, 2,215 моль) в воде (5,0 мл) добавляли по каплям к вышеписанной реакционной смеси в течение 10 мин, затем перемешивали дополнительно в течение 5 ч при комнатной температуре. Реакционную смесь разбавили водой (200 мл) и проэкстрагировали этилацетатом (3100 мл). Органический экстракт промыли водой (100 мл) и солевым раствором (50 мл); высушили над безводным сульфатом натрия. Органический растворитель выпарили, при этом образовалось 500 мг продукта в виде белого твердого вещества. ИК (KBr) 3108, 2885, 2867, 1652, 1558, 1469, 1441, 1349, 1282, 1271, 1204, 1032, 845, 655 см-1. 1(d, 1H, J=7.5 Гц). Полупродукт 22. 4-Изопропилоксидибензо[b,d]фуран-1-карбальдегид. Полупродукт 19 (500 мг, 2,358 ммоль) растворили в безводном ДМФ (5 мл). Безводный карбонат калия (650 мг, 4,716 ммоль) добавили к вышеописанному раствору и перемешивали в течение 10 мин при 80 С. К данной смеси добавили изопропилбромид (431 мг, 3,537 ммоль) и перемешивали в течение 4 ч. Реакционную смесь охладили до комнатной температуры, разбавили водой (100 мл) и проэкстрагировали этилацетатом (350 мл). Органический экстракт промыли водой (50 мл) и солевым раствором (25 мл); высушили над безводным сульфатом натрия. Удалили растворитель; в результате получили продукт в виде белого твердого вещества (600 мг). Полупродукт 23. 4-Изопропилоксидибензо[b,d]фуран-1-карбоновая кислота.- 25010408 К раствору полупродукта 22 (600 мг, 2,35 ммоль) в смеси ацетон-вода в соотношении 2:1 (20 мл) добавили сульфаминовую кислоту (348 мг, 3,52 ммоль) при перемешивании при 0 С. Раствор 80% хлорита натрия (232 мг, 2,58 моль) в воде (5,0 мл) добавляли по каплям к вышеписанной реакционной смеси в течение 10 мин, затем перемешивали дополнительно в течение 2 ч при комнатной температуре. Органический экстракт промыли водой (100 мл) и солевым раствором (50 мл); высушили над безводным сульфатом натрия. После отгонки растворителя получили продукт в виде белого твердого вещества (600 мг). Полупродукт 24. 4-Бензилоксидибензо[b,d]фуран-1-карбальдегид. Полупродукт 19 (1 г, 5,10 ммоль) растворили в безводном ДМФ (10 мл). Безводный карбонат калия(1,05 г, 7,65 ммоль) добавили к вышеназванному раствору и перемешивали в течение 10 мин при 80 С. К данной смеси добавили бензилбромид (0,87 г, 5,10 ммоль) и перемешивали в течение 2 ч. Реакционную смесь охладили до комнатной температуры, разбавили водой (100 мл) и проэкстрагировали этилацетатом(350 мл). Органический экстракт промыли водой (50 мл) и солевым раствором (25 мл); высушили над безводным сульфатом натрия. После удаления растворителя получили продукт в виде коричневого твердого вещества (1,4 г). Полупродукт 25. 4-Бензилоксидибензо[b,d]фуран-1-карбоновая кислота. К раствору полупродукта 24 (1,4 г, 4,89 ммоль) в смеси ацетон-вода в соотношении 2:1 (22 мл) добавили сульфаминовую кислоту (711 мг, 7,33 ммоль) при перемешивании при 0 С. Раствор 80% хлорита натрия (550 мг, 6,11 моль) в воде (5,0 мл) добавляли по каплям к вышеписанной реакционной смеси в течение 10 мин, затем перемешивали дополнительно в течение 2 ч при комнатной температуре. Реакционную смесь разбавили водой (200 мл) и проэкстрагировали этилацетатом (3100 мл). Органический экстракт промыли водой (100 мл) и солевым раствором (50 мл); высушили над безводным сульфатом натрия. После отгонки растворителя получили продукт в виде желтого твердого вещества (1,0 г). Полупродукт 26. 2-Бромизованилин. Изованилин (5 г, 0,033 моль) растворили в ледяной уксусной кислоте (30 мл). Безводный ацетат натрия (5, 4 г) добавили к вышеназванному раствору; затем добавили порошок железа (0,15 г). Затем провели продувку системы азотом. Раствор брома (5,79 г, 0,0362 моль) в ледяной уксусной кислоте (10 мл) добавляли при перемешивании к вышеназванной суспензии при 105 С в течение 15 мин. Реакционную смесь охладили и перемешивали при комнатной температуре в течение 45 мин. Реакционную смесь вылили в 2% водный раствор бисульфита натрия (200 мл) и перемешивали в течение 10 мин. Осадок отфильтровали, промыли водой (100 мл) и высушили; в результате получили 3,5 г 2-бромизованилина в виде белого порошка, т.пл.: (200-202 С). ИК (KBr) 3233, 2990, 2891, 2844, 1669, 1593, 1564, 1494, 1463, 1286, 1238, 1205, 1019, 987, 805, 786 см-1. 1 Н ЯМР (300 МГц, CDCl3)3.99 (s, 3 Н), 6.13 (s, 1H), 6.89 (d, 1H, J = 8.4 Гц), 7.55 (d, 1H, J= 8.4 Гц),10.23 (s, 1H). Полупродукт 27. 2-Бром-3-(n-нитрофенокси)-4-метоксибензальдегид. К суспензии фторида калия (1,89 г, 0,0326 ммоль) в безводном ДМСО (10 мл) добавили раствор полупродукта 26 (5,0 г, 0,0260 моль) в ДМСО (10 мл). Раствор 4-фторнитробензола (5,0 г, 0,0260 моль) в ДМСО (5 мл) добавили к вышеназванной суспензии; затем реакционную смесь перемешивали в течение 4 ч при температуре 140 С. Реакционную смесь охладили до комнатной температуры, затем смесь вылили в воду (150 мл) и проэкстрагировали этилацетатом (3100 мл). Органические экстракты объединили,промыли 1 N гидроксидом натрия (25 мл 2), водой (100 мл) и солевым раствором (50 мл); высушили над безводным сульфатом натрия. Обезвоженный органический слой сконцентрировали под вакуумом и очистили остаток колоночной хроматографией на силикагеле, используя 20% этилацетат-петролейный эфир в качестве элюента; в результате получили 2-бром-3-(n-нитрофенокси)-4-метоксибензальдегид в виде бледно-желтого твердого вещества (5,0 г), т.пл.: 132-140 С. ИК (KBr) 3084, 2874, 1689, 1584, 1506, 1486, 1348, 1285, 1253, 1234, 1114, 1025, 848, 815, 747 см-1. 1 Н ЯМР (300 МГц, CDCl3)3.86 (s, 3 Н), 6.89 (d, 2H, J= 7.2 Гц), 7.07 (d, 1H, J= 9.0 Гц), 7.92 (d, 1H, J= 8.4 Гц), 8.17 (d, 2H, J = 9.0 Гц), 10.24 (s, 1H). Полупродукт 28. 4-Метокси-8-нитро-1-формилдибензо[b,d]фуран. Полупродукт 26 (3,5 г, 0,0087 моль), безводный карбонат натрия (1,125 г, 0,0106 моль) и ацетат палладия (II) (0,19 г, 0,0008 моль) в диметилацетамиде (15 мл) нагревали и перемешивали в атмосфере азота в течение 2 ч при 170 С. К охлажденной реакционной смеси добавили воду (90 мл). Твердый осадок отфильтровали, промыли 5% соляной кислотой, затем водой. В результате получили продукт в виде желтого твердого вещества (3,4 г). ИК (KBr) 3115, 2925, 2856, 1682, 1609, 1576, 1522, 1343, 1295, 1076, 846, 829 см-1. 1H ЯМР (300 МГц, ДМСО)4.13 (s, 3H), 7.53 (d, 1H, J= 9.0 Гц), 8.01 (d, 1H, J= 9.0 Гц), 8.16 (d, 1H,J= 9.0 Гц), 8.48 (dd, 1H, J= 9.0 Гц, 3.0 Гц), 9.79 (d, 1H, J= 3.0 Гц), 10.1 (s, 1H). Полупродукт 29. 4-Метокси-8-нитродибензо[b,d]фуран-1-карбоновая кислота. Полупродукт 29 (1,1 г, 0,0034 моль) в ацетоне (5 мл) нагревали до 60-70 С в течение 10 мин. К вы- 26010408 шеназванной суспензии в течение 10 мин по каплям добавляли горячий раствор перманганата калия (1,07 г, 0,0068 моль) в смеси вода:ацетон (1:3) (15 мл). Реакционную смесь нагревали до 60-70 С в течение 10 мин, затем охладили до комнатной температуры и отфильтровали. Осадок промыли ацетоном, фильтрат проэкстрагировали 10% раствором гидроксида натрия. После подкисления, последующей фильтрации и промывки осадка получили 4-метокси-8-нитродибензо[b,d]фуран-1-карбоновую кислоту (0,6 г) в виде белого твердого вещества; т.пл.: 178 С (разлож.). ИК (KBr) 3467, 2942, 1711, 1694, 1633, 1610, 1574, 1522, 1453, 1417, 1344, 1278, 1069, 846, 826, 743 см-1. 1 Н ЯМР (300 МГц, ДМСО)4.08 (s, 3H), 7.36 (d, 1H, J= 8.4 Гц), 7.98 (d, 1H, J= 9.0 Гц), 8.07 (d, 1H,J= 8.4 Гц), 8.44 (dd, 1H, J= 9.0 Гц, 2.7 Гц), 9.79 (d, 1H, J= 2.4 Гц). Полупродукт 30. 4-Метокси-8-аминодибензо[b,d]фуран-1-карбоновая кислота. К суспензии полупродукта 29 (1,05 г, 3,105 ммоль) в метаноле (20 мл) добавили активированный никель Ранея (300 мг, 30% вес./вес.) и нагревали с обратным холодильником в течение 1 ч. Гидразин гидрат (0,77 г, 15,5 ммоль) добавляли медленно к вышеназванной суспензии в течение 30 мин. Реакционную смесь нагревали с обратным холодильником при перемешивании в течение 30 мин. После испарения метанола к осадку добавили водный раствор аммиака (25-28%) до получения прозрачного раствора. Взвесь никеля Ранея отфильтровали, фильтрат подкислили, в результате получили продукт реакции в виде белого твердого вещества (700 мг), т.пл.: 264-273 С. ИК (KBr): 3391, 2938, 1709, 1608, 1581, 1495, 1451, 1396, 1278, 1183, 933, 786, 634 см-1. 1 Н ЯМР (300 МГц, ДМСО)4.01 (s, 3H), 6.81 (d, 1H, J = 8.1 Гц), 7.14 (d, 1H), 7.35 (d, 1H, J = 8.1),7.84 (d, 1H), 8.1 (s, 1H). Полупродукт 31. 4-Метокси-8-хлордибензо[b,d]фуран-1-карбоновая кислота. Полупродукт 29 (350 мг, 1,13 ммоль), в виде суспензии в смеси концентрированная соляная кислота: вода (1:1) (5 мл), перемешивали в течении 30 мин при 50 С. Суспензию охладили до 0 С; раствор нитрита натрия (83 мг, 1,2 ммоль) в воде (2 мл) добавляли по каплям в течение 15 мин. Реакционную смесь перемешивали в течение 90 мин при 0-5 С, затем эту суспензию добавили к предварительно охлажденному раствору CuCl (123 мг, 1.24 ммоль) в концентрированной HCl (5 мл). Реакционная смесь остывала до комнатной температуры, затем ее нагревали до 80-90 С в течение 2 ч. Затем реакционную смесь вылили в воду (100 мл) и осадок отфильтровали, а затем очистили колоночной хроматографией с использованием в качестве элюента 20 % этилацетат-хлороформа; в результате получили 250 мг продукта в виде белого твердого вещества; т.пл.: 264-276 С. ИК (KBr): 3432, 2924, 2853, 1739, 1687, 1601, 1571, 1416, 1292, 1259, 1107, 1017, 907, 810, 630 см-1. 1 Н ЯМР (300 МГц, ДМСО)4.05 (s, 3 Н), 7.29 (d, 1H, J= 8.7 Гц), 7.64 (d, 1H, J = 8.7 Гц), 7.80 (d, 1H, J= 8.7 Гц), 8.01 (d, 1H, J= 9.0 Гц), 8.88 (s, 1H), 13.16 (s, 1H). Полупродукт 32. 4-Метокси-8-бромдибензо[b,d]фуран-1-карбоновая кислота. Полупродукт 30 (500 мг, 1,62 ммоль) в виде суспензии в смеси концентрированная соляная кислота: вода (1:1) (5 мл), перемешивали в течении 30 мин при 50 С. Суспензию охладили до 0 С; раствор нитрита натрия (83 мг, 1,2 ммоль) в воде (2 мл) добавляли по каплям в течение 15 мин. Реакционную смесь перемешивали в течение 90 мин при 0-5 С, затем охлажденный раствор фторбората натрия (25 мг, 1,62 ммоль) в воде (4 мл) добавили к вышеназванной суспензии и перемешивали в течение 30 мин. Твердый осадок быстро отфильтровали и промыли 5% раствором фторбората натрия. Из высушенного под вакуумом твердого осадка (400 мг) получили суспензию в 47% HBr (5 мл) и добавили бромид меди CuBr (512 мг, 1.78 ммоль). Реакционную смесь нагревали в течение 2 ч приблизительно до 80-90 С, затем ее вылили в воду (100 мл). Образовавшийся твердый осадок отфильтровали, промыли водой, высушили под вакуумом, а затем очистили колоночной хроматографией с использованием 20% этилацетат хлороформа в качестве элюента; в результате получили 120 мг продукта в виде белого твердого вещества, т.пл.: 275 С(разлож.). ИК (KBr): 3069, 2957, 2924, 2853, 1685, 1598, 1414, 1384, 1292, 1259, 1104, 1056, 978, 808, 728, 628 см-1. 1 Н ЯМР (300 МГц, ДМСО)4.06 (s, 3 Н), 7.29 (d, 1 Н, J = 8.7 Гц), 7.74 (m, 2 Н), 8.02 (d, 1H, J = 8.7 Гц), 9.04 (s, 1H). Полупродукт 33. 4-Метокси-8-иоддибензо[b,d]фуран-1-карбоновая кислота. Суспензию полупродукта 30 (500 мг, 1,62 ммоль) в смеси концентрированная соляная кислота : вода (1:1) (5 мл) перемешивали в течение 30 мин при 50 С. Суспензию охладили до 0 С и по каплям в течение 15 мин добавляли раствор нитрита натрия (118 мг, 1,72 ммоль) в воде (2 мл). Реакционную смесь перемешивали в течение 90 мин при температуре 0-5 С; затем охлажденный раствор фторбората натрия(25 мг, 1,62 ммоль) в воде (4 мл) добавили к данной суспензии и перемешивали в течение 30 мин. Осадок быстро отфильтровали и промыли 5% раствором фторбората натрия. Твердый осадок, высушенный под вакуумом (400 мг), в виде суспензии в растворе иодида калия (400 мг, 2,23 экв) в воде (25 мл). Реакционную смесь нагревали в течение 2 ч приблизительно до 80-90 С, затем разбавили водой (100 мл) и проэкстрагировали этилацетатом. После испарения этилацетета оставшийся неочищенный твердый осадок очи- 27010408 стили колоночной хроматографией с использованием 20% этилацетат-хлороформа в качестве элюента; в результате получили 320 мг продукта в виде белого твердого вещества; т.пл.: 249 С. ИК (KBr): 3079, 2973, 2934, 2856, 1686, 1628, 1595, 1571, 1412, 1291, 1209, 1104, 892, 722, 628 см-1 1H ЯМР (300 МГц, ДМСО)3.97 (s, ЗН), 7.09 (d, 1H, J= 8.4 Гц), 7.47 (d, 1H, J= 9.0 Гц), 7.72 (d, 1H,J= 8.7 Гц), 7.80 (d, 1H, J= 8.4 Гц), 9.66 (s, 1H). Полупродукт 34. 4-(2-Нитрофенокси)-3-метоксибензальдегид. К суспензии фторида калия (2,3 г, 0,0395 моль) в безводном ДМСО (15 мл) при перемешивании добавили раствор ванилина (5,0 г, 0,0329 моль) в ДМСО (15 мл). Раствор 2-фторнитробензола (4,63 г, 0,0329 моль) в ДМСО (15 мл) добавили к данной суспензии и перемешивали реакционную смесь в течение 3,5 ч при 140 С. Реакционную смесь охладили до комнатной температуры и вылили в воду (300 мл), затем проэкстрагировали этилацетатом (100 мл 3). Органические экстракты объединили и промыли 1 N раствором гидроксида натрия (50 мл 2), водой и соляным раствором; затем высушили над безводным сульфатом натрия. Осушенный органический слой сконцентрировали под вакуумом; в результате получили продукт в виде бледно-желтого твердого вещества (7,15 г); т.пл.: 70-77 С. ИК (KBr) 3064, 2982, 2821, 1692, 1588, 1531, 1355, 1238, 1161, 1024, 863, 778 см-1. 1 Н ЯМР (300 МГц, CDCl3)3.91 (s, 3 Н), 6.97 (d, 1H, J= 8.4 Гц), 7.03 (d, 1H, J= 7.8 Гц), 7.25 (t, 1H, J= 8.1 Гц), 7.43 (d, 1H, J= 7.8 Гц), 7.52 (t, 1H, J = 7.8 Гц), 8.0 (d, 1 H, J= 7.8 Гц), 9.90 (s, 1H). Полупродукт 35. 4-(2-Нитрофенокси)-3-метоксифенил карбоновая кислота. К раствору полупродукта 34 (7,15 г, 0,0262 моль) в ацетоне (60 мл) добавили сульфаминовую кислоту (3,81 г, 0,0393 моль) при перемешивании при 0 С. Раствор 80% хлорита натрия (3,31 г, 0,0366 моль) в воде (15,0 мл) добавляли по каплям к вышеписанной реакционной смеси в течение 10 мин, затем перемешивали дополнительно в течение 30 мин при комнатной температуре. Реакционную смесь разбавили водой (120 мл) и проэкстрагировали этилацетатом (3100 мл). Органический экстракт разбавили водой (100 мл) и перемешивали в течение 30 мин. Полученный осадок отфильтровали, промыли водой и высушили на воздухе; в результате получили 7,0 г продукта в виде белого твердого вещества, т.пл.: 153155 С. ИК (KBr): 3084, 2901, 2655, 1699, 1593, 1531, 1425, 1301, 1228, 1027, 876, 760 см-1. 1 Н ЯМР (300 МГц, CDCl3)3.89 (s, 3 Н), 6.95 (d, 1H, J= 8.4 Гц), 6.99 (d, 1H, J= 8.7 Гц). 7.25 (t, 1H, J= 8.4 Гц), 7.50 (t, 1H, J= 7.8 Гц), 7.70-7.73 (m, 2H), 7.99 (d, 1H, J= 7.8 Гц). Полупродукт 36. 4-(2-Аминофенокси)-3-метоксифенил карбоновая кислота. К суспензии полупродукта 35 (7,0 г) в дихлорметане (500 мл) 5% Pd/C (10% вес./вес.) и смесь гидрогенизировали при 2,72 атм в течение 3 ч в атмосфере водорода. Катализатор профильтровали на целите. Целитную подложку промыли метанолом. Объединенный фильтрат сконцентрировали под вакуумом; в результате получили желательный продукт в виде белого твердого вещества (5,68 г); т.пл.: 192-194 С. ИК (KBr) 3391, 3285, 2914, 2587, 1705, 1590, 1501, 1458, 1276, 1205, 1113, 1029, 836, 750 см-1. 1 Н ЯМР (300 МГц, CDCl3)3.98 (s, 3 Н), 6.71-6.77 (br m, 2H), 6.82 (d, 1H, J = 7.8 Гц), 6.89 (d, 1H, J= 7.8 Гц), 7.02 (t, 1H, J= 7.8 Гц), 7.62 (d, 1H, J= 7.8 Гц), 7.67 (s, 1H). Полупродукт 37. 4-Метоксидибензо[b,d]фуран-2-карбоновая кислота. Суспензию полупродукта 36 (5,1 г, 0,0197 моль) в смеси концентрированная соляная кислота : вода(1:1) (50 мл) нагревали в течение 30 мин до 45 С, охладили до -5 С. Раствор нитрита натрия (1,628 г,0,0236 моль) в воде (5 мл) добавили по каплям к вышеназванной суспензии при -5 С. Реакционную смесь перемешивали в течение 30 мин, затем к указанной смеси добавили охлажденный раствор фторбората натрия (3,43 г, 0,0315 моль) и перемешивали при температуре -5 С в течение 30 мин. Фторборатную соль(2,3 мг), полученную в результате, отфильтровали и промыли холодным 5% раствором фторбората натрия, затем высушили на воздухе. Сухую фторборатную соль добавили при перемешивании к суспензии оксида меди (5,63 г, 0,0394 моль) в 0,1 N серной кислоте (1800 мл) при 35 С и перемешивали в течение 15 мин. Образовавшийся осадок отфильтровали, промыли водой, высушили на воздухе и пропустили через хроматографическую колонку с силикагелем, в качестве элюента использовали 5% метанол в хлороформе; в результате получили желательный продукт в виде белого твердого вещества (700 мг); т.пл.: 229-240 С. ИК (KBr): 3066, 2919, 2850, 2590, 1686, 1588, 1413, 1348, 1276, 1195, 1037, 835, 760, 744 см-1. 1 Н ЯМР (300 МГц, ДМСО)4.06 (s, 3 Н), 7.45 (t, 1H, J= 7.2 Гц), 7.59 (t, 1H, J= 7.2 Гц), 7.68 (s, 1H),7.78 (d, 1H, J= 8.1 Гц), 8.27 (d, 1H, J= 7.2 Гц), 13.07 (br s, 1H). Полупродукт 38. 4-Метоксидибензо[b,d]фуран. Раствор дибензо[b,d]фуран-4-ола (5 г, 27.1 ммоль) в ДМФ (5 мл) добавили при перемешивании охлажденной (0 С) суспензии 60% гидрида натрия (1,62 г, 40,62 ммоль) в ДМФ (20). Смесь перемешивали при 0 С в течение 5 мин и добавляли по каплям метилиодид (7,71 г, 54,34 ммоль) в течение 10 мин. Охлаждающую ванну удалили и смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь разбавили ледяной водой (100 мл) и проэкстрагировали EtOAc (3 х 50 мл). Объединенные органические экстракты промыли водой (2100 мл), солевым раствором (100 мл) и безводным (Na2SO4).- 28010408 После испарения растворителя полученный продукт очистили колоночной хроматографией на силикагеле с применением в качестве элюента 5% этилацетат в петролейном эфире; в результате получили 5,1 г(95%) продукта в виде низкоплавкого твердого вещества, т.пл.: 45-47 С. ИК (KBr) 3053, 2968, 2838, 1451, 1272, 1196, 1095 см-1; 1 Н ЯМР (300 МГц, CDCl3)4.06 (s, 3 Н), 6.98 (d, J= 8.5 Гц, 1 Н), 7.26 (t, J= 8.2 Гц, 1H), 7.33 (t, J= 8.2 Гц, 1H), 7.45 (t, J= 8.2 Гц, 1H), 7.54 (d, J= 8.4 Гц, 1H), 7.60 (d, J= 8.5 Гц, 1H), 7.93 (d, J=8.4 Гц, 1H). Полупродукт 39. 1-Нитро-4-метоксидибензо[b,d]фуран. Полупродукт 38 (1,0 г, 5 ммоль) растворили в ледяной уксусной кислоте (15 мл); затем добавляли концентрированную азотную кислоту (10 мл) при 20-25 С в течение 10 мин. Реакционную смесь перемешивали в течение 2 ч, затем вылили в холодную воду (200 мл). Образовавшийся твердый осадок желтого цвета отфильтровали и промыли 5% раствором бикарбоната натрия, затем очистили на силикагелевой колонке, используя в качестве элюента 5% этилацетат в петролейном эфире, в результате получили 600 мг чистого продукта; т.пл.: 130-132 С. ИК (KBr): 3086, 2926, 1631, 1588, 1571, 1513, 1448, 1321, 1300, 1280, 1209, 1129, 1096, 1008, 987,814, 742 см-1. 1 Н ЯМР (300 МГц, ДМСО)4.12 (s, 3 Н), 7.38 (d, 1H, J= 8.7 Гц), 7.53 (t, 1H, J= 7.8 Гц), 7.69 (t, 1H, J= 7.8 Гц), 7.84 (d, 1H,J= 8.1 Гц), 8.32 (d, 1H, J= 9.0 Гц), 8.56 (d, 1H, J= 9.0 Гц). Полупродукт 40. 1-Амино-4-метоксидибензо[b,d]фуран. К полупродукту 38 (550 мг, 2,26 ммоль) в метаноле (10 мл) добавили никелевый катализатор Ранея(100 мг, 18% вес./вес.). Реакционную смесь нагревали с обратным холодильником, затем к ней медленно добавляли в течение 10 мин раствор (99%) гидразин гидрата (2 мл). Нагревание с обратным холодильником продолжали в течение 2 ч. Катализатор отфильтровали, фильтрат сконцентрировали и разбавили водой (100 мл), затем проэкстрагировали этилацетатом (325 мл). Органический слой промыли водой и сконцентрировали; в результате образовался продукт в виде коричневого твердого вещества (500 мг); т.пл.: 167-169 С. 1H ЯМР (300 МГц, ДМСО)3.84 (s, 3 Н), 5.37 (s, 2H), 6.50 (d, 1H, J= 9.0 Гц), 6.90 (d, 1H, J= 9.0 Гц),7.32 (t, 1H, J= 6.0 Гц), 7.40 (t, 1H, J= 6.0 Гц), 7.61 (d, 1H, J= 7.5 Гц), 8.20 (d, 1H,J=7.8 Гц). Полупродукт 41. 4-Этоксикарбометоксидибензо[b,d]фуран-1-карбальдегид. Полупродукт 19 (500 мг, 2,358 ммоль) растворили в безводном ДМФ (5 мл). Безводный карбонат калия (650 мг, 4,716 ммоль) добавили к вышеназванному раствору, затем раствор перемешивали в течение 10 мин при 80 С. К смеси добавили этилбромоацетат (2,0 экв), затем перемешивали ее в течение 1 ч. Затем реакционную смесь охладили до комнатной температуры, разбавили водой (100 мл) и проэкстрагировали этилацетатом (350 мл). Органический экстракт промыли водой (50 мл) и солевым раствором(25 мл) и высушили над безводным сульфатом натрия. После удаления растворителя получили продукт в виде белого твердого вещества (550 мг). Полупродукт 42. 4-Этоксикарбометоксидибензо[b,d]фуран-1-карбоновая кислота. К раствору полупродукта 41 (500 мг) в смеси ацетон-вода в соотношении 2:1 (20 мл) добавили сульфаминовую кислоту (280 мг, 2,818 ммоль) при перемешивании при 0 С. Раствор 80% хлорита натрия(200 мг, 2,215 ммоль) в воде (5 мл) добавляли по каплям в течение 10 мин, затем перемешивали при комнатной температуре дополнительно в течение 5 ч. Реакционную смесь разбавили водой (200 мл) и проэкстрагировали этилацетатом (3100 мл). Органический экстракт промыли водой (100 мл) и солевым раствором (50 мл) и высушили над безводным сульфатом натрия. После испарения органического растворителя получили продукт в виде белого твердого вещества. Полупродукт 43. 4-Метоксидибензо[b,d]фуран-3-карбальдегид. Полупродукт 38 (3,7 г, 0,0186 моль) растворили в дихлорметане (30 мл) и охладили раствор до 0 С. Хлорид олова (IV) (8,3 г, 0,0317 моль) добавили в один прием к вышеназванному раствору, затем по каплям добавили 1,1-дихлорметилметиловый эфир (2,2 г, 0,0186 моль). Реакционную смесь перемешали и на 1 ч оставили охлаждаться при комнатной температуре, затем охладили на ледяной бане и остановили реакцию добавлением ледяной воды (25 мл) с интенсивным перемешиванием с последующей экстракцией хлороформом (2100 мл). Слой, содержащий хлороформ, промыли водой (350 мл) и высушили над безводным сульфатом натрия. После удаления растворителя под вакуумом получили неочищенный продукт в виде белесого твердого вещества (3,4 г), которое представляло собой смесь 4 метоксидибензо[b,d]фуран-1-карбальдегида и 4-метоксидибензо[b,d]фуран-3-карбальдегида (80:20). Изомеры разделили на хроматографической колонке с силикагелем с использованием в качестве элюента 20% этилацетата в петролейном эфире; в результате получили 4-метоксидибензо[d,d]фуран-3 карбальдегид в виде белого твердого вещества (500 мг); т.пл.: 178-180 С. ИК (KBr): 2925, 2847, 1660, 1626, 1597, 1453, 1395, 1255, 1199, 1092, 1005, 820, 754 см-1. 1 Н ЯМР (300 МГц, ДМСО)4.36 (s, 3 Н), 7.46 (t, 1H, J = 7.2 Гц), 7.63 (t, 1H, J= 7.2 Гц), 7.71 (d, 1H,J= 9.0 Гц), 7.81 (d, 1H, J= 9.0 Гц), 7.92 (d, 1H, J= 7.8 Гц), 8.23 (d, 1H, J= 7.8 Гц), 10.41 (s, 1H). Полупродукт 44. 4-Метоксидибензо[b,d]фуран-3-карбоновая кислота. К раствору полупродукта 43 (250 мг, 1,106 ммоль) в смеси ацетон-вода в соотношении 2:1 (15 мл)- 29010408 добавили сульфаминовую кислоту (130 мг, 1,327 ммоль) при перемешивании при температуре 0 С. Раствор 80% хлорита натрия (150 мг, 1,659 ммоль) в воде (5 мл) добавляли по каплям в течение 10 мин, затем перемешивали при комнатной температуре дополнительно в течение 1 ч. Реакционную смесь разбавили водой (100 мл) и проэкстрагировали этилацетатом (325 мл). Органический экстракт промыли водой (50 мл) и солевым раствором (50 мл) и высушили над безводным сульфатом натрия. После отгонки органического растворителя получили 200 мг продукта в виде белого твердого вещества, т.пл.: 208209 С. ИК (KBr): 2940, 2830, 2692, 1677, 1632, 1598, 1574, 1442, 1414, 1301, 1198, 1091, 1001, 937, 780, 746 см-1. 1= 8.4 Гц), 7.77 (d, 1H, J= 7.8 Гц), 7.88 (d, 1H, J= 8.4 Гц), 8.18 (d, 1H, J= 8.4 Гц). Полупродукт 45. 4-Циклопентокси-3-гидроксибензальдегид. Суспензию 3,4-дигидроксибензальдегида (5,0 г, 0,0362 моль), безводного карбоната калия (6,0 г,0,0434 моль) и циклопентилбромида (6,5 г, 0,0434 моль) в безводном ДМФ (50 мл) нагрели и перемешивали в течение 24 ч при 80 С. Затем реакционную смесь охладили и разбавили водой (500 мл), подкислили 1 N HCl и проэкстрагировали этилацетатом (3100 мл). Экстракт этилацетат промыли 5% раствором бикарбоната натрия и волевым раствором и высушили над безводным сульфатом натрия. Осушенный экстракт сконцентрировали, в результате образовался осадок, который очистили хроматографией на колонке, заполненной силикагелем, с использованием 10% этилацетата в петролейном эфире в качестве элюента, в результате получили 5,0 г названного продукта в виде белого твердого вещества, т.пл.: 8789 С. ИК (KBr) 2964, 1670, 1605, 1580, 1500, 1463, 1358, 1271, 1122, 976, 806, 748 см-1. 1 Н ЯМР (300 МГц, CDCl3)1.65-2.04 (m, 8 Н), 4.93 (m, 1H), 5.83 (s, 1 Н), 6.94 (d, 1H), 7.38-7.43 (m,2 Н), 9.82 (s, 1H). Полупродукт 46. 2-Бром-4-циклопентокси-3-гидроксибензальдегид. Полупродукт 45 (1,0 г, 4,84 ммоль) растворили в ледяной уксусной кислоте (20 мл). Безводный ацетат натрия (0,8 г, 9,7 ммоль) добавили к вышеназванному раствору, после чего добавли порошок железа(0,22 г). Затем провели продувку системы азотом. Раствор брома (0,854 г, 5,32 ммоль) в ледяной уксусной кислоте (10 мл) в течение 45 мин добавляли при перемешивании к вышеназванной суспензии при температуре 15 С. Реакционную смесь вылили в 2% водный раствор бисульфита натрия (100 мл) и перемешивали в течение 10 мин. Осадок отфильтровали, промыли водой (100 мл), высушили, в результате получили 800 мг 2-бром-4-циклопентокси-3-гидрокси-бензальдегид в виде белого порошка, т.пл.: 107109 С. 1 Н ЯМР (300 МГц, CDCl3)1.66-2.03 (m, 8H), 4.92 (m, 1H), 6.15 (s, 1H), 6.90 (d, 1H), 7.54 (d, 1H),10.25 (s, 1H). Полупродукт 47. 2-Бром-4-циклопентокси-3-(n-нитрофенокси)бензальдегид. К суспензии фторида калия (125 мг, 2,104 ммоль) в безводном ДМСО (2,5 мл) при перемешивании добавили раствор полупродукта 46 (500 мг, 1,754 ммоль) в безводном ДМСО (2,5 мл). Раствор 4 фторнитробензола (500 мг, 2,631 ммоль) в ДМСО (2,5 мл) добавили к вышеописанной суспензии и перемешивали реакционуую смесь при 140 С в течение 6 ч. Реакционную смесь охладили до комнатной температуры и вылили в воду (100 мл) и проэкстрагировали этилацетатом (50 мл 3). Органические экстракты объединили и промыли 1 N раствором гидроксида натрия (25 мл 2), водой и солевым раствором и высушили над безводным сульфатом натрия. Осушенный органический слой сконцентрировали под вакуумом, в результате получили 2-бром-3-(n-нитрофенокси)-4-метоксибензальдегид в виде бледножелтого твердого вещества (500 мг), т.пл.: 115-117 С. 1 Н ЯМР (300 МГц, CDCl3)1.18-1.23 (m, 2H), 1.39-1.53 (m, 4H), 1.73-1.81 (m, 2H), 5.01 (m, 1H), 7.09(dd, 2H), 7.43 (d, 1H), 7.87 (d, 1H), 8.24 (dd, 2H), 10.13 (s, 1H). Полупродукт 48. 4-Циклопентокси-8-нитро-1-формилдибензо[b,d]фуран. Полупродукт 47 (500 мг, 1,09 ммоль), безводный карбонат натрия (150 мг, 1,325 ммоль) и ацетат палладия(II) (25 мг, 0,096 ммоль) в диметилформамиде (10 мл) нагревали при перемешивании в атмосфере азота при 130 С в течение 7 ч. К охлажденной реакционной смеси добавили воду (90 мл) и провели экстракцию этилацетатом (2 х 25 мл). Объединенный органический слой промыли 5% соляной кислотой,затем водой и высушили над безводным сульфатом натрия; в результате получили продукт в виде желтого твердого вещества (200 мг), т.пл.: 230-240 С. 1 Н ЯМР (300 МГц, ДМСО)1.70 (m, 2H), 1.77-1.92 (m, 4H), 2.09 (m, 2H), 5.25 (m, 1H), 7.53 (d, 1H),8.05 (d, 1H), 8.14 (d, 1H), 8.51 (d, 1H), 9.80 (s, 1H), 10.14 (s, 1H). Полупродукт 49. 4-Гидрокси-8-нитро-1-формилдибензо[b,d]фуран. Полупродукт 48 (200 мг, 0,530 моль) нагревали в HBr (47% в уксусной кислоте) (5 мл) в ледяной уксусной кислоте (10 мл) при 50 С в течение 7-8 ч. Реакционную смесь вылили в ледяную воду (200 мл) и проэкстрагировали этилацетатом (350 мл). Объединенные органические слои промыли насыщенным раствором бикарбоната натрия, затем водой и высушили над безводным сульфатом натрия. После удале- 30
МПК / Метки
МПК: A61P 37/00, C07D 333/76, C07D 405/14, A61K 31/403, C07D 307/91, A61K 31/381, C07D 409/12, C07D 209/88, C07D 405/12, C07D 401/12, A61K 31/34
Метки: лечения, нарушений, способы, составы, аллергических, приготовления, фармацевтические, содержащие, трициклические, воспалительных, соединения
Код ссылки
<a href="https://eas.patents.su/30-10408-triciklicheskie-soedineniya-dlya-lecheniya-vospalitelnyh-i-allergicheskih-narushenijj-sposoby-ih-prigotovleniya-i-soderzhashhie-ih-farmacevticheskie-sostavy.html" rel="bookmark" title="База патентов Евразийского Союза">Трициклические соединения для лечения воспалительных и аллергических нарушений, способы их приготовления и содержащие их фармацевтические составы</a>
Предыдущий патент: Фармацевтические препараты для проникновения через полунепроницаемые барьеры и для неинвазивного введения лекарственных средств in vivo
Следующий патент: Применение декстрансульфата для ингибирования немедленной воспалительной реакции, опосредованной кровью
Случайный патент: Способ изготовления электропроводящего рисунка


































