Новые пептиды, которые связываются с рецептором эритропоэтина
Номер патента: 10095
Опубликовано: 30.06.2008
Авторы: Земеде Гемет Х., Тумелти Дэвид, Хольмез Кристофер П., Шац Петер Дж., Лалонде Гай, Иин Кан, Палани Балу
Формула / Реферат
1. Соединение, которое связывается с рецептором к эритропоэтину (EPO-R, ЭПО-рецептор) и активирует его и которое содержит гомодимер пептидного мономера, который выбран из группы, включающей:
(a) (AcG)CLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1);
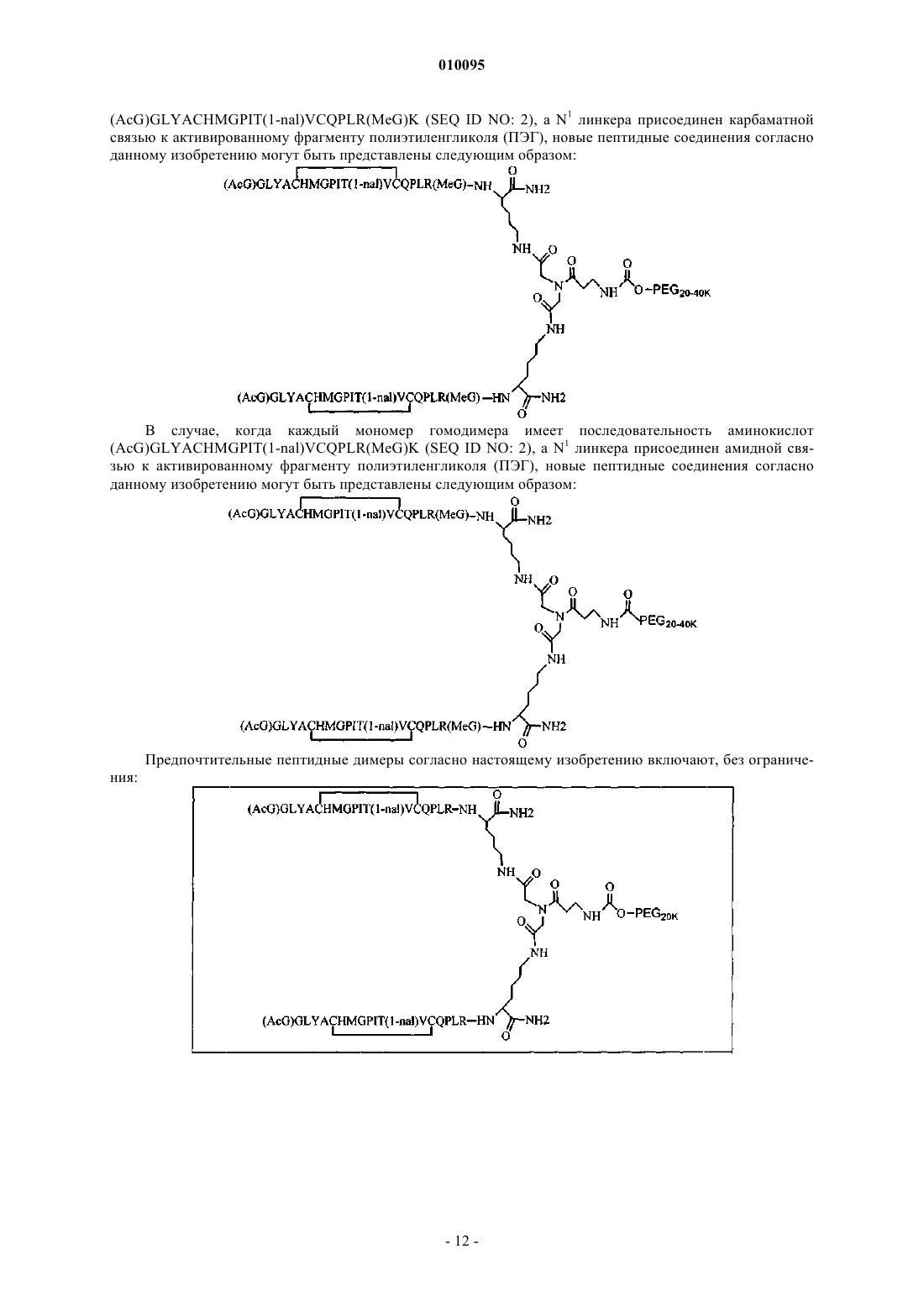
(b) (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2) и
(c) (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) (SEQ ID NO: 3),
где
(i) в каждом пептидном мономере пептидного димера каждая аминокислота обозначена стандартной однобуквенной аббревиатурой, AcG обозначает N-ацетилглицин, a 1-nal обозначает 1-нафтил-аланин;
(ii) каждый пептидный мономер пептидного димера содержит внутримолекулярную дисульфидную связь между двумя остатками цистеина (С) каждого мономера;
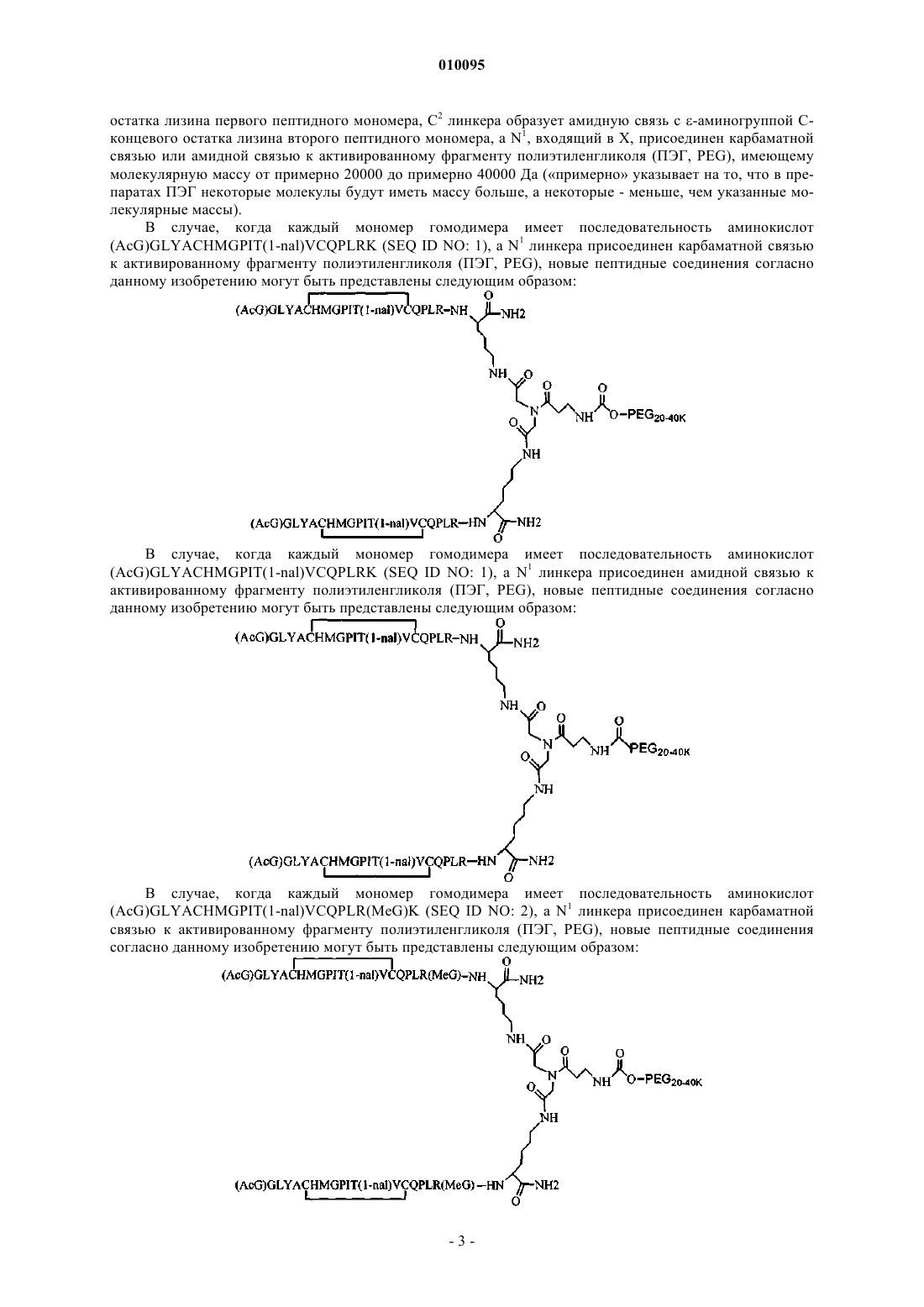
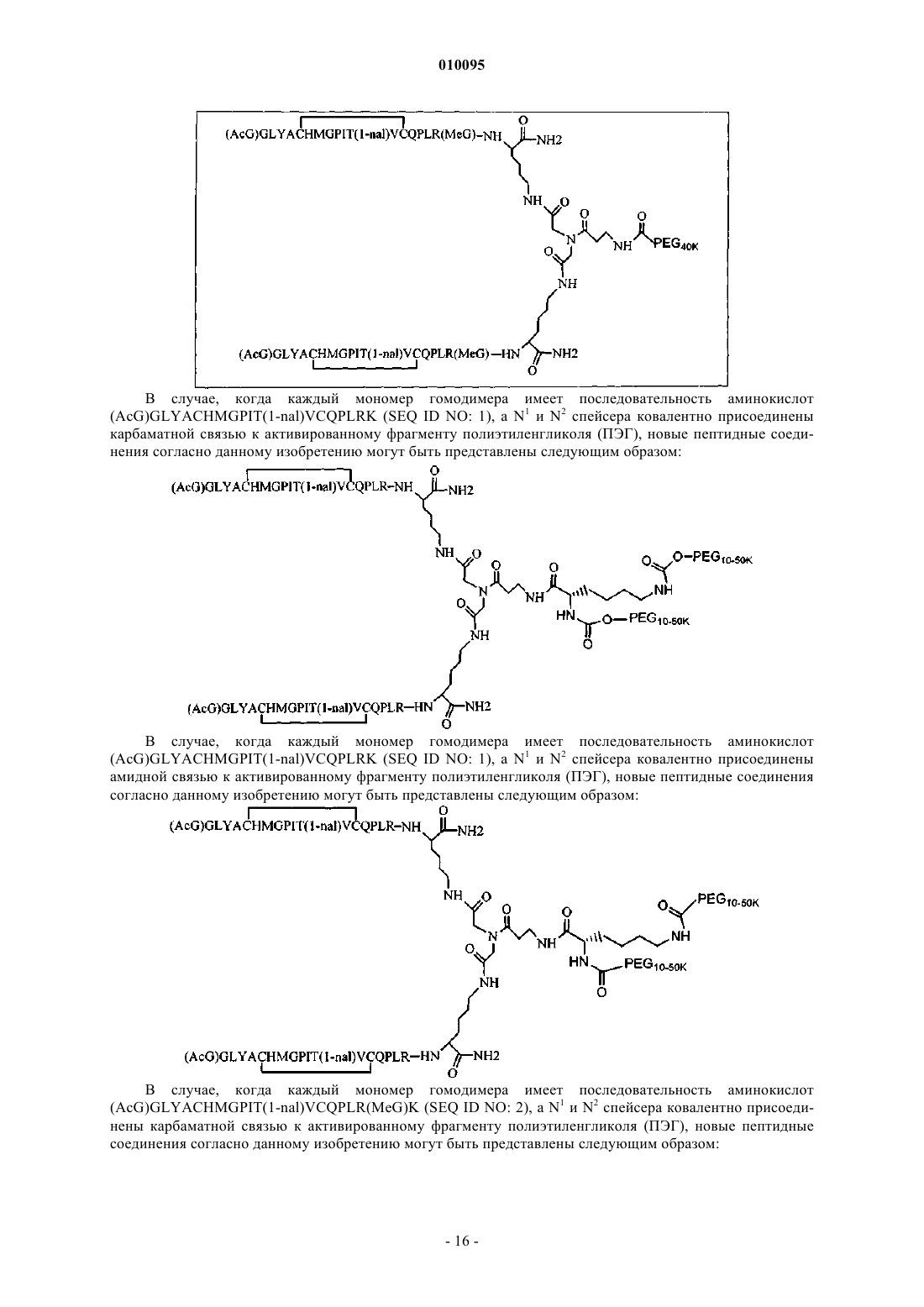
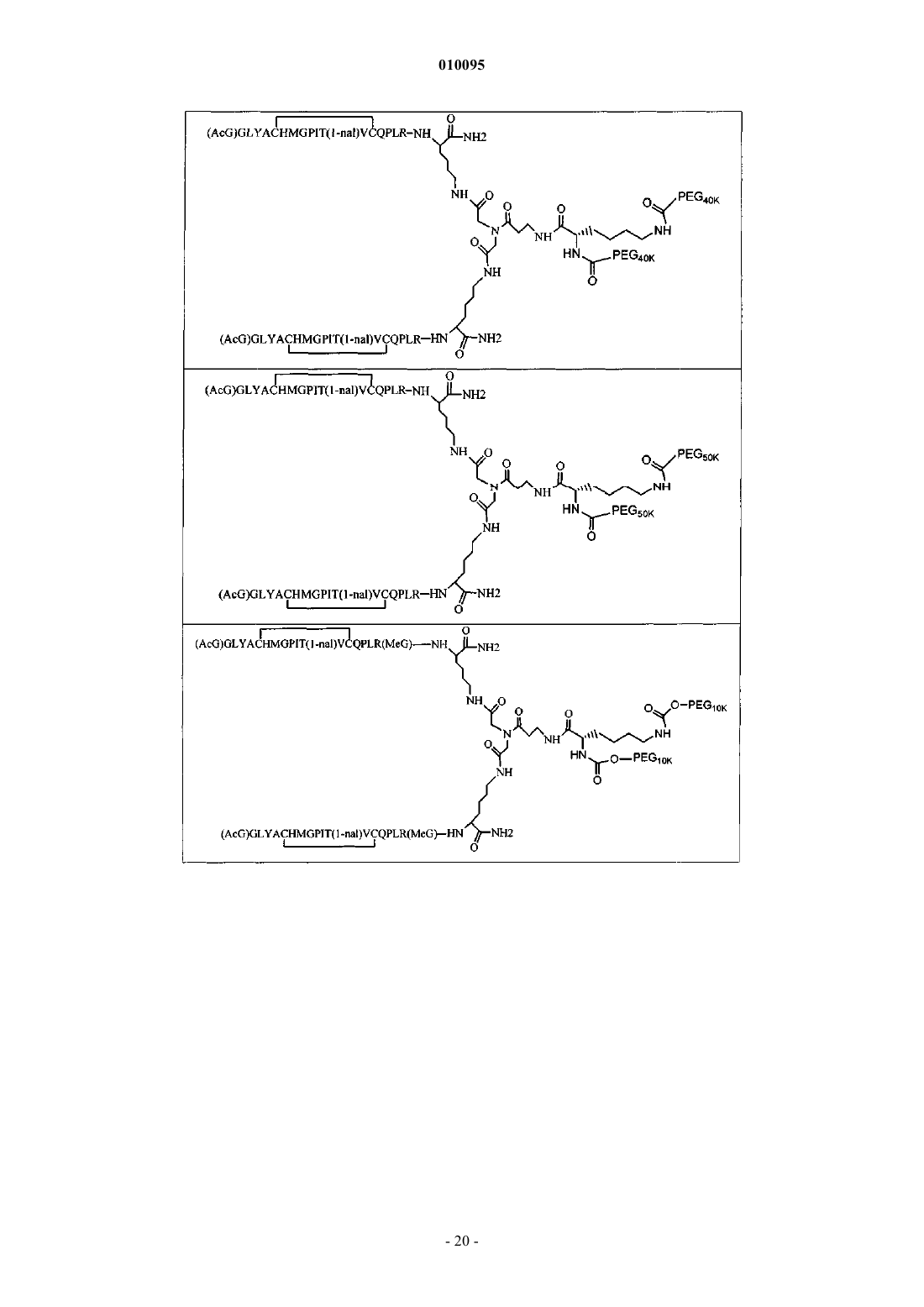
и где дополнительно указанные пептидные мономеры димеризованы путем ковалентной связи С-концевого остатка каждого мономера с линкером, и указанный линкер ковалентно соединен по меньшей мере с одним лизином и неразветвленным ПЭГ.
2. Соединение по п.1, которое содержит пептидный димер, имеющий формулу
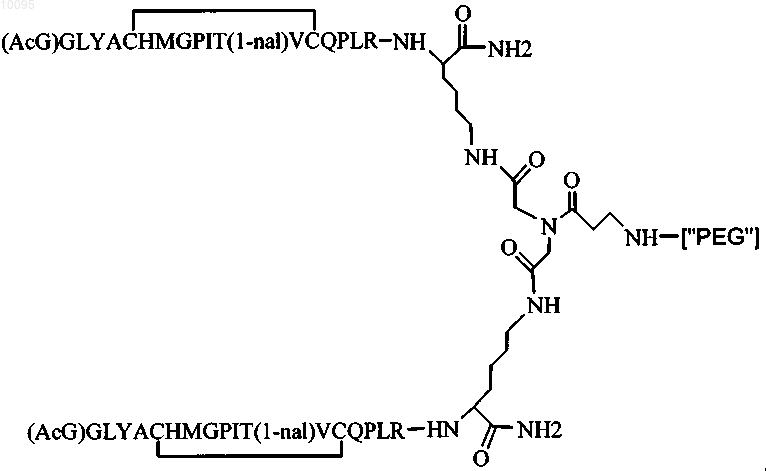
где ["PEG"] содержит по меньшей мере один линейный фрагмент полиэтиленгликоля (PEG, ПЭГ), причем каждый фрагмент ПЭГ имеет молекулярную массу примерно от 20000 до 40000 Да.
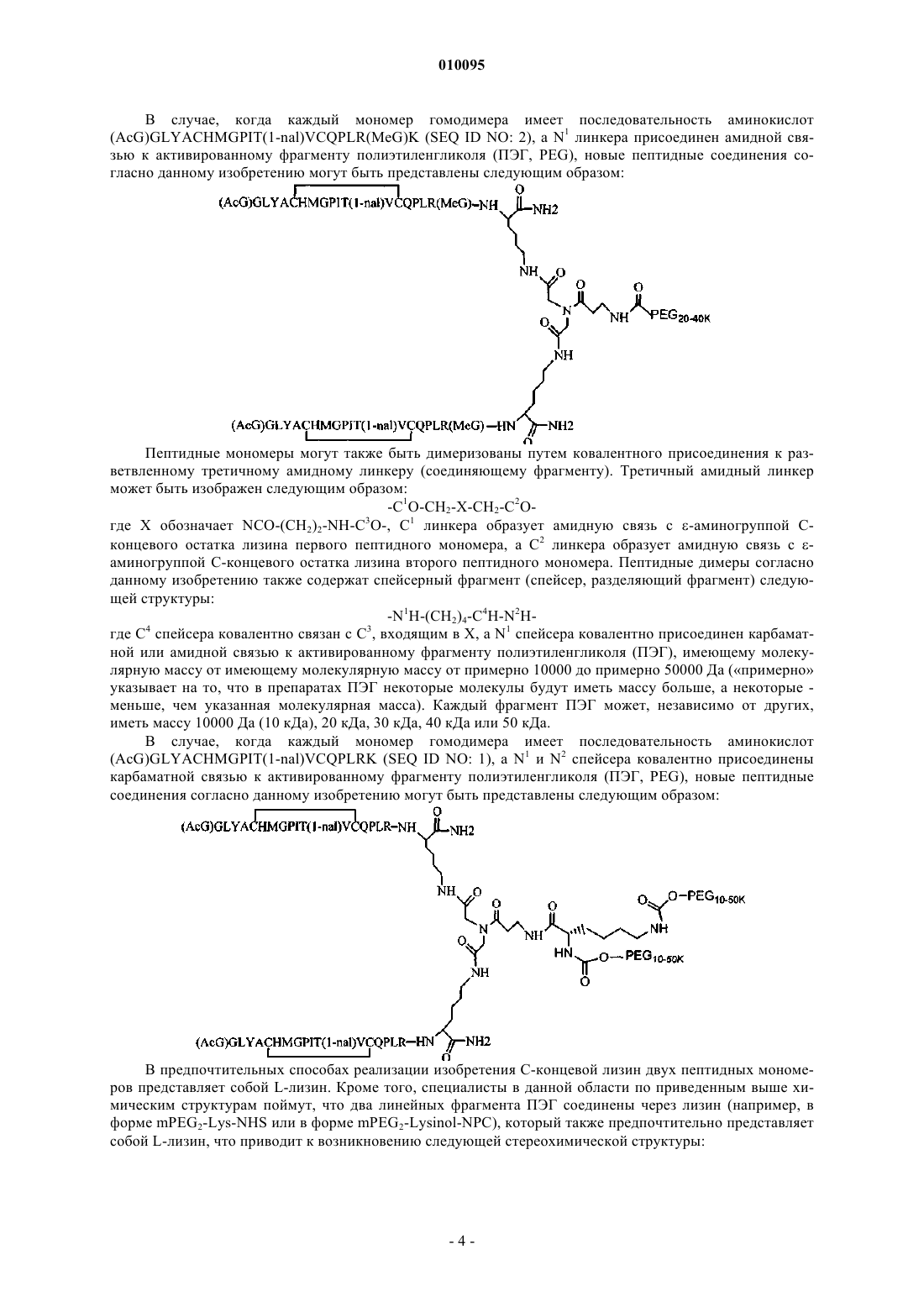
3. Соединение по п.1, которое содержит пептидный димер, имеющий формулу
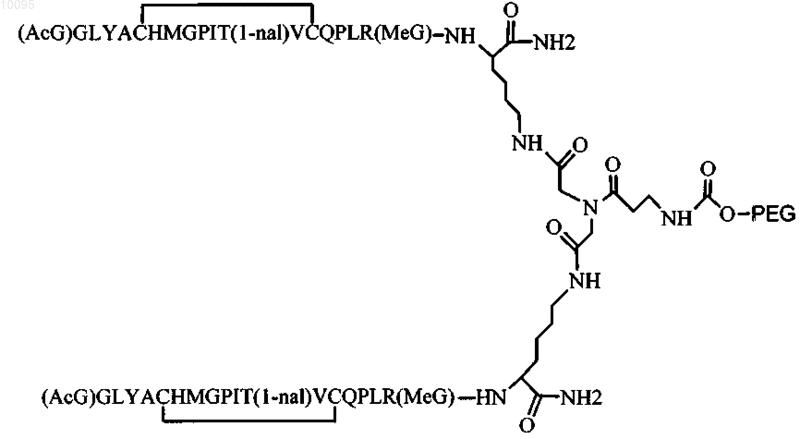
где PEG содержит одну линейную неразветвленную молекулу полиэтиленгликоля (ПЭГ), которая имеет молекулярную массу примерно от 20000 до 40000 Да.
4. Соединение по п.1, которое содержит пептидный димер, имеющий формулу
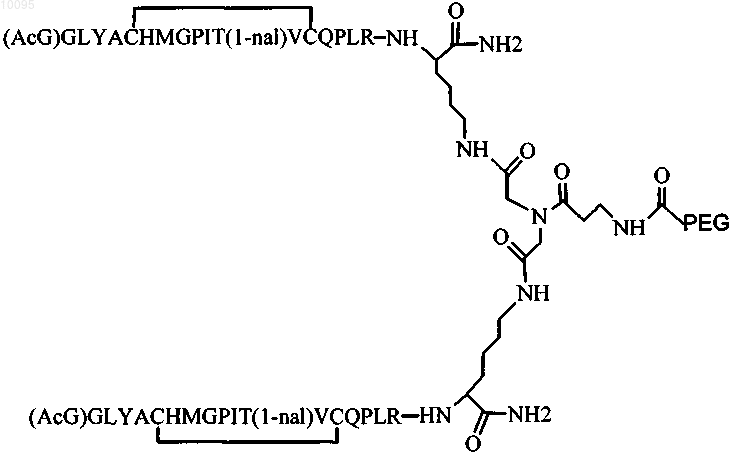
где PEG содержит линейную неразветвленную молекулу полиэтиленгликоля, причем каждая молекула ПЭГ имеет молекулярную массу примерно от 20000 до 40000 Да.
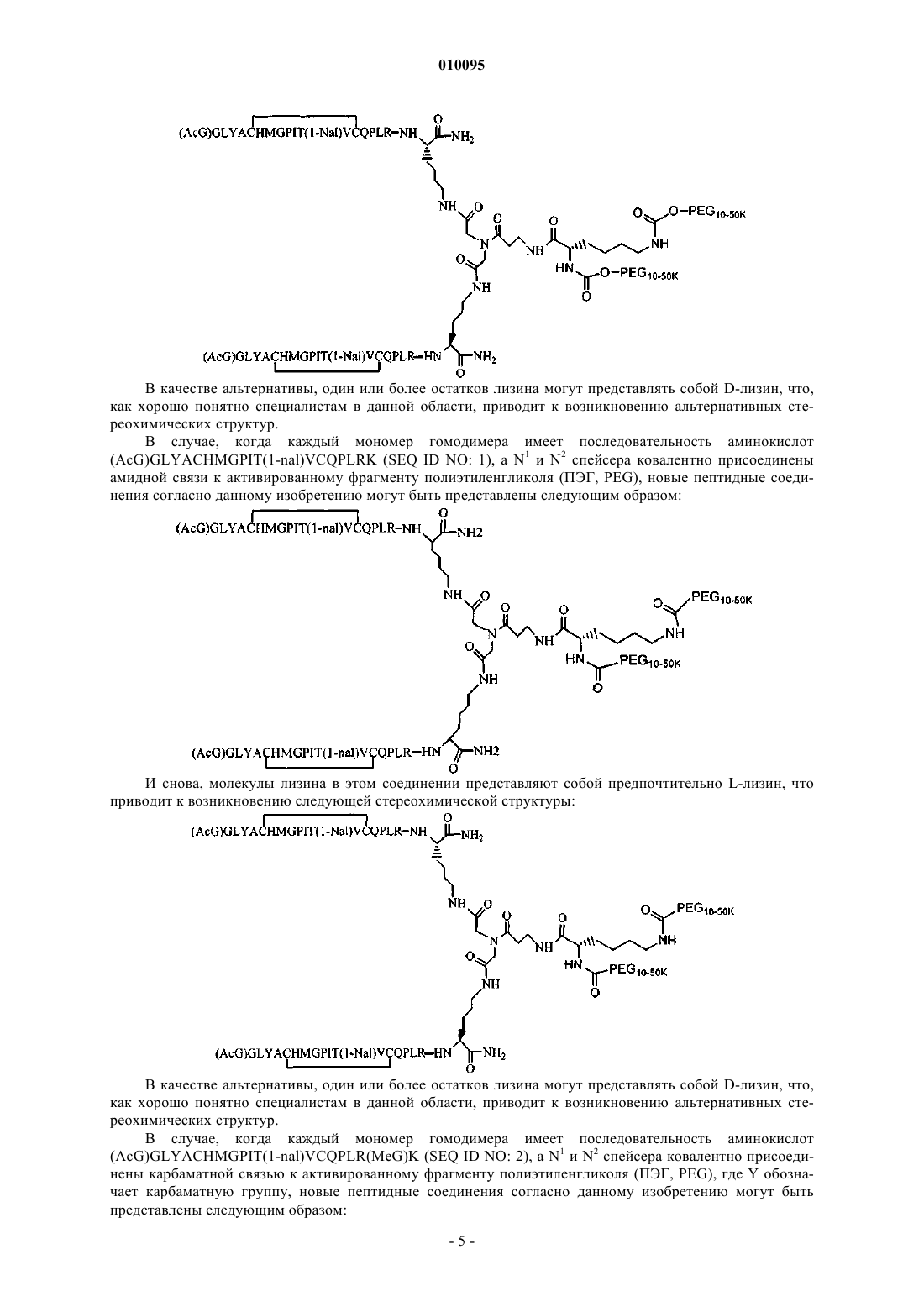
5. Соединение по п.1, которое содержит пептидный димер, имеющий формулу
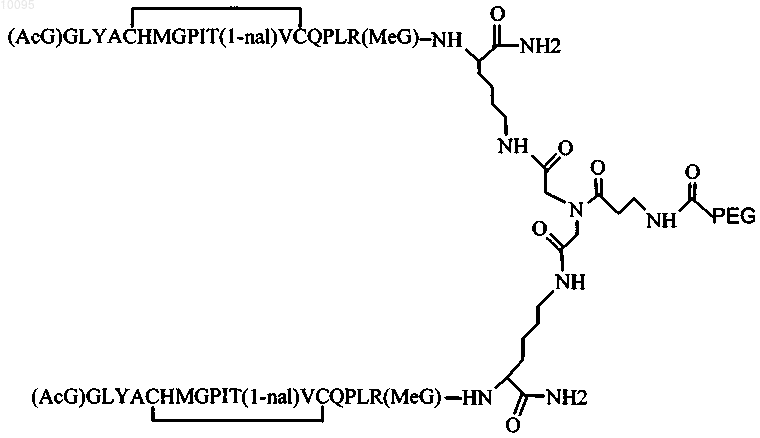
где PEG содержит линейную неразветвленную молекулу полиэтиленгликоля (ПЭГ), которая имеет молекулярную массу примерно от 20000 до 40000 Да.
6. Соединение по п.1, которое содержит пептидный димер, имеющий формулу
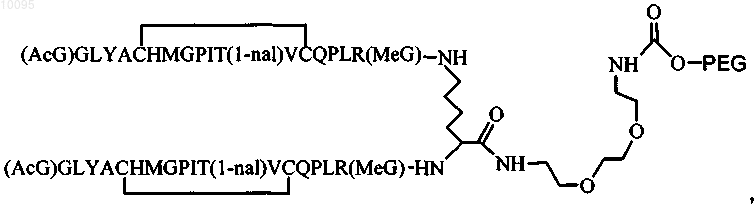
где PEG содержит линейную неразветвленную молекулу полиэтиленгликоля, которая имеет молекулярную массу примерно от 20000 до 40000 Да.
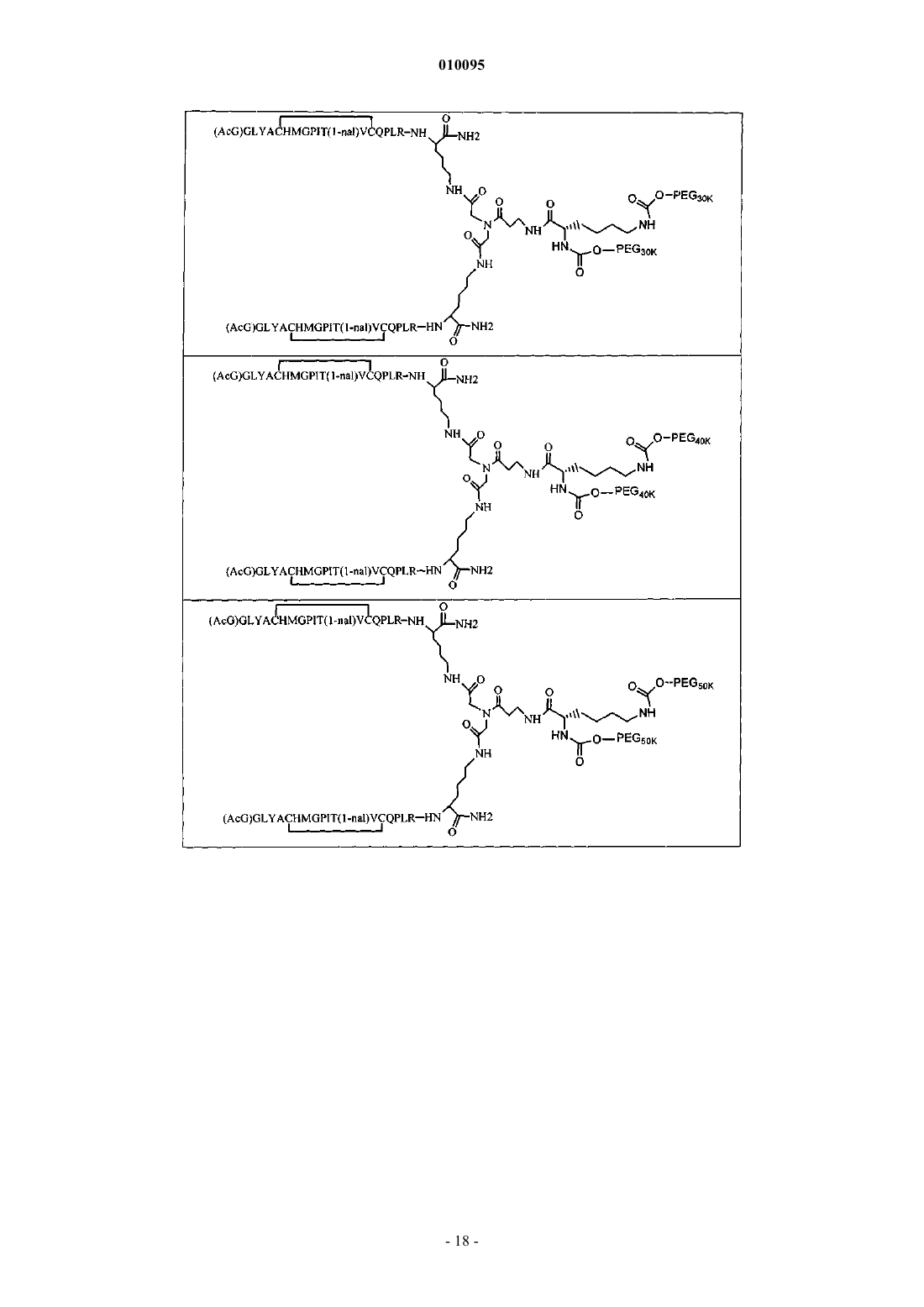
7. Соединение по любому из пп.2-6, в котором PEG обладает молекулярной массой, равной примерно 30000 Да.
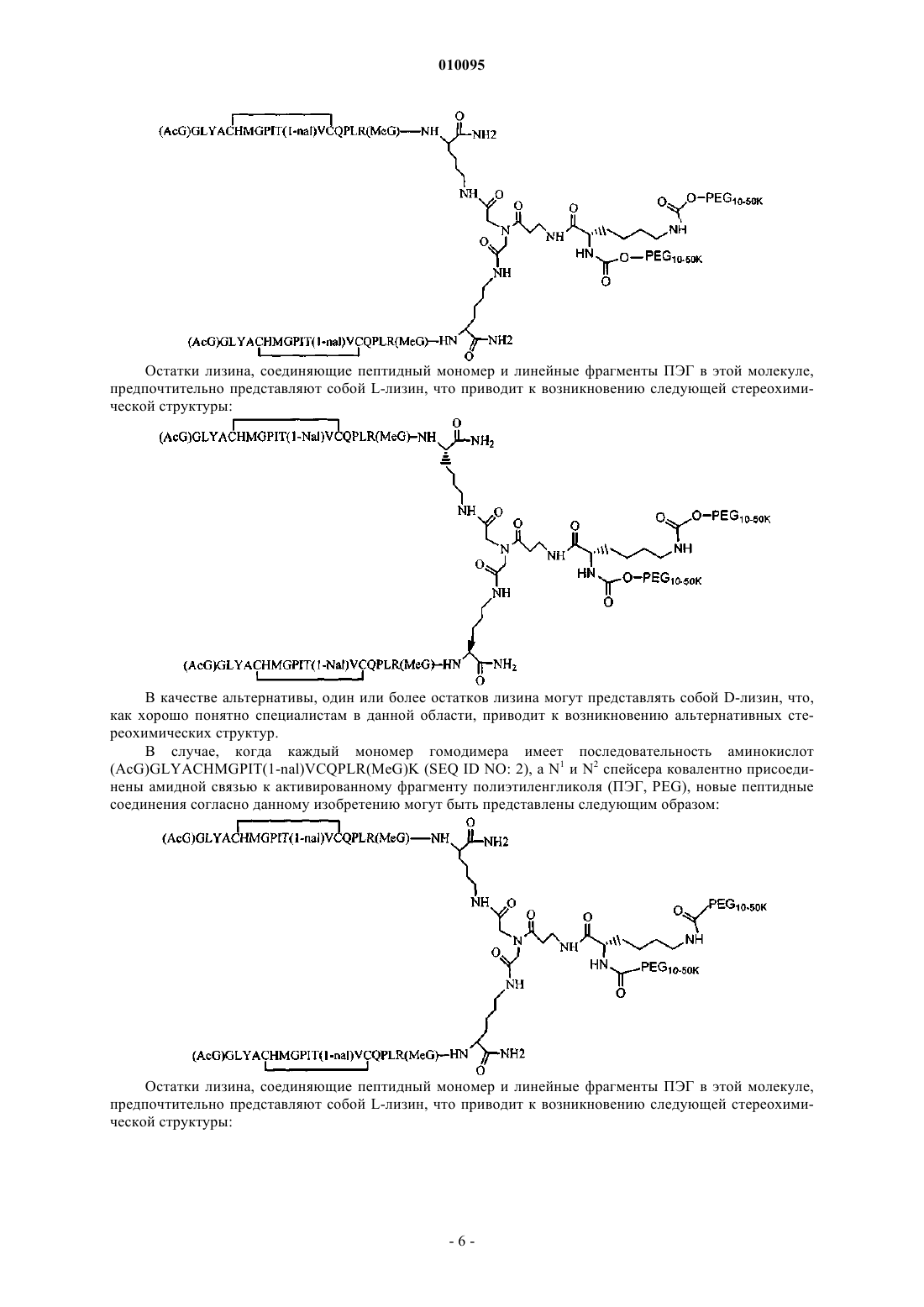
8. Соединение по п.1, которое содержит пептидный димер, имеющий формулу
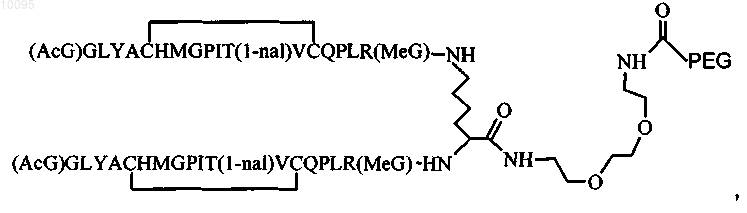
где PEG содержит линейную неразветвленную молекулу полиэтиленгликоля, которая имеет молекулярную массу примерно от 20000 до 40000 Да.
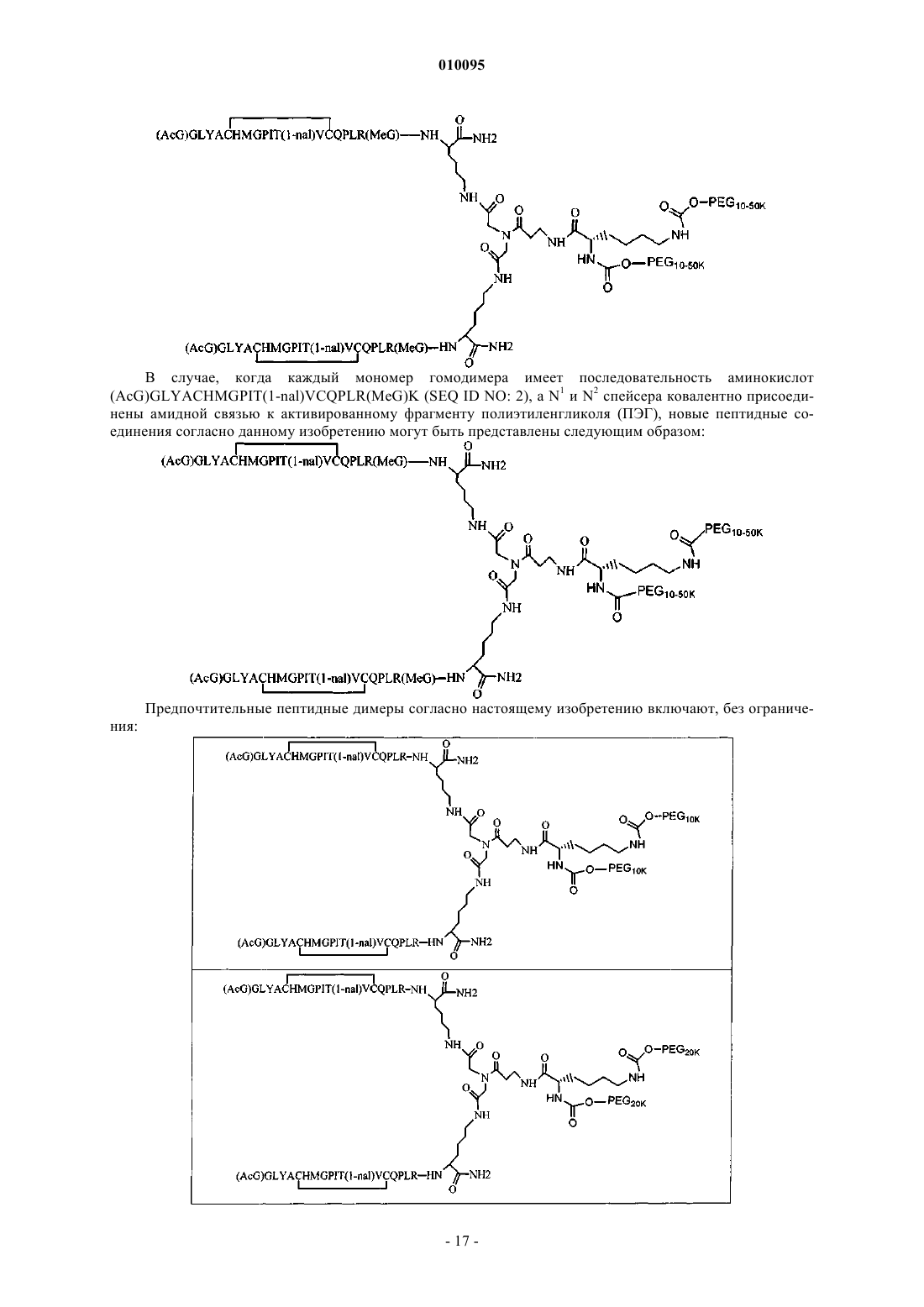
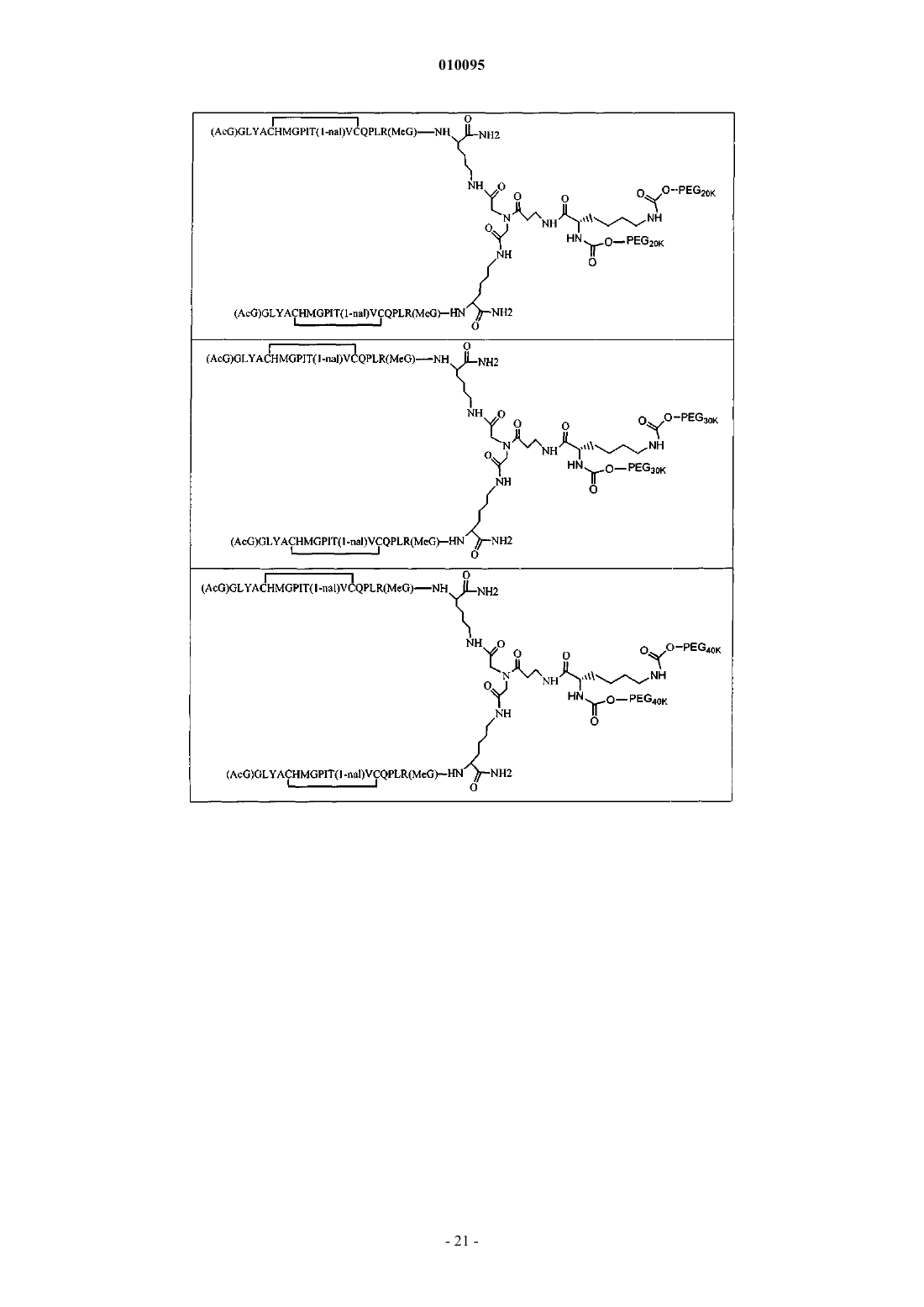
9. Соединение по п.1, которое содержит пептидный димер, имеющий формулу
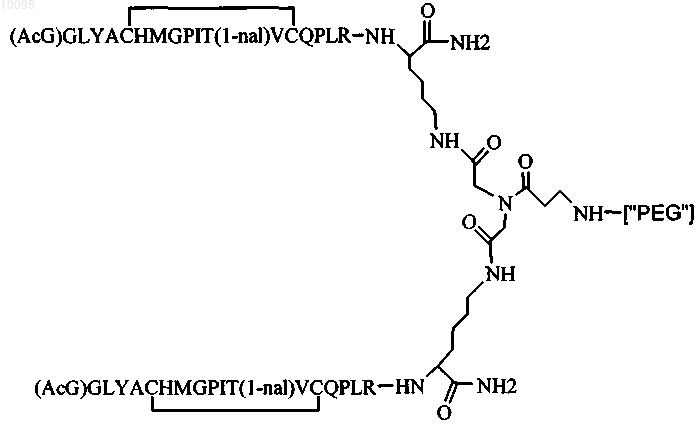
где ["PEG"] содержит по меньшей мере два линейных неразветвленных фрагмента полиэтиленгликоля (ПЭГ), связанных в одной точке присоединения и имеющих общую молекулярную массу примерно от 10000 до 60000 Да.
10. Соединение по п.1, которое содержит пептидный димер, имеющий формулу
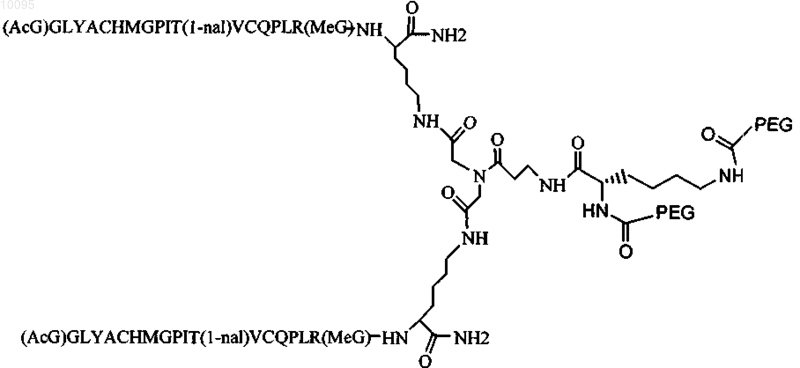
где PEG содержит два линейных фрагмента полиэтиленгликоля (ПЭГ), имеющие в сумме молекулярную массу примерно от 10000 до 30000 Да.
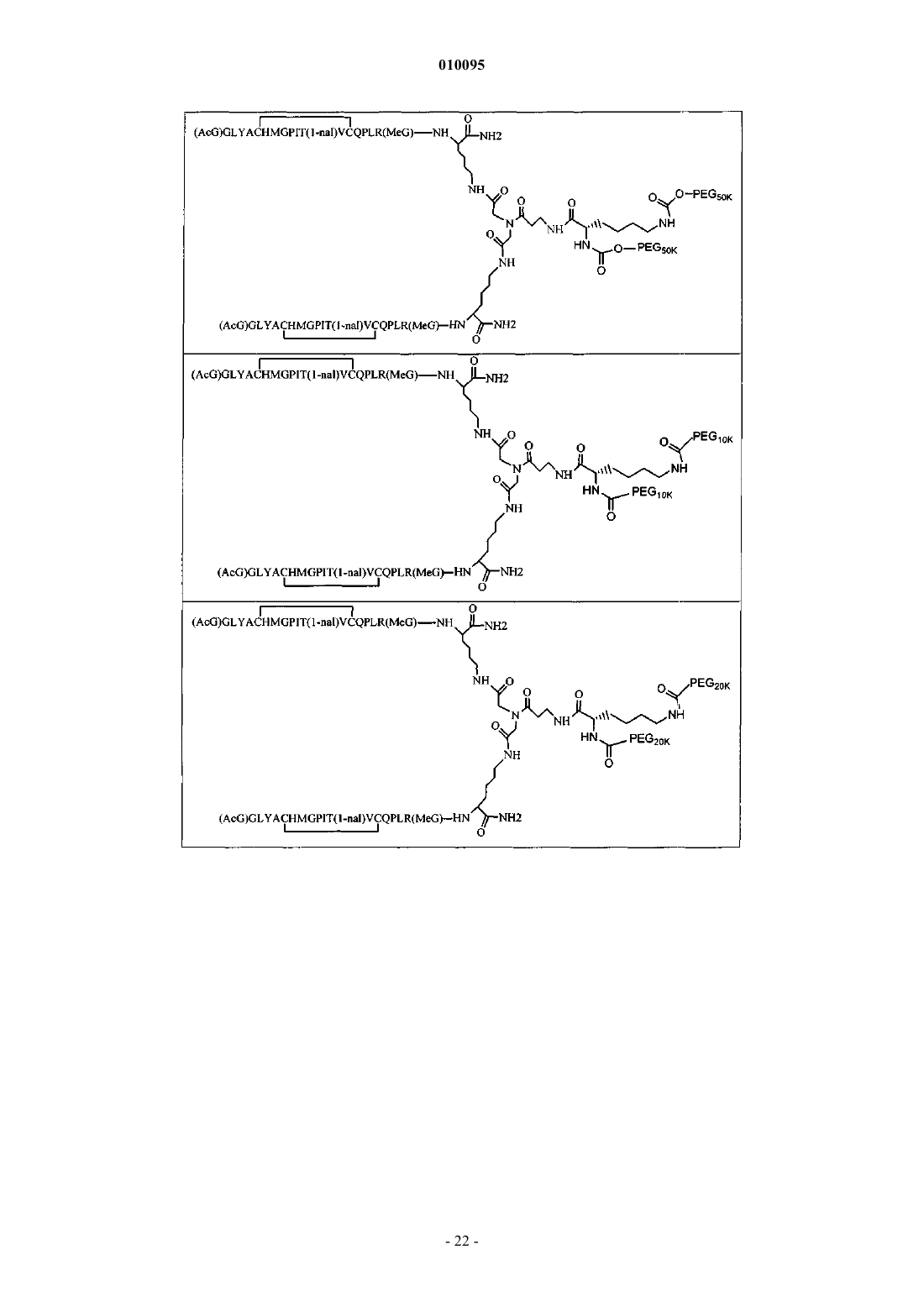
11. Соединение по п.1, которое содержит пептидный димер, имеющий формулу
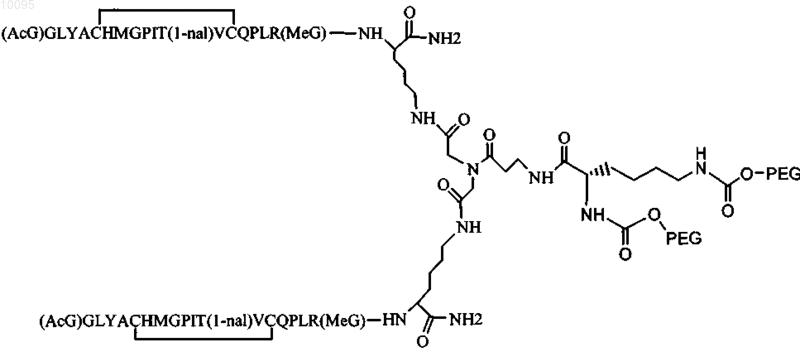
где PEG содержит два линейных фрагмента полиэтиленгликоля (ПЭГ), имеющие в сумме молекулярную массу примерно от 10000 до 30000 Да.
12. Соединение по п.1, которое содержит пептидный димер, имеющий формулу
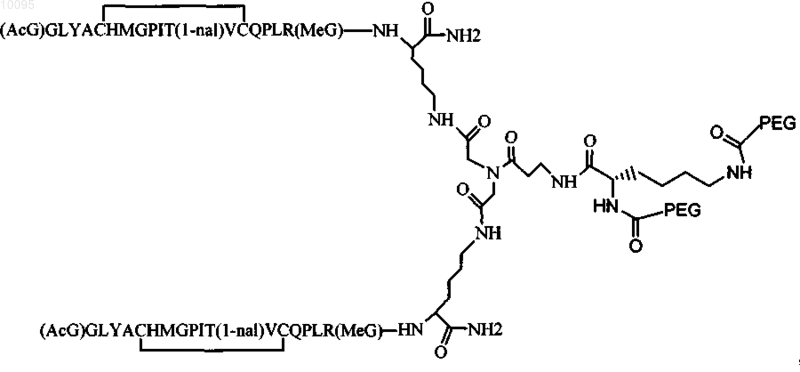
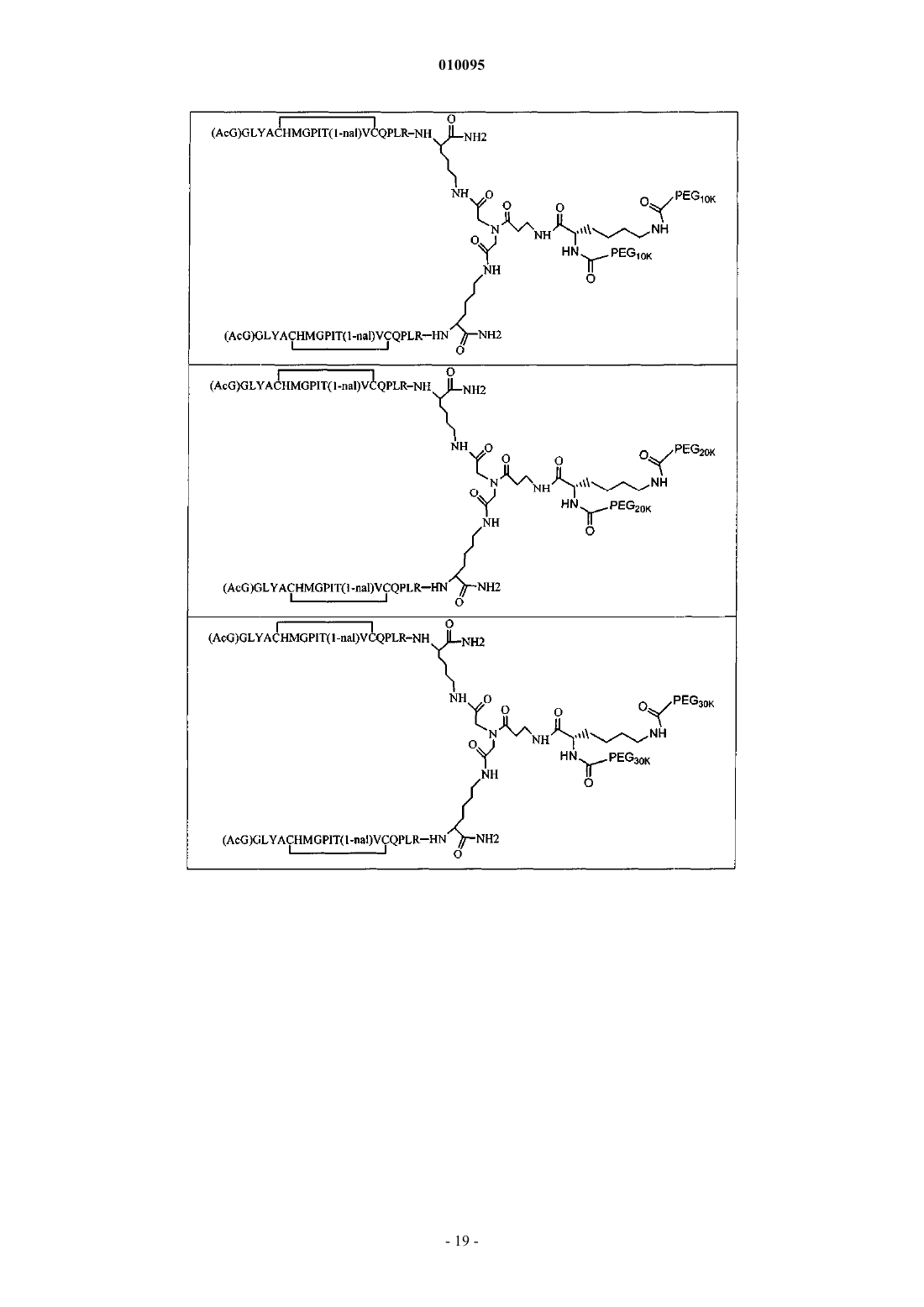
где PEG содержит два линейных фрагмента полиэтиленгликоля (ПЭГ), имеющие в сумме молекулярную массу примерно от 10000 до 30000 Да.
13. Соединение по любому из пп.8-12, в котором каждый PEG имеет молекулярную массу примерно 20000 Да.
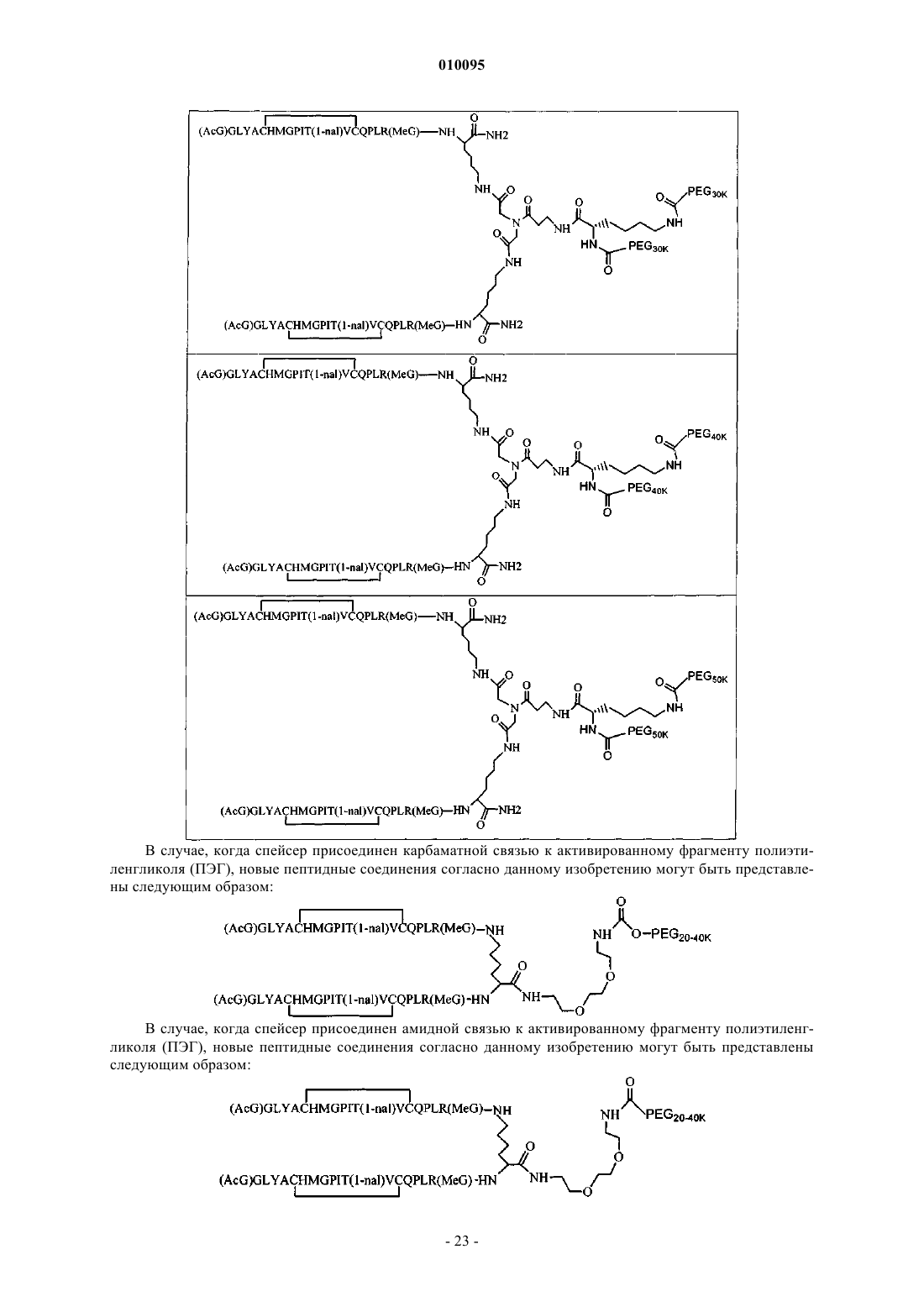
14. Соединение по п.1, которое содержит пептидный димер, имеющий формулу

где PEG содержит линейный неразветвленный фрагмент полиэтиленгликоля (ПЭГ), имеющий молекулярную массу примерно от 20000 до 40000 Да.
15. Соединение по п.1, которое содержит пептидный димер, имеющий формулу

где PEG содержит два линейных фрагмента полиэтиленгликоля (ПЭГ), имеющие в сумме молекулярную массу примерно от 10000 до 60000 Да.
16. Способ лечения пациента с нарушением, характеризующимся дефицитом эритропоэтина либо пониженной или недостаточной популяцией эритроцитов, который включает введение пациенту терапевтически эффективного количества соединения по любому из пп.1-15.
17. Способ согласно п.16, в котором нарушение выбирают из группы, состоящей из терминальной стадии почечной недостаточности или диализа, анемии на фоне СПИД, аутоиммунного заболевания или злокачественного заболевания, бета-талассемии, кистозного фиброза (муковисцедоза), анемии недоношенных детей, анемии, ассоциированной с хроническим воспалительным заболеванием, повреждения спинного мозга, острой потери крови, старения и состояний опухолевых заболеваний, сопровождаемых нарушенным эритропоэзом.
18. Фармацевтический состав, содержащий соединение по любому из пп.1-15 и фармацевтически приемлемый носитель.
Текст
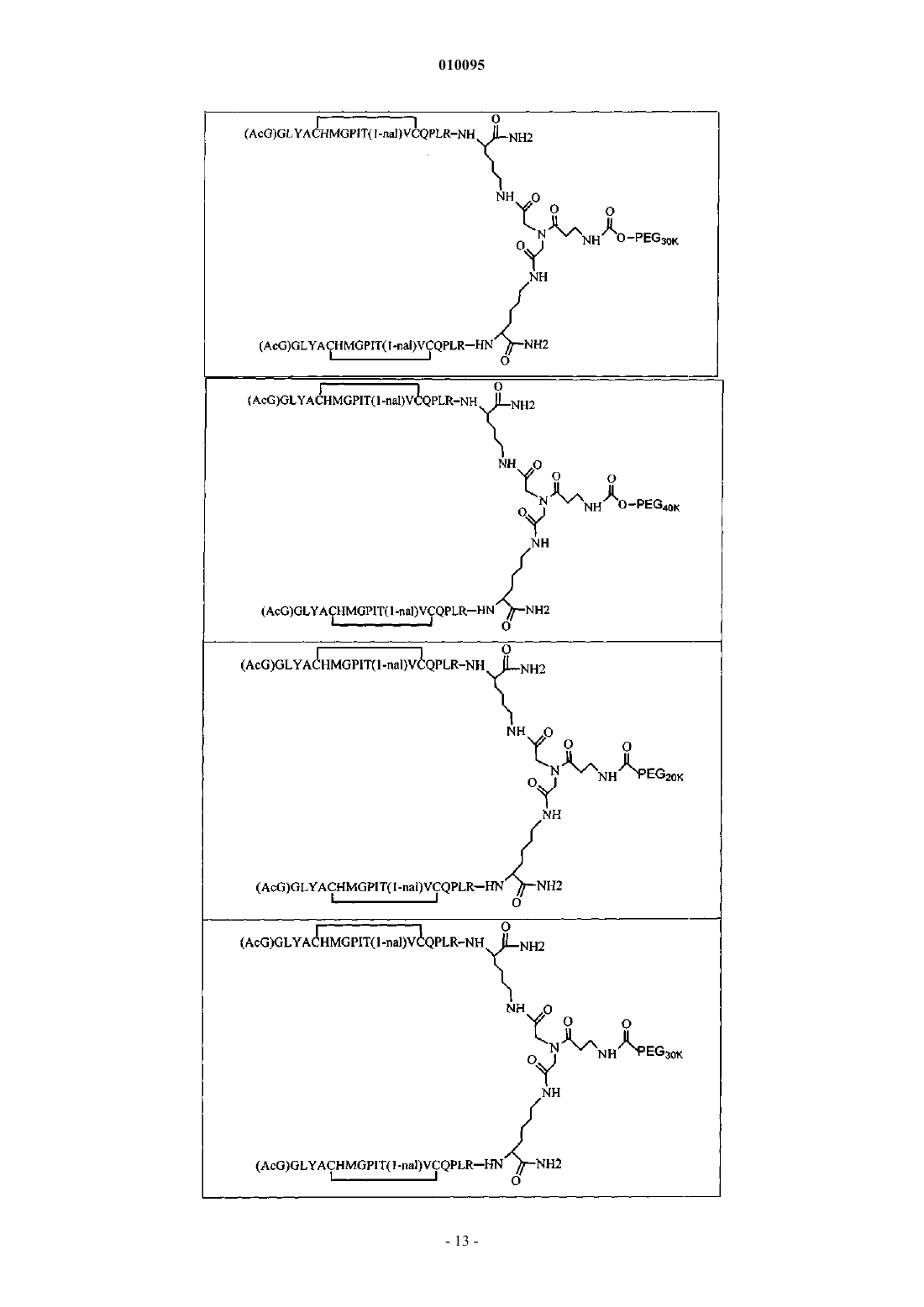
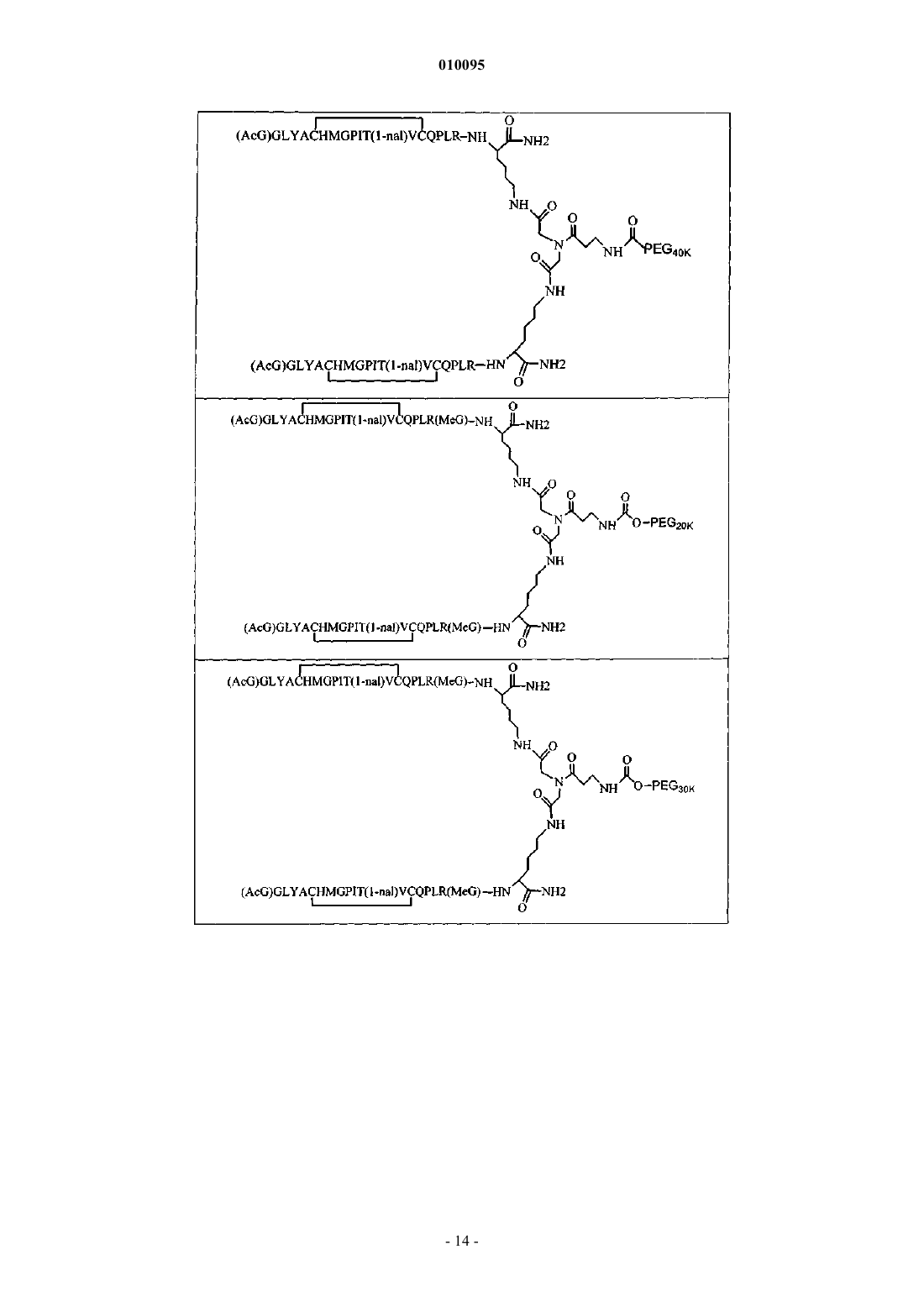
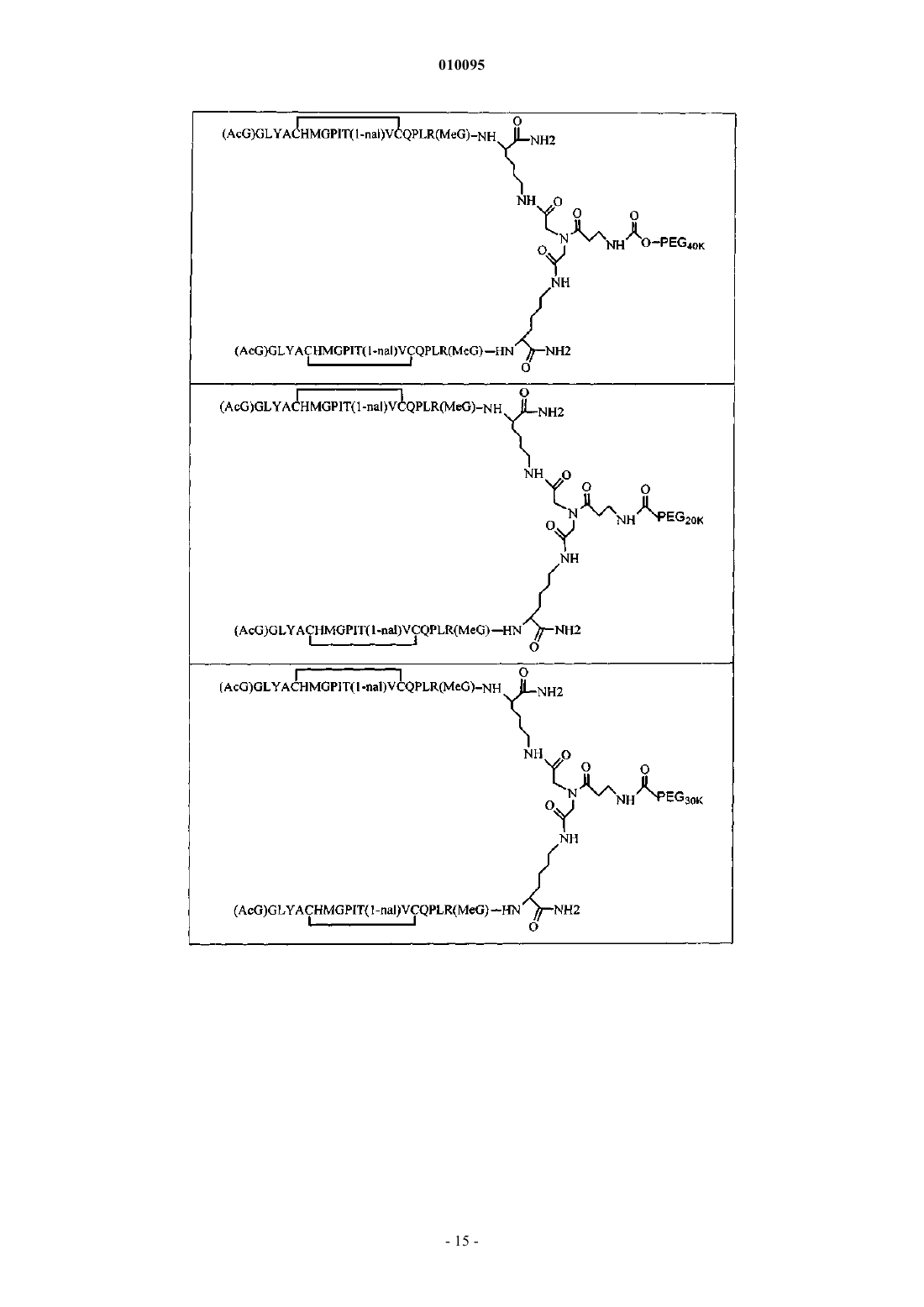
010095 Область техники Настоящее изобретение относится к пептидным соединениям, которые являются агонистами рецептора к эритропоэтину (EPO-R, ЭПО-рецептора). Данное изобретение также относится к терапевтическим способам, в которых такие пептидные соединения применяют для лечения нарушений, ассоциированных с недостаточной или дефицитной продукцией эритроцитов. Также предусмотрены фармацевтические составы, которые содержат пептидные соединения согласно данному изобретению. Уровень техники Эритропоэтин (ЭПО) представляет собой гормон гликопротеиновой природы, состоящий из 165 аминокислот, с молекулярной массой примерно 34 килоДальтон (кДа) и предпочтительными сайтами гликозилирования в 24, 38, 83 и 126 положениях аминокислот. ЭПО первоначально синтезируется в виде белка-предшественника с сигнальным пептидом из 23 аминокислот. Эритропоэтин существует в трех формах: -, - и асиало-. Формы - и - слегка различны в своей углеводной части, но обладают одинаковыми эффективностью, биологической активностью и молекулярной массой. Асиало-форма представляет собой - или -форму без концевого углевода (сиаловой кислоты). Последовательности ДНК, кодирующие эритропоэтин, были описаны ранее (Патент США US. Pat.4703008, выдан Lin). ЭПО стимулирует митотическое деление и дифференцировку клеток-предшественников эритроцитов, что обеспечивает продукцию эритроцитов. Продукция ЭПО происходит в почках в условиях гипоксии. В ходе индуцируемой эритропоэтином дифференцировки клеток-предшественников эритроцитов происходит индукция синтеза глобина, стимуляция синтеза гемсодержащего комплекса и увеличение числа рецепторов к ферритину. Эти изменения позволяют клетке поглощать больше железа и синтезировать функционально активный гемоглобин, который связывает кислород в зрелых эритроцитах. Следовательно, эритроциты и их гемоглобин играют ключевую роль в снабжении организма кислородом. Эти изменения инициированы взаимодействием эритропоэтина с соответствующим рецептором на поверхности клеток-предшественников эритроцитов [См., например., Graber, Krantz (1978) Ann. Rev. Med. 29.5166]. Если организм находится в здоровом состоянии, когда существующее число эритроцитов обеспечивает достаточную оксигенацию тканей, эритропоэтин присутствует в плазме в очень низких концентрациях. Эти нормальные низкие концентрации достаточны для стимуляции замещения эритроцитов, которые естественным образом погибают в результате старения. Количество ЭПО в циркулирующей крови возрастает в условиях гипоксии, когда транспорт кислорода эритроцитами в циркулирующей крови снижен. Гипоксия может быть вызвана, например, значительной потерей крови вследствие кровотечения, разрушением эритроцитов при передозировке радиации, уменьшении количества вдыхаемого кислорода вследствие нахождения на большой высоте или продолжительного обморока, либо различными формами анемии. В ответ на гипоксический стресс повышение уровня ЭПО увеличивает продукцию эритроцитов путем стимуляции пролиферации эритроидных предшественников. Когда количество эритроцитов превышает количество, необходимое для удовлетворения нормальной потребности тканей в кислороде, происходит снижение уровня ЭПО в циркулирующей крови. Поскольку ЭПО необходим для образования эритроцитов, существуют потенциально полезные применения этого гормона как в диагностике, так и в лечении болезней крови, характеризующихся низкой, либо дефицитной (недостаточной) продукцией эритроцитов. Недавние исследования обеспечили основу для планирования эффективного терапевтического применения ЭПО в лечении разнообразных болезненных состояний, нарушений и состояний с гематологическими расстройствами, включая бетаталассемию [См. Vedovato et al. (1984) Acta. Haematol. 71:211-213], кистозный фиброз (муковисцедоз)[См. Vichinsky et al. (1984) J. Pediatric 105:15-21], нарушения менструального цикла и беременности [См.Cotes et al. (193) Brit J. Ostet. Gyneacol. 90:304-311], анемию недоношенных детей [См. Haga et al. (1983)Acta Pediatr. Scand. 72; 827-831], повреждение спинного мозга [См. Claus-Walker et al. (1984) Arch. Phys.(1984) J. Lab. Clin. Med. 103:574-580 и 581-588, a также Lipschitz et al. (1983) Blood 63:502-509], различные опухолевые заболевания, сопровождающиеся нарушенным эритропоэзом [См. Dainiak et al. (1983)Cancer 5:1101-1106, а также Schwartz et al. (1983) Otolaryngol. 109:269-272], а также почечную недостаточность [См. Eschbach et al. (1987) N. Eng. J. Med. 316:73-78]. Был описан очищенный однородный ЭПО [Патент США U.S. Pat.4677195, Hewick]. Последовательность ДНК, кодирующая ЭПО, была очищена, клонирована и экспрессирована, в результате чего были получены рекомбинантные полипептиды, обладающие биохимическими иммунологическими свойствами природного ЭПО. Также была получена молекула рекомбинантного ЭПО с олигосахаридами,идентичными олигосахаридам природного ЭПО [См. Sasaki et al. (1987) J. Biol. Chem. 262:12059-12076]. Оказалось, что биологическое действие ЭПО частично опосредовано взаимодействием с мембраносвязанным клеточным рецептором. Первоначальные исследования на незрелых эритроидных клетках,выделенных из селезенки мыши, позволили предположить, что связывающие ЭПО белки на поверхности-1 010095 клетки содержат два полипептида, имеющие молекулярные массы, равные приблизительно 85000 Да и 100000 Да соответственно [Sawyer et al. (1987) Proc. Natl. Acad. Sci. USA 84:3690-3694]. Расчетное число сайтов связывания ЭПО составило в среднем от 800 до 1000 на поверхности одной клетки. Из этих сайтов связывания приблизительно 300 связывало ЭПО с Kd, равной приблизительно 90 пМ (пикомоль), в то время как остальные связывали ЭПО с пониженной аффинностью, равной приблизительно 570 пМ [Sawyer et al. (1987) J. Biol. Chem. 262:5554-5562]. Независимое исследование позволило предположить, что ЭПО-чувствительные эритробласты, полученные из селезенки мышей, которым путем инъекции вводили ослабленный штамм (FVA) вируса лейкоза Фрейда, обладают высоко- и низкоаффинными сайтами связывания ЭПО общим числом приблизительно 400, причем значения Kd составляют 10 и 800 пМ для высоко- и низкоаффинных сайтов соответственно [Landschulz et al. (1989) Blood 73:1476-1486]. Последующая работа показала, что единственный ген кодирует две формы рецептора к ЭПО (ЭПОрецептора). Этот ген был клонирован [См., например, Jones et al. (1990) Blood 76, 31-35, Noguchi et al.(1991) Blood 78:2548-2556; Maouche et al. (1991) Blood 78:2557-2563]. Например, последовательности ДНК и кодируемые пептидные последовательности для белков ЭПО-рецептора мыши и человека описаны в публикации РСТ номер WO 90/08822(D'Andrea et al.). Современные модели предполагают, что связывание ЭПО с ЭПО-рецептором приводит к димеризации и активации двух молекул ЭПО-рецептора,что приводит к ряду последовательных этапов передачи сигнала [См., например, Watowich et al. (1992)Proc. Natl. Acad. Sci. USA 89:2140-2144]. Доступность клонированных генов ЭПО-рецептора облегчает поиск агонистов и антагонистов этого важного рецептора. Доступность рекомбинантного белка рецептора позволяет изучать лигандрецепторные взаимодействия во множестве систем случайной и полупроизвольной генерации разнообразия белков. Эти системы включают систему пептиды на плазмидах [описана в патенте США U.S. Pat.6270170], систему пептиды на фаге [описана в патенте США U.S. Pat.5432018 и Cwirla et al.(1990) Proc. Natl. Acad. Sci. USA 87:6378-6382], систему библиотека кодированных синтетических пептидов [описана в заявке на Патент США U.S.946239, поданной 16 сентября 1992] и систему синтез иммобилизованных полимеров в очень крупных масштабах [описана в патенте США U.S. Pat.5143854, публикации РСТ Pub.90/15070; Fodor et al. (1991) Science 251:767-773; Dower, Fodor(1991) Ann. Rep. Med. Chem. 26:271-180; и Патенте США U.S. Pat.5424186]. Были идентифицированы пептиды, которые, по меньшей мере, в некоторой степени взаимодействуют с ЭПО-рецептором. Эти белки описаны, например, в U.S. Pat.5773569 и 5830851, а также US 5986047 (Wrighton et al.); публикации РСТ Pub.WO 96/40749 (Wrighton et al.); Патенте США U.S. Pat.5767078 и публикации РСТ Pub.96/40772 (Johnson и Zivin); публикации РСТ Pub.WO 01/38342(Balu); и WO 01/91780 (Smith-Swintosky et al.). В частности, была идентифицирована группа содержащих пептидный мотив пептидов, члены которой связываются с ЭПО-рецепторами и стимулируют ЭПОзависимую пролиферацию клеток. Однако идентифицированные до сих пор пептиды, которые содержат данный мотив, стимулируют ЭПО-зависимую пролиферацию клеток in vitro со значениями ЕС 50, равными от примерно 20 наномоль (нМ) до примерно 250 нМ. То есть для того, чтобы стимулировать 50% максимальной пролиферации, стимулируемой ЭПО, требуются концентрации пептида от 20 до 250 нМ. С учетом огромного потенциала агонистов ЭПО-рецепторов как для исследований важных биологических функций, опосредуемых этим рецептором, так и для лечения заболеваний, остается потребность в идентификации пептидов-агонистов ЭПО-рецепторов с повышенной эффективностью и активностью. Настоящее изобретение предусматривает такие соединения. Цитирование и/или обсуждение цитируемых источников в этом разделе и во всей спецификации приведено просто для разъяснения описания настоящего изобретения и не является признанием того, что какая-либо из ссылок представляет собой прототип настоящего изобретения. Сущность изобретения Настоящее изобретение предусматривает новые пептидные соединения, которые являются агонистами ЭПО-рецепторов с существенно повышенными эффективностью и активностью. Эти пептидные соединения представляют собой гомодимеры из пептидных мономеров, имеющих последовательность аминокислот (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), или гомодимеры из пептидных мономеров, имеющих последовательность аминокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K(SEQ ID NO: 2), или гомодимеры из белковых мономеров, имеющих последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG) (SEQ ID NO: 3), где каждая аминокислота обозначена стандартной однобуквенной аббревиатурой, (AcG) обозначает N-ацетилглицин, (1-nal) обозначает 1 нафтилаланин, a (MeG) обозначает N-метилглицин, известный также как саркозин. Каждый пептидный мономер пептидного димера содержит внутримолекулярную дисульфидную связь между остатками цистеина этого мономера. Пептидные мономеры могут быть димеризованы путем ковалентного присоединения к линкеру на основе разветвленного третичного амида (соединяющему фрагменту). Третичный амидный линкер может быть изображен следующим образом:-C1O-CH2-X-CH2-C2O-,1 1 где X обозначает NCO-(CH2)2-N H-, С линкера образует амидную связь с -аминогруппой С-концевого-2 010095 остатка лизина первого пептидного мономера, С 2 линкера образует амидную связь с -аминогруппой Сконцевого остатка лизина второго пептидного мономера, a N1, входящий в X, присоединен карбаматной связью или амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), имеющему молекулярную массу от примерно 20000 до примерно 40000 Да (примерно указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые - меньше, чем указанные молекулярные массы). В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), a N1 линкера присоединен карбаматной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), a N1 линкера присоединен амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), a N1 линкера присоединен карбаматной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом:-3 010095 В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), a N1 линкера присоединен амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: Пептидные мономеры могут также быть димеризованы путем ковалентного присоединения к разветвленному третичному амидному линкеру (соединяющему фрагменту). Третичный амидный линкер может быть изображен следующим образом:-C1O-CH2-X-CH2-C2O3 где X обозначает NCO-(CH2)2-NH-C O-, С 1 линкера образует амидную связь с -аминогруппой Сконцевого остатка лизина первого пептидного мономера, а С 2 линкера образует амидную связь с аминогруппой С-концевого остатка лизина второго пептидного мономера. Пептидные димеры согласно данному изобретению также содержат спейсерный фрагмент (спейсер, разделяющий фрагмент) следующей структуры:-N1H-(CH2)4-C4H-N2H4 3 где С спейсера ковалентно связан с С , входящим в X, a N1 спейсера ковалентно присоединен карбаматной или амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ), имеющему молекулярную массу от имеющему молекулярную массу от примерно 10000 до примерно 50000 Да (примерно указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые меньше, чем указанная молекулярная масса). Каждый фрагмент ПЭГ может, независимо от других,иметь массу 10000 Да (10 кДа), 20 кДа, 30 кДа, 40 кДа или 50 кДа. В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), a N1 и N2 спейсера ковалентно присоединены карбаматной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: В предпочтительных способах реализации изобретения С-концевой лизин двух пептидных мономеров представляет собой L-лизин. Кроме того, специалисты в данной области по приведенным выше химическим структурам поймут, что два линейных фрагмента ПЭГ соединены через лизин (например, в форме mPEG2-Lys-NHS или в форме mPEG2-Lysinol-NPC), который также предпочтительно представляет собой L-лизин, что приводит к возникновению следующей стереохимической структуры: В качестве альтернативы, один или более остатков лизина могут представлять собой D-лизин, что,как хорошо понятно специалистам в данной области, приводит к возникновению альтернативных стереохимических структур. В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), a N1 и N2 спейсера ковалентно присоединены амидной связи к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: И снова, молекулы лизина в этом соединении представляют собой предпочтительно L-лизин, что приводит к возникновению следующей стереохимической структуры: В качестве альтернативы, один или более остатков лизина могут представлять собой D-лизин, что,как хорошо понятно специалистам в данной области, приводит к возникновению альтернативных стереохимических структур. В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), a N1 и N2 спейсера ковалентно присоединены карбаматной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), где Y обозначает карбаматную группу, новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: Остатки лизина, соединяющие пептидный мономер и линейные фрагменты ПЭГ в этой молекуле,предпочтительно представляют собой L-лизин, что приводит к возникновению следующей стереохимической структуры: В качестве альтернативы, один или более остатков лизина могут представлять собой D-лизин, что,как хорошо понятно специалистам в данной области, приводит к возникновению альтернативных стереохимических структур. В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), a N1 и N2 спейсера ковалентно присоединены амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: Остатки лизина, соединяющие пептидный мономер и линейные фрагменты ПЭГ в этой молекуле,предпочтительно представляют собой L-лизин, что приводит к возникновению следующей стереохимической структуры: В других способах реализации один или более остатков лизина могут представлять собой D-лизин,что, как хорошо понятно специалистам в данной области, приводит к возникновению альтернативных стереохимических структур. Пептидные мономеры могут также быть димеризованы путем присоединения к лизиновому линкеру (связывающему агенту). В этом случае один пептидный мономер присоединен своим С-концом к-аминогруппе лизина, а второй пептидный мономер присоединен своим С-концом к -аминогруппе лизина. Пептидные димеры согласно данному изобретению содержат также спейсерный фрагмент (спейсер) следующей структуры:-N1H-(CH2)2-O-(CH2)2-O-(CH2)2-N2H1 На одном конце N спейсера присоединен амидной связью к углероду карбонильной группы лизинового линкера. На противоположном конце N2 спейсера присоединен карбаматной связью или амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), имеющему молекулярную массу от примерно 20000 до примерно 40000 Да (примерно указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые - меньше, чем указанная молекулярная масса). Каждый фрагмент ПЭГ может, независимо от других, иметь массу 10000 Да (10 кДа), 20 кДа, 30 кДа, 40 кДа или 50 кДа. В случае, когда спейсер присоединен карбаматной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), новые пептидные соединения согласно данному изобретению можно представить следующим образом: В случае, когда спейсер присоединен амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), новые белковые соединения согласно данному изобретению можно представить следующим образом: Изобретение также предусматривает фармацевтические составы, состоящие из таких пептидных соединений, и способы лечения разнообразных медицинских состояний с применением таких пептидных соединений.-7 010095 Подробное описание изобретения Определения. Названия остатков аминокислот в пептидах имеют следующие сокращения (аббревиатуры): Фенилаланин - Phe или F, Лейцин - Leu или L, Изолейцин - Ile или I, Метионин - Met или М, Валин - Val илиV, Серин - Ser или S, Пролин - Pro или Р, Треонин - Thr или Т, Алании - Ala или А, Тирозин - Tyr или Y,Гистидин - His или Н, Глутамин - Gln или Q, Аспарагин - Asn или N, Лизин - Lys или K, Аспарагиновая кислота - Asp или D, Глутаминовая кислота - Glu или Е, Цистеин - Cys или С, Триптофан - Trp или W,Аргинин - Arg или R, Глицин - Gly или G. Минорные аминокислоты в пептидах имеют следующие аббревиатуры: 1-нафтилаланин - 1-nal или Np, N-метилглицин (также известный как саркозин) - MeG илиSc, а ацетилированный глицин (N-ацетилглицин) - AcG. Термин полипептид или белок обозначает здесь полимер, мономерами которого являются аминокислоты, которые представляют собой альфа-аминокислоты, соединенные между собой амидными связями. Длина полипептидов равна, следовательно, по меньшей мере двум остатка аминокислот, а обычно полипептиды длиннее. Обычно термин пептид обозначает полипептид, длина которого составляет всего несколько остатков аминокислот. Длина новых пептидов - агонистов ЭПО-рецептора согласно настоящему изобретению составляет предпочтительно не больше, чем примерно 50 остатков аминокислот. Более предпочтительно, их длина составляет от примерно 17 до примерно 40 остатков аминокислот. Полипептид, в отличие от пептида, может содержать любое число остатков аминокислот. Следовательно,термин полипептид включает пептиды, а также более длинные последовательности аминокислот. Фраза фармацевтически приемлемый обозначает здесь молекулы или составы, которые считают в целом безопасными, например, те, которые являются физиологически приемлемыми и обычно не вызывают при введении человеку аллергических или аналогичных нежелательных реакций, таких как расстройство желудка, головокружение и т.п. Термин фармацевтически приемлемый предпочтительно употребляется здесь в значении одобренный органом федерального или государственного регулирования, либо перечисленный в Фармакопее США или другой общепризнанной фармакопее, как пригодный для применения у животных, а точнее - у людей. Термин носитель обозначает дилюент, адъювант, наполнитель или разбавитель, с которым вводят соединение. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода и масла, включая масла нефти, масла растительного, животного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. В качестве носителей, особенно для инъекционных растворов, используют предпочтительно воду или водные буферные растворы, а также водные растворы декстрозы и глицерина. Подходящие фармацевтические носители описаны в Remington's Pharmaceutical Sciences (автор E.W. Martin). Термин агонист обозначает здесь биологически активный лиганд, который связывается с комплементарным ему биологически активным рецептором и активирует последний, что либо вызывает биологический ответ рецептора, либо усиливает уже существующую биологическую активность рецептора. Новые пептиды, которые являются агонистами ЭПО-рецептора. Настоящее изобретение предусматривает новые пептидные соединения, которые являются агонистами ЭПО-рецептора и обладают существенно повышенными эффективностью и активностью. Эти пептидные соединения представляют собой гомодимеры из пептидных мономеров, имеющих последовательность аминокислот (AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), либо из пептидных мономеров, имеющих последовательность аминокислот (AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K(SEQ ID NO: 2), где каждая аминокислота обозначена стандартной однобуквенной аббревиатурой,(AcG) обозначает N-ацетилглицин, (1-nal) обозначает 1-нафтилаланин, a (MeG) обозначает Nметилглицин, также известный как саркозин. Каждый пептидный мономер пептидного димера содержит внутримолекулярную дисульфидную связь между остатками цистеина данного мономера. Такие мономеры могут быть схематически представлены следующим образом: или и или Эти мономерные пептиды димеризуют с получением в результате димеров с повышенной активностью агонистов ЭПО-рецепторов. Линкерный фрагмент (Lk) представляет собой линкер на основе разветвленного третичного амида, который соединяет С-концы двух пептидных мономеров путем одновременного присоединения к С-концевому остатку лизина каждого мономера. Третичный амидный линкер можно изобразить следующим образом:-C1O-CH2-X-CH2-C2O1 1 где X представляет NCO-(CH2)2-N H-, С линкера образует амидную связь с -аминогруппой С-концевого остатка лизина первого белкового мономера, С 2 линкера образует амидную связь с -аминогруппой Сконцевого остатка лизина второго белкового мономера, a N1, входящий в X, прикреплен карбаматной связью или амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), имеющему-8 010095 молекулярную массу от примерно 20000 до примерно 40000 Да (примерно указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые - меньше, чем указанные молекулярные массы). Третичный амидный линкер можно также изобразить следующим образом:-C1O-CH2-X-CH2-C2O3 где X обозначает NCO-(CH2)2-NH-C O-, C1 линкера образует амидную связь с -аминогруппой Сконцевого остатка лизина первого пептидного мономера, а C2 линкера образует амидную связь с аминогруппой С-концевого остатка лизина второго пептидного мономера. Пептидные димеры согласно данному изобретению также содержат спейсерный фрагмент (спейсер, разделяющий фрагмент) следующей структуры:-N1H-(CH2)4-C4H-N2H4 3 где C спейсера ковалентно связан с С , входящим в X, N1 спейсера ковалентно присоединен карбаматной или амидной связью к активированному фрагменту ПЭГ, а N2 спейсера ковалентно присоединен карбаматной или амидной связью к активированному фрагменту ПЭГ, где ПЭГ имеет молекулярную массу от примерно 10000 до примерно 60000 Да (примерно указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые - меньше, чем указанная молекулярная масса). Новые пептиды согласно данному изобретению могут также содержать фрагмент ПЭГ, который ковалентно присоединен посредством карбаматной или амидной связи с третичным амидным линкером к пептидному димеру. ПЭГ представляет собой водорастворимый полимер, который и является фармацевтически приемлемым. ПЭГ для применения в настоящем изобретении может представлять собой линейный, неразветвленный ПЭГ, имеющий молекулярную массу от примерно 20 до примерно 60 кДа (примерно указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые - меньше, чем указанная молекулярная масса). Более предпочтительно, ПЭГ имеет молекулярную массу от примерно 30 до примерно 40 кДа. Специалист в данной области сможет подобрать желаемый размер полимера, основываясь на таких параметрах, как желаемая дозировка, время циркуляции, устойчивость к протеолизу, влияние, если оно есть, на биологическую активность, простота в обращении, степень антигенности или ее отсутствие, а также другие известные воздействия ПЭГ на терапевтический пептид. Пептиды, пептидные димеры и другие молекулы на основе пептидов согласно данному изобретению могут быть присоединены к водорастворимым полимерам (например, ПЭГ) при помощи разнообразных химических способов, которые позволяют связать водорастворимый(е) полимер(ы) с рецепторсвязывающей частью молекулы (например, пептид + спейсер). В обычном способе реализации для ковалентного присоединения водорастворимого полимера(ов) к рецептор-связывающей части задействовано единственное место (сайт) присоединения. Однако в альтернативных способах реализации изобретения можно применять связывание во множественных сайтах присоединения, включая дальнейшие варианты,в которых разные виды водорастворимых полимеров присоединяют к рецептор-связывающей части в различных сайтах присоединения, которые могут включать сайты ковалентного присоединения (присоединений) к спейсеру и/или одной или обеим пептидным цепям. В некоторых способах реализации димер или более крупный полимер будет содержать различные виды пептидных цепей (т.е. будет представлять собой гетеродимер или другой гетеромультимер). В качестве примера, но не ограничения, димер может содержать одну пептидную цепь, имеющую сайт присоединения ПЭГ, а у второй пептидной цепи может либо отсутствовать сайт присоединения ПЭГ, либо для присоединения может быть использована связь не такого, как в первой цепи, химического состава. В некоторых вариантах спейсер может содержать или не содержать сайт присоединения ПЭГ, а в случае присоединения ПЭГ к указанному спейсеру, для присоединения может быть использована связь не такого, как в первой и/или второй цепи, химического состава. В альтернативном способе реализации ПЭГ присоединен к спейсерной части рецепторсвязывающей части, а другой водорастворимый полимер (например, углеводород) конъюгирован с боковым радикалом одной из аминокислот пептидной части молекулы. Для присоединения ПЭГ (пегилирования) к рецептор-связывающей части (пептиды+спейсер) может быть использовано множество разных видов полиэтиленгликоля (ПЭГ). Можно использовать практически любой подходящий химически активный реагент ПЭГ. В предпочтительных способах реализации применение химически активного реагента ПЭГ приведет к образованию карбаматной или амидной связи после конъюгирования с рецептор-связывающей частью. Подходящие химически активные реагенты ПЭГ включают, без ограничения, коммерчески доступные реагенты, которые можно приобрести по каталогу Drag Delivery Systems (2003) корпорации NOF Corporation (Yebisu Garden Place Tower, 20-3 Ebisu 4chome, Shibuyaku, Tokyo 150-6019) и каталогу Molecular Enginering 2003 компании Nectar Therapeutics(490 Discovery Drive, Huntsville, Alabama 35806). В качестве примера, но не ограничения, здесь приводятся следующие часто предпочитаемые в разных способах реализации реагенты ПЭГ: m-PEG2-NHS,mPEG2-ALD, multi-Arm PEG, mPEG(MAL)2, mPEG(MAL), m-PEG2-NH2, mPEG-SPA, mPEG-SBA,mPEG-тиоэфиры, mPEG-двойные сложные эфиры, mPEG-ВТС, mPEG-ButyrALD, mPEG-ACET, гетерофункциональные ПЭГ (NH2-PEG-COOH, Boc-PEG-NHS, Fmoc-PEG-NHS, NHS-PEG-VS, NHS-PEGMAL), акрилаты ПЭГ (ACRL-PEG-NHS), ПЕГ-фосфодилипиды (например, mPEG-DSPE), многолучевые(разветвленные ) ПЭГ серии SUNBRITE, включая серию GL ПЭГ на основе глицериновых, активированных химическим способом, выбранным специалистом, любой из активированных ПЭГ серии SUNBRITE,включая, без ограничения, карбоксил-ПЭГи, p-NP-ПЭГ, Тресил-PEGs, альдегид ПЭГи, ацеталь-ПЭГи,амино-ПЭГи, тиол-ПЭГи, имид-малеиновые ПЭГи, гидроксил-ПЭГ-амин, амино-ПЭГ-СООН, гидроксилПЭГ-альдегид, ПЭГ карбоксильно-ангидридного типа, функционализированные фосфолипид-ПЭГ и другие аналогичные и/или подходящие химически активные ПЭГ, выбираемые специалистами в данной области для конкретного применения и использования. Новые пептиды согласно данному изобретению могут также содержать два фрагмента ПЭГ, ковалентно присоединенных карбаматной или амидной связью к спейсерному фрагменту, который ковалентно присоединен к третичному амидному линкеру пептидного димера. Каждый из двух фрагментов ПЭГ,использованный в таком способе реализации настоящего изобретения, может быть линейным, или они могут быть связаны вместе в одной (общей) точке присоединения. Каждый фрагмент ПЭГ имеет молекулярную массу предпочтительно от примерно 10 до примерно 60 кДа (примерно указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые - меньше, чем указанные молекулярные массы). Линейные фрагменты ПЭГ особенно предпочтительны. Более предпочтительно каждый из двух фрагментов ПЭГ имеет молекулярную массу от примерно 20 до примерно 40 кДа, а еще более предпочтительно в интервале от примерно 20 до примерно 40 кДа. Еще более предпочтительно,чтобы каждый из двух фрагментов ПЭГ имел молекулярную массу примерно 20 кДа. Специалист в данной области сможет подобрать желаемый размер полимера, основываясь на таких параметрах, как желаемая дозировка, время циркуляции, устойчивость к протеолизу, влияние, если оно есть, на биологическую активность, простота в обращении, степень антигенности или ее отсутствие, а также другие известные воздействия ПЭГ на терапевтический пептид. Настоящее изобретение также включает пептиды - агонисты, которые представляют собой гомодимеры из пептидных мономеров, имеющих последовательность аминокислот (AcG)GLYACHMGPIT(1nal)VCQPLR(MeG) (SEQ ID NO: 3), где каждая аминокислота обозначена стандартной однобуквенной аббревиатурой, (AcG) обозначает N-ацетилглицин, (1-nal) обозначает 1-нафтилаланин, a (MeG) обозначает N-метилглицин, известный также как саркозин. Каждый пептидный мономер пептидного димера содержит внутримолекулярную дисульфидную связь между остатками цистеина данного мономера. Такие мономеры могут быть схематично представлены следующим образом: или Эти мономерные пептиды димеризуют, получая в результате димеры с повышенной активностью агонистов ЭПО-рецепторов. Линкерный фрагмент (Lk) представляет собой остаток лизина, который соединяет С-концы двух пептидных мономеров путем одновременного присоединения к С-концевой аминокислоте каждого мономера. Один пептидный мономер присоединен своим С-концом к -аминогруппе лизина, а второй пептидный мономер своим С-концом присоединен к -аминогруппе лизина. Например,структура данного димера может быть изображена, как показано в формуле 1. Обобщенное изображение показано в формуле 2. Формула 1- 10010095 В формуле 1 и формуле 2 N2 представляет атом азота -аминогруппы лизина, a N1 представляет атом азота -аминогруппы лизина. Пептидные димеры согласно данному изобретению также содержат спейсерный фрагмент (спейсер,разделяющий фрагмент) следующей структуры:-N1H-(CH2)2-O-(CH2)2-O-(CH2)2-N2H1 На одном конце N спейсера присоединен амидной связью к углероду карбонильной группы лизинового линкера. На противоположном конце N2 спейсера присоединен карбаматной связью или амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ, PEG), имеющему молекулярную массу от примерно 10000 до примерно 60000 Да (примерно указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые - меньше, чем указанная молекулярная масса). Более предпочтительно ПЭГ имеет молекулярную массу примерно от 20000 до 40000 Да. Таким образом, новые пептиды согласно данному изобретению также содержат фрагмент ПЭГ, ковалентно присоединенный к пептидному димеру. ПЭГ представляет собой водорастворимый полимер и является фармацевтически приемлемым. ПЭГ для применения в настоящем изобретении может представлять собой линейный, неразветвленный ПЭГ, имеющий молекулярную массу примерно от 20 до примерно 60 кДа (примерно указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые - меньше, чем указанная молекулярная масса). Наиболее предпочтительно ПЭГ имеет молекулярную массу от примерно 30 до примерно 40 кДа. Специалист в данной области сможет подобрать желаемый размер полимера, основываясь на таких параметрах, как желаемая дозировка,время циркуляции, устойчивость к протеолизу, влияние, если оно есть, на биологическую активность,простота в обращении, степень антигенности или ее отсутствие, а также другие известные воздействия ПЭГ на терапевтический пептид. В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), a N1 линкера присоединен карбаматной связью к активированному фрагменту полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), a Nl линкера присоединен амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом:(AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), a N1 линкера присоединен карбаматной связью к активированному фрагменту полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), a N1 линкера присоединен амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: Предпочтительные пептидные димеры согласно настоящему изобретению включают, без ограничения: В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), a N1 и N2 спейсера ковалентно присоединены карбаматной связью к активированному фрагменту полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLRK (SEQ ID NO: 1), a N1 и N2 спейсера ковалентно присоединены амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), a N1 и N2 спейсера ковалентно присоединены карбаматной связью к активированному фрагменту полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: В случае, когда каждый мономер гомодимера имеет последовательность аминокислот(AcG)GLYACHMGPIT(1-nal)VCQPLR(MeG)K (SEQ ID NO: 2), a N1 и N2 спейсера ковалентно присоединены амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: Предпочтительные пептидные димеры согласно настоящему изобретению включают, без ограничения: В случае, когда спейсер присоединен карбаматной связью к активированному фрагменту полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом: В случае, когда спейсер присоединен амидной связью к активированному фрагменту полиэтиленгликоля (ПЭГ), новые пептидные соединения согласно данному изобретению могут быть представлены следующим образом:- 23010095 Димерную структуру можно записать как [Ас-пептид, дисульфид]2Lys-спейсер-PEG20-40K, чтобы обозначить ацетилированный на N-конце пептид, связанный как с -, так и с -аминогруппами лизина,причем каждый пептид содержит внутримолекулярную дисульфидную петлю, а спейсерная молекула образует ковалентную связь между С-концом лизина и фрагментом ПЭГ, имеющим молекулярную массу от примерно 20000 до примерно 40000 Да. Предпочтительные пептидные димеры согласно настоящему изобретению включают, без ограничения: Стереоизомеры (например, D-аминокислоты) двадцати обычных аминокислот, не встречающиеся в природе аминокислоты, такие как а,а-дизамещенные аминокислоты, N-алкиламинокислоты и другие минорные аминокислоты также могут быть подходящими компонентами соединений согласно настоящему изобретению. Примеры минорных аминокислот включают, без ограничения, -аланин, 3 пирридилаланин,4-гидроксипролин,О-фосфосерин,N-метилглицин,N-ацетилсерин,Nформилметионин, 5-гидроксилизин, норлейцин и другие аналогичные аминокислоты и иминокислоты. Возможны также другие модификации, включая модификацию N-конца, модификацию С-конца, замену одной или более встречающихся в природе, генетически кодируемых аминокислот минорными аминокислотами, модификацию боковых радикалов одного или более остатков аминокислот, фосфорилирование пептида и т.п. Последовательности пептидов согласно настоящему изобретению могут присутствовать отдельно- 24010095 или в виде конъюгатов с дополнительными отрезками пептидной цепи на N-конце или С-конце (Nконцевыми или С-концевыми продолжениями). Такие продолжения могут представлять собой естественно кодируемые последовательности пептидов, возможно с невстречающимися в природе последовательностями, или практически без них. Продолжения могут включать, по решению специалиста в данной области, любые добавления, делеции, точечные мутации или другие модификации последовательности, либо их комбинации. В качестве примера, но не ограничения, встречающиеся в природе последовательности могут представлять собой полноразмерные или укороченные последовательности, а также могут включать замены аминокислот, которые создают сайт присоединения углевода, ПЭГ, другого полимера и т.п. путем соединения с боковым радикалом. В одном из вариантов замена аминокислоты приводит к гуманизации последовательности, что делает ее совместимой с иммунной системой человека. Предусмотрены все типы белков слияния, включая такие, в которых последовательности иммуноглобулина примыкают к последовательностям согласно настоящему изобретению, активирующим ЭПОрецепторы, или расположены вблизи от них, с последовательностью неиммуноглобулинового спейсера или без нее. Один вид реализации представляет собой цепь иммуноглобулина, содержащую вместо вариабельной области тяжелой и/или легкой цепи последовательность, активирующую ЭПО-рецептор. Приготовление пептидных соединений согласно данному изобретению. Синтез пептидов. Пептиды согласно данному изобретению могут быть приготовлены классическими способами, известными в данной области. Эти стандартные способы включают синтез полностью в твердой фазе(твердофазный синтез), способы синтеза частично в твердой фазе, конденсации фрагментов, классический синтез в растворе и технологию рекомбинантных ДНК [См., например, Merrifleld J. Am. Chem. Soc. 1963 85:2149]. В одном из способов реализации пептидные мономеры пептидного димера синтезируют отдельно,после чего подвергают димеризации. В другом способе реализации пептидные мономеры пептидного димера соединяют их С-концами через разветвленный третичный амидный линкерный фрагмент LK, который имеет две функциональные группы, которые могут служить сайтами инициации для синтеза пептидов, и третью функциональную группу (например, карбоксильную группу или аминогруппу), которая обеспечивает связывание с другим молекулярным фрагментом (который может, например, присутствовать на поверхности твердого носителя (подложки. В этом случае, два пептидных мономера могут быть синтезированы непосредственно на двух химически активных азотных группах линкерного фрагмента LK (варианта методики твердофазного синтеза). Такой синтез может быть последовательным или одновременным (параллельным). В другом способе реализации два пептидные мономера могут быть синтезированы непосредственно на двух химически активных азотных группах линкерного фрагмента LK (в качестве варианта методики твердофазного синтеза). Такой синтез может быть последовательным или одновременным. В этом способе реализации применяют лизиновый линкерный фрагмент (LK), имеющий две аминогруппы, которые могут служить сайтами инициации для синтеза пептидов, и третью функциональную группу (например,карбоксильную группу лизина, либо аминогруппу амида лизина, остатка лизина, в котором карбоксильная группа была трансформирована в амидный фрагмент -CONH2), которая обеспечивает связывание с другим молекулярным фрагментом (который может, например, присутствовать на поверхности твердого носителя (подложки. В случае, когда предстоит провести последовательный синтез пептидных цепей димера на линкере,две функциональные аминогруппы защищают двумя разными ортогонально удаляемыми защитными группами для аминогрупп (аминзащищающую группу). Защищенный линкер связывают (сшивают) с твердым носителем через третью функциональную группу линкера. Удаляют первую аминзащищающую группу и на первом лишенном защиты аминоостатке синтезируют первый пептид димера. Затем удаляют вторую аминзащищающую группу и на втором лишенном защиты аминоостатке синтезируют второй пептид димера. Например, первый аминоостаток линкера может быть защищен группойAlloc (аллилоксикарбонил), а второй - группой Fmoc (9-флуоренилметилкарбоксил). В этом случае группу Fmoc (но не группу Alloc), можно удалить обработкой слабым основанием [например, 20% пиперидином в диметилформамиде (ДМФ, DMF)] и синтезировать первую пептидную цепь. После этого можно удалить группу Alloc подходящим реагентом (например, Pd(PPh3)/4-метил морфолин и хлороформ) и синтезировать вторую пептидную цепь. Необходимо отметить, что в тех случаях, когда предстоит использовать тиолзащищающие группы для цистеина с целью контроля образования дисульфидных связей(как обсуждается ниже), необходимо применять эту методику, даже если последовательности аминокислот пептидных цепей димера идентичны. В случаях, когда предстоит провести одновременный (параллельный) синтез пептидных цепей димера на линкере, две функциональные аминогруппы защищают одной и той же удаляемой аминзащищающей группой. Защищенный линкер связывают с твердым носителем через третью функциональную группу линкера. В этом случае защиту с двух защищенных функциональных групп удаляют одновременно, и на лишенных защиты аминогруппах синтезируют одновременно две пептидные цепи. Необходимо отметить, что при применении этой методики последовательности пептидных цепей будут- 25010095 идентичными, а все тиолзащищающие группы для остатков цистеина одинаковы. Предпочтительным способом синтеза пептидов является твердофазный синтез. Процедуры синтеза пептидов в твердой фазе хорошо известны в данной области [См., например, Stewart Solid Phase Peptide(изд-во Houben-Weyl, Stuttgart (Штедгарт 2002]. В твердофазном синтезе, синтез обычно начинают с Сконца пептида, используя -аминозащищенную смолу. Подходящий исходный материал можно приготовить, например, путем присоединения требуемой -аминокислоты к хлорометилированной смоле, карбоксиметиловой смоле, полистиреновой смоле, бензгидриламиновой смоле и т.п. Одну из таких хлориметилированных смол продает компания Bio Rad Laboratories (Ричмонд, Калифорния) под торговой маркой BIO-BEADS SX-1. Препарат гидроксиметиловой смолы был описан Bodonszky et al. (1966) Chem.Ind. London 38:1597. Бензгидриламиновая смола (ВНА) была описана Pietta, Marshall (1970) Chem. Coramun. 650, а гидрохлоридная форма доступна коммерчески (Beckman Inxtruments, Inc, Пало Альто, Калифорния, США). Например, -аминозащищенная аминокислота может быть связана с хлорометилированной смолой с помощью бикарбонат цезия (катализатор), согласно способу, описанному у Gisin (1973)Helv. Chim. Acta 56:1467. После первоначального связывания -аминозащищающую группу удаляют, например, используя растворы трифторуксусной кислоты (ТФА, TFA) или соляной кислоты (HCl) в органических растворителях при комнатной температуре. После этого -аминозащищенные аминокислоты успешно связываются с растущей пептидной цепью, связанной с носителем, -аминозащищающие группы представляют собой те группы, которые применяют в области поэтапного синтеза пептидов, включая защитные группы алкильного типа (например, формил, трифторацетил, ацетил), ароматические защитные группы уретанового типа [например, бензилоксикарбоил (Cbz) и замещенный Cbz], алифатические уретановые защитные группы [например, t-бутилоксикарбонил (Вое), изопропилоксикарбонил, циклогексилоксикарбонил], и защитные группы аклильного типа (например, бензил, трифенилметил), флуоренилметил оксикарбонил(Fmoc), аллилоксикарбонил (Alloc) и 1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил(Dde). Группы, защищающие боковые радикалы (обычно эфиры, сложные эфиры, тритил, РМС и т.п.) остаются неповрежденными в ходе связывания и не отщепляются в ходе удаления защиты N-концевых групп или в ходе связывания. Удаление групп, защищающих боковые радикалы, должно становиться возможным после завершения синтеза конечного пептида и при таких условиях реакции, которые не приведут к изменению целевого пептида. Группы, защищающие боковой радикал тирозина, включают тетрагидропиранил, трет-бутил, тритил, бензил, Cbz, Z-Br-Cbz и 2,5-дихлоробензил. Группы, защищающие боковой радикал аспарагина, включают бензил, 2,6-дихлоробензил, метил, этил и циклогексил. Группы, защищающие боковой радикал треонина и серина, включают ацетил, бензоил, тритил, тетрагидропиранил, бензил, 2,6-дихлоробензил и Cbz. Группы, защищающие боковой радикал аргинина, включают нитро-, Tosyl (Tos), Cbz, адамантилоксикарбонил, мезитоилсульфонил (Mts), 2,2,4,6,7 пентаметилдигидробензофуран-5-сульфонил (Pbf), 4-метокси-2,3,6-триметил-бензансульфонил (Mtr) илиBoc. Группы, защищающие боковой радикал лизина, включают Cbz, 2-хлоробензилоксикарбонил (2-ClCbz), 2-бромобензилоксикарбонил (2-Br-Cbz), Toc или Boc. После удаления -аминозащищающих групп остающиеся защищенными аминокислоты поэтапно связывают в желаемом порядке. Обычно проводят реакцию каждой защищенной аминокислоты в примерно 3-кратном избытке, используя подходящий активатор карбоксильной группы, такой как 2-(1 Нбензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафлуорофосфат (HBTU) или дициклогексилкарбодимид (DDC), растворенный, например, в метиленхлориде (CH2Cl2), N-метилпирролидоне, диметилформамиде (DMF) или их смесей. После завершения синтеза желательной последовательности аминокислот, желательные пептиды отсоединяют от носителя (смолы) путем обработки реагентом, таким как трифторуксусная кислота (TFA) или фтороводород (HF), который не только отщепляет пептид от смолы, но и отщепляет все оставшиеся группы, защищающие боковые радикалы. В случае использования хлорметилированной смолы в результате обработки фтороводородом получают пептидные кислоты в растворе. В случае использования бензгидриламино смолы в результате обработки фтороводородом получают непосредственно амид пептида. В качестве альтернативы, в случае применения хлорметилированной смолы, пептид с защищенными боковыми радикалами может быть отсоединен путем обработки смолы, к которой присоединен пептид,аммиаком, что дает желаемый амид с защищенными боковыми радикалами, или алкиламином, что дает алкиламид или диалкиламид с защищенными боковыми радикалами. Защиту боковых радикалов затем удаляют стандартным образом путем обработки фторводородом с получением свободных амидов, алкиламидов или диалкиламидов. При приготовлении сложных эфиров согласно данному изобретению применяют смолы, используемые для приготовления кислот пептидов, а пептиды с защищенными боковыми радикалами соединяют с использованием основания и соответствующим спирта (например, метанола). Затем группы, защищающие боковые радикалы, удаляют обычным способом путем обработки фтороводородом, в результате- 26010095 чего получают желаемый эфир. Для синтеза пептидов можно также применять процедуры, в которых произведены замены 20 встречающихся в природе генетически кодируемых аминокислот на другие аминокислоты в одной, двух или более позиций состава позиций согласно данному изобретению. Синтетические аминокислоты, которые могут быть введены путем замены в пептиды согласно настоящему изобретению, включают, без ограничения, N-метил, L-гидроксипропил, L-3, 4-дигидроксифенилаланин, -аминокислоты, такие как L-гидроксилизил, Dметилаланинил, Lметилаланил, -аминокислоты и изоквинолил. Не встречающиеся в природе синтетические аминокислоты могут также быть введены в пептиды согласно настоящему изобретению. Модификация пептидов. Также можно модифицировать амино- и/или карбоксильные концы пептидных соединений согласно настоящему изобретению для того, чтобы получить другие соединения согласно данному изобретению. Например, N-конец может быть ацетилирован уксусной кислотой или ее галоген-производными,такими как -хлоруксусная кислота, -бромуксусная кислота или -йодуксусная кислота. Можно заменить встречающиеся в природе боковые радикалы 20 генетически кодируемых аминокислот (или стереоизомерических D-аминокислот) другими боковыми радикалами, например, такими группами, как алкильные группы, низшие алкилы, 4-, 5-, 6- до 7-членных алкилов, низший алкил-амид-,алкокси-, гидрокси-, карбоксигруппы и их производные с низшими эфирами, а также 4-, 5-, 6- до 7 членных гетероциклические группы. В частности, можно применять аналоги пролина, в которых размер кольца остатка пролина измененили с 4-членного на 5-, 6- или 7-членное. Циклические группы могут являться насыщенными или ненасыщенными, а ненасыщенные - ароматическими или неароматическими. Гетероциклические группы предпочтительно содержат следующие гетероатомы (один или более): азот, кислород и/или серу. Примеры таких групп включают фуразанил-, фуранил-, имидазолидил-, имидазолил-, имидазолил-, изотиазолил-, изоксазолил-, морфолинил- (например, морфолино-), оксазолил-,пиперазинил- (например, 1-пиперазил-), пиперидил- (например, 1-пиперидил-, пиперидино-), пиранил-,пиразинил-, пиразолидил-, пиразонил-, пиразолил-, пиридазинил-, пиридил-, пиримидинил-, пирролидинил- (например, 1-пирролидинил-), пирролинил-, пирролил-, тиадиазолил-, тиазолил-, тиенил-, тиоморфолинил- (например, тиоморфолино-) и триазолилгруппы. Эти гетероциклические группы могут являться замещенными или незамещенными. В случае замещенной группы, заместитель может представлять собой алкил, алкоксигруппу, галоген, кислород, либо замещенный или незамещенный фенил. Можно без труда модифицировать пептиды путем фосфорилирования, а также другими способами[например, как описано в Hruby et al. (1990) Biochem. J. 268:249-262]. Пептидные соединения согласно данному изобретению также могут служить структурной моделью непептидных соединений со сходной биологической активностью. Специалисты в данной области осознают, что доступно множество методик, позволяющих конструировать соединения с биологической активностью, идентичной или аналогичной активности пептидного соединения-образца, но с более подходящей, чем у взятого за образец пептида, активностью в отношении растворимости, стабильности и подверженности гидролизу и протеолизу [См. Morgan, Gainor (1989) Ann. Rep. Med. Chem. 24:243-252]. Эти методики включают замену пептидного остова остовом, составленным из фосфонатов, амидатов, карбаматов, сульфонамидов, вторичных амидов и N-метиламинокислот. Образование дисульфидных связей. Соединения согласно настоящему изобретению содержат две внутримолекулярные дисульфидные связи. Такие дисульфидные связи могут быть образованы путем окисления остатков цистеина в каждом пептидном мономере. В одном из способов реализации образование связей между остатками цистеина контролируют, выбирая тип и концентрацию окисляющего вещества таким образом, чтобы эффективно оптимизировать образование желательного изомера. Например, окисления пептидного димера с преимущественным (по сравнению с образованием межмолекулярных дисульфидных связей) образованием двух внутримолекулярных дисульфидных связей (по одной в каждой пептидной цепи) достигают, когда окисляющее вещество представляет ДМСО (DMSO) или йодин (I2). В других способах реализации образование связей между остатками цистеина контролируют путем выборочного применения тиолзащищающих групп в ходе синтеза пептидов. Например, если желательно получить димер с двумя межмолекулярными дисульфидными связями, первый мономер синтезируют с двумя остатками цистеина в последовательности каркаса, защищенными первой тиолзащищающей группой [например, тритильной (Trt), аллилоксикарбонильной(Alloc), 1-(4,4-диметил-2,6-дициклооксигекс-1 илиден)этильной (Dde) и т.п.], затем синтезируют второй мономерный пептид с двумя остатками цистеина в коровой последовательности, защищенными второй тиолзащищающей группой [например, ацетамидометильной (Acm) t-бутильной (tBu) и т.п]. После этого первую тиолзащищающую группу удаляют, что приводит к бисульфидной циклизации первого мономера, а затем удаляют вторую тиолзащищающую группу, что приводит к бисульфидной циклизации второго мономера. В других способах реализации данного изобретения предусмотрены аналоги этих дисульфидных- 27010095 производных, в которых один из атомов серы был заменен на группу CH2 или другой изотер серы. Эти аналоги могут быть приготовлены из соединений согласно настоящему изобретению, в которых каждый пептидный мономер содержит по меньшей мере один остаток С или гомоцистемина и -амино-масляную кислоту вместо второго остатка цистеина, путем внутримолекулярного или межмолекулярного замещения, которое производят, известными в данной области способами [см., например, Barker et al.(1992) J. Med. Chem. 35:2040-2048 и Or et al. (1991) J. Org. Chem. 56:3146-3149]. Специалист в данной области легко поймет, что этого замещения может также добиться, используя другие гомологи -амино-масляной кислоты и гомоцистеина. В дополнение к описанным выше стратегиям циклизации, можно применять другие стратегии циклизации пептидов, не связанные с образованием дисульфидных связей. Такие альтернативные стратегии циклизации включают, например, стратегии амидной циклизации наравне со стратегиями, связанными с образованием тиоэфирных связей. Таким образом, соединения согласно настоящему изобретению могут существовать в циклической форме, либо с внутримолекулярной амидной связью, либо с внутримолекулярной тиоэфирной связью. Например, может быть синтезирован пептид, в котором один цистеин коровой последовательности заменен на лизин, а второй цистеин заменен на глютаминовую кислоту. Следовательно, циклический мономер может быть образован посредством образования амидной связи между боковыми радикалами этих двух остатков. В качестве альтернативы может быть синтезирован пептид, в котором один цистеин последовательности каркаса заменен на лизин (или серин). Тогда циклический мономер может быть образован посредством образования тиоэфирной связи между боковыми радикалами этого лизина (или серина) и второго остатка цистеина последовательности каркаса. По существу, в дополнение к стратегиям дисульфидной циклизации для циклизации пептидов согласно настоящему изобретению можно без труда применять как стратегию амидной циклизации, так и стратегию тиоэфирной циклизации. В качестве альтернативы, к N-концу пептида может быть присоединена -замещенная уксусная кислота (кэппирование конца пептида), где -замещенная уксусная кислота представляет собой отделяемую группу, такую как -галоуксусная кислота, например, -хлороуксусная кислота, бромоуксусная кислота или -йодоуксусная кислота. Добавление линкера на основе разветвленного третичного амида. Пептидные мономеры могут быть димеризованы разветвленным третичным амидным линкерным фрагментом. В одном из способов реализации линкер вводят в пептид в ходе синтеза пептида. Например,если линкерный Lk фрагмент содержит две функциональные группы, которые могут служить сайтами инициации для синтеза пептида и одну или более других функциональных групп (например, карбоксильную группу или аминогруппу), которые дают возможность связывать один или более молекулярных фрагментов, линкер может быть конъюгирован с твердым носителем. После этого можно синтезировать два пептидных мономера непосредственно на двух химически активных группах азота линкерного Lk фрагмента (вариант методики твердофазного синтеза). В альтернативных способах реализации линкер может быть конъюгирован с двумя пептидными мономерами пептидного димера после синтеза пептидов. Такая конъюгация может быть достигнута способами, хорошо разработанными в данной области. В одном из способов реализации линкер содержит две функциональные группы, подходящие для присоединения к функциональным группам-мишеням синтезированных пептидных мономеров. Например, может быть проведена реакция линкера, содержащего две карбоксильные группы, либо предварительно активированные, либо в присутствии подходящего связующего реагента с аминогруппами-мишенями бокового радикала лизина каждого из двух пептидных мономеров. Например, пептидные мономеры могут быть химически связаны с третичным амидным линкеромAC1O-CH2-X-CH2-C2O-B где X обозначает NCO-(CH2)2-NH-Y, a Y обозначает подходящую защитную группу, такую как tбутилоксикарбонильная (Boc) защитная группа, A обозначает подходящую функциональную группу,такую как N-оксисукцинимид, используемый для конъюгирования С 2 линкера с -аминогруппой Сконцевого остатка лизина второго пептидного мономера. Дополнительно, например, пептидные мономеры могут быть химически связаны с третичным амидным линкеромA-C1O-CH2-X-CH2-C2O-B 3 где X обозначает NCO-(CH2)2-NH-C O, А обозначает подходящую функциональную группу, такую какN-оксисукцинимид, используемую для конъюгирования С 1 линкера с -аминогруппой С-концевого остатка лизина первого пептидного мономера, а В обозначает подходящую функциональную группу, такую как N-оксисукцинимид, используемую для конъюгирования С 2 линкера с -аминогруппой Сконцевого остатка лизина второго пептидного мономера, а третичный амидный линкер химически связан со спейсерным фрагментомY-NH-(CH2)4-C4H-NH-Y 3 где С , входящий в X, ковалентно связан с С 4 спейсера, a Y обозначает подходящую защитную группу,такую как t-бутилоксикарбонильная (Boc) защитная группа.- 28010095 Добавление линкера на основе лизина. Пептидные мономеры могут быть димеризованы лизиновым Lk линкерным фрагментом. В одном из способов реализации лизиновый линкер вводят в пептид в ходе синтеза пептида. Например, если лизиновый линкерный Lk фрагмент содержит две функциональные группы, которые могут служить сайтами инициации для синтеза пептида, и одну или более функциональных групп (например, карбоксильную группу или аминогруппу), которая дает возможность связывать один или более молекулярных фрагментов, линкер может быть конъюгирован к твердому носителю. После этого можно синтезировать два пептидных мономера непосредственно на двух химически активных группах азота лизинового линкерногоLk фрагмента (вариант методики твердофазного синтеза). В альтернативных способах реализации, в которых пептидные димер димеризуют лизиновым линкерным Lk фрагментом, указанный линкер может быть конъюгирован с двумя пептидными мономерами пептидного димера после синтеза пептидов. Такая конъюгация может быть достигнута способами, хорошо разработанными в данной области. В одном из способов реализации линкер содержит по меньшей мере две функциональные группы, подходящие для присоединения к функциональным группаммишеням синтезированных пептидных мономеров. Например, может быть проведена реакция двух свободных аминогрупп лизина с С-концевыми карбоксильными группами каждого из пептидных мономеров. Добавление спейсера. Пептидные соединения согласно данному изобретению содержат также спейсерный фрагмент. В одном из способов реализации спейсерный фрагмент может быть введен в пептид в ходе синтеза пептида. Например, если спейсер содержит свободную аминогруппу и вторую функциональную группу (например, карбоксильную группу или аминогруппу), которая дает возможность связывания с другим молекулярным фрагментом, спейсер может быть конъюнгирован с твердым носителем. В одном из способов реализации спейсер, содержащий две функциональные группы, вначале связывают с твердым носителем при помощи первой функциональной группы. Затем лизиновый линкерныйLk фрагмент, имеющий две функциональные группы, которые могут служить сайтами инициации синтеза пептидов, и третью функциональную группу (например, карбоксильную группу или аминогруппу), которая обеспечивает связывание с другим молекулярным фрагментом, конъюгируют со спейсером через вторую функциональную группу спейсера и третью функциональную группу линкера. После этого можно синтезировать два пептидных мономера непосредственно на двух функциональных азотных группах лизинового линкерного Lk фрагмента (вариант методики твердофазного синтеза). Например, можно провести реакцию связанного с твердым носителем спейсера со свободной аминогруппой с лизиновым линкером через свободную карбоксильную группу линкера. В альтернативных способах реализации спейсер может быть конъюгирован с двумя пептидными мономерами пептидного димера после синтеза пептидов. Такая конъюгация может быть достигнута способами, хорошо разработанными в данной области. В одном из способов реализации линкер содержит по меньшей мере одну функциональную группу, подходящую для присоединения к функциональным группам-мишеням синтезированных пептидных мономеров. Например, может быть проведена реакция спейсера со свободной аминогруппой с С-концевой карбоксильной группой пептида. В другом примере, может быть проведена реакция свободной карбоксильной группы линкера со свободной аминогруппой амида лизина. Присоединение полиэтиленгликоля (ПЭГ, PEG). В последние годы водорастворимые полимеры, такие как полиэтиленгликоль, применяют для модификации диагностически и терапевтически важных пептидов. Считается, что присоединение таких полимеров увеличивает биологическую активность, продлевает время циркуляции в крови, снижает иммуногенность, увеличивает растворимость в воде и повышает устойчивость к расщеплению протеазами. Например, сообщалось, что ковалентное присоединение ПЭГ к терапевтическим пептидам, таким как интерлейкины [Knauf et al. (1988) J. Biol. Chem. 263;15064; Tsutsumi et al. (1995) J. Controlled Release 33:447)], интерфероны (Kita et al. (1990) Drug Des. Delivery 6:157), каталаза (Abuchowski et al. (1977) J.Biol. Chem. 252:582), супероксид дисмутаза (Beauchamp et al. (1983) Anal. Biochem. 131:25) и аденозин деаминаза (Chen et al. (1981) Biochim. Biophy. Acta 660:293), увеличивает время их полужизни in vivo и/или снижает их иммуногенность и антигенность. Пептидные соединения согласно данному изобретению могут содержать фрагмент полиэтиленгликоля (ПЭГ), который ковалентно присоединен к разветвленному третичному амидному линкеру карбаматной связью или амидной связью. Пример ПЭГ, используемый в настоящем изобретении, представляет собой линейный неразветвленный ПЭГ, имеющий молекулярную массу от примерно 20 до примерно 40 кДа (примерно указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые - меньше указанной молекулярной массы). Предпочтительно ПЭГ имеет молекулярную массу от примерно 30 до примерно 40 кДа. Другой пример ПЭГ, используемого в настоящем изобретении, представляет собой линейный ПЭГ,имеющий молекулярную массу от примерно 10 до примерно 60 кДа (примерно указывает на то, что в препаратах ПЭГ некоторые молекулы будут иметь массу больше, а некоторые - меньше указанной моле- 29010095 кулярной массы). Предпочтительно ПЭГ имеет молекулярную массу от примерно 20 до примерно 40 кДа. Более предпочтительно ПЭГ имеет молекулярную массу примерно 20 кДа. Примеры способов ковалентного присоединения ПЭГ (ПЭГирования) описаны ниже. Эти иллюстративные описания не призваны быть ограничивающими. Средний специалист в данной области поймет,что в данной области хорошо известно множество различных способов ковалентного присоединения разнообразных видов ПЭГ. Также, настоящее изобретение охватывает пептидные соединения, к которым был присоединен ПЭГ любым из ряда известных в данной области способов присоединения. Например, ПЭГ может быть ковалентно связан с линкером через химически активную группу, с которой может быть связана молекула ПЭГ (например, свободная карбоксильная или аминогруппа). Молекулы ПЭГ можно присоединить к аминогруппе, используя метоксилированный ПЭГ (мПЭГ, mPEG),имеющий различные химически активные фрагменты. Такие полимеры включают мПЭГ-сукцинимидил сукцинат, мПЭГ-сукцинимидил карбонат, мПЭГ-имидат, мПЭГ-4-нитрофенил карбонат и хлорид мПЭГциануровой кислоты. Аналогично, молекулы ПЭГ можно присоединить к карбоксильным группам, используя метоксилированный ПЭГ со свободной аминогруппой (мПЭГ-NH2, mPEG-NH2). В некоторых способах реализации линкер или спейсер содержит концевую аминогруппу (т.е. расположенную на конце спейсера). Можно проводить реакции этой концевой аминогруппы с подходящей активированной молекулой ПЭГ, такой как мПЭГ-пара-нитрофенилкарбонат (мПЭГ-НФК, mPEG-NPC),в результате которой образуется прочная карбаматная связь. В качестве альтернативы, можно проводить реакции этой концевой аминогруппы с подходящим образом активированной молекулой ПЭГ, такой как мПЭГ-сукциинимидил бутират (mPEG-SBA) или мПЭГ-сукциинимидил протионат (mPEG-SPA), содержащей химически активную N-гидроксил-сукцинимидную группу (NHS), в результате которой образуется стабильная карбаматная связь. В других способах реализации химически активная группа линкера содержит карбоксильную группу, которую можно активировать для образования ковалентной связи с аминсодержащей молекулой ПЭГ в подходящих реакционных условиях. Подходящие молекулы ПЭГ включают мПЭГ-NH2, а подходящие реакционные условия включают карбоимид-опосредованное образование амидов или ему подобные. Методики анализа активности агонистов ЭПО-рецепторов. Методики функционального анализа in vitro. При анализе конкурентного связывания in vitro количественно определяют способность тестируемых пептидов конкурировать с ЭПО за связывание с ЭПО-рецептором. Например (см., например, описание в патенте США U.S. Patent 5733569), внеклеточный домен ЭПО-рецептора человека (ЭПОсвязывающий белок, ЭСБ) может быть получен по технологии рекомбинантных ДНК в клетках E.coli, а рекомбинантный белок, связанный с твердым носителем (подложкой), таким как поверхность ячейки микротитрационного планшета или синтетическая гранула (bead) [например, Sulfolink beads от PierceChemical Co. (Рокфорд, Иллинойс, США)]. Затем иммобилизованный ЭСБ инкубируют с меченым рекомбинантным ЭПО, либо с меченым рекомбинантным ЭПО и тестируемым пептидом. В таких экспериментах применяют серийные разведения тестируемого пептида. По результатам анализа без добавления тестируемого пептида определяют полное связывание ЭРО с ЭСБ. Для реакций, в которых присутствует тестируемый пептид, определяют количество связанного ЭПО и выражают его в процентных долях от связывания контроля (полное связывание=100%). Строят график, на котором эти значения откладывают против концентрации пептида. Значение IC50 определяют как концентрацию тестируемого пептида, при которой связывание ЭПО с ЭСБ уменьшается на 50% (т.е. 50% ингибирование связывания ЭПО). В другом способе анализа конкурентного связывания in vitro измеряют световой сигнал, генерируемый как функция близости двух гранул: ЭПО-конъюгированной гранулы и ЭПО-рецепторконъюгированной гранулы. Близость гранул порождается связыванием ЭПО и ЭПР-рецептора. Тестируемый пептид, который конкурирует с ЭПО за связывание с ЭПО-рецептором, будет препятствовать этому связыванию, вызывая уменьшение свечения. Концентрацию тестируемого пептида, при которой происходит ослабление свечения на 50%, определяют как значение IC50. Пептиды согласно настоящему изобретению очень эффективно конкурируют с ЭПО за связывание с ЭПО-рецепторами. Проявлением этой усиленной функции является их способность ингибировать связывание ЭПО в очень низких концентрациях (т.е. они обладают очень низкими значениями IC50). Биологическую активность и эффективность мономерных и димерных пептидов - агонистов ЭПОрецептора можно измерить, используя клеточные функциональные методики анализа. Один способ анализа основан на применении В-клеток-предшественников, экспрессирующих ЭПОрецептор человека и трансфецированных с конструкцией, содержащей репортерный ген люциферазы под контролем промотора fos. На воздействие ЭПО или другого агониста ЭПО-рецептора, такие клетки отвечают синтезом люциферазы. При добавлении к своему субстрату, люциферину, люцифераза вызывает свечение. Следовательно, уровень активации ЭПО-рецепторов в таких клетках можно количественно определить, измеряя активность люциферазы. Активность тестируемого пептида измеряют путем добавления серийных разведений тестируемого пептида к клеткам, которые затем инкубируют в течение 4 ч. После инкубации к клеткам добавляют субстрат - люциферин и измеряют интенсивность свечения. Концентрация тестируемого пептида, при которой интенсивность свечения равна половине максимального
МПК / Метки
МПК: C07K 14/505, C07K 7/64, A61K 38/12, A61K 38/18, C07K 14/71
Метки: эритропоэтина, новые, пептиды, связываются, которые, рецептором
Код ссылки
<a href="https://eas.patents.su/30-10095-novye-peptidy-kotorye-svyazyvayutsya-s-receptorom-eritropoetina.html" rel="bookmark" title="База патентов Евразийского Союза">Новые пептиды, которые связываются с рецептором эритропоэтина</a>
Предыдущий патент: Новые соединения циннамата бензо[β]пирано[3,2-h]акридин-7-она, способ их получения и фармацевтические композиции, которые их содержат
Следующий патент: Экспрессирующие векторы, содержащие ie2-промотор мсмv
Случайный патент: Способ получения этексилата дабигатрана