Способ получения этексилата дабигатрана
Номер патента: 23117
Опубликовано: 29.04.2016
Авторы: Шмитт Штефан, Мюллер-Бёттихер Германн, Дах Рольф, Хайтгер Хельмут, Гнад Фридер, Майнек Зигфрид, Хеддесхаймер Инго
Формула / Реферат
1. Способ получения соединений формулы 7
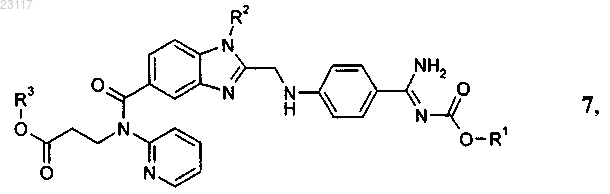
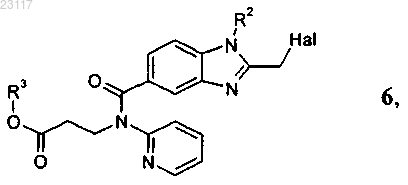
отличающийся тем, что соединение формулы 6
подвергают взаимодействию с соединением формулы 3
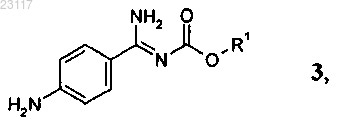
при этом в соединениях приведенных выше формул 7, 6 и 3 остатки R1, R2 и R3 независимо друг от друга представляют собой С1-С6алкил, a Hal обозначает хлор или бром.
2. Способ по п.1, при осуществлении которого соединение формулы 6
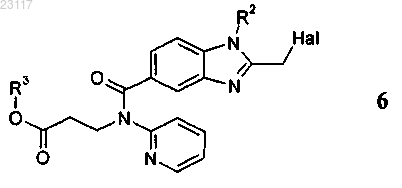
получают реакцией соединения формулы 4
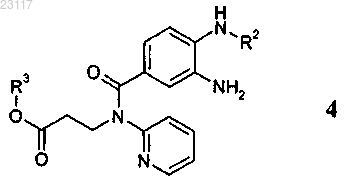
с соединением формулы 5, выбранным из группы, включающей галогенуксусный ангидрид, галогенуксусную кислоту, ортоэфир галогенуксусной кислоты и галогенацетилхлорид, где галоген (Hal) представляет собой хлор или бром, при этом в соединениях приведенных выше формул 4 и 6 остатки R1, R2 и R3 независимо друг от друга представляют собой C1-С6алкил.
3. Способ по п.1 или 2, при осуществлении которого соединение формулы 3 получают реакцией соединения формулы 1
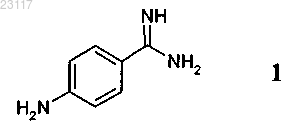
с соединением формулы 2
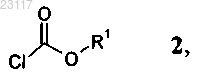
при этом в соединениях приведенных выше формул 3 и 2 остатки R1, R2 и R3 независимо друг от друга представляют собой C1-С6алкил.
4. Способ по одному из пп.1-3, где остатки R1, R2 и R3 независимо друг от друга представляют собой метил, этил, пропил, бутил или гексил.
5. Способ по одному из пп.1-4, где R1 представляет собой гексил, R2 представляет собой метил, a R3 представляет собой этил.
6. Способ по одному из пп.1-5, при осуществлении которого соединение формулы 5 выбирают из группы, включающей хлоруксусный ангидрид, хлоруксусную кислоту, ортоэфир хлоруксусной кислоты и хлорацетилхлорид.
7. Способ по одному из пп.1-5, при осуществлении которого соединение формулы 5 выбирают из группы, включающей хлоруксусный ангидрид и ортоэфир хлоруксусной кислоты.
8. Способ по одному из пп.1-7, при осуществлении которого взаимодействие промежуточного продукта формулы 6 с соединением формулы 3 проводят в двухфазной системе растворителей, состоящей из воды и не смешивающегося с водой органического растворителя.
9. Способ по п.8, при осуществлении которого взаимодействие промежуточного продукта формулы 6 с соединением формулы 3 проводят в двухфазной системе растворителей, состоящей из воды и одного либо нескольких растворителей, выбранных из группы, включающей толуол, тетрагидрофуран, 2-метилтетрагидрофуран, бутилацетат, циклогексан и этилацетат.
10. Соединение формулы 6
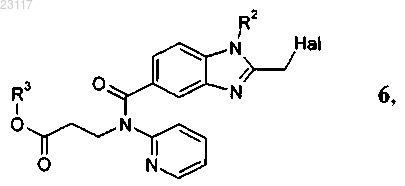
где остатки R2 и R3 независимо друг от друга представляют собой С1-С6алкил, а Hal обозначает хлор или бром.
11. Соединение по п.10, где R2 представляет собой метил, R3 представляет собой этил, a Hal обозначает хлор.
Текст
СПОСОБ ПОЛУЧЕНИЯ ЭТЕКСИЛАТА ДАБИГАТРАНА В патенте описан усовершенствованный способ получения этексилата дабигатрана, а также аналогичных соединений формулы (7)(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Предпосылки создания изобретения Замещенные (4-бензимидазол-2-илметиламино)бензамидины, прежде всего этексилат дебигатрана(CAS 593282-20-3), уже известны из публикации WO 98/37075 по их применению в качестве действующих веществ, обладающих ингибирующим тромбин и увеличивающим тромбиновое время действием. Основными показаниями к применению соединения приведенной ниже химической формулы I являются послеоперационная профилактика тромбозов глубоких вен и профилактика инсультов (профилактика инсульта вследствие мерцательной аритмии, сокращенно "ПИМА"). В указанной публикации WO 98/37075 замещенные (4-бензимидазол-2-илметиламино)бензамидины предлагается получать взаимодействием соответственно замещенных (4-бензимидазол-2-илметиламино) бензонитрилов с аммиаком. Однако этот способ с технологической точки зрения связан с исключительно высокими затратами и приводит к значительному загрязнению окружающей среды кислотами, которые требуется утилизировать (см. также WO 2007/071743, WO 2007/071742). Ниже описан усовершенствованный способ получения этексилата дабигатрана, а также аналогичных соединений. Благодаря переходу к использованию новых исходных материалов, применению межфазного катализа и образованию бензимидазола без использования агентов сочетания удается значительно повысить эффективность синтеза этексилата дабигатрана. При этом высокая степень избирательности при реакции сочетания промежуточных продуктов (стадия 2) является основным фактором, способствующим повышению экономической эффективности синтеза этексилата дабигатрана новым способом. Подробное описание изобретения В настоящем изобретении предлагается способ получения соединений формулы 7 в соответствии со следующей схемой: где R1, R2 и R3 в данном случае и в последующем независимо друг от друга обозначают C1-С 6 алкил,Hal обозначает хлор или бром, предпочтительно хлор, а в качестве соединения формулы 5 согласно изобретению можно использовать галогенуксусный ангидрид формулы 5b-1, галогенуксусную кислоту формулы 5b-2, ортоэфир галогенуксусной кислоты формулы 5b-3 или галогенацетилхлорид формулы 5b4, а предпочтительно использовать в качестве соединения формулы 5 галогенуксусный ангидрид формулы 5b-1 или ортоэфир галогенуксусной кислоты формулы 5b-3. В предпочтительном варианте R1, R2 и R3 в данном случае и в последующем независимо друг от друга обозначают метил, этил, пропил, бутил или гексил, особенно предпочтительно метил, этил или гексил, прежде всего R1 обозначает гексил, R2 обозначает метил, a R3 обозначает этил. На стадии 1 а в результате взаимодействия парааминобензамидина формулы 1 и C1-С 6 алкилхлорформиата формулы 2 получают промежуточный продукт формулы 3 (4-аминобензамидин-С 1 С 6 алкилкарбамат). Стадия 1 а С этой целью аминобензамидин формулы 1, предпочтительно в виде гидрохлорида, особенно предпочтительно в виде дигидрохлорида, охлаждают в полярном растворителе, выбранном из группы, вклю-1 023117 чающей ацетон, этилацетат и бутилацетат, предпочтительно в ацетоне, до температуры ниже 40 С, предпочтительно до температуры в пределах от 10 до 35 С, особенно предпочтительно от 15 до 25 С, прежде всего от 18 до 22 С. Затем добавляют NaOH или сопоставимое с ним основание и хлорформиат формулы 2 (R представляет собой C1-С 6 алкил). После протекания реакции в течение примерно 5-30 мин, предпочтительно 10-20 мин, фазы разделяют. Полученную смесь концентрируют, разбавляют полярным растворителем, выбранным из группы,включающей бутилацетат и этилацетат, предпочтительно бутилацетатом, и затем очищают водой путем экстракции. Далее осаждают продукт кислотой S, выбранной из группы, включающей соляную кислоту, щавелевую кислоту и метансульфоновую кислоту, предпочтительно соляной кислотой, и при необходимости промывают органическими растворителями, выбранными из группы, включающей ацетон, бутилацетат,этилацетат и их смеси, предпочтительно смесью ацетона и бутилацетата. Предпочтительное соотношение в смеси между ацетоном и бутилацетатом составляет 1:1. В результате получают соединение формулы 3 в виде соответствующей соли вышеуказанной кислоты S. На проводимой параллельно стадии 16 взаимодействием соединения формулы 4 с соединением формулы 5 получают промежуточный продукт формулы 6. Стадия 16 Синтез бензимидазолов с использованием активированных агентами сочетания карбоновых кислот или их хлорангидридов известен, однако применение -монохлоруксусных ангидридов в этих целях до настоящего времени в литературе не описано. При этом в качестве соединения формулы 5 согласно изобретению можно использовать следующие соединения: вариант 1 б-1: галогенуксусный ангидрид формулы 5b-1,вариант 1 б-2: галогенуксусная кислота формулы 5b-2,вариант 1 б-3: ортоэфир галогенуксусной кислоты формулы 5b-3,предпочтительно формулы Hal-CH3COR4)3 (R4 в каждом случае независимо обозначает C1 С 6 алкил, предпочтительно метил или этил), например, 2,2,2-триэтоксихлорэтан,вариант 1 б-4: галогенацетилхлорид формулы 5b-4. На приведенной выше схеме галоген (Hal) представляет собой бром или хлор, предпочтительно хлор. Во всех вариантах 1 б-1, 1 б-2, 1 б-3 и 1 б-4 предварительное выделение диамина формулы 4 (R2/3 представляют собой С 1-С 6 алкил) не требуется. В реакции можно также использовать раствор продукта,получаемого в реакции восстановления нитросоединения, описанной в уровне техники (см. WO 98/37075, WO 2007/071743, WO 2007/071742). В варианте 1 б-1 соединение формулы 4 суспендируют в охлажденном растворителе, выбранном из группы, включающей этилацетат, бутилацетат и тетрагидрофуран, предпочтительно в этилацетате, поддерживая температуру ниже 50 С, предпочтительно в пределах от 0 до 30 С, особенно предпочтительно от 5 до 25 С, прежде всего от 18 до 22 С. Затем к суспензии добавляют, например, хлоруксусный ангидрид формулы 5b-1' после чего нагревают до температуры в пределах от 50 до 80 С, предпочтительно от 55 до 75 С, особенно предпочтительно от 60 до 70 С, прежде всего до температуры 65 С. По истечении 1-6 ч, предпочтительно 1-4 ч, особенно предпочтительно 1-3 ч, прежде всего 2 ч, при температуре в пределах от 20 до 60 С, предпочтительно от 30 до 50 С, особенно предпочтительно от 35 до 45 С, прежде всего при температуре 40 С, добавляют слабое основание, выбранное из группы, включающей карбонат калия, карбонат натрия и гидрокарбонат натрия, предпочтительно карбонат калия, и перемешивают в течение последующих 30-60 мин, предпочтительно в течение 40-50 мин, особенно предпочтительно в течение 45 мин. После фильтрации фильтрат промывают растворителем, выбранным из группы, включающей этилацетат, бутилацетат и тетрагидрофуран, предпочтительно этилацетатом, концентрируют и при температуре в пределах от 25 до 65 С, предпочтительно от 35 до 55 С, особенно предпочтительно от 40 до 50 С, прежде всего при температуре 45 С, осаждают добавлением еще одного растворителя, выбранного из группы, включающей метил-трет-бутиловый эфир (МТБЭ) и тетрагидрофуран, предпочтительно добавлением МТБЭ. Охлаждение смеси позволяет повысить эффективность осаждения. Полученный таким путем продукт промывают органическими растворителями, выбранными из группы, включающей этилацетат, бутилацетат, МТБЭ, тетрагидрофуран и их смеси, предпочтительно смесью этилацетата и МТБЭ. После сушки фильтровального осадка получают продукт формулы 6. В варианте 1 б-2 соединение формулы 4 смешивают в толуоле с молекулярным ситом (4) и, например, хлоруксусной кислотой. Затем смесь нагревают до температуры максимум 60 С, предпочтительно до температуры в пределах от 30 до 55 С, особенно предпочтительно от 35 до 55 С, прежде всего до температуры 50 С, и перемешивают. По истечении 1-8 ч, предпочтительно 1-6 ч, особенно предпоч-2 023117 тительно 1-4 ч, прежде всего 3 ч, смесь охлаждают до температуры максимум 20 С и осаждают продукт. Полученный таким путем продукт промывают толуолом. После сушки фильтровального осадка получают продукт формулы 6. В варианте 1 б-3 соединение формулы 4 суспендируют в полярном растворителе, выбранном из группы, включающей этилацетат, бутилацетат и тетрагидрофуран, предпочтительно в этилацетате, добавляют, например, ортоэфир хлоруксусной кислоты формулы 5b-3' и необязательно паратолуолсульфокислоту, после чего нагревают до температуры в пределах от 40 до 80 С, предпочтительно от 50 до 70 С,особенно предпочтительно от 55 до 65 С, прежде всего до температуры 60 С. По истечении 1-6 ч, предпочтительно 2-5 ч, особенно предпочтительно 2,5-3,5 ч, прежде всего 3 ч, реакционную смесь концентрируют в вакууме и остаток осаждают растворителем, выбранным из группы, включающей МТБЭ и тетрагидрофуран, предпочтительно МТБЭ. Охлаждение смеси позволяет повысить эффективность осаждения. Полученный таким путем продукт промывают органическими растворителями, выбранными из группы, включающей этилацетат, МТБЭ, тетрагидрофуран и их смеси, предпочтительно смесью этилацетата и МТБЭ. После сушки фильтровального осадка получают продукт формулы 6. В варианте 1 б-4 соединение формулы 4 суспендируют в растворителе, выбранном из группы, включающей этилацетат, тетрагидрофуран (ТГФ) и диоксан, и в течение 3 ч при 50 С добавляют, например,хлорацетилхлорид формулы 5b-4', после чего подщелачивают с помощью NaOH или иного сопоставимого с ним основания. Затем отделяют водную фазу, а органическую фазу концентрируют, остаток растворяют в полярном растворителе, выбранном из группы, включающей бутилацетат и этилацетат, фазы разделяют и органическую фазу вновь концентрируют. Остаток осаждают растворителем, выбранным из группы, включающей МТБЭ и тетрагидрофуран. Охлаждение смеси позволяет повысить эффективность осаждения. Полученный таким путем продукт промывают органическими растворителями, выбранными из группы, включающей бутилацетат, этилацетат, МТБЭ, тетрагидрофуран и их смеси. После сушки фильтровального осадка получают продукт формулы 6. Промежуточные продукты формул 3 и 6 превращают на стадии 2 при межфазном катализе и активации иодидом в соединение формулы 7. Стадия 2 Реакция сочетания алкилхлоридов и амидинов при катализе иодид-ионами известна, однако до настоящего времени нигде не сообщалось о высокой селективности такой реакции сочетания, вследствие чего в уровне техники отсутствуют также какие-либо сведения о синтезе амидинов с двумя защитными группами. Тем более неожиданным является тот факт, что описанным ниже способом возможно проведение реакции сочетания с имеющим одну защитную группу парааминобензамидином (соединение формулы 3) с высокой степенью региоселективности (более 99,7%). Для проведения указанной реакции соединение формулы 3, а также основание, выбранное из группы, включающей NaOH, карбонат калия и карбонат натрия, предпочтительно NaOH, добавляют в смесь из органического растворителя, выбранного из группы, включающей толуол, тетрагидрофуран, 2 метилтетрагидрофуран, бутилацетат и этилацетат, предпочтительно бутилацетата, и воды и нагревают до температуры в пределах от 30 до 65 С, предпочтительно от 40 до 60 С, особенно предпочтительно от 45 до 55 С, прежде всего до температуры 50 С. После этого фазы разделяют и при необходимости органическую фазу вновь экстрагируют водой. Далее органическую фазу смешивают в циклогексане и воде с соединением формулы 6, а также с иодидом натрия, гидрокарбонатом натрия и тетрабутиламмонийиодидом и затем нагревают до температуры в пределах от 30 до 60 С, предпочтительно от 35 до 50 С, особенно предпочтительно от 35 до 45 С,прежде всего до температуры 40 С. По истечении 1-6 ч, предпочтительно 1-4 ч, особенно предпочтительно 1-3 ч, прежде всего 2 ч, циклогексан отгоняют, добавляют бутилацетат и в течение 1-6 ч, предпочтительно 1-4 ч, особенно предпочтительно 1 -3 ч, прежде всего в течение 2 ч, вновь нагревают до температуры в пределах от 50 до 90 С, предпочтительно от 60 до 80 С, особенно предпочтительно от 65 до 75 С, прежде всего до температуры 70 С. После этого фазы разделяют и органическую фазу при необходимости экстрагируют водой. Затем органическую фазу концентрируют, охлаждают и фильтруют. Полученный таким путем продукт промывают органическими растворителями, выбранными из группы,включающей бутилацетат и МТБЭ, предпочтительно бутилацетатом, или их смесями. После сушки фильтровального осадка получают продукт формулы 7 (R1/2/3 представляют собой C1-С 6 алкил). На селективность и скорость реакции существенное влияние оказывает указанная выше система растворителей. При этом прежде всего использование двухфазной системы из воды и двух органических растворителей с разной полярностью, таких как бутилацетат и циклогексан, позволяет до минимума со-3 023117 кратить продолжительность реакции и получать продукт соответствующей чистоты. При необходимости соединение формулы 7 можно на третьей стадии его взаимодействием аналогично уровню техники с метансульфоновой кислотой формулы 9 превращать в мезилат формулы 8. Еще одним объектом настоящего изобретения являются также новые промежуточные продукты,образующимся при проведении описанного выше процесса. Речь при этом идет о соединениях формулы 3 где остаток R1 представляет собой C1-С 6 алкил, предпочтительно метил, этил, пропил, бутил или гексил, особенно предпочтительно метил, этил или гексил, прежде всего н-гексил. Помимо этого объектом настоящего изобретения являются соединения формулы 6 где остатки R2 и R3 независимо друг от друга представляют собой C1-С 6 алкил, предпочтительно метил, этил, пропил, бутил или гексил, особенно предпочтительно метил, этил или гексил, прежде всего R2 представляет собой метил, a R3 представляет собой этил, и Hal обозначает хлор или бром, предпочтительно хлор. Используемые термины и понятия Под термином "C1-С 6 алкил" (в том числе и когда он является фрагментом других остатков) подразумеваются разветвленные и неразветвленные алкильные группы с 1-6 атомами углерода, а под термином "С 1-С 4 алкил" подразумеваются разветвленные и неразветвленные алкильные группы с 1-4 атомами углерода. Предпочтительны при этом алкильные группы с 1-4 атомами углерода. В качестве примера таких групп можно назвать метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил,н-пентил, изопентил, неопентил и н-гексил. Для обозначения подобных групп в некоторых случаях используются также соответствующие им сокращенные названия Me, Et, н-Pr, изо-Pr, н-Bu, изо-Bu, трет-Bu или tBu и т.д. Если не указано иное, то в понятия "пропил", "бутил", "пентил" и "гексил" включены также все возможные изомерные формы каждого из таких остатков. Так, например, в понятие "пропил" включены н-пропил и изопропил, в понятие "бутил" включены изобутил, втор-бутил и mpem-бутил и т.д. Под "органическим растворителем" согласно изобретению подразумевается органическое низкомолекулярное вещество, способное физическим путем переводить в раствор другие органические вещества. Необходимой предпосылкой для использования того или иного вещества в качестве растворителя является наличие у него свойства химически не изменять в процессе растворения ни растворяющееся, ни растворенное вещество, т.е. свойства, при котором компоненты раствора можно вновь получить из него в их исходном виде методами физического разделения, такими как дистилляция, кристаллизация, сублимация, испарение, адсорбция. По различным причинам возможно использование не только индивидуальных растворителей, но и их смесей, объединяющих в себе растворяющие свойства их компонентов. В качестве примера органических растворителей можно назвать следующие: спирты, предпочтительно метанол, этанол, пропанол, бутанол, октанол, циклогексанол,гликоли, предпочтительно этиленгликоль, диэтиленгликоль,простые эфиры/простые эфиры гликолей, предпочтительно диэтиловый эфир, трет-бутилметиловый эфир, дибутиловый эфир, анизол, диоксан, тетрагидрофуран, простые эфиры моно-, ди-, три-, полиэтиленгликоля,кетоны, предпочтительно ацетон, бутанон, циклогексанон,-4 023117 Аминобензамидин в виде его дигидрохлорида (21,2 г) растворяют в ацетоне (150 мл), выдерживают при температуре 20 С и по каплям добавляют раствор едкого натра (80 мл, 4 М). Затем при 20 С дозируют н-гексилхлорформиат (16,5 г). После промывки ацетоном (20 мл) перемешивают в течение последующих 15 мин при температуре в пределах от 5 до 10 С. Далее фазы разделяют. Органическую фазу концентрируют под вакуумом, остаток разбавляют бутилацетатом (150 мл) и фазы вновь разделяют. После этого еще раз экстрагируют водой (40 мл) и смешивают с соляной кислотой (9,84 мл, 32%-ной). Остаточную воду отгоняют на водоотделителе и затем концентрируют. Суспензию смешивают при 45 С с ацетоном (150 мл), охлаждают до 20 С и подвергают вакуум-фильтрации. Затем промывают смесью бутилацетата и ацетона (100 мл). Фильтровальный осадок сушат в вакууме, получая 29,2 г продукта формулы 3 (97,2% от теории). Стадия 16. Синтез соединения формулы 6 (N-1-метил-1 Н-бензимидазол-2-хлорметил 1-5-карбонил]-N-2-пиридинилэтилового эфира -аланина) Соединение формулы 5 может в зависимости от варианта синтеза представлять собой хлоруксусный ангидрид формулы 5b-1', хлоруксусную кислоту формулы 5b-2', ортоэфир хлоруксусной кислоты формулы 5b-3' или хлорацетилхлорид формулы 5b-4'. Вариант 1 б-1. Соединение формулы 4 (28,0 г) при 20 С суспендируют в этилацетате (120 мл). Затем при 20 С медленно добавляют смесь этилацетата (50 мл) и хлоруксусного ангидрида формулы 5b-1' (14,5 г), после чего нагревают до 65 С. После 2-часового перемешивания далее при 40 С добавляют карбонат калия(15,0 г) и через 45 мин фильтруют. Фильтровальный осадок промывают этилацетатом (8,0 мл). Фильтрат концентрируют в вакууме и при 45 С осаждают добавлением МТБЭ (150 мл). Далее охлаждают до -2 С и фильтруют. Продукт промывают смесью этилацетата и трет-бутилметилового эфира (МТБЭ) (50 мл). Фильтровальный осадок сушат в вакууме, получая 29,6 г продукта формулы 6 (90,3% от теории). Вариант 1 б-2. Соединение формулы 4 (2 г) смешивают в толуоле (20 мл) с молекулярным ситом (4, 2 г) и хлоруксусной кислотой (2,08 г). Смесь нагревают до 50 С и перемешивают. По истечении примерно 3 ч смесь охлаждают до температуры ниже 20 С и осаждают продукт. Полученный таким путем продукт промывают толуолом. После сушки фильтровального осадка получают продукт формулы 6 (30% от теории). Вариант 1 б-3. Соединение формулы 4 (4,28 г) при комнатной температуре суспендируют в этилацетате (26 мл) и смешивают с ортоэфиром хлоруксусной кислоты формулы 5b-3' (2,79 г) и паратолуолсульфоновой кислотой (0,02 г), после чего нагревают до 60 С. После 3-часового перемешивания реакционную смесь концентрируют в вакууме, остаток кристаллизуют добавлением МТБЭ (25 мл) и фильтруют. Продукт промывают МТБЭ (25 мл). Фильтровальный осадок сушат в вакууме, получая 4,77 г продукта формулы 6 Вариант 1 б-4. Соединение формулы 4 (28,0 г) суспендируют в ТГФ (80 мл). Затем в течение 2,5 ч при 50 С добавляют смесь ТГФ (200 мл) и хлорацетилхлорида формулы 5b-4' (10,0 г), после чего подщелачивают гидроксидом натрия (2 моль/л, 50 мл). Затем водную фазу отделяют, а органическую фазу концентрируют и растворяют в бутилацетате. Фазы вновь разделяют, органическую фазу концентрируют в вакууме и при 45 С осаждают добавлением МТБЭ (240 мл). Далее охлаждают до -2 С и фильтруют. Продукт промывают смесью бутилацетата и трет-бутилметилового эфира (МТБЭ) (50 мл). Фильтровальный осадок сушат в вакууме, получая 23,3 г продукта формулы 6 (71% от теории). Стадия 2. Синтез N-2-4-(гексилокси)карбонил]-4-амино]иминометил]фенил]амино]метил]-1 метил-1 Н-бензимидазол-5-ил]карбонил]-N-2-пиридинилэтилового эфира -аланина Соединение формулы 3 (7,7 г) добавляют в бутилацетат (65 мл), раствор едкого натра (25 мл, 45%ный) и воду (25 мл) и нагревают до 50 С. После этого фазы разделяют и органические фазы вновь экстрагируют водой (30 мл). Органическую фазу смешивают с иодидом натрия (1,54 г), гидрокарбонатом натрия (4,00 г), тетрабутиламмонийиодидом (ТБАИ) (0,75 г), соединением формулы 6 (10,0 г), циклогексаном (65 мл) и водой (30 мл) и перемешивают в течение 2 ч при 40 С. Затем циклогексан отгоняют под вакуумом, добавляют бутилацетат (95 мл) и перемешивают в течение 2 ч при 70 С. Далее фазы разделяют и органическую фазу дважды экстрагируют водой (10 мл). Затем органическую фазу концентрируют под вакуумом, раствор охлаждают до 0 С и фильтруют. Продукт промывают бутилацетатом (30 мл). Фильтровальный осадок сушат в вакууме, получая 13,8 г продукта формулы 7 (87,8% от теории). Стадия 3. Метансульфонат N-2-4-(гексилокси)карбонил]-4-амино]иминометил]фенил]амино] метил]-1-метил-1 Н-бензимидазол-5-ил]карбонил]-N-2-пиридинилэтилового эфира -аланина Соединение формулы 7 (20 г) при комнатной температуре суспендируют в ацетоне (238 мл) и нагревают с обратным холодильником. Раствор фильтруют до прозрачности и затем промывают ацетоном(20 мл). Фильтрат охлаждают до 33 С, затем дозируют охлажденный до 0 С раствор метансульфоновой кислоты (3,0 г) в ацетоне (34 мл) и вновь промывают ацетоном (5,0 мл). После охлаждения до 20 С фильтруют. Продукт промывают ацетоном (54 мл). Фильтровальный осадок сушат в вакууме, получая 22,2 г продукта формулы 8 (96,3% от теории). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединений формулы 7 отличающийся тем, что соединение формулы 6 при этом в соединениях приведенных выше формул 7, 6 и 3 остатки R1, R2 и R3 независимо друг от друга представляют собой С 1-С 6 алкил, a Hal обозначает хлор или бром. 2. Способ по п.1, при осуществлении которого соединение формулы 6 получают реакцией соединения формулы 4 с соединением формулы 5, выбранным из группы, включающей галогенуксусный ангидрид, галогенуксусную кислоту, ортоэфир галогенуксусной кислоты и галогенацетилхлорид, где галоген (Hal) представляет собой хлор или бром, при этом в соединениях приведенных выше формул 4 и 6 остатки R1, R2 иR3 независимо друг от друга представляют собой C1-С 6 алкил. 3. Способ по п.1 или 2, при осуществлении которого соединение формулы 3 получают реакцией соединения формулы 1 при этом в соединениях приведенных выше формул 3 и 2 остатки R1, R2 и R3 независимо друг от друга представляют собой C1-С 6 алкил. 4. Способ по одному из пп.1-3, где остатки R1, R2 и R3 независимо друг от друга представляют собой метил, этил, пропил, бутил или гексил. 5. Способ по одному из пп.1-4, где R1 представляет собой гексил, R2 представляет собой метил, a R3 представляет собой этил. 6. Способ по одному из пп.1-5, при осуществлении которого соединение формулы 5 выбирают из группы, включающей хлоруксусный ангидрид, хлоруксусную кислоту, ортоэфир хлоруксусной кислоты и хлорацетилхлорид. 7. Способ по одному из пп.1-5, при осуществлении которого соединение формулы 5 выбирают из группы, включающей хлоруксусный ангидрид и ортоэфир хлоруксусной кислоты. 8. Способ по одному из пп.1-7, при осуществлении которого взаимодействие промежуточного продукта формулы 6 с соединением формулы 3 проводят в двухфазной системе растворителей, состоящей из воды и не смешивающегося с водой органического растворителя. 9. Способ по п.8, при осуществлении которого взаимодействие промежуточного продукта формулы 6 с соединением формулы 3 проводят в двухфазной системе растворителей, состоящей из воды и одного либо нескольких растворителей, выбранных из группы, включающей толуол, тетрагидрофуран, 2 метилтетрагидрофуран, бутилацетат, циклогексан и этилацетат. 10. Соединение формулы 6 где остатки R2 и R3 независимо друг от друга представляют собой С 1-С 6 алкил, а Hal обозначает хлор или бром. 11. Соединение по п.10, где R2 представляет собой метил, R3 представляет собой этил, a Hal обозначает хлор.
МПК / Метки
МПК: C07C 257/20, C07D 401/12
Метки: дабигатрана, получения, этексилата, способ
Код ссылки
<a href="https://eas.patents.su/8-23117-sposob-polucheniya-eteksilata-dabigatrana.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения этексилата дабигатрана</a>












