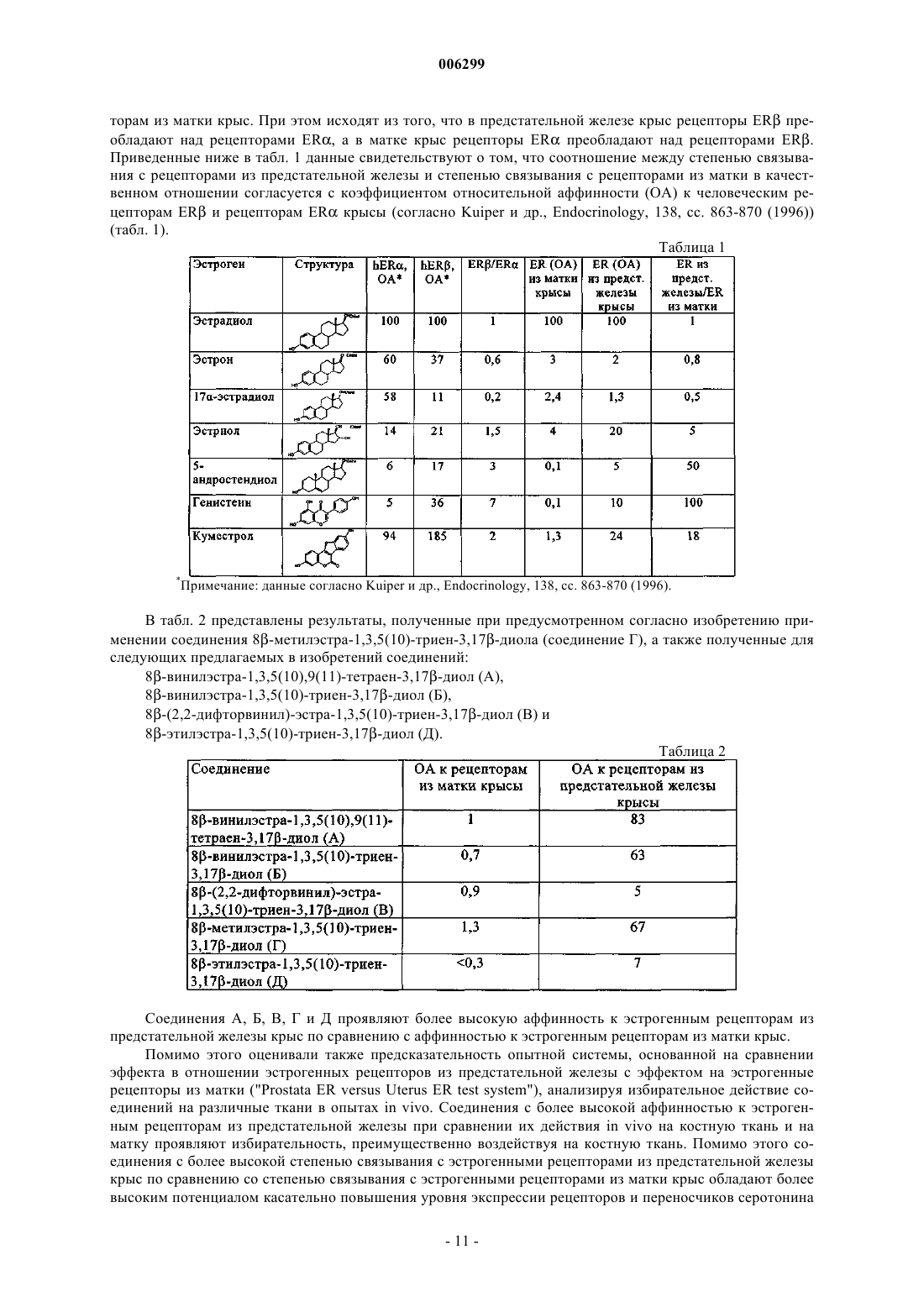
8β-гидрокарбилзамещенные эстратриены в качестве эстрогенов избирательного действия
Номер патента: 6299
Опубликовано: 27.10.2005
Авторы: Патчев Владимир, Тиме Ина, Петерс Олаф, Хагеле-Хартунг Криста, Элгер Вальтер, Колленкирхен Уве, Фритцемайер Карл-Генрих, Хиллиш Александер
Формула / Реферат
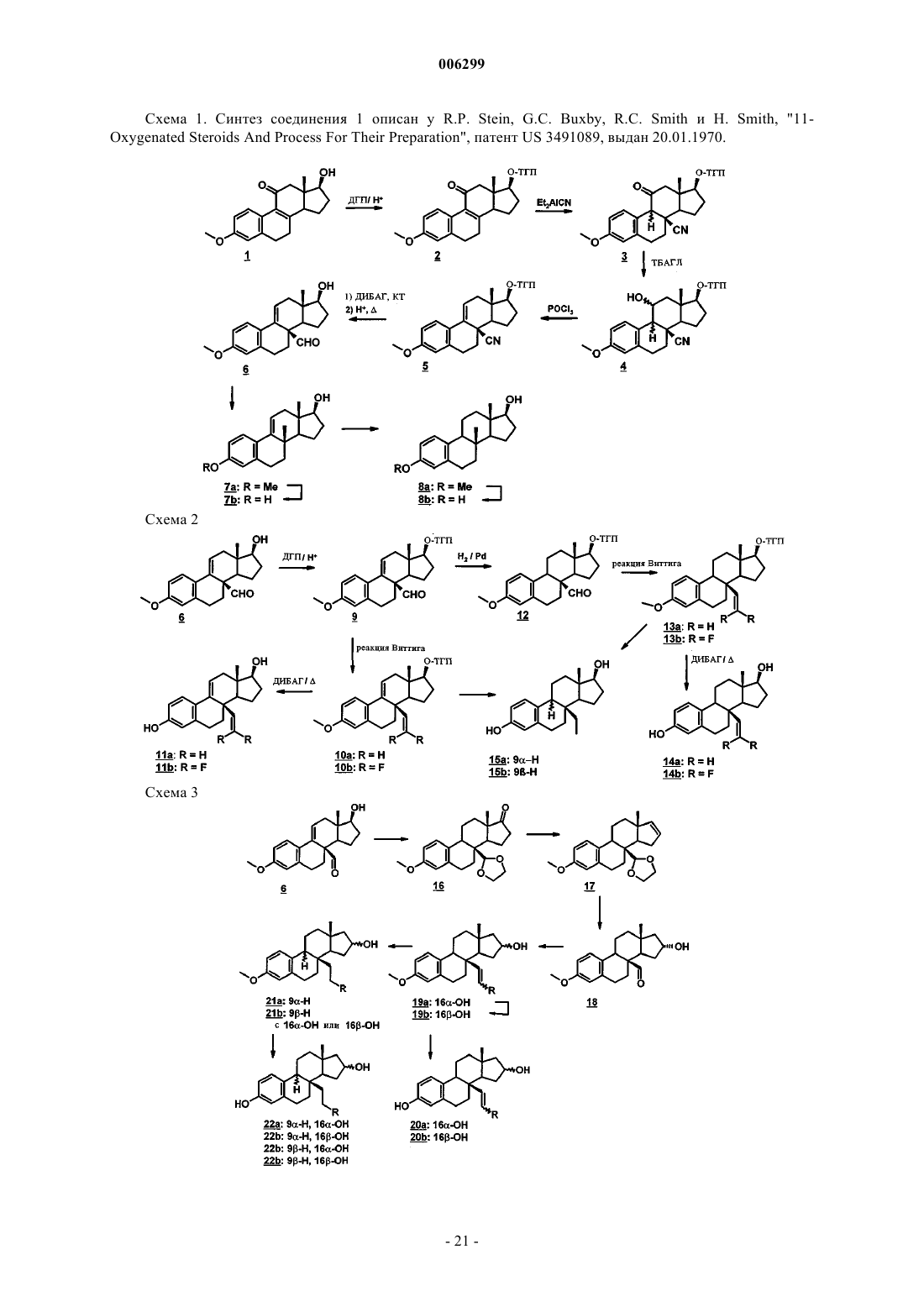
1. 8b-замещенные эстра-1,3,5(10)-триеновые производные общей формулы I
в которой R2 обозначает атом водорода, атом галогена, остаток R18 - либо R18 -O-, где R18 представляет собой атом водорода либо насыщенный или ненасыщенный углеводородный остаток с прямой или разветвленной цепью, содержащий до 6 атомов углерода, трифторметильную группу, группу R19 SO2-O-, где R19 представляет собой группу R20 R 21 N, в которой R20 и R21 независимо друг от друга обозначают атом водорода или C1-C5алкил, группу C(O)R22 , в которой R22 представляет собой необязательно замещенный, насыщенный или до трехкратно ненасыщенный, необязательно частично или полностью галогенированный углеводородный остаток с прямой или разветвленной цепью, содержащий до 10 атомов углерода, необязательно замещенный C3-C7циклоалкил, необязательно замещенный C4-C15циклоалкилалкил или необязательно замещенный арильный, гетероарильный или аралкильный остаток либо совместно с N-атомом обозначает полиметилениминогруппу с 4-6 C-атомами или морфолиногруппу,
R3 обозначает группу R18-O-, R19SO2-O- или -O-C(O)R22 , где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил, гетероарил или аралкил,
R6 и R7 каждый обозначает атом водорода или совместно обозначают дополнительную связь,
R6' и R7' независимо друг от друга обозначают атом водорода, атом галогена, группу R18-O-, R19SO2-O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,
R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил,
R9 обозначает атом водорода, насыщенный или ненасыщенный углеводородный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, или совместно с R11 обозначает дополнительную связь,
R11 обозначает атом водорода или совместно с R9 либо совместно с R12 обозначает дополнительную связь,
R11' обозначает атом водорода атом галогена, насыщенный или ненасыщенный, необязательно частично или полностью галогенированный (F, Cl) углеводородный остаток, у которого максимальная длина прямой цепи составляет 4 атома углерода, или группу -X-R18', где X представляет собой атом кислорода или серы, а R18' представляет собой алкил с 1-3 атомами углерода,
R12 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,
R14 обозначает атом водорода или совместно с R15 обозначает дополнительную связь,
R15 обозначает атом водорода или совместно с R14 либо совместно с R16 обозначает дополнительную связь,
R16 обозначает атом водорода или совместно с R15 обозначает дополнительную связь,
R15' и R16' независимо друг от друга обозначают атом водорода, атом галогена, группу R18-O-, R19SO2-O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,
R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22, группу R18-O- и группу R18- либо группу R18-O- и группу -O-C(O)R22, при этом во всех случаях каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, или R17 и R17' совместно обозначают группу =CR23R24, в которой R23 и R24 независимо друг от друга представляют собой атом водорода и атом галогена либо совместно представляют собой атом кислорода,
за исключением тех соединений общей формулы I', в которых
R3 обозначает гидрокси-, метокси- или ацетилоксигруппу и одновременно R2 обозначает атом водорода, R6, R6', R7 и R7' каждый обозначает атом водорода,
R8 обозначает метильную группу,
R9 обозначает атом водорода или R9 и R11 совместно обозначают дополнительную связь,
R11' и R12 каждый обозначает атом водорода,
R14, R15, R15', R16 и R16' каждый обозначает атом водорода, а также R17 и R17' попарно обозначают b-гидроксигруппу и атом водорода, b-гидроксигруппу и метильную группу, b-(2-бромацетил)оксигруппу и атом водорода, b-ацетильную группу и атом водорода, b-карбоксильную группу и атом водорода или R17 и R17' совместно обозначают атом кислорода.
2. Эстратриены общей формулы I по п.1, в которой
R2 обозначает атом водорода или галогена или гидроксигруппу,
R3 обозначает группу R18-O-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в п.1 в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил или аралкил,
R6 и R7 каждый обозначает атом водорода,
R6' обозначает атом водорода, гидроксигруппу, группу R22 в указанном в определении радикала R2 значении,
R7' обозначает атом водорода, атом галогена, группу R18-O-, R19SO2-O- или -R22, где каждый из R18, R19 и R22 имеет значение, указанное в п.1,
R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил,
R9 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,
R11 обозначает атом водорода или совместно с R9 обозначает дополнительную связь,
R11' обозначает атом водорода, атом галогена, насыщенный или ненасыщенный, необязательно частично или полностью фторированный или хлорированный углеводородный остаток, у которого максимальная длина прямой цепи составляет 4 атома углерода, или группу -X-R18', где X представляет собой атом серы, а R18' представляет собой алкил с 1-3 атомами углерода,
R12, R14, R15 и R16 каждый обозначает атом водорода,
R16' обозначает атом водорода, атом галогена, группу R18-O-, R19SO2-O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,
R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 шыш -O-C(O)R22, группу R18-O- и группу R18- либо группу R18-O- и группу -O-C(O)R22, где во всех случаях каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, или R17 и R17' совместно обозначают группу =CR23 R24 , где R23 и R 24 независимо друг от друга представляют собой атом водорода и атом галогена или совместно обозначают атом кислорода.
3. Эстратриены общей формулы I по п.1, в которой
R2 обозначает атом водорода или фтора или гидроксигруппу,
R3 обозначает группу R18-O-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в п.1 в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил или аралкил,
R6 и R7 каждый обозначает атом водорода,
R6' обозначает атом водорода или гидроксигруппу,
R7' обозначает атом водорода, фтора или хлора, группу R18-O-, R19SO2-O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,
R8 обозначает необязательно частично или полностью фторированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил,
R9 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,
R11' обозначает атом водорода, фтора или хлора, насыщенный C1-C4алкил с прямой или разветвленной цепью, группу -X-R18', где X представляет собой атом серы, а R18' представляет собой насыщенный C1-C3алкил с прямой или разветвленной цепью, хлорметил или хлорэтил,
R12, R14, R15 и R16 каждый обозначает атом водорода,
R16' обозначает атом водорода, фтора или хлора или группу R18-O либо -R22, где каждый из R18 и R22 имеет указанное в определении радикала R2 значение,
R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22, группу R18-O- и группу R18- либо группу R18-O- и группу -O-C(O)R11, где во всех случаях каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, или R17 и R17' совместно обозначают группу =CR23R24 , где R23 и R24 независимо друг от друга представляют собой атом водорода и атом галогена или совместно обозначают атом кислорода.
4. Эстратриены общей формулы I по п.1, в которой каждый из R6', R7', R9, R11 , R14, R15, R15' и R16 обозначает атом водорода или каждый из R6', R7', R14, R15 , R15' и R16 обозначает атом водорода, а R9 и R11 совместно обозначают дополнительную связь и все остальные заместители имеют указанные в п.1 значения.
5. Эстратриены общей формулы I по п.1, которые в положении 9(11), 14(15) или 15(16) имеют двойную связь или в положениях 9(11) и 14(15), соответственно 15(16) имеют две двойных связи.
6. Эстратриены общей формулы I по п.1, в которой R17 и R17' попарно обозначают группу R18 -O- и группу R18- либо группу R18- и группу -O-C(O)R22, где каждый из R18 и R22 имеет указанное в определении радикала R2 значение.
7. Эстратриены общей формулы I по п.6, в которой R17 и R17' попарно обозначают гидроксигруппу и атом водорода, C1-C4алкил либо C2-4алкинил.
8. Эстратриены общей формулы I по п.7, в которой R17 и R17' попарно обозначают гидроксигруппу и атом водорода, метил, этинил либо проп-1-инил.
9. Эстратриены общей формулы I по п.1, в которой R16' обозначает группу R18-O- или R19SO2-O-, где каждый из R18 и R19 имеет указанное в п.1 в определении радикала R2 значение, каждый из R17 и R17' обозначает атом водорода, а все остальные заместители могут иметь указанные для общей формулы I значения.
10. Эстратриены общей формулы I по п.1 из группы, включающей
8b-винилэстра-1,3,5(10),9(11)-тетраен-3,17b-диол,
3-метокси-8b-винилэстра-1,3,5(10),9(11)-тетраен-17b-ол,
8b-(2',2'-дифторвинил)эстра-1,3,5(10),9(11)-тетраен-3,17b-диол,
8b-(2',2'-дифторвинил)-3-метоксиэстра-1,3,5(10),9(11)-тетраен-17b-ол,
8b-винилэстра-1,3,5(10)-триен-3,17b-диол,
3-метокси-8b-винилэстра-1,3,5(10)-триен-17b-ол,
8b-(2',2'-дифторвинил)эстра-1,3,5(10)-триен-3,17b-диол,
8b-(2',2'-дифторвинил)-3-метоксиэстра-1,3,5(10)-триен-17b-ол,
8b-этилэстра-1,3,5(10)-триен-3,17b-диол,
8b-этил-3-метоксиэстра-1,3,5(10)-триен-17b-ол,
8b-винилэстрадиол-3-сульфамат,
8b-винилэстрадиол-3,17-дисульфамат,
8b-винилэстрадиол-3-(N-ацетил)сульфамат,
8b-винилэстрон-3-сульфамат,
8b-винилэстрон-3-ацетат,
8b-винилэстриол,
8b-винилэстриол-3-сульфамат,
8b-метилэстрон-3-сульфамат,
8b-метилэстриол,
8b-(проп-(Z)-енил)эстрадиол,
8b-(н-пропил)эстрадиол,
8b-этинилэстрадиол,
17a-этинил-8b-винилэстра-1,3,5(10)-триен-3,17b-диол,
17a-метил-8b-винилэстра-1,3,5(10)-триен-3,17b-диол,
16a-фтор-8b-метилэстра-1,3,5(10)-триен-3,17b-диол,
8b-винилэстра-1,3,5(10)-триен-3,17a-диол,
8b-метилэстра-1,3,5(10)-триен-3,17a-диол,
8b-винилэстрадиолдиацетат,
8b-метилэстрадиолдиацетат,
8b-винилэстрадиол-17-валерианат,
17b-ацетокси-8b-винилэстра-1,3,5(10)-триен-3-ол.
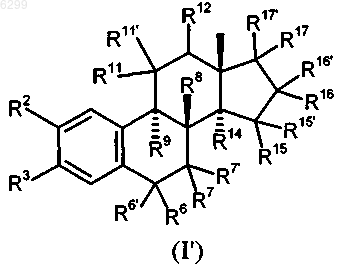
11. Применение 8b-замещенных эстра-1,3,5(10)-триеновых производных общей формулы I'
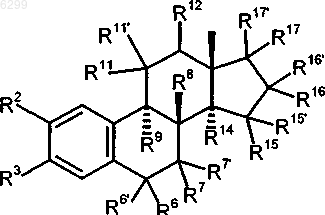
в которой R2 обозначает атом водорода, атом галогена, остаток R18- либо R18-O-, где R18 представляет собой атом водорода либо насыщенный или ненасыщенный углеводородный остаток с прямой или разветвленной цепью, содержащий до 6 атомов углерода, трифторметильную группу, группу R19SO2-O-, где R19 представляет собой группу R20 R21 N, в которой R20 и R21 независимо друг от друга обозначают атом водорода или C1-C5алкил, группу C(O)R22, в которой R22 представляет собой необязательно замещенный, насыщенный или до трехкратно ненасыщенный, необязательно частично или полностью галогенированный углеводородный остаток с прямой или разветвленной цепью, содержащий до 10 атомов углерода, необязательно замещенный C3-C7циклоалкил, необязательно замещенный C4-C15циклоалкилалкил или необязательно замещенный арильный, гетероарильный или аралкильный остаток либо совместно с N-атомом обозначает полиметилениминогруппу с 4-6 C-атомами или морфолиногруппу,
R3 обозначает группу R18-O-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил, гетероарил или аралкил,
R6 и R7 каждый обозначает атом водорода или совместно обозначают дополнительную связь,
R6' и R7' независимо друг от друга обозначают атом водорода, атом галогена, группу R18-O-, R19SO2-O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,
R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил,
R9 обозначает атом водорода, насыщенный или ненасыщенный углеводородный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, или совместно с R11 обозначает дополнительную связь,
R11 обозначает атом водорода или совместно с R9 либо совместно с R12 обозначает дополнительную связь,
R11' обозначает атом водорода, атом галогена, насыщенный или ненасыщенный, необязательно частично или полностью галогенированный (F, Cl) углеводородный остаток, у которого максимальная длина прямой цепи составляет 4 атома углерода, или группу -X-R18', где X представляет собой атом кислорода или серы, а R18' представляет собой алкил с 1-3 атомами углерода,
R12 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,
R14 обозначает атом водорода или совместно с R15 обозначает дополнительную связь,
R15 обозначает атом водорода или совместно с R14 либо совместно с R16 обозначает дополнительную связь, R16 обозначает атом водорода или совместно с R15 обозначает дополнительную связь,
R15' и R16' независимо друг от друга обозначают атом водорода, атом галогена, группу R18-O-, R19SO2-O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,
R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22, группу R18-O- и группу R18- либо группу R18-O- и группу -O-C(O)R22, при этом во всех случаях каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, или R17 и R17' совместно обозначают группу =CR23R24, в которой R23 и R24 независимо друг от друга представляют собой атом водорода и атом галогена либо совместно представляют собой атом кислорода,
для лечения обусловленных эстрогенной недостаточностью заболеваний и состояний у женщин и у мужчин.
12. Применение эстратриенов общей формулы I' по п.11, в которой
R2 обозначает атом водорода или галогена или гидроксигруппу,
R3 обозначает группу R18-O-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в п.1 в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил или аралкил,
R6 и R7 каждый обозначает атом водорода,
R6' обозначает атом водорода, гидроксигруппу, группу R22 в указанном в определении радикала R2 значении,
R7' обозначает атом водорода, атом галогена, группу R18-O-, R19SO2-O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,
R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил,
R9 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,
R11 обозначает атом водорода или совместно с R9 обозначает дополнительную связь,
R11' обозначает атом водорода, атом галогена, насыщенный или ненасыщенный, необязательно частично или полностью галогенированный (F, Cl) углеводородный остаток, у которого максимальная длина прямой цепи составляет 4 атома углерода, или группу -X-R18', где X представляет собой атом серы, а R18' представляет собой алкил с 1-3 атомами углерода,
R12, R14, R15 и R16 каждый обозначает атом водорода,
R16' обозначает атом водорода, атом галогена, группу R18-O-, R19SO2-O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,
R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22, группу R18-O- и группу R18- либо группу R18-O- и группу -O-C(O)R22, где во всех случаях каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, или
R17 и R17' совместно обозначают группу =CR23R24 , где R23 и R24 независимо друг от друга представляют собой атом водорода и атом галогена или совместно обозначают атом кислорода.
13. Применение эстратриенов общей формулы I' по п.11, в которой
R2 обозначает атом водорода или фтора или гидроксигруппу,
R3 обозначает группу R18-O-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в п.1 в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил шыш аралкил,
R6 и R7 каждый обозначает атом водорода,
R6' обозначает атом водорода или гидроксигруппу,
R7' обозначает атом водорода, фтора или хлора, группу R18-O-, R19SO2-O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,
R8 обозначает необязательно частично или полностью фторированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил,
R9 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,
R11' обозначает атом водорода, фтора или хлора, насыщенный C1-C4алкил с прямой или разветвленной цепью, группу -X-R18', где X представляет собой атом серы, а
R18' представляет собой насыщенный C1-C3алкил с прямой или разветвленной цепью, хлорметил или хлорэтил,
R12, R14, R15 и R16 каждый обозначает атом водорода,
R16' обозначает атом водорода, фтора или хлора или группу R18-O либо -R22, где каждый из R18 и R22 имеет указанное в определении радикала R2 значение,
R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22, группу R18-O- и группу R18- либо группу R18-O- и группу -O-C(O)R22, где во всех случаях каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, или
R17 и R17' совместно обозначают группу =CR23R24 , где R23 и R24 независимо друг от друга представляют собой атом водорода и атом галогена или совместно обозначают атом кислорода.
14. Применение эстратриенов общей формулы I' по п.11, в которой каждый из R6', R7', R9, R11, R14, R15, R15' и R16 обозначает атом водорода или каждый из R6', R7', R14, R15, R15' и R16 обозначает атом водорода, а R9 и R11 совместно обозначают дополнительную связь и все остальные заместители имеют указанные в п.1 значения.
15. Применение эстратриенов общей формулы I' по п.11, которые в положении 9(11), 14(15) или 15(16) имеют двойную связь или в положениях 9(11) и 14(15), соответственно 15(16) имеют две двойных связи.
16. Применение эстратриенов общей формулы I' по п.11, в которой R17 и R17' попарно обозначают группу R18-O- и группу R18- либо группу R18- и группу -O-C(O)R22, где каждый из R18 и R22 имеет указанное в определении радикала R2 значение.
17. Применение эстратриенов общей формулы I' по п.16, в которой R17 и R17' попарно обозначают гидроксигруппу и атом водорода, C1-C4алкил либо C2-C4алкинил.
18. Применение эстратриенов общей формулы I' по п.17, в которой R17 и R17' попарно обозначают гидроксигруппу и атом водорода, метил, этинил либо проп-1-инил.
19. Применение эстратриенов общей формулы I' по п.11, в которой R16' обозначает группу R18-O- или R19SO2-O-, где каждый из R18 и R19 имеет указанное в п.1 в определении радикала R2 значение, каждый из R17 и R17' обозначает атом водорода, а все остальные заместители могут иметь указанные для общей формулы I значения.
20. Применение эстратриенов общей формулы I' по п.11, выбранных из группы соединений, включающей
8b-метилэстра-1,3,5(10),9(11)-тетраен-3,17b-диол,
3-метокси-8b-метилэстра-1,3,5(10),9(11)-тетраен-17b-ол,
8b-метилэстра-1,3,5(10)-триен-3,17b-диол,
3-метокси-8b-метилэстра-1,3,5(10)-триен-17b-ол,
8b-винилэстра-1,3,5(10),9(11)-тетраен-3,17b-диол,
3-метокси-8b-винилэстра-1,3,5(10),9(11)-тетраен-17b-ол,
8b-(2',2'-дифторвинил)эстра-1,3,5(10),9(11)-тетраен-3,17b-диол,
8b-(2',2'-дифторвинил)-3-метоксиэстра-1,3,5(10),9(11)-тетраен-17b-ол,
8b-винилэстра-1,3,5(10)-триен-3,17b-диол,
3-метокси-8b-винилэстра-1,3,5(10)-триен-17b-ол,
8b-(2',2'-дифторвинил)эстра-1,3,5(10)-триен-3,17b-диол,
8b-(2',2'-дифторвинил)-3-метоксиэстра-1,3,5(10)-триен-17b-ол,
8b-этилэстра-1,3,5(10)-триен-3,17b-диол,
8b-этил-3-метоксиэстра-1,3,5(10)-триен-17b-ол,
8b-винилэстрадиол-3-сульфамат,
8b-винилэстрадиол-3,17-дисульфамат,
8b-винилэстрадиол-3-(N-ацетил)сульфамат,
8b-винилэстрон-3-сульфамат,
8b-винилэстрон-3 -ацетат,
8b-винилэстриол,
8b-винилэстриол-3 -сульфамат,
8b-метилэстрон-3-сульфамат,
8b-метилэстриол,
8b-(проп-(Z)-енил)эстрадиол,
8b-(н-пропил)эстрадиол,
8b-этинилэстрадиол,
17b-этинил-8b-винилэстра-1,3,5(10)-триен-3,17b-диол,
17a-метил-8b-винилэстра-1,3,5(10)-триен-3,17b-диол,
16a-фтор-8b-метилэстра-1,3,5(10)-триен-3,17b-диол,
8b-винилэстра-1,3,5(10)-триен-3,17a-диол,
8b-метилэстра-1,3,5(10)-триен-3,17a-диол,
8b-винилэстрадиолдиацетат,
8b-метилэстрадиолдиацетат,
8b-винилэстрадиол-17-валерианат,
17b-ацетокси-8b-винилэстра-1,3,5(10)-триен-3-ол.
21. Применение по п.11 для лечения расстройств и заболеваний, проявляющихся в пери- и постменопаузальный период.
22. Применение по п.11 для лечения расстройств и заболеваний, проявляющихся в пери- и постандропаузальный период.
23. Применение по п.21 для профилактики и устранения приливов, а также фыя профилактики и лечения нарушений сна (бессонницы), раздражимости, перепадов настроения (эмоциональной лабильности), недержания, атрофии влагалища и обусловленных гормональной недостаточностью психических расстройств.
24. Применение по п.23 для профилактики и лечения заболеваний мочеполового тракта.
25. Применение по п.11 для профилактики и терапии заболеваний желудка и кишечника.
26. Применение по п.25 для профилактики и терапии язвы и геморрагического диатеза в желудочно-кишечном тракте.
27. Применение по п.26 для профилактики и терапии неоплазий.
28. Применение по п.11 лечения in vitro мужского бесплодия.
29. Применение по п.11 для лечения in vivo мужского бесплодия.
30. Применение по п.11 для лечения in vitro женского бесплодия.
31. Применение по п.11 для лечения in vivo женского бесплодия.
32. Применение по п.11 для гормонзаместительной терапии (ГЗТ).
33. Применение по п.11 для терапии связанных с гормональной недостаточностью расстройств при дисфункции яичников, обусловленной хирургическим вмешательством, приемом лекарственных препаратов или иными причинами.
34. Применение по п.11 для профилактики и терапии обусловленного гормональной недостаточностью уменьшения костной массы.
35. Применение по п.34 для профилактики и терапии остеопороза.
36. Применение по п.11 для предупреждения и терапии сердечно-сосудистых заболеваний.
37. Применение по п.11 для предупреждения и лечения заболеваний сосудов.
38. Применение по п.37 для предупреждения и лечения атеросклероза.
39. Применение по п.37 для предупреждения и лечения неоинтимальных гиперплазий.
40. Применение по п.11 для предупреждения и лечения обусловленных гормональной недостаточностью нейродегенеративных заболеваний.
41. Применение по п.11 для предупреждения и лечения болезни Альцгеймера, а также обусловленного гормональной недостаточностью ухудшения функции памяти и обучаемости, соответственно познавательной способности.
42. Применение по п.11 для лечения воспалительных заболеваний и заболеваний иммунной системы.
43. Применение по п.11 для предупреждения и лечения доброкачественной гиперплазии предстательной железы (ДГПЖ).
44. Фармацевтические композиции, содержащие по меньшей мере одно соединение по любому из пп.1-10, а также фармацевтически приемлемый носитель.
Текст
006299 Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям как фармацевтическим действующим веществам, которые in vitro обладают более высокой аффинностью к эстрогенным рецепторам в препаратах из предстательной железы крыс по сравнению с аффинностью к эстрогенным рецепторам в препаратах из матки крыс и действие которых in vivo преимущественно направлено на костную ткань, а не на матку, и/или которые обладают ярко выраженным действием в отношении стимуляции экспрессии 5 НТ 2 а-рецепторов и -переносчиков, к получению таких соединений, к их терапевтическому применению и к фармацевтическим лекарственным формам, содержащим эти новые соединения. Подобные химические соединения в целом представляют собой стероидные эстрогены нового типа с избирательным действием в отношении определенных тканей. Предпосылки создания изобретения В терапии эстрогены хорошо зарекомендовали себя при лечении обусловленных гормональной недостаточностью заболеваний и обладают защитным действием на костную ткань, головной мозг, сосуды и другие органы и системы. Эффективность эстрогенов в лечении обусловленных гормональной недостаточности симптомов,таких как приливы, атрофия органов-мишеней для эстрогена и недержание, а также их успешное применение в терапии для предупреждения снижения костной массы у женщин в пери- и постменопаузальный период, является подтвержденным и общепризнанным фактом (Grady и др., Ann. Intern. Med. 117, cc. 1016-1037 (1992. Равным образом в литературных источниках подтверждается и тот факт, что эстрогензаместительная терапия у женщин в постменопаузальный период или у женщин с обусловленной иными факторами дисфункцией яичников снижает риск сердечно-сосудистых заболеваний по сравнению с женщинами, не подвергавшимися эстрогенной терапии (Grady и др., см. выше). Последние исследования подтверждают, кроме того, наличие у эстрогенов защитного действия в отношении нейродегенеративных заболеваний, таких, например, как болезнь Альцгеймера (Henderson,Neurology, 48 (дополнение 7) cc. S27-S35 (1997); Birge, Neurology, 48 (дополнение 7), cc. S36-S41 (1997,а также защитного действия в отношении функций головного мозга, таких как функция памяти и обучаемость, соответственно познавательная способность (McEwen и др., Neurology, 48 (дополнение 7), cc.S8-S15 (1997); Sherwin, Neurology, 48 (дополнение 7), cc. S21-S26 (1997, а также в отношении обусловленных гормональной недостаточностью перепадов настроения (эмоциональной лабильности) (Halbreich,Neurology, 48 (дополнение 7), cc. S16-S20 (1997. Помимо этого была подтверждена эффективность эстрогензаместительной терапии в снижении заболеваемости раком ободочной и прямой кишки (Calle E.F. и др., J. Natl. Cancer Inst. 87, cc. 517-523(1995. При обычной эстроген- или гормонзаместительной (ГЗТ) терапии применяют природные эстрогены, такие как эстрадиол и конъюгированные эстрогены из лошадиной мочи, либо индивидуально, либо в сочетании с гестагеном. Вместо природных эстрогенов могут использоваться также полученные этерификацией производные, такие, например, как 17-эстрадиолвалерат. При гормонзаместительной терапии из-за стимулирующего действия используемых эстрогенов на эндометрий, что связано с повышенным риском рака эндометрия (Harlap S., Am. J. Obstet. Gynecol., 166, cc. 1986-1992 (1992, преимущественно применяют комбинированные препараты на основе эстрогена/гестагена. Хотя гестагенный компонент в комбинации эстроген/гестаген и предотвращает гипертрофию эндометрия, тем не менее применение гестагенсодержащего комбинированного препарата связано также с появлением промежуточных кровотечений. Более новой альтернативой комбинированным препаратам на основе эстрогена/гестагена являются эстрогены с избирательным действием. До настоящего времени под подобными эстрогенами с избирательным действием подразумеваются соединения, которые вследствие их антиутеротрофного (т.е. антиэстрогенного) частичного действия воздействуют по типу эстрогена на головной мозг, костную ткань и сосудистую систему, но не оказывают пролиферативного действия на эндометрий. Один из классов веществ, свойства которых частично соответствуют необходимому набору свойств, которыми должен обладать эстроген избирательного действия, составляют так называемые "селективные модуляторы эстрогенных рецепторов" (СМЭР) (R.F. Kauffman, H.U. Bryant, DNAP, 8(9), cc. 531-539 (1995. При этом речь идет о частичных агонистах эстрогенных рецепторов, относящихся к подтипу эстрогенных рецепторов-альфа "ERa". Однако вещества этого типа неэффективны при терапии острых приступов таких проявляющихся в постменопаузальный период болезненных состояний, как, например, приливы. В качестве примера СМЭР можно назвать ралоксифен, который относительно недавно был разрешен к применению при таком показании, как остеопороз. Эстрогенный рецептор-бета (ER) Сравнительно недавно был выявлен второй подтип эстрогенных рецепторов, который обозначили как эстрогенные рецепторы-бета (ER) (Kuiper и др., Рrос. Natl. Acad. Sci., 93, cc. 5925-5930 (1996); Mosselman, Dijkema, Febs Letters 392, cc. 49-53 (1996); Tremblay и др., Molecular Endocrinology, 11, cc. 353-365(1997. Характер экспрессии рецепторов ER отличается от такового рецепторов ER (Kuiper и др., En-1 006299docrinology, 138, cc. 863-870 (1996. Так, в частности, в предстательной железе крыс рецепторы ER преобладают над рецепторами ER, тогда как в матке крыс рецепторы ER преобладают над рецепторами ER. В головном мозге были выявлены области, в которых экспрессируются только эстрогенные рецепторы, относящиеся к одному из обоих подтипов (Shugrue и др., Steroids, 61, cc. 678-681 (1996); Li и др., Neuroendocrinology, 66, cc. 63-67 (1997. Рецепторы ER экспрессируются, в частности, в тех областях, которые отвечают за познавательный (когнитивный) процесс и эмоциональное состояние ("настроение") (Shugrue и др., J. Comparative Neurology, 388, cc. 507-525 (1997. Молекулярными мишенями для рецепторов ER в этих областях головного мозга могли бы служить 5 НТ 2 а-рецептор и переносчик серотонина (G. Fink и В.Е.Н. Sumner, Nature, 383, с. 306 (1996); В.Е.Н.Sumner и др., Molecular Brain Research, в печати (1999. Нейротрансмиттер серотонин (5 гидрокситриптамин, 5 НТ) участвует в регуляции множества процессов, протекание которых может быть нарушено в период менопаузы. Так, в частности, влияние менопаузы на эмоциональное состояние и познание связывают с серотонинергической системой. Эстрогензаместительная терапия зарекомендовала себя как эффективный путь лечения подобных, связанных с эстрогенной недостаточностью расстройств,что, возможно, обусловлено модуляцией экспрессии рецепторов и переносчиков серотонина. К числу других органов и систем организма со сравнительно высоким уровнем экспрессии рецепторов ER относятся костная ткань (Оnое Y. и др., Endocrinology 138, cc. 4509-4512 (1997, сосудистая система (Register Т.С, Adams M.R., J. Steroid. Molec. Biol., 64, cc. 187-191 (1998, мочеполовой тракт(1996, включая сперматиды (Shugrue и др., Steroids, 63, cc. 498-504 (1998. Подобное распределение рецепторов в тканях свидетельствует о том, что эстрогены регулируют функции органов через рецепторы ER. Функциональная роль рецепторов ER в этом отношении подтверждается также исследованиями на ER-нокаутных (ERKO-), соответственно на ER-нокаутных (ERKO-) мышах: у ERKO-мышей после овариэктомии наблюдается уменьшение костной массы, что можно предотвратить за счет эстрогенного замещения (Kimbro и др., Abstract OR7-4, Endocrine Society Meeting New Orleans, 1998). Равным образом эстрадиол ингибирует в кровеносных сосудах самок ERKO-мышей пролиферацию клеток средней оболочки кровеносных сосудов и клеток гладкой мускулатуры (Iafrati M.D. и др., Nature Medicine, 3,cc. 545-548 (1997. Подобное защитное действие эстрадиола опосредуется у ERKO-мышей предположительно рецепторами ER. Наблюдения, проводившиеся на ERKO-мышах, указывают на тот факт, что рецепторы ER выполняют определенную функцию в предстательной железе и мочевом пузыре: у самцов мышей старшего возраста проявляются симптомы гиперплазии предстательной железы и мочевого пузыря (Krege J.H. и др., Рrос. Natl. Acad. Sci., 95, cc. 15677-15682 (1998. Помимо этого у женских (Lubahn D.B. и др., Рrос.Natl. Acad. Sci., 90, cc. 11162-11166 (1993 и мужских (Hess R.A. и др., Nature, 390, cc. 509-512 (1997 особей ERKO-мышей, а также у женских особей ERKO-мышей (Krege J.H., 1998) проявляются нарушения репродуктивной функции, т.е. бесплодие. Этим подтверждается важная роль эстрогенов, которую они играют в сохранении яичком и яичниками их функций, а также в сохранении репродуктивной способности. Избирательное действие эстрогенов на определенные органы-мишени можно обеспечить с учетом различного распределения обоих подтипов ER-рецепторов в тканях, соответственно в органах, за счет применения лигандов, специфических в отношении определенного подтипа рецепторов. Вещества, действие которых в опыте in vitro по связыванию с рецепторами преимущественно направлено на ERрецепторы, а не на ER-рецепторы, описаны у Kuiper и др. (Kuiper и др., Endocrinology, 138, cc. 863-870(1996. Избирательное действие лигандов, способных специфически связываться с эстрогенными рецепторами определенного их подтипа, на чувствительные к эстрогену параметры in vivo до настоящего времени не было обнаружено. Исходя из вышеизложенного в основу настоящего изобретения была положена задача получить соединения, которые in vitro обладали бы избирательностью в отношении связывания с эстрогенными рецепторами в препаратах из предстательной железы и матки крыс, а in vivo обладали бы избирательностью преимущественно в отношении воздействия на костную ткань, а не воздействия на матку. Такие соединения должны обладать in vitro более высокой аффинностью к эстрогенным рецепторам в препаратах из предстательной железы крыс по сравнению с аффинностью к эстрогенным рецепторам в препаратах из матки крыс, a in vivo потенциально должны обладать более эффективным действием, предотвращающим обусловленное гормональной недостаточностью уменьшение костной массы по сравнению со стимулирующим действием на матку, и/или обладать ярко выраженным действием в отношении стимуляции экспрессии 5 НТ 2 а-рецепторов и -переносчиков. Помимо этого согласно настоящему изобретению должна быть обеспечена такая взаимосвязь между химической структурой и характерным для нее действием, которая позволила бы получить соединения с описанным выше набором фармакологических свойств, т.е. с более высоким эстрогенным воздействием на костную ткань по сравнению с воздействием на матку. Указанная задача решается согласно изобретению с помощью 8-замещенных эстра-1,3,5(10)триеновых производных общей формулы I' в которой R2 обозначает атом водорода, атом галогена, остаток R18 - либо R18 -О-,где R18 представляет собой атом водорода либо насыщенный или ненасыщенный углеводородный остаток с прямой или разветвленной цепью, содержащий до 6 атомов углерода, трифторметильную группу, группу R19 SO2-O-, где R19 представляет собой группу R20 R21 N, в которой R20 и R21 независимо друг от друга обозначают атом водорода или С 1-С 5 алкил, группу C(O)R22 , в которойR22 представляет собой необязательно замещенный, насыщенный или до трехкратно ненасыщенный, необязательно частично или полностью галогенированный углеводородный остаток с прямой или разветвленной цепью, содержащий до 10 атомов углерода, необязательно замещенный С 3-С 7 циклоалкил,необязательно замещенный С 4-С 15 циклоалкилалкил или необязательно замещенный арильный, гетероарильный или аралкильный остаток либо совместно с N-атомом обозначает полиметилениминогруппу с 46 С-атомами или морфолиногруппу,R3 обозначает группу R18 -О-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил,гетероарил или аралкил,R6 и R7 каждый обозначает атом водорода или совместно обозначают дополнительную связь,R6' обозначает атом водорода, гидроксигруппу, группу R22 в указанном в определении радикала R2 значении,R7' обозначает атом водорода, атом галогена, группу R18-О-, R19SO2-O- или -R22, где каждый из R18,19R и R22 имеет значение, указанное в п.1,R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1 инил,R9 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,R11 обозначает атом водорода или совместно с R9 обозначает дополнительную связь,R11' обозначает атом водорода, атом галогена, насыщенный или ненасыщенный, необязательно частично или полностью фторированный или хлорированный углеводородный остаток, у которого максимальная длина прямой цепи составляет 4 атома углерода, или группу -X-R18', где X представляет собой атом серы, а R18' представляет собой алкил с 1-3 атомами углерода,R12, R14, R15 и R16 каждый обозначает атом водорода,R16' обозначает атом водорода, атом галогена, группу R18-O-, R19SO2-O- или -R22, где каждый из R18,19R и R22 имеет указанное в определении радикала R2 значение,R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22,группу R18-O- и группу R18- либо группу R18-О- и группу -O-C(O)R22, при этом во всех случаях каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, или R17 и R17' совместно обозначают группу =CR23 R24, в которой R23 и R24 независимо друг от друга представляют собой атом водорода и атом галогена либо совместно представляют собой атом кислорода, предназначенных для лечения обусловленных эстрогенной недостаточностью заболеваний и состояний. Возможные заместители у 6-го, 7-го, 9-го, 11-го, 15-го, 16-го и 17-го атомов углерода в каждом случае могут находиться в - или -положении. Согласно одному из вариантов осуществления изобретения предпочтительными для применения соединениями общей формулы I' являются соединения, в которыхR2 обозначает атом водорода или галогена либо гидроксигруппу,R3 обозначает группу R18 -O-, R19 SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, причем R18 дополнительно может обозначать арил или аралкил,R6 и R7 каждый обозначает атом водорода,R6' обозначает атом водорода, гидроксигруппу или группу R22 в указанном в определении радикала 2R значении,R7' обозначает атом водорода, атом галогена, группу R18-О-, R19SO2-O- или -R22, где каждый из R18,19R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1 инил,R9 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,R11 обозначает атом водорода или совместно с R9 обозначает дополнительную связь,R11' обозначает атом водорода, атом галогена, насыщенный или ненасыщенный, необязательно частично или полностью фторированный или хлорированный углеводородный остаток, у которого максимальная длина прямой цепи составляет 4 атома углерода, или группу -X-R18', где X представляет собой атом серы, а R18' представляет собой алкил с 1-3 атомами углерода,R12, R14, R15 и R16 каждый обозначает атом водорода,R 16' обозначает атом водорода, атом галогена, группу R18-О-, R19SO2-O- или -R22, где каждый из R18,19R и R22 имеет указанное в определении радикала R2 значение,R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 либо -OC(O)R22, группу R18-O- и группу R18- или группу R18-О- и группу -O-C(O)R22, при этом во всех случаях каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, илиR17 и R17' совместно обозначают группу =CR23R24, где R23 и R24 независимо друг от друга обозначают атом водорода и атом галогена или совместно представляют собой атом кислорода. В другом предпочтительном варианте осуществления настоящего изобретения предлагается применение тех соединений общей формулы I', в которойR2 обозначает атом водорода или фтора либо гидроксигруппу,R3 обозначает группу R18-O-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, причем R18 дополнительно может обозначать арил или аралкил,R6 и R7 каждый обозначает атом водорода,R6' обозначает атом водорода или гидроксигруппу,R7' обозначает атом водорода, атом фтора или хлора, группу R18-O-, R19SO2-O- или -R22, где каждый 18 из R , R19 и R22 имеет значение, указанное в п.1,R8 обозначает необязательно частично или полностью фторированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил,R9 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,R11' обозначает атом водорода, атом фтора или хлора, насыщенную С 1-С 4 алкильную группу с прямой или разветвленной цепью, группу -X-R18', где X представляет собой атом серы, а R18' представляет собой насыщенную C1-С 3 алкильную группу с прямой или разветвленной цепью, хлорметил или хлорэтил,R12, R14, R15 и R16 каждый обозначает атом водорода,R16' обозначает атом водорода, фтора или хлора или группу R18-О или -R22, где каждый из R18 и R22 имеет указанное в определении радикала R2 значение,R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22,группу R18-O- и группу R18- либо группу R18-О- и группу -O-C(O)R22, при этом во всех случаях каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, или R17 и R17' совместно обозначают группу =CR23R24, где R23 и R24 независимо друг от друга обозначают атом водорода и атом галогена либо совместно представляют собой атом кислорода. Согласно еще одному варианту предлагается применять 8-замещенные эстра-1,3,5(10)-триеновые производные общей формулы I', в которой каждый изR6', R7', R9, R11, R14, R15, R15' и R16 обозначает атом водорода либо каждый из R6', R7', R14, R15, R15' и R16 обозначает атом водорода, R9 и R11 совместно обозначают дополнительную связь, а все остальные заместители имеют указанные в п.1 значения. Если эстратриеновые производные общей формулы I' содержат в В-, С- и/или D-кольце дополнительные двойные связи, то в этом случае в положении 9(11), 14(15) или 15(16) присутствует одна двойная связь или в положениях 9(11) и 14(15), соответственно 15(16), присутствуют две двойные связи. В другом варианте осуществления изобретения в нем предлагается применение эстратриеновых производных общей формулы I', в которой R17 и R17' попарно обозначают группу R18-О- и группу R18 либо группу R18- и группу -O-C(O)R22, где каждый из R18 и R22 имеет указанное в определении радикалаR2 значение. Из числа этих указанных последними соединений в свою очередь предпочтительны те гонатриеновые производные, в которых R17 и R17' обозначают гидроксигруппу и атом водорода, С 1-С 4 алкил или С 2 С 4 алкенил, и прежде всего соединения, в которых R17 и R17' обозначают гидроксигруппу и атом водорода,метил, этинил или проп-1-инил. Помимо этого согласно еще одному возможному варианту R16' обозначает группу R18-О- или 19R SO2-O-, где каждый из R18 и R19 имеет указанное в определении радикала R2 значение, каждый из R17 и R 17' обозначает атом водорода, а все остальные заместители имеют значения, указанные выше для общей формулы I'.-4 006299 Согласно настоящему изобретению предпочтительно применение одного или нескольких соединений из следующей группы, включающей 8-метилэстра-1,3,5(10),9(11)-тетраен-3,17-диол,3-метокси-8-метилэстра-1,3,5(10),9(11 )-тетраен-17-ол,8-метилэстра-1,3,5(10)-триен-3,17-диол,3-метокси-8-метилэстра-1,3,5(10)-триен-17-ол,8-винилэстра-1,3,5(10),9(11)-тетраен-3,17-диол,3-метокси-8-винилэстра-1,3,5(10),9(11)-тетраен-17-ол,8-(2',2'-дифторвинил)эстра-1,3,5(10),9(11)-тетраен-3,17-диол,8-(2',2'-дифторвинил)-3-метоксиэстра-1,3,5(10),9(11)-тетраен-17-ол,8-винилэстра-1,3,5(10)-триен-3,17-диол,3-метокси-8-винилэстра-1,3,5(10)-триен-17-ол,8-(2',2'-дифторвинил)эстра-1,3,5(10)-триен-3,17-диол,8-(2',2'-дифторвинил)-3 -метоксиэстра-1,3,5(10)-триен-17-ол,8-этилэстра-1,3,5(10)-триен-3,17-диол,8-этил-3-метоксиэстра-1,3,5(10)-триен-17-ол,8-винилэстрадиол-3-сульфамат,8-винилэстрадиол-3,17-дисульфамат,8-винилэстрадиол-3-(N-ацетил)сульфамат,8-винилэстрон-3-сульфамат,8-винилэстрон-3-ацетат,8-винилэстриол,8-винилэстриол-3-сульфамат,8-мети лэстрон-3-сульфамат,8-метилэстриол,8-(проп-(Z)-енил)эстрадиол,8-(н-пропил)эстрадиол,8-этинилэстрадиол,17-этинил-8-винилэстра-1,3,5(10)-триен-3,17-диол,17-метил-8-винилэстра-1,3,5(10)-триен-3,17-диол,16-фтор-8-метилэстра-1,3,5(10)-триен-3,17-диол,8-винилэстра-1,3,5(10)-триен-3,17-диол,8-метилэстра-1,3,5(10)-триен-3,17-диол,8-винилэстрадиолдиацетат,8-метилэстрадиолдиацетат,8-винилэстрадиол-17-валерианат,17 Р-ацетокси-8-винилэстра-1,3,5(10)-триен-3-ол. Другие возможные варианты осуществления настоящего изобретения представлены в зависимых пунктах формулы изобретения. Помимо указанного выше применения соединений общей формулы I' объектом изобретения являются также сами эти соединения общей формулы I. При этом речь идет о соединениях общей формулы I',за исключением тех соединений общей формулы I', в которых R3 обозначает гидрокси-, метокси- или ацетилоксигруппу и одновременно R2 обозначает атом водорода, R6, R6', R7 и R7' каждый обозначает атом водорода, R8 обозначает метил, R9 обозначает атом водорода или R9 и R11 совместно обозначают дополнительную связь, R11' и R12' каждый обозначает атом водорода, R14, R15, R15', R16 и R16' каждый обозначает атом водорода и R17 и R17' попарно обозначают -гидроксигруппу и атом водорода, бета-гидроксигруппу и метильную группу, -(2-бромацетил)оксигруппу и атом водорода, -ацетильную группу и атом водорода или -карбоксильную группу и атом водорода либо R17 и R17' совместно представляют собой атом кислорода. Эта дисклеймированная группа соединений, подпадающих под общую формулу I', уже известна из следующих патентных публикаций и литературных источников:Ind. (London), (48), cc. 2047-2048 (1967),Nakai Hisayoshi, Koyama Hirozo, Acta Crystallogr., 23(4), с 674 (1967). Вместе с тем избирательное эстрогенное действие известных соединений и их применение в предусмотренных настоящим изобретением целях до настоящего времени не описано. В литературе уже известные эстратриены упоминаются преимущественно в качестве промежуточных продуктов, а также в качестве эстрогенов в обычном толковании этого понятия или описывается их применение в аналитических методах. В соединениях общих формул I и I', а также в описанных ниже субструктурах II и II' атомом галогена всегда может являться атом фтора, хлора, брома или йода, однако предпочтителен в каждом случае атом фтора. Помимо этого заместителем в 11-положении может являться прежде всего атом хлора. Под углеводородными остатками, которые могут быть частично или полностью галогенированы,подразумеваются прежде всего фторированные остатки. В качестве примера углеводородного остатка R18 можно назвать метил, этил, пропил, изопропил,бутил, изобутил, трет-бутил, пентил, изопентил, неопентил,гептил и гексил. Алкоксигруппы OR18 в соединениях общей формулы I и I', а также в описанных ниже субструктурах II и II' в каждом случае могут содержать от 1 до 6 атомов углерода, при этом предпочтительны метокси-, этокси-, пропокси-, изопропокси- и трeт-бутилоксигруппы. В качестве представителей С 1-С 5 алкила, указанного в значениях R20 и R21, можно назвать метил,этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил и неопентил. В качестве представителей углеводородного остатка R22 с прямой или разветвленной цепью, содержащего от 1 до максимум 10 атомов углерода, можно назвать среди прочих метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, изопентил, неопентил, гептил, гексил и децил, при этом предпочтительны метил, этил, пропил и изопропил. В качестве примера перфторированных алкильных групп можно назвать трифторметил, пентафторэтил и нонафторбутил. Примерами частично фторированных алкильных групп являются 2,2,2 трифторэтил, 5,5,5,4,4-пентафторпентил, 6,6,6,5,5,4,4,3,3-нонафторгексил и т.д. В качестве примера С 3-С 7 циклоалкильной группы можно назвать циклопропил, бутил, пентил, гексил или гептил, С 4-С 15 циклоалкилалкильный остаток имеет в циклоалкильном фрагменте от 3 до 7 атомов углерода, а его типичными представителями являются указанные непосредственно выше циклоалкильные группы. Алкильный фрагмент содержит до 8 атомов углерода. В качестве примера С 4-С 15 циклоалкилалкильного остатка можно назвать циклопропилметил, циклопропилэтил, циклопентилметил, циклопентилпропил и т.д. Под арильным остатком в контексте настоящего изобретения подразумевается фенил, 1- или 2 нафтил, при этом фенил предпочтителен. Под арилом во всех случаях подразумевается также гетероарильный остаток. Примерами гетероарильного остатка являются 2-, 3- или 4-пиридинил, 2- или 3-фурил,2- или 3-тиенил, 2- или 3-пирролил, 2-, 4- или 5-имидазолил, пиразинил, 2-, 4- или 5-пиримидинил либо 3- или 4-пиридазинил. В качестве заместителей арильного или гетероарильного остатка можно назвать среди прочих метил, этил, трифторметил, пентафторэтил, трифторметилтиогруппу, метоксигруппу, этоксигруппу, нитрогруппу, цианогруппу, галоген (фтор, хлор, бром, йод), гидроксигруппу, аминогруппу, моно(С 1-8 алкил)либо ди(С 1-8 алкил)аминогруппу, где обе алкильные группы являются идентичными или различными, и ди(аралкил)аминогруппу, где обе аралкильные группы являются идентичными или различными. Под аралкильным остатком подразумевается остаток, который в кольце содержит до 14, предпочтительно от 6 до 10, С-атомов, а в алкильной цепи содержит от 1 до 8, предпочтительно от 1 до 4, С-атомов. Так, например, аралкильными остатками являются бензил, фенилэтил, нафтилметил, нафтилэтил, фурилметил, тиенилэтил и пиридилпропил. Кольца могут быть одно- или многократно замещены галогеном, ОН-группой, О-алкилом, СО 2 Н, СО 2-алкилом, -NO2, -N3, -CN, C1-С 20 алкилом, С 1-С 20 ацилом, C1 С 20 ацил оксигруппой. Алкильные группы, соответственно углеводородные остатки, могут быть частично или полностью фторированы или замещены 1-5 атомами галогена, гидроксигруппами или С 1-С 4 алкоксигруппами. Под С 2-С 5 алкенильным остатком в первую очередь подразумевается винил или аллил. В других вариантах осуществления изобретения предусмотрено наличие одной или нескольких, не-6 006299 обязательно сопряженных, двойных связей в кольцах В, С и D эстратриенового скелета, а именно одна или несколько двойных связей в положениях 6, 7; 7, 8; 9, 11; 11, 12; 14, 15, а также 15, 16. Предпочтительно при этом наличие одной двойной связи в положении 7, 8или в положении 11, 12 либо двух двойных связей в положениях 6, 7 и 8, 9 (т.е. совместно с ароматическим кольцом А образуется нафталиновая система). Одна или несколько гидроксильных групп у 3-го, 16-го и 17-го С-атомов могут быть этерифицированы алифатической, насыщенной или ненасыщенной C1-C14-моно- или поликарбоновой кислотой с прямой или разветвленной цепью или ароматической карбоновой кислотой либо - или -аминокислотой. В качестве примера подобных карбоновых кислот для этерификации можно назвать монокарбоновые кислоты, такие как муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота,изомасляная кислота, валериановая кислота, изовалериановая кислота, пивалиновая кислота, лауриновая кислота, миристиновая кислота, акриловая кислота, пропиоловая кислота, метакриловая кислота, кротоновая кислота, изокротоновая кислота, олеиновая кислота и элаидиновая кислота, среди которых предпочтительны для этерификации уксусная кислота, валериановая кислота или пивалиновая кислота, дикарбоновые кислоты, такие как щавелевая кислота, малоновая кислота, янтарная кислота, глутаровая кислота, адипиновая кислота, пимелиновая кислота, пробковая кислота, азелаиновая кислота, себациновая кислота, малеиновая кислота, фумаровая кислота, муконовая кислота, цитраконовая кислота и мезаконовая кислота, и ароматические карбоновые кислоты, такие как бензойная кислота, фталевая кислота,изофталевая кислота, терефталевая кислота, нафтойная кислота, о-, м- и n-толуиловая кислота, гидратроповая кислота, атроповая кислота, коричная кислота, никотиновая кислота и изоникотиновая кислота,среди которых предпочтительна для этерификации бензойная кислота. В качестве аминокислот могут рассматриваться достаточно давно и хорошо известные специалистам представители этого класса веществ, например аланин, -аланин, аргинин, цистеин, цистин, глицин, гистидин, лейцин, изолейцин, фенилаланин, пролин и т.д., среди которых предпочтителен для этерификации -аланин. Предпочтительными согласно настоящему изобретению являются следующие соединения: 8-винилэстра-1,3,5(10),9(11)-тетраен-3,17-диол,3-метокси-8-винилэстра-1,3,5(10), 9(11)-тетраен-17-ол,8-(2',2'-дифторвинил)эстра-1,3,5 (10),9( 11 )-тетраен-3,17-диол,8-(2',2'-дифторвинил)-3-метоксиэстра-1,3,5(10),9(11)-тетраен-17-ол,8-винилэстра-1,3,5(10)-триен-3,17-диол,3-метокси-8-винилэстра-1,3,5(10)-триен-17-ол,8-(2',2'-дифторвинил)эстра-1,3,5(10)-триен-3,17-диол,8-(2',2'-дифторвинил)-3-метоксиэстра-1,3,5(10)-триен-17-ол,8-этилэстра-1,3,5(10)-триен-3,17-диол,8-этил-3-метоксиэстра-1,3,5(10)-триен-17-ол,8-винилэстрадиол-3-сульфамат,8-винилэстрадиол-3,17-дисульфамат,8-винилэстрадиол-3-(N-ацетил)сульфамат,8-винилэстрон-3 -сульфамат,8-винилэстрон-3-ацетат,8-винилэстриол,8-винилэстриол-3-сульфамат,8-метилэстрон-3-сульфамат,8-метилэстриол,8-(проп-(Z)-енил)эстрадиол,8-(н-пропил)эстрадиол,8-этинилэстрадиол,17-этинил-8-винилэстра-1,3,5(10)-триен-3,17-диол,17-метил-8-винилэстра-1,3,5(10)-триен-3,17-диол,16-фтор-8-метилэстра-1,3,5(10)-триен-3,17-диол,8-винилэстра-1,3,5(10)-триен-3,17-диол,8-метилэстра-1,3,5(10)-триен-3,17-диол,8-винилэстрадиолдиацетат,8-метилэстрадиолдиацетат,8-винилэстрадиол-17-валерианат,17-ацетокси-8-винилэстра-1,3,5(10)-триен-3-ол,8-винил-9-эстра-1,3,5(10)-триен-3,17-диол,8-этил-9-эстра-1,3,5(10)-триен-3,17-диол. Еще одним объектом настоящего изобретения является применение структурного фрагмента фор-7 006299 в которой R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил, в качестве составной части общей структуры соединений, которые in vitro обладают избирательностью в отношении связывания с эстрогенными рецепторами в препаратах из предстательной железы крыс и матки крыс, и прежде всего в качестве составной части общей структуры тех соединений,которые обладают избирательностью преимущественно в отношении их эстрогенного действия на костную ткань по сравнению с действием на матку. Дополнительно к ароматическому А-кольцу в В-, С- и/или D-кольце в положениях 6(7); 9(11); 11(12); 14(15), а также 15(16) могут присутствовать одна или несколько двойных связей. Возможные заместители у 6-го, 7-го, 11-го, 15-го, 16-го и 17-го атомов углерода в каждом случае могут находиться в - или -положении. Настоящее изобретение предпочтительно относится к тем структурным фрагментам общей формулы II' в которой R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил. Равным образом подобные структурные фрагменты дополнительно к ароматическому А-кольцу могут иметь одну или несколько двойных связей в В-, С- и/или D-кольце. Возможные заместители у 6-го, 7-го, 11-го, 15-го, 16-го и 17-го атомов углерода в каждом случае также могут находиться в - или -положении. Предлагаемые в изобретении эфиры 8-замещенных эстратриенов обладают в качестве пролекарств целым рядом преимуществ по сравнению с неэтерифицированными действующими веществами с точки зрения режима или схемы их введения, а также типа, интенсивности и длительности их действия. Определенными преимуществами с точки зрения фармакокинетики и фарамакодинамики обладают и предлагаемые в изобретении сульфаматы 8-замещенных эстратриенов. Соответствующие эффекты уже были описаны для других сульфаматов стероидов (J. Steroid Biochem. Molec. Biol, 55, cc. 395-403(1995); Exp. Opinion Invest. Drugs, 7, cc. 575-589 (1998. Согласно настоящему изобретению стероиды, основу которых составляет 8-замещенный эстра 1,3,5(10)-триеновый скелет, предназначены для лечения опосредуемых эстрогенными рецепторами рподтипа заболеваний и состояний в качестве избирательных эстрогенов, которые in vitro обладают избирательностью в отношении связывания с эстрогенными рецепторами в препаратах из предстательной железы крыс и матки крыс, a in vivo предпочтительно проявляют избирательность в отношении, например, действия на костную ткань по сравнению с действием на матку, при этом такие вещества в широком диапазоне доз оказывают защитное действие на костную ткань, не стимулируя матку. Помимо этого указанные вещества могут оказывать у мужских особей крыс защитное действие,предупреждая уменьшение костной массы после орхиэктомии, не ингибируя при этом секрецию таких гормонов гипофиза, как ЛГ (лютеинизирующий гормон) и ФСГ (фолликулостимулирующий гормон). В том же диапазоне доз эти вещества оказывают лишь незначительное воздействие на печень. Кроме того, такие вещества оказывают сходное эстрогенному действие на сосудистую систему и функции головного мозга. Вещества с более высокой степенью связывания с эстрогенными рецепторами из предстательной железы крыс по сравнению со степенью связывания с эстрогенными рецепторами из матки крыс обладают более высоким потенциалом касательно повышения уровня экспрессии рецепторов и переносчиков серотонина в сравнении с их положительным действием на выброс ЛГ. По этой причине-8 006299 проявляется благоприятное влияние на процессы, в регуляции которых участвует нейротрансмиттер серотонин, а предлагаемые в изобретении соединения оказывают благоприятное влияние прежде всего на эмоциональное состояние и когнитивный процесс. Подобные вещества можно применять в качестве эстрогенов в описанном в WO 97/45125 отношении для получения лекарственных средств, позволяющих влиять на уровень серотонина, соответственно на уровень кодирующей серотонин мРНК у человека. Было установлено, что предлагаемые в изобретении 8-замещенные эстра-1,3,5(10)-триены пригодны в качестве эстрогенов избирательного действия для лечения различных состояний и заболеваний, для которых характерно более высокое содержание в соответствующей ткани- или органе-мишени эстрогенных рецепторов- по сравнению с содержанием в них эстрогенных рецепторов-. Настоящее изобретение относится также к фармацевтическим препаратам (лекарственным средствам), которые содержат по меньшей мере одно соединение общей формулы I (или его физиологически приемлемые аддитивные соли с органическими и неорганическими кислотами), и к применению соединений общей формулы I' для получения лекарственных средств, назначаемых прежде всего при наличии описанных ниже показаний. Указанные соединения можно применять перорально и парентерально при следующих показаниях. Представленные в настоящем описании эстрогены нового типа, обладающие избирательным действием, можно использовать в качестве единственного компонента в фармацевтических композициях либо в сочетании прежде всего с антиэстрогенами или гестагенами. Наиболее предпочтительно применение эстрогенов избирательного действия в сочетании с антиэстрогенами, обладающими избирательным действием в отношении рецепторов ER, или с антиэстрогенами, обладающими избирательным действием в отношении периферии, т.е. не проходящими через гематоэнцефалический барьер. Предлагаемые в изобретении соединения и содержащие их лекарственные средства наиболее пригодны для лечения проявляющихся в пери- и постменопаузальный период расстройств и заболеваний,прежде всего приливов, нарушений сна (бессонницы), раздражимости, перепадов настроения (эмоциональной лабильности), недержания, атрофии влагалища, обусловленных гормональной недостаточностью психических (душевных) расстройств. Равным образом указанные соединения пригодны для замещения гормонов и для терапии связанных с гормональной недостаточностью расстройств при дисфункции яичников, обусловленной хирургическим вмешательством, приемом лекарственных препаратов или иными причинами. К числу подобных показаний относится также предупреждение уменьшения костной массы у женщин в постменопаузальный период и у мужчин в андропаузальный период, у женщин после гистерэктомии или у женщин, подвергавшихся лечению агонистами или антагонистами ЛГ-ВГ (гормон,высвобождающий лютеинизирующий гормон). Предлагаемые в изобретении соединения пригодны также для облегчения сопровождающих андропаузу и менопаузу симптомов, т.е. для гормонзаместительной терапии (ГЗТ) мужчин и женщин, а именно для применения как в профилактических, так и в лечебных целях, а также для лечения связанных с дисменореей расстройств и для лечения угрей. Указанные вещества могут применяться, кроме того, для профилактики обусловленного гормональной недостаточностью уменьшения костной массы и остеопороза, для предупреждения сердечнососудистых заболеваний, прежде всего заболеваний сосудов (ангиопатии), таких как атеросклероз, для ингибирования пролиферации клеток артериальной гладкой мускулатуры, для лечения первичной легочной гипертензии и для профилактики обусловленных гормональной недостаточностью нейродегенеративных заболеваний, таких как болезнь Альцгеймера, а также обусловленного гормональной недостаточностью ухудшения функции памяти и обучаемости, соответственно познавательной способности. Другой возможной областью применения предлагаемых в изобретении соединений является лечение воспалительных заболеваний и заболеваний иммунной системы, прежде всего аутоиммунных заболеваний, таких, например, как ревматоидный артрит. Помимо этого указанные соединения могут применяться для лечения нарушений репродуктивной функции у мужчин и заболеваний предстательной железы. Соединения по изобретению можно также применять в сочетании с природным витамином D3 или с аналогами кальцитриола для образования новой костной ткани либо в целях вспомогательной (поддерживающей) терапии в дополнение к терапии, сопровождающейся уменьшением костной массы (например, в дополнение к лечению глюкокортикоидами или химиотерапии). Кроме того, соединения общей формулы I' можно применять в сочетании с антагонистами рецепторов прогестерона и прежде всего для гормонзаместительной терапии и для лечения гинекологических нарушений. Терапевтический продукт, содержащий эстроген и чистый антиэстроген для одновременного, последовательного или отдельного применения в целях избирательной эстрогенной терапии перименопаузальных или постменопаузальных состояний, уже описан в ЕР-А 0346014. Вводимое в организм количество соединения общей формулы I' может варьироваться в широких пределах, включающих любое эффективное количество. Назначаемое пациенту количество указанного-9 006299 соединения может составлять в зависимости от подлежащего лечению состояния и метода введения от 0,01 мкг до 10 мг на кг веса тела, предпочтительно от 0,04 мкг до 1 мг на кг веса тела в день. Для человека это соответствует ежедневной дозе от 0,8 мкг до 800 мг, предпочтительно от 3,2 мкг до 80 мг. Разовая доза содержит согласно изобретению от 1,6 мкг до 200 мг одного или нескольких соединений общей формулы I'. Предлагаемые в изобретении соединения и кислотно-аддитивные соли пригодны для получения на их основе соответствующих фармацевтических композиций и составов. Подобные фармацевтические композиции, соответственно лекарственные средства, содержат в качестве действующего вещества одно или несколько соединений по изобретению или их кислотно-аддитивных солей, необязательно в смеси с другими фармакологически, соответственно фармацевтически, активными веществами. Лекарственные средства получают по обычной технологии, при этом можно использовать известные и обычно применяемые в фармацевтике вспомогательные вещества, а также иные обычные носители и разбавители. В качестве примера подобных носителей и вспомогательных веществ можно назвать те, которые рекомендованы, соответственно указаны, в следующих литературных источниках как вспомогательные вещества для применения в фармацевтике, косметической промышленности и смежных областях: Ullmans Encyklopadie der technischen Chemie, т. 4 (1953), cc. 1-39; Journal of Pharmaceutical Sciences, т. 52Ind.,2, 1961, cc. 72 и далее; Dr. H.P. Fiedler, Lexikon der Hilfsstoffe fur Pharmazie, Kosmetik und angrenzende Gebiete, Cantor KG, Aulendorf in Wurttemberg 1971. Предлагаемые в изобретении соединения можно вводить перорально или парентерально, например внутрибрюшинно, внутримышечно, подкожно или чрескожно. Указанные соединения можно также вводить с помощью имплантата, вживляемого в ткань. Для перорального введения пригодны капсулы, пилюли, таблетки, драже и т.д. В состав лекарственных форм, содержащих разовую дозу действующего вещества, помимо последнего могут входить также фармацевтически приемлемый носитель, такой, например, как крахмал, сахар, сорбит, желатин,смазывающее вещество, кремниевая кислота, тальк и т.д. Для парентерального введения действующие вещества могут быть представлены в растворенном или суспендированном в физиологически приемлемом разбавителе виде. В качестве подобных разбавителей наиболее часто используют масла с добавлением или без добавления гидротропного солюбилизатора, поверхностно-активного вещества, суспендирующего агента или эмульгатора. Примерами пригодных для применения в этих целях масел служат оливковое масло, арахисовое масло, хлопковое масло,соевое масло, касторовое масло и кунжутное масло. Предлагаемые в изобретении соединения допускают также их применение в виде инъекции с замедленным всасыванием действующего вещества или в виде имплантируемого препарата, т.е. в виде лекарственных форм, обеспечивающих замедленное (пролонгированное) высвобождение действующего вещества. В качестве инертных материалов имплантаты могут содержать, например, биологически разлагаемые полимеры или синтетические силиконы, в частности силоксановый каучук. Помимо этого для чрескожного введения действующих веществ можно использовать пластырь. Для изготовления содержащих активные соединения общей формулы I' интравагинальных (например вагинальных колец) или внутриматочных систем (например, пессариев, спиралей, ВМС, Mirena),предназначенных для местного применения, пригодны различные полимеры, такие, например, как полисилоксаны, этиленвинилацетат, полиэтилен или полипропилен. Для повышения биодоступности действующего вещества предлагаемые в изобретении соединения можно также перерабатывать в клатратные соединения циклодекстрина. С этой целью такие соединения подвергают взаимодействию с -, - или -циклодекстрином или его производными (РСТ/ЕР 95/02656). Согласно изобретению соединения общей формулы I' можно также заключать в липосомы. Методы исследования Исследования по связыванию с эстрогенными рецепторами Аффинность новых эстрогенов избирательного действия исследовали в опытах по конкурентному связыванию на препаратах эстрогенных рецепторов из предстательной железы и матки крыс с использованием 3 Н-эстрадиола в качестве лиганда. Для приготовления препаратов цитозоля предстательной железы и для проведения опыта по связыванию с эстрогенными рецепторами с использованием цитозоля предстательной железы использовали методику, описанную у Testas и др. (Testas J. и др., Endocrinology,109, cc. 1287-1289 (1987. Для приготовления препаратов цитозоля матки крыс, а также для проведения опыта по связыванию с рецепторами с использованием содержащего ER-рецептор цитозоля в основном использовали методику, описанную у Stack и Gorski (Stack, Gorski, Endocrinology, 117, cc. 2024-2032 (1985, с некоторыми модификациями, описанными у Fuhrmann и др. (Fuhrmann U. и др., Contraception, 51, cc. 45-52(1995. Представленные в настоящем описании вещества обладают более высокой аффинностью к эстрогенным рецепторам из предстательной железы крыс по сравнению с аффинностью к эстрогенным рецеп- 10006299 торам из матки крыс. При этом исходят из того, что в предстательной железе крыс рецепторы ER преобладают над рецепторами ER, а в матке крыс рецепторы ER преобладают над рецепторами ER. Приведенные ниже в табл. 1 данные свидетельствуют о том, что соотношение между степенью связывания с рецепторами из предстательной железы и степенью связывания с рецепторами из матки в качественном отношении согласуется с коэффициентом относительной аффинности (ОА) к человеческим рецепторам ER и рецепторам ER крысы (согласно Kuiper и др., Endocrinology, 138, cc. 863-870 (1996 В табл. 2 представлены результаты, полученные при предусмотренном согласно изобретению применении соединения 8-метилэстра-1,3,5(10)-триен-3,17-диола (соединение Г), а также полученные для следующих предлагаемых в изобретений соединений: 8-винилэстра-1,3,5(10),9(11)-тетраен-3,17-диол (А),8-винилэстра-1,3,5(10)-триен-3,17-диол (Б),8-(2,2-дифторвинил)-эстра-1,3,5(10)-триен-3,17-диол (В) и 8-этилэстра-1,3,5(10)-триен-3,17-диол (Д). Таблица 2 Соединения А, Б, В, Г и Д проявляют более высокую аффинность к эстрогенным рецепторам из предстательной железы крыс по сравнению с аффинностью к эстрогенным рецепторам из матки крыс. Помимо этого оценивали также предсказательность опытной системы, основанной на сравнении эффекта в отношении эстрогенных рецепторов из предстательной железы с эффектом на эстрогенные рецепторы из матки ("Prostata ER versus Uterus ER test system"), анализируя избирательное действие соединений на различные ткани в опытах in vivo. Соединения с более высокой аффинностью к эстрогенным рецепторам из предстательной железы при сравнении их действия in vivo на костную ткань и на матку проявляют избирательность, преимущественно воздействуя на костную ткань. Помимо этого соединения с более высокой степенью связывания с эстрогенными рецепторами из предстательной железы крыс по сравнению со степенью связывания с эстрогенными рецепторами из матки крыс обладают более высоким потенциалом касательно повышения уровня экспрессии рецепторов и переносчиков серотонина- 11006299 в сравнении с их положительным действием на выброс ЛГ. Опыты по исследованию костной ткани Трехмесячных самок крыс подвергали овариэктомии и животным сразу же после операции в течение 28 дней однократно в день вводили тестируемое соединение. Введение осуществляли подкожно в арахисовом масле/этаноле. В день последнего введения тестируемого соединения животных умерщвляли, у каждого из них удаляли большеберцовую кость, а также матку. Каждую матку взвешивали, фиксировали и путем соответствующей обработки подготавливали к гистологическим исследованиям. Плотность костной массы определяли ex vivo на препарированных длинных костях с помощью pQCT (количественная компьютерная томография). Измерения проводили на расстоянии 4-6 мм от головки сустава со стороны проксимального конца большеберцовой кости. В результате овариэктомии плотность трабекулярной костной ткани уменьшалась на исследуемом участке с примерно 400 мг Са 2+/см 3 до примерно 300 мг Са 2+/см 3. Введение одного из соединений общей формулы I согласно настоящему изобретению предотвращало, соответственно задерживало, деструкцию кости, проявляющуюся в уменьшении ее плотности. Плотность костной ткани определяли со стороны проксимального конца большеберцовой кости. О более высокой аффинности к эстрогенным рецепторам из предстательной железы крыс по сравнению с аффинностью к эстрогенным рецепторам из матки крыс в опытах in vivo свидетельствует преимущественно тот факт, что по отношению к уменьшению костной массы, которое в отличие от ложнооперированных, интактных животных наблюдалось у подвергнутых овариэктомии, но не получавших тестируемое соединение самок крыс через 28 дней после операции, 50%-ная защита костной ткани от деструкции обеспечивается при более низких количествах предлагаемых в изобретении соединений по сравнению с тем их количеством, которое необходимо для 50%-ной стимуляции матки. Действие предлагаемых в изобретении эстрогенов на сосуды определяли на модели АроЕнокаутных мышей по методу, описанному у R. Elhage и др., 1997, а также на модели индуцированного баллонным катетером повреждения сосуда (модель рестеноза) (Elhage R. и др., Arteriosclerosis, Thrombosis, and Vascular Biology, 17, cc. 2679-2684 (1997. Для подтверждения оказываемого эстрогенами действия на функцию головного мозга в качестве заменяющего (суррогатного) параметра использовали экспрессию кодирующей окситоцин, окситоциновый рецептор или вазопрессин мРНК (Hrabovszky Е. и др., Endocrinology, 1339, cc. 2600-2604 (1998. Подвергнутым овариэктомии крысам в течение 7 дней вводили тестируемое соединение или только носитель (введение осуществляли подкожно или перорально 6 раз в день). На 7-й день после первого введения животных обезглавливали, определяли вес каждой матки и на соответствующих срезах головного мозга путем гибридизации in situ выявляли уровень кодирующей окситоцин, окситоциновый рецептор или вазопрессин мРНК. При этом определяли значения ED50, относящиеся к стимуляции роста матки и индукции кодирующей окситоциновый рецептор мРНК. Другая возможность экспериментального подтверждения избирательного (диссоциированного) эстрогенного действия предлагаемых в изобретении соединений in vivo состоит в оценке того влияния, которое указанные соединения после их однократного введения оказывают у крыс на уровень экспрессии 5 НТ 2 а-рецепторного белка и белка-переносчика серотонина и на уровень экспрессии соответствующей мРНК в областях головного мозга с высокой концентрацией рецепторов ER. При этом влияние на экспрессию рецептора и переносчика серотонина сравнивали с влиянием на секрецию ЛГ. Соединения с более высокой степенью связывания (аффинности) с эстрогенными рецепторами из предстательной железы крыс по сравнению со степенью связывания с эстрогенными рецепторами из матки крыс обладают более высоким потенциалом касательно повышения уровня экспрессии рецептора и переносчика серотонина по сравнению с их положительным влиянием на выброс ЛГ. Концентрацию рецепторов и переносчиков серотонина определяли на срезах головного мозга с помощью радиоактивных лигандов, а наличие соответствующей мРНК определяли путем гибридизации in situ. Рассмотренная выше методика известна из литературы и описана, в частности, у G. Fink и В.Е.Н. Sumner, Nature, 383, с 306 (1996), а также у В.Е.Н. Sumner и др., Molecular Brain Research (1999) (в печати). Предлагаемые в изобретении соединения А, Б, В, Г и Д обеспечивают повышенный уровень экспрессии рецептора и переносчика серотонина, что согласуется с их более высокой степенью связывания с эстрогенными рецепторами из предстательной железыкрыс по сравнению со степенью связывания с эстрогенными рецепторами из матки крыс. Получение предлагаемых в изобретении соединений Предлагаемые в изобретении соединения общей формулы I (соответственно I') получают по методам, рассмотренным в приведенных ниже примерах. Аналогичным путем при применении реагентов,которые гомологичны описанным в примере реагентам, можно получать другие соединения общей формулы I'. Свободные гидроксигруппы этерифицируют до простого и/или сложного эфира по хорошо известным специалистам методам. Предлагаемые в изобретении соединения могут быть представлены по 6-му, 7-му, 11-му, 15-му, 16- 12006299 му и 17-му атомам углерода в виде ,-стереоизомеров. Предлагаемые в изобретении соединения при их получении описанными ниже методами преимущественно образуются в виде смесей соответствующих,-изомеров. Такие смеси можно разделять на индивидуальные изомеры, например, хроматографическими методами. Согласно общей формуле I возможные заместители могут присутствовать в окончательной форме или в форме предшественника уже в исходном соединении, т.е. в эстроне, который уже замещен в соответствии с целевым конечным продуктом. Так, в частности, вводить заместитель, соответственно его реакционноспособный предшественник,у 7-го атома углерода можно путем нуклеофильного присоединения такого заместителя, соответственно его предшественника, к 6-винилсульфону (DE 4218743 А 1). При этом в зависимости от конкретных реагентов и выбранных условий реакции 7- и 7-замещенные соединения, которые можно разделять, например, хроматографическими методами, получают в различных соотношениях между ними. Заместители в 17-е положение также вводят по известным методам, в частности нуклеофильным присоединением требуемого заместителя или его реакционноспособного предшественника, и затем при необходимости подвергают последующим структурным превращениям. Предлагаемые в изобретении эфиры 8-замещенных эстратриенкарбоновых кислот также получают аналогично известным методам из соответствующих гидроксистероидов (см., например, "Pharmazeutische Wirkstoffe, Synthesen, Patente, Anwendungen", A. Kleemann, J. Engel, изд-во Georg Thieme Verlag,Stuttgart 1978; "Arzneimittel, Fortschritte 1972 bis 1985", под ред. A. Kleemann, E. Lindner, J. Engel, изд-воVCH 1987, cc. 773-814). Предлагаемые в изобретении сульфаматы эстратриенов можно получать известным методом из соответствующих гидроксистероидов путем этерификации сульфамоилхлоридами в присутствии основания (Z. Сhеm., 15, cc. 270-272 (1975); Steroids, 61, cc. 710-717 (1996. В результате последующего ацилирования сульфамидной группы получают предлагаемые в изобретении (N-ацил)сульфаматы, для которых при отсутствии у них заместителя в 8-м положении уже были подтверждены положительные с точки зрения фармакокинетики свойства (см. DE 19540233 А 1). Региоселективную этерификацию полигидроксилированных стероидов N-замещенными и Nнезамещенными сульфамоилхлоридами осуществляют после частичной защиты тех гидроксильных групп, которые должны остаться неэтерифицированными. В качестве защитных групп с пригодной для этой цели избирательной реакционной способностью целесообразно использовать силиловые эфиры,поскольку они в условиях образования сульфамата остаются стабильными, а их повторное отщепление для регенерирования остальной(ых), еще сохранившейся(ихся) в молекуле гидроксильной(ых) группы(групп) не затрагивает сульфаматную группу (Steroids, 61, cc. 710-717 (1996. Предлагаемые в изобретении сульфаматы с одной или несколькими дополнительными гидроксильными группами в молекуле можно также получать, исходя из приемлемых гидроксистероидкетонов. Сначала в зависимости от поставленной цели одну или несколько имеющихся гидроксильных групп подвергают сульфамоилированию. После этого сульфаматные группы необязательно можно переводить с использованием требуемого ацилхлорида в присутствии основания в соответствующие (N-ацил) сульфаматы. Получаемые в результате оксосульфаматы или оксо(N-ацил)сульфаматы восстановлением превращают в соответствующие гидроксисульфаматы, соответственно гидрокси(N-ацил)сульфаматы (Steroids,61, cc. 710-717 (1996. В качестве восстановителей при этом целесообразно использовать борогидрид натрия и боран-диметилсульфидный комплекс. Введение функциональных групп у 2-го атома углерода можно осуществлять, например, путем электрофильного замещения после предшествующего депротонирования положения 2 соответствующего 3-(2-тетрагидропиранилового)- или 3-метилового эфира литийсодержащим основанием (например метиллитием, бутиллитием). Так, например, атом фтора можно вводить взаимодействием С-Нактивированного субстрата со фторирующим реагентом, таким как N-фторметансульфонимид (WO 94/24098). Вводить различные заместители в кольца В, С и D эстратриенового скелета в принципе можно в соответствии с известными специалистам в области химии рекомендациями, позволяющими получать соответствующие, не замещенные в 8-м положении эстратриеновые производные (см., в частности, "Steroide", L.F. Fieser, M. Fieser, изд-во Verlag Chemie, Weinheim/Bergstr., 1961; "Organic Reactions in SteroidChemistry", J. Fried, J.A. Edwards, изд-во Van Nostrand Reinhold Company, New York, Cincinnati, Toronto,London, Melbourne, 1972; "Medicinal Chemistry of Steroids", F.J. Zeelen, изд-во Elsevier, Amsterdam,Oxford, New York, Tokyo, 1990). Сказанное относится, например, к введению таких заместителей, как гидрокси- или алкилоксигруппы, алкильные, алкенильные или алкинильные группы либо галоген, прежде всего фтор. Однако заместители, соответствующие общей формуле I, можно также вводить и в уже замещенные в 8-м положении эстратриены. Сказанное может оказаться целесообразным, соответственно необходимым, прежде всего при многократном замещении целевого конечного соединения. Ниже изобретение более подробно рассмотрено на примерах.- 13006299 Общие методы синтеза, использованные в этих примерах, проиллюстрированы ниже на схемах 1-3. Исходным материалом в этих методах синтеза служат 11-кетоэстратетраеновые производные формулы 1, соответственно 2 (US 3491089, Tetrahedron Letters, 37, с. 3603 (1967, замещение которых при взаимодействии с цианидом диэтилалюминия происходит стереоселективно в положении 8. В результате последующего восстановления карбонильной функциональной группы у С(11) и элиминирования образовавшейся гидроксильной группы получают 8-замещенные эстра-1,3,5(10),9(11)-тетраены, которые в свою очередь можно переводить в 8-альдегиды. Функционализация, например, по реакции Виттига с последующим удалением защитных групп позволяет получить предлагаемые в изобретении 8 стероиды. В рассмотренной выше последовательности реакций сначала получают 11-оксигенированные эстрадиольные производные, которые, равно как и двойную связь С(9)-С(11), можно подвергать дальнейшим превращениям по известным специалистам методам с получением самых разнообразных схем замещения у стероида. Так, например, соединение с гидроксигруппой в положении 11 можно по описанному у Vorbrggen и др. методу переводить в соединение с атомом фтора в положении 11. Для получения предлагаемых в изобретении производных 8-замещенных эстра-1,3,5(10)-триен 3,16-диолов без заместителя в 17-м положении используют преимущественно следующую методику синтеза. При этом 8-карбонильную функциональную группу защищают в виде ацеталя. После последующего окисления 17-кетостероид можно переводить в сульфонилгидразон, что в простейшем случае можно осуществлять взаимодействием с фенилсульфонилгидразидом. В результате реакции расщепления образуется С(16)-С(17)-олефин (Z. Chem., 10, cc. 221-222 (1970); Liebigs Ann. Chem., cc. 1973-1981(1981, к которому регио-/стереоконтролируемым образом присоединяют гипобромит. Восстановительное дегалогенирование и удаление ацетальной защитной группы в положении 8 обеспечивают превращение в предлагаемые в изобретении соединения. Получаемые таким путем 16-спирты можно переводить по известным методам в 16-эпимер (Synthesis, 1 (1980. Другой вариант введения гидроксильной группы у 16-го С-атома состоит в гидроборировании двойной 16(17)-связи стерически затрудненными боранами. В результате подобной реакции, как это известно, образуются 16-оксигенированные продукты (Indian J. Chem. 1971, 9, cc. 287-288 (1971. В соответствии с этим в результате взаимодействия эстра-1,3,5(10),16-тетраенов 17 с 9-борабицикло[3.3.1]нонаном после окисления щелочным пероксидом водорода получают 16-гидроксиэстратриены. При этой реакции в меньшем количестве образуются эпимерные 16-гидроксистероиды. Последующие превращения, затрагивающие находящиеся в положении 8 заместители, позволяют получить предлагаемые в изобретении соединения общей формулы I. Типичные, но не ограничивающие объем изобретения методы синтеза, которые целесообразно использовать для получения характерных схем замещения эстронного скелета, в том числе и в сочетании с несколькими заместителями, можно найти, например, в следующих публикациях: замещение по C(l): J.(1994); замещение по С(14): Z. Chem. 23, с. 410 (1983). В приведенных ниже примерах и на схемах использованы следующие сокращения: ТГФ - тетрагидрофуран,ТГП - тетрагидропиран-2-ил,ДГП - дигидропиран,ДМСО - диметилсульфоксид,МТБЭ - метил-трет-бутиловый эфир,ДИБАГдиизобутилалюмогидрид,ТБАГЛ - три-трет-бутоксиалюмогидрид лития. Пример 1. 3-Метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10),8-тетраен-11-он (2) К 15,29 г 11-кето-3-метоксиэстра-1,3,5(10),8-тетраен-17-ола (1) в 35 мл дихлорметана при комнатной температуре добавляли 47 мл дигидропирана и 0,96 г пиридинтолуолсульфоната и перемешивали в течение 2 ч. После этого реакционный раствор многократно встряхивали с насыщенным раствором гидрокарбоната натрия, промывали водой и сушили над сульфатом магния. Растворитель выпаривали в вакууме и остаток очищали на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 8:2). Таким путем получили 16,8 г (83%) светло-желтого вязкого масла. 8-Циано-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен-11-он(3). К раствору 24,5 г 11-кетостероида 2 в 330 мл толуола при температуре -5 С в атмосфере аргона по каплям добавляли 195 мл цианида диэтилалюминия (1,0-молярного в толуоле) и перемешивали в течение 1,5 ч, продолжая охлаждать. После этого смесь сливали в 470 мл охлажденного льдом 1 н. едкого натра,- 14006299 перемешивали в течение 1 ч, несколько раз экстрагировали этилацетатом, объединенные органические фазы промывали водой и рассолом и сушили над сульфатом магния. В результате хроматографии полученного после упаривания остатка на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 4:1) получили соединение 3 в виде пены с общим выходом 12,0 г (37%). 8-циано-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен-11-ол(4). Раствор 33,1 г стероида 3 в 400 мл ТГФ охлаждали до 0 С, порциями смешивали с 51,0 г ТБАГЛ и раствор перемешивали в течение 1 ч при продолжающемся охлаждении и в течение 1 ч при комнатной температуре. Далее к реакционному раствору при 0 С по каплям добавляли 25 мл насыщенного раствора гидрокарбоната натрия, образовавшийся осадок отделяли путем фильтрации через целит и фильтрат концентрировали практически досуха. Остаток несколько раз экстрагировали этилацетатом, после чего объединенные органические фазы промывали рассолом, сушили над сульфатом магния и растворитель удаляли в вакууме. Таким путем получили 27,6 г (97%) пенистого соединения 4, которое без дополнительной очистки использовали на следующей стадии. 8-Циано-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10),9(11)-тетраен (5). К раствору 27,6 г соединения 4 в 275 мл пиридина при температуре в интервале от 0 до 5 С по каплям добавляли 27,6 мл оксихлорида фосфора и перемешивали при этой температуре в течение последующих 1,5 ч. После этого смесь переносили в капельную воронку и по каплям добавляли к охлажденному льдом насыщенному раствору гидрокарбоната натрия. Затем экстрагировали дихлорметаном, объединенные органические фазы промывали рассолом, сушили над сульфатом магния и растворитель удаляли в вакууме. Таким путем получили 23,5 г (89%) практически бесцветного пенистого соединения 5,которое без дополнительной очистки использовали на следующей стадии. 8-Карбонил- 3-метоксиэстра-1,3,5(10),9(11)-тетраен-17-ол (6). К 11,4 г 8-цианостероида 5 в 70 мл толуола в атмосфере аргона при 0 С по каплям добавляли раствор 41 мл ДИБАГ в 100 мл толуола и в течение 1,5 ч перемешивали при этой температуре. Далее раствор при 0 С последовательно смешивали с 33 мл этанола, 33 мл смеси этанола с водой (в объемном соотношении 1:1) и 120 мл полуконцентрированной соляной кислоты и затем в течение 2 ч кипятили с обратным холодильником. После этого смесь несколько раз экстрагировали этилацетатом, объединенные органические фазы промывали водой, сушили над сульфатом магния и досуха концентрировали в вакууме. В результате хроматографии остатка на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 3:2) получили 3,21 г (35%) пенистого соединения 6. 3-Метокси-8-метилэстра-1,3,5(10),9(11)-тетраен-17-ол (7 а). К раствору 225 мг гидроксида калия в 3,5 мл триэтиленгликоля при комнатной температуре добавляли 0,18 мл гидроксида гидразиния (80%-ного в воде) и 50 мг 8-карбонил-3-метоксиэстра 1,3,5(10),9(11)-тетраен-17-ола (6) в 6,5 мл триэтиленгликоля, нагревали до 200 С и выдерживали при этой температуре в течение 2 ч. После охлаждения последовательно смешивали с 10 мл воды и 3 мл 10%ной серной кислоты. Смесь несколько раз экстрагировали простым эфиром, объединенные органические фазы промывали водой, сушили над сульфатом магния и концентрировали досуха на роторном испарителе. В результате хроматографии остатка на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 8:2) получили 36 мг (79%) 3-метокси-8-метилэстра-1,3,5(10),9(11)-тетраен-17-ола с температурой плавления 168 С. Пример 2. Синтез соединения 7 а описан в примере 1 (1.1-1.6). 3-Метокси-8-метилэстра-1,3,5(10)-триен-17-ол (8 а) 75 мг 3-метокси-8-метилэстра-1,3,5(10),9(11)-тетраен-17-ола (7 а) растворяли в смеси растворителей из 3,5 мл ТГФ и 1,5 мл метанола и в течение 3,75 ч перемешивали при комнатной температуре с 75 мг палладия (10%-ного на карбонате магния) в атмосфере водорода. Затем реакционный раствор фильтровали через целит, фильтрат концентрировали досуха на роторном испарителе и полученный таким путем однородный по результатам ТСХ пенистый продукт (74 мг, 98%) без дополнительной очистки использовали на следующей стадии. 8-Метилэстра-1,3,5(10)-триен-3,17-диол (8b). 74 мг 3-метокси-8-метилэстра-1,3,5(10)-триен-17-ола растворяли в 3 мл безводного толуола, охлаждали до 0 С и в атмосфере аргона осторожно смешивали с 0,6 мл ДИБАГ. Реакционную смесь медленно нагревали до температуры перегонки и поддерживали эту температуру в течение 3,5 ч. После этого раствор вновь охлаждали до 0 С, последовательно смешивали с 2 мл этанола, 2 мл смеси этанола с водой (в объемном соотношении 1:1) и 2 мл полуконцентрированной соляной кислоты и несколько раз экстрагировали этилацетатом. Объединенные органические фазы промывали водой до нейтральной реакции, сушили над сульфатом магния и концентрировали досуха в вакууме. Таким путем получили 70 мг(99%) бесцветных кристаллов с температурой плавления 168-170 С. Пример 3. Синтез соединения 6 описан в примере 1 (1.1-1.5). 8-Карбонил-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10),9(11)-тетраен(9). Раствор 500 мг соединения 6 в 10 мл дихлорметана смешивали с 1,45 мл 3,4-дигидро-2 Н-пирана и 28 мг (0,11 ммоля) пиридинтолуолсульфоната и перемешивали в течение 16 ч при комнатной температуре. Далее смесь последовательно несколько раз промывали насыщенным раствором гидрокарбоната на- 15006299 трия и водой и органическую фазу после сушки над сульфатом магния досуха упаривали в вакууме. Таким путем получали продукт 9 в виде пены с выходом 527 мг (86%). 3-Метокси-17-(тетрагидропиран-2-илокси)-8-винилэстра-1,3,5(10),9(11)-тетраен (10 а). Раствор 585 мг 8-карбонил-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10),9(11)-тетраена в 25 мл ДМСО смешивали в атмосфере аргона сначала с 4,92 г метилтрифенилфосфонийбромида, а затем осторожно с 394 мг гидрида натрия (80%-ного в парафиновом масле) и после этого в течение 2 ч медленно нагревали до внутренней температуры 55 С. После охлаждения по каплям добавляли 25 мл воды, несколько раз экстрагировали диэтиловым эфиром, промывали водой и объединенные органические фазы сушили над сульфатом магния. После удаления растворителя остаток очищали хроматографией на силикагеле (смесь растворителей: циклогексан/МТБЭ в соотношении 30:1). Таким путем получили 520 мг (89%) 8-винилстероида в виде бесцветной пены. 8-Винилэстра-1,3,5(10),9(10)-тетраен-3,17-диол (11 а). 550 мг 3-метокси-17-(тетрагидропиран-2-илокси)-8-винилэстра-1,3,5(10),9(11)-тетраена подвергали химическому превращению в соответствии с общей методикой 19. Выход бесцветных кристаллов с температурой плавления 149-150 С составил 315 мг (76%). 8-(2,2-Дифторвинил)-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5,(10),9(11)тетраен(10b). Раствор 0,22 мл диэтил(дифторметил)фосфоната в 0,4 мл н-пентана и 2 мл 1,2-диметоксиэтана охлаждали в атмосфере аргона до -78 С, смешивали с 0,82 мл раствора трет-бутиллития (1,7-молярного в нпентане) и в течение 0,25 ч перемешивали при этой температуре. Далее при той же температуре по каплям добавляли раствор 220 мг 8-карбонил-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10),9(11)-тетраена в 3,5 мл 1,2-диметоксиэтана и 0,58 мл н-пентана и, продолжая охлаждать, перемешивали в течение 0,5 ч. После этого сначала нагревали до комнатной температуры, а затем, отгоняя н-пентан, в течение 1 ч выдерживали при внутренней температуре 84 С. После охлаждения смесь сливали в 20 мл смеси воды со льдом, отфильтровывали от светло-коричневого осадка, экстрагировали дихлорметаном и объединенные органические фазы сушили над сульфатом магния. После удаления растворителя остаток очищали хроматографией на силикагеле (смесь растворителей: циклогексан/МТБЭ в соотношении 30:1). Выход маслянистого, практически бесцветного стероида составил 108 мг (46%). 8-(2,2-Дифторвинил)эстра-1,3,5(10),9(11)-тетраен-3,17-диол (11b). 105 мг 8-(2,2-дифторвинил)-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10),9(11)-тетраена для отщепления эфира с помощью ДИБАГ/кислоты подвергали химическому превращению в соответствии с общей методикой 19. Выход бесцветных кристаллов с температурой плавления 103-106 С составил 75 мг (93%). Пример 4. Синтез соединения 9 описан в примере 3 (3.1). 8-Карбонил-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1, 3,5(10)-триен (12). 1,73 г соединения 9 растворяли в 75 мл смеси растворителей из ТГФ и метанола (в объемном соотношении 7:3) и в течение 3,75 ч перемешивали при комнатной температуре в атмосфере водорода с 1,0 г палладия (10%-ного на карбонате магния). Затем реакционный раствор фильтровали через целит, фильтрат досуха концентрировали на роторном испарителе и полученное таким путем однородное по результатам ТСХ светлое масло без дополнительной очистки использовали в последующих реакциях. 3-Метокси-17-(тетрагидропиран-2-илокси)-8-винилэстра-1,3,5(10)-триен (13 а). Раствор 2,47 г 8-карбонил-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10),9(11)-тетраена в 100 мл ДМСО в атмосфере аргона смешивали сначала с 19,80 г метилтрифенилфосфонийбромида, а затем осторожно с 1,58 г гидрида натрия (80%-ного в парафиновом масле) и после этого в течение 2 ч медленно нагревали до внутренней температуры 55 С. После охлаждения по каплям добавляли 100 мл воды, несколько раз экстрагировали диэтиловым эфиром, промывали водой и объединенные органические фазы сушили над сульфатом магния. После удаления растворителя остаток очищали хроматографией на силикагеле (смесь растворителей: циклогексан/МТБЭ в соотношении 30:1). Таким путем получили 1,91 г (78%) 8-винилстероида в виде бесцветной пены. 8-Винилэстра-1,3,5(10)-триен-3,17-диол (14 а). 1,86 г 3-метокси-17-(тетрагидропиран-2-илокси)-8-винилэстра-1,3,5(10)-триена подвергали химическому превращению в соответствии с общей методикой 19. После очистки продукта на силикагеле(смесь растворителей: циклогексан/этилацетат в соотношении 7:3) получили сырой 8-винилэстра 1,3,5(10)-триен-3,17-диол в виде бесцветных кристаллов с температурой плавления 163-165 С и с выходом 1,20 г (86%). 8-(2,2-Дифторвинил)-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен(13b). Раствор 0,6 мл диэтил(дифторметил)фосфоната в 1,0 мл н-пентана и 5,6 мл 1,2-диметоксиэтана охлаждали в атмосфере аргона до -78 С, смешивали с 2,2 мл раствора трет-бутиллития (1,7-молярного в нпентане) и в течение 0,25 ч перемешивали при этой температуре. Далее при той же температуре по каплям добавляли раствор 600 мг 8-карбонил-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10),- 16006299 9(11)-тетраена в 9,2 мл 1,2-диметоксиэтана и 1,6 мл н-пентана и, продолжая охлаждение, перемешивали в течение 0,5 ч. После этого сначала нагревали до комнатной температуры и затем, отгоняя н-пентан, в течение 1 ч нагревали до внутренней температуры 84 С. После охлаждения смесь сливали в 40 мл смеси воды со льдом, отфильтровывали светло-коричневый осадок, экстрагировали дихлорметаном и объединенные органические фазы сушили над сульфатом магния. После удаления растворителя остаток очищали хроматографией на силикагеле (смесь растворителей: циклогексан/МТБЭ в соотношении 30:1). Выход маслянистого, почти бесцветного стероида составил 75 мг (12%). 8-(2,2-Дифторвинил)эстра-1,3,5(10)-триен-3,17-диол (14b). 78 мг 3-метокси-8-(2,2-дифторвинил)-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триена подвергали химическому превращению в соответствии с общей методикой 19. Выход бесцветных кристаллов с температурой плавления 154-156 С составил 56 мг (90%). Пример 5. Синтез соединения 13 а описан в примере 4 (4.2). 8-Этил-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен. 0,50 г соединения 13 а растворяли в 25 мл смеси растворителей из ТГФ и метанола (в объемном соотношении 7:3) и в течение 3,75 ч перемешивали при комнатной температуре в атмосфере водорода с 0,30 г палладия (10%-ного на карбонате магния). Затем реакционный раствор фильтровали через целит,фильтрат досуха концентрировали на роторном испарителе и полученную светлую пену без дополнительной очистки использовали на следующей стадии. 8-Этилэстра-1,3,5(10)-триен-3,17-диол (15 а, 15b). 330 мг сырого 8-этил-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триена, полученного на предыдущей стадии, подвергали химическому превращению в соответствии с общей методикой 6.1 и 6.2. Хроматографией на силикагеле из полученного таким путем сырого продукта удалось выделить эпимерные эстратриендиолы 15 а и 15b с выходом 161 мг и 20 мг соответственно. Температура плавления соединения 15 а составляет около 149-152 С, а соединения 15b - около 185-187 С. Пример 6. 3-Метокси-8-винилэстра-1,3,5(10)-триен-17-он. Раствор 700 мг 3-метокси-8-винилэстра-1,3,5(10)-триен-17-ола в 30 мл дихлорметана смешивали с 740 мг хлорохромата пиридиния и в течение 3 ч перемешивали при комнатной температуре. В результате фильтрации реакционной смеси через силикагель (смесь растворителей: циклогексан/этилацетат в соотношении 7:3) и последующего концентрирования фильтрата на роторном испарителе получили 680 мг (98%) 3-метокси-8-винилэстра-1,3,5(10)-триен-17-она в виде почти бесцветной пены, которую без дополнительной очистки использовали на следующей стадии. 3-Гидрокси-8-винилэстра-1,3,5(10)-триен-17-он. К 9,2 г гидрохлорида пиридиния при 180 С добавляли 460 мг 3-метокси-8-винилэстра-1,3,5(10)триен-17-она и при той же температуре перемешивали в течение 3 ч. После этого смесь сливали на лед,выпавший осадок отфильтровывали, промывали водой и сушили. Выход 2-гидрокси-8-винилэстра 1,3,5(10)-триен-17-она с температурой плавления 239-242 С составил 400 мг (90%). Пример 7. 3-Сульфамоилокси-8-винилэстра-1,3,5(10)-триен-17-он. 76 мг 3-гидрокси-8-винилэстра-1,3,5(10)-триен-17-она растворяли в 7 мл дихлорметана, смешивали с 0,26 мл 2,6-ди-трет-бутилпиридина и 221 мг сульфамоилхлорида и перемешивали в течение 1,5 ч при комнатной температуре (КТ). После этого реакционную смесь сливали в воду и несколько раз экстрагировали дихлорметаном. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и практически досуха концентрировали в вакууме. В результате хроматографии полученного остатка на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 7:3) получили 46 мг (48%) 17-оксо-8-винилэстра-1,3,5(10)-триен-3-иламидосульфоната. 3-Сульфамоилокси-8-винилэстра-1,3,5(10)-триен-17-ол. 46 мг 17-оксо-8-винилэстра-1,3,5(10)-триен-3-иламидосульфоната растворяли в 1,5 мл ТГФ и 1,5 мл метанола, при 0 С смешивали с 33 мг борогидрида натрия и в течение 1 ч перемешивали при 0 С. Далее добавляли 0,2 мл концентрированной уксусной кислоты и концентрировали в вакууме. Остаток растворяли в этилацетате и воде, отделяли органическую фазу, а водную фазу несколько раз экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали в вакууме. Сырой продукт очищали хроматографией на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 6:4) с получением в результате 45 мг (98%) 17-гидрокси-8-винилэстра-1,3,5(10)-триен-3-ил-амидосульфоната в виде тонких игольчатых кристаллов с температурой плавления 82-86 С. Пример 8. 3-Метокси-8-проп-1-(Z)енил-17-(тетрагидропиран-2-илокси)эстра-1.3.5(10)-триен. Раствор 100 мг 8-формил-3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триена в 5 мл ДМСО смешивали в атмосфере аргона сначала с 830 мг этилтрифенилфосфонийбромида, а затем осторожно с 64 мг гидрида натрия (80%-ного в парафиновом масле) и после этого в течение 2 ч медленно нагревали до внутренней температуры 60 С. После охлаждения по каплям добавляли 10 мл воды, несколько раз экстрагировали этилацетатом, объединенные органические фазы промывали водой и сушили- 17006299 над сульфатом магния. После удаления растворителя остаток очищали хроматографией на силикагеле(смесь растворителей: циклогексан/этилацетат в соотношении 30:1). Таким путем получили 24 мг (23%) 8-пропенилстероида в виде бесцветной пены. 8-Проп-1-(Z)-енилэстра-1,3,5(10)-триен-3,17-диол. 24 мг 3-метокси-8-(проп-1-(Z)-енил)-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триена подвергали химическому превращению в соответствии с общими методиками по отщеплению ТГП- и 3 метилового эфира. После очистки продукта на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 7:3) получили сырой 8-проп-l-(Z)-енилэстра-1,3,5(10)-триен-3,17-диол в виде бесцветных кристаллов с температурой плавления 119-125 С и с выходом 10 мг (66%). Пример 9. 3-Метокси-17-этинил-8-винилэстра-1,3,5(10)-триен-17-ол. 85 мг 3-метокси-8-винилэстра-1,3,5(10)-триен-17-она растворяли в атмосфере аргона в 8 мл ТГФ,охлаждали до -78 С и смешивали с 5,5 мл раствора этинилмагнийбромида (0,5-молярного в ТГФ) и 100 мг комплекса литийацетиленид-этилендиамин. Реакционную смесь при нагревании до комнатной температуры перемешивали в течение 3 ч, после чего охлаждали до 0 С и смешивали с 10 мл насыщенного раствора хлорида аммония. Смесь несколько раз экстрагировали этилацетатом, объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали в вакууме. В результате хроматографии остатка на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 9:1) получили 30 мг (33%) маслянистого 17-этинил-3-метокси-8 винилэстра-1,3,5(10)-триен-17-ола. 17-Этинил-8-винилэстра-1,3,5(10)-триен-3,17-диол. Раствор 15 мг 17-этинил-3-метокси-8-винилэстра-1,3,5(10)-триен-17-ола и 82 мг тетрабутиламмониййодида в 2 мл дихлорметана охлаждали в атмосфере аргона до -78 С, смешивали с 0,3 мл раствора трихлорида бора (1-молярного в дихлорметане) и в течение 24 ч перемешивали при 0 С. Затем реакционный раствор по каплям добавляли к охлажденному до 5 С насыщенному раствору хлорида аммония,смесь несколько раз экстрагировали диэтиловым эфиром, объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали в вакууме. В результате хроматографии остатка на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 7:3) получили 5 мг (35%) 17-этинил-8-винилэстра-1,3,5(10)-триен-3,17-диола с температурой плавления 156 С. Пример 10. 3-Метокси-17-метил-8-винилэстра-1,3,5(10)-триен-17-диол. К охлажденному до -78 С раствору 1 мл метиллития (1,6-молярного в диэтиловом эфире) в атмосфере аргона по каплям добавляли раствор 50 мг 3-метокси-8-винилэстра-1,3,5(10)-триен-17-она в 2 мл безводного ТГФ, после чего добавляли 0,5 мл безводного диметилформамида и при нагревании до комнатной температуры перемешивали в течение 1,5 ч. Смесь смешивали с насыщенным раствором гидрокарбоната натрия, несколько раз экстрагировали этилацетатом, объединенные органические фазы промывали водой и сушили над сульфатом магния. В результате упаривания органических фаз получили 42 мг (80%) сырого 3-метокси-17-метил-8-винилэстра-1,3,5(10)-триен-17-ола, который без дополнительной очистки использовали на стадии отщепления 3-метилового эфира. 17-Метил-8-винилэстра-1,3,5(10)-триен-3,17-диол. 40 мг 3-метокси-17-метил-8-винилэстра-1,3,5(10)-триен-17-ола подвергали химическому превращению в соответствии с общей методикой по отщеплению 3-метилового эфира. После очистки на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 7:3) получили 17-метил-8 винилэстра-1,3,5(10)-триен-3,17-диол с выходом 30 мг (78%) и с температурой плавления 129-130 С. Пример 11. 3-Метокси-8-винилэстра-1,3,5(10)-триен-17-(4'-нитро)бензоат. К смеси из 100 мг 3-метокси-8-винилэстра-1,3,5(10)-триен-17-ола, 277 мг трифенилфосфина, 175 мг 4-нитробензойной кислоты и 5 мл толуола по каплям добавляли 0,48 мл 40%-ного раствора диэтилазодикарбоксилата в толуоле и в течение 3 ч перемешивали при 60 С. После охлаждения несколько раз экстрагировали этилацетатом, объединенные органические фазы последовательно промывали насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали в вакууме. В результате хроматографии на силикагеле (смесь растворителей: н-гексан/этилацетат в соотношении 25:1) получили 84 мг (57%) желтоватого маслянистого 3-метокси-8 винилэстра-1,3,5(10)-триен-17-(4'-нитро)бензоата. 3-Метокси-8-винилэстра-1,3,5(10)-триен-17-ол. Раствор 80 мг 3-метокси-8-винилэстра-1,3,5(10)-триен-17-(4'-нитро)бензоата в 12 мл метанола и 0,4 мл воды смешивали с 480 мг карбоната калия и в течение 24 ч перемешивали при комнатной температуре. После этого практически досуха концентрировали в вакууме, остаток растворяли в воде и несколько раз экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали на роторном испарителе. Таким путем получили 40 мг (54%) 3-метокси-8-винилэстра-1,3,5(10)-триен-17-ола. 8-Винилэстра-1,3,5(10)-триен-3,17-ол. 40 мг (0,13 ммоля) 3-метокси-8-винилэстра-1,3,5(10)-триен-17-ола подвергали химическому превращению в соответствии с общей методикой по отщеплению 3-метилового эфира. После очистки продукта на силикагеле (смесь растворителей: циклогексан/этилацетат 7:3) получили 8-винилэстра 1,3,5(10)-триен-3,17-диол с выходом 9 мг (24%) и температурой плавления 149-151 С. Пример 12. 16-Диметил-3-метокси-8-винилэстра-1,3,5(10)-триен-17-он. Охлажденный до -40 С раствор 150 мг 3-метокси-8-винилэстра-1,3,5(10)-триен-17-ола в 6 мл безводного ТГФ смешивали в атмосфере аргона с 1,2 мл раствора диизопропиламида лития (2-молярного в ТГФ/н-гептане/этилбензоле) и в течение 1 ч перемешивали при этой температуре. После этого при той же температуре добавляли 0,24 мл метилйодида и при нагревании до комнатной температуры перемешивали еще в течение 1 ч. Затем охлаждали до -5 С, добавляли 4 мл 2 н. едкого натра и смесь несколько раз экстрагировали этилацетатом. Объединенные органические фазы промывали водой, сушили над MgSO4 и концентрировали в вакууме. Полученный таким путем сырой продукт повторно использовали в тех же реакционных условиях. В результате получили 130 мг (80%) желто-коричневого маслянистого 16 диметил-3-метокси-8-винилэстра-1,3,5(10)-триен-17-она в виде сырого продукта. 16-Диметил-8-винилэстра-1,3,5(10)-триен-3,17-ол. 130 мг сырого 16-диметил-3-метокси-8-винилэстра-1,3,5(10)-триен-17-она подвергали химическому превращению в соответствии с общей методикой по отщеплению 3-метилового эфира. Полученный сырой продукт очищали хроматографией на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 85:15). Таким путем получили 50 мг (40%) бесцветного кристаллического 16-диметил-8 винилэстра-1,3,5(10)-триен-3,17-ола с температурой плавления 113-123 С (разлож.). Пример 13. 3-Метокси-8-(проп-1-(Е)-енил)-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триен. Охлажденную до -78 С смесь 4 мл пентана, 20 мл 1,2-диметоксиэтана и 2 мл диэтилэтилфосфоната смешивали в атмосфере аргона с 8 мл 1,7-молярного раствора трет-бутиллития (в пентане) и в течение 15 мин перемешивали при этой температуре. После этого по каплям добавляли раствор 500 мг 8-формил 3-метокси-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триена в 8 мл 1,2-диметоксиэтана и 1,5 мл пентана и перемешивали сначала в течение 30 мин, продолжая охлаждение, а затем в течение 1,5 ч при нагревании до комнатной температуры. После этого пентан отгоняли, а оставшийся реакционный раствор в течение 3 ч кипятили с обратным холодильником. Смесь сливали на ледяную крошку и образовавшийся в виде мелких частиц белый осадок отфильтровывали и сушили. После хроматографической очистки на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 20:1) получили 275 мг (54%) 3-метокси-8-(проп-1-(Е)-енил)-17-(тетрагидропиран-2-илокси)-эстра-1,3,5(10)-триена в виде бесцветной пены. 8-Проп-1-(Е)-енилэстра-1,3,5(10)-триен-3,17-диол. 275 мг 3-метокси-8-(проп-1-(Е)-енил)-17-(тетрагидропиран-2-илокси)эстра-1,3,5(10)-триена подвергали химическому превращению в соответствии с общими методиками по отщеплению ТГП- и 3 метилового эфира. После очистки продукта на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 8:2) получили сырой 8-проп-1-(Е)-енилэстра-1,3,5(10)-триен-3,17-диол с температурой плавления 110-125 С и с выходом 108 мг (52%). Пример 14. 3-Метокси-17-трифторметил-17-триметилсилилокси-8-винилэстра-1,3,5(10)-триен. Охлажденный до 0 С раствор 80 мг 3-метокси-8-винилэстра-1,3,5(10)-триен-17-она в 2 мл ТГФ смешивали в атмосфере аргона с 0,2 мл трифторметилтриметилсилана, а также с 5 мг тригидрата тетрабутиламмонийфторида и в течение 24 ч перемешивали при комнатной температуре. Темный реакционный раствор сливали на ледяную воду, несколько раз экстрагировали этилацетатом, промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали в вакууме. Полученный сырой продукт очищали экспресс-хроматографией на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 9:1). Таким путем получили 63 мг (54%) 3-метокси-17-трифторметил 17-триметилсилилокси-8-винилэстра-1,3,5(10)-триена в виде темного масла. 17-Трифторметил-8-винилэстра-1,3,5(10)-триен-3,17-диол. К раствору 60 мг 3-метокси-17-трифторметил-17-триметилсилилокси-8-винилэстра-1,3,5(10)триена в 6 мл ТГФ добавляли 1,26 г тригидрата тетрабутиламмонийфторида и в течение 2 ч перемешивали при комнатной температуре. Затем добавляли насыщенный раствор хлорида натрия, несколькораз экстрагировали этилацетатом, объединенные органические фазы сушили над сульфатом магния и концентрировали в вакууме. Маслянистый желтый остаток (50 мг) без дополнительной очистки использовали на следующей стадии. Охлажденный до -78 С раствор 50 мг сырого 3-метокси-17-трифторметил-8-винилэстра 1,3,5(10)-триен-17-ола в 3 мл дихлорметана последовательно смешивали в атмосфере аргона с 243 мг тетрабутиламмониййодида и 0,7 мл 1-молярного раствора трихлорида бора в дихлорметане и при нагревании до 0 С перемешивали в течение 2 ч. Затем реакционную смесь по каплям добавляли к охлажденному до 5 С насыщенному раствору хлорида аммония и несколько раз экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над- 19006299 сульфатом магния и концентрировали в вакууме. Сырой продукт (90 мг) очищали хроматографией на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 7:3). Таким путем получили 25 мг (52%) порошкового 17-трифторметил-8-винилэстра-1,3,5(10)-триен-3,17-диола с температурой плавления 76-79 С. Пример 15. 2-Фтор-3,17-бис(тетрагидропиран-2-илокси)-8-винилэстра-1,3,5(10)-триен. К охлажденному до -78 С раствору 120 мг 3,17-бис(тетрагидропиран-2-илокси)-8-винилэстра 1,3,5(10)-триена в 4 мл ТГФ в атмосфере аргона по каплям добавляли 3 мл 1,3-молярного раствора вторбутиллития, перемешивали в течение 30 мин и затем, продолжая охлаждать, по каплям добавляли раствор 650 мг N-фтордибензолсульфонимида в 4 мл ТГФ. Реакционную смесь перемешивали сначала в течение 1 ч при -78 С, а затем еще в течение 16 ч при нагревании до комнатной температуры. Реакционный раствор сливали на смесь воды со льдом, несколько раз экстрагировали этилацетатом, объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали в вакууме. Темный маслянистый сырой продукт (330 мг) без дополнительной очистки использовали на следующей стадии. 2-Фтор-8-винилэстра-1,3,5(10)-триен-3,17-диол. Маслянистый сырой продукт, полученный на предыдущей стадии, растворяли в 10 мл метанола,смешивали с 1 мл воды и 250 мг дигидрата щавелевой кислоты и в течение 1 ч нагревали до 60 С. Для последующей переработки разбавляли этилацетатом, последовательно промывали насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали в вакууме. Полученный сырой продукт очищали хроматографией на силикагеле (смесь растворителей: циклогексан/этилацетат в соотношении 8:2). Полученный таким путем 2-фтор-8 винилэстра-1,3,5(10)-триен-3,17-диол (15 мг, 18%) имел температуру плавления 67-73 С. Пример 16. 3,17-бис(тетрагидропиран-2-илокси)-8-винилэстра-1,3,5(10)-триен-2-ол. К охлажденному до -78 С раствору 120 мг 3,17-бис(тетрагидропиран-2-илокси)-8-винилэстра 1,3,5(10)-триена в 4 мл ТГФ в атмосфере аргона по каплям добавляли 3 мл 1,3-молярного раствора вторбутиллития, перемешивали в течение 30 мин и затем сразу же добавляли 0,5 мл триметилбората. При нагревании до 0 С перемешивали в течение 2 ч, после чего добавляли 2 мл 3 н. едкого натра и 1 мл 30%ного пероксида водорода и в завершение перемешивали еще в течение 4 ч при комнатной температуре. Далее смесь разбавляли водой, добавляли насыщенный раствор гидросульфита натрия, несколько раз экстрагировали метил-трет-бутиловым эфиром, объединенные органические фазы промывали насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали в вакууме. В результате хроматографии полученного после упаривания остатка на силикагеле (смесь растворителей: нгексан/этилацетат в соотношении 9:1) получили 65 мг (52%) бесцветного маслянистого 3,17 бис(тетрагидропиран-2-илокси)-8-винилэстра-1,3,5(10)-триен-2-ола. 83-Винилэстра-1,3,5(10)-триен-2,3,17-триол. Маслянистый продукт, полученный на предыдущей стадии, растворяли в 3 мл метанола, смешивали с 0,3 мл воды и 50 мг дигидрата щавелевой кислоты и в течение 1 ч нагревали до 60 С. Для последующей переработки разбавляли этилацетатом, последовательно промывали насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушили над сульфатом магния и концентрировали в вакууме. Полученный таким путем желтоватый порошковый 8-винилэстра-1,3,5(10)-триен 2,3,17-триол (38 мг, 95%) имел температуру плавления 82-85 С (разлож.). Общая методика отщепления эфиров от 3-метокси-17-(тетрагидропиран-2-илокси)эстратриенов и -тетраенов с помощью кислоты с получением соответствующих 17-спиртов. 1,0 ммоль стероида растворяют в 22 мл ацетона и при комнатной температуре перемешивают в течение 3 ч с 1,5 мл 4 н. соляной кислоты. Если по истечении этого промежутка времени не происходит полное превращение, то раствор дополнительно нагревают до 50 С и выдерживают при этой температуре в течение 1,5 ч. После этого разбавляют 20 мл воды, несколько раз экстрагируют дихлорметаном, объединенные органические фазы сушат над сульфатом магния и растворитель отгоняют на роторном испарителе. Получаемые таким путем сырые 17-гидроксильные соединения образуются в виде пены и их непосредственно подвергают последующей переработке. Общая методика отщепления эфиров от 3-метокси-17-(тетрагидропиран-2-илокси)эстратриенов и-тетраенов с помощью кислоты и ДИБАГ с получением соответствующих 3,17-диолов. 1,0 ммоль стероида растворяют в 15-20 мл безводного толуола, охлаждают до 0 С и в атмосфере аргона осторожно смешивают с 3,0 мл ДИБАГ. Реакционную смесь медленно нагревают до температуры перегонки и поддерживают эту температуру в течение 3,5 ч. После этого к охлажденному до 0 С раствору последовательно по каплям осторожно добавляют 10 мл этанола, 10 мл смеси этанола с водой (в объемном соотношении 1:1) и 10 мл полуконцентрированной соляной кислоты и несколько раз экстрагируют этилацетатом. Объединенные органические фазы промывают водой до нейтральной реакции, сушат над сульфатом магния и досуха концентрируют на роторном испарителе. Выход получаемых при этом продуктов составляет от 90 до 99%.- 21006299 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. 8-замещенные эстра-1,3,5(10)-триеновые производные общей формулы I в которой R2 обозначает атом водорода, атом галогена, остаток R18 - либо R18 -О-, где R18 представляет собой атом водорода либо насыщенный или ненасыщенный углеводородный остаток с прямой или разветвленной цепью, содержащий до 6 атомов углерода, трифторметильную группу, группу R19 SO2-O-, гдеR19 представляет собой группу R20 R 21 N, в которой R20 и R21 независимо друг от друга обозначают атом водорода или С 1-С 5 алкил, группу C(O)R22, в которой R22 представляет собой необязательно замещенный,насыщенный или до трехкратно ненасыщенный, необязательно частично или полностью галогенированный углеводородный остаток с прямой или разветвленной цепью, содержащий до 10 атомов углерода,необязательно замещенный С 3-С 7 циклоалкил, необязательно замещенный С 4-С 15 циклоалкилалкил или необязательно замещенный арильный, гетероарильный или аралкильный остаток либо совместно с Nатомом обозначает полиметилениминогруппу с 4-6 С-атомами или морфолиногруппу,R3 обозначает группу R18-О-, R19SO2-O- или -O-C(O)R22 , где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил, гетероарил или аралкил,R6 и R7 каждый обозначает атом водорода или совместно обозначают дополнительную связь,R6' и R7' независимо друг от друга обозначают атом водорода, атом галогена, группу R18-O-, R19SO2O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил,R9 обозначает атом водорода, насыщенный или ненасыщенный углеводородный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, или совместно с R11 обозначает дополнительную связь,R11 обозначает атом водорода или совместно с R9 либо совместно с R12 обозначает дополнительную связь,R11' обозначает атом водорода атом галогена, насыщенный или ненасыщенный, необязательно частично или полностью галогенированный (F, Cl) углеводородный остаток, у которого максимальная длина прямой цепи составляет 4 атома углерода, или группу -X-R18', где X представляет собой атом кислорода или серы, а R18' представляет собой алкил с 1-3 атомами углерода,R12 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,R14 обозначает атом водорода или совместно с R15 обозначает дополнительную связь,R15 обозначает атом водорода или совместно с R14 либо совместно с R16 обозначает дополнительную связь,R16 обозначает атом водорода или совместно с R15 обозначает дополнительную связь,R15' и R16' независимо друг от друга обозначают атом водорода, атом галогена, группу R18-O-,19R SO2-O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22,группу R18-O- и группу R18- либо группу R18-О- и группу -O-C(O)R22, при этом во всех случаях каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, или R17 и R17' совместно обозначают группу =CR23R24, в которой R23 и R24 независимо друг от друга представляют собой атом водорода и атом галогена либо совместно представляют собой атом кислорода,за исключением тех соединений общей формулы I', в которыхR3 обозначает гидрокси-, метокси- или ацетилоксигруппу и одновременно R2 обозначает атом водорода, R6, R6', R7 и R7' каждый обозначает атом водорода,R8 обозначает метильную группу,R9 обозначает атом водорода или R9 и R11 совместно обозначают дополнительную связь,R11' и R12 каждый обозначает атом водорода,R14, R15, R15', R16 и R16' каждый обозначает атом водорода, а также R17 и R17' попарно обозначают гидроксигруппу и атом водорода, -гидроксигруппу и метильную группу, -(2-бромацетил)оксигруппу и атом водорода, -ацетильную группу и атом водорода, -карбоксильную группу и атом водорода или R17- 22006299 и R17' совместно обозначают атом кислорода. 2. Эстратриены общей формулы I по п.1, в которойR2 обозначает атом водорода или галогена или гидроксигруппу,R3 обозначает группу R18-О-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в п.1 в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил или аралкил,R6 и R7 каждый обозначает атом водорода,R6' обозначает атом водорода, гидроксигруппу, группу R22 в указанном в определении радикала R2 значении,R7' обозначает атом водорода, атом галогена, группу R18 -О-, R19SO2-O- или -R22, где каждый из R18,19R и R22 имеет значение, указанное в п.1,R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1 инил,R9 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,R11 обозначает атом водорода или совместно с R9 обозначает дополнительную связь,R11' обозначает атом водорода, атом галогена, насыщенный или ненасыщенный, необязательно частично или полностью фторированный или хлорированный углеводородный остаток, у которого максимальная длина прямой цепи составляет 4 атома углерода, или группу -X-R18', где X представляет собой атом серы, а R18' представляет собой алкил с 1-3 атомами углерода,R12, R14, R15 и R16 каждый обозначает атом водорода,R16' обозначает атом водорода, атом галогена, группу R18-О-, R19SO2-O- или -R22, где каждый из R18,19R и R22 имеет указанное в определении радикала R2 значение,R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22,группу R18-O- и группу R18- либо группу R18-О- и группу -O-C(O)R22, где во всех случаях каждый из R18,R19 и R22 имеет указанное в определении радикала R2 значение, или R17 и R17' совместно обозначают группу =CR23 R24 , где R23 и R 24 независимо друг от друга представляют собой атом водорода и атом галогена или совместно обозначают атом кислорода. 3. Эстратриены общей формулы I по п.1, в которойR2 обозначает атом водорода или фтора или гидроксигруппу,R3 обозначает группу R18-О-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в п.1 в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил или аралкил,R6 и R7 каждый обозначает атом водорода,R6' обозначает атом водорода или гидроксигруппу,R7' обозначает атом водорода, фтора или хлора, группу R18-О-, R19SO2-O- или -R22, где каждый из 18R , R19 и R22 имеет указанное в определении радикала R2 значение,R8 обозначает необязательно частично или полностью фторированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил,R9 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,R11' обозначает атом водорода, фтора или хлора, насыщенный С 1-С 4 алкил с прямой или разветвленной цепью, группу -X-R18', где X представляет собой атом серы, а R18' представляет собой насыщенныйC1-С 3 алкил с прямой или разветвленной цепью, хлорметил или хлорэтил,R12, R14, R15 и R16 каждый обозначает атом водорода,R16' обозначает атом водорода, фтора или хлора или группу R18-О либо -R22, где каждый из R18 и R22 имеет указанное в определении радикала R2 значение,R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22,группу R18-O- и группу R18- либо группу R18-О- и группу -O-C(O)R11, где во всех случаях каждый из R18,R19 и R22 имеет указанное в определении радикала R2 значение, или R17 и R17' совместно обозначают группу =CR23R24 , где R23 и R24 независимо друг от друга представляют собой атом водорода и атом галогена или совместно обозначают атом кислорода. 4. Эстратриены общей формулы I по п.1, в которой каждый из R6', R7', R9, R11 , R14, R15, R15' и R16 обозначает атом водорода или каждый из R6', R7', R14, R15 , R15' и R16 обозначает атом водорода, a R9 и R11 совместно обозначают дополнительную связь и все остальные заместители имеют указанные в п.1 значения. 5. Эстратриены общей формулы I по п.1, которые в положении 9(11), 14(15) или 15(16) имеют двойную связь или в положениях 9(11) и 14(15), соответственно 15(16), имеют две двойных связи. 6. Эстратриены общей формулы I по п.1, в которой R17 и R17' попарно обозначают группу R18 -О- и группу R18- либо группу R18- и группу -O-C(O)R22, где каждый из R18 и R22 имеет указанное в определении радикала R2 значение.- 23006299 7. Эстратриены общей формулы I по п.6, в которой R17 и R17' попарно обозначают гидроксигруппу и атом водорода, С 1-С 4 алкил либо С 2-4 алкинил. 8. Эстратриены общей формулы I по п.7, в которой R17 и R17' попарно обозначают гидроксигруппу и атом водорода, метил, этинил либо проп-1-инил. 9. Эстратриены общей формулы I по п.1, в которой R16' обозначает группу R18-О- или R19SO2-O-, где каждый из R18 и R19 имеет указанное в п.1 в определении радикала R2 значение, каждый из R17 и R17' обозначает атом водорода, а все остальные заместители могут иметь указанные для общей формулы I значения. 10. Эстратриены общей формулы I по п.1 из группы, включающей 8-винилэстра-1,3,5(10),9(11)-тетраен-3,17-диол,3-метокси-8-винилэстра-1,3,5(10),9(11)-тетраен-17-ол,8-(2',2'-дифторвинил)эстра-1,3,5(10),9(11)-тетраен-3,17-диол,8-(2',2'-дифторвинил)-3-метоксиэстра-1,3,5(10),9(11)-тетраен-17-ол,8 винилэстра-1,3,5(10)-триен-3,17-диол,3-метокси-8-винилэстра-1,3,5(10)-триен-17-ол,8-(2',2'-дифторвинил)эстра-1,3,5(10)-триен-3,17-диол,8-(2',2'-дифторвинил)-3-метоксиэстра-1,3,5(10)-триен-17-ол,8-этилэстра-1,3,5(10)-триен-3,17-диол,8-этил-3-метоксиэстра-1,3,5(10)-триен-17-ол,8-винилэстрадиол-3-сульфамат,8-винилэстрадиол-3,17-дисульфамат,8-винилэстрадиол-3-(N-ацетил)сульфамат,8-винилэстрон-3-сульфамат,8-винилэстрон-3-ацетат,8-винилэстриол,8-винилэстриол-3-сульфамат,8-метилэстрон-3-сульфамат,8-метилэстриол,8-(проп-(Z)-енил)эстрадиол,8-(н-пропил)эстрадиол,8-этинилэстрадиол,17-этинил-8-винилэстра-1,3,5(10)-триен-3,17-диол,17-метил-8-винилэстра-1,3,5(10)-триен-3,17-диол,16-фтор-8-метилэстра-1,3,5(10)-триен-3,17-диол,8-винилэстра-1,3,5(10)-триен-3,17-диол,8-метилэстра-1,3,5(10)-триен-3,17-диол,8-винилэстрадиолдиацетат,8-метилэстрадиолдиацетат,8-винилэстрадиол-17-валерианат,17-ацетокси-8-винилэстра-1,3,5(10)-триен-3-ол. 11. Применение 8-замещенных эстра-1,3,5(10)-триеновых производных общей формулы I' в которой R2 обозначает атом водорода, атом галогена, остаток R18- либо R18-О-, где R18 представляет собой атом водорода либо насыщенный или ненасыщенный углеводородный остаток с прямой или разветвленной цепью, содержащий до 6 атомов углерода, трифторметильную группу, группу R19SO2-O-, гдеR19 представляет собой группу R20 R21 N, в которой R20 и R21 независимо друг от друга обозначают атом водорода или С 1-С 5 алкил, группу C(O)R22, в которой R22 представляет собой необязательно замещенный,насыщенный или до трехкратно ненасыщенный, необязательно частично или полностью галогенированный углеводородный остаток с прямой или разветвленной цепью, содержащий до 10 атомов углерода,необязательно замещенный С 3-С 7 циклоалкил, необязательно замещенный С 4-С 15 циклоалкилалкил или необязательно замещенный арильный, гетероарильный или аралкильный остаток либо совместно с Nатомом обозначает полиметилениминогруппу с 4-6 С-атомами или морфолиногруппу,R3 обозначает группу R18-O-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил,- 24006299 гетероарил или аралкил,R6 и R7 каждый обозначает атом водорода или совместно обозначают дополнительную связь,R6' и R7' независимо друг от друга обозначают атом водорода, атом галогена, группу R18-O-, R19SO2O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1 инил,R9 обозначает атом водорода, насыщенный или ненасыщенный углеводородный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, или совместно с R11 обозначает дополнительную связь,R11 обозначает атом водорода или совместно с R9 либо совместно с R12 обозначает дополнительную связь,R11' обозначает атом водорода, атом галогена, насыщенный или ненасыщенный, необязательно частично или полностью галогенированный (F, Cl) углеводородный остаток, у которого максимальная длина прямой цепи составляет 4 атома углерода, или группу -X-R18', где X представляет собой атом кислорода или серы, а R18' представляет собой алкил с 1-3 атомами углерода,R12 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,R14 обозначает атом водорода или совместно с R15 обозначает дополнительную связь,R15 обозначает атом водорода или совместно с R14 либо совместно с R16 обозначает дополнительную связь, R16 обозначает атом водорода или совместно с R15 обозначает дополнительную связь,R15' и R16' независимо друг от друга обозначают атом водорода, атом галогена, группу R18-О-,19R SO2-O- или -R22, где каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение,R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22,группу R18-O- и группу R18- либо группу R18-О- и группу -O-C(O)R22, при этом во всех случаях каждый из R18, R19 и R22 имеет указанное в определении радикала R2 значение, или R17 и R17' совместно обозначают группу =CR23R24, в которой R23 и R24 независимо друг от друга представляют собой атом водорода и атом галогена либо совместно представляют собой атом кислорода,для лечения обусловленных эстрогенной недостаточностью заболеваний и состояний у женщин и у мужчин. 12. Применение эстратриенов общей формулы I' по п.11, в которойR2 обозначает атом водорода или галогена или гидроксигруппу,R3 обозначает группу R18-O-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в п.1 в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил или аралкил,R6 и R7 каждый обозначает атом водорода,R6' обозначает атом водорода, гидроксигруппу, группу R22 в указанном в определении радикала R2 значении,R7' обозначает атом водорода, атом галогена, группу R18-О-, R19SO2-O- или -R22, где каждый из R18,19R и R22 имеет указанное в определении радикала R2 значение,R8 обозначает необязательно частично или полностью галогенированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил,R9 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,R11 обозначает атом водорода или совместно с R9 обозначает дополнительную связь,R11' обозначает атом водорода, атом галогена, насыщенный или ненасыщенный, необязательно частично или полностью галогенированный (F, Cl) углеводородный остаток, у которого максимальная длина прямой цепи составляет 4 атома углерода, или группу -X-R18', где X представляет собой атом серы, а R18' представляет собой алкил с 1-3 атомами углерода,R12, R14, R15 и R16 каждый обозначает атом водорода,R16' обозначает атом водорода, атом галогена, группу R18-О-, R19SO2-O- или -R22, где каждый из R18,19R и R22 имеет указанное в определении радикала R2 значение,R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22,группу R18-O- и группу R18- либо группу R18-О- и группу -O-C(O)R22, где во всех случаях каждый из R18,R19 и R22 имеет указанное в определении радикала R2 значение, илиR17 и R17' совместно обозначают группу =CR23R24 , где R23 и R24 независимо друг от друга представляют собой атом водорода и атом галогена или совместно обозначают атом кислорода. 13. Применение эстратриенов общей формулы I' по п.11, в которойR2 обозначает атом водорода или фтора или гидроксигруппу,R3 обозначает группу R18-O-, R19SO2-O- или -O-C(O)R22, где каждый из R18, R19 и R22 имеет указанное в п.1 в определении радикала R2 значение, причем R18 дополнительно может представлять собой арил или аралкил,- 25006299R6 и R7 каждый обозначает атом водорода,R6' обозначает атом водорода или гидроксигруппу,R7' обозначает атом водорода, фтора или хлора, группу R18-О-, R19SO2-O- или -R22, где каждый из 18R , R19 и R22 имеет указанное в определении радикала R2 значение,R8 обозначает необязательно частично или полностью фторированный алкильный или алкенильный остаток с прямой или разветвленной цепью, содержащий до 5 атомов углерода, этинил или проп-1-инил,R9 обозначает атом водорода или совместно с R11 обозначает дополнительную связь,R11' обозначает атом водорода, фтора или хлора, насыщенный С 1-С 4 алкил с прямой или разветвленной цепью, группу -X-R18', где X представляет собой атом серы, аR18' представляет собой насыщенный C1-С 3 алкил с прямой или разветвленной цепью, хлорметил или хлорэтил,R12, R14, R15 и R16 каждый обозначает атом водорода,R16' обозначает атом водорода, фтора или хлора или группу R18-О либо -R22, где каждый из R18 и R22 имеет указанное в определении радикала R2 значение,R17 и R17' попарно обозначают атом водорода каждый, атом водорода и атом галогена, атом водорода и бензилоксигруппу, атом водорода и группу R19SO2-O-, группу R18 и группу -C(O)R22 или -O-C(O)R22,группу R18-O- и группу R18- либо группу R18-О- и группу -O-C(O)R22, где во всех случаях каждый из R18,R19 и R22 имеет указанное в определении радикала R2 значение, илиR17 и R17' совместно обозначают группу =CR23R24 , где R23 и R24 независимо друг от друга представляют собой атом водорода и атом галогена или совместно обозначают атом кислорода. 14. Применение эстратриенов общей формулы I' по п.11, в которой каждый из R6', R7', R9, R11, R14,15R , R15' и R16 обозначает атом водорода или каждый из R6', R7', R14, R15, R15' и R16 обозначает атом водорода, a R9 и R11 совместно обозначают дополнительную связь и все остальные заместители имеют указанные в п.1 значения. 15. Применение эстратриенов общей формулы I' по п.11, которые в положении 9(11), 14(15) или 15(16) имеют двойную связь или в положениях 9(11) и 14(15), соответственно 15(16), имеют две двойных связи. 16. Применение эстратриенов общей формулы I' по п.11, в которой R17 и R17' попарно обозначают группу R18-О- и группу R18- либо группу R18- и группу -O-C(O)R22, где каждый из R18 и R22 имеет указанное в определении радикала R2 значение. 17. Применение эстратриенов общей формулы I' по п.16, в которой R17 и R17' попарно обозначают гидроксигруппу и атом водорода, С 1-С 4 алкил либо С 2-С 4 алкинил. 18. Применение эстратриенов общей формулы I' по п.17, в которой R17 и R17' попарно обозначают гидроксигруппу и атом водорода, метил, этинил либо проп-1-инил. 19. Применение эстратриенов общей формулы I' по п.11, в которой R16' обозначает группу R18-Оили R19SO2-O-, где каждый из R18 и R19 имеет указанное в п.1 в определении радикала R2 значение, каждый из R17 и R17' обозначает атом водорода, а все остальные заместители могут иметь указанные для общей формулы I значения. 20. Применение эстратриенов общей формулы I' по п.11, выбранных из группы соединений, включающей 8-метилэстра-1,3,5(10),9(11)-тетраен-3,17-диол,3-метокси-8-метилэстра-1,3,5(10),9(11)-тетраен-17-ол,8-метилэстра-1,3,5(10)-триен-3,17-диол,3-метокси-8-метилэстра-1,3,5(10)-триен-17-ол,8-винилэстра-1,3,5(10),9(11)-тетраен-3,17-диол,3-метокси-8-винилэстра-1,3,5(10),9(11)-тетраен-17-ол,8-(2',2'-дифторвинил)эстра-1,3,5(10),9(11)-тетраен-3,17-диол,8-(2',2'-дифторвинил)-3-метоксиэстра-1,3,5(10),9(11)-тетраен-17-ол,8-винилэстра-1,3,5(10)-триен-3,17-диол,3-метокси-8-винилэстра-1,3,5(10)-триен-17-ол,8-(2',2'-дифторвинил)эстра-1,3,5(10)-триен-3,17-диол,8-(2',2'-дифторвинил)-3 -метоксиэстра-1,3,5(10)-триен-17-ол,8-этилэстра-1,3,5(10)-триен-3,17-диол,8-этил-3-метоксиэстра-1,3,5(10)-триен-17-ол,8-винилэстрадиол-3-сульфамат,8-винилэстрадиол-3,17-дисульфамат,8-винилэстрадиол-3-(N-ацетил)сульфамат,8-винилэстрон-3-сульфамат,8-винилэстрон-3 -ацетат,8-винилэстриол,- 26006299 8-винилэстриол-3-сульфамат,8-метилэстрон-3-сульфамат,8-метилэстриол,8-(проп-(Z)-енил)эстрадиол,8-(н-пропил)эстрадиол,8-этинилэстрадиол,17-этинил-8-винилэстра-1,3,5(10)-триен-3,17-диол,17-метил-8-винилэстра-1,3,5(10)-триен-3,17-диол,16-фтор-8-метилэстра-1,3,5(10)-триен-3,17-диол,8-винилэстра-1,3,5(10)-триен-3,17-диол,8-метилэстра-1,3,5(10)-триен-3,17-диол,8-винилэстрадиолдиацетат,8-метилэстрадиолдиацетат,8-винилэстрадиол-17-валерианат,17-ацетокси-8-винилэстра-1,3,5(10)-триен-3-ол. 21. Применение по п.11 для лечения расстройств и заболеваний, проявляющихся в пери- и постменопаузальный период. 22. Применение по п.11 для лечения расстройств и заболеваний, проявляющихся в пери- и постандропаузальный период. 23. Применение по п.21 для профилактики и устранения приливов, а также для профилактики и лечения нарушений сна (бессонницы), раздражимости, перепадов настроения (эмоциональной лабильности), недержания, атрофии влагалища и обусловленных гормональной недостаточностью психических расстройств. 24. Применение по п.23 для профилактики и лечения заболеваний мочеполового тракта. 25. Применение по п.11 для профилактики и терапии заболеваний желудка и кишечника. 26. Применение по п.25 для профилактики и терапии язвы и геморрагического диатеза в желудочно-кишечном тракте. 27. Применение по п.26 для профилактики и терапии неоплазий. 28. Применение по п.11 лечения in vitro мужского бесплодия. 29. Применение по п.11 для лечения in vivo мужского бесплодия. 30. Применение по п.11 для лечения in vitro женского бесплодия. 31. Применение по п.11 для лечения in vivo женского бесплодия. 32. Применение по п.11 для гормонзаместительной терапии (ГЗТ). 33. Применение по п.11 для терапии связанных с гормональной недостаточностью расстройств при дисфункции яичников, обусловленной хирургическим вмешательством, приемом лекарственных препаратов или иными причинами. 34. Применение по п.11 для профилактики и терапии обусловленного гормональной недостаточностью уменьшения костной массы. 35. Применение по п.34 для профилактики и терапии остеопороза. 36. Применение по п.11 для предупреждения и терапии сердечно-сосудистых заболеваний. 37. Применение по п.11 для предупреждения и лечения заболеваний сосудов. 38. Применение по п.37 для предупреждения и лечения атеросклероза. 39. Применение по п.37 для предупреждения и лечения неоинтимальных гиперплазий. 40. Применение по п.11 для предупреждения и лечения обусловленных гормональной недостаточностью нейродегенеративных заболеваний. 41. Применение по п.11 для предупреждения и лечения болезни Альцгеймера, а также обусловленного гормональной недостаточностью ухудшения функции памяти и обучаемости, соответственно познавательной способности. 42. Применение по п.11 для лечения воспалительных заболеваний и заболеваний иммунной системы. 43. Применение по п.11 для предупреждения и лечения доброкачественной гиперплазии предстательной железы (ДГПЖ). 44. Фармацевтические композиции, содержащие по меньшей мере одно соединение по любому из пп.1-10, а также фармацевтически приемлемый носитель.
МПК / Метки
МПК: C07J 1/00, A61K 31/565, A61P 5/30
Метки: эстратриены, 8β-гидрокарбилзамещенные, эстрогенов, действия, качестве, избирательного
Код ссылки
<a href="https://eas.patents.su/29-6299-8beta-gidrokarbilzameshhennye-estratrieny-v-kachestve-estrogenov-izbiratelnogo-dejjstviya.html" rel="bookmark" title="База патентов Евразийского Союза">8β-гидрокарбилзамещенные эстратриены в качестве эстрогенов избирательного действия</a>
Предыдущий патент: Способ получения сульфонатных присадок к смазочным маслам
Следующий патент: Производные фталазинона
Случайный патент: Фунгицидные композиции