Клеточная везикула, называемая “экзосома”, ее получение и применение для стимуляции иммунного ответа
Номер патента: 2827
Опубликовано: 31.10.2002
Авторы: Рапосо Граса, Реньо Армелль, Амигорена Себасьян, Зитвожель Лоранс
Формула / Реферат
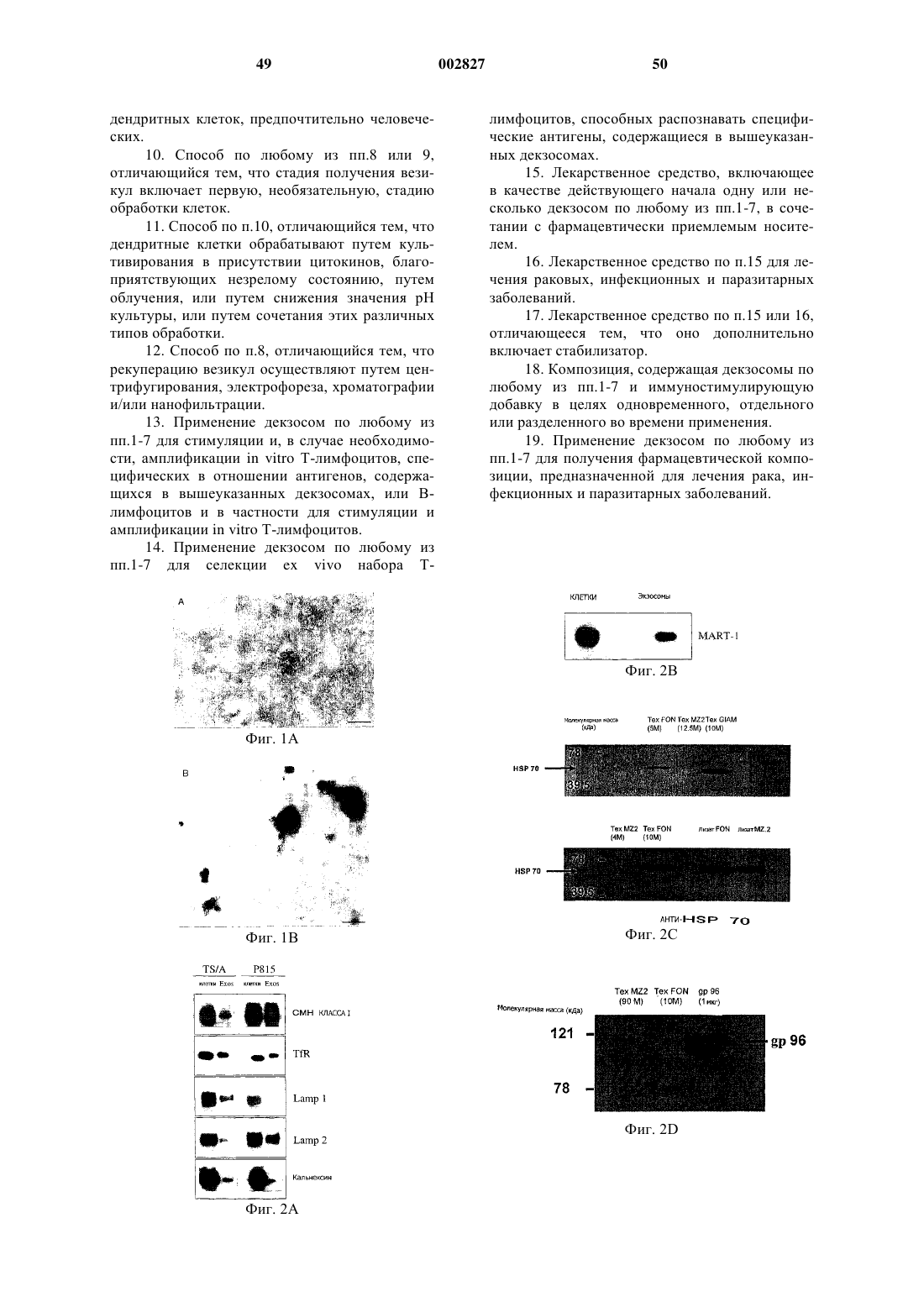
1. Мембранная везикула, называемая декзосомой, выделенная из своего естественного окружения, отличающаяся тем, что она (i) происходит от дендритной клетки, (ii) включает билипидный слой, окружающий цитозольную часть, (iii) имеет на своей поверхности молекулы класса I и/или II главного комплекса гистосовместимости (СМН), (iv) содержит одну или несколько молекул CD63 и (v) имеет диаметр примерно от 60 до 90 нм.
2. Везикула по п.1, отличающаяся тем, что она происходит от дендритной клетки, сенсибилизированной антигеном.
3. Везикула по п.1 или 2, отличающаяся тем, что она включает, кроме того, одну или несколько молекул CD82 или CD86.
4. Везикула по любому из пп.1-3, отличающаяся тем, что она происходит от незрелой дендритной клетки.
5. Везикула по любому из пп.1-4, отличающаяся тем, что она происходит от дендритной клетки, несущей один или несколько антигенных пептидов.
6. Везикула по п.5, отличающаяся тем, что она происходит от дендритной клетки, инкубированной с везикулой, называемой текзосомой, причем указанная текзосома происходит от опухолевой клетки, включает билипидный слой, окружающий цитозольную часть, которая содержит молекулы опухолевых антигенов, и/или иммуномодуляторы, и/или хемоаттрактанты и/или гормоны, и/или нуклеиновые кислоты, имеет на своей поверхности молекулы класса I и/или II главного комплекса гистосовместимости (СМН), содержит протеин "Heat Shock" HSP70 и имеет диаметр примерно от 60 до 100 нм.
7. Везикула по любому из пп.1-4, отличающаяся тем, что она происходит от иммортализованной дендритной клетки.
8. Способ получения везикулы по любому из пп.1-7, включающий
(i) первую стадию получения дендритных клеток или клеточной культуры, содержащей дендритные клетки, из предшественников моноцитов или костного мозга,
(ii) вторую стадию сенсибилизации клеток путем введения их в контакт с пептидами, антигенами, клетками, или мембранами, или везикулами, экспрессирующими антигены или антигенные пептиды, липосомами или нуклеиновыми кислотами, которые могут быть встроены в химические или вирусные векторы, в условиях, позволяющих осуществить сенсибилизацию дендритных клеток,
(iii) и третью стадию, включающую рекуперацию продуцированных дендритными клетками везикул из этих клеточных культур.
9. Способ по п.8, отличающийся тем, что первая стация включает получение незрелых дендритных клеток, предпочтительно человеческих.
10. Способ по любому из пп.8 или 9, отличающийся тем, что стадия получения везикул включает первую, необязательную, стадию обработки клеток.
11. Способ по п.10, отличающийся тем, что дендритные клетки обрабатывают путем культивирования в присутствии цитокинов, благоприятствующих незрелому состоянию, путем облучения, или путем снижения значения рН культуры, или путем сочетания этих различных типов обработки.
12. Способ по п.8, отличающийся тем, что рекуперацию везикул осуществляют путем центрифугирования, электрофореза, хроматографии и/или нанофильтрации.
13. Применение декзосом по любому из пп.1-7 для стимуляции и, в случае необходимости, амплификации in vitro Т-лимфоцитов, специфических в отношении антигенов, содержащихся в вышеуказанных декзосомах, или В-лимфоцитов и в частности для стимуляции и амплификации in vitro Т-лимфоцитов.
14. Применение декзосом по любому из пп.1-7 для селекции ex vivo набора Т-лимфоцитов, способных распознавать специфические антигены, содержащиеся в вышеуказанных декзосомах.
15. Лекарственное средство, включающее в качестве действующего начала одну или несколько декзосом по любому из пп.1-7, в сочетании с фармацевтически приемлемым носителем.
16. Лекарственное средство по п.15 для лечения раковых, инфекционных и паразитарных заболеваний.
17. Лекарственное средство по п.15 или 16, отличающееся тем, что оно дополнительно включает стабилизатор.
18. Композиция, содержащая декзосомы по любому из пп.1-7 и иммуностимулирующую добавку в целях одновременного, отдельного или разделенного во времени применения.
19. Применение декзосом по любому из пп.1-7 для получения фармацевтической композиции, предназначенной для лечения рака, инфекционных и паразитарных заболеваний.
Текст
1 Предметом изобретения является новый способ сенсибилизации антигенпредставляющих клеток, новые средства для осуществления способа и новые мембранные везикулы, обладающие иммуногенными свойствами. С момента доказательства существования цитотоксических Т-лимфоцитов CD8+, специфических к опухолевым антигенам, имеющихся в рамках молекул класса I (Rosenberg и др.,1996; Boon, 1992), несколько лабораторий смогли показать, что противоопухолевая иммунотерапия представляет собой эффективную стратегию лечения в случае используемых в качестве моделей животных (Pardoll, 1995). Принципом иммунотерапии является стимуляция эффективного иммунного ответа против специфических опухолевых антигенов. В настоящее время это может быть осуществлено различными способами. Прежде всего, опухолевые клетки, экспрессирующие рекомбинантные костимулирующие молекулы, и/или иммуномодуляторные цитокины, способны стимулировать противоопухолевые ответы, которые могут уничтожать[а]). Точно так же происходящие от опухолевых антигенов (или экзогенных антигенов, экспрессия которых осуществляется в опухолевых клетках) пептиды, инъецируемые в различных химических формах, включая использование липосом или вирусов (как, например, аденовирус или поксвирус) в качестве векторов, способны вызывать регрессию опухолей. Наконец,антигенпредставляющие специализированные клетки, как дендритные клетки, сенсибилизированные с помощью пептидов, происходящих от опухолевых антигенов, реинъецированные invivo, индуцируют эффективные противоопухолевые ответы, а также регрессию твердых опухолей, как установлено в случае мыши (Mayordomo и др., 1995). Иммунотерапия, основанная на использовании дендритных клеток, оказалась эффективной при исследованиях, проводимых на мыши. В связи с этим эту терапию недавно перенесли для применения в клинике. В США в настоящее время проводятся испытания, чтобы показать,что дендритные клетки, содержащие опухолевые пептиды, значительно увеличивают частоту специфических цитотоксических Т-клеток(CTL). Первым ограничением этого подхода является сенсибилизация дендритных клеток пептидами, происходящими от опухолевых антигенов. В самом деле, в большинстве случаев опухолей специфические антигены не индентифицированы. Специфические опухолевые антигены известны только в случаях опухолей, индуцированных вирусами (рак шейки матки), в случаях меланомы (антигены сами по себе, мутированные антигены, дифференцировочные антигены) или в небольшом проценте опухолей молочной железы (онкогены, или продукты ген 002827 2 супрессоров опухоли, которые были подвергнуты мутациям). Однако остается показать прямое вовлечение этих пептидов или опухолевых антигенов в процесс удаления опухолей у человека. Следовательно, оказываются необходимыми новые методы сенсибилизации антигенпредставляющих клеток, таких как дендритные клетки. Целью этих методов является индуцирование специфических противоопухолевых ответов в отношении молекул класса I и класса(СМН). В большинстве случаев методов сенсибилизации дендритных клеток, применяемых в настоящее время, используют пептиды, соответствующие эпитопам, находящимся в ассоциации с молекулами класса I, и идентифицированные в опухолевых клетках благодаря клонам специфических клеток CTL опухоли. Однако эти методы, очевидно, не являются оптимальными, так как они не учитывают эпитопов, известных в рамках молекул класса II, которые являются определяющими для пролиферации вспомогательных Т-лимфоцитов, необходимых для получения оптимальных цитотоксических ответов. Более того, представляемые опухолевыми клетками эпитопы и представляемые антигенпредставляющими клетками (как, например, дендритные клетки) эпитопы, вероятно, не являются одними и теми же. Наконец, опухолевые пептиды, распознаваемые специфическими цитотоксическими Т-лимфоцитами, имеются только у небольшого процента пациентов, обладающих молекулами класса I соответствующего гаплотипа. Идеальный метод сенсибилизации, который может быть применен к любой опухоли с минимальным риском иммуноселекции, не должен быть ограничен небольшим количеством идентифицированных опухолевых антигенов. Также в таком методе должны использоваться скорее интактные протеиновые антигены, чем пептиды, чтобы дендритная клетка могла их продуцировать и представлять адекватную комбинацию пептидов в ассоциации с молекулами класса I и класса II, и это для любого индивидуума. Недавно Gilboa и др. (Boczkowsky и др.,1996) смогли показать, что информационные РНК, полученные из биопсий опухолей, помещенные в дендритные клетки, могут оказывать противоопухолевое действие in vivo. Однако РНК очень нестабильны и потенциально представляющее интерес количество РНК по сравнению с полной РНК, очевидно, очень незначительно. Zitvogel и др. (Zitvogel и др., 1996 [b]) показали, что опухолевые пептиды, полученные из кислотного элюата опухолей (кислотный пептидный элюат: ЕРА), могут быть использованы для введения в дендритные клетки. Эти таким образом нагруженные клетки, инъецированные один раз, обладают способностью вызы 3 вать регрессию опухолей. Однако в случае опухолей, не экспрессирующих молекулы класса I(которые представляют собой большинство метастатических опухолей у человека), или в случае опухолей, которые не могут быть диссоциированы в виде клеточной суспензии, подход,при котором используют кислотные элюаты, не очень эффективен и невоспроизводим. Второе ограничение иммунотерапии, основанной на использовании дендритных клеток,связано с фенотипическими изменениями, которые могут происходить, когда эти клетки сохраняются в виде культуры или подвергаются различным обработкам. В самом деле, это может приводить к появлению мало однородных и недостаточно охарактеризованных для терапевтического использования клеточных популяций. Следовательно, существует реальная необходимость усовершенствования методов сенсибилизации антигенпредставляющих клеток,чтобы повышать эффективность этих подходов и расширять сферу их применений, так же как разработки новых способов векторизации антигенов или других молекул. Настоящее изобретение относится к решениям этих проблем. В самом деле, предметом изобретения является разработка новых методов сенсибилизации антигенпредставляющих клеток, в частности дендритных клеток, а также идентификация, выделение и характеризация новых мембранных везикул, обладающих замечательными иммуногенными свойствами. Один из аспектов изобретения более конкретно относится к новому воспроизводимому способу сенсибилизации антигенпредставляющих клеток с помощью опухолевых антигенов. Другой аспект изобретения относится к новому воспроизводимому способу сенсибилизации антигенпредставляющих клеток с помощью опухолевых антигенов, в случае которого нет необходимости в том, чтобы опухолевые антигены были известны. Следующий аспект изобретения относится к средствам, позволяющим составлять банк опухолевых антигенов. Еще один аспект изобретения относится к липидным мембранным везикулам, продуцируемым опухолевыми клетками или дендритными клетками и обладающим иммуногенными свойствами, а также к их применению для получения банков антигенов, сенсибилизации антигенпредставляющих клеток или векторизации антигенов, в частности, в рамках иммунотерапевтических подходов. В этом отношении первый предмет изобретения относится к везикуле, происходящей от опухолевых клеток и обладающей следующими характеристиками: она освобождена от своего естественного окружения; 4 она включает двойной липидный слой (называемый "поверхность"), который окружает цитозольную часть; и, в известных случаях,она имеет на своей поверхности молекулы класса I главного комплекса гистосовместимости (СМН) и/или класса II главного комплекса гистосовместимости (СМН), в известных случаях содержащие антигенные пептиды, и/или адгезивные молекулы, и/или молекулы лимфоцитарной костимуляции, и/или она содержит в своей цитозольной части антигенные опухолевые молекулы, и/или иммуномодуляторы, и/или хемоаттрактанты, и/или гормоны, и/или нуклеиновые кислоты. Секреция везикул клетками представляет собой явление, описанное в уровне техники (ретикулоциты, В-лимфоциты, макрофаги). Эти везикулы обычно обозначают родовым понятием "экзосома", которое отражает механизм их продуцирования путем экзоцитоза внутренних везикул. Однако физиологическая роль этих везикул реально не установлена. Более того,структурные характеристики, свойства и функции этих везикул находятся в зависимости от типа клеток, от которых они происходят. В настоящее время изобретатели неожиданно выявили, что опухолевые клетки способны секретировать везикулы, обладающие особенно интересными иммуногенными свойствами. Эти везикулы обычно соответствуют внутренней везикуле, содержащейся в эндосоме опухолевой клетки и выделяемой вышеуказанной опухолевой клеткой вследствие слияния наружной мембраны вышеуказанной эндосомы с цитоплазматической мембраной вышеуказанной опухолевой клетки. В соответствии с этим механизмом образования, их клеточным происхождением и их характеристиками и оригинальными функциональными свойствами, эти везикулы в дальнейшем обозначаются термином"текзосома". Выражение "освобожденная от своего естественного окружения" означает, что везикула физически отделена от клетки, из которой она происходит, или еще, что она частично выделена или очищена. Следовательно, везикула продуцируется клеткой за счет экзоцитоза, затем ее частично выделяют или очищают, чтобы получить обогащенную композицию. Это выражение также может означать, что везикула не только выделяется клеткой во время слияния мультивезикулярных эндосом с плазматической мембраной, но и то, что она более не окружена растворимыми компонентами, которые находятся в просвете эндосомы, или что она лишена интактных клеток. Выражение "происходящая от опухолевой клетки" означает, что везикула обладает структурными элементами опухолевой клетки. Эта везикула обычно является "производным" ("происходящей от") опухолевой клетки в том смысле, что она продуцируется, по крайней 5 мере, частично, затем высвобождается опухолевой клеткой на данной стадии ее развития. Согласно предпочтительному варианту осуществления, текзосомы согласно изобретению включают молекулы СМН, содержащие антигенные пептиды, и/или экспрессируют адгезивные молекулы, и/или экспрессируют молекулы лимфоцитарной костимуляции, но лишены в своей цитозольной части антигенных опухолевых молекул и иммуномодуляторов и нуклеиновых кислот. Согласно другому предпочтительному варианту осуществления, текзосомы согласно изобретению являются такими, что молекулы СМН являются "порожними", то есть не содержащими антигенных пептидов, и текзосомы включают в своей цитозольной части антигенные опухолевые молекулы, иммуномодуляторы и/или нуклеиновые кислоты. Текзосомы, содержащие "порожние" молекулы СМН, могут быть получены либо из опухолевых клеток, в которых наблюдается, например, дефицит переносчика пептидов (ТАР), либо путем промывки текзосом или опухолевых клеток, чтобы элюировать пептиды, связанные с молекулами СМН. Согласно предпочтительному варианту осуществления изобретения, текзосомы согласно изобретению являются такими, что молекулы СМН содержат антигенные пептиды и/или экспрессируют адгезивные молекулы и/или молекулы лимфоцитарной костимуляции, и текзосомы содержат в своей цитозольной части антигенные опухолевые молекулы, иммуномодуляторы и/или нуклеиновые кислоты. Термин "опухолевые клетки" включает вообще любую клетку, происходящую от опухоли,например твердой или жидкой опухоли, а также клетки, трансформированные или иммортализованные in vitro. Речь идет предпочтительно о твердой, асцитной или гемато-поэтической опухоли. В качестве примера можно назвать клетки рака типа злокачественной меланомы (происходящие от первичных линий, полученных "exvivo", или же от диссоциированных клеток,происходящих из операционного препарата),которые экспрессируют на своей поверхности пептиды, такие как MART-1/Melan-A, в рамках СМН - класс 1, HLA-A 02-01, и содержат протеиновый антиген MART-1. Можно также назвать клетки, происходящие от рака почки (аденокарцинома с "прозрачными клетками") или лейкемии, которые экспрессируют специфические продукты транслокации. Таким образом, антигенные пептиды, способные связываться с молекулами СМН, происходят, например, от следующих антигенов: антигены, происходящие от меланом, такие как MART-1, тирозиназа, MAGE-1/2/3, P53 6 указаны, например, в статье Rosenberg (Immunology Today, 18, 175 [1997]), включенной в настоящее описание в виде ссылки. Вообще, можно назвать продукты слияния/транслокации онкогенов или антионкогенов, или же дифференцировочные антигены,или пептиды сами по себе, или мутантные пептиды. Молекулами лимфоцитарной костимуляции называют, например, молекулы, которые придают Т-лимфоцитам сигналы, комплементарные сигналам, вызываемым во время взаимодействия комплексов молекула класса I и II пептид с рецептором Т-клеток. В качестве примера можно назвать CD80,CD86, ICAM, LFA, CD40, некоторые члены семейства TNF R и адгезивные или хемоаттрактантные молекулы (позволяющие осуществлять контакт между специализированной антигенпредставляющей клеткой и эффекторными лимфоцитами или специфическую внутриклеточную транспортировку/локализацию ("направленную миграцию/хоминг") других клеток в место прививки или воспаления). Антигенные опухолевые молекулы, содержащиеся в цитозоле или представляемые текзосомами, происходят от протеинов, экспрессируемых селективно и/или массово опухолевыми клетками. Иммуномодуляторы, которые могут присутствовать в цитозоле текзосом, представляют собой, например, следующие:C-CR (хемокины). Нуклеиновые кислоты, которые могут находиться в цитозоле текзосом, происходят от той же самой опухолевой клетки. Эти нуклеиновые кислоты находятся в цитозоле текзосом в прямом соответствии с их механизмом образования. Это могут также быть гетерологичные нуклеиновые кислоты. Более конкретными характеристиками текзосом согласно изобретению являются следующие: они представляют собой маленькие мембранные везикулы диаметром около 60-100 нм,чаще всего около 60-90 нм, в частности 60-80 нм,выделяемые опухолевыми клетками; они содержат молекулы, обычно присутствующие в эндосомах; они содержат опухолевые антигены, как,например, MART-1 в случае клеток меланомы; они лишены погибших клеток и/или клеточных остатков; они лишены загрязнений, таких как мембранные загрязнения, эндоплазматический ретикулюм, аппарат Гольджи, митохондрии или составляющие ядер; 7 в своей мембране они содержат функциональные молекулы класса I/II, связанные с антигенными опухолевыми пептидами; они могут стимулировать in vitro пролиферацию специфических Т-лимфоцитов; они могут сенсибилизировать in vivo и invitro дендритные клетки, способные затем активировать специфические к опухоли Т-клетки; они обладают способностью, когда они инокулированы in vivo, в частности внутрикожно, вызывать регрессию развившихся твердых опухолей; они содержат молекулы лимфоцитарной костимуляции, такие как CD40 и CD80; и/или они содержат протеин ("heat-shock")HSP70; они лишены протеина gр 96; они содержат интерлейкины или хемоаттрактанты или иммуномодуляторы. Другой интересной характеристикой текзосом является то, что они содержат фосфатидилсерин в своем наружном слое. Фосфатидилсерин (PS) представляет собой один из основных компонентов клеточных мембран, обычно присутствующий в очень большом количестве во внутреннем слое двойных липидных слоев. В некоторых условиях, таких как ранние этапы апоптоза, фосфатидилсерин перераспределяется по направлению к наружному слою. Наличие фосфатидилсерина в наружном слое цитоплазматической мембраны апоптотических клеток создает сигнал распознавания макрофагами. Для того чтобы определить, имеется ли фосфатидилсерин на поверхности текзосом, очищенные препараты экзосом из супернатантов клеток меланомы человека FON были проанализированы методом, описанным Aupeix и др. (J. Clin.Invest., 99, 1546-1554 [1997]). Содержание фосфатидилсерина в наружном слое образцов FON(содержащих 390 мкг/мл протеинов) составляет 460 нмоль фосфатидилсерина. Экзосомы содержат, следовательно, значительные количества фосфатидилсерина в своем наружном слое. Тесты, позволяющие подтвердить, что текзосомы согласно изобретению содержат молекулы, обычно присутствующие в эндосомах,состоят в электронной микроскопии и иммуноимпритинге (вестерн-блоттинге). Эти тесты позволяют показать, что текзосомы согласно изобретению экспрессируют рецептор трансферина, молекулы LAMP ("lizosome associated membrane protein": мембранный протеин, ассоциированный с лизосомой), молекулы класса I/II, опухолевые антигены. Тест, позволяющий подтвердить, что текзосомы согласно изобретению лишены загрязнений, представляет собой электронную микроскопию и иммуноимпритинг с антителами к кальнексину, который находится в эндоплазматическом ретикулюме. Тест, позволяющий подтвердить, что текзосомы содержат в своей мембране функцио 002827 8 нальные молекулы класса I/II, связанные антигенными опухолевыми пептидами, состоит в антигенной презентации Т-лимфоцитам, специфическим к антигенам соответствующей опухоли (тесты пролиферации Т-специфических клонов антигенов и молекул СМН класса I). Можно также использовать тест на секрецию цитокинов (IFN, GM-CSF, TNF) вышеуказанными Т-клонами. Тест, позволяющий подтвердить, что имеет место сенсибилизация in vivo и in vitro дендритных клеток, способных активировать специфические к опухоли Т-клетки, представлен на фиг. 7 (тест пролиферации и/или выделения цитокинов Т-специфическими клонами антигенов по методу перекрестной сенсибилизацииMART-1-, HLA-A2+). Тест, позволяющий подтвердить, что текзосомы обладают способностью, когда они инокулированы, в частности, внутрикожно, вызывать регрессию развившихся твердых опухолей,представлен на фиг. 6. В качестве примера осуществляют инъекцию 10-40 мкг текзосом опухоли внутрикожно с гомолатеральной стороны развившейся опухоли, начиная с 3-10 дней; наблюдают животное,являющееся носителем опухоли, и постепенное исчезновение развившейся опухоли за 7-10 дней(у грызунов типа мышей). Предпочтительная текзосома согласно изобретению представляет собой текзосому,такую как указанная выше и имеющую на своей поверхности молекулы класса I и/или класса II СМН, в известных случаях связанную с антигенными пептидами и содержащую в своей цитозольной части антигенные опухолевые молекулы. Более конкретно, предпочтительная текзосома включает также одну или несколько молекул лимфоцитарной костимуляции и/или протеин HSP70. В особом варианте осуществления текзосома лишена протеина gp96. Согласно предпочтительному варианту осуществления изобретение относится к текзосоме, такой как описанная выше,экспрессирующей на своей поверхности молекулы класса I и/или класса II главного комплекса гистосовместимости (СМН), и/или характерные опухолевые антигены, и/или молекулы лимфоцитарной костимуляции/адгезивные молекулы, и/или иммуномодуляторы, и/или хемоаттрактанты, экзогенные по отношению к опухолевой клетке, от которой происходит экзосома, или содержащей опухолевые антигены, и/или иммуномодуляторы, и/или нуклеиновые кислоты, или цитотоксические агенты, или гормоны,экзогенные по отношению к опухолевой клетке,от которой происходит экзосома. Изобретение также относится к способу получения текзосом, таких как указанные выше. 9 Этот способ предпочтительно включает стадию получения биологического образца и стадию выделения текзосом из вышеуказанного образца. Биологически образец предпочтительно образован мембранными фракциями, культуральными супернатантами или лизатами опухолевых клеток или же свежеприготовленными опухолевыми суспензиями. Биологический образец может происходить из операционных опухолевых препаратов после хирургической эксцизии (первый случай) или же из органов, несущих опухоль (удаленный хирургическим путем орган; второй случай), которые подвергают обработке путем механического диссоциирования (первый случай) или путем замедленной перфузии (второй случай). Конечную клеточную суспензию обрабатывают таким же образом, как культуральные супернатанты. Речь может также идти о клетках, обработанных путем нескольких последовательных циклов замораживание/размораживание. Согласно предпочтительному варианту осуществления используемым в способе согласно изобретению биологическим образцом является образец эфферентной крови из вены изолированного опухолевого органа; или образец сыворотки или плазмы крови,циркулирующей в организме пациента; или продукт дренажа (физиологическая сыворотка, содержащая, в случае необходимости,дексаметазон, или цитотоксический агент, стимулирующий экзоцитоз текзосом) удаленного хирургическим путем органа и обработанный exvivo путем цикла выделение/перфузия для дренажа опухоли, которая его содержит; или супернатант диссоциированного in vitro опухолевого эксплантата. Образец эфферентной крови из изолированного опухолевого органа соответствует 20-50 мл эфферентной крови из главной вены опухолевого органа, отобранной до хирургического вмешательства. Продукт дренажа удаленного хирургическим путем органа и обработанный ех vivo путем цикла выделение/перфузия получают следующим образом. В случае органа, имеющего приносящую(афферентную) артерию и выносящую (эфферентную) вену, артерию катетеризуют с помощью пластмассовой трубки, соединенной с наклоненным вперед резервуаром, содержащим физиологическую сыворотку, в случае необходимости, с другими агентами. Орган подвергают дренажу и жидкость выводят по другой наклонной трубке, катетеризующей вену (например, в случае рака почки или церебральной глиобластомы). 10 Целью дексаметазона, содержащегося в известных случаях в продукте дренажа, является повышение клеточного стресса и экзоцитоза текзосом вне опухолевой клетки. Супернатант диссоциированного in vitro опухолевого эксплантата получают следующим образом: осуществляют механическую диссоциацию опухоли, приводящую к образованию одноклеточной суспензии, содержащей опухолевые клетки, клетки опухолевой стромы и клетки иммунной системы; эта суспензия может быть облучена и рекуперирована путем дифференциальных центрифугирований. Как указано выше, в особом варианте осуществления способа согласно изобретению биологический образец может быть обработан с помощью одного или нескольких агентов, стимулирующих продукцию текзосом. Эта обработка может включать добавление стероидных агентов (как, например, дексаметазон), фармакологических агентов (как, например, цитотоксические агенты, такие как таксаны, цисплатин и т.д.), агентов, способных увеличивать количество мультивезикулярных эндосом, и/или быть осуществлена путем облучения образца. Что касается облучения, оно должно быть достаточным, чтобы спровоцировать цитостатическую активность в отношении опухолевых клеток. Облучение опухолевых клеток может быть проведено до культивирования клеток или во время или после культивирования опухолевых клеток. Кроме того, облучать следует тогда,когда опухолевые клетки являются живыми, то есть либо в случае удаленного органа, являющегося носителем опухоли, до перфузии,либо в случае культуры клеток,либо в случае механически диссоциированной клеточной суспензии,но во всех случаях до нарушения состояния ("страдания") опухолевых клеток вследствие гипоксии, и/или некроза сосудов, и/или дегидратации. Что касается обработки с помощью стероидов, она позволяет провоцировать клеточную активацию, приводящую к экзоцитозу текзосом. Что касается обработки с помощью фармакологических агентов, она позволяет модифицировать цитоскелет и реаранжировать внутриклеточные пространства для дерегуляции процессов интернализации и экзоцитоза; деполимеризовать микротрубочки. Что касается обработки с помощью агента,способного повышать количество мультивезикулярных эндосом, ее осуществляют во время культивирования клеток; в качестве агента можно назвать нокодазол (средство, позволяющее деполимеризовать микротрубочки), бафи 11 ломицин (средство, ингибирующее вакуолярные аденозинтрифосфатазы) ("Bafilomycins: A classAcad. Sci. USA, 85, 7972-7976 [1988]). Предпочтительный способ получения текзосом согласно изобретению осуществляют а) либо исходя из культур опухолевых клеток, и он включает облучение с интенсивностью, достаточной,чтобы спровоцировать цитостатическую активность в отношении опухолевых клеток, и не превышающей 15000 рад, предпочтительно примерно 10000 рад, опухолевых клеток до, во время или после их культивирования; или обработку во время культивирования опухолевых клеток с помощью стероидов, как, например, дексаметазон, или цитотоксических агентов, как, например, 5-фторурацил (5-Fu) или цисплатин, доцетаксел, антрациклин, митотический яд, антипиримидин, или с помощью интерлейкина, как, например, IL-10, IL-2, IL-15, GMCSF; или обработку с помощью агента, способного повышать количество мультивезикулярных эндосом, как, например, нокодазол (J. Gruenberg и др. "Characterization of the Early Endosome andCell Biology, 108, 1301-1316 [1989]), и, следовательно, увеличивать продукцию текзосом; б) либо исходя из образца физиологической сыворотки, отобранного путем дренажа удаленного хирургическим путем органа и обработки ех vivo с помощью цикла выделение/перфузия для дренажа опухоли, которая ее содержит; в) либо исходя из супернатанта опухолевого эксплантата, диссоциированного in vitro, и он включает обработку с помощью стероидов, как, например, дексаметазон, или цитотоксических агентов, как, например, 5-фторурацил (5-Fu),цисплатин, таксаны, или интерлейкина, как,например, IL-10, IL-2, GM-CSF. Стадия выделения текзосом может быть реализована различными способами, такими как центрифугирование, хроматография, электрофорез, нанофильтрация и т.д. Это может быть,например, дифференциальное центрифугирование мембранных фракций культуральных супернатантов или лизатов опухолевых клеток или свежеприготовленных опухолевых суспензий с рекуперацией фракции или фракций, содержащих вышеуказанные экзосомы (Raposo и др., J. Exp. Med., 183, 1161-1172 [1996]). В этом особом варианте осуществления мембранная фракция супернатантов представляет собой таковую, получаемую после центрифугирования при ускорении 100000 g. Речь может идти предпочтительно об электрофорезе в жидкой фазе,который позволяет осуществлять разделение 12 биологических материалов по их заряду. В нижеследующих примерах показано, что этот способ предпочтительно может быть использован для выделения текзосом с хорошими выходами. Этот способ, кроме того, особенно предпочтителен в промышленном плане. Предметом изобретения также является способ получения текзосом, таких как указанные выше, кроме того, включающий либо генетическую модификацию опухолевых клеток с помощью экзогенных генов, кодирующих молекулы класса I и/или класса II главного комплекса гистосовместимости(СМН), и/или генов, кодирующих характерные опухолевые антигены, и/или генов, кодирующих костимулирующие и/или адгезивные молекулы или хемокины-аттрактанты, причем продукты этих экзогенных генов могут быть экспрессированы на поверхности текзосом и/или могут быть секвестрированы внутри текзосом; либо модификацию in vitro текзосом, продуцированных опухолевыми клетками, такую как введение (путем электропорации, путем слияния с синтетической липосомой, с помощью рекомбинантного вируса или химическим методом) протеинов или нуклеиновых кислот или фармацевтически определенных лекарственных средств в текзосомы и/или с текзосомами. Изобретение также относится к текзосомам, которые могут быть получены согласно вышеуказанному способу. Текзосомы опухолевых клеток, трансфицированные как указано выше, получают и используют в качестве опухолевых вакцин. Текзосомы, модифицированные in vitro,как указано выше, предназначены для доставки экзогенного материала в клетку-мишень in vitro и in vivo. Что касается слияния с синтетической липосомой, этот способ осуществляют, например,как указано у Nabel и др. (1996) или у Walker и др. (Nature, 387, с. 61 и последующие [1997]). Изобретение относится также к антигенпредставляющим клеткам, в частности Влимфоцитам, макрофагам, моноцитам или дендритным клеткам, нагруженным вышеуказанными текзосомами. Предпочтительно это дендритные клетки. Дендритные клетки согласно изобретению имеют, в частности, следующие характеристики: в случае моделей опухолей, которые не экспрессируют молекулы класса I и которые,следовательно, не обладают способностью стимулировать Т-клетки CD8+, дендритные клетки,связанные с текзосомами опухолевых клеток,могут представлять эти опухолевые пептиды цитотоксическим Т-клеткам в рамках молекул класса I главного комплекса гистосовместимости (характеристика 1); связанные с текзосомами опухолевых клеток дендритные клетки, инъецированные внут 13 ривенно или подкожно, также являются очень эффективными (характеристика 2). Тест, позволяющий выявить характеристику 1, является следующим. В системе организма человека негативная текзосома класса I, инкубированная в присутствии позитивной дендритной клетки класса I,может вызывать стимуляцию антигенспецифических клонов CD8+T, содержащихся в текзосоме (см. фиг. 7). Тест, позволяющий выявить характеристику 2, является следующим. В системе организма мыши, где опухоль классифицирована как негативная I и где текзосомы сами также лишены молекул класса I, эти текзосомы, когда они инкубированы и связаны с дендритными клетками, могут медиировать противоопухолевый иммунный ответ, тогда как сами по себе одни, при внутрикожной инъекции, они неспособны это делать. Изобретение также относится к способу получения антигенпредставляющих клеток, таких как указанные выше, включающему стадии инкубации антигенпредставляющих клеток в присутствии текзосом, таких как указанные выше, и стадию рекуперации вышеуказанных антигенпредставляющих клеток, связанных с вышеуказанными текзосомами. Изобретение также относится к представляющим клеткам, связанным с текзосомами и которые могут быть получены согласно вышеуказанному способу. Предметом изобретения является также применение текзосом, таких как указанные выше, для сенсибилизации антигенпредставляющих клеток, в частности В-лимфоцитов, макрофагов, моноцитов или дендритных клеток, или для стимуляции специфических Т-лимфоцитов. Изобретение также относится к мембранной везикуле, осовобожденной от своей естественной окружающей среды, выделенной антигенпредставляющими клетками, связанной с текзосомами, такими как указанные выше. Для получения этих вышеуказанных мембранных везикул можно использовать способ,включающий стадию получения текзосомы, такой как указанная выше,стадию инкубации текзосомы с антигенпредставляющими клетками,стадию дифференциального центрифугирования мембранных фракций культуральных супернатантов или лизатов вышеуказанных антигенпредставляющих клеток, связанных с текзосомами, и стадию рекуперации фракции, содержащей вышеуказанные мембранные везикулы. Предметом изобретения также являются мембранные везикулы, такие как указанные выше, которые могут быть получены согласно вышеуказанному способу. 14 В этом отношении изобретение относится к мембранным везикулам, продуцируемым дендритными клетками. В самом деле, изобретатели неожиданно выявили, что дендритные клетки способны продуцировать мембранные везикулы, обладающие особенно предпочтительными иммуногенными свойствами. Такие везикулы, в частности, визуализированы, выделены и охарактеризованы, исходя из культуральных супернатантов дендритных клеток, в частности незрелых человеческих дендритных клеток. В противоположность описанным вплоть до настоящего времени везикулам, эти везикулы абсолютно предпочтительны, поскольку они содержат, в значительной степени и одновременно, молекулы главных комплексов гистосовместимости классов I и II. Эти мембранные везикулы включают двойной липидный слой, окружающий цитозольную часть, и в дальнейшем обозначаются термином "декзосома" по их происхождению и оригинальным биологическим и биологическим свойствам. Эти везикулы, в самом деле, обладают замечательными иммуногенными свойствами, так как они способны стимулировать продукцию и активность цитотоксических Т-лимфоцитов одновременно invitro и in vivo и позволяют прекращать in vivo рост развившихся опухолей в зависимости от Тлимфоцитов и ограничения типом СМН. Декзосомы, следовательно, представляют собой действующие начала, особенно адаптированные для неклеточных иммунотерапевтических подходов. Особые мембранные везикулы согласно изобретению, следовательно, представляют собой везикулы, которые могут быть продуцированы дендритными клетками и которые включают одну или несколько молекул главного комплекса гистосовместимости класса I и одну или несколько молекул главного комплекса гистосовместимости класса II. Декзосомы предпочтительно включают молекулы лимфоцитарной костимуляции, и в частности молекулы CD63, и/или CD82, и/илиCD86, предпочтительно, по крайней мере,CD86. Представленные в примерах исследования показывают на самом деле, что декзосомы сильно маркированы антителами, специфически направленными к этим костимулирующим молекулам. Кроме того, анализы с помощью электронной микроскопии показывают, что декзосомы однородны и имеют диаметр около 60-100 нм,чаще всего около 60-90 нм. Особенно предпочтительный вариант изобретения, следовательно, представляет декзосома, имеющая диаметр около 60-90 нм, получаемая из дендритной клетки и включающая одну или несколько молекул главного комплекса гистосовместимости класса I,одну или несколько молекул главного комплекса гистосовместимости класса II, 15 одну или несколько молекул CD63,одну или несколько молекул CD86 и одну или несколько молекул CD82. В особом варианте осуществления изобретения декзосомы включают, кроме того, один или несколько антигенных пептидов и/или их получают из незрелых дендритных клеток. Всегда, согласно особому варианту осуществления, декзосомы лишены маркеров Н 2-М,цепи Ii и кальнексина (специфический маркер эндоплазматического ретикулюма). С другой стороны, всегда, согласно предпочтительному варианту осуществления, декзосомы согласно изобретению включают, кроме того, фосфатидилсерин (PS) в своем наружном слое. Таким образом, очищенные препараты экзосом из супернатантов дендритных клеток,происходящих из костного мозга, анализируют по методу, описанному Aupeix и др. (J. Clin.BMDC (содержащих 35 мкг/мл протеинов) составляет 80 нмоль фосфатидилсерина. Следовательно, декзосомы содержат значительные количества фосфатидилсерина в своем наружном слое. Декзосомы могут быть получены согласно методологии, включающей первую стадию получения дендритных клеток или клеточной культуры, содержащей дендритные клетки; вторую стадию, необязательную, в процессе которой клетки могут быть сенсибилизированы представляющими интерес антигенами; и третью стадию, включающую получение декзосом из этих клеточных культур. Эти различные стадии могут быть предпочтительно реализованы согласно нижеописанным методикам. Получение дендритных клеток Первая стадия способа включает получение культуры (культур) дендритных клеток. Речь может идти о клеточных культурах, обогащенных дендритными клетками, даже о клеточных культурах, включающих, главным образом, дендритные клетки. Предпочтительно речь идет, конечно, о дендритных человеческих клетках. Получение дендритных клеток хорошо известно (документировано) из литературы. Так,известно, что эти клетки могут быть получены из клеточных штаммов иммунной системы или из предшественников-моноцитов или могут быть непосредственно выделены в дифференцированной форме (Revue par Hart, Blood, 90,3245 [1997]). Получение дендритных клеток из клеточных штаммов проиллюстрировано, например,Inaba и др. (J. Exp. Med., 176, 1693 [1992]), Caux и др. (Nature, 360, 258 [1992]) или Bernhard и др.(Cancer Res., 55, 1099 [1995]). Эти работы, в частности, показывают, что дендритные клетки могут быть получены путем культивирования костного мозга в присутствии фактора стимуля 002827 16 ции колоний гранулоцитов-макрофагов (GMCSF) или, более конкретно, могут быть получены из гемато-поэтических клеточных штаммов(CD34+) путем культивирования в присутствии сочетания цитокинов (GM-CSF + TNF). Получение дендритных клеток из предшественников-моноцитов проилюстрировано, например, Romani и др. (J. Exp. Med., 180, 83[1992]), а также Jansen и др. (J. Exp. Med., 170,577 [1989]). Эти методики, по существу, основаны на отборе мононуклеарных клеток из крови и культивировании в присутствии различных сочетаний цитокинов. Особый метод состоит в обработке предшественников-моноцитов крови в присутствии сочетаний цитокинов, таких как,например, интерлейкин-4 + GM-CSF или интерлейкин-13 + GM-CSF. Этот способ также проиллюстрирован Mayordomo и др., 1995. Кроме того, также можно обрабатывать предшественники-моноциты с помощью фармакологических агентов клеточной дифференциации, таких как активаторы кальциевых каналов. Другой подход к получению дендритных клеток состоит в выделении из биологических образцов уже дифференцированных дендритных клеток. Этот подход описывается, например, Hsu и др. (Nature Medicine, 2, 52 [1996]). Методика, описанная этой группой авторов,состоит, по существу, в получении образцов периферической крови и в их обработке с помощью различных градиентов и центрифугирований, чтобы экстрагировать дендритные клетки. Особенно подходящая методика в рамках настоящего изобретения основана на получении дендритных клеток из предшественниковмоноцитов или костного мозга. Эти методики проиллюстрированы в примерах. Более конкретно, в рамках настоящего изобретения предпочтительным является использование дендритных клеток, полученных путем обработки предшественников-моноцитов (содержащихся в крови или мозге) в присутствии сочетания GMCSF + IL-4 или GM-CSF + IL-13. Кроме того, для осуществления настоящего изобретения особенно предпочтительным является использование популяции дендритных клеток, включающей незрелые дендритные клетки. Предпочтительно используют популяцию дендритных клеток, состоящую, главным образом (то есть, по крайней мере, на 60%,предпочтительно на 70%), из незрелых дендритных клеток. Незрелое состояние дендритных клеток соответствует ранней стадии их развития, в которой они обладают сильной эндоцитозной активностью и экспрессируют незначительные количества молекул класса I и II СМН и молекул лимфоцитарной костимуляции на своей поверхности. В самом деле, изобретатели неожиданно обнаружили, что сами незрелые 17 дендритные клетки способны продуцировать мембранные везикулы в значительном количестве. Это открытие является удивительным тем более, что дендритные клетки в незрелой стадии известны своей слабой способностью стимулировать Т-лимфоциты и, следовательно, своей слабой биологической активностью (Cella, Nature London, 388, 782 [1997]). Первая стадия способа согласно изобретению, следовательно, может включать предпочтительно получение популяции дендритных клеток, содержащей незрелые дендритные клетки, в частности, из предшественниковмоноцитов, более конкретно, путем обработки с помощью сочетания цитокинов, такого как GMCSF + IL-4 или GM-CSF + IL-13. Кроме того, в рамках настоящего изобретения также можно использовать популяции иммортализованных дендритных клеток. Это могут быть линии иммортализованных дендритных клеток (линия D1, используемая в примерах, или любая другая линия, получаемая,например, путем введения mус-онкогена в дендритные клетки). Речь может идти также о полученных, затем иммортализованных in vitro дендритных клетках. Интерес к иммортализованным дендритным клеткам заключается в создании банков иммортализованных дендритных клеток, сенсибилизированных данными антигенными группами, используемых в промышленном масштабе для получения декзосом, которые могут быть введены целым группам пациентов. Когда дендритные клетки получены, их можно культивировать, преимуществeнно очищать, хранить или использовать непосредственно в следующих стадиях способа. Сенсибилизация дендритных клеток Декзосомы согласно изобретению могут быть получены из дендритных клеток, не содержащих антигены, то есть не включающих определенные антигены в своих мембранах или в своем цитозоле. Такие декзосомы тогда называют "наивными" или "девственными". Согласно предпочтительному варианту осуществления, декзосомы согласно изобретению получают, однако, из дендритных клеток,сенсибилизировнных антигеном или группой антигенов. В этом варианте осуществления декзосомы действительно сами по себе являются носителями вышеуказанного или вышеуказанных антигенов и, таким образом, способны индуцировать ответ против таковых. Для сенсибилизации дендритных клеток антигенами могут быть использованы различные способы. Эти способы упомянуты выше и, в частности, включают введение в контакт дендритных клеток с антигенными пептидами ("peptide pulsing"). Этот подход состоит в инкубации дендритных клеток в течение изменяемого времени (обычно примерно от 30 мин до 5 ч) вместе с одним или 18 несколькими антигенными пептидами, то есть вместе с пептидом, происходящим от антигена,таким, который может получаться в результате обработки вышеуказанного антигена антигенпредставляющей клеткой. Этот тип подхода описан, например, для антигенных пептидов ВИЧ, вируса гриппа или вируса папилломы человека или для пептидов, происходящих, например, от антигенов Mut1, Mart, Her2 или NeuMayordomo и др., указано выше; Mehta-Damani и др., J. Immunol, 996 [1994]). Также можно инкубировать дендритные клетки вместе с кислотным пептидным элюатом опухолевой клетки согласно методике, описанной Zitvogel и др.(1996, указано выше); введение в контакт дендритных клеток с одним или несколькими антигенами ("antigenpulsing"). Этот подход состоит в инкубации дендритных клеток не с одним или несколькими антигенными пептидами, а с интактным антигеном или интактными антигенами. Интерес к этому способу заключается в том, что антиген может быть трансформирован в антигенные пептиды за счет природных механизмов дендритной клетки так, что полученные в результате и представленные дендритной клеткой антигенные пептиды должны обеспечивать наилучшую иммуногенность. Этот подход проиллюстрирован, например, Inaba и др. (J. Exp. Med., 172, 631[1996]); введение в контакт дендритных клеток с одним или несколькими антигенными протеиновыми комплексами. Этот подход подобен предыдущему, однако, он может позволить улучшить эффективность трансформации и/или представление антигена. В частности, антиген может быть использован в растворимой форме или в комплексе с элементами нацеливания на мишень, что позволяет, в частности, нацеливать на мишень мембранные рецепторы, такие как рецепторы маннозы или рецепторы иммуноглобулинов (Rfc). Также можно получать особый антиген, чтобы улучшить его пенетрацию или фагоцитоз клетками; введение в контакт дендритных клеток с клетками или мембранами клеток, экспрессирующих антигены или антигенные пептиды. Этот способ основан на прямом переносе антигенов или антигенных пептидов за счет слияния клеток или клеточных мембран. Этот подход проиллюстрирован, например, путем слияния между дендритными клетками и мембранами опухолевых клеток (Zou и др., Cancer Immunol.Immunother., 15, 1 [1992]); введение в контакт дендритных клеток с мембранными везикулами, содержащими антигены или антигенные пептиды (в частности, 19 экзосомы опухолевых клеток, такие как указанные выше) . Этот подход к сенсибилизации дендритных клеток, при котором используют экзосомы, такой, который выявлен согласно настоящему изобретению, является особенно предпочтительным, поскольку он не требует знания особых антигенов или того, где нагруженные антигенные пептиды находятся в природной конформации. Этот способ проиллюстрирован в примерах; введение в контакт дендритных клеток с липосомами, содержащими антигены или антигенные пептиды (Nair и др., J. Ехр. Med., 175,609 [1992]); введение в контакт дендритных клеток с рибонуклеиновыми кислотами, кодирующими антигены или атигенные пептиды (см. Boczkowsky и др., 1996, указано выше); введение в контакт дендритных клеток с дезоксирибонуклеиновыми кислотами, кодирующими антигены или антигенные пептиды (в случае необходимости, включенные в векторы плазмидного, вирусного или химического типа). Так, способ сенсибилизации дендритных клеток состоит, например, в инфицировании дендритных клеток вирусом, против которого ищут защиту. Это описано, например, для вируса гриппа (Bhardwaj и др., J. Clin. Invest., 94, 797 [1994];Macatonia и др., указано выше). Другой подход состоит в высвобождении, с помощью вируса или других векторов переноса нуклеиновых кислот, ДНК, кодирующей антиген или антигены или антигенные пептиды, которые представляют интерес. Такой подход проиллюстрирован,например, Arthur и др. (Cancer Gene Therapy,1995) или Alijagie и др. (Eur. J. Immunol, 25,3100 [1995]). Некоторые вирусы, такие как аденовирусы, аденоассоциированные вирусы или ретровирусы, могут быть использованы в этом отношении для высвобождения нуклеиновой кислоты в дендритной клетке. Предпочтительными в рамках настоящего изобретения способами являются методы сенсибилизации, при которых используют мембранные везикулы (экзосомного типа), антигенные пептиды, векторы, рибонуклеиновые кислоты или опухолевые кислотные пептидные элюаты (ЕРА). Использование мембранных везикул,так же как "peptide pulsing" и метод ЕРА, проиллюстрированы в примерах и являются в высшей степени предпочтительными. Получение декзосом Когда популяции дендритных клеток получены и, в случае необходимости, сенсибилизированы одним или несколькими антигенами,могут быть получены декзосомы. Это приготовление включает первую, необязательную, стадию обработки клеток, затем вторую стадию выделения декзосом. Первая стадия обработки клеток проистекает из выявления заявителями факта, что продуцирование декзосом дендритными клетками 20 представляет собой регулируемый процесс. Так,в отсутствие обработки, количества продуцируемых декзосом являются относительно незначительными. В частности, когда используют популяцию незрелых дендритных клеток, предварительно не стимулированных, продукция декзосом практически не поддается обнаружению. Следовательно, изобретатели показали,что продукция декзосом зависит, главным образом, от типа дендритных клеток и осуществления обработки этих клеток. Это и есть предварительные основы, которые позволяют получать декзосомы, обладающие предпочтительными свойствами, в значительных количествах для промышленного использования. Обработку дендритных клеток, следовательно, реализуют с целью стимуляции продукции декзосом этими клетками. Эта стимулирующая обработка может быть реализована либо путем культивирования клеток в присутствии некоторых цитокинов,либо путем облучения клеток, либо за счет снижения значения рН при культивировании, либо путем комбинирования этих различных типов обработки. В первом варианте осуществления дендритные клетки инкубируют в присутствии цитокина, выбираемого предпочтительно из гаммаинтерферона (IFN), интерлейкина-10 (IL-10) и интерлейкина-12 (IL-12), предпочтительно из гамма-интерферона и IL-10. Как проиллюстрировано в примерах, эти цитокины способны оказывать довольно резко выраженное стимулирующее воздействие на продукцию декзосом(фактор 3-5). Более того, что является удивительным, никакого стимулирующего воздействия не наблюдали в присутствии следующих цитокинов: IL-1, IL-2, IL-4, IL-6 и IL-15 и даже наблюдали ингибирующее воздействие в присутствии липополисахарида (LPS) или фактора некроза опухоли (TNF), которые, однако, описаны как стимулирующие созревание дендритных клеток. Эти результаты, следовательно, показывают (i) регулируемый характер продукции декзосом и (ii) специфическое воздействие некоторых цитокинов на эту продукцию. Эти результаты иллюстрируют, кроме того, неожиданный интерес к использованию незрелых дендритных клеток и использованию, в стадии стимуляции, цитокинов, индуцирующих незрелое состояние клеток, таких как, в частности, IL-10. В этом варианте осуществления цитокины используют в количествах, адаптируемых специалистом в зависимости (i) от цитокина, (ii) от клеточной популяции и (iii) возможной реализации других обработок. Разумеется,цитокины предпочтительно используют в субтоксических количествах. Количества интерлейкина обычно составляют 1-100 нг/мл, предпочтительно 1-50 нг/мл. Интерферон может быть использован в количествах, составляющих 1-500 МЕ/мл, предпочтительно 5-200 МЕ/мл. 21 Во втором варианте осуществления дендритные клетки подвергают облучению. Представленные в примерах результаты на самом деле показывают, что облучение клеток также позволяет увеличивать уровень продукции декзосом. Облучение обычно осуществляют с помощью 1000-5000 рад, предпочтительно 20004000 рад, преимущественно примерно с помощью 3000 рад. Вторая стадия включает выделение декзосом. Целью этой стадии является выделение декзосом из дендритных клеток и/или культуральной среды. Эта стадия позволяет, в частности, получать обогащенную декзосомами и, по существу, лишенную интактных клеток композицию. Эта стадия предпочтительно приводит к композиции, включающей, по крайней мере,70% декзосом, предпочтительно, по крайней мере, 85%. Выделение декзосом может быть реализовано различными способами разделения биологических материалов. Как описано выше в случае текзосом опухолевых клеток, эти способы могут основываться на различных размере, массе, заряде и плотности декзосом. Так, декзосомы могут быть выделены путем центрифугирования культуральной среды или культурального супернатанта или мембранных фракций или лизатов дендритных клеток. Речь идет, например, о дифференциальном центрифугировании и/или центрифугировании по градиенту плотности, после которого (которых) следует рекуперация фракции или фракций, содержащих вышеуказанные декзосомы. Этот тип методики основан на разделении путем последовательных операций центрифугирования, с одной стороны, мембранных везикул и, с другой стороны, клеток, клеточных остатков, внутренних везикул и т.д. В этом особом варианте осуществления фракцией, включающей декзосомы,обычно является таковая, получаемая после ультрацентрифугирования при ускорении 100000 g. Этот метод проиллюстрирован в примерах 1 и 8. Стадия выделения декзосом также может быть реализована путем хроматографии, электрофореза и/или нанофильтрации. Это может быть, преимущественно, электрофорез в жидкой фазе и/или по градиенту плотности. Особенно предпочтителен электрофорез в жидкой фазе, который позволяет разделять биологические материалы по их заряду. В нижеследующем примере 11 на деле показано,что этот способ может быть преимущественно использован для выделения экзосом с хорошим выходами. Этот способ, кроме того, особенно предпочтительно в промышленном масштабе. Речь может идти также об очистке с помощью хроматографии. В частности, можно назвать ионообменную хроматографию, гельпроникающую (или эксклюзионную) хроматографию или гидрофобную хроматографию. 22 Учитывая липидную природу декзосом, особый интерес представляет ионообменная хроматография. Нанофильтрация может быть реализована известными способами, исходя из клеточного супернатанта. Использование методов хроматографии,и/или электрофореза, и/или нанофильтрации составляет другой важный аспект настоящего изобретения, так как по сравнению с обычными методами можно достигать получения продукта улучшенного качества в количествах, адаптированных для промышленного (в частности, фармакологического) использования. В этом отношении изобретение также относится к способу получения мембранных везикул, включающему, по крайней мере, стадию разделения путем электрофореза, хроматографии или нанофильтрации. Более конкретно этот способ адаптирован к получению мембранных везикул экзосомного типа, таких как текзосомы или декзосомы. В этом способе стадия разделения путем электрофореза или хроматографии может быть реализована непосредственно при использовании культурального супернатанта,клеточного лизата или предварительно очищенного препарата. Электрофорез более предпочтительно представляет собой электрофорез в жидкой фазе. Декзосомы обладают замечательными свойствами, которые проиллюстрированы в примерах. Так, декзосомы стимулируют in vitro пролиферацию цитотоксических Т-лимфоцитов. Более того, in vivo декзосомы способны блокировать рост опухоли. Эти везикулы, следовательно, могут очень эффективно представлять, в ассоциации с молекулами СМН класса I и класса II, вызывающие интерес антигены. Декзосомы, следовательно, имеют многочисленные применения, например в области онкологических заболеваний, инфекционных заболеваний или паразитарных заболеваний. Кроме того, в повышенных дозах (способных индуцировать толерантность) декзосомы могут быть также использованы при лечении патологий, таких как аллергия, астма или аутоиммунные заболевания. Кроме того, "наивные" декзосомы также могут быть использованы в качестве добавки для стимуляции и/или модуляции иммунного ответа. Предметом изобретения также является применение текзосом, таких как указанные выше, или антигенпредставляющих клеток, таких как указанные выше, или декзосом, таких как указанные выше, для стимуляции и, в случае необходимости, амплификации in vitro антигенспецифических Тлимфоцитов, содержащихся в вышеуказанных текзосомах, антигенпредставляющих клетках или декзосомах, или В-лимфоцитов и в частности для стимуляции и амплификации in vitro Тлимфоцитов. 23 Изобретение относится также к применению текзосом, таких как указанные выше, или антигенпредставляющих клеток, таких как указанные выше, или декзосом, таких как указанные выше, для отбора ex vivo набора Тлимфоцитов, способных распознавать специфические антигены, содержащиеся в вышеуказанных текзосомах, антигенпредставляющих клетках или декзосомах. Предметом изобретения также является лекарственное средство, содержащее в качестве действующего начала, по крайней мере, одну текзосому, такую как указанная выше, антигенпредставляющую клетку, такую как указанная выше, и/или декзосому, такую как указанная выше, в сочетании с фармацевтически приемлемым носителем. Изобретение предпочтительно относится к лекарственному средству, такому как указанное выше, для использования при лечении онкологических заболеваний, инфекционных заболеваний или паразитарных заболеваний. Более предпочтительно лекарственное средство включает текзосомы или декзосомы,такие как указанные выше. Согласно другому варианту осуществления, изобретение относится к лекарственному средству, такому как указанное выше, для применения в целях лечения патологии типа аллергии, астмы или аутоиммунного заболевания. В качестве соответствующей галеновой формы текзосомы или декзосомы могут содержаться в физиологической сыворотке, в ампуле или любом другом соответствующем средстве(шприц, резервуар и т.д.). Они могут быть приготовлены экстемпорально или храниться, например, в замороженном состоянии при температуре -80 С. Используемые растворы могут представлять собой солевые растворы, в случае необходимости дополненные стабилизаторами и/или добавками. Стабилизаторами могут быть,в частности, протеины или молекулы с высокой молекулярной массой. Более конкретно можно назвать протеины, такие как человеческий сывороточный альбумин, или молекулы, такие как,например, декстран или полоксамер. Композиции согласно изобретению могут также включать или быть использованными в ассоциации с одной или несколькими добавками. Более конкретно добавка может представлять собой любой фармакологический иммуностимулирующий агент, такой как, например,цитокин (в частности, интерлейкин-12). Такие агенты обычно используют согласно клиническим протоколам лечения или в составах вакцин. Кроме того, добавка согласно изобретению также может представлять собой агент, способный стимулировать продукцию in vivo дендритных клеток. В качестве примера можно назвать соединение Flt13. Комбинированное использование этого типа агента позволяет повышать количество дендритных клеток и, следователь 002827 24 но, потенциально увеличивать эффективность композиций согласно изобретению. Другой предмет изобретения, следовательно, относится к ассоциации текзосом и/или декзосом и добавки с целью одновременного, отдельного или разделенного во времени использования. Соответствующий способ введения лекарственных средств согласно изобретению представляет собой способ введения путем инъекций и в частности внутрикожных или подкожных инъекций. Этот способ введения особенно адаптирован к случаям, когда действующее начало лекарственного средства представляет собой дендритные клетки, нагруженные текзосомами или декзосомами. Соответствующие дозировки составляют 0,01-10 мкг/кг, и в частности 0,10-5 мкг/кг, и еще более предпочтительно 0,15-2 мкг/кг массы тела, и 10 мкг для внутрикожных реакционных тестов. Лекарственные средства согласно изобретению могут быть также использованы в количестве по 100 мкг для профилактических вакцинаций. Цели использования лекарственных средств согласно изобретению являются следующими: замедленная гиперчувствительность (тесты в случае больных раком), или профилактическая терапия, или использование в рамках определения частоты специфических лимфоцитарных цитотоксических предшественников или секретеров интерферона по методу ограниченного разведения. Речь идет об использовании аутологичных или аллогеничных дендритных клеток, предварительно инкубированных с текзосомами согласно изобретению, в качестве мишеней периферических лимфоцитов у носителей опухоли до, во время или после противоопухолевой обработки (как классическая обработка или активная специфическая иммунизация). Изобретение также относится к применению текзосомы, такой как указанная выше, или антигенпредставляющей клетки, такой как указанная выше, или декзосомы, такой как указанная выше, для получения лекарственного средства, предназначенного для обработки опухолей, в особенности твердых, асцитных и гематопоэтических опухолей. В качестве твердых опухолей можно назвать рак почки, молочной железы, ободочной кишки, легкого, желудка, печени; меланомы,саркомы и т.д. В качестве гемато-поэтических опухолей можно назвать лейкозы, злокачественные лимфомы по Ходжкину и не по Ходжкину. Как указано выше, композиции согласно изобретению, в частности композиции, включающие декзосомы, также можно применять для 25 лечения инфекционных или паразитарных заболеваний. Для этого типа применения в декзосомы вводят антигены или пептиды возбудителя(вируса) или паразита. Изобретение также относится к применению текзосомы, такой как указанная выше, или декзосомы, такой как указанная выше, в рамках теста замедленной гиперчувствительности рака или еще в качестве диагностического инструмента для исследования частоты CTLспецифических цитотоксических предшественников. Изобретение также относится к применению текзосомы или части или конститутивного компонента текзосомы, такой как указанная выше, или декзосомы, такой как указанная выше, для переноса биологического материала в клетку in vitro или in vivo. Изобретение также относится к созданию банков текзосом, происходящих от опухолевых клеток общего или различного гистологического типа. Эти банки образованы смесями текзосом,полученных из линий опухолевых клеток для данного типа рака. Эти банки текзосом могут вызывать сенсибилизацию антигенпредставляющих клеток, в частности дендритных клеток,против любых опухолей этого типа. Изобретение также относится к смесям текзосом или декзосом. Можно назвать, например, смеси текзосом для генетически связанных (рак молочной железы и яичника) или представляющих известные мутации р 53, р 16 (рак молочной железы, саркома) опухолей. Можно также указать смеси опухолевых текзосом с везикулами, происходящими от иммортализованных и трансфицированных клеток,для выражения костимулирующих молекул,адгезивных молекул, хемокинов-аттрактантов(отличных от тех, которые экспрессируются в текзосомах). Настоящее изобретение описывается далее более подробно с помощью нижеследующих примеров, которые нужно рассматривать как иллюстративные и не ограничивающие объем охраны изобретения. Пояснения к фигурам Таблица. Клетки опухолевых линий инкубировали в течение 24 ч при плотности один миллион клеток на миллилитр. Текзосомы затем получали (см. пример) из культуральных сред путем дифференциального ультрацентрифугирования. Концентрацию текзосомальных протеинов определяли с помощью теста BradfordMZ-2 описан Traversari и др.(1992). Знакозначает, что различные первичные линии установлены и охарактеризованы в клинической биологической лаборатории Института Gustave Roussy и доступны по требованию. 26 Фиг. 1 А и 1 В. Морфология мультивезикулярных эндосом и текзосом, происходящих от клеток TS/A. А. Ультратонкие срезы клеток TS/A, проанализированные с помощью электронного микроскопа. Часть цитоплазмы, показывающая эндосомальное пространство, содержащее везикулы диаметром 60-80 нм. В. Препарат текзосом клеток TS/A, проанализированных с помощью электронного микроскопа методом с использованием интактной везикулы (Raposo и др., 1966). Препараты текзосом содержат мажоритарную популяцию везикул диаметром 60-80 нм, по размеру и морфологии подобных внутренним везикулам мультивезикулярных эндосом, показанных в п.А. Фиг. 2. Наличие различных маркеров в текзосомах опухолевых клеток. А. 2 мкг текзосомальных протеинов (Ехоs) или 2 х 105 опухолевых клеток анализировали методом вестерн-блоттинга с помощью моноклональных антител, специфических к молекулам класса I CMH (Machold Robert P. и др.,"Peptide Influences the Folding and Intracellular[1992]); Lamp 1 и 2 (моноклональные антитела крысы против мыши; Pharmingen) и кальнексину (Hebert Daniel N. и др., "Glucose Trimmingand Reglucosylation determine Glycoproteine Association with Calnexin in the Endoplasmic Reticulum", Cell, 81, 425-433 [1995]). В. 10 мкг текзосомальных протеинов линии клеток меланомы (FON) или 10 мкг полных протеинов тех же клеток анализировали путем вестерн-блоттинга с помощью антитела антиMART-1 (Marincola F. и др., "Analysis of expression of the melanoma associated antigens MART-1"in situ" lesions", Journal of Immunotherapy, 19,192-205 [1996]). С. Текзосомальные протеины линии клеток меланомы (FON) или полные протеины тех же клеток анализировали методом вестернблоттинга с помощью антитела анти-НSР 70.D. Текзосомальные протеины линии клеток меланомы (FON) или линии MZ-2 анализировали методом вестерн-блоттинга с помощью антитела анти-gp96. Фиг. 3. Текзосомы, происходящие от позитивной опухолевой линии MART-1 (FON), стимулируют специфический к MART-1 Т-клон. Двадцать тысяч клеток Т-клона LT8 (или(клетки линии нефромы, MART-1-) в качестве отрицательного контроля, в течение 48 ч. Про 27 дукцию TNF клетками Т-клона определяли путем биологического теста с клетками WEHI(Espavik и др.). Текзосомы индуцируют продукцию IFN Т-клоном, раскрывая таким образом присутствие комплексов НLА-А 2/пептид, происходящиx от MART-1, на поверхности текзосом.LT8, инкубированным в присутствии текзосом,происходящих от опухолевых клеток GIAM;LT8, инкубированным в присутствии текзосом,происходящих от опухолевых клеток FON;LT8, инкубированным в присутствии текзосом,происходящих от опухолевых клеток FON. На оси абсцисс представлены определенные клетки, а на оси ординат указано продуцированное количество TNF (пг/мл). Фиг. 4. Текзосомы клеток Р 815, экспрессирующих Gal, стимулируют спленоциты мышей, иммунизированных рекомбинантными аденовирусами Gal. Спленоциты (105) мышей BALB/c, иммунизированных за 2 месяца до этого с помощью 106 pfu (бляшкообразующих единиц) рекомбинантного аденовируса Gal, способствующие отторжению опухоли, экспрессирующей Gal,инкубировали с текзосомами, происходящими от клеток Р 815 (незаполненные четырехугольники ), или клетками P815-Gal (заполненные квадраты ). Не подвергнутые инкубации с текзосомами спленоциты создают фоновый шум,обозначенный закрашенными точками . После культивирования в течение 5 дней добавляли 1 мкKи тритиированного тимидина на лунку культуры. Включение трития в клеточную ДНК определяли спустя 18 ч. Результаты, значительно отличные от полученных по точному методу Фишера, маркированы знаком . На оси абсцисс представлено количество текзосом (Тех), происходящих от опухолевых клеток Р 815 (мкг/мл), а на оси ординат указано число импульсов в минуту (СРМ). Фиг. 5. Опухолевый антиген MART-1, содержащийся в текзосомах, может быть представлен Т-лимфоцитам дендритными клетками. Текзосомы в возрастающих дозах, происходящие от линий опухолевых клеток FON(20000 клеток на лунку 96-луночных микроплашек) LT12 (специфический к HLAA2/пептид MART-1) в присутствии дендритных клеток HLA-A2+, происходящих от циркулирующих макрофагов (DCA2) (F. Sallusto и A.TNF", J. Exp. Med., 179, 1109-1118 [1994]). Выделение IFN, представленное на оси орди 002827 28 нат (пг/мл), определяли в культуральных супернатантах спустя 2 дня. Текзосомы, происходящие от FON, так же как текзосомы, происходящие от MZ2, индуцировали выделение IFN клетками LT12 и LT8 (результаты не представлены). Клетки FON также индуцировали сильное выделение IFN Т-клонами, тогда как клетки MZ2, которые не выражают адекватный гаплотип молекулы HLA (HLA-A2), не индуцировали продукцию IFN.LT12, инкубированным в присутствии дендритных клеток HLA-A2+;"LT12 + DCA2 + TexFON" соответствует Т-клонам LT12, инкубированным в присутствии дендритных клеток, содержащих текзосомы,происходящие от опухолевых клеток FON;"LT12 + DCA2 + TexMZ2" соответствует Т-клонам LT12, инкубированным в присутствии дендритных клеток, содержащих текзосомы,происходящие от опухолевых клеток MZ2. Фиг. 6 А и 6 В. Противоопухолевые эффекты текзосом in vivo. Сто тысяч опухолевых клеток TS/A инъецировали мышам BALB/c (А) или Nude (В). Спустя 3 дня каждая мышь получала две последовательные инъекции с интервалом 24 ч (представленные на фиг. как J3 и J4), 20-30 мкг текзосом внутрикожно. Размер опухоли затем определяли два раза в неделю. Были проведены статистические анализы точным методом Фишера(показатель 95% указан знаком ). А. Две группы по 5 мышей получали текзосомы, происходящие от TS/A (заполненные треугольники ) или МСА 38 (незаполненные треугольники ) (линия клеток аденокарциномы ободочной кишки, происходящая от мышиC57BL/6), в качестве отрицательного контроля. Сами текзосомы, происходящие от TS/A, обладают противоопухолевым эффектом in vivo. В. Две группы мышей Nude параллельно получали такие же дозы тех же препаратов текзосом (: экзосомы TS/A; : экзосомы МС 38). Никакого противоопухолевого эффекта не наблюдали в случае мышей Nude. Тлимфоциты, следовательно, необходимы для противоопухолевых эффектов текзосом in vivo. На оси абсцисс указаны дни, а на оси ординат указан средний размер опухоли (мм 2). Фиг. 7. Дендритные клетки, происходящие от костного мозга, сенсибилизированные текзосомами, происходящими от опухолевых клеток,вызывают полное удаление in vivo развившихся твердых опухолей. Пятьсот тысяч опухолевых клеток Р 815 инъецировали в правый бок мышей DBA/2 за 10 дней до обработки. Обработка состояла в разовой инъекции текзосом (10 мкг/мышь) в тот же бок,но на расстоянии от опухоли. Другой группе инъецировали внутривенно дендритные клетки(происходящие от костного мозга путем обра 29 ботки в течение 5 дней с помощью GM-CSF +IL-4 (Mayordomo и др., 1995), инкубированные предварительно в течение 3 ч с текзосомами Р 815. Опухоли измеряли и результаты анализировали, как показано на фиг. 6. Текзосомы Р 815 сенсибилизировали дендритные клетки для индуцирования отторжения развившихся опухолей. Микросомы не оказали значительного воздействия на рост опухоли. На вставке показан процент мышей без опухоли (по оси ординат); заштрихованный прямоугольник в виде бруска соответствует только группам животных типа,обозначенного заполненными квадратами; по оси абсцисс отложены дни. У этих мышей не происходило развития опухоли после повторной инъекции дубликата минимальной опухолевой дозы, и это показывает, что у них выработался противоопухолевый иммунитет. Используемые на фигуре символы являются следующими:X: необработанные животные. На оси абсцисс указаны дни, а на оси ординат указан средний объем опухоли. Фиг. 8 А, 8 В и 8 С. Химиотерапевтические/цитотоксические агенты и облучение могут стимулировать экзоцитоз опухолевых текзосом. Использовали мышиную лейкемию L1210 и линию раковых клеток почки человека GIAM(фиг. 8 С). Два миллиона опухолевых клеток инкубировали в присутствии возрастающих количеств 5-Fu (для L1210) или цисплатина(CDDP) (для GIAM) на мл в течение 16 ч. Супернатант рекуперировали, затем подвергали дифференциальным ультрацентрифугированиям, как указано в таблице.GIAM также инкубировали с IL-2 в количестве 1000 МЕ/мл или с дексаметазоном (10-6 моль) или облучали с помощью 10000 рад. Сильные дозы химиотерапевтических агентов и облучение являются хорошими примерами положительной регуляции экзоцитоза текзосом в случае этих животных, служащих в качестве моделей. Результаты воспроизводились также в случае других опухолей (фиг. 8 А и 8 В); в частности, оказалось, что облучение стимулирует экзоцитоз сильнее всего. Фиг. 8 А соответствует вышеописанной меланоме FON, а фиг. 8 В соответствует мышиной лимфоме, обозначаемой EL4 (J. Nat. CancerIns., 48, 265-271 [1972]). На фиг. 8 А представлены клетки FON, инкубированные в различных условиях: 1) CM: базальная среда для культуры 30 3) облучение: облучено с помощью 10000 рад; 4) без сыворотки; 5) IL-10: в присутствии IL-10, по 10 нг/мл. Вышеуказанные облучения действительны также для клеток EL4, L1210 и GIAM. Фиг. 9 А, 9 В и 9 С. Мембранные везикулы(декзосомы), продуцируемые дендритными клетками, сенсибилизированными опухолевыми антигенами меланом, эффективны для стимуляции специфических к этим меланомам Тлимфоцитов, и их продукция регулируется цитокинами.LT8 (СМ) соответствует Т-клонам LT8,инкубированным в базальной среде для культуры, как указано на фиг. 8 А;DexTexNUN соответствует декзосоме,происходящей от дендритных клеток, содержащих текзосомы, происходящие от опухолевых клеток NUN;DexTexFON соответствует декзосоме, происходящей от дендритных клеток, содержащих текзосомы, происходящие от опухолевых клеток FON;TumFON соответствует опухолевым клеткам FON. А. Тесты пролиферации: текзосомы Fon(использованные согласно фиг. 3) инкубировали с дендритными клетками HLA-A2 в течение 3 ч,затем промывали 9%-ным солевым раствором,после чего инкубировали в кислой среде с рН=6,3 в течение 18 ч. Мембранные везикулы дендритных клеток (декзосомы) таким образом рекуперировали из супернатанта культуры вышеуказанных дендритных клеток HLA-2. Мембранные везикулы, происходящие от дендритных клеток, содержащих текзосомы(DexTex), затем инкубировали со специфическими к MART-1 клонами LT8, представленными в рамках HLA-A2 (текзосомы Fon содержат антиген MART-1). В качестве отрицательного контроля использовали текзосомы Nun (линия раковых клеток почки HLA-A2-; MART-1-). В качестве положительного контроля использовали облученную опухолевую линию FON(TumFON) или антитело анти-СD3, предварительно адсорбированное на пластике (антиCD3Ab). Инкубацию DexTex с клонами LT8 продолжали 48 ч, затем в лунки объемом по 200 мкл добавляли 1 мкКи тритиированного тимидина. Лимфоцитарные пролиферации LT8 определяли спустя 18 ч. На оси ординат указано число импульсов в минуту. В. Следовали той же методике, но IFN определяли в супернатанте 48-часовой культуры с помощью твердофазного иммуноферментного анализа. На оси ординат указано содержаниеIFN (пг/мл). С. Декзосомы выделяли из супернатантов дендритных клеток после инкубации в течение 48 ч 31 в присутствии или в отсутствие LPS (20 мкг/мл),IFN- (100 МЕ/мл) или IL-10 (10 мкг/мл). Фиг. 10. Вид декзосом в иммуноэлектронной микроскопии. Декзосомы имеют сходный диаметр, составляющий от 50 до 90 нм, и интенсивно маркированы антителами анти-СD63 (фиг. 10 А). Большая часть этих декзосом также маркирована антителами анти-МНС-I (с. 15, фиг. 10 В) и анти-МНСII (с. 15, фиг. 10 С). Черточки: 250 нм. Фиг. 11. Определение количеств гаммаинтерферона, выделенных Т-лимфоцитами, которые инкубировали в присутствии декзосом,содержащих пептиды, или контрольных декзосом. Дендритные клетки (2 х 106/мл) инкубировали в течение 3-12 ч либо в присутствии 10 мкг/мл антигенного пептида MART-1/MelanА(27-35), либо в присутствии 10 мкг/мл пептида gp100(280-288)(контроль) в виде суспензии в растворе лимонной кислоты с рН=3,7, после чего выделяли декзосомы. Клетки клона LT12 (клон клеток CTL,ограниченный HLA-A2, специфический кMART-1(27-35) инкубировали (по 100000 CTL на лунку) с возрастающими количествами декзосом или пептидов gp100 (контроль) на 96 луночных плашках в течение 5 дней. Выделение гамма-интерферона клетками затем определяли с помощью твердофазного иммуноферментного анализа (Genzyme). Фиг. 12. Анализ путем вестерн-блоттинга маркеров, присутствующих в декзосомах (1,4 и 10 мкг), продуцированных дендритными клетками, происходящими от костного мозга: Н-2 Кin vivo декзосом на модель опухоли мастоцитомы (Р 815).Dex-H2d-AEP-P815: декзосомы, происходящие от дендритных клеток костного мозга,содержащие кислотный пептидный элюат опухоли Р 815. Dex-H2d-AEP селезенок: декзосомы,происходящие от дендритных клеток костного мозга, содержащие кислотный пептидный элюат селезенки. Фиг. 14. Противоопухолевое воздействиеin vivo декзосом, происходящих от дендритных клеток костного мозга, содержащих кислотный пептидный элюат опухоли, на модели опухоли груди (TS/A). (Cм. фиг. 13.)(А): Эксперимент, осуществляемый на иммунокомпетентных мышах. (В): Эксперимент,осуществляемый на мышах Nude. Фиг. 15. Тест высвобождения радиоактивного хрома (51Cr). Этот тест позволяет показать, что декзосомы согласно изобретению вызывают in vivo специфический ответ CTL. Клетки-мишени: 32 Р 815, лейкозная линия L1210, линия YAC, нечувствительная к клеткам NK. Фиг. 16. Сравнительная эффективность декзосом и дендритных клеток. Эта фигура показывает, что декзосомы являются более эффективными, чем незрелые дендритные клетки, от которых они происходят,для удаления in vivo развившихся опухолей. 5000000 дендритных клеток, содержащих кислотный пептидный элюат селезенкиили опухоли Р 815 вводили внутривенно или внутрикожно мышам, имеющим развившиеся опухоли Р 815 в день 8-10. Параллельно супернатант этих клеток после инкубации в течение 18 ч объединяли с пептидами селезенкиили опухоли Р 815 , ультрацентрифугировали и характеризовали в отношении содержания в нем декзосом. 5000000 дендритных клеток позволили получить 5-10 мкг декзосом, которые позволили иммунизировать 5 мышей путем внутрикожного введения в ipsi-латеральную сторону. Единственное введение декзосом осуществляли в день 8-10. Размер опухолей определяли два раза в неделю, и он представлен на фигуре. Знакипредставляют собой результаты, означающие 95% согласно точному методу Фишера,по сравнению с инъекциями солевого (физиологического) раствораили пульсирующих дендритных клеток. На вставке представлены проценты мышей, иммунизированных против Р 815, показывающие полное отсутствие (исчезновение) опухоли в течение (день 21) и по окончании (день 60) эксперимента в различных группах по пять мышей. Фиг. 17. Очистка декзосом путем электрофореза в жидкой фазе. Примеры 1. Продукция текзосом, осуществляемая линиями опухолевых клеток человека и мыши. Этот пример иллюстрирует способность опухолевых клеток продуцировать липидные везикулы. Мышиные или человеческие опухолевые клетки, происходящие от лейкемий или твердых опухолей (почки или меланомы ободочной кишки, см. таблицу), инкубировали в течение 24 ч при плотности один миллион клеток на миллилитр. Культуральную среду (среда RPMI, содержащая 10% зародышевой телячьей сыворотки) затем освобождали от клеток путем центрифугирования при ускорении 300 g в течение 10 мин. Клеточные остатки затем удаляли путем двух последовательных центрифугирований в течение 15 мин, каждое при ускорении 800 g (и путем возможного центрифугирования в течение 30 мин при ускорении 10000 g). Наконец, текзосомы получали путем центрифугирования в течение 60 мин при ускорении 100000 g, затем промывали один раз с помощью PBS в тех же условиях. Концентрацию протеинов в препаратах текзосом определяли по методу Bradford 33 Все испытуемые, человеческие и мышиные, опухолевые линии (твердые или гематопоэтические, первичные, или установленные в культуре, или происходящие от свежих диссоциированных опухолей) продуцируют текзосомы (таблица). Однако эффективность продукции различна в различных линиях. Линии мышиных опухолевых клеток продуцируют 100200 мкг протеинов текзосом на 50 миллионов клеток за 24 ч. Человеческие линии меланомы и нефромы продуцируют 10-100 мкг протеинов текзосом на 20 миллионов клеток за 24 ч. 2. Везикулы, продуцируемые опухолевыми клетками, имеют эндоцитическое происхождение. Для того чтобы определить, имеют ли очищенные везикулы из супернатантов линий опухолевых клеток эндоцитическое происхождение, авторы осуществляли морфологическое исследование под электронным микроскопом одной из этих опухолевых линий, TS/A (линия карциномы молочной железы мыши; Nanni P. и др. "TS/A: a new metastasizing cell line originatefrom a BALB/c spontаneous mammary adenocarcinoma", Clin. Exp. Mеtastasis, 1, 373-380 [1983]). Опухолевые клетки фиксировали и подготавливали для электронной микроскопии, как описано выше. Текзосомы прямо помещали на сетку и анализировали. На фиг. 1 А представлены примеры внутриклеточных компартментов мультивезикулярного характера, наблюдаемые в опухолевых клетках. Эти эндоцитические компартменты имеют диаметр 200-300 нм (черточка внизу рисунков А и В означает 200 нм) и образованы наружной мембраной,окружающей многочисленные внутренние везикулы диаметром 68-80 нм. Препараты текзосом содержат мажорную популяцию везикул диаметром 60-80 нм (фиг. 1 В), в некоторых случаях агрегированных, и имеют морфологию, подобную внутренним везикулам мультивезикулярных эндосом, наблюдаемых внутри клеток (фиг. А). Эти результаты наводят на мысль, что текзосомы секретировались во внеклеточную среду после слияния наружной мембраны эндосом с цитоплазматической мембраной. В самом деле, такие профили экзоцитоза наблюдали в этих клетках (данные не представлены). Для того чтобы определить, имеют ли текзосомы действительно эндоцитическое происхождение, затем осуществляли анализ путем вестерн-блоттинга маркеров, находящихся, как определено ниже, в текзосомах, происходящих от опухолевых линий, TS/A и Р 815 (мастоцитома; согласно данным Т. Boon, Ludwig Institute,Брюссель, Бельгия) (мышиная мастоцитома). Для этого 2 мкг протеинов текзосом или клеточный лизат из 200000 клеток TS/A разделяли на полиакриламидном геле, затем переносили на мембрану из найлона (Amersham). Возможное наличие различных маркеров затем опреде 002827I главного комплекса гистосовместимости, а также различные маркеры эндоцитического пути (рецептор трансферина, лизосомные протеины Lamp 1 и 2) (фиг. 1 А). Напротив, характерный маркер эндоплазматического ретикулюма(ЭР), кальнексин, не присутствует в препаратах текзосом, что говорит о том, что мембраны ЭР не включаются в состав текзосом. 3. Текзосомы, продуцируемые линией меланомы, содержат опухолевый цитозольный антиген. Эти результаты показывают, что секретируемые опухолевыми клетками текзосомы соответствуют внутренним мембранам мультивезикулярных эндосом. Однако эти внутриэндосомальные везикулы образуются путем инвагинации, затем отпочковывания от наружной мембраны эндосом вторичных мембран во внутреннюю часть эндосомы. Эти внутриэндосомные везикулы и, следовательно, текзосомы, должны содержать цитозольную часть. Это особенно важно в рамках противоопухолевой иммунотерапии, так как некоторое количество опухолевых антигенов, включая MART-1 (один из наиболее изученных), представляет собой цитозольные протеины. Следовательно, тестировали наличие MART-1 в текзосомах. Для этого 10 мкг протеинов текзосом или клеточного лизата из 200000 клеток линии меланомы человека (М 10; Т. Boon, Ludwig Institute, Брюссель, Бельгия) анализировали путем вестерн-блоттинга, как указано выше. Возможное присутствие MART-1 затем обнаруживали с помощью специфического антитела антиMART-1 (S. Rosenberg, NCI, Bethesda, USA). Текзосомы, секретируемые опухолевой линиейMART-1. Эксперименты по защите в отношении протеиназы К (Sigma) показали, что эпитопMART-1, распознаваемый этим моноклональным антителом, находится внутри текзосом (результаты не представлены). Эта первая часть работы показывает, что опухолевые клетки продуцируют и секретируют везикулы; эти везикулы представляют собой везикулы эндосомного происхождения, включающие наружную мембрану, где находятся различные мембранные молекулы (класса I CMH, различные маркеры эндосом); эти везикулы содержат цитозольную часть,включающую цитозольные опухолевые антигены, такие как MART-1. Эти результаты привели к подтверждению следующих видов биологической активности везикул, называемых текзосомами. 4. Текзосомы могут стимулировать Тлимфоциты CD8 in vitro. 35 Так как текзосомы содержат молекулы класса I на своей поверхности, тестировали их способность к стимуляции Т-лимфоцитов CD8. Использовали два Т-клона, LT8 и LT12, предоставленные Faure F., Институт Пастера, Париж,Франция, распознающие пептид, происходящий от MART-1, в ассоциации с HLA-A2 (Dufour и др., 1997). С этой целью, так как опухолевые клетки FON представляют собой HLA-A2, клетки Т-клонов LT8 и LT12 инкубировали с текзосомами, полученными из супернатантов FON,или, в качестве положительного контроля, с интактными клетками FON. Активацию Тлимфоцитов определяли по выделению TNF. Текзосомы FON индуцировали дозозависимое выделение TNF клетками LT8 и LT12 (фиг. 3). Клетки FON также индуцировали секрециюTNF, тогда как текзосомы, происходящие от опухолевых клеток, не экспрессирующихMART-1, не индуцировали секрецию TNFHLАА 2/пептид MART-1 находятся на поверхности текзосом. Подобные результаты получали на мыши с Т-лимфоцитами селезенки мыши, иммунизированной -галактозидазой (-gal). Текзосомы получали из супернатантов клеток мастоцитомы Р 815 или клеток Р 815, экспрессирующих -gal (линии A. Albina, InstitutGustave Roussy, Villejuif, France), или клеток другой опухоли (L1210) (мышиный лейкоз Н 2), не экспрессирующих -gal, L210. Возрастающие концентрации (от 0,3 до 20 мкг/мл) этих различных препаратов текзосом затем инкубировали в течение 4 дней с клетками селезенки мышей, иммунизированных -gal, экспрессируемой рекомбинантным аденовирусом. Сами текзосомы клеток Р 815 (при наиболее высокой концентрации 20 мкг/мл), экспрессирующих gal, индуцировали значительную пролиферацию(определяемую за счет включения тритиированного тимидина; см. фиг. 4), хотя мало интенсивную, клеток селезенки. Эти результаты показывают, что текзосомы, продуцируемые клетками Р 815, экспрессирующими -gal, содержат на своей поверхности комплексы H2/пeптиды,происходящие от -gal, и способны активировать мышиные Т-лимфоциты. 5. Текзосомы могут высвобождать цитозольные антигены, которые они содержат в антигенпредставляющих клетках, для представления Т-лимфоцитам. Для этой цели использовали Т-клоны LT8 иLT12, специфически распознающие пептид, происходящий от MART-1 (MART-127-25=AAGIGILTV,Dufour E. и др., "Diversity of the cytotoxic melanoma-specific immune response", J. Immunol, 158,3787-3795 [1997]), в ассоциации с HLA-A2. Показано, что текзосомы, продуцируемые линией меланомы человека FON (которая представляетMART-1 (см. фиг. 2) и способны непосредственно активировать клоны LT8 и LT12. Для того чтобы иметь в распоряжении текзосомы, содержащие также MART-1, но неспособные непосредственно стимулировать клоны LT12 и LT8,использовали линию меланомы MZ2 (Т. Boon,Ludwig Institute, Брюссель, Бельгия), положительный MART-1, но выражающую другой элемент рестрикции, чем HLA-A2 (в данном случаеHLA-A1). В самом деле, клетки MZ2, так же как текзосомы, происходящие от этих клеток, не активируют клоны LT8 и LT12 (результаты не представлены), в противоположность клеткамFON и текзосомам, происходящим от этих клеток (фиг. 3). Напротив, когда эти же самые текзосомы, происходящие от MZ2, инкубировали в присутствии дендритных клеток, экспрессирующих HLA-A2, наблюдали стимуляцию Тклонов LT12 и LT8, как в случае текзосом, происходящих от FON (фиг. 5). В случае текзосом, происходящих от MZ2,не может происходить активация Т-клонов, возникающая за счет комплексов HLA-A2/пептид,происходящих от предварительно существующих MART-1, так как они не экспрессируют адекватный элемент рестрикции (HLA-A2). Следовательно, речь может идти только об антигене, содержащемся в текзосомах, который продуцирован антигенпредставляющими клетками, разложен на пептиды, которые затем ассоциировались с молекулами HLA-A2 представляющей клетки. Текзосомы, следовательно,позволяют осуществлять перенос антигена между опухолевой клеткой и клеткой, представляющей антигены. Следовательно, текзосомы обладают функцией, подобной таковой "природных липосом". 6. Текзосомы индуцируют регрессию развившихся твердых опухолей in vivo. Наконец, так как текзосомы способны стимулировать Т-лимфоциты in vitro и сенсибилизировать дендритные клетки для активации специфических к опухолям Т-лимфоцитов, тестировали противоопухолевую активность текзосом in vivo. Для анализа такой противоопухолевой активности мышам инъецировали в бок два раза(105) минимальную дозу онкогена опухолевых клеток опухоли молочной железы (клетки TS/A гаплотипа H2d, сингенные клеткам BALB/c). Спустя 3 или 4 дня животным, имеющим развившиеся опухоли, инъецировали два раза (день 3 и 4) текзосомы, полученные из супернатантов клеток TS/A, или, в качестве отрицательного контроля, текзосомы клеток МС 38 (S. Rosenberg, NCI, Bethesda, USA; опухолевая клетка гаплотипа H2b) или подобный объем PBS. Средний размер опухолей в группе мышей, инокулированных препаратами текзосом TS/A, сильно сократился по сравнению с группами контрольных мышей. Этот противоопухолевый эффект 37 зависит от Т-клеток, так как мыши Nude (мутантные мыши, лишенные Т-лимфоцитов), несущие опухоль и инокулированные подобным образом препаратами текзосом, не показывают уменьшения опухолевой массы (фиг. 6 В). В этой же самой серии экспериментов наблюдали противоопухолевый эффект текзосом,полученных из клеток мастоцитомы Р 815 гаплотипа H2d, который позволяет полагать, что эти две опухоли выражают общие антигены. Подобные результаты получали с другой, очень иммуногенной моделью опухоли, мастоцитомы Р 815 (сингенная мыши DBA/2 и гаплотипа Н 2d). На этой модели показано, что текзосомы, инъецируемые внутрикожно в бок мыши, несущей опухоли, установленные на 10-й день (опухоль размером 80-100 мм 2), обладают способностью приводить к удалению опухоли более чем в 60% случаев. Более того, эти мыши длительное время обладают противоопухолевым иммунитетом(результаты не представлены). В этой серии экспериментов наблюдали противоопухолевые эффекты текзосом, полученных из лимфоцитовL1210, выделенных из клеток лейкемии мышей гаплотипа Н 2d и клеток TS/A, что указывает на то, что общие эпитопы существуют также между этими тремя опухолями (между Р 815 и TS/A,мутированный р 53 является общим для обеих опухолей). Могут существовать два механизма противоопухолевого эффекта текзосом. Прежде всего, инъецированные один раз текзосомы могут активировать непосредственно Т-лимфоциты хозяина, специфические к опухоли. Таким образом, может иметь место клональная экспансия Т-лимфоцитов, специфических к опухоли, или "priming" Т-клеток. Вторая гипотеза предполагает прямое взаимодействие инъецированных текзосом с дендритными клетками хозяина. В этом случае возможна стимуляция противоопухолевого ответа. Для тестирования этой второй гипотезы наблюдали за ростом опухолей у мышей, инъецированных внутривенно с помощью дендритных клеток, происходящих от костного мозга, содержащих текзосомы опухолевых клеток. Мышам DBA/2 (IFFA CREDO,Орлеан, Франция) также вводили путем инъекции два раза (50 х 105) минимальную дозу онкогена клеток мастоцитомы Р 815. Спустя десять дней каждому животному инъецировали 5x105 дендритных клеток, содержащих, и тем самым сенсибилизованных, 9 мкг текзосом. Средний размер опухолей в этих условиях значительно уменьшается по сравнению с группами мышей,инъецированных с помощью PBS или с помощью дендритных клеток, содержащих текзосомы клеток контрольной опухоли МС 38. В самом деле, более 60% обработанных животных в конце эксперимента больше не имеют опухоли. Более того, в течение длительного периода времени не наблюдали рецидивов (в 80-100% случаев). Представляет интерес констатация того, 002827 38 что такая субоптимальная доза текзосом, инъецированная внутрикожно, не оказывает действия, что наводит на мысль о том, что дендритные клетки могут продуцировать декзосомы,содержащие опухолевые антигены, намного более эффективно, чем дендритные клетки дермы или клетки Лангерганса. Подобные результаты получили с моделью клеток опухоли молочной железы TS/A. Результаты, полученные в рамках изобретения, показывают, что текзосомы эффективно сенсибилизируют дендритные клетки. Эти клетки, сенсибилизованные таким образом, обладают способностью индуцировать интенсивные противоопухолевые ответы in vivo в случае различных опухолей. Эти результаты наводят на мысль о том, что противоопухолевые эффекты,наблюдаемые после прямой инокуляции текзосом in vivo, возникают вследствие сенсибилизации дендритных клеток хозяина. Примечательно,что эффект наблюдали после одноразовой инъекции сенсибилизированных дендритных клеток. Большинство обработанных мышей показывают полную регрессию опухоли, или пролонгированное выживание (60 дней против 20 дней в случае контроля) вследствие регрессии опухоли. Метод сенсибилизации представляющих клеток согласно изобретению обладает различными преимуществами по отношению к методам уровня техники:i) он не требует предварительного распознавания опухолевых антигенов; это особенно важно, так как опухолевые антигены в огромном большинстве опухолей неизвестны;ii) способ согласно изобретению может быть применен к любой опухоли, продуцирующей текзосомы; на более чем пятнадцать линий опухолевых клеток, тестированных на сегодняшний день, только одна не продуцирует текзосомы (одна из шести тестированных линий меланомы);iii) этот метод не зависит от гаплотипа СМН пациента и опухолевых клеток, так как опухолевые антигены, присутствующие в текзосомах, снова продуцируются и представляются Т-лимфоцитам молекулами СМН антигенпредставляющих клеток пациента;iv) способ согласно изобретению, в принципе, может быть эффективно использован в случае опухолей различного происхождения,так как существуют общие опухолевые антигены не только в особом типе опухоли (например,MART-А в меланоме), но и также общие антигены в совершенно различных опухолях (как молекулы, принимающие участие в онкогенезе,например р 53);v) использование текзосом также может оказаться эффективным при лечении опухолей,экспрессирующих незначительные количества молекул класса I СМН или совсем их не экспрессирующих (эти опухоли представляют 4050% метастазирующих онкологических заболе 39 ваний человека). В самом деле, текзосомы позволяют осуществлять перенос интактных антигенов между опухолевыми клетками и дендритными клетками, причем эти антигены затем представляются Т-лимфоцитам молекулами СМН дендритной клетки. Предварительные результаты показывают, что текзосомы позволяют индуцировать удаление опухолей мыши, экспрессирующих незначительные количества молекул класса I СМН (как МСА 101; S. Rosenberg, NCI,Bethesda, USA). Это, вероятно, происходит вследствие того, что степени экспрессии молекул СМН, необходимые для индуцирования эффективного иммунного ответа, намного более высокие, чем таковые, требующиеся во время эффекторной фазы (клеточная цитотоксичность);vi) взятые индивидуально текзосомы за счет своей иммуногенной способности сами по себе представляют собой новую и эффективную форму профилактической или терапевтической вакцинации. 7. Дендритные клетки продуцируют иммуногенные мембранные везикулы (декзосомы). Этот пример показывает, что дендритные клетки продуцируют мембранные везикулы и что эти везикулы представляют собой иммуногенные везикулы, эффективные для противоопухолевой иммунизации. Эти везикулы являются особенно предпочтительными, так как они позволяют избегать стадии инъекции in vivo целых дендритных клеток, от которых они происходят. Терапия дендритными клетками не дает ни достоверности стабильного фенотипа инъецированной клетки, ни однородности используемых клеточных композиций. Введением стабильного продукта, секретируемого этими клетками, то есть вышеуказанных мембранных везикул, дают носителю опухолей гарантию эффективности и иммунизирующей силы. В этом примере дендритные клетки, происходящие от костного мозга за счет обработки в течение 5 дней в виде GM-CSF + IL-4 (Mayordomo и др., 1995), инкубировали в течение 3 ч с экзосомами опухолевых клеток. Таким образом сенсибилизированные клетки затем культивировали в кислой среде в течение 18 ч (чтобы стимулировать продукцию везикул), после чего везикулы выделяли и собирали согласно методике, описанной в примере 1. Для определения их иммуногенной способности эти везикулы затем инкубировали in vitro с цитотоксическими, специфическими к антигену MART-1 Тлимфоцитами. Представленные на фиг. 9 результаты показывают, что 0,6 мкг этих мембранных везикул, называемых DexTexFON (то есть декзосома, происходящая от дендритных клеток, инкубированных с текзосомами, происходящими от опухолевых клеток FON), позволяют стимулировать непосредственно пролиферацию и выделение IFN клонами LT8, специфическими к MART-1, и это то, чего нельзя дос 002827 40 тичь с помощью 0,6 мкг декзосом, происходящих от дендритных клеток, инкубированных с текзосомами опухолевых клеток NUN: DexTexNUN (причем NUN представляет собой опухоль почки, HLA-A2-, MART-1-). Эти результаты,следовательно, показывают, что дендритные клетки продуцируют мембранные везикулы и что эти мембранные везикулы представляют собой сильный иммуноген. Кроме того, представленные на фиг. 9 С результаты показывают, что неожиданно процесс продукции декзосом дендритными клетками является регулируемым процессом, который может быть стимулирован в присутствии некоторых цитокинов, таких как IFN- и IL-10. Таким образом, полученные результаты показывают, что IFN- или IL-10 значительно увеличивают (примерно в 5 раз) продукцию декзосом. Сравнимые результаты получают с помощьюIL-12. 8. Характеризация мембранных везикул,продуцируемых дендритными клетками. Способность дендритных клеток продуцировать мембранные везикулы, прежде всего,была подтверждена при использовании дендритных клеток, получаемых из человеческих предшественников-моноцитов, и линии мышиных дендритных клеток D1. Клеточная линия D1 и условия созревания этой линии описаны Winzler и др. (J. Exp. Med.,185, 317 [1997]). Дендритные клетки, происходящие от человеческих предшественников-моноцитов, получали из адгезивной фракции мононуклеарных клеток, выделяемых от здоровых людей, инкубировали в течение 7-8 дней в среде AIMV, содержащей L-Glu, антибиотики, 1000 МЕ/млrhGM-CSF и rhIL-4 (Schering Plough, Kenilworth,NJ, USA). После культивирования в течение 8 дней слабоадгезивные клетки и суспендированные клетки имеют типичную морфологию дендритных клеток, экспрессирующих большие количества молекул СМН класса I и II, так же какCD40 и CD86. Большая часть этих клеток положительна для CD1a и CD11b и отрицательна дляCD2, CD3, CD14, CD19 и CD83. Анализы этих клеток, сделанные с помощью микроскопии, показали присутствие мембранных везикул, обогащенных молекулами СМН классов I и II. Эти везикулы выделяли путем центрифугирований и анализировали с помощью иммуноэлектронной микроскопии. Более конкретно, супернатанты культур дендритных клеток объединяли, центрифугировали при ускорении 300 g в течение 20 мин, затем при ускорении 10000 g в течение 30 мин при температуре 4 С, для удаления клеток и клеточных остатков. Декзосомы затем выделяли путем центрифугирования при ускорении 100000 g в течение 1 ч при температуре 4 С, затем путем промывки в забуференном фосфатом физиоло 41 гическом растворе в тех же условиях (центрифугирование при ускорении 100000 g в течение 1 ч при температуре 4 С). Концентрацию протеинов в препаратах декзосом определяли по методу Bradford (BioRad Protein Assay[BioRad]). Полученные результаты показывают (фиг. 10) однородную популяцию везикул, имеющих диаметр около 60-90 нм. Кроме того, более 95% декзосом маркированы антителами к CD63,CD82, MHC-I и МНС-II. Эти результаты подтверждают, что дендритные клетки продуцируют мембранные везикулы, содержащие антигенпредставляющие молекулы, а также молекулы лимфоцитарной костимуляции. 9. Декзосомы представляют антигены в рамках ограниченного MHC-I. Одна из предпочтительных характеристик декзосом состоит в присутствии молекул СМН класса I. Эти молекулы в действительности необходимы для генерации эффективной клеточной реакции и в частности для активации и размножения клеток CTL. Следовательно, тестировали способность декзосом стимулировать лимфоциты CD8+ и тестировали специфический характер полученных лимфоцитов. Для этого дендритные клетки, полученные из человеческих предшественников-моноцитов(от индивидуума HLA-A2), сначала сенсибилизировали с помощью "peptide pulsing" с особым антигеном. С этой целью клетки (2 х 106/мл) инкубировали в течение 3-12 ч либо в присутствии 10 мкг/мл антигенного пептида MART1/MelanA(27-35), либо в присутствии 10 мкг/мл пептида gp100(280-288) (контроль) в виде суспензии в растворе лимонной кислоты с рН=3,7. После этой стадии сенсибилизации декзосомы выделяли, как описано в примере 1. Клетки клонаLT12 (клон CTL, ограниченный HLA-A2, специфический к MART-1(27-35 затем инкубировали с возрастающими количествами декзосом или пептидов gp100 (контроль) на 96-луночных плашках в течение 5 дней. Выделение гаммаинтерферона клетками затем определяли методом твердофазного иммуноферментного анализа (Genzyme). Как показано на фиг. 11, декзосомы, несущие пептид MART-1, способны стимулировать дозозависимую продукцию гамма-интерферона клоном LT12. Напротив, декзосомы, полученные из дендритных клеток, "пульсированных" контрольным пептидом gp100, не оказывают никакого стимулирующего воздействия на этот клон. Эти результаты подтверждают, что молекулы СМН-1, экспрессированные декзосомами согласно изобретению, являются функциональными. 10. Декзосомы блокируют рост опухоли in 42 Этот пример показывает способность декзосом согласно изобретению индуцировать иммунный ответ in vivo и, более конкретно, индуцировать пролиферацию специфических к опухоли Т-клеток. В дендритные клетки, получаемые из костного мозга, вводили кислотный элюат опухоли, включающий различные антигенные опухолевые пептиды. Методика получения и сенсибилизации дендритных клеток описана Zitvogel и др. (1996). На фиг. 12 представлены маркеры,выражаемые декзосомами, продуцированными этими дендритными клетками. Как указано выше, на этой фигуре показано присутствие в большом количестве молекул СМН класса I и класса II, а также маркеров CD86 и рецептора трансферрина. Напротив, хотя они появляются в клеточных лизатах, маркеры Н 2-М, Ii и кальнексин не поддаются обнаружению в экзосомальных препаратах. Были выбраны две экспериментальные модели опухолей для тестирования противоопухолевых свойств in vivo декзосом согласно изобретению. Первая модель, Р 815, представляет собой агрессивную сингенную мастоцитомуDBA/2 (H2d), в случае которой очень мало эффективных лечений было проведено на опухолях, установленных в день 10. Моделью TS-A является слабоиммуногенная, спонтанная карцинома молочной железы, экспрессирующая очень незначительные количества молекул СМН класса I, сингенная BALB/c (Н 2d). Опухолевые пептиды опухолей Р 815 или TS/A, выделенные путем кислотной обработки, вводили в сингенные дендритные клетки, происходящие от костного мозга, как указано выше. Декзосомы затем получали из супернатантов этих дендритных клеток и использовали для иммунизации in vivo. Мыши и опухолевые клеточные линии Самок мышей DBA/2J (H2d) и BALB/c(H2 ), в возрасте от шести до восьми недель,приобретали в Laboratoire Iffa Credo, Лион,Франция, и содержали в непатогенных условиях.TS/A была предоставлена Guido Forni (Центр иммуногенетики и гистосовместимости, Турин,Италия). Все опухолевые линии хранили в среде(Gibco BRL), 2 ммоль L-глутамина, 100 Ед./мл пенициллина, 100 мг/мл стрептомицина, аминокислот и пирувата. Эта среда также в дальнейшем обозначается как среда СМ. Протокол и результаты Два раза минимальную онкогенную дозу опухолевых клеток (5x105 P815; 105 TS/A) инокулировали внутрикожно в верхнюю область правого бока мышей DBA/2 и BALB/c соответственно. Животных,имеющих трех 43 четырехдневные опухоли TS/A или шестидесятидневные опухоли P815, затем иммунизировали путем одноразовой внутрикожной инъекции 3-5 мкг декзосом в нижнюю часть ipsiлатеральной боковой поверхности. Эти процедуры осуществляли подобным образом сразу в случае иммунокомпетентных животных и в случае "голых" мышей. Одноразовую терапевтическую инъекцию осуществляли в случае каждой мыши. Размер опухолей контролировали два раза в неделю и мышей умерщвляли, когда они имели изъязвленные опухоли или слишком большой размер. Каждую серию экспериментов проводили два-три раза, используя группы по пять мышей для каждой индивидуальной обработки. Полученные результаты представлены на фиг. 13. Как видно из фиг. 13 В, обработку опухолей Р 815, установленных в день 10 (имеющих размер 50-90 мм 2), осуществляли путем одноразового введения внутрикожно 3-5 мкг декзосом на мышь. За неделю рост опухоли прекращался в группах, получивших декзосомы, происходящие от дендритных клеток, содержащих аутологичный опухолевый пептид, и у 40-60% мышей опухоли исчезали полностью в день 60. Эти животные, кроме того, обладают долговременной иммунной реакцией и отторгали дополнительную инъекцию Р 815, обычно летальную для необработанных мышей. Однако эти мыши не защищены против инъекции сингенного лейкозного клона L1210, что хорошо показывает иммуноспецифический характер достигаемого эффекта. Наконец, группы мышей, иммунизированных с помощью контрольных декзосом (содержащих пептиды селезенки мыши) не проявляют никакого противоопухолевого эффекта, так же как необработанные мыши. Эти результаты, следовательно, показывают, что декзосомы, содержащие опухолевые пептиды согласно изобретению, способны индуцировать регрессию опухоли in vivo. Подобные противоопухолевые эффекты были достигнуты на модели опухоли TS/A,включающей опухоли, установленные в дни 3/4. В этой серии экспериментов все мыши проявляли статистически значительное торможение роста опухоли, которое продлевало их выживание (фиг. 14). Этот противоопухолевый эффект не наблюдали у атимических мышей Nu/Nu, как показано на фиг. 14 В, что, в свою очередь, показывает, что наличие Т-клеток необходимо для экспрессии противоопухолевого эффекта декзосом согласно изобретению. Кроме того, следующий эксперимент показывает, что декзосомы непосредственно стимулируют CTL-специфический ответ у животных,имеющих опухоль Р 815. Спленоциты мышей,отторгающие опухоли Р 815 после иммунизации с помощью декзосом, выделяли в день 90 и культивировали в течение 5 дней в присутствии облученных клеток Р 815, экспрессирующих антиген В 7.1, для повышения частоты специфи 002827 44 ческих предшественников. Эти эффекторные клетки тестировали в опыте по высвобождению хрома против (i) аутологичных опухолевых клеток Р 815 (H2d); (ii) неродственных клеток L1210 и (iii) клеток YAC. Наблюдали значительную специфическую цитологическую активность против клеток Р 815 в спленоцитах мышей, иммунизированных декзосомами (фиг. 15). Интересно отметить, что ни одна из селезенок мышей, спонтанно отторгающих опухоль Р 815 или имеющих опухоли Р 815, не проявляет этой цитолитической активности в тех же условиях. Эти результаты показывают, что одноразовая инъекция декзосом согласно изобретению, происходящих от дендритных клеток, сенсибилизированных с помощью антигена или соответствующих антигенных пептидов, способна эффективно вызывать CTL-специфический противоопухолевый ответ in vivo. Для определения того, ограничен ли декзосомами c главным комплексом гистосовместимости иммунный и противоопухолевый ответ,индуцированный, а не просто проявляющийся вследствие прямого воздействия опухолевых пептидов, в дендритные клетки, происходящие от мышей Н 2d (DBA/2) или H2b (C57BL/6), параллельно вводили опухолевые пептиды, выделенные из опухоли Р 815. Декзосомы, продуцируемые этими дендритными клетками мышей,затем выделяли и использовали отдельно для прямых внутрикожных инъекций мышамDBA/2, несущим опухоли Р 815, установленные в день 6/10. Как показано на фиг. 13 В, сами декзосомы,содержащие сингенные опухолевые пептиды,представляют собой эффективные противоопухолевые вакцины (индуцирующие у 60% мышей исчезновение опухоли), тогда как декзосомы аллогенных дендритных клеток практически не индуцируют никакого противоопухолевого эффекта. Эти результаты указывают, что декзосомы согласно изобретению индуцируют противоопухолевый ответ in vivo, ограниченный МНС. Эксперименты, подобные описанным выше, реализовали путем осуществления не внутрикожных, а внутривенных инъекций. Полученные результаты представлены на фиг. 16. Прежде всего, они показывают регрессию опухоли вследствие внутривенной инъекции декзосом. Кроме того, эти результаты показывают, что декзосомы более эффективны, чем дендритные клетки, от которых они происходят, для удаления опухолей in vivo. Эти результаты, следовательно, иллюстрируют замечательные и неожиданные свойства декзосом. Вышепредставленные результаты, следовательно, показывают, что незрелые, человеческие или мышиные, дендритные клетки выделяют декзосомы, что эти декзосомы содержат не только молекулы главного комплекса гистосовместимости (СМН) класса II, но и также СМН класса I, 45 а также костимулирующие молекулы, и, наконец,что эти декзосомы являются иммуногенными и индуцируют регрессию опухолей in vivo. Декзосомы могут быть получены в относительно больших количествах (1 мкг на миллион дендритных клеток за 18 ч согласно тесту Bradford) из культуральной среды дендритных клеток (дендритные клетки, происходящие от костного мозга в присутствии GM-CSF + IL-4, линии дендритных клеток D1 или дендритные клетки,происходящие от человеческих предшественников-моноцитов, выделенных из мононуклеарных клеток периферической крови). Декзосомы охарактеризованы в морфологическом и биохимическом плане. Мембранные везикулы, проанализированные путем иммуноэлектронной микроскопии, представляют собой однородную популяцию везикул, имеющих диаметр около 60-90 нм. Декзосомальные препараты, очевидно,лишены ретровирусов, плазматических мембран, микросомальных компонентов или апоптотических тел. Декзосомы суперэкспрессируют в большом количестве молекулы СМН класса II,класса I, CD63 и CD86 по сравнению с плазматическими мембранами. В декзосомах не обнаружено компартментов, происходящих от эндоплазматического ретикулюма, при анализе путем вестерн-блоттинга с использованием антител к кальнексину. Запрограммированная гибель клеток не была выявлена в этих культурах при использовании различных условий. Интересно отметить, что продукция этих везикул является регулируемым процессом. Количество везикул,по-видимому, может быть уменьшено за счет индуцирования созревания дендритных клеток,как определено путем теста Bradford, вестернблоттинга и иммуноэлектронной микроскопии. Более того, уровень секреции этих везикул может быть значительно улучшен путем снижения значения рН культуральной среды, или путем инкубирования клеток в присутствии некоторых цитокинов, или обработкой дендритных клеток путем облучения. Это явление оказывается особенно неожиданным в силу того, что незрелые дендритные клетки обычно рассматриваются как обладающие слабой способностью презентации антигена и, следовательно, слабой иммунологической активностью. Представленные результаты показывают, что это дендритные клетки, незрелые на этой стадии, которые обладают свойством эффективно продуцировать декзосомы. Представленные результаты, наконец, показывают, что эти декзосомы способны вызывать ответ за счет Т-клеток, эффективных сразу in vitro и in vivo, и что они также способны индуцировать регрессию опухоли in vivo. Эти везикулы, следовательно, являются "кандидатами", особенно привлекательными для иммунотерапевтических подходов при использовании неклеточной системы. 11. Очистка экзосом путем электрофореза в жидкой фазе. 46 В этом примере описывается использование оригинального способа очистки экзосом, базирующегося на электрофорезе в жидкой фазе. Электрофорез в жидкой фазе представляет собой препаративный метод разделения биологических соединений по их заряду. Этот метод использовали для отделения протеинов путем изоэлектрофокализации. Этот метод может обладать следующими преимуществами: это препаративный метод, позволяющий осуществлять непрерывное введение материала и, следовательно, очистку больших количеств везикул; этот метод позволяет осуществлять очистку декзосом в одну или две стадии, потенциально исключая стадии центрифугирования. Для определения, применим ли этот метод для очистки экзосом, изобретатели провели следующий эксперимент. Препарат декзосом, выделенных из супернатанта дендритных мышиных клеток путем дифференциального центрифугирования, вводили в электрофорез в жидкой стадии, в обычных условиях, описанных Amigorena и др. (Nature, 369, 113 [1994]). Объединяли сорок фракций и концентрацию протеинов в каждой из этих фракций определяли путем теста Bradford(BioRad), чтобы обнаружить присутствие декзосом. Как это показано на фиг. 17, 90% декзосом найдены сконцентрировавшимися в четырех фракциях EPF. Миграция декзосом в узком пике согласно этому методу показывает осуществляемость электрофореза как метода выделения декзосом. Список литературы (ссылки)Experimental Medicine 183, 87-97 [b]. Продукция текзосом человеческими и мышиными линиями опухолевых клеток Линии Текзосомы,опухолевых клеток мкг/2 х 107 клеток/18 ч Мышиные МСА 101 172 Р 815 163 МС 38 120 48 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Мембранная везикула, называемая декзосомой, выделенная из своего естественного окружения, отличающаяся тем, что она (i) происходит от дендритной клетки, (ii) включает билипидный слой, окружающий цитозольную часть, (iii) имеет на своей поверхности молекулы класса I и/или II главного комплекса гистосовместимости (СМН), (iv) содержит одну или несколько молекул CD63 и (v) имеет диаметр примерно от 60 до 90 нм. 2. Везикула по п.1, отличающаяся тем, что она происходит от дендритной клетки, сенсибилизированной антигеном. 3. Везикула по п.1 или 2, отличающаяся тем, что она включает, кроме того, одну или несколько молекул CD82 или CD86. 4. Везикула по любому из пп.1-3, отличающаяся тем, что она происходит от незрелой дендритной клетки. 5. Везикула по любому из пп.1-4, отличающаяся тем, что она происходит от дендритной клетки, несущей один или несколько антигенных пептидов. 6. Везикула по п.5, отличающаяся тем, что она происходит от дендритной клетки, инкубированной с везикулой, называемой текзосомой,причем указанная текзосома происходит от опухолевой клетки, включает билипидный слой,окружающий цитозольную часть, которая содержит молекулы опухолевых антигенов, и/или иммуномодуляторы, и/или хемоаттрактанты и/или гормоны, и/или нуклеиновые кислоты,имеет на своей поверхности молекулы класса I и/или II главного комплекса гистосовместимости(СМН), содержит протеин Heat Shock HSP70 и имеет диаметр примерно от 60 до 100 нм. 7. Везикула по любому из пп.1-4, отличающаяся тем, что она происходит от иммортализованной дендритной клетки. 8. Способ получения везикулы по любому из пп.1-7, включающий(i) первую стадию получения дендритных клеток или клеточной культуры, содержащей дендритные клетки, из предшественников моноцитов или костного мозга,(ii) вторую стадию сенсибилизации клеток путем введения их в контакт с пептидами, антигенами, клетками, или мембранами, или везикулами, экспрессирующими антигены или антигенные пептиды, липосомами или нуклеиновыми кислотами, которые могут быть встроены в химические или вирусные векторы, в условиях,позволяющих осуществить сенсибилизацию дендритных клеток,(iii) и третью стадию, включающую рекуперацию продуцированных дендритными клетками везикул из этих клеточных культур. 9. Способ по п.8, отличающийся тем, что первая стация включает получение незрелых 49 дендритных клеток, предпочтительно человеческих. 10. Способ по любому из пп.8 или 9,отличающийся тем, что стадия получения везикул включает первую, необязательную, стадию обработки клеток. 11. Способ по п.10, отличающийся тем, что дендритные клетки обрабатывают путем культивирования в присутствии цитокинов, благоприятствующих незрелому состоянию, путем облучения, или путем снижения значения рН культуры, или путем сочетания этих различных типов обработки. 12. Способ по п.8, отличающийся тем, что рекуперацию везикул осуществляют путем центрифугирования, электрофореза, хроматографии и/или нанофильтрации. 13. Применение декзосом по любому из пп.1-7 для стимуляции и, в случае необходимости, амплификации in vitro Т-лимфоцитов, специфических в отношении антигенов, содержащихся в вышеуказанных декзосомах, или Влимфоцитов и в частности для стимуляции и амплификации in vitro Т-лимфоцитов. 14. Применение декзосом по любому из пп.1-7 для селекции ex vivo набора Т 002827 50 лимфоцитов, способных распознавать специфические антигены, содержащиеся в вышеуказанных декзосомах. 15. Лекарственное средство, включающее в качестве действующего начала одну или несколько декзосом по любому из пп.1-7, в сочетании с фармацевтически приемлемым носителем. 16. Лекарственное средство по п.15 для лечения раковых, инфекционных и паразитарных заболеваний. 17. Лекарственное средство по п.15 или 16,отличающееся тем, что оно дополнительно включает стабилизатор. 18. Композиция, содержащая декзосомы по любому из пп.1-7 и иммуностимулирующую добавку в целях одновременного, отдельного или разделенного во времени применения. 19. Применение декзосом по любому из пп.1-7 для получения фармацевтической композиции, предназначенной для лечения рака, инфекционных и паразитарных заболеваний.
МПК / Метки
МПК: A61K 39/00, C12N 5/08
Метки: стимуляции, везикула, иммунного, ответа, экзосома, получение, применение, клеточная, называемая
Код ссылки
<a href="https://eas.patents.su/29-2827-kletochnaya-vezikula-nazyvaemaya-ekzosoma-ee-poluchenie-i-primenenie-dlya-stimulyacii-immunnogo-otveta.html" rel="bookmark" title="База патентов Евразийского Союза">Клеточная везикула, называемая “экзосома”, ее получение и применение для стимуляции иммунного ответа</a>
Предыдущий патент: Стабильные при хранении водные композиции на базе производных n-фенил-3,4,5,6-тетрагидрофталимидов
Следующий патент: Противогрибковые соединения на основе 2,4,4-тризамещенных-1,3-диоксоланов.
Случайный патент: Способ лечения кожных расстройств и удаления нежелательных волос путем облучения кожи некогерентным светом и предназначенное для этого устройство