Производные 3-циано-4-(4-фенилпиперидин-1-ил)пиридин-2-она
Номер патента: 17280
Опубликовано: 30.11.2012
Авторы: Лютьенс Роберт Иоганнес, Дювей Гийом Альбер Жак, Сид-Нуньес Хосе Мария, Трабанко-Суарес Андрес Авелино, Макдональд Грегор Джеймс
Формула / Реферат
1. Соединение формулы (I'')

включая любую его стереохимически изомерную форму, где
R1 представляет собой C4-6алкил или C1-3алкил, замещенный C3-7циклоалкилом;
R2 представляет собой водород; гидроксил; фторо; C1-4алкил, замещенный гидроксилом; C1-4алкил, замещенный фторо; или C1-4алкилокси, замещенный фторо;
R3 представляет собой водород или галогено;
при условии, что если R3 представляет собой галогено, то R2 представляет собой гидроксил,
которое не представляет собой
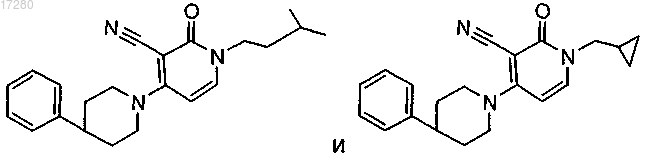
или его фармацевтически приемлемая соль либо его сольват.
2. Соединение по п.1, имеющее следующую формулу:
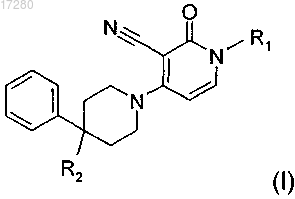
включая любую его стереохимически изомерную форму, где
R1 представляет собой C4-6алкил или C1-3алкил, замещенный C3-7циклоалкилом;
R2 представляет собой водород; фторо; C1-4алкил, замещенный гидроксилом; C1-4алкил, замещенный фторо; или C1-4алкилокси, замещенный фторо,
или его фармацевтически приемлемая соль или его сольват.
3. Соединение по любому из пп.1, 2, где R1 представляет собой 1-бутил или циклопропилметил.
4. Соединение по любому из пп.1-3, где R2 представляет собой фторо; или где R2 представляет собой C1-4алкил, замещенный гидроксилом, предпочтительно метил, замещенный гидроксилом; или где R2 представляет собой C1-4алкил, замещенный фторо, предпочтительно метил, замещенный фторо; или где R2 представляет собой C1-4алкилокси, замещенный фторо, предпочтительно этилокси, замещенный фторо.
5. Соединение по п.1, имеющее следующую формулу:
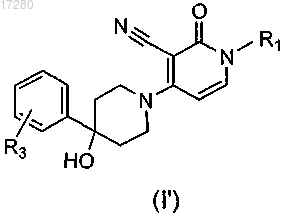
включая любую его стереохимически изомерную форму, где
R1 представляет собой C4-6алкил или C1-3алкил, замещенный С3-7циклоалкилом;
R3 представляет собой водород или галогено,
или его фармацевтически приемлемая соль или его сольват.
6. Соединение по п.5, где R3 представляет собой хлоро.
7. Соединение по п.6, представляющее собой
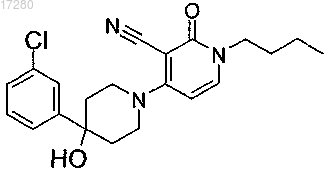
или его фармацевтически приемлемая соль либо его сольват.
8. Соединение по п.1, где R1 представляет собой 1-бутил, 3-метил-1-бутил или циклопропилметил; R2 представляет собой водород; фторо; метил, замещенный гидроксилом; метил, замещенный фторо; этилокси, замещенный фторо; или где R1 представляет собой 1-бутил или циклопропилметил; R2 представляет собой фторо; метил, замещенный гидроксилом; метил, замещенный фторо; этилокси, замещенный фторо.
9. Применение соединения по любому из пп.1-8 в качестве лекарственного средства.
10. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-8 и фармацевтически приемлемый носитель или разбавитель.
11. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства для лечения или предупреждения расстройства центральной нервной системы, выбранного из группы, состоящей из тревожных расстройств, психотических расстройств, расстройств личности, расстройств, связанных с веществами, расстройств питания, расстройств настроения, мигрени, эпилепсии или судорожных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации, нейротоксичности и ишемии.
12. Применение по п.11, где расстройство центральной нервной системы представляет собой тревожное расстройство, выбранное из группы, состоящей из агорафобии, генерализованного тревожного расстройства (GAD), обcесивно-компульсивного расстройства (OCD), панического расстройства, посттравматического стрессового расстройства (PTSD), социофобии и других фобий; или где расстройство центральной нервной системы представляет собой психотическое расстройство, выбранное из группы, состоящей из шизофрении, бредового расстройства, шизоаффективного расстройства, шизофреноформного расстройства и психотического расстройства, индуцированного веществами; или где расстройство центральной нервной системы представляет собой расстройство личности, выбранное из группы, состоящей из обcесивно-компульсивного расстройства личности и шизоидного, шизотипического расстройства; или где расстройство центральной нервной системы представляет собой расстройство, связанное с веществами, выбранное из группы, состоящей из злоупотребления алкоголем, алкогольной зависимости, алкогольной абстиненции, бреда при алкогольной абстиненции, психотического расстройства, индуцированного алкоголем, амфетаминовой зависимости, амфетаминовой абстиненции, кокаиновой зависимости, кокаиновой абстиненции, никотиновой зависимости, никотиновой абстиненции, опиоидной зависимости и опиоидной абстиненции; или где расстройство центральной нервной системы представляет собой расстройство питания, выбранное из группы, состоящей из нервной анорексии и нервной булимии; или где расстройство центральной нервной системы представляет собой расстройство настроения, выбранное из группы, состоящей из биполярных расстройств (I и II), циклотимического расстройства, депрессии, дистимического расстройства, глубокого депрессивного расстройства и расстройства настроения, индуцированного веществами; или где расстройство центральной нервной системы представляет собой мигрень; или где расстройство центральной нервной системы представляет собой эпилепсию или судорожное расстройство, выбранное из группы, состоящей из генерализованной бессудорожной эпилепсии, генерализованной судорожной эпилепсии, малого эпилептического припадка, большого эпилептического припадка, парциальной эпилепсии с нарушением сознания или без нарушения сознания, младенческих судорог, хронической прогрессирующей парциальной эпилепсии (epilepsy partialis continua) и других форм эпилепсии; или где расстройство центральной нервной системы представляет собой детское расстройство, например расстройство дефицита внимания/гиперактивности; или где расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из группы, состоящей из делирия, персистирующего делирия, индуцированного веществами, деменции, деменции вследствие ВИЧ-заболевания, деменции вследствие болезни Хантингтона, деменции вследствие болезни Паркинсона, деменции альцгеймеровского типа, персистирующей деменции, индуцированной веществами, и умеренного когнитивного нарушения; или где расстройство центральной нервной системы выбрано группы, состоящей из тревоги, шизофрении, мигрени, депрессии и эпилепсии.
13. Применение соединения по любому из пп.1-8 в комбинации с ортостерическим агонистом mGluR2 для изготовления лекарственного средства для лечения или предупреждения состояния, указанного в любом из пп.11, 12, у млекопитающего, включая человека.
14. Способ получения соединения по п.1, включающий стадии:
а) взаимодействия промежуточного соединения формулы (II), где Y представляет собой подходящую уходящую группу, с промежуточным соединением формулы (III) при нагревании, в подходящем реакционно-инертном растворителе, в присутствии подходящего основания, или взаимодействия промежуточного соединения формулы (II) с промежуточным соединением формулы (III) при нагревании, в подходящем реакционно-инертном растворителе, в присутствии подходящего основания, подходящего катализатора
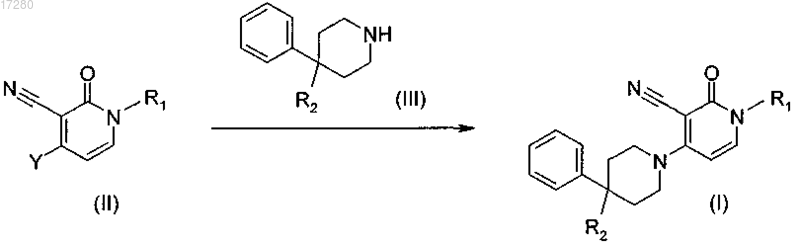
где R1 и R2 являются такими, как определено в п.1;
б) взаимодействия соединения формулы (I-b) с подходящим фторирующим агентом в подходящем реакционно-инертном растворителе при умеренно низкой температуре

где L представляет собой C1-4алкил и R1 является таким, как определено в п.1;
в) взаимодействия промежуточного соединения формулы (IV) с подходящим фторирующим агентом в подходящем реакционно-инертном растворителе при умеренно низкой температуре

где R1 является таким, как определено в п.1;
г) гидрирования промежуточного соединения формулы (XIV) в подходящем растворителе и в присутствии подходящего катализатора и подходящего основания

где R1 является таким, как определено в п.1, и R'2 представляет собой C1-4алкилокси, замещенный фторо;
и, возможно, дополнительного превращения соединений формулы (I) друг в друга; возможно, превращения соединений формулы (I) в терапевтически активную нетоксичную соль присоединения кислоты путем обработки кислотой, или превращения формы соли присоединения кислоты в свободное основание путем обработки щелочью; или, возможно, получения его стереохимически изомерных форм.
Текст
Изобретение относится к новым соединениям, в частности новым производным пиридинона формулы (I) Сид-Нуньес Хосе Мария, ТрабанкоСуарес Андрес Авелино (ES),Макдональд Грегор Джеймс (BE),Дювей Гийом Альбер Жак (FR),Лютьенс Роберт Иоганнес (CH) включая любую их стереохимически изомерную форму или их фармацевтически приемлемую соль либо их сольват, где все радикалы определены в заявке и формуле изобретения. Соединения по изобретению являются положительными аллостерическими модуляторами метаботропных глутаматных рецепторов подтипа 2 ("mGluR2"), которые полезны для лечения или предупреждения неврологических и психиатрических расстройств, связанных с глутаматной дисфункцией, и заболеваний, в которые вовлечен mGluR2 подтип метаботропных рецепторов. В частности, такие заболевания представляют собой расстройства центральной нервной системы, выбранные из группы, состоящей из тревоги, шизофрении, мигрени, депрессии и эпилепсии. Изобретение также направлено на фармацевтические композиции и способы получения таких соединений и таких композиций, а также на применение таких соединений для предупреждения и лечения таких заболеваний, в которые вовлечен mGluR2. 017280 Область изобретения Настоящее изобретение относится к новым производным пиридин-2-она, которые являются положительными аллостерическими модуляторами метаботропных глутаматных рецепторов подтипа 2("mGluR2") и которые полезны для лечения или предупреждения неврологических и психиатрических расстройств, связанных с глутаматной дисфункцией, и заболеваний, в которые вовлечен mGluR2 подтип метаботропных рецепторов. Изобретение также направлено на фармацевтические композиции, содержащие такие соединения, на способы получения таких соединений и таких композиций, и на применение таких соединений для предупреждения или лечения неврологических и психиатрических расстройств и заболеваний, в которые вовлечен mGluR2. Предшествующий уровень техники Глутамат представляет собой основной аминокислотный нейромедиатор в центральной нервной системе млекопитающих. Глутамат играет главную роль в многочисленных физиологических функциях,таких как обучение и память, а также чувственное восприятие, развитие синаптической пластичности,регуляция моторики, дыхание и регуляция сердечно-сосудистой функции. Более того, глутамату отводится центральное место при некоторых различных неврологических и психиатрических заболеваниях,при которых существует дисбаланс в глутаматергической нейропередаче. Глутамат опосредует синаптическую нейропередачу через активацию каналов ионотропных глутаматных рецепторов (iGluRs) и NMDA (N-метил-D-аспартат), АМРА (-амино-3-гидроксил-5-метил-4 изоксазолпропионат) и каинатных рецепторов, которые отвечают за быструю передачу возбуждения. Кроме того, глутамат активирует метаботропные глутаматные рецепторы (mGluRs), которые играют более модулирующую роль, которая служит для тонкой настройки синаптической эффективности. Глутамат активирует mGluRs путем связывания с большим внеклеточным аминоконцевым доменом рецептора, называемым в данной заявке ортостерическим сайтом связывания. Это связывание индуцирует конформационное изменение в рецепторе, которое приводит к активации G-белка и внутриклеточных сигнальных путей.mGluR2 подтип отрицательно связан с аденилатциклазой через активацию Gi-белка, и его активация приводит к ингибированию высвобождения глутамата в синапсе. В центральной нервной системе(caudate-putamen) и прилежащем ядре. Как было показано в клинических испытаниях, активация mGluR2 является эффективной для лечения тревожных расстройств. Кроме того, было показано, что активация mGluR2 в различных животных моделях является эффективной, представляя таким образом потенциальный новый терапевтический подход к лечению шизофрении, эпилепсии, аддикции/зависимости от веществ, болезни Паркинсона, боли,расстройств сна и болезни Хантингтона. В настоящее время большинство доступных фармакологических средств, нацеленных на mGluRs,представляет собой ортостерические лиганды, которые активируют несколько членов данного семейства,поскольку они являются структурными аналогами глутамата. Новый подход к разработке селективных соединений, действующих на mGluRs, состоит в идентификации соединений, которые действуют через аллостерические механизмы, модулируя рецептор путем связывания с сайтом, отличным от высококонсервативного ортостерического сайта связывания. Положительные аллостерические модуляторы mGluRs появились недавно в качестве новых фармакологических объектов, предлагающих эту привлекательную альтернативу. В качестве положительных аллостерических модуляторов mGluR2 были описаны различные соединения. В WO 2004/092135 (NPSAstra Zeneca), WO 2004/018386, WO 2006/014918 и WO 2006/015158(Merck), WO 2001/56990 (Eli Lilly) и WO 2006/030032 (AddexJanssen Pharmaceutica) описаны соответственно фенилсульфонамид, ацетофенон, инданон, пиридилметилсульфонамид и производные пиридинона в качестве положительных аллостерических модуляторов mGluR2. Ни одно из конкретно раскрытых соединений структурно не связано с соединениями по изобретению. В WO 2007/104783 описаны 1,4-дизамещенные производные 3-цианопиридона, которые являются положительными аллостерическими модуляторами метаботропных рецепторов подтипа 2 ("mGluR2"). Было показано, что такие соединения не активируют рецептор сами. Скорее, они позволяют рецептору производить максимальный ответ на концентрацию глутамата, которая сама по себе индуцирует минимальный ответ. Мутационный анализ продемонстрировал, что связывание положительных аллостерических модуляторов mGluR2 происходит не в ортостерическом сайте, а в аллостерическом сайте, расположенном в пределах седьмого трансмембранного участка данного рецептора. Данные на животных позволяют предположить, что положительные аллостерические модуляторыmGluR2 в моделях тревожности и психоза оказывают эффекты, схожие с эффектами, полученными с ортостерическими агонистами. Было показано, что аллостерические модуляторы mGluR2 активны в моделях тревоги: усиленный страхом испуг и стресс-индуцированная гипотермия. Более того, было показано,что такие соединения активны при обращении кетамин- или амфетамин-индуцированной гиперактивно-1 017280 сти и при обращении амфетамин-индуцированного нарушения преимпульсного ингибирования акустического эффекта испуга в моделях шизофрении (J. Pharmacol. Exp. Ther. 2006, 318, 173-185; Psychopharmacology 2005, 179, 271-283). Последние исследования на животных дополнительно показывают, что селективный положительный аллостерический модулятор метаботропных глутаматных рецепторов подтипа 2 бифенилинданон(BINA) блокирует галлюциногенную лекарственную модель психоза, поддерживая стратегию направленного воздействия на mGluR2 рецепторы для лечения глутаматергической дисфункции при шизофрении (Mol. Pharmacol. 2007, 72, 477-484). Положительные аллостерические модуляторы позволяют усиливать глутаматный ответ, но как также было показано, они усиливают ответ на ортостерические агонисты mGluR2, такие как LY379268 илиDCG-IV. Эти данные обеспечивают доказательство для еще одного нового терапевтического подхода к лечению вышеупомянутых неврологических и психиатрических заболеваний, вовлекающих mGluR2, при котором будут использовать комбинацию положительного аллостерического модулятора mGluR2 вместе с ортостерическим агонистом mGluR2. Соединения по настоящему изобретению характеризуются центральной пиридин-2-оновой группировкой, замещенной в положении 3 циано и в положении 4 пиперидин-1-илом, который, в свою очередь,замещен фенилом в положении 4. Соединения по настоящему изобретению представляют собой потенциальные положительные аллостерические модуляторы mGluR2. Описание изобретения Изобретение относится к соединениям, обладающим модуляторной активностью в отношении метаботропных глутаматных рецепторов 2. В настоящем изобретении предложено соединение формулы (I) включая любую его стереохимически изомерную форму, гдеR3 представляет собой водород или галогено; при условии, что если R3 представляет собой галогено, то R2 представляет собой гидроксил,которое не представляет собой или его фармацевтически приемлемая соль или его сольват. В настоящем изобретении также предложено соединение формулы (I), включая любую его стереохимически изомерную форму, гдеR2 представляет собой водород; фторо; C1-4 алкил, замещенный гидроксилом; C1-4 алкил, замещенный фторо; или C1-4 алкилокси, замещенный фторо,или его фармацевтически приемлемая соль или его сольват. Воплощением настоящего изобретения являются соединения формулы (I"), где R1 представляет собой 1-бутил или циклопропилметил. Воплощением настоящего изобретения являются соединения формулы (I"), где R2 представляет собой фторо; или где R2 представляет собой C1-4 алкил, замещенный гидроксилом, предпочтительно метил,замещенный гидроксилом; или где R2 представляет собой C1-4 алкил, замещенный фторо, предпочтительно метил, замещенный фторо; или где R2 представляет собой C1-4 алкилокси, замещенный фторо, предпочтительно этилокси, замещенный фторо.-2 017280 Воплощением настоящего изобретения являются соединения, имеющие формулу (I') включая любую его стереохимически изомерную форму, гдеR3 представляет собой водород или галогено,или его фармацевтически приемлемая соль или его сольват. Воплощением настоящего изобретения являются соединения формулы (I'), где R3 представляет собой хлоро. Воплощением настоящего изобретения является соединение, представляющее собой или его фармацевтически приемлемая соль или его сольват. Воплощением настоящего изобретения являются соединения формулы (I"), где R1 представляет собой 1-бутил, 3-метил-1-бутил или циклопропилметил; R2 представляет собой водород; фторо; метил, замещенный гидроксилом; метил, замещенный фторо; этилокси, замещенный фторо; или где R1 представляет собой 1-бутил или циклопропилметил; R2 представляет собой фторо; метил, замещенный гидроксилом; метил, замещенный фторо; этилокси, замещенный фторо. Настоящее изобретение также относится к применению соединений по изобретению в качестве лекарственного средства. Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения по изобретению и фармацевтически приемлемый носитель или разбавитель. Настоящее изобретение также относится к применению соединения по изобретению для изготовления лекарственного средства для лечения или предупреждения расстройства центральной нервной системы, выбранного группы, состоящей из тревожных расстройств, психотических расстройств, расстройств личности, расстройств, связанных с веществами, расстройств питания, расстройств настроения,мигрени, эпилепсии или судорожных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации, нейротоксичности и ишемии. В одном воплощении расстройство центральной нервной системы представляет собой тревожное расстройство, выбранное из группы, состоящей из агорафобии, генерализованного тревожного расстройства (GAD), обессивно-компульсивного расстройства (OCD), панического расстройства, посттравматического стрессового расстройства (PTSD), социофобии и других фобий; или расстройство центральной нервной системы представляет собой психотическое расстройство, выбранное из группы, состоящей из шизофрении, бредового расстройства, шизоаффективного расстройства, шизофреноформного расстройства и психотического расстройства, индуцированного веществами; или расстройство центральной нервной системы представляет собой расстройство личности, выбранное из группы, состоящей из обессивнокомпульсивного расстройства личности и шизоидного, шизотипического расстройства; или расстройство центральной нервной системы представляет собой расстройство, связанное с веществами, выбранное из группы, состоящей из злоупотребления алкоголем, алкогольной зависимости, алкогольной абстиненции,бреда при алкогольной абстиненции, психотического расстройства, индуцированного алкоголем, амфетаминовой зависимости, амфетаминовой абстиненции, кокаиновой зависимости, кокаиновой абстиненции, никотиновой зависимости, никотиновой абстиненции, опиоидной зависимости и опиоидной абстиненции; или расстройство центральной нервной системы представляет собой расстройство питания, выбранное из группы, состоящей из нервной анорексии и нервной булимии; или расстройство центральной нервной системы представляет собой расстройство настроения, выбранное из группы, состоящей из биполярных расстройств (I и II), циклотимического расстройства, депрессии, дистимического расстройства,глубокого депрессивного расстройства и расстройства настроения, индуцированного веществами; или расстройство центральной нервной системы представляет собой мигрень; или расстройство центральной нервной системы представляет собой эпилепсию или судорожное расстройство, выбранное из группы,состоящей из генерализованной бессудорожной эпилепсии, генерализованной судорожной эпилепсии,малого эпилептического припадка, большого эпилептического припадка, парциальной эпилепсии с нарушением сознания или без нарушения сознания, младенческих судорог, хронической прогрессирующей-3 017280 парциальной эпилепсии (epilepsy partialis continua) и других форм эпилепсии; или расстройство центральной нервной системы представляет собой детское расстройство, например расстройство дефицита внимания/гиперактивности; или расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из группы, состоящей из делирия, персистирующего делирия, индуцированного веществами, деменции, деменции вследствие ВИЧ-заболевания, деменции вследствие болезни Хантингтона, деменции вследствие болезни Паркинсона, деменции альцгеймеровского типа, персистирующей деменции, индуцированной веществами, и умеренного когнитивного нарушения; или расстройство центральной нервной системы выбрано группы, состоящей из тревоги, шизофрении, мигрени, депрессии и эпилепсии. Настоящее изобретение также относится к применению соединения по изобретению в комбинации с ортостерическим агонистом mGluR2 для изготовления лекарственного средства для лечения или предупреждения состояния, указанного выше, у млекопитающего, включая человека. Настоящее изобретение также относится к способу получения соединения формулы (I"), включающему стадии: а) взаимодействия промежуточного соединения формулы (II), где Y представляет собой подходящую уходящую группу, с промежуточным соединением формулы (III) в подходящем реакционноинертном растворителе, в присутствии подходящего основания, при нагревании, или взаимодействия промежуточного соединения формулы (II) при нагревании с промежуточным соединением формулы (III) в подходящем реакционно-инертном растворителе, в присутствии подходящего основания, подходящего катализатора где R1 и R2 являются такими, как определено выше; б) взаимодействия соединения формулы (I-b) с подходящим фторирующим агентом в подходящем реакционно-инертном растворителе, при умеренно низкой температуре где L представляет собой C1-4 алкил, и R1 является таким, как определено выше; в) взаимодействия промежуточного соединения формулы (IV) с подходящим фторирующим агентом в подходящем реакционно-инертном растворителе, при умеренно низкой температуре где R1 является таким, как определено выше; г) гидрирования промежуточного соединения формулы (XIV) в подходящем растворителе и в присутствии подходящего катализатора и подходящего основания, где R1 является таким, как определено выше, и R'2 представляет собой C1-4 алкилокси, замещенный фторо; и, возможно, дополнительного превращения соединений формулы (I) друг в друга после превращений, известных из уровня техники; возможно, превращения соединений формулы (I) в терапевтически активную нетоксичную соль присоединения кислоты путем обработки кислотой, или превращения формы соли присоединения кислоты в свободное основание путем обработки щелочью; или, возможно, получения его стереохимически изомерных форм. Воплощением настоящего изобретения являются соединения формулы (I), где R1 представляет собой C4-6 алкил, в частности C4-5 алкил, такой как, например, 1-бутил, 2-метил-1-пропил, 3-метил-1-бутил; в частности 1-бутил. Воплощением настоящего изобретения являются соединения формулы (I), где R1 представляет собой C1-3 алкил, замещенный С 3-7 циклоалкилом, в частности циклопропилметил или 2-(циклопропил)-1 этил.-4 017280 Воплощением настоящего изобретения являются соединения формулы (I) или любая их подгруппа,как упомянуто в данной заявке выше в качестве воплощения, где R2 представляет собой водород. Воплощением настоящего изобретения являются соединения формулы (I) или, когда это возможно,любая их подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой фторо; C1-4 алкил, замещенный гидроксилом; C1-4 алкил, замещенный фторо; или C1-4 алкилокси,замещенный фторо. Воплощением настоящего изобретения являются соединения формулы (I) или, когда это возможно,любая их подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой водород; фторо или C1-4 алкилокси, замещенный фторо; в частности, R2 представляет собой фторо или C1-4 алкилокси, замещенный фторо. Воплощением настоящего изобретения являются соединения формулы (I) или любая их подгруппа,как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой фторо. Воплощением настоящего изобретения являются соединения формулы (I) или, когда это возможно,любая их подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой C1-4 алкил, замещенный гидроксилом, в частности, где R2 представляет собой метил, замещенный гидроксилом. Воплощением настоящего изобретения являются соединения формулы (I) или, когда это возможно,любая их подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой C1-4 алкил, замещенный фторо, в частности, где R2 представляет собой метил, замещенный фторо. Воплощением настоящего изобретения являются соединения формулы (I) или, когда это возможно,любая их подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой C1-4 алкилокси, замещенный фторо, в частности, где R2 представляет собой этилокси, замещенный фторо. Воплощением настоящего изобретения являются соединения формулы (I), где R1 представляет собой C4-6 алкил, в частности 1-бутил или 3-метил-1-бутил; или C1-3 алкил, замещенный С 3-7 циклоалкилом, в частности цикпопропилметил; R2 представляет собой водород; фторо; C1-4 алкил, замещенный гидроксилом, в частности метил, замещенный гидроксилом; C1-4 алкил, замещенный фторо, в частности метил,замещенный фторо; или C1-4 алкилокси, замещенный фторо, в частности этилокси, замещенный фторо; или их фармацевтически приемлемая соль или их сольват. Воплощением настоящего изобретения являются соединения формулы (I), где R1 представляет собой C4-6 алкил, в частности 1-бутил; или C1-3 алкил, замещенный С 3-7 циклоалкилом, в частности циклопропилметил; R2 представляет собой фторо; C1-4 алкил, замещенный гидроксилом, в частности метил,замещенный гидроксилом; или C1-4 алкил, замещенный фторо, в частности метил, замещенный фторо; или C1-4 алкилокси, замещенный фторо, в частности этилокси, замещенный фторо; или их фармацевтически приемлемая соль или их сольват. Воплощением настоящего изобретения являются соединения формулы (I), выбранные из или их фармацевтически приемлемая соль или их сольват. Как использовано в данной заявке выше или ниже, обозначение C1-3 алкил в качестве группы или-5 017280 части группы определяет насыщенный, прямой или разветвленный, углеводородный радикал, имеющий от 1 до 3 атомов углерода, такой как метил, этил, 1-пропил и 1-метил-1-этил. Как использовано в данной заявке выше или ниже, обозначение C1-4 алкил в качестве группы или части группы определяет насыщенный, прямой или разветвленный, углеводородный радикал, имеющий от 1 до 4 атомов углерода, такой как метил, этил, пропил, 1-метил-1-этил, 1-бутил, 2-метил-1-пропил. Предпочтительно C1-4 алкил представляет собой метил. Как использовано в данной заявке выше или ниже, обозначение С 4-6 алкил в качестве группы или части группы определяет насыщенный, прямой или разветвленный, углеводородный радикал, имеющий от 4 до 6 атомов углерода, такой как 1-бутил, 2-метил-1-пропил, 1-пентил, 2-метил-1-бутил, 3-метил-1 бутил, 1-гексил и т.п. Как использовано в данной заявке выше или ниже, обозначение C4-5 алкил в качестве группы или части группы определяет насыщенный, прямой или разветвленный, углеводородный радикал, имеющий 4 или 5 атомов углерода, такой как 1-бутил, 2-метил-1-пропил, 1-пентил, 2-метил-1-бутил, 3-метил-1 бутил и т.п. Как использовано в данной заявке выше или ниже, обозначение С 3-7 циклоалкил определяет насыщенный, циклический углеводородный радикал, имеющий от 3 до 7 атомов углерода, такой как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Предпочтительно С 3-7 циклоалкил представляет собой циклопропил. Для терапевтического применения соли соединений формулы (I) представляют собой соли, где противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения. Фармацевтически приемлемые соли определяют как включающие терапевтически активные нетоксичные формы солей присоединения кислот, которые способны образовывать соединения формулы (I). Указанные соли могут быть получены путем обработки основной формы соединений формулы (I) подходящими кислотами, например неорганическими кислотами, например галогеноводородной кислотой, в частности соляной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, гидроксиуксусной кислотой,пропановой кислотой, молочная кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, пара-толуолсульфоновой кислотой, цикламовой кислотой, салициловой кислотой, парааминосалициловой кислотой и памовой кислотой. С другой стороны, указанные формы солей кислот могут быть превращены в форму свободного основания путем обработки подходящим основанием. Соединения формулы (I), содержащие кислотные протоны, также могут быть превращены в их терапевтически активные нетоксичные формы солей оснований путем обработки подходящими органическими и неорганическими основаниями. Подходящие формы солей оснований включают, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, в частности соли лития, натрия, калия,магния и кальция, соли с органическими основаниями, например бензатиновые, N-метил-Dглюкаминовые, гибраминовые соли, и соли с аминокислотами, например аргинином и лизином. Напротив, указанные формы солей оснований могут быть превращены в формы свободных кислот путем обработки подходящей кислотой. Фармацевтически приемлемые формы солей присоединения кислот соединений формулы (I) являются предпочтительными фармацевтически приемлемыми формами солей соединений формулы (I). Термин "сольват" включает формы присоединения растворителей, а также их фармацевтически приемлемые соли, которые способны образовывать соединения формулы (I). Примеры таких форм присоединения растворителей представляют собой, например, гидраты, алкоголяты и т.п. Следует понимать, что некоторые соединения формулы (I), их соли и сольваты могут содержать один или более центров хиральности и существовать в виде стереохимически изомерных форм. Термин "стереохимически изомерные формы", как использовано в данной заявке выше, определяет все возможные изомерные формы, которыми могут обладать соединения формулы (I). Если не упомянуто или не указано иное, то химическое название соединений обозначает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Но изобретение также охватывает каждую из индивидуальных изомерных форм формулы (I) и их солей или сольватов, по существу свободных, т.е. ассоциированных менее чем с 10%, предпочтительно менее чем 5%, в частности менее чем 2% и наиболее предпочтительно менее чем 1% других изомеров. Таким образом, когда соединение формулы (I) определено, например, как(R), это означает, что указанное соединение является по существу свободным от (S)-изомера. В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители на бивалентных циклических (частично) насыщенных радикалах могут иметь либо цис-, либо транс-конфигурацию.-6 017280 Согласно условиям номенклатуры CAS, когда в соединении присутствуют два стереогенных центра известной абсолютной конфигурации, дескриптор R или S присваивается (на основании правила последовательности Кана-Ингольда-Прелога) хиральному центру с наименьшим номером, центру отсчета. Конфигурацию второго стереогенного центра указывают с использованием относительных дескрипторов[R,R] или [R,S], где R всегда определяют как центр отсчета и [R,R] показывает центры с одинаковой хиральностью, a [R,S] показывает центры с разной хиральностью. Например, если хиральный центр с наименьшим номером в соединении имеет S-конфигурацию, а второй центр имеет Rконфигурацию, то стереодескриптор будет определяться как S-[R,S]. Если используют и : положение старшего заместителя на асимметрическом атоме углерода в кольцевой системе, имеющем наименьший номер в кольце, находится произвольно всегда в -положении средней плоскости, определяемой кольцевой системой. Положение старшего заместителя на другом асимметрическом атоме углерода в кольцевой системе (атом водорода в соединениях формулы (I относительно положения старшего заместителя на атоме отсчета обозначают , если он находится на той же стороне средней плоскости,определяемой кольцевой системой, или , если он находится на другой стороне средней плоскости,определяемой кольцевой системой. Как использовано ниже, термин "соединения формулы (I)" или любая их подгруппа означает, что также включены их стереохимически изомерные формы, их фармацевтически приемлемые соли и их сольваты. Особый интерес представляют такие соединения формулы (I), которые являются стереохимически чистыми. В рамках данной заявки элемент, в частности, когда он упоминается в отношении соединения формулы (I), содержит все изотопы и изотопные смеси этого элемента, либо имеющиеся в природе или полученные синтетическим путем, либо распространенные в природе или в изотопно обогащенной форме. В частности, когда упоминают водород, понятно, что речь идет о 1 Н, 2 Н, 3 Н или их смесях; когда упоминают углерод, понятно, что речь идет о 11 С, 12 С, 13 С, 14 С или их смесях; когда упоминают азот, понятно,что речь идет о 13N, 14N, 15N или их смесях; когда упоминают кислород, понятно, что речь идет о 14 О, 15 О,16 О, 17 О, 18 О или их смесях; когда упоминают фтор, понятно, что речь идет о 18F, 19F или их смесях. Поэтому соединения по изобретению также включают соединения с одним или более изотопами одного или более чем одного элемента, и их смеси, включая радиоактивные соединения, также называемые меченными радиоактивными изотопами соединениями, где один или более нерадиоактивных атомов замещены одним из его радиоактивных изотопов. В частности, радиоактивный атом выбран группы, состоящей из водорода, углерода, азота, серы, кислорода и галогена. Предпочтительно радиоактивный атом выбран группы, состоящей из водорода, углерода и галогена. В частности, радиоактивный изотоп выбран из группы, состоящей из 3 Н, 11 С, 18F, 122I, 123I, 125I, 131I, 75Br, 76Br, 77Br и 82Br. Предпочтительно радиоактивный изотоп выбран из группы, состоящей из 3 Н, 11 С и 18F. При использовании в данной заявке выше или ниже каждый из заместителей может быть выбран независимо из перечня определений, рассматриваются все возможные комбинации, которые являются химически возможными. В общем, соединения формулы (I) могут быть получены согласно приведенным ниже экспериментальным методикам 1-4. Экспериментальная методика 1. Соединения формулы (I) могут быть получены путем взаимодействия промежуточного соединения формулы (II), где Y представляет собой подходящую уходящую группу, такую как, например, F3CS(=O)2-O- или галогено, например бромо и т.п., с промежуточным соединением формулы (III) согласно реакционной схеме (1). Реакция может быть осуществлена в подходящем реакционно-инертном растворителе, таком как, например, диметоксиэтан или ацетонитрил, в присутствии подходящего основания,такого как, например, Cs2CO3 или N,N-диизопропилэтиламин, в термических условиях, таких как, например, нагревание реакционной смеси, например, при 150 С с использованием микроволнового излучения в течение 15 мин. Реакция, описанная на реакционной схеме (1), также может быть осуществлена в подходящем реакционно-инертном растворителе, таком как, например, 1,4-диоксан, в присутствии подходящего основания, такого как, например, K3PO4, подходящего катализатора, такого как Pd-комплексный катализатор,такой как, например,в термических условиях, таких как, например, нагревание реакционной смеси, например, при 80 С в течение 12 ч. На реакционной схеме (1) все переменные определены, как в формуле (I). Экспериментальная методика 2. Соединения формулы (I), где R2 представляет собой C1-4 алкил, замещенный фторо, причем указанный C1-4 алкил представлен L и указанные соединения представлены формулой (I-а), могут быть получены путем взаимодействия соединения формулы (I), где R2 представляет собой C1-4 алкил, замещенный гидроксилом, причем указанное соединение представлено формулой (I-b), с подходящим фторирующим агентом, таким как, например, (диэтиламино)серы трифторид [CAS: 38078-09-0]. Реакция может быть осуществлена в подходящем реакционно-инертном растворителе, таком как, например, дихлорметан, при умеренно низкой температуре, такой как, например, температура, варьирующая от -78 до 30 С, в течение, например, 0,5-12 ч. На реакционной схеме (2) все переменные определены, как в формуле (I). Реакционная схема (2) Экспериментальная методика 3. Соединения формулы (I), где R2 представляет собой фторо, причем указанные соединения представлены формулой (I-c), могут быть получены путем взаимодействия промежуточного соединения формулы (IV) с подходящим фторирующим агентом, таким как, например, (диэтиламино)серы трифторид. Реакция может быть осуществлена в подходящем реакционно-инертном растворителе, таком как, например, дихлорметан, при умеренно низкой температуре, такой как, например, температура, варьирующая от -78 до 30 С, в течение, например, 0,5-12 ч. На реакционной схеме (3) все переменные определены, как в формуле (I). Реакционная схема (3) Экспериментальная методика 4. Соединения формулы (I), где R2 представляет собой C1-4 алкилокси, замещенный фторо, причем указанный R2 представлен R'2 и указанные соединения представлены формулой (I-d), могут быть получены путем гидрирования промежуточного соединения формулы (XIV) согласно реакционной схеме (4). Реакция может быть осуществлена в подходящем растворителе, таком как, например, алкоголь, например метанол, в присутствии подходящего катализатора, такого как, например, палладий на активированном углероде, и подходящего основания, такого как, например, триэтиламин. На реакционной схеме (4) все переменные определены, как в формуле (I). Реакционная схема (4) Соединения формулы (I) и некоторые промежуточные соединения в настоящем изобретении могут содержать асимметрический атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанные промежуточные соединения могут быть получены с использованием методик, известных в данной области. Например, диастереоизомеры могут быть разделены физическими способами,такими как избирательная кристаллизация, или хроматографическими методами, например противоточным распределением, хиральной жидкостной хроматографией и тому подобными способами. Энантиомеры могут быть получены из рацемических смесей сначала путем превращения указанных рацемических смесей с подходящими разрешающими агентами, такими как, например, хиральные кислоты, в смеси диастереомерных солей или соединений; затем физического разделения указанных смесей диастерео-8 017280 мерных солей или соединений, например, избирательной кристаллизацией, или хроматографическими методами, например жидкостной хроматографией и тому подобными способами; и, наконец, превращения указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимически изомерные формы также могут быть получены из чистых стереохимически изомерных форм подходящих промежуточных соединений и исходных веществ при условии, что промежуточные реакции протекают стереоспецифически. Альтернативный способ разделения энантиомерных форм соединений формулы (I) и промежуточных соединений включает жидкостную хроматографию или SCF (сверхкритическую флюидную) хроматографию, в частности, с использованием хиральной стационарной фазы. Некоторые промежуточные соединения и исходные вещества представляют собой известные соединения и могут быть коммерчески доступны или могут быть получены согласно методикам, известным в данной области. Промежуточные соединения также могут быть получены согласно приведенным ниже экспериментальным методикам 5-13. Экспериментальная методика 5. Промежуточные соединения формулы (II), где Y представляет собой галогено, причем указанные промежуточные соединения представлены формулой (II-а), могут быть получены путем взаимодействия промежуточного соединения формулы (V) с подходящим галогенирующим агентом, таким как, например, Р(=О)Br3, согласно реакционной схеме (5). Реакция может быть осуществлена в подходящем реакционно-инертном растворителе, таком как, например, DMF, при умеренно повышенной температуре,такой как, например, 110 С. На реакционной схеме (5) все переменные определены, как в формуле (I). Реакционная схема (5) Экспериментальная методика 6. Промежуточные соединения формулы (II), где Y представляет собой F3C-S(=O)2-O-, причем указанные промежуточные соединения представлены формулой (II-b), могут быть получены путем взаимодействия промежуточного соединения формулы (V) с ангидридом трифторметансульфокислоты (также названным трифторметансульфоновым ангидридом) согласно реакционной схеме (6). Реакция может быть осуществлена в подходящем реакционно-инертном растворителе, таком как, например, дихлорметан, в присутствии подходящего основания, такого как, например, пиридин, при низкой температуре,такой как, например, -78 С. На реакционной схеме (6) все переменные определены, как в формуле (I). Реакционная схема (6) Экспериментальная методика 7. Промежуточные соединения формулы (V) могут быть получены известными в данной области методиками путем взаимодействия промежуточного соединения формулы (VI) с подходящим реагентом для расщепления метилового эфира, таким как, например, NaOH, согласно реакционной схеме (7). Реакция может быть осуществлена в подходящем растворителе, таком как, например, вода, при умеренно высокой температуре, такой как, например, 100 С. На реакционной схеме (6) все переменные определены, как в формуле (I). Реакционная схема (7) Экспериментальная методика 8. Промежуточные соединения формулы (VI) могут быть получены известными в данной области методиками путем взаимодействия имеющегося в продаже 4-метокси-2-оксо-1,2-дигидропиридин-3 карбонитрила с алкилирующим агентом формулы (VII), где Z представляет собой подходящую уходящую группу, такую как, например, галогено, например бромо и т.п., согласно реакционной схеме (8). Примером алкилирующего агента формулы (VII) является, например, циклопропилметилбромид. Реакция может быть осуществлена в инертном растворителе, таком как, например, ацетонитрил, с использованием подходящего основания, такого как, например, K2CO3, и, возможно, соли йода, такой как, напри-9 017280 мер, KI, при умеренно высокой температуре, такой как, например, 120 С. На реакционной схеме (8) все переменные определены, как в формуле (I). Реакционная схема (8) Экспериментальная методика 9. Промежуточные соединения формулы (III) могут быть получены путем снятия защиты с пиперидинового азота в промежуточное соединение формулы (VIII), где X представляет собой подходящую защитную группу для атома азота пиперидинового производного, такую как, например, третбутоксикарбонил, этоксикарбонил, бензилоксикарбонил, бензил и метил, согласно реакционной схеме(9) с использованием методик, известных в данной области. Например, когда X представляет собой бензил, тогда реакция снятия защиты может быть осуществлена в подходящем растворителе, таком как, например, алкоголь, например метанол, и 1,4 циклогексадиен, в присутствии подходящего катализатора,такого как, например, палладий на угле, при умеренно высокой температуре, такой как, например, 100 С. Например, когда X представляет собой сложный эфир, тогда реакция снятия защиты может быть осуществлена путем взаимодействия с подходящей кислотой, такой как, например, соляная кислота, в подходящем растворителе, таком как, например, диоксан. На реакционной схеме (9) все переменные определены, как в формуле (I). Реакционная схема (9) Экспериментальная методика 10. Промежуточные соединения формулы (III), где R2 представляет собой фторо или C1-4 алкил, замещенный фторо, причем указанный R2 представлен -L1-F, где L1 представляет собой C1-4 алкил или ковалентную связь, и указанные промежуточные соединения представлены формулой (III-а), могут быть получены известными в данной области методиками путем взаимодействия промежуточного соединения формулы (IX), где X представляет собой подходящую защитную группу для атома азота пиперидиновой группировки, такую как, например, трет-бутоксикарбонил, этоксикарбонил, бензилоксикарбонил, бензил и метил, с подходящим фторирующим агентом, таким как, например, (диэтиламино)серы трифторид[CAS: 38078-09-0], приводящего к получению промежуточного соединения формулы (X) согласно реакционной схеме (10), стадии (а). Реакция может быть осуществлена в подходящем реакционно-инертном растворителе, таком как, например, дихлорметан, при умеренно низкой температуре, такой как, например, температура, варьирующая от -78 до 30 С, в течение, например, 0,5-12 ч. Полученное промежуточное соединение формулы (X) затем может быть превращено согласно реакционной схеме (10), стадии (б),в промежуточное соединение формулы (III-a) путем снятия защиты с пиперидинового азота с использованием методик, известных в данной области, таких как, например, методики, описанные в экспериментальной методике 9 выше. На реакционной схеме (10) все переменные определены, как в формуле (I). Реакционная схема (10) Экспериментальная методика 11. Промежуточные соединения формулы (III), где R2 представляет собой C1-4 алкилокси, замещенный фторо, причем указанный C1-4 алкилокси представлен формулой Q, указанный R2 представлен -Q-F и указанные промежуточные соединения представлены формулой (III-b), могут быть получены известными в данной области методиками путем взаимодействия гидроксилзамещенного промежуточного соединения формулы (XI), где X представляет собой подходящую защитную группу для атома азота пиперидиновой группировки, такую как, например, трет-бутоксикарбонил, этоксикарбонил, бензилоксикарбонил, бензил и метил, с подходящим фторирующим агентом, таким как (диэтиламино)серы трифторид [CAS: 3807809-0], приводящего к получению промежуточного соединения формулы (XII) согласно реакционной схеме (11), стадии (а). Реакция может быть осуществлена в подходящем реакционно-инертном растворителе, таком как, например, дихлорметан, при умеренно низкой температуре, такой как, например, температура, варьирующая от -78 до 30 С, в течение, например, 0,5-12 ч. Промежуточное соединение формулы(XII) затем может быть превращено согласно реакционной схеме (11), стадии (б), в промежуточное соединение формулы (III-b) путем снятия защиты с пиперидинового азота с использованием методик, известных в данной области, таких как, например, методики, описанные в экспериментальной методике 9- 10017280 выше. На реакционной схеме (11) все переменные определены, как в формуле (I). Реакционная схема (11) Экспериментальная методика 12. Промежуточные соединения формулы (IX), где L1 представляет собой CH2, причем указанные промежуточные соединения представлены формулой (IX-a), могут быть получены путем взаимодействия промежуточного соединения формулы (XIII), где X представляет собой подходящую защитную группу для атома азота пиперидиновой группировки, такую как, например, трет-бутоксикарбонил, этоксикарбонил, бензилоксикарбонил, бензил и метил, с подходящим восстанавливающим агентом, таким как, например, алюмогидрид лития, согласно реакционной схеме (12). Реакция может быть осуществлена в подходящем растворителе, таком как, например, тетрагидрофуран, при умеренно низкой температуре, такой как, например, -20 С. На реакционной схеме (12) все переменные определены, как в формуле (I). Реакционная схема (12) Экспериментальная методика 13. Промежуточные соединения формулы (XIV) могут быть получены путем взаимодействия промежуточного соединения формулы (XV) с фторС 1-4 алкил-4-толуолсульфонатом согласно реакционной схеме(13). Реакция может быть осуществлена в подходящем растворителе, таком как, например, DME, и в присутствии NaH. На реакционной схеме (13) все переменные определены, как в формуле (I), и R'2 является таким, как определено выше. Реакционная схема (13) Промежуточные соединения формулы (IV) и формулы (XV) также демонстрируют активность в качестве положительных аллостерических модуляторов mGluR2. Поэтому настоящее изобретение также относится к соединению формулы (I') включая любую его стереохимически изомерную форму, гдеR3 представляет собой водород или галогено; в частности водород, фторо или хлоро; или его фармацевтически приемлемой соли или его сольвату. Воплощением настоящего изобретения являются соединения формулы (I'), где R1 представляет собой C4-6 алкил, в частности C4-5 алкил, такой как, например, 1-бутил, 2-метил-1-пропил, 3-метил-1-бутил; в частности 1-бутил. Воплощением настоящего изобретения являются соединения формулы (I'), где R1 представляет собой C1-3 алкил, замещенный C3-7 циклоалкилом, в частности циклопропилметил или 2-(циклопропил)-1 этил. Интересным воплощением соединений формулы (I') являются такие соединения, где R3 представляет собой водород.- 11017280 Интересным воплощением соединений формулы (I') являются такие соединения, где R3 представляет собой галогено, в частности хлоро или фторо. Интересным воплощением соединений формулы (I') являются такие соединения, где R1 представляет собой 1-бутил или циклопропилметил; R2 представляет собой водород; фторо или хлоро. Соединения формулы (I') представляют собой, например, или его фармацевтически приемлемую соль или его сольват. Указанные соединения формулы (I') могут быть получены, как описано выше для получения промежуточных соединений формулы (IV) или (XV). Ссылка также сделана на пример А 13 ниже. Настоящее изобретение также относится к применению соединения формулы (I') или любой его подгруппы для изготовления лекарственного средства для лечения или предупреждения, в частности для лечения, состояния у млекопитающего, включая человека, лечение или предупреждение которого находится под влиянием или облегчается нейромодуляторным эффектом аллостерического модулятораmGluR2, в частности положительного аллостерического модулятора. Поскольку соединения формулы (I) и формулы (I'), оба, являются положительными аллостерическими модуляторами mGluR2, настоящее изобретение также относится к соединению формулы (I") включая любую его стереохимически изомерную форму, гдеR3 представляет собой водород или галогено; при условии, что если R3 представляет собой галогено, то R2 представляет собой гидроксил; или его фармацевтически приемлемой соли или его сольвату. Воплощением настоящего изобретения являются соединения формулы (I"), где R1 представляет собой C4-6 алкил, в частности C4-5 алкил, такой как, например, 1-бутил, 2-метил-1-пропил, 3-метил-1-бутил; в частности 1-бутил. Воплощением настоящего изобретения являются соединения формулы (I"), где R1 представляет собой C1-3 алкил, замещенный С 3-7 циклоалкилом, в частности циклопропилметил или 2-(циклопропил)-1 этил. Воплощением настоящего изобретения являются соединения формулы (I") или любая его подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой водород. Воплощением настоящего изобретения являются соединения формулы (I") или, когда это возможно, любая его подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представ- 12017280 ляет собой фторо; C1-4 алкил, замещенный гидроксилом; C1-4 алкил, замещенный фторо; или C1-4 алкилокси, замещенный фторо. Воплощением настоящего изобретения являются соединения формулы (I") или, когда это возможно, любая его подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой водород; фторо; или C1-4 алкилокси, замещенный фторо; в частности, R2 представляет собой фторо или C1-4 алкилокси, замещенный фторо. Воплощением настоящего изобретения являются соединения формулы (I") или любая его подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой фторо. Воплощением настоящего изобретения являются соединения формулы (I") или, когда это возможно, любая его подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой C1-4 алкил, замещенный гидроксилом, в частности, где R2 представляет собой метил, замещенный гидроксилом. Воплощением настоящего изобретения являются соединения формулы (I") или, когда это возможно, любая его подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой C1-4 алкил, замещенный фторо, в частности, где R2 представляет собой метил, замещенный фторо. Воплощением настоящего изобретения являются соединения формулы (I") или, когда это возможно, любая его подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой C1-4 алкилокси, замещенный фторо, в частности, где R2 представляет собой этилокси, замещенный фторо. Воплощением настоящего изобретения являются соединения формулы (I") или, когда это возможно, любая его подгруппа, как упомянуто выше в данной заявке в качестве воплощения, где R2 представляет собой гидроксил. Настоящее изобретение также относится к применению соединения формулы (I") или любой его подгруппы для изготовления лекарственного средства для лечения или предупреждения, в частности для лечения, состояния у млекопитающего, включая человека, лечение или предупреждение которого находится под влиянием или облегчается нейромодуляторным эффектом аллостерического модулятораmGluR2, в частности положительного аллостерического модулятора. Фармакология. Соединения, предложенные в данном изобретении, являются положительными аллостерическими модуляторами метаботропных глутаматных рецепторов, в частности они являются положительными аллостерическими модуляторами mGluR2. Соединения по настоящему изобретению, по-видимому, не связываются с сайтом распознавания глутамата, ортостерическим сайтом лиганда, но напротив, с аллостерическим сайтом в седьмом трансмембранном участке данного рецептора. В присутствии глутамата или агониста mGluR2 соединения по данному изобретению усиливают ответ mGluR2. Соединения, предложенные в данном изобретении, как ожидают, оказывают свой эффект на mGluR2 благодаря их способности увеличивать ответ таких рецепторов на глутамат или агонисты mGluR2, усиливая ответ данного рецептора. Поэтому настоящее изобретение относится к соединению по настоящему изобретению для применения в качестве лекарственного средства, а также к применению соединения по изобретению или фармацевтической композиции по изобретению для изготовления лекарственного средства для лечения или предупреждения, в частности лечения, состояния у млекопитающего, включая человека, лечение или предупреждение которого находится под влиянием или облегчается нейромодуляторным эффектом аллостерических модуляторов mGluR2, в частности его положительных аллостерических модуляторов. Настоящее изобретение также относится к соединению по настоящему изобретению или фармацевтической композиции по изобретению для применения в изготовлении лекарственного средства для лечения или предупреждения, в частности лечения, состояния у млекопитающего, включая человека, лечение или предупреждение которого находится под влиянием или облегчается нейромодуляторным эффектом аллостерических модуляторов mGluR2, в частности, его положительных аллостерических модуляторов. Настоящее изобретение также относится к соединению по настоящему изобретению или фармацевтической композиции по изобретению для лечения или предупреждения, в частности лечения, состояния у млекопитающего, включая человека, лечение или предупреждение которого находится под влиянием или облегчается нейромодуляторным эффектом аллостерических модуляторов mGluR2, в частности его положительных аллостерических модуляторов. Кроме того, настоящее изобретение относится к применению соединения по изобретению или фармацевтической композиции по изобретению для изготовления лекарственного средства для лечения,предупреждения, облегчения, контролирования или снижения риска различных неврологических и психиатрических расстройств, связанных с глутаматной дисфункцией у млекопитающего, включая человека,лечение или предупреждение которых находится под влиянием или облегчается нейромодуляторным эффектом положительных аллостерических модуляторов mGluR2. Когда изобретение, как считают, относится к применению соединения или композиции по изобретению для изготовления лекарственного средства, например для лечения млекопитающего, тогда понимают, что такое применение следует интерпретировать в некоторых практиках как способ, например,- 13017280 лечения млекопитающего, включающий введение млекопитающему, нуждающемуся в таком, например,лечении, эффективного количества соединения или композиции по изобретению. В частности, неврологические и психиатрические расстройства, связанные с глутаматной дисфункцией, включают одно или более из следующих состояний или заболеваний: острые неврологические и психиатрические расстройства, такие как, например, церебральные дефициты после операции шунтирования сердца и трансплантации, инсульт, ишемия головного мозга, травма спинного мозга, травма головы, перинатальная гипоксия, остановка сердца, гипогликемическое повреждение нейронов, деменция(включая СПИД-индуцированную деменцию), болезнь Альцгеймера, хорея Хантингтона, амиотрофический боковой склероз, поражение глаз, ретинопатия, когнитивные расстройства, идиопатическая и индуцированная лекарственными средствами болезнь Паркинсона, мышечные спазмы и расстройства, ассоциированные с мышечной спастичностью, включающие треморы, эпилепсию, судороги, мигрень (включая мигренозную головную боль), недержание мочи, устойчивость к веществам, отмена веществ (включая такие вещества, как, например, опиаты, никотин, табачные изделия, алкоголь, бензодиазепины, кокаин, седативные средства, снотворные средства и т.д.), психоз, шизофрения, тревога (включая генерализованное тревожное расстройство, паническое расстройство и обессивно-компульсивное расстройство),расстройства настроения (включая депрессию, манию, биполярные расстройства), невралгия тройничного нерва, тугоухость, звон в ушах, дегенерация желтого пятна глаза, рвота, отек мозга, боль (включая острые и хронические состояния, тяжелую боль, неустранимую боль, невропатическую боль и посттравматическую боль), поздняя дискинезия, расстройства сна (включая нарколепсию), расстройство дефицита внимания/гиперактивности и расстройство поведения. В частности, настоящее изобретение относится к применению соединения формулы (I) для изготовления лекарственного средства для лечения или предупреждения, в частности для лечения, расстройства центральной нервной системы, выбранного группы, состоящей из тревожных расстройств, психотических расстройств, расстройств личности, расстройств, связанных с веществами, расстройств питания,расстройств настроения, мигрени, эпилепсии или судорожных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации, нейротоксичности и ишемии. Предпочтительно расстройство центральной нервной системы представляет собой тревожное расстройство, выбранное из группы, состоящей из агорафобии, генерализованного тревожного расстройства(GAD), обессивно-компульсивного расстройства (OCD), панического расстройства, посттравматического стрессового расстройства (PTSD), социофобии и других фобий. Предпочтительно расстройство центральной нервной системы представляет собой психотическое расстройство, выбранное из группы, состоящей из шизофрении, бредового расстройства, шизоаффективного расстройства, шизофреноформного расстройства и психотического расстройства, индуцированного веществами. Предпочтительно расстройство центральной нервной системы представляет собой расстройство личности, выбранное из группы, состоящей из обессивно-компульсивного расстройства личности и шизоидного, шизотипического расстройства. Предпочтительно расстройство центральной нервной системы представляет собой расстройство,связанное с веществами, выбранное из группы, состоящей из злоупотребления алкоголем, алкогольной зависимости, алкогольной абстиненции, бреда при алкогольной абстиненции, психотического расстройства, индуцированного алкоголем, амфетаминовой зависимости, амфетаминовой абстиненции, кокаиновой зависимости, кокаиновой абстиненции, никотиновой зависимости, никотиновой абстиненции, опиоидной зависимости и опиоидной абстиненции. Предпочтительно расстройство центральной нервной системы представляет собой расстройство питания, выбранное из группы, состоящей из нервной анорексии и нервной булимии. Предпочтительно расстройство центральной нервной системы представляет собой расстройство настроения, выбранное из группы, состоящей из биполярных расстройств (I и II), циклотимического расстройства, депрессии, дистимического расстройства, глубокого депрессивного расстройства и расстройства настроения, индуцированного веществами. Предпочтительно расстройство центральной нервной системы представляет собой мигрень. Предпочтительно расстройство центральной нервной системы представляет собой эпилепсию или судорожное расстройство, выбранное из группы, состоящей из генерализованной бессудорожной эпилепсии, генерализованной судорожной эпилепсии, малого эпилептического припадка, большого эпилептического припадка, парциальной эпилепсии с нарушением сознания или без нарушения сознания, младенческих судорог, хронической прогрессирующей парциальной эпилепсии (epilepsy partialis continua) и других форм эпилепсии. Предпочтительно расстройство центральной нервной системы представляет собой расстройство дефицита внимания/гиперактивности. Предпочтительно расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из группы, состоящей из делирия, персистирующего делирия, индуцированного веществами, деменции, деменции вследствие ВИЧ-заболевания, деменции вследствие болезни Хантингтона, деменции вследствие болезни Паркинсона, деменции альцгеймеровского типа, персистирующей- 14017280 деменции, индуцированной веществами, и умеренного когнитивного нарушения. Из расстройств, упомянутых выше, лечение тревоги, шизофрении, мигрени, депрессии и эпилепсии имеет особое значение. В настоящее время четвертое издание "Диагностического и статистического руководства по психическим расстройствам (DSM-IV)" Американской психиатрической ассоциации обеспечивает диагностический инструмент для идентификации расстройств, описанных в данной заявке. Специалисту в данной области будет понятно, что существуют альтернативные номенклатуры, нозологии и системы классификации для неврологических и психиатрических расстройств, описанных в данной заявке, и что они меняются с развитием медицины и науки. Поскольку такие положительные аллостерические модуляторы mGluR2, включая соединения формулы (I), усиливают ответ mGluR2 на глутамат, предпочтительно, чтобы в настоящих способах использовали эндогенный глутамат. Поскольку положительные аллостерические модуляторы mGluR2, включая соединения формулы(I), усиливают ответ mGluR2 на агонисты, понятно, что настоящее изобретение охватывает лечение неврологических и психиатрических расстройств, связанных с глутаматной дисфункцией, путем введения эффективного количества положительного аллостерического модулятора mGluR2, включая соединения формулы (I), в комбинации с агонистом mGluR2. Соединения по настоящему изобретению могут быть использованы в комбинации с одним или более другими лекарственными средствами в лечении, предупреждении, контролировании, уменьшении симптомов или снижении риска заболеваний или состояний, для которых соединения формулы (I) или другие лекарственные средства могут быть полезными, где комбинации лекарственных средств вместе являются более безопасными или более эффективными, чем любое лекарственное средство в отдельности. Фармацевтические композиции. Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или разбавитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по изобретению, в частности соединения формулы (I), включая его стереохимически изомерную форму или его фармацевтически приемлемую соль либо его сольват. Соединения по изобретению, в частности соединения формулы (I), включая их стереохимически изомерную форму или их фармацевтически приемлемую соль либо их сольват или любую их подгруппу или комбинацию, могут быть приготовлены в различных фармацевтических формах для целей введения. В качестве подходящих композиций могут быть упомянуты все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по данному изобретению эффективное количество конкретного соединения, возможно в форме соли, в качестве активного ингредиента объединяют в однородной смеси с фармацевтически приемлемым носителем или разбавителем, которые могут принимать различные формы в зависимости от формы препарата, желательной для введения. Эти фармацевтические композиции являются желательными в однократной лекарственной форме, подходящей, в частности, для перорального, ректального, подкожного введения, введения посредством парентеральной инъекции или посредством ингаляции. Например, при получении композиций в пероральной лекарственной форме могут быть использованы любые обычные фармацевтические среды, такие как, например, вода, гликоли,масла, спирты и т.п. в случае пероральных жидких препаратов, таких как, например, суспензии, сиропы,эликсиры, эмульсии и растворы; или твердые носители, такие как, например, крахмалы, сахара, каолин,разбавители, смазывающие вещества, связующие, разрыхлители и т.п. в случае порошков, пилюль, капсул и таблеток. Из-за легкости введения, пероральное введение является предпочтительным, и таблетки и капсулы являются наиболее предпочтительными пероральными лекарственными формами, в которых,конечно, используют твердые фармацевтические носители. Для парентеральных композиций носитель будет обычно включать стерильную воду, по меньшей мере в значительной степени, хотя могут быть включены и другие ингредиенты, например, для улучшения растворимости. Могут быть получены, например, инъецируемые растворы, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть получены инъецируемые суспензии, в которых могут быть использованы подходящие жидкие носители, суспендирующие агенты и т.п. Также включены препараты в твердой форме, которые предназначены для превращения,непосредственно перед применением, в препараты в жидкой форме. В композициях, подходящих для подкожного введения, носитель возможно содержит агент для усиления проникновения и/или подходящий увлажняющий агент, возможно объединенный с подходящими добавками любой природы в незначительных количествах, которые не оказывают существенного вредного воздействия на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезными для получения желательных композиций. Эти композиции можно вводить различными путями, например в виде трансдермального пластыря, локально, в виде мази. Особенно предпочтительно приготавливать вышеупомянутые фармацевтические композиции в стандартной лекарственной форме для удобного введения и однородности дозировки. Стандартная ле- 15017280 карственная форма, используемая в данной заявке, относится к физически дискретным единицам, подходящим в качестве однократных дозировок, причем каждая единица содержит заданное количество активного ингредиента, рассчитанное для получения желательного терапевтического эффекта, вместе с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с насечкой или таблетки с покрытием), капсулы, пилюли, пакеты для порошков, облатки, суппозитории, инъецируемые растворы или суспензии и т.п., и их обособленные кратные части. Точная дозировка и частота введения зависят от конкретного используемого соединения формулы(I), конкретного состояния, которое лечат, тяжести состояния, которое лечат, возраста, массы, пола, степени расстройства и общего физического состояния конкретного пациента, а также другой лекарственной терапии, которую может принимать индивидуум, как хорошо известно специалистам в данной области. Более того, очевидно, что указанное эффективное суточное количество может быть снижено или увеличено в зависимости от реакции субъекта, которого лечат, и/или в зависимости от оценки лечащего врача, назначающего соединения по настоящему изобретению. В зависимости от способа введения фармацевтическая композиция будет содержать от 0,05 до 99 мас.%, предпочтительно от 0,1 до 70 мас.%, более предпочтительно от 0,1 до 50 мас.% активного ингредиента и от 1 до 99,95 мас.%, предпочтительно от 30 до 99,9 мас.%, более предпочтительно от 50 до 99,9 мас.% фармацевтически приемлемого носителя, все проценты основаны на общей массе композиции. Как уже упомянуто, изобретение также относится к фармацевтической композиции, содержащей соединения по изобретению и одно или более других лекарственных средств, в лечении, предупреждении, контролировании, уменьшении симптомов или снижении риска заболеваний или состояний, для которых соединения формулы (I) или другие лекарственные средства могут быть полезными, а также к применению такой композиции для изготовления лекарственного средства. Настоящее изобретение также относится к комбинации соединения по настоящему изобретению и ортостерического агонистаmGluR2. Настоящее изобретение также относится к такой комбинации для применения в качестве лекарственного средства. Настоящее изобретение также относится к продукту, содержащему (а) соединение по настоящему изобретению, его фармацевтически приемлемую соль или его сольват, и (б) ортостерический агонист mGluR2, в виде объединенного препарата для одновременного, раздельного или последовательного применения в лечении или предупреждении состояния у млекопитающего, включая человека,лечение или предупреждение которого находится под влиянием или облегчается нейромодуляторным эффектом аллостерических модуляторов mGluR2, в частности положительных аллостерических модуляторов mGluR2. Различные лекарственные средства такой комбинации или продукта могут быть объединены в одном препарате вместе с фармацевтически приемлемыми носителями или разбавителями, или каждый из них может присутствовать в отдельном препарате вместе с фармацевтически приемлемыми носителями или разбавителями. Следующие примеры предназначены для иллюстрации, но не для ограничения объема настоящего изобретения. Экспериментальная часть. Некоторые способы получения соединений по данному изобретению проиллюстрированы в следующих примерах. Если не указано иное, то все исходные вещества получали от коммерческих поставщиков и использовали без дополнительной очистки. Конкретно, в примерах и во всем описании могут быть использованы следующие аббревиатуры: Все ссылки на рассол относятся к насыщенному водному раствору NaCl. Если не указано иное, то все температуры выражены в С (градусы Цельсия). Все реакции проводят не в инертной атмосфере при комнатной температуре, если не указано иное. Реакции с использованием микроволнового излучения осуществляли в одномодовом реакторе: микроволновом реакторе Emrys Optimizer (Personal Chemistry А.В., в настоящее время Biotage) или в мультимодовом реакторе: MicroSYNTH Labstation (Milestone, Inc.). К раствору 4-метокси-2-оксо-1,2-дигидропиридин-3-карбонитрила (12,2 г, 81,48 ммоль) в ацетонитриле (250 мл) добавляли бромметилциклопропан (11 г, 81,48 ммоль) и карбонат калия (22,48 г, 162,9 ммоль) и смесь нагревали при 110 С в течение 24 ч. Смесь охлаждали до комнатной температуры и твердое вещество отфильтровывали. Фильтрат упаривали досуха и полученный неочищенный остаток затем растирали с диэтиловым эфиром с получением чистого промежуточного соединения 1 (15,72 г, 94%) в виде белого твердого вещества. Пример А.2. 1-Бутил-4-метокси-2-оксо-1,2-дигидропиридин-3-карбонитрил (промежуточное соединение 2)(800 мл) добавляли 1-бромбутан (15,8 мл, 146 ммоль) и карбонат калия (36,7 г, 266 ммоль) и смесь нагревали при 110 С в течение 24 ч. Смесь охлаждали до комнатной температуры и твердое вещество отфильтровывали. Фильтрат упаривали досуха и полученный неочищенный остаток затем растирали с диэтиловым эфиром с получением чистого промежуточного соединения 2 (27,39 г, 99%) в виде белого твердого вещества. Пример А.3. 1-Циклопропилметил-4-гидрокси-2-оксо-1,2-дигидропиридин-3-карбонитрил (промежуточное соединение 3) Промежуточное соединение 1 (15,7 г, 76,8 ммоль) добавляли при комнатной температуре к 1 н. водному раствору гидроксида натрия (300 мл) и THF (50 мл). Реакционную смесь нагревали при 140 С (температура масляной бани) в течение 16 ч. Смесь охлаждали до комнатной температуры и большую частьTHF выпаривали в вакууме. Водный слой охлаждали до 0 С и подкисляли путем добавления водной 2 н.HCl, корректируя рН до примерно 3, при котором осаждалось белое твердое вещество. Твердое вещество отфильтровывали, промывали Et2O и сушили в вакууме с получением промежуточного соединения 3 в виде белого твердого вещества (10,44 г, 71%), которое использовали без дополнительной очистки. Пример А.4. 1-Бутил-4-гидрокси-2-оксо-1,2-дигидропиридин-3-карбонитрил (промежуточное соединение 4) Промежуточное соединение 2 (27,39 г, 133 ммоль) добавляли при комнатной температуре к 1 н. водному раствору гидроксида натрия (500 мл) и THF (100 мл). Реакционную смесь нагревали при 110 С(температура масляной бани) в течение 24 ч. Смесь охлаждали до комнатной температуры и растворитель выпаривали в вакууме до тех пор, пока объем не уменьшался до приблизительно 250 мл. Водный слой затем охлаждали до 0 С и подкисляли путем добавления водной 2 н. HCl, корректируя рН до примерно 3, при котором осаждалось белое твердое вещество. Твердое вещество отфильтровывали, промывали Et2O и сушили в вакууме с получением промежуточного соединения 4 в виде белого твердого вещества (25 г, 98%), которое использовали без дополнительной очистки. Пример А.5. 4-Бром-1-циклопропилметил-2-оксо-1,2-дигидропиридин-3-карбонитрил (промежуточное соединение 5) К раствору промежуточного соединения 3 (10,4 г, 54,67 ммоль) в DMF (250 мл) добавляли Р(=О)Br3(31,3 г, 109,3 ммоль) и смесь нагревали при 110 С в течение 1,5 ч. После охлаждения в ледяной бане раствор распределяли между водой и EtOAc. После трех экстракций EtOAc объединенные органические фракции промывали рассолом, сушили над MgSO4 и растворитель упаривали в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель; DCM в качестве элюента). Желаемые фракции собирали и упаривали в вакууме с получением промежуточного соединения 5 (8,83 г,64%). К раствору промежуточного соединения 4 (39 г, 203 ммоль) в DMF (600 мл) добавляли Р(=О)Br3(116 г, 406 ммоль) и смесь нагревали при 110 С в течение 1,5 ч. После охлаждения в ледяной бане раствор распределяли между водой и EtOAc. После трех экстракций EtOAc объединенные органические фракции промывали рассолом, сушили над Na2SO4 и растворитель упаривали в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель; DCM в качестве элюента). Желаемые фракции собирали и упаривали в вакууме с получением промежуточного соединения 6 (36,7 г,72%). Пример А.7. 4-Гидрокси-4-фенилпиперидин-1-карбоновой кислоты трет-бутиловый эфир (промежуточное соединение 7) К раствору 4-гидрокси-4-фенилпиперидина (2 г, 11,28 ммоль) в дихлорметане (50 мл) при комнатной температуре добавляли ди-трет-бутилдикарбонат (2,95 г, 13,53 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 5 ч. Летучие вещества выпаривали в вакууме с получением неочищенного промежуточного соединения 7, используемого без дополнительной очистки (3,12 г,100%). Пример А.8. 4-Фтор-4-фенилпиперидин-1-карбоновой кислоты трет-бутиловый эфир (промежуточное соединение 8) Реакцию осуществляли в атмосфере азота. К раствору трифторида (диэтиламино)серы (0,74 мл, 5,67 ммоль) в дихлорметане (30 мл), предварительно охлажденному до -78 С, добавляли по каплям раствор промежуточного соединения 7 (1,5 г, 5,4 ммоль) в дихлорметане (30 мл). Полученную смесь затем перемешивали при -78 С в течение 1 ч и затем реакционную смесь оставляли нагреваться до комнатной температуры и дополнительно перемешивали в течение 30 мин. Добавляли NaHCO3 (водный насыщенный раствор, 90 мл) и смесь перемешивали в течение 15 мин. Органический слой отделяли и обрабатывали 3 хлорпероксибензойной кислотой (0,2 г, 1,18 ммоль) и перемешивали в течение 30 мин. Реакционную смесь промывали последовательно NaHCO3 (водный насыщенный раствор), водой и рассолом. Органический слой сушили над Na2SO4 и упаривали в вакууме с получением неочищенного промежуточного соединения 8, используемого без дополнительной очистки (1,5 г, 100%). Пример А.9. 4-Фтор-4-фенилпиперидина гидрохлорид (промежуточное соединение 9) Промежуточное соединение 8 (1,5 г, 5,37 ммоль) растворяли в соляной кислоте (4 н. в 1,4-диоксане,20 мл) и полученный раствор перемешивали при комнатной температуре в течение 2 ч. Летучие вещества упаривали в вакууме и полученный таким образом остаток обрабатывали диэтиловым эфиром с получением промежуточного соединения 9 в виде твердого вещества (1,15 г, 100%; HCl). Пример А.10. 1-Бензил-4-фенилпиперидин-4-карбоновой кислоты бензиловый эфир (промежуточное соединение 10) 4-Фенил-4-пиперидинкарбоновой кислоты 4-метилбензолсульфонат (CAS 83949-32-0) (2 г, 5,3 ммоль), бензилбромид (0,76 мл, 6,36 ммоль) и карбонат калия (2,92 г, 21,2 ммоль) суспендировали в ацетонитриле (6 мл) и нагревали при 130 С в течение 15 мин с использованием микроволнового излучения. Охлажденную реакционную смесь фильтровали через слой диатомовой земли. Слой диатомовой земли промывали ацетонитрилом, EtOAc и дихлорметаном. Объединенные органические фильтраты упаривали- 18017280 в вакууме с получением неочищенного промежуточного соединения 10 (2,04 г, 100%), используемого без дополнительной очистки. Пример А.11. (1-Бензил-4-фенилпиперидин-4-ил)метанол (промежуточное соединение 11) Реакцию осуществляли в атмосфере азота. Промежуточное соединение 10 (2,04 г, 5,3 ммоль) суспендировали в сухом тетрагидрофуране (25 мл) и смесь охлаждали до -78 С. Добавляли по каплям алюмогидрид лития (1 M в тетрагидрофуране, 7,95 мл, 7,95 ммоль). Полученную реакционную смесь постепенно нагревали до комнатной температуры и дополнительно перемешивали в течение 2 ч. ДобавлялиNH4Cl (водный насыщенный раствор) и реакционную смесь экстрагировали сначала EtOAc, а затем 1 гидроксибутаном. Объединенные органические экстракты сушили над Na2SO4 и упаривали в вакууме с получением неочищенного промежуточного соединения 11 (0,65 г, 43%), используемого без дополнительной очистки. Пример А.12. (4-Фенилпиперидин-4-ил)метанол (промежуточное соединение 12) Реакцию осуществляли в атмосфере азота. Промежуточное соединение 11 (0,65 г, 2,31 ммоль) суспендировали в метаноле (10 мл) и затем добавляли 1,4-циклогексадиен (2,17 мл, 23,1 ммоль) и 10% палладия на активированном углероде (0,65 г). Полученную смесь нагревали при 100 С в течение 24 ч в запаянной трубке. Охлажденную реакционную смесь фильтровали через слой диатомовой земли. Слой диатомовой земли промывали последовательно метанолом и 7 н. раствором метанола, насыщенного аммиаком. Объединенные органические фильтраты упаривали в вакууме с получением неочищенного промежуточного соединения 12 (0,47 г, 100%), используемого без дополнительной очистки. Пример А.13. 1'-Бутил-4-гидрокси-2'-оксо-4-(4-хлорфенил)-3,4,5,6,1',2'-гексагидро-2 Н-[1,4']бипиридинил-3'-карбонитрил (промежуточное соединение 13) Смесь промежуточного соединения 6 (0,255 г, 1,39 ммоль), 4-(4-хлорфенил)-4-гидроксипиперидина(C.A.S. 39512-49-7) (0,265 г, 1,25 ммоль) и N,N-диизопропилэтиламина (0,348 мл, 2 ммоль) в ацетонитриле (2,5 мл) нагревали в микроволновой печи при 150 С в течение 10 мин. Реакционную смесь разбавлялиNaHCO3 (водный насыщенный раствор) и экстрагировали DCM. Органический слой сушили над Na2SO4 и упаривали в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель; от DCM до DCM/EtOAc 9:1 до 1:9). Желаемые фракции собирали и упаривали в вакууме с получением промежуточного соединения 13 (0,357 г, 93%). 1'-Бутил-4-гидрокси-2'-оксо-4-(3-хлорфенил)-3,4,5,6,1',2'-гексагидро-2H-[1,4']бипиридинил-3'-карбонитрил (промежуточное соединение 13 а) Промежуточное соединение 13 а получали согласно протоколу для промежуточного соединения 13,но используя в качестве исходного вещества 4-(3-хлорфенил)-4-гидроксипиперидин. Пример А.14. 1'-Бутил-4-фторэтилокси-2'-оксо-4-(4-хлорфенил)-3,4,5,6,1',2'-гексагидро-2 Н[1,4']бипиридинил-3'-карбонитрил (промежуточное соединение 14) К NaH (0,020 г, 0,5 ммоль, 60% в минеральном масле) при 0 С добавляли по каплям фторэтил-4 толуолсульфонат (C.A.S. 383-50-3) (0,063 г, 0,029 ммоль) в DME (2 мл). Смесь перемешивали при комнатной температуре в течение 15 мин. Затем добавляли промежуточное соединение 13 (0,1 г, 0,26 ммоль) в DME (1 мл), и реакционную смесь нагревали в микроволновой печи при 150 С в течение 15 мин. Затем- 19017280 добавляли NH4Cl (водный насыщенный раствор). Полученную смесь экстрагировали AcOEt. Органический слой сушили над Na2SO4 и упаривали в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель; от DCM до DCM/EtOAc 9:1). Желаемые фракции собирали и упаривали в вакууме с получением промежуточного соединения 14 (0,038 г, 34%). Для получения 1'-бутил-4-фторэтилокси-2'-оксо-4-(3-хлорфенил)-3,4,5,6,1',2'-гексагидро-2 Н[1,4']бипиридинил-3'-карбонитрила (промежуточное соединение 14 а), промежуточное соединение 13 а подвергают взаимодействию согласно протоколу получения промежуточного соединения 14. В. Получение конечных соединений. Пример В.1. 1'-Циклопропилметил-4-фтор-2'-оксо-4-фенил-3,4,5,6,1',2'-гексагидро-2H-[1,4']бипиридинил-3'-карбонитрил (соединение 1) Смесь промежуточного соединения 5 (1,0 г, 4,84 ммоль), промежуточного соединения 9 (1,15 г, 5,33 ммоль) и N,N-диизопропилэтиламина (3,3 мл, 19,36 ммоль) в ацетонитриле (3 мл) нагревали в микроволновой печи при 150 С в течение 15 мин. Смесь охлаждали до комнатной температуры и растворители упаривали в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель; от DCM до DCM/MeOH(NH3) вплоть до 5% в качестве элюента). Желаемые фракции собирали и упаривали в вакууме с получением соединения 1 в виде бледно-желтого твердого вещества (0,874 г, 51%) Пример В.2. 1'-Бутил-4-фтор-2'-оксо-4-фенил-3,4,5,6,1',2'-гексагидро-2H-[1,4']бипиридинил-3'карбонитрил (соединение 2) Смесь промежуточного соединения 6 (0,354 г, 1,39 ммоль), промежуточного соединения 9 (0,3 г,1,39 ммоль) и N,N-диизопропилэтиламина (0,72 мл, 4,17 ммоль) в ацетонитриле (3 мл) нагревали в микроволновой печи при 150 С в течение 15 мин. Смесь охлаждали до комнатной температуры и растворители упаривали в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель; от DCM до DCM/MeOH(NH3) вплоть до 10% в качестве элюента). Желаемые фракции собирали и упаривали в вакууме с получением соединения 2 в виде бледно-розового твердого вещества (0,104 г,21%). Пример В.3 1'-Циклопропилметил-4-гидроксиметил-2'-оксо-4-фенил-3,4,5,6,1',2'-гексагидро-2H[1,4']бипиридинил-3'-карбонитрил (соединение 3) Смесь промежуточного соединения 5 (0,32 г, 1,3 ммоль), промежуточного соединения 12 (0,25 г, 1,3 ммоль) и N,N-диизопропилэтиламина (0,45 мл, 2,6 ммоль) в ацетонитриле (3 мл) нагревали в микроволновой печи при 150 С в течение 15 мин. Смесь охлаждали до комнатной температуры и растворители упаривали в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель; от DCM до DCM/MeOH(NH3) вплоть до 10% в качестве элюента). Желаемые фракции собирали и упаривали в вакууме с получением соединения 3 в виде масла (0,385 г, 81%). Пример В.4. 1'-Бутил-4-гидроксиметил-2'-оксо-4-фенил-3,4,5,6,1',2'-гексагидро-2 Н-[1,4']бипиридинил-3'-карбонитрил (соединение 4) Смесь промежуточного соединения 6 (0,267 г, 1,04 ммоль), промежуточного соединения 12 (0,2 г,1,04 ммоль) и N,N-диизопропилэтиламина (0,54 мл, 3,12 ммоль) в ацетонитриле (2 мл) нагревали в микроволновой печи при 150 С в течение 15 мин. Смесь охлаждали до комнатной температуры и растворители упаривали в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель; от DCM до DCM/MeOH(NH3) вплоть до 10% в качестве элюента). Желаемые фракции собира- 20017280 ли и упаривали в вакууме с получением соединения 4 в виде бледно-коричневого твердого вещества Реакцию осуществляли в атмосфере азота. К раствору трифторида (диэтиламино)серы (0,145 мл,1,11 ммоль) в дихлорметане (30 мл), предварительно охлажденному до -78 С, добавляли по каплям раствор соединения 3 (0,385 г, 1,06 ммоль) в дихлорметане (30 мл). Полученную смесь затем перемешивали при -78 С в течение 1 ч, затем реакционную смесь оставляли нагреваться до комнатной температуры и дополнительно перемешивали в течение 30 мин. Добавляли NaHCO3 (водный насыщенный раствор, 90 мл) и смесь перемешивали в течение 15 мин. Органический слой отделяли и обрабатывали 3 хлорпероксибензойной кислотой (0,047 г, 0,27 ммоль) и перемешивали в течение 30 мин. Реакционную смесь промывали последовательно NaHCO3 (водный насыщенный раствор), водой и рассолом. Органический слой сушили над Na2SO4 и упаривали в вакууме. Неочищенный продукт очищали с помощью препаративной HPLC с обращенной фазой с получением соединения 5 (0,112 г, 29%). Пример В.6. 1'-Бутил-4-фторметил-2'-оксо-4-фенил-3,4,5,6,1',2'-гексагидро-2 Н-[1,4']бипиридинил-3'карбонитрил (соединение 6) Реакцию осуществляли в атмосфере азота. К раствору трифторида (диэтиламино)серы (0,075 мл,0,57 ммоль) в дихлорметане (15 мл), предварительно охлажденному до -78 С, добавляли по каплям раствор соединения 4 (0,20 г, 0,54 ммоль) в дихлорметане (15 мл). Полученную смесь затем перемешивали при -78 С в течение 1 ч и затем реакционную смесь оставляли нагреваться до комнатной температуры и дополнительно перемешивали в течение 30 мин. Добавляли NaHCO3 (водный насыщенный раствор, 90 мл) и смесь перемешивали в течение 15 мин. Органический слой отделяли и обрабатывали 3 хлорпероксибензойной кислотой (0,024 г, 0,14 ммоль) и перемешивали в течение 30 мин. Реакционную смесь промывали последовательно NaHCO3 (водный насыщенный раствор), водой и рассолом. Органический слой сушили над Na2SO4 и упаривали в вакууме. Неочищенный продукт очищали с помощью колоночной хроматографии (силикагель; от DCM до DCM/EtOAc вплоть до 20% в качестве элюента). Желаемые фракции собирали и упаривали в вакууме с получением соединения 6 в виде белого твердого вещества (0,035 г, 17%). Пример В.7. 1'-Бутил-4-фторэтилокси-2'-оксо-4-фенил-3,4,5,6,1',2'-гексагидро-2 Н-[1,4']бипиридинил-3'-карбонитрил (соединение 7) Раствор промежуточного соединения 14 (0,038 г, 0,09 ммоль) в метаноле (2 мл) и триэтиламине(0,025 мл, 0,18 ммоль) гидрировали при комнатной температуре в присутствии 10% палладия на активированном углероде (0,005 г) в течение 2 ч. Твердые вещества отфильтровывали и фильтрат упаривали досуха. Неочищенную реакционную смесь затем очищали с помощью колоночной хроматографии (силикагель; от DCM до DCM/MeOH вплоть до 1 % в качестве элюента). Желаемые фракции собирали и упаривали в вакууме с получением соединения 7 (0,019 г, 53%). Альтернативный путь получения соединения 7 состоит во взаимодействии промежуточного соединения 14 а согласно вышеуказанному протоколу. Смесь промежуточного соединения 5 (0,3 г, 1,18 ммоль), 4-фенилпиперидина (0,286 г, 1,77 ммоль) и диизопропилэтиламина (0,615 мл, 3,54 ммоль) в ацетонитриле (5 мл) нагревали в микроволновой печи при 150 С в течение 20 мин. Смесь охлаждали до комнатной температуры и растворители упаривали в вакууме. Полученный таким образом остаток очищали с помощью флэш-хроматографии (SiO2, смесиDCM/MeOH(NH3 с получением желательного соединения. Соединение затем перекристаллизовывали из этилового эфира с получением соединения 8 (0,29 г, 73%). Соединение 9 получали согласно протоколу, описанному для соединения 8. В табл. 1 перечислены соединения формулы (I), которые получали согласно одному из вышеприведенных примеров ( Пр.). Таблица 1 С. Аналитическая часть. Для LCMS-характеристики соединений по настоящему изобретению использовали следующий способ.HPLC измерение осуществляли с использованием HP 1100 от Agilent Technologies, включающего насос (четвертичный или бинарный) с дегазатором, автодозатор, колоночный термостат, диодноматричный детектор (DAD) и колонку, как определено в соответствующих способах ниже. Поток из колонки ответвляется в MS-детектор. MS-детектор оснащен источником ионизации электрораспылением. Азот использовали в качестве газа для небулайзера. Температуру источника поддерживали при 140 С. Сбор данных осуществляли с помощью программного обеспечения MassLynx-Openlynx. Способ 1. В дополнение к общей методике: HPLC с обращенной фазой осуществляли на картридже XDB-C18(1,8 мкм, 2,130 мм) от Agilent, со скоростью потока 1 мл/мин, при 60 С. Используемые градиентные условия: 90% А (0,5 г/л раствора ацетата аммония), 5% В (ацетонитрил), 5% С (метанол) до 50% В и 50% С через 6,5 мин, до 100% В в течение 7 мин и уравновешивали до первоначальных условий при 7,5 до 9,0- 22017280 мин. Объем инжекции 2 мкл. Масс-спектры высокого разрешения (время пролета от англ. Time of Flight,TOF) получали только в режиме ионизации положительными ионами путем сканирования от 100 до 750 через 0,5 с с использованием времени выдержки 0,1 с. Напряжение на капиллярной игле составляло 2,5 кВ, а напряжение на конусе составляло 20 В. Лейцин-энкефалин был стандартным веществом, используемым для калибровки фиксированных масс. Способ 2. В дополнение к общей методике: HPLC с обращенной фазой осуществляли на колонке LUNA-C18(2,5 мкм, 2,130 мм) от Phenomenex, со скоростью потока 1,0 мл/мин, при 60 С. Используемые градиентные условия: 90% А (0,5 г/л раствора ацетата аммония), 5% В (ацетонитрил), 5% С (метанол) до 50% В и 50% С через 6,5 мин, до 100% В в течение 7 мин и уравновешивали до первоначальных условий при 7,5 до 9,0 мин. Объем инжекции 5 мкл. Масс-спектры высокого разрешения (время пролета, TOF) получали только в режиме ионизации положительными ионами путем сканирования от 100 до 750 через 0,5 с с использованием времени выдержки 0,1 с. Напряжение на капиллярной игле составляло 2,5 кВ для режима ионизации положительными ионами, а напряжение на конусе составляло 20 В. Лейцин-энкефалин был стандартным веществом, используемым для калибровки фиксированных масс. Способ 3. В дополнение к общей методике: HPLC с обращенной фазой осуществляли на колонке АСЕ-С 18(3,0 мкм, 4,630 мм) от Advanced Chromatography Technologies, со скоростью потока 1,5 мл/мин, при 40 С. Используемые градиентные условия: 80% А (0,5 г/л раствора ацетата аммония), 10% В (ацетонитрил), 10% С (метанол) до 50% В и 50% С через 6,5 мин, до 100% В в течение 7 мин и уравновешивали до первоначальных условий при 7,5 минах до 9,0 мин. Объем инжекции 5 мкл. Масс-спектры высокого разрешения (время пролета, TOF) получали только в режиме ионизации положительными ионами путем сканирования от 100 до 750 через 0,5 с с использованием времени выдержки 0,1 с. Напряжение на капиллярной игле составляло 2,5 кВ для режима ионизации положительными ионами, а напряжение на конусе составляло 20 В. Лейцин-энкефалин был стандартным веществом, используемым для калибровки фиксированных масс. Определение точки плавления. Определения точек плавления осуществляли на аппарате Mettler FP62. Таблица 2 Аналитические данные (Rt означает время удерживания в минутах; (МН)+ означает протонированную массу соединения (свободное основаниеD. Фармакологические примеры. Соединения, предложенные в настоящем изобретении, являются положительными аллостерическими модуляторами mGluR2. Эти соединения, по-видимому, потенцируют глутаматные ответы путем связывания с аллостерическим сайтом, а не с сайтом связывания глутамата. Ответ mGluR2 на концентрацию глутамата увеличивается, когда присутствуют соединения формулы (I). Соединения формулы (I), как ожидают, будут оказывать свой эффект, по существу, на mGluR2 благодаря их способности усиливать функцию данного рецептора. Поведение положительных аллостерических модуляторов, тестируемых наmGluR2 с использованием способа определения связывания [35S]GTPS, описанного ниже, и который подходит для идентификации таких соединений, и более конкретно соединений формулы (I), показано в табл. 3. Анализ связывания [35S]GTPS. Анализ связывания [35S]GTPS представляет собой функциональный анализ на основе мембран, используемый для исследования функции G-белок-сопряженного рецептора (GPCR), где измеряют включение негидролизуемой формы GTP, [35S]GTPS (гуанозин-5'-трифосфат, меченный гамма-излучающим 35(GTP) и при активации GPCR агонистом, [35S]GTPS, встраивается и не может расщепляться для продолжения цикла обмена (Harper (1998) Current Protocols in Pharmacology 2.6.1-10, John WileySons,Inc.). Количество включения радиоактивного [35S]GTPS является прямым показателем активности Gбелка, и, следовательно, можно определить активность данного агониста. mGluR2 рецепторы, как пока- 23017280 зано, предпочтительно связываются с Gi-белком, предпочтительным агентом сочетания для этого способа, и поэтому его широко используют для исследования рецепторной активации mGluR2 рецепторов как в рекомбинантных клеточных линиях, так и в тканях (Schaffhauser et al. 2003, Pinkerton et al. 2004,Mutel et al. (1998) Journal of Neurochemistry, 71:2558-64; Schaffhauser et al. (1998) Molecular Pharmacology 53:228-33). Здесь авторы изобретения описывают применение анализа связывания [35S]GTPS с использованием мембран из клеток, трансфицированных человеческим mGluR2 рецептором и адаптированных из Schaffhauser и др. 2003) Molecular Pharmacology 4:798-810), для детекции свойств соединений по данному изобретению в отношении положительной аллостерической модуляции (РАМ). Получение мембран. Клетки СНО культивировали до достижения почти монослоя и стимулировали 5 мМ бутирата в течение 24 ч, затем промывали в PBS и затем собирали путем соскабливания в буфере для гомогенизации(50 мМ трис-HCl буфер, рН 7,4, 4 С). Клеточные лизаты гомогенизировали в течение короткого периода времени (15 с) с использованием гомогенизатора ultra-turrax. Гомогенат центрифугировали при 23500g в течение 10 мин и супернатант отбрасывали. Осадок ресуспендировали в 5 мМ трис-HCl, рН 7,4 и снова центрифугировали (30000g, 20 мин, 4 С). Конечный осадок ресуспендировали в 50 мМ HEPES, рН 7,4,и хранили при -80 С в подходящих аликвотах до применения. Концентрацию белка определяли по методу Бредфорда (Bio-Rad, США) с бычьим сывороточным альбумином в качестве стандарта. Анализ связывания [35S]GTPS. Измерение положительной аллостерической модуляторной активности тестируемых соединений в отношении mGluR2 в мембранах, содержащих человеческий mGluR2, осуществляли с использованием замороженных мембран, которые оттаивали и гомогенизировали в течение короткого периода времени перед предварительной инкубацией в 96-луночных микропланшетах (15 мкг/лунку для образца, 30 мин,30 С) в буфере для анализа (50 мМ HEPES рН 7,4, 100 мМ NaCl, 3 мМ MgCl2, 50 мкМ GDP, 10 мкг/мл сапонина) с увеличивающимися концентрациями положительного аллостерического модулятора (от 0,3 нМ до 50 мкМ) и либо минимальной заданной концентрацией глутамата (РАМ анализ), либо без добавления глутамата. Для РАМ анализа мембраны предварительно инкубировали с глутаматом при ЕС 25 концентрации, т.е. концентрации, которая дает 25% максимального ответа глутамата и соответствует опубликованным данным (Pin et al. (1999) Eur. J. Pharmacol. 375:277-294). После добавления [35S]GTPS (0,1 нМ, f.c.) для достижения общего объема реакции 200 мкл микропланшеты встряхивали в течение короткого периода времени и дополнительно инкубировали для того, чтобы [35S]GTPS мог включиться при активации (30 мин, 30 С). Реакцию останавливали быстрой вакуумной фильтрацией через стекловолоконные фильтр-планшеты (Unifilter 96-луночные GF/B фильтр-планшеты, Perkin-Elmer, Downers Grove,США) с использованием коллектора клеток для 96-луночных планшетов (Filtermate, Perkin-Elmer, США) и затем промывкой три раза 300 мкл ледяного буфера для промывки (Na2PO42H2O 10 мМ, NaH2PO4H2O 10 мМ, рН 7,4). Фильтры затем сушили на воздухе и в каждую лунку добавляли 40 мкл жидкостного сцинтилляционного коктейля (Microscint-O), и связанный с мембранами [35S]GTPS измеряли в 96 луночном сцинтилляционном планшет-ридере (Top-Count, Perkin-Elmer, США). Неспецифическое связывание [35S]GTPS определяют в присутствии 10 мкМ немеченого GTP. Каждую кривую получали по меньшей мере один раз, используя повторный образец для точки на графике и при 11 концентрациях. Анализ данных. Кривые зависимости ответа от концентрации репрезентативных соединений по настоящему изобретению в присутствии добавленной ЕС 25 агониста mGluR2, глутамата, для определения положительной аллостерической модуляции (РАМ) получали с использованием программного обеспечения Prism GraphPad (Graph Pad Inc., San Diego, США). Кривые подгоняли к четырехпараметрическому логистическому уравнению (Y=Bottom+(Top-Bottom)/(1+10LogEC50-X)Hill Slope), позволяющему определять значенияEC50. ЕС 50 представляет собой концентрацию соединения, которая вызывает полумаксимальное усиление глутаматного ответа. Ее вычисляют путем вычитания максимальных ответов глутамата в присутствии полностью насыщающей концентрации положительного аллостерического модулятора из ответа глутамата в отсутствие положительного аллостерического модулятора. Концентрацию, дающую полумаксимальный эффект, затем рассчитывают как ЕС 50.- 24017280 Таблица 3 Фармакологические данные для соединений по изобретению Все соединения тестировали в присутствии агониста mGluR2, глутамата, при заданной концентрации ЕС 25 для определения положительной аллостерической модуляции (GTPS-PAM). Приведенные значения представляют собой средние повторных значений кривых ответа для 11 концентраций по меньшей мере из одного эксперимента. Все тестируемые соединения продемонстрировали значение pEC50(-logEC50) более чем 5,0. Считают, что ошибка определения значения pEC50 для одного эксперимента составляет примерно 0,3 log-единиц. Е. Примеры композиций."Активный ингредиент", как использовано во всех этих примерах, относится к конечному соединению формулы (I), его фармацевтически приемлемым солям, сольватам и его стереохимически изомерным формам. Типичные примеры составов для препарата по изобретению являются следующими. 1. Таблетки В этом примере активный ингредиент можно заменить таким же количеством любого из соединений по настоящему изобретению, в частности таким же количеством любого из приведенных в примерах соединений. 2. Суспензия. Водную суспензию получают для перорального введения таким образом, что каждый 1 мл содержит от 1 до 5 мг одного из активных соединений, 50 мг натрий-карбоксиметилцеллюлозы, 1 мг бензоата натрия, 500 мг сорбита и воду до 1 мл. 3. Для инъекций. Парентеральную композицию получают путем смешивания 1,5 мас.% активного ингредиента по изобретению в 10 об.% пропиленгликоля в воде. 4. Мазь В этом примере активный ингредиент можно заменить таким же количеством любого из соединений по настоящему изобретению, в частности таким же количеством любого из приведенных в примерах соединений. Разумные вариации не следует рассматривать как отклонение от объема изобретения. Очевидно,что описанное таким образом изобретение может изменяться различными путями специалистами в данной области. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) включая любую его стереохимически изомерную форму, гдеR3 представляет собой водород или галогено; при условии, что если R3 представляет собой галогено, то R2 представляет собой гидроксил,которое не представляет собой или его фармацевтически приемлемая соль либо его сольват. 2. Соединение по п.1, имеющее следующую формулу: включая любую его стереохимически изомерную форму, гдеR2 представляет собой водород; фторо; C1-4 алкил, замещенный гидроксилом; C1-4 алкил, замещенный фторо; или C1-4 алкилокси, замещенный фторо,или его фармацевтически приемлемая соль или его сольват. 3. Соединение по любому из пп.1, 2, где R1 представляет собой 1-бутил или циклопропилметил. 4. Соединение по любому из пп.1-3, где R2 представляет собой фторо; или где R2 представляет собой C1-4 алкил, замещенный гидроксилом, предпочтительно метил, замещенный гидроксилом; или где R2 представляет собой C1-4 алкил, замещенный фторо, предпочтительно метил, замещенный фторо; или где включая любую его стереохимически изомерную форму, гдеR3 представляет собой водород или галогено,или его фармацевтически приемлемая соль или его сольват. 6. Соединение по п.5, где R3 представляет собой хлоро. 7. Соединение по п.6, представляющее собой или его фармацевтически приемлемая соль либо его сольват. 8. Соединение по п.1, где R1 представляет собой 1-бутил, 3-метил-1-бутил или циклопропилметил;R2 представляет собой водород; фторо; метил, замещенный гидроксилом; метил, замещенный фторо; этилокси, замещенный фторо; или где R1 представляет собой 1-бутил или циклопропилметил; R2 представляет собой фторо; метил, замещенный гидроксилом; метил, замещенный фторо; этилокси, замещен- 26017280 ный фторо. 9. Применение соединения по любому из пп.1-8 в качестве лекарственного средства. 10. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-8 и фармацевтически приемлемый носитель или разбавитель. 11. Применение соединения по любому из пп.1-8 для изготовления лекарственного средства для лечения или предупреждения расстройства центральной нервной системы, выбранного из группы, состоящей из тревожных расстройств, психотических расстройств, расстройств личности, расстройств, связанных с веществами, расстройств питания, расстройств настроения, мигрени, эпилепсии или судорожных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации, нейротоксичности и ишемии. 12. Применение по п.11, где расстройство центральной нервной системы представляет собой тревожное расстройство, выбранное из группы, состоящей из агорафобии, генерализованного тревожного расстройства (GAD), обсессивно-компульсивного расстройства (OCD), панического расстройства, посттравматического стрессового расстройства (PTSD), социофобии и других фобий; или где расстройство центральной нервной системы представляет собой психотическое расстройство, выбранное из группы,состоящей из шизофрении, бредового расстройства, шизоаффективного расстройства, шизофреноформного расстройства и психотического расстройства, индуцированного веществами; или где расстройство центральной нервной системы представляет собой расстройство личности, выбранное из группы, состоящей из обсессивно-компульсивного расстройства личности и шизоидного, шизотипического расстройства; или где расстройство центральной нервной системы представляет собой расстройство, связанное с веществами, выбранное из группы, состоящей из злоупотребления алкоголем, алкогольной зависимости, алкогольной абстиненции, бреда при алкогольной абстиненции, психотического расстройства, индуцированного алкоголем, амфетаминовой зависимости, амфетаминовой абстиненции, кокаиновой зависимости, кокаиновой абстиненции, никотиновой зависимости, никотиновой абстиненции, опиоидной зависимости и опиоидной абстиненции; или где расстройство центральной нервной системы представляет собой расстройство питания, выбранное из группы, состоящей из нервной анорексии и нервной булимии; или где расстройство центральной нервной системы представляет собой расстройство настроения, выбранное из группы, состоящей из биполярных расстройств (I и II), циклотимического расстройства, депрессии, дистимического расстройства, глубокого депрессивного расстройства и расстройства настроения, индуцированного веществами; или где расстройство центральной нервной системы представляет собой мигрень; или где расстройство центральной нервной системы представляет собой эпилепсию или судорожное расстройство, выбранное из группы, состоящей из генерализованной бессудорожной эпилепсии, генерализованной судорожной эпилепсии, малого эпилептического припадка, большого эпилептического припадка, парциальной эпилепсии с нарушением сознания или без нарушения сознания, младенческих судорог, хронической прогрессирующей парциальной эпилепсии (epilepsy partialiscontinua) и других форм эпилепсии; или где расстройство центральной нервной системы представляет собой детское расстройство, например расстройство дефицита внимания/гиперактивности; или где расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из группы, состоящей из делирия, персистирующего делирия, индуцированного веществами, деменции,деменции вследствие ВИЧ-заболевания, деменции вследствие болезни Хантингтона, деменции вследствие болезни Паркинсона, деменции альцгеймеровского типа, персистирующей деменции, индуцированной веществами, и умеренного когнитивного нарушения; или где расстройство центральной нервной системы выбрано группы, состоящей из тревоги, шизофрении, мигрени, депрессии и эпилепсии. 13. Применение соединения по любому из пп.1-8 в комбинации с ортостерическим агонистомmGluR2 для изготовления лекарственного средства для лечения или предупреждения состояния, указанного в любом из пп.11, 12, у млекопитающего, включая человека. 14. Способ получения соединения по п.1, включающий стадии: а) взаимодействия промежуточного соединения формулы (II), где Y представляет собой подходящую уходящую группу, с промежуточным соединением формулы (III) при нагревании, в подходящем реакционно-инертном растворителе, в присутствии подходящего основания, или взаимодействия промежуточного соединения формулы (II) с промежуточным соединением формулы (III) при нагревании, в подходящем реакционно-инертном растворителе, в присутствии подходящего основания, подходящего катализатора- 27017280 б) взаимодействия соединения формулы (I-b) с подходящим фторирующим агентом в подходящем реакционно-инертном растворителе при умеренно низкой температуре где L представляет собой C1-4 алкил и R1 является таким, как определено в п.1; в) взаимодействия промежуточного соединения формулы (IV) с подходящим фторирующим агентом в подходящем реакционно-инертном растворителе при умеренно низкой температуре где R1 является таким, как определено в п.1; г) гидрирования промежуточного соединения формулы (XIV) в подходящем растворителе и в присутствии подходящего катализатора и подходящего основания где R1 является таким, как определено в п.1, и R'2 представляет собой C1-4 алкилокси, замещенный фторо; и, возможно, дополнительного превращения соединений формулы (I) друг в друга; возможно, превращения соединений формулы (I) в терапевтически активную нетоксичную соль присоединения кислоты путем обработки кислотой, или превращения формы соли присоединения кислоты в свободное основание путем обработки щелочью; или, возможно, получения его стереохимически изомерных форм.
МПК / Метки
МПК: A61P 25/28, A61K 31/4545, C07D 401/04
Метки: производные, 3-циано-4-(4-фенилпиперидин-1-ил)пиридин-2-она
Код ссылки
<a href="https://eas.patents.su/29-17280-proizvodnye-3-ciano-4-4-fenilpiperidin-1-ilpiridin-2-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3-циано-4-(4-фенилпиперидин-1-ил)пиридин-2-она</a>
Предыдущий патент: Бивалентные миметики smac и их применения
Следующий патент: Производные пиримидинилпиридазинона
Случайный патент: Производные цефалоспорина и их фармацевтические композиции


































