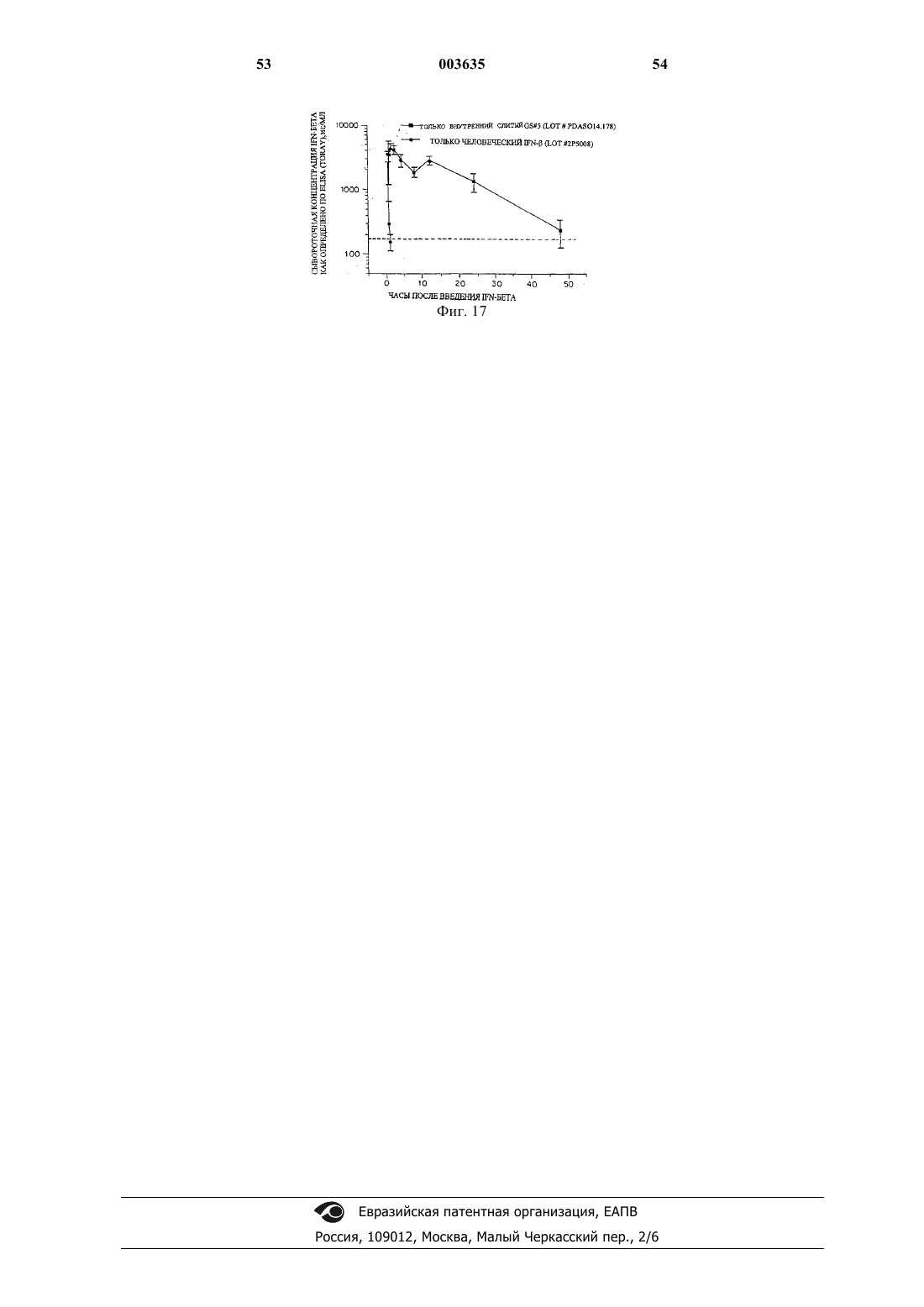
Комплекс ifnar2/ifn
Номер патента: 3635
Опубликовано: 28.08.2003
Авторы: Эл Тэйер Нэйбил, Теппер Марк, Каннингхэм Марк, Маккенна Син, Шеррис Дэвид
Формула / Реферат
1. Комплекс, включающий интерферон (IFN) типа I и субъединицу рецептора человеческого интерферона a /b (IFNAR), которая способна связываться с IFN типа I комплекса, в котором указанный IFN типа I представляет собой:
a) нативный IFN типа I;
b) фрагмент a), который обладает биологической активностью IFN типа I;
c) вариант a) или b), который обладает, по меньшей мере, 70% идентичностью последовательности с a) или b) и который обладает биологической активностью IFN типа I;
d) вариант a) или b), который кодируется последовательностью ДНК, которая гибридизуется с комплементом последовательности нативной ДНК, кодирующей a) или b) при умеренно строгих условиях, и который обладает биологической активностью IFN типа I; или
e) соль или функциональное производное a), b), c) или d), которое обладает биологической активностью IFN типа I; и в котором указанный IFNAR представляет собой:
f) полипептидную цепь нативного человеческого IFNAR;
g) фрагмент f), который обладает биологической активностью IFNAR;
h) вариант f) или g), который обладает, по меньшей мере, 70% идентичностью последовательности с f) или g) и который обладает биологической активностью IFNAR;
i) вариант f) или g), который кодируется последовательностью ДНК, которая гибридизуется с комплементом последовательности нативной ДНК, кодирующей f) или g) при умеренно строгих условиях, и который обладает биологической активностью IFNAR; или
j) соль или функциональное производное f), g), h) или i), которое обладают биологической активностью IFNAR.
2. Комплекс по п.1, отличающийся тем, что указанный IFN типа I связан с указанным IFNAR ковалентной связью.
3. Комплекс по п.1, отличающийся тем, что указанный IFN типа I связан с указанным IFNAR пептидной связью.
4. Комплекс по п.3, отличающийся тем, что указанный IFN типа I связан с указанным IFNAR посредством пептидного линкера.
5. Комплекс по п.4, отличающийся тем, что указанный пептидный линкер представляет собой (GGGGS)n, где n=1-5.
6. Комплекс по любому из пп.1-5, отличающийся тем, что указанный IFN типа I представляет собой IFNa , IFNb или IFNw .
7. Комплекс по п.5, отличающийся тем, что указанный IFN типа I представляет собой IFNb .
8. Комплекс по любому из пп.1-7, отличающийся тем, что указанный IFNAR представляет собой бета-субъединицу рецептора человеческого интерферона a /b (IFNAR2).
9. Молекула ДНК, кодирующая слитый белок по любому из пп.3-5.
10. Вектор, включающий молекулу ДНК по п.9.
11. Штамм клетки-хозяина, трансформированный вектором по п.10, таким образом, что позволяет экспрессировать указанный слитый белок.
12. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и комплекс по любому из пп.1-8.
13. Применение комплекса по любому из пп.1-8 в качестве лекарственного средства.
14. Применение комплекса по любому из пп.1-8 в противовирусной, противораковой или иммуномодулирующей терапии.
15. Применение комплекса по любому из пп.1-8 для пролонгирования действия IFN типа I у пациента in vivo.
16. Лекарственное средство, включающее комплекс по п.1, полученный путем раздельного, одновременного или последовательного введения интерферон (IFN) типа I и субъединицы рецептора человеческого интерферона a /b (IFNAR) пациенту, нуждающемуся в противовирусной, противораковой или иммуномодулирующей терапии, в котором указанный IFN типа I представляет собой:
a) нативный IFN типа I;
b) фрагмент a), который обладает биологической активностью IFN типа I.
17. Лекарственное средство по п.16, отличающееся тем, что указанный интерферон (IFN) типа I и указанный IFNAR вводят отдельно и комплекс по любому из пп.1-8 образуется in vivo.
18. Лекарственное средство по п.16 или 17, отличающееся тем, что IFN представляет собой IFNa , IFNb или IFNw .
19. Лекарственное средство по п.18, отличающееся тем, что IFN представляет собой IFNb .
20. Лекарственное средство по любому из пп.16-19, отличающееся тем, что указанный IFNAR представляет собой бета-субъединицу рецептора человеческого интерферона a /b (IFNAR2).
21. Применение рецептора человеческого интерферона a /b (IFNAR) для производства лекарственного средства, содержащего комплекс по п.1, для усиления биологического действия интерферона (IFN) типа I, где указанный IFNAR представляет собой:
a) полипептидную цепь нативного человеческого IFNAR;
b) фрагмент a), обладающий биологической активностью IFNAR;
c) вариант a) или b), обладающий, по крайней мере, 70% идентичностью последовательности с a) или b) и который обладает биологической активностью IFNAR;
d) вариант a) или b), кодируемый последовательностью ДНК, которая гибридизуется в умеренно строгих условиях с последовательностью, комплементарной ДНК, кодирующей a) или b), причем указанный вариант обладает биологической активностью IFNAR; или
e) соль или функциональное производное a), b), c) или d), которое обладает биологической активностью IFNAR.
22. Применение интерферона (IFN) типа I и субъединицы рецептора человеческого интерферона a /b (IFNAR), способной связываться с указанным IFN типа I для производства лекарственного препарата, содержащего комплекс по п.1, обладающего пролонгированным действием IFN, причем указанный препарат получают in vivo путем раздельного, одновременного или последовательного введения составляющих указанного комплекса нуждающемуся в этом пациенту, где указанный IFN типа I представляет собой:
a) нативный IFN типа I;
b) фрагмент a), который обладает биологической активностью IFN типа I;
c) вариант a) или b), обладающий, по крайней мере, 70% идентичностью последовательности с a) или b) и который обладает биологической активностью IFN типа I;
d) вариант a) или b), кодируемый последовательностью ДНК, которая гибридизуется в умеренно строгих условиях с последовательностью, комплементарной ДНК, кодирующей a) или b), причем указанный вариант обладает биологической активностью IFN типа I; или
e) соль или функциональное производное a), b), c) или d), которое обладает биологической активностью IFN типа I;
и где указанный IFNAR представляет собой:
a) полипептидную цепь нативного человеческого IFNAR;
b) фрагмент a), обладающий биологической активностью IFNAR;
c) вариант a) или b), обладающий, по крайней мере, 70% идентичностью последовательности с a) или b) и который обладает биологической активностью IFNAR;
d) вариант a) или b), кодируемый последовательностью ДНК, которая гибридизуется в умеренно строгих условиях с последовательностью, комплементарной ДНК, кодирующей a) или b), причем указанный вариант обладает биологической активностью IFNAR; или
e) соль или функциональное производное a), b), c) или d), которое обладает биологической активностью IFNAR.
23. Применение комплекса по любому из пп.1-8 для производства лекарственного средства, используемого для пролонгирования действия IFN типа I in vivo.
24. Способ получения слитого белка, включающий культивирование штамма клетки хозяина по п.11 и выделение экспрессируемого слитого белка.
25. Способ улучшения сохраняемости интерферона типа I, включающий хранение указанного интерферона в форме комплекса по любому из пп.1-8.
Текст
1 Область изобретения Настоящее изобретение относится к комплексу интерферона типа I, составленному из полипептидной последовательности внеклеточного домена рецептора интерферона / (IFNAR2) интерферона типа I (IFN, IFN иIFN). Такой комплекс улучшает стабильность,увеличивает эффективность и пролонгирует фармакокинетику in vivo свободного IFN при антивирусной, противораковой и иммуномодулирующей активности. Конкретнее, этот комплекс представляет собой слитый белок, или ковалентный комплекс, или нековалентный комплекс, содержащий полипептидную последовательность целого внеклеточного доменаIFNAR2,или любой его интерферонсвязывающей субфракции, в комплексе с интерфероном типа I (IFN, IFN, IFN), или любой его биологически активной субфракцией. Предпосылки создания изобретения Интерфероны классифицируются как интерфероны типа I, производные лейкоцитов и фибробластов, или как митоген-индуцированные или "иммунные" интерфероны типа II(Pestka et al, 1987). По анализам идентичности последовательностей и общей биологической активности, интерфероны типа I включают интерферон альфа (IFN), интерферон бета (IFN) и интерферон омега (IFN), тогда как интерферон типа II включает интерферон гамма (IFN). Гены IFN, IFN и IFN собраны на коротком плече хромосомы 9 (Lengyl, 1982). Существует,по меньшей мере, 25 неаллельных генов IFN, 6 неаллельных генов IFN и один ген IFN. Считается, что все они развиваются из одного общего гена-предшественника. У генов IFN,внутри видов, по меньшей мере, 80% последовательности является общей, идентичной одна другой. У гена IFN приблизительно 50% последовательности идентично последовательности IFN, и ген IFN имеет приблизительно 70% последовательности, гомологичной IFN(Weissman et al, 1986; Dron et al, 1992). IFN имеет молекулярный вес, находящийся в интервале 17-23 кДа (165-166 аминокислот), IFN имеет молекулярный вес, равный 23 кДа (166 аминокислот) и IFN имеет молекулярный вес,24 кДа (172 аминокислоты). Интерфероны типа I являются плейотропными (множественного действия) цитокинами,обладающими активностью при защите организма-хозяина против вирусной и паразитической инфекций, в качестве противораковых цитокинов и как иммуномодуляторы (Baron et al,1994; Baron et al, 1991). Физиологические ответы интерферона типа I включают антипролиферативную активность на нормальных и трансформированных клетках; стимуляцию цитотоксической активности лимфоцитов, натуральных киллерных клеток (натуральных киллеров или НК-клеток) и фагоцитарных клеток (фагоцитов); 2 модуляцию клеточной дифференциации; стимуляцию экспрессии антигенов класса I МНС; ингибирование класса II МНС; и модуляцию ряда клеточных поверхностных рецепторов. В нормальных физиологических условиях IFN иIFN (IFN/) в основном секретируются большинством клеток человека на низком уровне, с увеличением экспрессии под влиянием добавления ряда индукторов, включающих инфицирующие агенты (вирусы, бактерии, микоплазму и простейших), dsRNA и цитокины (M-CSF, ILl, IL-2, TNF). Действие интерферона типа I inal, 1996). Интерфероны типа I (IFN//) действуют через клеточный поверхностный рецепторный комплекс, вызывая специфические биологические эффекты, такие как антивирусная, противораковая и иммуномодуляторная активность. Рецептор IFN типа I (IFNAR) представляет собой гетеромультимерный рецепторный комплекс, составленный, по меньшей мере, из двух различных полипептидных цепей (Colamonici etal, 1992; Colamonici et al, 1993; Platanias et al,1993). Гены этих цепей обнаружены на хромосоме 21, и их белки экспрессируются на поверхности большинства клеток (Tan et al, 1973). Рецепторные цепи вначале обозначались альфа и бета по их способности распознаваться моноклональными антителами IFNR3 IFNR1,соответственно. Совсем недавно они были переименованы: альфа-субъединица в IFNAR1 и бета-субъединица в IFNAR2. В большинстве клеток IFNAR1 (альфа-цепь, субъединица Uze)(Uze et al, 1990) имеет молекулярный вес, равный 100-130 кДа, тогда как IFNAR2 (бета-цепь,BL, IFN/R) имеет молекулярный вес, равный 100 кДа. В клетках некоторых типов (клеточные линии моноцитов и нормальные клетки костного мозга) был идентифицирован альтернативный рецепторный комплекс, в котором субъединица IFNAR2 (s) экспрессируется в виде укороченного рецептора с молекулярным весом,равным 51 кДа. Субъединицы IFNAR1 иIFNAR2, s и L, имеют идентичные внеклеточные и трансмембранные домены; однако, в цитоплазматическом домене они идентичны только по первым 15 аминокислотам. Одна субъединица IFNAR2 способна связыватьIFN/, тогда как субъединица IFNAR1 не способна связывать IFN/. Если одну субъединицу человеческого рецептора IFNAR1 трансфицировать в мышиные фибробласты L-929, то никакие IFN, за исключением IFN8/IFNB,не способны связываться с клетками (Uze et аl,1990). Человеческая субъединица IFNAR2, 3 трансфицированная в L-клетки в отсутствии человеческой субъединицы IFNAR1, связывает человеческий IFN2 с Кд, приблизительно равной 0,45 нМ. Если человеческие субъединицыIFNAR2 трансфицируют в присутствии человеческой субъединицы IFNAR1, может быть продемонстрировано высокое сродство связывания с Кд, равной 0,026-0,114 нМ (Novick et аl, 1994;Domanski et al, 1995). Было оценено, что на большинстве клеток присутствует от 500-20000 связывающих IFN мест с высоким сродством и 2 000-100 000 с низким сродством. Хотя комплекс субъединиц IFNAR1/2 (/s или /L) связывает IFN с высоким сродством, оказалось, что только пара /L является функциональным сигнальным рецептором. Трансфекция субъединиц IFNAR1 и IFNAR2 L в клетки мыши L-929, с последующей инкубацией с IFN2, индуцирует антивирусное состояние,инициирует фосфорилирование внутриклеточного белка и вызывает активацию внутриклеточных киназ (Jak1 и Tyk2) и факторов транскрипции (STAT 1, 2, и 3) (Novick et al,1994; Domanski et al, 1995). В соответствующем эксперименте трансфекция субъединицыIFNAR2 L необходима для функциональной активности (антивирусного ответа) с максимальной индукцией, которая имеет место при ассоциации с субъединицей IFNAR1. Кроме связанных с мембраной клеточных поверхностных форм IFNAR, был обнаружен растворимый IFNAR, как в человеческой моче,так и в сыворотке (Novick et al, 1994; Novick etal, 1995; Novick et al, 1992; Lutfalla et al, 1995). Растворимый IFNAR, выделенный из сыворотки, имеет кажущийся молекулярный вес, равный 55 кДа, по SDS-PAGE, тогда как растворимый IFNAR из мочи имеет кажущийся молекулярный вес, равный 40-45 кДа (р 40). Транскрипты для растворимого р 40 IFNAR2 присутствуют на уровне мРНК и охватывают почти весь внеклеточный домен субъединицы IFNAR2 с двумя новыми аминокислотами и концевой карбоксильной группой. Существуют пять потенциальных сайтов гликозилирования на растворимом рецепторе IFNAR2. Показано, что растворимый р 40 IFNAR2 связывает IFN2 и IFN и ингибирует in vitro антивирусную активность смеси разновидностей IFN ("лейкоцитарныйIFN") и индивидуальных IFNs типа I (Novick et а 1, 1995). Показано, что рекомбинантная субъединица IFNAR2 слитого белка Ig ингибирует связывание разных видов IFN типа I (IFNA,IFNB, IFND, IFN, IFN Con1 и IFN) с клетками Daudi и Cos-клетками, дважды трансфицированными субъединицами /s. Недавно были идентифицированы сигнальные пути с участием IFN типа I (Platanias etDuncan et al, 1996; Sharf et al, 1995; Yang et al,1996). Считается, что начальные события сигнального пути происходят посредством связывания IFN// с субъединицей IFNAR2, что сопровождается ассоциацией с субъединицей(Platanias et al, 1994). Связывание IFN// с комплексом IFNAR1/2 приводит к активации двух киназ Janus (Jak1 и Tyk2), которые, как полагают, фосфорилируют специфические тирозины на субъединицах IFNAR1 и IFNAR2. По мере фосфорилирования этих субъединиц фосфорилируются молекулы STAT (STAT 1, 2 и 3),что приводит к димеризации транскрипционных комплексов STAT с последующей локализацией этого транскрипционного комплекса в ядре и активацией специфических генов, индуцируемых IFN. Фармакокинетику и фармакодинамикуIFN-ов типа I оценивали у людей (Alan et al,1997; Fierlbeck et al, 1996; Salmon et al, 1996). Выведение IFN является довольно быстрым при более низкой биодоступности IFN, чем ожидается для большинства цитокинов. Хотя фармакодинамику IFN оценивали у людей, не было установлено отчетливой корреляции между биодоступностью и клинической эффективностью IFN. У нормальных здоровых людейдобровольцев введение однократной внутривенной (вв) болюсной дозы (6 MIU) рекомбинантного СНО-производного IFN приводит к фазе быстрого распределения в 5 мин и конечному полупериоду жизни, равному 5 ч (Alam et(вм) введение, выходящие на плато, составляют только 15% от системно доступной дозы. Фармакодинамические параметры IFN после вв, вм или пк введения (что измеряли по изменению активности 2'5'-олигоаденилатсинтетазы (2'5'AS) в PBMCs) увеличивались в течение первых 24 ч и медленно уменьшались до базовых уровней в течение следующих 4 дней. Величина и длительность биологического эффекта были одинаковыми независимо от способа введения. Фармакокинетику (ФК) и фармакодинамику (ФД) IFN, произведенного двумя различными компаниями (REBIF-Serono и AVONEXBiogen), определяли после вм инъекции единичной дозы в 6 MIU рекомбинантного IFNIFN и заместительного маркера IFN, неоптерина, регистрировали в течение определенного времени. Для обоих препаратов IFN были получены сходные ФК профили с пиком сывороточного уровня IFN, достигаемого через 1215 ч, хотя REBIF дает более низкие максимальные уровни. Уровни IFN остаются повышенными как для REBIF, так и дляAVONEX, в течение, по меньшей мере, первых 36 ч после вм инъекции и затем уменьша 5 ются до уровня, слегка превышающего базовый в течение 48 ч. Для REBIF и AVONEX были получены очень сходные профили уровней неоптерина, причем максимальные уровни неоптерина достигаюсь через 44-50 ч после инъекции, оставаясь повышенными в течение 72 ч после инъекции, и затем постепенно снижались до базовой линии в течение 144 ч. Фармакодинамические исследования многократных доз IFN проводили на пациентах с меланомой (Fierlbeck et al, 1996), IFN вводили пк способом, три раза в неделю при 3 MIU/дозу в течение шести месяцев. Фармакодинамические маркеры,2'5'-AS синтетаза,2 микроглобулин, неоптерин и активация НКклеток достигали пика после второй инъекции(4 день) и уменьшались в течение 28 дней, оставаясь слегка увеличенными до шести месяцев. Итак, выведение интерферонов типа I у людей происходит быстро. Долго действующий препарат интерферона мог бы привести к улучшениям с клинической точки зрения. Краткое содержание изобретения В настоящее время обнаружено, что комплекс интерферона типа I, составленный из растворимой IFNAR в комплексе с интерферонами(IFN) типа I, проявляет по сравнению со свободным IFN повышенную стабильность, увеличенную эффективность и пролонгированную фармакокинетику in vivo в отношении антивирусной, противораковой и иммуномодулирующей активности. Таким образом, настоящее изобретение предоставляет комплекс интерферона (IFN) типа I, составленный из полипептидной последовательности внеклеточного домена субъединицы человеческого рецептора интерферона /(IFNAR) и интерферонов типа I, который проявляет по сравнению со свободным IFN повышенную стабильность, увеличенную эффективность и/или пролонгированную фармакокинетику invivo в отношении антивирусной, противораковой и иммуномодулирующей активности. Предпочтительно, этот комплекс представляет собой внеклеточный домен субъединицы IFNAR2 с любым интерфероном типа I, или субъединицуIFNAR1 с IFN. Более конкретно этот комплекс представляет собой слитый белок или ковалентный комплекс, или нековалентный комплекс, содержащий полипептидную последовательность всего внеклеточного домена IFNAR, предпочтительноIFNAR2, или его субфракции, связывающей интерферон, находящуюся в комплексе с IFN,или IFN, или IFN, или с любой его биологически активной субфракцией. Подразумевается, что IFNAR охватывает любой из известных внеклеточных рецепторовIFNAR, как определено выше, а также любой из его активных фрагментов. IFNAR может быть необязательно слит с другим белком, например, 003635 иммуноглобулином, таким как IgG. IFN, IFN,IFN и IFN подразумевают один из более чем 20 интерферонов типа I, идентифицированных к настоящему времени, или любой другой интерферон типа I, идентифицированный в будущем. В одном воплощении настоящего изобретения комплекс составлен из IFN или IFN,ковалентно связанного с IFNAR2 посредством химической связи. Дополнительное воплощение включает комплекс, составленный из IFN или IFN, нековалентно комплексующимися с IFNAR2. Это дополнительное воплощение также включает композицию, содержащую IFN типа I и IFNAR2 в любом соотношении. Смесь (состав) IFN типаI и избытка IFNAR2, как определено выше, также включена в определение "комплекс" настоящей заявки. Два компонента также могут быть введены раздельно с тем, чтобы образовать комплекс in vivo. Таким образом, в дополнительном воплощении комплекс представляет собой смесь IFNAR2 и IFN, полученный путем одновременного или последовательного совместного введения IFN или IFN и растворимойIFNAR2. Кроме того, IFNAR может быть введен без какого-либо сопутствующего введения IFN,так, что комплекс может быть образован in vivo с эндогенным циркуляционным IFN, посредством этого способствуя проявлению эффектов эндогенного IFN. В виде отдельного воплощения комплекс составлен из IFN, или IFN, или IFN, слитого с IFNAR2, как рекомбинантным слитым белком,где фрагменты IFN и IFNAR2 необязательно слиты через гибкую пептидную линкерную молекулу. Этот пептидный линкер может отщепляться или не отщепляться in vivo. Далее данное изобретение относится к ДНК, кодирующей такие слитые белки, векторам, содержащим такие ДНК, клеткамхозяинам, трансформированным этими векторами таким образом, чтобы они экспрессировали слитые белки, и к способам получения таких слитых белков путем культивирования таких клеток-хозяев и выделения слитых белков, экспрессированных ими. Дополнительный аспект настоящего изобретения представляет собой способы применения комплексов настоящего изобретения для пролонгирования in vivo эффекта IFN, который является полезным при лечении любого заболевания или состояния, которое лечится IFN. Другой аспект настоящего изобретения относится к применению IFNAR в качестве стабилизатора в композициях с IFN. Свободный IFN имеет тенденцию к олигомеризации. Это предотвращается при образовании комплекса сIFNAR, особенно IFNAR2. Существующие в настоящее время составы с рекомбинантнымIFN должны иметь кислый рН, который может вызвать некоторое местное раздражение при 7 введении. Некислые композиции могут быть составлены, если в качестве стабилизатора используется IFNAR. Краткое описание рисунков Настоящее изобретение станет понятнее из следующих рисунков. Фиг. 1 представляет собой график, демонстрирующий дозозависимую антивирусную активность sIFNAR2 или IFNAR2Ig (составленный из внеклеточного домена hIFNAR2, слитого с шарниром человеческого IgGI, доменами СН 2 и СН 3) в присутствии IFN. Фиг. 2 представляет собой график, демонстрирующий антивирусную активностьIFN и sIFNAR2 через один час преинкубации обнаруживается при промежуточной дозе IFN. Фиг. 3 представляет собой график, демонстрирующий антивирусную активностьsIFNAR2 и субэффективной дозы IFN (0,95 МЕ/мл) как функцию времени преинкубации. Клетки WISH подвергают воздействию IFN(0,95 МЕ/мл, субэффективная доза) и sIFNAR2 с последующей преинкубацией в течение определенного времени. Синергическая антивирусная активность наблюдалась только после 4 ч преинкубации. Антивирусную активность измеряли путем МТТ конверсии через 48 ч после воздействия VSV. При субтерапевтических уровняхIFN образование комплекса IFNAR2/IFN приводит к усилению антивирусной активности. Фиг. 4 представляет собой график, демонстрирующий повышение антивирусной активности человеческого IFN после преинкубации с sIFNAR2. Фиг. 5 представляет собой график, демонстрирующий, что повышение антивирусной активности человеческого IFN, связанное с sIFNAR, специфично для IFNAR2, но не для других белков. Фиг. 6 представляет собой график, демонстрирующий фармакокинетическое сравнение человеческого IFN и комплекса IFN/IFNAR2 у мышей, проводимое с помощью теста ELISA. Фиг. 7 представляет собой график, демонстрирующий фармакокинетическое сравнение человеческого IFN и комплекса IFN/IFNAR2 у мышей, проводимое с помощью биоанализа. Фиг. 8 представляет собой график, демонстрирующий фармакокинетическое сравнение человеческого IFN и комплекса IFN/ IFNAR2 у мышей, проводимое с помощью теста ELISA. Фиг. 9 представляет собой график, демонстрирующий фармакокинетическое сравнение человеческого IFN и комплекса IFN/IFNAR2 у мышей, проводимое с помощью биоанализа. Фиг. 10 демонстрирует аминокислотную последовательность слитого белка n=2 IFNAR2/ 8 Фиг. 11 представляет собой гель, демонстрирующий анализ pCMV-IFNAR2/IFN с помощью рестрикционного фермента; 10% PAG,дорожки 3-7: BamHI/XhoI расщепление; дорожка 2: SmaI/XhoI расщепление; дорожка 1: маркер расщепления pBR322 DNA-MspI; дорожка 2: pCMV-IFNAR2/IFN, OGS; дорожка 3: 1GS; дорожка 4: 2GS; дорожка 5: 3GS; дорожка 6: 4GS; дорожка 7: 5GS; дорожка 8: маркер расщепления Х 174 RFDNA HaeIII. Фиг. 12 представляет собой рестрикционную эндонуклеазную карту экспрессионного вектора IFNAR2/IFN. Фиг. 13 представляет собой анализ слитого белка IFNAR2/IFN методом Вестерн-блотинга. Дорожка 1, конструкция IFNAR2/IFN, не содержащая линкера; дорожка 2, конструкция IFNAR2/IFN, содержащая один линкер Gly4SerIFNAR2/IFN, содержащая два линкера Gly4SerIFNAR2/IFN, содержащая три линкера Gly4SerGly4Ser (SEQ ID NO:1). Фиг. 14 представляет собой график, демонстрирующий антивирусную активность внутренних слитых молекул, экспрессированных в супернатантах клеток СНО, и нормализованный к стандартной активности IFN. Фиг. 15 А-В представляют собой графики,демонстрирующие фармакокинетику IFN, введенного после внутривенной инъекции IFNAR2.IFN вводят либо один, в виде комплекса с IFNAR, или сразу после отдельного введенияsIFNAR2. Период полужизни в сыворотке оценивали через определенные промежутки времени после инъекции с помощью IFNспецифичного ELISA-теста (фиг. 15 А) и с помощью биоактивности в антивирусном анализеWISH (фиг. 15 В). Фиг. 16 представляет собой график, демонстрирующий защитный эффект, выраженный в процентах цитотоксичности различных доз комплекса "универсального" IFN (человеческий IFNA/D) с sIFNAR2 по сравнению с введением только универсального IFN или контролем. Фиг.17 представляет собой график, демонстрирующий сывороточную концентрациюIFN как функцию от времени, после однократной болюсной внутривенной инъекции или внутривенного слитого GS5, или одного hI:FN. Подробное описание предпочтительных воплощений Комплекс IFNAR/IFN настоящего изобретения и технология, необходимая для получения этого комплекса, описаны ниже в деталях. Для большинства результатов IFN был выбран в качестве неограничивающего примера. Слитый белок. С-конец IFNAR2, или любая его последовательность, связывающая интерферон, была слита с N-концом IFN или его биологически активными фрагментами, так,чтобы было кратчайшее расстояние для образования мостика между двумя молекулами. Могут быть также получены обратные конструкции, в которых С-конец IFN, или его фрагментов,сливают с N-концом IFNAR2, или его субпоследовательностями. Рассчитанная из молекулярных моделей комплекса IFNAR2/IFN, дистанция между напряженным С-концевым внеклеточным доменом IFNAR2 и N-концом IFN в активных моделях комплекса составляет 80 Ангстрем. Для конструирования комплекса IFNAR2/IFN, который позволяет сохранять активность, может быть использован, например, гибкий пептидный линкер, например, повторы Gly-Gly-Gly-Gly-Ser(GGGGS) (SEQ ID NO:1). Альтернативно, линкер может быть гибким, и являться мишенью для протеолитического расщепления под действием сывороточных, мембрано-связанных и/или клеточных протеаз. Как пример сайта расщепления для сывороточной протеазы, конструированный слитый комплекс IFNAR2/IFN может иметь сайт расщепления для фактора Ха. Фактор Ха расщепляет протромбин по двум положениям: Аrg273 и Аrg322, и он имеет тетрапептидный распознавательный сигнал Ile-Glu-GluArg (SEQ ID NO:2) (Nagai et al, 1984). Фактор Ха образуется посредством внутренних и внешних путей под действием различных активаторов, включая тканевый фактор, который высвобождается клетками сосудистого эндотелия,макрофагами и нейтрофилами. Фактор Ха может действовать на слитый белок sIFNAR2/IFN, содержащий последовательность, узнаваемую фактором Ха, в линкерном домене, и высвобождать комплекс IFNAR2/IFN так, что этот комплекс может функционировать как нековалентный комплекс. Альтернативно, слитый комплекс IFNAR2/IFN может иметь сайт расщепления клеточной мембранной протеазой (например, гепсином). Гепсин представляет собой мембраносвязанный сериновый протеолитический зимоген размером 51 кДа, экспрессирующийся на высоких уровнях в ткани печени, но также обнаруженный в почках, поджелудочной железе, легких, щитовидной железе, гипофизе и семенниках. Известно, что в одной последовательности гепсин расщепляет пептидную связь Arg152-Ile153 в факторе VII. Гепсин участвует в образовании тромбина на опухолевых клетках (Kazam et al,1995). Гепсин может действовать на слитый белок sIFNAR2/IFN, содержащий последовательность, узнаваемую гепсином, в линкерном до 003635 10 мене, и высвобождать комплекс IFNAR2/IFN так, что этот комплекс может функционировать как нековалентный. Альтернативно, слитый комплекс IFNAR2/IFN может иметь сайт расщепления внутриклеточной протеазой. Ряд протеаз высвобождается некрозными и апоптозными клетками. К ним относятся каспазы (протеазы, подобные ферменту, конвертирующему интерлейкин 1 бета), металлопротеиназы, лизомальные протеазы (например, катепсин В) и эластаза. Эластаза высвобождается гранулоцитами в процессе болезненных состояний (например, сепсиса),и имеет широкую специфичность в отношении расщепления аминокислотной последовательности, сродни трипсину (Ertel et al, 1994; Szilagyiet al, 1995). Внутриклеточная протеаза может действовать на слитый белок sIFNAR2/IFN, содержащий последовательность, узнаваемую внутриклеточной протеазой, в линкерном домене, и высвобождать комплекс IFNAR2/IFN так, что этот комплекс может функционировать как нековалентный комплекс. В действительности, было получено несколько примеров конструкций слитого белка, в которых С-конец sIFNAR2 (P40-ESEFS) связан сN-концом IFN (MSY) посредством гибких линкеров. Примерами пептидных линкеров являются следующие: ESEFS (GGGGS)nMSY, где(SEQ ID NO: 12), или 2 (SEQ ID NO: 13), и любой другой подходящий линкер, который покрывает дистанцию между связывающим сайтом IFNAR2 и IFN в комплексной модели, и который не образует иммуногенный эпитоп между фрагментами интерферона и рецептора. Предпочтительно, эти линкеры составляют в длину до 30 аминокислот. Ковалентный комплекс. Одним примером образования химически связанных молекул является сайт-специфическое модифицированиеIFNAR2 путем взаимодействия биодеградируемого линкера, такого как полиэтилен гликоль(PEG), с остатками цистеина, присутствующими или вставленными в IFNAR2 путем того или другого аминокислотного замещения, такого как Ser210 на Cys или Аsn89 на Cys (сайтнаправленный мутагенез). Могут быть составлены следующие конструкции:IFNAR(S210C)-PEGn-IFN(Cysl7), где n = 2000, 5000 или 10000 Да, или IFNAR(N89C)PEGn-IFN(Cysl7). Образование ковалентных дисульфидных связей между Cys двух различных (необязатель 11 но модифицированных) фрагментов также находится в сфере настоящего изобретения. Нековалентный комплекс Проводят образование комплекса человеческого IFNAR2 с INF в условиях, которые максимально способствуют образованию активного комплекса. Как изложено в примерах, для получения максимально активного комплекса inIFNAR2 к INF, которое максимально способствует образованию активного комплекса для активности in vivo, в настоящее время определяется, хотя, видимо, оптимальное соотношение зависит от концентрации INF. Так, например,оптимальное соотношение IFNAR2 и IFN для увеличения антиопухолевой активности при концентрации 2 х 104 ME/мышь/день IFN составляет 2,5 нг IFNAR2 на пг IFN, тогда как при концентрации 5 х 104 МЕ/мышь/день IFN оптимальным является 0,3 нг IFNAR2 на пгIFN. Такое же соотношение используется для максимизации образования активного комплекса in vitro, приводящего к пролонгированию фармакокинетики IFN in vivo. Предпочтительно, IFNAR2 и IFN, используемые для образования комплекса, являются рекомбинантными молекулами. В антивирусном анализе in vitro комплекс интерферон/рецептор проявлял повышенную активность по сравнению с активностью одного IFN. IFN при постоянной концентрации смешивают с различными концентрациями рекомбинантногоsIFNAR2, и эту смесь (комплекс IFNAR2/IFN) добавляют к клеткам WISH (человеческие амниотические клетки). Затем эти WISH клетки заражают вирусом везикулярного стоматита(VSV) и регистрируют антивирусную активность IFN как степень выживания клеток после 48 ч инкубации. В каждом эксперименте добавление IFNAR2 к постоянному количеству IFN приводит к дозозависимому увеличению выживания клеток при заражении VSV при оптимальном соотношении IFNAR2 к IFN. Эти результаты доказывают, что комплекс IFNAR2 иIFN проявляет в антивирусном анализе повышенную активность по сравнению со свободным IFN. Практическими заключениями из этого является то, что комплекс IFNAR2/IFN обладает большей мощностью и повышенной активностью по сравнению со свободным IFN для ряда терапевтических назначений, при которых сам IFN является активным. Эти назначения включают такие, при которых свободныеIFN показывают некоторую терапевтическую активность, такую как антивирусную, противоопухолевую и иммуномодуляторную. Ожидается, что комплекс IFNAR2/IFN в силу своей большей мощности, увеличенной активности и/или улучшенной фармакокинетики (например, 003635 12 период полужизни), будет более эффективным при лечении вирусных, онкологических и иммунных расстройств. При введении in vivo рецепторный комплекс интерферона увеличивает биодоступность, фармакокинетику и/или фармакодинамику IFN путем усиления антивирусных, противораковых и иммуномодулирующих свойств IFN. Повышенная биодоступность IFN, опосредованная комплексом, может быть достигнута либо путем предварительного образования нековалентного комплекса IFN/IFNAR, совместного введения свободного IFN с IFNAR, последовательного введения компонента IFN илиIFN/IFNAR, либо путем введения слитого белкаIFNAR/IFN. В дополнительном воплощении такое увеличение биодоступности может быть также достигнуто путем введения одного компонентаIFNAR, без добавления какого-либо IFN. IFNAR будет образовывать "комплекс" in vivo с эндогенным IFN и таким образом повышать биодоступность, фармакокинетику и/или фармакодинамику эндогенного IFN. Это особенно полезно для лечения пациентов с заболеванием или состоянием, которое естественно вызывает индукцию нативного IFN, так что IFN будет уже циркулировать для выполнения своего природного предназначения, борьбы с таким заболеванием или состоянием. Добавленный IFNAR будет потенцировать эффекты нативного IFN. Предпочтительные молекулы для применения в комплексах настоящего изобретения имеют последовательность нативного IFN иIFNAR. Нативная последовательность - это последовательность встречающихся в природе человеческих IFN или IFNAR. Такие последовательности являются известными и могут быть легко найдены в литературе. Встречающиеся в природе аллельные вариации также рассматриваются как нативные последовательности. Настоящее изобретение также касается аналогов вышеупомянутого комплекса IFNAR/IFN данного изобретения, которые в основном сохраняют такую же биологическую активность, как у комплекса, имеющего, по существу,последовательности нативных IFNAR2 и IFN. Такими аналогами могут быть аналоги, в которых до 30 аминокислотных остатков может быть удалено, добавлено или замещено другими в IFNAR2 и/или IFN фрагментах комплекса, так чтобы модификации такого рода существенно не изменяли бы биологической активности химерного белкового аналога в отношении самого комплекса. Различные аналоги могут сильно отличаться один от другого и от основной комплексной молекулы (которая имеет в основном только встречающиеся в природе последовательности IFNAR2 и IFN) по сайту линкерного пептида, который соединяет два фрагмента в комплекс. Как описано выше, такой линкер 13 предпочтительно составляет в длину приблизительно до 30 аминокислот и служит для разделения фрагментов IFNAR2 и IFN один от другого в комплексе. Что касается такого линкера, его последовательность необходимо тщательно выбирать (и, следовательно, также биологически тестировать каждый такой аналог в соответствующих стандартных анализах), так, чтобы она не привела, например, к неправильному складыванию комплекса, что может сделать его неактивным, или не увеличит его активности, или сделает аналог комплекса иммуногенным, который будет вызывать появление антител против него у пациента, который подвергнут лечению,что приведет к тому, что такой аналог будет неэффективным, по меньшей мере, как среднеили долгодействующий лекарственный препарат. Что касается вышеупомянутых аналогов комплекса данного изобретения, эти аналоги являются такими, в которых один или несколько, приблизительно до 30, аминокислотных остатков основного комплекса данного изобретения замещены различными аминокислотными остатками или удалены, или один или несколько аминокислотных остатков, приблизительно до 30, добавлены к исходной последовательности комплекса данного изобретения (которая в основном имеет только нативные последовательности IFNAR2/IFN) без значительного изменения активности полученных продуктов по сравнению с основным комплексом данного изобретения. Эти аналоги получают с помощью известных методик синтеза и/или сайт-направленного мутагинеза, или любой другой подходящей для этого известной методики. Любой другой аналог предпочтительно имеет последовательность аминокислот, в достаточной степени воспроизводящую последовательность основного комплекса IFNAR2/IFN так, чтобы иметь активность, в основном подобную активности этого комплекса. Так, может быть определено, имеет ли какой-либо данный аналог, по существу, такую же активность и/или стабильность, как основной комплекс данного изобретения, с помощью рутинных экспериментов, включающих подвергание каждого такого аналога тестам биологической активности и стабильности, приведенным ниже в примерах 27. Аналоги данного комплекса, которые могут быть использованы в соответствии с настоящим изобретением, или последовательность нуклеиновой кислоты, кодирующая их, включают ограниченный набор, по существу, аналогичных последовательностей, как замещенных пептидов или полинуклеотидов, которые могут быть получены обычным способом рядовым специалистом в данной области, без лишних экспериментов, на основании методик и руководств, присутствующих в данном документе. Для детального описания химии и структуры белка см. Schulz, et al, Principles of Protein(1983), которые включены в данном документе в качестве ссылки. Для представления замещенных нуклеотидных последовательностей, таких как предпочтительные кодоны, (см. Ausubel et alD). Предпочтительные изменения аналогов в соответствии с настоящим изобретением - это такие, которые известны как "консервативные" замещения. Консервативные аминокислотные замещения в комплексе, имеющем в основном встречающиеся в природе последовательностиIFNAR2 и IFN, могут включать синонимные аминокислоты в пределах группы, в которой они имеют в достаточной степени подобные физико-химические свойства, так что замещение между членами группы будет сохранять биологическую функцию молекулы (Grantham,1974). Ясно, что вставки и удаления аминокислот могут быть также проведены в определенных выше последовательностях без изменения их функции, особенно, если вставки или удаления включают только несколько аминокислот,например, до тридцати, и, предпочтительно, до десяти, и не удаляют или не смещают аминокислоты, которые являются существенными для функциональной конформации, например, остатки (Anfinsen, 1973). Аналоги, полученные в результате таких удалений или вставок, входят в объем настоящего изобретения. Предпочтительно группы синонимных аминокислот являются такими, как определено в табл. I. Более предпочтительно группы синонимных аминокислот являются такими, как определено в табл. II, и наиболее предпочтительно группы синонимных аминокислот являются такими, как определено в табл. III. Таблица I. Предпочтительные группы синонимных аминокислот Аминокислота Синонимная группа 15 Таблица II. Более предпочтительные группы синонимных аминокислот Аминокислота Синонимная группаTrp Таблица III. Наиболее предпочтительные группы синонимных аминокислот Аминокислота Синонимная группа Примеры проведения аминокислотных замещений в белках, которые могут быть использованы для получения аналогов комплекса IFNAR2/IFN для применения в настоящем изобретении, включают любые известные методические стадии, такие как представленные в патентах США RE 33653; 4959314; 4588585 и 4737462, Mark et al; 5116943, Koths et al; 4965195, Namen et al; и 5017691 Lee, et al, и лизин-замещенные белки, представленные в патенте США 4904584 (Shaw et al). В другом предпочтительном воплощении настоящего изобретения любой аналог комплекса для использования в настоящем изобретении имеет аминокислотную последовательность, по существу, аналогичную последовательности вышеупомянутого основного комплекса данного изобретения. Термин "по существу аналогичный" подразумевает охваченные аналоги с небольшими изменениями в последовательности основного комплекса, которые не влияют на его 16 основные характеристики, в частности такие,например, которые связаны с его способностью ингибировать пролиферацию раковых клеток или способствовать трансплантации костного мозга. Тип изменений, которые обычно считают относящимися к термину "по существу аналогичный", это такие изменения, которые получались бы в результате традиционных методов мутагенеза ДНК, кодирующей комплекс данного изобретения, приводящих к нескольким небольшим модификациям, и которые анализировали на наличие желательной активности с помощью способа, обсужденного выше. Предпочтительно, фрагмент IFNAR2 данного комплекса будет иметь коровую последовательность, которая является такой же, как нативная последовательность, или ее биологически активный фрагмент, или ее вариантный аналог, который имеет аминокислотную последовательность, имеющую, по меньшей мере, 70% идентичности нативной аминокислотной последовательности и сохраняет ее биологическую активность. Более предпочтительно, такая последовательность имеет, по меньшей мере, 85% идентичности, по меньшей мере, 90% идентичности, или наиболее предпочтительно, по меньшей мере, 95% идентичности нативной последовательности. Что касается фрагмента IFN данного комплекса, коровая последовательность, которая может быть использована, является нативной последовательностью, или ее биологически активным фрагментом, или ее вариантным аналогом, который имеет аминокислотную последовательность, имеющую, по меньшей мере, 70% идентичности, более предпочтительно, по меньшей мере, 85% или, по меньшей мере, 90% идентичности, и наиболее предпочтительно, по меньшей мере, 95% идентичности. Такие аналоги должны сохранять биологическую активность нативной последовательности IFN, или ее фрагмента, или обладать антагонистической активностью, как описано ниже. Термин идентичность последовательности, использующийся в данном документе,означает, что последовательности сравнивают следующий образом. Последовательности выстраивают в ряд с помощью версии 9 GeneticComputing Group's GAP (global alignment program), используя дефолтную (BLOSUM62) матрицу (значения от -4 до +11) со штрафом по открытому гэпу, равному 12 (для первого нуля гэпа) и со штрафом по расширенному гэпу,равному -4 (для каждого дополнительного последующего нуля в гэпе). После выстраивания процентную идентичность рассчитывают путем выражения числа совпадений как процент от числа аминокислот в заявляемой последовательности. Аналоги в соответствии с настоящим изобретением могут быть также определены в соответствии со следующей процедурой. В отно 17 шений как фрагмента IFNAR, так и фрагментаIFN комплекса, ДНК нативной последовательности известна из предыдущего уровня техники,и либо может быть найдена из литературы, расположенной в сопровождающей секции настоящего описания, либо может быть легко обнаружена специалистом в данной области. Полипептиды, которые кодируются какой-либо нуклеиновой кислотой, такой как ДНК или РНК,которая гибридизуется с комплементом нативной ДНК или РНК в очень строгих или умерен строгих условиях, по мере того, как этот полипептид сохраняет биологическую активность нативной последовательности, или в случае IFN,или сохраняет биологическую активность, или обладает антогонистической активностью, также попадают в объем настоящего изобретения. Строгие условия являются функцией от температуры, использующейся в процессе гибридизации, молярности моновалентных катионов и процентного содержания формамида в гибридизационном растворе. Для определения степени строгости, включенной с любым данным набором условий, вначале используют уравнение Meinkoth et al. (1984) для определения стабильности гибридов 100% идентичности,выраженной как температура плавления (Тпл) гибрида ДНК-РНК: Тпл = 81,5 С + 16,6 (logM) + 0,41 (%GC) -0,61 (%форм) - 500/L, где М представляет собой молярность моновалентных катионов, %GC - процентное содержание нуклеотидов G и С в ДНК, %форм - процентное содержание формамида в гибридизационном растворе, a L - длина гибрида в парах оснований. Для каждого 1 С, на который понижается Тпл по сравнению с рассчитанной для гибрида со 100% идентичностью, количество допущенных ошибок увеличивается примерно на 1%. Таким образом, если Тпл, используемая для любого данного процесса гибридизации при конкретных концентрациях соли и формамида на 10 С ниже, чем Тпл, рассчитанная для 100% гибрида в соответствии с уравнением Meinkoth, гибридизация будет происходить, даже если количество ошибок достигает приблизительно 10%. В данном документе очень строгие условия это такие, которые являются толерантными до 15% дивергенции последовательности, тогда как умеренно строгие условия это такие, которые являются толерантными до 20% дивергенции последовательности. Не ограничиваясь этим, в примерах очень строгих (на 12-15 С ниже рассчитанной Тпл гибрида) и умеренных (на 15-20 С ниже рассчитанной Тпл гибрида) условий используют раствор для промывания 2 хSSC (стандартный солевой цитрат) и 0,5% SDS при соответствующей температуре ниже рассчитанной Тпл гибрида. Окончательная строгость условий в первую очередь обусловлена условиями промывания, особенно, если используемые условия гибридизации являются такими,которые позволяют менее стабильным гибридам 18 образовываться наряду со стабильными гибридами. При очень строгих условиях менее стабильные гибриды удаляются при промывке. Обычные условия гибридизации, которые могут быть использованы с описанными выше условиями промывания от очень строгих до умеренно строгих, это гибридизация в растворе 6 х SSC(6 х SSPE), 5 х реагента Denhardt, 0,5% SDS, 100 мг/мл денатурированной, фрагментированной ДНК спермы лосося, при температуре, ниже Тпл приблизительно на 20-25 С. Если используются смешанные пробы, предпочтительно использовать хлорид тетраметиламмония (ТМАС) вместо"Функциональные производные", используемые в данном документе, охватывают производные, которые могут быть получены из функциональных групп, которые встречаются в виде боковых цепей на остатках N- или С-концевых групп, с помощью средств, известных в данной области, и включены в данное изобретение пока они остаются фармацевтически приемлемыми,т.е. они не нарушают биологическую активность соответствующего белка комплекса, как описано в данном документе, и не придают токсических свойств композициям, содержащим их, или комплексу, сделанному для них. Производные могут иметь химические фрагменты,такие как углеводные или фосфатные остатки,при условии, что такая фракция имеет такую же биологическую активность и остается фармацевтически приемлемой. Например, производные могут включать алифатические эфиры карбоксилов карбоксильных групп, амиды карбоксильных групп, полученные путем взаимодействия с аммиаком или с первичными или вторичными аминами, Nацилированные производные свободных аминогрупп аминокислотных остатков, полученные с помощью ацильных фрагментов (например,алканоильных или карбоциклических ароильных групп), или 0-ацилированные производные свободных гидроксильных групп (например из серильных или треонильных остатков), полученные с помощью ацильных фрагментов. Такие производные могут также включать, например, полиэтиленгликолевые боковые цепи, которые могут маскировать антигенные сайты и продлевать присутствие комплекса или его фракций в жидкостях организма. Термин "производные" подразумевает включение только тех производных, в которых не происходило изменение одной аминокислоты на другую из двадцати обычно встречающихся в природе аминокислот. Термин "соли" относится как к солям карбоксильных групп, так и к кислотным добавочным солям аминогрупп комплекса данного изобретения или его аналогов. Соли карбоксильной группы могут быть образованы с помощью методов, известных в данной области, и включают неорганические соли, например, соли натрия, 19 кальция, аммония, железа или цинка и т. п., и соли, образованные с органическими основаниями, например, с аминами, такими как триэтаноламин, аргинин или лизин, пиперидин,прокаин и т. п. Кислотные добавочные соли включают, например, соли с минеральными кислотами, такими как, например, хлористоводородная кислота или серная кислота, и соли с органическими кислотами, такими как, например, уксусная кислота или щавелевая кислота. Конечно, любые такие соли должны иметь, по существу, биологическую активность, подобную активности комплекса данного изобретения или его аналогов. Термин биологическая активность, используемый в данном документе, интерпретируется следующим образом. Поскольку рассматривается фрагмент комплекса IFNAR2, то важной биологической активностью является его способность связывать интерферон типа I. Таким образом, аналоги или варианты, соли и функциональные производные должны быть выбраны так, чтобы сохранить их способность связывать интерферон. Это можно анализировать с помощью рутинных анализов связывания. Кроме того, могут быть также использованы фрагменты IFNAR2 или их аналоги, если они сохраняют интерферон-связывающую активность. Фрагменты могут быть легко получены путем удаления аминокислот с любого конца интерферон-связывающего полипептида и тестирования полученных фрагментов на интерферон-связывающие свойства. Протеазы для удаления одной аминокислоты с N-конца или с Сконца полипептида известны, и, таким образом,определяющие фрагменты, которые сохраняют интерферон-связывающую способность, включают только рутинные эксперименты. Кроме того, полипептид, который имеет такую интерферон-связывающую активность,будет ли это IFNAR2, sIFNAR2, аналог или вариант, соль, функциональное производное или его фрагмент, может также содержать дополнительные аминокислотные остатки, фланкирующие интерферон-связывающий полипептид. По мере того как полученная молекула сохраняет интерферон-связывающую способность корового полипептида, с помощью рутинных экспериментов можно определить действительно ли такие фланкирующие остатки влияют на основные и новые характеристики корового пептида,т.е. его интерферон-связывающие характеристики. Термин "состоящий по существу", если относится к конкретной последовательности,обозначает, что могут присутствовать дополнительные фланкирующие остатки, которые не влияют на основные и новые характеристики конкретной последовательности. Этот термин не охватывает замещения, удаления или добавления в пределах конкретной последовательности. 20 Хотя во всем описании и в примерах используются IFNAR2 иди sIFNAR2, надо понять,что это только предпочтительный пример, и что субъединица IFNAR1, и особенно ее внеклеточный домен, может заменять IFNAR2 везде, где бы он ни упоминался в данном описании. IFNAR1 может быть использован в сочетании с интерферонами, с которыми он связывается. Известно, что IFNAR1 связывается с IFN. Любой комплекс, использующий IFNAR1 должен быть с разновидностями интерферона, предпочтительно с разновидностями IFN, с которым связывается IFNAR1. Что касается интерфероновой части комплекса настоящего изобретения, биологическая активность, которая должна сохраняться в любом аналоге или варианте, соли, функциональном производном или фрагменте, является активностью интерферона, положенной для предполагаемого применения. В большинстве примеров это будет способностью связывать нативный клеточный поверхностный рецептор и посредством этого опосредовать продукцию сигнала рецептором. Таким образом, любой такой аналог, производное или фрагмент, должен поддерживать такую рецептор-агонистическую активность, чтобы быть полезным в настоящем изобретении для такого применения. С другой стороны, иногда полезно иметь молекулу с антагонистической активностью по отношению к рецептору, так, чтобы предотвратить биологическую активность нативного интерферона. Такой антагонист может быть также использован для пролонгированного улучшенного эффекта посредством комплекса настоящего изобретения. Для таких применений, в который желательно исключить нежелательный эффект интерферона, аналоги, которые еще связываются рецептором и фрагментом IFNAR комплекса, но которые не опосредуют сигнал, или блокируют образование сигнала под действием нативного интерферона на этот рецептор, могут также считаться биологически активными для целей данного изобретения и охватываться термином интерферон при использовании в отношении комплексов настоящего изобретения. Прямые анализы могут определить, действительно ли такой аналог сохраняет такую агонистическую активность, или имеет антагонистическую активность по отношению к рецептору, и, таким образом будет полезным для одного из применений настоящего изобретения. Настоящее изобретение также относится к последовательностям ДНК, кодирующим вышеупомянутый комплекс данного изобретения и его аналоги, а также ДНК векторам, несущим такие последовательности ДНК для экспрессии в подходящих прокариотических или эукариотических клетках-хозяинах. Способность генерировать большие количества гетерологичных белков с помощью системы экспрессии реком 21 бинантного белка привело к развитию различных терапевтических агентов, например, t-PA и ЕРО (Edington, 1995). Могут быть использованы различные экспрессирующие хозяева, начиная с прокариотов (например, бактерии) (Olins, 1993) и низших эукариотов (например, дрожжи) (Ratner, 1989) заканчивая высшими видами эукариотов (например, клетками насекомых или млекопитающих) (Reuveny, 1993; Reff, 1993), в которых могут быть образованы рекомбинантные белки. Все эти системы основаны на одном и том же принципе - введении последовательности ДНК интересующего белка в клетки выбранного типа (неустойчивым или устойчивым образом, как интегрированный или эписомальный элемент) и использовании механизмов транскрипции, трансляции и транспортации хозяина для сверхэкспрессии введенной последовательности ДНК в виде гетерологичного белка(Кеown, 1990). Кроме экспрессии нативных последовательностей генов, умение обращаться с ДНК на нуклеотидном уровне способствует развитию новых конструированных последовательностей,которые, хотя и основаны на природных белках,обладают новыми активностями в результате изменения первичной структуры белка (Grazia,1997). Более того, выбранные последовательности ДНК могут быть физически связаны с образованием транскриптов, которые проявляются в новых слитых белках, где некогда независимые белки теперь экспрессируются как одна полипептидная единица (Ibanez, 1991). Активность таких слитых белков может быть различной,например, более мощной, чем у любого из индивидуальных белков (Curtis, 1991). Человеческий IFN получают по способу,который использует клетки яичника млекопитающего китайского хомячка (СНО). Интерфероны типа 1 могут быть экспрессированы в ряд клеток-хозяев, включая клетки бактерий(Utsumi, 1987), насекомых (Smith, 1983) и человека (Christofinis, 1981). Человеческий sIFNAR2 также экспрессируют, используя клетки-хозяева СНО. Альтернативно растворимые рецепторы,такие как sIFNAR2, могут успешно экспрессироваться в бактериальных экспрессионных системах (Terlizzese, 1996). ДНК для каждого гена вводят в геном СНО, используя метод трансфекции, который приводит к рекомбинации и интеграции экспрессионного вектора. Затем клетки, которые экспрессируют интересующий белок, выделяют, культивируют и белок выделяют и очищают, используя стандартные промышленные процедуры, хорошо известные в данной области. Данное изобретение также относится к фармацевтической композиции, включающей в качестве активного ингредиента комплекс IFNAR2/IFN или его аналоги, или их смеси, или их соли, и фармацевтически приемлемый носи 003635 22 тель, разбавитель или эксципиент. Воплощение фармацевтической композиции данного изобретения включает фармацевтическую композицию для увеличения активности типа IFN при лечении вирусных заболеваний, противораковой терапии, при иммуномодулирующей терапии и других применениях интерферонов и родственных им цитокинов. Фармацевтические композиции данного изобретения получают для введения путем смешивания комплекса или его аналогов с физиологически приемлемыми носителями и/или стабилизаторами и/или эксципиентами, и получают в дозировочной форме, например, путем лиофилизации в дозировочных флаконах. Способ введения может осуществляться через любой из допускаемых путей введения для подобных агентов и будет зависеть от состояния, которое надо лечить, например, внутривенно, внутримышечно, подкожно, путем местной инъекции или наружного применения, или длительно путем инфузий и т. д. Количество активного соединения, которое должно быть введено, будет зависеть от способа введения, заболевания, подлежащего лечению и состояния пациента. Местные инъекции, например, будут требовать более низкого количества белка по отношению к весу тела, чем при внутривенной инфузий. Свободный IFN имеет тенденцию к олигомеризации. Для подавления этой тенденции современные композиции на основе IFN имеют кислый рН, который может вызвать некоторое местное раздражение при введении. Так как IFNAR может служить как стабилизирующий фактор для IFN и посредством этого предотвращать олигомеризацию, его применение в композициях на основе IFN может служить для стабилизации IFN и таким образом позволяет избежать необходимости в кислых составах. Соответственно, некислая фармацевтическая композиция, содержащая IFN и IFNAR вместе с другими традиционными фармацевтически приемлемыми эксципиентами также является частью настоящего изобретения. Настоящее изобретение также относится к применениям комплекса данного изобретения или его аналогов или их смесей для антивирусной, противораковой и иммуномодулирующей терапии. Особенно комплексы рецептор интерферона-интерферон данного изобретения являются полезными для антивирусной терапии при таких терапевтических показаниях, как хроническая гранулематозная болезнь, остроконечная кондилома, юношеский папилломатоз гортани,гепатит А и хронические инфекции вирусов гепатита В и С. Особенно комплексы рецептор интерферона-интерферон данного изобретения являются полезными для противораковой терапии при таких терапевтических показаниях, как волосатоклеточный лейкоз, саркома Капоши, рассеян 23 ная миелома, хронический миелоидный лейкоз,лимфома и меланома не-Ходжкина. Комплексы рецептор интерферонаинтерферон данного изобретения являются полезными для иммуномодулирующей терапии при таких заболеваниях, как рассеянный склероз, ревматоидный артрит, тяжелая псевдопаралитическая миастения, диабет, СПИД, волчанка и т.д. Настоящее изобретение также относится к комплексу или его аналогам, или их смесям для применения в получении лекарственных препаратов для лечения вышеупомянутых болезней,или для применения в вышеуказанных показаниях. Далее настоящее изобретение будет описано более подробно в следующих не ограничивающих примерах и сопровождающих рисунках. Примеры Материалы и методы Антивирусный биоанализ WISH и образование комплекса:WISH-метод был разработан на основании работы Novick et al (1982). Материалы:- WISH клетки (АТСС CCL 25),- препараты вируса везикулярного стоматита (АТСС V-520-001-522), хранение при-70 С,- IFN, человеческий рекомбинантный,InterPharm Laboratories LTD 90 x 106 МЕ/мл специфическая активность: 264,5 x 106 МЕ/мг,- человеческий растворимый IFNAR2, концентрация для хранения в PBS 373 мкг/мл,- среда для выращивания WISH (MEM с высокой глюкозой и с солями Эрла + 10% FBS + 0,1 % L-глютамин + пенициллин/стрептомицин- среда для метода WISH (MEM с высокой глюкозой с солями Эрла + 5% FBS+ 0,1% Lглютамин + пенициллин/стрептомицин (100 Е/мл, 100 мкг/мл), МТТ, 5 мг/мл в PBS, хранение при -70 С. Методы:IFN до 19 МЕ/мл (4 Х предварительно определенная доза ЕС 50) в среде для метода WISH.- Начиная с 90 мкг/мл, сделать одиннадцать (11) трехкратных разведений человеческого рекомбинантного sIFNAR2 в пробирках Эппиндорфа в среде для WISH. 12-ая пробирка содержит только среду WISH.- Добавить 25 мкл IFN в каждую лунку плоскодонного 96-луночного планшета (добавить 25 мкл только среды WISH в секцию 3 х 12 для контроля действия IFNAR2 в отсутствие 24 кратном разведении вниз на 12 рядов 96 луночного планшета.- Проинкубировать IFN с sIFNAR2 в течение 1-4 ч при 37 С в инкубаторе перед добавлением WISH клеток.- Собрать WISH клетки в логарифмической фазе роста в растворе трипсин/EDTA, промыть вWISH среде, и довести до конечной концентрации 0, 8 х 106 клеток/мл.- Добавить по 50 мкл суспензии WISH клеток (4 х 104 клеток в лунку) в каждую лунку. Конечная концентрация IFN и sIFNAR2 такая,как представлена клеткам, то есть конечная концентрация IFN составляет 4,75 МЕ/мл (IX) и конечная концентрация sIFNAR2 в первом ряду составляет 22,5 мкг/мл.WISH среде) раствора VSV (в дозе, которая предварительно определена для лизиса 100%WISH клеток за 48 ч) добавляют во все лунки, за исключением контрольных (туда добавляют равное количество среды) .- После еще одной инкубации в течение 48 ч 25 мкл раствора МТТ добавляют во все лунки,после чего планшет инкубируют еще 2 ч в инкубаторе.- Через 1 ч планшеты считывают при 595 нм, используя программное обеспечение Softmax Pro и Spectramax спектрофотометр (Molecular Devices). Все реакции секвенирования проводят, используя набор ThermoSequenase радиоактивно меченого терминатора цикла секвенирования(Amersham Life Science; Cleveland, ОН). Придерживаются методики производителя. Все реакции секвенирования анализируют на CastAway Precast гелях для секвенирования (Stratagene; LaJolla, СА) которые содержат 6% полиакриламида и 7 М мочевины. Реакции секвенирования загружают в порядке A-C-G-T. Авторадиографию гелей для секвенирования считывают согласно инструкции. Для анализа последовательности ДНК используют программное обеспечение The Genetics Computer Group Sequence Analysis Software Package и UNIX workstation. Пример 1. Для определения антивирусной активности человеческого sIFHAR2/IFN комплекса и человеческого sIFNAR2Ig-IFN комплекса, фиксированную концентрацию IFN (4,75 МЕ/мл) преинкубируют в течение 3 ч при 37 С с человеческим sIFNAR2 (рекомбинант р 40) или человеческим sIFNAR2Ig при различных концентрациях (0,25 - 300000 нг/мл) и затем определяют вIFN антивирусная защита не обнаруживается(результаты не представлены). Антивирусная активность интерферонов типа I (использованных в предопределенных концентрациях ЛД 50) в присутствии приблизительно 30 нг/мл sIFNAR2 обнаруживается при оптимальной агонистической активности сIFN, но не сама по себе. Антивирусную активность измеряют по концентрации МТТ через 48 ч после добавления VSV. Если интерферон находится в ожидаемой концентрации для ЛД 50, наблюдают защиту (см. фиг. 1 - абсорбция, равная 0,45, отсутствие защиты - абсорбция 0,0, полная защита - абсорбция 1,8). Если IFNAR2 и IFNAR2Ig титруют при различных концентрациях, получают 4 Х усиление активности IFN вплоть до 32 нг/млIFNAR2 и IFNAR2Ig (также см. пример 2 и фиг. 2). Выше 32 нг/мл IFNAR2 и IFNAR2Ig, активность IFN уменьшалась, как и ожидали, предположительно за счет борьбы за IFN и между sIFNAR и мембранным IFNAR. Этот эксперимент, таким образом, поддерживает предположение о повышенной потенции и усиленной активности IFN в комплексе IFNAR2/IFN. Пример 2. Эффект влияния изменения концентрацииIFN на активности в комплексе sIFNAR2/IFN проверяли при различных концентрациях IFN в дополнение к ED50. Как видно на фиг. 2, при 4,75 МЕ/мл IFN, преинкубация IFNAR2 в течение 1 ч усиливает активность IFN в 2 Х при максимальной концентрации -32 нг/мл. При каждой из более высоких концентраций IFN, уже невозможно определить усиление антивирусной активности IFN, т.к. активность и так максимальна. Эти результаты также подтверждают,что IFNAR2/IFN комплекс имеет усиленную активность IFN. Пример 3. Кинетику образования комплекса IFNAR2/IFN оценивали путем измерения антивирусной активности субэффективной концентрации IFN(0,95 МЕ/мл) за различное время преинкубации при различных концентрациях IFNAR2. Как видно на фиг. 3, 4 ч преинкубация необходима для усиления антивирусной активности IFN при этой субэффективной дозе. Таким образом,при уровнях IFN, в которых он неактивен сам по себе, добавление IFNAR2 для образования комплекса приводит к значительной антивирусной активности IFN. Этот эксперимент является дополнительным подтверждением того, что комплекс IFNAR2/ IFN усиливает активностьIFN. Пример 4. Полагают, что биоактивность IFN быстро падает вслед за реконституцией in vitro при 37 С (PBS рН 7,4). Это происходит, по крайней мере, частично за счет формирования олиго 003635 мерных структур IFN, которые имеют пониженную активность. Чтобы проверить, усиливает ли IFNAR2 стабильность IFN при физиологических рН, провели эксперимент, в которомIFN при различных концентрациях инкубировали сам по себе (в RPMI 1640 среде, Gibco) или в этой же среде в присутствии IFNAR2 при постоянном соотношении IFNAR2 к IFN (2,5 нг/МЕ).IFN (500 МЕ/мл) проинкубировали с равным объемом или sIFNAR2 (1,25 мкг/мл) или только с RPMI в течение 3 ч при 37 С. Титрование обоих растворов IFN проводили в WISH среде в 96-луночном планшете до добавленияWISH клеток. VSV добавили через 24 ч, и измерение проводили еще через 48 ч инкубации, как и определяют превращение МТТ. Как видно на фиг. 4, IFN сам по себе имеет ED50 -104 МЕ/млм, а преинкубация IFN с растворимым IFNAR2 приводит к значительному увеличению ED50 = 7 МЕ/мл. Высокая ЛД 50IFN самого по себе возможна благодаря олигомеризации IFN в растворе. Выше приведенные результаты еще раз показывают повышение стабильности IFN в комплексе с IFNAR2. Пример 5. Чтобы оценить происходит ли повышение активности IFN в присутствии IFNAR2 благодаря специфической защите sIFNAR2, активность IFN измеряли вслед за образованием комплекса с IFNAR2 или другими неродственными белками в той же концентрации (человеческий IgG, бычий сывороточный альбумин(BSA. Как показано на фиг. 5, IFN (500 МЕ/мл) проинкубировали с равным объемом из вышеуказанных белков (1,25 мкг/мл) или только сRPMI в течение 4 ч при 37 С. Титрование этих растворов IFN в WISH среде проводили в 96 луночных планшетах перед добавлением WISH клеток. Свежеприготовленный IFN также включают для определения эффекта преинкубации на активность IFN. VSV добавляют через 24 ч и СРЕ оценивают еще через 48 ч инкубации по превращению МТТ. Преинкубация IFN с не специфическими белками (например, BSA или IgG) человека при 2,5 нг/МЕ IFN не защищала активность IFN после восстановления. Активность IFNAR2/IFN комплекса в этом тесте сходна с активностью свежедобавленного IFN, что поддерживает идею о том, что sIFNAR2 стабилизирует активность IFN. Пример 6. Комплекс IFNAR2/IFN имеет сильно пролонгированный фармакокинетический профиль IFN у мыши при определении с помощьюELISA и биотестов (фиг. 6 и 7). Мыши линии B6D2F1 получили одно внутривенное болюсное введение или человече 27 ского IFN (2,5 х 106 МЕ/кг) или ту же концентрацию IFN; проинкубированного в течение 1 ч при 4 С с человеческим IFNAR2 (2,5 нг/МЕIFN). Сыворотки собирают через 0,05 - 48 ч после введения из ретроорбитального синуса, и концентрацию IFN, а также антивирусную активность IFN оценивают по ELISA (фиг. 6) или по WISH биотесту (фиг. 7) соответственно. При концентрациях сыворотки ниже уровня чувствительности теста (7,55 МЕ/мл) в ELISA результаты не отображают. Комплекс показал не только расширенный фармакокинетический профиль, но и по WISH антивирусному анализу уровень биологической активности IFN у мыши был сильно увеличен по времени, что показывает повышенную стабильность и пролонгированное время полужизни комплекса IFNAR2/IFN настоящего изобретения по отношению только к IFN. Пример 7.IFNAR2/IFN2a комплекс показывает очень пролонгированный фармакокинетический профиль IFN2a в мыши на основании ELISA и биотестов (фиг. 8 и 9). Мыши линии B6D2F1 получили одно внутривенное болюсное ведение или человеческого IFN (1,25 х 105 МЕ/кг) или ту же концентрацию IFN, проинкубированного в течение 1 ч при 4 С с человеческим IFNAR2 (14,9 нг/МЕIFN). Сыворотку собирали в обозначенное время после введения из ретроорбитального синуса и оценивали концентрацию IFN2a и антивирусную активность IFN по ELISA (фиг. 8) или по WISH биотесту (фиг. 9) соответственно.IFN оценивали по ELISA, специфичному к человеческому IFN. Сыворотки, концентрация которых была ниже уровня чувствительности теста (30 МЕ/мл) в ELISA, не отмечали. Комплекс показал не только расширенный фармакокинетический профиль для IFN, но и по WISH антивирусной активности уровень биологической активности IFN у мыши был сильно увеличен по времени, что показывает повышенную стабильность и пролонгированное время полужизни в плазме комплексаIFNAR2/IFN. настоящего изобретения в отношении только IFN. Пример 8. Конструирование IFNAR2/IFN сшитых белков. Конструкции созданы таким образом, что С-конец внеклеточного домена IFNAR2 сшит сN-концом зрелого IFN, с помощью следующих пептидных линкеров, G и S, представляющих собой аминокислоты глицин и серин соответственно: внеклеточный IFNAR2 (линкер) зрелый 28 Полная аминокислотная последовательность, n = 2 IFNAR2/IFN химеры показана на фиг. 10 (SEQ ID NO:14). Вектор экспрессии pSVEIF, который содержит ген, экспрессирующий человеческий рекомбинантный IFN, использовали как матрицу для ПЦР. Синтетические праймеры были созданы таким образом, что только кодирующий участок зрелого белка человеческогоIFN(MSY) может быть амплифицирован с матрицы. 5' праймер состоит из последовательностей для сайта расщепления SmaI, последних 7 аминокислот IFNAR2 (GQESEFS) остатков 344349 последовательности (SEQ ID NO:14) иXhoI сайты также введены в 5' ПЦР праймер для облегчения клонирования других кассет. 3' праймер содержит AvrII сайт сразу после TGA стоп-кодона hIFN. ПЦР содержала примерно 1 г матричной ДНК, 1 г каждого ПЦР праймера,0,2 мМ каждого дАТФ, дСТФ, дГТФ и дТТФ, IXMgSO4 конечная концентрация) в объеме реакции 100 мкл. После VENTR начальной инкубации при 99,9 С в течение 30 с, 2 единицыVENTR ДНК полимеразы добавляют к реакции. ПЦР состоит из 20 циклов, таких как: а) 99,9 С 30 с, б) 65-55 С 30 с, понижение на 0,5 С с каждым циклом, с) 75 С 40 с. Еще 15 циклов делают по вышеуказанному профилю, но температуру отжига поддерживают при 55 С. Реакции ПЦР очищают, используя Wizard PCRPreps DNA Purification System (Promega; Madison, WI). После расщепления продуктов ПЦРAvrII, реакции очищают при низкой точке плавления в агарозном геле. Гель-очищенные фрагменты, содержащие последовательность hIFN зрелого белка с 1 GS линкером, лигируют в(SmaI + AvrII)-расщепляемый вектор экспрессии pCMV-p40, который содержит ген, кодирующий растворимую форму человеческого рекомбинантного INFAR2. Реакцию лигирования используют для трансформации компетентных клеток Е. coli XL-1 голубых клеток, используя стандартные способы (Sambrook et al, 1989). Правильную сборку конструкции, называемуюpCMV-IFNAR2/IFNAGS подтверждают расщеплением рестрикционной эндонуклеазой и секвенированием ПЦР-образуемого участка"внутреннего слияния". Последующие конструкции создавали с помощью кассет олигонуклеотидов, каждая содержала BamHI выступ,соответственно (GGGGS)n линкер (SEQ IDNO:1, n = 1) и XhoI выступ. О GS кассеты содержали SmaI и XhoI выступы. После подтверждения pCMV-IFNAR2/IFNA 1 GS вектора, его расщепляют SmaI и XhoI и соответствующие кассеты лигируют в этот вектор. Для О GS кон 29 струкции вектор расщепляют SmaI и XhoI для лигирования с кассетой. Создают общий из 6 векторов, pCMVIFNAR2 /IFNn (GS), где n является 0, 1, 2, 3, 4 или 5 GGGGS (SEQ ID NO: 1) линкерными единицами. Результаты рестриктозного расщепления показаны на фиг. 11. Праймеры секвенирования конструируют так, что кассета для каждой конструкции секвенируется полностью. Для каждой из подтвержденных конструкций получают культуры плазмидной ДНК в большом количестве, используя коммерчески доступный набор и протоколы, описанные производителями (Qiagen; Chatsworth, CA). Фиг. 12 представляет собой иллюстративную плазмидную карту pCMV-IFNAR2/IFN"внутренних слитых" векторов экспрессии. Транскрипция IFNAR2/IFN слитого белка управляется человеческим непосредственным ранним промотером CMV. Сигнальную последовательность полуаденилирования гормона роста человека (hGH), предоставляемую посредством вектора, используют для процессинга 3' IFNAR2/IFN транскриптов. Номер Список векторов Название Вектор экспрессииN/A один два три четыре пять Информация о последовательности получена для ПЦР-образованного участка IFNAR2/IFN 1GS химеры; эта информация показывает,что последовательность такая, как и было предсказано. Информация о последовательности получена для участка пептидного линкера других конструкций; последовательности такие же,как были предсказаны. На клетках, трансфицированных каждым из конструктов, проводили нозерн-блот анализ. Полоса размера приблизительно 1,4 тпн имеется во всех дорожках, содержащих IFNAR2-IFN nGS образцы для IFNAR2 пробы и для IFN пробы. В IFN пробе обнаружена дополнительная полоса приблизительно в 0,9 тпн. Дорожка такого размера может соответствовать транскрипту альтернативного сплайсинга, который содержит 6 последних аминокислот IFNAR2 (n) GS пептидный линкер и кодирующую последовательность hIFN зрелого белка. Это подтверждается секвенированием кДНК, полученной из общей РНК, выделенной из временно трансфицированных клеток СНО примера 9. Пример 9. Временная трансфекция. Клетки CHO-DUKX представляют собой клональный мутант клеток яичников китайского 30 хомячка, без дигидрофолатредуктазной активности (Urlaub et al (1980), Graff et al (1982. Клетки поддерживают на Альфа Минимальной необходимой среде (МЕМ) плюс рибонуклеозиды и дезоксирибонуклеозиды, снабженные 10% плодной бычьей сывороткой (FBS) и 1% Lглютамином (полная среда). Временную трансфекцию осуществляют с использованием Lipofectamine PLUSTM Reagent (GibcoBRL Life Technologies; Gaithersburg, MD) и методики, предложенной производителем. Приблизительно за 24 ч до трансфекции клетки размещают на чашках 100 мм диаметра с плотностью 2 х 106 клеток/чашка. Для трансфекции используют 4 мкг суперскрученной векторной плазмидной ДНК(pCMV-IFNAR2/IFN n GS, где n = 0, 1, 2, 3, 4, 5). Для разведения ДНК и PLUS реагента используют бессывороточную среду, предоставляемую производителем. Клеточные супернатанты собирают после инкубации при 37 С в течение 48 ч в полной среде для ELISA (IFNAR2-IFN) и Вестерн гелей. Экстрагирование РНК и нозерн анализ. Общую клеточную РНК (Chomczynski et al 1987) экстрагируют из временно трансфицированных CHO-DUKX клеток. 10 г тотальной РНК на дорожку фракционируют по размеру в агарозных гелях, которые содержат формальдегид в качестве денатурирующего агента. Образцы размещают в дубликатах. РНК переносят на(DuPont/NEW Medical Products; Boston, MA) путем капиллярного блота в 10 х SSC (1,5 М хлорид натрия, 0,15 М цитрат натрия). Иммобилизованную РНК гибридизуют с меченными 32P(1984). Буфер содержит 0,25 М фосфата натрия,рН 7,2 0,25 М хлорида натрия, 7% додецилсульфата натрия (SDS), 1 мМ этилендиаминтетрауксусной кислоты и 100 мкг/мл E.coli тРНК. Меченные 32P зонды получают, используя коммерчески доступный набор ("High Prime" BoehringerMannheim; Indiapolis, IN) и методики, описанные здесь. Невключенную радиоактивность отмывают с помощью хроматографии на SephadexG-50 колонках. После гибридизации блоты промывают, наиболее строгие условия представляют собой 0,2 х SSC, 0,1% SDS при 65 С. Блоты радиографируют. Экспрессия внутренних слитых белков. Супернатанты каждой внутренней слитой конструкции временно трансфицируют в СНО клетки, анализируют на уровень экспрессииIFNAR2 и IFN, используя INFAR2 специфические ELISA и IFN ELISA (Toray), соответственно. Результаты этого анализа показаны ниже в табл. IV.IFNAR2 Не обнару 1176 34,200 жено Культуральная среда Не обнару 0 жено- определено при помощи набора Тоray- определено с помощью hIFNAR2 ELISA- на основании специфической активности 2,0 х 105 E/mg (2 х 108/mg)- основано на массе в 22 200 дальтон (средняя масса по MALDITOF анализу hIFN)+ - основано на массе в 34 400 дальтон (средняя масса по MALDITOF анализу) Как можно понять, с увеличением длины линкера наблюдается уменьшение определенияIFNAR2 и IFN. В это же время, невозможно установить происходит ли это благодаря понижению экспрессии количества внутреннего слитого белка вследствие увеличения длины линкера, или поскольку длина линкера увеличивается,IFN может связаться с IFNAR2 связывающим сайтами и, таким образом, не полностью определяется с помощью ELISA. Известно, что IFN анализ определяет только несвязанный IFN. Вестерн блот анализ IFNAR2/IFN составного белка Для того чтобы установить, что внутренние слитые белки экспрессируются при определенном молекулярном весе и что нет свободного экспрессируемого IFN, супернатанты от трансфицированных клеток анализируют с помощью Вестерн блотинга с использованием анти-IFN антител для определения внутреннего слияния. Результаты анализа показаны на фиг. 13. 15 мкл культуральных супернатантов от клеток СНО временно трансфицированныхIFNAR2 конструкциями (дорожка 7), культуральную среду (дорожка 8) или IFN (дорожка 9) подвергли SDS-PAGE в невосстанавливающих условиях, а за этим электропереносу наPVDF мембрану. Мембрану зондировали антителами кролика к IFN и затем антителами козы против кролика, конъюгированными с щелочной фосфатазой с использованием Western-Star набора определения люминисценции. Не было обнаружено свободного IFN в супернатантах любой из внутренних слитых конструкций. Более того, каждая из конструкций экспрессировала белок, который при Вестерн блоте имел соответствующий MB для каждой составной внутренней слитой конструкции. Пример 10. Антивирусная активность внутренних слитых молекул. Каждый культуральный супернатант, содержащий внутреннюю химеру, тестируют на антивирусную активность в тесте цитопатичности, в котором WISH клетки (амниотические клетки человека) подвергают действиюVSV, а за тем добавляют или IFN (контроль) или внутренние химеры. Результаты приведены на фиг. 14. Супернатанты СНО клеток, содержащие экспрессированные рекомбинантные белки (что определено в ELISA и Вестерн блоте) или СНО культуральную среду саму по себе добавили в повторах в верхний ряд 96-луночного плоскодонного планшета в объеме 75 мкл/лунка. 50 мкл клеток WISH добавляли в оставшиеся лунки планшета. Трехкратные последовательные разведения каждого образца проводили путем удаления 25 мкл из лунок, содержащих супернатанты (верхний ряд) и добавления их в следующий ряд содержащий 50 мкл WISH тестируемой среды. В лунках положительного контроля супернатант в верхнем ряду замещают средой WISH, содержащей 1000 МЕ/мл человеческого IFN, который затем разводят трехкратно далее по всей длине планшета. В каждой лунке, таким образом, получается 50 мкл суспензии WISH клеток (0,6 х 106 клеток/мл вWISH тестируемой среде), так, что конечная концентрация в верхнем ряду, содержащем REBIF, составляет 500 МЕ/мл и начальное разведение для супернатантов СНО клеток составляет 1:2. После 24 ч инкубации в 5% СO2 при 37 С в каждую лунку (за исключением тех, которые представляют собой неинфицированные контрольные лунки) добавляют 50 мкл WISH тестируемой среды, содержащей VSV (1:10 из раствора для хранения) . Жизнеспособность WISH клеток определяют после 48 ч инкубации культуры по превращению МТТ. 33 Антивирусную активность, опосредованную внутренними слитыми молекулами, определяют путем нормализации фактора разведения супернатантов, необходимого для достижения EC50 до ЕС 50, определяемой для очищенного человеческого стандарта IFN. С увеличением длины линкера увеличивается антивирусная активность внутренних слитых конструкций. Пример 11. Этот пример представляет собой фармакокинетическое исследование комплекса человеческого IFNAR2/IFN у мыши после внутривенного введения. Сравнение проводят между приготовленными заранее и раздельно введенными компонентами комплекса. 36 мышей линии D2F1 (6-8 недельные приблизительно 20 г каждая) разделили на 4 группы следующим образом: Группа 1 содержала 9 мышей для внутривенного введения единственной болюсной дозы 200 мкл 50 000 МЕ/мл человеческого IFN (конечная доза 10 000 МЕ/мышь). Группа 2 (9 мышей) получила 200 мкл раствора 5000 МЕ/мл человеческого IFN и 125 мг/мл sIFNAR2 (2,5 нг/МЕ соотношение). Группа 3 (9 мышей) получила (1) 200 мкл раствора 125 мг/мл, а за этим (2) 200 мкл раствора 50 000 МЕ/мл человеческого IFN (2,5 нг/МЕ соотношение). Группа 4 (9 мышей) получила (1) 200 мкл раствора 625 мг/мл, а за этим (2) 200 мкл раствора 50 000 МЕ/мл человеческого IFN (10 нг/МЕ соотношение). Образцы крови (приблизительно 200 мкл/образец) собрали в определенное время,разрывая ретроорбитальный синус с помощью капиллярной трубки. У трех мышей из каждой группы забирали образцы крови через 0,05, 2 и 12 ч после введения. У трех мышей из каждой группы образцы крови забирали через 0,54 и 24 ч после введения и у остальных трех мышей через 1, 8 и 48 ч после введения. Образцам крови дают возможность свернуться в течение 1 ч при комнатной температуре, отбирают и микроцентрифугируют. Сыворотку, отмытую таким образом, хранят при -70 С до тех пор пока не будут собраны все образцы. Сыворотку анализируют на присутствие человеческого IFN путем измерения IFN в специфическом тестеELISA показаны на фиг. 15 А и результаты антивирусного теста WISH показаны на фиг. 15 В. Видно, что время полужизни IFN в сыворотке, введенного в комплексе с IFNAR2, такое же, как и у отдельно введенного IFN, с последующим отдельным введением IFNAR. Эти результаты подтверждают образование in vitro комплекса IFN/IFNAR2, который увеличивает время полужизни. Пример 12. Мышей C57BL/6 обрабатывали комплексом "универсального" IFN (человеческийIFNA/D) и sIFNAR2. Измеряли защитный эффект по цитотоксичности по сравнению с введением различных доз универсального IFN самого по себе или с контролем. Первая группа получила 5 х 103 ME универсального IFN в комплексе с 5 нг/МЕ sIFNAR2. Вторая группа получила 5 х 103 ME универсального IFN. Третья группа получила 5 х 104 ME универсальногоIFN и четвертая группа получила PBS/2% NMS. Для каждой из этих мышей измеряли активность НК как цитотоксичность клеток селезенки против клеток-мишеней НК YAC-1. Результаты показаны на фиг. 16. Активность НК значительно выше у мышей, обработанных комплексом универсального IFN с sIFNAR2 по сравнению с мышами, обработанными только универсальным IFN. Пример 13. Как определено выше, фармакокинетические исследования показали значительное увеличение времени полужизни в сыворотке IFN типа I при введении в комплексе с sIFNAR2,растворимой формы субъединиц рецептора IFN. Результаты in vitro предполагают, что физическое соединение с IFNAR2 приводит к стабилизации в норме лабильного IFN. Для того чтобы определить, являются ли увеличение РК профиля и стабилизирующий эффект IFNAR2 причиной усиления и пролонгирования IFNопосредованной активности in vivo, была разработана модель, в которой мышам с тяжелым комбинированным иммунодефицитом (scid/scid) были введены летальные дозыIFNчувствительных В клеток Дауди клеточной линии человеческой лимфомы (Ghetie 1991; Ghetie 1990). У этих мышей развивался паралич между 14 - 20 днями после введения опухолевых клеток в комплексе с гистологической очевидностью диффузной лимфомы. Следует отметить,что выживание таких мышей можно продлить дозозависимым способом с помощью ежедневного подкожного введения человеческого IFN. Эту модель использовали для определения IFNAR2 в качестве потенциатора биологической активности, связанной с IFN типа I in vivo. Для того чтобы установить взаимоотношения между значением времени до паралича и дозы IFN в scid модели Дауди, пяти группам мышей BALB/cByJSmn-scid/scid линии, 4-5 недельного возраста, самкам, производили подкожное введение 200 мкл на мышь в день человеческого IFN ежедневно, начиная с 0 дня до 30 дня. Стандартная доза клеток Дауди, разведенная из замороженного раствора хранения составляет 5 х 106 клеток на мышь путем подкожного введения в загривок в 0 день в PBS. Группы мышей получили следующие количества IFN: Группа 1: 135 х 104 МЕ/мышь (675 х 104 МЕ/мл). Группа 2: 45 х 104 МЕ/мышь (225 х 104 МЕ/мл). Группа 3: 15 х 104 МЕ/мышь (75 х 104 МЕ/мл). Группа 4: 5 х 104 МЕ/мышь (25 х 104 МЕ/мл). Группа 5: PBS с 4% NMS. Время до паралича индивидуально и средние значения показаны в табл. V. Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Дни до паралича 26, 31, 35, 37, 40 20, 23, 23, 23, 26 20, 20, 22, 22, 23 17, 18, 18, 18, 18 14, 14, 15, 15, 15 Возможно, что среднее значение времени до паралича в модели ксенотрансплантанта Дауди/scid увеличено путем ежедневных подкожных введений человеческого IFN дозозависимым образом. Пример 14. Чтобы определить, можно ли усилить антиопухолевое действие IFN путем его объединения в комплекс с IFNAR2 при 2,5 нг/МЕ, семь групп по пять мышей обработали по тому же протоколу, который обсуждали в примере 13, за исключением того, что тестируемый материал вводили в каждую группу следующим образом:IFN только/мышь Группа 1 2 х 102 ME Группа 2 2 х 103 ME Группа 3 2 х 104 ME Группа 7 получила клетки Дауди, обработана только средой разведения Время до паралича индивидуально и средние значения показаны в следующей таблице: Таблица VI Дней до паралича Средние значения ( SD) Группа 1 16, 16, 17, 18, 19 17,2 (1,3) Группа 2 17, 18, 18, 19, 19 18,2 (0,8) Группа 3 17, 17, 17, 18, 18 17,6 (0,9) Группа 4 17, 17, 18, 18, 19 17,8 (0,8) Группа 5 17, 18, 19, 20, 20 18,8 (1,3) Группа 6 21, 22, 22, 23, 26 22,8 (1,9) Группа 7 16, 16, 17, 17, 17 16,6 (0,6) 3 начительно отличается (значение р 0,05) от такой же концентрации IFN в некомплексном виде в сравнениях пар групп, как определено с помощью однодорожечного Видно, что антиопухолевая активность низкой дозы IFN, равной 2 х 104 МЕ/мышь/день и модели ксенотрансплантанта Дауди/scid значительна увеличивается при образовании комплекса с IFNAR2. 36 В дополнительном эксперименте (не показано) влияние частоты инъекции исследовали по среднему времени паралича. Было определено,что значительнее повышение антиопухолевой активности на модели ксенотрансплантанта Дауди/stid может быть получено путем обработки комплексом IFN/IFNAR G2 при частоте инъекции один раз в неделю по сравнению со свободным IFN, вводимым один раз в день. Кроме того, в дополнительном эксперименте (не показано) определяли оптимальное соотношение IFNAR2 к IFN. Было обнаружено, что оптимальное соотношение IFNAR2: IFN для увеличения противоопухолевой активности при единственной концентрации IFN (2 х 104 МЕ/мышь/день) составляет 2,5 нг IFNAR2 на пгIFN. Во втором эксперименте было обнаружено, что оптимальное соотношение IFNAR2:IFN для увеличения противоопухолевой активности при концентрации IFN 5 х 104 МЕ/мышь/день составляет 0,3 нг IFNAR2 на пг IFN. Эти два эксперимента определяют, что оптимальное соотношение зависит от концентраций IFN, и оказывается, что, чем выше концентрация IFN,тем ниже должно быть соотношение . В другом эксперименте, использующем такую же модель, было установлено, что введение только IFNAR2 не повышает выживаемость мышей в данном исследовании. Пример 15. Этот пример представляет собой фармакокинетическое исследование для определения периода полужизни внутренней слитой молекулы 5GS в сыворотке мыши после однократной болюсной внутривенной инъекции. Двадцать одну самку мыши штамма B6D2F1 (6-8 недель)(приблизительно по 20 г каждая) разделили на три группы следующим образом: Группа 1: содержит девять мышей, которым вводили внутривенно один болюс с 200 мкл раствора, содержащего 100000 МЕ/мл внутреннего слитного 5GS (конечная доза составляет 20000 МЕ/мышь или 5 х 106 МЕ/кг). Группа 2: (девять мышей) получали 200 мкл раствора 100000 МЕ/мл человеческогоIFN. Группа 3: содержит трех неинъецированных мышей, которые служат как отрицательный контроль. Полагая объем крови приблизительно 2 мл/мышь, теоретические значения Сmax и Тmax составляют 10000 МЕ/мл для групп 1 и 2. У трех мышей из каждой из групп 1 и 2 брали образцы крови через 0,05, 2 и 12 ч после введения. У трех мышей из каждой группы 1 и 2 брали образцы крови через 0,5, 4 или 24 ч и трех мышей из каждой группы 1 и 2 брали образцы крови через 1, 8 и 48 ч после введения. Сыворотку исследовали на присутствие биоактивного человеческого IFN, используя анализ WISH. 37 Результаты показаны на фиг. 17. Тогда какIFN выводится почти немедленно, внутренняя слитая молекула остается в сыворотке в течение длительного времени после инъекции. Это демонстрирует, что слитый белок имеет желательный стабилизирующий эффект. Предшествующее описание конкретных воплощений настолько полно открывает основную природу изобретения, что другие специалисты могут, применяя существующие в настоящее время знания, легко модифицировать и/или приспособить для различных применений такие конкретные воплощения без лишнего экспериментирования и без отклонения от основной концепции, и, следовательно, считается, что такие приспособления и модификации находятся в средствах и области эквивалентов раскрытых воплощений. Должно быть понятно, что фразеология и терминология, применяемые в данном документе, предназначены для описания, но не для ограничения. Средства, материалы и стадии для проведения различных раскрытых функций могут принимать ряд альтернативных форм без отступлений от изобретения. Таким образом, под выражениями "означает,что" и "означает для" или любая формулировка стадии способа, какая может быть найдена в вышеприведенном описании и/или в нижеприведенной формуле изобретения, сопровождаемыми функциональными утверждениями,подразумевают определение и охват какого либо структурного, физического, химического или электрического элемента или структуры, или в какой-либо стадии способа, которые могут существовать в настоящее время или в будущем, и которые выполняют указанную функцию вне зависимости от точной эквивалентности воплощению или воплощениям, раскрытым в вышеприведенном описании, то есть, могут использоваться другие средства или стадии для выполнения тех же функций, и под этим подразумевают, что таким выражениям придается их широчайшая интерпретация. Ссылки(IFN) типа I и субъединицу рецептора человеческого интерферона / (IFNAR), которая способна связываться с IFN типа I комплекса, в котором указанный IFN типа I представляет собой:b) фрагмент а), который обладает биологической активностью IFN типа I;c) вариант а) или b), который обладает, по меньшей мере, 70% идентичностью последовательности с а) или b) и который обладает биологической активностью IFN типа I;d) вариант а) или b), который кодируется последовательностью ДНК, которая гибридизуется с комплементом последовательности нативной ДНК, кодирующей а) или b) при умеренно строгих условиях, и который обладает биологической активностью IFN типа I; илиe) соль или функциональное производное а), b), с) или d), которое обладает биологической активностью IFN типа I; и в котором указанныйf) полипептидную цепь нативного человеческого IFNAR;g) фрагмент f), который обладает биологической активностью IFNAR;h) вариант f) или g), который обладает, по меньшей мере, 70% идентичностью последовательности с f) или g) и который обладает биологической активностью IFNAR;i) вариант f) или g), который кодируется последовательностью ДНК, которая гибридизуется с комплементом последовательности нативной ДНК, кодирующей f) или g) при умеренно строгих условиях, и который обладает биологической активностью IFNAR; илиj) соль или функциональное производноеf), g), h) или i), которое обладают биологической активностью IFNAR. 2. Комплекс по п.1, отличающийся тем,что указанный IFN типа I связан с указаннымIFNAR посредством пептидного линкера. 5. Комплекс по п.4, отличающийся тем,что указанный пептидный линкер представляет собой (GGGGS)n, где n=1-5. 6. Комплекс по любому из пп.1-5, отличающийся тем, что указанный IFN типа I представляет собой IFN, IFN или IFN. 7. Комплекс по п.5, отличающийся тем,что указанный IFN типа I представляет собойIFN. 8. Комплекс по любому из пп.1-7, отличающийся тем, что указанный IFNAR представляет собой бета-субъединицу рецептора человеческого интерферона /(IFNAR2). 9. Молекула ДНК, кодирующая слитый белок по любому из пп.3-5. 10. Вектор, включающий молекулу ДНК по п.9. 11. Штамм клетки-хозяина, трансформированный вектором по п.10, таким образом, что позволяет экспрессировать указанный слитый белок. 46 12. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и комплекс по любому из пп.1-8. 13. Применение комплекса по любому из пп.1-8 в качестве лекарственного средства. 14. Применение комплекса по любому из пп.1-8 в противовирусной, противораковой или иммуномодулирующей терапии. 15. Применение комплекса по любому из пп.1-8 для пролонгирования действия IFN типа I у пациента in vivo. 16. Лекарственное средство, включающее комплекс по п.1, полученный путем раздельного, одновременного или последовательного введения интерферон (IFN) типа I и субъединицы рецептора человеческого интерферона / (IFNAR) пациенту, нуждающемуся в противовирусной, противораковой или иммуномодулирующей терапии, в котором указанный IFN типаb) фрагмент а), который обладает биологической активностью IFN типа I. 17. Лекарственное средство по п.16, отличающееся тем, что указанный интерферон (IFN) типа I и указанный IFNAR вводят отдельно и комплекс по любому из пп.1-8 образуется invivo. 18. Лекарственное средство по п.16 или 17,отличающееся тем, что IFN представляет собойIFN, IFN или IFN. 19. Лекарственное средство по п.18, отличающееся тем, что IFN представляет собойIFN. 20. Лекарственное средство по любому из пп.16-19, отличающееся тем, что указанныйIFNAR представляет собой бета-субъединицу рецептора человеческого интерферона / (IFNAR2). 21. Применение рецептора человеческого интерферона / (IFNAR) для производства лекарственного средства, содержащего комплекс по п.1, для усиления биологического действия интерферона (IFN) типа I, где указанный IFNAR представляет собой:a) полипептидную цепь нативного человеческого IFNAR;b) фрагмент а), обладающий биологической активностью IFNAR;c) вариант а) или b), обладающий, по крайней мере, 70% идентичностью последовательности с а) или b) и который обладает биологической активностью IFNAR;d) вариант а) или b), кодируемый последовательностью ДНК, которая гибридизуется в умеренно строгих условиях с последовательностью, комплементарной ДНК, кодирующей а) или b), причем указанный вариант обладает биологической активностью IFNAR; или 47 е) соль или функциональное производное а), b), с) или d), которое обладает биологической активностью IFNAR. 22. Применение интерферона (IFN) типа I и субъединицы рецептора человеческого интерферона / (IFNAR), способной связываться с указанным IFN типа I для производства лекарственного препарата, содержащего комплекс по п.1, обладающего пролонгированным действиемIFN, причем указанный препарат получают invivo путем раздельного, одновременного или последовательного введения составляющих указанного комплекса нуждающемуся в этом пациенту, где указанный IFN типа I представляет собой:b) фрагмент а), который обладает биологической активностью IFN типа I;c) вариант а) или b), обладающий, по крайней мере, 70% идентичностью последовательности с а) или b) и который обладает биологической активностью IFN типа I;d) вариант а) или b), кодируемый последовательностью ДНК, которая гибридизуется в умеренно строгих условиях с последовательностью, комплементарной ДНК, кодирующей а) или b), причем указанный вариант обладает биологической активностью IFN типа I; илиe) соль или функциональное производное а), b), с) или d), которое обладает биологической активностью IFN типа I;a) полипептидную цепь нативного человеческого IFNAR;b) фрагмент а), обладающий биологической активностью IFNAR;c) вариант а) или b), обладающий, по крайней мере, 70% идентичностью последовательности с а) или b) и который обладает биологической активностью IFNAR;d) вариант а) или b), кодируемый последовательностью ДНК, которая гибридизуется в умеренно строгих условиях с последовательностью, комплементарной ДНК, кодирующей а) или b), причем указанный вариант обладает биологической активностью IFNAR; или е) соль или функциональное производное а), b), с) или d), которое обладает биологической активностью IFNAR. 23. Применение комплекса по любому из пп.1-8 для производства лекарственного средства, используемого для пролонгирования действия IFN типа I in vivo. 24. Способ получения слитого белка,включающий культивирование штамма клетки хозяина по п.11 и выделение экспрессируемого слитого белка. 25. Способ улучшения сохраняемости интерферона типа I, включающий хранение указанного интерферона в форме комплекса по любому из пп.1-8.
МПК / Метки
МПК: A61K 38/21, C07K 14/555, A61P 31/12, C12N 15/12
Метки: комплекс
Код ссылки
<a href="https://eas.patents.su/28-3635-kompleks-ifnar2-ifn.html" rel="bookmark" title="База патентов Евразийского Союза">Комплекс ifnar2/ifn</a>
Предыдущий патент: Новые способы терапевтической вакцинации
Следующий патент: Остеопротегеринсвязующие белки и рецепторы
Случайный патент: Системы и способы построения геофизических изображений с использованием аморфной вычислительной обработки