Замещенные 5-фтор-1н-пиразолопиридины и их применение
Номер патента: 23631
Опубликовано: 30.06.2016
Авторы: Грибенов Нильс, Кро Вальтер, Ли Фолькхарт Мин-Джиан, Шлеммер Карл-Хайнц, Хартманн Эльке, Миттендорф Ёахим, Кнорр Андреас, Аккерштафф Енс, Фольманн Маркус, Бирер Доналд, Беккер Ева-Мария, Вундер Франк, Сташ Йоханнес-Петер, Редлих Горден, Яутелат Рольф
Формула / Реферат
1. Соединение формулы (I)
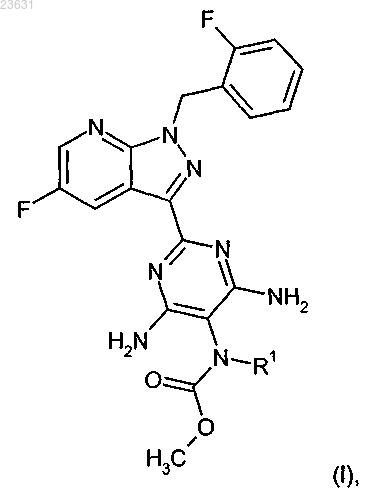
в которой R1 означает водород или (C1-C4)-алкил, незамещенный или замещенный одним или двумя заместителями, независимо один от другого выбираемыми из группы, которая включает фтор и трифторметил, а также их соли, сольваты и сольваты солей.
2. Соединение формулы (I) по п.1, в которой R1 означает водород или метил, причем метил может быть замещен таким заместителем, как трифторметил, а также их соли, сольваты и сольваты солей.
3. Соединение формулы (I) по п.1 или 2, выбираемое из группы:
метил{4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}карбамат,
метил{4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}метилкарбамат,
метил{4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}(2,2,2-трифторэтил)карбамат,
гидрохлорид метил{4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}карбамата,
сульфат метил{4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}карбамата,
фосфат метил{4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}карбамата,
мезилат метил{4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}карбамата,
этан-1,2-дисульфонат метил{4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1Н-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}карбамата,
малеат метил{4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}карбамата,
нитрат метил{4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-ил}карбамата.
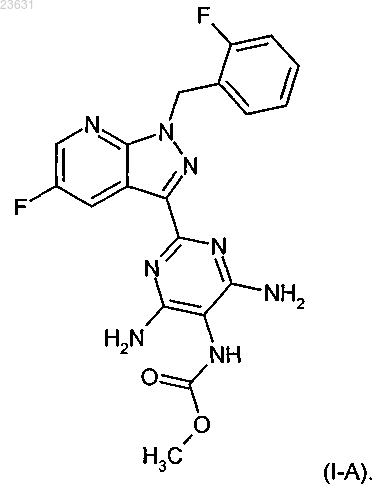
4. Соединение формулы (I-A)
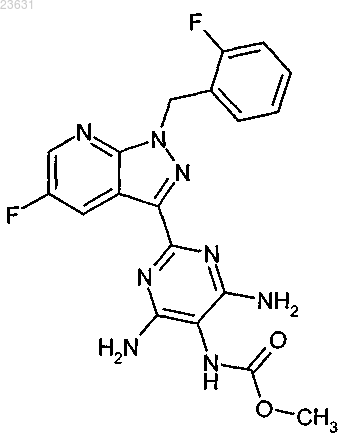
5. Способ получения соединения формулы (I-A) по п.4, отличающийся тем, что соединение формулы (II)
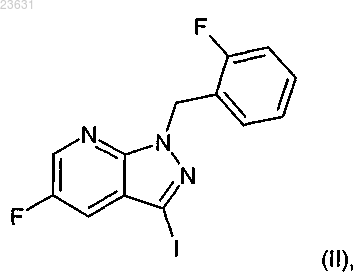
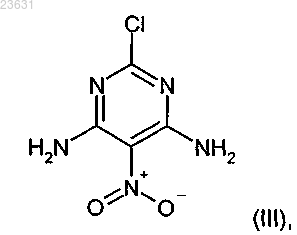
в инертном растворителе в присутствии гексабутилолова и подходящего палладиевого катализатора с промежуточным образованием оловосодержащей частицы с соединением формулы (III)
превращают в соединение формулы (IV)
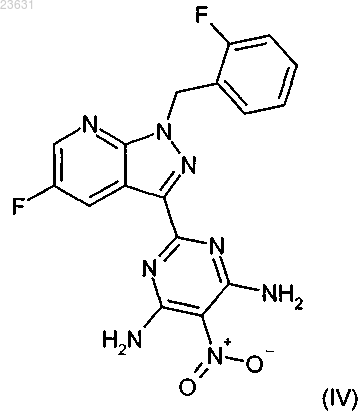
затем это соединение в инертном растворителе с помощью подходящего восстановителя восстанавливают в соединение формулы (V)
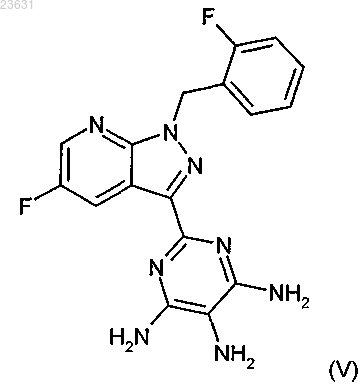
а это соединение затем в присутствии подходящего основания с растворителем или без него с помощью метилового эфира хлормуравьиной кислоты превращают в соединение формулы (I-А)
6. Способ по п.5, отличающийся тем, что полученное соединение формулы (I-А) с соответствующими (i) растворителями, и/или (ii) кислотами, и/или основаниями переводят в его сольваты, соли и/или сольваты солей.
7. Способ получения соединения формулы (I-A) по п.4, отличающийся тем, что соединение формулы (II)
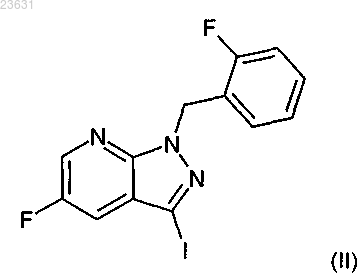
в инертном растворителе с помощью цианида меди превращают в соединение формулы (VI)
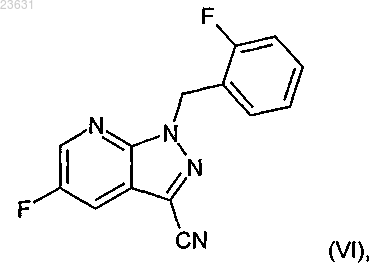
а затем это соединение в кислых условиях переводят в соединение формулы (VII)
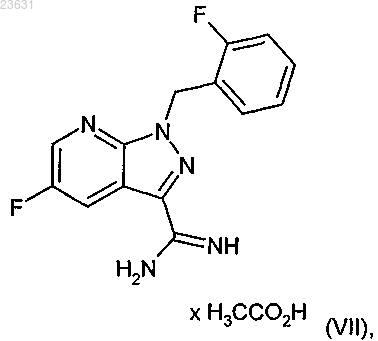
затем это соединение в инертном растворителе в присутствии подходящего основания подвергают взаимодействию с соединением формулы (VIII)

с образованием соединения формулы (IX)
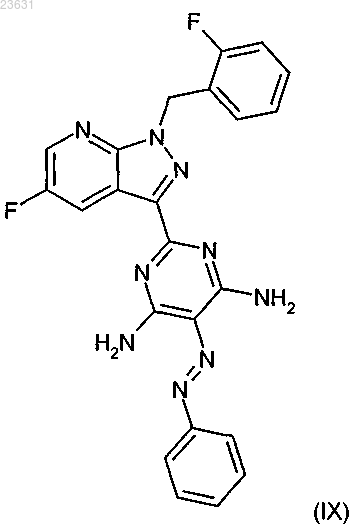
и в заключение это соединение в инертном растворителе в присутствии подходящего восстановителя восстанавливают в соединение (V)
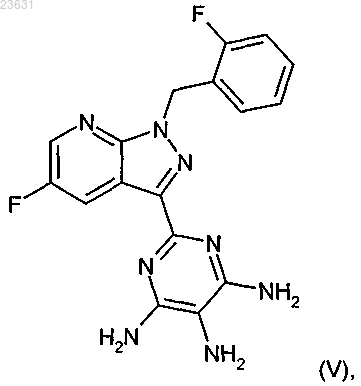
а это соединение в дальнейшем в присутствии подходящего основания с растворителем или без него подвергают взаимодействию с метиловым эфиром хлормалеиновой кислоты с получением соединения формулы (I-A)
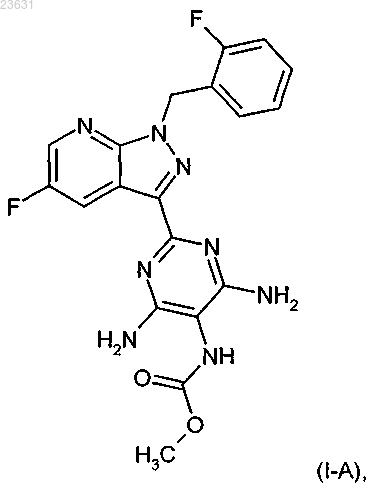
8. Способ по п.7, отличающийся тем, что полученное соединение формулы (I-A) с соответствующими (i) растворителями, и/или (ii) кислотами, и/или основаниями переводят в его сольваты, соли и/или сольваты солей.
9. Способ получения соединений формулы (I) по пп. 1-3, в которой R1 означает (C1-C4)-алкил, который может быть замещен одним или двумя заместителями, независимо один от другого выбираемыми из группы, которая включает фтор и трифторметил, отличающийся тем, что соединение формулы (I-A)
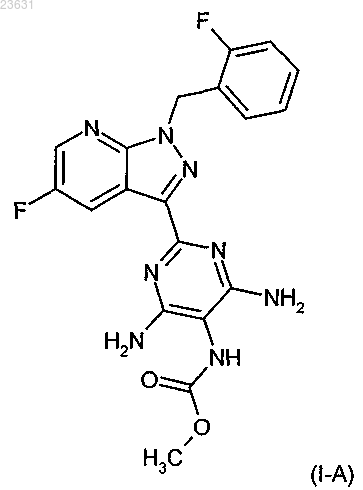
в инертном растворителе в присутствии подходящего основания подвергают взаимодействию с соединением формулы (X)
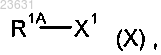
в которой R1A означает (C1-C4)-алкил, незамещенный или замещенный одним или двумя заместителями, которые выбирают независимо один от другого из группы, включающей фтор и трифторметил, и
X1 означает отщепляемую группу,
с получением соединения формулы (I-B)
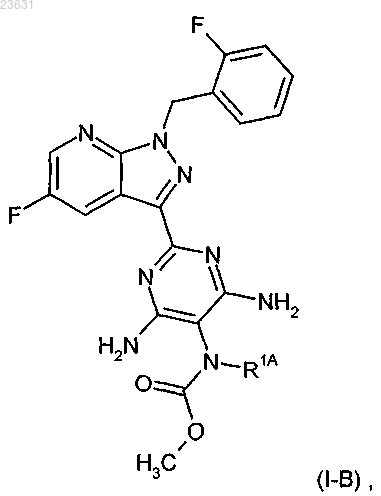
в которой R1A имеет значения, приведенные выше.
10. Способ по п.9, отличающийся тем, что полученное соединение формулы (I-B) с соответствующими (i) растворителями и/или (ii) кислотами, и/или основаниями переводят в его сольваты, соли и/или сольваты солей.
11. Способ по п.9, в котором X1 означает галоид.
12. Способ по п.9, в котором X1 означает бром или йод.
13. Способ по п.9, в котором X1 означает трихлорметансульфонат, мезилат или тозилат.
14. Применение соединения формулы (I) по одному из пп.1-3 или соединения формулы (I-A) по п.4 в способе лечения и/или профилактики сердечной недостаточности, стенокардии, гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза.
15. Применение соединения формулы (I) по одному из пп.1-3 или соединения формулы (I-A) по п.4 для получения лекарства для лечения и/или профилактики сердечной недостаточности, стенокардии, гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза.
16. Лекарственное средство, содержащее соединение формулы (I) по одному из пп.1-3 или соединение формулы (I-A) по п.4, для лечения и/или профилактики сердечной недостаточности, стенокардии, гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза.
17. Способ лечения и/или профилактики сердечной недостаточности, стенокардии, гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза у людей и животных путем применения эффективного количества как минимум одного соединения формулы (I) по одному из пп.1-3, или соединения формулы (I-A) по п.4, или лекарственного средства по п.16.
Текст
в которой R1 означает водород или (С 1-С 4)-алкил, незамещенный или замещенный одним или двумя заместителями, независимо один от другого выбираемыми из группы, которая включает фтор и трифторметил, способам их получения, к их применению для лечения и/или профилактики заболеваний, в частности для лечения и/или профилактики сердечно-сосудистых заболеваний.(71)(73) Заявитель и патентовладелец: АДВЕРИО ФАРМА ГМБХ (DE) 023631 Данное изобретение относится к новым замещенным 5-фтор-1H-пиразолопиридинам, способам их получения, к их применению самих или в комбинации для лечения и/или профилактики заболеваний, а также к их применению для получения лекарств для лечения и профилактики заболеваний, в частности для лечения и профилактики сердечно-сосудистых заболеваний. Одной из важнейших клеточных систем переноса в клетках млекопитающих является циклический гуанозинмонофосфат (cGMP). Вместе с моноокисью азота (NO), которая высвобождается из эндотелия и переносит гормональные и механические сигналы, он образует NO/cGMP-систему. Гуанилатциклазы катализируют биосинтез cGMP из гуанозинтрифосфата (GTP). Известные к настоящему времени представители этого семейства можно разделить как по структурным признакам, так и по виду лигандов на две группы: партикулярные, стимулируемые натрийуретическими пептидами гуанилатциклазы, и растворимые, стимулируемые с помощью NO гуанилатциклазы. Растворимые гуанилатциклазы состоят из двух подъединиц и содержат с высокой вероятностью один гем на каждый гетеродимер, который является частью регуляторного центра. Это имеет центральное значение для механизма активирования. NO может связываться с атомом железа гема и тем самым отчетливо повышать активность энзима. Не содержащие гема препараты, напротив, не стимулируются с помощью NO. Моноокись углерода (CO) также способна присоединяться к центральному атому железа гема, причем стимулирование с помощью CO отчетливо меньше, чем с помощью NO. В результате образования cGMP и результирующего из этого регулирования фосфордиэстераз, ионных каналов и протеинкиназ гуанилатциклаза играет решающую роль при различных физиологических процессах, в частности при релаксации и пролиферации гладких мышц, при агрегации и адгезии тромбоцитов, при нейронном переносе сигнала, а также при заболеваниях, которые вызваны нарушением названных выше явлений. При патофизиологических условиях может подавляться NO/cGMP-система, что может приводить, например, к высокому кровяному давлению, к активированию тромбоцитов (пластинок крови), к увеличению пролиферации клеток, эндотелиальной дисфункции, артериосклерозу, стенокардии, сердечной недостаточности, инфаркту миокарда, тромбозам, инсульту и сексуальной дисфункции. Одна нацеленная на влияние на путь cGMP-сигнала независимая от NO возможность лечения такого рода заболеваний является по причине ожидаемой высокой эффективности и небольших побочных действий многообещающим основанием. Для терапевтического стимулирования растворимой гуанилатциклазы до этого применялись исключительно такие соединения, как органические нитраты, действие которых основано на NO. Оно образуется при биоконверсии и активирует растворимую гуанилатциклазу путем атаки на центральный атом железа гема. Наряду с побочными эффектами развитие толерантности к нему относится к определяющим недостаткам этого способа лечения. В последние годы были описаны некоторые соединения, которые стимулируют напрямую растворимую гуанилатциклазу, то есть без предварительного высвобождения NO, такие как, например, 3-(5'гидроксиметил-2'-фурил)-1-бензилиндазол [YC-1; Wu и др., Blood 84 (1994), 4226; Mulsch и др., Brit. J.Pharmacol. 120 (1997), 681], жирные кислоты [Goldberg и др., J. Biol. Chem. 252 (1977), 1279], дифенилйодоний-гексафторфосфат [Pettibone и др., Eur. J. Pharmacol. 116 (1985), 307], изоликвиритигенин [Yu и др., Brit. J. Pharmacol. 114 (1995), 1587], а также различные замещенные производные пиразола (WO 98/16223). В качестве стимуляторов растворимой гуанилатциклазы опубликованы в WO 00/06569 аннелированные производные пиразола и в WO 03/095451 карбаматзамещенные 3-пиримидинилпиразолопиридины. Задача данного изобретения состояла в предоставлении новых веществ, которые действуют в качестве стимуляторов растворимой гуанилатциклазы и имеют одинаковый или улучшенный терапевтический профиль по сравнению с известными из уровня техники соединениями, таких как, например, в отношении их in-vivo свойств, например их фармакокинетического и фармакодинамического поведения и/или в том, что касается эффективности их дозы. Объектом данного изобретения являются соединения общей формулы (I) в которой R1 означает водород или (C1-C4)-алкил,причем (C1-C4)-алкил может быть замещен одним или двумя заместителями, независимо один от другого выбираемыми из группы, которая включает фтор и трифторметил,-1 023631 а также их соли, сольваты и сольваты солей. К соединениям согласно данному изобретению относятся соединения формулы (I), их соли, сольваты и сольваты солей, охватываемые формулой (I) соединения приведенных далее формул и их соли,сольваты и сольваты солей, а также охватываемые формулой (I), приведенные ниже в качестве примеров получения соединения и их соли, сольваты и сольваты солей, если только в случае охваченных формулой(I), названных позднее соединений не имеются в виду как раз соли, сольваты и сольваты солей. В качестве солей в рамках данного изобретения предпочтительны физиологически не вызывающие сомнений соли соединений данного изобретения. Охвачены также соли, которые сами по себе не пригодны для фармацевтического применения, однако могут применяться для выделения или очистки соединений согласно данному изобретению. Физиологически приемлемые соли соединений данного изобретения охватывают соли присоединения с минеральными кислотами, карбоновыми кислотами и сульфоновыми кислотами, такие как соли хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты,метансульфоновой кислоты, этансульфоновой кислоты, толуолсульфоновой кислоты, бензолсульфоновой кислоты, нафталиндисульфоновой кислоты, муравьиной кислоты, уксусной кислоты, трифторуксусной кислоты, пропионовой кислоты, молочной кислоты, винной кислоты, яблочной кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты и бензойной кислоты. Физиологически приемлемые соли соединений данного изобретения охватывают соли с обычными основаниями, такими как, например и предпочтительно, соли с щелочными металлами (например, натриевые и калиевые соли), соли с щелочно-земельными металлами (например, кальциевые и магниевые соли) или аммониевые соли, полученные с аммиаком или органическими аминами, содержащими 1-16 Cатомов, такие как, например и предпочтительно, этиламин, диэтиламин, триэтиламин, этилдиизопропиламин, моноэтаноламин, диэтаноламин, триэтаноламин, дициклогексиламин, диметиламиноэтанол, прокаин, дибензиламин, N-метилморфолин, аргинин, лизин, этилендиамин и N-метилпиперидин. Сольватами в рамках данного изобретения обозначают такие формы соединений данного изобретения, которые в твердом или в жидком состоянии образуют комплекс в результате координации с молекулами растворителя. Гидраты представляют собой особую форму сольватов, у которых происходит координация с молекулами воды. В качестве сольватов в рамках данного изобретения предпочтительны гидраты. Соединения согласно данному изобретению могут существовать в зависимости от их структуры в виде стереоизомерных форм, то есть в виде конфигурационных изомеров или при необходимости также в виде конформационных изомеров (энантиомеров и/или диастереомеров, включая также атропоизомеры). В связи с этим данное изобретение охватывает также энантиомеры или диастереомеры и любые их смеси. Из таких смесей энантиомеров и/или диастереомеров можно выделить известными методами стереоизомерно одинаковые компоненты; предпочтительно для такого разделения применяют хроматографические способы, в частности ЖХВР (жидкостная хроматография высокого разрешения) - хроматография на ахиральной соответственно хиральной фазе. В том случае, когда соединения согласно данному изобретению встречаются в таутомерной форме,данное изобретение охватывает все таутомерные формы. Данное изобретение охватывает также все подходящие изотопные варианты соединений согласно данному изобретению. Под изотопным вариантом соединения согласно данному изобретению при этом понимают соединение, которое содержит как минимум один атом внутри соединения данного изобретения, который замещен на атом с тем же порядковым номером, однако с другой массой атома, чем обычная или встречающаяся в природе масса атома. К примерам изотопов, которые могут содержаться в соединении согласно данному изобретению, относятся изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора, брома и йода, такие как 2H (дейтерий), 3H (тритий), 13C, 14C, 15N, 17O, 18O, 32P,33P, 33S, 34S, 35S, 36S, 18F, 36Cl, 82Br, 123I, 124I, 129I и 131I. Определенные изотопные варианты соединения согласно данному изобретению, как в частности такие, у которых содержится один или несколько радиоактивных изотопов, могут оказаться, например,полезными при исследовании механизма действия или распределения биологически активного вещества в теле человека; в связи с относительно легким получением и детектированием для этого в особенности подходят соединения, меченные 3H- или 14C-изотопами. Кроме того, встраивание изотопов, например дейтерия, может приводить к определенным терапевтическим преимуществам вследствие большей метаболической стабильности соединения, как например увеличению времени полураспада в теле человека или к уменьшению необходимой действующей дозы; такие модификации соединений согласно данному изобретению могут поэтому также при необходимости представлять собой предпочтительный вариант данного изобретения. Изотопные соединения согласно данному изобретению могут быть получены известными специалистам способами, так например описанными ниже способами или по прописям, приведенным в примерах получения, при которых применяются соответствующие модификации каждого реагента и/или исходного соединения. Кроме того, данное изобретение также охватывает пролекарства соединений согласно данному изобретению. Термин "пролекарство" при этом означает соединения, которые сами по себе могут быть био-2 023631 логически активными или неактивными, однако во время их нахождения в теле человека превращаться в соединения согласно данному изобретению (например, метаболически или гидролитически). В рамках данного изобретения заместители, если особо не оговорено, имеют приведенные ниже значения. Алкил означает в рамках данного изобретения линейный или разветвленный алкильный радикал с 1-4 атомами углерода. В качестве примера и предпочтительно следует назвать метил, этил, н-пропил,изопропил, н-бутил, изо-бутил, 1-метилпропил, трет-бутил. Галоид означает в рамках данного изобретения фтор, хлор, бром и йод. Если радикалы в соединениях данного изобретения замещены, то радикалы, если особо не оговорено, могут быть замещены однократно или многократно. В рамках данного изобретения справедливо, что все радикалы, которые встречаются несколько раз, имеют независимые друг от друга значения. Предпочтительно замещение одним, двумя или тремя одинаковыми или различными заместителями. Предпочтительны в рамках данного изобретения соединения формулы (I), в которой R1 означает водород или метил, причем метил может быть замещен таким заместителем, как трифторметил, а также их соли, сольваты и сольваты солей. Более предпочтительными в рамках данного изобретения являются следующие соединения формулы (I): Приведенные по-отдельности в любых комбинациях, соответственно, предпочтительных комбинациях значения радикалов могут независимо от приведенных комбинаций радикалов быть любым образом заменены значениями радикалов других комбинаций. Более предпочтительны комбинации двух или более приведенных выше предпочтительных значений радикалов. Другим предметом данного изобретения является способ получения соединений данного изобретения формулы (I), отличающийся тем, что соединение формулы (II)[A] в инертном растворителе в присутствии гексабутилолова и подходящего палладиевого катализатора с промежуточным образованием оловосодержащей частицы с соединением формулы (III) затем это соединение в инертном растворителе с помощью подходящего восстановителя восстанавливают в соединение формулы (V) а это соединение затем в присутствии подходящего основания с растворителем или без него с помощью метилового эфира хлормуравьиной кислоты превращают в соединение формулы (I-A)[B] соединение формулы (II) в инертном растворителе с помощью цианида меди превращают в соединение формулы (VI) а затем это соединение в кислых условиях переводят в соединение формулы (VII) затем это соединение в инертном растворителе в присутствии подходящего основания подвергают взаимодействию с соединением формулы (VIII) получая соединение формулы (IX) и в заключение это соединение в инертном растворителе в присутствии подходящего восстановителя восстанавливают в соединение (V), а это соединение в дальнейшем согласно способу [А] подвергают дальнейшему превращению в соединение (I-A), или[C] соединение формулы (I-A) в инертном растворителе в присутствии подходящего основания подвер-4 023631 гают взаимодействию с соединением формулы (X) в которойR1A означает (С 1-С 4)-алкил,причем (С 1-С 4)-алкил может быть замещен одним или двумя заместителями, которые выбирают независимо один от другого из группы, включающей фтор и трифторметил, иX1 означает отщепляемую группу, такую как, например, галоид, предпочтительно бром или йод,трихлорметансульфонат, мезилат или тозилат, с получением соединения формулы (I-B) в которой R1A имеет значения, приведенные выше,при необходимости полученные соединения формулы (I-A) и (I-B) можно перевести с помощью соответствующих (i) растворителей и/или (ii) кислот или оснований в их сольваты, соли и сольваты солей. Инертными растворителями для стадии способа (II)+(III)(IV) являются, например, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол или трет-бутанол, простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир или диэтиленгликольдиметиловый эфир, углеводороды, такие как бензол, ксилол, толуол, гексан, циклогексан или фракции нефтей, или другие растворители, такие как диметилформамид (ДМФ), диметилсульфоксид (ДМСО), N,N'диметилпропиленмочевина (ДМПМ), диметилацетамид, N-метилпирролидон (N МП), пиридин, ацетонитрил, сульфолан или также вода. Также возможно применение смесей указанных растворителей. Более предпочтителен диоксан. В качестве палладиевого катализатора на стадии способа (II)+(III)(IV) подходят, например, палладий на активном угле, палладий(II)-ацетат, тетракис-(трифенилфосфин)-палладий(0), хлорид бис(трифенилфосфин)-палладия(II), хлорид бис-(ацетонитрил)-палладия (II) и комплекс [1,1'бис(дифенилфосфино)-ферроцен]дизлорпалладий(II)дихлорметан, при необходимости в соединении с дополнительными фосфановыми лигандами, такими как, например, (2-бифенил)ди-трет-бутилфосфин,дициклогексил-[2',4',6'-трис(1-метилэтил)бифенил-2-ил]фосфан(XPHOS),бис(2-фенилфосфинофенил)эфир (DPEphos) или 4,5-бис(дифенилфосфино)-9, 9-диметилксантен (ксантфос) [см., например,Hassan J. и др., Chem. Rev. 102, 1359-1469 (2002)]. Предпочтительно применяют тетракис(трифенилфосфин)-палладий(0). Реакцию (II)+(III)(IV) проводят, как правило, при температуре в интервале от +20 до +180C,предпочтительно от +50 до +120C, при необходимости в микроволновой печи. Превращение может проводиться при нормальном, повышенном или пониженном давлении (например, от 0,5 до 5 бар). Как правило, работают при нормальном давлении. Восстановление (IV)(V) и (IX)(V) проводят в присутствии подходящего катализатора в инертном растворителе, в температурном интервале от +20 до +40C при нормальном давлении водорода. Инертными растворителями для восстановления (IV)(V) и (IX)(V) являются, например, спирты,такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол или трет-бутанол, простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир или диэтиленгликольдиметиловый эфир, или другие растворители, такие как диметилформамид (ДМФ), диметилсульфоксид(ДМСО), N,N'-диметилпропиленмочевина (ДМПМ), диметилацетамид, N-метилпирролидон (N МП), пиридин, ацетонитрил, сульфолан или также вода. Также возможно применение смесей указанных растворителей. Более предпочтительны ДМФ и пиридин. Подходящими катализаторами для превращений (IV)(V) и (IX)(V) являются, например, палладий на активном угле, платина на активном угле, гидроксид палладия или никель Ренея. Восстановление (IV)(V) и (IX)(V) можно альтернативно проводить с помощью металла, соответственно соли металла, такого как, например, железо, цинк или хлорид олова (II) в подходящей кислоте, такой как, например, хлористо-водородная, соляная кислота, серная кислота, фосфорная кислота или уксусная кислота при температуре в интервале от +20 до +140C. Инертными растворителями для стадии способа (V)(I-A) являются, например, спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол или трет-бутанол, простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир или диэтиленгликольдиметиловый эфир, галоидуглеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан, трихлорэтилен или хлорбензол, углеводороды, такие как бензол, ксилол, толуол, гексан, циклогексан или фракции нефтей, или другие растворители, такие как диметилформамид (ДМФ), диметилсульфоксид (ДМСО), N,N'-5 023631 диметилпропиленмочевина (ДМПМ), N-метилпирролидон (N МП), ацетонитрил или также вода. Также возможно применение смесей указанных растворителей. Более предпочтительны диметилформамид и толуол, а также смесь, состоящая из диметилформамида и толуола. Подходящими основаниями для проведения стадии способа (V)(I-A) являются гидриды щелочных металлов, такие как гидрид натрия, гидроксиды щелочных металлов, такие как, например, гидроксид лития, натрия или калия, карбонаты щелочных металлов, такие как карбонат лития, натрия, калия или цезия, гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия или калия, алкоголяты щелочных металлов, такие как метанолат натрия или калия, этанолат натрия или калия или трет-бутилат калия, или органические амины, такие как триэтиламин, диизопропилэтиламин, пиридин, 1,8 диазабицикло[5.4.0]ундец-7-ен (ДБУ) или 1,5-диазабицикло[4.3.0]нон-5-ен (ДБН). Более предпочтителен пиридин. Реакцию (V)(I-A) обычно проводят в интервале температур от -10 до +30C, более предпочтительно от 0 до +20C. Превращение можно проводить при нормальном, пониженном или повышенном давлении (например, от 0,5 до 5 бар). Как правило, работают при нормальном давлении. Инертными растворителями для проведения стадии способа (II)(VI) являются, например, простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир или диэтиленгликольдиметиловый эфир, углеводороды, такие как бензол, ксилол, толуол, гексан, циклогексан или фракции нефтей, или другие растворители, такие как диметилформамид (ДМФ), диметилсульфоксид(ДМСО), N,N'-диметилпропиленмочевина (ДМПМ), N-метилпирролидон (N МП), пиридин или ацетонитрил. Также возможно применение смесей указанных растворителей. Более предпочтителен ДМСО. Реакцию (II)(VI) обычно проводят при температуре в интервале от +20 до +180C, более предпочтительно от +100 до +160C, при необходимости в микроволновой печи. Превращение можно проводить при нормальном, пониженном или повышенном давлении (например, от 0,5 до 5 бар). Как правило,работают при нормальном давлении. Превращение (VI)(VII) проводят известными специалистам способами при двухстадийном процессе, причем вначале образуется иминоэфир с метанолатом натрия в метаноле при температуре от 0 до+40C и затем происходит нуклеофильное присоединение эквивалента аммиака, такого как, например,аммиак или хлорид аммония в уксусной кислоте с образованием амидина (VII) при температуре от +50 до +150C. Инертными растворителями для стадии способа (VII)+(VIII)(IX) являются спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол или трет-бутанол, простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир или диэтиленгликольдиметиловый эфир, углеводороды, такие как бензол, ксилол, толуол, гексан, циклогексан или фракции нефтей, или другие растворители, такие как диметилформамид (ДМФ), диметилсульфоксид (ДМСО), N,N'диметилпропиленмочевина (ДМПМ), N-метилпирролидон (N МП), пиридин, ацетонитрил или также вода. Также возможно применение смесей указанных растворителей. Более предпочтителен ДМФ. Подходящими основаниями для стадии способа (VII)+(VIII)(IX) являются гидроксиды щелочных металлов, такие как, например, гидроксид лития, натрия или калия, карбонаты щелочных металлов, такие как карбонат лития, натрия, калия или цезия, гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия или калия, алкоголяты щелочных металлов, такие как метанолат натрия или калия, этанолат натрия или калия или трет-бутилат калия, или органические амины, такие как триэтиламин, диизопропилэтиламин, пиридин, 1,8-диазабицикло[5.4.0]ундец-7-ен (ДБУ) или 1,5-диазабицикло[4.3.0]нон-5-ен(ДБН). Более предпочтителен триэтиламин. Реакцию (VII)+(VIII)(IX) проводят обычно при температуре в интервале от +20 до +150C, более предпочтительно от +80 до +120C, при необходимости в микроволновой печи. Превращение можно проводить при нормальном, пониженном или повышенном давлении (например, от 0,5 до 5 бар). Как правило, работают при нормальном давлении. Соединение формулы (VIII) можно получить аналогично описанному в литературе L.F.Cavalieri,J.F.Tanker, A.Bendich, J. Am. Chem. Soc, 1949, 71, 533. Инертными растворителями для превращения (I-A)(I-B) являются, например, галоидуглеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан, трихлорэтилен или хлорбензол, простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир или диэтиленгликольдиметиловый эфир, или другие растворители, такие как диметилформамид (ДМФ), диметилсульфоксид (ДМСО), N,N'-диметилпропиленмочевина (ДМПМ), N-метилпирролидон (N МП), пиридин,ацетонитрил. Более предпочтителен тетрагидрофуран. Подходящими основаниями для проведения стадии способа (I-A)(I-B) являются гидриды щелочных металлов, такие как гидрид натрия, карбонаты щелочных металлов, такие как карбонат лития, натрия, калия или цезия, гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия или калия,алкоголяты щелочных металлов, такие как метанолат натрия или калия, этанолат натрия или калия или трет-бутилат калия, амиды, такие как амид натрия, бис-(триметилсилил)амид лития, натрия или калия,-6 023631 или диизопропиламид лития, металлоорганические соединения, такие как бутиллитий или фениллитий,или органические амины, такие как триэтиламин, диизопропилэтиламин, пиридин, 1,8 диазабицикло[5.4.0]ундец-7-ен (ДБУ) или 1,5-диазабицикло[4.3.0]-нон-5-ен (ДБН). Более предпочтительны бис-(триметилсилил)амид лития, бис-(триметилсилил)амид натрия и гидрид натрия. Реакцию (I-A)(I-B) обычно проводят при температуре в интервале от -78 до +40C, предпочтительно от 0 до +20C. Превращение можно проводить при нормальном, пониженном или повышенном давлении (например, от 0,5 до 5 бар). Как правило, работают при нормальном давлении. Описанные способы получения можно наглядно представить, например, в виде следующих схем синтеза (схемы 1 - 3): Схема 1[а): Pd(PPh3)4, гексабутилдиолово; b) H2, Pd-C; с) метиловый эфир хлормуравьиной кислоты, пириСхема 2[a) LiHMDS, метилйодид, ТГФ]. Соединение формулы (II) можно получить, если соединение формулы (X) в инертном растворителе подвергнуть циклизации с гидратом гидразина с образованием соединения формулы (XI) а это соединение затем в инертном растворителе в присутствии подходящей кислоты Льюиса при взаимодействии с изопентилнитритом превращают в соответствующую диазониевую соль, а эту соль затем напрямую с помощью йодида натрия превращают в соединение формулы (XII) а это соединение в дальнейшем в инертном растворителе в присутствии подходящего основания подвергают взаимодействию с соединением формулы (XIII) Инертными растворителями для стадии способа (X)(XI) являются спирты, такие как метанол,этанол, н-пропанол, изопропанол, н-бутанол, трет-бутанол или 1,2-этандиол, простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир или диэтиленгликольдиметиловый эфир, углеводороды, такие как бензол, ксилол, толуол, гексан, циклогексан или фракции нефтей, или другие растворители, такие как диметилформамид (ДМФ), диметилсульфоксид (ДМСО), N,N'диметилпропиленмочевина (ДМПМ), N-метилпирролидон (N МП), пиридин, ацетонитрил или также вода. Возможно также применение смесей этих растворителей. Более предпочтителен 1,2-этандиол. Реакцию (X)(XI) проводят обычно при температуре в интервале от +60 до +200C, более предпочтительно от +120 до +180C. Превращение можно проводить при нормальном, пониженном или повышенном давлении (например, от 0,5 до 5 бар). Как правило, работают при нормальном давлении. Инертными растворителями для превращения (XI)(XII) являются, например, галоидуглеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан, трихлорэтилен или хлорбензол, простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир или диэтиленгликольдиметиловый эфир, или другие растворители, такие как диметилформамид (ДМФ), диметилсульфоксид (ДМСО), N,N'-диметилпропиленмочевина (ДМПМ), N-метилпирролидон (N МП), пиридин или ацетонитрил. Более предпочтителен ДМФ. В качестве кислот Льюиса для стадии способа (XI)(XII) подходит комплекс трифторборадиэтилового эфира, церий(IV)аммонийнитрат (ЦАН), хлорид олова (II), перхлорат лития, хлорид цинка(II), хлорид индия(III) или бромид индия (III). Более предпочтителен комплекс трифторборадиэтилового эфира. Реакцию (XI)(XII) проводят обычно при температуре в интервале от -78 до +40C, более предпочтительно от 0 до +20C. Превращение можно проводить при нормальном, пониженном или повышенном давлении (например, от 0,5 до 5 бар). Как правило, работают при нормальном давлении. Инертными растворителями для превращения (XII)+(XIII)(II) являются, например, галоидуглеводороды, такие как дихлорметан, трихлорметан, тетрахлорметан, трихлорэтилен или хлорбензол, простые эфиры, такие как диэтиловый эфир, диоксан, тетрагидрофуран, гликольдиметиловый эфир или диэтиленгликольдиметиловый эфир, или другие растворители, такие как диметилформамид (ДМФ), диметилсульфоксид (ДМСО), N,N'-диметилпропиленмочевина (ДМПМ), N-метилпирролидон (N МП), пиридин,ацетонитрил. Более предпочтителен ДМФ. Подходящими основаниями для стадии способа (XII)+(XIII)(II) являются гидриды щелочных металлов, такие как гидрид натрия, карбонаты щелочных металлов, такие как карбонат лития, натрия, калия или цезия, гидрокарбонаты щелочных металлов, такие как гидрокарбонат натрия или калия, алкоголяты щелочных металлов, такие как метанолат натрия или калия, этанолат натрия или калия или трет-бутилат калия, амиды, такие как амид натрия, бис-(триметилсилил)амид лития, натрия или калия, или диизопропиламид лития, металлоорганические соединения, такие как бутиллитий или фениллитий, или органические амины, такие как триэтиламин, диизопропилэтиламин, пиридин, 1,8-диазабицикло[5.4.0]ундец-7-ен(ДБУ) или 1, 5-диазабицикло[4.3.0]нон-5-ен (ДБН). Более предпочтителен карбонат цезия. Реакцию (XII)+(XIII)(II) проводят обычно при температуре в интервале от 0 до +60C, предпочтительно от +10 до +25C. Превращение можно проводить при нормальном, пониженном или повышенном давлении (например, от 0,5 до 5 бар). Как правило, работают при нормальном давлении. Описанный способ получения можно наглядно представить, например, в виде следующей схемы синтеза (схема 4).[а): гидрат гидразина, 1,2-этандиол; b): изо-пентилнитрит, NaI, ТГФ; b): 2-фторбензилбромид,Cs2CO3, ДМФ;]. Другим предметом данного изобретения является соединение: 5-фтор-1-(2-фторбензил)-3-йод-1Hпиразоло[3,4-b]пиридин Еще одним предметом данного изобретения является соединение: 5-фтор-3-йод-1H-пиразоло[3,4b]пиридин Соединения формулы (III) и (XIII) имеются в продаже, известны из литературы или могут быть получены способами, известными из литературы. Соединения формулы (X) известны из литературы [см., например, Winn M., J. Med. Chem. 1993, 36,2676-7688; EP 634 413-A1; CN 1613849-A; EP 1626045-A1; WO 2009/018415], могут быть получены по аналогии со способами, известными из литературы или согласно приведенной ниже схеме синтеза (схема 5) Схема 5[а): серная кислота; b): цинк, метанол, ледяной уксус; с): ангидрид трифторуксусной кислоты, дихлорметан]. Соединения согласно данному изобретению действуют в качестве стимуляторов растворимой гуанилатциклазы и показывают одинаковый или улучшенный терапевтический профиль по отношению к известным из уровня техники соединениям, например, в отношении их in-vivo свойств, например, их фармакокинетического и фармакодинамического поведения и/или в отношении их действующей дозы,и/или их профиля безопасности. Они пригодны в связи с этим для лечения и/или профилактики заболеваний у людей и животных. Соединения согласно данному изобретению оказывают влияние на релаксацию сосудов и ингибирование агрегации тромбоцитов и приводят к понижению кровяного давления, а также к возрастанию коронарного потока крови. Эти действия передаются через прямое стимулирование растворимой гуанилатциклазы и возрастание внутриклеточного cGMP. Кроме того, соединения согласно данному изобретению усиливают действие веществ, которые повышают уровень cGMP, такие как, например, EDRF (полученный в эндотелии расслабляющий фактор), NO-доноры, протопорфирин IX, арахидоновая кислота или производные фенилгидразина. Соединения согласно данному изобретению подходят для лечения и/или профилактики сердечнососудистых, легочных, тромбоэмболических и фиброзных заболеваний. Соединения согласно данному изобретению могут поэтому применяться в лекарствах для лечения и/или профилактики сердечно-сосудистых заболеваний, таких как, например, высокое кровяное давление, острая и хроническая сердечная недостаточность, коронарное сердечное заболевание, стабильная и не стабильная стенокардия, заболевания периферийных и сердечных сосудов, аритмии, нарушения ритма предсердий и желудочков, а также нарушения пропускания, такие как, например, предсердножелудочковые блокады степени I-III (AB-блок I-III), наджелудочковая тахиаритмия, мерцание предсердий, трепетание предсердий, мерцание желудочков, трепетание желудочков, желудочковая аритмия, трепетательно-мерцательная тахикардия желудочков, экстрасистолы предсердия и желудочка, атриовентри-9 023631 кулярно-соединительные экстрасистолы, сикк-синус синдром, синкопы (обмороки), циркуляция возбуждения тахикардии атриовентрикулярного узла, синдром Вольффа-Паркинсона-Уайта, острый коронарный синдром (ACS), аутоиммунные сердечные заболевания (перикардит, эндокардит, вальвулит, аортит,кардиомиопатии), шок, такой как кардиогенемный шок, септический шок и анафилактический шок, аневризмы, кардиомиопатия боксеров (преждевременное сжатие желудочка (PVC, для лечения и/или профилактики тромбоэболических заболеваний и ишемий, таких как ишемия миокарда, инфаркт миокарда,инсульт, гипертрофия сердца, транзиторные ишемические атаки, преэклампсия, воспалительные сердечно-сосудистые заболевания, спазмы коронарных артерий и периферийных артерий, образование отков,таких как, например, отк легких, отк мозга, отк почек или обусловленный сердечной недостаточностью отк, периферийные нарушения кровообращения, реперфузионные нарушения, артериальные и венозные тромбозы, микроальбуминурия, слабость сердечной мышцы, эндотелиальная дисфункция, для предотвращения рестенозов, таких как после терапий тромболиза, перкутан-транслуминальных ангиопластий (PTA), транслуминальных коронарных ангиопластий (PTCA), трансплантации сердца и операций коронарного шунтирования, а также микро- и макроваскулярные повреждения (васкулитис), повышенный уровень фибриногена и липопротеина низкой плотности (LDL) и повышенная концентрация плазминогенактиватора-ингибитора 1 (PAI-1), а также для лечения и/или профилактики эрективной дисфункции и женской сексуальной дисфункции. По смыслу данного изобретения понятие сердечная недостаточность охватывает также более специфические или родственные формы болезни, такие как острая декомпенсированная сердечная недостаточность, недостаточность правой половины сердца, недостаточность левой половины сердца, глобальная сердечная недостаточность, ишемическая кардиомиопатия, дилатативная кардиомиопатия, гипертрофическая кардиомиопатия, идиопатическая кардиомиопатия, врожденный порок сердца, клапанный порок сердца, сердечная недостаточность при клапанных пороках сердца, стеноз митрального клапана,недостаточность митрального клапана, стеноз клапана аорты, недостаточность клапана аорты, стеноз трехстворчатого клапана, недостаточность трехстворчатого клапана, стеноз клапана легочной артерии,недостаточность клапана легочной артерии, комбинированный порок клапанов сердца, воспаление сердечной мышцы (миокардит), хронический миокардит, острый миокардит, вирусный миокардит, диабетическая сердечная недостаточность, алкогольтоксическя кардиомиопатия, кардиальные болезни накопления, диастолическая сердечная недостаточность, а также систолическая сердечная недостаточность. С учетом вышеизложенного другим объектом данного изобретения является применение соединений согласно данному изобретению для лечения и/или профилактики сердечной недостаточности, стенокардии, гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности,тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза. Дальнейшими объектами данного изобретения являются: применение соединений согласно данному изобретению в способе лечения и/или профилактики сердечной недостаточности, стенокардии, гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза,применение соединений согласно данному изобретению для получения лекарственного средства для лечения и/или профилактики сердечной недостаточности, стенокардии, гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний,фиброзных заболеваний и артериосклероза,лекарственное средство для лечения и/или профилактики сердечной недостаточности, стенокардии,гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза, содержащее соединения согласно изобретению, а также способ лечения и/или профилактики сердечной недостаточности, стенокардии, гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза путем применения эффективного количества как минимум одного соединения согласно данному изобретению или лекарственного средства согласно изобретению. Соединения согласно данному изобретению могут применяться сами по себе или при необходимости в комбинации с другими биологически активными веществами, в качестве которых можно назвать,например: органические нитраты и NO-доноры, такие как, например, нитропруссид натрия, нитроглицерин,мононитрат изосорбида, динитрат изосорбида, молсидомин или SIN-1, а также ингалятивный NO; соединения, которые ингибируют распад циклического гуанозинмонофосфата (cGMP), такие как,например, ингибиторы фосфодиэстераз (PDE) 1, 2 и/или 5, предпочтительно PDE 5-ингибиторы, такие как силденафил, фарденафил и тадалафил; антитромботически действующие средства, например и предпочтительно, из группы ингибиторов агрегации тромбоцитов, антикоагулянтов или профибринолитических веществ; понижающие кровяное давление биологически активные вещества, например и предпочтительно, из- 10023631 группы антагонистов кальция, антагонистов ангиотензин AII, ACE-ингибиторов, антагонистов эндотелина, ингибиторов ренина, блокаторов альфа-рецепторов, блокаторов бета-рецепторов, антагонистов минералокортикоид-рецептора, а также диуретиков; и/или биологически активные вещества, изменяющие обмен жиров, например и предпочтительно, из группы агонистов рецептора щитовидной железы, ингибиторов синтеза холестерина, таких как, например и предпочтительно, ингибиторы HMG-СоА-редуктазы или ингибиторы синтеза сквалена, ACATингибиторы, CEPT-ингибиторы, MTP-ингибиторы, PPAR-альфа-, PPAR-гамма- и/или PPAR-дельтаагонисты, ингибиторы абсорбции холестерина, ингибиторы липазы, полимерные адсорберы желчной кислоты, ингибиторы реабсорбции желчной кислоты и антагонисты липопротеина. Соединения согласно данному изобретению могут действовать системно или локально. Для этой цели их можно применять подходящим образом, например орально, парентерально, пульмонально, насально, сублингвально, лингвально, буккально, ректально, дермально, трансдермально, конъюктивально,отически или в виде имплантанта соответственно стента. При этих путях применения соединения согласно данному изобретению могут приниматься в подходящих для применения формах. Для орального применения подходят функционирующие согласно уровню техники формы для применения, которые легко или модифицировано высвобождают соединения данного изобретения и которые содержат соединения данного изобретения в кристаллической и/или аморфной форме, и/или растворенной форме, такие как, например, таблетки (не покрытые или покрытые таблетки, например, с устойчивыми к желудочному соку покрытиями или с медленно растворяющимися или не растворяющимися покрытиями, которые контролируют высвобождение соединений данного изобретения), таблетки, легко распадающиеся в полости рта, или пленки/облатки, пленки/лиофилизаты, капсулы (например, твердые или мягкие желатиновые капсулы), драже, грануляты, гранулы, порошки, эмульсии, суспензии, аэрозоли или растворы. Парентеральное применение может происходить с избеганием ресорбционной стадии (например,внутривенно, внутриартериально, внутрисердечно, интраспинально или интралумбально) или путем включения ресорбции (например, внутримышечно, субкутан, интракутан, перкутан или интраперитонеал). Для парентерального применения подходят в качестве форм для приема среди других инъекционные и инфузионные препараты в виде растворов, суспензий, эмульсий, лиофилизатов или стерильных порошков. Для других путей применения подходят, например, ингаляционные лекарственные формы (среди других ингаляторы порошков, распылители), капли в нос, растворы в нос или спреи в нос, язычно, подъязычно применяемые таблетки или буккально применяемые таблетки, пленки/облатки или капсулы, суппозитории, препараты для ушей и глаз, вагинальные капсулы, водные суспензии (лосьоны, встряхиваемые микстуры), липофильные суспензии, мази, кремы, трансдермальные терапевтические системы (например, пластырь), молочко, пасты, пены, пудра для посыпания, имплантаты или стенты. Предпочтительными являются оральные или парентеральные применения, более предпочтительны оральные применения. Соединения согласно данному изобретению могут быть переведены в приведенные формы применения. Это можно осуществить известным образом путем смешивания с инертными, не токсичными,фармацевтически пригодными вспомогательными веществами. К этим вспомогательным веществам относятся среди других вещества-носители (например, микрокристаллическая целлюлоза, лактоза, маннитол), растворители (например, жидкие полиэтиленгликоли), эмульгаторы и диспергирующие или смачивающие средства (например, додецилсульфат натрия, полиоксисорбитанолеат), связующие средства (например, поливинилпирролидон), синтетические и природные полимеры (например, альбумин), стабилизаторы (например, антиоксиданты, такие как, например, аскорбиновая кислота), красители (например,неорганические пигменты, такие как, например, оксиды железа) и вещества вызывающие коррекцию вкуса и/или запаха. Как правило, при парентеральном применении оказалось предпочтительным прием количества от около 0,001 до 1 мг/кг, более предпочтительно от около 0,01 до 0,5 мг/кг веса тела для достижения эффективных результатов. При оральном применении дозировка составляет от около 0,01 до 100 мг/кг, более предпочтительно от около 0,01 до 20 мг/кг и еще более предпочтительно от 0,1 до 10 мг/кг веса тела. Однако, при необходимости возможны отклонения от указанных количеств и причем в зависимости от веса тела, пути применения, индивидуального поведения по отношению к биологически активному веществу, вида препарата и времени, соответственно интервала времени, в который происходит применение. Так в некоторых случаях может оказаться достаточным прием меньшего, чем указанное выше минимальное количество, тогда как в других случаях приходится превысить указанную выше верхнюю границу. В случае применения больших количеств можно рекомендовать разделить эту большую дозу на несколько доз поменьше, принимаемых в течение дня. Приведенные ниже примеры получения поясняют изобретение. Изобретение ни в коем случае не ограничивается этими примерами. Все данные приведенные в процентах в приведенных ниже тестах и примерах, если только особо не- 11023631 оговорено, относятся к весовым процентам; доли являются весовыми долями. Соотношения растворителей, соотношения разбавления и приведенные концентрации жидко/жидких растворов опираются в каждом случае на объемы.br s - широкий синглет (при ЯМР) ПХИ - прямая химическая ионизация (при МС) разл. - точка разложения ДМФ - диметилфомамид ДМСО - диметилсульфоксид ДДК - динамическая дифференциальная калориметрия от теор. - от теории (при выходе) экв. - эквивалент(ы) ИЭП - ионизация электронным пучком (при МС)Et - этил обн. - обнаружено ЖХВР - жидкостная хроматография высокого разрешения МСВР - масс-спектрометрия высокого разрешения конц - концентрированный ЖХ-МС - жидкостная хроматография сопряженная с масс-спектрометриейMe - метил мин. - минут МС - масс-спектрометрия ЯМР - спектрометрия ядерного магнитного резонансаPh - фенил ПСМ - поляризационный световой микроскоп УФ - ультрафиолетовая спектрометрияGOLD 1,9 мкм 501 мм; элюент А: 1 л воды+0,5 мл 50%-ной муравьиной кислоты, элюент В: 1 л ацетонитрила+0,5 мл 50%-ной муравьиной кислоты; градиент: 0,0 мин. 90% А 0,1 мин 90% А 1,5 мин 10% А 2,2 мин 10% А; печь: 50C; поток: 0,33 мл/мин; УФ-детектирование: 210 нм. Общие способы. ПСМ. Поляризационную световую микроскопию проводили с помощью поляризационного светового микроскопа Clemex PS3, а измерение размеров системы частиц проводили микроскопом Leica DM с линзами 50 Х, 100 Х, 200 Х и 500 Х, оснащенным высокоразрешающей монохромной с 16001200 пикселей цифровой камерой и с моторизированной станцией X-Y Marzhauser Station (управляемой Clemex ST2000 управляющим блоком). Пробы кристаллического материала измерялись на стеклянном носителе объекта (7626 мм) в капле масла, причем проба была закрыта покровным стеклом (2240 мм). ДДК. Динамическая дифференциальная калориметрия применялась для определения температур плавления. Определение проводили на приборе Mettler-Toledo 823 е DSC, который оснащен роботом для пробы TSO801RO и программным обеспечением STARe Software. Брали пробы около 1,5 до 3 мг и навески помещали в небольшие алюминиевые сковородки, дырчатые крышки запирались. Тепловой поток измеряли в интервале температур от 30 до 400C при скорости нагрева 10C/мин в условиях потока аргона 30 мл/мин. ТГА. Термогравиметрический анализ проводился с помощью прибора Mettler-ToledoTGA/SDTA851e TGA-Gerat, который оснащен роботом для пробы TSO801RO Probenroboter и программным обеспечением STARe Software. Брали пробы около 1,5 до 3 мг и навески помещали в небольшие открытые алюминиевые сковородки (100 мкл). Вес пробы измеряли в интервале температур от 30 до 400C при скорости нагрева 10C/мин в условиях потока аргона 30 мл/мин. Элементный анализ проводили известными специалистам способами согласно промышленной норме DIN-ISO 17025 фирмой Currenta GmbHCo. Исходные соединения и промежуточные соединения. Пример 1 А. 2,6-Дихлор-5-фторникотинамид Суспензию, состоящую из 25 г (130,90 ммоль) 2,6-дихлор-5-фтор-3-цианопиридина в концентрированной серной кислоте (125 мл), перемешивают в течение 1 ч при температуре 60-65C. После охлаждения до комнатной температуры содержимое колбы выливают в ледяную воду и три раза экстрагируют этиловым эфиром уксусной кислоты (по 100 мл). Объединенные органические фазы промывают водой(100 мл) и затем насыщенным водным раствором гидрокарбоната натрия (100 мл), сушат и отгоняют растворитель на ротационном испарителе. Полученный материал сушат при высоком вакууме. Выход: 24,5 г (90% от теор.). 1 К суспензии, состоящей из 21,9 г (335,35 ммоль) цинка в метаноле (207 мл), добавляют при комнатной температуре 44 г (210,58 ммоль) 2,6-дихлор-5-фторникотинамида. После этого добавляют уксусную кислоту (18,5 мл) и перемешивают в течение 24 ч при нагревании в условиях рефлюкса. После этого содержание колбы декантируют от цинка и добавляют этиловый эфир уксусной кислоты (414 мл), а также насыщенный водный раствор гидрокарбоната натрия (414 мл) и интенсивно перемешивают. Затем отсасывают через кизельгур и три раза промывают этиловым эфиром уксусной кислоты (по 517 мл). Отделяют органическую фазу, и водную фазу промывают этиловым эфиром уксусной кислотыг (258 мл). Объединенные органические фазы промывают один раз насыщенным водным раствором гидрокарбоната натрия (414 мл), сушат и отгоняют растворитель в вакууме. К полученным таким путем кристаллам добавляют дихлорметан (388 мл) и перемешивают в течение 20 мин. Снова отсасывают и промывают диэтиловым эфиром и отсасывают до сухости. Выход: 20,2 г (53% от теор.). 1 К суспензии, состоящей из 46,2 г (264,66 ммоль) 2-хлор-5-фторникотинамида в дихлорметане (783 мл), добавляют 81,2 мл (582,25 ммоль) триэтиламина и охлаждают до температуры 0C. Затем при перемешивании добавляют медленно по каплям 41,12 мл (291,13 ммоль) ангидрида трифторуксусной кислоты и перемешивают в течение 1,5 ч при температуре 0C. После этого реакционный раствор промывают два раза насыщенным водным раствором гидрокарбоната натрия (по 391 мл), сушат и в вакууме отгоняют растворитель. Выход: 42,1 г (90% от теор.). 1 Суспензию из 38,5 г (245,93 ммоль) 2-хлор-5-фторникотиннитрила помещают в 1,2-этандиол (380 мл) и после этого добавляют гидрат гидразина (119,6 мл, 2,459 моль). Перемешивают в течение 4 ч при нагревании в условиях рефлюкса. При охлаждении продукт выпадает в осадок. К желтым кристаллам добавляют воду (380 мл) и перемешивают в течение 10 мин при комнатной температуре. Затем суспензию отсасывают через фильтр Фритте, промывают водой (200 мл) и охлажденным до температуры -10C ТГФ (200 мл). Остаток сушат при высоком вакууме над пятиокисью фосфора. Выход: 22,8 г (61% от теор.) 1 В ТГФ (329 мл) помещают 10 г (65,75 ммоль) 5-фтор-1H-пиразоло[3,4-b]пиридин-3-амина и охлаждают до температуры 0C. Затем медленно добавляют 16,65 мл (131,46 ммоль) комплекса трифторборадиэтиловго эфира. Реакционную смесь охлаждают до температуры -10C. Затем медленно по каплям добавляют раствор 10,01 г (85,45 ммоль) изопентилнитрита в ТГФ (24,39 мл) и перемешивают еще 30 мин. Смесь разбавляют охлажденным диэтиловым эфиром (32 9 мл) и отфильтровывают образовавшееся твердое вещество. Полученную таким путем диазониевую соль добавляют по порциям в раствор, охлажденный до температуры 0C, 12,81 г (85,45 ммоль) йодида натрия в ацетоне (329 мл) и смесь перемешивают еще в течение 30 мин при комнатной температуре. Реакционную смесь выливают в ледяную воду(1,8 л) и два раза экстрагируют этиловым эфиром уксусной кислоты (по 487 мл). Объединенные органические фазы промывают насыщенным водным раствором хлористого натрия (244 мл), сушат, фильтруют и отгоняют растворитель. Получают 12,1 г (86%-ной чистоты, 60% от теор.) желательного соединения в виде коричневого твердого вещества. Сырой продукт без дальнейшей очистки подвергают превращению. ЖХ-МС (способ 1): Rt=1,68 мин; МС (ИЭПпол): m/z=264 (М+Н)+. Пример 6 А. 5-Фтор-1-(2-фторбензил)-3-йод-1H-пиразоло[3,4-b]пиридин В ДМФ (2538 мл) помещают 141 г (462,11 ммоль) соединения примера 5 А и затем добавляют 96,09 г (508,32 ммоль) 2-фторбензилбромида, а также 165,62 г (508,32 ммоль) карбоната цезия. Смесь перемешивают в течение 2 ч при комнатной температуре. Затем реакционную смесь выливают в насыщенный водный раствор хлористого натрия (13670 мл) и экстрагируют два раза этиловым эфиром уксусной кислоты (5858 мл). Объединенные органические фазы промывают насыщенным водным раствором хлористого натрия (3905 мл), сушат, фильтруют и отгоняют растворитель. Остаток хроматографируют на силикагеле (растворитель: петролейный эфир/этиловый эфир уксусной кислоты 97:3) и отгоняют растворитель из продуктной фракции. Полученное твердое вещество растворяют в дихлорметане и промывают один раз насыщенным водным раствором тиосульфата натрия (500 мл) и затем насыщенным водным раствором хлористого натрия (500 мл). Отгоняют растворитель до сухости и остаток с диэтиловым эфиром превращают в шлам, отсасывают и сушат при высоком вакууме. Получают 106,6 г (62% от теор.) желательного соединения. 1Chimica Acta (1951), 34, 835-40). После этого добавляют 860 мг (0,744 ммоль) тетракис(трифенилфосфин)-палладия(0) и реакционную смесь нагревают в течение ночи в условиях рефлюкса. Затем охлаждают до комнатной температуры, добавляют воду и два раза экстрагируют этиловым эфиром уксусной кислоты. Объединенные органические фазы сушат над сульфатом натрия, фильтруют и отгоняют растворитель. Остаток перемешивают с этиловым эфиром уксусной кислоты, отфильтровывают твердое вещество и сушат в высоком вакууме. Получают 355 мг (62%-ной чистоты, 24% от теор.) желательного соединения. Сырой продукт без дальнейшей очистки подвергают дальнейшему превращению. ЖХ-МС (способ 2): Rt=1,03 мин. МС (ИЭПпол): m/z=399 (М+Н)+. Пример 8 А. 5-Фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-карбонитрил(пример 6 А) и 4,25 г (47,51 ммоль) цианида меди помещают в ДМСО (120 мл) и перемешивают в течение 2 ч при температуре 150C. После охлаждения до около 40C содержимое колбы выливают в раствор концентрированной аммиачной воды (90 мл) и воды (500 мл), добавляют этиловый эфир уксусной кислоты (200 мл) и кратковременно перемешивают. Водную фазу отделяют и экстрагируют еще два раза этиловым эфиром уксусной кислоты (по 200 мл). Объединенные органические фазы промывают два раза 10%-ным водным раствором хлористого натрия (по 100 мл), сушат и отгоняют растворитель в вакууме. Сырой продукт подвергают превращению без дальнейшей очистки. Выход: 11,1 г (91% от теор.) 1 К 2,22 г (41,07 ммоль) метанолата натрия в метаноле (270 мл) добавляют 11,1 г (41,07 ммоль) 5 фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-карбонитрила (пример 8 А) и перемешивают в течение 2 ч при комнатной температуре. Затем добавляют 2,64 г (49,29 ммоль) хлористого аммония и (9,17 мл) уксусной кислоты и в течение ночи нагревают в условиях рефлюкса. После этого отгоняют растворитель до сухости и остаток помещают в воду (100 мл) и этиловый эфир уксусной кислоты (100 мл) и с помощью 2H натронного щелока устанавливают значение рН 10. Интенсивно перемешивают в течение около 1 ч при комнатной температуре. Полученную суспензию отсасывают и промывают этиловым эфиром уксусной кислоты (100 мл), водой (100 мл) и еще один раз этиловым эфиром уксусной кислоты (100 мл). Остаток сушат над пятиокисью фосфора при высоком вакууме. Выхор: 9,6 г (78% от теор.). МС (ИЭПпол): m/z=288 (М+Н)+. 1 К воде (40 мл) и концентрированной соляной кислоте (7,07 мл) добавляют при перемешивании 3,85 г (41,34 ммоль) анилина и охлаждают до 0C. Затем добавляют по каплям раствор 2,85 г (41,34 ммоль) нитрита натрия в воде (21 мл) при температуре между 0 и 5C и перемешивают в течение 15 мин при температуре 0C. Затем при температуре около 0C медленно по каплям добавляют раствор 4,28 г (52,25 ммоль) ацетата натрия в воде (19 мл), а после этого при хорошем перемешивании добавляют по каплям раствор 2,73 г (41,34 ммоль) динитрила малоновой кислоты в этаноле (10 мл). Через 2 ч при температуре 0C отсасывают образовавшийся осадок и три раза промывают водой (по 50 мл) и петролейным эфиром(50 мл). Сильно влажный остаток растворяют в ДМФ (46 мл) и добавляют по каплям раствор 9,5 г (33,07 ммоль) 5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-карбоксимидамид-ацетата (пример 9 А) в ДМФ (46 мл) и триэтиламине (5,76 мл) при температуре 85C. Затем перемешивают в течение 4 ч при температуре 100C и в течение ночи охлаждают до комнатной температуры. Смесь выливают в воду (480 мл) и перемешивают в течение 1 ч при комнатной температуре. После отсасывания остатка его промывают два раза водой (по 100 мл) и два раза метанолом (по 50 мл) и затем сушат при высоком вакууме. Выход: 9,6 г (59% от теор.). ЖХ-МС (способ 2): Rt=1,21 мин. МС (ИЭПпол): m/z=458 (М+Н)+. Пример 11 А. 2-[5-Фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]-пиримидин-4,5,6-триамин Вариант А. Получение исходя из примера 7 А. В пиридин (30 мл) помещают 378 мг (0,949 ммоль) соединения примера 7 А и затем добавляют 143- 15023631 мг (0,135 ммоль) палладия (10%-ный на угле). Смесь гидрируют в течение ночи при комнатной температуре и при нормальном давлении водорода. Затем суспензию фильтруют через кизельгур, и фильтровальный остаток промывают этанолом. Отгоняют растворитель из фильтрата и получают 233 мг (81%ный, 51% от теор.) желательного соединения, которое подвергают превращению без дальнейшей очистки. Вариант В. Получение исходя из примера 10 А. В ДМФ (800 мл) помещают 39,23 г (85,75 ммоль) соединения примера 10 А, а после этого добавляют 4 г палладия (10%-ного на угле). Смесь гидрируют в течение ночи при перемешивании при комнатной температуре и при нормальном давлении водорода. Реакционную смесь фильтруют через кизельгур и промывают небольшим количеством ДМФ, а затем небольшим количеством метанола и отгоняют растворитель до сухости. К остатку добавляют этиловый эфир уксусной кислоты и сильно перемешивают,осадок отсасывают, промывают этиловым эфиром уксусной кислоты и диизопропиловым эфиром и сушат над сикапентом при высоком вакууме. Выход: 31,7 г (100% от теор.). ЖХ-МС (способ 2): Rt=0,7 8 мин. МС (ИЭПпол): m/z=369 (М+Н)+. Примеры получения. Пример 1. Метил-4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илкарбамат В пиридин (600 мл) помещают 31,75 г (86,20 ммоль) соединения примера 11 А в атмосфере аргона и охлаждают до температуры 0C. Затем добавляют по каплям раствор 6,66 мл (86,20 ммоль) метилового эфира хлормуравьиной кислоты в дихлорметане (10 мл), и смесь перемешивают в течение 1 ч при температуре 0C. После этого реакционную смесь нагревают до комнатной температуры, отгоняют растворитель в вакууме и многократно перегоняют вместе с толуолом. Остаток перемешивают с водой/этанолом и затем отсасывают через фильтр Фритте и промывают этанолом и этиловым эфиром уксусной кислоты. После этого остаток перемешивают с диэтиловым эфиром, отсасывают и сушат при высоком вакууме. Выход: 24,24 г (65% от теор.). ЖХ-МС (способ 2): Rt=0,79 мин. МС (ИЭПпол): m/z=427 (М+Н)+. 1 3,470 г (8,138 ммоль) соединения примера 1 суспендируют в 35 мл ТГФ, при температуре 0C добавляют 358 мг (8,952 ммоль) гидрида натрия (60%-ная суспензия в минеральном масле) и перемешивают в течение 90 мин при температуре 0C, при этом образуется раствор. Добавляют 2,519 г (8,952 ммоль) 2,2,2-трифторэтилтрихлорметансульфоната и смесь перемешивают в течение 48 ч при комнатной температуре. После этого перемешивают с водой и на ротационном испарителе отгоняют растворитель. Остаток помещают в этиловый эфир уксусной кислоты, органическую фазу промывают два раза водой и сушат над сульфатом натрия. Получают 5,005 г целевого соединения (79% от теор., чистота согласно ЖХВР 65%). 250 мг остатка чистят с помощью препаративной ЖХВР (элюент:метанол/вода, градиент 30:7090:10). ЖХ-МС (способ 2): Rt=0,97 мин; МС (ИЭУпол): m/z=509 [М+Н]+. 1 Раствор 100 мг (0,235 ммоль) примера 1 в 2 мл 1,4-диоксана приготавливают в коричневой 5 мл стеклянной бутылочке. К этому раствору добавляют последовательно 2 мл изопропанола и 235 мкл(0,235 ммоль) 1 М соляной кислоты, и раствор перемешивают при комнатной температуре до тех пор,пока не испарятся растворители. После сушки на воздухе выделяют 102 мг (94% от теор.) титульного соединения. ПСМ (100x): кристаллическое. ДДК: 224C (разл., H=189 Дж/г). ТГА: 1% потери веса при 80C. ЖХ-МС (способ 3): Rt=0,91 мин. МС (ИЭПпол): m/z=427 (М+Н)+. 1H-ЯМР (400 МГц, ДМСО-d6):[млн.долей]=3,35 и 3,65 (2s, 3H), 5,92 (s, 2H), 7,15 (dd, 1H), 7,25 (m,2H), 7,37 (m, 1H), 7,75 (br s, 4H), 8,08-8,39 (2 s, 1H), 8,82 (m, 2H), 13,2 (br s, 1H). Элементный анализ для C19H16F2N8O2+HCl: рассчитанное: С 49,31%; Н 3,70%; N 24,21%; измеренное: С 49,5%; Н 3,7%; N 24,3%. Пример 5. Сульфат метил-4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3 ил]пиримидин-5-илкарбамата Раствор 100 мг (0,235 ммоль) примера 1 в 2 мл 1,4-диоксана приготавливают в коричневой 5 мл стеклянной бутылочке. К этому раствору добавляют последовательно 2 мл изопропанола и раствор 938 мкл (0,235 ммоль) 0,25 М серной кислоты, и раствор перемешивают при комнатной температуре до тех пор, пока не испарятся растворители. После сушки на воздухе выделяют 103 мг (83,7% от теор.) титульного соединения. ПСМ (100x): кристаллическое. ДДК: 242C (разл., H=115 Дж/г). ТГА: нет потери веса до точки разложения. ЖХ-МС (способ 3): Rt=0,91 мин. МС (ИЭПпол):H-ЯМР (400 МГц, ДМСО-d6):[млн.долей]=3,56-3,66 (2 s, 3H), 5,93 (s, 2H), 7,16 (m, 2H), 7,25 (dd,1H), 7,38 (m, 1H), 7,59 (br s, 4H), 8,03 и 8,32 (2 s, 1H), 8,82 (m, 2H), 13,0 (br s, 1H). Элементный анализ для C19H16F2N8O2 + H2SO4: рассчитанное: С 43,51%; Н 3,46%; N 21,37%; измеренное: С 43,6%; Н 3,4%; N 21,2%. Пример 6. Фосфат метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3 ил]пиримидин-5-илкарбамата Раствор 100 мг (0,235 ммоль) примера 1 в 2 мл 1,4-диоксана приготавливают в коричневой 5 мл стеклянной бутылочке. К этому раствору добавляют последовательно 2 мл ТГФ и раствор 16 мкл (0,235 ммоль) 85%-ной фосфорной кислоты в 0,3 мл воды, и раствор перемешивают при комнатной температуре до тех пор, пока не испарятся растворители. После сушки на воздухе выделяют 105 мг (85,4% от теор.) титульного соединения. ПСМ (100x): кристаллическое. ДДК: 183C (разл., H=65 Дж/г). ТГА: 6% потери веса перед точкой разложения. ЖХ-МС (способ 3): Rt=0,91 мин. МС (ИЭПпол): m/z=427 (М+Н)+. 1H-ЯМР (400 МГц, ДМСО-d6):[млн.долей]=3,57 и 3,62 (2 s, сигнал воды перекрывает сигнал ме- 17023631 тила, 3H), 5,79 (s, 2H), 6,22 (br s, 4H), 7,15 (m, 2H), 7,22 (dd, 1H), 7,36 (m, 1H), 7,67 и 7,99 (2 s, 1H), 8,66 Раствор 100 мг (0,235 ммоль) примера 1 в 2 мл 1,4-диоксана приготавливают в коричневой 5 мл стеклянной бутылочке. К этому раствору добавляют последовательно 2 мл этанола и раствор 22,5 мг(0,235 ммоль) метансульфоновой кислоты в 0,3 мл воды, и раствор перемешивают при комнатной температуре до тех пор, пока не испарятся растворители. После сушки на воздухе выделяют 103 мг (84% от теор.) титульного соединения. ПСМ (100x): кристаллическое. ДДК: 154C (ДН=11,7 Дж/г), 167C (ДН=-5 Дж/г), 215,2C (разл., ДН=56,1 Дж/г). ТГА: градуальная потеря веса во время измерения. ЖХ-МС (метод 3): Rt=0,91 мин. МС (ИЭПпол):H-ЯМР (400 МГц, ДМСО-d6):[млн.долей]=2,31 (s, 3H), 3,57 и 3,66 (2 s, 3H), 5,93 (s, 2H), 7,17 (m,2H), 7,25 (dd, 1H), 7,39 (m, 1H), 7,66 (s br, 4H), 8,06 и 8,34 (2 s, 1H), 8,81 (dd, 1H), 8,83 (s, 1H), 13,0 (br s,1H). Элементный анализ для C19H16F2N8O2+CH4O3S+Н 2 О: рассчитанное: С 44,44%; Н 4,10%; N 20,7%; измеренное: С 44,3%; Н 4,1%; N 20,2%. Пример 8. Этан-1,2-дисульфонатметил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4b]пиридин-3-ил]пиримидин-5-илкарбамата Раствор 100 мг (0,235 ммоль) примера 1 в 2 мл 1,4-диоксана приготавливают в коричневой 5 мл стеклянной бутылочке. К этому раствору добавляют последовательно 2 мл изопропанола и 44,6 мг (0,235 ммоль) этан-1,2-дисульфоновой кислоты, и раствор перемешивают при комнатной температуре до тех пор, пока не испарятся растворители. После сушки на воздухе выделяют 111 мг (73,7% от теор.) титульного соединения. ПСМ (100x): преобладает кристаллическое. ДДК: 97C (разл., H=103 Дж/г). ТГА: градуальная потеря веса во время измерения. ЖХ-МС (способ 3): Rt=0,90 мин. МС (ИЭПпол): m/z=427 (М+Н)+. 1H-ЯМР (400 МГц, ДМСО-d6):[млн. долей]=2,66 (s, 4H), 3,57 и 3,66 (2 s, сигнал воды перекрывает сигнал метила, 3H), 5,93 (s, 2H), 7,17 (m, 2H), 7,25 (m, 1H), 7,39 (m, 1H), 8,05 и 8,35 (2 s, 1H), 8,80 (dd,1H), 8,84 (s, 1H). Элементный анализ для C19H16F2N8O2+C2H6O6S2+0,25 Н 2 О+0,25 С 4 Н 8 О 2: рассчитанное: С 41,09%; Н 3,84%; N 17,42%; измеренное: С 41,2%; Н 4,2%; N 17,6%. Пример 9. Малеат метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3 ил]пиримидин-5-илкарбамата Раствор 100 мг (0,235 ммоль) примера 1 в 2 мл 1,4-диоксана приготавливают в коричневой 5 мл стеклянной бутылочке. К этому раствору добавляют последовательно 2 мл изопропанола и 27,2 мг (0,235 ммоль) малеиновой кислоты, и раствор перемешивают при комнатной температуре до тех пор, пока не испарятся растворители. После сушки на воздухе выделяют 108 мг (84,9% от теор.) титульного соединения. ПСМ (100x): кристаллическое. ДДК: 192C (разл., H=173 Дж/г) ТГА: 3% потери веса перед точкой разложения.H-ЯМР (400 МГц, ДМСО-d6):[млн.долей]=3,56 и 3,64 (2 s, перекрывание сигналом от диоксана,3H), 5,85 (s, 2H), 6,16 (s, 2H), 6,9 (br s, 4H), 7,15 (m, 2H), 7,23 (dd, 1H), 7,37 (m, 1H), 7,85 и 8,13 (2 s, 1H),8,73 (s, 1H), 8,86 (dd, 1H). Элементный анализ для C19H16F2N8O2+С 4 Н 4 О 4+0,5 Н 2 О+0,5 С 4 Н 8 О 2: рассчитанное: С 50,42%; Н 4,23%; N 18,82%; измеренное: С 50,7%; Н 3,9%; N 18,8%. Пример 10. Нитрат метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3 ил]пиримидин-5-илкарбамата Раствор 100 мг (0,235 ммоль) примера 1 в 2 мл 1,4-диоксана приготавливают в коричневой 5 мл стеклянной бутылочке. К этому раствору добавляют последовательно 2 мл изопропанола и 0,235 мкл(0,235 ммоль) 1 М азотной кислоты, и раствор перемешивают при комнатной температуре до тех пор,пока не испарятся растворители. После сушки на воздухе выделяют 103 мг (89,7% от теор.) титульного соединения. ПСМ (100x): кристаллическое. ДДК: 175C (разл, H=-224 Дж/г). ТГА: 3% потери веса перед точкой разложения. ЖХ-МС (способ 3): Rt=0,91 мин. МС (ИЭПпол): m/z=427 (М+Н)+. 1H-ЯМР (400 МГц, ДМСО-d6):[млн.долей]=3,57 и 3,66 (2s, 3H), 5,93 (s, 2H), 7,16 (m, 2H), 7,25 (dd,1H), 7,38 (m, 1H), 7,65 (br s, 4H), 8,02 и 8,32 (2 s, 1H), 8,80 (dd, 1H), 8,83 (s, 1H), 13,0 (br s, 1H). Элементный анализ для C19H16F2N8O2+HNO3+0,75 Н 2 О: рассчитанное: С 45,38%; Н 3,71%; N 25,07%; измеренное: С 45,4%; Н 3,7%; N 25,0%.B. Оценка фармакологической эффективности. Фармакологическое действие соединений согласно данному изобретению показано в следующих опытах.B-1. Релаксирующее сосуды действие in vitro. Кроликов оглушают ударом по затылку и выпускают кровь. Извлекают аорту, освобождают от присоединенных тканей, разделяют на кольца шириной 1,5 мм и по отдельности при предварительном натяжении помещают в 5 мл бани для органов в нагретый до температуры 37C обдуваемый карбогенным газом раствор Кребса-Хензелайта следующего состава (каждый мМ): хлористый натрий 119; хлористый калий 4,8; дигидрат хлористого кальция 1; гептагидрат сульфата магния 1,4; дигидрофосфат калия 1,2; гидрокарбонат натрия 25; глюкоза 10. Силу сжатия определяют с помощью Statham UC2-ячеек, усиливают и через A/D-преобразователь (DAS-1802 HC, фирмы Keithley Instruments, Мюнхен) переводят в цифровую форму, а также параллельно записывают линию на самописце. Для создания сжатия к бане добавляют фенилэфрин кумулятивно с возрастающей концентрацией. После нескольких контрольных циклов подлежащее исследованию вещество при каждом следующем проходе добавляют каждый раз с возрастающей дозировкой, и степень сжатия сравнивают со степенью сжатия, достигнутой при предыдущем проходе. В результате этого рассчитывается концентрация, которая необходима, для того чтобы- 19023631 степень контрольного значения уменьшить на 50% (IC50-значение). Стандартный применяемый объем составляет 5 мкл, доля ДМСО в растворе бани соответствует 0,1%. Репрезентативные IC50-значения для соединений согласно данному изобретению приведены в табл. 1. Таблица 1B-2. Действие на рекомбинантную репортерную клеточную линию гуанилатциклазы. Клеточное действие соединений согласно данному изобретению определяют на рекомбинантной клеточной линии гуанилатциклазы, как описано в статье F. Wunder и др., Anal. Biochem. 339, 104-112(2005). Репрезентативные значения (MEC=минимальная эффективная концентрация) для соединений согласно данному изобретению приведены в табл. 2. Таблица 2B-3. Радиотелеметрические измерения кровяного давления на живых спонтанно гипертензивных крысах. Для описанных ниже измерений кровяного давления на живых крысах применяют имеющуюся в продаже телеметрическую систему фирмы DATA SCIENCES INTERNATIONAL DSI, США. Система состоит из 3 главных компонентов: имплантированные передатчики (Physiotel телеметрический передатчик),принимающие устройства (Physiotel приемник), которые через мултиплекс (DSI Data ExchangeMatrix) соединены с компьютером для сбора и обработки данных. Телеметрическая установка создает возможность для непрерывного охвата кровяного давления, частоты сокращений сердца и движений тела у живых животных в их обычном жилом пространстве. Животный материал. Исследования проводят на взрослых женских особях спонтанно гипертензивных крыс (SHR Okamoto) с весом тела более 200 г. SHR/NCrl из Окамото Киото медицинской школы (Okamoto Kyoto Schoolof Medicine), 1963 были получены скрещиванием мужских особей крыс Вистара Киото с сильно повышенным кровяным давлением и женских особей со слегка повышенным кровяным давлением и на стадииF13 переданных в Национальный институт по здоровью США (U.S. National Institutes of Health). Испытуемых животных после имплантации им радиопередатчиков помещают по одному в макролон-клетки типа 3 и содержат там. Они имеют свободный доступ к стандартному корму и воде. Ритм день-ночь в испытательной лаборатории регулируется путем включения освещения в 6:00 ч утром и выключения в 19:00 ч вечера. Имплантация радиопередатчиков. Применяемые телеметрические передатчики TA11 PA-C40 имплантируют при асептических условиях испытываемым животным как минимум за 14 дней перед первым применением в опытах. Инструментированные таким образом животные можно после заживления раны и врастания имплантата повторно использовать. Для имплантации животных натощак подвергают наркозу пентобабиталом (нембутал, Санофи: 50 мг/кг веса тела) и на стороне живота бреют на большой площади и дезинфицируют. После вскрытия живота вдоль Linea alba вставляют наполненный жидкостью измерительный катетер системы выше бифуркации в сторону черепа в аорту Aorta descendens и закрепляют с помощью клея для тканей (VetBonD TM, 3 М). Корпус радиопередатчика фиксируют интраперитонеально на мускулатуре стенки живота и рану зашивают слоями. Постоперационно для профилактики инфекции дают для приема антибиотик (Tardomyocel COMPBayer 1 мл/кг в.т.) Вещества и растворы. Если особо не описано, подлежащие испытанию вещества вводят в каждом случае группе животных (n=6) орально через желудочный зонд. В соответствии с принимаемым объемом в 5 мл/кг веса тела тестируемые соединения растворяют в подходящих смесях растворителей или суспендируют в 0,5%-ном тилосе.- 20023631 Группа животных, которой вводили растворители, используется в качестве контрольной группы. Ход опыта. Наличная телеметрия - измерительное устройство конфигурированы на 24 животных. Каждый опыт регистрируется под номером опыта (V год месяц день). Живущим в установке инструментированным животным каждому предназначена собственная приемная антенна (1010 Receiver, DSI). Имплантированные датчики можно активировать встроенным магнитным включателем. Они при проведении опыта включаются на режим передачи. Излученные сигналы могут через систему сбора данных (Dataquest TM A.R.T. для WINDOWS, DSI) охвачены онлайн и соответствующим образом обработаны. Сбор данных происходит в каждом случае в открытой для этого папке, на которой стоит номер опыта. При стандартном протекании опыта через каждые 10 с измеряют: систолическое кровяное давление (SBP),диастолическое кровяное давление (DBP),среднее артериальное давление (MAP),частоту сокращений сердца (HR),активность (ACT). Охват измеряемых величин под управлением компьютера повторяют с 5-минутными интервалами. Данные источника, приведенные как абсолютные значения, исправляются в диаграмме с помощью действительно измеренного на барометре давления (монитор для сравнения с комнатным давлением; APR-1) и откладываются в памяти в виде отдельных данных. Другие технические детали можно получить из исчерпывающей документации фирмы изготовителя (DSI). Если по другому не описано, прием испытываемых веществ происходит в день проведения опыта в 9.00 ч. После приема измеряют описанные выше параметры в течение 24 ч. Обработка результатов. После окончания опыта полученные отдельные данные сортируются аналитическим программным обеспечением (DATAQUEST TM A. R.T. ТМ ANALYSIS). В качестве нулевого (фонового) значения здесь принимают 2 ч перед применением, так что выбранный комплект данных охватывает промежуток времени от 7:00 ч в день испытаний вплоть до 9:00 ч следующего дня. Данные усредняются по заранее заданному промежутку времени и сглаживаются по среднему значению (15 мин в среднем) и в виде текстовых данных переносятся на носитель данных. Измеренные данные, предварительно отсортированные и сжатые таким образом, переносятся в Excel-сборники и представляются в виде таблиц. Сохранение полученных за 1 день опытов данных проводят в собственной папке, на которой ставится номер опыта. Результаты и протоколы опытов сортируют в бумажной форме согласно номерам и раскладывают по папкам. Репрезентативные значения для соединений согласно данному изобретению приведены ниже в табл. 3.B-4. Определение фармакокиниетических характеристик после внутривенного введения и орального введения. Фармакокинетические параметры вещества определяли у мужских особей CD-1-мышей, мужских особей крыс Вистера и женских особей собак Беагла. Применяемый объем составляет у мышей 10 мл/кг,у крыс 5 мл/кг и у собак 0,5 мл/кг. Внутривенное введение происходит у мышей и крыс с помощью специфического для видов препарата плазма/ДМСО (99/1) и у собак с помощью воды/PEG400/этанола(50/40/10). Крысам для облегчения забора крови перед дачей вещества вводят силиконовый катетер в правую вену Vena jugularis externa. Операцию проводят за один день до опыта под наркозом изофлурана и при даче анальгетика (атропин/римадил (3/1) 0,1 мл субкутан). Дача вещества проводят у мышей с помощью внутривенных пилюль, у крыс с помощью внутривенных пилюль или 15-минутной инфузии и у собак с помощью 15-минутной инфузии. Забор крови у мышей происходит через 0,033, 0,083, 0,17, 0,5, 1,2, 3, 4, 6, 7 и 24 ч, а также у собак и крыс при 15-минутной инфузии через 0,083, 0,25, 0,28, 0,33, 0,42,0,75, 1, 2, 3, 4, 6, 7 и 24 ч, а также у крыс после внутривенной дачи пилюли после 0,033, 0,083, 0,17, 0,5, 1,2, 3, 4, 6, 7 и 24 ч. Оральную дачу растворенного вещества с помощью желудочного зонда у всех видов проводится с препаратом, базирующимся на воде/PEG400/этаноле (50/40/10). Отбор крови у крыс и собак в этом случае проводят через 0,083, 0,17, 0,5, 0,75, 1, 2, 3, 4, 6, 7 и 24 ч. Кровь при отборе направляется в гепаринизированные трубочки. После этого получают при центрифугировании плазму крови и при необходимости хранят до дальнейшей переработки при температуре -20C. К неизвестным пробам, калибровочным пробам и образцам контроля качества добавляют внутренний стандарт (ZK 228859) и следует осаждение белка с помощью избытка ацетонитрила. После добавления аммонийацетатного буфера (0,01 М, pH 6,8 (пример 1/3) или pH 3,0 (пример 2 и последующего встряхивания центрифугируют при 1000 g и надстоящую жидкость анализируют с помощью ЖХ-МС/МС(прибор API 4000, АВ Sciex). Хроматографическое разделение проводят на жидкостном хроматографе- 22023631 высокого разрешения 1100-HPLC фирмы Agilent. Инъекцируемый объем составляет 10 мкл. В качестве разделительной колонки применяют нагретую до температуры 40C колонку Luna 5 мкм C8(2) 100 А 502 мм фирмы Phenomenex. Применяется бинарный градиент растворителей при потоке 400 мкл/мин для примера 1 (А: 0,01 М аммонийацетатный буфер pH 6,8, В: 0,1%-ная муравьиная кислота в ацетонитриле): 0 мин (90% А), 1 мин (90% А), 3,5 мин (15% А), 4,5 мин (15% А), 4,6 мин (90% А), 7 мин (90% А). В отличие от этого в примере 2 используют бинарный градиент растворителей при потоке 500 мкл/мин(90% А), 1,5 мин (90% А), 3,5 мин (10% А), 4,5 мин (10% А), 5 мин (90% А), 7 мин (90% А). В отличие от этого в примере 3 используют следующий бинарный градиент растворителей при потоке 500 мкл/мин (А: 0,01 М аммонийацетатного буфера pH 6,8, В: 0,1%-ная муравьиная кислота в ацетонитриле): 0 мин (90% А), 1 мин (90% А), 3 мин (10% А), 4 мин (10% А), 4,5 мин (90% А), 6 мин (90% А). Температура ионного источника Turbo V составляет 500C. Применяются следующие параметры МС-прибора: сталкивающийся газ составляет 20 единиц (пример 1), 16 единиц (пример 2), соответственно 15 единиц (пример 3), ускоряющее напряжение ионного пучка составляет 5 кВ (пример 1/2) или 4,5 единиц (пример 3), газ 135 единиц (пример 1/3), соответствнно 25 единиц (пример 2), газ 230 единиц, CAD газ 4 единицы (пример 1/3) или 3 единицы (пример 2). Количественное определение веществ происходит на основе высоты пиков или площадей под пиком из экстрагированных (выбранных) хроматограмм ионов специфическихMRM-экспериментов. Исходя из установленной зависимости концентрации плазмы от времени определяют фармакокинетические характеристики, такие как AUC (площадь под кривой пика), Cmax, MRT (среднее время удерживания), t1/2 (время полураспада) и CL (клиренс) с помощью проверенной фармакокинетической математической программы обработки данных KinEx (Vers. 2.5 и 3). В связи с тем, что проводится количественное определение вещества в плазме, должно быть проведено определение распределения вещества в крови/плазме, для того чтобы соответственно подогнать фармакокинетические параметры. Для этого определенное количество вещества инкубируют в гепаринизированной нормальной крови соответствующего вида в колебательной роликовой мешалке в течение 20 мин. После центрифугирования при 1000 g измеряют концентрацию плазмы (смотри выше) и через образование делителя определяют cb/cp-значение. После внутривенной дачи 0,3 мг/кг соединений согласно данному изобретению крысам были получены следующие значения:B-5. Профиль надежности. Соединения согласно данному изобретению показывают неожиданно благоприятный профиль надежности in vivo, который был получен не клиническими испытаниями надежности согласно OECD(OECD инструкции для тестирования химикатов,407) и ICH (3BS2A) директив.C. Примеры приготовления фармацевтических препаратов. Соединения согласно данному изобретению можно следующим образом перевести в фармацевтические препараты. Таблетка. Состав: 100 мг соединения согласно данному изобретению, 50 мг лактозы (моногидрат), 50 мг кукурузного крахмала (нативный), 10 мг поливинилпирролидона (PVP 25) (фирмы BASF, Ludwigshafen,Германия) и 2 мг стеарата магния. Вес таблетки 212 мг. Диаметр 8 мм, радиус закругления 12 мм. Изготовление. Смесь, состоящую из соединения согласно данному изобретению, лактозы и крахмала, гранулируют с 5%-ным раствором (м/м) PVP в воде. Гранулят после высыхания перемешивают со стеаратом магния в течение 5 мин. Эту смесь прессуют обычным таблеточным прессом (формат таблетки приведен выше). Необходимое значение для прессования составляет силу прессования 15 кН. Орально принимаемая суспензия. Состав: 1000 мг соединения согласно данному изобретению, 1000 мг этанола (96%), 400 мг родителя (ксантановая смола фирмы FMC, Pennsylvania, США) и 99 г воды. Единичной дозе в 100 мг соединения согласно данному изобретению соответствует 10 мл оральной- 23023631 суспензии. Приготовление. Родигель суспендируют в этаноле, к суспензии добавляют соединение согласно данному изобретению. При перемешивании добавляют воду. Перемешивание продолжают до завершения набухания родигеля примерно 6 ч. Орально принимаемый раствор. Состав: 500 мг соединения согласно данному изобретению, 2,5 г полисорбата и 97 г полиэтиленгликоля 400. Единичной дозе в 100 мг соединения согласно данному изобретению соответствует 20 г орального раствора. Приготовление. Соединение согласно данному изобретению суспендируют при перемешивании в смеси полиэтиленгликоля и полисорбата. Процесс перемешивания продолжают до полного растворения соединения согласно данному изобретению. Внутривенный раствор. Соединение согласно данному изобретению растворяют при концентрации ниже насыщенного раствора в физиологически переносимом растворителе (например, изотонический раствор поваренной соли,5%-ный раствор глюкозы и/или 30%-ный раствор PEG 400). Раствор стерильно фильтруют и заполняют в стерильные и свободные от пирогенов инъекционные емкости. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) в которой R1 означает водород или (C1-C4)-алкил, незамещенный или замещенный одним или двумя заместителями, независимо один от другого выбираемыми из группы, которая включает фтор и трифторметил, а также их соли, сольваты и сольваты солей. 2. Соединение формулы (I) по п.1, в которой R1 означает водород или метил, причем метил может быть замещен таким заместителем, как трифторметил, а также их соли, сольваты и сольваты солей. 3. Соединение формулы (I) по п.1 или 2, выбираемое из группы: метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5 илкарбамат,метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5 илметилкарбамат,метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5 ил(2,2,2-трифторэтил)карбамат,гидрохлорид метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илкарбамата,сульфат метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илкарбамата,фосфат метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илкарбамата,мезилат метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илкарбамата,этан-1,2-дисульфонат метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1 Н-пиразоло[3,4-b]пиридин 3-ил]пиримидин-5-илкарбамата,малеат метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илкарбамата,нитрат метил 4,6-диамино-2-[5-фтор-1-(2-фторбензил)-1H-пиразоло[3,4-b]пиридин-3-ил]пиримидин-5-илкарбамата. 4. Соединение формулы (I-A) 5. Способ получения соединения формулы (I-A) по п.4, отличающийся тем, что соединение формулы (II) в инертном растворителе в присутствии гексабутилолова и подходящего палладиевого катализатора с промежуточным образованием оловосодержащей частицы с соединением формулы (III) затем это соединение в инертном растворителе с помощью подходящего восстановителя восстанавливают в соединение формулы (V) а это соединение затем в присутствии подходящего основания с растворителем или без него с помощью метилового эфира хлормуравьиной кислоты превращают в соединение формулы (I-А) 6. Способ по п.5, отличающийся тем, что полученное соединение формулы (I-А) с соответствующими (i) растворителями, и/или (ii) кислотами, и/или основаниями переводят в его сольваты, соли и/или сольваты солей. 7. Способ получения соединения формулы (I-A) по п.4, отличающийся тем, что соединение формулы (II) в инертном растворителе с помощью цианида меди превращают в соединение формулы (VI)- 25023631 а затем это соединение в кислых условиях переводят в соединение формулы (VII) затем это соединение в инертном растворителе в присутствии подходящего основания подвергают взаимодействию с соединением формулы (VIII) с образованием соединения формулы (IX) и в заключение это соединение в инертном растворителе в присутствии подходящего восстановителя восстанавливают в соединение (V) а это соединение в дальнейшем в присутствии подходящего основания с растворителем или без него подвергают взаимодействию с метиловым эфиром хлормалеиновой кислоты с получением соединения формулы (I-A) 8. Способ по п.7, отличающийся тем, что полученное соединение формулы (I-A) с соответствующими (i) растворителями, и/или (ii) кислотами, и/или основаниями переводят в его сольваты, соли и/или сольваты солей. 9. Способ получения соединений формулы (I) по пп. 1-3, в которой R1 означает (C1-C4)-алкил, который может быть замещен одним или двумя заместителями, независимо один от другого выбираемыми из группы, которая включает фтор и трифторметил, отличающийся тем, что соединение формулы (I-A) в инертном растворителе в присутствии подходящего основания подвергают взаимодействию с соединением формулы (X) в которой R1A означает (C1-C4)-алкил, незамещенный или замещенный одним или двумя заместителями, которые выбирают независимо один от другого из группы, включающей фтор и трифторметил, иX1 означает отщепляемую группу,с получением соединения формулы (I-B) в которой R1A имеет значения, приведенные выше. 10. Способ по п.9, отличающийся тем, что полученное соединение формулы (I-B) с соответствующими (i) растворителями и/или (ii) кислотами, и/или основаниями переводят в его сольваты, соли и/или сольваты солей. 11. Способ по п.9, в котором X1 означает галоид. 12. Способ по п.9, в котором X1 означает бром или йод. 13. Способ по п.9, в котором X1 означает трихлорметансульфонат, мезилат или тозилат. 14. Применение соединения формулы (I) по одному из пп.1-3 или соединения формулы (I-A) по п.4 в способе лечения и/или профилактики сердечной недостаточности, стенокардии, гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза. 15. Применение соединения формулы (I) по одному из пп.1-3 или соединения формулы (I-A) по п.4 для получения лекарства для лечения и/или профилактики сердечной недостаточности, стенокардии, гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза. 16. Лекарственное средство, содержащее соединение формулы (I) по одному из пп.1-3 или соединение формулы (I-A) по п.4, для лечения и/или профилактики сердечной недостаточности, стенокардии,гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза. 17. Способ лечения и/или профилактики сердечной недостаточности, стенокардии, гипертонии, легочной гипертонии, ишемий, заболеваний сосудов, почечной недостаточности, тромбоэмболических заболеваний, фиброзных заболеваний и артериосклероза у людей и животных путем применения эффективного количества как минимум одного соединения формулы (I) по одному из пп.1-3, или соединения формулы (I-A) по п.4, или лекарственного средства по п.16.
МПК / Метки
МПК: C07D 471/04, A61K 31/437, A61P 9/00, A61P 15/00
Метки: 5-фтор-1н-пиразолопиридины, замещенные, применение
Код ссылки
<a href="https://eas.patents.su/28-23631-zameshhennye-5-ftor-1n-pirazolopiridiny-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные 5-фтор-1н-пиразолопиридины и их применение</a>
Предыдущий патент: Биомаркер для детекции высокогорной адаптации и высокогорного отека легких
Следующий патент: Деталь топливной системы и способ изготовления детали топливной системы
Случайный патент: Соединения бензотиазина и бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат












