Fab-фрагменты моноклонального антитела человека, направленные против гликопротеина е2 hcv и обладающие нейтрализующей активностью in vitro
Формула / Реферат
1. Применение человеческого антитела или его функциональных фрагментов, распознающих эпитоп белка Е2 вируса HCV, распознаваемый Fab-фрагментами е137 и е301 человеческого моноклонального антитела и обладающий нейтрализующей активностью in vivo, для получения:
а) лекарственного средства для терапии против вируса HCV или
б) профилактического средства в виде препаратов для местного применения с целью ингибирования передачи вируса субъектам при повышенном риске.
2. Применение человеческого антитела или его функциональных фрагментов, распознающих эпитоп белка Е2 вируса HCV, распознаваемый Fab-фрагментами е137 и е301 человеческого моноклонального антитела и обладающий нейтрализующей активностью in vivo, для:
а) создания вакцин против вируса HCV или
б) идентификации антител, обладающих нейтрализующей HCV активностью.
3. Применение по п.1 или 2, где указанное антитело или указанный функциональный фрагмент содержит аминокислотные последовательности, экспрессируемые мутантным V-геном VH1-69 для тяжелой цепи и мутантным V-геном KV1-8 или KV3-15 для легкой цепи.
4. Применение по п.3, где указанное антитело или его фрагмент характеризуется тем, что имеет следующие последовательности вариабельных областей тяжелой цепи и легкой цепи:
тяжелая цепь е137 (HC)
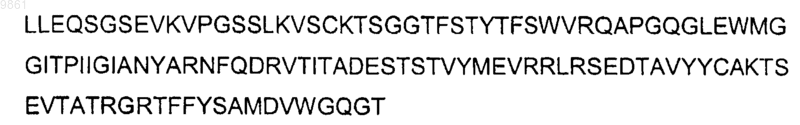
легкая цепь е137 (LC)

5. Применение по п.4, где указанное антитело или его фрагмент является Fab-фрагментом е137 человеческого моноклонального антитела или полноразмерным моноклональным антителом человека, содержащим указанный Fab-фрагмент.
6. Применение по п.3, где указанное антитело или его фрагмент характеризуется тем, что имеет следующие последовательности вариабельных областей тяжелой цепи и легкой цепи:
тяжелая цепь е301 (HC)
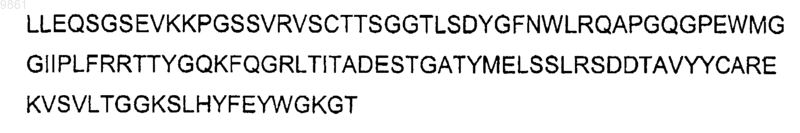
легкая цепь е301 (LC)

7. Применение по п.6, где указанное антитело или его фрагмент является Fab-фрагментом е301 человеческого моноклонального антитела или полноразмерным моноклональным антителом человека, содержащим указанный Fab-фрагмент.
8. Применение по пп.1-7, где человеческое антитело представляет собой полноразмерную молекулу IgG1.
9. Композиция для терапии против вируса HCV, содержащая в терапевтически эффективном количестве, по меньшей мере, человеческое антитело или его функциональные фрагменты, распознающие эпитоп белка Е2 вируса HCV, распознаваемый Fab-фрагментами е137 и е301 человеческого моноклонального антитела и обладающий нейтрализующей активностью in vivo.
10. Композиция по п.9, где указанное человеческое антитело или его функциональный фрагмент представляет собой Fab-фрагменты е137 и е301 человеческого моноклонального антитела или полноразмерное человеческое моноклонального антитело, содержащее любой из указанных Fab-фрагментов.
11. Композиция по п.9 или 10 для парентерального или местного применения.
12. Способ определения присутствия антител, обладающих нейтрализующей HCV активностью в экстрагированной биологической жидкости, включающий в себя стадии:
а) мечения Fab-фрагментов е137 или е301 человеческого моноклонального антитела или полноразмерного человеческого моноклонального антитела, содержащего по меньшей мере один из указанных Fab-фрагментов;
б) определения присутствия антител в указанной жидкости, способных ингибировать связывание указанных меченых Fab-фрагментов человеческого моноклонального антитела или указанного полноразмерного человеческого моноклонального антитела против белка Е2 HCV.
Текст
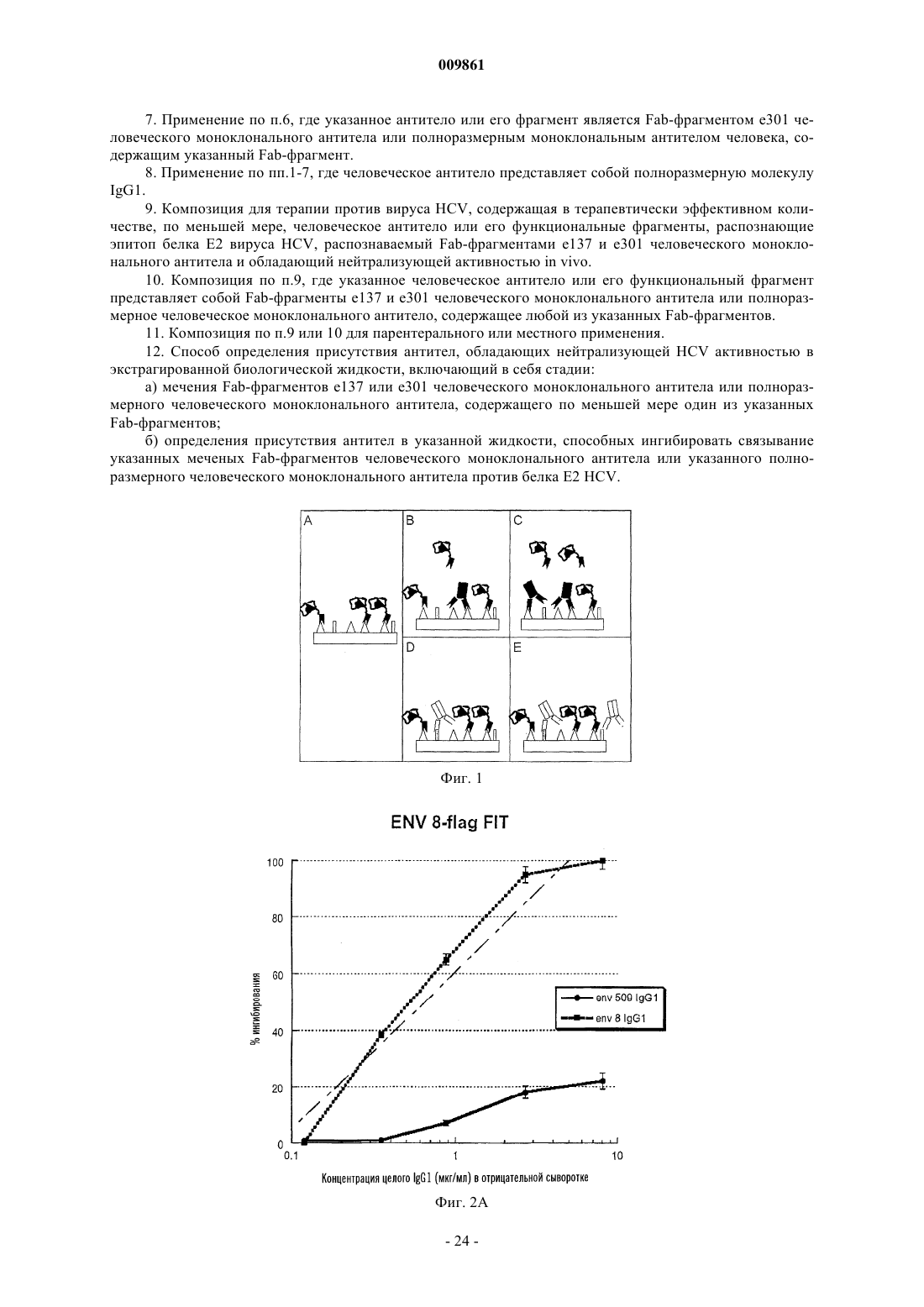
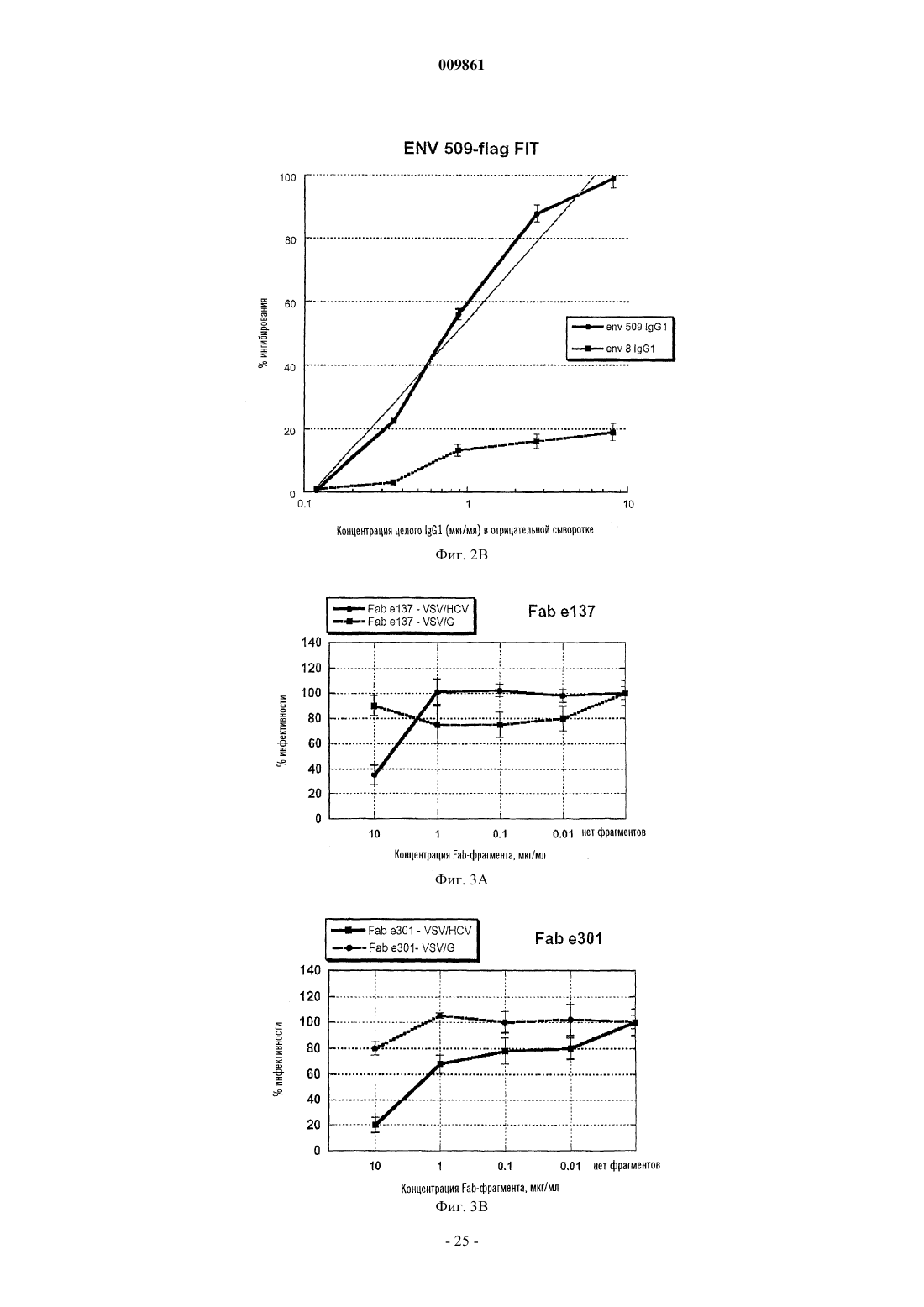
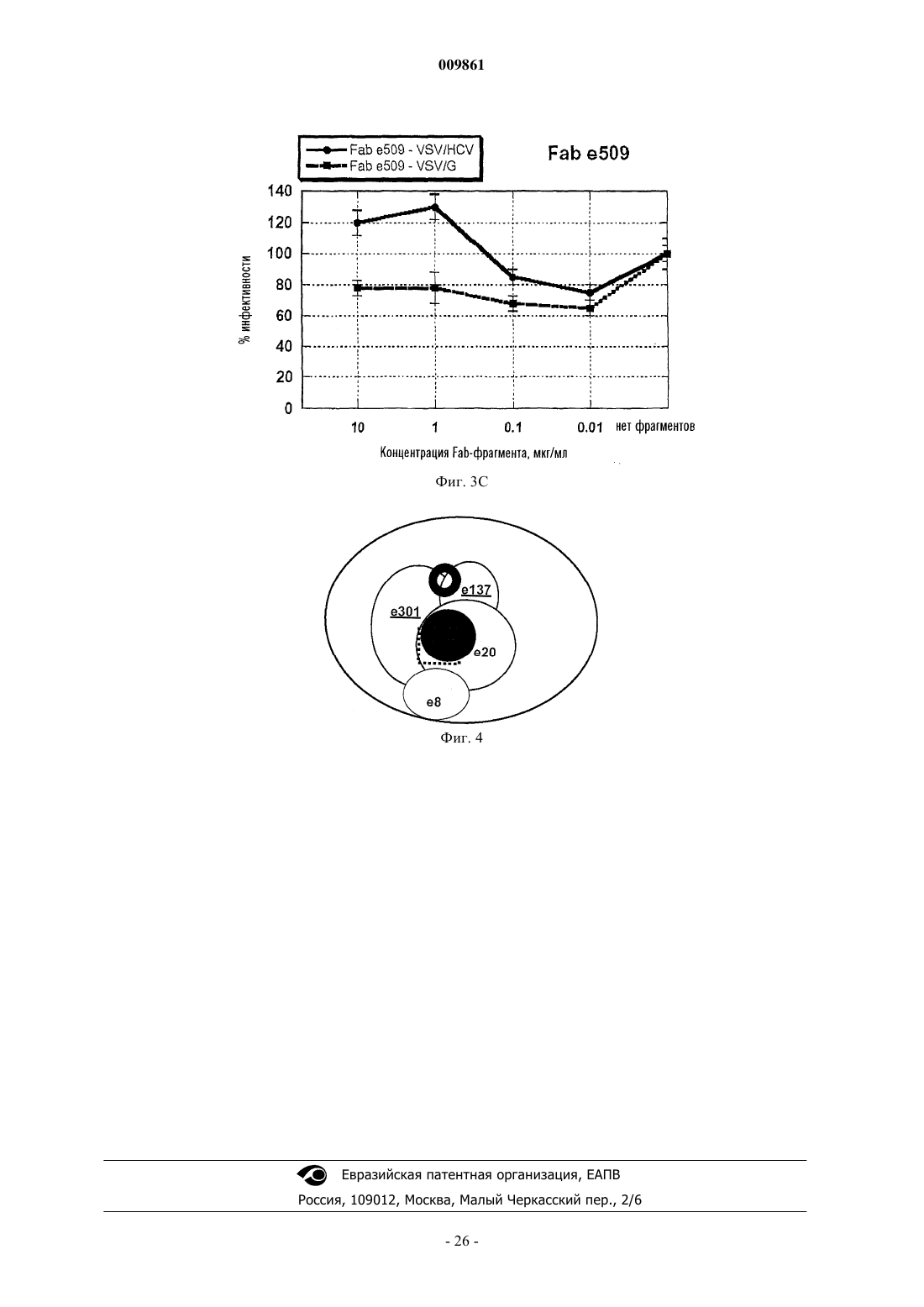
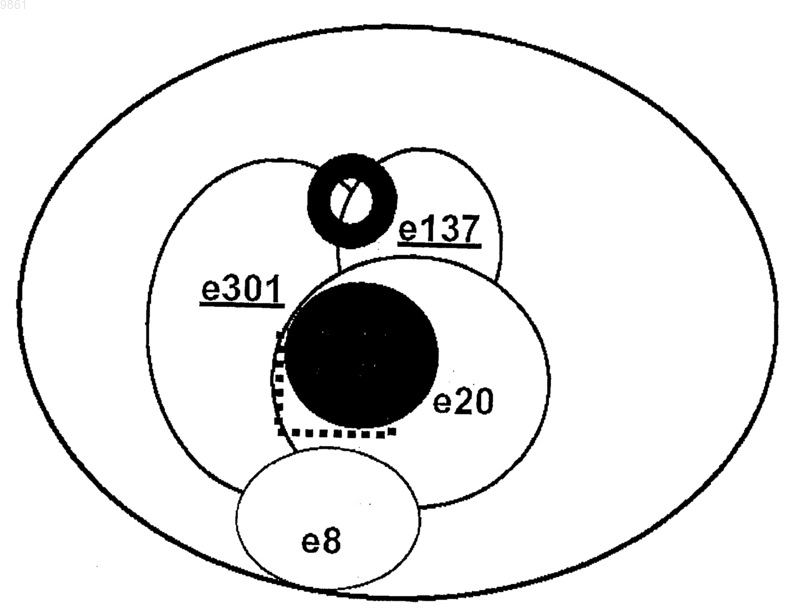
009861 Изобретение касается Fab-фрагментов человеческого моноклонального антитела, направленных против гликопротеина Е 2 вируса HCV и обладающих нейтрализующей активностью in vitro. Вирусом гепатита С (HCV) инфицировано около 4% населения в мире (World Health Organization, 1999). Более чем у 80% субъектов, имеющих контакт с данным патогеном, развивается хроническая инфекция вследствие того, что иммунная система хозяина не может побороть инфекцию, причем инфекция сопровождается риском возникновения тяжелых заболеваний печени, таких как хронический гепатит, цирроз и гепатома [1, 2]. Лечение хронической инфекции основано на комбинированной терапии интерфероном и рибавирином, которая является дорогостоящей, приводит к основным побочным эффектам и оказывает умеренное действие (только у одного больного из четырех наблюдается продолжительный эффект) [3, 4]. Вирусная инфекция не обеспечивает иммунную защиту. Этот факт, а также высокая вариабельность антигенной структуры вируса, распознаваемой иммунной системой, сдерживают разработку эффективной терапии сывороткой и вакцинами для защиты индивидов против HCV-инфекции. Отсюда следует, что новые антивирусные стратегии весьма необходимы. Автор изобретения клонировал гены, кодирующие большое количество Fab-фрагментов человеческого антитела, направленных против одного из белков вируса HCV, Е 2-гликопротеина, находящегося на поверхности, рассматриваемого как самая важная мишень иммунного защитного ответа [5]. Однако оценка биологической активности указанных фрагментов антител представляет собой непростую задачу,поскольку никакие надежные системы in vitro не пригодны для определения нейтрализующей HCV активности. Поэтому автор только оценил и описал вариабельную способность различных Fab-фрагментов ингибировать связывание белка Е 2 с клеткой-мишенью, не выявляя корреляции между этой активностью и нейтрализующей активностью сывороток [5]. В предыдущей работе Burioni et al. (2001) [6] было показано, что некоторые антитела против белка Е 2, продуцируемые HCV-инфицированными больными, оказывают отрицательное действие, приводящее к тому, что вирус становится менее чувствительным к иммунному ответу хозяина, вероятно, вследствие их связывания с Е 2-антигеном и изменений его конформации [6]. Эти данные могут объяснить, почему высокие титры антитела против белка Е 2 прямо не коррелируют с защитой против инфекции HCV. Исследователь Bugli et al. 2001 [7] создал карту эпитопов белка Е 2, которые могут in vitro связываться с набором Fab-фрагментов антител человека против белка Е 2, выявляющую четыре дискретные области антигена, против которых направлен иммунный ответ (фиг. 2) [7]. Присутствие антител, направленных против одной или более из этих областей в сыворотке хронически инфицированных больных, может быть связано с осложнениями, снижением эффективности лечения и другими прогнозами. Поэтому очевидно, что существует потребность в способе определения антител в биологической жидкости, направленных против различных эпитопов белка Е 2 вируса HCV. Воплощение настоящего изобретения обеспечивает такой способ. Авторы изобретения также оценили нейтрализующую активность различных антител против белка Е 2 в системе вирусных псевдотипов, т.е. вирусов, внешне идентичных вирусу HCV, только после проникновения в клетки-мишени, способные продуцировать белок, который может флуоресцировать [8]. Путем обнаружения присутствия или отсутствия флуоресценции в клетках способ позволяет осуществить прямое измерениеin vivo нейтрализующей активности антител против белка Е 2, направленных против различных эпитопов. Неожиданно авторы обнаружили, что два из исследованных антител, е 137 и е 307, могут нейтрализовать вирус при концентрациях, достигаемых посредством одного парентерального введения препарата антитела; два других антитела не проявляют нейтрализующей активности, а одно даже может стимулировать вирусную инфекцию. Создание способа титрования различных популяций антител у больного позволит получить ценный диагностический и прогностический инструмент, с помощью которого удастся отличить пораженных болезнью субъектов с повышенным риском развития тяжелых осложнений и с более благоприятным прогнозом. В последней группе указанный способ устранит необходимость проведения весьма неэффективного лечения, которое, кроме того, связано с серьезными побочными эффектами, и в то же время значительно снизит расходы. Поскольку идентифицированные таким образом эпитопы белка Е 2 нельзя воспроизвести путем синтеза синтетических пептидов [5], этот способ представляет собой единственный путь определения количества антител против различных частей белка Е 2, коррелирующий с клиническими и эпидемиологическими данными. Идентификация антител против белка Е 2 в формате человеческих Fab-фрагментов с хорошей нейтрализующей активностью позволяет производить их в большом масштабе и использовать в качестве противовирусного средства для лечения HCV-инфекций или в качестве профилактического средства в виде препаратов для местного применения с целью ингибирования передачи вируса субъектам при повышенном риске (пары с различным статусом по вирусу HCV, индивиды, подвергаемые профессиональному риску заражения, и т.д.). Антитела согласно изобретению могут быть с успехом использованы для оценки in vitro молекулкандидатов для создания вакцин против вируса HCV, т.е. способных стимулировать нейтрализующие антитела, но ненеэффективные или негативные антитела. Способность нейтрализующих человеческих антител распознавать широкий спектр вирусов может стать решающей в производстве искусственных вакцин. Нейтрализующие антитела, описанные в данном документе, могут быть использованы в качестве образца для создания вакцин (сделанных из пептидов или антиидиотипических антител), способных стимулировать нейтрализующую перекрестную реакцию. Целью данного изобретения является человеческое антитело или его функциональные фрагменты,-1 009861 направленные против белка Е 2 вируса HCV, обладающие in vivo нейтрализующей активностью. В особом аспекте антитело согласно изобретению представляет собой антитело е 137, которое отличается следующими аминокислотными последовательностями вариабельной части тяжелых и легких цепей. Тяжелая цепь (HC) е 137. В альтернативном аспекте антитело согласно изобретению представляет собой антитело е 301, которое отличается следующими аминокислотными последовательностями вариабельной части тяжелых и легких цепей. Тяжелая цепь (HC) е 301. Другой целью изобретения является композиция для терапии против вируса HCV, содержащая терапевтически эффективное количество по меньшей мере одного из антител согласно изобретению. Предпочтительно композиция представлена в очищенном виде для парентерального использования или в виде другого препарата для местного использования, такого как гель, крем, мазь, вагинальные свечи, с наполнителями, известными специалистам в данной области. Другой целью изобретения является нуклеиновая кислота, кодирующая каждое из антител согласно изобретению. Преимущественно нуклеиновая кислота может содержаться в экспрессирующем векторе, который может эффективно экспрессировать антитело согласно изобретению в прокариотических или также эукариотических клетках. В предпочтительном варианте рекомбинантный вектор также содержит нуклеотидную последовательность, кодирующую сигнальный пептид, который, по существу, граничит с последовательностью, кодирующей антитело согласно изобретению, и способствует экспорту антитела из клеточного окружения. Другой целью изобретения является применение рекомбинантного вектора, описанного в генной терапии. Изобретение описано далее в экспериментальных примерах, не ограничивающих изобретение, со ссылкой на следующие фигуры. Фиг. 1 FIT: теоретическая основа. На панели А показано связывание Fab-FLAG с его эпитопами без конкурентов. Используя такую же концентрацию Fab-фрагмента, присутствующую в (А), преинкубация антигена с сывороткой больного позволяет осуществить количественный анализ антител, направленных против эпитопа, узнаваемого Fab-фрагментом в сыворотке. В панелях В и С связанные антитела, которые конкурируют с Fab-фрагментом, пропорционально снижают количество связанных Fab-фрагментов по сравнению с панелью А. В панелях D и E присутствие антител, не направленных против специфического эпитопа, не влияет на связывание Fab-фрагмента. Фиг. 2 А и 2 В: ингибирование связывания между e8-FLAG (A) и e509-FLAG (B) с белком Е 2 вирусаHCV посредством сывороток, содержащих известные концентрации e8-IgG1 и e509-IgG1 (целые антитела, направленные против эпитопов, распознаваемых Fab-фрагментом). Ясно, что ингибирование связывания Fab-фрагмента можно наблюдать только в присутствии целого антитела, обладающего такой же специфичностью, и что оно зависит от концентрации антитела. Фиг. 3 А, 3 В и 3 С: торможение заражения псевдотипами VSV/HCV и VSV/G посредством очищенных человеческих рекомбинантных Fab-фрагментов против белка Е 2 вируса HCV при различных концентрациях. Клетки HepG2, инфицированные Fab-обработанными псевдотипами, инкубировали в течение 16 ч и ряд клеток, экспрессирующих зеленый флуоресцирующий белок, определяли с помощью флуоресцентного микроскопа. Данные представлены в виде % заражения, определяемого в контрольных лунках (Fab-фрагменты не добавляли). Полученные результаты представляют собой средние значения из трех независимых анализов, выполненных дважды. Фиг. 4: двумерная имитирующая клеточную поверхность карта эпитопов В-клеток человека, присутствующих на поверхности белка Е 2 вируса HCV, распознаваемых моноклональными антителами,применяемыми в данном исследовании. Перекрывающиеся круги указывают на реципрокное ингибирование. Fab-фрагменты, обладающие активностью, нейтрализующей псевдотип VSV/HCV, подчеркнуты. Предполагаемая область, опосредующая взаимодействие белка Е 2 вируса HCV с клеточной мишенью,обозначена пунктирной линией. Предполагаемая область, распознаваемая нейтрализующими антитела-2 009861 ми, обозначена сплошным черным кругом. Из-за модификаций, которые могут быть вызваны взаимодействиями антиген-антитело, данная диаграмма не соответствует действительной физической карте. Пример 1. Материалы и методы.Fab-фрагменты против вируса HCV и продукция полноразмерного IqG1. Получение, очистка и характеристика Fab-фрагментов, направленных против белка Е 2 вируса HCV,были описаны в других работах [5]. FLAG-Fab (Fab-фрагменты, меченные FLAG-эпитопом, конденсированным у карбоксильного конца фрагмента тяжелой цепи, с пентапептидным мостиком) были сконструированы и очищены, как описано в других работах [6]. Проверку достоверности и стандартизацию анализа осуществляли, используя Fab-кодирующие гены для создания полноразмерных человеческих моноклональных антител (HuMab), которые вводили в соответствующий эукариотический вектор для последующего продуцирования в трансфицированных клетках [9]. HuMab, присутствующие в культуральном супернатанте, очищали иммуноаффинным методом, как описано [10], и чистоту проверяли посредством ЭФ в ПААГ. Количество человеческого антитела оценивали сэндвич-иммуноанализом. Все антитела и Fab-фрагменты хранили при -70 С до использования. Сыворотки и образцы. Сыворотки, полученные от здоровых доноров и HCV-положительных больных, анализировали с помощью коммерческих диагностических наборов (Ortho, Raritan, NJ), следуя стандартным процедурам. Для приготовления опытных образцов с известными количествами антител, направленных против данного эпитопа, HCV-отрицательные сыворотки смешивали с концентрированными очищенными антителамиHuMab в PBS и обрабатывали подобным образом положительные и отрицательные сыворотки. Разработка анализа титра ингибирования [сывороткой] Fab-[фрагмента] (FIT). Целью данного анализа является оценка способности сыворотки ингибировать связывание меченого Fab-фрагмента с его эпитопом с получением, таким образом, непрямого измерения количества эпитопсвязывающих антител в сыворотках (фиг. 1).ELISA, чтобы определить истинную концентрацию, которую необходимо использовать в экспериментах по ингибированию. Кратко, препараты FLAG-Fab-фрагмента известной концентрации титровали посредством ELISA [11], где покрытые антигеном планшеты блокировали в течение 1 ч при 37 С растворомPBS с 1% BSA. После удаления блокирующего раствора по 50 мкл раствора последовательных разведений FLAG-Fab-фрагмента в PBS с 1% BSA добавляли к лункам и инкубировали в течение 2 ч при 37 С. Планшеты промывали 10 раз раствором PBS с 0,05% твином-20 в автоматической машине для мойки планшетов (DiaSorin, Saluggia, Italy) до добавления 50 мкл раствора 10 мкг/мл анти-FLAG мышиного моноклонального антитела М 2 (Sigma, St. Louis, MO; 10 мкг/мл в PBS) в PBS с 1% BSA. После 1 ч инкубации при 37 С лунки промывали 10 раз PBS с твином-20, как выше, и связывание мышиного моноклонального антитела обнаруживали с помощью конъюгированного с пероксидазой хрена козьего антитела против IgG мыши (Pierce; 1:8000 в ЗФР). Субстрат добавляли и планшеты считывали при OD450 в автоматическом аппарате для чтения планшетов после 30 мин инкубации при комнатной температуре в темноте. Все анализы выполняли по меньшей мере дважды. Всегда учитывали отрицательный контрольный антиген (BSA) и показание OD вычитывали как фон. С целью определения титра сывороток, ингибирующих Fab-фрагмент (FIT), концентрацию очищенных FLAG-Fab-фрагментов, определяемую в стандартных условиях с помощью оценки показанияOD450, составляющего 50% максимального показания, использовали для дальнейших экспериментов по ингибированию Fab-фрагмента методом ELISA. Для этого планшеты покрывали и блокировали, как описано выше. Последовательно разведенные сыворотки 1:4 в растворе PBS с 1% BSA добавляли в количестве 50 мкл на лунку в планшеты для ELISA. После 2 ч инкубации при 37 С очищенный FLAG-Fabфрагмент непосредственно добавляли к разведенным сывороткам для получения желаемой конечной концентрации. Планшеты инкубировали еще 30 мин и затем обрабатывали, как описано выше для анализа FLAG-Fab-фрагмента методом ELISA. Подключали также положительный контроль, содержащий избыток 20:1 очищенного немеченого Fab-фрагмента, соответствующего 100% ингибирования. Вводили также отрицательный контроль, содержащий избыток контрольного некоррелированного Fab-фрагмента[12] и соответствующий 0% ингибирования. Конечные результаты выражали как % ингибирования по формуле процент ингибирования = 100(OD450 пробы отдельно FLAG-Fab-фрагмента - OD450 пробыFLAG-Fab-фрагмента с конкурирующей сывороткой)/OD450 пробы отдельно FLAG-Fab-фрагмента. Самое высокое разведение сыворотки, оказывающее более 70% ингибирования связывания FLAGFab-фрагмента, рассматривают как титр ингибирования сывороткой Fab-[фрагмента] (FIT) для данного эпитопа и для данной сыворотки. Результаты. Соответствующие концентрации FLAG-Fab-фрагмента, которые следует использовать в анализе,определяли для каждого FLAG-Fab-фрагмента и указанные концентрации варьировали от 10 (е 8, е 20,е 137, е 301, е 509) до 0,1 мкг/мл (е 10-В). Аминокислотные последовательности легких и тяжелых цепей различных антител даны ниже. Метод ELISA для исследования FLAG-Fab-фрагмента, использующий очищенные меченые молекулы Fab-фрагмента, дает специфические и воспроизводимые результаты. Определение FIT осуществляли при использовании 10 HCV-отрицательных сывороток; титр составил 1:20, верхний предел области тестирования, что указывает на то, что никакого ингибирования не происходит в отсутствие специфических антител против вируса HCV. Для того, чтобы продемонстрировать, что определение FIT является эффективным способом количественного определения антител, направленных против эпитопов, распознаваемых FLAG-Fab-фрагментами согласно изобретению, такой же анализ выполняли с использованием образцов, приготовленных путем смешивания отрицательных сывороток с человеческими моноклональными антителами данной специфичности, получая искусственные образцы, содержащие известные количества IgG, направленных против эпитопов белка Е 2 вируса HCV, определяемых с помощью Fab-фрагментов согласно изобретению. Результаты (фиг. 2 А и В) показали хорошую корреляцию между FIT и количеством антитела, что указывает на то, что показатель FIT может предоставить достоверную информацию о количестве эпитопспецифических антител в сыворотке больного. В заключение, показатель FIT является всегда положительным для HCV-положительных сывороток с величинами, охватывающими широкую область разведений. Показатель FIT является различным для разныхFab-фрагментов в одном и том же образце сыворотки со значительной гетерогенностью между больными. Пример 2. Материалы и методы. Фрагменты человеческих антител. Человеческие рекомбинантные фрагменты антитела в данном примере полностью описаны Bugli etal. (2001) [7] и соответствуют фрагментам, используемым в примере 1. Кратко, кодирующие Fab-фрагменты гены получали из комбинаторной библиотеки фагов, содержащей набор IgG1/каппа 58-летней женщины, страдающей хроническим гепатитом, с постоянным присутствием в крови РНК вируса HCV генотипа 1b. Отобранные гены вводили в соответствующий бактериальный экспрессирующий вектор[13] и трансформированные клетки затем использовали в качестве источника рекомбинантных Fab-фрагментов, которые получали и очищали, как описано [14]. Описаны нейтрализация связывания Е 2 с клеткой (NOB) [5, 15] и реципрокные взаимодействия [7] данных молекул. Присутствие подобных антител в сыворотке HCV-инфицированных больных определяли путем ингибирования методом ELISA [7]. Псевдотипы и анализ нейтрализации. Используемые в данном изобретении псевдотипы были полностью охарактеризованы и описаныMatsuura et al. 2001 [8]. Кратко, псевдотип VSVG/HCVE1-E2 (VSV/HCV) состоит из вируса везикуляр-6 009861 ного стоматита, где белок оболочки G заменяют химерными гликопротеинами E1 и Е 2 оболочки вирусаHCV, состоящими из эктодоменов белков E1 и Е 2, кодированных кДНК вируса HCV типа 1b (NIH-J1),слитых с N-концевыми сигнальными последовательностями, с трансмембранными и цитоплазматическими доменами G-белка вируса VSV [8]. Конструкция плазмид [16] и эукариотические экспрессирующие векторы описаны в литературе [8, 17]. Псевдотип VSV/HCV получали путем инфицирования клетокCHO, постоянно экспрессирующих химерные кДНК белков E1 и Е 2, рекомбинантным вирусом VSV, в котором область, кодирующую G-белок, заменяли геном зеленого флуоресцирующего белка (GFP) [18]. Псевдотип VSVG/HCVE1-E2 (VSV/G), используемый в качестве контроля (и чтобы продуцироватьVSV/HCV псевдотип), получали путем инфицирования посредством VSVG клеточной линии, транзитно экспрессирующей G-белок. Определение нейтрализующей активности осуществляли, как описано в литературе [8]. Растворы очищенных человеческих рекомбинантных Fab-фрагментов в различных разведениях инкубировали с псевдотипом VSV/HCV или VSV/G с активностью, составляющей 2,4x103 инфицирующих единиц (IU), в течение 30 мин при 37 С и инокулировали в клетки HepG2 (4x104 клеток), находящиеся в 96-луночном планшете. После адсорбции в течение 60 мин при 37 С клетки промывали 3 раза средой DMEM, содержащей 10% FSB, и инкубировали при 37 С в течение 16 ч. Оценку IU вируса определяли путем подсчета числа GFP-экспрессирующих клеток с помощью флуоресцентного микроскопа. Данные выражали как процент ингибирования по сравнению с контрольными лунками, в которые антитело не добавляли. Данные представляют собой средние величины из трех экспериментов, выполненных дважды. Результаты. Получение набора человеческого моноклонального антитела против белка Е 2 вируса HCV и характеристика последовательности. Набор Fab-фрагментов человеческого моноклонального антитела представляет собой иммунный набор антител против белка Е 2 вируса HCV больного с персистирующей инфекцией вируса HCV генотипа 1b [5, 19]. Фрагменты антитела, отобранные с помощью очищенного рекомбинантного белка Е 2 вируса HCV генотипа 1a (штамм H) [20], экспрессированного в CHO клетках, были полностью охарактеризованы и соответствовали клонам, присутствующим в сыворотке хронически инфицированных больных [7] с общим равным сродством к белку Е 2 вируса HCV. Каждое из пяти антител представляет одно из пяти семейств, в котором сгруппирован набор целых антител против белка Е 2 данного больного. Fabфрагменты, принадлежащие к тому же семейству, имеют подобную биологическую активность и имеют сильные гомологии последовательностей ДНК [5]. Каждый из пяти Fab-фрагментов распознает отличный эпитоп на поверхности Е 2 [7]. Отклонения от последовательностей соответствующих зародышевых линий, как правило, сопровождают индуцированное антигеном созревание сродства антитела (табл. 1a и 1b), предполагающего длительную экспозицию с антигеном. Табл. 1A, В. Мутации зародышевых линий и V-гена в вариабельных областях человеческих моноклональных антител против белка Е 2 вируса HCV. Последовательности определяли, как описано у Burioni et al., 1998 [5], и сравнивали с последовательностями в базе данных IMGT [21]. Процент мутаций в нуклеотидных и аминокислотных последовательностях рассчитывали согласно методу выравнивания по Kabat and Wu [22] с учетом области рамки считывания (FR) 1, FR 2 и FR 3 для тяжелых и легких цепей, комплементарность детерминирующей области (CDR) 1 CDR 2 для тяжелых цепей, CDR 1, CDR 2 и CDR 3 для легких цепей. Таблица 1a Тяжелые цепи-7 009861 Нейтрализующую связывание (NOB) активность каждого Fab-фрагмента определяли [5] с использованием некоторых клонов (e137 и е 8), которые, как было обнаружено, не способны были ингибировать связывание белка Е 2 вируса HCV с клетками, и других клонов, ингибирующих связывание белка Е 2 вируса HCV даже при очень низкой концентрации (см. ниже). Нейтрализация псевдотипа вируса человеческими рекомбинантными Fab-фрагментами. Два из Fab-фрагментов, е 8 и е 20, распознающие различные эпитопы на поверхности белка Е 2 вирусаHCV [7], не нейтрализовали псевдотип VSV/HCV даже при высоких концентрациях (80 мкг/мл). Один из указанных двух Fab-фрагментов, е 20, проявлял сильную NOB активность [5], что подтверждает тот факт,что даже антитела, ингибирующие связывание белка Е 2, не могут предотвратить вирусную инфекцию. Два других Fab-фрагмента, е 137 и е 301, эффективно нейтрализовали псевдотип VSV/HCV при концентрации 10 мкг/мл, в то время как псевдотипы VSV, несущие G-белок оболочки VSV (VSV/G псевдотипы), были неэффективны (фиг. 3 А и 3B). Полученные результаты согласуются с предварительными данными, указывающими на то, что эти два клона конкурируют за одну и ту же область Е 2, вероятно,распознаваемую человеческими антителами, обладающими нейтрализующей активностью, как показано на двумерной карте поверхности человеческих эпитопов на HCV/E2 (фиг. 4). В настоящее время Fab-фрагмент 509 рассматривают как самое эффективное доступное антитело на основании NOB-активности, он способен ингибировать связывание между белком Е 2 и клеточной мишенью в очень низких концентрациях (табл. 2). Инкубация псевдотипов VSV/HCV с указанным Fab-фрагментом повышает внедрение вируса в клетки гепатомы вплоть до концентрации 1 мкг/мл. Никакого увеличения инфективности не наблюдали в случае использования псевдотипов VSV/G, таким образом, исключается возможность того, что неспецифическое взаимодействие данного Fab-фрагмента с клеточной мембраной стимулирует внедрение вируса в клетку (фиг. 3C). Таблица 2 Свойства антител против белка Е 2 вируса HCV Активность NOB рассчитывали как концентрацию (в мкг/мл), осуществляющую 50% нейтрализацию связывания очищенного препарата белка Е 2 вируса HCV с клеточными мишенями. Контрольное антитело [23] не оказывало никакого действия на систему псевдотипов, поскольку оно не нейтрализовало ни VSV/HCV, ни VSV/G псевдотипы. Псевдотип VSV/G в достаточной степени был нейтрализован путем разведений 1:1000 поликлональной антисыворотки против вируса VSV, используемой в качестве нейтрализующего контроля в данных экспериментах [8], которая не влияла на псевдотипVSV/HCV. Поликлональные и моноклональные антитела против белка El и белка Е 2, стимулированные в некоторых хозяйских организмах, не проявляли нейтрализующего действия на псевдотипы VSV/HCV. Нейтрализующая активность моновалентных Fab-фрагментов показывает, что внедрение вирусаHCV можно ингибировать без необходимости агрегации вириона или поперечного связывания; кроме того, маловероятно, что блокирование взаимодействия между вирусом и его клеточной мишенью является ключевым фактором в нейтрализации вируса HCV. Полученные данные могут объяснить на молекулярном уровне отсутствие корреляции между активностью NOB в сыворотке и защитой от заболевания. В некоторой степени перекрестная нейтрализация достигается с помощью антител против вирусаHCV как антител против белка Е 2, отобранных с помощью Е 2 генотипа 1a, которые способны нейтрализовать псевдотип, несущий Е 2 генотипа 1b. Результаты показывают, что Fab-фрагмент 509 был способен повысить инфективность вируса псевдотипа VSV/HCV, хотя никакого действия на конструкцию VSV/G не наблюдали. Возможное объяснение способности е 509 стимулировать внедрение вируса может быть найдено на основании того, что указанное антитело связывается специфически и весьма эффективно с областью Е 2, которая связывается сCD81-клеточной структурой, участвующей в прикреплении вируса к клетке [24]. Связывание е 509 с Е 2 может имитировать связывание Е 2 с одной из его клеточных мишеней и стимулировать изменение конформации Е 2, подобное изменению, вызванному CD81. Белок Е 2 присутствует по меньшей мере в двух конформационных состояниях, и связывание антитела с данным белком может модифицировать стерический статус белка путем модуляции активности NOB человеческих Fab-фрагментов без конкурентного связывания [6]. Следовательно, Fab-фрагмент 509 представляется основным средством для изучения взаимодействий между вирусом HCV и клеточной поверхностью и может быть использован в моделях in ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение человеческого антитела или его функциональных фрагментов, распознающих эпитоп белка Е 2 вируса HCV, распознаваемый Fab-фрагментами е 137 и е 301 человеческого моноклонального антитела и обладающий нейтрализующей активностью in vivo, для получения: а) лекарственного средства для терапии против вируса HCV или б) профилактического средства в виде препаратов для местного применения с целью ингибирования передачи вируса субъектам при повышенном риске. 2. Применение человеческого антитела или его функциональных фрагментов, распознающих эпитоп белка Е 2 вируса HCV, распознаваемый Fab-фрагментами е 137 и е 301 человеческого моноклонального антитела и обладающий нейтрализующей активностью in vivo, для: а) создания вакцин против вируса HCV или б) идентификации антител, обладающих нейтрализующей HCV активностью. 3. Применение по п.1 или 2, где указанное антитело или указанный функциональный фрагмент содержит аминокислотные последовательности, экспрессируемые мутантным V-геном VH1-69 для тяжелой цепи и мутантным V-геном KV1-8 или KV3-15 для легкой цепи. 4. Применение по п.3, где указанное антитело или его фрагмент характеризуется тем, что имеет следующие последовательности вариабельных областей тяжелой цепи и легкой цепи: тяжелая цепь е 137 (HC) 5. Применение по п.4, где указанное антитело или его фрагмент является Fab-фрагментом е 137 человеческого моноклонального антитела или полноразмерным моноклональным антителом человека, содержащим указанный Fab-фрагмент. 6. Применение по п.3, где указанное антитело или его фрагмент характеризуется тем, что имеет следующие последовательности вариабельных областей тяжелой цепи и легкой цепи: тяжелая цепь е 301 (HC)- 23009861 7. Применение по п.6, где указанное антитело или его фрагмент является Fab-фрагментом е 301 человеческого моноклонального антитела или полноразмерным моноклональным антителом человека, содержащим указанный Fab-фрагмент. 8. Применение по пп.1-7, где человеческое антитело представляет собой полноразмерную молекулуIgG1. 9. Композиция для терапии против вируса HCV, содержащая в терапевтически эффективном количестве, по меньшей мере, человеческое антитело или его функциональные фрагменты, распознающие эпитоп белка Е 2 вируса HCV, распознаваемый Fab-фрагментами е 137 и е 301 человеческого моноклонального антитела и обладающий нейтрализующей активностью in vivo. 10. Композиция по п.9, где указанное человеческое антитело или его функциональный фрагмент представляет собой Fab-фрагменты е 137 и е 301 человеческого моноклонального антитела или полноразмерное человеческое моноклонального антитело, содержащее любой из указанных Fab-фрагментов. 11. Композиция по п.9 или 10 для парентерального или местного применения. 12. Способ определения присутствия антител, обладающих нейтрализующей HCV активностью в экстрагированной биологической жидкости, включающий в себя стадии: а) мечения Fab-фрагментов е 137 или е 301 человеческого моноклонального антитела или полноразмерного человеческого моноклонального антитела, содержащего по меньшей мере один из указанныхFab-фрагментов; б) определения присутствия антител в указанной жидкости, способных ингибировать связывание указанных меченых Fab-фрагментов человеческого моноклонального антитела или указанного полноразмерного человеческого моноклонального антитела против белка Е 2 HCV.
МПК / Метки
МПК: G01N 33/576, C07K 16/42, C07K 16/10
Метки: антитела, гликопротеина, человека, направленные, fab-фрагменты, против, нейтрализующей, моноклонального, vitro, активностью, обладающие
Код ссылки
<a href="https://eas.patents.su/27-9861-fab-fragmenty-monoklonalnogo-antitela-cheloveka-napravlennye-protiv-glikoproteina-e2-hcv-i-obladayushhie-nejjtralizuyushhejj-aktivnostyu-in-vitro.html" rel="bookmark" title="База патентов Евразийского Союза">Fab-фрагменты моноклонального антитела человека, направленные против гликопротеина е2 hcv и обладающие нейтрализующей активностью in vitro</a>
Предыдущий патент: Пиперазинил- и диазапанилбензамиды и бензтиоамиды
Следующий патент: Плоский самооткрывающийся затвор для композитных упаковок или для горловин бутылок и емкостей, закрываемых плёночным материалом
Случайный патент: Замкнутое крыло