Очистка вариантов her-2
Формула / Реферат
1. Способ очистки белка, производного семейства EGFR, причем указанный белок создают рекомбинантным способом в культуре клеток насекомых, и указанный белок представляет собой белок, который является подходящим для очистки посредством аффинной хроматографии с иммобилизованным металлом, при этом способ предусматривает получение из указанной культуры клеток насекомых, по существу, бесклеточного образца, содержащего указанный белок, производный семейства EGFR, и последующее обогащение указанного белка, производного семейства EGFR, при помощи последовательных этапов
диафильтрации и замены культуральной среды буфером,
аффинной хроматографии с иммобилизованным металлом (IMAC),
эксклюзионной хроматографии (SEC),
анионообменной хроматографии (AIE).
2. Способ по п.1, в котором белок, производный семейства EGFR, включает гетерологичную аминокислотную последовательность, которая облегчает очистку при помощи IMAC.
3. Способ по п.2, в котором гетерологичная аминокислотная последовательность имеет высокое содержание гистидиновых остатков.
4. Способ по п.3, в котором гетерологичная аминокислотная последовательность содержит остатки 1-14 SEQ ID NO:2.
5. Способ по любому из предшествующих пунктов, в котором белок, производный семейства EGFR, содержит существенную часть аминокислотной последовательности человеческого EGFR или человеческого HER-2.
6. Способ по п.5, в котором существенную часть в основном выделяют из внеклеточной части EGFR или HER-2.
7. Способ по п.5 или 6, в котором белок, производный семейства EGFR, представляет собой вариант человеческого HER-2.
8. Способ по п.7, в котором вариант человеческого HER-2 включает по меньшей мере один чужеродный эпитоп Т-клетки-хелпера.
9. Способ по п.8, в котором вариант человеческого HER-2 включает эпитопы столбнячного анатоксина Р2 (остатки 269-282 SEQ ID NO:2) и Р30 (остатки 649-669 SEQ ID NO:2).
10. Способ по п.9, в котором вариант человеческого HER-2 включает аминокислотные остатки 17-677 SEQ ID NO:2.
11. Способ по п.10, в котором аминокислотная последовательность варианта человеческого HER-2 состоит из остатков 1-677 SEQ ID NO:2.
12. Способ по любому из предшествующих пунктов, в котором этап диафильтрации/замены буфера выполняют при температуре от примерно 2 до примерно 25шС, предпочтительно при температуре от примерно 3 до примерно 8шС, необязательно с добавлением детергента, такого как Твин, если температура превышает 10шС.
13. Способ по п.12, в котором диафильтрацию выполняют в два этапа: сначала для увеличения концентрации макромолекулярных соединений в образце культуральной среды, и затем замены культуральной среды буфером.
14. Способ по п.13, в котором макромолекулярные соединения концентрируют в пределах от примерно 2 до примерно 25 раз.
15. Способ по п.14, в котором макромолекулярные соединения концентрируют примерно в 3-5 раз.
16. Способ по любому из пп.12-15, в котором замену буфера выполняют в один или два последовательных этапа, из которых первый происходит при рН по меньшей мере 6,5 и не больше чем 7,2, и второй необязательный этап происходит при рН по меньшей мере 7,0 и не больше чем 8,0.
17. Способ по любому из пп.12-16, в котором для замены буфера используется фосфатный буфер.
18. Способ по любому из предшествующих пунктов, в котором имидазол, гистидин или буфер с высокой концентрацией соли добавляют в образец, подвергнутый диафильтрации и замене буфера, или в котором образец с замененным буфером по существу не изменяют.
19. Способ по п.18, в котором имидазол, если добавляют, то добавляют для достижения концентрации в пределах между примерно 0,05 и примерно 20 мМ.
20. Способ по любому из предшествующих пунктов, в котором детергент, выбранный из полиоксиэтиленового эфира сорбита и жирной кислоты, такого как Твин-20, Твин-40, Твин-60, Твин-80 и Твин-85, алкиларильного полиэфирного спирта, такого как Тритон Х-100, неионного детергента и детергента на основе углеводородов, такого как октилгликозид, добавляют в образец, подвергнутый диафильтрации и замене буфера, для достижения концентрации в пределах между примерно 0,05 и 10% (об./об.), такой как примерно 0,1%.
21. Способ по любому из предшествующих пунктов, в котором этап IMAC включает внесение в хроматографическую среду ионов двухвалентного металла перед нанесением образца с замененным буфером.
22. Способ по п.21, в котором ион двухвалентного металла выбирают из группы, состоящей из Ni2+, Cu2+, Zn2+, Co2+ и Fe2+, предпочтительно Zn2+.
23. Способ по п.21 или 22, в котором элюцию хроматографической среды проводят с применением имидазола, гистидина, буфера с высокой концентрацией соли или изменением рН хроматографической среды.
24. Способ по п.23, в котором элюцию хроматографической среды выполняют с применением имидазола в один этап с концентрацией в пределах между примерно 50 мМ и примерно 500 мМ, предпочтительно с концентрацией 200 мМ, или в котором элюцию выполняют с применением гистидина в один этап с концентрацией в пределах между 20 и 400 мМ, предпочтительно примерно 100 мМ.
25. Способ по любому из предшествующих пунктов, в котором этап SEC включает элюцию фосфатным буфером, или Трис буфером, или биологическим буфером, таким как HEPES.
26. Способ по п.25, в котором поддерживают рН примерно 7-8, предпочтительно примерно 7,5.
27. Способ по п.25 или 26, в котором средний размер пор матрицы SEC разделяет глобулярный белок между 10 и 600 кДа.
28. Способ по любому из предшествующих пунктов, в котором образцы, содержащие белок, производный семейства EGFR, полученные из SEC, при необходимости, разбавляют до этапа AIE для доведения концентрации фосфатов до менее чем 15 мМ, такой как в пределах между 10 и 12,5 мМ.
29. Способ по любому из предшествующих пунктов, в котором этап AIE включает загрузку образца, содержащего белок, производный семейства EGFR, полученного после SEC, на ионообменную матрицу с сильным анионом или со слабым анионом, или и на ту, и на другую.
30. Способ по п.29, в котором элюцию выполняют буферизованным раствором NaCl при рН между 7 и 8.
31. Способ по любому из предшествующих пунктов, в котором этап инактивации вирусов вводят между этапами диафильтрации/замены буфера и IMAC.
32. Способ по любому из предшествующих пунктов, в котором за этапом AIE следует этап фильтрования вирусов.
33. Способ по любому из предшествующих пунктов, в котором этап AIE, использующий ионообменную колонку со слабым анионом, вводят между этапами IMAC и SEC.
34. Иммуногенный вариант белка HER-2, который содержит аминокислотную последовательность, приведенную в SEQ ID NO:2, остатки 17-677.
35. Иммуногенный вариант белка HER-2 по п.34, который состоит из аминокислотной последовательности, приведенной в SEQ ID NO:2, остатки 1-677.
36. Фрагмент нуклеиновой кислоты, который кодирует иммуногенный вариант белка HER-2 по п.34 или 35.
37. Фрагмент нуклеиновой кислоты по п.36, который представляет собой фрагмент ДНК.
38. Вектор, несущий фрагмент нуклеиновой кислоты по п.36 или 37.
39. Вектор по п.38, который способен к автономной репликации.
40. Вектор по п.38 или 39, выбранный из группы, состоящей из плазмиды, фага, космиды, минихромосомы и вируса.
41. Вектор по любому из пп.38-40, который представляет собой вектор экспрессии.
42. Вектор по п.41, содержащий в направлении 5'R3' и в рабочем сцеплении промотор, запускающий экспрессию фрагмента нуклеиновой кислоты по п.36 или 37, необязательно, последовательность нуклеиновой кислоты, кодирующую белок-лидер, обеспечивающий возможность секреции или встраивания в мембрану фрагмента полипептида, фрагмент нуклеиновой кислоты по п.36 или 37, и, необязательно, последовательность нуклеиновой кислоты, кодирующую терминатор.
43. Трансформированная клетка хозяина, несущая вектор по любому из пп.38-42.
44. Стабильная клеточная линия, которая несет вектор по п.41 или 42 и которая экспрессирует фрагмхэт нуклеиновой кислоты по п.36 или 37, и которая, необязательно, секретирует или несет иммуногенный вариант белка HER-2 по п.34 или 35 на своей поверхности.
45. Иммуногенная композиция для иммунизации человека против белка HER-2, содержащая иммуногенный вариант белка HER-2 по п.34 или 35 в смеси с фармацевтически приемлемым носителем или наполнителем и, необязательно, адъювантом.
46. Иммуногенная композиция для иммунизации человека против белка HER-2, содержащая вектор по п.41 или 42 в смеси с фармацевтически приемлемым носителем или наполнителем и, необязательно, адъювантом.
47. Способ иммунизации человека против аутогенного HER-2, предусматривающий введение иммуногенно эффективного количества
иммуногенного варианта белка HER-2 по п.34 или 35, или
иммуногенной композиции по п.45, или
вектора по п.41 или 42, или
иммуногенной композиции по п.46 человеку.
48. Способ по п.47, в котором иммунизацию против аутогенного белка HER-2 применяют для лечения или облегчения рака.
Текст
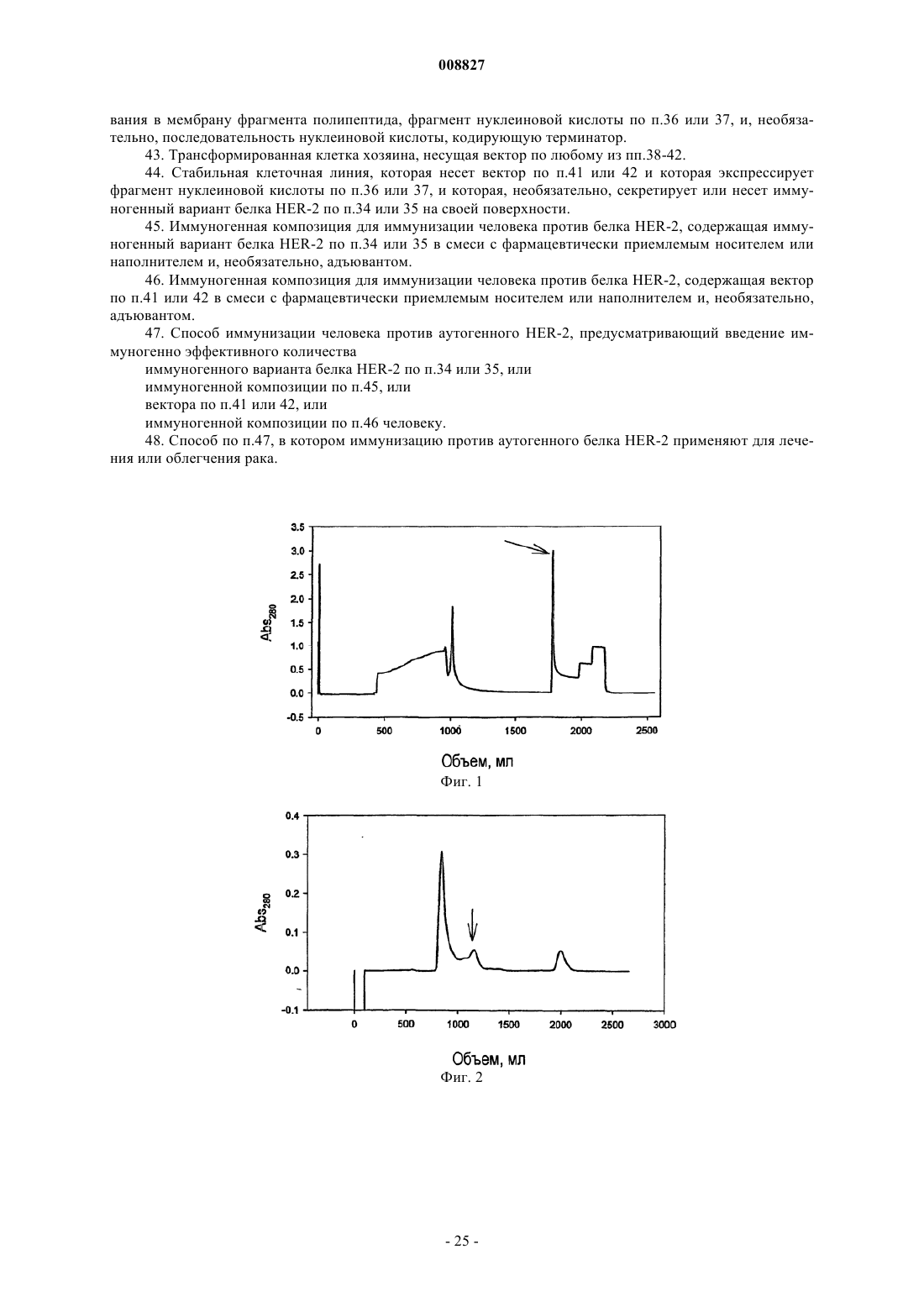
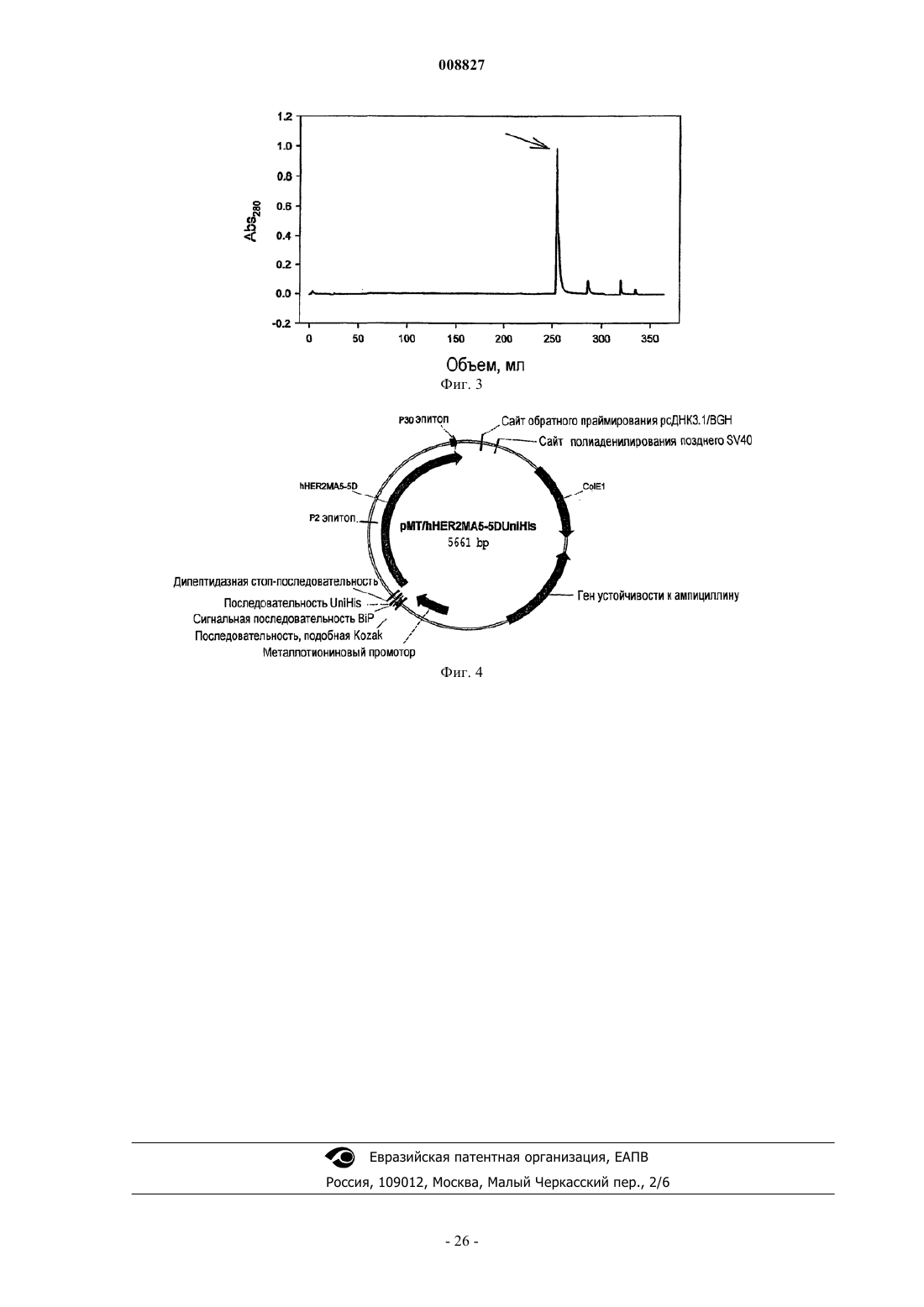
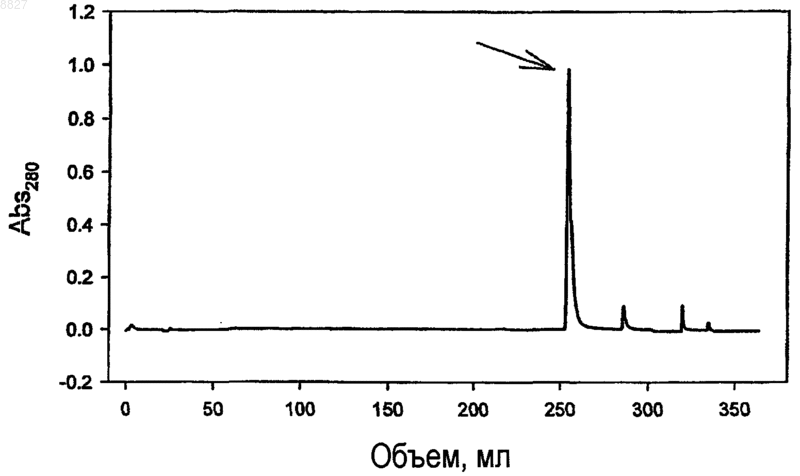
008827 Область техники, к которой относится изобретение Настоящее изобретение относится к области аффинной очистки белков. Более конкретно, настоящее изобретение относится к улучшениям в металло-аффинной очистке белков, особенно, в очистке белков, тагированных гистидином (имеющих на конце гистидиновую последовательность (таг, или обогащенных гистидином, которые созданы рекомбинантным способом в клетках насекомых. Настоящее изобретение также относится к специфическим схемам очистки, подходящим для вариантов тагированных гистидином белков, производных семейства EGFR (рецепторов эндотелиального фактора роста) белков,особенно ассоциированного с раком антигена HER-2. Кроме того, настоящее изобретение относится к иммуногенному варианту человеческого HER-2,который способен вызывать иммунный ответ у людей, который также нацелен на нативную человеческую молекулу HER-2. Уровень техники Ассоциированный с раком мембранный белок HER-2 является членом семейства EGFR белков. Этот конкретный белок является перспективным в качестве иммуногена при активной селективной иммунотерапии некоторых видов рака, в особенности, рака молочной железы и рака ободочной и прямой кишки. Правопреемник настоящей заявки на патент предварительно подал заявки на патент, имеющие отношение к активной вакцинации против антигена HER-2, см. WO 00/20027, которые включены в настоящее описание во всей своей полноте в качестве ссылки. Кроме того, исследования в этой области привели в настоящее время к идентификации предпочтительных вариантов HER-2 для таких вакцин, но основной задачей в химии белков является разработка улучшенных средств для получения достаточного количества рекомбинантного белка с высокой степенью чистоты. Аффинная хроматография с иммобилизованным ионом металла (IMAC) впервые была введена Porath (Porath J., J.Carlsson, I.Olsson, G.Belfrage [1975] Nature 258:598-599) под названием металлохелатная хроматография, и ранее обсуждалась в нескольких статьях (Porath J. [1992] Protein purification and expression 3:263-281; и статьях, цитированных в этой работе). Процесс очистки IMAC основан на использовании хелатной матрицы, загруженной мягкими ионами металлов, такими как Cu2+ или Ni2+. Электронодонорные группы на поверхности белков, особенно имидазольная боковая цепь гистидина, могут связываться с некоординированными участками загруженного металла. Взаимодействие между электронодонорной группой и металлом может быть обращено понижением рН или путем замещения имидазолом. Таким образом, белок, имеющий электронодонорные группы, такие как гистидин, может быть очищен при помощи обратимых взаимодействий металлокомплекс/белок. В 1991 г. Ford и др. (Ford С., I.Suominen, C.Glatz [1991] Protein Expression and Purification 2:95-107) описали очистку белка с использованием технологии IMAC (лиганда Ni-NTA), как применимую к рекомбинантным белкам, имеющим хвосты с гистидиновыми остатками (полигистидиновые рекомбинантные белки, "His-тагированные белки"). Этот способ имеет преимущество, заключающееся в том, что два или более гистидиновых остатка могут объединяться для формирования очень сильных комплексов с ионами металлов. Существует множество вариантов этого способа, в которых гистидиновые остатки прикрепляют в виде "тагов" к релевантному рекомбинантному белку в различных комбинациях, например, включающих в себя участки узнавания специфических протеаз с тем, чтобы his-таг мог быть впоследствии ферментативно удален. Экспрессия белков в клетках насекомых требует использования множества специализированных культуральных сред, а также вызывает загрязнение рекомбинантного белка различными составляющими,производными клетки насекомого, которые не обнаруживаются в клетках бактерий, грибов и млекопитающих. Следовательно, схемы очистки, разработанные для рекомбинантных белков, продуцированных в клетках бактерий, грибов или млекопитающих, безусловно, не являются оптимальным выбором, если необходимо очистить белок, продуцированный в клетках насекомых. Таким образом, продолжает существовать необходимость в улучшении очистки белков для получения фармацевтически качественного белка, полученного в процессе рекомбинантного продуцирования в клетках насекомых. Цель изобретения Целью настоящего изобретения является обеспечение улучшенного способа для очистки рекомбинантного белка семейства EGFR, экспрессированного в клетках насекомого. Другой целью настоящего изобретения является обеспечение иммуногенного варианта белка HER-2, который является пригодным,например, для лечения рака при помощи специфической активной иммунотерапии. Сущность изобретения Авторы настоящего изобретения разработали новый способ очистки белка семейства EGFR до степени чистоты, которая допустима для фармацевтического применения, в особенности для применения в качестве агентов вакцины. Следовательно, в одном из аспектов настоящее изобретение относится к способу очистки белка,производного семейства EGFR, причем указанный белок рекомбинантно продуцируют в культуре клеток-1 008827 насекомых, и указанный белок представляет собой белок, который является подходящим для очистки при помощи аффинной хроматографии с иммобилизованным металлом, при этом способ содержит получение из указанной культуры клеток насекомых по существу бесклеточного образца, содержащего указанный белок, производный семейства EGFR, и последующее обогащение указанного белка, производного семейства EGFR, при помощи этапов диафильтрации и замены культуральной среды буфером,аффинной хроматографии с иммобилизованным металлом (IMAC),эксклюзионной хроматографии (SEC),анионообменной хроматографии (AIE). Другой аспект настоящего изобретения относится к иммуногенному варианту белка HER-2, который содержит аминокислотную последовательность, приведенную в SEQ ID NO: 2, остатки 17-677. Краткое описание чертежей Фиг. 1 - хроматографический профиль IMAC, стрелка указывает на пик 104.1; фиг. 2 - хроматографический профиль SEC, стрелка указывает на пик мономера; фиг. 3 - хроматографический профиль AIE, стрелка указывает на пик 104.1; фиг. 4 - pMT/hHER2MA5-5DUniHis вектор р 992, карта плазмиды.hHER2MA5-5D: ген, кодирующий белок hHER2MA5-5DUH (нуклеотиды 3604-5592). Р 2 эпитоп: последовательность, кодирующая Р 2 эпитоп в белке hHER2MA5-5DUH (нуклеотиды 4357-4401). Р 30 эпитоп: последовательность, кодирующая Р 30 эпитоп в белке hHER2MA5-5DUH (нуклеотиды 5500-5562). Сайт полиаденилирования позднего SV40: полиА сигнал (нуклеотиды 263-268).ColE1: участок инициации репликации для репликации Е. coli (нуклеотиды 701-1434). Ген устойчивости к ампициллину: ген, наделяющий бактерию устойчивостью к ампициллину (нуклеотиды 1579-2439). Металлотионеиновый промотор: промотор, который может быть индуцирован несколькими соединениями (например, кадмием) (нуклеотиды 3050-3415).HER-2 для секреции во внеклеточное пространство (нуклеотиды 3502-3555).UniHis последовательность: последовательность, кодирующая UniHis таг, используемый для очистки белка AtoVac HER-2 (нуклеотиды 3556-3597). Дипептидазная стоп-последовательность: используемая в случае, если от белка AtoVac HER-2 должен быть отщеплен свободный конец UniHis (нуклеотиды 3598-3603). Подробное раскрытие изобретения Ниже определены некоторые термины и выражения в контексте настоящего изобретения."Белок, производный семейства EGFR", означает белок, который гомологичен или идентичен человеческому EGFR (или ErbB-1); человеческому HER-2/neu (ErbB-2); HER-3 (ErbB-3); или HER-4 (ErbB-4)."Аутогенный" белок семейства EGFR в настоящей спецификации и формуле изобретения предназначен для обозначения полипептида семейства EGFR животного, которое предназначено для вакцинации против его собственного белка семейства EGFR. Другими словами, предполагается, что указанный термин является релевантным только в случае, если он относится к животному, предназначенному для вакцинации. Термины "Т-лимфоцит" и "Т-клетка" могут быть использованы взаимозаменяемо для лимфоцитов тимического происхождения, которые восприимчивы к различным клеточно-опосредованным иммунным ответам, а также к функциям эффектора, таким как хелперная активность в гуморальном иммунном ответе. Аналогично, термины "В-лимфоциты" и "В-клетки" могут быть использованы взаимозаменяемо для лимфоцитов, продуцирующих антитела."Антиген-представляющая клетка" (АРС) представляет собой клетку, которая представляет эпитопы Т-клеток. Обычные антиген-представляющие клетки являются макрофагами, дендритными клетками и другими фагоцитирующими и пиноцитирующими клетками. Следует отметить, что В-клетки также функционируют как АРС путем представления ТH эпитопов, связанных с молекулами II класса МНС в ТH клетках, но в случае обычного применения в настоящем описании и формуле изобретения термин АРС предназначен для обозначения вышеуказанных фагоцитирующих и пиноцитирующих клеток."Т-лимфоциты-хелперы" или "ТH клетки" означают CD4 позитивные Т-клетки, которые помогают В-клеткам и цитотоксическим Т-клеткам связываться с молекулами II класса МНС или антигенпредставляющими клетками путем узнавания ТH эпитопов. Термин "цитотоксический Т-лимфоцит" (CTL) применяется для СD8-позитивных Т-клеток, которым для активации необходима помощь ТH клеток."Специфический" иммунный ответ в настоящем контексте предназначен для обозначения поликлонального иммунного ответа, направленного в основном против молекул или групп квазиидентичных мо-2 008827 лекул или, в качестве альтернативы, против клеток, которые представляют эпитопы CTL молекул или групп квазиидентичных молекул. Термин "полипептид" в настоящем контексте предназначен для обозначения как коротких пептидов от 2 до 10 аминокислотных остатков, олигонуклеотидов от 11 до 100 аминокислотных остатков, так и полипептидов с более чем 100 аминокислотными остатками. Кроме того, термин также предназначен для обозначения белков, т.е., функциональных биомолекул, содержащих по меньшей мере один полипептид; причем при содержании по меньшей мере двух полипептидов они могут формировать комплексы, быть ковалентно связанными, или могут быть нековалентно связанными. Полипептид(полипептиды) в белке могут быть гликозилированными и/или липидизированными и/или содержать простетические группы. Термин "подпоследовательность" означает любой последовательный фрагмент из по меньшей мере 3 аминокислот, или, если это обосновано из по меньшей мере 3 нуклеотидов, выделенных непосредственно из аминокислотной последовательности или последовательности нуклеиновых кислот естественного происхождения, соответственно. Под термином "понижающая регуляция аутогенного белка семейства EGFR" в настоящем описании подразумевается снижение в живых организмах количества и/или активности релевантного белка семейства EGFR. Понижающая регуляция может быть достигнута при помощи нескольких механизмов, включающих в себя удаление СЕА макрофагоцитами (например, макрофагами и другими фагоцитирующими клетками), и, что более важно, у животных CTL убивают клетки, несущие или скрывающие антиген. Термин "иммуноген" предназначен для обозначения субстанции, способной индуцировать иммунный ответ у конкретного животного. Следовательно, следует принять во внимание, что аутогенный белок семейства EGFR не является иммуногеном в аутогенном хозяине - необходимо использовать или сильный адъювант и/или совместно присутствующие эпитопы Т-хелперов с аутогенным белком для поддержания иммунного ответа против аутогенного белка, и в таком случае "иммуноген" представляет собой композицию частиц, способных разрушить аутотолерантность. Термин "иммуногенно эффективное количество" имеет свое обычное значение в данной области техники, т.е., количество иммуногена, способное индуцировать иммунный ответ, который в значительной степени поражает патогенные агенты, имеющие общие с иммуногеном иммунологические признаки. Термин "фармацевтически приемлемый" имеет свое обычное значение в данной области техники,т.е., используется для субстанции, которая может быть применена в виде части лекарственного средства для применения человеком при лечении рассматриваемого заболевания и, таким образом, термин фактически исключает применение высокотоксичных веществ, которые могут скорее ухудшить, а не улучшить состояние пациента, проходящего курс лечения."Чужеродный Т-клеточный эпитоп" представляет собой пептид, который способен связываться с молекулой МНС и который стимулирует Т-клетки у животных видов. Предпочтительные чужеродные эпитопы представляют собой "разнородные" эпитопы, т.е., эпитопы, которые связываются со значительной частью молекул II класса МНС у животных видов или популяции. Для эпитопа такого типа термин,который в данной области техники часто используется взаимозаменяемо, представляет собой термин"универсальные Т-клеточные эпитопы". Известно только очень ограниченное количество таких разнородных Т-клеточных эпитопов, и более подробно они будут рассмотрены ниже. Следует отметить, что для того, чтобы иммуногены, используемые согласно настоящему изобретению, были эффективными в большой части популяции животных, насколько это возможно, может быть необходимым 1) введение нескольких чужеродных Т-клеточных эпитопов в одну и ту же модель или 2) подготовка нескольких моделей, причем каждая модель имеет различные разнородные встроенные эпитопы. Следует отметить, что концепция чужеродных эпитопов также охватывает применение латентных Т-клеточных эптопов, т.е.,эпитопов, которые выделены из своего белка и которые вызывают иммуногенное поведение только в случае их присутствия в изолированной форме без вхождения в состав своего рассматриваемого белка."Чужеродный эпитоп Т-лимфоцита-хелпера" (чужеродный ТH эпитоп) представляет собой чужеродный Т-клеточный эпитоп, который связывается с молекулой II класса МНС и может присутствовать на поверхности антиген-представляющей клетки (АРС), связанной с молекулой II класса МНС. Следовательно, также необходимо отметить, что свойство "чужеродности" имеет два аспекта: чужеродный эпитоп ТH 1) представлен в рассматриваемом контексте II класса МНС у животных, 2) чужеродный эпитоп не является производным того же самого полипептида, что и целевой антиген для иммунизации; таким образом, эпитоп является также чужеродным для целевого антигена.CTL эпитоп" представляет собой белок, который способен связываться с молекулой I класса МНС. Термин "адъювант" имеет свое обычное значение в области технологии вакцин, т.е., субстанция или композиция веществ, которые 1) не способны сами по себе вызывать специфический иммунный ответ против иммуногена вакцины, но которые 2) тем не менее, способны усиливать иммунный ответ против иммуногена. Или, другими словами, вакцинация только одним адъювантом не обеспечивает иммунного ответа против иммуногена, вакцинация иммуногеном может вызывать или может не вызывать иммунный ответ против иммуногена, но объединенная вакцинация иммуногеном и адъювантом индуцирует иммунный ответ против иммуногена, который сильнее иммунного ответа, индуцированного только иммуногеном.-3 008827 Диафильтрация" представляет собой способ, использующий ультрафильтрационные мембраны для удаления соли или растворителя, замены буферов или разделения на фракции биомолекул, различающихся по размеру, в макромолекулярных растворах. Макромолекулы, удержанные ультрафильтрационной мембраной, концентрируют до тех пор, пока не будут удалены растворитель и низкомолекулярные виды. Однако простое концентрирование макромолекулярного образца полностью не удаляет более мелкие виды. Следовательно, более мелкие виды должны быть "вымыты" из образца с использованием многочисленных объемов для промывания (диафильтрация). После процесса диафильтрации образец может быть концентрирован для дальнейшего анализа или очистки. Это является преимуществом по сравнению с гель-фильтрацией или диализом, когда образец может быть разбавлен во время отдельного процесса,требующего дополнительного этапа концентрации. При использовании диафильтрации отсутствуют потери или загрязнение, что может иметь место в двухэтапном процессе."Аффинная хроматография с иммобилизованным металлом" (IMAC) представляет собой способ хроматографии, в котором очищают белки последовательно в соответствии с их аффинностью к некоторым двухвалентным ионам металла, см. описание в разделе "Уровень техники". Эксклюзионная хроматография" (SEC) представляет собой способ хроматографии, в котором белки и другие макромолекулы фракционируются согласно их физическому размеру. Небольшие молекулы остаются в порах матрицы и, следовательно, элюируют медленно, тогда как большие молекулы не проникают в поры и, следовательно, элюируют из матрицы раньше."Анионообменная хроматография" (AIE) представляет собой способ хроматографии, в котором молекулы, имеющие суммарный отрицательный заряд, остаются на матрице колонки и, следовательно,элюируют путем замещения аниона из буфера для элюции или путем изменения суммарного заряда белка. Описание предпочтительных вариантов осуществления Настоящее изобретение относится к процессу очистки, который приспособлен специально для очистки белков, производных семейства EGFR, которые были рекомбинанто продуцированы в клетках насекомых. Настоящее изобретение было разработано в связи с деятельностью, которая привела к получению иммуногенных вариантов человеческого антигена HER-2, ассоциированного с раком, эти варианты продуцировали в системе экспрессии DES, в системе экспрессии, принадлежащей GlaxoSmithKline, и продаваемой, например, Invitrogen. Система использует клетки дрозофилы S2 и специализированные векторы. Однако использование клеток S2 в качестве клеток хозяина для рекомбинантного продуцирования выявило ряд проблем, требующих решения, относительно рассматриваемого варианта HER-2, и эти проблемы были решены с использованием изобретенного способа (например, проблема совместной миграции белков, которые выделены из клеток S2). Конкретный белок, который использовался в примерах, представляет собой вариант человеческогоHER-2, который является у людей иммуногенным; вариант включает в себя аминокислотную последовательность, приведенную в SEQ ID NO: 2, остатки 17-677. Однако поскольку такая аминокислотная последовательность сама по себе не является подходящей для IMAC, она содержит N-терминальный гистидиновый таг (аминокислотные остатки 1-14 в SEQ ID NO:1), который может быть отщеплен аминодипептидазой (дипептидилпептидазой I, DPPI, например, Predersen J и др., 1999, Protein Expression and Purification 15, 389-400). Стоп-последовательность для диаминопептидазы содержит остатки 15 и 16 в SEQID NO:2. Следовательно, обычно способ прямой очистки является особенно подходящим для белков, производных семейства EGFR, которые содержат гетерологичную аминокислотную последовательность, облегчающую очистку при помощи IMAC. Такая последовательность может быть нативной для белков,производных семейства EGFR, но чаще она представляет собой гетерологичную аминокислотную последовательность (т.е., не связанную естественным образом с белком, производным семейства EGFR). Предпочтительные аминокислотные последовательности для этой цели обогащают гистидиновыми остатками (например, His6-тагом или другими аминокислотными последовательностями с несколькими последовательными остатками гистидина). Наиболее предпочтительная гетерологичная аминокислотная последовательность, которая облегчает очистку при помощи IMAC, представляет собой последовательность, содержащую остатки 1-14 SEQ ID NO:2. Белок, производный EGFR, подвергаемый разработанному процессу, предпочтительно представляет собой белок, который содержит значительную часть аминокислотной последовательности человеческого EGFR или человеческого HER-2, и особенно предпочтительным является то, что эту значительную часть в основном выделяют из внеклеточной части человеческого EGFR или человеческого HER-2. Наиболее предпочтительным является вариант человеческого HER-2, и в наиболее предпочтительных вариантах осуществления вариант человеческого HER-2 содержит по меньшей мере один чужеродный эпитоп Т-клетки-хелпера. Как указывалось выше, изобретенный процесс разработан в связи с работой над рекомбинантым продуцированием некоторых вариантов человеческого антигена HER-2. Эти варианты характерны тем,что включают разнородные чужеродные эпитопы Т-хелперов, которые вводят в аминокислотную последовательность внеклеточного домена человеческого HER-2. Предпочтительные варианты человеческогоHER-2 содержат эпитопы столбнячного анатоксина Р 2 (остатки 269-282 SEQ ID NO:2) и Р 30 (остатки 649-669 SEQ ID NO:2), и наиболее предпочтительный вариант осуществления имеет аминокислотную последовательность, которая состоит из остатков 1-667 SEQ ID NO:2. Диафильтрация/замена буфера Этап диафильтрации/замены буфера проводят при температуре от примерно 2 до примерно 25 С. Однако предпочтительно используется температура в более низкой части указанного диапазона, например температура ниже 20 С, такая как ниже 15 или ниже 10 С. Наиболее предпочтительная температура находится в диапазоне от 2 до 9 С, например, в диапазоне от 3 до 9 С с наиболее предпочтительным диапазоном температур от примерно 3 до примерно 8 С, и особенно предпочтительным от 4 до примерно 6 С. При более высоких температурах (например, выше 10 С) существует тенденция агрегации белков, и это может быть нейтрализовано добавлением детергента, такого как детергент типа Твин. Обычно диафильтрацию выполняют в два этапа так, чтобы сначала концентрировать макромолекулярные соединения в образце культуральной среды и затем заменить культуральную среду буфером. Эти процедуры осуществляют, следуя стандартным процедурам в данной области техники, также см. примеры. Предпочтительным является то, что этап концентрирования в результате приводит к увеличению концентрации макромолекулярных соединений в 2-25 раз, например к увеличению концентрации в 2-20 раз, в 3-15 раз, в 3-10 раз. Предпочтительное концентрированно макромолекулярных соединений составляет от 4 до 8 раз, и наиболее предпочтительное концентрирование составляет примерно 5 раз, или до общей концентрации белка среды, не превышающей 3 мг/мл или предпочтительно не превышающей 2 мг/мл. Замену буфера обычно проводят в два последовательных этапа, из которых первый происходит при рН по меньшей мере 6,5 и по большей мере 7,2 и из которых второй происходит при рН по меньшей мере 7,0 и по большей мере 8,0. Однако возможно выполнение обоих этапов при одном и том же рН в перекрывающихся частях двух диапазонов. Обычно замену буфера выполняют с использованием фосфатного буфера. После завершения замены буфера жесткость последующих этапов предпочтительно увеличивается путем добавления агента в образец, который конкурирует при связывании с хроматографической матрицей на этапе IMAC для того, чтобы уменьшить количество незначимого связывания с загрязняющими составляющими. Например, для увеличения жесткости может быть добавлен имидазол, гистидин или буфер с высокой концентрацией соли в образец, подвергнутый диафильтрации и замене буфера. Предпочтительно при использовании имидазола его добавляют для увеличения концентрации в пределах между примерно 0,05 и примерно 20 мМ, предпочтительно в пределах от примерно 0,5 до примерно 15 мМ,например в пределах от примерно 1 до примерно 10 мМ. Особенно предпочтительной является концентрация имидазола в пределах от примерно 2 до примерно 9 мМ, например концентрация от примерно 3 до примерно 8 мМ. Наиболее предпочтительной является концентрация имидазола от примерно 4 до примерно 6 мМ, например концентрация примерно 5 мМ. При использовании буфера с высокой концентрацией соли (часто NaCl) концентрация находится в пределах от 100 мМ до примерно 1 М. Также предпочтительным является добавление детергента в образец, подвергнутый диафильтрации и замене буфера, перед этапом IMAC. Детергент обычно может быть выбран из полиоксиэтиленового эфира сорбита и жирной кислоты, например Твин-20, Твин-40, Твин-60, Твин-80 и Твин-85, алкиларильного полиэфирного спирта, например Тритон Х-100, неионного детергента и детергента на основе углеводородов, например, октилгликозида. Преимущественно детергент добавляют для увеличения концентрации от примерно 0,05% (об./об.) до 10% (об./об.), например 0,1% (об./об.).IMAC Этап IMAC включает внесение в хроматографическую среду ионов двухвалентного металла до нанесения на нее образца с замененным буфером. Обычно ион двухвалентного металла выбирают из группы, состоящей из Ni2+, Cu2+, Zn2+, Co2+ и Fe2+. Предпочтительно двухвалентный металл представляет собой Zn2+. Элюцию хроматографической среды в IMAC выполняют путем применения к хроматографической среде (обычно в хроматографической колонке) имидазола, гистидина, буфера с высокой концентрацией соли или путем изменения рН. Например, при использовании для элюции имидазола это преимущественно выполняют путем применения имидазола на одном этапе с концентрацией между примерно 50 мМ и примерно 500 мМ (например, между 100 и 400 мМ), предпочтительно с концентрацией примерно 200 мМ. В качестве альтернативы, при использовании гистидина, это выполняют путем применения гистидина на одном этапе с концентрацией между примерно 20 мМ и 400 мМ (например, между 50 и 200 мМ),предпочтительно примерно 100 мМ. Буфер с высоким содержанием соли обычно содержит NaCl с концентрацией до примерно 1 или даже 2 М.SEC Средний размер пор матрицы SEC предпочтительно представляет собой размер, который разделяет глобулярный белок между 10 и 600 кДа.-5 008827 После нанесения образца на матрицу элюцию проводят фосфатным буфером или трис-буфером,или, в качестве альтернативы, биологическим буфером, таким как HEPES. Предпочтительным буфером является трис-буфер. Во время SEC pH поддерживают в пределах от примерно 7 до примерно 8, и предпочтительно pH сохраняют при примерно 7,5. Если это релевантно и необходимо (т.е., при использовании фосфатного буфера на этапе SEC), образцы, содержащие белок, производный семейства EGFR, полученный из SEC, разбавляют перед этапомAIE, для доведения концентрации фосфатов до менее чем 15 мМ, например, в пределах между 10 и 12,5 мМ. Однако удивительным является то, что AIE вообще можно выполнять, используя такую концентрацию фосфатного буфера.AIE Окончательным этапом процедуры очистки согласно настоящему изобретению является по меньшей мере один этап AIE, в которой AIE выполняют с использованием ионообменной матрицы с сильным анионом - в предпочтительных вариантах осуществления, также существует предшествующий этап,включающий использование ионообменной матрицы со слабым анионом. Это предпочтительно включает загрузку образца, содержащего белок, производный семейства EGFR, полученный после SEC на ионообменную матрицу с сильным или слабым анионом. Обычно элюцию выполняют буферизованным (фосфатом, трис или биологическим буфером, например, HEPES) раствором NaCl при pH между 7 и 8, предпочтительно примерно pH 7,5. Белок, полученный в элюате, после этого этапа имеет клиническую степень чистоты и по существу свободен от загрязнений, производных культуры клеток насекомых. Предполагается, что этап AIE, использующий ионообменную матрицу со слабым анионом, может быть применим в качестве этапа между этапами IMAC и SEC, вместо включения его в виде части заключительного AIE этапа. Дополнительные необязательные этапы После диафильтрации предпочтительным является включение этапа вирусной очистки (например,при помощи 2% Твин-20 и 0,3% ТnBP) и, кроме того, предпочтительным является включение этапа фильтрования вирусов после AIE (например, с использованием фильтра Planova 15N или аналогичного фильтра), где оба этапа включены для гарантии того, что полученный в результате продукт является свободным от клинически неприемлемых загрязнений. Однако в случае применения безвирусной системы эти два этапа не являются существенными. Вариант HER-2 настоящего изобретения Как указывалось выше, способ настоящего изобретения был разработан при очистке варианта человеческого антигена опухоли HER-2. Доказано, что этот конкретный вариант является особенно хорошо подходящим в качестве агента вакцины для стимулирования иммунологических реакций против аутогенного HER-2 так, что этот конкретный вариант также является частью настоящего изобретения. В общем случае, специфическое использование, лекарственные средства, рекомбинантное продуцирование, подходящие векторы и клетки хозяина, а также другие детали, характерные для этого специфического варианта HER-2, можно найти в раскрытии WO 00/20027. Следовательно, ниже будет предоставлено только краткое обсуждение, которое, в частности, характерно для указанного варианта. Таким образом, раскрытие WO 00/20027 включено в настоящее описание во всей своей полноте в качестве ссылки и предоставляет необходимое описание, имеющее отношение к иммунизации вариантами HER-2 и общим способам получения их и их лекарственных форм. Также в настоящее описание включено во всей своей полноте в качестве ссылки раскрытие WO 00/20027, относящееся к вакцинации нуклеиновой кислотой против аутогенного HER-2. Как указывалось выше, другой аспект настоящего изобретения относится к иммуногенному варианту белка HER-2, который содержит аминокислотную последовательность, приведенную в SEQ ID NO:2,остатки 17-677. Предпочтительным является то, что этот вариант представляет собой полипептид, который состоит из аминокислотной последовательности, приведенной в SEQ ID NO: 2, остатки 1-677, т.е.,вариант, который также включает гистидинил-обогащенный таг очистки, состоящий из остатков 1-14 вSEQ ID NO:2, и аминопептидазную стоп-последовательность, состоящую из остатков 15 и 16 в SEQ IDNO:2. Также включенным в настоящее описание является фрагмент нуклеиновых кислот, который кодирует этот иммуногенный вариант белка HER-2, такой как ДНК фрагмент. Особенно предпочтительный фрагмент ДНК имеет вариант HER-2, кодирующий последовательность, приведенную в SEQ ID NO:1. Полезными инструментами при рекомбинантном продуцировании вариантов HER-2 являются векторы, несущие фрагмент нуклеиновых кислот настоящего изобретения. Особенно предпочтительным является вектор, способный к автономной репликации. Обычно вектор выбирают из группы, состоящей из плазмиды, фага, космиды, мини-хромосомы и вируса. Особенно предпочтительными являются векторы экспрессии. Обычный вектор экспрессии настоящего изобретения содержит, в направлении 5'3' и в рабочем сцеплении, промотор, запускающий экспрессию фрагмента нуклеиновых кислот настоящего изобретения, необязательно, последовательность-6 008827 нуклеиновых кислот, кодирующую белок-лидер, обеспечивающий возможность секреции или встраивания в мембрану фрагмента полипептида, фрагмент нуклеиновых кислот настоящего изобретения и, необязательно, последовательность нуклеиновых кислот, кодирующую терминатор. Для рекомбинантного продуцирования особенно предпочтительной является клетка хозяина,трансформируемая вектором настоящего изобретения. Особо интересной клеткой хозяина является клетка насекомого, и наиболее предпочтительной являемся клетка хозяина, выделенная из дрозофилы, например, клетка S2. Также частью настоящего изобретения является стабильная клеточная линия, которая несет вектор настоящего изобретения и которая экспрессирует фрагмент нуклеиновых кислот настоящего изобретения, и которая, необязательно, секретирует или несет на своей поверхности иммуногенный вариант белкаHER-2 настоящего изобретения. Кроме того, настоящее изобретение также предоставляет иммуногенную композицию для иммунизации человека против белка HER-2, содержащую иммуногенный вариант белка HER-2, описанный выше, в смеси с фармацевтически приемлемым носителем или наполнителем и, необязательно, адъювантом. Подробности подходящих лекарственных форм можно найти в WO 00/20027. В качестве альтернативы, вакцина может находиться в виде вакцины нуклеиновых кислот (подробности, касающиеся этого способа, см. в WO 00/20027). Таким образом, частью настоящего изобретения также является иммуногенная композиция для иммунизации человека против белка HER-2, содержащая вектор, описанный выше, в смеси с фармацевтически приемлемым носителем или наполнителем и, необязательно, адъювантом. Также объемом настоящего изобретения охвачен способ иммунизации человека против аутогенногоHER-2, причем способ содержит введение человеческому существу иммуногенно эффективного количества иммуногенного варианта белка HER-2, раскрытого в настоящем описании, или иммуногенной композиции, содержащей указанный вариант, или вектора, раскрытого в настоящем описании, или иммуногенной композиции, содержащей указанный вектор. Особенно предпочтительным является то, что этот способ иммунизации (а также различные средства для иммунизации, приведенные в настоящем описании) используются для лечения или облегчения рака. Введение к примерам В нижеследующих примерах используется "104.1 молекула" (например, SEQ ID NO:2), которая представляет собой иммуногенный аналог белка HER-2, ассоциированный с раком. Однако специалистам в данной области техники следует принять во внимание, что общие принципы настоящего изобретения применимы к другим His-тагированным белкам, особенно белкам, продуцированным рекомбинантным способом в клеточных системах насекомых. Процесс очистки состоит из следующих 4 общих этапов очистки: 1. Диафильтрации с заменой буфером ферментационного супернатанта. 2. Аффинной хроматографии с иммобилизованным металлом (IMAC). 3. Гель-фильтрации/эксклюзионной хроматографии (SEC). 4. Анионообменной хроматографии (AIE). Существуют два дополнительных этапа вирусной очистки, включенные в общий предпочтительный процесс, один этап инактивации вирусов и один этап фильтрования вирусов. Диафильтрация/замена буфера Диафильтрация служит трем целям: 1) концентрированию вещества "104.1"; 2) удалению низкомолекулярных веществ из ферментационной среды, которые могут интерферировать с последующим этапом захвата, например, ионов металла; 3) замене буфера на буфер, более подходящий для металлохелатной хроматографии (IMAC). Замена буфера происходит в один или два этапа. Первый этап является заменой на 50 мМ фосфатный буфер рН 7,0; второй этап является заменой на 50 мМ фосфатный буфер рН 7,5, который является необязательным. Если диафильтрацию выполняют при рН 7,5, такая последовательность рН оказывается критической, поскольку переход непосредственно к рН 7,5 приводит к преципитации неидентифицированных компонентов из клеточной ферментационной среды насекомых. Концентрирование выполняют главным образом для уменьшения времени загрузки в последующей IMAC и для уменьшения расхода буфера на этапе замены буфера, и не установлено, что оно является существенным для данного процесса, поскольку последующая IMAC по своей природе представляет собой этап процесса концентрирования. Степень концентрирования составляет в настоящее время примерно 5 раз или до общей концентрации белков среды, не превышающей 3 мг/мл (предпочтительно не превышающей 2 мг/мл), но эксперименты, использующие 10-кратное концентрирование также являются рабочими,если уровень белка не становится слишком высоким, и ожидается, что возможно дальнейшее увеличение, например, в 20 или даже в 25 раз. Кроме того, концентрирование менее чем в 5 раз, описанное в протоколе, может улучшить процесс, поскольку это в последующем может уменьшить время загрузки колонки IMAC.-7 008827 Получение образцов для IMAC Диафильтрат может быть приготовлен перед нанесением на колонку IMAC при помощи добавления имидазола до конечной концентрации 0-10 мМ, если в буфере для элюции используется имидазол; если имидазол (или аналогичное вещество) не добавляли, авторы получали совместно со 104.1 очистку других белков из клеток насекомых. С другой стороны, если элюция проводилась с L-гистидином, вместо этого в буфер для элюции добавляли соль. Кроме того, добавляли (после фильтрации) Твин-20 до конечной концентрации 0,1% (об./об.). До 5% может быть применено на этапе IMAC, и концентрация, превышающая 0,1%, будет приводить к уменьшению формирования димеров. Предполагается, что другие детергенты также являются полезными, например, другие детергенты Твин (Твин 40, 60, 80 и 85).IMAC Вещество 104.1 имеет так называемый His-таг на N-конце, который имеет сродство к комплексообразующим ионам двухвалентных металлов, иммобилизованных на матрице колонки. Критическими параметрами являются выбор иона двухвалентного металла и выбор агента/способа элюции. Ni2+, Сu2+ иZn2+, все, могут быть использованы в качестве хелатообразующего иона металла. Однако Zn2+ обеспечивал хорошее извлечение и меньшее количество примесей. Для элюции захваченного 104.1 может быть использовано несколько стратегий: 1) применение в колонке имидазола; 2) применение в колонке гистидина; 3) применение в колонке буфера с высокой концентрацией соли и 4) изменение рН в колонке. В процессе, предпочтительном в настоящее время, используется элюция с применением 100 мМ Lгистидина на одном этапе. Однако может быть использовано до 50 мМ, но результатом является менее концентрированный 104.1 и более низкое извлечение. Также возможно использование имидазола (применяемого в виде 200 мМ раствора), и также он может быть использован при более низких концентрациях (до 50 мМ) с таким же эффектом извлечения.SEC В нижеприведенном примере описано выполнение SEC в Трис-буфере. Однако оказывается, что также хорошо работает фосфатный буфер, но Трис является более подходящим для последующей AIE,чем фосфатный. При использовании фосфатного или Трис-буфера, содержащего соль, необходимо разбавление элюата SEC перед применением в колонке AIE для уменьшения концентрации фосфатов, и это не является необходимым при использовании только Трис-буфера. Если IMAC была выполнена при концентрации Твин-20, превышающей 0,4%, ее следует довести до 0,4% в SEC, поскольку белок 104.1 не связывается с AIE колонкой, если концентрация Твин-20 превышает 0,2%. Это может отличаться при проведении AIE в других буферных системах. Получение образцов для AIE хроматографии Релевантные фракции из SEC разбавляют водой, 1 объем элюата + 3 объема воды, для уменьшения концентрации фосфатов при использовании фосфатов, поскольку они интерферируют с AIE хроматографией. Этот вопрос также обсуждается в параграфе SEC.AIE хроматография Критическими параметрами являются рН и ионная сила образца и буферных систем. Если SEC проводили в Трис, приготовление образцов (разбавление водой) может быть исключено и объем загрузки (и время загрузки) будет уменьшен. Если AIE проводили в Трис-буфере, содержащем соль, AIE разбавляли в Трис-буфере до тех пор, пока ионная сила не понижалась до 3 мСм/см. Конечный объединенный продукт анализируют при помощи SDS-PAGE, вестерн-блоттинга (WB),ELISA, ВЭЖХ, визуальным осмотром, OD280, рН, амебоцитным лизатом "лимулуса" (LAL) и аминокислотным анализом. Промежуточные продукты анализируют при помощи SDS-PAGE, ELISA и OD280. Как будет очевидно, AIE предпочтительно выполняют в виде двух последовательных этапов, где на первом этапе используется ионообменная матрица со слабым анионом, а на втором этапе используется ионообменная матрица с сильным анионом. Однако следует принять во внимание, что этап, использующий слабую AIE матрицу, может быть введен между этапами IMAC и SEC. Пример 1. Культивирование 104.1 варианта HER-2 Создание клеточной линии Поликлональную культуру клеток S2 Drosophila melanogaster трансфецировали вектором рМТ (система DES, Invitrogen), содержащим ген, кодирующий 104.1 варианта HER-2; полная последовательность нуклеиновых кислот вектора рМТ приведена в SEQ ID NO:1. Клетки параллельно трансфецировали плазмидой, несущей ген, наделяющий резистентностью к гигромицину, предоставляющей возможность использовать гигромицин для отбора трансфецированных клеток. Способ предельных разбавлении использовали для изоляции единичных клеточных клонов, и из выбранной клеточной линии создавали главный банк клеток (МСВ). Получение белка HER-2 AutoVac Восстанавливали физиологическую активность одной пробирки из МСВ в Т-флаконе и распределяли во встряхиваемые колбы, содержащие среду ExCell 420 (JRH) при 25 С для получения достаточного количества биомассы для инокуляции биореактора. Общее количество клеток 45 х 109 разбавляли в 3000 мл с ExCell 420, дополненной 4 мМ глутамином, 0,1% Pluronic F68 и 0,5 мл/л противовспенивателемPD30. 3000 мл использовали для инокуляции биореактора Applicon (рабочий объем 7 л), в котором куль-8 008827 тура росла в течение 3-х дней при 25 С, dO2=50% (100% = насыщение воздухом), рН=6,50,1 (доводили 5% Н 3 РO4 и 0,5 М NaOH), и перемешивали при 170 об./мин. Эту культуру разбавляли ExCell 420, дополненной 4 мМ глутамином, 0,1% Pluronic F68 и 0,5 мл/л противовспенивателем PD30, до общей концентрации клеток 15 х 106 клеток/мл и использовали для инокуляции биореактора Applicon с рабочим объемом 15 л, поддерживающим 25 С, dO2=50% (барботирование чистым кислородом), рН=6,50,1 (доводили 5% Н 3 РO4 и 0,5 М NaOH), и перемешивали при 142 об/мин. Культуру постоянно разбавляли ExCell 420, дополненной 4 мМ глутамином, 0,1% Pluronic F68,до достижения общего объема 10 л. Скорость разбавления регулировали ежедневно для предотвращения падения количества клеток ниже 15 х 106 клеток/л. В культуру вручную добавляли противовспенивательPD30 для поддержания общей концентрации 0,5 мл/л. При завершении наполнения инициировали перфузию из расчета 1 RV/день (объемов реактора в день), используя акустическое устройство удержания клеток BioSep (AppliSens) для предотвращения потери клеток с удаляемой средой. При концентрации клеток 30 х 106 клеток/мл культуру индуцировали путем добавления к культуре и в резервуар со средой всего 2 мкМ CdCl2 (10 мМ исходный раствор). Собирали ферментационную среду, центрифугировали для получения бесклеточного супернатанта и фильтровали через фильтр PALL 0,8/0,22 мкм. Полученный в результате стерильный супернатант хранили либо при -80 С до момента использования (хранение до 3-х месяцев при -80 С не создавало обнаруживаемых проблем со стабильностью), либо хранили при 4 С до одной недели (также без какой-либо обнаруживаемой деградации белка). Культивирование прерывали через 10 дней после индукции и оставшуюся в биореакторе культуральную среду сливали. Пример 2. Диафильтрация/концентрация и замена буфера Перед использованием ферментационный супернатант из примера 1, при хранении при -80 С, медленно оттаивали при 4 С в течение ночи (последние 3-4 ч может выполняться в охлажденной воде), и затем хранили в течение максимум 3-х дней при 4 С. В других случаях ферментационный супернатант использовали непосредственно. Ферментационный супернатант центрифугировали в центрифуге Sorvall RE 5C Plus в пробиркахSCA3000 при 10000 об./мин в течение 15 мин при 4 С. Диафильтрацию проводили в холодной комнате при 53 С на ProFlux M12 (Millipore) с 2 кассетным фильтром Pellicon 30K 0,5 м 2 (Millipore, Cat P2B030A05). До использования фильтр хранили в 0,1 М NaOH. Соответственно, перед диафильтрацией фильтр как следует тщательно промывали водойmilli-Q: стандартный резервуар заполняли водой milli-Q (3 л) и промывали водой, пропуская через фильтр до тех пор, пока в резервуаре не оставалось 200 мл. Эту процедуру повторяли 3 раза до тех пор,пока через фильтр не было пропущено всего 12 л. После этого можно было начинать диафильтрацию. Максимум 15 л ферментационного супернатанта концентрировали примерно в 5 раз или до общей концентрации белка в среде, не превышающей 2 мг/мл, как было измерено калориметрическим способом. Включали рециркуляционный насос. Клапан противодавления следует частично закрыть для того,чтобы давление на выходе соответствовало обратному давлению (например, 0,2 бар). Скорость всасывания регулировали до 30-50%. Разница давления должна составлять 0,7-1,2 бар, поскольку при этом используется максимальная производительность фильтра, и поток через фильтр соответствует 3-4 л/мин(например, давление на входе Р=0,2 бар, давление на выходе Р=0,1 бар, Р=0,8). Давление на входе должно составлять максимум 1,4 бара, учитывая срок годности трубы и производительность. Если требуется более высокое давление на входе, давление рециркуляционного насоса может быть повышено(%), или может быть повышено механическое давление в трубе путем использования более высокого давления в трубе (в масштабе 0-5). Если клапан противодавления закрыт, получают более высокое давление на входе и на выходе. Клапан противодавления никогда не следует закрывать полностью. Затем концентрированный ферментационный супернатант подвергали замене буфера на одном или двух этапах, сначала используя 10 объемов 50 мМ Na2HPO4/NaH2PO4, pH 7,0, и затем, на необязательном втором этапе, 10 объемов 50 мМ Na2HPO4/NaH2PO4, pH 7,5: стандартный резервуар в приборе ProFluxM12 Millipore заполняли буфером до общего объема 3 л, а также заполняли буфером боковой резервуар. Установки прибора такие же, что и при концентрировании образца. Измеряли объем образца с замененным буфером (Vb), и образец извлекали для SDS-PAGE (Sb). Концентрированный образец с замененным буфером делили на части по 11 мл и 50 мл и быстро замораживали до -80 С. Анализ диафильтрата Для гарантии эффективности замены буфера измеряли рН и ионную силу. Общую концентрацию белка оценивали спектрофотометрически при 280 нм в 1 см кювете. Образец, разбавленный в 10 раз (разбавленный в 50 мМ натрийфосфатном буфере рН 7,5) при помощи 50 мМ натрийфосфатного буфера рН 7,5, использовали в качестве контроля (используя аппроксимацию Abs280 1=1 мг/мл общего белка). Концентрацию общего белка дополнительно можно измерять калориметриче-9 008827 ским способом Bradford (BioRad). Удельную концентрацию варианта 104.1 измеряли ELISA, и, кроме того, анализировали диафильтрат при помощи SDS-PAGE, окрашиванием серебром и детектированиемWB-ECL. Комментарии к этапу диафильтрации Важно начинать замену буфера при рН ниже 7,1 перед изменением до рН 7,5. В противном случае преципитируются остаточные компоненты из ферментационной среды. Диафильтрованные образцы хранились при -80 С в течение нескольких месяцев без изменений характеристик в количественном HER-2 ELISA. Однако при оттаивании даже короткое воздействие температурой 37 и 54 С резко уменьшает характеристики диафильтрата в том же ELISA. При хранении при 0 С (лед/вода) и 4 С после оттаивания от -80 С характеристики диафильтрата в ELISA остаются стабильными в течение по меньшей мере 4 ч. После диафильтрации удобно инактивировать любой вирус, который может присутствовать в диафильтрате. Для этого образцы оттаивают при 2-8 С и объединяют, последовательно фильтруя через 1,0/0,45/0,2 мкм фильтры, куда затем добавляют 50% Твин-20 и ТnВР до конечной концентрации 2 и 0,3%, соответственно. Раствор хранят при 2-8 С в течение 16-20 ч при мягком помешивании. Затем раствор фильтруют через фильтр 0,2 мкм до последующего этапа IMAC хроматографии (пример 3). Пример 3. IMAC Общим хроматографическим принципом для IMAC является аффинность между "тагом" в белке и хелатным комплексом иона металла на матрице колонки. Хроматографическая матрица представляет собой POROS 20 МС или, предпочтительно, 50 МС (оба из Applied Biosystems), а хелатообразующий ион металла представляет собой Zn2+. Молекула 104.1 снабжена His-тагом, и буферная система для связывания His-тага с матрицей колонки представляет собой 50 мМ Na2HPO4/NaH2PO4, 0,1% Твин-20, рН 7,5. Загружают 2-4 мг 104.1 на мл материала колонки и затем элюируют с использованием 100 мМ Lгистидина, 50 мМ Na2HPO4/NaH2PO4, рН 7,5, 0,1% Твин-20. В качестве альтернативы, если элюцию выполняют 200 мМ имидазолом, буферная система для связывания также содержит 5 мМ имидазол. Инструмент: рабочая станция VISION (Applied Biosystems). Программное обеспечение: программное обеспечение анализа данных для Vision, BioCad 700E, версия 3, Perseptive Biosystem. Детектирование: УФ поглощение при =280 и 220 нм. Проводимость: 0-200 мСм. рН калиброван при: 7,0 и 10. Температура: процедуру проводили с буфером и колонкой при комнатной температуре (20-24 С) и проводили загрузку образцов на льду и сбор фракций при 10 С. Получение образцов В диафильтрат, содержащий молекулу 104,1, добавляли 800 мМ имидазол до конечной концентрации 5 мМ имидазола, если для элюции в IMAC использовался буфер, содержащий имидазол, тогда как при использовании для элюции в IMAC L-гистидина добавляли Твин-20 до конечной концентрации 0,1%(об./об.). Непосредственно перед нанесением на колонку образец фильтровали под вакуумом через 0,22 мкм фильтр. Образец хранили при 53 С (предпочтительно 4 С) до нанесения на колонку, где его держали на льду после нанесения. Время обработки при комнатной температуре следует минимизировать. КолонкаPOROS 20 МС или 50 МС (предпочтительно) в 16 х 100 мм (20,1 мл) колонке PEEK (Applied Biosystems), упакованной при 2000-2500 фунтов на кв. дюйм - другие колонки в зависимости от масштаба процедуры очистки являются в равной степени пригодными. Программа активации колонки (стриппинг-активация) Поток: 10 мл/мин. 1. 5 CV (объемами колонки) 50 мМ NaPO4 (аббревиатура для Na2HPO2/NaH2PO4) рН 7,5, 0,1% Твин 20 (стриппинг). 2. 5 CV H2O (Milli-Q). 3. 40 CV 100 мM ZnCl2, pH 4,5. 4. 40 CV H2O (Milli-Q). 5. 20 CV 50 мM NaPO4 pH 7,5, 0,1% Твин-20. Колонку следует активировать перед каждым прогоном. Хроматографическая программа Скорость потока 30 мл/мин, загрузка 5 мл/мин. Размер сбора фракций 9 мл, и 5 мл при пике элюции со 100 мМ L-гистидином (или, если применимо, при пике элюции с 200 мМ имидазолом). Собирают в охлажденный (10 С) коллектор для фракций. Раствор, содержащий диафильтрат с инактивированными вирусами, загружали в колонку при 4 С и промывали 20 CV 50 мМ NaPO4 pН 7,5, 0,1% Твин-20, 0,5 М NaCl, затем 5 CV 50 мМ NaPO4 pH 7,5, 0,1% Твин-20 до элюции при помощи 50 мМ NaPO4 рН 7,5, 0,1% Твин-20, 100 мМ гистидина.- 10008827 Фракции объединяли из пика элюции хроматограммы (см. фиг. 1). Сбор начинали в начале пика и собирали всего 50 мл (или 1,5 объема колонки), или фракции объединяли на основании результатов SDSPAGE/WB или ELISA до общего объема 50 мл. Этот пул можно хранить в течение ночи при 53 С или сразу провести SEC. Хранение пула до 7 дней при 53 С, -20 С и ниже -70 С не показывает потери в общем белке после фильтрации через 0,22 мкм фильтр при анализе SDS PAGE и WB-ECL. Санирование колонки Колонку промывали 5 CV 1 М NaOH, 2 М NaCl, затем 10 CV воды. Если необходима дополнительная санация, см. RSP производителя. Колонку хранили в 30% EtOH при 5-30 С. Анализ промежуточных продуктов IMAC Начальный материал, проточные фракции и элюированные фракции анализировали WB-ECL иSDS-PAGE/окрашивание серебром. Анализ пула IMAC Пул анализировали WB-ECL и SDS-PAGE/окрашивание серебром, ВЭЖХ и OD280 (на разбавленном в 10 раз образце). Удельную концентрацию 104.1 определяли ELISA. Пример 4. Гель-фильтрационная хроматография SEC Этап гель-фильтрации проводят в 20 мМ Трис, 0,1% Твин-20, рН 7,5, но Трис можно заменить 50 мМ Na2HPO4/NaH2PO4 в качестве буферной системы. 50 мл из IMAC по примеру 3 загружали при помощи Sooperloop (Pharmacia) на матрицу Superdex 200 prep grad. Инструмент: рабочая станция BioCad 700E для перфузионной хроматографии, оборудованная полупрепаративной проточной ячейкой для уменьшения давления на колонке. Программное обеспечение: программное обеспечение анализа данных для Vision, BioCad 700E, 3 версия, Perseptive Biosystem. Детектирование: УФ поглощение при =280 и 220 нм. Проводимость: 0-200 мСм. рН калиброван при: 7,0 и 10. Температура: буферные системы и колонка находились при комнатной температуре (20-24 С), а образец загружали непосредственно при 4 С. Фракции, содержащие 104.1 мономер, следует поместить в температуру 4 С сразу после сбора, если коллектор не охлаждается. Получение образцов Пул из IMAC в буфере, 50 мМ Na2HPO4/NaH2PO4, 0,1% Твин-20, 100 мМ L-гистидина (или 200 мМ имидазола), рН 7,5, не требует специального приготовления. До загрузки образцы следует держать охлажденными (53 С). КолонкаSuperdex 200 prep grad упаковали в колонку Pharmacia XK 50 х 960 мм (1884 мл) из расчета 15 мл/мин в качестве конечной скорости потока. Максимальная загрузка 50 мл. Хроматографическая программа Общая скорость потока 8 мл/мин, загрузка 5 мл/мин Размер фракций 9,0 мл 1. Уравновешивание: 1,5 CV 20 мМ трис, 0,1% Твин-20, рН 7,5 2. Загрузка: через 50 мл Superloop, 5 мл/мин 3. Элюция: 1,2 CV 20 мМ трис, 0,1% Твин-20, рН 7,5 Фракции из мономерного пика (см. фиг. 2) объединяли путем сравнения с результатами гельфильтрации и/или МС/ОФ-ВЭЖХ результатами для получения чистого продукта (приблизительно 130 мл). Этот пул можно хранить в течение ночи при 53 С или сразу использовать для AIE хроматографии по примеру 5. Хранение пула до 7 дней при 53 С, -20 С и ниже -70 С не показало потери общего белка после фильтрации через 0,22 мкм фильтр при анализе SDS PAGE и WB-ECL. Санация и очистка колонки Колонку очищали пропусканием 0,5 NaOH в обратном потоке в течение 1-2 ч при 6,5 мл/мин (20 см/ч), затем - буфера в количестве 3 объемов слоя колонки. Для санации прогоняли 0,5-1,0 NaOH в обратном потоке, 13 мл/мин (40 см/ч), в течение 30-60 мин, затем стерильный буфер в количестве 3-5 объемов слоя колонки. Колонку хранили в 20% этаноле при 4-8 С. Дополнительную информацию см. в инструкции производителя. Анализ промежуточного продукта SEC Начальный материал и элюированные фракции анализировали WB-ECL и SDS-PAGE/окрашивание серебром и МС/ОФ-ВЭЖХ. Анализ пула SEC Пул анализировали WB-ECL и SDS-PAGE/окрашиванием серебром, ВЭЖХ и OD280 нм. Удельную концентрацию 104.1 определяли при помощи ELISA. Комментарии к SEC Следует убедиться в том, что между IMAC и загрузкой из Superloop образцы хранятся при 53 С.- 11008827 Если коллектор для фракций не охлаждается (10 С), следует убедиться в том, что фракции перенесены в холодную комнату/холодильник сразу после сбора. Если колонка используется часто, в колонке используется постоянный поток (0,2 мл/мин) 20 мМ трис, рН 7,5, 0,1% Твин-20 (в качестве альтернативы 50 мМ Na2HPO4/NaH2PO4 используется вместо 20 мМ трис, причем в этом случае используется 0,5% Твин-20). Пример 5. Хроматография AIE Первый необязательный этап Сначала необязательно выполняется анионообменная хроматография на колонке с матрицей Poros 50PI. Колонку уравновешивают при помощи 20 мМ Трис-HCl, 0,1% Твин-20 при рН 7,5. После уравновешивания сохраняли образец для тестирования на бионагрузку. Элюат SEC загружали в колонку при 4 С и колонку промывали 20 CV 20 мМ Трис-HCl, 0,1% Твин 20 при рН 7,5 с последующей элюцией продукта при помощи 20 мМ Трис-HCl, 250 мМ NaCl, 0,1% Твин 20, рН 7,5. Пул продукта фильтровали через 0,2 мкм фильтр, анализировали OD280 нм, 104.1 ELISA, ОФВЭЖХ и ВЭЖХ-МС (эксклюзионная ВЭЖХ) и хранили при 2-8 С в течение 3 дней. Колонку Poros 50PI промывали H2O (milli-Q) и очищали 10 CV 2 М NaCl, 1M NaOH перед хранением в 20 мМ NaOH. Ее санировали 5 CV 0,5 М NaOH и промывали H2O (milli-Q) перед уравновешиванием и последующим повторным использованием. Обязательный этап Анионообменную хроматографию выполняли при рН 7,5 (20 мМ Трис), предпочтительно на ионообменной перфузионной матрице с сильным анионом POROS 50HQ (Applied Biosystems) на колонкеPEEK 4,6 х 100 мм (1,662 мл). 104.1 элюировали 200 мМ NaCl. Инструмент: рабочая станция VISION для перфузионной хроматографии. Программное обеспечение: программное обеспечение анализа данных для Vision, BioCad 700E, 3 версия, Perseptive Biosystem. Детектирование: УФ поглощение при =280 и 220 нм. Проводимость: 0-200 мСм. рН калиброван при: 7,0 и 10. Температура: процедуру проводили с буферными системами и колонкой при комнатной температуре (20-24 С), и загружали образец со льда. Коллектор фракций охлаждался до 10 С. Получение образцов Если первый необязательный AIE этап был опущен, промежуточный продукт SEC разбавляли 1+3(до 25%) в воде, содержащей 0,1% Твин-20 при мягком помешивании на магнитной мешалке. В других случаях элюат POROS 50PI разбавляли в 15 объемах 20 мМ Трис-HCl, 0,1% Твин-20 при рН 7,5 для уменьшения проводимости. Образцы следует держать охлажденными (53 С) до и во время загрузки. КолонкаPOROS 50HQ упаковывали в колонку 4,6 х 100 мм (1,662 мл) PEEK (Applied Biosystems) при 20002500 фунтов на кв. дюйм. Хроматографическая программа Общая скорость потока 10 мл/мин, загрузка образца 5 мл/мин. Размер фракций: 9 мл во время загрузки образца, 1 мл во время 1-го этапа элюции и 5 мл во время 2-го этапа элюции. Анионообменную хроматографию проводили на колонке с матрицей Poros 50HQ при 4 С. Колонку уравновешивали 20 мМ Трис-HCl, 0,1% Твин-20 при рН 7,5. После уравновешивания сохраняли образец для тестирования на бионагрузку. Образец загружали на колонку, и колонку промывали 10 CV 20 мМ Трис-HCl, 0,1% Твин-20 при рН 7,5 и 10 CV 20 мМ Трис-HCl, 20 мМ NaCl, 0,1% Твин-20 при рН 7,5 с последующей элюцией продукта 20 мМ Трис-HCl, 200 мМ NaCl, 0,1% Твин-20, рН 7,5. Фракции из пика элюции (см. фиг. 3) объединяли путем сравнения с результатами гель-фильтрации для получения концентрации более чем 2,5 мг/мл или OD280 нм более чем 2,5. Фракции до объединения можно хранить в течение ночи при 53 С. Хранение пула до 7 дней при 53 С, -20 С и ниже -70 С не показало потери общего белка после фильтрации через 0,22 мкм фильтр при анализе при помощи SDSPAGE и WB-ECL. Санация колонки Колонку промывали 10 объемами колонки (CV) 1M NaOH, 2M NaCl затем 20 CV воды. При необходимости в дополнительной санации см. инструкцию производителя. Колонку хранили в 30% этанола при 5-30 С. Анализ Начальный материал, проточные фракции и элюированные фракции анализировали WB-ECL иELISA. Комментарии к AIE Если промежуточный продукт SEC разбавляли менее чем 1+3 (25%), то 104.1 обнаруживали в прогоне фосфатного буфера из AIE в результате интерференции. До 25 мг 104.1 наносили на колонку AIE без обнаруживаемых количеств 104.1 в прогоне. Необязательное фильтрование вирусов Фильтрование вирусов и последующее разбавление и заполнение лекарственной субстанции происходило в среде Class 100. Очищенные предварительным фильтрованием объемы из одного или нескольких прогонов Poros 50HQ извлекали из холодильника и оттаивали при 2-8 С. Затем их фильтровали через 0,1 мкм фильтр и пропускали через фильтрационную мембрану для вирусов Planova 20N. Фильтр сохраняли для тестирования на целостность. Материал, отфильтрованный от вирусов, доводили до концентрации 2,5-3,0 мг/мл путем измерения OD280 нм. Хранение конечного объединенного продукта После фильтрования через 0,22 мкм фильтр конечный объединенный продукт хранили при температуре ниже -70 С в полипропиленовом контейнере или CZ флаконе. Полученный таким образом продукт имел чистоту, подходящую для клинического применения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ очистки белка, производного семейства EGFR, причем указанный белок создают рекомбинантным способом в культуре клеток насекомых, и указанный белок представляет собой белок, который является подходящим для очистки посредством аффинной хроматографии с иммобилизованным металлом, при этом способ предусматривает получение из указанной культуры клеток насекомых, по существу, бесклеточного образца, содержащего указанный белок, производный семейства EGFR, и последующее обогащение указанного белка, производного семейства EGFR, при помощи последовательных этапов диафильтрации и замены культуральной среды буфером,аффинной хроматографии с иммобилизованным металлом (IMAC),эксклюзионной хроматографии (SEC),анионообменной хроматографии (AIE). 2. Способ по п.1, в котором белок, производный семейства EGFR, включает гетерологичную аминокислотную последовательность, которая облегчает очистку при помощи IMAC. 3. Способ по п.2, в котором гетерологичная аминокислотная последовательность имеет высокое содержание гистидиновых остатков. 4. Способ по п.3, в котором гетерологичная аминокислотная последовательность содержит остатки 1-14 SEQ ID NO:2. 5. Способ по любому из предшествующих пунктов, в котором белок, производный семействаEGFR, содержит существенную часть аминокислотной последовательности человеческого EGFR или человеческого HER-2. 6. Способ по п.5, в котором существенную часть в основном выделяют из внеклеточной частиEGFR или HER-2. 7. Способ по п.5 или 6, в котором белок, производный семейства EGFR, представляет собой вариант человеческого HER-2. 8. Способ по п.7, в котором вариант человеческого HER-2 включает по меньшей мере один чужеродный эпитоп Т-клетки-хелпера. 9. Способ по п.8, в котором вариант человеческого HER-2 включает эпитопы столбнячного анатоксина Р 2 (остатки 269-282 SEQ ID NO:2) и Р 30 (остатки 649-669 SEQ ID NO:2). 10. Способ по п.9, в котором вариант человеческого HER-2 включает аминокислотные остатки 17677 SEQ ID NO:2. 11. Способ по п.10, в котором аминокислотная последовательность варианта человеческого HER-2 состоит из остатков 1-677 SEQ ID NO:2. 12. Способ по любому из предшествующих пунктов, в котором этап диафильтрации/замены буфера выполняют при температуре от примерно 2 до примерно 25 С, предпочтительно при температуре от примерно 3 до примерно 8 С, необязательно с добавлением детергента, такого как Твин, если температура превышает 10 С. 13. Способ по п.12, в котором диафильтрацию выполняют в два этапа: сначала для увеличения концентрации макромолекулярных соединений в образце культуральной среды, и затем замены культуральной среды буфером. 14. Способ по п.13, в котором макромолекулярные соединения концентрируют в пределах от примерно 2 до примерно 25 раз.- 23008827 15. Способ по п.14, в котором макромолекулярные соединения концентрируют примерно в 3-5 раз. 16. Способ по любому из пп.12-15, в котором замену буфера выполняют в один или два последовательных этапа, из которых первый происходит при рН по меньшей мере 6,5 и не больше чем 7,2, и второй необязательный этап происходит при рН по меньшей мере 7,0 и не больше чем 8,0. 17. Способ по любому из пп.12-16, в котором для замены буфера используется фосфатный буфер. 18. Способ по любому из предшествующих пунктов, в котором имидазол, гистидин или буфер с высокой концентрацией соли добавляют в образец, подвергнутый диафильтрации и замене буфера, или в котором образец с замененным буфером по существу не изменяют. 19. Способ по п.18, в котором имидазол, если добавляют, то добавляют для достижения концентрации в пределах между примерно 0,05 и примерно 20 мМ. 20. Способ по любому из предшествующих пунктов, в котором детергент, выбранный из полиоксиэтиленового эфира сорбита и жирной кислоты, такого как Твин-20, Твин-40, Твин-60, Твин-80 и Твин-85,алкиларильного полиэфирного спирта, такого как Тритон Х-100, неионного детергента и детергента на основе углеводородов, такого как октилгликозид, добавляют в образец, подвергнутый диафильтрации и замене буфера, для достижения концентрации в пределах между примерно 0,05 и 10% (об./об.), такой как примерно 0,1%. 21. Способ по любому из предшествующих пунктов, в котором этап IMAC включает внесение в хроматографическую среду ионов двухвалентного металла перед нанесением образца с замененным буфером. 22. Способ по п.21, в котором ион двухвалентного металла выбирают из группы, состоящей из Ni2+,2+Cu , Zn2+, Co2+ и Fe2+, предпочтительно Zn2+. 23. Способ по п.21 или 22, в котором элюцию хроматографической среды проводят с применением имидазола, гистидина, буфера с высокой концентрацией соли или изменением рН хроматографической среды. 24. Способ по п.23, в котором элюцию хроматографической среды выполняют с применением имидазола в один этап с концентрацией в пределах между примерно 50 мМ и примерно 500 мМ, предпочтительно с концентрацией 200 мМ, или в котором элюцию выполняют с применением гистидина в один этап с концентрацией в пределах между 20 и 400 мМ, предпочтительно примерно 100 мМ. 25. Способ по любому из предшествующих пунктов, в котором этап SEC включает элюцию фосфатным буфером, или Трис буфером, или биологическим буфером, таким как HEPES. 26. Способ по п.25, в котором поддерживают рН примерно 7-8, предпочтительно примерно 7,5. 27. Способ по п.25 или 26, в котором средний размер пор матрицы SEC разделяет глобулярный белок между 10 и 600 кДа. 28. Способ по любому из предшествующих пунктов, в котором образцы, содержащие белок, производный семейства EGFR, полученные из SEC, при необходимости, разбавляют до этапа AIE для доведения концентрации фосфатов до менее чем 15 мМ, такой как в пределах между 10 и 12,5 мМ. 29. Способ по любому из предшествующих пунктов, в котором этап AIE включает загрузку образца, содержащего белок, производный семейства EGFR, полученного после SEC, на ионообменную матрицу с сильным анионом или со слабым анионом, или и на ту, и на другую. 30. Способ по п.29, в котором элюцию выполняют буферизованным раствором NaCl при рН между 7 и 8. 31. Способ по любому из предшествующих пунктов, в котором этап инактивации вирусов вводят между этапами диафильтрации/замены буфера и IMAC. 32. Способ по любому из предшествующих пунктов, в котором за этапом AIE следует этап фильтрования вирусов. 33. Способ по любому из предшествующих пунктов, в котором этап AIE, использующий ионообменную колонку со слабым анионом, вводят между этапами IMAC и SEC. 34. Иммуногенный вариант белка HER-2, который содержит аминокислотную последовательность,приведенную в SEQ ID NO:2, остатки 17-677. 35. Иммуногенный вариант белка HER-2 по п.34, который состоит из аминокислотной последовательности, приведенной в SEQ ID NO:2, остатки 1-677. 36. Фрагмент нуклеиновой кислоты, который кодирует иммуногенный вариант белка HER-2 по п.34 или 35. 37. Фрагмент нуклеиновой кислоты по п.36, который представляет собой фрагмент ДНК. 38. Вектор, несущий фрагмент нуклеиновой кислоты по п.36 или 37. 39. Вектор по п.38, который способен к автономной репликации. 40. Вектор по п.38 или 39, выбранный из группы, состоящей из плазмиды, фага, космиды, минихромосомы и вируса. 41. Вектор по любому из пп.38-40, который представляет собой вектор экспрессии. 42. Вектор по п.41, содержащий в направлении 5'3' и в рабочем сцеплении промотор, запускающий экспрессию фрагмента нуклеиновой кислоты по п.36 или 37, необязательно, последовательность нуклеиновой кислоты, кодирующую белок-лидер, обеспечивающий возможность секреции или встраи- 24008827 вания в мембрану фрагмента полипептида, фрагмент нуклеиновой кислоты по п.36 или 37, и, необязательно, последовательность нуклеиновой кислоты, кодирующую терминатор. 43. Трансформированная клетка хозяина, несущая вектор по любому из пп.38-42. 44. Стабильная клеточная линия, которая несет вектор по п.41 или 42 и которая экспрессирует фрагмент нуклеиновой кислоты по п.36 или 37, и которая, необязательно, секретирует или несет иммуногенный вариант белка HER-2 по п.34 или 35 на своей поверхности. 45. Иммуногенная композиция для иммунизации человека против белка HER-2, содержащая иммуногенный вариант белка HER-2 по п.34 или 35 в смеси с фармацевтически приемлемым носителем или наполнителем и, необязательно, адъювантом. 46. Иммуногенная композиция для иммунизации человека против белка HER-2, содержащая вектор по п.41 или 42 в смеси с фармацевтически приемлемым носителем или наполнителем и, необязательно,адъювантом. 47. Способ иммунизации человека против аутогенного HER-2, предусматривающий введение иммуногенно эффективного количества иммуногенного варианта белка HER-2 по п.34 или 35, или иммуногенной композиции по п.45, или вектора по п.41 или 42, или иммуногенной композиции по п.46 человеку. 48. Способ по п.47, в котором иммунизацию против аутогенного белка HER-2 применяют для лечения или облегчения рака.
МПК / Метки
МПК: C07K 14/47, C07K 1/16
Метки: her-2, вариантов, очистка
Код ссылки
<a href="https://eas.patents.su/27-8827-ochistka-variantov-her-2.html" rel="bookmark" title="База патентов Евразийского Союза">Очистка вариантов her-2</a>
Предыдущий патент: Вторичные аминоанилиновые пиперидины в качестве антагонистов мкг1 и их применение
Следующий патент: Лекарство, содержащее сильнодействующий бета2-агонист длительного действия в комбинации с другими активными ингредиентами
Случайный патент: Способ отделения и очистки цезия-131 из нитрата бария