3-&beta-d-рибофуранозилтиазоло [4,5-d] пиримидиннуклеозиды и их применения
Номер патента: 8380
Опубликовано: 27.04.2007
Авторы: Леннокс Джозеф Р., Веббер Стефен И., Руден Эрик Дж., Эверетт Деврон Р.
Формула / Реферат
1. Соединение, представленное формулой I
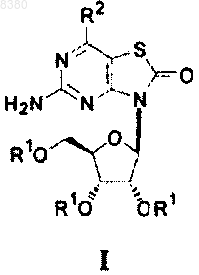
где R1 независимо означает Н, -C(O)R3 или рацемическую L- или D-аминокислотную группу
-С(О)CHNH2R4, где R3 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила, a R4 означает Н или алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила;
R2 означает Н или OR5, где R5 независимо означает Н или алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила; и
где, если R2 означает -ОН, по меньшей мере одна из групп R1 является рацемической, L- или D-аминокислотной группой -C(O)CHNH2R4;
или его фармацевтически приемлемая соль.
2. Соединение или фармацевтически приемлемая соль по п.1, где по меньшей мере одна из групп R1 является рацемической, L- или D-аминокислотной группой -С(О)CHNH2R4, где R4 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила, и где остальные группы R1 означают Н; R2 означает OR5, где R5 независимо выбран из Н или алкила.
3. Соединение или фармацевтически приемлемая соль по п.2, где по меньшей мере одна из групп R1 является L-аминокислотной группой -С(О)CHNH2R4, где R4 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила, и где остальные группы R1 означают Н; R2 означает OR5, где R4 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила.
4. Соединение или фармацевтически приемлемая соль по п.3, где по меньшей мере одна из групп R1 является L-аминокислотной группой -С(О)CHNH2R4, где R4 означает -СН(СН3)2 и где остальные группы R1 означают Н; и R2 означает ОН.
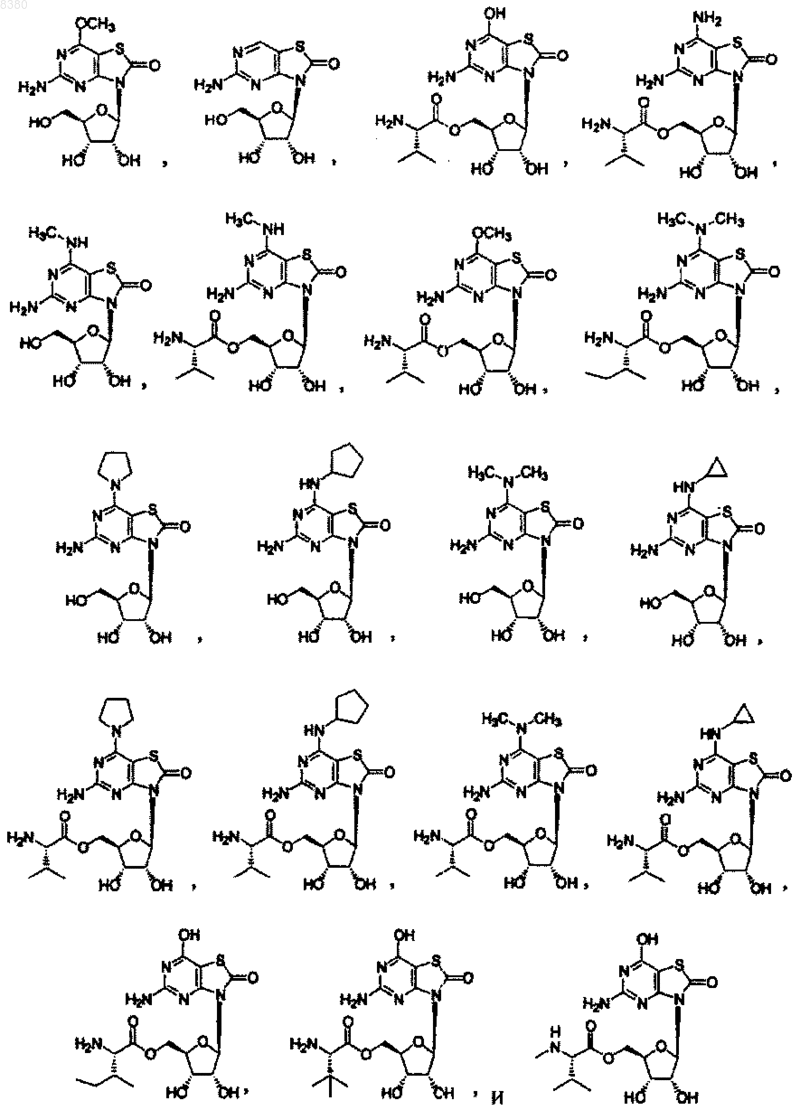
5. Соединение или фармацевтически приемлемая соль по п.1, выбранная из группы, состоящей из
6. Соединение или фармацевтически приемлемая соль по п.1, где R1 независимо означает Н,
-C(O)R3 или рацемическую L- или D-аминокислотную группу -С(О)CHNH2R4, a R2 означает Н, где R3 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила, a R4 означает Н или алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила.
7. Соединение или фармацевтически приемлемая соль по п.1, где R1 означает Н и R2 означает Н.
8. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение, представленное формулой I
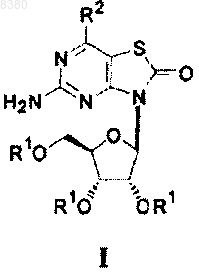
где R1 независимо означает Н, -C(O)R3 или рацемическую, L- или D-аминокислотную группу
-С(О)CHNH2R4, где R3 означает алкил, а R4 означает Н или алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила;
R2 означает Н, OR5, где R5 независимо означает Н или алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила; и
где, если R2 означает -ОН, по меньшей мере одна из групп R1 является рацемической, L- или D-аминокислотной группой -C(O)CHNH2R4;
или его фармацевтически приемлемую соль.
9. Фармацевтическая композиция по п.8, где по меньшей мере одна из групп R1 является рацемической, L- или D-аминокислотной группой -С(О)CHNH2R4, где R4 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила, и где остальные группы R1 означают Н; R2 означает OR5, где R5 независимо выбран из Н или алкила, выбранного из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила.
10. Фармацевтическая композиция по п.9, где по меньшей мере одна из групп R1 является L-аминокислотной группой -C(O)CHNH2R4, где R4 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила, и где остальные группы R1 означают Н; R2 означает OR5, где R5 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила.
11. Фармацевтическая композиция по п.10, где по меньшей мере одна из групп R1 является L-аминокислотной группой -C(O)CHNH2R4, где R4 означает -СН(СН3)2 и где остальные группы R1 означают Н; и R2 означает ОН.
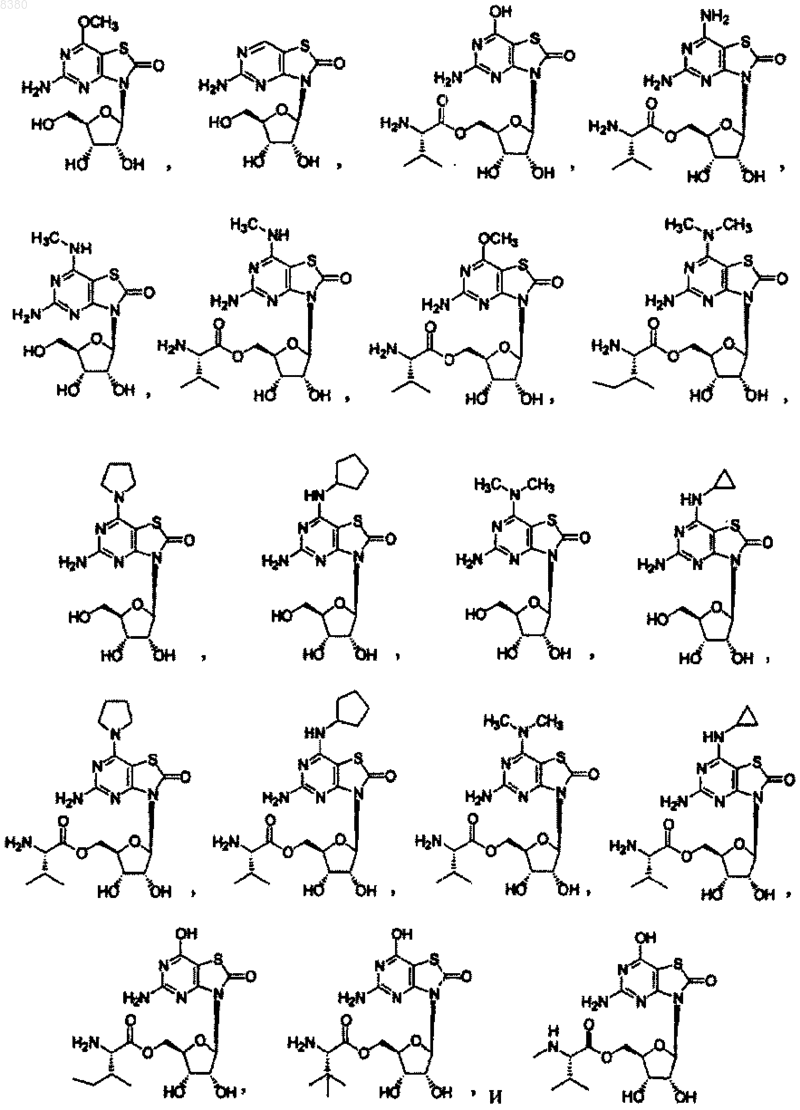
12. Фармацевтическая композиция по п.8, которая выбрана из группы, состоящей из
13. Фармацевтическая композиция по п.8, где R1 независимо означает Н, -C(O)R3 или рацемическую, L- или D-аминокислотную группу -С(О)CHNH2R4, a R2 означает Н, где R3 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила, a R4 означает Н или алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила.
14. Фармацевтическая композиция по п.13, где R1 означает Н и R2 означает Н.
15. Применение соединения или фармацевтически приемлемой соли по пп.1-7 для приготовления лекарственного средства, которое, в случае необходимости, модулирует у пациента активность цитокина.
16. Применение соединения или фармацевтически приемлемой соли по пп.1-7 для приготовления лекарственного средства для лечения вирусных или опухолевых заболеваний.
17. Применение по п.16, где вирусное заболевание вызвано аденовирусом, цитомегаловирусом, вирусом гепатита A (HAV), вирусом гепатита В (HBV), вирусом желтой лихорадки, вирусом гепатита С (HCV), вирусом простого герпеса типа 1 и 2, вирусом опоясывающего лишая, герпесвирусом 6 человека, вирусом иммунодефицита человека (ВИЧ), папилломавирусом человека (HPV), вирусом гриппа А, вирусом гриппа В, вирусом кори, вирусом парагриппа, полиовирусом, поксвирусом, вирусом натуральной оспы и обезьяньим вирусом, риновирусом, респираторно-синцитиальным вирусом (RSV), вирусами, которые вызывают геморрагические лихорадки, аренавирусами, буньявирусами и филовирусами, вирусом энцефалита, вирусом западного Нила, вирусом ЛаКроссе, вирусом Калифорнийскюую энцефалита, вирусом Венесуэльского лошадиного энцефалита, вирусом Восточного лошадиного энцефалита, вирусом Западного лошадиного энцефалита, вирусом Японского энцефалита, вирусом лесов Кизанура и передаваемым клещами вирусом.
18. Применение соединения или фармацевтически приемлемой соли по пп.1-7 для приготовления лекарственного средства для лечения бактериальных, грибковых инфекций или инфекций простейших.
Текст
008380 Данная заявка подана в виде международной заявки на патент РСТ от имени Devron R. Averett иStephen E. Webber, которые являются гражданами и постоянными жителями США, 27 ноября 2002 года,с названиями всех стран, кроме США. Область изобретения Данное изобретение относится к 3D-рибофуранозилтиазоло[4,5-d]пиримидиннуклеозидам и фармацевтическим композициям, содержащим такие соединения, которые имеют иммуномодуляторную активность. Данное изобретение относится также к терапевтическому или профилактическому применению таких соединений и композиций и к способам лечения описанных здесь заболеваний и нарушений путем введения эффективных количеств таких соединений. Предпосылки изобретения Последние несколько десятилетий можно было наблюдать существенные усилия, затрачиваемые на исследование возможных терапевтических применений аналогов D- и L-пуриннуклеозидов. Ряд аналогов нуклеозидов в настоящее время продается в качестве антивирусных средств, в том числе ингибиторы обратной транскриптазы ВИЧ (AZT, ddI, ddC, d4T и 3 ТС). Многочисленные аналоги D- и L-пуриннуклеозидов исследовались также в поиске иммуномодуляторов. Например, было показано, что аналоги гуанозина, имеющие заместители в 7- и/или 8-положениях,стимулируют иммунную систему. См. Reitz et al., J. Med. Chem., 37, 3561-78 (1994); Michael et al., J. Med.Chem., 36, 3431-36 (1993). В другом исследовании, патенте США 5821236, выданном Krenitsky et al.,описаны 6-алкоксипроизводные производных арабинофуранозилпурина, которые применимы для противоопухолевой терапии. В патенте США 5539098, выданном Krenitsky et al., сообщаются ингибиторы вируса ветряной оспы, в том числе 5'-О-пропиониловый и 5'-О-бутириловый эфиры 2-амино-6-метокси 9-(-D-арабинофуранозил)-9 Н-пурина. Было показано, что 7-деазагуанозин и его аналоги проявляют антивирусную активность в мышах против различных РНК-вирусов, даже хотя это соединение не обнаруживает антивирусной активности в клеточной культуре. 3-Деазагуаниннуклеозиды и -нуклеотиды также продемонстрировали значительный широкий спектр антивирусной активности против некоторых ДНК- и РНКвирусов. Revankar et al., J. Med. Chem. 27, 1489-96 (1984). Некоторые 7- и 9-деазагуанин-С-нуклеозиды проявляют способность защищать против летального заражения вирусом лесов Семлики. Girgis et al., J. Med.Chem., 33, 2750-55 (1990). Избранные 6-сульфенамид- и 6-сульфинамидпуриннуклеозиды описаны в патенте США 4328336, выданном Robins et al., как имеющие значительную противоопухолевую активность. Некоторые пиримидо[4,5-d]пиримидиннуклеозиды описаны в патенте США 5041542, выданномRobins et al., в качестве эффективных средств в лечении против L1210 у мышей BDF1. Предполагается,что эти конкретные нуклеозиды являются эффективными вследствие их роли в качестве иммуномодуляторов. См. Bonnet et al., J. Med. Chem., 36, 635-53 (1993). Wang et al. (WIPO International PublicationWO 98/16184) сообщают, что L-нуклеозидные соединения и их аналоги использовали для лечения инфекции,инвазии, неоплазмы, аутоиммунного заболевания или для модуляции аспектов иммунной системы. Кроме того, в патентах с номерами 5041426 и 4880784, выданных Robins et al., описаны 3D-рибофуранозилтиазоло[4,5-d]пиримидины, демонстрирующие существенную иммуноактивность, включающую в себя пролиферацию клеток селезенки мышей и активность in vivo против вируса лесов Семлики. Возможной мишенью иммуномодуляции являются стимуляция или супрессия Тh1- и Тh2-лимфокинов. Клетки типа 1 (Th1) продуцируют интерлейкин 2 (IL-2), фактор некроза опухолей (TNF) и интерферон гамма (IFN), и они являются ответственными, прежде всего, за клеточно-опосредованный иммунитет, такой как аллергическая реакция замедленного типа и антивирусный иммунитет. Клетки типа 2(Th2) продуцируют интерлейкины, IL-4, IL-5, IL-6, IL-9, IL-10 и IL-13, и первично участвуют в содействии гуморальным иммунным реакциям, таким как реакции, наблюдаемые в ответ на аллергены. См., например, Mosmann, Annu. Rev. Immunol., 7, 145-73 (1989). Было показано, что аналоги D-гуанозина индуцируют различные эффекты на лимфокинах IL-1, IL-6, INF и TNF (опосредованно) in vitro (Goodman,Int. J. Immunopharmacol., 10, 579-88 (1988); патент США 4746651, выданный Goodman) и in vivo (Smeeet al., Antiviral Res., 15, 229 (1991); Smee et al., Antimicrobial Agents and Chemotherapy, 33, 1487-92 (1989. Однако способность аналогов D-гуанозина, таких как 7-тио-8-оксогуанозин, модулировать цитокины типа 1 или типа 2 непосредственно в Т-клетках была неэффективной или не была описана. Кроме того, известно, что пероральное введение многих аналогов нуклеозидов создает трудности,возникающие из-за слабой абсорбции, слабой растворимости или деградации в пищеварительном тракте вследствие кислотных или щелочных условий, или действия ферментов, и/или комбинации этих явлений. Таким образом, остается необходимость в аналогах пуриннуклеозидов с улучшенной пероральной доступностью, переносимостью и введением, которые используют для модуляции аспектов иммунной системы. Сущность изобретения Данное изобретение направлено на эту потребность благодаря обнаружению 3D-рибофуранозилтиазоло[4,5]пиримидннуклеозидов, их фармацевтически приемлемых пролекарств, фармацевтически активных метаболитов и фармацевтически приемлемых солей (такие соединения, пролекарства, метаболиты и соли совокупно называют "агентами"), описанных ниже, которые применимы в качестве иммуномодуляторов. В общем аспекте, данное изобретение относится к соединениям формулы I где R1 независимо означает Н, -C(O)R3 или рацемическую, L- или D-аминокислотную группу С(О)CHNH2R4, где R3 означает замещенный или незамещенный алкил, a R4 означает Н или замещенный или незамещенный алкил;R2 означает Н, OR5 или N(R6)2, где R5 независимо означает Н или алкил и где R6 независимо означает Н, замещенный или незамещенный алкил, циклоалкил или вместе с азотом образует замещенное или незамещенное гетероциклоалкильное кольцо; и где, если R2 означает -ОН, по меньшей мере одна из групп R1 является рацемической, L- или D-аминокислотной группой -C(O)CHNH2R4. В предпочтительном варианте данное изобретение относится к соединениям, имеющим формулу I, где по меньшей мере одна из групп R1 является рацемической, L- или D-аминокислотной группой -C(O)CHNH2R4, гдеR4 означает замещенный или незамещенный алкил и где остальные группы R1 означают Н; R2 означает OR5 илиN(R6)2, где R5 независимо выбран из Н или алкила и где R6 независимо означает Н, замещенный или незамещенный алкил, циклоалкил или вместе с азотом образует замещенное или незамещенное гетероциклоалкильное кольцо. В другом предпочтительном варианте данное изобретение относится к соединениям, имеющим формулу I,где по меньшей мере одна из групп R1 является рацемической, L-аминокислотной группой -C(O)CHNH2R4, гдеR4 означает замещенный или незамещенный алкил и где остальные группы R1 означают Н; R2 означает OR5 илиN(R6)2, где R4 означает замещенный алкил и где R6 независимо означает Н, замещенный или незамещенный алкил. Еще в одном предпочтительном варианте данное изобретение относится к соединениям, имеющим формулу I, где по меньшей мере одна из групп R1 является L-аминокислотной группой -С(О)CHNH2R4,где R4 означает -СН(СН 3)2 и где остальные группы R1 означают Н; и R2 означает ОН. В другом аспекте согласно изобретению соединения согласно изобретению выбраны из-2 008380 Данное изобретение относится также к фармацевтически приемлемым пролекарствам, фармацевтически активным метаболитам и фармацевтически приемлемым солям этих соединений, пролекарств или метаболитов формулы I. Описаны также предпочтительные способы получения соединений формулы I. Соединения формулы I применимы в качестве усилителей иммунной системы и имеют определенные свойства иммунной системы, в том числе модуляцию, митогенность, стимуляцию и/или потенциирование, или они являются промежуточными продуктами для соединений, которые имеют эти свойства. Ожидается, что эти соединения будут проявлять действия, по меньшей мере, на природных клеткахкиллерах, макрофагах и лимфоцитах иммунной системы хозяина. Вследствие этих свойств они применимы в качестве антивирусных и противоопухолевых агентов или в качестве промежуточных продуктов для антивирусных и противоопухолевых агентов. Они могут быть использованы для лечения пораженного хозяина в качестве активных ингредиентов подходящих фармацевтических композиций. В одном аспекте согласно изобретению соединения формулы I используют для лечения полного спектра вирусных заболеваний у млекопитающих путем введения млекопитающему терапевтически эффективного количества этих соединений. Вирусные заболевания, рассматриваемые для лечения соединениями формулы I, включают в себя острые и хронические инфекции, вызываемые как РНК-вирусами, так и ДНК-вирусами. Без ограничения каким-либо образом спектра вирусных инфекций, которые можно лечить ими, соединения формулы I применимы, в частности, в лечении инфекций, вызываемых аденовирусом, цитомегаловирусом, вирусом гепатита A (HAV), вирусом гепатита В (HBV), флавивирусами, в том числе вирусом желтой лихорадки и вирусом гепатита С (HCV), вирусом простого герпеса типа 1 и 2,вирусом опоясывающего лишая, герпесвирусом 6 человека, вирусом иммунодефицита человека (ВИЧ),папилломавирусом человека (HPV), вирусом гриппа А, вирусом гриппа В, вирусом кори, вирусом парагриппа, полиовирусом, поксвирусом (в том числе вирусом натуральной оспы и обезьяньим вирусом),риновирусом, респираторно-синцитиальным вирусом (RSV), множественными семействами вирусов,которые вызывают геморрагические лихорадки, в том числе аренавирусами (LCM (вирусом лимфоцитарного хориоменингита), вирусом Хунин, вирусом Мачупо, вирусом Гуанарито и вирусом геморрагической лихорадки Ласса), буньявирусами (вирусами Ханта и вирусом лихорадки долины Рифт) и филовирусами (вирусом лихорадки Эбола и вирусом Марбурга), диапазона вирусных энцефалитов, в том числе вируса западного Нила, вируса ЛаКроссе, вируса Калифорнийского энцефалита, вируса Венесуэльского лошадиного энцефалита, вируса Восточного лошадиного энцефалита, вируса Западного лошадиного энцефалита, вируса Японского энцефалита, вируса лесов Кизанура и вирусов клещевого энцефалита, таких как вирусы геморрагической лихорадки Крыма-Конго. В другом аспекте согласно изобретению соединения формулы I используются для лечения бактериальных, грибковых инфекций и инфекций простейших у млекопитающих путем введения млекопитающему терапевтически эффективного количества этих соединений. Рассматривается полный диапазон патогенных микроорганизмов, которые можно лечить соединениями согласно изобретению, в том числе,без ограничения, тех организмов, которые являются устойчивыми к антибиотикам. Способность соединений формулы I активировать множественные компоненты иммунной системы обходит механизмы устойчивости, которые, как обычно обнаруживают, снижают чувствительность к антибиотикам, и, следовательно, лечение инфекций в млекопитающих, вызываемых такими устойчивыми микроорганизмами, соединениями формулы I является конкретной применимостью согласно изобретению. В другом аспекте согласно изобретению соединения формулы I используют для лечения опухолей у млекопитающих путем введения терапевтически эффективного количества этих соединений. Рассматриваемые опухоли или рак, которые можно лечить этими соединениями, включают в себя опухоли и рак,вызываемые вирусом, и это действие может включать в себя ингибирование трансформации инфицированных вирусом клеток в неопластическое состояние, ингибирование распространения вирусов из измененных вирусом клеток в другие, нормальные клетки, и/или остановку роста измененных вирусом клеток. Ожидается, что соединения формулы I будут полезными против широкого спектра опухолей, в том числе, но не только, карцином, сарком и лейкозов. В этот класс включены карциномы молочной железы,ободочной кишки, мочевого пузыря, легкого, предстательной железы, желудка и поджелудочной железы и лимфобластный и миелоидный лейкоз. В другом аспекте согласно изобретению способ лечения млекопитающего включает в себя введение терапевтически и/или профилактически эффективного количества фармацевтического средства, содержащего соединение согласно изобретению. В этом аспекте действие может относиться к модуляции некоторой части иммунной системы млекопитающего, в частности модуляции активностей цитокинов Тh1 и Th2, в том числе, но не только, семейства интерлейкинов, например IL-1 - IL-12, и других цитокинов,таких как TNF, и интерферонов, в том числе интерферона альфа, интерферона тета и интерферона гамма и их отрицательных эффекторов. Если имеет место модуляция цитокинов Th1 и Тh2, предполагается,что эта модуляция может включать в себя стимуляцию как Тh1, так и Тh2, супрессию обоих Тh1 и Тh2,стимуляцию любого из Тh1 и Th2, стимуляцию либо Th1, либо Тh2 и супрессию второго или бимодальную модуляцию, при которой одно действие на уровни Th1/Th2 (например, генерализованная супрессия) происходит при высокой концентрации, тогда как другое действие (такое как стимуляция либо Th1, либоTh2 и супрессия другого) происходит при более низкой концентрации.-3 008380 В другом аспекте согласно изобретению фармацевтические композиции, содержащие соединение формулы I, вводят в терапевтически эффективной дозе млекопитающему, которое получает противоинфекционные лекарственные средства, не включенные в формулу I. В предпочтительном аспекте согласно изобретению фармацевтические композиции, содержащие соединение формулы I, вводят в терапевтически эффективной дозе с противоинфекционным лекарственным средством (средствами), которые действуют непосредственно на данный инфекционный агент посредством ингибирования роста или уничтожения инфекционного агента. В предпочтительном аспекте согласно изобретению фармацевтическая композиция, содержащая терапевтически эффективное соединение в соответствии с формулой I, обеспечивает улучшенную пероральную доступность и введение в качестве иммуномодулятора. В другом предпочтительном аспекте согласно изобретению фармацевтическая композиция согласно изобретению, содержащая терапевтически эффективное количество соединения в соответствии с формулой I, обеспечивает маскирование активной структуры, когда этот агент проходит через выстилку лимфоидной ткани желудка, минимизируя тем самым активацию этой ткани и обеспечивая улучшенную пероральную переносимость. Краткое описание фигуры Прилагаемая фигура является графическим изображением уровней в плазме изаторибина и интерферона альфа у мышей. Подробное описание изобретения и предпочтительные варианты При использовании в данном описании следующих терминов они используются в определенном ниже значении. Термины "содержащий" и "включающий в себя" используются в их известном, неограничивающем смысле. Термин "нуклеозид" означает соединение, состоящее из любой пентозной или модифицированной пентозной части, присоединенной к специфическому положению гетероцикла, или к природному положению пурина (положение 9) или пиримидина (положение 1), или к эквивалентному положению в аналоге. Термин "пурин" означает азотистые (азотсодержащие) бициклические гетероциклы. Термин "пиримидин" означает азотистые (азотсодержащие) моноциклические гетероциклы. Термин "D-нуклеозиды" относится к нуклеозидным соединениям, которые имеют D-рибозную сахарную часть (например, аденозину). Термин "L-нуклеозиды" означает нуклеозидные соединения, которые имеют L-рибозную сахарную часть. Термин "алкил" в данном контексте относится к алкильной группе с прямой или разветвленной цепью, имеющей 1-12 атомов углерода. Примеры алкильных групп включают в себя метил (Me, который может также структурно изображаться как "/"), этил (Et), н-пропил, изопропил, бутил, изобутил, вторбутил, трет-бутил (tBu), пентил, изопентил, трет-пентил, гексил, изогексил и т.п. Термин "алкокси" означает -О-алкил. Иллюстративные примеры включают в себя метокси, этокси,пропокси и т.п. Термин "галоген" означает хлор, фтор, бром или иод. Термин "гало" означает группы хлора, фтора,брома или иода. Термин "циклоалкил" означает насыщенный или частично насыщенный, моноциклический или конденсированный спирополициклический карбоцикл, имеющий от 3 до 12 кольцевых атомов в кольце. Иллюстративные примеры циклоалкильных групп включают в себя следующие части молекул: и т.п. Термин "гетероциклоалкил" означает моноциклическую, или конденсированную, или спирополициклическую кольцевую структуру, которая является насыщенной или частично насыщенной и имеет 312 кольцевых атомов в кольце, выбранных из атомов С и гетероатомов N, О и S. Иллюстративные примеры гетероциклоалкильных групп включают в себя следующие:-4 008380 Термин "арил" (Аr) означает моноциклический, или конденсированный, или спирополициклический ароматический карбоцикл (кольцевую структуру, имеющую атомы кольца, все из которых являются атомами углерода), имеющий 3-12 кольцевых атомов в кольце. Иллюстративные примеры арильных групп включают в себя следующие части молекул: и т.п. Термин "замещенный" означает, что указанная группа или радикал несет один или более заместителей. Термин "незамещенный" означает, что указанная группа не несет заместителей. Замещенный алкил, циклоалкил или гетероциклоалкил замещен одним или несколькими заместителями, включающими в себя галоген (F, Cl, Br или I), низший алкил (C1-6), -OH, -NO2, -CN, -СО 2 Н, -О-низший алкил, -арил, -арил-низший алкил, -СО 2 СН 3, -CONH2, -OCH2CONH2, -NH2, -SO2NH2, галогеналкил(например, -CF3, -CH2CF3), -О-галогеналкил (например, OCF3, -OCHF2) и т.п. Термин "иммуномодулятор" означает природные или синтетические продукты, способные модифицировать нормальную или отклоняющуюся от нормы иммунную систему посредством стимуляции или супрессии. Термин "предупреждающий" относится к способности соединения или композиции согласно изобретению предупреждать заболевание, идентифицированное здесь, у пациентов, у которых диагностировано это заболевание или имеющих риск развития такого заболевания. Этот термин может также включать в себя предупреждение дальнейшего прогрессирования заболевания у пациентов, которые уже страдают от такого заболевания или имеют симптомы такого заболевания. Термин "лечение" означает(i) предупреждение возникновения заболевания, нарушения или состояния у животного, которое может быть предрасположено к этому заболеванию, нарушению и/или состоянию, но у которого оно еще не было диагностировано;(iii) облегчение этого заболевания, нарушения или состояния, т.е. инициацию регресса этого заболевания, нарушения и/или состояния. Термины и указывают на специфическую стереохимическую конфигурацию заместителя при асимметричном атоме углерода в нарисованной химической структуре. Все соединения, описанные здесь, имеют D-фуранозильную конфигурацию. Соединения согласно изобретению могут проявлять явление таутомерии. Хотя формула I не может специально изобразить все возможные таутомерные формы, должно быть понятно, что формула I предполагает любую таутомерную форму изображенного соединения и не ограничивается только специфической формой соединения, изображенной рисунками формулы. Например, для формулы I понятно, что независимо от того, показаны или не показаны заместители в их енольной или кето-форме, они представляют собой одно и то же соединение (как показано в примере ниже). Некоторые из соединений согласно изобретению могут существовать в виде индивидуальных стереоизомеров (т.е., по существу, не содержащих других стереоизомеров), рацематов, и/или смесей энантиомеров, и/или смесей энантиомеров и/или диастереомеров. Все такие индивидуальные стереоизомеры,рацематы и их смеси считаются входящими в объем согласно изобретению. Предпочтительно соединения согласно изобретению, которые являются оптически активными, используют в оптически чистой форме. Как обычно понимают специалисты в данной области, оптически чистое соединение, имеющее один хиральный центр (т.е. один асимметричный атом углерода), является соединением, которое состоит, в основном, из одного из двух возможных энантиомеров (т.е. является энантиомерно чистым), а оптически чистое соединение, имеющее более чем один хиральный центр, является соединением, которое является как диастереомерно чистым, так и энантиомерно чистым. Предпочтительно соединения согласно изобретению используют в форме, которая является по меньшей мере на 90% оптически чистой, т.е. форме, которая содержит по меньшей мере 90% одного изомера (80% энантиомерный избыток ("е.е.") или диастереомерный избыток("d.e.", более предпочтительно по меньшей мере 95% (90% е.е. или d.e.), еще более предпочтительно по меньшей мере 97,5% (95% е.е. или d.e.) и наиболее предпочтительно по меньшей мере 99% (98% е.е. или d.e.). Кроме того, формула I предполагает включение в нее сольватированных, а также несольватированных форм идентифицированных структур. Например, формула I включает в себя соединения указанной-5 008380 структуры как в гидратированной, так и в негидратированной формах. Другие примеры сольватов включают в себя эти структуры в комбинации с изопропанолом, этанолом, метанолом, ДМСО, этилацетатом,уксусной кислотой или этаноламином. Кроме соединений формулы I, данное изобретение включает в себя фармацевтически приемлемые пролекарства, фармацевтически активные метаболиты и фармацевтически приемлемые соли таких соединений и метаболитов."Фармацевтически приемлемое пролекарство" является соединением, которое может быть превращено в физиологических условиях или в результате сольволиза в указанное соединение или в фармацевтически приемлемую соль такого соединения перед проявлением его фармакологического действия (действий). Обычно пролекарство готовят с целью (с целями) получения улучшенной химической стабильности, улучшенного принятия (одобрения) пациентом, улучшенной органоселективности, улучшенного приготовления (например, увеличенной растворимости в воде) и/или уменьшенных побочных неблагоприятных действий (например, токсичности). Пролекарство может быть легко приготовлено из соединений формулы I с использованием способов, известных в данной области, таких как способы, описанные"Фармацевтически активный метаболит" означает фармакологически активный продукт, продуцируемый в результате метаболизма в организме указанного соединения или его соли. После попадания в организм большинство лекарственных средств являются субстратами для химических реакций, которые могут изменять их физические свойства и биологические эффекты. Эти метаболические превращения,которые обычно влияют на полярность соединений формулы I, изменяют характер распределения лекарственных средств в организме и секреции из организма. Однако в некоторых случаях метаболизм лекарственного средства необходим для терапевтического действия. Например, противораковые лекарственные средства класса антиметаболитов должны превращаться в их активные формы, после того как они транспортируются в раковую клетку. Поскольку большинство лекарственных средств подвергается метаболическим превращениям некоторого рода, биохимические реакции, которые могут играть роль в метаболизме лекарственных средств,могут быть многочисленными и разнообразными. Основным местом метаболизма лекарственных средств является печень, хотя в этом могут также участвовать и другие ткани. Характерным признаком многих их этих превращений является то, что метаболические продукты,или "метаболиты", являются более полярными, чем исходные лекарственные средства, хотя полярное лекарственное средство иногда фактически дает менее полярный продукт. Вещества с высокими коэффициентами распределения липид/вода, которые легко проходят через мембраны, также диффундируют легко обратно из мочи канальцев через клетки почечных канальцев в плазму. Таким образом, такие вещества имеют тенденцию низкого почечного клиренса и продолжительной персистенции в организме. Если лекарственное средство метаболизируется до более полярного соединения, соединения с более низким коэффициентом распределения, его реабсорбция канальцами будет сильно уменьшаться. Кроме того,специфические секреторные механизмы для анионов и катионов в проксимальных почечных канальцах и в паренхимных клетках печени функционируют в случае высокополярных веществ. В качестве характерного примера, фенацетин (ацетофенетидин) и ацетанилид являются слабыми аналгезирующими и антипиретическими агентами, но в организме превращаются в более полярный и более эффективный метаболит, п-гидроксиацетанилид (ацетаминофен), который широко используется в настоящее время. При введении дозы ацетанилида пациенту последующие метаболиты последовательно накапливаются до максимума и разрушаются в плазме. В течение первого часа ацетанилид является основным компонентом плазмы. На втором часу, по мере падения уровня ацетанилида, концентрация метаболита ацетаминофена достигает максимума. Наконец, через несколько часов основным компонентом плазмы является далее метаболит, который является инертным и может экскретироваться из тела. Таким образом, концентрации в плазме одного или более метаболитов, а также самого лекарственного средства могут быть фармакологически важными."Фармацевтически приемлемая соль" означает соль, которая сохраняет биологическую эффективность свободных кислот и оснований указанного соединения и которая не является биологически или иным образом нежелательной. Соединение согласно изобретению может обладать достаточно кислотными, достаточно основными или и теми, и другими группами и, соответственно, может взаимодействовать с любыми из множества неорганических или органических оснований и неорганических или органических кислот с образованием фармацевтически приемлемой соли. Примеры фармацевтически приемлемых солей включают в себя соли, полученные в результате реакции соединений согласно изобретению с минеральной или органической кислотой или неорганическим основанием, такие как соли, включающие в себя сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрофосфаты,-6 008380 дигидрофосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, иодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гепатноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себацаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты, метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты,сульфонаты, ксилолсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, гидроксибутираты, гликолаты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты,нафталин-2-сульфонаты и манделаты. Если соединение согласно изобретению является основанием, желательная фармацевтически приемлемая соль может быть получена при помощи любого подходящего способа, доступного в данной области, например в результате обработки этого свободного основания неорганической кислотой, такой как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., или органической кислотой, такой как уксусная кислота, малеиновая кислота, янтарная кислота, миндальная кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, пиранозидиловая кислота, такая как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислота, такая как лимонная кислота или винная кислота, аминокислота, такая как аспарагиновая кислота или глутаминовая кислота, ароматическая кислота, такая как бензойная кислота или коричная кислота, сульфоновая кислота, такая как птолуолсульфоновая кислота или этансульфоновая кислота, или т.п. Если соединение согласно изобретению является кислотой, желательная фармацевтически приемлемая соль может быть получена при помощи любого подходящего способа, например в результате обработки этой свободной кислоты неорганическим или органическим основанием, таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла или гидроксид щелочно-земельного металла, или т.п. Иллюстративные примеры подходящих солей включают в себя органические соли, полученные из аминокислот, таких как глицин и аргинин, аммиака, первичных, вторичных или третичных аминов и циклических аминов, таких как пиперидин, морфолин и пиперазин, и неорганические соли, полученные из натрия, кальция, калия,магния, марганца, железа, меди, цинка, алюминия и лития. В случае агентов, которые являются твердыми веществами, специалистам с квалификацией в данной области должно быть понятно, что соединения и соли согласно изобретению могут находиться в различных кристаллических или полиморфных формах, все из которых, как предполагается, включены в объем данного изобретения и указанных формул. Следующий аспект данного изобретения относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или разбавитель и терапевтически эффективное количество соединения формулы I, фармацевтически приемлемой соли, гидрата, эфира, сольвата, пролекарства, метаболита или стереоизомера. Соединения формулы I применимы в приготовлении фармацевтических композиций, содержащих эффективное количество соединения, вместе или в виде смеси, с наполнителями или носителями, подходящими для энтерального или парентерального применения. Как таковые, композиции согласно изобретению, пригодные для перорального введения, могут быть в форме дискретных единиц, таких как капсулы,крахмальные облатки, таблетки, пастилки или лепешки, каждая из которых содержит предварительно определенное количество активного ингредиента; в форме порошка или гранул; в форме раствора или суспензии в водной жидкости или неводной жидкости; в форме эмульсии типа масло-в-воде или эмульсии типа вода-в-масле. Активный ингредиент может также быть в форме шарика, лекарственной кашки или пасты. Эта композиция будет обычно приготовлена в виде унифицированной (стандартной) дозированной формы, такой как таблетка, капсула, водная суспензия или раствор. Такие формы обычно включают в себя твердое вещество, полутвердое вещество или жидкий носитель. Примеры носителей включают в себя лактозу, декстрозу, сахарозу, сорбит, маннит, крахмалы, аравийскую камедь, фосфат кальция, минеральное масло,какао-масло, масло шоколадного дерева, альгинаты, трагакант, желатин, сироп, метилцеллюлозу, монолаурат полиоксиэтиленсорбитана, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и т.п. Особенно предпочтительные формы включают в себя таблетки и желатиновые капсулы, содержащие активный ингредиент вместе с (а) разбавителями, такими как лактоза, декстроза, сахароза, маннит, сорбит, целлюлоза, высушенный кукурузный крахмал и глицин; и/или (b) смазывающие вещества, такие как диоксид кремния, тальк, стеариновая кислота, ее магниевая или кальциевая соль и полиэтиленгликоль. Таблетки могут также содержать связывающие вещества, такие как силикат магния-алюминия,крахмальная паста, желатин, трагакант, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и поливинилпирролидон; носители, такие как лактоза и кукурузный крахмал; дезинтегрирующие агенты, такие как крахмалы, агар, альгиновая кислота или ее натриевая соль, и выделяющие газ смеси; и/или абсорбенты,красители, ароматизаторы и подслащивающие вещества. Композиции согласно изобретению могут быть стерилизованными и/или содержать адъюванты, такие как консервирующие, стабилизирующие, способствующие набуханию или эмульгирующие агенты, ускорители растворения, соли для регуляции осмотического давления и/или буферы. Кроме того, композиция может также содержать другие терапевтически полезные вещества. Водные суспензии могут содержать эмульгирующие и суспендирующие агенты,объединенные с активным ингредиентом. Все пероральные формы могут дополнительно содержать под-7 008380 слащивающие и/или улучшающие вкус и запах агенты и/или красящие агенты. Эти композиции готовят в соответствии с общепринятыми способами смешивания, гранулирования или нанесения покрытий, соответственно, и они содержат приблизительно 0,1-75% активного ингредиента, предпочтительно приблизительно 1-50% активного ингредиента. Таблетка может быть приготовлена путем прессования или путем формования активного ингредиента, необязательно с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки могут быть получены прессованием в подходящей таблетировочной машине активного ингредиента в свободно текучей форме, такой как порошок или гранулы, необязательно смешанного со связывающим веществом, смазывающим веществом, инертным разбавителем, поверхностно-активым или диспергирующим агентом. Сформованные таблетки могут быть приготовлены формованием в подходящей машине смеси порошкообразного активного ингредиента и подходящего носителя, увлажненного инертным жидким разбавителем. При парентеральном введении эта композиция будет обычно находиться в унифицированной (стандартной) дозе, стерильной инъекционной форме (водном изотоническим растворе, суспензии или эмульсии) с фармацевтически приемлемым носителем. Такие носители предпочтительно являются нетоксичными, парентерально приемлемыми и содержат нетерапевтические разбавители или растворители. Примеры таких носителей включают в себя воду; водные растворы, такие как солевой раствор (изотонический раствор хлорида натрия); раствор Рингера, раствор декстрозы и раствор Хенкса; и неводные растворы, такие как 1,3-бутандиол, нелетучие масла (например, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло и синтетические моно- или диглицериды), этилолеат и изопропилмиристат. Масляные суспензии могут быть приготовлены в соответствии со способами, известными в данной области, с использованием подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов. Среди приемлемых растворителей или суспендирующих сред находятся стерильные нелетучие масла. Для этой цели может быть использовано любое безвкусное нелетучее масло. В приготовлении инъекционных растворов применимы также жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, в том числе оливковое масло и касторовое масло, в частности, в их полиоксиэтилированных формах. Эти масляные растворы или суспензии могут также содержать разбавители или диспергирующие агенты в виде спиртов с длинной цепью. Стерильный солевой раствор является предпочтительным носителем, и эти соединения являются часто достаточно хорошо растворимыми в воде для приготовления раствора для всех предвидимых целей. Носитель может содержать минорные количества добавок, таких как вещества, которые усиливают растворимость, изотоничность и химическую стабильность, например антиоксиданты, буферы и консерванты. При ректальном введении эта композиция будет обычно приготовлена в унифицированной дозированной форме, такой как суппозиторий или крахмальная облатка. Эти композиции могут быть приготовлены путем смешивания соединения с подходящими не вызывающими раздражения эксципиентами, которые являются твердыми при комнатной температуре, но жидкими при ректальной температуре, так что они будут расплавляться в прямой кишке с высвобождением данного соединения. Обычные эксципиенты включают в себя масло какао, пчелиный воск и полиэтиленгликоли или другие масляные эмульсии или суспензии. Композиции, пригодные для назального или буккального введения (такие как самодиспергирующиеся порошкообразные распределительные композиции), мсгут содержать приблизительно 0,1% - приблизительно 5% (масса/масса) активного ингредиента или, например, приблизительно 1% (масса/масса) активного ингредиента. Кроме того, некоторые формы могут быть составлены в подъязычную пастилку или лепешку. Кроме того, эти соединения могут вводиться местно, в частности, когда состояния, на которые направлено лечение, включают в себя зоны или органы, легко доступные для местного нанесения, в том числе нарушения глаз, кожи или нижних отделов кишечного тракта. Для местного применения к глазу, или офтальмического применения, эти соединения могут быть приготовлены в виде микронизированных суспензий в изотоническом, с доведенным рН, стерильном солевом растворе или предпочтительно в виде раствора в изотоническом, с доведенным рН, стерильном солевом растворе, либо с консервантом, таким как хлорид бензилалкония, либо без консерванта. Альтернативно, эти соединения могут быть приготовлены в виде мазей, таких как вазелин. Для местного нанесения на кожу эти соединения могут быть приготовлены в виде подходящих мазей, содержащих эти соединения, суспендированные или растворенные, например смесей с одним или несколькими из следующих ингредиентов: минеральным маслом, жидким вазелином, белым вазелином,пропиленгликолем, производным полиоксиэтилена, производным полиоксипропилена, эмульгирующим воском и водой. Альтернативно, эти соединения могут быть приготовлены в виде лосьонов или кремов,содержащих активное соединение, суспендированное или растворенное, например, в смеси одного или нескольких из следующих ингредиентов: минерального масла, сорбитанмоностеарата, полисорбата 60,воска с цетиловым эфиром, цетеарилового спирта, 2-октилдодеканола, бензилового спирта и воды. Местное нанесение в нижние отделы кишечного тракта может выполняться с использованием форм ректальных суппозиториев (см. выше) или подходящих форм клизм. Эти формы могут быть предпочтительно представлены в унифицированной дозированной форме и могут быть приготовлены любыми из способов, хорошо известных в области фармации. Все способы включают в себя стадию приведения активного ингредиента в связь с носителем, который состоит из одного или-8 008380 нескольких вспомогательных ингредиентов. Обычно эти формы готовят путем тщательного смешивания активного ингредиента с жидким носителем, или тонкоизмельченным твердым носителем, или с обоими до однородной кондиции и затем, если необходимо, формованием этого продукта в желаемую форму. Фармацевтическая композиция согласно изобретению используется в количестве, которое является терапевтически эффективным, и используемые количества могут зависеть от желаемого профиля высвобождения, концентрации фармацевтической композиции, требуемой для сенсибилизированного действия, и продолжительности времени, в течение которого эта фармацевтическая композиция должна высвобождаться для лечения. Соединения формулы I согласно изобретению предпочтительно вводят в виде капсулы или таблетки,содержащей однократную дозу или разделенную дозу этого соединения, или в виде стерильного раствора,суспензии или эмульсии, для парентерального введения в виде однократной дозы или в виде разделенных доз. Соединения согласно изобретению используют в композиции в количествах, которые являются терапевтически эффективными. Хотя эффективное количество соединений формулы I будет зависеть от конкретного используемого соединения, количества этих соединений, варьируемые от приблизительно от 1 до 65%, легко включались с системы доставки с жидким или твердым носителем. Для медицинского использования количество, требуемое для того, чтобы соединение формулы I дало терапевтический эффект, будет варьироваться в зависимости от конкретного вводимого соединения,способа введения, млекопитающего, получающего введение, и конкретного нарушения, связанного с рассматриваемым заболеванием. Подходящая системная доза соединения формулы I для млекопитающего, страдающего или, вероятно, страдающего от любого состояния, описанного здесь, находится обычно в диапазоне приблизительно 0,1-100 мг основания на килограмм массы тела. Понятно, что врач или ветеринар с обычной квалификацией в данной области сможет легко определить и прописать количество этого соединения, эффективное для желаемого профилактического или терапевтического лечения. При этом врач или ветеринар может использовать внутривенную болюсную инъекцию с последующей внутривенной инфузией и периодическими введениями, как он считает подходящим. В способах согласно изобретению эти соединения могут вводиться, например, перорально, парентерально, в виде ингаляционного спрея, местно, ректально, назально, буккально, сублингвально, вагинально, внутрижелудочковым путем или посредством имплантированного резервуара в виде дозированных форм, содержащих общепринятые фармацевтически приемлемые носители, адъюванты и наполнители. Парентеральное введение включает в себя, но не ограничивается ими, следующие примеры введения: внутривенную, подкожную, внутримышечную, интраспинальную, внутрикостную, внутрибрюшинную, внутриоболочечную, внутрижелудочковую, интрастернальную или внутричерепную инъекцию или инфузионные способы, такие как инфузия с использованием субдурального насоса. Инвазивные способы являются предпочтительными, в частности прямое введение в поврежденную нервную ткань. Хотя соединение (соединения) формулы I могут вводиться отдельно, предпочтительно его (их) обеспечивают в виде части фармацевтической композиции. Для того, чтобы они были эффективными терапевтически в центральной нервной системе, соединения, используемые в способах согласно изобретению, должны легко проникать через гематоэнцефалический барьер при периферическом введении. Однако соединения, которые не могут проникать через гематоэнцефалический барьер, могут все-таки быть эффективными при введении внутрижелудочковым способом. Соединения, используемые в способах согласно изобретению, могут вводиться в однократной дозе,множественных дискретных дозах или путем непрерывной инфузии. Поскольку эти соединения являются небольшими, легко диффундируемыми и относительно стабильными, они хорошо пригодны для непрерывной инфузии. Средства типа насоса, в частности подкожные или субдуральные насосы, являются предпочтительными для непрерывной инфузии. Для способов согласно изобретению может быть использован любой эффективный режим введения,регулирующий время и последовательность введения доз. Дозы соединений предпочтительно включают в себя фармацевтические дозированные единицы, содержащие эффективное количество активного соединения. Под эффективным количеством имеют в виду количество, достаточное для обеспечения иммунной усиливающей реакции и/или получения желаемых благоприятных эффектов посредством введения одной или нескольких фармацевтических дозированных единиц. Пример суточной дозированной единицы для позвоночного хозяина содержит количество приблизительно от 0,001 до 50 мг/кг. Обычно уровни доз порядка приблизительно 0,1-10000 мг активного ингредиента применимы в лечении указанных выше состояний, причем предпочтительные уровни доз приблизительно составляют 0,5-2000 мг. Конкретный уровень дозы для любого конкретного пациента будет варьироваться в зависимости от разнообразных факторов, в том числе от активности конкретного используемого соединения; возраста, массы тела, общего состояния здоровья, пола и пищевого рациона пациента; времени введения; скорости экскреции, любой комбинации данного соединения с другими лекарственными средствами; тяжести конкретного подлежащего лечению заболевания; и формы и способа введения. Обычно результаты зависимости доза-эффект in vitro обеспечивают полезное руководство в отношении правильных доз для введения пациенту. Исследования на животных моделях могут также быть полезными. Соображения в отношении определения правильных уровней доз хорошо известны в данной области.-9 008380 Соединения и композиции могут вводиться вместе с одним или несколькими терапевтическими агентами либо (i) вместе в единой композиции, либо (ii) отдельно в виде индивидуальных композиций,созданных для оптимальных скоростей высвобождения их соответствующих активных агентов. Каждая композиция может содержать приблизительно 0,01-99,99% по весу, предпочтительно приблизительно 3,5-60% по весу соединения согласно изобретению, а также одного или более фармацевтических эксципиентов, таких как увлажняющий, эмульгирующий и забуферивающий агенты. При использовании этих соединений в способах согласно изобретению в комбинации с одним или несколькими другими терапевтическими агентами конкретные уровни доз для этих агентов будут зависеть от рассмотрений, описанных выше в отношении композиций и способов согласно изобретению вообще. Для способов согласно изобретению может быть использована любая схема введения, регулирующая время и последовательность доставки данного соединения, и она может повторяться по мере необходимости для достижения лечения. Такая схема введения может включать в себя предварительное лечение и/или совместное введение с дополнительными терапевтическими агентами. Агенты согласно изобретению могут быть получены с использованием путей реакций и схем синтеза, описанных ниже, с использованием общих способов, известных в данной области, с использованием исходных материалов, которые являются легкодоступными. Синтез не приведенных в примерах соединений в соответствии с данным изобретением может успешно проводиться при помощи модификаций,очевидных для специалистов с квалификацией в данной области, например подходящей защитой мешающих групп, заменой на другие подходящие реагенты, известные в данной области, или путем введения рутинных модификаций условий реакций. Альтернативно, другие реакции, описанные здесь или известные в общем в данной области, будут легко узнаваться в качестве реакций, применимых для получения других соединений согласно изобретению. Получение соединений В описанных ниже синтетических схемах, если нет других указаний, температуры указаны в градусах по шкале Цельсия, а части и проценты даются по массе. Реагенты получали из коммерческих источников, таких как Aldrich Chemical Company или Lancaster Synthesis Ltd., и использовали без дополнительной очистки, если нет других указаний. Тетрагидрофуран (ТГФ) и N,N-диметилформамид (ДМФ) фирмы Aldrich покупали во флаконах с надежной герметизацией (Sure Seal) и использовали в том виде, в каком они были получены. Если нет других указаний, следующие растворители и реагенты перегоняли с использованием рубашки сухого азота. ТГФ и Et2O перегоняли над Na-бензофенонкетилом; CH2Cl2, диизопропиламин, пиридин и Et3N перегоняли над СаH2; MeCN перегоняли сначала над P2 О 5, затем надCaH2; MеОH перегоняли над Mg; PhMe, EtOAc и i-PrOAc перегоняли над CaH2; TFAA очищали простой атмосферной перегонкой в атмосфере сухого аргона. Реакции, представленные ниже, проводили обычно при положительном давлении аргона при температуре окружающей среды (если нет других указаний) в безводных растворителях, и реакционные колбы были снабжены резиновой перегородкой для введения субстратов и реагентов через шприц. Стеклянную посуду сушили в термостате и/или нагреванием. Реакции анализировали с использованием ТСХ и останавливали согласно оценке потребления исходного материала. Аналитическую тонкослойную хроматографию (ТСХ) выполняли на пластинках силикагеля 60 F254 0,2 мм на алюминиевой основе (ЕМScience) и визуализировали с использованием УФ (254 нм) с последующим нагреванием с коммерческой фосфомолибденовой кислотой в виде раствора в этаноле. Препаративную тонкослойную хроматографию(ТСХ) выполняли на пластинках силикагеля 60 F254 1,0 мм на алюминиевой основе (ЕМ Science) и визуализировали с использованием УФ (254 нм). Обработки обычно выполняли, удваивая реакционный объем растворителем реакции или растворителем экстракции и затем промывая указанные водные растворы с использованием 25% по объему экстракционного объема, если нет других указаний. Полученные растворы сушили над безводным Na2SO4 и/или Mg2SO4 перед фильтрованием и выпариванием растворителей при пониженном давлении на роторном испарителе и указанные растворители удаляли в вакууме. Колоночную хроматографию проводили при положительном давлении с использованием силикагеля 230-400 меш или нейтрального оксида алюминия 50-200 меш. Гидрогенолиз выполняли при давлении, указанном в примерах, или при атмосферном давлении. 1 Н-ЯМР-спектры регистрировали на приборе Varian Mercury-VX400, работающем при 400 МГц, а 13 С-ЯМР регистрировали при 75 МГц. ЯМР-спектры получали в виде СН 2 Сl3-растворов (сообщаемых в м.д.) с использованием хлороформа в качестве ссылочного стандарта (7,27 м.д. и 77,00 м.д.), CD3OD (3,4 и 4,8 м.д. и 49,3 м.д.), ДМСО-d6 или внутреннего тетраметилсилана (0,00 м.д.), по мере необходимости. Другие растворители для ЯМР использовали по мере необходимости. Когда приводятся мультиплетности пиков, используются следующие аббревиатуры: s (с) (синглет), d (д) (дублет) , t (т) (триплет), q (к)(квартет), m (м) (мультиплет), br (шир) (расширенный), dd (дд) (дублет дублетов), dt (дт) (дублет триплетов). Константы связывания, когда они приводятся, даются в герцах (Гц). Инфракрасные (ИК) спектры регистрировали на спектрофотометре FT-IR в виде неразбавленных масел,в виде КВr-гранул или растворов CDCl3, и, когда они приводятся, они выражаются в волновых числах (см-1). Приведенные масс-спектры представляют (+)-ES LC/MS, проводимые Отделом аналитической химии фирмыAnadys Pharmaceuticals, Inc. Элементные анализы проводились Atlantic Microlab, Inc. в Norcross, GA. Точки- 10008380 плавления (т.пл.) определяли на приборе с открытыми капиллярами, и они являются некорректированными. Описанные синтетические пути и экспериментальные процедуры используют многочисленные обычные химические аббревиатуры: ТГФ (тетрагидрофуран), ДМФ (N,N-диметилформамид), EtOAC(3-хлорпероксибензойная кислота), EDC (гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида),HATU (гексафторфосфат 7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония), НОВТ (гидрат 1-гидроксибензотриазола), TFAA (трифторуксусный ангидрид), руВОР (гексафторфосфат бензотриазол-1-илокси) трипирролидинофосфония), DIEA (диизопропилэтиламин) и т.п. На схеме 1 показана общая процедура получения 5'-аминокислотных эфиров 5-амино-3D-рибофуранозилтиазоло[4,5-d]пиримидин-2,7-диона. Схема 1c) Безв. НСl, iPrOAc, iPrOH. В типичном синтетическом пути 2',3'-гидроксильные группы -D-рибозной части молекулы 5-амино-3-D-рибофуранозилтиазоло[4,5-d]пиримидин-2,7-диона сначала защищают, предпочтительно ацетонидом,как показано в 2. Затем свободный 5'-гидроксил может быть подвергнут различным способам этерификации с N-защищенной аминокислотой с образованием IIа. Затем азот эфира аминокислоты и 2',3'-гидроксилы рибозной единицы подвергают различным условиям удаления защитных групп, предпочтительно одновременно, с последующим образованием соли свободного амина эфира аминокислоты, как показано для II. Пример 1. Дигидрохлорид 5-амино-3-(5'-O-L-валинилD-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона (3). Стадия 1. Получение 5-амино-3-(2',3'-O-изопропилиденD-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона. К гетерогенной смеси 1 (5,37 г, 17,0 ммоль), полученной согласно процедуре, приведенной в патенте США 5041426 (пример 2), который включен в качестве ссылки в его полном виде, в ацетоне (40 мл),содержащейся в колбе Мортона на 250 мл, добавляли последовательно 2,2-DMP (6,26 мл, 50,9 ммоль),ДМСО (6,6 мл) и MeSO3H (220 мкл, 3,39 ммоль) при комнатной температуре. Реакционную смесь перемешивали интенсивно, она становилась гомогенной и золотисто-желтой по мере потребления диола. ТСХ-анализ (SiO2, 10% МеОН-СНСl3) показал завершение реакции после 6 ч. Нерастворенные твердые вещества удаляли фильтрованием под действием силы тяжести с использованием рифленой фильтровальной бумаги Whatman type 1. Затем следовало выливание фильтрата в 10 объемов ледяной воды (400 мл),что приводило к немедленному осаждению белого твердого вещества. После короткого периода перемешивания NaHCO3 (285 мг, 3,39 ммоль), растворенный в воде (10 мл), добавляли для нейтрализацииMeSO3H. Сильное перемешивание в реакторе Мортона продолжали в течение 15 мин, после чего смесь фильтровали через стеклянный фильтр с фриттой из грубого спекшегося стекла. Твердый материал промывали ледяной водой (100 мл), сушили на воздухе, затем сушили дополнительно при глубоком вакууме- 11008380 при 65 С с получением 5,36 г (88%) ацетонида 2 в виде белого твердого вещества: т.пл. 280-81 С; 1HEDC (588 мг, 3,07 ммоль). Полученную гомогенную смесь перемешивали в течение 45 мин при 0 С, и в этот момент она становилась гетерогенной, и добавляли в виде одной порции твердый ацетонид 2 из стадии 1 выше (1,00 г, 2,81 ммоль). Затем добавляли твердый DMAP (522 мг, 4,27 ммоль). Реакционной смеси давали достичь комнатной температуры и перемешивали дополнительно в течение 5 ч, после чего ее концентрировали при 25 С роторным испарением с получением желтого сиропа. Остаток растворяли вEtOAC (50 мл), распределяли с использованием 1 н. НСl (10 мл) с последующей нейтрализацией кислоты насыщенным водным NaНСО 3 (10 мл). Кислотную водную фазу дополнительно экстрагировали EtOAC(2x50 мл) и затем распределяли с использованием основной водной фазы. Объединенные органические фазы сушили над Na2SO4, фильтровали через короткую подушку SiO2 и концентрировали с получением 1,480 г (96%) эфира Воc-защищенной аминокислоты 4 в виде пенообразного вещества: т.пл. 158 С(шир.с, 1 Н), 2,08-2,19 (м, 1 Н), 4,20-4,24 (м, 2 Н), 4,30-4,37 (м, 1 Н), 4,56 (дд, J=11,0, 5,9, 1H), 4,96 (дд,J=6,2, 3,7, 1 Н), 5,11 (шир.д, J=8,8, 1H), 5,29 (шир.д, J=6,6, 1 Н), 5,88 (шир.с, 2 Н), 6,23 (с, 1 Н). Стадия 3. Получение дигидрохлорида 5-амино-3-(5'-O-L-валинилD-рибофуранозил)тиазоло[4,5d]пиримидин-2,7-диона (3). Поток HCl-газа пропускали через барботер концентрированной H2SO4 и затем направляли (через снабженную фриттой диспергирующую трубку) в 3-горлую колбу Мортона на 250 мл, содержащую сухой изопропилацетат (80 мл), при 0 С до получения насыщенного раствора. К нему добавляли раствор эфира Вос-защищенной аминокислоты из стадии 2 выше (5,53 г, 9,95 ммоль) в изопропилацетате (30 мл) с получением белого твердого остатка в пределах 5 мин. К нему добавляли 10% (об./об.) IPA (11 мл). Реакционную смесь нагревали при комнатной температуре, затем перемешивали 12 ч. Эту гетерогенную реакционную смесь разбавляли сухим толуолом (100 мл). Фильтрование с использованием стеклянной воронки с фриттой из спекшегося стекла со средним размером пор в атмосфере N2 давало аморфное твердое вещество нестандартного белого цвета. Растирание этого твердого вещества в сухом ТГФ с последующим фильтрованием и сушкой в вакууме при 65 С давало 3,677 г (81%) указанного в заголовке соединения 3 в виде белого твердого вещества: т.пл. 166-168 С (разл.); 1 Н (DMSO-d6)0,90 (д, J=7,0, 3 Н), 0,94 (д,J=7,0, 3 Н), 2,14-2,18 (м, 1 Н), 3,83-3,85 (м, 1 Н), 3,96-4,00 (м, 1 Н), 4,23-4,28 (м, 2 Н), 4,42 (дд, J=11,7, 3,4, 1 Н),4,75 (дд, J=10,3, 5,5 1 Н), 5,81 (д, J=4,4 1H), 6,46 (шир.с, 3 Н), 7,23 (шир.с, 2 Н), 8,47 (с, 3 Н), 11,5 (шир.с, 1 Н). Элементный анализ для C15H21N5O7S2HCl: рассчитано: С, 36,89; Н, 4,75; Сl, 14,52; N, 14,34; S, 6,57; найдено: С, 37,03; Н, 4,74; Сl, 14,26; N, 14,24; S, 6,42. Пример 2. 3/2 Гидрохлорид 5-амино-3-(5'-O-L-изолейцилD-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона (5). Стадия 1. Получение 5-амино-3-(2',3'-O-изопропилиден-5'-N-трет-бутоксикарбонил-L-изолейцил)-D-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона (6). Подобно процедуре, сходной со стадией 2 примера 1, 5-амино-3-(2',3'-O-изопропилиден-5'-N-трет-бутоксикарбонил-L-изолейцил)D-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона 6 получали с выходом 93% из 5-амино-3-(2',3'-O-изопропилиденD-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона 2 и N-трет-бутокси-L-изолейцина 7 в виде пенообразного вещества нестандартного белого цвета: 1 Н ЯМР (400 МГц d6-DMSO)11,29 (с, 1 Н), 7,09 (д, J=8,0, 1 Н), 7,02 (шир.с, 1 Н), 6,02 (с, 1 Н), 5,28 (д, J=6,2, 1 Н), 5,06 (шир.с, 1 Н), 4,164,22 (м, 2 Н), 3,85 (дд, J=8,0, 6,6 1 Н), 1,68 (шир.с, 1 Н), 1,47 (с, 3 Н), 1,34 (с, 9 Н), 1,29 (с, 3 Н), 0,71-0,89 (м, 5 Н). Стадия 2. Получение дигидрохлорида 5-амино-3-(5'-O-L-изолейцилD-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона (5). Подобно процедуре, сходной со стадией 3 примера 1, получали указанное в заголовке соединение в виде белого твердого вещества из указанного выше промежуточного продукта с выходом 80%: т.пл. 173174 С (разл.); 1 Н ЯМР (400 МГц d6-DMSO)11,41 (шир.с, 1 Н), 8,41 (шир.с, 3 Н), 7,15 (шир.с, 2 Н), 5,82 (д,J=4,8, 1 Н), 4,50-5,00 (м, 2 Н), 4,40 (дд, J=11,7, 3,3, 1 Н), 4,21-4,30 (м, 2 Н), 3,91-4,0 (м, 2 Н), 1,84-1,91 (м, 1 Н),1,37-1,44 (м, 1 Н), 1,19-1,27 (м, 1 Н), 0,80-0,87 (м, 6 Н). Элементный анализ для C16H23N5O7S3/2HCl: рассчитано: С, 39,69; Н, 5,10; Сl, 10,98; N, 14,47; S,6,62; найдено: С, 39,05; Н, 5,13; Cl, 13,73; N, 11,08; S, 6,02. Стадия 1. Получение 5-амино-3-(2',3'-O-изопропилиден-5'-N-трет-бутоксикарбонил-[-L-трет-бутилглицил]D-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона (9). Подобно процедуре, сходной со стадией 2 примера 1, 5-амино-3-(2',3'-O-изопропилиден-5'-N-третбутоксикарбонил-[-L-трет-бутилглицинил]D-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-дион 10 получали с выходом 66% из 5-амино-3-(2,3-O-изопропилиденD-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона 2 и NL-трет-бутоксиглицина в виде пенообразного вещества нестандартного белого цвета: 1 Н ЯМР (400 МГц d6-DMSO)11,28 (шир.с, 1 Н), 6,70-7,40 (м, 3 Н), 6,02 (с, 1 Н), 5,30 (д, J=6,2, 1 Н),5,05 (шир.с, 1 Н), 4,17-4,24 (м, 3 Н), 3,77 (д, J=8,4, 1 Н), 1,47 (с, 3 Н), 1,33 (с, 9 Н), 1,29 (с, 3 Н), 0,85 (с, 9 Н). Стадия 2. Получение 5-амино-3-(5'-О-[-L-трет-бутилглицил]D-рибофуранозил)тиазоло[4,5-d] пиримидин-2,7-диона (8). Подобно процедуре, сходной со стадией 3 примера 1, получали указанное в заголовке соединение в виде белого твердого вещества из указанного выше промежуточного продукта с выходом 80%: т.пл. 202203 С (разл.); 1 Н ЯМР (400 МГц d6-DMSO)11,35 (шир.с, 1 Н), 8,31 (шир.с, 3 Н), 7,08 (шир.с, 2 Н), 5,83 (д,J=4,0, 1 Н), 5,45 (шир.с, 1 Н), 5,21 (шир.с, 1 Н), 4,77-4,82 (м, 1 Н), 4,42 (дд, J=11,4, 2,6, 1 Н), 4,23-4,28 (м, 1 Н),3,96-4,04 (м, 1 Н), 3,74 (с, 1 Н), 0,97 (с, 9H). Элементный анализ для C16H23N5O7SHCl: рассчитано: С, 41,25; Н, 5,19; Сl, 7,61; N, 15,03; S, 6,88; найдено: С, 40,41; Н, 5,41; Сl, 7,01; N, 4,16; S, 6,23. Пример 4. Гидрохлорид 5-амино-3-(5'-О-[-L-N-метилвалинил]D-рибофуранозил)тиазоло[4,5-d] пиримидин-2,7-диона (11). Стадия 1. Получение 5-амино-3-(2',3'-O-изопропилиден-5'-N-трет-бутоксикарбонил-[-L-N-метилвалинил]D-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона (12). Подобно процедуре, сходной со стадией 2 примера 1, 5-амино-3-(2',3'-O-изопропилиден-5'-N-третбутоксикарбонил-[-L-N-метилвалинил]D-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-дион 12 получали с выходом 63% из 5-амино-3-(2',3'-О-изопропилиденD-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона 2 и N-трет-бутокси-L-N-метилвалина 13 в виде пенообразного вещества нестандартного белого цвета: 1 Н ЯМР (400 МГц d6-DMSO) ротамерный карбамат 11,28 (шир.с, 1 Н), 7,00 (шир.с, 2 Н),6,02 (с, 1 Н), 5,27 (д, J=6,6, 1 Н), 5,04 (шир.с, 1 Н), 4,14-4,28 (м, 3 Н), 3,91 (д, J=9,5, 1H), 2,79 (шир.с, 3 Н),2,09 (шир.с, 1 Н), 1,46 (с, 3 Н), 1,36 (с, 4,5 Н), 1,32 (с, 4,5 Н), 1,28 (с, 3 Н), 0,78-0,89 (м, 6 Н). Стадия 2. Получение гидрохлорида 5-амино-3-(5'-О-[-L-N-метилвалинил]D-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7-диона (11). Подобно процедуре, сходной со стадией 3 примера 1, получали указанное в заголовке соединение 11 в виде слегка нечистого белого твердого вещества из указанного выше промежуточного продукта с выходом 60%: т.пл. 180% (разл.); 1 Н ЯМР (400 МГц d6-DMSO)11,31 (шир.с, 1 Н), 9,05 (шир.с, 2 Н), 7,05 (шир.с, 2 Н),5,83 (д, J=4,4, 1 Н), 5,46 (шир.с, 1 Н), 5,21 (шир.с, 1 Н), 4,76-4,82 (м, 1 Н), 4,42-4,48 (м, 1 Н), 4,28-4,38 (м, 1 Н),4,22-4,28 (м, 1 Н), 3,94-4,04 (м, 2 Н), 2,54 (шир.с, 3 Н), 2,23 (шир.с, 1 Н), 0,98 (д, J=7,0, 3 Н), 0,88 (д, J=7,0, 3 Н). Элементный анализ для C16H23N5O7SHCl: рассчитано: С, 41,25; Н, 5,02; Сl, 7,61; N, 15,03; S, 6,88; найдено: С, 40,57; Н, 5,37; Сl, 7,29; N, 13,57; S, 6,16. На схеме 2 показана общая процедура получения 5-амино-7-метокси-3D-рибофуранозилтиазоло- 13008380 Пример 5. 5-Амино-3D-рибофуранозил-7-метокситиазоло[4,5-d]пиримидин-2-он (14). Безводный 1 (2,0 г, 6,3 ммоль) растворяли в сухом пиридине в атмосфере аргона. Этот раствор охлаждали до 0 С, после чего к этой смеси добавляли по каплям TFAA (13,3 г, 63 ммоль). Спустя 5 мин реакционную смесь помещали на масляную баню 60 С на 1,5 ч и подвергали мониторингу при помощи ТСХ(SiO2, 20% МеОН-СНСl3) для образования катиона пиридиния. Исходный материал с Rf 0,2 превращался в пятно фона, которое подвергалось синей флуоресценции при экспонировании на УФ-свете 254 нм. После превращения в активированный промежуточный продукт к реакционной смеси добавляли свежеприготовленный раствор метоксида натрия (1,8 г Na, 78 ммоль, 300 мл метанола) при 0 С. Реакционной смеси давали нагреться до комнатной температуры и протекать в течение 2 дней. Затем эту смесь гасили 1 МNH4Cl (100 мл) и экстрагировали смесью 25% IРА-СНСl3 (5x100 мл). Неочищенный материал фильтровали через пробку силикагеля и затем концентрировали с получением 1,6 г (75%) указанного в заголовке соединения 14. Аналитическую пробу получали методом препаративной ТСХ (SiO2; вода, метанол, этилацетат, 5:10:85) в виде белого твердого вещества: т.пл. 160 С (разл.); [М+Н]+ 330,9, [2 М+Н]+ 661,1,[3 М+Н]+ 991,0; Rf=0,6 (20% МеОН-СНСl3); т.пл. 200,4 С-200,9 С; 1 Н ЯМР (400 МГц d6-DMSO)6,92 (с,2 Н), 5,86 (д, J=5,2, 1H), 5,28 (д, J=5,6, 1 Н), 4,96 (д, J-5,2, 1 Н), 4,78 (дд, J=10,8, 5,6, 1 Н), 4,67 (т, J=6,0, 1 Н),4,07-4,10 (м, 1 Н), 3,91 (с, 3 Н), 3,70-3,80 (м, 1 Н), 3,55-3,60 (м, 1 Н), 3,40-3,45 (м, 1 Н). Элементный анализ для C11H14N4O6S: рассчитано: С, 40,00; Н, 4,27; N, 16,96; S, 9,71; найдено: С,40,07; Н, 4,43; N, 16,71; S, 9,53. Пример 6. 5,7-Диамино-3D-рибофуранозилтиазоло[4,5-d]пиримидин-2-он (15). Безводный 1 (0,3 г, 0,9 ммоль) растворяли в сухом пиридине в атмосфере аргона. Этот раствор охлаждали до 0 С, после чего к этой смеси добавляли по каплям TFAA (1,2 г, 9,5 ммоль). Спустя 5 мин реакционную смесь помещали на масляную баню 60 С на 1,5 ч и подвергали мониторингу при помощи ТСХ(20% МеОН-СНСl3) для образования катиона пиридиния. Исходный материал с Rf 0,2 превращался в пятно фона, которое подвергалось синей флуоресценции при экспонировании на УФ-свете 254 нм. После превращения в активированный промежуточный продукт реакционную колбу помещали на баню со льдом. После уравновешивания температуры добавляли по каплям 30% водный NH3 (25 мл) до прекращения экзотермической реакции и добавляли остаток. В пределах нескольких минут образовывался продукт, как показано Rf 0,25 аналитической ТСХ (SiO2, 20% МеОН-СНСl3). Колбу нагревали до комнатной температуры на протяжении 30 мин, затем этот водный раствор дегазировали в ротационном вакууме,затем экстрагировали смесью 25% IРА-СНСl3 (5x100 мл). Продукт подвергали флеш-хроматографии(SiO2, 10% МеОН-СНСl3) с получением 55 мг (17%) слегка нечистого указанного в заголовке соединения 15. Аналитическую пробу получали методом препаративной ТСХ (SiO2; вода-MeOH-EtOAC, 5:10:85) в виде белого твердого вещества: т.пл. 155 С (разл.); [М+Н]+ 316,0; Rf=0,25 (SiO2, 20% МеОН-СНСl3); 1 Н ЯМР (400 МГц d6-DMSO)6,76 (с, 2 Н), 6,14 (с, 2 Н), 5,85 (д, J=5,2, 1H), 5,22 (д, J=4,8, 1 Н), 4,92 (д, J=2,8,1 Н), 4,70-4,83 (м, 2 Н), 4,05-4,10 (м, 1 Н), 3,65-3,80 (м, 1 Н), 3,52-3,62 (м, 1 Н), 3,40-3,50 (м, 1 Н). Элементный анализ для C10H13N5O5S1/2 Н 2 О: рассчитано: С, 37,03; Н, 4,35; N, 21,59; S, 9,89; найдено: С, 37,27; Н, 4,32; N, 20,43; S, 10,11. Схема 3 Стадия 1. Получение 5-ацетиламино-3-(2',3',5'-три-О-ацетилD-рибофуранозил)тиазоло[4,5-d]пиримидин-2,7(6 Н)-диона (16). Безводный 1 (8,0 г, 39,5 ммоль) растворяли в сухом пиридине (65 мл). Добавляли DMAP (3,1 г, 25,3 ммоль) и уксусный ангидрид (19,1 мл, 202,4 ммоль) последовательно. Реакции давали протекать в течение 2 ч при комнатной температуре, после чего ее гасили насыщенным NaHCO3 (100 мл) и экстрагировали DCM(3x200 мл). Органическую фазу концентрировали и затем растирали с эфиром. Это давало 12,5 г (103%) слегка нечистого 5-ацетиламино-3-(2,3,5-три-О-ацетилD-рибофуранозил)тиазоло[4,5-d]пиримицин 2,7(6 Н)-диона в виде белого твердого вещества 16: т.пл. 246,7-248,1 С; Rf=0,20 (SiO2, 50% EtOACCHCl3); 1 Н ЯМР (400 МГц d6-DMSO)12,23 (с, 1 Н), 11,85 (с, 1 Н), 5,97 (м, 2 Н), 5,48 (т, J=6, 1H), 4,35-4,40(м, 1 Н), 4,25-4,31 (м, 1 Н), 4,08-4,18 (м, 1 Н), 2,49 (с, 3 Н), 2,07 (с, 3 Н), 2,01 (с, 3 Н), 2,00 (с, 3 Н). Стадия 2. Получение 5-ацетиламино-7-(2,4,6-триизопропилбензолсульфонилокси)-3-(2,3,5-три-ОацетилD-рибофуранозил)тиазоло[4,5-d]пиримидин-2-она (17). Промежуточный продукт из стадии 1 выше (500 мг, 0,98 ммоль) растворяли в DCM (15 мл) при температуре окружающей среды. К раствору добавляли DMAP (7,3 мг, 0,06 ммоль) и TEA (16 мл, 11 ммоль),а затем 2,4,6-триизопропилбензолсульфонилхлорид (454 мг, 1,5 ммоль). Спустя 1 ч реакция завершалась,неочищенную смесь концентрировали и затем очищали методом флэш-хроматографии (SiO2, 10%EtOAC-CHCl3) с получением 690 мг (92%) 5-ацетиламино-7-(2,4,6-триизопропилбензолсульфонилокси)3-(2',3',5'-три-О-ацетилD-рибофуранозил)тиазоло[4,5-d]пиримидин-2-она в виде пенообразного твердого вещества 17: т.пл. 74,5-76,3 С; Rf=0,7 (SiO2, 20% EtOAC-CHCl3); 1 Н ЯМР (400 МГц d6-DMSO)10,83 (с, 1 Н), 7,39 (с, 2 Н), 6,03 (д, J=4,0, 1 Н), 5,91-5,96 (м, 1 Н), 5,69 (т, J=6,4, 1 Н), 4,30-4,70 (м, 1 Н), 4,224,26 (м, 1 Н), 4,16-4,20 (м, 1 Н), 3,90-4,00 (м, 2 Н), 2,97-3,01 (м, 1 Н), 2,07 (с, 3 Н), 2,06 (с, 3 Н), 2,04 (с, 3 Н),1,88 (с, 3 Н), 1,17-1,25 (м, 18 Н). Стадия 3. Получение 5-ацетиламино-7-метиламино-3-(2',3',5'-три-О-ацетилD-рибофуранозил)тиазоло[4,5-d]пиримидин-2-она (19). Промежуточный продукт из стадии 2 выше (1,7 г, 2,27 ммоль) растворяли в диоксане (20 мл) при температуре окружающей среды. К раствору добавляли 2,0 М раствор метиламина (3,4 мл, 6,8 ммоль) в метаноле. Спустя 2 ч исходный материал потреблялся. Реакционную смесь концентрировали и затем очищали методом флэш-хроматографией (SiO2, градиентная элюция, 20-80% ЕtОАС-СНСl3) с получением 945 мг (83%) чистого указанного в заголовке соединения в виде желтого масла: [М+Н]+ 498,2,[2 М+Н]+ 995,4; Rf=0,55 (10% CH3OH-CHCl3); 1 Н ЯМР (400 МГц d6-DMSO)10,13 (с, 1 Н), 7,70 (д, J=4,41,1 Н), 5,95-6,02 (м, 2 Н), 5,69 (с, 1 Н), 4,35-4,39 (м, 1 Н), 4,16-4,23 (м, 2 Н), 2,90 (д, J=4,8, 3 Н), 2,20 (с, 3 Н),2,07 (с, 3 Н), 2,02 (с, 3 Н), 2,00 (с, 3 Н). Стадия 4. Получение 5-амино-7-метиламино-3D-рибофуранозил)тиазоло[4,5-d]пиримидин-2-она (18). Промежуточный продукт из стадии 3 выше (420 мг, 0,85 ммоль) растворяли в диоксане (4 мл) и к раствору добавляли 1 М LiOH (8,5 мл, 8,5 ммоль). О-Ацетильные группы удалялись в пределах 40 мин с образованием промежуточного продукта при Rf=0,15 (SiO2, 5% MeOH-EtOAC). Спустя 2 ч N-ацетил удалялся, как показано ТСХ Rf=0,20 (SiO2, 5% MeOH-EtOAC). Реакционную смесь нейтрализовали стехиометрической уксусной кислотой, экстрагировали смесью 25% IРА-СНСl3 и затем концентрировали с получением 195 мг (70%) 18. Аналитическую пробу указанного в заголовке соединения 18 получали методом препаративной ТСХ (SiO2; вода-MeOH-EtOAC, 10:20:70) в виде белого твердого вещества: [М+Н]+ 330,0; Rf=0,20 (5% MeOH-EtOAc); т.пл. 108 С; 1H ЯМР (400 МГц d6-DMSO)7,06 (д, J=3,6, 1 Н), 6,24 (с,2 Н), 5,85 (д, J=5,2, 1H), 5,22 (д, J=4,8, 1H), 4,93 (д, J=5,2, 1H), 4,70-4,80 (м, 2 Н), 4,07 (д, J=4,8, 1H), 3,75 (д,J=4,4, 1H), 3,5-3,6 (м, 1 Н), 3,40-3,50 (м, 1 Н), 2,82 (д, J=4,4, 3 Н). Пример 8. 5-Амино-7-диметиламиноD-рибофуранозилтиазоло[4,5-d]пиримидин-2-она (20).[4,5-d]пиримидин-2-она. Подобно процедуре, сходной со стадией 2 примера 7, 5-ацетиламино-7-диметиламино-3-(2',3',5'три-О-ацетилD-рибофуранозил)тиазоло[4,5-d]пиримицин-2-он получали с выходом 80% в виде желтого масла: М+ 511,14; Rf=0,70 (SiO2, 10% MeOH-СНСl3); 1 Н ЯМР (400 МГц d6-DMSO)10,15 (с, 1 Н), 6,106,15 (м, 1 Н), 5,98-6,09 (м, 1 Н), 5,5,66-5,70 (м, 1 Н), 4,35-4,40 (м, 1 Н), 4,22-4,27 (м, 1 Н), 4,14-4,08 (м, 1 Н),3,18 (с, 6 Н), 2,19 (с, 3 Н), 2,08 (с, 3 Н), 2,06 (с, 3 Н), 1,99 (с, 3 Н). Стадия 2. Получение 5-амино-7-диметиламино-3D-рибофуранозилтиазоло[4,5-d]пиримидин-2 она (20). Подобно процедуре, сходной со стадией 3 примера 7, указанное в заголовке соединение 20 получали с выходом 82%. Аналитическую пробу получали методом препаративной ТСХ (SiO2; вода-MeOHEtOAC, 10:20:70) в виде белого твердого вещества: [М+Н]+ 344,0; [2 М+Н]+ 687,4; т.пл. 112,С; Rf=0,20(д, J=5,2, 1H), 4,71-4,76 (м, 2 Н), 4,07-4,09 (м, 1 Н), 3,7-3,8 (м, 1 Н), 3,5-3,6 (м, 1 Н), 3,5-3,6 (м, 1 Н), 3,09 (с,6 Н). Элементный анализ для C12H17N5O5S: рассчитано: С, 41,98; Н, 4,99; N, 20,40; найдено: С, 41,32; Н,5,14; N, 18,59. Пример 9. Моногидрохлоридная соль 5-амино-7-циклопропиламино-3D-рибофуранозилтиазоло Стадия 1. Получение 5-ацетиламино-7-циклопропиламино-3-(2',3',5'-три-О-ацетилD-рибофуранозил)тиазоло[4,5-d]пиримидин-2-она. Подобно процедуре, сходной со стадией 2 примера 3, получали 5-ацетиламино-7-циклопропиламино-3-(2',3',5'-три-О-ацетилD-рибофуранозил)тиазоло[4,5-d]пиримидин-2-он с выходом 80% в виде желтого масла: Rf=0,45 (SiO2, 75% EtOAC-CHCl3); 1H ЯМР (400 МГц d6-DMSO)10,11 (с, 1 Н), 7,87 (д,J=2,8, 1H), 5,98-6,01 (м, 1 Н), 5,70-5,76 (с, 1 Н), 4,32-4,39 (м, 1 Н), 4,16-4,30 (м, 2 Н), 3,85 (с, 1 Н), 2,87 (с,1 Н), 2,25 (с, 3 Н), 2,07 (с, 3 Н), 2,06 (с, 3 Н), 1,98 (с, 3 Н), 0,73-0,76 (м, 2 Н), 0,57-0,60 (м, 2 Н). Стадия 2. Получение 5-амино-7-циклопропиламино-3D-рибофуранозилтиазоло[4,5-d]пиримидин-2-она. Подобно процедуре, сходной со стадией 3 примера 7, 5-амино-7-циклопропиламино-3D-рибофуранозилтиазоло[4,5-d]пиримидин-2-он получали с выходом 79%. Аналитическую пробу получали методом препаративной ТСХ (SiO2; вода-MeOH-EtOAC, 10:20:70) в виде белого твердого вещества: Rf=0,20(д, J=5,6, 1H), 5,22 (д, J=6, 1H), 4,92 (д, J=5,2, 1 Н), 4,70-4,80 (м, 2 Н), 4,05-4,10 (м, 1 Н), 3,7-3,8 (м, 1 Н), 3,53,6 (м, 1 Н), 3,45-3,50 (м, 1 Н), 2,8 (с, 1 Н), 0,68-0,70 (м, 2 Н), 0,54-0,57 (м, 2 Н). Стадия 3. Получение гидрохлоридной соли 5-амино-7-циклопропиламино-3D-рибофуранозилтиазоло[4,5-d]пиримидин-2-она (21). Указанное в заголовке соединение получали добавлением твердого вещества, полученного в стадии 2 выше, к интенсивно перемешиваемой 4 М НСl в диоксане с получением указанного в заголовке соединения в виде белого твердого вещества: т.пл. 99 С; 1H ЯМР (400 МГц d6-DMSO)7,25 (д, J=2,8, 1H), 6,23(с, 2 Н), 5,87 (д, J=5,2, 1 Н), 5,21 (шир.с, 1 Н), 4,98 (шир.с, 1 Н), 4,73-4,79 (м, 2 Н), 4,09 (т, J=5,6, 1 Н), 3,723,79 (м, 1 Н), 3,55-3,60 (м, 1 Н), 3,45-3,37 (м, 1 Н), 2,75-2,82 (м, 1 Н), 0,72-0,79 (м, 2 Н), 0,55-0,63 (м, 2 Н). Элементный анализ для C13H17N5O5SHCl: рассчитано: С, 39,85; Н, 4,63; N, 17,87; Сl, 9,05; найдено: С, 39,66; Н, 4,85; N, 16,57; Сl, 8,13. Пример 10. 5-Амино-7-циклопентиламино-3D-рибофуранозилтиазоло[4,5-d]пиримидин-2-он (22).- 16008380 Стадия 1. Получение 5-ацетиламино-7-пирролидино-3-(2',3',5'-три-O-ацетилD-рибофуранозил) тиазоло[4,5-d]пиримидин-2-она. Подобно процедуре, сходной со стадией 2 примера 7, 5-ацетиламино-7-пирролидино-3-(2',3',5'-триО-ацетилD-рибофуранозил)тиазоло[4,5-d]пиримидин-2-он получали с выходом 70%. Аналитическую пробу получали методом препаративной ТСХ (SiO2; вода-MeOH-EtOAC, 10:20:70) в виде белого твердого вещества; т.пл. 108 С (разл.); Rf=0,80 (10% вода и 20% метанол в этилацетате); [М+Н]+ 384,0; 1H ЯМР (400 МГц d6-DMSO)7,00 (д, J=7,2, 1 Н), 6,17 (с, 2 Н), 5,18 (д, J=5,2, 1H), 5,21 (д, J=5,6, 1 Н), 4,92 (д,J=5,6, 1 Н), 4,74-4,80 (м, 2 Н), 4,30-4,35 (м, 1 Н), 4,05-4,10 (м, 1 Н), 3,70-3,80 (м, 1 Н), 3,55-3,60 (м, 1 Н), 3,303,45 (м, 1 Н), 1,40-2,0 (м, 8 Н). Стадия 2. Получение 5-амино-7-циклопентиламино-3D-рибофуранозилтиазоло[4,5-d]пиримидин 2-она. Подобно процедуре, сходной стадии 3 примера 7, указанное в заголовке соединение 22 получали с выходом 70%. Аналитическую пробу получали методом препаративной ТСХ (SiO2; вода-МеОН-EtOAC,10:20:70) в виде белого твердого вещества: т.пл. 108 С (разл.); Rf=0,80 (10% вода и 20% метанол в этилацетате); [М+Н]+ 384,0; 1 Н ЯМР (400 МГц d6-DMSO)7,00 (д, J=7,2, 1H), 6,17 (с, 2 Н), 5,18 (д, J=5,2, 1H),5,21 (д, J=5,6, 1H), 4,92 (д, J=5,6, 1 Н), 4,74-4,80 (м, 2 Н), 4,30-4,35 (м, 1 Н), 4,05-4,10 (м, 1 Н), 3,70-3,80 (м,1 Н), 3,55-3,60 (м, 1 Н), 3,30-3,45 (м, 1 Н), 1,40-2,0 (м, 8 Н). Пример 11. 5-Амино-7-пирролидино-3D-рибофуранозилтиазоло[4,5-d]пиримидин-2-он (23). Стадия 1. Получение 5-ацетиламино-7-пирролидино-3-(2',3',5'-три-О-ацетилD-рибофуранозил) тиазоло[4,5-d]пиримидин-2-она. Подобно процедуре, сходной со стадией 2 примера 7, 5-ацетиламино-7-пирролидино-3-(2,3,5-три-ОацетилD-рибофуранозил)тиазоло[4,5-d]пиримидин-2-он получали с выходом 79% в виде желтого масла: [М+Н]+ 538,1; Rf=0,80 (SiO2, вода-MeOH-EtOAC, 10:20:70); 1 Н (400 МГц d6-DMSO)10,04 (с, 1 Н),5,97-6,02 (м, 2 Н), 5,68 (с, 1 Н), 4,38 (дд, J=11,6, 3,6, 1 Н), 4,15-4,23 (м, 2 Н), 3,58 (с, 4 Н), 2,23 (с, 3 Н), 2,08 (с,3 Н), 2,05 (с, 3 Н), 1,98 (с, 3 Н), 1,89 (с, 4 Н). Стадия 2. Получение 5-амино-7-пирролидино-3D-рибофуранозил)тиазоло[4,5-d]пиримидин-2-она. Подобно процедуре, сходной со стадией 3 примера 7, указанное в заголовке соединение 23 получали с выходом 81%. Аналитическую пробу получали методом препаративной ТСХ (SiO2; вода-MeOH-EtOAC,10:20:70) в виде белого твердого вещества: т.пл. 112,4 С (разл.); [М+Н]+ 370,3; 1H ЯМР (400 МГц d6DMSO)6,22 (с, 2 Н), 5,90 (д, J=4,8, 1 Н), 5,23 (д, J=5,2, 1 Н), 4,94 (д, J=4,4, 1 Н), 4,68-4,75 (м, 2 Н), 4,08 (д,J=4,8, 1 Н), 3,71-3,76 (м, 1 Н), 3,55 (шир.с, 5 Н), 3,38-3,54 (м, 1 Н), 1,87 (с, 4 Н). Схема 4c) Безв. НСl, iPrOAc, iPrOH. Пример 12. Гидрохлорид 5-амино-7-циклопентиламино-3-(5'-O-L-валинил)D-рибофуранозил)тиазоло[4,5-d]пиримидин-2-она (24). При интенсивном перемешивании промежуточный продукт В растворяют в растворе безводного хлорида водорода в изопропилацетате при 0 С и дают раствору нагреться до комнатной температуры. К этой гетерогенной смеси добавляют дополнительное количество изопропилацетата. Реакционную смесь перемешивают в течение дополнительных 12 ч. Добавляют толуол и продукт фильтруют и сушат в вакууме с получением желаемой ди-НСl-соли 24. Промежуточные продукты получают следующим образом. 5-Амино-7-циклопентиламино-3-(2',3'-О-изопропилиденD-рибофуранозилтиазоло[4,5-d]пиримидин-2-он (А). Соединение А получают в соответствии с процедурой Kini et al., перемешиванием смеси 5-амино-7 циклопентиламино-3D-рибофуранозил)тиазоло[4,5-d]пиримидин-2-она 22 с ацетоном, ДМСО, метансульфоновой кислотой и избытком диметоксипропана при 0 С до потребления исходного материала. Реакционную смесь добавляют в ледяную воду и нейтрализуют до рН 7 насыщенным раствором NaHCO3 и экстрагируют EtOAC. Органический слой концентрируют и подвергают колоночной хроматографии на силикагеле с получением 2',3'-защищенного диолового продукта. 5-Амино-7-циклопентиламино-3-(5'-О-(N-(трет-бутоксикарбонил)-L-валинил)-2',3'-О-изопропилиден-D-рибофуранозил)тиазоло[4, 5-d]пиримидин-2-он (В). К раствору 1,0 экв. N-(трет-бутоксикарбонил)-L-валина в ТГФ при 0 С добавляют 1,1 экв. EDC. После перемешивания в течение 30 мин добавляют 1,0 экв. 5-амино-7-циклопентил-3-(2',3'-О-изопропилиденD-рибофуранозил)тиазоло[4,5-d]пиримидин-2-она, А, и 1,5 экв. DMAP. Эту реакционную смесь нагревают до комнатной температуры, и дают ей перемешиваться в течение 5 ч, и концентрируют. Остаток растворяют в EtOAC, распределяют с 1 н. НСl и нейтрализуют насыщенным водным NaНСО 3 (10 мл). Водную фазу сушат над Na2SO4, фильтруют и упаривают в вакууме с получением промежуточного продукта В, который очищают методом колоночной хроматографии на силикагеле. Биологическое тестирование Способность соединений формулы I демонстрировать благоприятные характеристики пероральной доставки и индуцировать иммунные реакции при введении выбранным способом была с легкостью продемонстрирована в экспериментах на мышах и гончих собаках. Результаты таких измерений для соединений формулы I могут быть сравнены с результатами подобных экспериментов с соединениями, описанными в литературе, цитируемой в данном описании (например, патентах США с номерами 5041426 и 4880784) для выявления преимуществ соединений формулы I, касающихся фармакокинетических (т.е. показывающих, как эти соединения влияют на организм) и фармакодинамических (т.е. показывающих,что организм делает с ними) свойств. Концентрации интерферона альфа (Mu-IFN-) в мышах. Здоровая мышь обеспечивает полезную систему для оценки степени, в которой описанные здесь изобретения обеспечивают улучшение в пероральной доставке 1 (изаторибина). Можно не только измерить концентрации изаторибина в плазме, возникающие в результате перорального введения указанного пролекарства, но было также проведено интенсивное иммунологическое исследование на мыши, которое обеспечило реагенты, подходящие для измерения уровней интерферона альфа, представляющего интерес цитокина, отражающих одну из желаемых биологических активностей изаторибина. Авторы использовали мышиную систему в серии экспериментов, которые показывают, что соединение 3, эфир 5'-валина 1 (вал-изаторибин), индуцирует реакцию интерферона, существенно улучшенную в сравнении с реакцией, полученной от введения самого изаторибина. Табл. 1 регистрирует результаты анализа на мышиный интерферон альфа в плазме мышей, которым вводили 2 раза изаторибин, приготовленный в бикарбонате, при уровне 50 мг/кг пероральным способом. Очевидно, что интерферон не измерялся даже в том случае, когда введение этой дозы повторяли после интервала 4 ч.- 18008380 Таблица 1 Концентрация (пг/мл) интерферона альфа (Mu-IFN-) в плазме мышей после двух пероральных доз 50 мг/кг изаторибина с интервалом 4 ч между нимиBQLn - Ниже повышенного определяемого предела n пг/мл. Табл. 2 регистрирует результаты анализов на мышиный интерферон альфа в плазме мышей, которым сначала вводили дозу бикарбоната, а затем спустя 4 ч вводили перорально изаторибин, приготовленный в бикарбонате, при уровне 50 мг/кг. Интерферон сообщался в плазме из 4 мышей, в том числе 2 мышей, которые получали дозу носителя бикарбоната. Все величины, сообщенные в этом эксперименте, были низкими, и сообщенные уровни интерферона не были стабильно сообщаемыми для всех 3 мышей, оцениваемых в каждой временной точке, что предполагает, что эти сигналы могут быть артефактами, возникающими из измерений, лежащих вблизи нижних пределов данного анализа. Таблица 2 Концентрация (пг/мл) интерферона альфа (Mu-IFN-) в плазме мышей после одной дозы носителя и одной дозы 50 мг/кг изаторибина спустя 4 чBQLn - Ниже повышенного определяемого предела n пг/мл.- 19008380 Табл. 3 регистрирует результаты анализов на мышиный интерферон альфа в плазме мышей, которым сначала вводили перорально вал-изаторибин, растворенный в бикарбонате, в дозе, эквивалентной 50 мг/кг изаторибина на молярной основе. Очевидно, что интерферон легко измерялся при 1,0, 1,5 и при 2,0 ч после введения дозы. Интерферон детектировался во всех мышах, анализируемых в конкретной временной точке, что свидетельствует о достоверности эффекта после введения вал-изаторибина. Таким образом, единственное введение вализаторибина было превосходящим в сравнении с либо единственной дозой, либо с повторяемой дозой изаторибина. Таблица 3 Концентрация (пг/мл) интерферона альфа (Mu-IFN-) в плазме мышей после единственной дозы 73,0 мг/кг вал-изаторибинаBQL - Ниже определяемого предела 12,5 пг/мл.BQLn - Ниже повышенного определяемого предела n пг/мл.NR - Не сообщаемые. Данные, представленные в табл. 1, 2 и 3, могут быть также рассмотрены с точки зрения встречаемости измеряемых уровней интерферона. Интерферон детектировался в плазме только у 4 из 114 мышей, использованных в исследованиях по изаторибину, тогда как 10 из 30 мышей, которым вводили вал-изаторибин, имели детектируемый интерферон в плазме. Таким образом, это пролекарство увеличивало долю мышей, проявляющих реакцию интерферона с 4 до 30%, а величина как средней, так и максимальной реакции увеличивалась в 2 раза. В других экспериментах уровни в плазме изаторибина и интерферона альфа измеряли в мышах, которым вводили дозы изаторибина внутривенным способом, и эти уровни сравнивали с уровнями изаторибина и интерферона альфа, возникающими после перорального введения вал-изаторибина. Эти результаты суммированы на фиг. 1. На этой фигуре очевидно, что уровни интерферона альфа, индуцированные перорально вводимым вал-изаторибином ("вал-изатор") (при молярном эквиваленте 50 мг/кг изаторибина), были сходными с уровнями для внутривенного изаторибина ("изатор") при 25 мг/кг. Таким образом,пероральный вал-изаторибин обеспечивает уровни изаторибина и интерферона, которые составляют приблизительно 50% уровней, наблюдаемых после внутривенного введения самого изаторибина. Гончая (коротконогая) собака. Исследовали действие пролекарства (вал-изаторибина, 3) на системное экспонирование изаторибину (1) после перорального введения гончим собакам. Изаторибин готовили в растворе бикарбоната натрия. Вал-изаторибин и изаторибин готовили в виде следующих композиций, которые были выбраны для гарантии растворимости. Композиция 1. Изаторибин в растворе бикарбоната натрия, 1 и 4 мг/мл. Композиция 2. Вал-изаторибин в забуференном фосфатом солевом растворе, 1,62 и 6,48 мг/мл, эквивалентные 1 и 4 мг/мл изаторибина в расчете на моль. 4 самца и 4 самки взрослых гончих собак с весом 15-27 кг и в возрасте приблизительно 1-2 года использовали в начале этого исследования. Животных делили на две группы по 2 самца и 2 самки каждая. Тестматериал вводили кормлением через желудочный зонд в дни 1 и 8, оставляя 7-дневный период вымывания между введениями. Пробы крови (2 мл) брали у каждого животного при предварительной дозе, 15, 30 мин, 1,2, 3, 4, 6, 8 и 10 ч в обработанные литием-гепарином пробирки после каждого введения дозы. Плазму замораживали при -70 С до анализа. Плазму анализировали на изаторибин с использованием HPLC-MS/MS-анализа. Фармакокинетические параметры для изаторибина, образованного из изаторибина или вал-изаторибина,в каждой собаке суммированы в табл. 4 и 5. Отношения ключевых фармакокинетических параметров, определяющие максимальную концентрацию (Cmax) и общее экспонирование, измеренные по площади под кривой зависимости концентрации от времени (AUC), для пролекарства и раствора бикарбоната в дозе 50 мг/кг,суммированы в табл. 6. Для пролекарства 3 отношение Cmax составляло 2,980,695 и отношение AUC составляло 2,380,485. Эти результаты показывают, что при дозе 50 мг/кг пролекарство вал-изаторибин обеспечивало существенно более высокую Сmах и более высокую биодоступность, чем изаторибин в растворе бикарбоната. Отношения для Сmах и AUC для пролекарства относительно раствора бикарбоната для дозы 10 мг/кг суммированы в табл. 7. Для пролекарства отношение Сmах составляло 2,240,249 и отношение AUC составляло 1,820,529. Эти результаты свидетельствуют о том, что при дозе 10 мг/кг пролекарство вализаторибин обеспечивало существенно более высокую Сmах и более высокую биодоступность, чем изаторибин в бикарбонатном растворе.- 20008380 Таким образом, максимальные концентрации изаторибина, полученные после перорального введения доз, являются по меньшей мере удвоенными и системное экспонирование изаторибину усиливается приблизительно в 2 раза после перорального введения пролекарства вал-изаторибина в сравнении с одним изаторибином, как при дозе 10 мг/кг, так и при дозе 50 мг/кг. Таблица 4 Фармакокинетические параметры изаторибина в собаках, которым вводили дозы 50 мг/кг Таблица 5 Фармакокинетические параметры изаторибина в собаках, которым вводили дозы 10 мг/кг- 21008380 Таблица 6 Отношение фармакокинетических параметров изаторибина в собаках, которым вводили дозы 50 мг/кг Таблица 7 Отношение фармакокинетических параметров изаторибина в собаках, которым вводили дозы 10 мг/кг Пролекарство является предпочтительным по нескольким причинам. Во-первых, пролекарство можно легко приготовить с обеспечением высокой доли активного агента. Это приводит к малым размерам капсул для конкретной дозы, что является преимуществом для перорально вводимого продукта. Вовторых, пролекарства предоставляют перспективу маскирования активной структуры, когда данный агент проходит через выстилку лимфоидной ткани кишечника, что должно минимизировать активацию этой ткани и посредством этого улучшать пероральную переносимость. Наконец, при испытанных дозах вал-изаторибин обеспечивает уровни изаторибина в плазме, которые находятся вполне в диапазоне, желательном для биологического действия после перорального введения, что не имеет места в случае самого изаторибина. Описанные выше примеры соединений могут быть приготовлены в виде фармацевтических композиций в соответствии со следующими общими примерами. Пример 1. Парентеральная композиция. Для приготовления парентеральной фармацевтической композиции, пригодной для введения посредством инъекции, 100 мг водорастворимой соли соединения формулы I растворяют в ДМСО и затем смешивают с 10 мл 0,9% стерильного солевого раствора. Эту смесь включают в дозированную унифицированную форму, пригодную для введения посредством инъекции. Пример 2. Пероральная композиция. Для приготовления фармацевтической композиции для пероральной доставки 100 мг соединения- 22008380 формулы I смешивают с 750 мг лактозы. Эту смесь включают в пероральную дозированную унифицированную форму, такую как твердая желатиновая капсула, которая пригодна для перорального введения. Должно быть понятно, что приведенное выше описание имеет примерный и объясняющий характер и предназначено для иллюстрации согласно изобретению и его предпочтительных вариантов. При помощи рутинного экспериментирования специалист сможет найти очевидные модификации и вариации,которые могут быть произведены без отклонения от идеи согласно изобретению. Таким образом, предполагается, что данное изобретение определяется не приведенным выше описанием, а следующей формулой изобретения и ее эквивалентами. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное формулой IR2 означает Н или OR5, где R5 независимо означает Н или алкил, выбранный из метила, этила, нпропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила,гексила, изогексила; и где, если R2 означает -ОН, по меньшей мере одна из групп R1 является рацемической, L- или Dаминокислотной группой -C(O)CHNH2R4; или его фармацевтически приемлемая соль. 2. Соединение или фармацевтически приемлемая соль по п.1, где по меньшей мере одна из групп R1 является рацемической, L- или D-аминокислотной группой -С(О)CHNH2R4, где R4 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила,изопентила, трет-пентила, гексила, изогексила, и где остальные группы R1 означают Н; R2 означает OR5,где R5 независимо выбран из Н или алкила. 3. Соединение или фармацевтически приемлемая соль по п.2, где по меньшей мере одна из групп R1 является L-аминокислотной группой -С(О)CHNH2R4, где R4 означает алкил, выбранный из метила, этила,н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила,гексила, изогексила, и где остальные группы R1 означают Н; R2 означает OR5, где R4 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила,изопентила, трет-пентила, гексила, изогексила. 4. Соединение или фармацевтически приемлемая соль по п.3, где по меньшей мере одна из групп R1 является L-аминокислотной группой -С(О)CHNH2R4, где R4 означает -СН(СН 3)2 и где остальные группыR1 означают Н; и R2 означает ОН. 5. Соединение или фармацевтически приемлемая соль по п.1, выбранная из группы, состоящей из 6. Соединение или фармацевтически приемлемая соль по п.1, где R1 независимо означает Н,-C(O)R3 или рацемическую L- или D-аминокислотную группу -С(О)CHNH2R4, a R2 означает Н, где R3 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила,трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила, a R4 означает Н или алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила. 7. Соединение или фармацевтически приемлемая соль по п.1, где R1 означает Н и R2 означает Н. 8. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и соединение, представленное формулой IR2 означает Н, OR5, где R5 независимо означает Н или алкил, выбранный из метила, этила, н- 24008380 пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила,гексила, изогексила; и где, если R2 означает -ОН, по меньшей мере одна из групп R1 является рацемической, L- или Dаминокислотной группой -C(O)CHNH2R4; или его фармацевтически приемлемую соль. 9. Фармацевтическая композиция по п.8, где по меньшей мере одна из групп R1 является рацемической, L- или D-аминокислотной группой -С(О)CHNH2R4, где R4 означает алкил, выбранный из метила,этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, третпентила, гексила, изогексила, и где остальные группы R1 означают Н; R2 означает OR5, где R5 независимо выбран из Н или алкила, выбранного из метила, этила, н-пропила, изопропила, бутила, изобутила, вторбутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила. 10. Фармацевтическая композиция по п.9, где по меньшей мере одна из групп R1 является Lаминокислотной группой -C(O)CHNH2R4, где R4 означает алкил, выбранный из метила, этила, н-пропила,изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила,изогексила, и где остальные группы R1 означают Н; R2 означает OR5, где R5 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила. 11. Фармацевтическая композиция по п.10, где по меньшей мере одна из групп R1 является Lаминокислотной группой -C(O)CHNH2R4, где R4 означает -СН(СН 3)2 и где остальные группы R1 означают Н; и R2 означает ОН. 12. Фармацевтическая композиция по п.8, которая выбрана из группы, состоящей из 13. Фармацевтическая композиция по п.8, где R1 независимо означает Н, -C(O)R3 или рацемическую, L- или D-аминокислотную группу -С(О)CHNH2R4, a R2 означает Н, где R3 означает алкил, выбранный из метила, этила, н-пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила, гексила, изогексила, a R4 означает Н или алкил, выбранный из метила, этила, н- 25008380 пропила, изопропила, бутила, изобутила, втор-бутила, трет-бутила, пентила, изопентила, трет-пентила,гексила, изогексила. 14. Фармацевтическая композиция по п.13, где R1 означает Н и R2 означает Н. 15. Применение соединения или фармацевтически приемлемой соли по пп.1-7 для приготовления лекарственного средства, которое, в случае необходимости, модулирует у пациента активность цитокина. 16. Применение соединения или фармацевтически приемлемой соли по пп.1-7 для приготовления лекарственного средства для лечения вирусных или опухолевых заболеваний. 17. Применение по п.16, где вирусное заболевание вызвано аденовирусом, цитомегаловирусом, вирусом гепатита A (HAV), вирусом гепатита В (HBV), вирусом желтой лихорадки, вирусом гепатита С(HCV), вирусом простого герпеса типа 1 и 2, вирусом опоясывающего лишая, герпесвирусом 6 человека,вирусом иммунодефицита человека (ВИЧ), папилломавирусом человека (HPV), вирусом гриппа А, вирусом гриппа В, вирусом кори, вирусом парагриппа, полиовирусом, поксвирусом, вирусом натуральной оспы и обезьяньим вирусом, риновирусом, респираторно-синцитиальным вирусом (RSV), вирусами, которые вызывают геморрагические лихорадки, аренавирусами, буньявирусами и филовирусами, вирусом энцефалита, вирусом западного Нила, вирусом ЛаКроссе, вирусом Калифорнийского энцефалита, вирусом Венесуэльского лошадиного энцефалита, вирусом Восточного лошадиного энцефалита, вирусом Западного лошадиного энцефалита, вирусом Японского энцефалита, вирусом лесов Кизанура и передаваемым клещами вирусом. 18. Применение соединения или фармацевтически приемлемой соли по пп.1-7 для приготовления лекарственного средства для лечения бактериальных, грибковых инфекций или инфекций простейших.
МПК / Метки
МПК: A61K 31/7052, A61P 37/02, C07H 19/24
Метки: 4,5-d, применения, пиримидиннуклеозиды, 3-&beta-d-рибофуранозилтиазоло
Код ссылки
<a href="https://eas.patents.su/27-8380-3-beta-d-ribofuranoziltiazolo-45-d-pirimidinnukleozidy-i-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">3-&beta-d-рибофуранозилтиазоло [4,5-d] пиримидиннуклеозиды и их применения</a>
Предыдущий патент: Фосфорсодержащие соединения и их применения
Следующий патент: Высокоселективные ингибиторы обратного захвата норэпинефрина и способы их применения
Случайный патент: Получение функционально эффективных органических соединений расщеплением лигнита












