С-4″-замещенные макролидные производные
Номер патента: 2440
Опубликовано: 25.04.2002
Авторы: Канеко Такуши, Глейзер Эдвард Алан, Ченг Хенгмяо, Янг Бингуэй Виэра, Бронк Брайан Скотт, Литейвик Майкл Энтони
Формула / Реферат
1. Соединение формулы
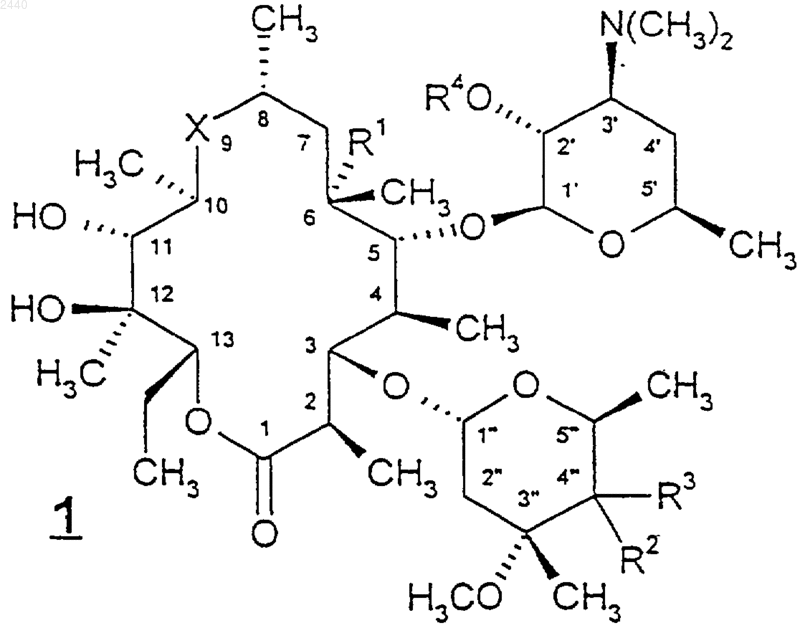
или его фармацевтически приемлемая соль, где
Х представляет собой -С(O)- или -N(С1-С6алкил)СН2-, для которых первая черточка в каждой из перечисленных выше групп Х обозначает связь, через которую эта группа присоединена к С-10-углероду соединения формулы 1, а последняя черточка для каждой группы обозначает связь, через которую эта группа присоединена к С-8-углероду соединения формулы 1;
R1 представляет собой Н, гидрокси или метокси;
R2 представляет собой гидрокси;
R3 представляет собой C1-С10алкил, С2-С10алкенил, С2-С10алкинил, циано, -CH2S(O)nR8, где n является целым числом от 0 до 2, -CH2OR8, -CH2N(OR9)R8, -CH2NR8R15, -(СН2)m(С6-С10арил) или -(СН2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R3 возможно замещены группами R16 в количестве от 1 до 3;
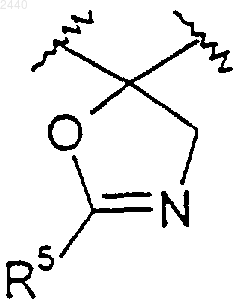
или R2 и R3 вместе образуют оксазолильное кольцо, как показано ниже

R4 представляет собой Н, -C(O)R9, -C(O)OR9, -C(O)NR9R10 или гидроксизащитную группу;
R5 представляет собой -SR8, -(CH2)nC(O)R8, где n равно 0 или 1, C1-С10алкил, С2-С10алкенил, С2-С10алкинил, -(СН2)m(С6-С10арил) или -(СН2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R5 возможно замещены группами R16 в количестве от 1 до 3;
каждая R6 и R7 независимо представляет собой Н, гидрокси, C1-С6алкокси, С1-С6алкил, С2-С6алкенил, С2-С6алкинил, -(СН2)m(С6-С10арил) или -(СН2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4;
каждая R8 независимо представляет собой Н, C1-С10алкил, С2-С10алкенил, С2-С10алкинил, -(CH2)qCR11R12(CH2)rNR13R14, где q и r, каждый независимо, является целым числом от 0 до 3, за исключением того, что q и r оба не равны 0, -(СН2)m(С6-С10арил) или -(СН2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R8, исключая Н, возможно замещены группами R16 в количестве от 1 до 3;
или в том случае, когда R8 представлена как -CH2NR8R15, R15 и R8 вместе могут образовывать 4-10-членное моноциклическое или полициклическое насыщенное кольцо либо 5-10-членное гетероарильное кольцо, причем указанные насыщенные и гетероарильные кольца возможно включают в себя 1 или 2 гетероатома, выбранных из О, S и -N(R8)-, в дополнение к азоту, к которому присоединены R15 и R8, указанное насыщенное кольцо возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи и указанные насыщенные и гетероарильные кольца возможно замещены группами R16 в количестве от 1 до 3;
каждая R9 и R10 независимо представляет собой Н или C1-С6алкил;
каждую R11, R12, R13 и R14 независимо выбирают из Н, C1-С10алкила, -(СН2)m(С6-С10арила) и -(CH2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4, причем упомянутые выше группы R11, R12, R13 и R14, исключая Н, возможно замещены группами R16 в количестве от 1 до 3;
или R11 и R13 вместе образуют -(СН2)p-, где р является целым числом от 0 до 3, так что образуется 4-7-членное насыщенное кольцо, которое возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи;
или R13 и R14 вместе образуют 4-10-членное моноциклическое или полициклическое насыщенное кольцо либо 5-10-членное гетероарильное кольцо, причем указанные насыщенные и гетероарильные кольца возможно включают в себя 1 или 2 гетероатома, выбранных из О, S и -N(R8)-, в дополнение к азоту, к которому присоединены R13 и R14, указанное насыщенное кольцо возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи, и указанные насыщенные и гетероарильные кольца возможно замещены группами R16 в количестве от 1 до 3;
R15 представляет собой Н, C1-С10алкил, С2-С10алкенил или С2-С10алкинил, причем упомянутые выше группы R15 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено и -OR9;
каждую R16 независимо выбирают из галогено, циано, нитро, трифторметила, азидо, -C(O)R17, -C(O)OR17, -OC(O)OR17, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, гидрокси, C1-С6алкила, C1-С6алкокси, -(СН2)m(С6-С10арила) и -(СН2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4, и где указанные арильные и гетероарильные заместители возможно замещены 1 или 2 заместителями, независимо выбранными из галогено, циано, нитро, трифторметила, азидо, -C(O)R17, -C(O)OR17, -OC(O)OR17, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, гидрокси, C1-С6алкила и C1-С6алкокси;
каждую R17 независимо выбирают из Н, C1-С10алкила, С2-С10алкенила, С2-С10алкинила, -(СН2)m(С6-С10арила) и -(СН2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4;
при условии, что R8 не является Н в том случае, когда R3 представляет собой -CH2S(O)nR8.
2. Соединение по п.1, где R4 представляет собой Н, ацетил или бензилоксикарбонил.
3. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2NR15R8 или -CH2SR8.
4. Соединение по п.3, где R3 представляет собой -CH2NR15R8, а R15 и R8 независимо выбирают из Н, C1-С10алкила, С2-С10алкенила и С2-С10алкинила, причем упомянутые выше группы R15 и R8, исключая Н, возможно замещены 1 или 2 заместителями, независимо выбранными из гидрокси, галогено и C1-С6алкокси.
5. Соединение по п.4, где R15 и R8, каждую независимо, выбирают из Н, метила, этила, аллила, н-бутила, изобутила, 2-метоксиэтила, циклопентила, 3-метоксипропила, 3-этоксипропила, н-пропила, изопропила, 2-гидроксиэтила, циклопропила, 2,2,2-трифторэтила, 2-пропинила, втор-бутиыр, тpeт-бутила и н-гексила.
6. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2NHR8, а R8 представляет собой -(СН2)m(С6-С10арил), где m является целым числом от 0 до 4.
7. Соединение по п.6, где R8 представляет собой фенил или бензил.
8. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2NR15R8, a R15 и R8 вместе образуют 4-7-членное насыщенное кольцо.
9. Соединение по п.8, где R15 и R8 вместе образуют пиперидиновое, триметилениминовое или морфолиновое кольцо.
10. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2NR15R8, a R15 и R8 вместе образуют 5-10-членное гетероарильное кольцо, возможно замещенное одной или двумя C1-С6алкильными группами.
11. Соединение по п.10, где R15 и R8 вместе образуют пирролидиновое, триазолильное или имидазолильное кольцо, причем указанные гетероарильные группы возможно замещены 1 или 2 метильными группами.
12. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2SR8, а R8 выбирают из C1-С10алкила, С2-С10алкенила и С2-С10алкинила, причем указанные выше группы R8 возможно замещены 1 или 2 заместителями, независимо выбранными из гидрокси, галогено и C1-С6алкокси.
13. Соединение по п.12, где R8 представляет собой метил, этил или 2-гидроксиэтил.
14. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, а R3 выбирают из C1-С10алкила, С2-С10алкенила и С2-С10алкинила, причем указанные группы R3 возможно замещены 1 или 2 заместителями, независимо выбранными из гидрокси, -C(O)R17, -NR6R7, галогено, циано, азидо, 5-10-членного гетероарила и C1-С6алкокси.
15. Соединение по п.14, где R3 представляет собой метил, аллил, винил, этинил, 1-метил-1-пропенил, 3-метокси-1-пропинил, 3-диметиламино-1-пропинил, 2-пиридилэтинил, 1-пропинил, 3-гидрокси-1-пропинил, 3-гидрокси-1-пропенил, 3-гидроксипропил, 3-метокси-1-пропенил, 3-метоксипропил, 1-пропинил, н-бутил, этил, пропил, 2-гидроксиэтил, азидометил, формилметил, 6-циано-1-пентинил, 3-диметиламино-1-пропенил или 3-диметиламинопропил.
16. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, а R3 представляет собой -(СН2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4.
17. Соединение по п.16, где R3 представляет собой 2-тиенил, 2-пиридил, 1-метил-2-имидазолил, 2-фурил или 1-метил-2-пирролил.
18. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, а R3 представляет собой -(СН2)m(С6-С10арил), где m является целым числом от 0 до 4.
19. Соединение по п.18, где R3 представляет собой фенил.
20. Соединение по п.2, где R2 и R3 вместе образуют оксазолильное кольцо, как показано ниже
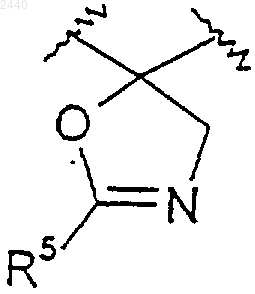
21. Соединение по п.2, где R3 выбирают из следующего:

где X3 представляет собой О, S или -N(R15)-; R9 и R15 такие, как определены в п.1, а группа -OR9 может быть присоединена к любому доступному углероду фенильной группы.
22. Фармацевтическая композиция для лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, которая содержит терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
23. Способ лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, при котором указанным млекопитающему, рыбе или птице вводят терапевтически эффективное количество соединения по п.1.
24. Способ получения соединения формулы
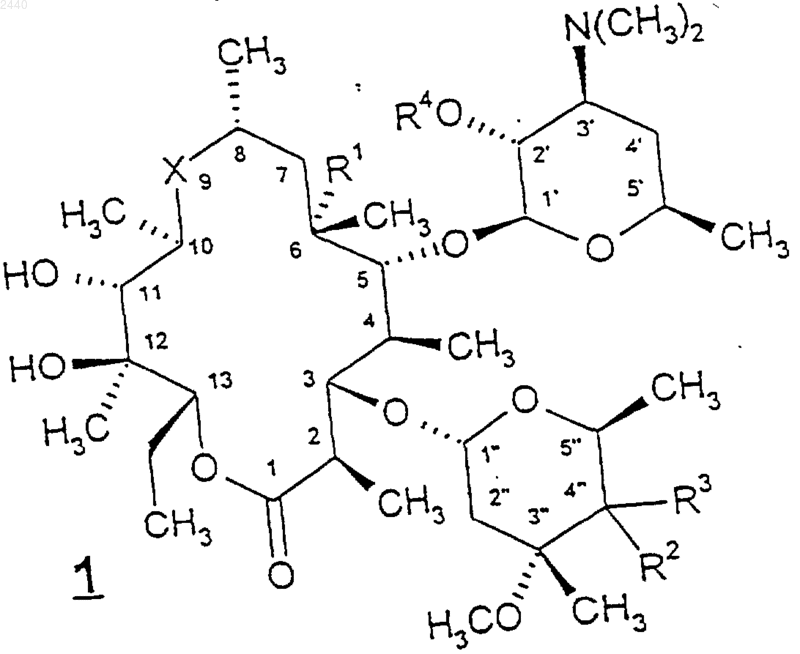
или его фармацевтически приемлемой соли, где
Х представляет собой -С(O)- или -N(С1-С6алкил)СН2-, для которых первая черточка в каждой из перечисленных выше групп Х обозначает связь, через которую эта группа присоединена к С-10-углероду соединения формулы 1, а последняя черточка для каждой группы обозначает связь, через которую эта группа присоединена к С-8-углероду соединения формулы 1;
R1 представляет собой Н, гидрокси или метокси;
R2 представляет собой гидрокси;
R3 представляет собой C1-С10алкил, С2-С10алкенил, С2-С10алкинил, циано, -CH2S(O)nR8, где n является целым числом от 0 до 2, -CH2OR8, -CH2N(OR9)R8, -CH2NR8R15, -(СН2)m(С6-С10арил) или -(СН2)m(5-10-членный гетероарил), где m представляет собой целое число от 0 до 4, причем упомянутые выше группы R3 возможно замещены группами R16 в количестве от 1 до 3;
или R2 и R3 вместе образуют оксазолильное кольцо, как показано ниже
R4 представляет собой Н, -C(O)R9, -C(O)OR9, -С(O)NR9R10 или гидроксизащитную группу;
R5 представляет собой -SR8, -(CH2)nC(O)R8, где n равно 0 или 1, C1-С10алкил, С2-С10алкенил, С2-С10алкинил, -(СН2)m(С6-С10арил) или -(СН2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R5 возможно замещены группами R16 в количестве от 1 до 3;
каждая R6 и R7 независимо представляет собой Н, гидрокси, C1-С6алкокси, С1-С6алкил, С2-С6алкенил, С2-С6алкинил, -(СН2)m(С6-С10арил) или -(СН2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4;
каждая R8 независимо представляет собой Н, C1-С10алкил, С2-С10алкенил, С2-С10алкинил, -(CH2)qCR11R12(CH2)rNR13R14, где q и r, каждый независимо, является целым числом от 0 до 3, за исключением того, что q и r оба не равны 0, -(СН2)m(С6-С10арил) или -(СН2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R8, исключая Н, возможно замещены группами R16 в количестве от 1 до 3;
или в том случае, когда R8 представлена как -CH2NR8R15, R15 и R8 вместе могут образовывать 4-10-членное моноцикличесъюх или полициклическое насыщенное кольцо либо 5-10-членное гетероарильное кольцо, причем указанные насыщенные и гетероарильные кольца возможно включают в себя 1 или 2 гетероатома, выбранных из О, S и -N(R8)-, в дополнение к азоту, к которому присоединены R15 и R8, указанное насыщенное кольцо возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи, и указанные насыщенные и гетероарильные кольца возможно замещены группами R16 в количестве от 1 до 3;
каждая R9 и R10 независимо представляет собой Н или С1-С6алкил;
каждую R11, R12, R13 и R14 независимо выбирают из Н, C1-С10алкила, -(СН2)m(С6-С10арила) и -(СН2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4, причем упомянутые выше группы R11, R12, R13 и R14, исключая Н, возможно замещены группами R16 в количестве от 1 до 3;
или R11 и R13 вместе образуют -(СН2)p-, где р является целым числом от 0 до 3, так что образуется 4-7-членное насыщенное кольцо, которое возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи;
или R13 и R14 вместе образуют 4-10-членное моноциклическое или полициклическое насыщенное кольцо либо 5-10-членное гетероарильное кольцо, причем указанные насыщенные и гетероарильные кольца возможно включают в себя 1 или 2 гетероатома, выбранных из О, S и -N(R8)-, в дополнение к азоту, к которому присоединены R13 и R14, указанное насыщенное кольцо возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи и указанные насыщенные и гетероарильные кольца возможно замещены группами R16 в количестве от 1 до 3;
R15 представляет собой Н, C1-С10алкил, С2-С10алкенил или С2-С10алкинил, причем упомянутые выше группы R15 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено и -OR9;
каждую R16 независимо выбирают из галогено, циано, нитро, трифторметила, азидо, -C(O)R17, -C(O)OR17, -OC(O)OR17, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, гидрокси, C1-С6алкила, C1-С6алкокси, -(СН2)m(С6-С10арила) и -(СН2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4, и где указанные арильные и гетероарильные заместители возможно замещены 1 или 2 заместителями, независимо выбранными из галогено, циано, нитро, трифторметила, азидо, -C(O)R17, -C(O)OR17, -OC(O)OR17, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, гидрокси, C1-С6алкила и C1-С6алкокси;
каждую R17 независимо выбирают из Н, C1-С10алкила, С2-С10алкенила, С2-С10алкинила, -(СН2)m(С6-С10арила) и -(СН2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4;
при условии, что R8 не является Н в том случае, когда R3 представляет собой -CH2S(O)nR8;
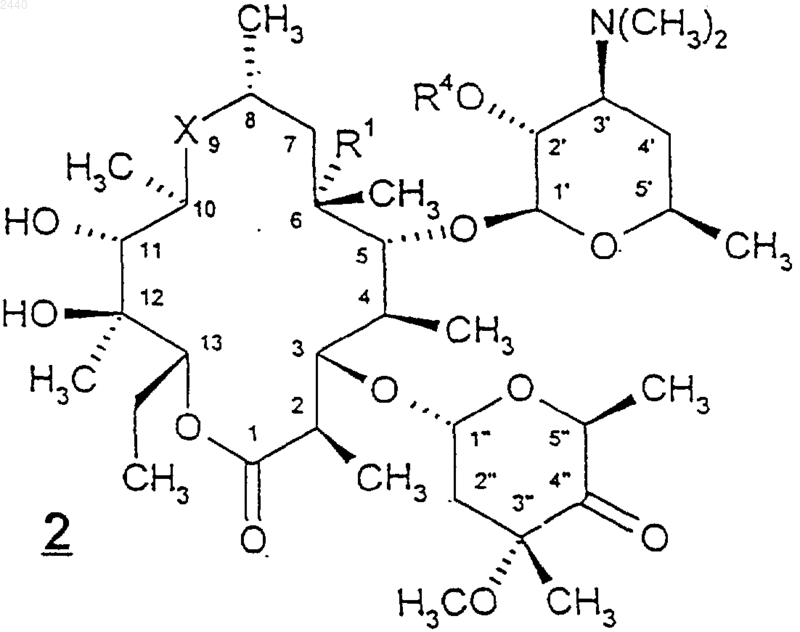
при котором соединение формулы
где X, R1 и R4 такие, как определены выше, обрабатывают соединением формулы HOR8, HSR8 или HNR15R8, в которых n, R15 и R8 такие, как определены выше; при этом, если используют указанное соединение формулы HSR8, то полученную группу R3 формулы -CH2SR8 возможно окисляют до -CH2S(O)R8 или -CH2S(O)2R8.
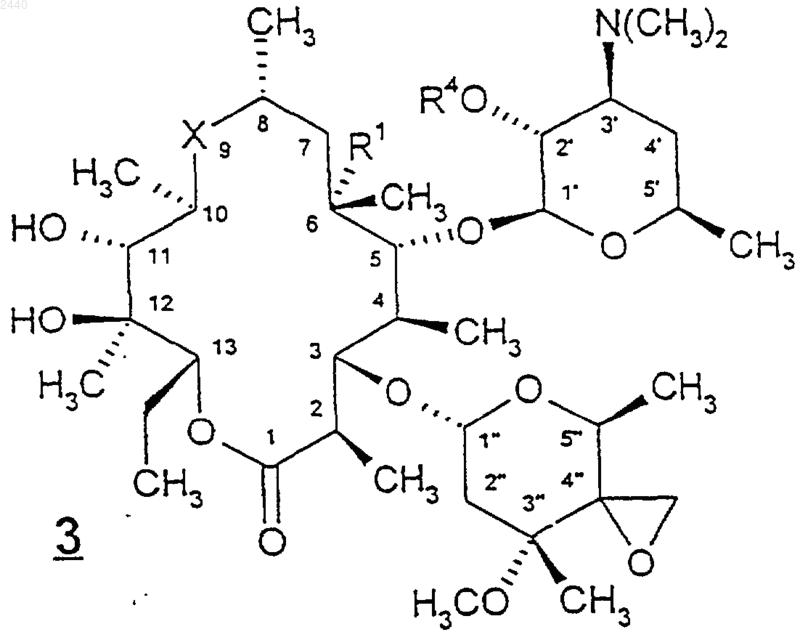
25. Способ по п.24, при котором соединение формулы 3 получают путем обработки соединения формулы
где X, R1 и R4 такие, как определены в п.24, соединением (СН3)3S(O)nХ2, в котором n равно 0 или 1, а X2 представляет собой галогено, -BF4 или -PF6, в присутствии основания.
26. Способ по п.25, при котором X2 представляет собой иод или -BF4, a указанное основание выбирают из тpeт-бутилата калия, трет-бутилата натрия, этилата натрия, гидрида натрия, 1,1,3,3-тетраметилгуанидина, 1,8-диазабицикло[5.4.0]ундец-7-ена, 1,5-диазабицикло[4.3.0]нон-5-ена, гексаметилдисилазида калия (KHMDS), этилата калия и метилата натрия.
27. Соединение формулы
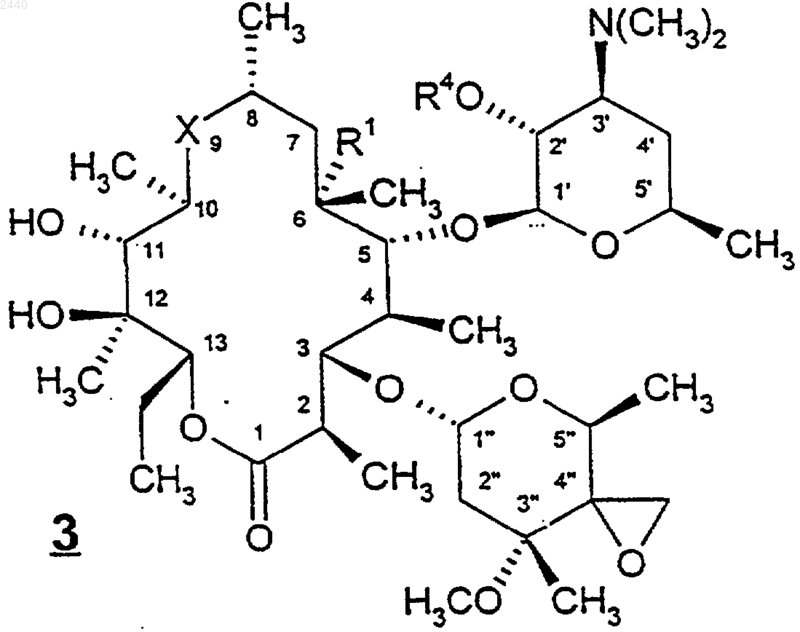
или его фармацевтически приемлемая соль, где
Х представляет собой -С(O)- или -N(С1-С6алкил)СН2-, для которых первая черточка в каждой из перечисленных выше групп Х обозначает связь, через которую эта группа присоединена к С-10-углероду соединения формулы 3, а последняя черточка для каждой группы обозначает связь, через которую эта группа присоединена к С-8-углероду соединения формулы 3;
R1 представляет собой Н, гидрокси или метокси;
R4 представляет собой Н, -C(O)R9, -C(O)OR9, -C(O)NR9R10 или гидроксизащитную группу;
каждая R9 и R10 независимо представляет собой Н или C1-С6алкил.
Текст
1 Предпосылки изобретения Это изобретение относится к новым С-4"зaмещенным макролидным производным, которые полезны в качестве антибактериальных и противопротозойных агентов для млекопитающих, включая человека, равно как для рыб и птиц. Кроме того, это изобретение относится к фармацевтическим композициям, содержащим данные новые соединения, и к способам лечения бактериальных и протозойных инфекций у млекопитающих, рыб и птиц путем введения данных новых соединений млекопитающим,рыбам и птицам, нуждающимся в таком лечении. Известно, что макролидные антибиотики полезны при лечении широкого спектра бактериальных и протозойных инфекций у млекопитающих, рыб и птиц. Такие антибиотики включают в себя различные производные эритромицина А, такие как азитромицин, который имеется в продаже, и о котором упоминается в патентах Соединенных Штатов 4,474,768 и 4,517,359,включенных посредством ссылки. Подобно азитромицину и другим макролидным антибиотикам, новые макролидные соединения по настоящему изобретению обладают мощной активностью против различных бактериальных и протозойных инфекций, как описано ниже. Сущность изобретения Настоящее изобретение относится к соединениям формулы и к их фармацевтически приемлемым солям,где: Х представляет собой -С(O)- или -N(С 1 С 6aлкил)СН 2-, для которых первая черточка в каждой из перечисленных выше групп Х обозначает связь, через которую эта группа присоединена к С-10-углероду соединения формулы 1,а последняя черточка для каждой группы обозначает связь, через которую эта группа присоединена к С-8-углероду соединения формулы 1;R3 представляет собой C1-С 10 алкил, С 2 С 10 алкенил, С 2-С 10-алкинил, циано, -СН 2S(O)nR8,где n является целым числом от 0 до 2, -CH2OR8,-CH2N(OR9)R8, -CH2NR8R15, -(CH2)m(C6-C10 арил) или -(CH2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R3 возможно замещены группами R16 в количестве от 1 до 3; 2 или R2 и R3 вместе образуют оксазолильное кольцо, как показано ниже-(CH2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R5 возможно замещены группами R16 в количестве от 1 до 3; каждая R6 и R7 независимо представляет собой Н, гидрокси, C1-С 6 алкокси, C1-С 6 алкил,С 2-С 6 алкинил,-(CH2)m(C6 С 2-С 6 алкенил,C10 арил) или -(CH2)m(5-10-членный гетероарил),где m является целым числом от 0 до 4; каждая R8 независимо представляет собой Н, C1-С 10 алкил, С 2-С 10 алкенил, С 2-С 10 алкинил,-(CH2)qCR11R12(CH2)rNR13R14, где q и r каждый независимо является целым числом от 0 до 3, за исключением того, что q и r оба не равны 0,-(CH2)m(C6-C10 арил) или -(CH2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R8, исключая Н, возможно замещены группами R16 в количестве от 1 до 3; или в том случае, когда R8 представлена как -CH2NR8R15, R15 и R8 могут вместе образовывать 4-10-членное насыщенное моноциклическое или полициклическое насыщенное кольцо либо 5-10-членное гетероарильное кольцо, причем указанные насыщенные и гетероарильные кольца возможно включают в себя 1 или 2 гетероатома, выбранных из О, S и -N(R8)-, в дополнение к азоту, к которому присоединены R15 иR8, указанное насыщенное кольцо возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи, и указанные насыщенные и гетероарильные кольца возможно замещены группами R16 в количестве от 1 до 3; каждая R9 и R10 независимо представляет собой Н или C1-С 6 алкил; каждую R11, R12, R13 и R14 независимо выбирают из Н, C1-С 10 алкила, -(СН 2)m(С 6-С 10 арила) и -(CH2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4, причем упомянутые выше группы R11, R12, R13 и R14, исключая Н, возможно замещены группами R16 в количестве от 1 до 3; или R11 и R13 вместе образуют -(CH2)p-, где р является целым числом от 0 до 3, так что образуется 4-7-членное насыщенное кольцо, которое возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи; или R13 и R14 вместе образуют 4-10 членное моноциклическое или полициклическое насыщенное кольцо или 5-10-членное гетеро 3 арильное кольцо, причем указанные насыщенные и гетероарильные кольца возможно включают в себя 1 или 2 гетероатома, выбранных из О, S и -N(R8)-, в дополнение к азоту, к которому присоединены R13 и R14, указанное насыщенное кольцо возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи, и указанные насыщенные и гетероарильные кольца возможно замещены группами R16 в количестве от 1 до 3;R15 представляет собой Н, C1-С 10 алкил, С 2 С 10 алкенил или С 2-С 10 алкинил, причем упомянутые выше группы R15 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено и -OR9; каждую R16 независимо выбирают из галогено, циано, нитро, трифторметила, азидо,-C(O)R17, -С(О)OR17, -ОС(О)OR17, -NR6C(O)R7,-C(O)NR6R7, -NR6R7, гидрокси, C1-С 6 алкила, C1 С 6 алкокси, -(СН 2)m(С 6-С 10 арила) и -(CH2)m(5-10 членного гетероарила), где m является целым числом от 0 до 4, и где указанные арильные и гетероарильные заместители возможно замещены 1 или 2 заместителями, независимо выбранными из галогено, циано, нитро, трифторметила, азидо, -C(O)R17, -C(O)OR17, -OC(O)OR17,-NR6C(O)R7, -C(O)NR6R7, -NR6R7, гидрокси, C1 С 6 алкила и C1-С 6 алкокси; каждую R17 независимо выбирают из Н,C1-С 10 алкила, С 2-С 10 алкенила, С 2-С 10 алкинила,-(CH2)m(C6-C10 арилa) и -(СН 2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4; при условии, что R8 не является Н в том случае,когда-СН 2S(O)nR . Предпочтительные соединения формулы 1 включают в себя такие соединения, в которыхR4 представляет собой Н, ацетил или бензилоксикарбонил. Другие предпочтительные соединения формулы 1 включают в себя такие соединения, в которых R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2NR8R15, R4 представляет собой Н,ацетил или бензилоксикарбонил, R15 и R8 каждую выбирают из Н, C1-C10 алкила, C2-C10 алкенила и С 2-С 10 алкинила, причем указанные группы R15 и R8, за исключением Н, возможно замещены 1 или 2 заместителями, независимо выбранными из гидрокси, галогено и C1 С 6 алкокси. Особо предпочтительные соединения, имеющие упомянутую выше общую структуру, включают в себя такие соединения, в которых R15 либо представляет собой Н, либо ее выбирают из следующих групп, из которых также независимо выбирают R8: метил, этил,аллил, н-бутил, изобутил, 2-метоксиэтил, цик 002440 4 лопентил, 3-метоксипропил, 3-этоксипропил, нпропил, изопропил, 2-гидроксиэтил, циклопропил, 2,2,2-трифторэтил, 2-пропинил, втор-бутил,трет-бутил и н-гексил. Другие предпочтительные соединения формулы 1 включают в себя такие соединения, в которых R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2NHR8, R4 представляет собой Н, ацетил или бензилоксикарбонил, и R8 представляет собой -(СН 2)m(С 6-С 10 арил), где m является целым числом от 0 до 4. Особо предпочтительные соединения, имеющие упомянутую выше общую структуру, включают в себя такие соединения, в которых R8 представляет собой фенил или бензил. Другие предпочтительные соединения формулы 1 включают в себя такие соединения, в которых R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2NR15R8, R4 представляет собой Н,ацетил или бензилоксикарбонил, а R15 и R8 вместе образуют насыщенное кольцо. Особо предпочтительные соединения, имеющие упомянутую выше общую структуру, включают в себя такие соединения, в которых R15 и R8 вместе образуют пиперидиновое, триметилениминовое или морфолиновое кольцо. Другие предпочтительные соединения формулы 1 включают в себя такие соединения, в которых R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2NR15R8, R4 представляет собой Н,ацетил или бензилоксикарбонил, а R15 и R8 вместе образуют гетероарильное кольцо, возможно замещенное одной или двумя С 1-С 6 алкильными группами. Особо предпочтительные соединения, имеющие упомянутую выше общую структуру, включают в себя такие соединения, в которыхR8 вместе образуют пирролидиновое, триазолильное или имидазолильное кольцо, причем указанные гетероарильные группы возможно замещены 1 или 2 метильными группами. Другие предпочтительные соединения формулы 1 включают в себя такие соединения, в которых R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2SR8, R4 представляет собой Н, ацетил или бензилоксикарбонил, а R8 выбирают из С 1 С 10aлкила, С 2-С 10 алкенила и С 2-С 10 алкинила,причем указанные группы R8 возможно замещены 1 или 2 заместителями, независимо выбранными из гидрокси, галогено и C1-С 6 алкокси. Особо предпочтительные соединения, имеющие упомянутую выше общую структуру, включают в себя такие соединения, в которых R8 представляет собой метил, этил или 2-гидроксиэтил. Другие предпочтительные соединения формулы 1 включают в себя такие соединения, в которых R1 представляет собой гидрокси, R2 представляет собой гидрокси, R4 представляет 5 собой Н, ацетил или бензилоксикарбонил, а R3 выбирают из C1-С 10 алкила, С 2-С 10 алкенила и С 2 С 10 алкинила, причем указанные группы R3 возможно замещены 1 или 2 заместителями, независимо выбранными из гидрокси, -C(O)R17,-NR6R7, галогено, циано, азидо, 5-10-членного гетероарила и C1-С 6 алкокси. Особо предпочтительные соединения, имеющие упомянутую выше общую структуру, включают в себя такие соединения, в которых R3 представляет собой метил, аллил, винил, этинил, 1-метил-1 пропенил, 3-метокси-1-пропинил, 3-диметиламино-1-пропинил, 2-пиридилэтинил, 1-пропинил, 3-гидрокси-1-пропинил, 3-гидрокси-1 пропенил, 3-гидроксипропил,3-метокси-1 пропенил, 3-метоксипропил, 1-пропинил, нбутил, этил, пропил, 2-гидроксиэтил, формилметил, 6-циано-1-пентинил, 3-диметиламино-1 пропенил или 3-диметиламинопропил. Другие предпочтительные соединения формулы 1 включают в себя такие соединения, в которых R1 представляет собой гидрокси, R2 представляет собой гидрокси, R4 представляет собой Н, ацетил или бензилоксикарбонил, а R3 представляет собой -(СН 2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4. Особо предпочтительные соединения, имеющие упомянутую выше общую структуру, включают в себя такие соединения, в которых R3 представляет собой 2-тиенил, 2-пиридил, 1-метил-2 имидазолил, 2-фурил или 1-метил-2-пирролил. Другие предпочтительные соединения формулы 1 включают в себя такие соединения, в которых R1 представляет собой гидрокси, R2 представляет собой гидрокси, R4 представляет собой Н, ацетил или бензилоксикарбонил, а R3 представляет собой -(СН 2)m(С 6-С 10aрил), где m является целым числом от 0 до 4. Особо предпочтительные соединения, имеющие упомянутую выше общую структуру, включают в себя такие соединения, в которых R3 представляет собой фенил. Особые соединения формулы 1 включают в себя такие соединения, в которых R2 и R3 вместе образуют оксазолильное кольцо, как показано ниже где R5 такая, как определена выше. Особые соединения формулы 1 включают в себя такие соединения, в которых R3 выбирают из следующего: где X3 представляет собой О, S или -N(R15)-, и где группа -OR9 может быть присоединена к 6 любому доступному углероду фенильной группы. Кроме того, изобретение относится к фармацевтической композиции для лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, которая содержит терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли и фармацевтически приемлемый носитель. Изобретение также относится к способу лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, при котором указанным млекопитающему, рыбе или птице вводят терапевтически эффективное количество соединения формулы 1 или его фармацевтически приемлемой соли. Если не оговорено особо, использованный здесь термин "лечение", включает в себя лечение или профилактику бактериальной инфекции или протозойной инфекции, как предложено в способе по настоящему изобретению. Если не оговорено особо, то использованные здесь термины "бактериальная(ые) инфекция(и)" и "протозойная(ые) инфекция(и)" включают в себя бактериальные инфекции и протозойные инфекции, которые встречаются у млекопитающих, рыб и птиц, равно как и расстройства, связанные с бактериальными инфекциями и протозойными инфекциями, которые могут быть подвергнуты лечению или профилактике путем введения антибиотиков, таких как соединения по настоящему изобретению. Такие бактериальные инфекции и протозойные инфекции,а также расстройства, связанные с такими инфекциями, включают в себя следующие: пневмонию, воспаление среднего уха, синусит,бронхит, тонзиллит и мастоидит, связанные с инфекцией Streptococcus pneumonias, Haemophilus Influenzae, Moraxella catarrhalis, Staphylococcus aureus или видами Peptostreptococcus; фарингит, ревматическую лихорадку и гломерулонефрит, связанные с инфекцией Streptococcus pyogenes, стрептококками групп С и G,Clostridium diptheriae или Actinobacillus haemolyticum; инфекции дыхательного тракта, связанные с инфекцией Mycoplasma pneumoniae, Legionella pneumophila, Streptococcus pneumoniae,Haemophilus influenzae или Chlamydia pneumoniae; неосложненные кожные инфекции и инфекции мягких тканей, абсцессы и остеомиелит,послеродовую лихорадку, связанные с инфекцией Staphylococcus aureus, коагулазоположительными стафилококками (т.е. S. epidermidis, S.C-F (стрептококками с мельчайшими колониями), зеленящими стрептококками, Corynebacterium minutissimum, видами Clostridium или Bartonella henselae; неосложненные острые инфекции мочевых путей, связанные с инфекциейducreyi, Treponema pallidum, Ureaplasma urealyticum или Neiserria gonorrheae; заболевания под действием токсинов, связанные с инфекцией S.aureus (пищевая интоксикация и синдром токсического шока) или стрептококками групп А, В и С; язвы, связанные с инфекцией HelicobacterChlamydia pneumoniae. Бактериальные инфекции, и протозойные инфекции, и расстройства,связанные с такими инфекциями, которые могут быть подвергнуты лечению или профилактике у животных, включают в себя следующие: болезнь органов дыхания коров, связанная с инфекцией Р. haem., Р. multocida, Mycoplasma bovis или видами Bordetella; заболевание тонкого кишечника у коров, связанное с инфекцией Е.Enterococcus; болезнь органов дыхания свиней,связанная с инфекцией A. pleuro., Р. multocida или видами Mycoplasma; заболевание тонкого кишечника у свиней, связанное с инфекцией Е.coli, Lawsonia intracellularis, Salmonella или Serpulina hyodyisinteriae; копытная гниль у коров,связанная с инфекцией видами Fusobacterium; метрит у коров, связанный с инфекцией Е. coli; покрытые волосами бородавки у коров, связанные с инфекцией Fusobacterium nесrорhorum илиbovis; выкидыш на ранних сроках у коров, связанный с инфекцией простейшими (т.е., nеosporium); инфекцию мочевых путей у собак и кошек, связанную с Е. coli; кожные инфекции и инфекции мягких тканей у собак и кошек, связанные с инфекцией Staph. epidermidis, Staph.cida; инфекции зубов и полости рта у собак и кошек, связанные с инфекцией видами Alcaligenes, видами Bacteroides, видами Clostridium,видами Enterobacter, Eubacterium, Peptostreptococcus, Porphyromonas или Prevotella. О других бактериальных инфекциях и протозойных инфекциях и расстройствах, связанных с такими инфекциями, которые могут быть подвергнуты лечению или профилактике в соответствии со способом по настоящему изобретению, упоминается в J.P. Sanford et al. "The Sanford Guide ToAntimicrobial Therapy", 26th Edition (Antimicrobial Therapy, Inc., 1996). Кроме того, настоящее изобретение относится к способу получения упомянутого выше соединения формулы 1 или его фармацевтически приемлемой соли, где R3 представляет собой -CH2S(O)nR8, -CH2OR8 или -CH2NR8R15,причем n, R15 и R8 такие, как определены выше,при условии, что R8 не является Н, когда R3 представляет собой -СН 2S(O)nR8 , при котором соединение формулы где X, R1 и R4 такие, как определены выше, обрабатывают соединением формулы HSR8, HOR8 или HNR15R8, причем n, R15 и R8 такие, как определены выше, возможно с последующим окислением заместителя -SR8 с образованием-S(O)R8 или -S(O)2R8. Согласно еще одному аспекту вышеприведенного способа получения соединения формулы 1 или его фармацевтически приемлемой соли, упомянутое выше соединение формулы 3 получают путем обработки соединения формулы где X, R1 и R4 такие, как определены выше, соединением (СН 3)3S(O)nХ 2, в котором n равно 0 или 1, а Х 2 представляет собой галогено, -BF4 или -PF6, предпочтительно иод или -BF4, в присутствии основания, такого как трет-бутилат калия, трет-бутилат натрия, этилат натрия, гидрид натрия, 1,1,3,3-тетраметил-гуанидин, 1,8 9 диазабицикло[5.4.0]ундец-7-ен, 1,5-диазабицикло[4.3.0]нон-5-ен, гексаметилдисилазид калия(KHMDS), этилат калия или метилат натрия,предпочтительноKHMDS или натрийсодержащего основания, такого как гидрид натрия. Настоящее изобретение также относится к вышеупомянутому соединению формулы 3, которое, как указано выше, полезно при получении вышеупомянутых соединений формулы 1 и их фармацевтически приемлемых солей. Если не оговорено особо, использованный здесь термин "гидроксизащитная группа" включает в себя ацетильные,бензилоксикарбонильные и разнообразные гидроксизащитные группы, известные специалистам,включая группы, упомянутые в Т.W. Greene,P.G.M. Wuts, "Protective Groups In Organic Synthesis" (J. WileySons, 1991). Если не оговорено особо, использованный здесь термин "галогено" включает в себя фтор,хлор, бром или иод. Если не оговорено особо, использованный здесь термин "алкил" включает в себя насыщенные одновалентные углеводородные радикалы с прямой, циклической или разветвленной группировками или их смеси. Понятно, что в том случае, когда подразумеваются циклические группировки, в указанном алкиле должны быть,по меньшей мере, три углерода. Такие циклические группировки включают в себя циклопропил, циклобутил и циклопентил. Если не оговорено особо, использованный здесь термин "алкокси" включает в себя -Оалкильные группы, причем алкил такой, как определен выше. Если не оговорено особо, использованный здесь термин "арил" включает в себя органический радикал, получающийся из ароматического углеводорода путем удаления одного водорода,такой как фенил или нафтил. Если не оговорено особо, использованный здесь термин "5-10-членный гетероарил" включает в себя ароматические гетероциклические группы, содержащие один или более чем один гетероатом, выбранный каждый из О, S и N,причем каждая гетероциклическая группа в системе своего кольца имеет от 5 до 10 атомов. Примеры подходящих 5-10-членных гетероарильных групп включают в себя пиридинил,имидазолил, пиримидинил, пиразолил, (1,2,3)- и(1,2,4)-триазолил, пиразинил, тетразолил, фурил, тиенил, изоксазолил, оксазолил, пирролил и тиазолил. Если не оговорено особо, использованная здесь фраза "фармацевтически приемлемая(ые) соль(и)" включает в себя соли кислотных или основных групп, которые могут присутствовать в соединениях по настоящему изобретению. Соединения по настоящему изобретению, которые являются по своей природе основными,способны образовывать большое число солей с 10 различными неорганическими и органическими кислотами. Эти кислоты, которые могут быть использованы для приготовления фармацевтически приемлемых полученных присоединением кислоты солей таких основных соединений,представляют собой такие кислоты, которые образуют нетоксичные соли, полученные присоединением кислоты, т.е. соли, содержащие фармакологически приемлемые анионы, такие как соли гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, ацетат, лактат, салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, птолуолсульфонат и памоат [т.е. 1,1-метиленбис-(2-гидрокси-3-нафтоат)]. Соединения по настоящему изобретению, которые содержат аминогруппировку, могут образовывать фармацевтически приемлемые соли с различными аминокислотами в дополнение к упомянутым выше кислотам. Те соединения по изобретению, которые являются кислотными по природе, способны к образованию солей при взаимодействии с основаниями с различными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных металлов или щелочно-земельных металлов и, в частности,кальциевые, магниевые, натриевые и калиевые соли соединений по настоящему изобретению. Некоторые соединения по настоящему изобретению могут иметь центры асимметрии и поэтому существовать в различных энантиомерных и диастереомерных формах. Это изобретение относится к использованию всех оптических изомеров и стереоизомеров соединений по настоящему изобретению и их смесей, и ко всем фармацевтическим композициям и способам лечения, которые могут использовать или содержать их. Настоящее изобретение охватывает соединения по настоящему изобретению и их фармацевтически приемлемые соли, в которых один или более чем один атом водорода, углерода или другой атом замещены их изотопами. Такие соединения могут быть полезны в качестве научных и диагностических инструментов для фармакокинетического изучения метаболизма и при изучении связывания. Подробное описание изобретения Соединения по настоящему изобретению могут быть получены в соответствии с приведенными ниже схемами 1-3 и их описаниями. Если не оговорено особо, заместители X, R1, R2,R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14,R15, R16 и R17 в представленных ниже схемах такие, как определены выше. В настоящем изобретении в качестве исходного материала используются разнообразные макролидные основы. Они включают в себя азитромицин, эритромицин, кларитромицин,эритромициламин и их аналоги. Азитромицин может быть получен в соответствии с указанными ниже способами, описанными в патентах Соединенных Штатов 4,474,768 и 4,517,359. Эритромицин может быть получен или выделен в соответствии со способами, описанными в патентах Соединенных Штатов 2,653,899 и 2,823,203. Кларитромицин может быть получен в соответствии со способами, описанными в патенте Соединенных Штатов 4,331,803. Упомянутые выше исходные материалы требуют введения подходящей защиты для функциональных групп перед проведением с ними разнообразных модификаций и снятия защиты по завершении желаемых модификаций. Наиболее употребимыми защитными группами для аминогруппировок макролидных соединений по настоящему изобретению являются бензилоксикарбонильная (Cbz) и трет-бутилоксикарбонильная (Воc) группы. Гидроксильные группы, как правило, защищают в виде ацетатов или (Cbz)-карбонатов. Хорошо установлена относительная реакционная способность различных гидроксильных групп в молекулах макролидов общего типа, заявленных в данном изобретении. Такие различия в реакционной способности позволяют осуществлять выборочные модификации различных частей соединений по настоящему изобретению. На приведенных ранее схемах С-2'гидроксильную группу (R4 представляет собой Н) выборочно защищают путем обработки макролидного соединения одним эквивалентом уксусного ангидрида в дихлорметане в отсутствие внешнего основания с получением соответствующего соединения, в котором R4 представля 002440 14 ет собой ацетил. Ацетильная защитная группа может быть удалена путем обработки соединения формулы 3 метанолом при температуре 2365 С в течение 10-48 ч. Кроме этого, С-2'гидрокси может быть защищен другими защитными группами, известными специалистам, как например Cbz-группой. В том случае, когда Х представляет собой -CH2NH-, C-9-аминогруппа перед проведением дальнейших модификаций в ходе синтеза также может нуждаться в защите. Подходящими защитными группами для аминогруппировки являются Cbz- и Воc-группы. Для защиты С-9-аминогруппы макролид можно обработать трет-бутилдикарбонатом в безводном тетрагидрофуране (THF), либо бензилоксикарбонильным эфиром N-гидроксисукцинимида,или бензилхлорформиатом с получением защищенной аминогруппы в виде ее трет-бутил- или бензилкарбамата. Как С-9-амино, так и С-2'гидрокси могут быть селективно защищены в одну стадию с помощью Cbz-группы в результате обработки соединения формулы 2 бензилхлорформиатом в THF и воде. Воc-группу можно удалить путем кислотной обработки, а Cbzгруппу - путем обычного каталитического гидрирования. В следующем далее описании подразумевается, что в тех случаях, когда Х представляет собой -CH2NH-, для С-9-аминогруппировки, равно как и для С-2'-гидроксильной группы, введение и снятие защит производят так, как удобно специалистам. На схеме 1 соединение формулы 2 может быть получено известными специалистам способами, включая один или более чем один известный (Journal of Antibiotics, 1988, на страницах 1029-1047) способ. На стадии 1 схемы 1 соединение формулы 2 обрабатывают R3MgX1 илиR3Li и Мg(Х 1)2, где X1 представляет собой галогенид, такой как хлор или бром, в растворителе,таком как ТНF, диметиловый эфир этиленгликоля (DME), диизопропиловый эфир, толуол,диэтиловый эфир или тетраметилэтилендиамин(ТМЕDA), гексаны, либо в смеси двух или более чем двух перечисленных выше растворителей,предпочтительно в эфирном растворителе, при температуре в интервале от приблизительно 78 С до приблизительно комнатной (20-25 С) температуры с получением соединения формулы 1, в котором R2 представляет собой гидрокси, a R1, R3 и R4 такие, как определены выше. Схема 2 иллюстрирует получение соединений формулы 1 посредством использования эпоксидного промежуточного соединения. На стадии 1 схемы 2 соединение формулы 3 может быть получено двумя способами. В одном из способов (способ А) соединение формулы 2 обрабатывают (СН 3)3S(O)Х 2, где Х 2 представляет собой галогено, -BF4 или -PF6, предпочтительно иод, в присутствии основания, такого как третбутилат калия, этилат натрия, трет-бутилат натрия, гидрид натрия, 1,1,3,3-тетраметилгуанидин, 1,8-диазабицикло[5.4.0]ундец-7-ен, 1,5 15 диазабицикло[4.3.0]нон-5-ен, этилат калия или метилат натрия, предпочтительно натрийсодержащего основания, такого как гидрид натрия, в растворителе, таком как THF, эфирный растворитель, диметилформамид (DMF) или метилсульфоксид (DMSO), либо в смеси двух или более чем двух из перечисленных выше растворителей, в температурном интервале от приблизительно 0 до приблизительно 60 С с получением соединения формулы 3, в котором преобладающей является следующая конфигурация эпоксидной группировки: Во втором способе (способ Б) соединение формулы 2 обрабатывают (СН 3)3SХ 2, где Х 2 представляет собой галогено, -ВF4 или -PF6,предпочтительно -ВF4, в присутствии основания, такого как трет-бутилат калия, третбутилат натрия, этилат натрия, гидрид натрия,1,1,3,3-тетраметилгуанидин, 1,8-диазабициклоKHMDS, в растворителе, таком как THF, эфирный растворитель, DMF или DMSO, либо в смеси двух или более чем двух из перечисленных выше растворителей, в температурном интервале от приблизительно 0 до приблизительно 60 С с получением соединения формулы 3, в котором преобладающей является следующая конфигурация эпоксидной группировки: На стадии 2 схемы 2 соединение формулы 3 может быть превращено в соединение формулы 1, в котором R2 представляет собой гидрокси, а R3 представляет собой группу, присоединенную к С-4"-углероду через метиленовую группу, при этом R3 представляет собой-CH2NR15R8 или -СН 2S(O)nR8, где n, R15 и R8 такие, как определены выше. Для получения соединения формулы 1, в котором R3 представляет собой -CH2NR15R8, соединение формулы 3 может быть обработано соединением формулыHNR15R8, в котором R15 и R8 такие, как определены выше, в отсутствие или присутствии полярного растворителя, такого как вода, метанол или ТНF, либо в смеси перечисленных выше растворителей, в температурном интервале от приблизительно комнатной температуры до приблизительно 100 С, предпочтительно приблизительно при 60 С, возможно в присутствии галогенидного реагента, такого как иодид калия,перхлорат лития, перхлорат магния, тетрафторборат лития, гидрохлорид пиридиния, либо тетраалкиламмонийгалогенидного реагента, такого 16 как иодид тетрабу тиламмония. Для получения соединения формулы 1, в котором R3 представляет собой -CH2S(O)nR8, где n и R8 такие, как определены выше, соединение формулы 3 может быть обработано соединением формулыHSR8 в присутствии К 2 СО 3, KI или метилата натрия в ароматическом растворителе, таком как метанол, бензол или толуол, в температурном интервале от приблизительно комнатной температуры до приблизительно 120 С. В тех случаях, когда это целесообразно, серная группировка может быть окислена до -SO- или -SО 2 известными специалистам способами. Для получения соединения формулы 1, в котором R3 представляет собой -CH2SR8, и R8 представляет собой -(СН 2)qСR11R12-(СН 2)rNR13R14, причем заместители указанной группы R8 такие, как определены выше, соединение формулы 3 может быть обработано соединением формулы HS(СН 2)qCR11R12(СН 2)r-NPhth, в котором NPhth представляет собой фталимидо, и иодидом калия с получением соединения формулы 1, в котором R3 представляет собой -СН 2S(CH2)qCR11R12- (CH2)rNH2, после удаления фталимидогруппировки, которое при необходимости может быть далее модифицировано. Подобным же способом соединение формулы 1, в котором R3 представляет собой -CH2NR15R8, и R8 представляет собой -(CH2)qCR11R12 (CH2)rNR13R14, может быть получено обработкой соединения формулы 3 или соединением формулы HNR9(CH2)qCR11R12-(СН 2)r-NR13R14, или соединением формулы H2N-(CH2)qCR11R12-(CH2)r-NH2 с последующим восстановительным алкилированием атомов азота. Соединение формулы 1, в котором R3 представляет собой -CH2OR8, и R8 такая, как определена выше, может быть получено обработкой соединения формулы 3 соединением формулы HOR8 с использованием того же самого или аналогичного способа. Схема 3 иллюстрирует получение соединений формулы 1, в которых R2 и R3 вместе образуют оксазолильную группировку. На стадии 1 схемы 3 соединение формулы 3 обрабатывают азидом натрия в присутствии NH4Cl в метаноле или воде, или в смеси этих двух растворителей в температурном интервале от приблизительно 0 до приблизительно 100 С, предпочтительно приблизительно при 80 С, с получением соединения формулы 4. На стадии 2 схемы 3 соединение формулы 4 может быть превращено в соответствующий амин формулы 5 посредством общепринятого каталитического гидрирования. Предпочтительным является проведение такого гидрирования с использованием порошка Pd(10%-ного на угле) в атмосфере H2 (1 атм; 98 кПа). Полученный амин формулы 5 может быть превращен в разнообразные соединения формулы 1, в которых R3 представляет собой-CH2NR15R8, с использованием общепринятых способов синтеза, таких как восстановительное аминирование. 17 На стадии 3 схемы 3 соединение формулы 5 может быть превращено в соединение формулы 1, в котором R2 и R3 образуют кольцо как показано, в результате обработки соединения формулы 5 соединением формулы R5-CN, R5C=N(OCH3), R5-C=N(OC2H5), R5-C(O)Cl или R5 СО 2 Н, где R5 такая, как определена выше, за исключением того, что она не может быть NH2,в присутствии или в отсутствие кислоты, такой как НСl, либо кислоты Льюиса, такой как ZnCl2 или BF4Et3O, либо основания, такого как NaOH или TEA, в растворителе, таком как THF, хлоруглеводород (такой как СН 2 Сl2 или хлорбензол), в температурном интервале от приблизительно комнатной температуры до температуры дефлегмации. Для получения соответствующего соединения, в котором R5 является амино, соединение формулы 5 обрабатывают BrCN и ацетатом натрия в метаноле в температурном интервале от приблизительно комнатной температуры до температуры дефлегмации. С другой стороны, происхождение соединения формулы 5 может быть таким, как указано на стадиях 4 и 5 схемы 3. На стадии 4 схемы 3 соединение формулы 5 обрабатывают тиокарбонилдиимидазолом в метиленхлориде в температурном интервале от приблизительно 0 С до комнатной температуры с получением соединения формулы 25. На стадии 5 схемы 3 соединение формулы 25 обрабатывают соединением формулы R5X1, в котором X1 представляет собой галогенид,такой как бром или иод, и основанием, таким как метилат натрия, в растворителе, таком как метанол или ацетон, в температурном интервале от приблизительно 0 С до комнатной температуры. Соединения по настоящему изобретению могут содержать асимметричные атомы углерода и ввиду этого существовать в различных энантиомерных и диастереомерных формах. Диастереомерные смеси могут быть разделены на их индивидуальные диастереомеры на основании их физико-химических различий известными специалистам способами, например хроматографией или фракционной кристаллизацией. Энантиомеры могут быть разделены путем превращения энантиомерных смесей в диастереомерную смесь в результате взаимодействия с подходящим оптически активным соединением(например, спиртом), разделения диастереомеров и превращения (например, в результате гидролиза) отдельных диастереомеров в соответствующие чистые энантиомеры. Кроме того, такое разделение может быть достигнуто посредством использования стандартной хиральной ВЭЖХ. Полагают, что применение всех таких изомеров,включая диастереомерные смеси и чистые энантиомеры, составляет часть настоящего изобретения. Соединения по настоящему изобретению,являющиеся по своей природе основными, способны образовывать большое разнообразие раз 002440 18 личных солей с разнообразными неорганическими и органическими кислотами. Несмотря на то, что такие соли должны быть фармацевтически приемлемыми для введения млекопитающим, часто на практике желательно первоначальное выделение из реакционной смеси соединения по настоящему изобретению в виде фармацевтически неприемлемой соли и затем простое превращение последней обратно в соединение в виде свободного основания путем обработки щелочным реагентом с последующим превращением полученного свободного основания в фармацевтически приемлемую соль, полученную присоединением кислоты. Получаемые присоединением кислоты соли основных соединений по данному изобретению без труда могут быть получены обработкой основного соединения существенно эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе, таком как метанол или этанол. После аккуратного упаривания растворителя получают желаемую соль в твердом состоянии. Желаемую соль также можно осадить из раствора свободного основания в органическом растворителе путем добавления к раствору подходящей минеральной или органической кислоты. Те соединения по настоящему изобретению, которые по своей природе являются кислотными, способны к образованию солей при взаимодействии с основаниями (катионы могут быть различными). Для соединений, предназначенных для введения млекопитающим, рыбам и птицам, такие соли должны быть фармацевтически приемлемыми. В тех случаях, когда требуется фармацевтически приемлемая соль, желательным может быть первоначальное выделение из реакционной смеси соединения по настоящему изобретению в виде фармацевтически неприемлемой соли и затем простое превращение последней в фармацевтически приемлемую соль способом, аналогичным описанному выше для превращения фармацевтически неприемлемых солей, полученных присоединением кислоты, в фармацевтически приемлемые. Примеры солей, образованных при взаимодействии с основаниями, включают в себя соли щелочных или щелочно-земельных металлов и, в частности, соли натрия, амина и калия. Все эти соли получают с помощью общепринятых методик. Для получения фармацевтически приемлемых солей, полученных в результате взаимодействия с основаниями, по настоящему изобретению в качестве реагентов используют те химические основания, которые образуют нетоксичные соли при таком взаимодействии с кислотными соединениями по настоящему изобретению. Такие нетоксичные соли, полученные при взаимодействии с основаниями, включают в себя соли,полученные из таких фармакологически приемлемых катионов, как катионы натрия, калия, 19 кальция, магния, различные катионы-амины и так далее. Эти соли легко могут быть приготовлены путем обработки соответствующих кислотных соединений водным раствором, содержащим желаемые фармакологически приемлемые основания с такими катионами, как катионы натрия, калия, кальция, магния, различные катионы-амины и так далее, и затем упаривания полученного раствора досуха предпочтительно при пониженном давлении. С другой стороны,они также могут быть получены в результате смешивания растворов кислотных соединений в низших спиртах и желаемого алкоголята щелочного металла с последующим упариванием полученного раствора досуха таким же способом, как и ранее. В том и другом случае для обеспечения полноты реакции и максимального выхода желаемого конечного продукта предпочтительно использование стехиометрических количеств реагентов. Антибактериальную и противопротозойную активность соединений по настоящему изобретению против бактериальных и протозойных патогенов демонстрируют по способности данных соединений ингибировать рост определенных штаммов патогенов человека (тест I) или животных (тесты II и III). Тест I Описанный ниже тест I использует традиционные методологию и критерии интерпретации и предназначается для выбора направления химических модификаций, которые могут приводить к получению соединений, "обходящих" определенные механизмы устойчивости к макрoлидам. В тесте I набор бактериальных штаммов составляют таким образом, чтобы он включал в себя различные патогенные виды-мишени,собирают набор бактериальных штаммов,включая уже охарактеризованных представителей механизма устойчивости к макролидам. Использование этого набора дает возможность определить взаимоотношение химическая структура/активность, касающееся эффективности, спектра активности и структурных элементов или модификаций, которые могут быть необходимы для "обхождения" механизмов устойчивости. Бактериальные патогены, входящие в набор для скрининга, показаны ниже в таблице. Во многих случаях имеются как макролидчувствительный родительский штамм, так и происходящий от него макролид-устойчивый штамм, что позволяет производить более точную оценку способности соединений обходить механизм устойчивости. Штаммы, несущие ген с названием еrmА/еrmВ/еrmС, устойчивы к антибиотикам макролидам, линкозамидам и стрептограмину В ввиду наличия модификаций(метилирования) молекул 23S рРНК Еrmметилазой, в целом препятствующих связыванию всех трех структурных классов. Описано два типа оттока макролидов; msrA кодирует компонент системы оттока в стафилококках, 002440 20 который препятствует проникновению макролидов и стрептограминов, в то время как mеfА/Е кодирует трансмембранный белок, влияющий на отток только макролидов. Инактивация макролидных антибиотиков может происходить и может быть опосредована или фосфорилированием 2'-гидроксила (mph), или расщеплением макроциклического лактона (эстераза). Штаммы могут быть охарактеризованы с использованием общепринятой технологии полимеразной цепной реакции (ПЦР) и/или секвенирования детерминанты устойчивости. Применение технологии ПЦР в настоящей заявке описано в J. Sutcliffe et al., "Detection Of Erythromycin-ResistantLaboratory Standards (NCCLS); для сравнения штаммов используют значения минимальной ингибирующей концентрации (МИК). Первоначально готовят концентрированные (40 мг/мл) растворы соединений в диметилсульфоксидеmefE чувствительный чувствительный чувствительный промежуточная устойчивость к эритромицину чувствительный Тест II используют для тестирования на активность против Pasteurella multocida, а тестIII - для тестирования на активность против 21 Тест II Данный тест основан на методе разбавления в жидкости в микролитровом формате. Единичной колонией Р. multocida (штамм 59 А 067) инокулируют 5 мл бульона с сердечно-мозговым экстрактом (BHI). Тестируемые соединения готовят путем растворения 1 мг соединения в 125 мкл диметилсульфоксида (DMSO). Разбавления тестируемого соединения готовят, применяя неинокулированный BHI-бульон. Используемые концентрации тестируемого соединения,лежащие в интервале от 200 мкг/мл до 0,098 мкг/мл, получают в результате последовательных двукратных разведений. BHI, инокулированный Р. multocida, разбавляют неинокулированным BHI-бульоном, получая суспензию из 104 клеток в 200 мкл. Клеточные суспензии вBHI смешивают с соответствующими серийными разведениями тестируемого соединения и инкубируют при 37 С в течение 18 ч. Минимальная ингибирующая концентрация (МИК) равна концентрации соединения, демонстрирующей 100%-ное ингибирование роста Р. multocida, в сравнении с неинокулированным контролем. Тест III Данный тест основан на методе разбавления в агаре с применением пипетирующего диспенсера. От двух до пяти колоний, выделенных с чашки с агаром, вносят в BHI-бульон и инкубируют в течение ночи при 37 С со встряхиванием (200 об./мин). На следующее утро 300 мкл полностью выросшей предкультуры Р. haemolytica инокулируют 3 мл свежего BHI-бульона и инкубируют при 37 С со встряхиванием (200 об./мин). Соответствующие количества тестируемых соединений растворяют в этаноле и готовят серии двукратных разведении. 2 мл соответствующего серийного разведения смешивают с 18 мл расплавленного BHI-агара и оставляют затвердевать. Когда инокулированная культура Р.haemolytica достигает стандартной плотности 0,5 по Мак-Фарланду, с помощью пипетирующего диспенсера приблизительно 5 мкл культуры Р. haemolytica инокулируют чашки с BHIагаром, содержащие различные концентрации тестируемого соединения, и инкубируют при 37 С в течение 18 ч. Начальные концентрации тестируемого соединения лежат в интервале от 100 до 200 мкг/мл. МИК равна концентрации тестируемого соединения, демонстрирующей 100%-ное ингибирование роста Р. haemolytica, в сравнении с неинокулированным контролем. Активность соединений формулы (I) invivo может быть определена в результате общепринятых исследований по защите животных,которые хорошо известны специалистам и обычно проводятся на мышах. Мышей по прибытии размещают по клеткам (10 на клетку) и позволяют им акклиматизироваться как минимум в течение 48 ч перед 22 использованием. Животных внутрибрюшинно инокулируют 0,5 мл бактериальной суспензии(Р. multocida штамм 59 А 006; 3103 КОЕ/мл). В каждом эксперименте имеется, по меньшей мере, три группы контрольных животных (не подвергаемых лечению), включающих в себя одну группу животных, инфицированных заражающей дозой, составляющей 0,1 от вводимой, и две - инфицированных заражающей дозой, равной вводимой опытным животным; кроме этого,может быть использована контрольная группа с 10-кратной заражающей дозой. Обычно для всех используемых в данном исследовании мышей заражение осуществляют в течение 30-90 мин,особенно в тех случаях, когда для заражения применяется автоматический шприц для повторного введения (такой как шприц CornwallR). Через тридцать минут после начала заражения производят первую обработку соединением. Может появиться необходимость привлечения второго специалиста для дозирования соединения, если не все животные были заражены по окончании 30 мин. Способ введения является подкожным или пероральным. Подкожное введение осуществляют в свободновисящую кожу тыльной части шеи, в то время как пероральное введение проводят, применяя иглу для кормления. В обоих случаях лекарственное средство используют в объеме 0,2 мл на мышь. Соединения вводят через 30 мин, 4 ч и 24 ч после заражения. Каждый тест включает в себя применение контрольного соединения известной эффективности, вводимого аналогичным способом. Животные подвергаются ежедневному наблюдению, производится регистрация числа выживших в каждой группе. Регистрация Р.(четырех дней) после заражения. ЗД 50 представляет собой рассчитанную дозу, в которой тестируемое соединение защищает 50% мышей в группе от смертельного исхода,обусловленного бактериальной инфекцией, летальной в отсутствие лекарственного средства. При лечении бактериальных и протозойных инфекций соединения формулы 1 и их фармацевтически приемлемые соли (в дальнейшем"активные соединения") могут вводиться посредством перорального, парентерального, местного или ректального способов введения. В общем, наиболее желательно вводить эти соединения в дозировках от приблизительно 0,2 мг на кг массы тела в день (мг/кг/день) до приблизительно 200 мг/кг/день в разовых или разделенных дозах (т.е. от 1 до 4 доз в день), хотя в зависимости от вида, массы и состояния подвергаемого лечению субъекта и выбранного конкретного способа введения непременно будут иметь место вариации. Однако уровень доз в интервале от приблизительно 4 до приблизительно 50 мг/кг/день оказывается наиболее желательно применимым. Тем не менее, вариации могут иметь место в зависимости от вида под 23 вергаемых лечению млекопитающего, рыбы или птицы и от их индивидуальной чувствительности к указанному лекарственному средству,равно как и от типа выбранного фармацевтического препарата и от временного периода и интервала, за которые осуществляется такое введение. В некоторых случаях более адекватными могут оказаться уровни доз ниже более низкого предела вышеуказанного интервала, в то время как в других случаях могут быть применены еще большие дозы, не вызывающие никаких вредных побочных эффектов, при условии, что такие большие дозы первоначально делят на несколько маленьких доз для введения в течение всего дня. Активные соединения могут быть введены сами по себе или в комбинации с фармацевтически приемлемыми носителями или разбавителями с помощью указанных ранее способов, и такое введение может быть осуществлено в разовых или многократных дозах. В частности, активные соединения могут быть введены в большом разнообразии различных лекарственных форм, т.е. они могут быть скомбинированы с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, пастилок, леденцов, порошков,аэрозолей, кремов, целебных мазей, суппозиториев, желе, гелей, паст, лосьонов, мазей, водных суспензий, растворов для инъекций, эликсиров,сиропов и им подобным. Такие носители включают в себя твердые разбавители или наполнители, стерильные водные среды и различные нетоксичные органические растворители, и так далее. Более того, в фармацевтические композиции для перорального введения могут быть добавлены подходящие подсластители и/или ароматизаторы. Обычно активные соединения в таких лекарственных формах представлены уровнями концентрации от приблизительно 5,0 до приблизительно 70 мас.%. Для перорального введения могут быть использованы таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция,фосфат дикальция и глицин, наряду с различными разрыхлителями, такими как крахмал (и предпочтительно кукурузный, картофельный крахмал и крахмал из тапиоки), альгиновая кислота и некоторые комплексные силикаты, вместе с такими связующими гранулирования, как поливинилпирролидон, сахароза, желатин и аравийская камедь. Вдобавок, часто очень полезными для таблетирования оказываются смазывающие вещества, такие как стеарат магния,лаурил сульфат натрия и тальк. Кроме того, в качестве наполнителя для желатиновых капсул могут быть использованы твердые композиции аналогичного типа; в этой связи предпочтительные материалы также включают в себя лактозу или молочный сахар, равно как и полиэтиленгликоли большой молекулярной массы. 24 Если для перорального введения желательны водные суспензии и/или эликсиры, активное соединение может быть скомбинировано с разнообразными подсластителями или ароматизаторами, окрашивающим веществом или красителями и, при желании, с эмульгирующими и/или суспендирующими агентами вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин, и различными подобными их комбинациями. Для парентерального введения могут быть использованы растворы активного соединения либо в кунжутовом, либо в арахисовом масле или в водном пропиленгликоле. Если необходимо, данные водные растворы следует подходящим образом забуферить (предпочтительно рН выше 8), а жидкий разбавитель сначала сделать изотоническим. Эти водные растворы пригодны для внутривенных инъекций. Растворы в масле пригодны для внутрисуставных, внутримышечных и подкожных инъекций. Приготовление всех этих растворов в стерильных условиях легко выполняется с помощью стандартных фармацевтических методик, также известных специалистам. Вдобавок, активные соединения по настоящему изобретению также возможно вводить местно, и это может быть сделано посредством кремов, желе, гелей, паст, пластырей, мазей и им подобным, в соответствии с обычной фармацевтической практикой. Активные соединения для введения животным, исключая людей, таким как крупный рогатый скот или домашние животные, могут быть введены в корм для животных или перорально как вливание лекарственной композиции. Кроме того, активные соединения могут быть введены в форме систем доставки в липосомах, таких как малые однослойные везикулы,большие однослойные везикулы и многослойные везикулы. Липосомы могут быть образованы из большого разнообразия фосфолипидов,таких как холестерин, стеариламин или фосфатидилхолины. Кроме того, активные соединения могут быть связаны с растворимыми полимерами, как носителями для доставки лекарственного средства к мишени. Такие полимеры могут включать в себя поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламид фенил,полигидроксиэтиласпартамидфенол или полиэтиленоксид-полилизин, замещенный остатками пальмитоила. Более того, активные соединения могут быть связаны с классом биодеградируемых полимеров, полезных для достижения контролируемого высвобождения лекарственного средства, например с полимолочной кислотой,полигликолевой кислотой, сополимерами полимолочной и полигликолевой кислот, полиэпсилонкапролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, 25 полидигидропиранами, полицианоакрилатами и перекрестно-сшитыми или амфипатическими блок-сополимерами гидрогелей. Следующие далее примеры дают иллюстрацию способа и промежуточных соединений по настоящему изобретению. Ясно, что настоящее изобретение не ограничивается специфическими деталями предложенных ниже примеров. 26 Соединения из примеров 1-18 имеют общую формулу 6, представленную ниже, с заместителями R, указанными ниже в данной таблице. Соединения получают, как описано ниже в способах получения 1-6. Данные по выходу и масс-спектрам ("масс-спектр"), представленные в таблице, относятся к конечному продукту. Таблица 1 Заместитель R н-бутиламино пропиламино метоксиэтиламино диметиламино циклопропиламино аллиламино имидазол-1-ил 2,2,2-трифторэтиламино бис(2-гидроксиэтил)амино бис(2-метоксиэтил)амино 2-гидроксиэтилтио меркапто 4-метилимидазол-1-ил 2-пропиниламино диаллиламино 1,2,3-триазол-1- ил 2-метилимидазол-1-ил 1,2,4-триазол-1-ил Способы получения для таблицы 1 Способ получения 1. 250-500 мг соединения формулы 3, в котором Х представляет собой -N(СН 3)СН 2-, R1 представляет собой гидрокси, и R4 представляет собой Н, полученного в соответствии с приведенным выше способом А, растворяют в 1-2 мл амина, соответствующего R-группам, указанным выше в табл. 1. Добавляют каталитическое количество (20 мг) пиридиния гидрохлорида и раствор нагревают до 50-75 С в течение приблизительно от двух до пяти дней. Реакцию останавливают с помощью 50 мл насыщенногоNаНСО 3. Органический слой экстрагируют 350 мл СН 2 Сl2 и высушивают над Na2SO4. Фильтрование, концентрирование и высушивание фильтрата дает неочищенное масло или твердое вещество. Дальнейшая очистка на колонке с силикагелем (1,5-4% МеОН/СНСl3; 0,2%NH4OH) позволяет получить аминоспирт в качестве конечного продукта. Способ получения 2. 250-500 мг соединения формулы 3, в котором Х представляет собой -N(СН 3)СН 2-, R1 представляет собой гидрокси, и R4 представляет собой Н, полученного в соответствии с приведенным выше способом А, растворяют в 1-2 мл амина, соответствующего R-группам, указанным выше в табл. 1, в герметизированной пробирке. Добавляют каталитическое количество(20 мг) пиридиния гидрохлорида и раствор нагревают до 40-75 С в течение приблизительно от четырех до восьми дней. Реакцию останавливают с помощью 50 мл насыщенного NаНСО 3. Органический слой экстрагируют 350 мл СН 2 Сl2 и высушивают над Na2SO4. Фильтрование, концентрирование и высушивание фильтрата дает неочищенное масло или твердое вещество. Дальнейшая очистка на колонке с силикагелем (1,5-4% МеОН/СНСl3; 0,2% NH4OH) позволяет получить аминоспирт в качестве конечного продукта. 27 Способ получения 3. 300 мг соединения формулы 3, в котором Х представляет собой -N(СН 3)СН 2-, R1 представляет собой гидрокси, и R4 представляет собой Н, полученного в соответствии с приведенным выше способом А, растворяют в 2-4 мл МеОН/Н 2 О. Добавляют имидазольный реагент,соответствующий R-группам, указанным выше в табл. 1 (25 экв.), и каталитическое количество(20 мг) пиридиния гидрохлорида. Реакционную смесь кипятят с обратным холодильником при температуре 45-50 С в течение от трех до четырех дней. Затем реакцию останавливают с помощью насыщенного NаНСО 3, реакционную смесь экстрагируют 3300 мл CH2Cl2, высушивают над Na2SO4, фильтруют и концентрируют до твердого вещества. Твердое вещество перерастворяют в 500 мл EtOAc и промывают 3150 мл 2 н. NaOH для удаления избытка имидазола. Дальнейшая очистка на колонке с силикагелем (2-4% МеОН/СНСl3; 0,2% NH4OH) позволяет получить конечный продукт. Способ получения 4. 200-500 мг соединения формулы 3, в котором Х представляет собой -N(СН 3)СН 2-, R1 представляет собой гидрокси, и R4 представляет собой Н, полученного в соответствии с приведенным выше способом А, растворяют в 1-2 мл 2-пропанола или метанола. Добавляют избыток реагента и каталитическое количество (20 мг) пиридиния гидрохлорида. Раствор нагревают до 40-75 С в течение приблизительно от двух до семи дней. Реакционную смесь концентрируют до получения неочищенного продукта. Дальнейшая очистка на колонке с силикагелем (2-4% МеОН/СНСl3; 0,2% NH4OH) позволяет получить аминоспирт в качестве конечного продукта. Способ получения 5. 180 мг соединения формулы 3, в котором Х представляет собой -N(СН 3)СН 2-, R1 представляет собой гидрокси, и R4 представляет собой Н, полученного в соответствии с приведенным выше способом А, растворяют в 2 мл бензола. Добавляют избыток К 2 СО 3 и 0,5 мл тиола. Смесь перемешивают при комнатной температуре в течение 16 ч. Реакцию останавливают с помощью 100 мл насыщенного NаНСО 3, реакционную смесь экстрагируют 325 мл СН 2 Сl2,высушивают над Na2SO4, фильтруют и концентрируют до твердого вещества. Дальнейшая очистка на колонке с силикагелем (2% МеОН/СНСl3; 0,2% NH4OH) позволяет получить конечный продукт. Способ получения 6. 115 мг соединения формулы 3, в котором Х представляет собой -N(СН 3)СН 2-, R1 представляет собой гидрокси, и R4 представляет собой Н, полученного в соответствии с приведенным выше способом А, растворяют в 3 мл этанола. Добавляют избыток тиола. Смесь нагревают до 50 С в течение 4 ч. Реакцию останавли 002440CH2Cl2, высушивают над Na2SO4, фильтруют и концентрируют до твердого вещества. Дальнейшая очистка на колонке с силикагелем (2-4% МеОН/СНСl3; 0,2% NH4OH) позволяет получить конечный продукт. В приведенных ниже примерах 19-35 описывается получение соединений, имеющих общую структуру формулы 7, приведенной ниже,в которой R такой, как определен в примерах. Пример 19. К раствору метилмагнийбромида в Et2O (3,0 М; 1,7 мл) при 0 С добавляют раствор метилпропаргилового эфира (0,421 г; 6 ммоль) в THF (5 мл). После перемешивания при 0 С в течение 6 ч добавляют при комнатной температуре раствор 4"-дезокси-4"-оксо-9 дезоксо-9 а-аза-9 а-метил-9 а-гомоэритромицина А (0,224 г; 0,3 ммоль) в DME (10 мл). После перемешивания в течение 1 ч реакционную смесь разбавляют водой (50 мл) и EtOAc (50 мл). После разделения водный слой промываютEtOAc (330 мл). Объединенные органические экстракты промывают насыщенным водным раствором бикарбоната натрия (40 мл) и солевым раствором (40 мл), высушивают над Na2SO4 и концентрируют под вакуумом. Хроматография на силикагеле в системе растворителей МеОН-СН 2 Сl2-NH4OH (от 6:93,5:0,5 до 8:91,5:0,5) позволяет получить 0,095 г (39%-ный выход) соединения формулы 7, в котором R представляет собой 3-метокси-1-пропинил: МС: 817 (ИАД, ионизация при атмосферном давлении). Пример 20. К раствору метилмагнийбромида в Et2O (3,0 М; 1,7 мл) при 0 С добавляют раствор 1-диметиламино-2-пропина (0,499 г; 6 ммоль) в THF (5 мл). После перемешивания при 0 С в течение 6 ч добавляют при комнатной температуре раствор 4"-дезокси-4"-оксо-9 дезоксо-9 а-аза-9 а-метил-9 а-гомоэритромицина А (0,224 г; 0,3 ммоль) в DME (10 мл). После перемешивания при комнатной температуре в течение 1 ч реакционную смесь разбавляют водой (50 мл) и EtOAc (40 мл). После разделения водный слой промывают EtOAc (330 мл). Объединенные органические экстракты промывают насыщенным водным раствором бикарбоната натрия (40 мл) и солевым раствором (50 мл), высушивают над Na2SO4 и концентрируют под вакуумом. Хроматография на силикагеле в системе растворителей МеОН-CH2Cl2-NH4OH(от 6:93,5:0,5 до 10:89,5:0,5) позволяет получить 0,093 г (37%-ный выход) соединения формулы 7, в котором R представляет собой 3 диметиламино-1-пропинил: МС: 831 (ИАД). Пример 21. К суспензии тетрафторбората триметилсульфония (1,03 г; 6,3 ммоль) в THF(40 мл) при -10 С добавляют KHMDS (1,20 г; 6,0 ммоль). После перемешивания при температуре ниже 0 С в течение 0,5 ч реакционный сосуд охлаждают до -78 С и добавляют раствор соединения формулы IV, в котором Х представляет собой -N(СН 3)СН 2-, а R13 представляет собой бензилоксикарбокси (2,60 г; 3 ммоль) вDME (10 мл). Через 0,5 ч реакционную смесь разбавляют насыщенным водным раствором хлорида аммония (40 мл) и EtOAc (50 мл). После разделения водный слой промывают EtOAc(330 мл). Объединенные органические экстракты промывают солевым раствором (40 мл),высушивают над Na2SO4 и концентрируют под вакуумом. Хроматография на силикагеле в системе растворителей МеОН-СН 2 Сl2-NH4OH (от 2:97,6:0,4 до 4:95,5:0,4) позволяет получить 0,834 г (32%-ный выход) соединения формулы 3, в котором Х представляет собой -N(СН 3)СН 2-,а R13 представляет собой бензилоксикарбонил: МС: 881 (ИАД). Конфигурация эпоксидной группировки соответствует способу Б в соответствии с приведенной выше схемой 2. Пример 22. К раствору соединения из примера 21 (0,101 г; 0,115) в DME (3 мл) по каплям добавляют LiAlH4 (1,0 М; 2,1 мл). Через 10 мин реакционную смесь последовательно обрабатывают водой (0,044 мл), 15%-ным растворомNaOH (0,044 мл) и водой (0,132 мл), затем перемешивают при комнатной температуре в течение 0,5 ч. Смесь разбавляют EtOAc (20 мл) и водой (20 мл). После разделения водный слой промывают EtOAc (330 мл). Объединенные органические экстракты промывают насыщенным водным раствором бикарбоната натрия (50 мл) и солевым раствором (60 мл), высушивают над Na2SO4 и концентрируют под вакуумом. Хроматография на силикагеле в системе растворителей МеОН-СН 2 Сl2-NH4OH (от 3:96,5:0,5 до 3,5:95:0,5) позволяет получить 0,042 г (49%-ный выход) промежуточного соединения: МС: 749(ИАД). К раствору описанного выше промежуточного соединения (0,151 г; 0,202 ммоль) и формальдегида (0,17 мл; 2,02 ммоль) в метаноле (20 мл) добавляют палладиевый катализатор (0,075 мг; 10%-ного Pd/C). Реакционный сосуд продувают и заполняют водородом (50 ф/кв. дюйм; 344,75 кПа), встряхивают при комнатной температуре в течение 24 ч. Реакционную смесь фильтруют через Celite и концентрируют под вакуумом. Хроматография на силикагеле в системе растворителей гексан - ацетон - н-пропанол 30 метил-9-дезоксо-9 а-аза-9 а-метил-9 а-гомоэритромицина А: МС: 763 (ИАД). Пример 23. К раствору 4"-дезокси-4"-оксо 9-дезоксо-9 а-аза-9 а-метил-9 а-гомоэритромицина А (1,0 г; 1,34 ммоль) в DME (50 мл) при 0 С добавляют этинилмагнийбромид в THF (0,5 М; 40,2 мл). После перемешивания при 0 С в течение 0,5 ч реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия(100 мл) и EtOAc (100 мл). После разделения водный слой промывают EtOAc (3100 мл). Объединенные органические экстракты промывают насыщенным водным раствором бикарбоната натрия (100 мл) и солевым раствором (100 мл), высушивают над Na2SO4 и концентрируют под вакуумом. Хроматография на силикагеле в системе растворителей МеОН-СН 2 Сl2-NH4OH(0,217 г; 2,68 ммоль) в THF (5 мл) при -78 С добавляют BuLi (2,5 М; 1,08 мл). Раствор в течение 2 ч нагревают до комнатной температуры и затем при комнатной температуре с помощью канюли добавляют в колбу, содержащую МgСl2(0,38 г; 4,02 ммоль) и THF (5 мл). Через 1 ч при комнатной температуре вводят раствор 4"дезокси-4"-оксо-9-дезоксо-9 а-аза-9 а-метил-9 агомоэритромицина А (0,200 г; 0,268 ммоль) вTHF (2 мл) и перемешивание при комнатной температуре продолжают в течение 45 мин. Реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия (50 мл) иEtOAc (50 мл). После разделения водный слой промывают EtOAc (350 мл). Объединенные органические экстракты промывают насыщенным водным раствором бикарбоната натрия (50 мл) и солевым раствором (50 мл), высушивают над Na2SO4 и концентрируют под вакуумом. Хроматография на силикагеле в системе растворителей МеОН-CH2Cl2-NH4OH (от 1:98:1 до 8:91:1) позволяет получить 0,032 г (14%-ный выход) соединения формулы 7, в котором R представляет собой 1-метил-2-пирролил: МС: 829 (ИАД). Пример 25. К раствору N-метилимидазола(0,440 г; 5,36 ммоль) в THF (5 мл) при -78 С добавляют BuLi (2,5 М; 2,15 мл). Раствор в течение 1 ч нагревают до комнатной температуры и затем при комнатной температуре с помощью канюли добавляют в колбу, содержащую MgCl2(0,6374 г; 6,69 ммоль) и THF (5 мл). Через 2 ч при комнатной температуре вводят раствор 4"дезокси-4"-оксо-9-дезоксо-9 а-аза-9 а-метил-9 агомоэритромицина А (0,200 г; 0,268 ммоль) вDMF (2 мл) и перемешивание при комнатной температуре продолжают в течение 45 мин. Реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия (50 мл) иEtOAc (50 мл). После разделения водный слой 31 промывают EtOAc (350 мл). Объединенные органические экстракты промывают насыщенным водным раствором бикарбоната натрия (50 мл) и солевым раствором (50 мл), высушивают над Nа 2SO4 и концентрируют под вакуумом. Хроматография на силикагеле в системе растворителей МеОН-СН 2 Сl2-NH4OH (от 1:98:1 до 8:91:1) позволяет получить 0,042 г (19%-ный выход) соединения формулы 7, в котором R представляет собой 1-метил-2-имидазолил: МС: 830 (ИАД). Пример 26. К раствору неочищенного образца соединения, полученного в примере 20(0,360 г), в изопропаноле (40 мл) добавляют оксид платины (0,076 г; 0,335 ммоль). Реакционный сосуд продувают и заполняют водородом(50 ф/кв. дюйм; 344,75 кПа), встряхивают при комнатной температуре в течение 24 ч. Фильтрование аликвоты реакционной смеси через Celite и концентрирование под вакуумом позволяет получить соединение формулы 7, в котором R представляет собой 3-диметиламино-1 пропенил: МС: 833 (ИАД). Пример 27. К раствору, оставшемуся из примера 26, добавляют оксид платины (0,076 г; 0,335 ммоль) и реакционный сосуд продувают и заполняют водородом (50 ф/кв. дюйм; 344,75 кПа), встряхивают при комнатной температуре в течение 96 ч. Реакционную смесь фильтруют через Celite и концентрируют под вакуумом. Хроматография на силикагеле в системе растворителей МеОН-CH2Cl2-NH4OH (от 1:98:1 до 8:91:1) позволяет получить 0,027 г (5%-ный выход) соединения формулы 7, в котором R представляет собой 3-диметиламинопропил: МС: 835 (ИАД). Пример 28. К раствору неочищенного образца соединения, полученного в примере 19(0,400 г), в изопропаноле (40 мл) добавляют оксид платины (0,076 г; 0,335 ммоль). Реакционный сосуд продувают и заполняют водородом(50 ф/кв. дюйм; 344,75 кПа), встряхивают при комнатной температуре в течение 24 ч. Фильтрование аликвоты реакционной смеси через Celite и концентрирование под вакуумом позволяет получить соединение формулы 7, в котором R представляет собой 3-метокси-1 пропенил: МС: 819 (ИАД). Пример 29. К раствору, оставшемуся из примера 26, добавляют оксид платины (0,076 г; 0,335 ммоль) и реакционный сосуд продувают и заполняют водородом (50 ф/кв. дюйм; 344,75 кПа), встряхивают при комнатной температуре в течение 96 ч. Реакционную смесь фильтруют через Celite и концентрируют под вакуумом. Хроматография на силикагеле в системе растворителей МеОН-CH2Cl2-NH4OH (от 1:98:1 до 8:91:1) позволяет получить 0,119 г (21%-ный выход) соединения формулы 7, в котором R представляет собой 3-метоксипропил: МС: 822DME (2 мл) и перемешивание продолжают в течение 1 ч при 0 С, затем при комнатной температуре в течение 0,5 ч. Реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия (75 мл) и EtOAc (75 мл). После разделения водный слой промываютEtOAc (375 мл). Объединенные органические экстракты промывают насыщенным водным раствором бикарбоната натрия (75 мл) и солевым раствором (75 мл), высушивают над Nа 2SO4 и концентрируют под вакуумом. Хроматография на силикагеле в системе растворителей МеОН-СН 2 Сl2-NH4OH (от 1:98:1 до 8:91:1) позволяет получить 0,099 г (31%-ный выход) соединения формулы 7, в котором R представляет собой 1-пропинил, в виде смеси изомеров: МС: 788 (ИАД). Пример 31. К раствору 4"-дезокси-4"-оксо 9-дезоксо-9 а-аза-9 а-метил-9 а-гомоэритромицина А (0,59 г; 0,79 ммоль) в THF (20 мл) при 0 С добавляют раствор МеМgВr в Et2O (1,7 мл; 5,1 ммоль; 3 М раствора в Et2O). Взвесь перемешивают при 0 С в течение 1 ч и постепенно нагревают до комнатной температуры. Через 3 ч реакцию останавливают с помощью насыщенного раствора NH4Cl (10 мл). Органический растворитель удаляют in vacuo на роторном испарителе. рН оставшегося водного раствора подводят до значения 9,5 с помощью насыщенного раствора NаНСО 3 с последующим добавлением этилацетата (30 мл). Водный слой после отделения экстрагируют этилацетатом (230 мл). Объединенные органические экстракты промывают солевым раствором, высушивают над сульфатом магния и концентрируют, что позволяет получить неочищенный продукт. Хроматографическая очистка (силикагель со смесью МеОН/CHCl3/NH4OH (4:95,9:0,1) в качестве элюента) дает 4"R-метил-9-дезоксо-9 а-аза-9 аметил-9 а-гомоэритромицин А (представляющий собой соединение формулы 7, в котором R является метилом в R-конфигурации) в виде твердого вещества белого цвета, 240 мг (0,315 ммоль; 40%-ный выход): АИЭ-МС (вторичная атомноионная эмиссия): m/е 763 (МН+). Пример 32. Следуя методике из примера 31, приводят во взаимодействие 4"-дезокси-4"оксо-9-дезоксо-9 а-аза-9 а-метил-9 а-гомоэритромицин А (299 мг; 0,403 ммоль) и фенилмагнийбромид (0,87 мл; 2,61 ммоль; 3,0 М раствора в ТНF) с получением соединения формулы 7, в котором R представляет собой фенил, 74 мг Пример 33. Следуя методике из примера 31, приводят во взаимодействие 4"-дезокси-4"оксо-9-дезоксо-9 а-аза-9 а-метил-9 а-гомоэритромицин А (482 мг; 0,646 ммоль) и винилмагнийбромид (4,2 мл; 4,2 ммоль; 1,0 М раствора вTHF) с получением соединения формулы 7, в котором R представляет собой винил, 133 мг(0,172 ммоль; 26,6%-ный выход): АИЭ-МС: m/е 774 (МН+). Пример 34. Следуя методике из примера 31, приводят во взаимодействие 4"-дезокси-4"оксо-9-дезоксо-9 а-аза-9 а-метил-9 а-гомоэритромицин А (494 мг; 0,662 ммоль) и бензилмагнийхлорид (4,4 мл; 4,4 ммоль; 1,0 М раствора вTHF) с получением соединения формулы 7, в котором R представляет собой бензил, 30 мг(0,172 ммоль; 5,4%-ный выход): АИЭ-МС: m/е 839 (МН+). Пример 35. К раствору 4"-дезокси-4"-оксо 9-дезоксо-9 а-аза-9 а-метил-9 а-гомоэритромицина А (602 мг; 0,806 ммоль) в хлороформе (8 мл) добавляют TMSCN (220 мл; 1,64 ммоль) с последующим добавлением ZnI2 (13 мг; 0,04 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 30 мин. Добавляют 10%-ный раствор К 2 СО 3 в воде (10 мл). Органический слой промывают солевым раствором, высушивают (MgSO4) и концентрируютin vacuo, что позволяет получить неочищенный продукт. Хроматография на силикагеле в системе растворителей СНСl3-МеОН-NH4OH(97:3:0,1) в качестве элюента позволяет получить соединение формулы 7, в котором R представляет собой циано, в виде твердого вещества белого цвета, 94,4 мг (0,122 ммоль; 15%-ный выход): АИЭ-МС: m/е 774 (МН+). Приведенная далее схема иллюстрирует получение соединений из табл. 2 (ниже). На схеме Cbz представляет собой бензилоксикарбонил. аллиламино пропиламино изопропиламино циклопропиламино изобутиламино втор-бутиламино диметиламино триметиленимино бутиламино диэтиламино этиламино Указанное на схеме соединение формулы 8(150 мл) с последующим добавлением формальдегида (5,1 мл 37%-ного раствора; 68,1 ммоль) и муравьиной кислоты (2,8 мл; 74,9 ммоль). Полученный раствор нагревают до 60 С в течение ночи для получения соединения формулы 9. Реакционную смесь выливают в воду (150 мл) и метиленхлорид (50 мл). Органический слой еще один раз промывают водой (150 мл), водные слои объединяют и рН раствора подводят до значения 9, добавляя 5 н. раствор NaOH. Далее продукт экстрагируют метиленхлоридом (3100 мл). Объединенные органические слои промывают солевым раствором, высушивают над сульфатом натрия и органический растворитель удаляют in vacuo, получая соединение формулы 9 (19,6 г; 96%). МС (ТР (термораспыление m/z 895. 1-2 г соединения формулы 9 растворяют в метаноле (10 мл) с последующим добавлениемKI (10 экв.) и амина, соответствующего Rгруппам, представленным ниже в табл. 2 (10 экв.). По прошествии указанного ниже времени взаимодействия реакционную смесь разбавляют водой (10 мл) и экстрагируют СН 2 Сl2 (315 мл). Объединенные органические слои промывают солевым раствором, высушивают с помощью Na2SO4, фильтруют и очищают флэш-хроматографией, получая соединения формулы 10 с Приведенная далее схема иллюстрирует получение соединений из примеров 48-49 (ниже).(41,5 мг; 1,73 ммоль) в DMF (5 мл) добавляют триметилсульфоксонийиодид (399 мг; 1,77 ммоль). Через 15 мин мутная реакционная смесь становится прозрачной. Медленно добавляют раствор 4"-дезокси-4"-оксо-9-дезоксо-9 а-аза-9 аметил-9 а-гомоэритромицина А (940 мг; 1,26 ммоль) в DMSO (3 мл). Полученный раствор желтого цвета перемешивают в течение 15 мин при комнатной температуре и 45 мин при 55 С,а затем при комнатной температуре в течение ночи. Реакционную смесь переводят в воду (20 мл) и этилацетат (20 мл). Органический слой(MgSO4) и концентрируют, что позволяет получить неочищенный продукт, который хроматографируют на силикагеле (СНСl3-МеОНNH4 ОН (97/3/0,1, получая указанное выше соединение формулы 12 в виде твердого вещества белого цвета, 362 мг (0,476 ммоль; 38%-ный выход): АИЭ-МС: m/е 761 (МH+). Пример 49. К раствору соединения, полученного в примере 48 (95 мг; 0,12 ммоль), в 9 мл смеси MeOH-H2O (8/1) добавляют азид натрия(39 мг; 0,60 ммоль) с последующим добавлением NH4Cl (19 мг; 0,36 ммоль). Реакционную смесь нагревают при 80 С в течение 24 ч. Метанол удаляют in vacuo на роторном испарителе. Смесь, содержащую продукт, переводят в этилацетат (15 мл) и Н 2 О (15 мл). Водный слой после отделения экстрагируют этилацетатом (15 мл). Объединенные органические экстракты промывают солевым раствором, высушивают над сульфатом магния и концентрируют, что позволяет получить соединение формулы 13 в виде твердого вещества белого цвета, 90 мг(0,11 ммоль; 93%-ный выход): АИЭ-МС: m/е 804 (МH+). Приведенная далее схема иллюстрирует получение соединений из примеров 50-54 (ниже). Пример 50. К раствору соединения, полученного в примере 49 (709 мг; 0,882 ммоль),добавляют порошок Pd (10%-ный на угле; 94 мг; 0,088 ммоль). Взвесь перемешивают в атмосфере Н 2 (1 ат; 98 кПа) в течение 18 ч. Реакционную смесь фильтруют через CeliteTM. Упаривание фильтрата позволяет получить соединение формулы 14 в виде твердого вещества белого цвета,670 мг (0,88 ммоль; 100%-ный выход): АИЭМС: m/е 778 (МН+). Пример 51. К раствору соединения, полученного в примере 50 (163 мг; 0,209 ммоль), в СН 2 Сl2 (10 мл) при 0 С добавляют тиокарбонилдиимидазол (43 мг; 0,242 ммоль). Ледяную баню удаляют и реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Удаляют растворитель. Смесь, содержащую продукт, переводят в этилацетат и воду. Органический слой промывают 5%-ным раствором К 2 СО 3 и затем солевым раствором, высушивают над сульфатом магния и концентрируют, что позволяет получить соединение формулы 15 в виде твердого вещества белого цвета,170 мг (0,207 ммоль; 99%-ный выход). Соединение формулы 15 (168 мг; 0,205 ммоль) растворяют в ацетоне (6 мл) с последующим добавлением 3,4-дихлорфенацилбромида (63 мг; 0,234 ммоль) и бикарбоната натрия(38 мг; 0,417 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение 20 ч. Удаляют органический растворитель. Смесь, содержащую продукт, переводят в этилацетат и промывают 5%-ным раствором К 2 СО 3, солевым раствором, высушивают над сульфатом магния и концентрируют, что позволяет получить неочищенный продукт. Хроматография на силикагеле (СНСl3-МеОН-NH4OH 98/2/0,1) дает соединение формулы 16, в котором R такая, как дается ниже, в виде твердого вещества белого цвета, 90 мг (0,09 ммоль; 44%ный выход): АИЭ-МС: m/е 1006 (МН+). Пример 52. К раствору соединения формулы 15 (225 мг; 0,274 ммоль) в безводном метаноле (10 мл) добавляют метилат натрия (50 мг; 0,926 ммоль). Раствор перемешивают в течение 10 мин и охлаждают до 0 С. По каплям добавляют йодистый метил (60 мл; 0,99 ммоль). Реакционную смесь нагревают до комнатной температуры и перемешивают при температуре окружающей среды в течение 7 ч. Удаляют органический растворитель. Смесь, содержащую продукт, переводят в этилацетат и промывают 5%ным раствором К 2 СО 3, солевым раствором, высушивают над сульфатом магния и концентрируют, что позволяет получить неочищенный продукт. Хроматография на силикагеле (СНСl3 МеОН-NН 4OН=97/3/0,1) дает соединение формулы 16, в котором R представляет собой метилтио, в виде твердого вещества белого цвета,231 мг (0,277 ммоль; 36%-ный выход): АИЭМС: m/е 834 (МН+). Пример 53. К раствору соединения формулы 14 (250 мг; 0,321 ммоль) в дихлорэтане (10 мл) добавляют этил-2-тиофенкарбоксимидат гидрохлорид (72 мг; 0,461 ммоль), который получают посредством барботирования газообразного НСl через бензольный раствор 2-тиофенкарбонитрила и этанола (1,1 эквивалент) в течение 2 ч и перемешивания при температуре окружающей среды в течение ночи. Мутная реакционная смесь становится прозрачной в результате добавления триэтиламина (65 мл; 0,467 ммоль). Ее кипятят с обратным холодильником в течение ночи. Смесь, содержащую продукт,переводят в этилацетат и воду и рН подводят до значения 1,9 с помощью 10%-ного раствора НСl. рН водного слоя подводят до значения 9,5 и экстрагируют этилацетатом. Органический экстракт промывают солевым раствором, высушивают над сульфатом магния и концентрируют, что позволяет получить неочищенный продукт. Хроматография на силикагеле (СНСl3 МеОН-NH4 ОН=99/1/0,1) дает соединение формулы 16, в котором R представляет собой 2 тиенил, в виде твердого вещества белого цвета,92 мг (0,106 ммоль; 33%-ный выход): АИЭ-МС:m/е 870 (МН+). Пример 54. В круглодонную колбу помещают ZnCl2 (2 мг) и под вакуумом нагревают до плавления. После охлаждения до комнатной температуры добавляют раствор соединения формулы 14 (236 мг; 0,303 ммоль) и 2 цианопиридина (49 мг; 0,467 ммоль) в хлорбензоле (10 мл). Реакционную смесь нагревают до температуры дефлегмации в течение ночи. Добавляют воду и рН подводят до значения 2. После разделения рН водного слоя подводят до значения 9,5 и экстрагируют этилацетатом. Ор 39 ганический экстракт промывают солевым раствором, высушивают над сульфатом магния и концентрируют, что позволяет получить неочищенный продукт. Хроматография на силикагеле (CHCl3-MeOH-NH4OH=98/2/0,1) дает соединение формулы 16, в котором R представляет собой 2-пиридил, в виде твердого вещества белого цвета, 47 мг (0,054 ммоль; 18%-ный выход): АИЭ-МС: m/е 865 (МН+). Пример 55. К раствору соединения формулы 14 (383 мг; 0,492 ммоль) в метаноле (5 мл) по каплям добавляют раствор бромоциана (57 мг; 0,538 ммоль) и ацетата натрия (90 мг; 1,097 ммоль) в метаноле (5 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Растворитель упаривают и твердое вещество переводят в этилацетат и воду, рН подводят до значения 9,5 с помощью 10%-ного раствора К 2 СО 3. Органический экстракт промывают солевым раствором, высушивают над сульфатом магния и концентрируют,что позволяет получить неочищенный продукт. Хроматография на силикагеле (CHCl3-MeOHNH4OH=96/4/0,1) дает соединение формулы 16,в котором R представляет собой амино, в виде твердого вещества белого цвета, 124 мг (0,155 ммоль; 31%-ный выход): АИЭ-МС: m/e 803(МН+). Приведенная далее схема иллюстрирует получение соединений из примеров 56-63 (ниже). Пример 56. Раствор соединения формулы 17 (3 г; 3,7 ммоль) в 30 мл МеОН нагревают в течение ночи при температуре 50 С с 2,25 г(37,5 ммоль) этилендиамина и 6,21 г (37,1 ммоль) иодистого калия. Из полученной смеси упаривают МеОН, остаток растворяют в СН 2 Сl2 и промывают солевым раствором. После высушивания над Na2SO4 СН 2 Сl2 упаривают при пониженном давлении. Остаток хроматографируют на SiO2 (от 5% МеОН-СН 2 Сl2-0,5% NH4OH до 10% МеОН-СН 2 Сl2-1% NH4OH), получая 2,72 г (89%) соединения формулы 18, в котором Y представляет собой -NH-: МС m/e 821 (М+1). Пример 57. Раствор соединения, полученного в примере 56 (1,0 г; 1,2 ммоль), оанисового альдегида (174 мг; 1,3 ммоль) и ацетата натрия (100 мг; 1,2 ммоль) в 20 мл СН 2 Сl2 перемешивают при комнатной температуре в 40 течение 1 ч. К этому раствору добавляют 388 мг(1,8 ммоль) триацетоксиборгидрида натрия. После перемешивания при комнатной температуре в течение 2,5 ч реакционную смесь разбавляют СН 2 Сl2 и промывают насыщенным растворомNаНСО 3 и солевым раствором. После высушивания над Na2SO4 органический растворитель удаляют. Остаток дважды хроматографируют наSiO2 (2% MeOH-CH2Cl2-0,2% NH4 ОН). Далее материал очищают на препаративных SiO2 пластинах (10% MeOH-CH2Cl2-1% NH4OH), получая 660 мг (58%) соединения формулы 19, в котором Y представляет собой -NH-, Y1 представляет собой Н, а Y2 представляет собой 2 метоксибензил: МС m/е 940 (М+1). Примеры 58-59. Соединения из примеров 58 и 59 могут быть получены способами, аналогичными описанному в примере 57, в результате замены о-анисового альдегида на п-трифторметилбензальдегид и п-феноксибензальдегид, соответственно, причем указанные соединения имеют общую структуру формулы 19, Y и Y1 такие, как определены для соединения из примера 57, а Y2 дается ниже. Пример Пример 60. Раствор соединения, полученного ранее в примере 57 (468 мг; 0,5 ммоль),изомасляного альдегида (36 мг; 0,5 ммоль) и ацетата натрия (42 мг; 0,5 ммоль) в 5 мл СН 2 Сl2 перемешивают при комнатной температуре в течение 1,5 ч. К этому раствору добавляют 164 мг (0,77 ммоль) триацетоксиборгидрида натрия. После перемешивания при комнатной температуре в течение 0,5 ч реакционную смесь разбавляют CH2Cl2 и промывают раствором NaHCO3 и солевым раствором. После высушивания надMgSO4 растворитель удаляют при пониженном давлении. Остаток хроматографируют на SiO2(4% MeOH-CH2Cl2-0,4% NH4OH), получая 256 мг (51%) соединения формулы 19, в котором Y представляет собой -NH-, Y1 представляет собой 2-метилпропил, а Y2 представляет собой 2-метоксибензил: МС m/е 996 (М+1). Пример 61. Раствор соединения формулы 20 (522 мг; 0,65 ммоль), 2-фталимидэтантио(1,08 г; 5,2 ммоль) и иодистого натрия (865 мг; 5,2 ммоль) в 5 мл МеОН нагревают в атмосфере азота в течение 48 ч. Затем МеОН удаляют при пониженном давлении, остаток растворяют вCH2Cl2 и промывают раствором NаНСО 3 и солевым раствором. После высушивания над MgSO4 СН 2 Сl2 удаляют при пониженном давлении. Полученный остаток растворяют в 10 мл EtOH и обрабатывают 7,5 мл гидразина гидрата. После перемешивания при комнатной температуре в течение 3 ч EtOH удаляют при пониженном давлении и остаток экстрагируют CH2Cl2. Органический слой промывают солевым раствором и высушивают над MgSO4. Хроматография остат 41 ка на SiO2 (от 4% МеОН-СН 2 Сl2-0,4% NH4OH до 5% МеОH-СН 2 Сl2-0,5% NH4OH) дает 287 мг(53%) соединения формулы 18, в котором Y представляет собой S: МС m/е 837 (M+1). Пример 62. Соединение формулы 19, в котором Y представляет собой S, Y1 и Y2 оба представляют собой 2-метоксибензил (79%-ный выход, MS m/e 957 (M+1, и соединение формулы 19, в котором Y представляет собой S, Y1 представляет собой Н, а Y2 представляет собой 2-метоксибензил (3%-ный выход, МС m/е 1077(М+1, получают способом, аналогичным описанному в примере 57, используя в качестве исходного материала соединение из примера 60. Пример 63. Соединение формулы 19, в котором Y представляет собой S, Y1 представляет собой н-пропил, а Y2 представляет собой 2 метоксибензил, получают с 70%-ным выходом(МС m/е 999 (М+1 способом, аналогичным описанному в примере 60, используя в качестве исходного материала соединение формулы 19, в котором Y представляет собой S, Y1 представляет собой Н, а Y2 представляет собой 2 метоксибензил, и пропионовый альдегид. Приведенная далее схема иллюстрирует получение соединений из примеров 64-72 (ниже). Пример 64. Соединение формулы 20, в котором Y=NH, получают с 35%-ным выходом,используя в качестве исходного материала соединение формулы 12, по методике, аналогичной описанной в примере 56; МС m/е 821 (М+1). Пример 65. Используя методику, аналогичную описанной в примере 63, и в качестве исходного материала продукт из примера 64,получают с 16%-ным выходом соединение формулы 21, в котором Y представляет собой NH,Y1 представляет собой Н, а Y2 представляет собой 2-метоксибензил; МС m/е 942 (М+1). Пример 66. Используя методику, аналогичную описанной в примере 63, и в качестве исходного материала продукт из примера 64 и п-трифторметилбензальдегид, получают с 18%ным выходом соединение формулы 21, в котором Y представляет собой NH, Y1 представляет 42 собой Н, а Y2 представляет собой 4 трифторметилбензил; МС m/е 980 (М+1). Пример 67. Раствор продукта из примера 64 (145 мг; 0,18 ммоль) и о-анисового альдегида(122 мг; 0,9 ммоль) в 10 мл EtOH перемешивают при комнатной температуре в течение ночи.EtOH удаляют при пониженном давлении и остаток растворяют в 5 мл МеОН. Добавляют боргидрид натрия (34 мг; 0,9 ммоль) и смесь перемешивают при комнатной температуре в течение 2 ч. МеОН удаляют при пониженном давлении, остаток растворяют в СН 2 Сl2 и промывают водой и солевым раствором. Органический слой высушивают над Nа 2SO4 и упаривают. Хроматография остатка на SiO2 (5% МеОН-СН 2 Сl2-0,2%m/е 1061 (М+1). Пример 68. Следуя методике, аналогичной описанной в примере 61, получают с 63%-ным выходом соединение формулы 20, в котором Y представляет собой S; MC m/e 838 (М+1). Пример 69. Следуя методике, аналогичной описанной в примере 57, получают с 28%-ным выходом соединение формулы 21, в котором Y представляет собой S, Y1 представляет собой Н,а Y2 представляет собой 2-метоксибензил; MCm/e 958 (М+1). Пример 70. Раствор продукта из примера 64 (80 мг; 0,1 ммоль), о-анисового альдегида(136 мг; 1 ммоль), ацетата натрия (64 мг; 0,78 ммоль) и триацетоксиборгидрида натрия (64 мг; 0,3 ммоль) перемешивают при комнатной температуре в течение ночи. Полученный раствор разбавляют СН 2 Сl2 и промывают насыщенным раствором Nа 2 СО 3 и солевым раствором. Органический слой высушивают над К 2 СО 3 и упаривают. Остаток хроматографируют на SiO2 пластинке (2,5% МеОН-(метил-трет-бутиловый эфир)-2,5% триэтиламин), получая 20 мг (19%) соединения формулы 21, в котором Y представляет собой S, а Y1 и Y2 представляют собой 2 метоксибензил; MC m/e 1078 (М+1). Пример 71. Раствор продукта из примера 70 (31 мг; 0,03 ммоль), формальдегида (37%ный водный раствор; 83 мкл; 1 ммоль) и муравьиной кислоты (18 мкл; 0,47 ммоль) в 2 мл СНСl3 нагревают при 61 С в течение 1 ч. Реакционную смесь разбавляют СH2 Сl2 и промывают насыщенным раствором NаНСО 3 и солевым раствором. После высушивания над К 2 СО 3 растворители удаляют при пониженном давлении. Остаток хроматографируют на SiO2-пластинкеY представляет собой S, Y1 представляет собой метил, а Y2 представляют собой 2 метоксибензил; МС m/е 972 (М+1). Пример 72. Раствор соединения формулы 12 (380 мг; 0,5 ммоль) и перхлората магния (223 мг; 1 ммоль) в 5 мл МеОН кипятят с обратным 43 холодильником в атмосфере N2 в течение 9 дней. МеОН удаляют при пониженном давлении и остаток растворяют в СH2 Сl2 и промывают водой и солевым раствором. Остаток хроматографируют на SiO2 (2,5% MeOH-CH2Cl2-0,5%NH4OH), получая 25 мг (6%) соединения, указанной ниже конформации (МС m/е 793 (М+1 Приведенная далее схема иллюстрирует получение соединений из примеров 73-75 (ниже). Пример 73. Раствор соединения формулы 17 (500 мг; 0,62 ммоль), азида натрия (80 мг; 1,23 ммоль) и перхлората лития (135 мг; 1,27 ммоль) в 5 мл ацетонитрила кипятят с обратным холодильником в течение 4 дней. После упаривания ацетонитрила остаток растворяют в СН 2 Сl2 и промывают водой и солевым раствором. Слой СН 2 Сl2 высушивают над MgSO4 и концентрируют. Остаток растворяют в 5 мл МеОН и кипятят с обратным холодильником в течение ночи. Остаток, полученный после упаривания растворителя, хроматографируют на(М+1). Пример 74. Раствор соединения формулы 23 (250 мг; 0,311 ммоль) в 15 мл EtOH гидрируют в присутствии 30 мг 10%-ного Pd/C в шейкере Парра. Через 2 ч при комнатной температуре реакционную смесь фильтруют через Celite и растворитель удаляют при пониженном давлении. Остаток хроматографируют на SiO2 (98% МеОН-СН 2 Сl2-0,8% NH4OH), получая 140 мг(М+1). Пример 75. Следуя методике, аналогичной описанной в примере 57, и используя в качестве исходного материала соединение формулы 26,получают с 43%-ным выходом соединение формулы 24, в котором Y1 представляет собой Н, а или его фармацевтически приемлемая соль, где Х представляет собой -С(O)- или -N(С 1 С 6 алкил)СН 2-, для которых первая черточка в каждой из перечисленных выше групп Х обозначает связь, через которую эта группа присоединена к С-10-углероду соединения формулы 1,а последняя черточка для каждой группы обозначает связь, через которую эта группа присоединена к С-8-углероду соединения формулы 1;R3 представляет собой C1-С 10 алкил, С 2 С 10 алкенил, С 2-С 10 алкинил, циано, -CH2S(O)nR8,где n является целым числом от 0 до 2, -CH2OR8,-CH2N(OR9)R8, -CH2NR8R15, -(СН 2)m(С 6-С 10 арил) или -(СН 2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R3 возможно замещены группами R16 в количестве от 1 до 3; или R2 и R3 вместе образуют оксазолильное кольцо, как показано ниже-(СН 2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R5 возможно замещены группами R16 в количестве от 1 до 3; каждая R6 и R7 независимо представляет собой Н, гидрокси, C1-С 6 алкокси, С 1-С 6 алкил,С 2-С 6 алкенил, С 2-С 6 алкинил, -(СН 2)m(С 6-С 10 арил) или -(СН 2)m(5-10-членный гетероарил),где m является целым числом от 0 до 4; каждая R8 независимо представляет собой Н, C1-С 10 алкил, С 2-С 10 алкенил, С 2-С 10 алкинил,-(CH2)qCR11R12(CH2)rNR13R14, где q и r, каждый независимо, является целым числом от 0 до 3, за исключением того, что q и r оба не равны 0,-(СН 2)m(С 6-С 10 арил) или -(СН 2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R8, ис 45 ключая Н, возможно замещены группами R16 в количестве от 1 до 3; или в том случае, когда R8 представлена как -CH2NR8R15, R15 и R8 вместе могут образовывать 4-10-членное моноциклическое или полициклическое насыщенное кольцо либо 5-10 членное гетероарильное кольцо, причем указанные насыщенные и гетероарильные кольца возможно включают в себя 1 или 2 гетероатома,выбранных из О, S и -N(R8)-, в дополнение к азоту, к которому присоединены R15 и R8, указанное насыщенное кольцо возможно содержит 1 или 2 двойных либо тройных углеродуглеродных связи и указанные насыщенные и гетероарильные кольца возможно замещены группами R16 в количестве от 1 до 3; каждая R9 и R10 независимо представляет собой Н или C1-С 6 алкил; каждую R11, R12, R13 и R14 независимо выбирают из Н, C1-С 10 алкила, -(СН 2)m(С 6-С 10 арила) и -(CH2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4, причем упомянутые выше группы R11, R12, R13 и R14, исключая Н, возможно замещены группами R16 в количестве от 1 до 3; или R11 и R13 вместе образуют -(СН 2)p-, где р является целым числом от 0 до 3, так что образуется 4-7-членное насыщенное кольцо, которое возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи; или R13 и R14 вместе образуют 4-10 членное моноциклическое или полициклическое насыщенное кольцо либо 5-10-членное гетероарильное кольцо, причем указанные насыщенные и гетероарильные кольца возможно включают в себя 1 или 2 гетероатома, выбранных из О, S и-N(R8)-, в дополнение к азоту, к которому присоединены R13 и R14, указанное насыщенное кольцо возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи, и указанные насыщенные и гетероарильные кольца возможно замещены группами R16 в количестве от 1 до 3;R15 представляет собой Н, C1-С 10 алкил, С 2 С 10 алкенил или С 2-С 10 алкинил, причем упомянутые выше группы R15 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено и -OR9; каждую R16 независимо выбирают из галогено, циано, нитро, трифторметила, азидо,-C(O)R17, -C(O)OR17, -OC(O)OR17, -NR6C(O)R7,-C(O)NR6R7, -NR6R7, гидрокси, C1-С 6 алкила, C1 С 6 алкокси, -(СН 2)m(С 6-С 10 арила) и -(СН 2)m(5-10 членного гетероарила), где m является целым числом от 0 до 4, и где указанные арильные и гетероарильные заместители возможно замещены 1 или 2 заместителями, независимо выбранными из галогено, циано, нитро, трифторметила, азидо, -C(O)R17, -C(O)OR17, -OC(O)OR17,-NR6C(O)R7, -C(O)NR6R7, -NR6R7, гидрокси, C1 С 6 алкила и C1-С 6 алкокси; 46 каждую R17 независимо выбирают из Н,C1-С 10 алкила, С 2-С 10 алкенила, С 2-С 10 алкинила,-(СН 2)m(С 6-С 10 арила) и -(СН 2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4; при условии, что R8 не является Н в том случае,когда-CH2SR8. 4. Соединение по п.3, где R3 представляет собой -CH2NR15R8, а R15 и R8 независимо выбирают из Н, C1-С 10 алкила, С 2-С 10 алкенила и С 2 С 10 алкинила, причем упомянутые выше группыR15 и R8, исключая Н, возможно замещены 1 или 2 заместителями, независимо выбранными из гидрокси, галогено и C1-С 6 алкокси. 5. Соединение по п.4, где R15 и R8, каждую независимо, выбирают из Н, метила, этила, аллила, н-бутила, изобутила, 2-метоксиэтила, циклопентила, 3-метоксипропила, 3-этоксипропила,н-пропила, изопропила, 2-гидроксиэтила, циклопропила, 2,2,2-трифторэтила, 2-пропинила,втор-бутила, тpeт-бутила и н-гексила. 6. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2NHR8, а R8 представляет собой -(СН 2)m(С 6-С 10 арил), где m является целым числом от 0 до 4. 7. Соединение по п.6, где R8 представляет собой фенил или бензил. 8. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2NR15R8, a R15 иR8 вместе образуют 4-7-членное насыщенное кольцо. 9. Соединение по п.8, где R15 и R8 вместе образуют пиперидиновое, триметилениминовое или морфолиновое кольцо. 10. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2NR15R8, a R15 иR8 вместе образуют 5-10-членное гетероарильное кольцо, возможно замещенное одной или двумя C1-С 6 алкильными группами. 11. Соединение по п.10, где R15 и R8 вместе образуют пирролидиновое, триазолильное или имидазолильное кольцо, причем указанные гетероарильные группы возможно замещены 1 или 2 метильными группами. 12. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, R3 представляет собой -CH2SR8, а R8 выбирают из C1-С 10 алкила, С 2-С 10 алкенила и С 2 С 10 алкинила, причем указанные выше группы 13. Соединение по п.12, где R8 представляет собой метил, этил или 2-гидроксиэтил. 14. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, а R3 выбирают из C1-С 10 алкила, С 2 С 10 алкенила и С 2-С 10 алкинила, причем указанные группы R3 возможно замещены 1 или 2 заместителями, независимо выбранными из гидрокси, -C(O)R17, -NR6R7, галогено, циано, азидо,5-10-членного гетероарила и C1-С 6 алкокси. 15. Соединение по п.14, где R3 представляет собой метил, аллил, винил, этинил, 1-метил 1-пропенил, 3-метокси-1-пропинил, 3-диметиламино-1-пропинил, 2-пиридилэтинил, 1-пропинил, 3-гидрокси-1-пропинил, 3-гидрокси-1 пропенил, 3-гидроксипропил,3-метокси-1 пропенил, 3-метоксипропил, 1-пропинил, нбутил, этил, пропил, 2-гидроксиэтил, азидометил, формилметил, 6-циано-1-пентинил, 3 диметиламино-1-пропенил или 3-диметиламинопропил. 16. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, а R3 представляет собой -(СН 2)m(5-10 членный гетероарил), где m является целым числом от 0 до 4. 17. Соединение по п.16, где R3 представляет собой 2-тиенил, 2-пиридил, 1-метил-2 имидазолил, 2-фурил или 1-метил-2-пирролил. 18. Соединение по п.2, где R1 представляет собой гидрокси, R2 представляет собой гидрокси, а R3 представляет собой -(СН 2)m(С 6 С 10 арил), где m является целым числом от 0 до 4. 19. Соединение по п.18, где R3 представляет собой фенил. 20. Соединение по п.2, где R2 и R3 вместе образуют оксазолильное кольцо, как показано ниже щего, рыбы или птицы, при котором указанным млекопитающему, рыбе или птице вводят терапевтически эффективное количество соединения по п.1. 24. Способ получения соединения формулы-(СН 2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R5 возможно замещены группами R16 в количестве от 1 до 3; каждая R6 и R7 независимо представляет собой Н, гидрокси, C1-С 6 алкокси, С 1-С 6 алкил,С 2-С 6 алкенил,С 2-С 6 алкинил,-(СН 2)m(С 6 С 10 арил) или -(СН 2)m(5-10-членный гетероарил),где m является целым числом от 0 до 4; каждая R8 независимо представляет собой Н, C1-С 10 алкил, С 2-С 10 алкенил, С 2-С 10 алкинил,-(CH2)qCR11R12(CH2)rNR13R14, где q и r, каждый где X3 представляет собой О, S или -N(R15)-; R9 и R15 такие, как определены в п.1, а группа -OR9 может быть присоединена к любому доступному углероду фенильной группы. 22. Фармацевтическая композиция для лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, которая содержит терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель. 23. Способ лечения бактериальной инфекции или протозойной инфекции у млекопитаю или его фармацевтически приемлемой соли, где Х представляет собой -С(O)- или -N(С 1 С 6 алкил)СН 2-, для которых первая черточка в каждой из перечисленных выше групп Х обозначает связь, через которую эта группа присоединена к С-10-углероду соединения формулы 1,а последняя черточка для каждой группы обозначает связь, через которую эта группа присоединена к С-8-углероду соединения формулы 1;R3 представляет собой C1-С 10 алкил, С 2 С 10 алкенил, С 2-С 10 алкинил, циано, -CH2S(O)nR8,где n является целым числом от 0 до 2, -CH2OR8,-CH2N(OR9)R8, -CH2NR8R15, -(СН 2)m(С 6-С 10 арил) или -(СН 2)m(5-10-членный гетероарил), где m представляет собой целое число от 0 до 4, причем упомянутые выше группы R3 возможно замещены группами R16 в количестве от 1 до 3; или R2 и R3 вместе образуют оксазолильное кольцо, как показано ниже 49 независимо, является целым числом от 0 до 3, за исключением того, что q и r оба не равны 0,-(СН 2)m(С 6-С 10 арил) или -(СН 2)m(5-10-членный гетероарил), где m является целым числом от 0 до 4, причем упомянутые выше группы R8, исключая Н, возможно замещены группами R16 в количестве от 1 до 3; или в том случае, когда R8 представлена как -CH2NR8R15, R15 и R8 вместе могут образовывать 4-10-членное моноциклическое или полициклическое насыщенное кольцо либо 5-10 членное гетероарильное кольцо, причем указанные насыщенные и гетероарильные кольца возможно включают в себя 1 или 2 гетероатома,выбранных из О, S и -N(R8)-, в дополнение к азоту, к которому присоединены R15 и R8, указанное насыщенное кольцо возможно содержит 1 или 2 двойных либо тройных углеродуглеродных связи и указанные насыщенные и гетероарильные кольца возможно замещены группами R16 в количестве от 1 до 3; каждая R9 и R10 независимо представляет собой Н или С 1-С 6 алкил; каждую R11, R12, R13 и R14 независимо выбирают из Н, C1-С 10 алкила, -(СН 2)m(С 6-С 10 арила) и -(СН 2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4, причем упомянутые выше группы R11, R12, R13 и R14, исключая Н, возможно замещены группами R16 в количестве от 1 до 3; или R11 и R13 вместе образуют -(СН 2)p-, где р является целым числом от 0 до 3, так что образуется 4-7-членное насыщенное кольцо, которое возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи; или R13 и R14 вместе образуют 4-10 членное моноциклическое или полициклическое насыщенное кольцо либо 5-10-членное гетероарильное кольцо, причем указанные насыщенные и гетероарильные кольца возможно включают в себя 1 или 2 гетероатома, выбранных из О, S и-N(R8)-, в дополнение к азоту, к которому присоединены R13 и R14, указанное насыщенное кольцо возможно содержит 1 или 2 двойных либо тройных углерод-углеродных связи, и указанные насыщенные и гетероарильные кольца возможно замещены группами R16 в количестве от 1 до 3;R15 представляет собой Н, C1-С 10 алкил, С 2 С 10 алкенил или С 2-С 10 алкинил, причем упомянутые выше группы R15 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из галогено и -OR9; каждую R16 независимо выбирают из галогено, циано, нитро, трифторметила, азидо,-C(O)R17, -C(O)OR17, -OC(O)OR17, -NR6C(O)R7,-C(O)NR6R7, -NR6R7, гидрокси, C1-С 6 алкила, C1 С 6 алкокси, -(СН 2)m(С 6-С 10 арила) и -(СН 2)m(5-10 членного гетероарила), где m является целым числом от 0 до 4, и где указанные арильные и гетероарильные заместители возможно замещены 1 или 2 заместителями, независимо выбран 002440 50 ными из галогено, циано, нитро, трифторметила, азидо, -C(O)R17, -C(O)OR17, -OC(O)OR17,-NR6C(O)R7, -C(O)NR6R7, -NR6R7, гидрокси, C1 С 6 алкила и C1-С 6 алкокси; каждую R17 независимо выбирают из Н,C1-С 10 алкила, С 2-С 10 алкенила, С 2-С 10 алкинила,-(СН 2)m(С 6-С 10 арила) и -(СН 2)m(5-10-членного гетероарила), где m является целым числом от 0 до 4; при условии, что R8 не является Н в том случае,когда-CH2S(O)nR ; при котором соединение формулы где X, R1 и R4 такие, как определены выше, обрабатывают соединением формулы HOR8, HSR8 или HNR15R8, в которых n, R15 и R8 такие, как определены выше; при этом, если используют указанное соединение формулы HSR8, то полученную группу R3 формулы -CH2SR8 возможно окисляют до -CH2S(O)R8 или -CH2S(O)2R8. 25. Способ по п.24, при котором соединение формулы 3 получают путем обработки соединения формулы где X, R1 и R4 такие, как определены в п.24, соединением (СН 3)3S(O)nХ 2, в котором n равно 0 или 1, а X2 представляет собой галогено, -BF4 или -PF6, в присутствии основания. 26. Способ по п.25, при котором X2 представляет собой иод или -BF4, a указанное основание выбирают из тpeт-бутилата калия, третбутилата натрия, этилата натрия, гидрида натрия, 1,1,3,3-тетраметилгуанидина, 1,8-диазабицикло[5.4.0]ундец-7-ена,1,5-диазабицикло или его фармацевтически приемлемая соль, где Х представляет собой -С(O)- или -N(С 1 С 6 алкил)СН 2-, для которых первая черточка в каждой из перечисленных выше групп Х обозначает связь, через которую эта группа присое 52 динена к С-10-углероду соединения формулы 3,а последняя черточка для каждой группы обозначает связь, через которую эта группа присоединена к С-8-углероду соединения формулы 3;R4 представляет собой Н, -C(O)R9,-C(O)OR9, -C(O)NR9R10 или гидроксизащитную группу; каждая R9 и R10 независимо представляет собой Н или C1-С 6 алкил.
МПК / Метки
МПК: C07H 17/08, A61K 31/7048, A61P 31/04
Метки: производные, с-4"-замещенные, макролидные
Код ссылки
<a href="https://eas.patents.su/27-2440-s-4-zameshhennye-makrolidnye-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">С-4″-замещенные макролидные производные</a>
Предыдущий патент: Нитробензамиды, полезные в качестве антиаритмических агентов
Следующий патент: 4″- замещенные производные 9-дезоксо-9а-аза-9а-гомоэритромицина а
Случайный патент: 2 - аминобензотиазолсульфонамидные ингибиторы протеазы вич широкого спектра действия