Производное хиназолин-2,4-диона и лекарственные композиции на его основе для профилактики и лечения заболевания, обусловленного поражением черепно-мозгового нерва
Номер патента: 18142
Опубликовано: 30.05.2013
Авторы: Ким Вон Сеок, Канг Син Чеол, Ли Чул Киу, Ли Еун Банг, Чо Ил Хван
Формула / Реферат
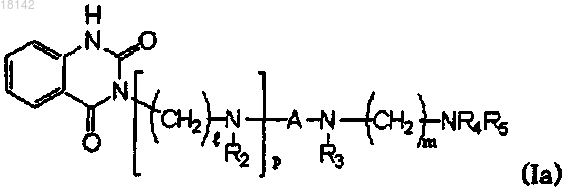
1. Производное хиназолин-2,4-диона формулы (I)
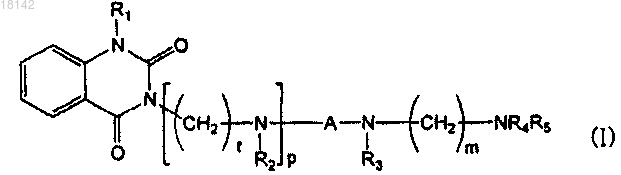
где R1 представляет собой водород или C1-6алкил;
каждый из R2 и R3 независимо выбирают из водорода, C1-6алкила, -COR6, -SO2R7 или из фенила или бензила, где R6 представляет собой С1-6алкил, С1-4алкокси, фенил, фенилокси или бензилокси, каждый из которых незамещен или замещен галогеном, гидрокси, метокси, этокси или нитро, и R7 представляет собой C1-4алкил или незамещенный или замещенный С1-6алкилом фенил;
А представляет собой -(СН2)n- или -СН2СН=СНСН2-, где n является целым числом от 2 до 4;
R4 представляет собой водород и R5 представляет собой водород или бензоил, незамещенный или замещенный одной или более группами, выбранными из галогена, гидрокси, С1-4алкокси или нитро, в бензольном кольце, или в том случае, когда R4 и R5 вместе с N образуют кольцо, то R4 и R5 образуют двухвалентный фрагмент
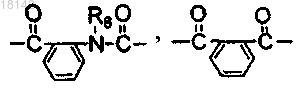 или
или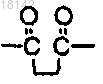
где R8 представляет собой водород или С1-6алкил;
каждый из l и m независимо представляет собой целое число от 2 до 4 и
р представляет собой целое число, имеющее значение 0 или 1,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где
R1 представляет собой водород;
каждый из R2 и R3 независимо выбирают из водорода, C1-6алкила, -COR6, -SO2R7 или из фенила или бензила, где R6 представляет собой С1-6алкил, С1-4алкокси, фенил, фенилокси или бензилокси, каждый из которых незамещен или замещен галогеном, гидрокси, метокси, этокси или нитро, и R7 представляет собой С1-4алкил или незамещенный или замещенный С1-4алкилом фенил;
А представляет собой -(CH2)n- или -CH2CH=CHCH2-, где n является целым числом от 2 до 4;
R4 представляет собой водород и R5 представляет собой водород или бензоил, незамещенный или замещенный одной или более группами, выбранными из галогена, гидрокси, С1-4алкокси или нитро, в бензольном кольце, или в том случае, когда R4 и R5 вместе с N образуют кольцо, то R4 и R5 образуют двухвалентный фрагмент , где R8 представляет собой водород или С1-6алкил;
, где R8 представляет собой водород или С1-6алкил;каждый из l и m независимо представляет собой целое число от 2 до 4 и
р представляет собой целое число, имеющее значение 0 или 1,
или его фармацевтически приемлемая соль.
3. Соединение по п.1, которое выбирают из группы, состоящей из
3-{3-[4-(3-аминопропиламино)бутиламино]пропил}-1Н-хиназолин-2,4-диона;
3-(3-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутиламино}пропил)-1Н-хиназолин-2,4-диона;
N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}ацетамида;
N-(4-{ацетил-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]амино}бутил)-N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]ацетамида;
этилового эфира [3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}карбаминовой кислоты;
N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-(4-{[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]метиламино}бутил)ацетамида;
3-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}-1Н-хиназолин-2,4-диона;
N-(3-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутиламино}пропил)-4-гидроксибензамида;
3-{3-[4-({N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-бензил}амино)бутиламино]пропил}-1Н-хиназолин-2,4-диона;
N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}бензамида;
трет-бутилового эфира [3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}карбаминовой кислоты;
N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}метансульфонамида;
N-(4-{бензил-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]амино}бутил)-N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]ацетамида;
этилового эфира (4-{ацетил-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]амино}бутил)-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]карбаминовой кислоты;
3-{[3-(4-{N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-бензиламино}бутил)-N-бензиламино]пропил}-1Н-хиназолин-2,4-диона;
этилового эфира [3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-(4-{[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]этоксикарбониламино}бутил)карбаминовой кислоты;
трет-бутилового эфира (4-{трет-бутоксикарбонил-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]амино}бутил)-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]карбаминовой кислоты;
N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-(4-{[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]метансульфониламино}бутил)метансульфонамида;
N-[3-(ацетил-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}амино)пропил]-4-гидроксибензамида;
N-[3-(4-{ацетил-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]амино}бутиламино)пропил]-4-гидроксибензамида;
N-{3-[ацетил-(4-{ацетил-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]амино}бутил)амино]пропил}-4-гидроксибензамида;
N-[4-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)бутил]-N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]ацетамида;
3-(2-{3-[2-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)этиламино]пропиламино}этил)-1Н-хиназолин-2,4-диона;
3-(3-{3-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]пропиламино}пропил)-1Н-хиназолин-2,4-диона;
3-(3-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]-2-бутениламино}пропил)-1Н-хиназолин-2,4-диона;
трет-бутилового эфира (4-{трет-бутоксикарбонил-[3-(1-метил-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]амино}бутил)-[3-(1-метил-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]карбаминовой кислоты;
1-метил-3-(3-{4-[3-(1-метил-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутиламино}пропил)-1Н-хиназолин-2,4-диона;
3-(3-{4-[3-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)пропиламино]бутиламино}пропил)-1Н-хиназолин-2,4-диона;
3-(3-{2-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]этиламино}пропил)-1Н-хиназолин-2,4-диона;
трет-бутилового эфира [3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-(4-{[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]гексиламино}бутил)карбаминовой кислоты;
3-[3-(4-{N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-гексиламино}бутиламино)пропил]-1Н-хиназолин-2,4-диона;
трет-бутилового эфира (4-{трет-бутоксикарбонил-[3-(1-гексил-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]амино}бутил)-[3-(1-гексил-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]карбаминовой кислоты;
1-гексил-3-(3-{4-[3-(1-гексил-2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутиламино}пропил)-1Н-хиназолин-2,4-диона;
трет-бутилового эфира [3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-(4-{[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]гептаноиламино}бутил)карбаминовой кислоты;
амида [3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}гептановой кислоты;
N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}-2,2,2-трифторацетамида;
N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-{4-[[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-(2,2,2-трифторацетил)амино]бутил}-2,2,2-трифторацетамида;
N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}-2-метоксиацетамида;
бензилового эфира [3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}карбаминовой кислоты;
N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}-4-метилбензолсульфонамида;
N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-(4-{[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-4-метилбензолсульфониламино}бутил)-4-метилбензолсульфонамида и
3-(3-{4-[3-(2,5-диоксопирролидин-1-ил)пропиламино]бутиламино}пропил)-1Н-хиназолин-2,4-диона,
или его фармацевтически приемлемая соль.
4. Соединение по п.1, которое представляет собой N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}ацетамид или его фармацевтически приемлемую соль.
5. Соединение по п.1, которое представляет собой 3-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}-1Н-хиназолин-2,4-дион или его фармацевтически приемлемую соль.
6. Соединение по п.1, которое представляет собой 3-{3-[4-({N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-бензил}амино)бутиламино]пропил}-1Н-хиназолин-2,4-дион или его фармацевтически приемлемую соль.
7. Соединение по п.1, которое представляет собой N-[3-(ацетил-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}амино)пропил]-4-гидроксибензамид или его фармацевтически приемлемую соль.
8. Соединение по п.1, которое представляет собой N-[3-(4-{ацетил-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]амино}бутиламино)пропил]-4-гидроксибензамид или его фармацевтически приемлемую соль.
9. Соединение по п.1, которое представляет собой 3-(2-{3-[2-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)этиламино]пропиламино}этил)-1Н-хиназолин-2,4-дион или его фармацевтически приемлемую соль.
10. Соединение по п.1, которое представляет собой трет-бутиловый эфир [3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-(4-{[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]гексиламино}бутил)карбаминовой кислоты или его фармацевтически приемлемую соль.
11. Соединение по п.1, которое представляет собой бензиловый эфир [3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}карбаминовой кислоты или его фармацевтически приемлемую соль.
12. Соединение по п.1, которое представляет собой N-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропил]-N-{4-[3-(2,4-диоксо-1,4-дигидро-2Н-хиназолин-3-ил)пропиламино]бутил}-4-метилбензолсульфонамид или его фармацевтически приемлемую соль.
13. Способ получения соединения формулы (IX), включающий стадию взаимодействия соединения формулы (IV) с аминосоединением формулы (V) с получением соединения формулы (IX) в присутствии или в отсутствие растворителей
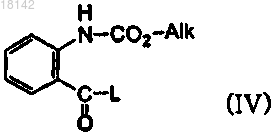
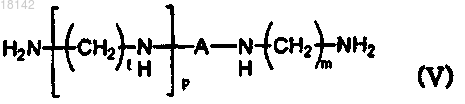
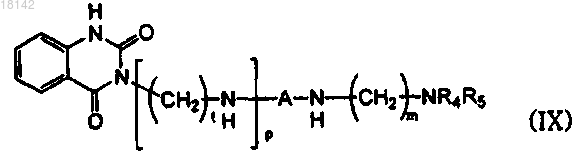
где А, l, m и p являются такими, как определено в п.1;
R4 и R5 представляют собой атомы водорода или в том случае, когда R4 и R5 вместе с N образуют кольцо, то R4 и R5 образуют двухвалентный фрагмент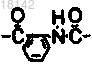 , Alk представляет собой C1-6алкил и L представляет собой уходящую группу.
, Alk представляет собой C1-6алкил и L представляет собой уходящую группу.14. Способ получения соединения формулы (IX) по п.13, где соединение формулы (IV) представляет собой этил-2-этоксикарбониламинобензоат, который получают посредством реакции этил-2-аминобензоата формулы (II) с этилхлорформиатом формулы (III) в органическом растворителе
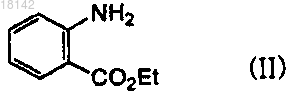

15. Способ получения соединения формулы (IX), включающий стадию взаимодействия первичного аминосоединения формулы (VI) с соединением формулы (VII) или формулы (VIII) с получением соединения формулы (IX) в присутствии или в отсутствие растворителей
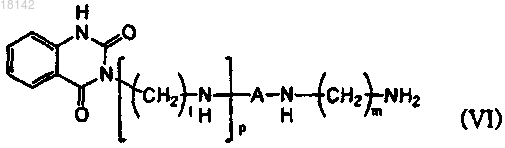
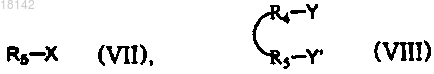

где A, R4, R5, l, m и р являются такими, как определено в п.1;
R5 не является водородом;
X представляет собой гидрокси, галоген, С1-4алкокси или -OR5;
каждый из Y и Y' представляет собой гидрокси, галоген или С1-4алкокси или в том случае, когда Y и Y' образуют кольцо, то Y и Y' образуют -О-.
16. Способ получения соединения формулы (Ia), в котором по меньшей мере один из R2 и R3 не является водородом, путем замены по меньшей мере одного водорода вторичного аминосоединения формулы (IX) на R2, R3 или R2 и R3
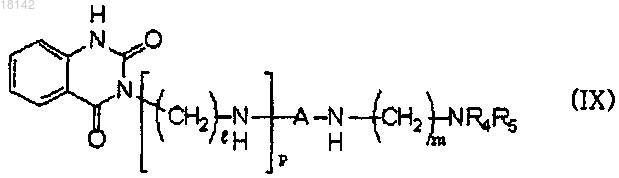
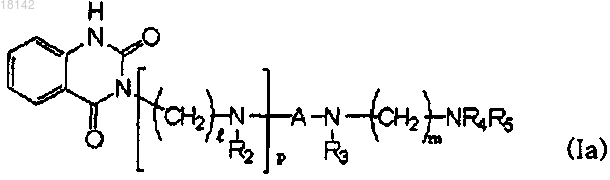
где R2, R3, R4, R5, A, l, m и p являются такими, как определено в п.1, при условии, что R5 не является водородом.
17. Способ получения соединения формулы (I), в которой R1 представляет собой С1-6алкил, включающий стадию взаимодействия соединения формулы (Ia) с алкилирующим агентом и, при необходимости, удаления защитной группы, с получением соединения формулы (I), в которой R1 представляет собой C1-6алкил
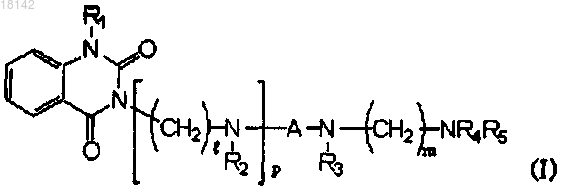
где R1, R2, R3, R4, R5, A, l, m и p являются такими, как определено в п.1, при условии, что R1 и R5 не являются атомами водорода.
18. Фармацевтическая композиция для защиты нервных клеток или для предотвращения или лечения неврологического заболевания мозга, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль.
19. Фармацевтическая композиция для предотвращения или лечения дегенеративного неврологического заболевания мозга, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль.
20. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль, для предотвращения или лечения заболевания, которое выбирают из неврологической дисфункции, потери памяти, недостаточности мозгового кровообращения, локального повреждения головного мозга, очаговой травмы головного мозга, диффузной травмы головного мозга, повреждения спинного мозга, ишемии головного мозга, кровоизлияния в мозг, ишемического инсульта, геморрагического инсульта, деменции, церебрального инфаркта, эмболической окклюзии, тромботической окклюзии, реперфузии, развивающейся после острой ишемии, преходящей ишемической атаки, перинатального гипоксически-ишемического повреждения, остановки сердца, внутричерепного кровотечения, субарахноидального кровоизлияния, аневризмы сосудов головного мозга, аневризмы Виллизия, острой детской церебральной гемиплегии, "хлыстовой" травмы, синдрома тряски младенца, болезни Альцгеймера, болезни Пика, деменции с тельцами Леви, прогрессирующего супрануклеарного паралича (синдром Стила-Ричардсона), мультисистемной дегенерации (синдром Шай-Драгера), хронических эпилептических состояний, сопутствующих нейродегенерации, болезней двигательных нейронов, амиотрофического бокового склероза, первичного латерального склероза, дегенеративных атаксий, корково-базальной дегенерации, подострого склерозирующего панэнцефалита, болезни Гантингтона, болезни Паркинсона, синуклеопатий, первичной прогрессирующей афазии, спинальной мышечной атрофии и спинобульбарной мышечной атрофии (болезнь Кеннеди), рассеянного склероза, болезни Тея-Сакса, спастической параплегии, прионного заболевания, болезни Крейтфтельдта-Якоба, эпилепсии, плексопатии или невропатии.
21. Фармацевтическая композиция для предотвращения или лечения инсульта, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль.
22. Фармацевтическая композиция для предотвращения или лечения болезни Альцгеймера, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль.
23. Фармацевтическая композиция для предотвращения или лечения эпилепсии, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль.
24. Фармацевтическая композиция для улучшения памяти, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль.
Текст
ПРОИЗВОДНОЕ ХИНАЗОЛИН-2,4-ДИОНА И ЛЕКАРСТВЕННЫЕ КОМПОЗИЦИИ НА ЕГО ОСНОВЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ,ОБУСЛОВЛЕННОГО ПОРАЖЕНИЕМ ЧЕРЕПНО-МОЗГОВОГО НЕРВА Настоящее изобретение относится к новому производному хиназолин-2,4-диона формулы (I), к его фармацевтически приемлемой соли и к фармацевтической композиции, содержащей соединение формулы (I) в качестве активного ингредиента для предотвращения или лечения неврологического заболевания мозга. Чо Ил Хван, Ли Еун Банг, Канг Син Чеол, Ким Вон Сеок, Ли Чул Киу (KR) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: СИН ПООНГ ФАРМАСЬЮТИКАЛ КО., ЛТД. (KR) Область техники, к которой относится изобретение Настоящее изобретение относится к производному хиназолин-2,4-диона формулы (I) где R1 представляет собой водород или С 1-6 алкил; каждый из R2 и R3 независимо выбирают из водорода, C1-6 алкила, -COR6, -SO2R7 или фенила или бензила, где R6 представляет собой С 1-6 алкил, С 1-4 алкокси, фенил, фенилокси или бензилокси, каждый из которых является незамещенным или замещенным галогеном, гидрокси, метокси, этокси или нитро, и R7 представляет собой С 1-4 алкил или незамещенный или замещенный C1-6 алкилом фенил; А представляет собой -(СН 2)n- или -СН 2 СН=СНСН 2-, где n является целым числом от 2 до 4;R4 представляет собой водород, и R5 представляет собой водород или бензоил, незамещенный или замещенный одним или более заместителями, выбранными из галогена, гидрокси, C1-4 алкокси или нитро,в бензольном кольце, или в том случае, когда R4 и R5 вместе с N образуют кольцо, то R4 и R5 образуют двухвалентный фрагмент где R8 представляет собой водород или С 1-6 алкил; каждый из l и m независимо представляет собой целое число от 2 до 4 и р представляет собой целое число, имеющее значение 0 или 1,или к его фармацевтически приемлемой соли, способам его получения и к фармацевтической композиции, содержащей соединение формулы (I) в качестве активного ингредиента, для предотвращения или лечения неврологических заболеваний мозга. Предпосылки создания изобретения Неврологические заболевания мозга развиваются в результате гибели нервных клеток в течение короткого или продолжительного периода времени и приводят к фатальной потери функции мозга. Инсульт представляет собой одно из наиболее часто проявляющихся цереброваскулярных заболеваний. В связи с тем, что количество случаев заболеваний, обусловленных поражением черепно-мозгового нерва,у пациентов в трудоспособной возрастной группе от сорока до пятидесяти лет значительно возросло,этот факт рассматривают не только как индивидуальную проблему, но и также как национальную проблему. Главным образом, существует два вида инсульта: церебральный инфаркт и кровоизлияние в мозг. Церебральный инфаркт происходит в результате некроза ткани мозга, вызванного блокадой кровоснабжения ткани мозга, спровоцированной тромбом и тому подобным. Кровоизлияние в мозг, с другой стороны, происходит в результате потери крови вследствие повреждения кровеносных сосудов в мозге. Хотя патогенезы церебрального инфаркта и кровоизлияния в мозг отличаются, их симптомы часто совпадают. Стандартный способ лечения острого периода инфаркта в текущий момент представляет собой тромболиз (растворение тромба). Период времени от появления симптомов церебрального инфаркта до начала проведения лечения является очень важным, и известно, что функциональный статус пациента может быть улучшен в том случае, когда тромболитическое средство вводят в пределах 3 ч после появления симптомов церебрального инфаркта. Причина некроза клеток мозга вследствие ишемии была выявлена многими исследователями, и основной путь некроза клеток мозга предполагается через возбуждаемую избыточным количеством нейромедиатора токсичность, окислительную токсичность, вызванную стрессом, токсичность, вызванную цинком, апоптоз и тому подобное. Глутамат, который является одним из возбуждающих токсичных веществ, представляет собой возбуждающий нейромедиатор центральной нервной системы, и он реагирует с NMDA (N-метил-Dаспартат)-рецептором. Гибель нервных клеток инициируется в том случае, когда глутамат вырабатывается сверх нормы в результате ишемии. В последнее время появились сообщения о том, что такие возбуждаемые токсичности могут представлять собой основной механизм гибели нервных клеток в результате ишемического инсульта, а также эпилепсии. Если подача кислорода и глюкозы в нервную ткань после ишемии снижается, то глутамат, который является возбуждающим нейромедиатором, аккумулируется в участке соединения между нейронами. И затем в основном происходит гибель нервных клеток в резуль-1 018142 тате избыточной активности глутаматного NMDA-рецептора. Таким образом, гибель нервных клеток при ишемическом инсульте может быть подавлена путем использования антагониста глутаматного NMDAрецептора. Свободные радикалы также представляют собой один из основных механизмов гибели нервных клеток. Увеличение количества свободных радикалов в результате ишемии и прочих процессов в нервных клетках инициирует деструкцию мембранных липидов посредством их пероксидирования, разложение нуклеиновой кислоты под действием кислородных радикалов, денатурацию белка и тому подобное. Это приводит к фатальному нарушению важнейших факторов выживания клеток. Многие исследователи сообщали о том, что ишемия приводит к увеличению концентрации активного кислорода в мозге, реакционноспособных кислородных молекул при болезни Паркинсона, болезни Гантингтона и болезни Альцгеймера, каталазы (фермент-акцептор радикалов), активности дисмутазы супероксида Cu/Zn (SOD) иFe2+. Как указано выше, несмотря на то, что многие механизмы для лечения нарушений, обусловленных поражением черепно-мозгового нерва, раскрыты, разработка новых лекарственных средств приостановлена из-за проблем, касающихся эффективности и токсичности. Авторы настоящего изобретения при изучении средств народной медицины, долго используемых в восточных странах, обнаружили, что при наличии электростимуляции из живых красных калифорнийских дождевых червей Eisenia Andrei и из компостных (калифорнийских) дождевых червей Eisenia fetida высвобождаются природные вещества. И они обнаружили, что конкретные соединения этих веществ показывают действенную защиту черепно-мозговых нервов. Многие производные, включающие новые соединения, выделенные из природных продуктов, были синтезированы, основываясь на этом открытии. Было обнаружено, что производное хиназолин-2,4-диона формулы (I) и его соль дают превосходный эффект в отношении защиты активности нервных клеток, и, таким образом, было создано настоящее изобретение. Подробное описание изобретения Задача изобретения Задачей настоящего изобретения является обеспечение соединения формулы (I) или его фармацевтически приемлемой соли и фармацевтической композиции, содержащей указанное соединение в качестве активного ингредиента, для предотвращения или лечения неврологических заболеваний мозга. Техническое средство Настоящее изобретение обеспечивает производное хиназолин-2,4-диона формулы (I) где R1 представляет собой водород или С 1-6 алкил; каждый из R2 и R3 независимо выбирают из водорода, C1-6 алкила, -COR6, -SO2R7 или фенила или бензила, где R6 представляет собой С 1-6 алкил, С 1-4 алкокси, фенил, фенилокси или бензилокси, каждый из которых незамещен или замещен галогеном, гидрокси, метокси, этокси или нитро, и R7 представляет собой C1-4 алкил или незамещенный или замещенный C1-6 алкилом фенил; А представляет собой -(СН 2)n - или -СН 2 СН=СНСН 2-, где n является целым числом от 2 до 4;R4 представляет собой водород, и R5 представляет собой водород или бензоил, незамещенный или замещенный в бензольном кольце одним или более заместителями, выбранными из галогена, гидрокси,С 1-4 алкокси или нитро, или в том случае, когда R4 и R5 вместе с N образуют кольцо, R4 и R5 образуют двухвалентный фрагмент где R8 представляет собой водород или С 1-6 алкил; каждый из l и m независимо представляет собой целое число от 2 до 4 и р представляет собой целое число, имеющее значение 0 или 1,или его фармацевтически приемлемую соль. Как использовано в этом документе, термин "алкил" относится к алкилу, имеющему от 1 до 6 атомов углерода, например к алифатической углеводородной цепи, включающей линейную цепь, разветвленную цепь или циклическую форму, такую как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил,-2 018142 изобутил, трет-бутил, н-пентил, 2-метилпентил, гексил или циклогексил. Термин "алкокси" относится к -О-алкилу, где "алкил" относится к линейной или разветвленной углеводородной цепи, имеющей от 1 до 4 атомов углерода. Соединения формулы (I) могут быть использованы в виде их фармацевтически приемлемых солей,и фармацевтически приемлемые соли включают общеизвестные в данной области соли присоединения кислоты или соли щелочных металлов. Типичные примеры соединений формулы (I) в соответствии с настоящим изобретением представляют собой следующее: 3-3-[4-(3-аминопропиламино)бутиламино]пропил-1 Н-хиназолин-2,4-дион; 3-(3-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-1 Нхиназолин-2,4-дион;N-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-(4-[3-(2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)пропил]-4-метилбензолсульфониламинобутил)-4-метилбензолсульфонамид или 3-(3-4-[3-(2,5-диоксопирролидин-1-ил)пропиламино]бутиламинопропил)-1 Н-хиназолин-2,4-дион. Соединение формулы (I) может быть получено с помощью реакций, которые описаны в последующих реакционных схемах I-III. Таким образом, другой целью настоящего изобретения является обеспечение таких способов получения. Однако последующие реакционные схемы иллюстрируют наиболее общие способы получения согласно настоящему изобретению. Способы получения соединения формулы (I) в соответствии с настоящим изобретением не ограничены следующими иллюстративными реакционными схемами. Соединение формулы (I) может быть получено различными способами, известными в данной области. Реакционная схема I Путем проведения реакции между производным бензойной кислоты (IV), имеющем алкоксикарбониламинозаместитель в положении 2, и аминосоединением (V), в котором А является подходящим образом выбранным для получения кольца, в присутствии или в отсутствие растворителя может быть получено производное хиназолин-2,4-диона первичного аминосоединения (IX), имеющее хиназолин-2,4 дионовую скелетную структуру, где R4 и R5 являются водородами. Альтернативно, путем увеличения стехиометрических количеств соединения (IV) может быть получено производное хиназолин-2,4-диона(IX), в котором R4 и R5 образуют циклический хиназолин-2,4-дион с атомом N. Реакцию слияния колец в отсутствие растворителей следует проводить при температуре, достаточной для плавления двух реагентов. В вышеуказанной реакционной схеме А, l, m и p являются такими же, как они определены выше, R4 и R5 представляют собой водороды, или в том случае, когда R4 и R5 вместе с N образуют кольцо, то R4 иR5 образуют двухвалентный фрагмент и Alk представляет собой С 1-6 алкил. L является уходящей группой, которая представляет собой предпочтительно гидрокси, алкокси или галоген. Путем проведения реакции между соединением (VI) и соединением (VII) или (VIII), имеющем заместители R4 и R5, может быть получено производное хиназолин-2,4-диона (IX), в котором R4 и R5 подходящим образом введены в терминальный первичный амин, где реакция может быть проведена в присутствии растворителей, реакция слияния может быть проведена в отсутствие растворителей, или реакция конденсации может быть проведена, если X представляет собой гидрокси. Реакция конденсации может быть проведена с использованием DCC (дициклогексилкарбодиимид) или EDC (1-(3-диметиламинопропил)-3-этилкарбодиимид). Альтернативно, соединение (IX) может быть получено путем превращения карбоксильной группы в более реакционноспособную группу, такую как группа ангидрида кислоты или группа хлорангидрида кислоты, и затем путем проведения реакции между ней и соединением (VI). В вышеуказанной реакционной схеме A, R4, R5, l, m и p являются такими же, как они определены ранее, R5 не является водородом, X представляет собой гидрокси, галоген, алкокси или -OR5, каждый из Путем замены по меньшей мере одного водорода соединения формулы (IX) на R2 и/или R3 может быть получено производное хиназолин-2,4-диона (I), где R2 и R3 являются подходящим образом введенными в аминогруппу, R1 представляет собой водород и по меньшей мере один из R2 и R3 не является водородом. В случае получения соединения, в котором R2 и R3 являются одинаковыми заместителями, заместители R2 и R3 могут быть введены одновременно. В случае получения соединения, в котором R2 и R3 являются различными заместителями, заместитель R2 может быть введен первым в соединение (IX) с получением производного хиназолин-2,4-диона(I), где R1 и R3 являются водородами, и затем заместитель R3 может быть введен в присутствии органического растворителя и основания. С другой стороны, заместитель R3 может быть введен первым в соединение (IX), и затем заместитель R2 может быть введен в R3-замещенное соединение с получением производного хиназолин-2,4-диона (I), в котором заместители R2 и R3 являются подходящим образом введенными и R1 представляет собой водород. Также, после того как желательные заместители введены в положении N вторичной аминогруппы соединения (IX), производное хиназолин-2,4-диона (I), в котором R1 является С 1-6 алкилом и желательные заместители являются введенными, может быть получено алкилированием в положении 1 в хиназолиновом кольце посредством алкилирующего агента в присутствии основания и дополнительным снятием защитных групп после алкилирования. В качестве вышеуказанного алкилирующего агента может быть использован алкилгалогенид, диалкилсульфат или алкилсульфонат. В вышеуказанной реакционной схеме A, R1, R2, R3, R4, R5, l, m и p являются такими же, как они определены ранее, и R5 не является водородом. Более точные реакционные условия описаны в последующих примерах 1-42. С другой стороны, соединение формулы (I) в соответствии с настоящим изобретением, полученное вышеуказанными способами, может быть подвергнуто дополнительным выделению и очистке традиционными способами пост-обработки или может быть получено в виде соответствующей фармацевтически приемлемой соли традиционными способами. Соль, как хорошо известно специалистам в данной области, должна быть фармацевтически приемлемой и нетоксичной. Для получения соединения настоящего изобретения и его нетоксичной фармацевтически приемлемой соли могут быть использованы несколько солей. Фармацевтически приемлемая соль соединения в соответствии с настоящим изобретением включает соли присоединения кислоты или соли щелочных металлов. Такая соль присоединения кислоты может представлять собой соль хлористо-водородной кислоты, бромисто-водородной кислоты, иодистоводородной кислоты, серной кислоты, уксусной кислоты, бензолсульфоновой кислоты, метансульфоновой кислоты, фосфорной кислоты, азотной кислоты, муравьиной кислоты, пропионовой кислоты, янтар-5 018142 ной кислоты, гликолевой кислоты, молочной кислоты, яблочной кислоты, оротовой кислоты, никотиновой кислоты, адипиновой кислоты, винной кислоты, лимонной кислоты, аскорбиновой кислоты, малеиновой кислоты, бензойной кислоты, салициловой кислоты, фумаровой кислоты, камсиловой (camsylic) кислоты или карбоновой кислоты, но не ограничивается этим, и такая соль щелочного металла может представлять собой соль натрия, калия, лития, магния или кальция, но не ограничивается этим. Кроме того, настоящее изобретение обеспечивает фармацевтическую композицию, которая является полезной для предотвращения или лечения неврологических заболеваний мозга, которые указаны выше, путем комбинирования производного хиназолин-2,4-диона формулы (I) и его фармацевтически приемлемой соли с фармацевтически приемлемым носителем. Соединение формулы (I) в соответствии с настоящим изобретением является полезным в лечении заболевания, вызванного наследственной или патологической дегенерацией неврологической мозговой системы, или в осуществлении защиты ее нервных клеток, что подтверждено результатами последующих примеров. Настоящее изобретение обеспечивает фармацевтическую композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль в качестве активного ингредиента с фармацевтически приемлемым носителем, для предотвращения или лечения неврологического нарушения мозговой системы, дегенеративного неврологического заболевания мозга или дисфункции нервной системы. Более конкретно, фармацевтическая композиция в соответствии с настоящим изобретением является полезной в предотвращении или лечении заболевания, которое выбирают из неврологической дисфункции,потери памяти, недостаточности мозгового кровообращения, локального повреждения головного мозга,очаговой травмы головного мозга, диффузной травмы головного мозга, повреждения спинного мозга,ишемии головного мозга, кровоизлияния в мозг, ишемического инсульта, геморрагического инсульта,деменции, церебрального инфаркта, эмболической окклюзии, тромботической окклюзии, реперфузии,развивающейся после острой ишемии, преходящей ишемической атаки, перинатального гипоксическиишемического повреждения, остановки сердца, внутричерепного кровотечения, субарахноидального кровоизлияния, аневризмы сосудов головного мозга, аневризмы Виллизия, острой детской церебральной гемиплегии, "хлыстовой" травмы, синдрома тряски младенца, болезни Альцгеймера, болезни Пика, деменции с тельцами Леви, прогрессирующего супрануклеарного паралича (синдром Стила-Ричардсона),мультисистемной дегенерации (синдром Шай-Драгера), хронических эпилептических состояний, сопутствующих нейродегенерации, болезней двигательных нейронов, амиотрофического бокового склероза,первичного латерального склероза, дегенеративных атаксий, корково-базальной дегенерации, подострого склерозирующего панэнцефалита, болезни Гантингтона, болезни Паркинсона, синуклеопатий, первичной прогрессирующей афазии, спинальной мышечной атрофии и спинобульбарной мышечной атрофии (болезнь Кеннеди), рассеянного склероза, болезни Тея-Сакса, спастической параплегии, прионного заболевания, болезни Крейтцфельдта-Якоба, эпилепсии, плексопатии или невропатии; и для улучшения памяти. Фармацевтическая композиция настоящего изобретения может быть приготовлена путем комбинирования соединения настоящего изобретения с фармацевтически приемлемым неактивным носителем в твердом или жидком виде и может быть составлена в соответствующей фармацевтически приемлемой форме для введения. Вышеуказанный состав может быть приготовлен в форме мгновенного высвобождения или замедленного высвобождения, которая должна быть хорошо известна специалисту в данной области. Фармацевтическая композиция может быть составлена в таблетках, пилюлях, гранулах, порошках, капсулах, суспензиях, сиропах, эликсирах, растворах, эмульсиях или инъекционных растворах для перорального, внутривенного или парентерального введения. Фармацевтическая композиция может быть составлена в таблетках, капсулах, порошках, микрогранулах, стерилизованных растворах или суспензиях для ректального введения или в форме суппозиториев. Вышеуказанный фармацевтически приемлемый носитель может включать лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, аравийскую камедь, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, микрокристаллическую целлюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния или минеральные масла. Кроме того, вышеуказанный фармацевтически приемлемый носитель может включать разбавители или добавки, такие как наполнители, разбавители-заменители, связывающие агенты, смачивающие агенты, разрыхлители, поверхностно-активные вещества и так далее. Твердый состав для перорального введения может быть в форме таблеток, пилюль, порошков, гранул, капсул и так далее и может включать по меньшей мере одну добавку, например, такую как крахмал,карбонат кальция, сахароза, лактоза и желатин, или скользящие вещества, такие как стеарат магния,тальк и так далее. Жидкий состав для перорального введения может быть в форме суспензий, растворов,эмульсий, сиропов и так далее и может включать разбавители, такие как вода и жидкий парафин, смачивающие добавки, подсластители, ароматизаторы и консерванты. Состав для парентерального введения может быть в форме стерилизованных растворов, неводных растворителей, суспензий, эмульсий, лиофилизованных препаратов или суппозиториев. Неводные растворители и суспензии включают пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, инъецируемые сложные эфиры, такие как этилолеат, и так далее. Витепсол, макрогол, твин 61, масло какао, лауриновое масло,-6 018142 глицерожелатин и тому подобное могут быть использованы в качестве носителя для суппозиториев. Желательная доза соединения формулы (I) или его фармацевтически приемлемой соли, включенного(ой) в фармацевтическую композицию настоящего изобретения, варьируется в зависимости от состояния, веса, возраста и пола субъекта, тяжести заболевания, лекарственной формы и пути и периода введения и может быть выбрана специалистами в данной области. Например, как правило, рекомендуемая для введения доза составляет количество, колеблющееся в диапазоне от 0,01 до 500 мг/кг, предпочтительно от 0,1 до 100 мг/кг по массе/день соединения формулы (I) или его фармацевтически приемлемой соли, но рекомендуемая доза не ограничивается такими диапазонами. Разовая доза может быть введена за один прием или она может быть поделена на несколько приемов в день или в неделю. Кроме того, фармацевтическая композиция настоящего изобретения может включать 0,001-50 мас.%, предпочтительно 0,1-50 мас.% соединения формулы (I) или его фармацевтически приемлемой соли, исходя из общей массы композиции, но это не ограничивается такими диапазонами. Преимущественные эффекты Производное хиназолин-2,4-диона, его фармацевтически приемлемая соль и композиция, содержащая производное хиназолин-2,4-диона и его фармацевтически приемлемую соль, в соответствии с настоящим изобретением дают эффекты в отношении подавления гибели клеток в мозге, защиты нервных клеток, подавления окисления, подавления судорог и релаксации кровеносных сосудов, и, таким образом, являются полезными для предотвращения или лечения вышеуказанных различных заболеваний, например инсульта, болезни Альцгеймера и эпилепсии, а также для усиления памяти. Краткое описание чертежей Фиг. 1 показывает противоинсультный эффект соединения 3 в модели окклюзии средней мозговой артерии (MCAO = middle cerebral artery occlusion). Красный цвет (окрашенные части) обозначает нормальную зону мозга, и белый цвет (неокрашенные части) обозначает зону окклюзии. 100 мг/кг соединения 3 и 2000 мг/кг цитиколина вводят за 1 ч до индукции инсульта и непосредственно перед индукцией инсульта (в каждой экспериментальной группе используют по 8 мышей). Фиг. 2 показывает эффект соединения 3 в отношении подавления окислительного стресса, вызванного NMDA (N-метил-D-аспартат) клеток мозга у мышей. "Нормальный контроль" отражает нормальные клетки без какой-либо обработки, и "негативный контроль" соответствует клеткам мозга, обработанным посредством 300 мкМ NMDA. Вводят 125 и 250 мкг/мл соединения 3 (обработанные соединениями группы). Пометки ,ипредназначены для того, чтобы показать значимое различие Р 0,05 по сравнению с каждым соответствующим контрольным значением в случаях выполнения дисперсионного анализа ANOVA и теста t-Стьюдента ( для сравнения нормального контроля с негативным контролем; иидля сравнения обработанных соединениями групп с негативным контролем). Конкретные варианты осуществления технического выполнения изобретения Настоящее изобретение будет объяснено более конкретно путем ссылки на следующие примеры,которые обеспечены с целью иллюстрации и не предназначены для ограничения. Пример 1. 3-3-[4-(3-Аминопропиламино)бутиламино]пропил-1 Н-хиназолин-2,4-дион (соединение 1). 1) Получение этил-2-этоксикарбониламинобензоата. Этил-2-аминобензоат (20 г, 0,12 моль) растворяют в 140 мл ксилола и добавляют этилхлорформиат(13,8 мл, 0,15 моль). После реакционного взаимодействия при кипячении с обратным холодильником в течение 3 ч растворитель удаляют перегонкой при пониженном давлении. К остатку добавляют 30 мл петролейного эфира и охлаждают. Соединение, указанное в заголовке, в виде твердого вещества белого цвета (26 г, 90,5%) получают путем собирания образованного твердого вещества посредством фильтрационного процесса и путем концентрирования отфильтрованного раствора и кристаллизации. 1H ЯМР (CDCl3): 10,51 (с, 1 Н), 8,43 (дд, 1 Н), 8,01 (дд, 1 Н), 7,51 (т, 1 Н), 7,01 (т, 1 Н), 4,37 (кв, 2 Н),4,22 (кв, 2 Н), 1,40 (т, 3 Н), 1,32 (т, 3 Н). 2) Получение 3-3-[4-(3-аминопропиламино)бутиламино]пропил-1 Н-хиназолин-2,4-диона. Этил-2-этоксикарбониламинобензоат (8,0 г, 33,7 ммоль) и N,N'-бис-(3-аминопропил)бутан-1,4 диамин (8,87 г, 43,8 ммоль) плавят путем нагревания. После перемешивания в течение 4 ч при 125-135 С к нему добавляют изопропиловый спирт и добавляют концентрированную хлористо-водородную кислоту с получением твердого вещества. Твердое вещество, отделенное посредством фильтрационного процесса, растворяют в воде и нейтрализуют водным раствором гидроксида натрия. После удаления воды перегонкой при пониженном давлении выполняют колоночную хроматографию на силикагеле остатка, что дает соединение, указанное в заголовке, в виде масла (5,0 г, 43%). 1 му добавляют 25 мл изопропилового спирта с получением твердого вещества и после фильтрации сушат при пониженном давлении, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (3,3 г, 64%). 1H ЯМР (CDCl3): 8,05 (д, 2 Н), 7,62 (т, 2 Н), 7,22 (т, 2 Н), 7,15 (д, 2 Н), 4,11 (т, 4 Н), 2,62 (м, 8 Н), 1,94 (м,4 Н), 1,55 (с, 4 Н). Способ 2. 3-3-[4-(3-Аминопропиламино)бутиламино]пропил-1 Н-хиназолин-2,4-дион (2,1 г, 6,0 ммоль) и этил-2-этоксикарбониламинобензоат (1,6 г, 6,6 ммоль) плавят при 125-135 С. По истечении 5 ч к нему добавляют 20 мл изопропилового спирта с получением твердого вещества и после фильтрации сушат при пониженном давлении, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (2,2 г, 74%), которое идентично соединению, полученному способом 1. Пример 3. Солянокислая соль N-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-4-[3(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилацетамида (соединение 3). После растворения 3-(3-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-1 Н-хиназолин-2,4-диона (3 г, 6,1 ммоль) в 60 мл пиридина к нему добавляют уксусный ангидрид (0,7 мл, 7,3 ммоль). По истечении 2 ч пиридин удаляют перегонкой при пониженном давлении. К остатку добавляют дихлорметан и воду и после удаления образованного твердого вещества с помощью фильтрационного процесса каждый слой в растворе отделяют. К водному слою добавляют концентрированную хлористо-водородную кислоту и рН корректируют с доведением до 2-3. После удаления воды перегонкой при пониженном давлении выполняют колоночную хроматографию на силикагеле остатка,что дает соединение, указанное в заголовке (1,1 г, 32%). 1(м, 4 Н), 2,12 (м, 5 Н), 1,96 (м, 2 Н), 1,73 (м, 4 Н). Посредством обработки 1,0 г соединения из вышеприведенного примера 3 ионообменной смолой,получают соединение в основной форме, N-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилацетамид (0,65 г). 1H ЯМР (MeOD): 7,89 (м, 2 Н), 7,53 (м, 2 Н), 7,15-7,01 (м, 4 Н), 3,97 (м, 4 Н), 3,40 (т, 2 Н), 3,32 (кв., 2 Н),2,54 (м, 4 Н), 2,05 (д, 3 Н), 1,94-1,83 (м, 4 Н), 1,61-1,44 (м, 4 Н). Пример 4. N-(4-Ацетил-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]аминобутил)-N[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]ацетамид (соединение 4). После растворения 3-(3-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-1 Н-хиназолин-2,4-диона (2 г, 4,1 ммоль) в 50 мл пиридина добавляют уксусный ангидрид(1,0 мл, 10,2 ммоль). По истечении 2 ч пиридин удаляют перегонкой при пониженном давлении и выполняют колоночную хроматографию на силикагеле остатка, что дает соединение, указанное в заголовкеH ЯМР (ДМСО-d6): 11,40 (с, 2 Н), 7,91 (м, 2 Н), 7,63 (м, 2 Н), 7,17 (м, 4 Н), 3,86 (м, 4 Н), 3,27 (м, 8 Н),1,95 (м, 6 Н), 1,80 (м, 4 Н), 1,43 (м, 4 Н). Пример 5. Солянокислая соль этилового эфира [3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)пропил]-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилкарбаминовой кислоты (соединение 5). 3-(3-4-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-1 Нхиназолин-2,4-дион (2 г, 4,1 ммоль) растворяют в 20 мл гексаметилфосфорамида при нагревании, охлаждают и к нему добавляют этилхлорформиат (0,4 мл, 4,1 ммоль). По истечении 2 ч выполняют колоночную хроматографию на силикагеле реакционной смеси, что дает соединение, указанное в заголовке, в виде твердого вещества желтого цвета (0,48 г, 20%). 1H ЯМР (MeOD): 8,00 (т, 2 Н), 7,63 (кв., 2 Н), 7,21 (кв., 2 Н), 7,14 (м, 2 Н), 4,15 (т, 2 Н), 4,09 (кв., 2 Н),4,02 (т, 2 Н), 3,36 (м, 4 Н), 3,05 (м, 4 Н), 2,10 (м, 2 Н), 1,95 (м, 2 Н), 1,71 (т, 4 Н), 1,21 (шир.с, 3 Н). Пример 6. N-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-(4-[3-(2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)пропил]метиламинобутил)ацетамид (соединение 6). Солянокислую соль N-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-4-[3-(2,4-диоксо 1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилацетамида (2 г, 3,5 ммоль) растворяют в 80 мл дихлорметана и 10 мл метанола. К этому добавляют триэтиламин (0,45 г, 4,5 ммоль) и параформальдегид(0,14 г, 4,5 ммоль) и перемешивают в течение 2 ч при комнатной температуре. После концентрирования растворителя добавляют 40 мл метанола и боргидрид натрия (0,76 г, 20,2 ммоль) и перемешивают в течение 15 ч. После удаления метанола перегонкой при пониженном давлении выполняют колоночную хроматографию на силикагеле остатка, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (1,2 г, 62%). 1 14,8 ммоль) плавят при 140 С. По истечении 3 ч к нему добавляют 50 мл изопропилового спирта для образования твердого вещества, отфильтровывают и сушат при пониженном давлении. Получают соединение, указанное в заголовке, в виде твердого вещества желтого цвета (3,2 г, 50%). 1H ЯМР (ДМСО-d6): 7,91 (м, 2 Н), 7,63 (м, 2 Н), 7,18 (м, 4 Н), 3,90 (м, 4 Н), 2,50 (м, 4 Н), 1,69 (м, 2 Н),1,58 (м, 2 Н), 1,39 (м, 2 Н). Пример 8. Дигидрохлорид N-(3-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино] бутиламинопропил)-4-гидроксибензамида (соединение 8). 4-Гидроксибензойную кислоту (1,13 г, 8,2 ммоль), 1-гидроксибензотриазол (1,27 г, 9,4 ммоль), 1,3 дициклогексилкарбодиимид (1,94 г, 9,4 ммоль) и N,N'-диизопропилэтиламин (1,64 мл, 9,4 ммоль) добавляют в 20 мл диметилсульфоксида и перемешивают в течение 15 мин. К этому добавляют 3-3-[4-(3 аминопропиламино)бутиламино]пропил-1 Н-хиназолин-2,4-дион (2,18 г, 6,3 ммоль), растворенный в 10 мл диметилсульфоксида, и перемешивают при 50 С при нагревании. По истечении 5 ч диметилсульфоксид удаляют, оставшийся раствор растворяют в метаноле с концентрированной хлористо-водородной кислотой. После удаления метанола выполняют колоночную хроматографию на силикагеле остатка, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (1,6 г, 47%). 1H ЯМР (D2O): 7,91 (д, 1 Н), 7,74 (т, 1 Н), 7,63 (д, 2 Н), 7,33 (т, 1 Н), 7,16 (д, 1 Н), 6,87 (д, 2 Н), 4,07 (т,2 Н), 3,53 (т, 2 Н), 3,20 (м, 8 Н), 2,11 (м, 4 Н), 1,91 (с, 4 Н). Пример 9. 3-3-[4-(N-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-бензиламино) бутиламино]пропил-1 Н-хиназолин-2,4-дион (соединение 9). 3-(3-4-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-1 Нхиназолин-2,4-дион (2 г, 4,1 ммоль) растворяют в 60 мл тетрагидрофурана и в 60 мл водного раствора гидроксида натрия (0,3 г, 8,1 моль) и охлаждают. К этому добавляют по каплям бензилбромид (0,48 мл,4,1 ммоль). По истечении 15 ч образованные твердые частицы отфильтровывают и фильтрат перегоняют при пониженном давлении. Остаток подвергают колоночной хроматографии на силикагеле, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,28 г, 12%). 1H ЯМР (CDCl3): 7,91 (дд, 2 Н), 7,48 (м, 4 Н), 7,29-7,04 (м, 7 Н), 4,13 (т, 2 Н), 3,92 (т, 2 Н), 3,57 (с, 2 Н),3,13 (т, 2 Н), 3,04 (т, 2 Н), 2,51 (м, 4 Н), 2,30 (м, 2 Н), 2,00 (м, 2 Н), 1,78 (м, 2 Н), 1,63 (м, 2 Н). Пример 10. Солянокислая соль N-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-4-[3(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилбензамида (соединение 10). Относительно вышеприведенного примера 5 используют бензоилхлорид (0,69 г, 4,9 ммоль) вместо этилхлорформиата. Следуют методике, аналогичной методике, описанной в вышеприведенном примере 5, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,2 г, 7,8%). 1H ЯМР (ДМСО-d6): 7,94-7,84 (м, 2 Н), 7,65 (м, 2 Н), 7,38 (м, 2 Н), 7,22-7,01 (м, 7 Н), 3,96-3,72 (м, 4 Н),3,48-3,16 (м, 4 Н), 2,89-2,64 (м, 4 Н), 1,96-1,82 (м, 4 Н), 1,62-1,34 (м, 4 Н). Пример 11. трет-Бутиловый эфир [3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-4-[3-(2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилкарбаминовой кислоты (соединение 11). 3-3-4-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-1 Нхиназолин-2,4-дион (2 г, 4,1 ммоль) растворяют в 20 мл пиридина и затем охлаждают. К этому добавляют 0,93 г ди-трет-бутилдикарбоната (4,3 ммоль). По истечении 3 ч пиридин удаляют при пониженном давлении и делают колоночную хроматографию на силикагеле, что дает соединение, указанное в заголовке,в виде твердого вещества желтого цвета (0,25 г, 10,4%). 1H ЯМР (MeOD): 7,99 (м, 2 Н), 7,60 (м, 2 Н), 7,22-7,09 (м, 4 Н), 4,04 (м, 4 Н), 3,25 (т, 4 Н), 2,59 (м, 4 Н),1,90 (м, 4 Н), 1,60-1,48 (м, 4 Н), 1,40 (с, 9 Н). Пример 12. Солянокислая соль N-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-4-[3(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилметансульфонамида (соединение 12). 3-(3-4-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-1 Нхиназолин-2,4-дион (2 г, 4,1 ммоль) растворяют в 10 мл гексаметилфосфорамида при нагревании. К этому добавляют 30 мл дихлорметана и охлаждают и затем добавляют метансульфонилхлорид (0,5 г, 4,3 ммоль). По истечении 2 ч дихлорметан удаляют при пониженном давлении и делают колоночную хроматографию на силикагеле остатка, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,67 г, 27%). 1H ЯМР (ДМСО-d6): 7,93 (м, 2 Н), 7,64 (м, 2 Н), 7,20 (м, 4 Н), 3,97 (т, 2 Н), 3,91 (т, 2 Н), 3,17 (м, 4 Н),2,90 (с, 3 Н), 2,89 (м, 4 Н), 1,97 (м, 2 Н), 1,85 (м, 2 Н), 1,61 (с, 4 Н). Пример 13. N-(4-Бензил-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]аминобутил)-N[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]ацетамид (соединение 13). 3-3-[4-(N-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-бензиламино)бутиламино] пропил-1 Н-хиназолин-2,4-дион (0,28 г, 0,48 ммоль) растворяют в 5 мл дихлорметана. К этому добавляют триэтиламин (0,13 мл, 0,96 ммоль) и уксусный ангидрид (0,06 мл, 0,58 ммоль) и перемешивают в течение 1 ч. Отделяют органический слой путем добавления воды и сушат над сульфатом магния. После фильтрации и концентрирования выполняют колоночную хроматографию на силикагеле остатка, что дает соединение, указанное в заголовке, в виде масла (0,12 г, 40%). 1 2 Н), 3,41 (м, 2 Н), 3,29 (м, 2 Н), 2,54 (м, 4 Н), 2,09, 2,04 (с, 3 Н), 1,98-1,85 (м, 4 Н), 1,63-1,49 (м, 4 Н). Пример 14. Этиловый эфир (4-ацетил-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил] аминобутил)-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]карбаминовой кислоты (соединение 14). Относительно вышеприведенного примера 4 используют солянокислую соль N-[3-(2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)пропил]-N-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино] бутилацетамида (3 г, 5,3 ммоль) и этилхлорформиат (0,6 мл, 6,3 ммоль) вместо 3-(3-4-[3-(2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-1 Н-хиназолин-2,4-диона и уксусного ангидрида. Следуют методике, аналогичной методике из вышеприведенного примера 4, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (1,1 г, 34%) в смеси растворителей пиридина и дихлорметана. 1H ЯМР (CDCl3): 10,40 (д, 2 Н), 8,06 (м, 2 Н), 7,56 (м, 2 Н), 7,17 (м, 4 Н), 4,10 (м, 6 Н), 3,50-3,30 (м, 8 Н),2,10 (с, 3 Н), 1,97 (м, 4 Н), 1,55 (д, 4 Н), 1,21 (м, 3 Н). Пример 15. 3-[3-(4-N-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-бензиламинобутил)-N-бензиламино]пропил-1 Н-хиназолин-2,4-дион (соединение 15). Относительно вышеприведенного примера 9 соединение, указанное в заголовке (0,4 г, 15%), получают отфильтровыванием твердого вещества белого цвета, образованного посредством реакции, протекающей в течение 15 ч. 1(соединение 16). 3-(3-4-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-1 Нхиназолин-2,4-дион (2 г, 4,1 ммоль) растворяют в 40 мл пиридина и добавляют этилхлорформиат (0,46 мл, 4,9 ммоль). По истечении 2 ч пиридин удаляют при пониженном давлении и к остатку добавляют дихлорметан и воду. После отделения каждого слоя удаляют дихлорметан и проводят колоночную хроматографию на силикагеле остатка, что дает соединение, указанное в заголовке, в виде твердого вещества желтого цвета (0,61 г, 24%). 1H ЯМР (CDCl3): 8,09 (д, 2 Н), 7,58 (т, 2 Н), 7,20 (т, 2 Н), 7,12 (д, 2 Н), 4,09 (м, 8 Н), 3,35-3,25 (м, 8 Н),1,96 (м, 4 Н), 1,52 (с, 4 Н), 1,21 (т, 6 Н). Пример 17. трет-Бутиловый эфир (4-трет-бутоксикарбонил-[3-(2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)пропил]аминобутил)-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]карбаминовой кислоты (соединение 17). Относительно вышеприведенного примера 11 соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,3 г, 11%) получают, если берут другую фракцию колоночной хроматографии на силикагеле. 1H ЯМР (CDCl3): 10,08 (шир.с, 2 Н), 8,09 (д, 2 Н), 7,56 (т, 2 Н), 7,19 (т, 2 Н), 7,12 (д, 2 Н), 4,05 (м, 4 Н),3,30-3,20 (м, 8 Н), 1,94 (т, 4 Н), 1,51 (с, 4 Н), 1,42 (с, 18 Н). Пример 18. N-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-(4-[3-(2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)пропил]метансульфониламинобутил)метансульфонамид (соединение 18). Относительно вышеприведенного примера 12, соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,24 г, 9,1%) получают, если берут другую фракцию колоночной хроматографии на силикагеле. 1N-(3-4-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-4 гидроксибензамид (1,27 г, 2,72 ммоль) растворяют в 10 мл пиридина и к нему добавляют уксусный ангидрид (0,4 мл, 4,07 ммоль). По истечении 2 ч пиридин удаляют перегонкой при пониженном давлении и добавляют дихлорметан и воду. Органический слой отделяется и его удаляют. После концентрирования при пониженном давлении остаток подвергают колоночной хроматографии на силикагеле и обрабатывают ионообменной смолой, что дает соединение, указанное в заголовке, в виде масла (0,06 г, 4,3%). 1H ЯМР (MeOD): 8,00 (д, 1 Н), 7,70 (д, 2 Н), 7,63 (т, 1 Н), 7,21 (т, 1 Н), 7,16 (д, 1 Н), 6,80 (д, 2 Н), 4,09 (т,2 Н), 3,39 (м, 6 Н), 2,77 (м, 4 Н), 2,12, 2,09 (с, 3 Н), 1,99-1,82 (м, 4 Н), 1,59 (м, 4 Н). Пример 20. N-[3-(4-Ацетил-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]аминобутиламино)пропил]-4-гидроксибензамид (соединение 20). Относительно вышеприведенного примера 19 соединение, указанное в заголовке, в виде масла (0,06 г, 4,0%) получают, если берут другую фракцию колоночной хроматографии на силикагеле и обрабатывают эту фракцию ионообменной смолой CG-50. 1(м, 6 Н), 2,87 (м, 4 Н), 2,10 (с, 3 Н), 1,97-1,90 (м, 4 Н), 1,64 (м, 4 Н). Пример 21. N-3-[Ацетил-(4-ацетил-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]аминобутил)амино]пропил-4-гидроксибензамид (соединение 21). Относительно вышеприведенного примера 19 соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,53 г, 35,4%) получают, если берут другую фракцию колоночной хроматографии на силикагеле. 1H ЯМР (MeOD): 7,98 (т, 1 Н), 7,70 (дд, 2 Н), 7,60 (м, 1 Н), 7,15 (м, 2 Н), 6,80 (дд, 2 Н), 3,99 (м, 2 Н),3,42-3,30 (м, 10 Н), 2,09 (т, 3 Н), 2,07 (т, 3 Н), 1,92-1,78 (м, 4 Н), 1,55 (м, 4 Н). Пример 22. N-[4-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)бутил]-N-[3-(2,4-диоксо-1,4-дигидро 2 Н-хиназолин-3-ил)пропил]ацетамид (соединение 22). Относительно вышеприведенного примера 4 3-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)пропиламино]бутил-1 Н-хиназолин-2,4-дион (1 г, 2,3 ммоль) используют вместо 3-(3-4-[3-(2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-1 Н-хиназолин-2,4-диона. Следуют методике, аналогичной методике вышеприведенного примера 4, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,89 г, 81%) в смеси растворителей пиридина и дихлорметана. 1(м, 2 Н), 1,64 (м, 4 Н). Пример 23. 3-(2-3-[2-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)этиламино]пропиламиноэтил)1 Н-хиназолин-2,4-дион (соединение 23). Относительно вышеприведенного примера 7 используют N,N'-бис(2-аминоэтил)-1,3-пропандиамин(2,4 г, 14,8 ммоль) вместо N-(3-аминопропил)бутан-1,4-диамина. Следуют методике, аналогичной методике вышеприведенного примера 7, что дает соединение, указанное в заголовке, в виде твердого вещества желтого цвета (3,7 г, 55%). 1H ЯМР (ДМСО-d6): 7,88 (д, 2 Н), 7,59 (т, 2 Н), 7,14 (м, 4 Н), 3,92 (т, 4 Н), 2,65 (т, 4 Н), 2,47 (м, 4 Н),1,43 (м, 2 Н). Пример 24. 3-(3-3-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]пропиламино пропил)-1 Н-хиназолин-2,4-дион (соединение 24). Относительно вышеприведенного примера 7 используют N,N'-бис(3-аминопропил)-1,3 пропандиамин (2,8 г, 14,8 ммоль) вместо N-(3-аминопропил)бутан-1,4-диамина. Следуют методике, аналогичной методике вышеприведенного примера 7, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (2,9 г, 41%). 1H ЯМР (ДМСО-d6): 7,91 (д, 2 Н), 7,63 (т, 2 Н), 7,17 (м, 4 Н), 3,92 (т, 4 Н), 2,49 (т, 8 Н), 1,70 (м, 4 Н),1,49 (м, 2 Н). Пример 25. 3-(3-4-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]-2-бутениламино пропил)-1 Н-хиназолин-2,4-дион (соединение 25). Относительно вышеприведенного примера 7 используют N,N'-бис(3-аминопропил)-2-бутен-1,4 диамин (2,96 г, 14,8 ммоль) вместо N-(3-аминопропил)бутан-1,4-диамина. Следуют методике, аналогичной методике вышеприведенного примера 7, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (4,5 г, 62%). 1(2 г, 2,9 ммоль) растворяют в 10 мл тетрагидрофурана и 10 мл дихлорметана и охлаждают. К этому добавляют гидрид натрия (0,2 г, 8,3 ммоль) и метилиодид (0,6 мл, 9,6 ммоль) и перемешивают в течение 2 ч. После концентрирования растворителя при пониженном давлении проводят колоночную хроматографию на силикагеле остатка, что дает соединение, указанное в заголовке, в виде масла (1,9 г, 91%). 1H ЯМР (CDCl3): 8,21 (д, 2 Н), 7,66 (т, 2 Н), 7,24 (т, 2 Н), 7,18 (д, 2 Н), 4,09 (т, 4 Н), 3,59 (с, 6 Н), 3,263,19 (м, 8 Н), 1,91 (м, 4 Н), 1,48 (с, 4 Н), 1,40 (с, 18 Н). Пример 27. Дигидрохлорид 1-метил-3-(3-4-[3-(1-метил-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)пропиламино]бутиламинопропил)-1 Н-хиназолин-2,4-диона (соединение 27). трет-Бутиловый эфир (4-трет-бутоксикарбонил-[3-(1-метил-2,4-диоксо-1,4-дигидро-2 Н-хиназолин 3-ил)пропил]аминобутил)-[3-(1-метил-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]карбаминовой кислоты (1,8 г, 2,5 ммоль) растворяют в 20 мл метанола, к нему добавляют концентрированную хлористо-водородную кислоту и перемешивают. После концентрирования метанола путем кристаллизации получают соединение, указанное в заголовке, в виде твердого вещества белого цвета (1,3 г, 88%). 1 Пример 28. Дигидрохлорид 3-(3-4-[3-(1,3-диоксо-1,3-дигидроизоиндол-2-ил)пропиламино]бутиламинопропил)-1 Н-хиназолин-2,4-диона (соединение 28). 3-3-[4-(3-Аминопропиламино)бутиламино]пропил-1 Н-хиназолин-2,4-дион (1,06 г, 3,1 ммоль) и диэтилфталат (0,68 г, 3,1 ммоль) греют и перемешивают при 125-130 С. Через 3 ч добавляют 25 мл изопропилового спирта и концентрированной хлористо-водородной кислоты для получения твердого вещества. Проводят колоночную хроматографию на силикагеле твердого вещества, извлеченного фильтрацией, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,25 г, 15%). 1H ЯМР (D2O): 7,77 (д, 1 Н), 7,71 (м, 4 Н), 7,61 (м, 1 Н), 7,19 (т, 1 Н), 6,99 (д, 1 Н), 3,98 (т, 2 Н), 3,71 (т,2 Н), 3,10 (м, 8 Н), 2,06 (м, 4 Н), 1,81 (с, 4 Н). Пример 29. Дигидрохлорид 3-(3-2-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино] этиламинопропил)-1 Н-хиназолин-2,4-диона (соединение 29). Относительно вышеприведенного примера 7 здесь используют N,N'-бис(3-аминопропил)этилендиамин (2,5 г, 14,3 ммоль) вместо N-(3-аминопропил)бутан-1,4-диамина. Следуют методике, аналогичной методике вышеприведенного примера 7, с получением твердого вещества и затем применяют концентрированную хлористо-водородную кислоту, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (1,5 г, 9,5%) в метаноле. 1H ЯМР (D2O): 7,91 (д, 2 Н), 7,64 (м, 2 Н), 7,25 (м, 2 Н), 7,07 (д, 2 Н), 4,07 (т, 4 Н), 3,48 (с, 4 Н), 3,21 (т,4 Н), 2,12 (м, 4 Н). Пример 30. трет-Бутиловый эфир [3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-(4-[3(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]гексиламинобутил)карбаминовой кислоты (соединение 30). трет-Бутиловый эфир [3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-4-[3-(2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилкарбаминовой кислоты (2 г, 3,4 ммоль) растворяют в 40 мл тетрагидрофурана. К этому добавляют гидрид натрия (0,16 г, 6,7 ммоль) и 1-бромгексан (0,67 г, 4,0 ммоль) и перемешивают при кипячении с обратным холодильником. Растворитель концентрируют при пониженном давлении и делают колоночную хроматографию на силикагеле остатка, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,52 г, 23%). 1(м, 6 Н), 1,93 (м, 4 Н), 1,54 (м, 6 Н), 1,40 (с, 9 Н), 1,29 (с, 6 Н), 0,88 (т, 3 Н). Пример 31. Дигидрохлорид 3-[3-(4-N-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-Nгексиламинобутиламино)пропил]-1 Н-хиназолин-2,4-диона (соединение 31). С трет-бутилового эфира [3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-(4-[3-(2,4 диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]гексиламинобутил)карбаминовой кислоты (0,4 г, 0,6 ммоль) снимают защитные группы, следуя методике, аналогичной методике вышеприведенного примера 27, и выделяют хроматографией, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,1 г, 26%). 1(3 г, 4,3 ммоль) растворяют в 120 мл ацетонитрила. К этому добавляют карбонат калия (3,45 г, 25,0 ммоль) и 1-бромгексан (3,5 г, 21,1 ммоль) и перемешивают в течение 3 ч при кипячении с обратным холодильником. Растворитель концентрируют при пониженном давлении и делают колоночную хроматографию на силикагеле остатка, что дает соединение, указанное в заголовке, в виде бесцветного масла (3,7 г, 99%). 1(м, 4 Н), 1,64 (м, 4 Н), 1,36 (с, 18 Н), 1,41-1,25 (м, 16 Н), 0,82 (т, 6 Н). Пример 33. Дигидрохлорид 1-гексил-3-(3-4-[3-(1-гексил-2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)пропиламино]бутиламинопропил)-1 Н-хиназолин-2,4-диона (соединение 33). С трет-бутилового эфира (4-трет-бутоксикарбонил-[3-(1-гексил-2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)пропил]аминобутил)-[3-(1-гексил-2, 4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил] карбаминовой кислоты (2 г, 2,3 ммоль) снимают защитные группы, следуя методике, аналогичной методике вышеприведенного примера 27, и кристаллизуют в этаноле, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (1,07 г, 63%). 1(соединение 34). трет-Бутиловый эфир [3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-4-[3-(2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилкарбаминовой кислоты (0,4 г, 0,7 ммоль) подвергают реакции с ангидридом гептановой кислоты (0,2 г, 0,8 ммоль) вместо уксусного ангидрида, используемого в вышеприведенном примере 4. Следуя методике, аналогичной методике вышеприведенного примера 4,получают соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,37 г, 88%). 1H ЯМР (CDCl3): 8,10 (м, 2 Н), 7,58 (м, 2 Н), 7,26-7,10 (м, 4 Н), 4,08 (м, 4 Н), 3,49-3,23 (м, 8 Н), 2,28 (т,2 Н), 1,95 (м, 4 Н), 1,66-1,50 (м, 6 Н), 1,43 (д, 9 Н), 1,27 (м, 6 Н), 0,87 (м, 3 Н). Пример 35. Солянокислая соль амида [3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-4-[3(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилгептановой кислоты (соединение 35). С использованием трет-бутилового эфира [3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил](4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]гептаноиламинобутил)карбаминовой кислоты (0,36 г, 0,5 ммоль), по методике, аналогичной методике вышеприведенного примера 31, получают соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,2 г, 61%). 1H ЯМР (MeOD): 8,01 (м, 2 Н), 7,63 (м, 2 Н), 7,23-7,13 (м, 4 Н), 4,14 (т, 2 Н), 4,05 (м, 2 Н), 3,45 (м, 4 Н),3,02 (м, 4 Н), 2,35 (м, 2 Н), 2,10-1,95 (м, 4 Н), 1,76-1,55 (м, 6 Н), 1,27 (м, 6 Н), 0,87 (м, 3 Н). Пример 36. Солянокислая соль N-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-4-[3(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутил-2,2,2-трифторацетамида (соединение 36). Относительно вышеприведенного примера 3 используют трифторуксусный ангидрид (1,5 г, 7,3 ммоль) вместо уксусного ангидрида и по методике, аналогичной методике вышеприведенного примера 3,получают соединение, указанное в заголовке, в виде твердого вещества желтого цвета (0,6 г, 15,8%). 1H ЯМР (MeOD): 8,00 (м, 2 Н), 7,63 (м, 2 Н), 7,25-7,13 (м, 4 Н), 4,14 (м, 2 Н), 4,06 (м, 2 Н), 3,54 (м, 4 Н),3,01 (м, 4 Н), 2,07 (м, 4 Н), 1,74 (м, 4 Н). Пример 37. N-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-4-3-(2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)пропил]-(2,2,2-трифторацетил)амино]бутил-2,2,2-трифторацетамид (соединение 37). Получают соединение, указанное в заголовке, в виде твердого вещества белого цвета (1,1 г, 26,4%),если берут другую фракцию колоночной хроматографии на силикагеле твердого вещества, полученного в вышеприведенном примере 36. 1H ЯМР (MeOD): 8,01 (м, 2 Н), 7,62 (м, 2 Н), 7,23-7,12 (м, 4 Н), 4,03 (м, 4 Н), 3,50 (м, 8 Н), 2,01 (м, 4 Н),1,65 (м, 4 Н). Пример 38. Солянокислая соль N-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-4-[3(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутил-2-метоксиацетамида (соединение 38). Используют исходное вещество из вышеприведенного примера 5 (0,5 г, 1,0 ммоль) и метоксиацетилхлорид (0,12 г, 1,1 ммоль) вместо этилхлорформиата. Следуют методике, аналогичной методике из вышеприведенного примера 5, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,1 г, 16,4%). 1H ЯМР (MeOD): 8,00 (м, 2 Н), 7,63 (м, 2 Н), 7,23-7,12 (м, 4 Н), 4,14 (м, 4 Н), 4,05 (м, 2 Н), 3,48-3,32 (м,7 Н), 3,01 (м, 4 Н), 2,12-2,01 (м, 4 Н), 1,70 (м, 4 Н). Пример 39. Солянокислая соли бензилового эфира [3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)пропил]-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилкарбаминовой кислоты (соединение 39). Используют бензилхлорформиат (1,05 г, 6,1 ммоль) вместо уксусного ангидрида, применяемого в вышеприведенном примере 3, и следуют методике, аналогичной методике вышеприведенного примера 3,что дает соединение, указанное в заголовке, в виде твердого вещества желтого цвета (0,34 г, 8,4%). 1H ЯМР (MeOD): 8,00 (м, 2 Н), 7,63 (м, 2 Н), 7,33-7,19 (м, 7 Н), 7,13 (т, 2 Н), 5,08 (с, 2 Н), 4,13 (т, 2 Н),4,00 (м, 2 Н), 3,41 (м, 4 Н), 3,00-2,92 (м, 4 Н), 2,06 (м, 2 Н), 1,96 (м, 2 Н), 1,69 (шир.с, 4 Н). Пример 40. N-[3-(2,4-Диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропил]-N-4-[3-(2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)пропиламино]бутил-4-метилбензолсульфонамид (соединение 40). Вместо метансульфонилхлорида из вышеприведенного примера 12 используют птолуолсульфонилхлорид (1,4 г, 7,3 ммоль). Методику, аналогичную методике вышеприведенного примера 12, выполняют в метаноле и затем применяют ионообменную смолу CG-50, что дает соединение, указанное в заголовке, в виде твердого вещества белого цвета (0,3 г, 8%). 1(соединение 41). Относительно вышеприведенного примера 40 получают соединение, указанное в заголовке, в виде твердого вещества белого цвета (1,27 г, 26%), если берут другую фракцию колоночной хроматографии на силикагеле.H ЯМР (ДМСО-d6): 11,40 (с, 2 Н), 7,90 (д, 2 Н), 7,62 (м, 6 Н), 7,32 (д, 4 Н), 7,17 (м, 4 Н), 3,86 (т, 4 Н),3,08 (м, 8 Н), 2,35 (с, 6 Н), 1,75 (м, 4 Н), 1,42 (с, 4 Н). Пример 42. Дигидрохлорид 3-(3-4-[3-(2,5-диоксопирролидин-1-ил)пропиламино]бутиламино пропил)-1 Н-хиназолин-2,4-диона (соединение 42). Используют исходное вещество (1,5 г, 4,3 ммоль) из вышеприведенного примера 28 и используют янтарный ангидрид (0,43 г, 4,33 ммоль) вместо диэтилфталата. Следуют методике, аналогичной методике вышеприведенного примера 28, что дает соединение, указанное в заголовке, в виде твердого вещества желтого цвета (0,23 г, 11%). 1(м, 8 Н), 2,72 (с, 4 Н), 2,12 (м, 2 Н), 1,97 (м, 2 Н), 1,82 (м, 4 Н). Ниже будет подробно разъяснено то, что соединение с вышеуказанной формулой (I) в соответствии с настоящим изобретением дает превосходные эффекты в качестве нейропротекторного агента, с помощью последующих примеров с использованием соединений, полученных в вышеприведенных примерах. Следующие экспериментальные примеры изложены с целью облегчения понимания изобретения и не должны быть истолкованы как какое-либо ограничение изобретения, изложенного в пунктах формулы, которые следуют в этом документе после экспериментальных примеров. Экспериментальный пример 1. Эксперимент по изучению противоинсультного эффекта в модели окклюзии средней мозговой артерии (МСАО). В качестве лабораторных животных используют крыс-самцов линии SD с массой тела 290-300 г, в каждой экспериментальной группе используют по 8 крыс. Операцию проводят с использованием способаNagasava et al. (Nagasava, H. and Gogure, K. 1989, Stroke, 20: 1037-1043). Крысам делают анестезию кетамином и операцию проводят при поддерживании температуры тела с использованием термопланшета. Церебральную зону рассекают по медианной линии шеи и отделяют левую общую сонную артерию, внутреннюю сонную артерию и наружную сонную артерию, заботясь от том, чтобы не повредить блуждающий нерв. Общую сонную артерию и наружную сонную артерию перевязывают и вводят зонд во внутреннюю сонную артерию через место ответвления внутренней и наружной сонных артерий. И затем нижнюю часть средней мозговой артерии окклюдируют посредством перевязывания непосредственно на верхней стороне зоны введения. Зонд делают путем нагревания конца хирургической нити из нейлона 4-0 (Dafilon, B. Braun, Germany) и разрезают на 30-миллиметровые сегменты. 7-9-Миллиметровый конец зонда покрывают смесью силикона (Xantopren VL plus, Heraeus Kulzer, Germany) и отверждающего агента (Optosyl-Xantopren VL plus, Heraeus Kulzer, Germany), и толщина должна составлять 0,3-0,4 мм. По завершении вмешательства посредством введения зонда и после выхода животных из анестезии отдельные особи, у которых наблюдают симптом неврологического дефицита(движение по кругу в направлении вправо), включают в группу больных ишемией. По истечении 3-часового протекания ишемии введенный зонд удаляют для восстановления кровообращения при реперфузии. Через 24 ч мозг извлекают с последующим гистологическим окрашиванием. Соединение 3 вводят в запрограммированное время до введения и после введения зонда перорально или внутривенно. Окрашивание посредством ТСС (2,3,5-трифенилтетразолийхлорид) выполняют для того, чтобы оценить повреждение ткани мозга в результате ишемии. Процефалон извлеченного мозга разрезают на 2-миллиметровые последовательно идущие срезы с использованием "матрицы" для мозга(ASI instrument, Warren, MI, USA). Срезы помещают в 2%-ный раствор ТСС и инкубируют при 37 С в течение 60 мин для достижения окрашивания. ТСС-окрашенный мозговой срез закрепляют в 10%-ном буферном растворе формалина и переднюю часть каждого среза фотографируют с помощью цифровой камеры. Инфарктные зоны (см 2), которые не окрашены в темно-красный цвет в каждом полученном изображении, измеряют с использованием анализатора изображений и общий инфарктный объем (см 3) вычисляют путем умножения на толщину срезов. В результате пероральное введение (100 мг/кг) соединения 3 показывает ингибирующий эффект,процентная доля которого в отношении инфарктного объема мозга составляет 22,3 и 69,8% по сравнению с негативным контролем при пероральном введении, выполненном за 1 ч до вызывания инсульта и непосредственно перед вызыванием инсульта. Для цитиколина (2 г/кг), введенного в качестве позитивного контроля, это составляет 51,1 и 37,8% соответственно (табл. 1 и фиг. 1). В данном эксперименте после вызывания инсульта зонд удаляют для восстановления кровообращения при реперфузии. Затем вводят соединение 3 в режиме разделенного времени дозой 5 мг/кг, и наблюдают ингибирующий эффект в отношении объема некроза, составляющий 62,7%, даже если введение проводят через 12 ч после реперфузии. С другой стороны, MK-801, введенный в качестве позитивного контроля, показывает максимальный эффект через 30 мин после реперфузии (табл. 2). Таким образом,соединение 3 дает очевидные эффекты в отношении предотвращения и лечения инсульта и также может быть применено для пациентов, чье лечение отложено после появления симптомов инсульта. Таблица 1 Противоинсультный эффект при пероральном введении Инфарктный объем при негативном контроле 0,450,03 Таблица 2 Противоинсультный эффект при внутривенном введении Инфарктный объем при негативном контроле 0,430,02 Экспериментальный пример 2. Ингибирующий эффект в отношении возбуждаемой нейротоксичности в смешанной культуре нервных клеток-глиальных клеток. Выделение и выращивание нервных клеток проводят способом Choi (Choi, D.W. 1985, Neurosci.Lett., 58: 293-297). А именно, кору головного мозга отделяют у эмбриона мыши ICR, которая имела беременность 14 дней, и затем с использованием пипетки из ткани получают отдельно взятые клетки. Берут аликвоты клеток с плотностью 2105/лунка в 24-луночном планшете (Falcon), в котором выращены глиальные клетки коры головного мозга с применением инкубатора, поддерживаемого при 37 С с 5%CO2 в течение 3 недель. Культуральную среду дополняют минимальной эссенциальной средой Игла(MEM = minimum essential medium, Sigma), 2 мМ глутамина, 21 мМ глюкозы, 26,5 мМ бикарбоната, 10% фетальной бычьей сыворотки (FBS). По истечении 3-5 дней после аликвотирования вносят 10 мкМ Ara-С(арабинозид цитозина) для подавления пролиферации нейроглии. И обрабатывают посредством 100 мкМNMDA и 1 мкг/мл или 2 мкг/мл каждого образца (соединение) для вызывания гибели нервных клеток вследствие возбуждаемой токсичности в течение 20 мин через 12-15 дней после аликвотирования. Вследствие гибели нервных клеток лактатдегидрогеназа (LDH) аккумулируется пропорционально числу погибших клеток. Через 24 ч после обработки лекарственным средством измеряют количество лактатдегидрогеназы (LDH), высвобождаемой из клеток, с использованием набора реактивов для измерения LDH(CytoTox 96, Promega). По завершении реакции измеряют изменение поглощения в зависимости от количества LDH с использованием спектрофотометра для прочтения микропланшетов. Ингибирующий эффект в отношении гибели клеток по сравнению с негативным контролем показан в табл. 3, и, как видно, он является значительным. Таблица 3 Защитный эффект в отношении NMDA-вызванной гибели нервных клеток в смешанной культуре нервных клеток-глиальных клетокND: не обнаруживается Экспериментальный пример 3. Ингибирующий эффект в отношении Н 2 О 2-обусловленной цитотоксичности в клетках SH-SY5Y. Клетки SH-SY5Y, которые максимально приближены к линии нервных клеток человека, выращивают с концентрацией клеток 3104 в 96-луночном планшете и образец-пробу обрабатывают. Через 30 мин вносят 200 мкМ пероксида водорода для вызывания токсичности в течение 24 ч. По завершении реакции измеряют уровень выживания клеток посредством анализа жизнеспособности с МТТ (бромид 3(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия). В результате определяют, что уровень выживания клеток SH-SY5Y безусловно связан с концентрацией соединения 4, и, как показано, при концентрации 100 мкг/мл защитный эффект в отношении клеток составляет приблизительно 35% (табл. 4). Экспериментальный пример 4. Ингибирующий эффект в отношении ZnSO4-обусловленной цитотоксичности в клетках SH-SY5Y. Клетки SH-SY5Y выращивают с концентрацией клеток 3104 в 96-луночном планшете, и вносят соединение (50 мкг/мл). Через 30 мин применяют 600 мкМ сульфата цинка для вызывания токсичности в течение 24 ч и измеряют уровень выживания клеток посредством анализа жизнеспособности с МТТ(бромид 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия). Получающиеся в результате данные показывают ингибирующий эффект в отношении токсичности, который составляет 9,1-21,7% (табл. 5). Таблица 5 Ингибирующий эффект в отношении вызванной цинком токсичности Экспериментальный пример 5 Ингибирующий эффект в отношении продуцирования реакционноспособных молекул кислорода (ROS) в клетках мозга. Окислительный стресс измеряют для обнаружения ингибирующих эффектов в отношении продуцирования реакционноспособных молекул кислорода (ROS) с использованием DCF-DA (дихлорфлуоресцин диацетата), который является флуоресцентным зондом. Из коры головного мозга мыши получают клетки мозга для приготовления раствора клеток с концентрацией 2106 клеток/мл. Каждую клетку мозга обрабатывают посредством 11 мкМ DCF-DA с последующей реакцией в инкубаторе при 37 С в 5% СО 2 в течение часа. После двукратного промывания вносят соединение 3 с концентрацией 125 мкг/мл и 250 мкг/мл. В то же самое время применяют 300 мкМ NMDA и выдерживают в инкубаторе при 37 С, в 5% СО 2 в течение 24 ч. После завершения реакции измеряют флуоресценцию, которая показывает реакционноспособный кислород в реакционном растворе, с использованием флуоресцентного спектрофотометра(возбуждение при 480 нм/испускание при 535 нм). В результате соединение 3 подавляет окислительный стресс, вызванный NMDA нервных клеток, в зависимости от дозы (фиг. 2). Ингибирующий эффект соединений в отношении реакционноспособных молекул кислорода (ROS) представлен в виде дозы, подавляющей 50% продуцирования реакционноспособного кислорода, по сравнению с контрольными данными. Отмечают увеличение активности супероксиддисмутазы (SOD), фермента, который играет ключевую роль в продуцировании реакционноспособного кислорода, и степень увеличения представляют в сравнении с контрольными данными. Активность супероксиддисмутазы(SOD) измеряют с использованием набора реагентов, приобретенного в компании Sigma. В результате большинство соединений показывает более низкие дозы ID50 по сравнению с MK-801, который представляет собой позитивный контроль. Это указывает на то, что они имеют превосходный эффект при более низких дозах в сравнении с MK-801. Таблица 6 Ингибирующий эффект в отношении продуцирования реакционноспособных молекул кислорода (ROS) в клетках мозга мыши Таблица 7 Эффект в отношении увеличения активности супероксид-дисмутазы (SOD) в клетках мозга мыши Антагонистические эффекты соединений по отношению к NMDA-рецептору, изученные в экспериментальных примерах 2-5, демонстрируют то, что соединения настоящего изобретения могут быть использованы в качестве лекарственного средства не только для лечения ишемического инсульта, но также для предотвращения и лечения дегенеративного заболевания мозга, связанного с этим рецептором, тако- 18018142 го как эпилепсия, амиотрофический боковой склероз (ALS), болезнь Паркинсона, болезнь Гантингтона,болезнь Альцгеймера, и травматическое повреждение головного мозга или повреждение спинного мозга. Это также может быть использовано для улучшения памяти. Экспериментальный пример 6. Эксперимент по изучению противосудорожного эффекта. Эксперимент проводят способом Ali et al. (Ali, A. et al. 2006, Pharmacological Reports, 58: 242-245). Дозу соединения 10 мг/кг вводят внутрибрюшинно для обнаружения противосудорожного эффекта, и данный эффект отмечают (табл. 8). Изучение процесса изменения активности проводят по Программе разработки противоэпилептических лекарственных средств (ADD) национальных институтов здравоохранения (NIH) в ходе разработки противосудорожного лекарственного средства. Одним из оцениваемых пунктов при изучении противосудорожной активности на первом этапе этой программы является испытание с пентилентетразолом (PTZ). После введения испытываемого лекарственного средства подкожно вводят PTZ дозой 80 мг/кг, и ведут наблюдения в течение по меньшей мере 30 мин. После введения 10 мг/кг испытываемого лекарственного средства проводят оценку путем определения времени начала проявления судороги, продолжительности судороги до полного ее исчезновения и коэффициента смертности. Дают оценку о наличии противосудорожного эффекта в том случае, когда один эпизод клонического спазма не проявляется в течение 5 с по меньшей мере у одного из четырех лабораторных животных после введения PTZ. Таблица 8 Противосудорожный эффект соединений Каждое значение представляет собой среднее значение (n=6) измеренийN.D.: Не обнаруживается Экспериментальный пример 7. Релаксирующий эффект в отношении грудной аорты у крыс. После того как крысам-самцам линии SD (250-300 г) делают анестезию посредством ингаляции простого эфира, их грудные аорты извлекают и помещают в буферный раствор Krebs (мМ; NaCl 118,NaHCO3 27,3, KCl 4,8, MgSO4 1,2, KH2PO4 1,0, CaCl2 1,25, глюкоза 11,1). 2 мм аортального кольца делают под препаровальной лупой и выращивают в инкубаторе органов для измерения натяжения кровеносных сосудов. Инкубатор органов наполняют буферным раствором Krebs и насыщают 95% O2, 5% CO2 для поддержания концентрации растворенного кислорода и физиологического рН. Изменение натяжения измеряют с помощью прибора для измерения натяжения (Hugo-sachs, model K30) и записывают с помощью регистратора физиологических параметров (полиграф Coulbourn). Длину кровеносных сосудов увеличивают постепенно до достижения базального натяжения в 1,0 г в течение 90 мин. Находящийся в состоянии равновесия кровеносный сосуд суживают посредством фенилэфрина (0,5 мкМ). В том случае,когда бороздка при суживании достигает состояния равновесия, добавляют соединения с последующим наблюдением за реакцией релаксации. Результат, а именно релаксация грудной аорты крыс, суженной под действием фенилэфрина, в зависимости от дозы соединения 3 (табл. 9) для тех случаев, когда соединение 3 добавляют в дозе 50, 100 и 200 мкг/мл, приведен в табл. 9. Результат для тех случаев, когда каждое соединение вводят в дозе 67 мкг/мл, приведен в табл. 10, и этот результат предполагает замедление или отсрочивание гибели клеток и вызывание ревитализации (оживление) мертвых клеток, благодаря увеличению кровотока в результате расширения кровеносного сосуда в организме. Таблица 9 Релаксирующий эффект в зависимости от дозы в отношении мышц кровеносных сосудов Каждое значение представляет собой среднее значениестандартное отклонение (n=3) измерений. Таблица 10 Релаксирующий эффект соединений в отношении мышц кровеносного сосуда грудной аорты Каждое значение представляет собой среднее значение (n=3) измерений.ND: Не обнаруживается. Наблюдают превосходный релаксирующий эффект в отношении мышц кровеносного сосуда по сравнению с контрольными данными для большинства соединений. Промышленная применимость Как указано выше в примерах, соединения настоящего изобретения показывают противоинсультный эффект, антагонистический эффект в отношении NMDA-рецептора, ингибирующий эффект в отношении токсичности H2O2 и токсичности ZnSO4 в нервных клетках, антиокислительный эффект в нервных клетках, противосудорожный эффект и релаксирующий эффект в отношении грудной аорты. Таким образом, они могут быть использованы в качестве лекарственного средства для предотвращения и лечения вышеуказанных различных заболеваний, таких как инсульт, функциональное расстройство нервной системы, потеря памяти, цереброваскулярная дисфункция, повреждение головного мозга и спинного мозга,церебральная ишемия, деменция, болезнь Альцгеймера, болезнь Паркинсона и эпилепсия. где R1 представляет собой водород или C1-6 алкил; каждый из R2 и R3 независимо выбирают из водорода, C1-6 алкила, -COR6, -SO2R7 или из фенила или бензила, где R6 представляет собой С 1-6 алкил, С 1-4 алкокси, фенил, фенилокси или бензилокси, каждый из которых незамещен или замещен галогеном, гидрокси, метокси, этокси или нитро, и R7 представляет собой C1-4 алкил или незамещенный или замещенный С 1-6 алкилом фенил; А представляет собой -(СН 2)n- или -СН 2 СН=СНСН 2-, где n является целым числом от 2 до 4;R4 представляет собой водород и R5 представляет собой водород или бензоил, незамещенный или замещенный одной или более группами, выбранными из галогена, гидрокси, С 1-4 алкокси или нитро, в бензольном кольце, или в том случае, когда R4 и R5 вместе с N образуют кольцо, то R4 и R5 образуют двухвалентный фрагмент или где R8 представляет собой водород или С 1-6 алкил; каждый из l и m независимо представляет собой целое число от 2 до 4 и р представляет собой целое число, имеющее значение 0 или 1,или его фармацевтически приемлемая соль. 2. Соединение по п.1, гдеR1 представляет собой водород; каждый из R2 и R3 независимо выбирают из водорода, C1-6 алкила, -COR6, -SO2R7 или из фенила или бензила, где R6 представляет собой С 1-6 алкил, С 1-4 алкокси, фенил, фенилокси или бензилокси, каждый из которых незамещен или замещен галогеном, гидрокси, метокси, этокси или нитро, и R7 представляет собой С 1-4 алкил или незамещенный или замещенный С 1-4 алкилом фенил; А представляет собой -(CH2)n- или -CH2CH=CHCH2-, где n является целым числом от 2 до 4;R4 представляет собой водород и R5 представляет собой водород или бензоил, незамещенный или замещенный одной или более группами, выбранными из галогена, гидрокси, С 1-4 алкокси или нитро, в бензольном кольце, или в том случае, когда R4 и R5 вместе с N образуют кольцо, то R4 и R5 образуют двухвалентный фрагмент, где R8 представляет собой водород или С 1-6 алкил; каждый из l и m независимо представляет собой целое число от 2 до 4 и р представляет собой целое число, имеющее значение 0 или 1,или его фармацевтически приемлемая соль. 3. Соединение по п.1, которое выбирают из группы, состоящей из 3-3-[4-(3-аминопропиламино)бутиламино]пропил-1 Н-хиназолин-2,4-диона; 3-(3-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутиламинопропил)-1 Нхиназолин-2,4-диона; хиназолин-3-ил)пропил]-4-метилбензолсульфониламинобутил)-4-метилбензолсульфонамида и 3-(3-4-[3-(2,5-диоксопирролидин-1-ил)пропиламино]бутиламинопропил)-1 Н-хиназолин-2,4 диона,или его фармацевтически приемлемая соль. 4. Соединение по п.1, которое представляет собой N-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)пропил]-N-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутилацетамид или его фармацевтически приемлемую соль. 5. Соединение по п.1, которое представляет собой 3-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)пропиламино]бутил-1 Н-хиназолин-2,4-дион или его фармацевтически приемлемую соль. 6. Соединение по п.1, которое представляет собой 3-3-[4-(N-[3-(2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)пропил]-N-бензиламино)бутиламино]пропил-1 Н-хиназолин-2,4-дион или его фармацевтически приемлемую соль. 7. Соединение по п.1, которое представляет собой N-[3-(ацетил-4-[3-(2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)пропиламино]бутиламино)пропил]-4-гидроксибензамид или его фармацевтически приемлемую соль. 8. Соединение по п.1, которое представляет собой N-[3-(4-ацетил-[3-(2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)пропил]аминобутиламино)пропил]-4-гидроксибензамид или его фармацевтически приемлемую соль. 9. Соединение по п.1, которое представляет собой 3-(2-3-[2-(2,4-диоксо-1,4-дигидро-2 Нхиназолин-3-ил)этиламино]пропиламиноэтил)-1 Н-хиназолин-2,4-дион или его фармацевтически приемлемую соль. 10. Соединение по п.1, которое представляет собой трет-бутиловый эфир [3-(2,4-диоксо-1,4 дигидро-2 Н-хиназолин-3-ил)пропил]-(4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)пропил]гексиламинобутил)карбаминовой кислоты или его фармацевтически приемлемую соль. 11. Соединение по п.1, которое представляет собой бензиловый эфир [3-(2,4-диоксо-1,4-дигидро 2 Н-хиназолин-3-ил)пропил]-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)пропиламино]бутилкарбаминовой кислоты или его фармацевтически приемлемую соль. 12. Соединение по п.1, которое представляет собой N-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3 ил)пропил]-N-4-[3-(2,4-диоксо-1,4-дигидро-2 Н-хиназолин-3-ил)пропиламино]бутил-4 метилбензолсульфонамид или его фармацевтически приемлемую соль. 13. Способ получения соединения формулы (IX), включающий стадию взаимодействия соединения формулы (IV) с аминосоединением формулы (V) с получением соединения формулы (IX) в присутствии или в отсутствие растворителейR4 и R5 представляют собой атомы водорода или в том случае, когда R4 и R5 вместе с N образуют кольцо, то R4 и R5 образуют двухвалентный фрагментL представляет собой уходящую группу. 14. Способ получения соединения формулы (IX) по п.13, где соединение формулы (IV) представляет собой этил-2-этоксикарбониламинобензоат, который получают посредством реакции этил-2 аминобензоата формулы (II) с этилхлорформиатом формулы (III) в органическом растворителе 15. Способ получения соединения формулы (IX), включающий стадию взаимодействия первичного аминосоединения формулы (VI) с соединением формулы (VII) или формулы (VIII) с получением соеди- 24018142Y' образуют кольцо, то Y и Y' образуют -О-. 16. Способ получения соединения формулы (Ia), в котором по меньшей мере один из R2 и R3 не является водородом, путем замены по меньшей мере одного водорода вторичного аминосоединения формулы (IX) на R2, R3 или R2 и R3 где R2, R3, R4, R5, A, l, m и p являются такими, как определено в п.1, при условии, что R5 не является водородом. 17. Способ получения соединения формулы (I), в которой R1 представляет собой С 1-6 алкил, включающий стадию взаимодействия соединения формулы (Ia) с алкилирующим агентом и, при необходимости, удаления защитной группы, с получением соединения формулы (I), в которой R1 представляет собой где R1, R2, R3, R4, R5, A, l, m и p являются такими, как определено в п.1, при условии, что R1 и R5 не являются атомами водорода. 18. Фармацевтическая композиция для защиты нервных клеток или для предотвращения или лечения неврологического заболевания мозга, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль. 19. Фармацевтическая композиция для предотвращения или лечения дегенеративного неврологического заболевания мозга, содержащая в качестве активного ингредиента соединение по любому из пп.112 или его фармацевтически приемлемую соль. 20. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль, для предотвращения или лечения заболевания, которое выбирают из неврологической дисфункции, потери памяти, недостаточности мозгового кровообращения, локального повреждения головного мозга, очаговой травмы головного мозга, диффузной травмы головного мозга, повреждения спинного мозга, ишемии головного мозга, кровоизлияния в мозг, ишемического инсульта, геморрагического инсульта, деменции, церебрального инфаркта, эмболической окклюзии, тромботической окклюзии, реперфузии, развивающейся после острой ишемии, прехо- 25018142 дящей ишемической атаки, перинатального гипоксически-ишемического повреждения, остановки сердца, внутричерепного кровотечения, субарахноидального кровоизлияния, аневризмы сосудов головного мозга, аневризмы Виллизия, острой детской церебральной гемиплегии, "хлыстовой" травмы, синдрома тряски младенца, болезни Альцгеймера, болезни Пика, деменции с тельцами Леви, прогрессирующего супрануклеарного паралича (синдром Стила-Ричардсона), мультисистемной дегенерации (синдром ШайДрагера), хронических эпилептических состояний, сопутствующих нейродегенерации, болезней двигательных нейронов, амиотрофического бокового склероза, первичного латерального склероза, дегенеративных атаксий, корково-базальной дегенерации, подострого склерозирующего панэнцефалита, болезни Гантингтона, болезни Паркинсона, синуклеопатий, первичной прогрессирующей афазии, спинальной мышечной атрофии и спинобульбарной мышечной атрофии (болезнь Кеннеди), рассеянного склероза,болезни Тея-Сакса, спастической параплегии, прионного заболевания, болезни Крейтцфельдта-Якоба,эпилепсии, плексопатии или невропатии. 21. Фармацевтическая композиция для предотвращения или лечения инсульта, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль. 22. Фармацевтическая композиция для предотвращения или лечения болезни Альцгеймера, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль. 23. Фармацевтическая композиция для предотвращения или лечения эпилепсии, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль. 24. Фармацевтическая композиция для улучшения памяти, содержащая в качестве активного ингредиента соединение по любому из пп.1-12 или его фармацевтически приемлемую соль.
МПК / Метки
МПК: C07D 239/96
Метки: производное, поражением, обусловленного, нерва, черепно-мозгового, заболевания, лекарственные, основе, композиции, профилактики, хиназолин-2,4-диона, лечения
Код ссылки
<a href="https://eas.patents.su/27-18142-proizvodnoe-hinazolin-24-diona-i-lekarstvennye-kompozicii-na-ego-osnove-dlya-profilaktiki-i-lecheniya-zabolevaniya-obuslovlennogo-porazheniem-cherepno-mozgovogo-nerva.html" rel="bookmark" title="База патентов Евразийского Союза">Производное хиназолин-2,4-диона и лекарственные композиции на его основе для профилактики и лечения заболевания, обусловленного поражением черепно-мозгового нерва</a>
Предыдущий патент: Система и способ анализа флюидов в месте заложения скважины
Следующий патент: Устройство отображения на лобовом стекле
Случайный патент: Керамическая масса












