Лекарственные средства для лечения хронического обструктивного заболевания лёгких
Номер патента: 8665
Опубликовано: 29.06.2007
Авторы: Шолленберггер Германн, Шнапп Андреас, Буассу Тьерри, Хёнке Кристоф, Конетцки Инго, Хайне Клаудиа, Лустенбергер Филиппо, Шромм Курт, Бютнер Франк, Пестель Забине, Рудольф Клаус
Формула / Реферат
1. Применение соединений общей формулы 1
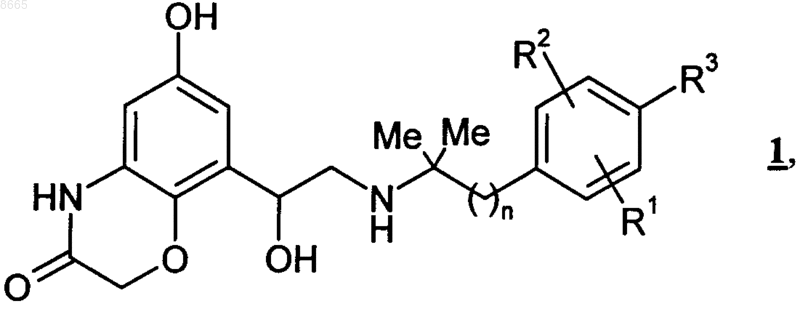
в которой
n обозначает 1 или 2,
R1 обозначает водород, С1-С4алкил, галоген, ОН или -O-С1-С4алкил,
R2 обозначает водород, С1-С4алкил, галоген, ОН или -O-С1-С4алкил и
R3 обозначает водород, С1-С4алкил, ОН, галоген, -O-С1-С4алкил, -O-С1-С4алкилен-СООН или -О-С1-С4алкилен-СО-О-С1-С4алкил,
для получения лекарственного средства, предназначенного для лечения хронического обструктивного заболевания легких (ХОЗЛ).
2. Применение соединений общей формулы 1 по п.1, в которой n обозначает 1 или 2, R1 обозначает водород, галоген или С1-С4алкил, R2 обозначает водород, галоген или С1-С4алкил, a R3 обозначает водород, С1-С4алкил, ОН, галоген, -О-С1-С4алкил, -O-С1-С4алкилен-СООН или -O-С1-С4алкилен-СО-O-С1-С4алкил, для получения лекарственного средства, предназначенного для лечения ХОЗЛ.
3. Применение соединений общей формулы 1 по п.1 или 2, в которой n обозначает 1 или 2, R1 обозначает водород, фтор, хлор или метил, R2 обозначает водород, фтор, хлор или метил, a R3 обозначает водород, С1-С4алкил, ОН, фтор, хлор, бром, -O-С1-С4алкил, -O-С1-С4алкилен-СООН, -O-С1-С4алкилен-СО-O-С1-С4алкил, для получения лекарственного средства, предназначенного для лечения ХОЗЛ.
4. Применение соединений общей формулы 1 по п.1 или 2, в которой n обозначает 1 или 2, R1 обозначает водород, метил или этил, R2 обозначает водород, метил или этил, a R3 обозначает водород, метил, этил, ОН, метоксигруппу, этоксигруппу, -О-СН2-СООН, -О-СН2-СО-О-метил или -О-СН2-СООэтил, для получения лекарственного средства, предназначенного для лечения ХОЗЛ.
5. Применение соединений общей формулы 1 по одному из пп.1-4, в которой n обозначает 1 или 2, R1 обозначает водород или метил, R2 обозначает водород или метил, a R3 обозначает водород, метил, ОН, метоксигруппу, -О-СН2-СООН или -О-СН2-СООэтил, для получения лекарственного средства, предназначенного для лечения ХОЗЛ.
6. Применение соединений общей формулы 1 по одному из пп.1-5, которые представлены в виде их индивидуальных оптических изомеров, смесей индивидуальных энантиомеров или рацематов, предпочтительно в виде энантиомерночистых соединений.
7. Применение соединений общей формулы 1 по одному из пп.1-6, которые представлены в виде их кислотно-аддитивных солей с фармакологически приемлемыми кислотами, а также при определенных условиях в виде сольватов и/или гидратов.
8. Соединения общей формулы 1
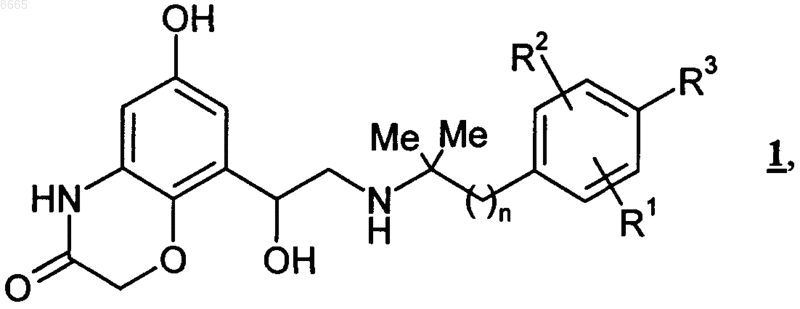
в которой
n обозначает 1,
R1 обозначает водород, галоген, С1-С4алкил или -O-С1-С4алкил,
R2 обозначает водород, галоген, С1-С4алкил или -O-С1-С4алкил и
R3 обозначает С1-С4алкил, ОН, галоген, -O-С1-С4алкил, -O-С1-С4алкилен-СООН, -О-С1-С4алкилен-СО-О-С1-С4алкил,
при условии, что если каждый из R1 и R2 обозначает ортометил, R3 не может одновременно представлять собой ОН.
9. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 обозначает водород, фтор, хлор, метил или метоксигруппу, R2 обозначает водород, фтор, хлор, метил или метоксигруппу, a R3 обозначает С1-С4алкил, ОН, фтор, хлор, бром, -О-С1-С4алкил, -О-С1-С4алкилен-СООН, -O-С1-С4алкилен-СО-О-С1-С4алкил, при условии, что если R1 и R2 каждый обозначает соответственно ортометил, R3 не может одновременно представлять собой ОН.
10. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 обозначает водород или С1-С4алкил, R2 обозначает водород или С1-С4алкил, a R3 обозначает С1-С4алкил, ОН, -O-С1-С4алкил, -O-С1-С4алкилен-СООН или -O-С1-С4алкилен-СО-O-С1-С4алкил, при условии, что если R1 и R2 каждый обозначает соответственно ортометил, R3 не может одновременно представлять собой ОН.
11. Соединения общей формулы 1, по п.8, в которой n обозначает 1, R1 обозначает водород, метил или этил, R2 обозначает водород, метил или этил, а R3 обозначает метил, этил, ОН, метоксигруппу, этоксигруппу, -О-СН2-СООН, -О-СН2-СООметил или -О-СН2-СООэтил, при условии, что если R1 и R2 каждый обозначает соответственно ортометил, R3 не может одновременно представлять собой ОН.
12. Соединения общей формулы 1 по одному из пп.8-11, в которой R3 обозначает метоксигруппу, этоксигруппу, -О-СН2-СООН, -О-СН2-СООметил или -О-СН2-СООэтил, a R1, R2 и n могут иметь значения, указанные в пп.8-11.
13. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 обозначает галоген, С1-С4 алкил или -O-С1-С4алкил, R2 обозначает галоген, С1-С4алкил или -O-С1-С4алкил, a R3 обозначает галоген, С1-С4алкил или -O-С1-С4алкил.
14. Соединения общей формулы 1 по п.13, в которой n обозначает 1, R1 обозначает фтор, хлор, метил или метоксигруппу, R2 обозначает фтор, хлор, метил или метоксигруппу, a R3 обозначает фтор, хлор, метил или метоксигруппу.
15. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 обозначает водород, R2 обозначает водород, фтор, хлор или метил, a R3 обозначает метил, этил, изопропил, трет-бутил, ОН, фтор, хлор, бром, метоксигруппу, этоксигруппу, -О-СН2-СООН, -O-CH2-CH2-COOH, -O-СН2-СН2-СН2-СООН,
-O-СН2-СООметил, -O-СН2-СООэтил, -O-СН2-СН2-СООметил, -O-СН2-СН2-СООэтил, -O-СН2-СН2-СН2-СООметил, -O-СН2-СН2-СН2-СООэтил.
16. Соединения общей формулы 1 по п.15, в которой n обозначает 1, R1 обозначает водород, R2 обозначает водород, фтор, хлор или метил, a R3 обозначает ОН, фтор, хлор, метил, метоксигруппу, этоксигруппу или -O-СН2-СООН.
17. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 и R2 обозначают водород, a R3 обозначает метил, этил, изопропил, трет-бутил, ОН, фтор, хлор, бром, метоксигруппу, этоксигруппу,
-О-СН2-СООН, -O-СН2-СН2-СООН, -O-СН2-СН2-СН2-СООН, -O-СН2-СООметил, -O-СН2-СООэтил, -O-СН2-СН2-СООметил, -O-СН2-СН2-СООэтил, -O-СН2-СН2-СН2-СООметил, -O-СН2-СН2-СН2-СООэтил.
18. Соединения общей формулы 1 по п.17, т которой n обозначает 1, R1 и R2 обозначают водород, a R3 обозначает ОН, фтор, хлор, метоксигруппу, этоксигруппу, -О-СН2-СООН, предпочтительно ОН, фтор, хлор, этоксигруппу или метоксигруппу.
19. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 обозначает водород, галоген, С1-С4алкил или -O-С1-С4алкил, R2 обозначает водород, галоген, С1-С4алкил или -O-С1-С4алкил, a R3 обозначает водород.
20. Соединения общей формулы 1 по п.19, в которой n обозначает 1, R1 обозначает водород, фтор, хлор, метил или метоксигруппу, R2 обозначает водород, фтор, хлор, метил или метоксигруппу, a R3 обозначает водород.
21. Соединения общей формулы 1 по одному из пп.8-20, которые представлены в виде их индивидуальных оптических изомеров, смесей индивидуальных энантиомеров или рацематов, предпочтительно в виде энантиомерночистых соединений.
22. Соединения общей формулы 1 по одному из пп.8-21, которые представлены в виде их кислотно-аддитивных солей с фармакологически приемлемыми кислотами, а также при определенных условиях в виде сольватов и/или гидратов.
23. Применение соединений общей формулы 1 по одному из пп.8-22 в качестве лекарственных средств.
24. Применение соединений общей формулы 1 по одному из пп.8-22 для получения лекарственного средства, предназначенного для лечения ХОЗЛ.
25. Фармацевтический препарат, отличающийся тем, что он содержит соединение формулы 1 по одному из пп.8-22.
26. Предназначенный для ингаляции фармацевтический препарат, отличающийся тем, что он содержит соединение формулы 1 по одному из пп.8-22.
27. Предназначенный для ингаляции фармацевтический препарат по п.26, отличающийся тем, что он выбран из группы, включающей ингаляционные порошки, содержащие пропеллент дозируемые аэрозоли и не содержащие пропеллент ингаляционные растворы.
Текст
008665 Настоящее изобретение относится к применению соединений общей формулы 1 в которой остатки R1, R2 и R3 могут иметь указанные в формуле изобретения и в последующем описании значения, для получения лекарственного средства, предназначенного для лечения хронического обструктивного заболевания легких (ХОЗЛ), а также к новым соединениям общей формулы 1 и к способу их получения. Предпосылки создания изобретения Бетамиметики (-адренергические вещества) известны из уровня техники. При этом, например,можно сослаться на патент US 4460581, в котором бетамиметики предлагаются для терапии самых разнообразых заболеваний. Для медикаментозной терапии различных заболеваний часто желательно располагать лекарственными средствами, обладающими продолжительным действием. За счет этого, как правило, удается в течение длительного промежутка времени обеспечить поддержание в организме необходимой для достижения терапевтического эффекта концентрации действующего вещества без необходимости излишне частого повторного введения лекарственного средства. В остальном же введение в организм действующего вещества с меньшей периодичностью в значительной степени способствует хорошему самочувствию пациента. Наиболее желательно при этом располагать лекарственным средством, которое позволяло бы достигать требуемого терапевтического эффекта при его однократном введении в организм в день(т.е. лекарственным средством, рассчитанным на однократный прием в день). Преимущество, связанное с применением лекарственного препарата только один раз в день, состоит в удобстве подобной схемы лечения для пациента благодаря сравнительно быстрому его привыканию к регулярному приему медикамента в определенное время суток. С учетом вышеизложенного в основу настоящего изобретения была положена задача предложить бетамиметики, которые при лечении ХОЗЛ проявляли бы требуемую терапевтическую эффективность и отличались бы, кроме того, длительным действием и тем самым могли бы использоваться для получения лекарственных средств длительного (пролонгированного) действия. Задача изобретения состояла прежде всего в том, чтобы предложить бетамиметики, которые благодаря их длительному действию можно было бы применять для получения предназначенного для терапии ХОЗЛ лекарственного средства, рассчитанного на однократное в сутки введение в организм. Наряду с вышеуказанными задачами еще одна задача изобретения состояла в том, чтобы предложить бетамиметики, которые обладали бы не только высокой эффективностью, но и высокой степенью селективности по отношению к 2-адренорецептору. Подробное описание изобретения Согласно изобретению неожиданно было установлено, что указанные выше задачи позволяют решить соединения общей формулы 1R3 обозначает водород, С 1-С 4 алкил, ОН, галоген, -О-С 1-С 4 алкил,-O-С 1-С 4 алкилен-СООН или -O-С 1-С 4 алкилен-СО-O-С 1-С 4 алкил, для получения лекарственного средства, предназначенного для лечения хронического обструктивного заболевания легких (ХОЗЛ). Предпочтительно применение соединений общей формулы 1, в которой n обозначает 1 или 2, R1 обозначает водород, галоген или С 1-С 4 алкил, R2 обозначает водород, галоген или С 1-С 4 алкил, a R3 обозначает водород, С 1-С 4 алкил, ОН, галоген, -О-С 1-С 4 алкил, -O-С 1-С 4 алкилен-СООН или -О-С 1-С 4 алкиленСО-О-С 1-С 4 алкил, для получения лекарственного средства, предназначенного для лечения ХОЗЛ. Предпочтительно далее применение соединений общей формулы 1, в которой n обозначает 1 или 2,R1 обозначает водород, фтор, хлор или метил, R2 обозначает водород, фтор, хлор или метил, a R3 обозначает водород, С 1-С 4 алкил, ОН, фтор, хлор, бром, -O-С 1-С 4 алкил, -О-С 1-С 4 алкилен-СООН, -О-С 1-С 4 алкилен-СО-О-С 1-С 4 алкил, для получения лекарственного средства, предназначенного для лечения ХОЗЛ. Особенно предпочтительно применение соединений общей формулы 1, в которой n обозначает 1 или 2, R1 обозначает водород, метил или этил, R2 обозначает водород, метил или этил, a R3 обозначает водород, метил, этил, ОH, метоксигруппу, этоксигруппу, -О-СН 2-СООН, -О-СН 2-СО-О-метил или -О-1 008665 СН 2-СООэтил, для получения лекарственного средства, предназначенного для лечения ХОЗЛ. Особенно предпочтительно также применение соединений общей формулы 1, в которой n обозначает 1 или 2, R1 обозначает водород или метил, R2 обозначает водород или метил, a R3 обозначает водород, метил, ОН, метоксигруппу, -О-СН 2-СООН или -О-СН 2-СООэтил, для получения лекарственного средства, предназначенного для лечения ХОЗЛ. Особенно важное значение имеет согласно изобретению применение соединений общей формулы 1,в которой n обозначает 1 или 2, R1 обозначает водород или метил, R2 обозначает водород или метил, a R3 обозначает водород, ОН, метоксигруппу или -О-СН 2-СООН, для получения лекарственного средства,предназначенного для лечения ХОЗЛ. В одном из предпочтительных вариантов осуществления изобретения предусматривается применение соединений общей формулы 1, в которых n обозначает 1, а остатки R1, R2 и R3 могут иметь указанные выше значения, для получения лекарственного средства, предназначенного для лечения ХОЗЛ. В другом предпочтительном варианте осуществления изобретения предлагается применение соединений общей формулы 1, в которых n обозначает 1 или 2, R3 обозначает остаток, выбранный из группы,включающей водород, ОН, -O-С 1-С 4 алкил и-O-С 1-С 4 алкилен-СООН, а остатки R1 и R2 могут иметь указанные выше значения, для получения лекарственного средства, предназначенного для лечения ХОЗЛ. Еще в одном из предпочтительных вариантов осуществления изобретения предлагается применение соединений общей формулы 1, в которых n обозначает 2, R1 и R2 обозначают водород, а остаток R может иметь указанные выше значения, для получения лекарственного средства, предназначенного для лечения ХОЗЛ. В соединениях формулы 1 остатки R1 и R2, если они не обозначают водород, могут находиться соответственно в орто- либо мета-положении по отношению к бензильной СН 2-группе. Если ни один из остатков R1 и R2 не обозначает водород, то предпочтительно согласно изобретению применение таких соединений формулы 1, в которых оба остатка R1 и R2 находятся либо в орто-, либо в мета-положении,при этом особенно предпочтительно применение таких соединений, в которых оба остатка R1 и R2 находятся в орто-положении. В соединениях формулы 1, в которых один из остатков R1 и R2 обозначает не водород, этот остаток может находиться в орто- либо мета-положении по отношению к бензильной СН 2-группе. В этом случае предпочтительно согласно изобретению прежде всего применение таких соединений формулы 1, в которых остаток R1 или R2, обозначающий не водород, находится в орто-положении. Еще в одном варианте осуществления настоящего изобретения предусматривается указанное выше применение соединений формулы 1 в виде их индивидуальных оптических изомеров, смесей индивидуальных энантиомеров или рацематов. Особенно предпочтительно при этом указанное выше применение соединений формулы 1 в виде энантиомерночистых соединений, причем исключительное значение придается согласно изобретению применению R-энантиомеров соединений формулы 1. В другом варианте осуществления настоящего изобретения предусматривается указанное выше применение соединений формулы 1 в виде их кислотно-аддитивных солей с фармакологически приемлемыми кислотами, а также при определенных условиях в виде сольватов и/или гидратов. Настоящее изобретение относится также, как указывалось выше, к применению предлагаемых в нем соединений общей формулы 1 для получения лекарственного средства, предназначенного для лечения ХОЗЛ при его одноразовом введении в сутки. Настоящее изобретение относится далее к способу лечения ХОЗЛ, который отличается тем, что одно или несколько указанных выше соединений общей формулы 1 вводят в организм пациента в терапевтически эффективном количестве. Настоящее изобретение относится далее к способу лечения ХОЗЛ,который отличается тем, что одно или несколько указанных выше соединений общей формулы 1 вводят в организм пациента в терапевтически эффективном количестве один раз в сутки. Соединения общей формулы 1 частично известны из уровня техники. В этом отношении можно сослаться на патент US 4460581. Однако целый ряд соединений общей формулы 1 до настоящего времени в уровне техники не упоминался. В соответствии с этим объектом настоящего изобретения являются именно такие новые соединения формулы 1. С учетом этого настоящее изобретение относится к соединениям общей формулы 1R3 обозначает С 1-С 4 алкил, ОН, галоген, -О-С 1-С 4 алкил, -О-С 1-С 4 алкилен-СООН, -О-С 1-С 4 алкилен-2 008665 СО-О-С 1-С 4 алкил,при условии, что если каждый из R1 и R2 обозначает ортометил, R3 не может одновременно представлять собой ОН. К предпочтительным относятся соединения общей формулы 1, в которой n обозначает 1, R1 обозначает водород, фтор, хлор, метил или метоксигруппу, R2 обозначает водород, фтор, хлор, метил или метоксигруппу, a R3 обозначает С 1-С 4 алкил, ОН, фтор, хлор, бром, -О-С 1-С 4 алкил, -O-С 1-С 4 алкилен-СООН,-О-С 1-С 4 алкилен-СО-О-С 1-С 4 алкил, при условии, что если R1 и R2 каждый обозначает соответственно ортометил, R3 не может одновременно представлять собой ОН. Предпочтительными далее являются соединения общей формулы 1, в которой n обозначает 1, R1 обозначает водород или С 1-С 4 алкил, R2 обозначает водород или С 1-С 4 алкил, a R3 обозначает С 1-С 4 алкил,ОН, -O-С 1-С 4 алкил, -О-С 1-С 4 алкилен-СООН или -О-С 1-С 4 алкилен-СО-О-С 1-С 4 алкил, при условии, что если R1 и R2 каждый обозначает соответственно ортометил, R3 не может одновременно представлять собой ОН. К предпочтительным относятся также соединения общей формулы 1, в которой n обозначает 1, R1 обозначает водород, метил или этил, R2 обозначает водород, метил или этил, a R3 обозначает метил, этил,ОН, метоксигруппу, этоксигруппу, -O-СН 2-СООН, -O-СН 2-СООметил или -O-СН 2-СООэтил, при условии, что если R1 и R2 каждый обозначает соответственно ортометил, R3 не может одновременно представлять собой ОН. Предпочтительными являются также соединения общей формулы 1, в которой n обозначает 1, R1 обозначает водород или метил, R2 обозначает водород или метил, a R3 обозначает метил, ОН, метоксигруппу, -O-СН 2-СООН или -O-СН 2-СООэтил, при условии, что если R1 и R2 каждый обозначает соответственно ортометил, R3 не может одновременно представлять собой ОН. К предпочтительным согласно изобретению относятся далее соединения общей формулы 1, в которой R3 обозначает метоксигруппу, этоксигруппу, -O-СН 2-СООН, -O-СН 2-СООметил или -O-СН 2 СООэтил, a R1, R2 и n могут иметь значения, указанные выше. Настоящее изобретение относится далее к соединениям общей формулы 1, в которой n обозначает 1, R1 обозначает галоген, С 1-С 4 алкил или -O-С 1-С 4 алкил, R2 обозначает галоген, С 1-С 4 алкил или -O-С 1 С 4 алкил, a R3 обозначает галоген, С 1-С 4 алкил или -О-С 1-С 4 алкил. Настоящее изобретение относится далее к соединениям общей формулы 1, в которой n обозначает 1, R1 обозначает фтор, хлор, метил или метоксигруппу, R2 обозначает фтор, хлор, метил или метоксигруппу, a R3 обозначает фтор, хлор, метил или метоксигруппу. Предпочтительными согласно настоящему изобретению являются также соединения общей формулы 1, в которой n обозначает 1, R1 обозначает водород, R2 обозначает водород, фтор, хлор или метил, a R3 обозначает метил, этил, изопропил, трет-бутил, ОН, фтор, хлор, бром, метоксигруппу, этоксигруппу, -OСН 2-СООН, -O-СН 2-СН 2-СООН, -O-СН 2-СН 2-СН 2-СООН, -O-СН 2-СООметил, -O-СН 2-СOOэтил, -O-СН 2 СН 2-СООметил, -O-СН 2-СН 2-СООэтил, -O-СН 2-СН 2-СН 2-СООметил,-O-СН 2-СН 2-СН 2-СООэтил. К особенно предпочтительным относятся далее соединения общей формулы 1, в которой n обозначает 1, R1 обозначает водород, R2 обозначает водород, фтор, хлор или метил, a R3 обозначает ОН, фтор,хлор, метил, метоксигруппу, этоксигруппу или -O-СН 2-СООН. Особенно предпочтительны согласно изобретению также соединения общей формулы 1, в которойn обозначает 1, R1 обозначает водород, R2 обозначает галоген, С 1-С 4 алкил или -О-С 1-С 4 алкил, предпочтительно фтор, хлор, метоксигруппу или метил, a R3 обозначает галоген, С 1-С 4 алкил или -O-С 1-С 4 алкил,предпочтительно фтор, хлор, метоксигруппу или метил. К предпочтительным согласно настоящему изобретению относятся также соединения общей формулы 1, в которой n обозначает 1, R1 и R2 обозначают водород, а остаток R3 может иметь указанные выше значения. Предпочтительно далее настоящее изобретение относится к соединениям общей формулы 1, в которой n обозначает 1, R1 и R2 обозначают водород, a R3 обозначает метил, этил, изопропил, трет-бутил,ОН, фтор, хлор, бром, метоксигруппу, этоксигруппу, -O-СН 2-СООН, -O-СН 2-СН 2-СООН, -O-СН 2-СН 2 СН 2-СООН, -O-СН 2-СООметил, -O-СН 2-СООэтил, -O-СН 2-СН 2-СООметил,-O-СН 2-СН 2-СООэтил, -OСН 2-СН 2-СН 2-СООметил, -O-СН 2-СН 2-СН 2-СООэтил. Особенно предпочтительными являются соединения общей формулы 1, в которой n обозначает 1,R1 и R2 обозначают водород, a R3 обозначает ОН, фтор, хлор, метоксигруппу, этоксигруппу, -O-СН 2 СООН, предпочтительно ОН, фтор, хлор, этоксигруппу или метоксигруппу. Особенно предпочтительными являются соединения общей формулы 1, в которой n обозначает 1,R1 и R2 обозначают водород, a R3 обозначает фтор, хлор, метоксигруппу или этоксигруппу. Настоящее изобретение относится далее к соединениям общей формулы 1, в которой n обозначает 1, R1 обозначает водород, галоген, С 1-С 4 алкил или -O-С 1-С 4 алкил, R2 обозначает водород, галоген, С 1 С 4 алкил или -O-С 1-С 4 алкил, а R3 обозначает водород. Предпочтительны при этом соединения общей формулы 1, в которой n обозначает 1, R1 обозначает водород, фтор, хлор, метил или метоксигруппу, R2 обозначает водород, фтор, хлор, метил или метоксигруппу, a R3 обозначает водород.-3 008665 Настоящее изобретение относится далее к соединениям общей формулы 1, в которой n обозначает 1, R1 обозначает фтор, хлор, метил или метоксигруппу, R2 обозначает фтор, хлор, метил или метоксигруппу, a R3 обозначает водород. В соединениях формулы 1, остатки R1 и R2 , если они не обозначают водород, могут находиться соответственно в орто- либо мета-положении по отношению к бензильной "СН 2"-группе. Если ни один из остатков R1 и R2 не обозначает водород, то предпочтительны согласно изобретению такие соединения формулы 1, в которых оба остатка R1 и R2 находятся либо в орто-, либо в мета-положении, при этом особенно предпочтительны такие соединения, в которых оба остатка R1 и R2 находятся в орто-положении. В соединениях формулы 1, в которых один из остатков R1 и R2 обозначает не водород, этот остаток может находиться в орто- либо мета-положении по отношению к бензильной "СН 2"-группе. В этом случае предпочтительны согласно изобретению прежде всего такие соединения формулы 1, в которых остатокR1 или R2 , обозначающий не водород, находится в орто-положении. К особенно предпочтительным относятся далее соединения общей формулы 1, выбранные из группы, включающей 6-гидрокси-8-1-гидрокси-2-[2-(4-метоксифенил)-1,1-диметилэтиламино]этил-4 Н-бензо[1,4]оксазин-3-он,6-гидрокси-8-1-гидрокси-2-[2-(4-феноксиэтилацетат)-1,1-диметилэтиламино]этил-4 Н-бензо[1,4] оксазин-3-он,6-гидрокси-8-1-гидрокси-2-[2-(4-феноксиуксусная кислота)-1,1-диметилэтиламино]этил-4 Н-бензо[1,4]оксазин-3-он,8-2-[2-(3,5-дихлорфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он,8-2-[2-(4-хлор-3-метилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4] оксазин-3-он,8-2-[2-(3,4,5-трифторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4] оксазин-3-он,8-2-[2-(3-метилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин 3-он и 8-2-[2-(3,4-дихлорфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он. Настоящее изобретение относится далее к указанным выше новым соединениям формулы 1 в виде их индивидуальных оптических изомеров, смесей индивидуальных энантиомеров или рацематов. Особенно предпочтительны при этом соединения формулы 1 в виде энантиомерночистых соединений, причем исключительное значение придается согласно изобретению R-энантиомерам соединений формулы 1. Методы разделения рацематов на соответствующие энантиомеры известны из уровня техники и аналогичным образом могут использоваться для получения энантиомерночистых R-, соответственно Sэнантиомеров соединений формулы 1. Еще одним объектом настоящего изобретения являются указанные выше предлагаемые в нем соединения формулы 1 в виде их кислотно-аддитивных солей с фармакологически приемлемыми кислотами, а также при определенных условиях в виде сольватов и/или гидратов. Настоящее изобретение относится, как указывалось выше, к новым соединениям формулы 1 для их применения в качестве лекарственных средств. В соответствии с этим настоящее изобретение относится также к применению вышеуказанных новых соединений формулы 1 для получения лекарственного средства, предназначенного для лечения ХОЗЛ. Более конкретно настоящее изобретение относится к применению вышеуказанных новых соединений формулы 1 для получения лекарственного средства, предназначенного для лечения ХОЗЛ при его одноразовом суточном введении. Настоящее изобретение относится далее к способу лечения ХОЗЛ, который заключается в том, что одно или несколько из числа указанных выше новых соединений общей формулы 1 вводят в организм пациента в терапевтически эффективном количестве. Настоящее изобретение относится далее к способу лечения ХОЗЛ, который заключается в том, что одно или несколько из числа указанных выше новых соединений общей формулы 1, вводят в организм пациента в терапевтически эффективном количестве один раз в сутки. Под кислотно-аддитивными солями с фармакологически приемлемыми кислотами согласно настоящему изобретению подразумеваются, например, соли, выбранные из группы, включающей гидрохлорид, гидробромид, гидроиодид, гидросульфат, гидрофосфат, гидрометансульфонат, гидронитрат,гидромалеат, гидроацетат, гидробензоат, гидроцитрат, гидрофумарат, гидротартрат, гидрооксалат, гидросукцинат и гидро-n-толуолсульфонат, предпочтительно гидрохлорид, гидробромид, гидросульфат,гидрофосфат, гидрофумарат и гидрометансульфонат. Среди вышеназванных кислотно-аддитивных солей особенно предпочтительны согласно изобретению соли хлористоводородной кислоты, метансульфоновой кислоты, бензойной кислоты и уксусной кислоты. Соединения общей формулы 1, для их предусмотренного в изобретении применения при определенных условиях могут использоваться в виде их индивидуальных оптических изомеров, смесей индивидуальных энантиомеров или рацематов. При применении соединений в энантиомерночистом виде предпочтительно использовать R-энантиомеры. Согласно настоящему изобретению под алкильными группами подразумеваются, если не указано иное, разветвленные и неразветвленные алкильные группы с 1-4 атомами углерода. В качестве примера таких групп можно назвать метил, этил, пропил или бутил. Для обозначения подобных групп, т.е. метила, этила, пропила или же бутила, в некоторых случаях используются также соответствующие им сокращенные названия Me, Et, Prop или Bu. Если не указано иное, то в понятия "пропил" и "бутил" включены также все возможные изомерные формы каждого из таких остатков. Так, например, в понятие "пропил" включены н-пропил и изопропил, а в понятие "бутил" включены изобутил, втор-бутил и трет-бутил и т.д. Под алкиленовыми группами имеются в виду, если не указано иное, разветвленные и неразветвленные алкильные мостики с двумя связями и с 1-4 атомами углерода. В качестве примера при этом можно назвать метилен, этилен, н-пропилен или н-бутилен.-5 008665 Под алкилоксигруппами (или же соответственно под -О-алкильными группами) подразумеваются,если не указано иное, разветвленные и неразветвленные алкильные группы с 1-4 атомами углерода, присоединенные через атом кислорода. В качестве примера при этом можно назвать метилокси-, этилокси-,пропилокси- или бутилоксигруппу. В некоторых случаях для обозначения таких групп, т.е. метилокси-,этилокси-, пропилокси- или же бутилоксигруппы, используются также соответствующие им сокращенные названия МеО-, ЕtO-, PropO- или BuO-. Если не указано иное, то в понятия "пропилоксигруппа" и"бутилоксигруппа" включены также все возможные изомерные формы каждого из таких остатков. Так,например, в понятие "пропилоксигруппа" включены н-пропилоксигруппа и изопропилоксигруппа, в понятие "бутилоксигруппа" включены изобутилоксигруппа, втор-бутилоксигруппа и трет-бутилоксигруппа и т.д. В некоторых случаях в настоящем описании вместо обозначения "алкилоксигруппа" используется также эквивалентное ему понятие "алкоксигруппа". В соответствии с этим для обозначения таких групп,как метилокси-, этилокси-, пропилокси- или же бутилоксигруппа, в некоторых случаях используются эквивалентные им понятия метокси-, этокси-, пропокси- или бутоксигруппа. Галоген согласно настоящему изобретению представляет собой фтор, хлор, бром или иод. Если не указано иное, то фтор, хлор и бром являются предпочтительными галогенами. Предлагаемые в изобретении соединения можно получать аналогично методам, уже известным из уровня техники. Так, например, ряд соответствующих методов получения известен из патента US 4460581, который в этом отношении включен в настоящее описание в качестве ссылки. Представленные ниже примеры служат более подробной иллюстрацией известных из уровня техники соединений, которые согласно настоящему изобретению могут, как неожиданно было установлено,применяться для терапии ХОЗЛ. Пример 1. 6-Гидрокси-8-1-гидрокси-2-[2-(4-гидрокси-2,6-диметилфенил)-1,1-диметилэтиламино] этил-4 Н-бензо[1,4]оксазин-3-он Это соединение известно из US 4460581. Пример 2. 8-2-[1,1-диметил-3-фенилпропиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он. Это соединение известно из US 4460581. Ниже настоящее изобретение дополнительно поясняется на примерах синтеза предлагаемых в нем соединений. Очевидно, что такие примеры носят исключительно иллюстративный характер и служат только для пояснения лежащих в основе изобретения принципов, не ограничивая его объем рассмотренными в последующем описании в качестве примеров конкретными вариантами его осуществления. Пример 3. 6-Гидрокси-8-1-гидрокси-2-[2-(4-метоксифенил)-1,1-диметилэтиламино]этил-4 Н-бензо а) 8-2-[1,1-Диметил-2-(4-метоксифенил)этиламино]-1-гидроксиэтил-6-бензилокси-4 Н-бензо[1,4] оксазин-3-он. К раствору 3,6 г 1,1-диметил-2-(4-метилоксифенил)этиламина в 100 мл этанола добавляют при 70 С 7,5 г глиоксальгидрата (6-бензилокси-4 Н-бензо[1,4]оксазин-3-она) и оставляют на 15 мин для перемешивания компонентов. Затем в течение 30 мин при 10-20 С добавляют 1 г борогидрида натрия. Далее перемешивают в течение 1 ч, примешивают 10 мл ацетона и продолжают перемешивание еще в течение 30 мин. Затем реакционную смесь разбавляют 150 мл этилацетата, промывают водой, сушат сульфатом натрия и концентрируют. Остаток растворяют в 50 мл метанола и 100 мл этилацетата и подкисляют концентрированной соляной кислотой. После добавления 100 мл диэтилового эфира продукт выпадает в осадок. Выпавшие кристаллы отфильтровывают, промывают и перекристаллизовывают в 50 мл этанола. Выход: 7 г (68%, гидрохлорид), tпл 232-234C. б) 8-2-[1,1-Диметил-2-(4-метоксифенил)этиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он.-6 008665 6,8 г полученного выше бензильного соединения при комнатной температуре и нормальном давлении гидрируют в 125 мл метанола при добавлении 1 г палладия на угле (5%-ного). Затем катализатор отфильтровывают и из фильтрата удаляют растворитель. После перекристаллизации остатка в 50 мл ацетона и небольшом количестве воды получают твердое вещество, которое отфильтровывают и промывают. Выход: 5,0 г (89%, гидрохлорид), tпл 155-160C.(R)- и (S)-энантиомеры указанного в заголовке примера 3 соединения можно получать, например, с помощью хиральной ЖХВР (жидкостной хроматографии высокого разрешения) (например, колонка:Chirobiotic T, 250 х 22,1 мм, фирма Astec). В качестве подвижной фазы можно использовать метанол с 0,05% триэтиламина и 0,05% уксусной кислоты. В качестве материала для колонки можно применять силикагель с крупностью частиц 5 мкм, с которым ковалентной связью связан гликопротеин тейкопланин. Время удерживания для (R)-энантиомер составляет 40,1 мин, а для (S)-энантиомера - 45,9 мин. По этому методу оба энантиомера получают в виде свободных оснований. Исключительное значение придается согласно изобретению R-энантимеру соединения из примера 3. Пример 4. 6-Гидрокси-8-1-гидрокси-2-[2-(4-феноксиэтилацетат)-1,1-диметилэтиламино]этил-4 Нбензо[1,41 оксазин-3-он[1.4]оксазин-3-он. По аналогично описанной в примере 3 а) методике из 15 г глиоксальгидрата (6-бензилокси-4 Н-бензо[1,4]оксазин-3-он. 8 г полученного выше бензилового спирта растворяют в 100 мл этанола, 100 мл метанола и 10 мл воды и гидрируют в присутствии 1 г палладия на угле (5%-ного). После поглощения рассчитанного теоретически количества водорода катализатор отфильтровывают и фильтрат концентрируют. Выкристаллизовавшийся при отгонке растворителя продукт отделяют вакуум-фильтрацией и промывают. Выход: 5,5 г (81%, гидрохлорид), tпл 137-140 С.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным из уровня техники методам разделения рацематов. Пример 5. 6-Гидрокси-8-1-гидрокси-2-[2-(4-феноксиуксусная кислота)-1,1-диметилэтиламино] этил-4 Н-бензо[1,4]оксазин-3-он. 11 г гидрохлорида 8-2-[1,1-диметил-2-(4-феноксиэтилацетат)этиламино]-1-гидроксиэтил-6-бензилокси-4 Н-бензо[1,4]оксазин-3-она (пример 4 а растворяют в 125 мл метанола и гидрируют в присутствии 1 г палладия на угле (5%-ного). После поглощения рассчитанного теоретически количества водорода катализатор отфильтровывают. К фильтрату добавляют 2,6 г гидроксида натрия, растворенного в 20 мл воды. Далее в течение 30 мин нагревают с обратным холодильником, метанол отгоняют и примешивают 10 мл воды, 20 мл н-бутанола и 3,9 мл уксусной кислоты. Выпавшее в осадок твердое вещество отделяют вакуум-фильтрацией и промывают диэтиловым эфиром. Выход: 7 г (87%). Перекристаллизацией из 0,5-молярной соляной кислоты получают указанный гидрохлорид с tпл 152C.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 6. 8-2-[1,1-Диметил-2-(2,4,6-триметилфенил)этиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо[1,4]оксазин-3-он.-7 008665 этанон. 7,2 г глиоксальгидрата (6-бензилокси-4 Н-бензо[1,4]оксазин-3-она) и 3,6 г 1,1-диметил-2-(2,4,6 триметилфенил)этиламина в течение 1 ч нагревают в 100 мл этанола до 70 С. После охлаждения выпавшие кристаллы отфильтровывают и промывают этанолом и диэтиловым эфиром. Выход: 8,6 г (94%), tпл 175C. б) 8-2-[1,1-Диметил-2-(2,4,6-триметилфенил)этиламино]-1-гидроксиэтил-6-бензилокси-4 Н-бензо[1,4]оксазин-3-он. 8,6 г полученного по методике 6 а) шиффова основания растворяют в 100 мл этанола и 20 мл ТГФ, в течение 30 мин при 10-20 С смешивают с 0,7 г борогидрида натрия и перемешивают в течение 1 ч. После добавления 10 мл ацетона перемешивание продолжают в течение последующих 30 мин и затем разбавляют этилацетатом и водой. Выкристаллизовавшийся при подкислении концентрированной соляной кислотой продукт отфильтровывают и промывают. Выход: 7,4 г (80%, гидрохлорид), tпл 235C (разложение). в) 8-2-[1,1-Диметил-2-(2,4,6-триметилфенил)этиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он. 7,4 г полученного на стадии б) бензильного соединения при комнатной температуре и нормальном давлении гидрируют в 125 мл метанола при добавлении 1 г палладия на угле (5%-ного). Затем катализатор отфильтровывают и фильтрат концентрируют. Выкристаллизовавшийся при добавлении ацетона продукт отделяют вакуум-фильтрацией и промывают ацетоном и диэтиловым эфиром. Выход: 5 г (78%, гидрохлорид), tпл 160C (разложение).(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 7. 6-Гидрокси-8-1-гидрокси-2-[2-(4-гидроксифенил)-1,1-диметилэтиламино]этил-4 Нбензо[1,4]оксазин-3-он. а) 8-2-[1,1-Диметил-2-(4-гидроксифенил)этиламино]-1-гидроксиэтил-6-бензилокси-4 Н-бензо[1,4] оксазин-3-он. Указанное в заголовке соединение получают из 10 г глиоксальгидрата (6-бензилокси-4 Н-бензо[1,4] оксазин-3-она) и 4,6 г 1,1-диметил-2-(4-гидроксифенил)этиламина по методике, аналогично описанной в примере 3 а). Выход: 9,0 г (64%, гидрохлорид), tпл 255-258C. б) 8-2-1,1-Диметил-2-(4-гидроксифенил)этиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4] оксазин-3-он. 5,7 г полученного выше по реакции сочетания продукта гидрируют в присутствии 0,6 г палладия на угле (5%-ного) в 100 мл метанола. После поглощения рассчитанного теоретически количества водорода катализатор отфильтровывают и из фильтрата удаляют растворитель. Остаток растворяют при нагревании в этаноле и затем смешивают с диэтиловым эфиром. Выпавший в осадок продукт отделяют вакуумфильтрацией и один раз перекристаллизовывают в воде. Выход: 3,6 г (72%, гидрохлорид), tпл 159-162C.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 8. 6-Гидрокси-8-1-гидрокси-2-[2-(4-изопропилфенил)-1,1-диметилэтиламино]этил-4 Нбензо[1,4]оксазин-3-он. а) 1-(4-Изопропилфенил)-2-метилпропан-2-ол. Взаимодействием соединения Гриньяра, полученного из 20 г (119 ммолей) 4-изопропилбензилхлорида, с 11,4 мл (155 ммолей) ацетона получают данное целевое соединение в виде бесцветного масла. Выход: 13,0 г (57%), масс-спектрометрия: [М+Н]+ =193. б) N-[2-(4-Изопропилфенил)-1,1-диметилэтил]ацетамид. Для получения данного соединения по описанной в примере 9 б) методике проводят реакцию Риттера с использованием 10,2 г (53 ммоля) 1-(4-изопропилфенил)-2-метилпропан-2-ола. Реакционную смесь сливают на смесь воды и льда и подщелачивают едким натром, при этом в осадок выпадает твердое вещество, которое отделяют вакуум-фильтрацией и сушат.-8 008665 Выход: 9,90 г (80%), масс-спектрометрия: [М+Н]+ = 234. в) 2-(4-Изопропилфенил)-1,1-диметилэтиламин. Данное соединение получают по методике, аналогично описанной в примере 9 в), в результате химического превращения 9,80 г (42 ммоля) N-[2-(4-изопропилфенил)-1,1-диметилэтил]ацетамида. Выход: 7,00 г (71%, гидрохлорид), tпл 202-206C. г) 6-Бензилокси-8-1-гидрокси-2-[2-(4-изопропилфенил)-1,1-диметилэтиламино]этил-4 Н-бензо(5,8 ммоля) 2-(4-изопропилфенил)-1,1-диметилэтиламина в течение 1 ч перемешивают при 50-80 С в 40 мл этанола. После охлаждения до комнатной температуры добавляют 0,24 г (6,3 ммоля) борогидрида натрия. Затем оставляют на 1 ч перемешиваться, разбавляют 5 мл ацетона и оставляют для перемешивания компонентов в течение последующих 30 мин. Далее реакционную смесь подкисляют соляной кислотой, смешивают со 100 мл воды и 80 мл этилацетата и подщелачивают аммиаком. Органическую фазу отделяют, сушат сульфатом натрия и удаляют из нее растворитель. Остаток растворяют в 20 мл этилацетата и 10 мл воды, подкисляют концентрированной соляной кислотой и разбавляют диэтиловым эфиром. После добавления способствующего кристаллизации вспомогательного вещества выпавший в осадок твердый продукт отделяют вакуум-фильтрацией и промывают. Продукт представляет собой твердое вещество белого цвета. Выход: 1,7 г (52%, гидрохлорид), tпл 220-222C. д) 6-Гидрокси-8-1-гидрокси-2-[2-(4-изопропилфенил)-1,1-диметилэтиламино]этил-4 Н-бензо[1,4] оксазин-3-он. 1,6 г (3,0 ммоля) 6-бензилокси-8-1-гидрокси-2-[2-(4-изопропилфенил)-1,1-диметилэтиламино] этил-4 Н-бензо[1,4]оксазин-3-она растворяют в метаноле и в присутствии катализатора (палладия на угле)гидрируют при нормальном давлении и комнатной температуре. Затем катализатор отфильтровывают, растворитель отгоняют и остаток выкристаллизовывают в изопропаноле. В результате получают твердое вещество белого цвета. Выход: 1,1 г (85%, гидрохлорид), tпл 248-250C, масс-спектрометрия: [М+Н]+ = 399.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 9. 8-2-[2-(4-Этилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо а) 1 (4-Этилфенил)-2-метилпропан-2-ол. К 39 мл 3-молярного раствора метилмагнийбромида в диэтиловом эфире при охлаждении ледяной баней по каплям добавляют 14,8 г (90 ммолей) 1-(4-этилфенил)пропан-2-она, растворенного в диэтиловом эфире, таким образом, чтобы температура не превышала при этом 30 С. После добавления указанного соединения реакционную смесь в течение 1,5 ч нагревают с обратным холодильником и затем гидролизуют под действием 10%-ного раствора хлорида аммония. После отделения органической фазы водную фазу экстрагируют диэтиловым эфиром. Объединенные эфирные фазы промывают водой, сушат сульфатом натрия и концентрируют. Полученное таким путем масло непосредственно используют на последующей стадии. Выход: 15,5 г (90%). б) N-[2-(4-Этилфенил)-1,1-диметилэтил]ацетамид. К 15,5 г (87 ммолей) 1-(4-этилфенил)-2-метилпропан-2-ола в 4,8 мл (91 ммоль) ацетонитрила и 15 мл ледяной уксусной кислоты в течение 15 мин добавляют по каплям 6,2 мл концентрированной серной кислоты, при этом температура возрастает до 65 С. Затем перемешивают в течение 1 ч, разбавляют ледяной водой и подщелачивают концентрированным едким натром. После дальнейшего 30-минутного перемешивания выпавшее в осадок твердое вещество отделяют вакуум-фильтрацией и промывают водой. Сырой продукт растворяют в этилацетате, сушат сульфатом натрия и концентрируют. Образующееся масло смешивают с петролейным эфиром, при этом в осадок выпадает твердое вещество, которое отфильтровывают и сушат. Выход: 16,3 г (85%), tпл 90-92C. в) 2-(4-Этилфенил)-1,1-диметилэтиламин. 16,3 г (74 ммоля) N-[2-(4-этилфенил)-1,1-диметилэтил]ацетамида и 8,0 г гидроксида калия в течение 15 ч нагревают с обратным холодильником в 60 мл этиленгликоля. Затем реакционную смесь смешивают со смесью льда и воды и трижды экстрагируют этиловым эфиром. Объединенные органические фазы промывают водой, сушат сульфатом натрия и удаляют из них растворитель. Для получения гидрохлори-9 008665 да сырой продукт растворяют в ацетонитриле и последовательно смешивают с раствором соляной кислоты в простом эфире и c диэтиловым эфиром. Выпавшее в осадок твердое вещество отделяют вакуумфильтрацией и сушат. Выход: 11,0 г (69%, гидрохлорид), tпл 165-167C. г) 6-Бензилокси-8-2-[2-(4-этилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо[1,4]оксазин-3-он. Данное целевое соединение получают по методике, описанной в примере 8 г), из 2,14 г (6,0 ммолей) 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она и 1,0 г (5,6 ммоля) 2-(4-этилфенил)-1,1-диметилэтиламина. Продукт представляет собой твердое вещество белого цвета. Выход: 1,7 г (54%, гидрохлорид), tпл 210-214 С. д) 8-2-[2-(4-этилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он. Путем гидрогенолиза 1,45 г (2,75 ммоля) 6-бензилокси-8-2-[2-(4-этилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо[1,4]оксазин-3-она, проводимого по методике, описанной в примере 8 д), получают целевое соединение в виде твердого вещества белого цвета. Выход: 1,07 г (92%, гидрохлорид), tпл 266-269C, масс-спектрометрия: [М+Н]+ = 385.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 10. 8-2-[2-(4-Фтор-3-метилфенил)-1,1-диметилэтиламино 1-1-гидроксиэтил-6-гидрокси 4 Н-бензо[1,4]оксазин-3-он. а) 1-Фтор-2-метил-4-(2-метилпропенил)бензол. 100 мл 0,5-молярного раствора 4-фтор-3-метилфенилмагнийбромида в ТГФ смешивают в течение 30 мин с 4,7 мл (50 ммолей) изопропилальдегида, при этом температура возрастает до 45 С. Смесь в течение 30 мин перемешивают, в течение 1 ч нагревают с обратным холодильником и затем гидролизуют под действием 10%-ного раствора хлорида аммония. После отделения органической фазы проводят экстракцию диэтиловым эфиром. Далее органические фазы объединяют, сушат и концентрируют. Полученный таким путем спирт растворяют в 100 мл толуола, смешивают с 1 г моногидрата n-толуолсульфоновой кислоты и в течение 3 ч нагревают с обратным холодильником с использованием водоотделителя. Реакционную смесь сливают на воду и подщелачивают концентрированным едким натром. После отделения органической фазы эту фазу промывают водой, сушат сульфатом натрия и удаляют из нее растворитель. После фракционной перегонки остатка получают продукт в виде бесцветной жидкости (tпл 8085C/10 мбар). Выход: 4,1 г (50%). б) N-[2-(4-Фтор-3-метилфенил)-1,1-диметилэтил]формамид. К 1,5 г (31 ммоль) цианида натрия в 5 мл ледяной уксусной кислоты по каплям добавляют при 515 С 4,9 мл концентрированной серной кислоты. Затем к смеси примешивают 3,9 г (24 ммоля) 1-фтор-2 метил-4-(2-метилпропенил)бензола, растворенного в 10 мл ледяной уксусной кислоты, и в течение 1 ч перемешивают при 50-60 С. Затем реакционную смесь разбавляют ледяной водой, подщелачивают концентрированным едким натром и экстрагируют дихлорметаном. Органическую фазу сушат сульфатом натрия и в вакууме удаляют из нее растворители. Полученное таким путем масло, слегка окрашенное в желтый цвет, непосредственно используют на последующей стадии. Выход: 4,3 г (87%). в) 2-(4-Фтор-3-метилфенил)-1,1-диметилэтиламин. 4,3 г (20,6 ммоля) N-[2-(4-фтор-3-метилфенил)-1,1-диметилэтил]формамида, 20 мл концентрированной соляной кислоты и 20 мл воды нагревают в течение 2 ч с обратным холодильником. Затем реакционную смесь разбавляют водой, подщелачивают концентрированным едким натром и экстрагируют дихлорметаном. Органические фазы сушат сульфатом натрия и концентрируют. Остаток растворяют в этилацетате, смешивают с раствором соляной кислоты в простом эфире и охлаждают. Выпавшие в осадок кристаллы отделяют вакуум-фильтрацией, промывают диэтиловым эфиром и сушат. Полученный продукт представляет собой твердое вещество белого цвета. Выход: 3,9 г (87%, гидрохлорид), tпл 196198C. г) 6-Бензилокси-8-2-[2-(4-фтор-3-метилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо(2,8 ммоля) 2-(4-фтор-3-метилфенил)-1,1-диметилэтиламина по методике, описанной в примере 8 г), подвергают взаимодействию между собой и перерабатывают. Полученный продукт представляет собой- 10008665 твердое вещество белого цвета. Выход: 0,75 г (47%, гидрохлорид), tпл 228-230C. д) 8-2-[2-(4-Фтор-3-метилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он. Путем гидрирования 0,70 г (1,4 ммоля) 6-бензилокси-8-2-[2-(4-фтор-3-метилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо[1,4]оксазин-3-она получают целевое соединение в виде твердого вещества белого цвета. Выход: 0,50 г (87%, гидрохлорид), tпл 278-280C, масс-спектрометрия: [М+Н]+ = 389.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 11. 8-2-[2-(4-Фтор-2-метилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси 4 Н-бензо[1,4]оксазин-3-он. а) 1-(4-Фтор-2-метилфенил)-2-метилпропиловый эфир уксусной кислоты. 500 мл 0,5-молярного раствора 4-фтор-6-метилфенилмагнийбромида и 23,2 мл (260 ммолей) изопропилальдегида по методике, аналогично описанной в примере 10 а), подвергают взаимодействию между собой. После гидролиза, проводимого под действием 10%-ного раствора хлорида аммония, водную фазу отделяют и экстрагируют диэтиловым эфиром. Объединенные органические фазы сушат сульфатом натрия и концентрируют. Затем полученный таким путем спирт растворяют в 50 мл ацетангидрида, смешивают с 1 мл концентрированной серной кислоты и в течение 3 ч перемешивают при нагревании с обратным холодильником. Реакционную смесь сливают на воду, перемешивают еще в течение 1 ч и устанавливают рН на щелочное значение. Далее экстрагируют дихлорметаном, органические фазы сушат сульфатом натрия и отгоняют растворители. После фракционной перегонки остатка получают продукт в виде бесцветной жидкости (tкип 105-110 С/8 мбар). Выход: 29,0 г (52%). б) N-[2-(4-Фтор-2-метилфенил)-1,1-диметилэтил]формамид. 29,0 г (130 ммолей) 1-(4-фтор-2-метилфенил)-2-метилпропилового эфира уксусной кислоты подвергают химическому превращению и переработке по методике, аналогично описанной в примере 106). Полученный продукт представляет собой масло желтого цвета. Выход: 27,0 г (99%). в) 2-(4-Фтор-2-метилфенил)-1,1-диметилэтиламин. Для получения амина 27,0 г (130 ммолей) N-[2-(4-фтор-2-метилфенил)-1,1-диметилэтил]формамида подвергают химическому превращению по методике, аналогично описанной в примере 10 в). Полученный продукт представляет собой твердое вещество белого цвета. Выход: 15,5 г (55%, гидрохлорид), tпл 277-280 С. г) 6-Бензилокси-8-2-[2-(4-фтор-2-метилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо[1,4]оксазин-3-он. Данное соединение получают по методике, аналогично описанной в примере 8 г), из 0,95 г (2,66 ммоля) бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она и 0,43 г (2,37 ммоля) 2-(4 фтор-2-метилфенил)-1,1-диметилэтиламина. Выход: 0,75 г (55%, гидрохлорид), tпл 233-236C. д) 8-2-[2-(4-Фтор-2-метилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он. Путем дебензилирования 0,70 г (1,36 ммоля) 6-бензилокси-8-2-[2-(4-фтор-2-метилфенил)-1,1 диметилэтиламино]-1-гидроксиэтил-4 Н-бензо [1,4]оксазин-3-она получают целевое соединение в виде твердого вещества белого цвета. Выход: 0,50 г (87%, гидрохлорид), tпл 278-280C, масс-спектрометрия: [М+Н]+ = 389.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 12. 8-2-[2-(2,4-Дифторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо [1,4]оксазин-3-он.- 11008665 20 мин по каплям добавляют 11,0 мл ацетона, разбавленного 50 мл диэтилового эфира. Затем в течение 1,5 ч перемешивают при нагревании с обратным холодильником и далее гидролизуют под действием 10%-ного раствора хлорида аммония. Эфирную фазу отделяют, промывают водой, сушат сульфатом натрия и концентрируют. После фракционной перегонки остатка получают спирт в виде бесцветной жидкости (tкип 70-73 С/2 мбара). Выход: 20,0 г (86%). б) N-[2-(2,4-Дифторфенил)-1,1-диметилэтил]формамид. Данное соединение получают по реакции Риттера взаимодействием с 20 г (110 ммолей) 1-(2,4 дифторфенил)-2-метилпропан-2-ола, осуществляемым по методу, описанному в примере 10 б). Полученный продукт представляет собой масло желтого цвета. Выход: 22,0 г (94%). в) 2-(2,4-Дифторфенил)-1,1-диметилэтиламин. Данное соединение получают в результате химического превращения 22,0 г (100 ммолей) N-[2-(2,4 дифторфенил]-1,1-диметилэтил]формамида по методике, аналогично описанной в примере 10 в). Выход: 16,0 г (72%, гидрохлорид), tnn 201-203C. г) 6-Бензилокси-8-2-[2-(2,4-дифторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо[1,4] оксазин-3-он. Данное соединение получают взаимодействием 0,89 г (2,49 ммоля) бензилокси-8-(2-этокси-2 гидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она с 0,40 г (2,16 ммоля) 2-(2,4-дифторфенил)-1,1-диметилэтиламина, осуществляемым по методике, описанной в примере 8 г). Выход: 0,80 г (62%, гидрохлорид), tпл 245-247C. д) 8-2-[2-(2,4-Дифторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4] оксазин-3-он. Путем гидрогенолиза 0,70 г (1,35 ммоля) 6-бензилокси-8-2-[2-(2,4-дифторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо[1,4]оксазин-3-она получают целевое соединение в виде твердого вещества белого цвета. Выход: 0,48 г (83%, гидрохлорид), tпл 279-280C, масс-спектрометрия: [М+Н]+ = 393.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 13. 8-2-[2-(3,5-Дифторфенил)1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо[1,4]оксазин-3-он. а) 1-(3,5-Дифторфенил)-2-метилпропан-2-ол. Данное целевое соединение получают взаимодействием соединения Гриньяра, полученного из 25,0 г (121 ммоль) 3,5-дифторбензилбромида, с 12,6 мл (171 ммоль) ацетона. Полученное таким путем соединение представляет собой масло желтого цвета. Выход: 13,5 г (60%). б) 2-(3,5-Дифторфенил)-1,1-диметилэтиламин. По реакции Риттера с использованием 5,5 г (29,5 ммоля) 1-(3,5-дифторфенил)-2-метилпропан-2-ола и 1,8 г цианида натрия получают 7,0 г формамида, который с целью отщепления формильной группы обрабатывают соляной кислотой. Полученный продукт представляет собой масло, слегка окрашенное в желтый цвет. Выход: 4,6 г (75%). в) 6-Бензилокси-8-2-[2-(3,5-дифторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо[1,4] оксазин-3-он. Данное соединение получают по обычной методике из 1,73 г (4,84 ммоля) бензилокси-8-(2-этокси 2-гидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она и 0,80 г (4,32 ммоля) 2-(3,5-дифторфенил)-1,1-диметилэтиламина. Выход: 1,50 г (58%, гидрохлорид), tпл 240-244C. г) 8-2-[2-(3,5-Дифторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4] оксазин-3-он. Путем гидрогенолиза 1,30 г (2,43 ммоля) 6-бензилокси-8-2-[2-(3,5-дифторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо[1,4]оксазин-3-она получают целевое соединение в виде твердого вещества белого цвета. Выход: 0,90 г (86%, гидрохлорид), tпл 150-158C, масс-спектрометрия: [М+Н]+ = 393.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. а) Бензиловый эфир [2-(4-этоксифенил)-1,1-диметилэтил]карбаминовой кислоты. 15,0 г (50 ммолей) бензилового эфира [2-(4-гидроксифенил)-1,1-диметилэтил]карбаминовой кислоты в течение 10 ч перемешивают при 90-100 С с 7,5 мл (92 ммоля) этилиодида и 21 г (150 ммолей) карбоната калия. Затем к реакционной смеси примешивают этилацетат, дважды промывают водой и сушат сульфатом натрия. После отгонки растворителей образуется масло желтого цвета (15,0 г, 92%), которое непосредственно используют на последующей стадии. б) 2-(4-Этоксифенил)-1,1-диметилэтиламин. Раствор 15,0 г (49 ммолей) бензилового эфира [2-(4-этоксифенил)-1,1-диметилэтил]карбаминовой кислоты в 100 мл ледяной уксусной кислоты смешивают с 2 г палладия на угле (10%-ного), после чего гидрируют при давлении 5 бар и температуре в интервале от 40 до 50 С. Затем катализатор отфильтровывают и из фильтрата удаляют растворитель. Остаток растворяют в небольшом количестве воды, подщелачивают концентрированным едким натром и экстрагируют этилацетатом. Органическую фазу промывают водой, сушат сульфатом натрия и концентрируют. Сырой продукт растворяют в ацетонитриле и подкисляют раствором соляной кислоты в простом эфире. Выпавшее в осадок после добавления диэтилового эфира твердое вещество отделяют вакуум-фильтрацией и сушат. Выход: 8,8 г (84%, гидрохлорид), tпл 198-200C. в) 6-Бензилокси-8-2-[2-(4-этоксифенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо[1,4] оксазин-3-он. 2,14 г (6,0 ммолей) 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она и 1,0 г(5,2 ммоля) 2-(4-этоксифенил)-1,1-диметилэтиламина перемешивают в 40 мл этанола в течение 1 ч при 50-80 С. После охлаждения до комнатной температуры добавляют 0,23 г (6,0 ммолей) борогидрида натрия и оставляют еще на 1 ч перемешиваться. Затем к реакционной смеси примешивают 5 мл ацетона, в течение 30 мин перемешивают, подкисляют ледяной уксусной кислотой и концентрируют. Остаток смешивают с водой и этилацетатом и подщелачивают. Органическую фазу отделяют, промывают водой, сушат сульфатом натрия и в вакууме удаляют из нее растворитель. Остаток повторно растворяют в этилацетате и воде, смешивают с концентрированной соляной кислотой и разбавляют диэтиловым эфиром. Выпавшее твердое вещество отделяют вакуум-фильтрацией и промывают диэтиловым эфиром. Полученный продукт представляет собой твердое вещество белого цвета. Выход: 2,0 г (61%, гидрохлорид), tпл 214-216C. г) 8-2-[2-(4-этоксифенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он. 1,5 г (2,8 ммоля) 6-бензилокси-8-2-[2-(4-этоксифенил)-1,1-диметилэтиламино]-1-гидроксиэтил 4 Н-бензо[1,4]оксазин-3-она в 80 мл метанола при комнатной температуре и нормальном давлении гидрируют в присутствии 250 мг палладия на угле (10%-ного) в качестве катализатора. Затем катализатор отделяют вакуум-фильтрацией и фильтрат концентрируют. Остаток растворяют за счет нагревания в 5 мл этанола, вводят кристаллическую затравку и разбавляют этилацетатом. Выпавшее в осадок твердое вещество отфильтровывают и промывают. Полученный целевой продукт представляет собой твердое вещество белого цвета. Выход: 1,0 г (83%, гидрохлорид), tпл 232-235C, масс-спектрометрия: [М+Н]+ = 401.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 15. 8-2-[2-(3,5-Диметилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо[1,4]оксазин-3-он. а) 1-(3,5-Диметилфенил)-2-метилпропанол-2-ол. Данное соединение получают взаимодействием этилового эфира (3,5-диметилфенил)уксусной кислоты и метилмагнийбромида. б) 2-(3,5-диметилфенил)-1,1-диметилэтиламин. Взаимодействием 6,00 г (34 ммоля) 1-(3,5-диметилфенил)-2-метилпропанол-2-ола и 2,00 г (41 ммоль) цианида натрия, осуществляемым по реакции Риттера, получают 2,40 г 2-(3,5-диметилфенил)-1,1- 13008665 диметилэтилформамида (выход 35%). С целью высвободить амин формамид (2,40 г, 11,7 ммоля) обрабатывают соляной кислотой. Дальнейшую реакцию и переработку проводят по методике, описанной в примере 10 в), с получением продукта в виде масла. Выход: 1,70 г (82%), масс-спектрометрия: [М+Н]+ = 178. в) 6-Бензилокси-8-2-[2-(3,5-диметилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо[1,4] оксазин-3-он. Данное соединение получают по методике, аналогично описанной в примере 8 г), из 1,47 г (4,1 ммоля) бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она и 0,65 г (3,7 ммоля) 2-(3,5 диметилфенил)-1,1-диметилэтиламина. Выход: 1,1 г (51%, гидрохлорид), tпл 220-222C. г) 8-2-[2-(3,5-Диметилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4] оксазин-3-он. Целевое соединение получают путем гидрогенолиза 0,90 г (1,71 ммоля-6-бензилокси-8-2-[2-(3,5 диметилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-4 Н-бензо[1,4]оксазин-3-она и перекристаллизации сырого продукта из изопропанола. Полученное соединение представляет собой твердое вещество белого цвета. Выход: 0,50 г (69%, гидрохлорид), tпл 235-238C, масс-спектрометрия: [М+Н]+ = 385.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 16. 4-(4-2-[2-Гидрокси-2-(6-гидрокси-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-8-ил)этиламино]-2-метилпропилфенокси)масляная кислота. а) Этиловый эфир 4-[4-(2-амино-2-метилпропил)фенокси]масляной кислоты. 4,5 г (15,0 ммолей) бензилового эфира [2-(4-гидроксифенил)-1,1-диметилэтил]карбаминовой кислоты, 2,3 мл (16 ммолей) этилового эфира 4-броммасляной кислоты, 2,3 г (16,6 ммоля) карбоната калия и 0,3 г (1,8 ммоля) иодида калия в 20 мл диметилформамида нагревают в течение 13 ч при 120 С. Затем реакционную смесь разбавляют этилацетатом и последовательно промывают водой, раствором гидроксида натрия и еще раз водой. Органическую фазу сушат сульфатом натрия и концентрируют. Остаток очищают хроматографией (система растворителей: циклогексан/этилацетат в соотношении 9:1). В результате выделяют 5,0 г масла желтого цвета, которое растворяют в 50 мл уксусной кислоты и в присутствии 1,0 г палладия на угле в качестве катализатора гидрируют при температуре 40 С и давлении 3 бара. Затем катализатор отфильтровывают и из фильтрата удаляют растворитель. Остаток растворяют в диэтиловом эфире и смешивают с раствором соляной кислоты в простом эфире. Выпавшее в осадок твердое вещество отделяют вакуум-фильтрацией и сушат. Выход: 2,9 г (66% в две стадии, гидрохлорид), tпл 103-105 С. б) Этиловый эфир 4-(4-2-[2-(6-бензилокси-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-8-ил)-2 гидроксиэтиламино]-2-метилпропилфенокси)масляной кислоты. 1,20 г (3,36 ммоля) бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она и 0,90 г(3,22 ммоля) этилового эфира 4-[4-(2-амино-2-метилпропил)фенокси]масляной кислоты по методике,описанной в примере 8 г), подвергают взаимодействию между собой. Полученный сырой продукт растворяют в 10 мл этилацетата и 10 мл воды и при перемешивании смешивают с щавелевой кислотой. Раствор разбавляют диэтиловым эфиром, а выпавшее в осадок твердое вещество отделяют вакуум-фильтрацией и промывают диэтиловым эфиром. Выход: 1,20 г (54%, оксалат), tпл 223-227C. в) 4-(4-2-[2-(6-Бензилокси-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-8-ил)-2-гидроксиэтиламино]2-метилпропилфенокси)масляная кислота. Раствор 1,00 г (1,73 ммоля) этилового эфира 4-(4-2-[2-(6-бензилокси-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-8-ил)-2-гидроксиэтиламино]-2-метилпропилфенокси)масляной кислоты в 25 мл метанола смешивают с 2,5 мл 1 н. раствора гидроксида натрия, в течение 30 мин нагревают с обратным холодильником и затем нейтрализуют 1 н. соляной кислотой. Раствор концентрируют и образовавшееся масло путем нагревания растворяют в 5 мл н-бутанола. После добавления способствующего кристаллизации вспомогательного вещества в осадок выпадает твердое вещество, которое отделяют вакуум-фильтрацией и промывают ацетоном и диэтиловым эфиром. Выход: 0,75 г (79%), tпл 216-218C. г) 4-(4-2-[2-Гидрокси-2-(6-гидрокси-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-8-ил)этиламино]-2 метилпропилфенокси)масляная кислота. 0,70 г (1,28 ммоля) 4-(4-2-[2-(6-бензилокси-3-оксо-3,4-дигидро-2 Н-бензо[1,4]оксазин-8-ил)-2- 14008665 гидроксиэтиламино]-2-метилпропилфенокси)масляной кислоты растворяют в 25 мл метанола и 2 мл уксусной кислоты и в присутствии 150 мг палладия на угле (10%-ного) гидрируют при комнатной температуре и нормальном давлении. Затем катализатор отфильтровывают и из фильтрата удаляют растворитель. Целевой продукт получают путем кристаллизации из смеси метанола и ацетона. Выход: 0,40 г (68%), tпл 201-204C, масс-спектрометрия: [М+Н]+ = 459.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 17. 8-2-[2-(3,4-Дифторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо [1,4]оксазин-3-он. а) 1-(3,4-Дифторфенил)-2-метилпропан-2-ол. Из 23,0 г (111 ммолей) 3,4-дифторбензилбромида получают реактив Гриньяра, который затем подвергают взаимодействию с 11,6 мл (158 ммолей) ацетона. В результате получают масло, слегка окрашенное в желтый цвет. Выход: 9,7 г (47%), Rf-значение: 0,55 (этилацетат/петролейный эфир в соотношении 1:3). б)N-[2-(3,4-дифторфенил)-1,1-диметилэтил]формамид. Данное целевое соединение получают по реакции Риттера с использованием 4,0 г (21,5 ммоля) 1(3,4-дифторфенил)-2-метилпропан-2-ола. Полученное соединение представляет собой масло, слегка окрашенное в желтый цвет. Выход: 4,0 г (87%), масс-спектрометрия: [М+Н]+ =214. в) 2-(3,4-Дифторфенил)-1,1-диметилэтиламин. 4,00 г (18,5 ммоля) N-[2-(3,4-дифторфенил)-1,1-диметилэтил]формамида растворяют в этаноле,смешивают с концентрированной соляной кислотой и в течение ночи нагревают с обратным холодильником. Затем реакционную смесь сливают на смесь воды и льда, подщелачивают гидроксидом натрия и экстрагируют трет-бутилметиловым эфиром. Органические фазы промывают водой, сушат сульфатом натрия и концентрируют. В результате получают масло желтого цвета. Выход: 3,2 г (92%), масс-спектрометрия: [М+Н]+ = 186. г) 8-2-[2-(3,4-Дифторфенил)1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он. 357 мг (1 ммоль) 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она и 185 мг(1 ммоль) 2-(3,4-дифторфенил)-1,1-диметилэтиламина в течение 30 мин перемешивают в 5 мл тетрагидрофурана при комнатной температуре. Затем охлаждают до 0 С и по каплям добавляют в атмосфере аргона 1,5 мл 2-молярного раствора борогидрида лития в тетрагидрофуране. Далее перемешивают в течение 30 мин при комнатной температуре, смешивают с 10 мл дихлорметана и 3 мл воды, продолжают перемешивание еще в течение 1 ч, после чего фильтруют через Extrelut. Из содержащего этаноламин элюата удаляют растворитель. Остаток растворяют в метаноле и гидрируют в присутствии палладия на угле (10%-ного) в качестве катализатора при давлении 2,5 бара и комнатной температуре. Затем катализатор отфильтровывают и сырой продукт очищают хроматографией. Полученный продукт представляет собой твердое вещество белого цвета. Выход: 31 мг (6%, трифторэтилацетат), масс-спектрометрия: [М+Н]+ = 393.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 18. 8-2-[2-(2-Хлор-4-фторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо[1,4]оксазин-3-он. а) 1-(2-Хлор-4-фторфенил)-2-метилпропан-2-ол. Данное соединение получают из 20 г (97 ммолей) метилового эфира (2-хлор-4-фторфенил)уксусной кислоты и 98 мл 3-молярного раствора метилмагнийбромида по методике, аналогично описанной в примере 8 а). б) N-[2-(2-Хлор-4-фторфенил)-1,1-диметилэтил]формамид. 7,5 г (37 ммолей) 1-(2-хлор-4-фторфенил)-2-метилпропан-2-ола подвергают химическому превращению и переработке по методике, описанной в примере 106). Полученное таким путем масло для по- 15008665 следующей очистки хроматографируют на короткой силикагельной колонке (петролейный эфир/этилацетат в соотношении 9:1). Выход: 7,4 г (87%), масс-спектрометрия: [М+Н]+ = 230/232. в) 2-(2-Хлор-4-фторфенил)-1,1-диметилэтиламин. Данное соединение получают в виде масла коричневого цвета в результате химического превращения 7,4 г (32 ммоля) N-[2-(2-хлор-4-фторфенил)-1,1-диметилэтил]формамида по методике, описанной в примере 17 в). Выход: 5,14 г (79%), масс-спектрометрия: [М+Н]+ = 202/204. г) 8-2-[2-(2-Хлор-4-фторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4] оксазин-3-он. 357 мг (1 ммоль) 6-бензилокси-8-(2-этокси-2-гидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она и 202 мг(1 ммоль) 2-(2-хлор-4-фторфенил)-1,1-диметилэтиламина подвергают по методике, аналогично описанной в примере 10 г), взаимодействию с борогидридом лития. Для дебензилирования полученного таким путем этаноламина последний растворяют в 3 мл дихлорметана и охлаждают до -78 С. При этой температуре по каплям добавляют 2 мл 1-молярного раствора трибромида бора в дихлорметане и оставляют медленно нагреваться до комнатной температуры. Затем реакционную смесь смешивают с 10 мл дихлорметана и 3 мл воды и фильтруют через Extrelut. Из элюата удаляют растворитель и остаток очищают посредством хроматографии. Полученный продукт представляет собой твердое вещество белого цвета. Выход: 70 мг (13%, трифторэтилацетат), масс-спектрометрия: [М+Н]+ = 409/11.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 19. 8-2-[2-(4-Хлорфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо Раствор 300 мг (0,91 ммоля) 6-бензилокси-8-(2,2-дигидроксиацетил)-4 Н-бензо[1,4]оксазин-3-она и 200 мг (1,09 ммоля) 2-(4-хлорфенил)-1,1-диметилэтиламина в 3 мл этанола смешивают с молярным ситом и перемешивают в течение 90 мин при 80 С. Затем смеси дают остыть до комнатной температуры,добавляют 35 мг (0,91 ммоля) борогидрида натрия и оставляют на 1 ч перемешиваться. После этого к реакционной смеси примешивают раствор гидрокарбоната натрия и экстрагируют этилацетатом. Из объединенных органических фаз удаляют растворитель и остаток хроматографируют (система растворителей: гексан/этилацетат/метанол) с получением в результате 305 мг этаноламина. Затем этаноламин растворяют в 3 мл дихлорметана и охлаждают в атмосфере аргона до -78 С. Далее по каплям добавляют 3 мл 1-молярного раствора трибромида бора в дихлорметане и оставляют перемешиваться в течение 1 ч при -78 С и в течение 20 мин при комнатной температуре. Затем при -78 С по каплям добавляют 3 мл концентрированного раствора аммиака и оставляют на 5 мин перемешиваться. После этого к реакционной смеси примешивают раствор хлорида аммония и экстрагируют этилацетатом. Объединенные органические фазы концентрируют и остаток для последующей очистки хроматографируют (силикагель, система растворителей: дихлорметан/метанол +1% аммиака). Полученный продукт представляет собой твердое вещество бежевого цвета. Выход: 93 мг (26%), масс-спектрометрия: [М+Н] = 391.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Пример 20. 8-2-[2-(4-Бромфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо Процесс получения этаноламина и дебензилирования осуществляют по методике, описанной в примере 19, используя в этих целях 300 мг (0,91 ммоля) 6-бензилокси-8-(2,2-дигидроксиацетил)-4 Нбензо[1,4]оксазин-3-она и 250 мг (1,09 ммоля) 2-(4-бромфенил)-1,1-диметилэтиламина. Полученный продукт представляет собой твердое вещество бежевого цвета. Выход: 54 мг (14%), масс-спектрометрия: [М+Н]+ = 435, 437.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов.(1,09 ммоля) 2-(4-фторфенил)-1,1-диметилэтиламина растворяют в 3 мл этанола. Затем добавляют молярное сито и нагревают в течение 30 мин до 80 С. После охлаждения до комнатной температуры добавляют 35 мг (0,91 ммоля) борогидрида натрия. Далее оставляют на 1 ч при комнатной температуре перемешиваться, затем добавляют к реакционной смеси раствор гидрокарбоната натрия и экстрагируют этилацетатом. Органические фазы концентрируют и остаток хроматографируют (система растворителей: гексан/этилацетат/метанол). Полученный таким путем этаноламин (223 мг) с целью отщепления бензильной защитной группы растворяют в метаноле и гидрируют в присутствии 150 мг гидроксида палладия в качестве катализатора при комнатной температуре и нормальном давлении. Затем катализатор отделяют фильтрацией через Celite, из фильтрата удаляют растворитель и остаток хроматографируют (силикагель, система растворителей: дихлорметан/метанол). Полученный продукт представляет собой твердое вещество бежевого цвета. Выход: 76 мг (22%), масс-спектрометрия: [М+Н]+ = 375.(R)- и (S)-энантиомеры соединения, полученного в этом примере осуществления изобретения, можно получать по обычным, известным в уровне техники методам расщепления рацематов. Аналогично описанным выше в примерах методам синтеза можно также получить следующие предлагаемые в изобретении соединения формулы 1: Пример 22. 8-2-[2-(4-Фтор-3-метоксифенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси 4 Н-бензо[1,4]оксазин-3-он. Пример 23. 8-2-[2-(4-Фтор-2,6-диметилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он. Пример 24. 8-2-[2-(4-Хлор-2-метилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси 4 Н-бензо[1,4]оксазин-3-он. Пример 25. 8-2-[2-(4-Хлор-3-фторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо[1,4]оксазин-3-он. Пример 26. 8-2-[2-(4-Хлор-2-фторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо[1,4]оксазин-3-он. Пример 27. 8-2-[2-(3-Хлор-4-фторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо[1,4]оксазин-3-он. Пример 28. 8-2-[2-(2,6-Дифтор-4-метоксифенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6 гидрокси-4 Н-бензо[1,4]оксазин-3-он. Пример 29. 8-2-[2-(2,5-Дифтор-4-метоксифенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6 гидрокси-4 Н-бензо[1,4]оксазин-3-он. Пример 30. 8-2-[2-(4-Фтор-3,5-диметилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6 гидрокси-4 Н-бензо[1,4]оксазин-3-он. Пример 31. 8-2-[2-(3,5-Дихлорфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо[1,4]оксазин-3-он. Пример 32. 8-2-[2-(4-Хлор-3-метилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси 4 Н-бензо[1,4]оксазин-3-он. Пример 33. 8-2-[2-(3,4,5-Трифторфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо[1,4]оксазин-3-он. Пример 34. 8-2-[2-(3-Метилфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Н-бензо[1,4]оксазин-3-он. Пример 35. 8-2-[2-(3,4-Дихлорфенил)-1,1-диметилэтиламино]-1-гидроксиэтил-6-гидрокси-4 Нбензо[1,4]оксазин-3-он. Согласно изобретению соединения общей формулы 1 могут применяться индивидуально или в сочетании с другими предлагаемыми в изобретении действующими веществами формулы 1. При необходимости соединения общей формулы 1 могут применяться также в сочетании с иными фармакологически активными действующими веществами. При этом речь прежде всего идет об антихолинергических средствах, при определенных условиях о других бетамиметиках, противоаллергических средствах, ингибиторах фосфодиэстеразы типа IV (PDE IV), антагонистах фактора активации тромбоцитов (PAF), антагонистах лейкотриенов и кортикостероидах, а также о различных сочетаниях таких действующих веществ. В качестве предпочтительных примеров антихолинергических средств можно назвать соли ипрато- 17008665 рия, окситропия и тиотропия. Комбинированные лекарственные средства, в состав которых наряду с предлагаемыми в изобретении соединениями формулы 1 входят вышеназванные соли, содержат предпочтительно такие соли ипратория, окситропия или тиотропия, в которых анион выбран из группы,включающей хлорид, бромид, иодид, сульфат, фосфат, метансульфонат, нитрат, малеат, ацетат, цитрат,фумарат, тартрат, оксалат, сукцинат, бензоат и n-толуолсульфонат, при определенных условиях в виде одного из их сольватов или гидратов. Согласно настоящему изобретению под кортикостероидами, которые при определенных условиях можно применять в сочетании с соединениями формулы 1, подразумеваются соединения, выбранные из группы, включающей флунисолид, беклометазон, триамцинолон, будесонид, флутиказон, мометазон,циклесонид, рофлепонид и дексаметазон. В некоторых случаях в настоящем описании вместо понятия"кортикостероиды" используется также только понятие "стероиды". При упоминании в настоящем описании стероидов подразумеваются также соли или производные, которые могут быть образованы стероидами. В качестве примера подобных возможных солей или производных можно назвать натриевые соли, сульфобензоаты, фосфаты, изоникотинаты, ацетаты, пропионаты, дигидрофосфаты, пальмитаты,пивалаты или фуроаты. При определенных условиях кортикостероиды могут быть также представлены в виде их гидратов. Согласно настоящему изобретению под агонистами допамина, которые при определенных условиях можно применять в сочетании с соединениями формулы 1, подразумеваются соединения, выбранные из группы, включающей бромокриптин, каберголин, альфа-дигидроэргокриптин, лисурид, перголид, прамипексол, роксиндол, ропинирол, талипексол, тергурид и виозан. Под указанными выше агонистами допамина согласно настоящему изобретению подразумеваются также их возможные фармакологически приемлемые кислотно-аддитивные соли и при определенных условиях их гидраты. Под физиологически совместимыми кислотно-аддитивными солями, которые могут быть образованы с вышеописанными агонистами допамина, подразумеваются, например, фармацевтически приемлемые соли, выбранные из солей соляной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, уксусной кислоты, фумаровой кислоты, янтарной кислоты, молочной кислоты, лимонной кислоты, винной кислоты и малеиновой кислоты. В качестве примера противоаллергических средств, которые согласно изобретению можно использовать в сочетании с соединениями формулы 1, можно назвать эпинастин, цетиризин, азеластин, фексофенадин, левокабастин, лоратадин, мизоластин, кетотифен, эмедастин, диметинден, клемастин, бамипин,цексхлорфенирамин, фенирамин, доксиламин, хлорфеноксамин, дименгидринат, дифенгидрамин, прометазин, эбастин, деслоратидин и меклозин. Под указанными выше противоаллергическими средствами согласно настоящему изобретению подразумеваются также их возможные фармакологически приемлемые кислотно-аддитивные соли. В качестве примера ингибиторов PDE IV, которые согласно изобретению можно использовать в сочетании с соединениями формулы 1, можно назвать соединения, выбранные из группы, включающей энпрофиллин, рофлумиласт, арифло, Вау-198004, СР-325,366, BY343, D-4396 (Sch-351591), V-11294A иAWD-12-281. Предпочтительные ингибиторы PDE IV выбраны из группы, включающей энпрофиллин,рофлумиласт, арифло и AWD-12-281. При упоминании указанных выше ингибиторов PDE IV согласно настоящему изобретению имеются в виду также их возможные фармакологически приемлемые кислотно-аддитивные соли. Под физиологически приемлемыми (совместимыми) кислотно-аддитивными солями, которые можно образовывать с указанными выше ингибиторами PDE IV, согласно изобретению подразумеваются фармацевтически приемлемые соли, выбранные из солей соляной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, уксусной кислоты,фумаровой кислоты, янтарной кислоты, молочной кислоты, лимонной кислоты, винной кислоты или малеиновой кислоты. В этом отношении предпочтительные в соответствии с изобретением соли выбраны из группы, включающей ацетат, гидрохлорид, гидробромид, сульфат, фосфат и метансульфонат. В качестве примера лекарственных форм, пригодных для введения в организм соединений формулы 1, можно назвать таблетки, капсулы, суппозитории, растворы, порошки и т.д. На долю фармацевтически активного(-ых) соединения(-ий) в таких лекарственных формах должно приходиться в каждом случае от 0,05 до 90 мас.%, предпочтительно от 0,1 до 50 мас.%, от общей массы препарата. Соответствующие таблетки можно изготавливать, например, смешением действующего вещества или действующих веществ с известными вспомогательными веществами, например инертными разбавителями, такими как карбонат кальция, фосфат кальция или лактоза, разрыхлителями, такими как кукурузный крахмал или альгиновая кислота, связующими, такими как крахмал или желатин, смазывающими веществами, такими как стеарат магния или тальк, и/или средствами для обеспечения депо-эффекта, такими как карбоксиметилцеллюлоза, ацетофталат целлюлозы или поливинилацетат. Таблетки могут также состоять из нескольких слоев. Соответствующим образом можно изготавливать драже нанесением на полученные аналогично таблеткам ядра покрытий из обычно применяемых в этих целях материалов, например коллидона или шеллака, гуммиарабика, талька, диоксида титана или сахара. Для обеспечения депо-эффекта или во избежание несовместимости ядра драже также можно изготавливать многослойными. Равным образом и оболочка драже также может состоять для обеспечения депо-эффекта из нескольких слоев, при этом- 18008665 можно использовать вспомогательные вещества, указанные выше для таблеток. В состав микстур на основе предлагаемых в изобретении действующих веществ, соответственно комбинаций действующих веществ дополнительно могут входить также подслащивающее вещество, такое как сахарин, цикламат, глицерин или сахар, а также улучшитель вкуса, например ароматизатор, такой как ванилин или апельсиновый экстракт. Помимо этого микстуры могут содержать суспендирующие вспомогательные вещества или загустители, такие как натрийкарбоксиметилцеллюлоза, смачиватели,например продукты конденсации жирных спиртов с этиленоксидом, или защитные вещества (консерванты), такие как n-гидроксибензоаты. Растворы получают по известной технологии, например с добавлением придающих изотоничность агентов, консервантов, таких как n-гидроксибензоаты, или стабилизаторов, таких как соли этилендиаминтетрауксусной кислоты с щелочными металлами, и при необходимости с применением эмульгаторов и/или диспергаторов, при этом, например, при применении воды в качестве разбавителя при необходимости можно использовать органические растворители в качестве гидротропных солюбилизаторов, соответственно вспомогательных растворителей, и затем разливают по бутылкам для инъекций, ампулам или бутылкам для инфузии. Капсулы, содержащее одно или несколько действующих веществ, соответственно комбинации действующих веществ, можно изготавливать, например, смешением действующих веществ с инертными носителями, такими как лактоза или сорбит, и инкапсулированием полученной смеси в желатиновые капсулы. Соответствующие суппозитории можно изготавливать, например, смешением действующего вещества или действующих веществ с предусмотренными для этой цели носителями, такими как нейтральные жиры или полиэтиленгликоль, соответственно его производные. В качестве примера вспомогательных веществ, которые могут использоваться при изготовлении лекарственных форм, можно назвать воду, фармацевтически приемлемые (безвредные) органические растворители, такие как парафины (например фракции минерального масла), масла растительного происхождения (например арахисовое или кунжутное масло), моно- или полифункциональные спирты (например этанол или глицерин), носители, такие как природная мука горных пород (например каолин, глиноземы,тальк, мел), синтетическая мука горных пород (например высокодисперсная кремниевая кислота и силикаты), сахара (например тростниковый, молочный и виноградный сахар), эмульгаторы (например лигнин, сульфитный щелок, метилцеллюлоза, крахмал и поливинилпирролидон) и скользящие вещества(например стеарат магния, тальк, стеариновая кислота и лаурилсульфат натрия). В случае перорального введения в состав таблеток помимо вышеуказанных носителей можно, как очевидно, включать также такие добавки, как, например, цитрат натрия, карбонат кальция и дикальцийфосфат, совместно с различного рода наполнителями, такими как крахмал, предпочтительно картофельный крахмал, желатин и т.п. Помимо этого при производстве таблеток могут использоваться также скользящие вещества, такие как стеарат магния, лаурилсульфат натрия и тальк. В случае водных суспензий действующие вещества помимо вышеописанных вспомогательных веществ можно также смешивать с различного рода улучшителями вкуса или красителями. При предпочтительном согласно изобретению применении соединений формулы 1 для терапии ХОЗЛ наиболее предпочтительно использовать лекарственные формы, соответственно фармацевтические препараты, вводимые в организм путем ингаляции. В качестве примера ингалируемых лекарственных форм можно назвать ингаляционные порошки, дозированные аэрозоли с пропеллентом или ингаляционные растворы без пропеллента. Согласно настоящему изобретению под выражением "ингаляционные растворы без пропеллента" подразумеваются также концентраты или стерильные, готовые к применению растворы для ингаляции. Подобные используемые согласно настоящему изобретению лекарственные формы более подробно рассмотрены в последующей части описания. В применяемых согласно изобретению ингаляционных порошках соединения формулы 1 могут содержаться либо индивидуально, либо в смеси с приемлемыми физиологически безвредными вспомогательными веществами. Если действующие вещества формулы 1 содержатся в предлагаемых в изобретении ингаляционных порошках в смеси с физиологически безвредными вспомогательными веществами,то для получения таких ингаляционных порошков могут использоваться следующие физиологически безвредные вспомогательные вещества: моносахариды (например глюкоза или арабиноза), дисахариды(например лактоза, сахароза, мальтоза), олиго- и полисахариды (например декстраны), полиспирты (например сорбит, маннит, ксилит), соли (например хлорид натрия, карбонат кальция) либо смеси этих вспомогательных веществ между собой. Предпочтительно использовать моно- или дисахариды, при этом особенно предпочтительно применение лактозы или глюкозы, прежде всего, но не исключительно, в виде их гидратов. Особенно предпочтительным согласно изобретению является применение в качестве вспомогательного вещества лактозы, наиболее предпочтительно моногидрата лактозы. Максимальная средняя крупность частиц вспомогательных веществ, применяемых в составе предлагаемых в изобретении ингаляционных порошков, составляет вплоть до 250 мкм, предпочтительно от 10 до 150 мкм, наиболее предпочтительно от 15 до 80 мкм. При определенных условиях может оказаться целесообразным примешивать к указанным выше вспомогательным веществам их же фракции с меньшей- 19008665 средней крупностью частиц, составляющей от 1 до 9 мкм. Подобные вспомогательные вещества с меньшей крупностью частиц также выбирают из описанной выше группы вспомогательных веществ, применяемых в ингаляционных порошках. Помимо этого при получении предлагаемых в изобретении ингаляционных порошков предлагается примешивать к смеси вспомогательных веществ микронизированное действующее вещество формулы 1, средняя крупность частиц которого предпочтительно составляет от 0,5 до 10 мкм, наиболее предпочтительно от 1 до 5 мкм. Способы получения предлагаемых в изобретении ингаляционных порошков путем размола и микронизации компонентов с последующим их смешением известны из уровня техники. Для введения в организм предлагаемых в изобретении ингаляционных порошков могут использоваться известные из уровня техники ингаляторы. В предлагаемых в изобретении ингаляционных аэрозолях с пропеллентом действующие вещества формулы 1 могут присутствовать в растворенном или в диспергированном в пропелленте виде. При этом действующие вещества формулы 1 могут содержаться в раздельных лекарственных формах либо в одной единой лекарственной форме, причем указанные компоненты формулы 1 либо оба могут присутствовать в растворенном виде, либо оба могут присутствовать в диспергированном виде, либо только один из них может присутствовать в растворенном, а другой в диспергированном виде. Используемые для получения ингаляционных аэрозолей пропелленты известны из уровня техники. Пригодные для этой цели пропелленты выбирают из группы, включающей углеводороды, такие как нпропан, н-бутан или изобутан, и галогензамещенные углеводороды, такие как фторированные производные метана, этана, пропана, бутана, циклопропана или циклобутана. Указанные выше пропелленты могут при этом использоваться индивидуально либо в виде их смесей. Наиболее предпочтительными пропеллентами являются галогенированные производные алкана, выбранные из группы, включающейTG134a и TG227, а также их смеси. В состав ингаляционных аэрозолей с пропеллентом могут входить также другие компоненты, такие как сорастворители, стабилизаторы, поверхностно-активные вещества (ПАВ), антиоксиданты, смазывающие вещества, а также средства для регулирования значения рН. Все такие компоненты известны из уровня техники. Для введения в организм описанных выше ингаляционных аэрозолей с пропеллентом могут использоваться известные из уровня техники ингаляторы (ингаляторы, выдающие мерную дозу препарата). Предлагаемые в изобретении действующие вещества формулы 1 можно также вводить в организм в виде ингаляционных растворов и ингаляционных суспензий без пропеллента. В качестве таких растворов могут использоваться водные или спиртовые, предпочтительно этанольные, растворы. Растворителем при этом может служить только вода либо смесь воды с этанолом. Относительное содержание этанола в пересчете на количество воды не ограничено какими-либо конкретными пределами, предпочтительно,однако, чтобы максимальное содержание этанола составляло до 70 об.%, прежде всего до 60 об.%, наиболее предпочтительно до 30 об.%. Остальное количество, недостающее до 100 об.%, приходится на воду. Значение рН растворов или суспензий, содержащих действующие вещества формулы 1, устанавливают с помощью пригодных для этой цели кислот на 2-7, предпочтительно на 2-5. Для регулирования значения рН с целью его установки на указанные выше значения могут использоваться кислоты из числа неорганических или органических кислот. В качестве примера особенно предпочтительных в этом отношении неорганических кислот можно назвать соляную кислоту, бромистоводородную кислоту, азотную кислоту, серную кислоту и/или фосфорную кислоту. В качестве примера наиболее пригодных для применения в указанных целях органических кислот можно назвать аскорбиновую кислоту, лимонную кислоту, яблочную кислоту, винную кислоту, малеиновую кислоту, янтарную кислоту, фумаровую кислоту, уксусную кислоту, муравьиную кислоту и/или пропионовую кислоту, а также другие кислоты. Предпочтительными неорганическими кислотами являются соляная кислота и серная кислота. Возможно также использование кислот, которые с одним из действующих веществ уже образуют кислотноаддитивную соль. Среди органических кислот предпочтительны аскорбиновая кислота, фумаровая кислота и лимонная кислота. При определенных условиях допустимо использование и смесей указанных кислот, прежде всего в случае тех кислот, которые наряду с их повышающими кислотность свойствами обладают и иными свойствами, например могут использоваться в качестве вкусовых веществ, антиоксидантов или комплексообразователей, как, например, лимонная кислота или аскорбиновая кислота. Для регулирования значения рН согласно изобретению наиболее предпочтительно использовать соляную кислоту. Согласно изобретению можно отказаться от включения в состав таких препаратов эдитиновой кислоты (ЭДТК) или одной из ее известных солей, в частности эдетата натрия, в качестве стабилизатора или комплексообразователя. Однако в других вариантах предусматривается использование этого(-их) соединения(-ий). В одном из таких предпочтительных вариантов, в котором предусмотрено применение эдетата натрия, его концентрация в растворе составляет менее 100 мг на 100 мл, предпочтительно менее 50 мг на 100 мл, наиболее предпочтительно менее 20 мг на 100 мл. В целом же предпочтительны такие ингаляционные растворы, содержание в которых эдетата натрия составляет от 0 до 10 мг на 100 мл. К не содержащим пропеллента ингаляционным растворам можно добавлять сорастворители и/или- 20008665 другие вспомогательные вещества. В качестве таких сорастворителей предпочтительно использовать таковые, которые содержат гидроксильные группы или иные полярные группы, например спирты, прежде всего изопропиловый спирт, гликоли, прежде всего пропиленгликоль, полиэтиленгликоль, полипропиленгликоль, гликолевый эфир, глицерин, полиоксиэтиленовые спирты и эфиры полиоксиэтилена и жирных кислот. Под вспомогательными веществами и добавками в данном контексте подразумевается любое фармакологически приемлемое вещество, которое не является действующим веществом, но которое можно включать в состав препарата совместно с действующим(-и) веществом(-ами) в фармакологически приемлемом растворителе для улучшения качественных характеристик такого препарата. Эти вещества не должны проявлять никакого или с учетом целевого терапевтического эффекта никакого скольнибудь значительного или по меньшей мере никакого нежелательного фармакологического действия. К подобным вспомогательным веществам и добавкам относятся, например, поверхностно-активные вещества, такие как соевый лецитин, олеиновая кислота, сорбитановый эфир, в частности полисорбаты, поливинилпирролидон, прочие стабилизаторы, комплексообразователи, антиоксиданты и/или консерванты,обеспечивающие сохранность готового лекарственного препарата или позволяющие продлить срок его годности, вкусовые вещества, витамины и/или иные известные из уровня техники добавки. К таким добавкам относятся также фармакологически безвредные соли, такие, например, как хлорид натрия, в качестве придающих изотоничность агентов. К числу предпочтительных вспомогательных веществ относятся антиоксиданты, такие, например,как аскорбиновая кислота, если только она уже не используется для регулирования значения рН, витамин А, витамин Е, токоферол и аналогичные встречающиеся в организме человека витамины или провитамины. Консерванты могут использоваться для защиты препарата от заражения патогенными микроорганизмами. В качестве подобных консервантов могут использоваться известные из уровня техники вещества, прежде всего цетилпиридинийхлорид, бензалконийхлорид или бензойная кислота, соответственно бензоаты, такие как бензоат натрия, в известных из уровня техники концентрациях. Концентрация указанных выше консервантов предпочтительно составляет до 50 мг на 100 мл раствора, наиболее предпочтительно от 5 до 20 мг на 100 мл раствора. Предпочтительные препараты помимо растворителя, которым является вода, и действующего вещества формулы 1 содержат также только бензалконийхлорид и эдетат натрия. В другом предпочтительном варианте предлагается полностью отказаться от применения эдетата натрия. Назначаемая доза предлагаемых в изобретении соединений в существенной степени зависит, как очевидно, от метода их введения в организм и подлежащего лечению заболевания. При введении путем ингаляции выраженный эффект от применения соединений формулы 1 проявляется уже при их введении в дозах, лежащих в микрограммовом диапазоне. Однако соединения формулы 1 целесообразно применять и в дозах, превышающих микрограммовый диапазон. При этом соответствующая доза может, например, лежать в граммовом диапазоне. Настоящее изобретение относится также к указанным выше фармацевтическим препаратам как таковым, которые отличаются содержанием в них соединения формулы 1, особенно предпочтительно к указанным выше фармацевтическим препаратам, предназначенным для введения путем ингаляции. Ниже изобретение проиллюстрировано на примерах, в которых представлены составы некоторых лекарственных форм и которые не ограничивают его объем. Примеры лекарственных форм А) Таблетки Компонент Содержание в одной таблетке Тонкоизмельченное действующее вещество смешивают с лактозой и частью от всего предусмотренного количества кукурузного крахмала. Полученную смесь просеивают, после чего ее увлажняют раствором поливинилпирролидона в воде, месят, гранулируют во влажном состоянии и сушат. Полученный гранулят совместно с остальным количеством кукурузного крахмала и стеаратом магния просеивают и смешивают между собой. Из полученной смеси прессуют таблетки требуемых формы и размеров. Б) Таблетки Тонкоизмельченное действующее вещество смешивают с частью от всего предусмотренного количества кукурузного крахмала, лактозой, микрокристаллической целлюлозой и поливинилпирролидоном,полученную смесь просеивают и совместно с остальным количеством кукурузного крахмала и водой перерабатывают в гранулят, который сушат и просеивают. Далее добавляют натрийкарбоксиметилкрахмал и стеарат магния, перемешивают и из полученной смеси прессуют таблетки требуемых размеров. Действующее вещество при собственном значении рН или при определенных условиях при рН от 5,5 до 6,5 растворяют в воде и смешивают с хлоридом натрия в качестве придающего изотоничность агента. Полученный раствор фильтруют в непирогенных условиях и фильтрат в асептических условиях расфасовывают в ампулы, которые затем стерилизуют и запаивают. Такие ампулы могут содержать 5 мг,25 мг и 50 мг действующего вещества. Суспензию заливают в обычный аэрозольный баллончик, снабженный дозирующим клапаном. Выдаваемая за однократное нажатие на такой клапан порция суспензии предпочтительно составляет 50 мкл. При необходимости действующее вещество можно вводить и в более высоких дозах (например 0,02 мас.%). Раствор такого состава можно приготавливать по обычной технологии. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединений общей формулы 1R3 обозначает водород, С 1-С 4 алкил, ОН, галоген, -O-С 1-С 4 алкил, -O-С 1-С 4 алкилен-СООН или -О-С 1 С 4 алкилен-СО-О-С 1-С 4 алкил,для получения лекарственного средства, предназначенного для лечения хронического обструктивного заболевания легких (ХОЗЛ). 2. Применение соединений общей формулы 1 по п.1, в которой n обозначает 1 или 2, R1 обозначает водород, галоген или С 1-С 4 алкил, R2 обозначает водород, галоген или С 1-С 4 алкил, a R3 обозначает водород, С 1-С 4 алкил, ОН, галоген, -О-С 1-С 4 алкил, -O-С 1-С 4 алкилен-СООН или -O-С 1-С 4 алкилен-СО-O-С 1 С 4 алкил, для получения лекарственного средства, предназначенного для лечения ХОЗЛ. 3. Применение соединений общей формулы 1 по п.1 или 2, в которой n обозначает 1 или 2, R1 обозначает водород, фтор, хлор или метил, R2 обозначает водород, фтор, хлор или метил, a R3 обозначает водород, С 1-С 4 алкил, ОН, фтор, хлор, бром, -O-С 1-С 4 алкил, -O-С 1-С 4 алкилен-СООН, -O-С 1-С 4 алкиленСО-O-С 1-С 4 алкил, для получения лекарственного средства, предназначенного для лечения ХОЗЛ. 4. Применение соединений общей формулы 1 по п.1 или 2, в которой n обозначает 1 или 2, R1 обозначает водород, метил или этил, R2 обозначает водород, метил или этил, a R3 обозначает водород, метил, этил, ОН, метоксигруппу, этоксигруппу, -О-СН 2-СООН, -О-СН 2-СО-О-метил или -О-СН 2-СООэтил,для получения лекарственного средства, предназначенного для лечения ХОЗЛ. 5. Применение соединений общей формулы 1 по одному из пп.1-4, в которой n обозначает 1 или 2,R1 обозначает водород или метил, R2 обозначает водород или метил, a R3 обозначает водород, метил, ОН,метоксигруппу, -О-СН 2-СООН или -О-СН 2-СООэтил, для получения лекарственного средства, предназначенного для лечения ХОЗЛ. 6. Применение соединений общей формулы 1 по одному из пп.1-5, которые представлены в виде их индивидуальных оптических изомеров, смесей индивидуальных энантиомеров или рацематов, предпочтительно в виде энантиомерночистых соединений. 7. Применение соединений общей формулы 1 по одному из пп.1-6, которые представлены в виде их кислотно-аддитивных солей с фармакологически приемлемыми кислотами, а также при определенных условиях в виде сольватов и/или гидратов. 8. Соединения общей формулы 1R3 обозначает С 1-С 4 алкил, ОН, галоген, -O-С 1-С 4 алкил, -O-С 1-С 4 алкилен-СООН, -О-С 1-С 4 алкиленСО-О-С 1-С 4 алкил,при условии, что если каждый из R1 и R2 обозначает ортометил, R3 не может одновременно представлять собой ОН. 9. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 обозначает водород, фтор,хлор, метил или метоксигруппу, R2 обозначает водород, фтор, хлор, метил или метоксигруппу, a R3 обозначает С 1-С 4 алкил, ОН, фтор, хлор, бром, -О-С 1-С 4 алкил, -О-С 1-С 4 алкилен-СООН, -O-С 1-С 4 алкилен-СОО-С 1-С 4 алкил, при условии, что если R1 и R2 каждый обозначает соответственно ортометил, R3 не может одновременно представлять собой ОН. 10. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 обозначает водород или С 1 С 4 алкил, R2 обозначает водород или С 1-С 4 алкил, a R3 обозначает С 1-С 4 алкил, ОН, -O-С 1-С 4 алкил, -O-С 1 С 4 алкилен-СООН или -O-С 1-С 4 алкилен-СО-O-С 1-С 4 алкил, при условии, что если R1 и R2 каждый обозначает соответственно ортометил, R3 не может одновременно представлять собой ОН. 11. Соединения общей формулы 1, по п.8, в которой n обозначает 1, R1 обозначает водород, метил или этил, R2 обозначает водород, метил или этил, а R3 обозначает метил, этил, ОН, метоксигруппу, этоксигруппу, -О-СН 2-СООН, -О-СН 2-СООметил или -О-СН 2-СООэтил, при условии, что если R1 и R2 каждый обозначает соответственно ортометил, R3 не может одновременно представлять собой ОН. 12. Соединения общей формулы 1 по одному из пп.8-11, в которой R3 обозначает метоксигруппу,этоксигруппу, -О-СН 2-СООН, -О-СН 2-СООметил или -О-СН 2-СООэтил, a R1, R2 и n могут иметь значения, указанные в пп.8-11. 13. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 обозначает галоген, С 1-С 4 алкил или -O-С 1-С 4 алкил, R2 обозначает галоген, С 1-С 4 алкил или -O-С 1-С 4 алкил, a R3 обозначает галоген,С 1-С 4 алкил или -O-С 1-С 4 алкил.- 23008665 14. Соединения общей формулы 1 по п.13, в которой n обозначает 1, R1 обозначает фтор, хлор, метил или метоксигруппу, R2 обозначает фтор, хлор, метил или метоксигруппу, a R3 обозначает фтор, хлор,метил или метоксигруппу. 15. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 обозначает водород, R2 обозначает водород, фтор, хлор или метил, a R3 обозначает метил, этил, изопропил, трет-бутил, ОН, фтор,хлор, бром, метоксигруппу, этоксигруппу, -О-СН 2-СООН, -O-CH2-CH2-COOH, -O-СН 2-СН 2-СН 2-СООН,-O-СН 2-СООметил, -O-СН 2-СООэтил, -O-СН 2-СН 2-СООметил, -O-СН 2-СН 2-СООэтил, -O-СН 2-СН 2-СН 2 СООметил, -O-СН 2-СН 2-СН 2-СООэтил. 16. Соединения общей формулы 1 по п.15, в которой n обозначает 1, R1 обозначает водород, R2 обозначает водород, фтор, хлор или метил, a R3 обозначает ОН, фтор, хлор, метил, метоксигруппу, этоксигруппу или -O-СН 2-СООН. 17. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 и R2 обозначают водород, a 3R обозначает метил, этил, изопропил, трет-бутил, ОН, фтор, хлор, бром, метоксигруппу, этоксигруппу,-О-СН 2-СООН, -O-СН 2-СН 2-СООН, -O-СН 2-СН 2-СН 2-СООН, -O-СН 2-СООметил, -O-СН 2-СООэтил, -OСН 2-СН 2-СООметил, -O-СН 2-СН 2-СООэтил, -O-СН 2-СН 2-СН 2-СООметил, -O-СН 2-СН 2-СН 2-СООэтил. 18. Соединения общей формулы 1 по п.17, в которой n обозначает 1, R1 и R2 обозначают водород, a 3R обозначает ОН, фтор, хлор, метоксигруппу, этоксигруппу, -О-СН 2-СООН, предпочтительно ОН, фтор,хлор, этоксигруппу или метоксигруппу. 19. Соединения общей формулы 1 по п.8, в которой n обозначает 1, R1 обозначает водород, галоген,С 1-С 4 алкил или -O-С 1-С 4 алкил, R2 обозначает водород, галоген, С 1-С 4 алкил или -O-С 1-С 4 алкил, a R3 обозначает водород. 20. Соединения общей формулы 1 по п.19, в которой n обозначает 1, R1 обозначает водород, фтор,хлор, метил или метоксигруппу, R2 обозначает водород, фтор, хлор, метил или метоксигруппу, a R3 обозначает водород. 21. Соединения общей формулы 1 по одному из пп.8-20, которые представлены в виде их индивидуальных оптических изомеров, смесей индивидуальных энантиомеров или рацематов, предпочтительно в виде энантиомерночистых соединений. 22. Соединения общей формулы 1 по одному из пп.8-21, которые представлены в виде их кислотноаддитивных солей с фармакологически приемлемыми кислотами, а также при определенных условиях в виде сольватов и/или гидратов. 23. Применение соединений общей формулы 1 по одному из пп.8-22 в качестве лекарственных средств. 24. Применение соединений общей формулы 1 по одному из пп.8-22 для получения лекарственного средства, предназначенного для лечения ХОЗЛ. 25. Фармацевтический препарат, отличающийся тем, что он содержит соединение формулы 1 по одному из пп.8-22. 26. Предназначенный для ингаляции фармацевтический препарат, отличающийся тем, что он содержит соединение формулы 1 по одному из пп.8-22. 27. Предназначенный для ингаляции фармацевтический препарат по п.26, отличающийся тем, что он выбран из группы, включающей ингаляционные порошки, содержащие пропеллент дозируемые аэрозоли и не содержащие пропеллент ингаляционные растворы.
МПК / Метки
МПК: A61K 31/538, A61P 11/00, A61K 31/535
Метки: лечения, лёгких, хронического, обструктивного, лекарственные, средства, заболевания
Код ссылки
<a href="https://eas.patents.su/25-8665-lekarstvennye-sredstva-dlya-lecheniya-hronicheskogo-obstruktivnogo-zabolevaniya-lyogkih.html" rel="bookmark" title="База патентов Евразийского Союза">Лекарственные средства для лечения хронического обструктивного заболевания лёгких</a>
Предыдущий патент: Новые сольваты n-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил) бензолсульфонамида
Следующий патент: Модифицированная реакция пикте-шпенглера и полученные с ее использованием продукты
Случайный патент: Способ получения твердой фармацевтической дозированной формы












