Привитые макромолекулярные конъюгаты доксорубицина, обладающие противораковой активностью, и способ их получения
Номер патента: 17073
Опубликовано: 28.09.2012
Авторы: Ульбрих Карел, Ригова Бланка, Этрих Томаш, Хитиль Петр, Мркван Томаш
Формула / Реферат
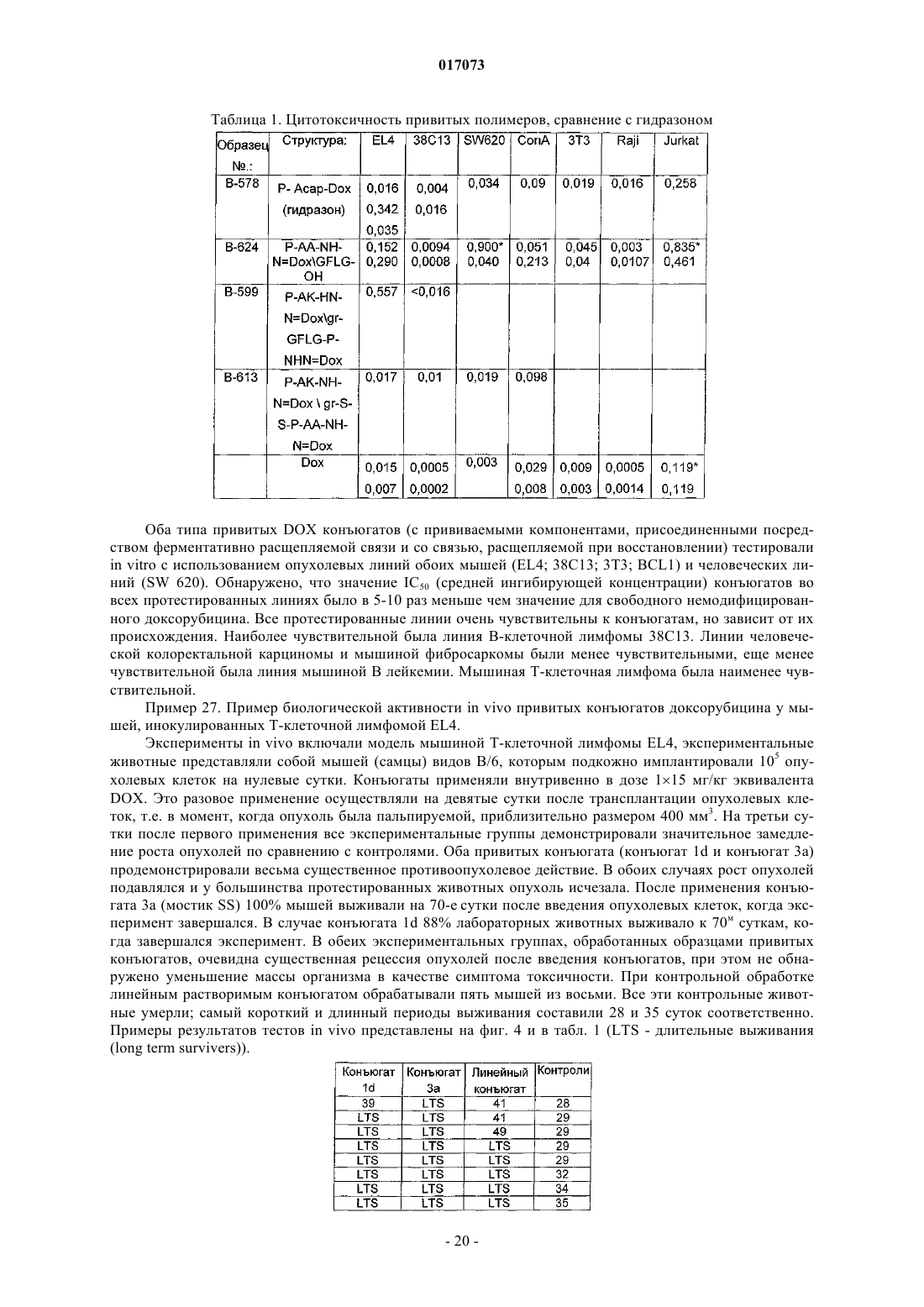
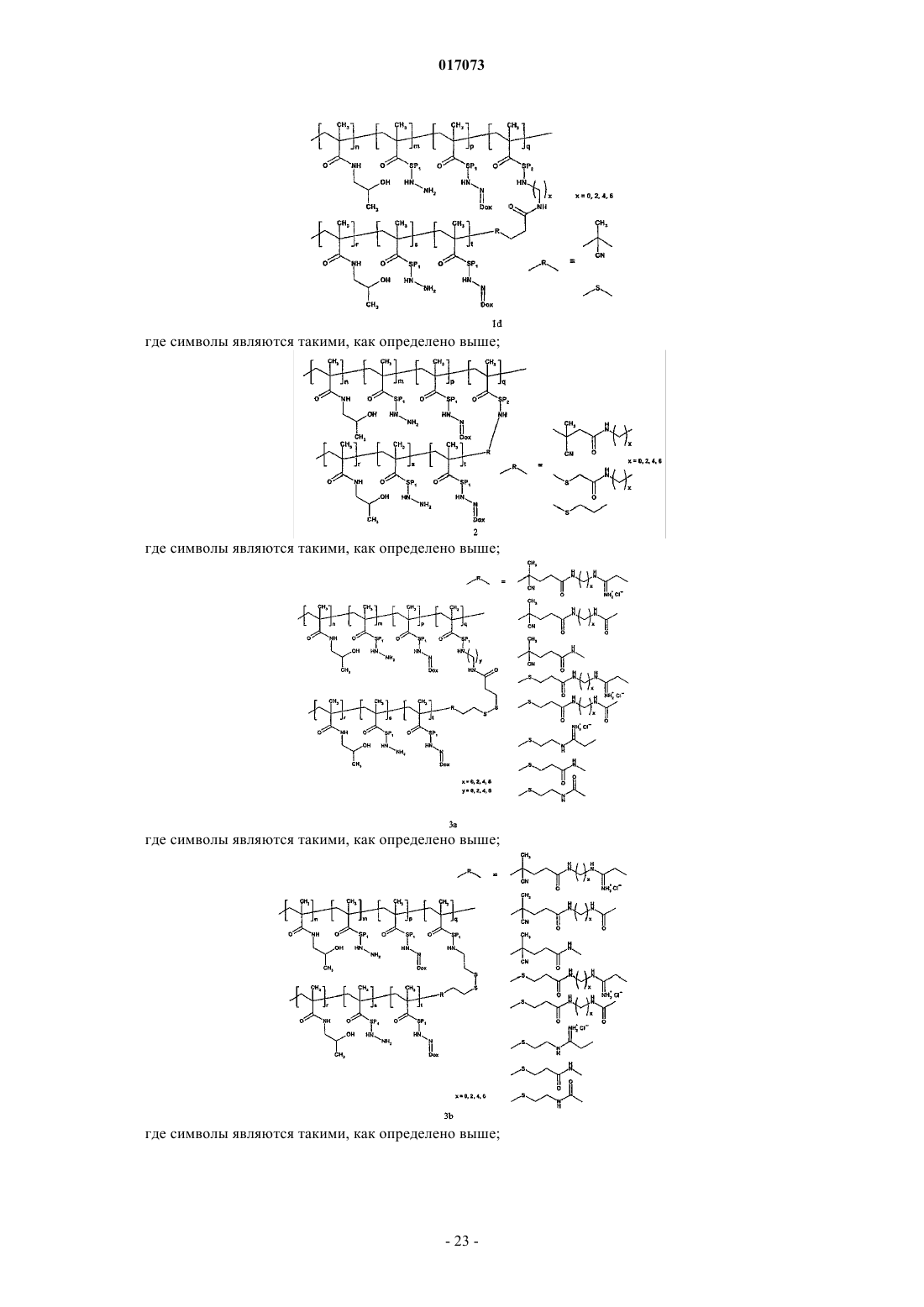
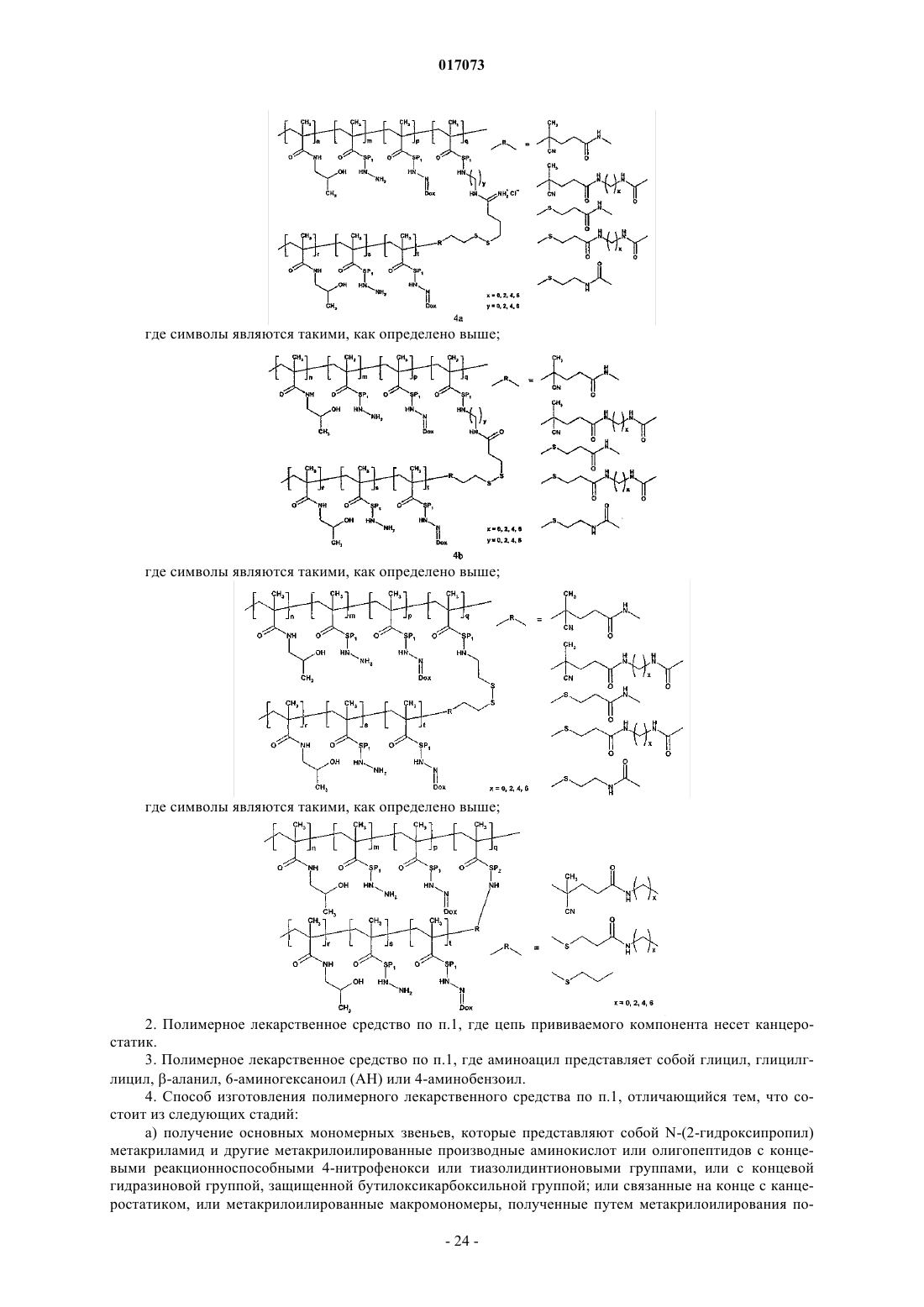
1. Полимерное лекарственное средство, в котором канцеростатик, присоединенный через промежуточные участки, содержащие гидролитически расщепляемые гидразоновые связи, связан с водорастворимым полимерным носителем, приготовленным на основе N-(2-гидроксипропил)метакриламидного сополимера, отличающееся тем, что структура полимерного лекарственного средства состоит из основной цепи N-(2-гидроксипропил)метакриламида, несущей канцеростатик, и другой цепи N-(2-гидроксипропил)метакриламида - прививаемого компонента, где молекулярные массы основной цепи и прививаемого компонента выбраны таким образом, что и основная цепь перед связыванием с прививаемым компонентом и прививаемый компонент способны выводиться из организма после разрушения, тогда как общая молекулярная масса привитого полимера превосходит предел выведения из организма, где полимерное лекарственное средство имеет структуру, выбранную из структур 1a, 1b, 1с, 1d, 2, 3a, 3b, 4a, 4b, 4c и 5, представленных ниже:
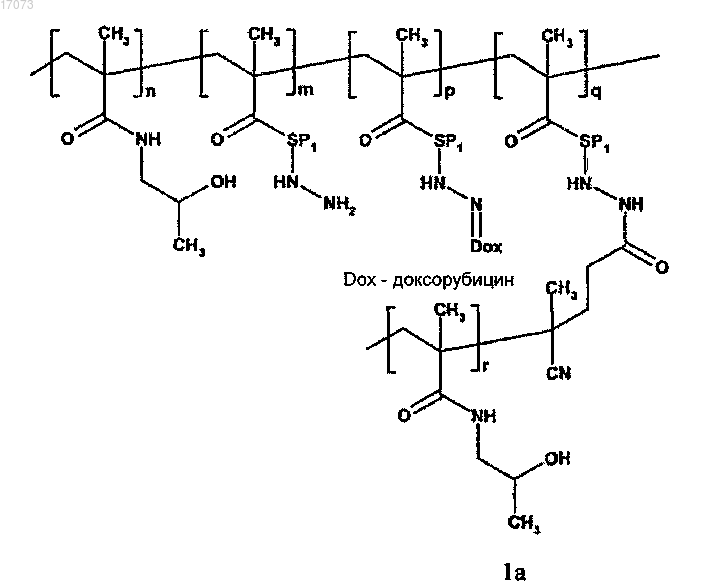
где n находится в диапазоне от 40 до 335, m от 0 до 85, p от 1 до 20, q от 1 до 10 и r от 34 до 350; SP1 представляет собой аминоацил и/или комбинированный ацил, являющийся производным олигопептидов GlyPheGly, GlyLeuGly, GlyLeuPheGly или GlyPheLeuGly;
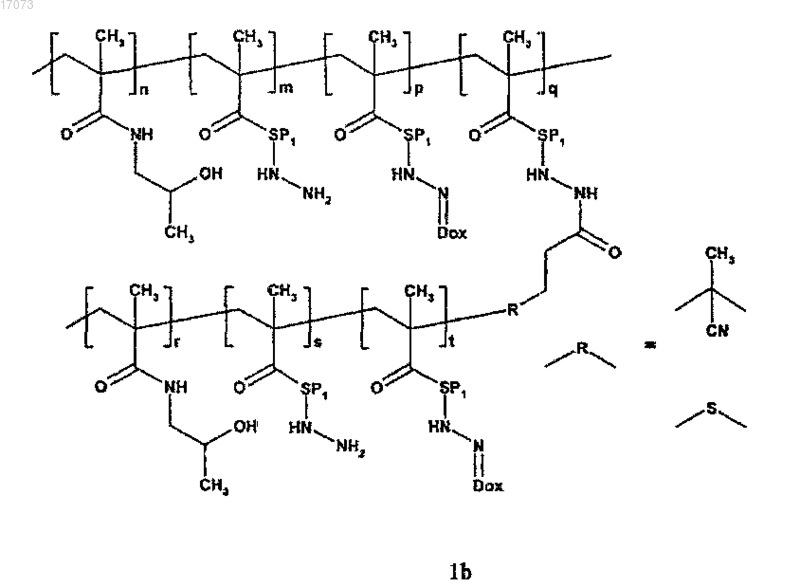
где s находится в диапазоне от 0 до 50 и t от 1 до 20 и другие символы являются такими, как определено выше;
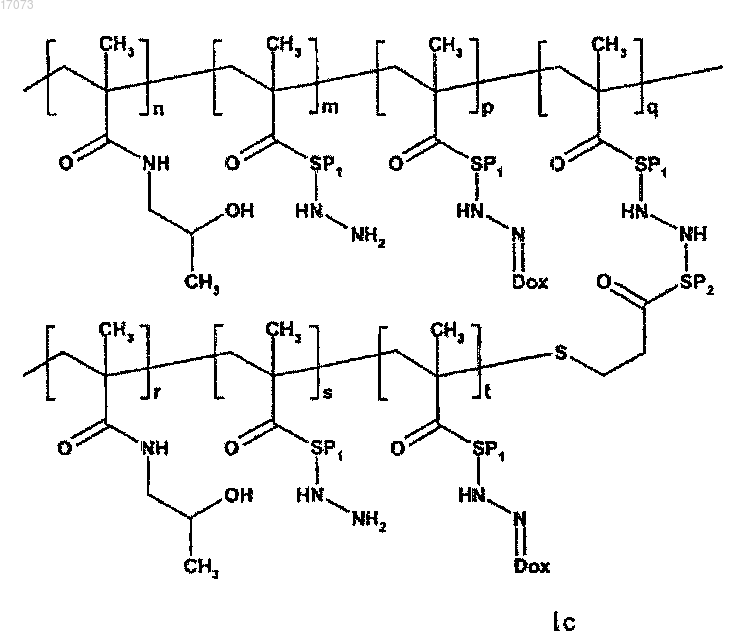
где SP2 представляет собой комбинированный ацил, являющийся производным ферментативно разрушаемой олигопептидной последовательности типа GlyPheGly, GlyLeuGly, GlyLeuPheGly или GlyPheLeuGly, и другие символы являются такими, как определено выше;
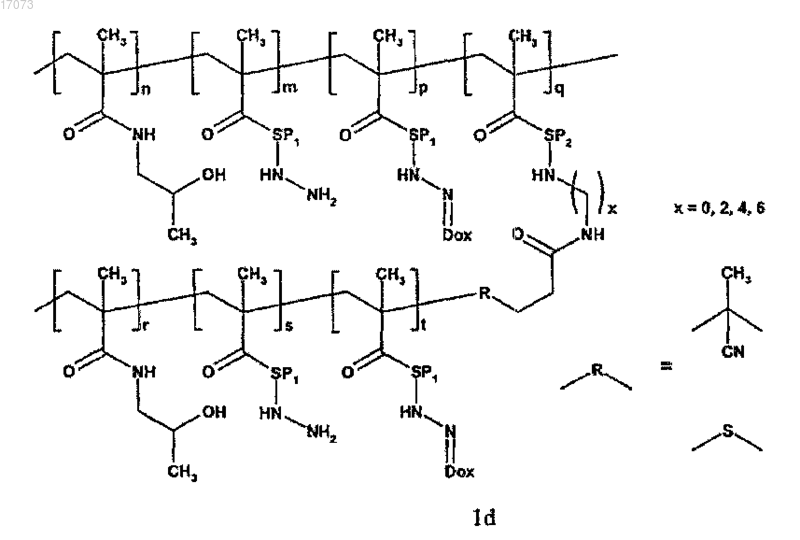
где символы являются такими, как определено выше;
где символы являются такими, как определено выше;
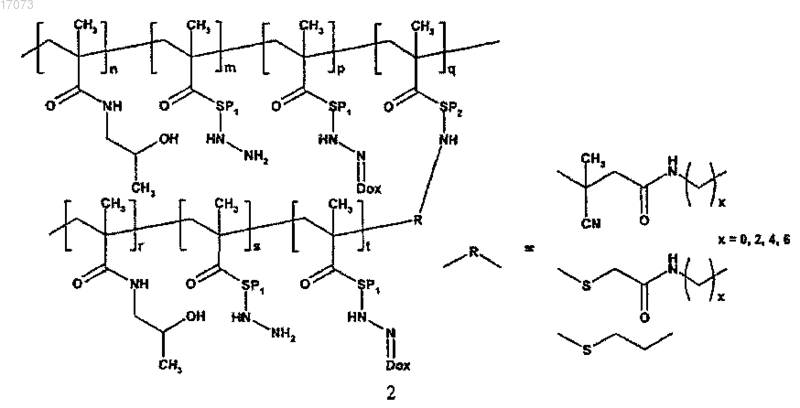
где символы являются такими, как определено выше;
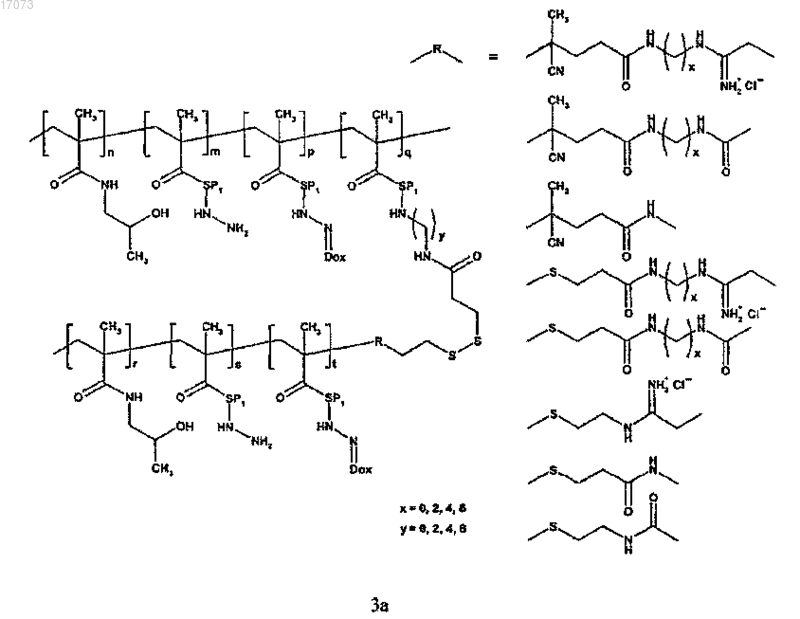
где символы являются такими, как определено выше;
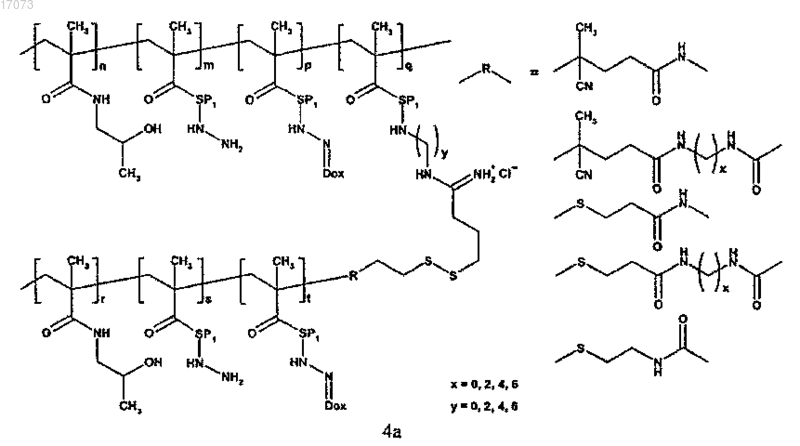
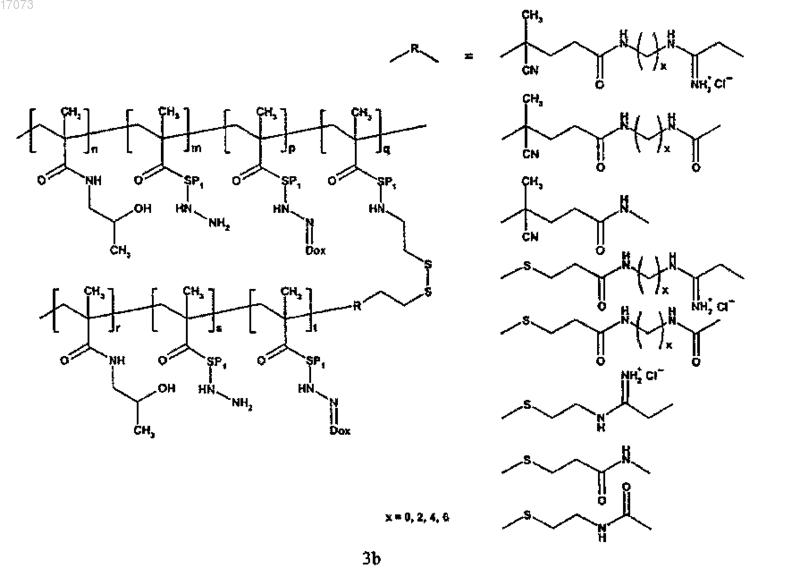
где символы являются такими, как определено выше;
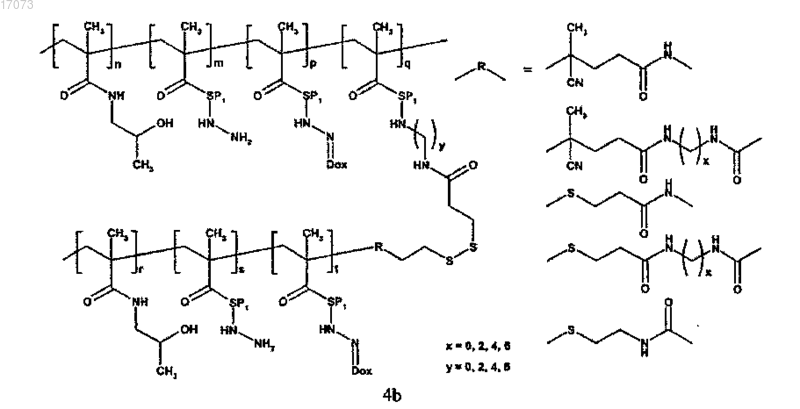
где символы являются такими, как определено выше;
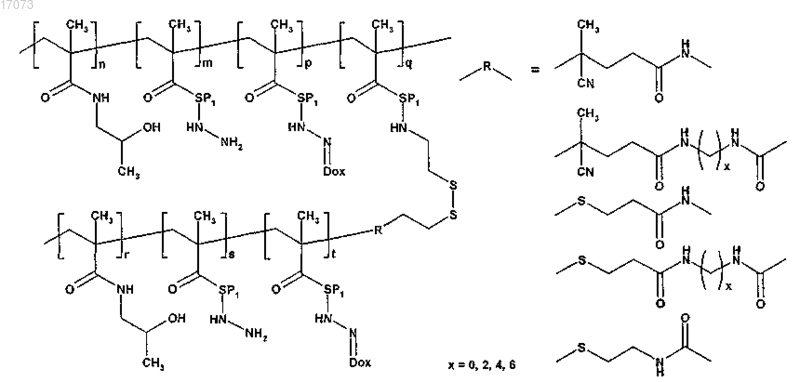
где символы являются такими, как определено выше;
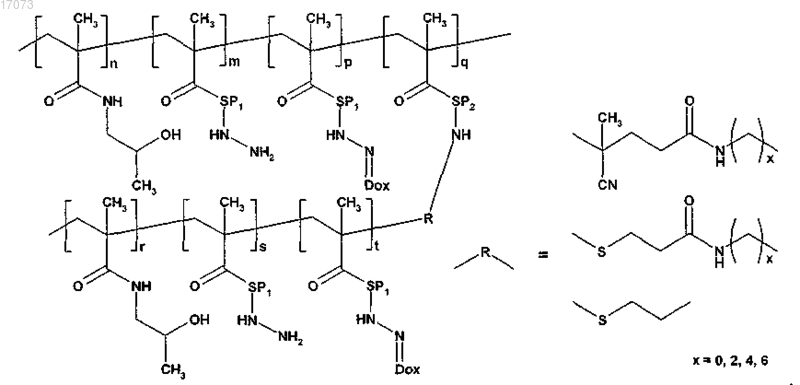
2. Полимерное лекарственное средство по п.1, где цепь прививаемого компонента несет канцеростатик.
3. Полимерное лекарственное средство по п.1, где аминоацил представляет собой глицил, глицилглицил, β-аланил, 6-аминогексаноил (AH) или 4-аминобензоил.
4. Способ изготовления полимерного лекарственного средства по п.1, отличающийся тем, что состоит из следующих стадий:
а) получение основных мономерных звеньев, которые представляют собой N-(2-гидроксипропил)метакриламид и другие метакрилоилированные производные аминокислот или олигопептидов с концевыми реакционноспособными 4-нитрофенокси или тиазолидинтионовыми группами, или с концевой гидразиновой группой, защищенной бутилоксикарбоксильной группой; или связанные на конце с канцеростатиком, или метакрилоилированные макромономеры, полученные путем метакрилоилирования полутелехелатного сополимера N-(2-гидроксипропил)метакриламида с концевой первичной аминогруппой;
б) синтез полимерных предшественников: (а) основной цепи, несущей функциональные 4-нитрофенокси, тиазолидин-2-тионовые, гидразидные, первичные амино, сульфгидрильные (SH) или дитиопиридильные (PDS) группы, путем полимеризации основных мономеров, несущих указанные группы, или путем модификации функциональных групп при полимераналогичном взаимодействии, и (б) прививаемого компонента с концевой реакционноспособной группой, получаемого путем радикальной полимеризации основных мономерных звеньев, или путем радикальной сополимеризации, осуществляемой в присутствии агента передачи цепи или инициируемой инициатором 3,3'-[4,4'-аза-бис(4-циано-4-метил-1-оксобутан-4,1-диил)]бис(тиазолидин-2-тион)ом (ABIA-TT) с последующей модификацией концевых групп;
в) проведение реакции функциональных групп основной цепи с реакционноспособными группами прививаемого компонента с образованием полимерного носителя или конечного полимерного конъюгата в случае, если для получения полимеров использовали мономерные блоки, содержащие канцеростатик;
г) возможное удаление Вос-группы, которая защищает гидразидные группы, и их последующее взаимодействие с канцеростатиком, где
для изготовления полимерного лекарственного средства формул 1a-1c или 1d основная цепь в реакции на стадии в) содержит гидразидные или первичные аминогруппы, тогда как прививаемый компонент имеет концевую N-сукцинимидилэфирную или ацилтиазолидин-2-тионовую группу;
для изготовления полимерного лекарственного средства формулы 2 основная цепь в реакции на стадии в) содержит реакционноспособные 4-нитрофенокси или тиазолидин-2-тионовые группы, тогда как прививаемый компонент имеет концевую гидразидную или первичную аминогруппу;
для изготовления полимерного лекарственного средства формул 3a или 3b основная цепь в реакции на стадии в) содержит реакционноспособные дитиопиридильные группы, тогда как прививаемый компонент имеет концевую сульфгидрильную группу;
для изготовления полимерного лекарственного средства формул 4a; 4b или 4c основная цепь в реакции на стадии в) имеет сульфгидрильные группы, тогда как прививаемый компонент имеет концевую дитиопиридильную группу;
для изготовления полимерного лекарственного средства формулы 5 осуществляют радикальную терполимеризацию N-(2-гидроксипропил)метакриламида с метакрилоилированными аминокислотами или олигопептидами с концевой трет-бутилоксикарбонильной гидразиновой группой и макромономерами, получаемыми путем метакрилоилирования N-(2-гидроксипропил)метакриламида полутелехелатного сополимера с концевой аминогруппой следующей формулы:
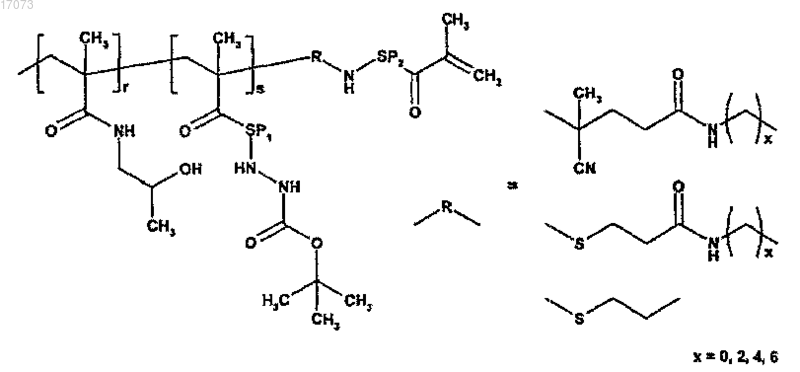
где символы являются такими, как определено выше.
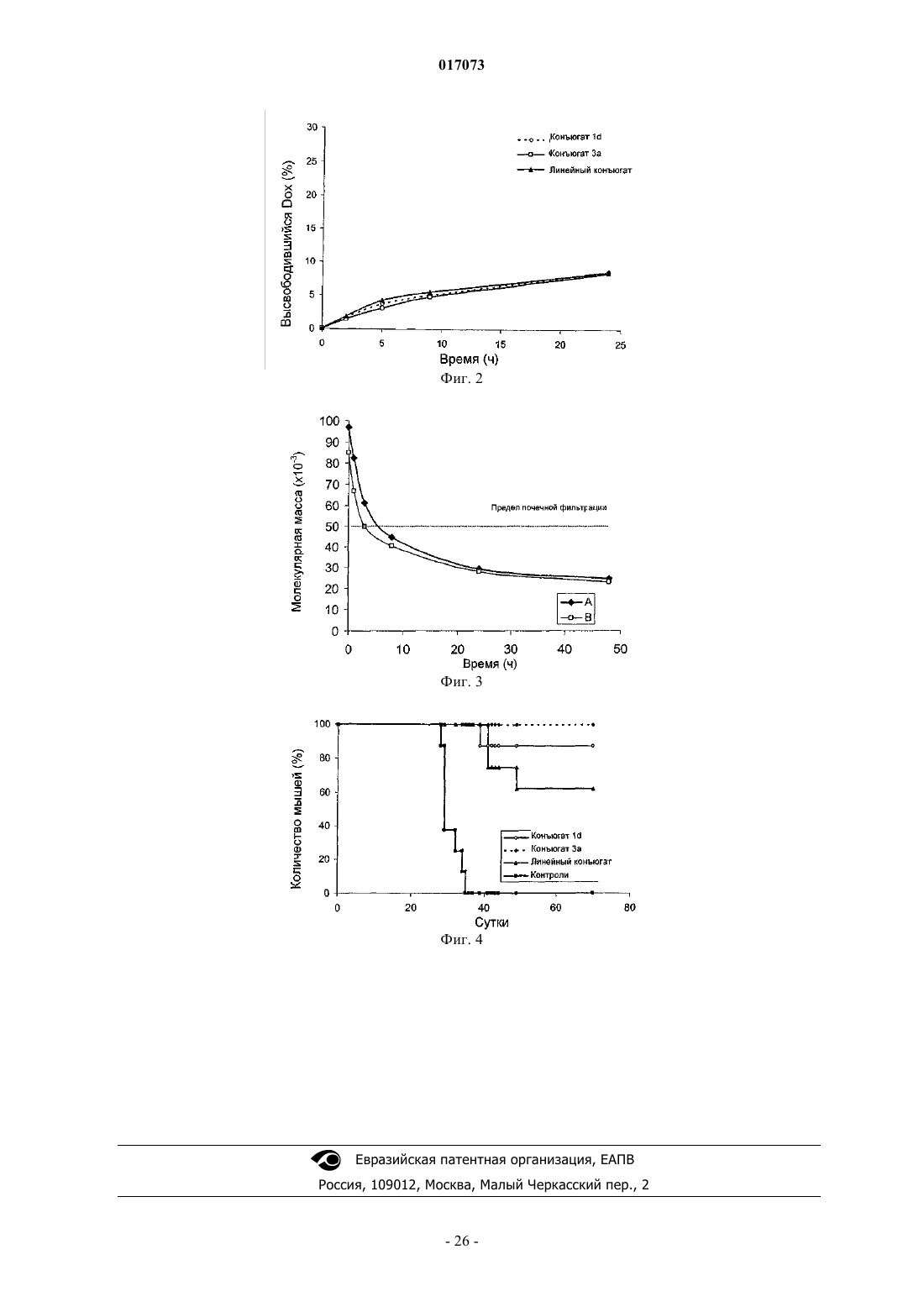
Текст
ПРИВИТЫЕ МАКРОМОЛЕКУЛЯРНЫЕ КОНЪЮГАТЫ ДОКСОРУБИЦИНА,ОБЛАДАЮЩИЕ ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ Полимерное лекарственное средство, в котором канцеростатик, присоединенный через промежуточные участки, содержащие гидролитически расщепляемые гидразоновые связи, связан с водорастворимым полимерным носителем, приготовленным на основе M-(2-гидроксипропил)метакриламидного сополимера, отличающееся тем, что структура полимерного лекарственного средства состоит из основной цепи M-(2-гидроксипропил)метакриламида, несущей канцеростатик, и другой цепи M-(2-гидроксипропил)метакриламида прививаемого компонента, где молекулярные массы основной цепи и прививаемых компонентов выбраны таким образом, что основная цепь перед связыванием с прививаемыми компонентами и сами прививаемые компоненты были способны выводиться из организма после разрушения, тогда как общая молекулярная масса привитого полимера превосходит предел выведения из организма, где указанное полимерное лекарственное средство имеет структуру, выбранную из структур 1a, 1b, 1c, 1d, 2, 3a, 3b, 4 а, 4b, 4 с и 5, раскрытых в описании, а также способ его изготовления. 017073 Область изобретения Изобретение относится к макромолекулярным водорастворимым полимерным носителям канцеростатиков, которые дают возможность для направленного транспорта цитостатиков, в особенности доксорубицина (DOX-doxorubicin), в солидные опухоли и обеспечивают удаление полимера из организма. Эффект конъюгирования полимерного носителя и канцеростатического препарата заключается в направленной терапии опухолей при лечении человека. Предшествующий уровень техники Самые последние тенденции разработки препаратов сфокусированы на таких лекарственных формах, которые дают возможность направленной терапии с помощью биологически активного вещества,предпочтительно в месте требуемого терапевтического действия. Лекарственные средства, обеспечивающие направленное действие, первично применяются в таких областях, в которых побочные эффекты активного компонента могут потенциально вызвать нарушение в какой-либо из здоровых частей тела. Эта опасность наиболее актуальна при лечении цитостатиками. Полимерные вещества, особенно водорастворимые полимеры, применяемые в качестве носителей лекарственных средств, представляют собой замечательную возможность решения проблемы. Присоединение цитостатика к водорастворимому полимеру посредством химической связи способствует значительному повышению растворимости нерастворимых или слабо растворимых лекарственных средств, существенно снижая их токсичность. Высокая молекулярная масса полимеров защищает лекарственное средство от быстрого выведения из организма путем гломерулярной фильтрации, способствуя длительной циркуляции в крови, а также повышенной биологической эффективности лекарственного средства. Кроме того, макромолекулярные вещества, особенно синтетические полимеры, могут аккумулироваться в солидных опухолях благодаря эффекту повышенной проницаемости и задержки (EPR - enhanced permeability and retention) [Maeda 2000, 2001]. Если канцеростатик связан с макромолекулярным носителем, этот факт можно использовать для его направленной аккумуляции в опухоли. Разработано огромное количество систем, основанных на этом принципе. Одну из них представляют собой полимерные мицеллы. Они представляют собой системуноситель, которая отличается по своей структуре от растворимых полимеров, разработанных для осуществления опухолеспецифического транспорта цитостатиков в солидные опухоли, также они выгодным образом используют эффект EPR солидных опухолей для увеличения накопления макромолекулярного лекарственного средства в опухоли, но их обычно получают путем комбинирования амфифильных диблочных сополимеров в макромолекулярные мицельные образования с получением коллоидных растворов. В мицеллах лекарственное средство обычно связано с гидрофобным кором мицеллы путем физических (гидрофобных взаимодействий, ионных связей) или ковалентных связей [Kataoka 2001, Yokoyama 1999, Bae 2003, Yoo 2002, Bronich 1999]. Если лекарственное средство должно высвобождаться из мицеллы, химическую связь необходимо разрушить и при этом гидрофобные взаимодействия в коре мицеллы распадаются. Это в особенности справедливо для гидрофобных лекарств. С другой стороны, в растворимых системах, которые накапливаются в солидных опухолях, макромолекулы растворены в водной среде на молекулярном уровне и молекула обычно принимает форму статистической спирали. Лекарственное средство затем оказывается в контакте с гидрофильным полимером, и при высвобождении ему не требуется преодолевать барьер гидрофобных взаимодействий. Получены и исследованы полимерные конъюгаты канцеростатиков с растворимыми полимерами, в которых лекарственное средство,обладающее противораковым эффектом, связано с полимером путем нерасщепляемой ковалентной связи, гидролитически нестабильной ионной связи или путем ковалентной связи, нестойкой к ферментативному или простому химическому гидролизу. Такие системы способны высвобождать канцеростатик из носителя в его активной форме или в опухоли, или, более специфично, прямо в опухолевой клетке. Значительная группа таких лекарств образована полимерными лекарственными средствами на основе сополимеров N-(2-гидроксипропил)метакриламида (HPMA), некоторое количество которых активно нацелено на опухоли посредством направляющей структуры, присоединенной к полимеру (антитела, гормоны)[Duncan 1985, Rihova 2000, Kopecek 2001, 2000]. Однако их синтез довольно сложен. В литературе приведено много информации по получению и изучению свойств полимеров, несущих канцеростатик, прикрепленный к полимеру с помощью связи, подверженной гидролизу в водной окружающей среде [Kratz 1999]. Среди них значительную роль также играют сополимеры HPMA, несущие канцеростатик доксорубицин, связанный с полимерной цепью с помощью гидролитически расщепляемой гидразоновой связи[Etrych 2002, Ulbrich 2004a, Ulbrich 2004b, Ulbrich - патенты]. Эта связь сравнительно стабильна в среде системы кровообращения (во время транспорта в организме) и гидролитически нестабильна в слегка кислой среде живой клетки. Скорость гидролиза этой связи контролирует скорость высвобождения лекарственного средства и, таким образом, концентрацию активного вещества в том месте, где требуется эффект. В тестах in vitro и in vivo на мышах обнаружили, что эти полимерные канцеростатики демонстрируют значительно более высокий противораковый эффект в отношении ряда опухолевых линий по сравнению со свободным лекарственное средством, и в ряде случаев их применение приводит к полному излечению тестируемых животных даже при терапевтическом способе введения [Rihova 2001, Etrych 2001]. Главная проблема, связанная с применением сополимеров HPMA, состоит в наличии у них нерасщепляемой углеводородной цепи, вследствие чего диапазон молекулярных масс, которые могут быть ис-1 017073 пользованы для получения полимерного носителя, ограничен молекулярными массами меньше чем 40000-50000, т.е. ниже предела выведения из организма. Полимеры, обладающие большими молекулярными массами, не могут быть эффективно и достаточно удалены из организма, и их применение приводит к избыточному накоплению в организме. Для достижения значимого EPR эффекта, т.е. значительного накопления в опухолях, необходимо применять полимеры, включающие сополимеры HPMA, обладающие молекулярной массой, значительно превышающей предел выведения (Seymour 1995, Noguchi 1998). Следовательно, удобно, чтобы молекулярная масса полимерного носителя была достаточно высокой, но, в тоже время, чтобы обеспечивалось разрушение полимера после высвобождения активного компонента на фрагменты, которые могут быть выведены из организма путем, например гломерулярной фильтрации. В настоящем изобретении предполагается и продемонстрирована эффективность макромолекулярного полимерного лекарственного средства с определенным биоразрушаемым носителемкаркасом, которое обеспечивает транспорт цитостатика в опухоль, а также последующее выведение полимерного носителя из организма. Подробное описание изобретения Сущность полимерного лекарственного средства по изобретению заключается в том, что канцеростатик доксорубицин, прикрепленный к полимерным цепям с помощью промежуточных участков, содержащих pH-чувствительные гидролитически расщепляемые гидразоновые связи, связан с водорасвторимым полимерным носителем, изготовленным на основе сополимера HPMA. Такие промежуточные участки могут быть образованы одиночными аминокислотами, олигопептидами или любыми другими структурами, которые могут допускают наличие на конце гидразидной группы. Структура полимерного лекарственного средства выбрана такой, что она состоит из основной полимерной цепи, образованной сополимером HPMA, несущим доксорубицин, связанный посредством гидразоновой связи через промежуточный участок, на который привиты другие цепи гомополимера или сополимера HPMA, также несущие доксорубицин, связанный через гидразоновую связь. Лекарственные средства по изобретению отличаются тем, что прививаемый полимерный компонент присоединен к главной цепи или посредством связи, стабильной в организме, или посредством связей, расщепляемых в организме, предпочтительно связей, расщепляемых в опухолевой клетке-мишени, например, с помощью ферментативно расщепляемой олигопептидной последовательности или с помощью расщепляемой при восстановлении дисульфидной связи. Молекулярная масса основной цепи выбрана ниже предела выведения из организма, предпочтительно находится в диапазоне от 10000 до 50000 г/моль; молекулярные массы прививаемых полимерных компонентов находятся в диапазоне от 5000 до 50000 г/моль. Ферментативно расщепляемые олигопептидные последовательности предпочтительно содержат олигопептидные последовательности GlyLeuGly,GlyPheGly, GlyPheLeuGly или GlyLeuPheGly, расщепляемые при восстановлении связи содержат дисульфидные структуры различного состава. Молекулярные массы прививаемых компонентов и основной цепи выбраны таким образом, что как основная цепь сама по себе до прививания, так и отдельные прививаемые компоненты выводятся из организма, предпочтительно, путем гломерулярной фильтрации. Молекулярная масса привитого сополимера, таким образом, является высокой, превышая предел выведения из организма, и обеспечивает длительное время нахождения в системе кровообращения и существенный EPR эффект, а также захват тканями солидных опухолей. Молекулярные массы новых привитых конъюгатов доксорубицина могут определяться не только молекулярными массами основного полимера и прививаемых полимерных компонентов, но и соотношением количества прививаемых полимерных компонентов на одну главную цепь. Молекулярная масса такого привитого сополимера предпочтительно находится в диапазоне от 50000 до 400000 г/моль; содержание доксорубицина и в основной цепи и в прививаемых полимерных компонентах находится в диапазоне от 1 до 25 мас.% (от 0,3 до 8 мол.%). Полимерное лекарственное средство по изобретению следует вводить преимущественно внутривенно (путем инъекции или инфузии), но его также можно вводить внутрь опухоли или внутрибрюшинно. Полимер с химически связанным цитостатиком стабилен во время циркуляции в кровотоке; гидразоновая связь между доксоруюицином и полимером относительно стабильна в физиологических условиях кровотока (pH 7,4). После выхода из сосудов в ткани и захвата солидными опухолями благодаря EPR эффекту молекулярно сольватированный конъюгат проникает в каждую опухолевую клетку при помощи пиноцитоза, и в результате снижения значения pH от pH 7,4 снаружи до pH 5-6 внутри клетки гидразоновая связь гидролизуется и цитостатик высвобождается в клетку-мишень, что должно активировать его цитотоксическое действие. В слабо кислой восстановительной среде клетки (в ссылках приводятся концентрации глутатиона в цитоплазме живых клеток, варьирующие от 1 до 5 ммоль) должно происходить контролируемое гидролизом высвобождение лекарственного средства и восстановление дисульфидных связей, а также разрушение макромолекулярного привитого полимера на исходные полимерные фрагменты, выводимые из организма. Аналогичное разрушение носителя должно происходить в носителе,содержащем привитые сополимеры, связанные с помощью ферментативно расщепляемых олигопептидных последовательностей. Это разрушение полимерного скелета должно быть вызвано действием лизосомальных клеточных ферментов. Объективность механизма действия полимерных лекарств по настоящему изобретению, как предполагалось выше, продемонстрирована с помощью экспериментов, включающих модель высвобождения доксорубицина из полимерной цепи, а также экспериментов по разру-2 017073 шению полимеров, проводимых в физиологической окружающей среде, моделирующей ситуацию в живой клетке. Результаты таких тестов, включая тесты на противораковую активность, приведены в разделе примеров настоящей заявки. Синтез и структуры полимерных конъюгатов Полимерные конъюгаты по изобретению синтезируют в несколько стадий; подробная конечная структура конъюгата существенно зависит от выбранного подхода синтетиза. На первой стадии синтеза синтезируют основные мономеры: HPMA, метакрилоилированные производные аминокислот и олигопептидов с концевыми 4-нитрофенокси (ONp) или тиазолидин-2-тионовой(TT) группой, метакрилоилированные производные аминокислот и олигопептидов с концевой гидразидной (NHNH2) группой, или с концевой гидразидной группой, защищенной с помощью третбутилоксикарбонильной группы (Boc), или с концевым доксорубицином, связанным посредством гидразоновой связи, и метакрилоилированные макромономеры, полученные путем метакрилоилированияHPMA полутелехелатного сополимера с концевой первичной аминогруппой (NH2). На второй стадии синтезируют полимерные предшественники, т.е. статистические сополимерыHPMA служат в качестве основной цепи, а полутелехелатные полимеры с концевыми реакционноспособными группами служат для прививания к основной полимерной цепи. Основную полимерную цепь, несущую на всем протяжении функциональные группы, такие как 4 нитрофенокси, тиазолидин-2-тионовые группы, гидразидные группы, первичные аминогруппы, сульфгидрильные (SH) группы или дитиопиридильные (PDS) группы, можно получить или путем радикальной сополимеризации вышеописанных функциональных мономеров с HPMA, или путем полимераналогового превращения основного сополимера, несущего функциональные группы. Основной сополимер представляет собой сополимер HPMA и метакрилированные гидразиды аминокислот или олигопептидов, который, по существу, состоит из 70-98 мол.% HPMA и 2-30 мол.% звеньев, несущих функциональные группы. На нижеприведенных структурных схемах приведены два сокращения для промежуточных участков в боковых сополимерных цепях: 1) SP1 представляет собой аминоацил в метакрилоил(аминоацил)гидразидах и метакрилоил(аминоацил)аминах, например глицил, глицилглицил, -аланил, 6-аминогексаноил (AH), 4-аминобензоил или комбинированный ацил, происходящий из олигопептидов, таких как GlyPheGly, GlyLeuGly, GlyLeuPheGly или GlyPheLeuGly; 2) SP2 представляет собой комбинированный ацил в метакрилоил(аминоацил)гидразидах и метакрилоил(аминоацил)аминах, происходящих из ферментативно разрушающейся олигопептидной последовательности, предпочтительно содержащей олигопептидные последовательности GlyLeuGly, GlyPheGly,GlyPheLeuGly или GlyLeuPheGly. Следующие статистические сополимеры с мономерными звеньями, как описано выше, можно получить путем сополимеризации или полимераналоговых взаимодействий. Сополимеры 1. Эти сополимеры несут реакционноспособные 4-нитрофенокси или ацилтиазолидин-2-тионовые группы вдоль всей цепи. Радикальная сополимеризация приводит к получению терполимера HPMA с метакрилоилированными аминокислотами или олигопептидам с концевой Вос-защищенной гидразидной группой, и метакрилоилированным биоразрушаемым олигопептидом (например GlyPheLeuGly) с концевыми 4 нитрофенокси (сополимер 1a) или тиазолидин-2-тионовыми группами (сополимер 1b). Структурная схема сополимеров 1a, 1b Сополимеры 2. Эти сополимеры несут реакционноспособные гидразидные или первичные аминокислотные группы вдоль всей цепи. Радикальная сополимеризация HPMA с метакрилоилированными аминокислотами или олигопептидами с концевой гидразидной группой приводит к получению сополимера 2a.-3 017073 Структурная схема сополимера 2a Радикальная сополимеризация приводит к получению терполимера HPMA с метакрилоилированными аминокислотами или олигопептидами с концевой Boc-защищенной гидразидной группой и с метакрилоилированным биоразрушаемым олигопептидом (например, GlyPheLeuGly) с концевой гидразидной группой (сополимер 2b). Структурная схема сополимера 2b Сополимер 2c получают путем полимераналогового взаимодействия с использованием сополимеров 1a и 1b. Статистический сополимер, несущий реакционноспособные гидразидные или первичные аминокислотные группы вдоль всей цепи, получают при взаимодействии 4-нитрофенилового эфира (сополимер 1a) или ацилтиазолидин-2-тионовых групп (сополимер 1b) с избытком гидразина гидрата, этилендиамина, бутилендиамина или гексаметилендиамина. Структурная схема сополимера 2c Сополимеры 3. Эти статистические сополимеры несут реакционноспособные дитиопиридильные группы вдоль всей цепи. После удаления защитных групп полимераналоговое взаимодействие сополимера 2a и Nсукцинимидил-[3-(2-пиридилтио)]пропионата (SPDP) (в общем случае, любого бифункционального агента с активированной карбоксильной группой и пиридилдисульфидной группой, такого как SPDP, 4 сукцинимидилоксикарбонилметил(2-пиридилдитио)толуол, N-сукцинимидил-[4-(2-пиридилдитио)] бутират, N-(2-сульфосукцинимидил-[3-(2-пиридилдитио)]пропионат) приводит к получению терполимера HPMA с метакрилоилированными аминокислотами или олигопептидами с концевой гидразидной группой, и с метакрилоилированными аминокислотами или олигопептидами с концевой N-[3-(2 пиридилдитио)пропионил]этиламидной группой (сополимер 3a). Структурная схема сополимера 3a Полимераналоговое взаимодействие сополимеров 2b и 2c с N-сукцинимидил-[3-(2-пиридилдитио)] пропионатом (SPDP) приводит к получению терполимера HPMA с метакрилоилированными аминокис-4 017073 лотами или олигопептидами с концевой Boc-защищенной гидразидной группой, и с метакрилоилированным биоразлагаемым олигопептидом (например, GlyPheLeuGly) с концевой N-[3-(2-пиридилдитио)пропионил]этиламидной группой (сополимер 3b). Структурная схема сополимера 3b Полимераналоговое взаимодействие сополимеров 1a и 1b с 2-(2-пиридилдитио)этиламином (PDEA)(в общем случае, с любым бифункциональным агентом с первичной амино или гидразидной группой, и пиридилсульфидной группой, таким как PDEA, 2-(2-пиридилдитио)этилгидразин, 4-(2-пиридилдитио) бутиламин) приводит к получению терполимера HPMA с метакрилоилированными аминокислотами или олигопептидами с концевой Вос-защищенной гидразидной группой, и метакрилоилированным биоразлагаемым олигопептидом (например, GlyPheLeuGly) с концевой 2-(2-пиридилдитио)этиламидной группой.(сополимер 3c). Структурная схема сополимера 3c Сополимеры 4. Эти статистические сополимеры несут реакционноспособные сульфгидрильные группы вдоль всей цепи. После удаления защитной группы полимераналоговое взаимодействие сополимера 2a и 2 иминотиолата (ITH - iminothiolate) приводит к получению терполимера HPMA с метакрилоилированными аминокислотами или олигопептидами с концевой гидразидной группой, и с метакрилоилированными аминокислотами или олигопептидами с концевой 4-сульфанилбутанимидогидразидной группой (сополимер 4 а). Структурная схема сополимера 4a Полимераналоговое взаимодействие сополимеров 2b и 2c с 2-иминотиолатом (ITH) приводит к получению терполимера HPMA с метакрилоилированными аминокислотами или олигопептидами с концевой Boc-защищенной гидразидной группой, и с метакрилоилированным олигопептидом (например GlyPheLeuGly) с концевой 4-сульфанилбутанимидамидной группой (сополимер 4b). Структурная схема сополимера 4b-5 017073 Полимераналоговое взаимодействие сополимера 3a с дитиотреитолом (DTT - dithiothreitol) приводит к получению терполимера HPMA с метакрилоилированными аминокислотами или олигопептидами с концевой гидразидной группой, и с метакрилоилированными аминокислотами или олигопептидами с концевой 3-сульфанилпропангидразидной группой (сополимер 4c). Структурная схема сополимера 4 с Полимераналоговое взаимодействие сополимеров 3b и 3c с дитиотриэтолом (DTT) приводило к получению терполимера HPMA с метакрилоилированными аминокислотами или олигопептидами с концевой Вос-защищенной гидразидной группой, и с метакрилоилированным олигопептидом (например GlyPheLeuGly) с концевой 3-сульфанилпропанамидной (сополимер 4d) или 2-сульфанилэтиламинной группой (сополимер 4e). Структурная схема сополимеров 4d, 4e Полутелехелатные сополимеры характеризуются содержанием HPMA в количестве от 85 до 99 мол.%, 1-15 мол.% звеньев метакрилоилированных Boc-защищенных гидразидов аминокислот или олигопептидов, и реакционноспособными группами, расположенными на конце полимерной цепи. Эти полимеры получают путем радикальной сополимеризации, проводимой в присутствии регулятора степени полимеризации [сульфанилпропионовой кислоты (SPA) или цистеамина], в условиях инициации 3,3'-азабис(4-цианоизовалериановая кислота) (ABIA) азоинициатора или 3,3'-[4,4'-аза-бис(4-циано-4-метил-1 оксобутан-4,1-диил)]бис(тиазолидин-2-тион) (ABIA-TT) реакционноспособного азоинициатора. Следующие полутелехелатные сополимеры получают в виде прививаемых компонентов для получения привитых сополимеров путем сополимеризации и модификации концевых функциональных групп: Структурная схема ABIA-TT Прививаемые компоненты 1. Эта группа полимеров включает полутелехелатные сополимеры, содержащие концевые реакционноспособные группы N-сукцинимидильного эфира или ацилтиазолидин-2-тионовые группы. Радикальная полимеризация HPMA, инициированная с помощью инициатора ABIA-TT, приводит к получению гомополимера HPMA с концевой реакционноспособной ацилтиазолдин-2-тионовой группой(прививаемый компонент 1a). Структурная схема прививаемого компонента 1a Сополимер HPMA с метакрилоилированными аминокислотами или олигопептидами с концевойBoc-защищенной гидразидной группой получают путем радикальной полимеризации HPMA, проводимой в присутствии трансформирующего агента SPA. Сополимер заканчивается группой Nсукцинимидильного эфира (прививаемый компонент 1b).-6 017073 Структурная схема прививаемого компонента 1b Сополимер HPMA с метакрилоилированными аминокислотами или олигопептидами с концевойBoc-защищенной гидразидной группой и концевой ацилтиазолидин-2-тионовой группой получают путем радикальной полимеризации соответствующих мономеров в условиях инициации с помощью ABIA-TT. Сополимер с концевой N-сукцинимидильной эфирной группой получают аналогично в условиях инициации с помощью ABIA и последующей активацией концевой карбоксильной группы с помощью Nгидроксисукцинимида (прививаемый компонент 1 с). Структурная схема прививаемого компонента 1 с Сополимер HPMA с метакрилоилированными аминокислотами или олигопептидами с концевойBoc-защищенной гидразидной группой, и с концевым N-сукцинимидильным эфиром биоразрушаемого олигопептида (например GlyPhe LeuGly-OSu), в общем случае, SP2 (прививаемый компонент 1d), получают путем радикальной сополимеризации HPMA с соответствующими мономерами, инициированной с помощью ABIA, с последующей активацией концевой карбоксильной группы с помощью N-гидроксисукцинимида. Структурная схема прививаемого компонента 1d Прививаемые компоненты 2. Эти полутелехелатные сополимеры содержат концевой реакционноспособный гидразид или первичные аминогруппы. Сополимер HPMA с метакрилоилированными аминокислотами или олигопептидами с концевой Boc-защищенной гидразидной группой получают путем радикальной сополимеризации,проводимой в присутствии цистамина. Этот сополимер заканчивается первичной аминогруппой (прививаемый компонент 2 а). Структурная схема прививаемого компонента 2 а Сополимер HPMA с метакрилоилированными аминокислотами или олигопептидами с концевойBoc-защищенной гидразидной группой, заканчивающейся аминокислотой, получают взаимодействии концевых активированных карбоксильных групп прививаемых компонентов 1b и 1c в избытке гидразингидрата, этилендиамина, бутилендиамина или гексаэтилендиамина (прививаемый компонент 2b). Структурная схема прививаемого компонента 2b Прививаемые компоненты 3. Эти полутелехелатные сополимеры содержат концевые реакционноспособные дитиопиридильные группы. Сополимер HPMA с метакрилоилированными аминокислотами или олигопептидами с концевой Вос-защищенной гидразидной группой с концевой 2-(2-пиридилдитио)этиламидной группой получают путем взаимодействия концевых реакционноспособных групп прививаемых компонентов 1b и 1 с с PDEA(Прививаемый компонент 3a). Структурная схема прививаемого компонента 3a Сополимер HPMA с метакрилоилированными аминокислотами или олигопептидами с концевойBoc-защищенной гидразидной группой с концевой N-[3-(2-пиридилтио)пропионил]амидной группой получают путем взаимодействия концевых реакционноспособных групп прививаемых компонентов 2 а и 2b с SPDP (Прививаемый компонент 3b). Структурная схема прививаемого компонента 3b Прививаемые компоненты 4. Эти полутелехелатные сополимеры содержат концевые реакционноспособные сульфгидрильные группы. Сополимер HPMA с метакрилоилированными аминокислотами или олигопептидами с концевойBoc-защищенной гидразидной группой получают путем взаимодействия прививаемых компонентов 2 а и 2b с ITH. Полимерная цепь этого сополимера заканчивается 4-сульфанилбутанимидамидной или 4 сульфанилбутанимидогидразидной группой (прививаемый компонент 4 а). Структурная схема прививаемого компонента 4 а-8 017073 Сополимер HPMA с метакрилоилированными аминокислотами или олигопептидами с концевойBoc-защищенной гидразидной группой получают путем взаимодействия прививаемых компонентов 3a и 3b с DTT. Цепь этого сополимера заканчивается 3-сульфанилпропангидразидной, 3-сульфанилпропанамидной или 2-сульфанилэтиламинной группой (прививаемый компонент 4b). Структурная схема прививаемого компонента 4b Полимерный носитель и полимерный конъюгат Полимерный носитель представляет собой привитый макромолекулярный полимер без связанного с ним лекарственного средства, полученный путем реакции прививания полутелехелатного сополимера к основному сополимеру, как показано в разделе примеров. Для этих реакций преимущественно применяют упомянутые выше сополимеры, гидразидные группы которых защищены с помощью Boc группы(трет-бутилоксикарбонила). На последней стадии синтеза конъюгата защитную группу удаляют из гидразидной группы и конъюгат связывают с доксорубицином через гидразоновую связь путем реакции в метаноле в условиях катализа уксусной кислотой. Конечное полимерное лекарственное средство (конъюгат) очищают с помощью осаждения и, при необходимости, с помощью колоночной хроматографии, как продемонстрировано в разделе примеров. Предмет данного патента включает полимерные конъюгаты доксорубицина, подробные структуры которого продемонстрированы в разделе схем, и синтез которого описан в разделе примеров. В отношении типа групп в основных полимерах и полутелехелатных привитых сополимерах, вступающих в реакцию, полимерные конъюгаты дополнительно разделены на 5 основных групп. Получали следующие конъюгаты. Конъюгаты 1. Эти конъюгаты несут DOX, связанный с полимером посредством гидразоновой связи; привитые сополимеры связаны с основной цепью при помощи не подвергающейся расщеплению связи. Для получения этих полимерных конъюгатов используют сополимеры, несущие гидразид или первичные аминогруппы вдоль основной цепи, и полутелехелатные сополимеры с концевым N-сукцинимидильным эфиром или ацилтиазолидин-2-тионовые группы. Конъюгат 1a получают путем реакции гидразидных групп сополимера 2a с ацилтиазолидин-2 тионовыми группами прививаемого компонента 1a с последующим удалением защиты гидразидных групп и связыванием DOX с полимером. Структурная схема конъюгата 1a (n = 40 - 335, m = 0 - 85, p = 1 - 20, q = 1 -10, r = 34-350) Конъюгат 1b получают путем реакции гидразидных групп сополимера 2a с тиазолидин-2 тионовыми или N-сукцинимидильными группами прививаемого компонента 1b или 1 с с последующим удалением защиты с гидразидных групп и связыванием DOX с полимером.-9 017073 Структурная схема конъюгата 1b (n=40-335, m=0-85, p=1-20, q=1-10, r=34-350, s=0-50, t=1-20) Конъюгат 1c получают путем реакции гидразидных групп сополимера 2a с группами Nсукцинимидильного эфира прививаемого компонента 1d с последующим удалением защиты с гидразидных групп и связыванием DOX с полимером. Структурная схема конъюгата 1 с (n=40-335, m=0-85, p=1-20, q=1-10, r=34-350, s=0-50, t=1-20) Конъюгат 1d получают путем реакции гидразида или первичных аминогрупп сополимера 2b или 2c с ацилтиазолидин-2-тионовой группой или группой N-сукцинимидильного эфира прививаемого компонента 1b или 1c с последующим удалением защиты с гидразидных групп и связыванием DOX с полимером. Структурная схема конъюгата 1d (n=40-335, m=0-85, p=1-20, q= 1-10, r= 34-350, s=0-50, t= 1-20) Конъюгаты 2. Эти конъюгаты несут DOX, связанный с полимером посредством гидразоновой связи; прививаемые компоненты связаны с основной цепью посредством биоразрушаемой связи - ферментативно расщепляемой олигопептидной последовательности. Для получения этих полимерных конъюгатов использовали сополимеры, несущие 4-нитрофенокси или тиазолидин-2-тионовые группы вдоль основной цепи, и полутелехелатные сополимеры с концевой гидразидной или первичной аминогруппами. Коньюгат 2 получают путем реакции ацилтиазолидин-2-тионовой или 4-нитрофенильной эфирной групп сополимера 1a или 1b с гидразидными или первичными аминогруппами прививаемых компонентов 2a и 2b, после чего осуществляют снятие защиты с гидразидных групп и присоединяют к полимеру- 10017073 Структурная схема конъюгата 2 (n=40-335, m=0-85, p=1-20, q=1-10, r=34-350, s=0-50, t=1-20) Конъюгаты 3. Эти конъюгаты несут DOX, связанный с полимером посредством гидразоновой связи; прививаемые компоненты связаны с основной цепью посредством биоразрушаемой связи - дисульфидные мостики расщепляются при восстановлении в цитоплазме клеток-мишеней. Для получения этих полимерных конъюгатов использовали сополимеры, несущие реакционноспособные дитиопиридильные группы вдоль основной цепи, и полутелехелатные сополимеры с концевыми сульфгидрильными группами. Конъюгат 3a получают путем реакции дитиопиридильных групп сополимера 3a или 3b с сульфгидрильными группами прививаемого компонента 4a или 4b с последующим удалением защиты с гидразидных групп и присоединением DOX к полимеру. Структурная схема конъюгата 3 (n=40-335, m=0-85, p=1-20, q=1-10, r= 34-350, s=0-50, t= 1-20) Конъюгат 3b получают путем реакции дитиопиридильных групп сополимера 3c с сульфгидрильными группами прививаемого компонента 4a или 4b с последующим удалением защиты с гидразидных групп и связыванием DOX с полимером. Структурная схема конъюгата 3b (n=40-335, m=0-85, p=1-20, q= 1-10, r= 34-350, s= 0-50, t=1-20)- 11017073 Конъюгаты 4. Эти конъюгаты несут DOX, связанный с полимером посредством гидразоновой связи; прививаемые компоненты связаны с основной цепью посредством биоразрушаемой связи - дисульфидные мостики расщепляются при восстановлении в цитоплазме клеток-мишеней. Для получения этих полимерных конъюгатов используют сополимеры, несущие сульфгидрильные группы вдоль основной цепи, и полутелехелатный сополимер с концевыми реакционноспособными дитиопиридильными группами. Конъюгат 4a получали путем реакции сульфгидрильных групп сополимера 4a или 4b с дитиопиридильными группами прививаемого компонента 3a или 3b с последующим удалением защиты гидразидных групп и связыванием DOX с полимером. Структурная схема конъюгата 4a (n=40-335, m=0-85, р=1-20, q=1-10, r=34-350, s=0-50, t=1-20) Конъюгат 4b получают путем реакции сульфгидрильных групп сополимера 4 с или 4d с дитиопиридильными группами прививаемого компонента 3a или 3b с последующим удалением защиты с гидразидных групп и присоединением DOX к полимеру. Структурная схема конъюгата 4b (n=40-335, m=0-85, p=1-20, q=1-10, r=34-350, s= 0-50, t= 1-20) Конъюгат 4c получают путем реакции сульфгидрильных групп сополимера 4e с дитиопиридильными группами прививаемого компонента 3a или 3b с последующим удалением защиты с гидразидных групп и присоединением DOX к полимеру. Структурная схема конъюгата 4 с (n=40-335, m=0-85, p=1-20, q=1-10, r= 34-350, s=0-50, t=1-20)- 12017073 Конъюгаты 5. Эти конъюгаты несут DOX, связанный с полимером посредством гидразоновой связи; прививаемые компоненты связаны с основной цепью путем биоразрушаемой связи - ферментативно расщепляемой олигопептидной последовательности. Их получают путем радикальной терполимеризации HPMA с метакрилоилированными аминокислотами или олигопептидами, оканчивающимися Boc-защищенной гидраэидной группой, а метакрилоилированные макромономеры получают путем метакрилоилированияHPMA полутелехелатного сополимера, оканчивающегося первичной аминогруппой (макромономеры,фиг. 32). Макромономеры получают путем реакции гидразида или первичных аминогрупп прививаемых компонентов 2a и 2b с метакрилоилированными производными биоразрушаемых олигопептидов, оканчивающихся 4-нитрофенокси или тиазолидин-2-тионовой группой. Структурная схема макромономеров (r=34-350, s=1-0) Структурная схема конъюгата 5 (n=40-335, m=0-85, p=1-20, q=1-10, r=34-350, s=0-50, t=1-20) Краткое описание графических материалов На фиг. 1 показан график скорости высвобождения DOX из привитых полимерных конъюгатов и линейного полимерного конъюгата в буфере с pH 5 (модель внутриклеточной среды). На фиг. 2 показан график скорости высвобождения DOX из привитых полимерных конъюгатов и линейного полимерного конъюгата в буфере с pH 7,4 (модель системы кровотока). Фиг. 3 демонстрирует зависимость молекулярной массы полимерных конъюгатов от времени в ходе их разрушения - A) разрушение конъюгата 1d с помощью лизосомального фермента катепсина B[с(катепсин B) = 5,10-7 моль/л]; B) разрушение конъюгата 3a с помощью глутатиона [с(глутатион) = 3,10-3 моль/л]. На фиг. 4 показан график уровня выживания мышей B/6, инокулированных мышиной лимфомой EL 4, обработанных конъюгатами, привитыми DOX, после внутривенного введения разовой дозы 15 мг/кг эквивалента DOX в терапевтическом способе введения лекарственного средства. Примеры способов синтеза промежуточных продуктов и конъюгатов по изобретению Пример 1. Синтез мономеров и инициатора ABIA-TT. 3,3'-[4,4'-азобис(4-циано-4-метил-1-оксо-бутан-4,1-диил)]бис(тиазол идин-2-тион) (ABIA-TT) получали в соответствии с ранее описанным способом [Subr 2006].HPMA получали в соответствии с ранее описанным способом [Ulbrich a kol. 2000]. Элементарный анализ: аналитически вычислено: 58,8% С, 9,16% Н, 9,79% N; получено: 58,98% С, 9,18% Н, 9,82% N. Продукт был хроматографически чистым. 6-(Метакрилоиламино)гексаноил-N'-(трет-бутилоксикарбонил)гидразин (MA-AH-NHNH-Boc) получали в соответствии с ранее описанным способом [Ulbrich 2004a]. 6-(Метакрилоиламино)гексаноилгидразин (N1-(6-гидразино-6-оксогексил)-2-метилакриламид) (MAAH-NHNH2) получали в соответствии с ранее описанным способом [патенты Ulbrich, патент Etrych].MA-GFLG-TT или MA-GFLG-ONp. 4-Нитрофениловый эфир N-метакрилоилглицил-DL-фенилаланил лейцилглицина (MA-GFLG-ONp) получали в соответствии с ранее описанным способом [Rejmanova 1977]. Тиазолидин-2-тион N-метакрилоилглицил-DL-фенилаланиллейцил глицина (MA-GFLG-TT) получали в соответствии с ранее описанным способом [патент Subr]. 6-(Метакрилоиламино)гексаноилгидразин-доксорубицин (МА-АН-NFfN=DOX). 6-(Метакрилоиламино)гексаноилгидразин (40 мг, 0,188 ммоль) растворяли в 6 мл метанола при комнатной температуре. Раствор выливали в реакционный сосуд, в который помещали доксорубицинHCl (115 мг, 0,198 ммоль), и суспензию интенсивно перемешивали. К суспензии добавляли 310 мкл уксусной кислоты и реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Протекание процесса реакции отслеживали при помощи тонкослойной хроматографии (TCX) на пластине с силикагелем 60 F254 (метанол:хлороформ:уксусная кислота 2:8:1, Rf(DOX) = 0,75, Rf(MAAH-NHN=DOX)= 0,9) к гомогенной реакционной смеси затем добавляли 100 мг сополимера 1 (для связывания оставшегося свободного DOX) и реакционную смесь перемешивали при комнатной температуре в течение еще 4 ч. Продукт очищали от полимерных и низкомолекуляриых примесей при помощи гель- 13017073 хроматографии в колонке (30 см 3 см), заполненной Sephadex LH-20 в метаноле. Фильтрат концентрировали до 2 мл и продукт осаждали в 30 мл диэтилового эфира. Продукт высасывали, промывали небольшим количеством диэтилового эфира, и сушили в вакууме до постоянной массы. Выход составил 110 мг продукта (79%), имеющего температуру плавления от 172 до 175C. ТСХ (метанол:хлороформ:уксусная кислота 2:8:1): одно пятно при Rf = 0,9, времяпролетной масс-спектрометрии с ионизацией лазерной десорбцией с использованием матрицы (MALDI-TOF MS): 762 (M+Na). Метакрилоилированный макромономер Поли(HPMA-co-MA-AH-NHNH-Boc)-GLFG-MA получали путем реакции концевого гидразида первичных аминогрупп полутелехелатных сополимеров (прививаемые компоненты 2a и 2b) с 4-нитрофенокси или тиазолидин-2-тионовыми группами метакрилоилированных производных биоразрушаемых олигопептидов. 200 мг прививаемого компонента 2a (0,0125 ммоль групп NH2) растворяли в 2 мл метанола и при интенсивном перемешивании при комнатной температуре добавляли раствор 7,7 мг MA-GFLG-TT(0,0137 моль, 110% по отношению к группе NH2) в 1 мл метанола. Через 2 ч реакционную смесь очищали от низкомолекулярных примесей при помощи гель-хроматографии в колонке заполненной Sephadex LH20 в метаноле с обнаружением при помощи RI. Полимерную фракцию отбирали, концентрировали до 3 мл в вакуумном роторном испарителе и макромономер выделяли путем осаждения в 30 мл этилацетата. Продукт сушили до постоянной массы. Пример 2. Синтез полимерного предшественника - сополимера 1b - сополимера HPMA с MAGFLG-TT. Сополимер поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-GFLG-TT) получали при помощи радикальной сополимеризации в растворе HPMA, MA-AH-NHNH-Boc и MA-GFLG-TT в диметилсульфоксиде(ДМСО) при 60C. 465 мг (3,25 ммоль) HPMA, 44,5 мг (0,14 ммоль) MA-AH-NHNH-Boc, 100 мг (0,18 ммоль) MAGFLG-TT (12,5% по массе мономеров) и 98,3 мг (0,60 ммоль) ABIN (2 мас.%) растворяли в 3,8 мл ДМСО. Ампулу с раствором полимеризационной смеси продували азотом в течение 10 мин, затем помещали в термостат, нагретый до 60C, на 6 ч. Затем реакционную смесь осаждали в 80 мл смеси ацетона:диэтилового эфира 3:1 и центрифугировали. Полимер осаждали из метанола в той же самой смеси,отфильтровывали на S4 фриттованном стекле и сушили до постоянной массы. Пример 3. Синтез полимерного предшественника - сополимера 2a -сополимера HPMA с MA-AHNHNH2. Сополимер поли(HPMA-co-MA-AH-NHNH2) получали при помощи радикальной сополимеризации в растворе HPMA и MA-AH-NHNH2 в метаноле при 60C в соответствии с ранее описанным способом[патент Etrych]. Пример 4. Синтез полимерного предшественника - сополимера 2c - сополимера поли(HPMA-coMA-AH-NHNH-Boc-co-MA-GFLG-NH2). Сополимер поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-GFLG-NH2) получали при помощи полимераиалоговой реакции поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-GFLG-TT) сополимера с избытком этилендиамина (EDA). 410 мг поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-GFLG-TT) полимера (0,10 ммоль групп TT) растворяли в 6 мл метанола. К интенсивно перемешиваемому желтоватому раствору добавляли 70 мкл EDA(1,05 ммоль). Через 30 мин обесцвеченный раствор осаждали в 120 мл смеси ацетон:диэтиловый эфир 3:1, вновь осаждали из метанола в той же самой смеси и отфильтровывали. Полимер сушили до постоянной массы. Пример 5. Синтез полимерного предшественника - сополимера 3a - сополимера поли(HPMA-coMA-AH-NHNH2-co-MA-AH-PDS). Сополимер поли(HPMA-co-MA-AH-NHNH2-co-MA-AH-PDS) получали при помощи полимераналоговой реакции поли(HPMA-co-MA-AH-NHNH2) сополимера с бифункциональным агентом SPDP. 400 мг поли(HPMA-co-MA-AH-NHNH2) полимера (0,17 ммоль группы NHNH2) растворяли в 7 мл метанола и раствор 30 мг SPDP (0,094 ммоль) в 1 мл метанола добавляли к интенсивно перемешиваемому раствору. Через 2 ч реакционную смесь разбавляли до 15 мл метанолом и сополимер очищали от низкомолекулярных примесей при помощи гель-хроматографии в колонке, заполненной Sephadex LH-20, в метаноле с детекцией при помощи RI. Полимерную фракцию выделяли, концентрировали в вакуумном роторном испарителе до 8 мл, и сополимер выделяли путем осаждения в 100 мл этилацетата. Полимер сушили до постоянной массы. Пример 6. Синтез полимерного предшественника - сополимера 3c - сополимера поли(HPMA-coMA-AH-NHNH-Boc-co-MA-AH-PDS). Сополимер поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-AH-PDS) получали при помощи полимераналоговой реакции поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-AH-TT) сополимера с бифункциональным агентом PDEA. 20 мг PDEA.HCI1 (0,089 ммоль) растворяли в 1 мл ДМСО и при интенсивном перемешивании добавляли 14,5 мкл диизопропилэтиламина (0,089 ммоль). Через 5 мин при интенсивном перемешивании- 14017073 при комнатной температуре к этому раствору добавляли раствор 300 мг поли(HPMA-co-MA-AH-NHNHBoc-co-MA-AH-TT) полимера (0,073 ммоль групп ТТ) в 4 мл ДМСО. Через 2 ч реакционную смесь разбавляли до 15 мл метанолом и сополимер очищали от низкомолекулярных примесей при помощи гельхроматографии в колонке, заполненной Sephadex LH-20, в метаноле с обнаружением при помощи RI. Полимерную фракцию закрывали, концентрировали в вакуумном роторном испарителе до 6 мл и сополимер выделяли путем осаждения в 80 мл смеси ацетон:диэтиловый эфир 1:3 Продукт сушили до постоянной массы. Пример 7. Синтез полимерного предшественника - сополимера 4b - сополимера поли(HPMA-coMA-AH-NHNH-Boc-co-MA-GFLG-SH). Поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-GFLG-SH) сополимер получали при помощи полимераналоговой реакции сополимера поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-GFLG-NH2) с ITH в фосфатном буфере. 350 мг поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-GFLG-NH2) сополимера (0,11 ммоль групп NH2) растворяли в 7 мл фосфатного буфера (0,05 М фосфатного буфера с 0,1 М NaCl, pH 7,4). 80 мг ITH (0,58 ммоль) растворяли в 1 мл дистиллированной воды и этот раствор добавляли к раствору сополимера при интенсивном перемешивании при комнатной температуре. Через 30 мин реакционную смесь разбавляли до 20 мл дистиллированной водой и сополимер очищали от низкомолекулярных примесей при помощи гель-хроматографии в колонке, заполненной Sephadex G-25, в дистиллированной воде с обнаружением при помощи RI. Полимерную фракцию выделяли и лиофилизировали в лиофилизаторе Lyovac GT-2. Пример 8. Синтез полимерного предшественника - сополимера 4 с - сополимера поли(HPMA-coMA-AH-NHNH2-co-MA-АН-SH). Сополимер поли(HPMA-co-MA-AH-NHNH2-co-MA-AH-SH) получали путем восстановления группы PDS сополимера поли(HPMA-co-MA-AH-NHNH2-co-MA-AH-PDS) при помощи DTT в дистиллированной воде. 300 мг сополимера поли(HPMA-co-MA-AH-NHNH2-co-MA-AH-PDS) (0,075 ммоль групп PDS) растворяли в 5 мл дистиллированной воды. 40 мг DTT (0,26 ммоль) растворяли в 1 мл дистиллированной воды и этот раствор добавляли к раствору сополимера при интенсивном перемешивании при комнатной температуре. Через 20 мин реакционную смесь разбавляли до 15 мл дистиллированной водой и сополимер очищали от низкомолекулярных примесей при помощи гель-хроматографии в колонке, заполненнойSephadex G-25, в дистиллированной воде с обнаружением при помощи RI. Полимерную фракцию выделяли и лиофилизировали в лиофилизаторе Lyovac GT-2. Пример 9. Синтез полутелехелатного полимерного предшественника - прививаемого компонента 1b- сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-ТТ. Полутелехелатный сополимер поли(HPMA-co-MA-AH-NHNH-Boc)-ТТ получали при помощи радикальной сополимеризации в растворе HPMA и МА-AH-NHNH-Boc в ДМСО при 60C с инициацией при помощи инициатора ABIA-TT. 367 мг (2,57 ммоль) HPMA, 70 мг (0,224 ммоль) MA-AH-NHNH-Boc (14% по массе мономеров) растворяли в 2,7 мл ДМСО и раствор помещали в ампулу для полимеризации, в которую ранее навесили 140 мг (0,290 ммоль) ABIA-TT (4 мас.%). Раствор в ампуле продували азотом в течение 15 мин, ампулу закрывали и помещали в термостат, нагретый до 60C. Инициатор растворяли через 3 мин при 60C. Через 6 ч реакционную смесь осаждали в 80 мл смеси ацетон:диэтиловый эфир 2:1, полимер растворяли в 4 мл метанола и вновь осаждали в 60 мл той же самой осаждающей смеси. Осажденный сополимер отфильтровывали на фриттованном стекле S4 и сушили до постоянной массы. Пример 10. Синтез полутелехелатного полимерного предшественника - прививаемого компонента 1 с - сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-OSu. Полутелехелатный сополимер поли(HPMA-co-MA-AH-NHNH-Boc)-OSu получали при помощи радикальной сополимеризации в растворе HPMA и MA-AH-NHNH-Boc в этаноле при 50C с инициацией при помощи инициатора ABIA с последующей активацией концевых карбоксильных групп до Nсукцинимидильного эфира. 3,33 г (23,2 ммоль) HPMA, 674 мг (2,16 ммоль) MA-AH-NHNH-Boc (12% по массе мономеров) и 600 мг (2,14 ммоль) ABIA (1,8% по массе) растворяли в 35 мл этанола. Раствор помещали в ампулу для полимеризации и продували азотом в течение 15 мин. Ампулу затем закрывали и помещали в термостат,нагретый до 50C. Спустя 21 ч реакционную смесь осаждали в 700 мл ацетона и центрифугировали. Сополимер вновь осаждали из метанола в том же самом осадителе, отфильтровывали на фриттованном стекле S4 и сушили до постоянной массы. На второй стадии 400 мг полимера (0,027 ммоль COOH) растворяли в 1,75 мл ДМФ. 27,5 мг дициклогексилкарбодиимида (DCC) (0,133 ммоль) и 15,4 мг Nгидроксисукцинимида (0,133 ммоль) растворяли в 0,2 мл ДМФ и добавляли к перемешиваемому раствору сополимера, охлажденному до 4C (со смесью вода-лед). Реакционную смесь перемешивали в течение 1,5 ч при 4C и в течение 2 ч при комнатной температуре. Полимер осаждали в 50 мл ацетона и отфильтровывали на фриттованном стекле S4. После сушки до постоянной массы образец хранили в атмосфере аргона при -18C.- 15017073 Пример 11. Синтез полутелехелатиого полимерного предшественника (синтез с переносчиком SPA)- прививаемого компонента 1 с - сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-OSu. Полутелехелатный сополимер поли(HPMA-co-MA-AH-NHNH-Boc)-OSu получали при помощи радикальной сополимеризации с осаждением HPMA и MA-AH-NHNH-Boc в ацетоне при 50C в присутствии инициатора ABIN и SPA в качестве агента-переносчика. На второй стадии концевые карбоксильные группы превращали путем реакции с DCC и N-гидроксисукцинимидом до N-сукцинимидильного эфира. 438 мг (3,07 ммоль) HPMA, 76 мг (0,36 ммоль) MA-AH-NHNH-Boc, 4,6 мг (0,028 ммоль) ABIN и 6 мг (0,057 ммоль) SPA растворяли в 3,86 мл ацетона и раствор помещали в ампулу для полимеризации. Раствор в ампуле продували азотом в течение 10 мин, ампулу затем закрывали и помещали в термостат,нагретый до 50C, на 19 ч. Отделенный полимер отфильтровывали, растворяли в 2 мл метанола и фракционировали в колонке, заполненной Sephadex LH-60 с использованием метанола в качестве элюента. После отделения олигомерной фракции раствор полимера концентрировали в вакууме и осаждали в 10 кратном избытке смеси ацетона и диэтилового эфира (1:1). Полимер отфильтровывали на фриттованном стекле S4 и сушили до постоянной массы. На второй стадии 340 мг полимера (0,028 ммоль COOH) растворяли в 1,6 мл ДМФ. 28,5 мг дициклогексилкарбодиимида (DCC) (0,138 ммоль) и 15,9 мг Nгидроксисукцинимида (0,138 ммоль) растворяли в 0,2 мл ДМФ и добавляли к перемешиваемому раствору сополимера, охлажденному до 4C. Реакционную смесь перемешивали в течение 3,5 ч при 4C и в течение 3 ч при комнатной температуре. Полимер выделяли путем осаждения в 50 мл ацетона и отфильтровывали на фриттованном стекле S4. После сушки до постоянной массы образец хранили в атмосфере аргона при -18C. Пример 12. Синтез полутелехелатного полимерного предшественника - прививаемого компонента 1d - сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-GFLG-OSu. Полутелехелатный сополимер поли(HPMA-co-MA-AH-NHNH-Boc)-GFLG-OSu получали при помощи двухстадийного синтеза, на первой стадии N-сукцинимидильный эфир сополимера поли(HPMAco-MA-AH-NHNH-Boc)-OSu подвергали реакции с аминогруппой олигопептида GFLG. На второй стадии концевые карбоксильные группы полученного поли(HPMA-co-MA-AH-NHNH-Boc)-GFLG-COOH сополимера превращали в N-сукцинимидильный эфир путем реакции с DCC и N-гидроксисукцинимидом. 300 мг сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-OSu (0,025 ммоль групп OSu) растворяли в 2 мл ДМФ. Затем к раствору добавляли раствор 14 мг олигопептида GFLG (0,036 ммоль) в 0,2 мл ДМФ. Реакционную смесь перемешивали в течение 3,5 ч при комнатной температуре. Полимер выделяли путем осаждения в 40 мл ацетона и отфильтровывали на фриттованном стекле S4. После сушки до постоянной массы образец хранили в атмосфере аргона при -18C. На второй стадии 320 мг полимера (0,027 ммольCOOH) растворяли в 1,6 мл ДМФ. 28,5 мг дициклогексилкарбодиимида (DCC) (0,138 ммоль) и 15,9 мг Nгидроксисукцинимида (0,138 ммоль) растворяли в 0,2 мл ДМФ и добавляли к перемешиваемому раствору сополимера, охлажденному до 4C. Реакционную смесь перемешивали в течение 4 ч при 4C и в течение 3 ч при комнатной температуре. Полимер выделяли путем осаждения в 50 мл ацетона и отфильтровывали на фриттованном стекле S4. После сушки до постоянной массы образец хранили в атмосфере аргона при -18C. Пример 13. Синтез полутелехелатного полимерного предшественника (синтез с цистеаминовым переносом) - прививаемого компонента 2a - сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-NH2. Поли(HPMA-co-MA-AH-NHNH-Boc)-NH2 полутелехелатный сополимер получали путем радикальной сополимеризации в растворе HPMA и MA-AH-NHNH-Boc в метаноле при 50C в присутствии инициатора ABIN и цистеамина в качестве агента-переносчика. 385 мг (2,69 ммоль) HPMA, 76 мг (0,36 ммоль) MA-AH-NHNH-Boc, 1,55 мг (0,0095 ммоль) ABIN и 2,8 мг (0,036 ммоль) цистеамина растворяли в 4 мл метанола, и раствор помещали в ампулу для полимеризации. Раствор в ампуле продували азотом в течение 10 мин, ампулу затем закрывали и помещали в термостат, нагретый до 50C, на 24 ч. Полимер выделяли путем осаждения в 60 мл смеси ацетона и диэтилового эфира (2:1). Сополимер отфильтровывали на фриттованном стекле S4 и вновь осаждали из метанола (3 мл) в 40 мл той же самой осаждающей смеси. Полимер отфильтровывали на фриттованном стекле S4 и сушили до постоянной массы. Пример 14. Синтез полутелехелатного полимерного предшественника - прививаемого компонента 2b - сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-NH2. Полутелехелатный сополимер поли(HPMA-co-MA-AH-NHNH-Boc)-NH2 получали путем полимераналоговой реакции сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-TT с этилендиамином в метаноле. 450 мг полимера поли(HPMA-co-MA-AH-NHNH-Boc)-ТТ (0,041 ммоль групп ТТ) растворяли в 6 мл метанола. 30 мкл EDA (0,45 ммоль) добавляли к интенсивно перемешиваемому желтоватому раствору. Через 30 мин обесцвеченный раствор осаждали в 120 мл смеси ацетон:диэтиловый эфир 3:1, вновь осаждали из метанола в той же самой смеси и отфильтровывали. Полимер сушили до постоянной массы. Пример 15. Синтез полутелехелатного полимерного предшественника - прививаемого компонента 3a - сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-PDS. Полутелехелатный сополимер поли(HPMA-co-MA-AH-NHNH-Boc)-PDS получали путем полиме- 16017073 раналоговой реакции поли(HPMA-co-MA-AH-NHNH-Boc)-ТТ сополимера с бифункциональным агентомPDEA в ДМСО. 10 мг PDEA.HCI (0,045 ммоль) растворяли в 0,5 мл ДМСО и при интенсивном перемешивании добавляли 7,3 мкл диизопропилэтиламина (0,045 ммоль). Через 5 мин к этому раствору при интенсивном перемешивании при комнатной температуре добавляли раствор 400 мг сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-TT (0,036 ммоль групп ТТ) в 5 мл ДМСО. Через 2 ч реакционную смесь разбавляли до 15 мл метанолом и сополимер очищали от низкомолекулярных примесей при помощи гель-хроматографии в колонке, заполненной Sephadex LH-20 в метаноле (обнаружение при помощиRI). Полимерную фракцию выделяли, концентрировали в вакуумном роторном испарителе дл 6 мл и сополимер выделяли путем осаждения в 80 мл смеси ацетон:диэтиловый эфир 3:1. Продукт сушили до постоянной массы. Пример 16. Синтез полутелехелатного полимерного предшественника - прививаемого компонента 3b - сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-PDS. Поли(HPMA-co-MA-AH-NHNH-Boc)-PDS полутелехелатный сополимер получали при помощи полимераналоговой реакции сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-NH2 с бифункциональным агентом SPDP в метаноле. 300 мг поли(HPMA-co-MA-AH-NHNH-Boc)-NH2 полимера (0,025 ммоль групп NHNH2) растворяли в 4 мл метанола и к интенсивно перемешиваемому раствору добавляли раствор 11 мг SPDP (0,035 ммоль) в 1 мл. Через 2 ч реакционную смесь разбавляли метанолом до 15 мл и сополимер очищали от низкомолекулярных примесей путем гель-хроматографии в колонке, заполненной Sephadex LH-20, в метаноле с обнаружением при помощи RI. Полимерную фракцию выделяли, концентрировали в вакуумном роторном испарителе до 8 мл и сополимер выделяли путем осаждения в 100 мл этилацетата. Продукт сушили до постоянной массы. Пример 17. Синтез полутелехелатного полимерного предшественника - прививаемого компонента 4 а - сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-SH. Полутелехелатный сополимер поли(HPMA-co-MA-AH-NHNH-Boc)-SH получали при помощи полимераналоговой реакции (HPMA-co-MA-AH-NHNH-Boc)-NH2 сополимера с ITH в фосфатном буфере. 250 мг сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-NH2 (0,021 ммоль групп NH2) растворяли в 5 мл фосфатного буфера (0,05 М фосфатный буфер с 0,1 М NaCl, pH 7,4). 16 мг ITH (0,116 ммоль) растворяли в 0,5 мл дистиллированной воды и этот раствор добавляли к раствору сополимера при интенсивном перемешивании при комнатной температуре. Через 25 мин реакционную смесь разбавляли до 15 мл дистиллированной водой и сополимер очищали от низкомолекулярных примесей путем гельхроматографии в колонке, заполненной Sephadex G-25, в дистиллированной воде с обнаружением при помощи RI. Полимерную фракцию выделяли и лиофилизировали в лиофилизаторе Lyovac GT-2. Пример 18. Синтез полутелехелатного полимерного предшественника - прививаемого компонента 4b - сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-SH. Поли(HPMA-co-MA-AH-NHNH-Boc)-SH полутелехелатный сополимер получали путем восстановления групп PDS группы поли(HPMA-co-MA-AH-NHNH-Boc)-PDS сополимера с помощью DTT в дистиллированной воде. 300 мг сополимера поли(HPMA-co-MA-AH-NHNH2)-PDS (0,022 ммоль групп PDS) растворяли в 5 мл дистиллированной воды. 20 мг DTT (0,13 ммоль) растворяли в 1 мл дистиллированной воды и этот раствор добавляли к раствору сополимера при интенсивном перемешивании при комнатной температуре. Через 20 мин реакционную смесь разбавляли до 15 мл дистиллированной водой и сополимер очищали от низкомолекулярных примесей при помощи гель-хроматографии в колонке, заполненной Sephadex G-25, в дистиллированной воде с обнаружением при помощи RI. Полимерную фракцию выделяли и лиофилизировали в лиофилизаторе Lyovac GT-2. Пример 19. Синтез полимерного конъюгата - конъюгата 1d -сополимера поли(HPMA-co-MA-AHNHNH2-MA-AH-NHN=DOX-co-MA-GFLG-NH-)-привитой-[(GFLF)-поли(HPMA-co-MA-AH-NHNH2-coMA-AH-NHN=DOX)]. Полимерный конъюгат поли(HPMA-co-MA-AH-NHNH2-co-MA-AH-NHN=DOX-co-MA-GFLG-NH-)привитой-[(GFLG)-поли(HPMA-co-MA-NHNH2-co-MA-AH-NHN=DOX)] получали путем реакции аминогруппы поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-GFLG-NH2)сополимера с группами ТТ сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-ТТ, с последующей защитой гидразидных групп при помощи трифторуксусной кислоты (TFA) и связывания DOX в метаноле с катализом уксусной кислотой. 180 мг поли(HPMA-co-MA-AH-NHNH-Boc)-TT (0,015 ммоль ТТ) растворяли в 3 мл ДМСО и добавляли при комнатной температуре к перемешиваемому раствору 70 мг поли(HPMA-co-MA-AH-NHNHBoc-co-MA-GFLG-NH2) (0,017 ммоль NH2) в 2 мл ДМСО. Через 2,5 ч реакции при комнатной температуре раствор осаждали на 50 мл смеси этилацетата:диэтилового эфира 3:1 и отфильтровывали на фриттованном стекле S4. Прививаемый компонент растворяли в 4 мл метанола, вновь осаждали в смесь этилацетат:диэтиловый эфир, фильтровали и сушили до постоянной массы. После удаления защитных Boc групп 220 мг прививаемого компонента растворяли в 6 мл смеси ТФУ:триизопропилсилан:вода 95:2,5:2,5. Через 15 мин смесь повторно упаривали с метанолом (в 5-кратном избытке) в вакуумном испарителе с использованием вакуумного аспиратора воды до образования кристаллов. Продукт растворя- 17017073 ли в воде и pH водного раствора увеличивали до pH 7-8. Сополимер очищали от низкомолекулярных примесей путем гель-хроматографии в колонке, заполненной Sephadex G-25, в дистиллированной воде с обнаружением при помощи RI. Полимерную фракцию выделяли и лиофилизировали в лиофилизатореLyovac GT-2. После связывания DOX с прививаемым компонентом 200 мг сополимера растворяли в 2 мл метанола и раствор выливали в ячейку с регулируемой температурой, в которую помещали 20 мгDOX.HCI (0,034 ммоль). Негомогенную суспензию перемешивали в темноте при 25C и через 1 мин добавляли 100 мкл уксусной кислоты. Суспензию постепенно растворяли и после 23 ч реакции полимерный продукт очищали от низкомолекулярных примесей и любого остаточного свободного лекарственного средства при помощи гель-хроматографии в колонке, заполненной Sephadex LH-20, в метаноле. Полимерную фракцию выделяли, концентрировали до 3 мл в вакуумном роторном испарителе и сополимер выделяли путем осаждения в 30 мл этилацетата. Продукт сушили до постоянной массы. Пример 20. Синтез полимерного конъюгата - конъюгата 2 - сополимера поли(HPMA-co-MA-AHNHNH2-MA-AH-NHN=DOX-co-MA-GFLG-NH-)-привитого-[(GFLG)-поли(HPMA-co-MA-AH-NHNH2MA-AH-NFTN=DOX)]. Полимерный конъюгат поли(HPMA-co-MA-AH-NHNH2-co-MA-AH-NHN=DOX-co-MA-GFLG-NH-)привитой-[(GFLG)-поли(HPMA-co-MA-AH-NHNH2-MA-AH-NHN=DOX)] получали путем реакции группONp сополимера поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-GFLG-ONp) с гидразидными группами сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-NHNH2 с последующей защитой гидразидных групп трифторуксусной кислотой (ТФУ) и катализируемым уксусной кислотой связыванием DOX в метаноле. 250 мг поли(HPMA-co-MA-AH-NHNH-Boc)-NHNH2 (0,019 ммоль ТТ) растворяли в 4 мл ДМСО и при комнатной температуре добавляли к перемешиваемому раствору 90 мг поли(HPMA-co-MA-AHNHNH-Boc-co-MA-GFLG-ONp) (0,021 ммоль NH2) в 2,5 мл ДМСО. После реакции в течение 3 ч при комнатной температуре раствор осаждали в 50 мл смеси ацетон:диэтиловый эфир 3:1 и отфильтровывали на фриттованном стекле S4. Прививаемый компонент растворяли в 5 мл метанола, вновь осаждали на смеси этилацетат:диэтиловый эфир, фильтровали и сушили до постоянной массы. Удаление защитнойBoc группы, а также связывание лекарственного средства с привитым сополимером осуществляли по аналогии с примером 19. Пример 21. Синтез полимерного конъюгата - конъюгата 3a - сополимера поли(HPMA-co-MA-AHNHNH2-co-MA-AH-NHN=DOX-co-MA-АН-SS-)-привитого-[(SS)-поли(HPMA-co-MA-AH-NHNH2-MAАН-NHN=DOX)]. Полимерный конъюгат поли(HPMA-co-MA-AH-NHNH2-co-MA-AH-NHN=DOX-co-MA-AH-SS-)привитой-[(SS)-поли(HPMA-co-MA-AH-NHNH2-MA-AH-NHN=DOX)] получали путем реакции группPDS сополимера поли(HPMA-co-MA-AH-NHNH2-co-MA-AH-PDS) с сульфгидрильными группами сополимера поли(HPMA-co-MA-AH-NHNH-Boc)-SH с последующей защитой гидразидных групп трифторуксусной кислотой (ТФУ) и присоединением DOX в метаноле с катализом уксусной кислотой. 330 мг поли(HPMA-co-MA-AH-NHNH-Boc)-SH (0,021 ммоль групп SH) растворяли в 7 мл фосфатного буфера (0,05 М фосфатный буфер с 0,1 М Nad, 0,01 М этилендиаминтетрауксусная кислота (EDTA),pH 7,4) и добавляли при комнатной температуре к перемешиваемому раствору 108 мг поли(HPMA-coMA-AH-NHNH2-co-MA-AH-PDS) (0,025 ммоль групп PDS) в 2,5 мл того же самого буфера. После реакции в течение 3 ч при комнатной температуре привитой сополимер очищали от низкомолекулярных примесей при помощи гель-хроматографии в колонке, заполненной Sephadex G-25, в дистиллированной воде с обнаружением при помощи RI. Полимерную фракцию выделяли и лиофилизировали в лиофилизаторе Lyovac GT-2. Удаление защитных Boc групп, а также связывание лекарственного средства с привитым сополимером осуществляли по аналогии с примером 19. Пример 22. Синтез полимерного конъюгата - конъюгата 3a - сополимера поли(HPMA-co-MA-АНNHNH2-co-MA-AH-NHN=DOX-co-MA-АН-SS-)-привитого-[(SS)-поли(HPMA-co-MA-AH-NHNH2-MAAH-NHN=DOX)]. Полимерный конъюгат поли(HPMA-co-MA-AH-NHNH2-co-MA-AH-NHN=DOX-co-MA-AH-SS-)привитой-[(SS)-поли(HPMA-co-MA-AH-NHNH2-MA-AH-NHN=DOX)] получали путем реакции групп SH поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-AH-SH) с группами PDS поли(HPMA-co-MA-AH-NHNHBoc)-PDS сополимера с последующей защитой гидразидных групп трифторуксусной кислотой (ТФУ) и связыванием DOX в метаноле, катализируемым уксусной кислотой. 280 мг поли(HPMA-co-MA-AH-NHNH-Boc)-PDS (0,019 ммоль групп PDS) растворяли в 6 мл фосфатного буфера (0,05 М фосфатного буфера с 0,1 М NaCl, 0,01 М этилендиаминтетрауксусная кислота(EDTA), pH 7,4) и добавляли при комнатной температуре к перемешиваемому раствору 95 мг поли(HPMA-co-MA-AH-NHNH-Boc-co-MA-AH-SH) (0,024 ммоль групп SH) в 2,5 мл того же самого буфера. После реакции в течение 3 ч при комнатной температуре привитой сополимер очищали от низкомолекулярных примесей при помощи гель-хроматографии в колонке, заполненной Sephadex G-25, в дистиллированной воде с обнаружением при помощи RI. Полимерную фракцию выделяли и лиофилизировали в лиофилизаторе Lyovac GT-2. Удаление защитных Boc групп, а также связывание лекарственного средства с привитым сополимером осуществляли по аналогии с примером 19. Пример 23. Синтез полимерного конъюгата - конъюгата 5 - сополимера поли(HPMA-co-MA- 18017073NHNH2-co-MA-NHN=DOX-co-MA-GFLG-NH-)-привитого-[(GFLG)-поли(HPMA-co-MA-AH-NHNH2MA-AH-NHN=DOX)]. Поли(HPMA-co-MA-AH-NHNH2-co-MA-AH-NHN==DOX-co-MA-GFLG-NH-)-привитой-[(GFLG)поли(HPMA-co-MA-AH-NHNH2-MA-AH-NHN=DOX)] полимерный конъюгат получали при помощи радикальной сополимеризации в растворе HPMA, MA-AH-NHNH2 и поли(HPMA-co-MA-AH-NHNH-Boc)GLFG-MA в метаноле при 60C. 465 мг (3,25 ммоль) HPMA, 44,5 мг (0,20 ммоль) MA-AH-NHNH2, 950 мг (0,076 ммоль) поли(HPMA-co-MA-AH-NHNH-Boc)-GLFG-MA и 98,3 мг (0,60 ммоль) ABIN растворяли в 9 мл метанола. Ампулу с раствором полимеризационной смеси продували азотом в течение 10 мин, затем закрывали и помещали в термостат, нагретый до 60C, в течение 24 ч. Реакционную смесь затем осаждали в 100 мл смеси ацетон:диэтиловый эфир 3:1 и центрифугировали. Полимер вновь осаждали из метанола в той же самой смеси, отфильтровывали на фриттованном стекле S4 и сушили до постоянной массы. Удаление защитных Boc групп, а также связывание лекарственного средства с привитым сополимером осуществляли по аналогии с примером 19. Пример 24. Высвобождение доксорубицина из привитых полимерных конъюгатов. Измеряли количества доксорубицина, высвободившиеся из привитых полимерных конъюгатов после их инкубации в фосфатном буфере с pH 5,0 (0,1 M фосфатный буфер, содержащий 0,05 М NaCl), моделирующем внутриклеточную среду, и в фосфатном буфере с pH 7,4, моделирующем среду кровотока. Количество высвободившегося DOX в инкубируемом растворе определяли при помощи ВЭЖХ (высокоэффективной жидкостной хроматографии) (Shimadzu). Спустя заранее определенные интервалы времени отбирали образцы 50 мкл инкубируемого раствора и анализировали их в колонке TSKGel G 30001, изократический поток 0,5 мл/мин подвижной фазы, состоящей из смеси метанол:ацетатный буфер с pH 6,5(80:20 об.%). Количество DOX расчитывали по площадям пиков вободного и связанного DOX (обнаружение в УФ-ВИД (ультрафиолет - видимый свет) при 488 нм). После инкубации конъюгатов (концентрация 5 мг/мл) в физиологической среде при 36C (фосфатный буфер, pH 7,4) высвобождается только небольшое количество лекарственного средства (до 8%/24 ч) (фиг. 33); наоборот, скорость высвобожденияDOX из привитых полимерных конъюгатов, и, следовательно, скорость активации цитотоксического лекарственного средства существенна в слегка кислой среде при pH 5,0 (фиг. 35). При pH 7,4 и pH 5 скорость высвобождения лекарственного средства из привитых полимерных конъюгатов полностью сравнима с установленной для гидразоновых конъюгатов, полученных только из линейных сополимеров [патент Etrych]. Пример 25. Разрушение привитых полимерных конъюгатов при помощи глутатиона или катепсина В в продуктах распада, выводимых из организма. Эксперименты с разрушением осуществляли в фосфатном буфере (0,1 М фосфатный буфер, содержащий 0,05 М NaCl, pH 6) в присутствии катепсина B или глутатиона в качестве разрушающих агентов,т.е. в среде, моделирующей внутриклеточную среду (цитоплазма, эндосома и вторичная лизосома). Привитые полимерные конъюгаты растворяли в фосфатном буфере в концентрации 50 мг/мл и непосредственно перед помещением растворов в термостат (37C) к растворам добавляли маточный раствор катепсина В или глутатиона, таким образом, что конечная концентрация этих агентов в инкубируемой среде составила 5,10-7 моль/л и 3,10-3 моль/л для катепсина и глутатиона, соответственно. Спустя заранее определенные интервалы времени из инкубируемых растворов отбирали аликвоты (200 мкл). Образцы обессоливали в колонках PD-10 и лиофилизировали. Молекулярную массу продуктов разрушения измеряли с использованием жидкостного хроматографа Shimadzu SIL-HT, оборудованного дифференциальным рефрактометром (Shimadzu RID-10A) и многоугловым детектором светорассеяния (DAWN EOS, Wyatt Technology, USA). Анализ осуществляли в колонке Superose6 (30010 мм) (Amersham Bioscience). В качестве подвижной фазы использовали 0,3 М ацетатный буфер (CH3COONa/CH3COOH; pH 6,5; 0,5 г/л NaN3) со скоростью потока 0,5 мл/мин. Молекулярную массу и полидисперсность сополимера рассчитывали с использованием программного обеспечения Astra (Wyatt Technology, USA). Конъюгаты, содержащие ферментативно разрушаемые последовательности GlyPheLeuGly (конъюгат 1d), разрушали в течение 24 ч при помощи катепсина B для разрушения продуктов, молекулярные массы которых были меньше предела почечной фильтрации (фиг. 37). В растворе, содержащем глутатион (3,10-3 моль/л), определяли быстрое разрушение привитых конъюгатов, содержащих дисульфидные мостики. Эти привитые конъюгаты разрушались через 24 ч в полимерных продуктах разрушения с молекулярной массой меньше предела почечной фильтрации (приблизительно 25000 г/моль). Пример 26. Пример биологической активности in vitro привитых конъюгатов доксорубицина во время инкубации с клетками различных опухолевых линий. Оба типа привитых DOX конъюгатов (с прививаемыми компонентами, присоединенными посредством ферментативно расщепляемой связи и со связью, расщепляемой при восстановлении) тестировалиin vitro с использованием опухолевых линий обоих мышей (EL4; 38C13; 3T3; BCL1) и человеческих линий (SW 620). Обнаружено, что значение IC50 (средней ингибирующей концентрации) конъюгатов во всех протестированных линиях было в 5-10 раз меньше чем значение для свободного немодифицированного доксорубицина. Все протестированные линии очень чувствительны к конъюгатам, но зависит от их происхождения. Наиболее чувствительной была линия B-клеточной лимфомы 38 С 13. Линии человеческой колоректальной карциномы и мышиной фибросаркомы были менее чувствительными, еще менее чувствительной была линия мышиной B лейкемии. Мышиная T-клеточная лимфома была наименее чувствительной. Пример 27. Пример биологической активности in vivo привитых конъюгатов доксорубицина у мышей, инокулированных T-клеточной лимфомой EL4. Эксперименты in vivo включали модель мышиной Т-клеточной лимфомы EL4, экспериментальные животные представляли собой мышей (самцы) видов B/6, которым подкожно имплантировали 105 опухолевых клеток на нулевые сутки. Конъюгаты применяли внутривенно в дозе 115 мг/кг эквивалентаDOX. Это разовое применение осуществляли на девятые сутки после трансплантации опухолевых клеток, т.е. в момент, когда опухоль была пальпируемой, приблизительно размером 400 мм 3. На третьи сутки после первого применения все экспериментальные группы демонстрировали значительное замедление роста опухолей по сравнению с контролями. Оба привитых конъюгата (конъюгат 1d и конъюгат 3a) продемонстрировали весьма существенное противоопухолевое действие. В обоих случаях рост опухолей подавлялся и у большинства протестированных животных опухоль исчезала. После применения конъюгата 3a (мостик SS) 100% мышей выживали на 70-е сутки после введения опухолевых клеток, когда эксперимент завершался. В случае конъюгата 1d 88% лабораторных животных выживало к 70 м суткам, когда завершался эксперимент. В обеих экспериментальных группах, обработанных образцами привитых конъюгатов, очевидна существенная рецессия опухолей после введения конъюгатов, при этом не обнаружено уменьшение массы организма в качестве симптома токсичности. При контрольной обработке линейным растворимым конъюгатом обрабатывали пять мышей из восьми. Все эти контрольные животные умерли; самый короткий и длинный периоды выживания составили 28 и 35 суток соответственно. Примеры результатов тестов in vivo представлены на фиг. 4 и в табл. 1 (LTS - длительные выживания- 20017073 Таблица 1. Выживание мышей B/6, инокулированных мышиной лимфомой EL4 (сутки 0, 105 клеток, п.к.), обработанных DOX привитыми конъюгатами после внутривенного применения разовой дозы 15 мг/кг эквивалента DOX в терапевтическом способе введения лекарственного средства (9 сутки). Линейный конъюгат представляет собой контрольный "классический" растворимый не привитой конъюгат. Сутки обозначают конкретные сутки, когда животное умирает, LTS обозначает выживших животных без пальпируемой опухоли. Ссылки:- 21017073 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Полимерное лекарственное средство, в котором канцеростатик, присоединенный через промежуточные участки, содержащие гидролитически расщепляемые гидразоновые связи, связан с водорастворимым полимерным носителем, приготовленным на основе N-(2-гидроксипропил)метакриламидного сополимера, отличающееся тем, что структура полимерного лекарственного средства состоит из основной цепи N-(2-гидроксипропил)метакриламида, несущей канцеростатик, и другой цепи N-(2 гидроксипропил)метакриламида - прививаемого компонента, где молекулярные массы основной цепи и прививаемого компонента выбраны таким образом, что и основная цепь перед связыванием с прививаемым компонентом и прививаемый компонент способны выводиться из организма после разрушения, тогда как общая молекулярная масса привитого полимера превосходит предел выведения из организма, где полимерное лекарственное средство имеет структуру, выбранную из структур 1a, 1b, 1 с, 1d, 2, 3a, 3b, 4a,4b, 4c и 5, представленных ниже: где n находится в диапазоне от 40 до 335, m от 0 до 85, p от 1 до 20, q от 1 до 10 и r от 34 до 350; SP1 представляет собой аминоацил и/или комбинированный ацил, являющийся производным олигопептидов где s находится в диапазоне от 0 до 50 и t от 1 до 20 и другие символы являются такими, как определено выше; где SP2 представляет собой комбинированный ацил, являющийся производным ферментативно разрушаемой олигопептидной последовательности типа GlyPheGly, GlyLeuGly, GlyLeuPheGly или GlyPheLeuGly, и другие символы являются такими, как определено выше; где символы являются такими, как определено выше; где символы являются такими, как определено выше; где символы являются такими, как определено выше; где символы являются такими, как определено выше; где символы являются такими, как определено выше; где символы являются такими, как определено выше; где символы являются такими, как определено выше; 2. Полимерное лекарственное средство по п.1, где цепь прививаемого компонента несет канцеростатик. 3. Полимерное лекарственное средство по п.1, где аминоацил представляет собой глицил, глицилглицил, -аланил, 6-аминогексаноил (AH) или 4-аминобензоил. 4. Способ изготовления полимерного лекарственного средства по п.1, отличающийся тем, что состоит из следующих стадий: а) получение основных мономерных звеньев, которые представляют собой N-(2-гидроксипропил) метакриламид и другие метакрилоилированные производные аминокислот или олигопептидов с концевыми реакционноспособными 4-нитрофенокси или тиазолидинтионовыми группами, или с концевой гидразиновой группой, защищенной бутилоксикарбоксильной группой; или связанные на конце с канцеростатиком, или метакрилоилированные макромономеры, полученные путем метакрилоилирования по- 24017073 лутелехелатного сополимера N-(2-гидроксипропил)метакриламида с концевой первичной аминогруппой; б) синтез полимерных предшественников: (а) основной цепи, несущей функциональные 4 нитрофенокси, тиазолидин-2-тионовые, гидразидные, первичные амино, сульфгидрильные (SH) или дитиопиридильные (PDS) группы, путем полимеризации основных мономеров, несущих указанные группы,или путем модификации функциональных групп при полимераналогичном взаимодействии, и (б) прививаемого компонента с концевой реакционноспособной группой, получаемого путем радикальной полимеризации основных мономерных звеньев, или путем радикальной сополимеризации, осуществляемой в присутствии агента передачи цепи или инициируемой инициатором 3,3'-[4,4'-аза-бис(4-циано-4-метил-1 оксобутан-4,1-диил)]бис(тиазолидин-2-тион)ом (ABIA-TT) с последующей модификацией концевых групп; в) проведение реакции функциональных групп основной цепи с реакционноспособными группами прививаемого компонента с образованием полимерного носителя или конечного полимерного конъюгата в случае, если для получения полимеров использовали мономерные блоки, содержащие канцеростатик; г) возможное удаление Вос-группы, которая защищает гидразидные группы, и их последующее взаимодействие с канцеростатиком, где для изготовления полимерного лекарственного средства формул 1a-1c или 1d основная цепь в реакции на стадии в) содержит гидразидные или первичные аминогруппы, тогда как прививаемый компонент имеет концевую N-сукцинимидилэфирную или ацилтиазолидин-2-тионовую группу; для изготовления полимерного лекарственного средства формулы 2 основная цепь в реакции на стадии в) содержит реакционноспособные 4-нитрофенокси или тиазолидин-2-тионовые группы, тогда как прививаемый компонент имеет концевую гидразидную или первичную аминогруппу; для изготовления полимерного лекарственного средства формул 3a или 3b основная цепь в реакции на стадии в) содержит реакционноспособные дитиопиридильные группы, тогда как прививаемый компонент имеет концевую сульфгидрильную группу; для изготовления полимерного лекарственного средства формул 4a; 4b или 4c основная цепь в реакции на стадии в) имеет сульфгидрильные группы, тогда как прививаемый компонент имеет концевую дитиопиридильную группу; для изготовления полимерного лекарственного средства формулы 5 осуществляют радикальную терполимеризацию N-(2-гидроксипропил)метакриламида с метакрилоилированными аминокислотами или олигопептидами с концевой трет-бутилоксикарбонильной гидразиновой группой и макромономерами, получаемыми путем метакрилоилирования N-(2-гидроксипропил)метакриламида полутелехелатного сополимера с концевой аминогруппой следующей формулы: где символы являются такими, как определено выше.
МПК / Метки
МПК: A61K 47/48
Метки: активностью, обладающие, доксорубицина, макромолекулярные, способ, привитые, получения, противораковой, конъюгаты
Код ссылки
<a href="https://eas.patents.su/27-17073-privitye-makromolekulyarnye-konyugaty-doksorubicina-obladayushhie-protivorakovojj-aktivnostyu-i-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Привитые макромолекулярные конъюгаты доксорубицина, обладающие противораковой активностью, и способ их получения</a>
Предыдущий патент: Полиэлектролитные комплексы для применения в области добычи нефти и газа
Следующий патент: Ингибиторы hdac
Случайный патент: Уплотнение для расширяющихся соединений