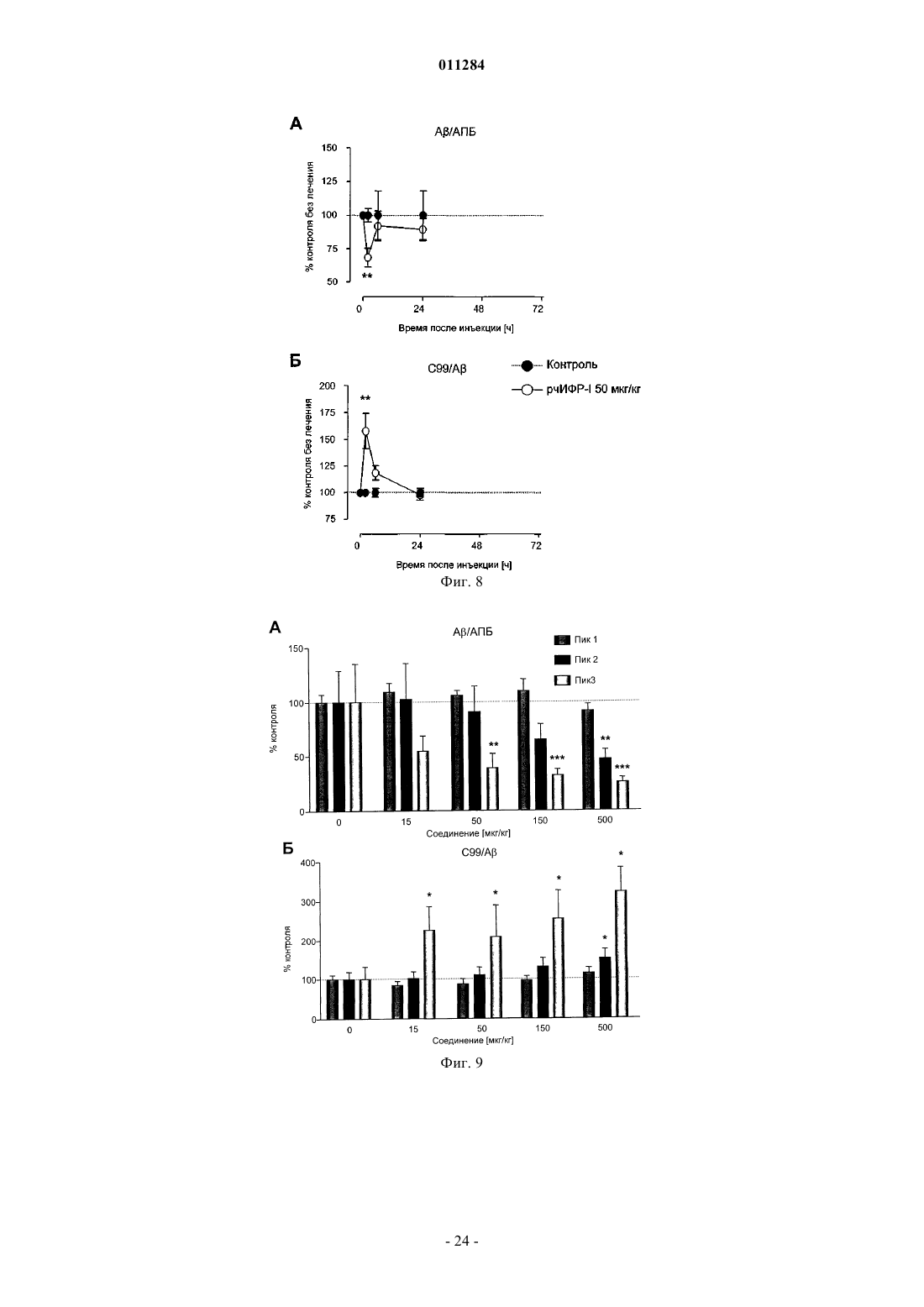
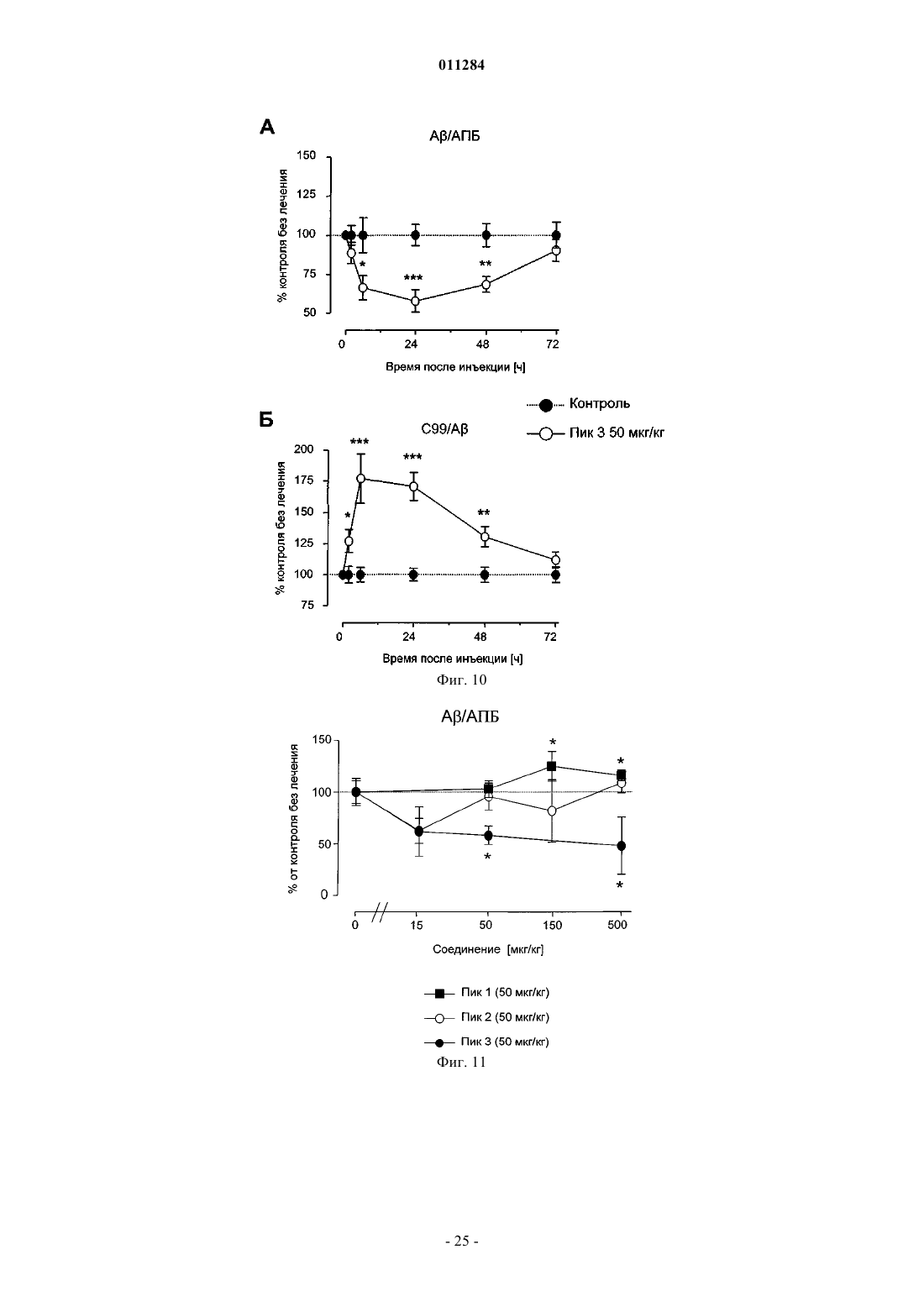
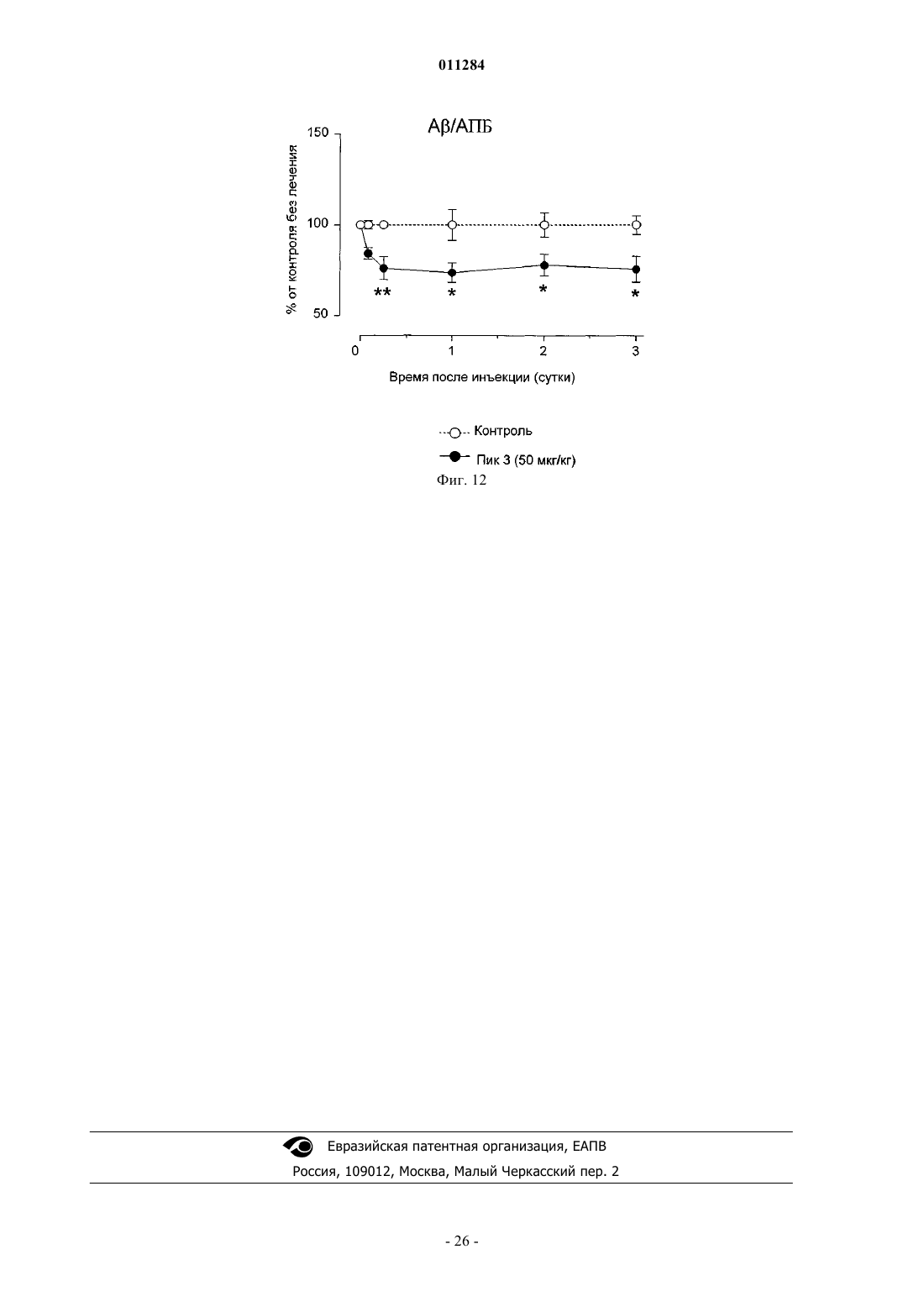
Конъюгаты инсулиноподобного фактора роста i ( ифр-i) и полиэтиленгликоля
Номер патента: 11284
Опубликовано: 27.02.2009
Авторы: Регула Йёрг, Фозер Штефан, Амрайн Беат, Ланг Курт, Шаубмар Андреас, Метцгер Фридрих, Кюнкеле Клаус-Петер, Хессе Фридерике, Ланцендёрфер Мартин
Формула / Реферат
1. Конъюгат, включающий вариант инсулиноподобного фактора роста I (ИФР-I) и полиэтиленгликоль (ПЭГ), отличающийся тем, что указанный вариант ИФР-I содержит замены (замену) аминокислот в положениях 27, 37, 65, 68 в последовательности исходного ИФР-I таким образом, что одна или несколько аминокислот в положениях 37, 65, 68 являются лизином (K), а аминокислота в положении 27 является полярной аминокислотой, но не лизином, причем указанный ПЭГ конъюгирован с указанным вариантом ИФР-I по первичной аминогруппе (аминогруппам).
2. Конъюгат по п.1, отличающийся тем, что указанный ПЭГ имеет молекулярную массу в среднем равную 20-100 кДа.
3. Конъюгат по п.1 или 2, отличающийся тем, что указанный вариант ИФР-I дополнительно пэгилирован по N-концевой аминокислоте.
4. Конъюгат по п.1 или 3, отличающийся монопэгилированием по аминокислотам K65, K68 или K37 или двойным пэгилированием по K65 и K68.
5. Конъюгат по пп.1-4, отличающийся тем, что указанный вариант ИФР-I является R27, R37, K65, K68 (RRKK), R27, R37, R65, K68 (RRRK), R27, R37, K65, R68 (RRKR), R27, K37, R65, R68 (RKRR).
6. Конъюгат по пп.1-5 или вариант ИФР-I по п.5, отличающийся тем, что у варианта ИФР-I до трех аминокислот с N-конца процессировано.
7. Конъюгат по пп.1-6, отличающийся тем, что группа(ы) полиэтиленгликоля является разветвленной группой(ами) полиэтиленгликоля.
8. Конъюгат по пп.1-7, отличающийся тем, что средняя молекулярная масса группы (групп) полиэтиленгликоля равна 20-100 кДа.
9. Вариант ИФР-I, отличающийся наличием замены (замен) аминокислоты в положениях 27, 37, 65, 68 в последовательности исходного ИФР-I, из которых одна или несколько аминокислот в положениях 37, 65, 68 являются лизином (K), а аминокислота в положении 27 является полярной аминокислотой, но не лизином.
10. Применение варианта ИФР-I по п.9 в качестве промежуточного соединения для получения пэгилированного варианта ИФР-I.
11. Способ получения конъюгата, включающего вариант ИФР-I и одну или две полиэтиленгликолевые группы со средней молекулярной массой примерно от 20 до примерно 100 кДа, который предусматривает взаимодействие промежуточного соединения ИФР по п.9 с активированным полиэтиленгликолем в условиях, когда указанный полиэтиленгликоль химически связан с указанным промежуточным соединением ИФР-I по первичным аминогруппам лизина варианта ИФР-I.
12. Способ по п.11, отличающийся тем, что указанный полиэтиленгликоль дополнительно химически связан с указанным промежуточным соединением ИФР-I по N-концевой аминогруппе варианта ИФР-I.
13. Фармацевтическая композиция, включающая конъюгат по пп.1-8 и фармацевтически приемлемый носитель.
14. Применение конъюгата по пп.1-8 для получения лекарственного средства для лечения болезни Альцгеймера.
15. Способ лечения болезни Альцгеймера, предусматривающий введение в организм пациента, нуждающегося в этом, терапевтически эффективного количества конъюгата по пп.1-8.
16. Композиция лизин-пэгилированного варианта ИФР-I, содержащего замену (замены) аминокислот в положениях 27, 37, 65, 68 в аминокислотной последовательности исходного ИФР-I, из которых одна или несколько аминокислот в положениях 37, 65, 68 являются лизином (K), аминокислота в положении 27 является полярной аминокислотой, но не лизином, причем указанный ПЭГ конъюгирован с указанным вариантом ИФР-I по первичной аминогруппе (аминогруппам), а вариант ИФР-I пэгилирован по N-концу.
17. Фармацевтическая композиция, включающая лизин-пэгилированный вариант ИФР-I, содержащий замену (замены) аминокислот в положениях 27, 37, 65, 68 в аминокислотной последовательности исходного ИФР-I, из которых одна или несколько аминокислот в положениях 37, 65, 68 являются лизином (K), аминокислота в положении 27 является полярной аминокислотой, но не лизином, причем указанный ПЭГ конъюгирован с указанным вариантом ИФР-I по первичной аминогруппе (аминогруппам), а вариант ИФР-I пэгилирован по N-концу, и фармацевтически приемлемый носитель.
18. Применение композиции лизин-пэгилированного варианта ИФР-I, содержащего замену (замены) аминокислот в положениях 27, 37, 65, 68 в аминокислотной последовательности исходного ИФР-I, из которых одна или несколько аминокислот в положениях 37, 65, 68 являются лизином (K), аминокислота в положении 27 является полярной аминокислотой, но не лизином, указанный ПЭГ конъюгирован с указанным вариантом ИФР-I по первичной аминогруппе (аминогруппам), а вариант ИФР-I пэгилирован по N-концу, для получения лекарственного средства для лечения болезни Альцгеймера.
19. Способ лечения болезни Альцгеймера, предусматривающий введение в организм пациента, нуждающегося в этом, терапевтически эффективного количества композиции по п.16 или 17.
Текст
011284 Настоящее изобретение относится к конъюгатам инсулиноподобного фактора роста I (ИФР-I) с полиэтиленгликолем (ПЭГ), фармацевтическим композициям, содержащим эти конъюгаты, способам получения и способам применения этих конъюгатов. Предпосылки создания изобретения Болезнь Альцгеймера (БА) становится все более превалирующей формой нейродегенерации, которая составляет примерно 50-60% всех случаев слабоумия у людей старше 65 лет. По современным оценкам это заболевание встречается у 15 млн чел. в мире, и в связи с тем, что происходит относительное увеличение доли пожилых людей в сообществе, вероятно, в последующие 20-30 лет количество больных возрастет. БА является прогрессирующим заболеванием, средняя продолжительность которого составляет 8,5 лет от начала появления клинических симптомов до смерти. Гибель пирамидальных нейронов и нейрональных синапсов в областях мозга, связанных с высшими психическими функциями, приводит к появлению типичных симптомов, проявляющихся в обширном и прогрессирующем ухудшении когнитивной функции (Francis P.T. и др. J. Neurol. Neurosurg. Psychiatry 66,1999, c. 137-147). БА - наиболее распространенная форма старческого и предстарческого слабоумия в мире и распознается клинически в качестве беспрестанно прогрессирующего слабоумия, которое характеризуется возрастающей потерей памяти, интеллекта, а также расстройством речи (Merritt в кн.: ATextbook of Neurology, Lea Febiger, 1979, 6-е изд. Филадельфия, c. 484-489). По данным нейропатологии основным отличительным признаком БА является наличие двух характерных повреждений: амилоидных сенильных бляшек и нейрофибриллярных сплетений (НФС). Хотя бляшка расположена экстранейронально, сплетение наблюдается в мозге интранейронально, что следует из результатов посмертного вскрытия. Одним из основных компонентов оболочки амилоидных бляшек являются патологические отложения низкомолекулярных амилоидных бета-пептидов (А), которые образуются в результате расщепления секретазами амилоидного белка-предшественника (АБП) (Selkoe D.J. Physiol. Rev. 81, 2001,c. 741-766, Hardy J. и Selkoe D.J. Science 297, 2002, c. 353-356, Bush A.I. и Tanzi R.E. Proc. Natl. Acad. Sci.USA 99, 2002, c. 7317-7319). А является самоагрегирующимся пептидом, состоящим из 39-43 остатков аминокислот (молекулярная масса 4 кДа) и синтезируется в качестве части более крупного АБП (110120 кДа). АБП является интегрированным в мембрану гликопротеином I типа с крупным N-концевым внеклеточным доменом, одним трансмембранным доменом и коротким цитоплазматическим хвостом. Область А перекрывает части внеклеточного и трансмембранного доменов АБП. Наиболее признанной гипотезой участия АБП в гибели нейрональных клеток при БА является амилоидная гипотеза. Эта гипотеза постулирует, что отложение амилоидных бляшек или частично агрегированный растворимый А запускают нейротоксичный каскад, тем самым вызывая нейродегенеративные изменения, напоминающие патологические изменения при БА (Selkoe, D.J. Physiol. Rev. 81, 2001, c. 741-766; Hardy, J. и Selkoe, D.J.Science 297, 2002, c. 353-356). Инсулиноподобный фактор роста I (ИФР-I) является циркулирующим гормоном, близким по структуре инсулину. ИФР-I всегда рассматривался в качестве основного медиатора действия гормона роста на периферические ткани. ИФР-I, также называемый соматомедином С и SwissProt No. Р 01343, состоит из 70 аминокислот. Применение, действие и образование описаны, например, в работах le Bouc Y. и др.Res. Commun. 175, 1991, c. 507-514, Tanner J.M. и др. Acta Endocrinol. (Copenh.) 84, 1977, с. 681-696,Uthne K. и др. J. Clin. Endocrinol. Metab. 39, 1974, c. 548-554, EP 0123228, EP 0128733, US 5861373, US 5714460, EP 0597033, WO 02/32449, WO 93/02695. Регуляция действия ИФР-I весьма сложна. При циркуляции только 0,2% ИФР-I существует в свободной форме, а большая часть связана с ИФР-связывающими белками (ИФРСБ), которые обладают чрезвычайно высоким сродством с инсулиноподобными факторами роста и модулируют функцию ИФР-I. Этот фактор может высвобождаться локально с помощью механизмов высвобождения ИФР-I,например, протеолиза ИФРСБ протеазами. ИФР-I выполняет паракринную роль в развитии и созревании мозга (Werther G.A. и др. Mol. Endocrinol. 4, 1990, c. 773-778). Исследования in vitro показали, что ИФР-I является мощным неселективным трофическим агентом для нескольких типов нейронов в ЦНС (Knusel В. и др. J. Neurosci. 10, 1990, с. 558570, Svrzic D. и Schubert, D. Biochem. Biophys. Res. Commun. 172, 1990, с. 54-60), включая дофаминергические нейроны (Knusel B. и др. J. Neurosci. 10, 1990, с. 558-570) и олигодендроциты (McMorris, F.A. иDubois-Dalcq, M.J. Neurosci. Res. 21, 1988, с. 199-209, McMorris F.A. и др. Proc. Natl. Acad. Sci. USA 83,1986, с. 822-826, Mozell, R.L. и McMorris F.A. J. Neurosci. Res. 30, 1991, с. 382-390). В патенте US 5093317 указано, что выживание холинергических нейрональных клеток повышается в результате введения ИФР-I. Также было установлено, что ИФР-I стимулирует регенерацию периферических нервов (Kanje M. и др. Brain Res. 486, 1989, с. 396-398) и повышает активность орнитиндекарбоксилазы (US 5093317). ВUS 5861373 и WO 93/02695 описан способ лечения повреждений и заболеваний центральной нервной системы, которые преимущественно воздействуют на невроглию и/или нехолинергические нейрональные клетки путем повышения действующих концентраций ИФР-I и/или его аналогов в центральной-1 011284 нервной системе пациента. В WO 0232449 описаны способы понижения или предупреждения ишемических повреждений в центральной нервной системе млекопитающего путем введения в носовую полость млекопитающего фармацевтической композиции, включающей терапевтически эффективное количество ИФР-I или его биологически активных вариантов. ИФР-I или его варианты адсорбируются по всей носовой полости и транспортируются в центральную нервную систему млекопитающего в количестве, эффективном для уменьшения или предупреждения ишемического повреждения, связанного с развитием ишемии. В ЕР 0874641 заявлено применение ИФР-I или ИФР-II для получения лекарственного средства для лечения или предупреждения нейронального повреждения в центральной нервной системе из-за связанного со СПИДом слабоумия, БА, болезни Паркинсона, болезни Пика, болезни Гантингтона, печеночной энцефалопатии, кортикально-базальных ганглиозных синдромов, прогрессирующего слабоумия, семейного слабоумия со спастическим парапарезом, прогрессирующего надъядерного паралича, рассеянного склероза, церебрального склероза Шильдера или острого некротизирующего геморрагического энцефаломиелита, в котором лекарственное средство предусмотрено в форме для парентерального введения эффективного количества указанного ИФР за пределами гематоэнцефалического барьера или барьера кровь-спинной мозг. Снижение уровней содержания несвязанного ИФР-I в сыворотке и в мозге связано с патогенезом спорадических и семейных форм БА. Кроме того, ИФР-I защищает нейроны от А-индуцированной нейротоксичности (Niikura T. и др. J. Neurosci. 21, 2001, с. 1902-1910, Dore S. и др. Proc. Natl. Acad. Sci. USA,94, 1997, с. 4772-4777, Dore S. и др. Ann. NY Acad. Sci. 890, 1999, с. 356-364). Ранее было установлено,что периферическое введение ИФР-I способно понизить уровни содержания А в мозге у крыс и мышей(Carro E. и др. Nat. Med. 8, 2002, с. 1390-1397). Кроме того, установлено, что у трансгенных модельных мышей с БА пролонгированное лечение ИФР-I приводит к значительному снижению нагрузки амилоидных бляшек в мозге. Эти результаты убедительно подтверждают предположение о том, что ИФР-I может понизить уровни содержания A и проявление связанного с отложением бляшек слабоумия путем очищения мозга от А. Было доказано, что ковалентные модификации белков с полиэтиленгликолем (ПЭГ) пригодны для продления полупериода циркуляции белков в организме (Hershfield M.S. и др. N. Engl. J. Med. 316, 1987,с. 589-596, Meyers F.J. и др. Clin. Pharmacol. Ther. 49, 1991, с. 307-313, Delgado C. и др. Crit. Rev. Ther.Bioconjugate Chem. 5, 1994, с. 133-140). Другие преимущества пэгилирования заключаются в увеличении растворимости и в понижении иммуногенности белков (Katre N.V. J. Immunol. 144, 1990, с. 209-213). Обычный способ пэгилирования белков заключается в применении полиэтиленгликоля, активированного аминореактивными реагентами,например, N-гидроксисукцинимидом (NГС). С помощью таких реагентов полиэтиленгликоль присоединяется к белкам по свободным первичным аминогруппам, например N-концевой -аминогруппе и-аминогрупп остатков лизина. Однако серьезный недостаток такого подхода заключается в том, что белки обычно содержат большое количество остатков лизина, поэтому группы полиэтиленгликоля присоединяются к белку неспецифически по всем свободным -аминогруппам, образуя смесь гетерогенных продуктов, а именно случайным образом пэгилированных белков. Следовательно, многиеNГС-пэгилированные белки не пригодны для коммерческого применения из-за низкой специфической активности. Инактивирование происходит из-за ковалентной модификации одного или нескольких остатков лизина или N-концевой аминогруппы, требуемых для биологической активности, или от ковалентного присоединения остатков полиэтиленгликоля по активному сайту белка или около него. Например, было обнаружено, что модификация гормона роста человека при использованииNГС-пэгилирующих реагентов снижает биологическую активность белка более чем в 10 раз (Clark R. и др. J. Biol. Chem. 271, 1996, с. 21969-21977). В составе гормона роста человека содержится 9 лизинов помимо N-концевой аминокислоты. Некоторые из этих лизинов расположены в областях белка, о которых известно, что они являются принципиально важными для связывания рецептора (Cunningham B.C. и др.Science 254, 1991, с. 821-825). Кроме того, модификация эритропоэтина в результате применения аминореактивных полиэтиленгликолевых реагентов также приводит почти к полной потере биологической активности (Wojchowski D.M. и др. Biochim. Biophys. Acta 910, 1987, с. 224-232). Ковалентная модификация 2-интерферона аминореактивными реагентами для пэгилирования приводит к потере на 40-75% биологической активности (US 5382657). Сходная модификация приводит к потере биологической активности гранулоцитарного колониестимулирующего фактора (Г-КСФ) более чем на 60% (Tanaka Н. и др. Cancer Res. 51, 1991, с. 3710-3714), а интерлейкина-2 - более чем на 90% (Goodson R.J. Katre N.V.BioTechnology 8, 1990, с. 343-346). В WO 94/12219 и WO 95/32003 описаны конъюгаты полиэтиленгликоля, включающие ПЭГ и ИФР или ИФР с мутацией по цистеину, в которых ПЭГ присоединен к указанному мутеину по свободному-2 011284 цистеину в N-концевой области мутеина. В WO 2004/60300 описан N-концевой пэгилированный ИФР-I. Краткое описание изобретения В настоящем изобретении описан вариант ИФР-I, у которого аминокислотная последовательность отличается от аминокислотной последовательности ИФР-I природного типа заменами аминокислот в положениях 27, 37, 65 и/или 68 таким образом, что одна или несколько аминокислот в положениях 37,65, 68 являются лизином (K), а аминокислота в положении 27 является полярной аминокислотой, но не лизином. Предпочтительно аминокислотой в положении 27 является аргинин. Такие варианты ИФР-I применяют в качестве промежуточных соединений (ИФР-I-промежуточных соединений) для получения лизин-пэгилированного ИФР-I. Неожиданно было обнаружено, что лизин-пэгилированный ИФР-I-вариант (аминоактивированный пэгилированный ИФР-I вариант), предпочтительно массой 20-100 кДа пэгилированный ИФР-I вариант и особенно предпочтительно монопэгилированный ИФР-I вариант, обладает описанными выше свойствами, касающимися терапевтического применения. Другим вариантом осуществления настоящего изобретения является композиция лизинпэгилированного ИФР-I варианта по настоящему изобретению и варианта ИФР-I, пэгилированного сN-конца. Предпочтительно молекулярное соотношение находится в диапазоне от 9:1 до 1:9. Другим предпочтительным вариантом осуществления настоящего изобретения является композиция, в которой молярное соотношение составляет по меньшей мере 1:1 (по меньшей мере одна часть лизинпэгилированного ИФР-I варианта на одну часть варианта ИФР-I, пэгилированного с N-конца), предпочтительно по меньшей мере 6:4 (по меньшей мере 6 частей лизин-пэгилированного варианта ИФР-I на четыре части варианта ИФР-I, пэгилированного с N-конца). Предпочтительно оба варианта, и лизинпэгилированный вариант ИФР-I, и вариант ИФР-I, пэгилированный с N-конца, являются монопэгилированными. Предпочтительно в такой композиции вариант идентичен одновременно и лизинпэгилированному варианту ИФР-I, и пэгилированному с N-конца варианту ИФР-I. Вариант предпочтительно выбран из группы, включающей RRKK, RRKR, RRRK, RKRR. ПЭГ предпочтительно имеет молекулярную массу 30-45 кДа, особенно 30 кДа или 40 кДа. Лизин-пэгилированный вариант ИФР-I и пэгилированный с N-конца вариант ИФР-I имеют сопоставимое сродство с ИФР-связывающими белками(например, СБ 4 и СБ 5), но разную активность в отношении фосфорилирования ИФР-IR. Настоящее изобретение предусматривает конъюгат, состоящий из варианта ИФР-I (ИФР-I конъюгата или конъюгата) и полиэтиленгликольной группы (групп), отличающийся тем, что указанный вариант ИФР-I имеет такую аминокислотную замену(ы) в положениях 27, 37, 65 и/или 68 аминокислотной последовательности природного ИФР-I, что одна или несколько аминокислот в положениях 37, 65, 68 являются лизином (K), аминокислота в положении 27 является полярной аминокислотой, но не лизином, а указанный ПЭГ конъюгирован с указанным вариантом ИФР-I через первичную аминогруппу(ы), предпочтительно через первичную аминогруппу(ы) лизина(ов). Предпочтительно средняя молекулярная масса полиэтиленгликолевых групп(ы) составляет по меньшей мере 20 кДа, более предпочтительно 20-100 кДа и особенно предпочтительно 20-80 кДа. Группы(а) полиэтиленгликоля сопряжены с вариантом ИФР-I по первичным аминогруппам(е) лизина одной или нескольких аминокислот в положениях 37, 65, 68 (аминореактивное пэгилирование) и необязательно пэгилированы по N-концевой аминокислоте. Конъюгат предпочтительно моно- или дипэгилирован по остатку (остаткам) лизина по одной или нескольким аминокислотам в положении (положениях) 37, 65, 68 и необязательно пэгилирован по N-концевой аминокислоте. В другом предпочтительном варианте осуществления настоящего изобретения конъюгат является монопэгилированным поK65, K68 или K37 или дипэгилированным по K65 и K68 и необязательно пэгилированным по Nконцевой аминокислоте. Предпочтительно не более 20% пэгилированного варианта ИФР-I дополнительно пэгилировано с N-конца. Варианты ИФР-I обозначены следующим образом: K65 означает, что аминокислотой в положении 65 является лизин, R27 означает, что аминокислотой в положении 27 является аргинин и т.д. Вариант ИФР-I, несущий аминокислоты R27, K37, K65, K68, обозначается аббревиатурой RKKK. Исходный вариант ИФР-I обозначается аббревиатурой KRKK. Особенно предпочтительными вариантами ИФР-I и вариантами в составе конъюгатов являютсяRRKK, RRKR, RRRK, RKRR. Также предпочтительным является пэгилированный вариант ИФР-I, у которого согласно настоящему изобретению процессированно до трех аминокислот (предпочтительно все три) с N-конца. Соответствующий мутант природного типа, называемый Des(1-3)-ИФР-I, лишен остатков аминокислот gly, pro иglu с N-конца (Kummer A. и др. Int. J. Exp. Diabesity Res. 4, 2003, с. 45-57). Полиэтиленгликолевые группы(а) являются линейными или разветвленными. Настоящее изобретение также предусматривает способы приготовления конъюгата по настоящему изобретению с использованием в качестве промежуточных соединений ИФР-I. Способ заключается в приготовлении конъюгата, содержащего вариант ИФР-I и одну или две полиэтиленгликолевые группы,причем указанные ПЭГ группы(а), имеющие предпочтительно молекулярную массу по меньшей мере-3 011284 равную 20 кДа, более предпочтительно примерно 20-100 кДа и особенно предпочтительно 20-80 кДа,путем химической реакции промежуточного соединения ИФР-I с активированным полиэтиленгликолем в условиях, при которых указанный полиэтиленгликоль становится химически связанным с указанным промежуточным соединением ИФР-I по первичной аминогруппе(ам) варианта ИФР-I. Настоящее изобретение также предусматривает фармацевтические композиции, содержащие конъюгат согласно настоящему изобретению, предпочтительно вместе с фармацевтически приемлемым носителем. Настоящее изобретение также предусматривает способы получения фармацевтических композиций,содержащих конъюгат согласно настоящему изобретению. Настоящее изобретение также предусматривает применение конъюгата согласно настоящему изобретению для получения лекарственного средства для лечения БА. Настоящее изобретение также предусматривает способы лечения БА, отличающиеся тем, что фармацевтически эффективное количество аминореактивного пэгилированного варианта ИФР-I вводят в организм пациента, нуждающегося в таком лечении, предпочтительно один или два раза в неделю. Подробное описание изобретения Понятия пэгилированный вариант ИФР-I или аминореактивное пэгилирование в контексте настоящего изобретения означают, что вариант ИФР-I ковалентно связан с одной или двумя полиэтиленгликолевыми группами путем аминореактивного соединения с одним или двумя лизинами в молекуле варианта ИФР-I. Группы(а) ПЭГ присоединены по сайтам молекулы варианта ИФР-I, являющимися первичными -аминогруппами боковых цепей лизина. Возможно также дополнительное наличие пэгилирования по N-концевой -аминогруппе. Из-за применяемого способа синтеза и используемого варианта пэгилированный вариант ИФР-I может состоять из смеси вариантов ИФР-I, пэгилированных по аминокислотам K65, K68 и/или K37, пэгилированных или не пэгилированных по N-концу, в соответствии с чем сайты пэгилирования могут быть разными у разных молекул или могут быть в основном однородными в зависимости от количества полиэтиленгликолевых боковых цепей, приходящихся на одну молекулу,и/или сайт пэгилирования в молекуле. Предпочтительно варианты ИФР-I являются моно- и/или дипэгилированными и специально очищенными от пэгилированных по N-концу вариантов ИФР-I. Аминореактивное пэгилирование в контексте настоящего изобретения означает способ случайного присоединения цепей полиэтиленгликоля к первичным аминогруппам(е) лизина в варианте ИФР-I путем использования реактивного (активированного) полиэтиленгликоля, предпочтительно путем использования N-гидроксисукцинимидильного сложного эфира, предпочтительно метоксиполиэтиленгликоля. В результате реакции сочетания происходит присоединение полиэтиленгликоля к реактивным первичным-аминогруппам остатков лизина и необязательно к -аминогруппе N-концевой аминокислоты ИФР-I. Такое сопряжение ПЭГ к белкам хорошо известно в данной области. Например, обзор таких методов приведен в работе Veronese F.M. Biomaterials 22, 2001, с. 405-417. Согласно Veronese сопряжение ПЭГ с первичными аминогруппами белков может быть выполнено путем использования активированных молекул ПЭГ, которые производят алкилирование указанных первичных аминогрупп. Для такой реакции могут применяться активированные алкилирующие полиэтиленгликоли, например, ПЭГ-альдегид,ПЭГ-тресилхлорид или ПЭГ-эпоксид. Пригодными реагентами также являются ацилированные полиэтиленгликоли, например, гидроксисукцинимидильные сложные эфиры карбоксилированных полиэтиленгликолей или полиэтиленгликоли, в которых концевая гидроксильная группа активирована хлорформиатами или карбонилимидазолом. Пригодными полиэтиленгликолевыми реагентами также являются полиэтиленгликоли с аминокислотными цепями. К таким реагентам могут относиться так называемые разветвленные полиэтиленгликоли, в соответствии с чем по меньшей мере две идентичные или различные молекулы ПЭГ связываются друг с другом пептидным спейсером (предпочтительно лизином) и, например, связываются с вариантом ИФР-I в качестве активированного карбоксилата лизинового спейсера. Моно-N-концевое сопряжение также описано Kinstler O. и др. в Adv. Drug Deliv. Rev. 54, 2002, с. 477485. В контексте настоящего изобретения понятие ПЭГ или полиэтиленгликоль означает водорастворимый полимер, который коммерчески доступен или может быть приготовлен способом полимеризации этиленгликоля с раскрытием цикла, хорошо известным в данной области (Kodera Y. и др. Progress inPolymer Science 23, 1998, с. 1233-1271, Francis G.E. и др. Int. J. Hematol. 68, 1998, с. 1-18). Термин ПЭГ широко используется и распространяется на любую молекулу полиэтиленгликоля, в которой число звеньев этиленгликоля составляет по меньшей мере 460, предпочтительно 460-2300, особенно предпочтительно 460-1840 (молекулярная масса 230 звеньев ПЭГ примерно равна 10 кДа). Максимальное число звеньев ПЭГ ограничено только растворимостью конъюгата. Обычно не используются полиэтиленгликоли, содержащие более 2300 звеньев. Предпочтительно ПЭГ, применяемый в настоящем изобретении,заканчивается по одному концу гидрокси- или метоксигруппой (метоксиПЭГ, мПЭГ), а с другого конца ковалентно присоединен к линкерной части молекулы оксиэфирной связью. Полимер является прямым или разветвленным. Разветвленные полиэтиленгликоли, например, описаны Veronese F.M. и др. в Journalof Bioactive and Compatible Polymers 12, 1997, с. 196-207. Пригодными в качестве регентов, например,-4 011284 являются полиэтиленгликоли фирмы Nektar Therapeutics (www.nektar.com). Могут применяться ПЭГ разной молекулярной массы, например примерно 20-100 кДа(n=460-2300). Число повторяющихся звеньев n в ПЭГ приближено к молекулярной массе, выраженной в дальтонах. Например, если две молекулы ПЭГ присоединены к линкеру, причем обе молекулы ПЭГ имеют одинаковую молекулярную массу 10 кДа (у каждой молекулы n примерно равно 230), суммарная молекулярная масса на одном линкере примерно равна 20 кДа. Молекулярная масса молекул ПЭГ, присоединенных к линкеру, может быть разной, например из двух молекул на одном линкере одна молекула может иметь молекулярную массу 5 кДа, а другая молекула ПЭГ может иметь молекулярную массу 15 кДа. Молекулярная масса всегда отражает среднюю молекулярную массу. В приведенных ниже примерах описаны некоторые предпочтительные реагенты для получения аминореактивных пэгилированных вариантов ИФР-I. Очевидно, что модификации, основанные на методах, описанных Veronese F.M. в Biomaterials 22, 2001, с. 405-417, могут проводиться в той степени, в которой они позволяют получать конъюгаты согласно настоящему изобретению. Наличие до трех потенциально реактивных первичных аминогрупп в целевом белке (до двух лизинов и одной концевой аминокислоты) приводит к сериям изомеров пэгилированных вариантов ИФР-I,которые отличаются в точке присоединения цепи полиэтиленгликоля. Настоящее изобретение предусматривает пэгилированные формы варианта ИФР-I с улучшенными свойствами. Такие конъюгаты пэгилированного варианта ИФР-I содержат одну или две случайным образом присоединенные линейные или разветвленные группы ПЭГ, поэтому средняя молекулярная масса всех групп ПЭГ в конъюгате предпочтительно составляет примерно 20-80 кДа. Специалистам в данной области очевидно, что возможны незначительные отклонения от этого диапазона молекулярной массы до тех пор, пока пэгилированный вариант ИФР-I проявляет активность по снижению уровней амилоидных-пептидов (А) в мозге. Кроме того, пэгилирование варианта ИФР-I с ПЭГ, чья молекулярная масса превышает 80 кДа, приводит к повышению биодоступности. Однако предполагается, что такая активность снижается по мере увеличения молекулярной массы из-за пониженной активации рецептора ИФР-I и ухудшенного транспорта через гематоэнцефалический барьер. Таким образом, диапазон 20-100 кДа для молекулярной массы ПЭГ расценивается оптимальным для конъюгата ПЭГ и варианта ИФР-I, пригодных для эффективного лечения пациентов с БА. В контексте настоящего изобретения понятие молекулярная масса означает среднюю молекулярную массу ПЭГ. Приводимые ниже пэгилированные формы вариантов ИФР-I являются примерами, соответствующими конъюгатам настоящего изобретения: монопэгилированный вариант ИФР-I, в котором молекулярная масса группы ПЭГ составляет 20-80 кДа (460-1840 звеньев ПЭГ); дипэгилированный вариант ИФР-I, в котором молекулярная масса каждой группы ПЭГ составляет примерно 10-50 кДа (230-1150 звеньев ПЭГ) и их смеси. Особенно предпочтительным является монопэгилированный ИФР-I, выбранный из группы,включающей RRKK, RRKR, RRRK и RKRR, в котором разветвленная группа ПЭГ имеет молекулярную массу 30-45, предпочтительно 40-45 кДа (примерно 920 звеньев). Например, при средней молекулярной массе ПЭГ 44 кДа и молекулярной массе ИФР-I 7,6 кДа суммарная средняя молекулярная масса такого монопэгилированного ИФР-I составляет примерно 51,6 кДа. Предпочтительным также является монопэгилированный ИФР-I, выбранный из группы, включающей RRKK, RRKR, RRRK и RKRR, в котором средняя молекулярная масса ПЭГ составляет 30 или 40 кДа. Понятие ПЭГ или группа ПЭГ согласно настоящему изобретению означает остаток, чьей значительной частью является полиэтиленгликоль. Такой ПЭГ может содержать дополнительные химические группы, которые необходимы для реакций связывания, образуются в результате химического синтеза молекулы или являются спейсером для оптимального расстояния между разными частями молекулы. Кроме того, ПЭГ может содержать одну или несколько боковых цепей ПЭГ, связанных вместе. Группы ПЭГ, содержащие более одной цепи ПЭГ, являются разветвленными полиэтиленгликолями. Разветвленные ПЭГ могут быть получены, например, добавлением полиэтиленоксида к различным полиолам,включая глицерин, пентаэритрит и сорбит. Например, ПЭГ с четырьмя разветвлениями может быть получен из пентаэритрита и этиленоксида. Разветвленные полиэтиленгликоли обычно имеют 2-8 цепей,они описаны, например, в ЕР-А-0473084 и в патенте US 5932462. Особенно предпочтительными являются полиэтиленгликоли с двумя боковыми ПЭГ-цепями (ПЭГ 2), связанными по первичным аминогруппам лизина (Monfardini C. и др. Bioconjugate Chem. 6, 1995, с. 62-69). Понятие в значительной степени гомогенные в контексте настоящего изобретения означает, что получены молекулы только одного пэгилированного варианта ИФР-I, содержащие только одну или две присоединенные группы ПЭГ. Препарат может содержать небольшое количество нереакционноспособного (т.е. утратившего группу ПЭГ) белка. С помощью пептидного картирования и N-концевого секвенирования в одном из приводимых ниже примеров предусмотрен способ получения препарата, состоящего по меньшей мере на 90% из конъюгата варианта ПЭГ-ИФР-I и не более чем 5% непрореагировав-5 011284 шего белка. Выделение и очистка таких гомогенных препаратов пэгилированного варианта ИФР-I может быть проведена обычными способами очистки, предпочтительно эксклюзионной хроматографией. Понятие монопэгилированный в контексте настоящего изобретения означает, что вариант ИФР-I пэгилирован только по одному лизину в молекуле варианта ИФР-I, т.е. только одна группа ПЭГ ковалентно присоединена к этому сайту. Такой монопэгилированный ИФР-I может быть дополнительно пэгилирован по N-концу до определенной длины. Чистый вариант монопэгилированного ИФР-I(без N-концевого пэгилирования) составляет по меньшей мере 80% препарата, предпочтительно 90% и наиболее предпочтительно монопэгилированный вариант ИФР-I составляет 92% в препарате или более,остальной состав препарата представлен нереакционноспособным (непэгилированным) ИФР-I и/илиN-концевым пэгилированным вариантом ИФР-I. Таким образом, препараты монопэгилированного варианта ИФР-I согласно настоящему изобретению являются достаточно гомогенными и в качестве гомогенного препарата обладают преимуществом, например, для фармацевтического применения. Таким же качеством обладают дипэгилированные препараты. Активированные полиэтиленгликоли или активированные полиэтиленгликолевые реагенты хорошо известны в данной области. Предпочтительно используются электрофильно активированные полиэтиленгликоли, например алкоксимасляной кислоты сукцинимидные эфиры полиэтиленгликоля (низшие алкокси-ПЭГ-СМК), или алкоксипропионовой кислоты сукцинимидные эфиры полиэтиленгликоля(низшие алкокси-ПЭГ-СПК), или N-гидроксисукцинимидактивированные полиэтиленгликоли. Может быть применен любой способ осуществления взаимодействия активированного сложного эфира с амином для образования амида. В реакции активированного ПЭГ с ИФР-I приводимый сукцинимидильный сложный эфир является отщепляемой группой, вызывающей образование амида. Применение сукцинимидных сложных эфиров для получения конъюгатов с белками описано в патенте US 5672662. Условия проведения реакции влияют на соотношение различных пэгилированных вариантов ИФР-I. Изменяя условия проведения реакции (например, соотношение реагентов, рН, температуру, длительность реакции и т.д.), можно варьировать соотношение различных пэгилированных вариантов ИФР-I. Предпочтительно реакцию проводят в буферном водном растворе с рН 8-10, содержащем 5-15 об.% этанола и 0,5-4 об.% этиленгликоля. Соотношение белок:ПЭГ предпочтительно составляет от 1:0,5 до 1:2,если получают монопэгилированные варианты, и от 1:2 до 1:5, если получают дипэгилированные варианты. Температуру и время реакции можно варьировать по решению специалиста, причем высокая температура и увеличенная длительность реакции приводят к усилению пэгилирования. Если получают монопэгилированные варианты, предпочтительнее проводить реакцию при 4 С на протяжении до 30 мин. Если пэгилированный реагент объединяют с вариантом ИФР-I в реакционном буфере, предпочтительно содержащем 50 ммоль бората натрия, 10% этанола и 1% диэтиленгликоля (ДЭГ), при величине рН примерно 9,0, соотношение белок:ПЭГ составляет примерно 1:1,5, температура при проведении реакции 4 С, получают смесь моно-, ди- и следовые количества трипэгилированных молекул. Если соотношение белок:ПЭГ составляет примерно 1:3, получают преимущественно ди- и олигопэгилированные молекулы. Конъюгаты варианта ИФР-I согласно настоящему изобретению могут быть получены ковалентным взаимодействием первичной аминогруппы лизина варианта ИФР-I с бифункциональным реагентом для получения промежуточного соединения с амидной связью, а также ковалентным взаимодействием промежуточного соединения, содержащего амидную связь, с активированным производным полиэтиленгликоля для получения конъюгата варианта ИФР-I. В последующем процессе бифункциональным реагентом предпочтительно являетсяN-сукцинимидил-Sацетилтиоацетат, а активированное производное полиэтиленгликоля предпочтительно выбрано из группы, включающей йод-ацетилметокси-ПЭГ, метокси-ПЭГ-винилсульфон и метокси-ПЭГ-имид малеиновой кислоты. Особенно предпочтительным является применение N-гидроксисукцинимидилактивированного разветвленного сложного эфира ПЭГ (mПЭГ 2-NГС) с молекулярной массой 40 кДа (Monfardini C. и др. Bioconjugate Chem. 6, 1995, с. 62-69, Veronese F.M. и др. J. Bioactive Compatible Polymers 12, 1997, с. 197-207,патент US 5932462). Конъюгаты варианта ИФР-I могут быть получены аминореактивным ковалентным связыванием тиоловых групп с вариантом ИФР-I (активация) и взаимодействием получаемого активированного варианта ИФР-I с производным полиэтиленгликоля (ПЭГ). Первая стадия заключается в ковалентном связывании тиоловых групп с NH2-группами лизина варианта ИФР-I. Активация варианта ИФР-I проводится бифункциональными реагентами, несущими защищенную тиоловую группу и дополнительную реактивную группу, например активными сложными эфирами (например, сложный эфир сукцинимидила),ангидридами, сложными эфирами сульфоновых кислот, галогенидами карбоновых кислот и сульфоновых кислот соответственно. Тиоловая группа защищена группами, известными в данной области, например, ацетильными группами. Бифункциональные реагенты способны реагировать с -аминогруппами аминокислот с образованием амидной связи. Получение бифункциональных реагентов известно в данной области. Предшественники бифункциональных N-гидроксисукцинильных сложных эфиров описаны вDE 3924705, а получение ацетилтиопроизводного соединения описано March J. Advanced Organic Chem-6 011284istry, 1977, с. 375-376. Бифункциональный реагент SATA коммерчески доступен (фирма Molecular Probes,Eugene, Орегон, США и фирма Pierce, Рокфорд, Иллинойс) и описан в Duncan R.J. Anal. Biochem. 132,1983, с. 68-73. Реакцию проводят, например, в водном буферном растворе, рН 6,5-8,0, например в 10 мМ фосфате калия, 300 мМ NaCl, рН 7,3. Бифункциональный реагент может добавляться в ДМСО. После завершения реакции, предпочтительно через 30 мин, реакцию прекращают добавлением лизина. Избыток бифункционального реагента может быть отделен способами, известными в данной области, например диализом или колоночной фильтрацией. Среднее число тиоловых групп, добавленных к варианту ИФР-I, может быть определено фотометрическими методами, описанными, например, Grasetti D.R. и Murray J.F. Arch.Biochem. Biophys. 119, 1967, с. 41-49. Указанная выше реакция сопровождается ковалентным связыванием активированного производного полиэтиленгликоля. Активированные производные ПЭГ известны в данной области и описаны, например, Morpurgo М. и др. J. Bioconjugate Chem. 7, 1996, с. 363-368, для ПЭГ-винилсульфона. Полиэтиленгликоли с линейной и разветвленной цепью пригодны для получения соединений формулы I. Примерами реагентов реактивных ПЭГ являются йод-ацетилметокси-ПЭГ и метокси-ПЭГ-винилсульфон. Использование этих йодактивированных веществ известно в данной области и описано, например, Hermanson G.T. BioconjugateTechniques, Academic Press, San Diego, 1996, с. 147-148. Дальнейшая очистка соединений согласно настоящему изобретению включает разделение монои/или дипэгилированных вариантов ИФР-I, предпочтительно от N-концевых пэгилированных форм, и может быть осуществлена способами, известными в данной области, например колоночной хроматографией, предпочтительно ионообменной хроматографией, особенно катионообменной хроматографией. Процентное содержание монопэгилированных конъюгатов, а также соотношение моно- и дипэгилированных вариантов может контролироваться более широким объединением фракций вокруг пика элюции для понижения процентного содержания монопэгилированных конъюгатов или более узким сбором фракций для повышения процентного содержания монопэгилированных конъюгатов в композиции. Примерно 90% монопэгилированных конъюгатов составляет хороший баланс выхода и активности. Могут быть желательными некоторые композиции, в которых, например, по меньшей мере 95% или по меньшей мере 98% конъюгатов являются монопэгилированными формами. В варианте осуществления настоящего изобретения процентное содержание монопэгилированных конъюгатов составляет 90-98%. В настоящем изобретении понятие полярная аминокислота относится к аминокислоте, выбранной из группы, включающей цистеин (C), аспарагиновую кислоту (D), глутаминовую кислоту (E), гистидин(H), аспарагин (N), глутамин (Q), аргинин (R), серин (S) и треонин (T). Лизин также является полярной аминокислотой, однако он не входит в указанную группу, поскольку замещается согласно настоящему изобретению. Предпочтительно в качестве полярной аминокислоты используется аргинин. Фармацевтические составы Пэгилированный ИФР-I согласно настоящему изобретению предусматривает улучшенную стабильность при циркуляции в организме, обеспечивающую устойчивый доступ к рецепторам ИФР-I по всему организму при низких интервалах применения. Варианты пэгилированного IGF-I могут вводиться в организм в виде смеси или в качестве различных отдельных пэгилированных образцов, разделенных ионобменной хроматографией или эксклюзионной хроматографией. Соединения настоящего изобретения могут быть переработаны методами получения фармацевтических композиций, известными специалистам в данной области. Для получения таких композиций варианты пэгилированного IGF-I по настоящему изобретению объединяют в смесь с фармацевтически приемлемым носителем предпочтительно путем диализа против водного раствора, содержащего желаемые ингредиенты фармацевтических композиций. Такие приемлемые носители, например,описаны в кн.: Remington's Pharmaceutical Sciences, 18-е изд. изд-во Mack Publishing Company, под ред.Oslo и др., с. 1435-1712. Типичные композиции содержат эффективное количество вещества согласно настоящему изобретению, например примерно 0,1-100 мг/мл, вместе с приемлемым количеством носителя. Композиции могут быть введены парентерально. Пэгилированные IGF-I согласно настоящему изобретению вводят предпочтительно внутрибрюшинно, подкожно, внутривенно или интраназально. Фармацевтические составы согласно настоящему изобретению могут быть получены известными в данной области способами. Обычно растворы пэгилированного варианта ИФР-I диализируют против буфера,применяемого в фармацевтических композициях, и величину необходимой конечной концентрации белка доводят путем концентрирования или разведения. Такие фармацевтические композиции могут применяться для введения инъекцией или инфузией предпочтительно внутрибрюшинно, подкожно, внутривенно или интраназально и содержать эффективное количество пэгилированного варианта ИФР-I вместе с фармацевтически приемлемыми растворителями, консервантами, солюбилизаторами, эмульгаторами, адъювантами и/или носителями. Такие композиции включают растворители с различными буферными компонентами (например, аргинином, ацетатом, фосфатом), величиной рН и ионной силой, добавками, например разрыхлителями и солюбилизирующими агентами (например, продуктом Tween 80/полисорбатом, продуктом Pluronic F68), антиоксидантами (например, аскорбиновой кислотой, метабисульфитом натрия), консервантами (продуктомTimersol, бензиловым спиртом), наполнителями (например, сахарозой, маннитом), а также полимерными соединениями, например полимерами молочной кислоты, полигликолевой кислоты и др. для включения материалов в частицы или липосомы. Такие композиции могут влиять на состояние физической стабильности при высвобождении и клиренсе монопэгилированного ИФР-I согласно настоящему изобретению. Дозировки и концентрации лекарственных средств. Обычно при стандартном режиме лечения пациентов лечат дозами в диапазоне 0,001-3 мг, предпочтительно 0,01-3 мг пэгилированного варианта ИФР-I/кг/сутки на протяжении определенного периода,составляющего 1-30 суток или даже больше. Лекарственное средство применяют один раз в сутки в виде подкожной, внутривенной или внутрибрюшинной болюсной инъекции или инфузии фармацевтического состава, содержащего 0,1-100 мг пэгилированного ИФР-I в мл. Такое лечение может сочетаться с какимлибо стандартным (например, химиотерапевтическим) лечением, при этом применяют пэгилированный ИФР-I до, во время или после стандартного лечения. Это приводит к улучшенному результату по сравнению с применением только одного стандартного лечения. Установлено, что для успешного лечения пэгилированный ИФР-I по настоящему изобретению может вводиться только один или два раза в неделю. В другом варианте осуществления настоящего изобретения описан способ лечения болезни Альцгеймера, заключающийся во введении пациенту, нуждающемуся в этом, терапевтически эффективного количества пэгилированного ИФР-I согласно настоящему изобретению в виде одной дозы, находящейся в диапазоне 0,001-3 мг, предпочтительно 0,01-3 мг варианта пэгилированного ИФР-I на 1 кг на протяжении 3-8 суток, предпочтительно 7 суток. В качестве пэгилированного ИФР-I предпочтительно используют монопэгилированный ИФР-I, предпочтительно в виде композиции варианта лизин-пэгилированного ИФР-I согласно настоящему изобретению и варианта ИФР-I, пэгилированного с N-конца в молярном соотношении по меньшей мере 1:1. В другом варианте осуществления настоящего изобретения используют пэгилированный ИФР-I согласно настоящему изобретению для получения лекарственного средства для лечения болезни Альцгеймера, которое вводят пациенту, нуждающемуся в этом, в терапевтически эффективном количестве в виде одной или двух доз, находящихся в диапазоне 0,001-3 мг, предпочтительно 0,01-3 мг варианта пэгилированного ИФР-I на 1 кг на протяжении 6-8 суток, предпочтительно 7 суток. В качестве пэгилированного ИФР-I предпочтительно используют монопэгилированный ИФР-I, предпочтительно в виде композиции варианта лизин-пэгилированного ИФР-I по настоящему изобретению и варианта ИФР-I, пэгилированного с N-конца в молярном соотношении по меньшей мере 1:1. Приводимые ниже примеры, ссылки и фигуры поясняют настоящее изобретение, но не ограничивают его области охвата, описанной в формуле изобретения. Очевидно, что в приводимых ниже методиках могут быть произведены изменения, которые также соответствуют сути настоящего изобретения. Перечень последовательностейSEQ ID NO: 1 аминокислотная последовательность ИФР-I человека (аминокислоты 1-70 ИФР-I,аминокислоты 71-105 пропептида согласно SwissProt Р 01343). Краткое описание фигур Фиг. 1. Ионообменная хроматография-ВЭЖХ пэгилированного ИФР. Чистые изомеры положения отделяют от пэгилированной смеси, используя препаративную строго катионообменную колонку (фирмаTOSOH-BIOSEP, колонка SP-5PW). Фракции пяти разных пиков (обозначенных 0-4) выделены и процессированы для дальнейшего анализа. Фиг. 2. Анализ методом электрофореза в натрий додецилсульфат-полиакриламидном геле пиков монопэгилированных ИФР-I. Фракции пяти очищенных пиков (обозначенных 0-4) подвергают электрофорезу в 4-12% трис-глицин натрий додецилсульфат-полиакриламидном геле в условиях без восстановления (А) и при восстановлении (Б) и гели окрашивают красителем для белков кумасси голубым. Ммм - маркер молекулярной массы. Фиг. 3. Пептидный анализ пиков 1, 2 и 3 монопэгилированного ИФР-I. Пики 1, 2 и 3 очищенного монопэгилированного ИФР-I разрушают с помощью Asp-N и полученные пептидные фрагменты разделяют ВЭЖХ. Пептидные последовательности пэгилированных фрагментов получают методом N-концевого разрушения пептидов по Эдману. А - Методом ВЭЖХ получено 6 разных пептидных фрагментов рчИФР-I с временем задержки от 30 до 45 мин и седьмой крупный фрагмент (и минорный фрагмент 7') пэгилированных пиков с примерным временем задержки 70 мин. Стрелки показывают соответствующие крупные изменения в пептидных фрагментах различных пиков по сравнению с рчИФР-I. Б - Пептидная последовательность 6 фрагментов, полученных в результате расщепления рчИФР-I с помощью Asp-N. Лизины (K) выделены жирным шрифтом во фрагментах 3 и 4. Фрагмент 5 обозначаетN-концевой пептид. В - Пептидная последовательность пэгилированных пептидных фрагментов 7 после разрушения методом Эдмана. Остатки цистеина и пэгилированного лизина вызывают разрывы пептидной последовательности.-8 011284 Фиг. 4. Иерархическое кластерирование БА разных профилей глобальной экспрессии от ИФР-I и монопэгилированных изомеров. Время инкубирования ИРФ-I и пэгилированных вариантов составляло 24 ч; использовали мышей линии NIH-3T3. Условия и результаты анализа описаны в тексте: А - кластеры генов, регуляция которых ослабляется; Б - кластеры генов, регуляция которых усиливается. Фиг. 5. Фосфорилирование ИФР-IR с помощью рчИФР-I и монопэгилированного ИФР-I. Клетки линии NIH-3T3, стабильно трансфецированные ИФР-IR человека, в течение ночи выдерживают в среде без сыворотки и затем инкубируют с возрастающими дозами (0,01-10 мкг/мл) рчИФР-I или монопэгилированными ИФР-I изомерами (пики 1, 2, 3, смесь пиков, Des(1-3) пик 3) в течение 30 мин. Затем клетки обрабатывают для Вестерн-блоттинга или внутриклеточного анализа, описанных в методах. Кривые дозы-ответа с рчИФР-I (А), пиком 1 (Б), пиком 2 (В), пиком 3 (Г), смесью пиков (Д) и Des(1-3) пика 3 (Е) соответственно. Сигнал фосфорилирования нормализовали для уровней ИФР-IR в отдельных лунках. Представленные точки показывают средние значения SEM по 6 измерениям для 3 независимых культур. Фиг. 6. Количественный анализ фосфорилирования ИФР-IR в клетках линии NIH-3T3. Кривые дозы-ответа, полученные в ходе экспериментов примера 7, были положены в основу кинетики связывания по одной точке для получения показателей специфического связывания (BMax), 50% от концентраций связывания (ЕС 50) и коэффициентов Хилла (nH). Представленные данные показывают средние значенияSEM по 6 измерениям для 3 независимых культур. Фиг. 7. Снижение содержания A in vivo у мышей линии PS2APP за счет применения рчИФР-I. Дважды трансгенных мышей линии PS2AAP в возрасте 2-3 месяцев (n=10) лечат в течение 2 ч рчИФР-I(50 мкг/кг, внутрибрюшинное введение). Получают экстракты коры головного мозга и оценивают уровни содержания АБП, С 99, A и контрольного белка (альбумина) согласно описанному в методах способу. Исходя из нормализованных по альбумину значений, подсчитывают соотношения С 99/АБП, А/АБП и С 99/А, выражают в виде % от контроля без лечения и представляют средние значения SEM: А - представлены результаты Вестерн-блоттинга экстрактов коры головного мозга двухмесячных мышей. Выражено четкое снижение уровней содержания А, однако в результате лечения рчИФР-I уровни других соединений остаются неизменившимися; Б - количественный анализ экстрактов коры головного мозга мышей линии PS2APP (р 0,01 по сравнению с контролем без лечения). Фиг. 8. Динамика понижения in vivo у мышей линии PS2APP содержания А за счет применения рчИФР-I. Двухмесячных мышей лечат рчИФР-I (50 мкг/кг, внутрибрюшинное введение) 2, 6 или 24 ч. Затем определяют и высчитывают соотношения уровней А/АПБ и С 99/АПБ описанным способом. Полученные данные выражают в виде % по отношению к контролю без лечения и представляют средним значением SEM (n=10-13):B - соотношения С 99/А через 2, 6 и 24 ч после инъекции (р 0,01 по сравнению с контролем без лечения). Фиг. 9. Снижение содержания А in vivo у мышей линий ААР и PS2APP за счет применения пиков 1-3. Эксперименты проводят на смешанных популяциях однократно трансгенных (АРР) и дважды трансгенных (PS2APP) мышей. Соотношения А/АПБ и С 99/А для пиков 1, 2 и 3 представлены вместе для непосредственного сопоставления их воздействий на снижение содержания А и клиренс (n=8-10): А - соотношения А/АПБ, показывающие воздействие пиков 1-3 на содержание в мозге А; Б - соотношения С 99/А, показывающие клиренс А из мозга (р 0,05; р 0,01; р 0,001 по сравнению с контролем без лечения). Фиг. 10. Динамика понижения in vivo у мышей ААР и PS2APP содержания А за счет применения пика 3. Двухмесячных мышей в смешанных популяциях, включающих АРР и PS2APP мышей, лечат введением пика 3 (50 мкг/кг, внутрибрюшинное введение) 2, 6, 24, 48 или 72 ч. Затем определяют уровни содержания АПБ, С 99, А и актина и подсчитывают их соотношения описанным способом. Полученные данные выражают в виде % по отношению к контролю без лечения и представляют средним значениемB - соотношения С 99/АР через 6, 24 и 48 ч после инъекции (р 0,05; р 0,01; р 0,001 по сравнению с контролем без лечения). Фиг. 11. Понижения содержания А in vivo у мышей линии PS2APP за счет применения пиков пэгилированных ИФР 1-3. Соотношения А/АПБ для пиков 1, 2 и 3 представлены вместе для непосредственного сопоставления их воздействий на понижение содержания А и клиренс (n=3-13; р 0,05 по сравнению с контролем без лечения). Фиг. 12. Динамика понижения in vivo у мышей линии PS2APP содержания А за счет применения пика 3. Двухмесячных мышей линии PS2APP лечат в течение 2, 6, 24, 48 или 72 ч после однократной-9 011284 внутрибрюшинной инъекцией пика 3 (50 мкг/кг). Затем определяют соотношения А/АБП согласно описанному способу. Полученные данные выражают в виде % по отношению к контролю без лечения и представляют средним значением SEM (n=4-13; р 0,05; р 0,01 по отношению к контрольным животным, не подвергавшимся лечению). Примеры Материалы и методы. Рекомбинантный инсулиноподобный фактор роста человека (рчИФР-I) приобретают в фирмеDes(1-3)-ИФР-I приобретают в фирме GroPep (Аделаида, Австралия). Полиэтиленгликолевый реагент может быть приобретен в фирме Nektar Ltd. (Сан-Карлос, Калифорния, США). Все другие химикаты и растворители выбирают самой высокой степени чистоты из доступных химикатов и реактивов. Варианты ИФР-I могут быть получены рекомбинацией с помощью методов, известных в данной области, например, с помощью сайт-специфичного мутагенеза в сочетании со способами экспрессии, предпочтительно в Е.coli, например, согласно описанным методам в патентах US 6509443 или US 6403764. Пэгилирование ИФР-I. Получают изомеры ИФР-I, пэгилированные по одному сайту (монопэгилированные ИФР-I). Монопэгилированный ИФР-I получают сопряжением -аминогрупп лизина, расположенных по длине молекулы или по N-концу молекулы ИФР-I с активированной разветвленной частью ПЭГ с молекулярной массой 40 кДа. Реакционная смесь для пэгилирования содержит реагенты рчИФР-I и ПЭГ-NГC с молекулярной массой 40 кДа в молярном соотношении 1:1,5 в буфере 50 мМ бората натрия (10% этанола и 1% ДЭГ), рН 9,0. Реакцию проводят в течение 30 мин при 4 С. Основываясь на том, что у применяемой части молекулы ПЭГ средняя молекулярная масса составляет 44 кДа, а у ИФР-I молекулярная масса составляет 7,6 кДа, следует ожидать, что молекулярная масса монопэгилированного ИФР-I примерно будет составлять 51,6 кДа. Разделение позиционированных ПЭГ-ИФР-I изомеров ионообменной хроматографией. Применяют схему очистки с помощью препаративной строго катионобменной колонки (фирмаTOSOH-BIOSEP, колонка SP-5PW, внутренний диаметр 30 мм, длина 75 мм) для получения изоформ чистых монопэгилированных ИФР-I. У буферной системы, включающей два буфера, доводят величину рН у буфера, состоящего из 7,5 ммоль ацетата натрия, 10% этанола и 1% диэтиленгликоля (буфера А), до 4,5, а у буфера, состоящего из 20 ммоль фосфата калия, 10% этанола и 1% диэтиленгликоля, доводят величину рН до 6,5 (буфер Б). Колонку предварительно уравновешивают 25% буфера Б. После загрузки пэгилированных образцов ИФР-I колонку промывают 35% буфера Б, затем восходящим линейным градиентом до концентрации 65% буфера Б для разделения изомеров. Для элюции непэгилированных ИФР-I систему изменяют, используя модифицированный буфер Б с величиной рН 8,0. Скорость тока составляет 8 мл/мин, определение проводят при 218 нм. Получаемые образцы белка собирают вручную и аликвоты хранят при -20 С для анализа разнообразия белков химическими и биологическими методами исследования (см. ниже). Используют аналитическую строго катионобменную колонку (фирма TOSOH-BIOSEP, колоннаSP-NPR, размер частиц 2,5 мкм, диаметр 4,6 мм, длина 3,5 см) для изучения чистоты разделенных позиционированных изомеров. Для этой аналитической колонки применяют те же мобильные фазы, что и для препаративной колонки, но с уменьшенной скоростью тока и боле кратким временем пробега. Концентрацию монопэгилированных изомеров ИФР-I определяют с помощью спектрофотометрии по адсорбции при 280 нм (E1mg/ml280=0,584) белковой части монопэгилированных ИФР-I. Анализ чистоты монопэгилированных ИФР-I. Отдельные изомеры монопэгилированных ИФР-I анализируют с помощью 4-12% трис-глицин додецилсульфат натрия-электрофореза в полиакриламидном геле или в условиях восстановления или при условиях не восстановления. Белки фиксируют и окрашивают красителем Simple Blue SaveStain (фирмаInvitrogen, Базель, Швейцария). Идентификация изомеров монопэгилированных ИФР-I методом масспектроскопии. Очищенные изомеры монопэгилированных ИФР-I расщепляют ферментом Asp-N для идентификации четырех возможных сайтов пэгилирования по N-концу, K27, K65 или K68. Буфер для расщепления включает 100 ммоль трис/HCl рН 8,0 с 0,04 мкг/мкл Asp-N (фирма Roche Diagnostics GmbH, Делавэр). 20 мкг монопэгилированного ИФР инкубируют в буфере для расщепления в течение 16 ч при 37 С с 1 мкг Asp-N. После 16 ч реакционную смесь разводят добавлением трихлорэтилфосфата (10 ммоль) на 1,5 ч при 37 С. Затем реакционный раствор блокируют внесением 1/20 объема 10% TFA для прекращения реакции расщепления. Полученную пептидную смесь также либо непосредственно анализируют методом ВЭЖХ-ионообменной хроматографии-масс-спектрометрии (ВЭЖХ-ИОХ-МС) в оперативном режиме, ВЭЖХ, либо хранят при -80 С. Для проведения анализа методом ионообменной хроматографии-жидкостной хроматографии-массспектрометрии (ИОХ-ЖХ-МС) пептидную смесь разделяют в системе Agilent 1100 ВЭЖХ, оснащенной колонкой Phenomenex Jupiter C18 с обратной фазой (1250 мм, 5 мкм, 300 ) со скоростью тока- 10011284 40 мкл/мин. УФ-сигнал записывают также при длине волны 220 нм. A Q-ToF II или LCT массспектрометр (фирма Micromass) непосредственно объединяют с системой ВЭЖХ. Спектры ИОХ-ToF записывают со скоростью 1 сканирование/с в диапазоне массы 200-2000 m/z. Оценивают УФ и TIC спектры и каждый пептид определяют в виде отдельного пика на хроматограмме. Для анализа методом ВЭЖХ смесь пептидов разделяют в системе Agilent 1100 ВЭЖХ, оснащенной колонкой Phenomenex Jupiter C18 с обратной фазой (1250 мм, 5 мкм, 300 ) со скоростью тока 40 мкл/мин. УФ-сигнал записывают при 220 нм. Время задержки пептидов ПЭГ сдвинуто в ответ на повышенные концентрации ацетонитрила, отбор соединений проводят вручную и подвергают N-концевому расщеплению по Эдману. Условия проведения ВЭЖХ (растворитель А: 0,1% TFA в воде, растворитель Б: 0,1% TFA в ацетонитриле) показаны в табл. 1. Таблица 1 ГрадиентN-концевое расщепление аминокислотной последовательности по Эдману проводят в системеApplied Biosystems Procise 492 с программным обеспечением точной системы контроля согласно инструкциям производителя. Фракции объемом 20 мкл, собранные с помощью ВЭЖХ, сразу переносят наBioBrene Plus стандартные микро-TFA-фильтры. Фильтры высушивают в атмосфере аргона и помещают в секвинатор белка. Применяют автоматизированную стандартную программу для проведения последовательного разрушения полипептида. Анализ хроматограмм ВЭЖХ для каждого цикла расщепления с применением Applied Biosystems и программного обеспечения 610 А показывает положение каждой аминокислоты. Цистеины, а также модифицированные аминокислоты, например пэгилированный лизин,проявляются в качестве пробелов на хроматограмме. Транскрипционный анализ олигонуклеотидной последовательности. Для анализа транскрипционального профиля различных монопэгилированных ИФР-I изомеров клетки линии NIH-3T3, стабильно трансфецированные геном ИФР-IR, в течение 2 ч выдерживают в среде без сыворотки и затем инкубируют на протяжении 24 ч без сыворотки с 0,1 или 1 мкг/мл рчИФР и 1 мкг/мл соответствующих монопэгилированных ИФР-I изомеров или смеси всех изомеров, полученной без разделения. Затем культивировавшиеся клетки собирают и суммарную клеточную РНК экстрагируют РНК-BeeTM. Из каждого образца 10 мкг РНК подвергают обратной транскрипции, наносят метку и процессируют с применением коммерческих наборов и руководствуясь инструкциями производителя (фирма Invitrogen, Базель, Швейцария, фирма Ambion, Хантингдон, Великобритания). Способы фрагментации нагревом в щелочной среде и условия гибридизации для MOE 430A GeneChip последовательностей являются стандартными методами, предоставленными производителем (фирма Affymetrix, США). Флюоресценцию последовательностей (плотность клеток) записывают с помощью конфокального лазерного сканера и полученные данные анализируют с применением программного обеспечения MAS 5,0 (фирма Affymetrix, США). Уровень экспрессии каждого гена подсчитывают в качестве стандартизированного среднего отклонения интенсивности флюоресценции при сравнении с гибридизацией с ошибочно спаренными олигонуклеотидами и выражают в качестве среднего отклонения (СО). Каждый опыт проводят в трех повторах для учета биологических вариаций. Следующие два критерия были выбраны для отбора генов с отличающейся экспрессией:i) значения уровней содержания иРНК в обработанных клетках должны быть по меньшей мере в пять раз выше или в пять раз ниже по сравнению с необработанными клетками;ii) стандартное отклонение должно быть значительно меньше абсолютного изменения среднего отличия, а подсчитанный доверительный уровень гена выше 97% (р 0,03). Исследование фосфорилирования ИФР-IR. Для этих исследований используют клетки линии NIH-3T3, трансфецированные геном человека ИФР-IR, после проведения 2-4 пассажей. Клетки культивируют в 24- или 96-луночных планшетах до 70% слияния клеток. Затем клетки в течение ночи выдерживают в среде без сыворотки и затем инкубируют с рчИФР-I или с соответствующими пиками (или смесью пиков) пэгилированных ИФР-I в течение 30 мин. Затем клетки либо лизируют в буфере Лэммли для Вестерн-блоттинга, либо фиксируют 4% параформальдегидом в течение 30 мин для внутриклеточного анализа фосфорилирования ИФР-IR. Для- 11011284 Вестерн-блоттинга экстракты белков разделяют с помощью 10% бис-трис электрофореза в натрий додецилсульфат-полиакриламидном геле и осаждают на нитроцеллюлозных мембранах. Пятна инкубируют совместно с мышиным антителом к фосфотирозину (4G10, 1:1000, фирма Upstate) и кроличьим антителом к ИФР-IR (С-20, 1:1000, фирма Santa Cruz) первичными антителами и метят мышиным антителом Alexa680 (1:10000, фирма Molecular Probes) и вторичными мышиными антителами IRDye800(1:10000, фирма Jackson). Для внутриклеточного анализа фиксированные клетки блокируют и насыщают 2% козьей сывороткой и тритоном Х-100 (0,1%) и инкубируют с теми же первичными и вторичными антителами. Полосы белка идентифицируют по флуоресценции с помощью системы Odyssey imaging system (фирма Licor Biosciences). У цифровых изображений подсчитывают интенсивность пикселей полос белка и анализируют кривые дозы-ответа с применением программного обеспечения GraphPad Prism. Уровни фосфотирозина стандартизируют значениями ИФР-IR, полученными из тех же областей интереса для получения значений реальных изменений активирования ИФР-IR. Эксперименты дублируют и повторяют трижды для получения 6 независимых исследований каждой дозы. Результаты выражают средним значением SEM. Эксперименты in vivo с рчИФР-I и пэгилированными ИФР-I изомерами. Используют модельных мышей для изучения болезни Альцгеймера, являющихся однократно трансгенными (линия ААР) или дважды трансгенными (линия PS2AAP) (Richards J.G. и др. J. Neurosci. 23,2003, с. 8989-9003), для изучения воздействия рчИФР-I (и монопэгилированного ИФР-I) на амилоидоз мозга, ранее установленного на других модельных мышах и крысах (Carro E. и др. Nat. Med. 8, 2002,с. 1390-1397). Установлено, что у модельных мышей линии PS2APP развивается амилоидоз с фиксируемыми уровнями А в возрасте 2 месяцев, а начало отложения бляшек происходит в возрасте 8 месяцев(Richards J.G. и др. J. Neurosci. 23, 2003, с. 8989-9003). Однократно трансгенные мыши линии ААР обладают весьма схожими уровнями А в таком раннем возрасте и, следовательно, были включены в испытуемые группы животных. Анализируют возраст, предшествующий возрасту формирования бляшек(2-3 месяца) для исследования воздействия рчИФР-I и пэгилированных ИФР-I изомеров на уровни растворимого А в мозге. Все эксперименты проводят в соответствии со шведскими правилами защиты животных, сводя к минимуму страдания животных. Из исходных растворов в 1 мМ HCl (рчИФР-I) или ФСБ с 10% глицерина (монопэгилированные ИФР-I изомеры) приготовляют инъекционные растворы в 0,9%NaCl с содержанием растворителя менее 1%. Контроли вводят инъекцией с 0,9% NaCl. Инъекции проводят внутрибрюшинно при слабой анестезии изофлюраном. В разное время после инъекции (2, 6, 24, 48 или 72 ч) животных, находящихся под анестезией изофлюраном, умерщвляют. Мышей обезглавливают и удаляют мозг для отделения конечного мозга (коры, включая гиппокамп). Экстракты белков коры мозга приготовляют в изотоническом литическом буфере, содержащем 4 ммоль триса, рН 7,4 и 320 ммоль сахарозы (оба реактива фирмы Fluka) с протеазным и фосфатазным ингибирующими коктейлями (оба реактива фирмы Sigma). Буфером для образца является буфер Лэммли, содержащий 8 М мочевины (фирмаFluka). Белки разделяют с помощью 4-12% бис-трис электрофореза в натрий додецилсульфатполиакриламидном геле и осаждают на нитроцеллюлозных мембранах. Пятна инкубируют совместно с мышиным антителом к амилоидному белку-предшественнику (АПБ) (клон WO-2, 1:5000, фирма The Genetics Company), обнаруживая первичные антитела к АПБ, С 99 фрагменту, А и мышиному антителу к козьему актину (С-11, 1:5000, фирма Santa Cruz) и меченые мышиным антителом Alexa680 (1:10000,фирма Molecular Probes) и вторичными козьими антителами IRDye800 (1:10000, фирма Jackson). Обнаружение по флуоресценции полос белка проводят с использованием системы визуализации Odyssey(фирма Licor Biosciences). У цифровых изображений подсчитывают интенсивность пикселей полос белка и анализируют с применением программного обеспечения GraphPad Prism. Результаты выражают средним значением SEM. Все значения стандартизируют по актину (или альбумину в качестве контрольного белка) и высчитывают соотношения С 99/АПБ, А/АПБ, С 99/А. Соотношение С 99/АПБ свидетельствует об активности- и -секретаз, поскольку С 99 является продуктом -секретазы и субстратом для -секретазы; изменения в этом измерении может свидетельствовать о модулирующем воздействии на одну из этих секретаз независимо от дальнейшей судьбы А. При постоянных уровнях С 99/АПБ после определенного лечения соотношение С 99/А отражает клиренс А независимо от его образования, причем оно выше при повышенной скорости клиренса и ниже при пониженной скорости клиренса. Кроме того, А нормализуется для АПБ, поскольку его образование зависит от трансгенной экспрессии АПБ, которая варьирует у отдельных мышей. Подсчеты соотношений вычисляют для каждого конкретного животного. Все полученные данные выражают в виде процента от данных, полученных от животных контрольной группы, присутствовавших в каждом эксперименте, которых не подвергали лечению. Отдельные эксперименты с 2-5 животными на дозу/временной интервал повторяют 2-4 раза. Статистические отличия оцениваются по среднему значению SEM непарными t тестами с р 0,05 как статистически достоверные.- 12011284 Пример 1. Хроматографическое разделение монопэгилированных ИФР-I позиционированных изомеров. ИФР-I содержит 4 аминогруппы, которые являются точками возможного пэгилирования, поэтому можно ожидать возникновение 4 монопэгилированных ИФР-I (моно-ПЭГ-ИФР-I) изомера. Другие возможные производные могут быть олигопэгилированными в зависимости от условий реакции. Применяют метод строго катионобменной жидкостной хроматографии высокого давления (ЖХВД) для разделения пэгилированных ИФР-I или пэгилированных Des(1-3)-ИФР-I изомеров, основываясь на отличиях их локальных зарядов. Профиль препаративной элюции 5 мг ПЭГ-ИФР-I показан на фиг. 1. Результат этого метода заключается в разделении на 5 больших пиков, 3 пика с основным разделением и 2 пика с частичным разделением. Снижение базисной адсорбции к концу хроматограммы означает, что больше нет дополнительных типов монопэгилированных ИФР-I, элюируемых при большем времени задержки. Дополнительный пик появляется между пиками 3 и 4, образуясь при переходе на модифицированный буфер Б с отличным рН. Аналитическую катионобменную ЖХВД применяют для установки чистоты отдельных изомеров и загрязнения другими позиционированными изомерами фракций катионобменной хроматографии. Все пики монопэгилированных соединений обладают чистотой 99%. Пример 2. Анализ методом электрофореза в натрий додецилсульфат-полиакриламидном геле изомеров монопэгилированного ИФР-I. Анализ методом электрофореза в натрий додецилсульфат-полиакриламидном геле осуществляют в условиях восстановления, а также в условиях без восстановления, для элюции различных нежелательных молекул ИФР-I, которые могли образоваться за счет перекрестных внутримолекулярных бисульфидных мостиков. Оба условия проведения реакции дают схожие результаты, показывая, что значительного количества нежелательного белка с перекрестными связями не образуется (фиг. 2). Анализ методом электрофореза в натрий додецилсульфат-полиакриламидном геле показывает, что молекулярная масса пика 0 очевидно 100 кДа, а крупные обнаруживаемые полосы являются пиками 1-3 с молекулярной массой 70 кДа, пик 4 выявляется с молекулярной массой 7 кДа - размер, ожидаемый для непэгилированного ИФР-I (фиг. 2). Из профиля пробега и времени задержки, полученных с помощью ВЭЖХ, следует, что пик 0 состоит, наиболее вероятно, из ди- и олигопэгилированных вариантов ИФР-I. И напротив, пики 1-3 соответствуют трем разным монопэгилированным изомерам ИФР-I. Наблюдается несоответствие между ожидаемой молекулярной массой монопэгилированного ИФР-I (51,6 кДа) и очевидной полученной массой 70 кДа, однако наблюдаемое завышение молекулярной массы может быть объяснено большим гидродинамическим объемом ПЭГ из-за связывания воды, значительно снижающей электрофоретическую подвижность пэгилированного ИФР-I и повышающей определяемую молекулярную массу (Foser S. и др.Pharmacogenomic J. 3, 2003, с. 319). Из результатов ионообменной хроматографии (ИОХ)-жидкостной хроматографии высокого давления и электрофореза в натрий додецилсульфат-полиакриламидном геле следует, что чистоту фракций ИОХ можно считать достаточной для дальнейшего описания. Пэгилирование и разделение монопэгилированного-Des(1-3)-ИФР-I проводят аналогично пэгилированию и разделению рчИФР-I и в результате получают схожим образом 3 основных монопэгилированных-Des(1-3)-ИФРI пика. Пример 3. Анализ монопэгилированных изомеров ИФР- I. Расщепление рчИФР-I с помощью Asp-N высвобождает 6 независимых пептидных фрагментов, которые разделяют с помощью ВЭЖХ со временем задержки 30-45 мин (фиг. 3 А, верхняя панель). После расщепления очищенных пиков 1-3 (фиг. 3A, нижние панели) наблюдают различные распределения 6 фрагментов и присутствие дополнительного фрагмента (фрагмента 7), которые элюируют со временем задержки 70 мин. У пика 1 количество специфического пептидного фрагмента 4 уменьшается с одновременным увеличением содержания фрагмента 7. У пика 2 наблюдают четкое снижение содержания фрагмента 3 и небольшое понижение фрагмента 5, а также появление крупного и минорного пэгилированных фрагментов (7 и 7'). Сходным образом анализ ВЭЖХ пика 3 показывает четкое понижение фрагментов 3 и 5 и одновременное появление фрагментов 7 и 7'. Фиг. 3 Б показывает пептидные последовательности соответствующих фрагментов, которые получают расщеплением рчИФР-I с помощью Asp-N. Используя N-концевое расщепление пептидов по Эдману, анализируют пептидные последовательности крупных фрагментов 7, полученных от пэгилированных пиков 1, 2 и 3. Таким образом, цистеины и пэгилированные аминокислоты поставляют разрывы в пептидной последовательности. Используя такой методический прием, можно четко подтвердить, что пик 1 является рчИФР-I, пэгилированным по аминокислоте K27 (фиг. 3 В). Для пика 2 показано, что крупный фрагмент 7 (90%) является пэгилированным по аминокислоте K65, поскольку установлено разрушением по Эдману, что K68 представляет собой немодифицированный лизин (K). Напротив, фракция пика 3 поставляет пэгилированный по K68 вариант(интервал в последовательности) с аминокислотой K65, проявляющейся в качестве сигнала при хроматографировании ВЭЖХ после разрушения по Эдману (фиг. 3 В). Минорный пик 7' не может быть секвенирован по Эдману, следовательно, N-конец недоступен для реакции, наиболее вероятно для пэгилирования. Общий анализ полученных данных показывает, что пик 1 состоит из K27 пэгилированного изомера,пик 2 является ИФР-I, пэгилированным по аминокислоте K65, а пик 3 пэгилирован по аминокислоте K68 и значительное количество ИФР-I пэгилировано с N-конца.- 13011284 Пример 4. Профиль транскрипции рчИФР-I и изомеров монопэгилированных ИФР-I. Используя микропоследовательности ДНК, определяют ответную транскрипцию клеток линииNIH-3T3, стабильно трансфецированных ИФР-IR человека, на протяжении 24 ч лечения рчИФР-I или пэгилированными ИФР-I изомерами. Для этого стимулируют клетки с помощью 0,1 и 1 мкг/мл ИФР-I,или 1 мкг/мл пиков монопэгилированных ИФР-I, или смеси пиков, полученных в результате реакции пэгилирования. Сравнивают общую транскрипционную активность стимулированных клеток с контрольными культурами, используя коммерческий фрагментный тип (продукт МОЕ 430 А, фирмаAffymetrix Inc.), включающий примерно 14000 генов мыши, в том числе все известные гены ответа на ИФР-I. Нагрузку иРНК выражают в виде средней разницы (СР) между совершенной парой олигонуклеотидных зондов и соответствующего зонда, несущего ошибочное спаривание оснований в центральном положении. Учитывают только гены с фактором изменения выше пяти и 97% воспроизводимостью(р 0,03) в рамках трех биологических репликаций. Такой анализ выявил в общей сложности 162 гена, из которых у 86 регуляция усиливается, а у 76 регуляция ослабляется под воздействием всех вариантов ИФР-I. Общий профиль относительной транскрипциональной активности разных монопэгилированных ИФР-I изомеров показан в виде иерархической группы генов с усиленной или ослабленной регуляцией на фиг. 4. Анализ уровней индукции отдельных генов, вызванной 0,1 мкг/мл и 1,0 мкг/мл ИФР-I, показывает, что выбранные кластеры весьма схожи. Пик 3 формирует профиль экспрессии, схожий с профилем экспрессии непэгилированного ИФР-I, причем в той же концентрации, и проявляет большую активность по сравнению со смесью пэгилированных ИФР и другими пиками. Интересно отметить, что пик 2 индуцирует схожий ответ транскрипции, что и смесь пэгилированных ИФР. Помимо биологической активности пик 1 показывает самый слабый ответ транскрипции, демонстрируя, что пэгилирование препятствует рецепторному взаимодействию. Примеры 5 и 6. Фосфорилирование ИФР-IR in vitro с помощью рчИФР-I и монопэгилированного ИФР-I. Для анализа in vitro активности ИФР-IR используют клетки NIH-3T3, стабильно экспрессирующие ИФР-IR человека. После пребывания в течение ночи в условиях голодания (в среде без сыворотки), клетки обрабатывают повышенными дозами рчИФР-I или соответствующим пэгилированным ИФР-I изомером (0,003-10 мкг/мл). Вестерн-блоттинг фосфорилированного ИФР-IR проводят согласно описанному выше, и полученные кривые дозы-ответа совпадают с кинетическими кривыми связывания по одной точке, включая коэффициент Хилла (nH); количественные данные ассоциированных кривых показаны в таблице фиг. 6. Дозовый ответ рчИФР-I (фиг. 5 А) имеет значение ЕС 50 6,3 нмоль и наблюдается почти по принципу все или ничего при nH 2,27 (фиг. 6). Напротив, пик 1 монопэгилированного ИФР-I не показывает четкого дозового ответа в отсутствие насыщения, nH 0,34 и определенная величина ЕС 50 составляет 91,5 нмоль (фиг. 5 Б, 6). Пики 2 и 3 (фиг. 5 В и 5 Г) показывают схожее связывающее сродство при значениях ЕС 50 13,4 и 21,5 нмоль соответственно (фиг. 6). В обоих случаях nH является упорядоченным при 1,27 и 1,19, соответственно. Пик смеси показывает схожий с ИФР-IR тип активации с немного сниженным сродством при ЕС 50 28,8 нмоль и упорядоченной величиной nH 1,28 (фиг. 5 Д, 7). В итоге, пэгилированный Des(1-3)-ИФР-I пик 3 обладает самым высоким сродством из всех ПЭГ-изомеров с ЕС 50 10,8 нмоль и упорядоченной величиной nH 1,08 (фиг. 5 Е, 7). Эти данные доказывают, что все пики, кроме пика 1, специфически активируют ИФР-IR человека с 2-5-кратной потерей сродства по сравнению с рчИФР-I. Пример 7. Понижение in vivo содержания А у двухмесячных мышей линии PS2APP за счет применения рчИФП-I. Используют дважды трансгенных мышей линии PS2APP для анализа краткосрочных воздействий рчИФР-I на нагрузку мозга А. Этих мышей лечат внутрибрюшинным введением 50 мкг/кг рчИФР-I и анализируют содержание А в коре головного мозга через 2 ч после инъекции. Фиг. 7 показывает результаты Вестерн-блоттинга экстрактов мозга двухмесячных мышей, согласно которым уровни АПБ,С 99 и контрольного белка (альбумина) остаются неизменными после применения рчИФР-I, а уровни А снижаются через 2 ч после инъекции рчИФР-I. Проводят количественный анализ и подсчитывают соотношения соответствующих интенсивностей пикселей для получения информации о силе воздействия рчИФР-I на образование А. Этот анализ показывает, что соотношения АПБ/контрольный белок(97,55,7% контроля) и С 99/АПБ (87,29,8% контроля) не изменяются, доказывая, что ни экспрессия АПБ, ни процессинг АПБ, не изменяются через 2 ч после лечения рчИФР-I (фиг. 7 Б). Напротив, соотношение А/АПБ значительно снижается до 68,47,1% от контроля (р 0,01), а соотношение С 99/А - до 157,916,6% от контроля (р 0,01), показывая, что рчИФР-I понижает содержание А. Рассмотрение всех полученных данных позволяет сделать вывод, что лечение молодых мышей линии PS2APP рчИФР-I приводит к значительному повышению клиренса А из мозга. Пример 8. Динамика понижения содержания А in vivo у мышей линии PS2APP за счет применения рчИФР-I. Для оценки динамики краткосрочного воздействия рчИФР-I на растворимые А в мозге молодых мышей линии PS2APP, не имеющих бляшек в мозге (двухмесячного возраста), животных лечат внутри- 14011284 брюшинным введением 50 мкг/кг рчИФР-I и определяют в коре головного мозга уровни АПБ, С 99, А и актина через 2, 6 или 24 ч. Соотношения АПБ/альбумин и С 99/АПБ существенно не изменяются под воздействием рчИФР-I на протяжении исследования. Понижение соотношений А/АПБ за счет применения рчИФР-I наблюдают через 2 ч после инъекции, но эффект отсутствует через 6 и 24 ч (фиг. 8 А). Аналогичным образом усиление падения концентрации А, мониторинг которых проводят по соотношению С 99/А, определяется только через 2 ч и исчезает через 6 и 24 ч (фиг. 8 Б). Отсюда следует, что эффект рчИФР-I на клиренс A происходит на протяжении короткого периода, возможно из-за короткого полупериода распада выделенного из крови ИФР-I. Пример 9. Сравнительный анализ воздействия пиков 1-3 на интенсивность клиренса А in vivo у двухмесячных мышей линий АРР и PS2APP. В данном примере показаны вместе результаты по пикам 1-3 пэгилированных ИФР-I для прямого сопоставления способностей снижения содержания А и клиренса А. Подобно рчИФР-I, соотношения АПБ/актин (актин в данном случае является контрольным белком) или С 99/АПБ не изменяются под воздействием каких-либо концентраций пиков 1, 2 или 3. Пик 3 имеет самую высокую активность по снижению А/АПБ через 6 ч после внутрибрюшинной инъекции (фиг. 9 А). Напротив, пик 1 не проявляет активность во всем диапазоне исследованных концентраций, а пик 2 проявляет достоверный эффект по снижению А/АПБ только при самой высокой из применявшихся концентраций (500 мкг/кг). Из фиг. 9 Б следует, что подобным же образом пик 3 является единственным соединением, действующим в низких дозах (15-50 мкг/кг) и повышающим соотношение С 99/А, что характерно для повышенного клиренса А. Также следует, что пик 1 неактивен, а пик 2 проявляет значимые активности при концентрации 500 мкг/кг. При совместном рассмотрении этих результатов следует, что пик 3 является наиболее активным монопэгилированным ИФР-I изомером в таком эксперименте in vivo. Фиг. 11 показывает результаты, полученные только на модели дважды трансгенных мышей линии PS2APP. Пример 10. Динамика понижения содержания A in vivo у мышей линии PS2APP за счет применения пика 3. Через 6 ч после внутрибрюшинной инъекции пик 3 в дозе 50 мкг/кг проявляет значительный эффект, проявляющийся в виде снижения уровней A в мозге. Для того чтобы определить, насколько долго сохраняется этот эффект, изучают экстракты мозга мышей линии PS2APP, которых лечили пиком 3 в количестве 50 мкг/кг, через 2, 6, 24, 48 и 72 ч. На протяжении всего периода не наблюдают значительных изменений соотношений АПБ/актин или С 99/АПБ. Напротив, уровни А/АПБ были значительно снижены через 6, 24 и 48 ч после внутрибрюшинной инъекции (р 0,05, р 0,001 и р 0,01 соответственно), что свидетельствует о воздействии пика 3 на снижение А на протяжении по меньшей мере 48 ч (фиг. 10 А). Соотношения С 99/А, представляющие клиренс А независимо от выработки А (поскольку соотношение С 99/АПБ остается неизменным), значительно возросли при весьма схожей динамике и хорошо поддерживаются на протяжении по меньшей мере 24 ч после инъекции (фиг. 10 Б). Рассмотренные вместе эти данные показывают, что пик 3 способен понизить содержание А в мозге мышей линии PS2APP. Фиг. 12 показывает результаты, полученные только на модели дважды трансгенных мышей линии PS2APP. Пример 11. Связывание ИФР-связывающих белков ИФРСБ 4 (СБ 4) и ИФРСБ 5 (СБ 5). Соединение ИФРСБ 4 (SwissProt 22692) идентифицируют и клонируют (Shimasaki S. в Mol. Endocrinol. 4, 1990, с. 1451-1458). Соединение ИФРСБ 5 (SwissProt 24593) идентифицируют и клонируют(Kiefer M.C. в Biochem. Biophys. Res. Commun. 176, 1991, с. 219-225). Оба связывающих белка получают рекомбинацией в E.coli. Для анализа взаимодействия белков методом поверхностного плазменного резонанса (ППР) используют инструмент Biacore 3000. Для пробега и проведения реакции используют буфер HBS-P(10 ммоль HEPES, 150 ммоль NaCl, 0,005% полимерного поверхностно-активного вещества, рН 7,4) при 25 С. Все образцы предварительно охлаждают при 12 С. ИФРСБ 4 и ИФРСБ 5 спаривают с амином в концентрациях 5 мкг/мл. Сопряжение с фрагментом СМ 5 приводит к загрузке сигнала размером 700 RUs. Образцы пэгилированных ИФР-I (анализируемые соединения) вводят инъекцией в пяти концентрациях, находящихся в диапазоне от 1,23 до 100 нмоль в течение 5 мин (фаза ассоциации) и промывают HBS-P в течение 5 мин при скорости тока 50 мкл/мин. Поверхность фрагмента регенерируют одной инъекцией 100 ммоль HCl в течение 1 мин. Фрагмент, формат исследования и последовательность инъекций соответствуют описанию в табл. 2. Оценку результатов проводят с применением ленгмюровской модели связывания 1:1. 40 кДа: разветвленный ПЭГ с молекулярной массой 40 кДа. 40 кДа/NT-RRRK: RRRK, пэгилированный с N-конца ПЭГ с молекулярной массой 40 кДа. 40 кДа/RRRK: RRRK, пэгилированный по лизину в положении K68 ПЭГ с молекулярной массой 40 кДа. Состав: состав из 40 кДа/N-концевого RRRK и 40 кДа/RRRK (1:1). Эти результаты подтверждают, что все пэгилированные образцы ИФР активно связываются с ИФРВР 4 и ИФРВР 5 в сходном диапазоне. Все пэгилированные образцы показывают существенно уменьшенную константу скорости связывания по сравнению с непэгилированным ИФР. Данные отрицательного контроля (например, кривые буферов) вычитают от данных кривых образцов для коррекции сдвига системной естественной линии отсчета и для уменьшения шума сигнала. Пример 12. Аутофосфорилирование ИФР-I лигандами. Для определения способности полипептидов настоящего изобретения активировать ИФР-IR и индуцировать фосфорилирование ИФР-IR, клетки с повышенной экспрессией ИФР-IR стимулируют полипептидами согласно настоящему изобретению и последовательно определяют статус фосфорилирования ИФР-IR методом ELISA. Для осуществления метода ELISA в 96-луночные полистроловые планшеты с покрытием из стрептавидина (фирма Nunc) наносят по 100 мкл моноклонального антитела против ИФР-IRa человека(0,5 мг/мл), разведенного 1:350 в буфере PBST с 3% БСА. После инкубирования в течение 1 ч при комнатной температуре на качалке для планшеток покровный раствор удаляют и планшетки промывают трижды PBST в количестве 200 мкл на лунку. Клетки линии NIH-3T3, трансфецированные ИФР-IR, помещают в среду MEM Dulbecco (продуктDMEM) с высоким содержанием глюкозы (фирма РАА, номер в каталоге Е 15-009) с добавлением 2 ммоль L-глутамина (фирма Gibco, номер в каталоге 25030-024) и 0,5% активированной нагреванием ФСТ (фирма РАА, номер в каталоге А 15-771). Для определения значений ЕС 50 инкубируют 96-луночные планшеты, инокулированные клетками в количестве 1,3-104 клеток/лунку, в течение 2 суток при 37 С в атмосфере 5% CO2. Через 48 ч культивирования в среде с низким содержанием сыворотки среду аккуратно удаляют и замещают разными концентрациями полипептидов настоящего изобретения, разведенными в 50 мкл соответствующей среды. Через 10 мин инкубации при 37 С в атмосфере 5% CO2 среду аккуратно удаляют отсасыванием и добавляют по 120 мкл холодного литического буфера в лунку (50 ммоль трис рН 7,5,1 ммоль ЭДТА (этилендиамин-тетрауксусной кислоты), 1 ммоль ЭГТА (этиленгликолевой тетраацетиловой кислоты), 20% глицерина, 1% тритон-X100, 100 ммоль NaF, 1 ммоль NaVO4, ингибитор протеазы(продукт Complete). Планшеты инкубируют с литическим буфером в течение 15 мин при 4 С на качалке для планшеток и затем по 100 мкл содержимого лунок переносят в планшетки для метода ELISA с покрытием моноклональными антителами против ИФР-IR человека. Лизаты инкубируют в течение 1 ч при комнатной температуре на качалке для планшеток, для того чтобы ИФР-IR соединился с иммобилизованным антителом, и затем тщательно отсасывают. Несвязанный материал удаляют путем трехкратного промывания 200 мкл PBST/лунку. Для определения связанного фосфорилированного ИФР-IR, по 100 мкл поликлонального IgG кроличьего антитела против ИФР-IRa человека, разведенного 1:12650 в 3% БСА/PBST, добавляют в каждую лунку и инкубируют в течение 1 ч при комнатной температуре на качалке для планшеток. Затем содержание лунок опять аккуратно удаляют и лунки трижды промывают 200 мкл PBST/лунку. Для определения поликлонального кроличьего антитела по 100 мкл поликлонального антитела против кроличьего IgG, соединенного с HRP (фирма Cell Signaling Technology Inc. США), разведенного 1:6000 в 3% БСА/PBST, добавляют в каждую лунку. После инкубации в течение 1 ч при комнатной температуре на качалке несвязанное выявляемое антитело удаляют путем шестикратного промывания планшеток 200 мкл PBST/лунку. В качестве субстрата для антителосвязанного HRP, в каждую лунку добавляют по 100 мкл из 3,3'-5,5'-тетраметилбензидина и еще раз инкубируют в течение 0,5 ч при комнатной температуре на качалке.- 16011284 Количественную оценку проводят после остановки реакции внесением 1 М H2SO4 по 25 мкл/лунку путем измерения абсорбции при длине волны 450 нм. Полученные значения OD450 образцов переводят в процент активирования, используя 10 нмоль ИФР-I в качестве 100% контроля (контроль max), и контроль, не содержащий ИФР-I, в качестве 0% (контроль min), используя формулу: процент активации = (образец-min)/(max-min). Получаемые значения ЕС 50 (концентрации полипептида при активности, равной половине максимальной активации IGF-1R),представлены в табл. 3. Таблица 3 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Конъюгат, включающий вариант инсулиноподобного фактора роста I (ИФР-I) и полиэтиленгликоль (ПЭГ), отличающийся тем, что указанный вариант ИФР-I содержит замены (замену) аминокислот в положениях 27, 37, 65, 68 в последовательности исходного ИФР-I таким образом, что одна или несколько аминокислот в положениях 37, 65, 68 являются лизином (K), а аминокислота в положении 27 является полярной аминокислотой, но не лизином, причем указанный ПЭГ конъюгирован с указанным вариантом ИФР-I по первичной аминогруппе (аминогруппам). 2. Конъюгат по п.1, отличающийся тем, что указанный ПЭГ имеет молекулярную массу в среднем равную 20-100 кДа. 3. Конъюгат по п.1 или 2, отличающийся тем, что указанный вариант ИФР-I дополнительно пэгилирован по N-концевой аминокислоте. 4. Конъюгат по п.1 или 3, отличающийся монопэгилированием по аминокислотам K65, K68 илиK37 или двойным пэгилированием по K65 и K68. 5. Конъюгат по пп.1-4, отличающийся тем, что указанный вариант ИФР-I является R27, R37, K65,K68 (RRKK), R27, R37, R65, K68 (RRRK), R27, R37, K65, R68 (RRKR), R27, K37, R65, R68 (RKRR). 6. Конъюгат по пп.1-5 или вариант ИФР-I по п.5, отличающийся тем, что у варианта ИФР-I до трех аминокислот с N-конца процессировано. 7. Конъюгат по пп.1-6, отличающийся тем, что группа(ы) полиэтиленгликоля является разветвленной группой(ами) полиэтиленгликоля.- 19011284 8. Конъюгат по пп.1-7, отличающийся тем, что средняя молекулярная масса группы (групп) полиэтиленгликоля равна 20-100 кДа. 9. Вариант ИФР-I, отличающийся наличием замены (замен) аминокислоты в положениях 27, 37, 65,68 в последовательности исходного ИФР-I, из которых одна или несколько аминокислот в положениях 37, 65, 68 являются лизином (K), а аминокислота в положении 27 является полярной аминокислотой, но не лизином. 10. Применение варианта ИФР-I по п.9 в качестве промежуточного соединения для получения пэгилированного варианта ИФР-I. 11. Способ получения конъюгата, включающего вариант ИФР-I и одну или две полиэтиленгликолевые группы со средней молекулярной массой примерно от 20 до примерно 100 кДа, который предусматривает взаимодействие промежуточного соединения ИФР по п.9 с активированным полиэтиленгликолем в условиях, когда указанный полиэтиленгликоль химически связан с указанным промежуточным соединением ИФР-I по первичным аминогруппам лизина варианта ИФР-I. 12. Способ по п.11, отличающийся тем, что указанный полиэтиленгликоль дополнительно химически связан с указанным промежуточным соединением ИФР-I по N-концевой аминогруппе варианта ИФР-I. 13. Фармацевтическая композиция, включающая конъюгат по пп.1-8 и фармацевтически приемлемый носитель. 14. Применение конъюгата по пп.1-8 для получения лекарственного средства для лечения болезни Альцгеймера. 15. Способ лечения болезни Альцгеймера, предусматривающий введение в организм пациента, нуждающегося в этом, терапевтически эффективного количества конъюгата по пп.1-8. 16. Композиция лизин-пэгилированного варианта ИФР-I, содержащего замену (замены) аминокислот в положениях 27, 37, 65, 68 в аминокислотной последовательности исходного ИФР-I, из которых одна или несколько аминокислот в положениях 37, 65, 68 являются лизином (K), аминокислота в положении 27 является полярной аминокислотой, но не лизином, причем указанный ПЭГ конъюгирован с указанным вариантом ИФР-I по первичной аминогруппе (аминогруппам), а вариант ИФР-I пэгилирован поN-концу. 17. Фармацевтическая композиция, включающая лизин-пэгилированный вариант ИФР-I, содержащий замену (замены) аминокислот в положениях 27, 37, 65, 68 в аминокислотной последовательности исходного ИФР-I, из которых одна или несколько аминокислот в положениях 37, 65, 68 являются лизином (K), аминокислота в положении 27 является полярной аминокислотой, но не лизином, причем указанный ПЭГ конъюгирован с указанным вариантом ИФР-I по первичной аминогруппе (аминогруппам), а вариант ИФР-I пэгилирован по N-концу, и фармацевтически приемлемый носитель. 18. Применение композиции лизин-пэгилированного варианта ИФР-I, содержащего замену (замены) аминокислот в положениях 27, 37, 65, 68 в аминокислотной последовательности исходного ИФР-I, из которых одна или несколько аминокислот в положениях 37, 65, 68 являются лизином (K), аминокислота в положении 27 является полярной аминокислотой, но не лизином, указанный ПЭГ конъюгирован с указанным вариантом ИФР-I по первичной аминогруппе (аминогруппам), а вариант ИФР-I пэгилирован поN-концу, для получения лекарственного средства для лечения болезни Альцгеймера. 19. Способ лечения болезни Альцгеймера, предусматривающий введение в организм пациента, нуждающегося в этом, терапевтически эффективного количества композиции по п.16 или 17.
МПК / Метки
МПК: A61K 47/48
Метки: полиэтиленгликоля, фактора, роста, ифр-i, конъюгаты, инсулиноподобного
Код ссылки
<a href="https://eas.patents.su/27-11284-konyugaty-insulinopodobnogo-faktora-rosta-i-ifr-i-i-polietilenglikolya.html" rel="bookmark" title="База патентов Евразийского Союза">Конъюгаты инсулиноподобного фактора роста i ( ифр-i) и полиэтиленгликоля</a>
Предыдущий патент: Гидрохлорид дигидрат (s)-(-)-1-(4-фторизохинолин-5-ил)сульфонил-2-метил-1.4-гомопиперазина
Следующий патент: Производные 4- деметилпенкломедина, их применение и их получение
Случайный патент: Способ удаления гемиоксида азота из газового потока