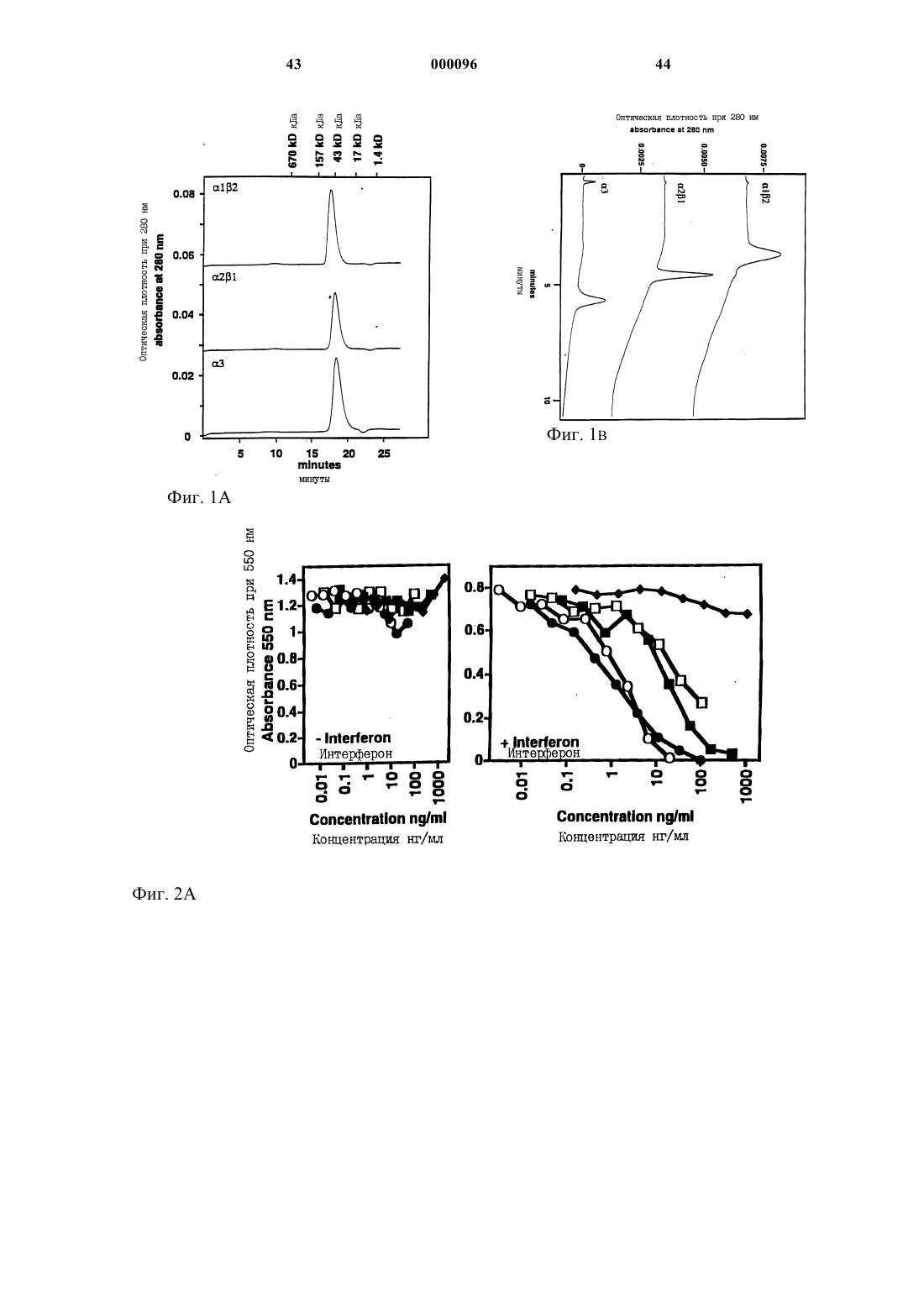
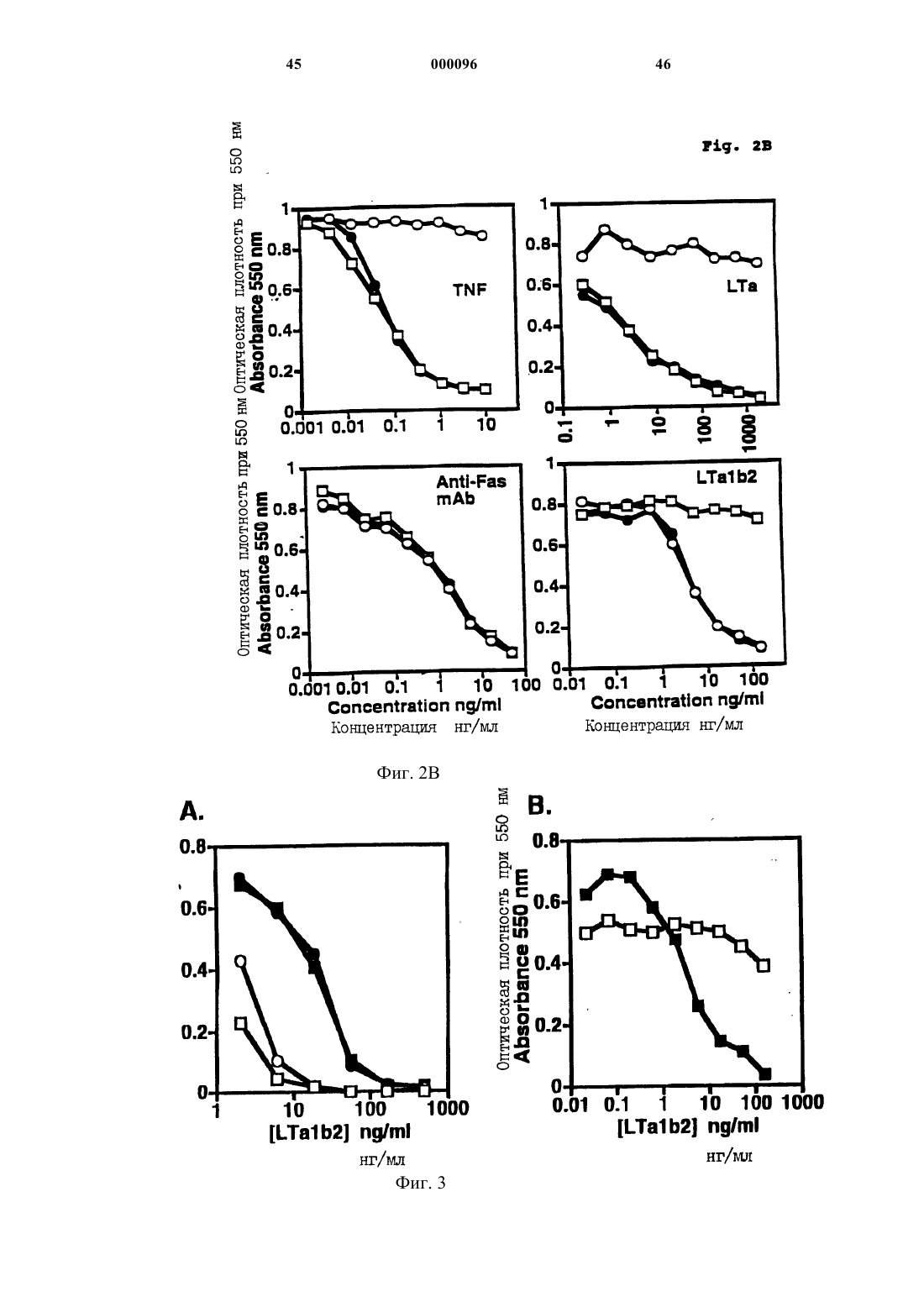
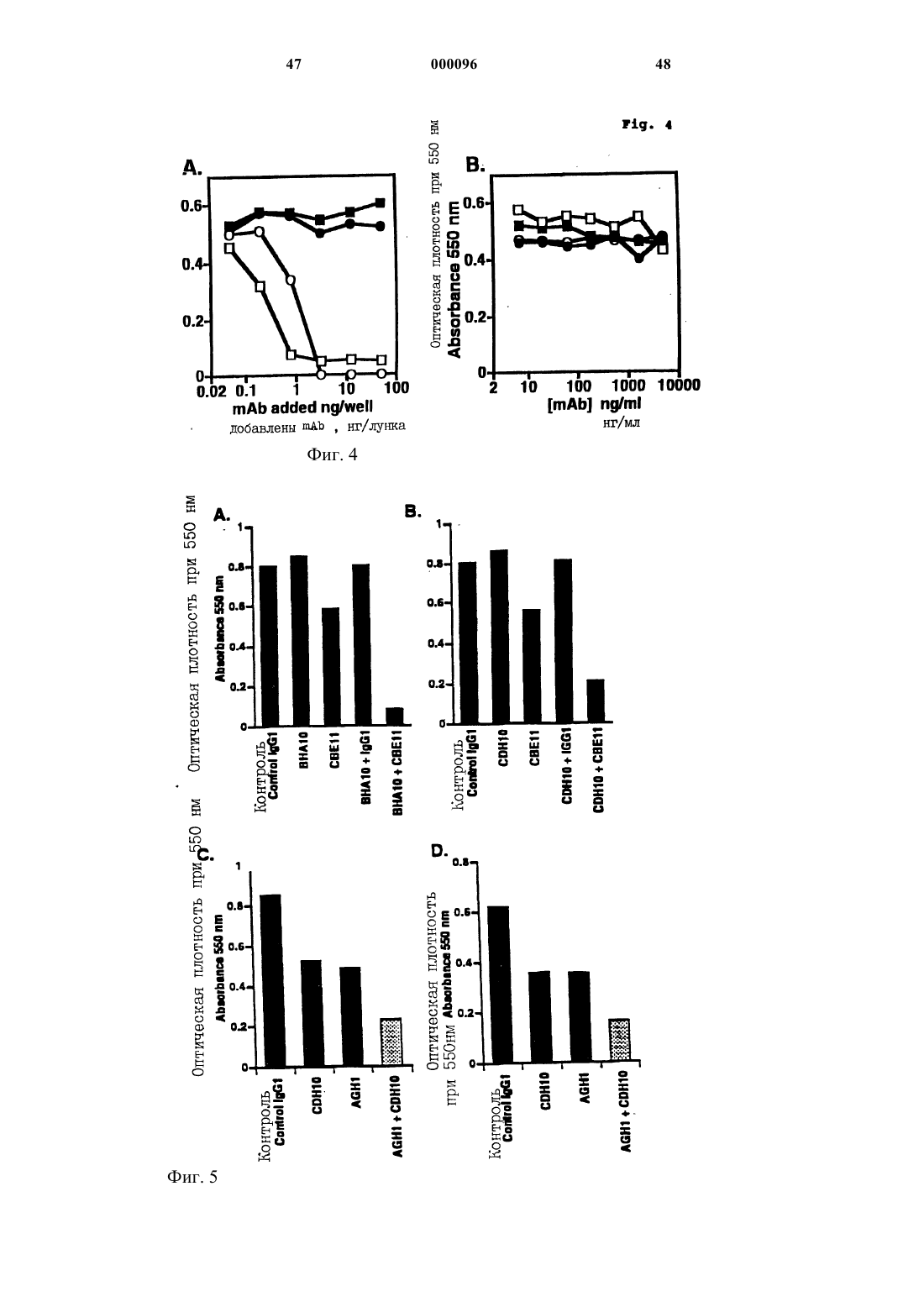
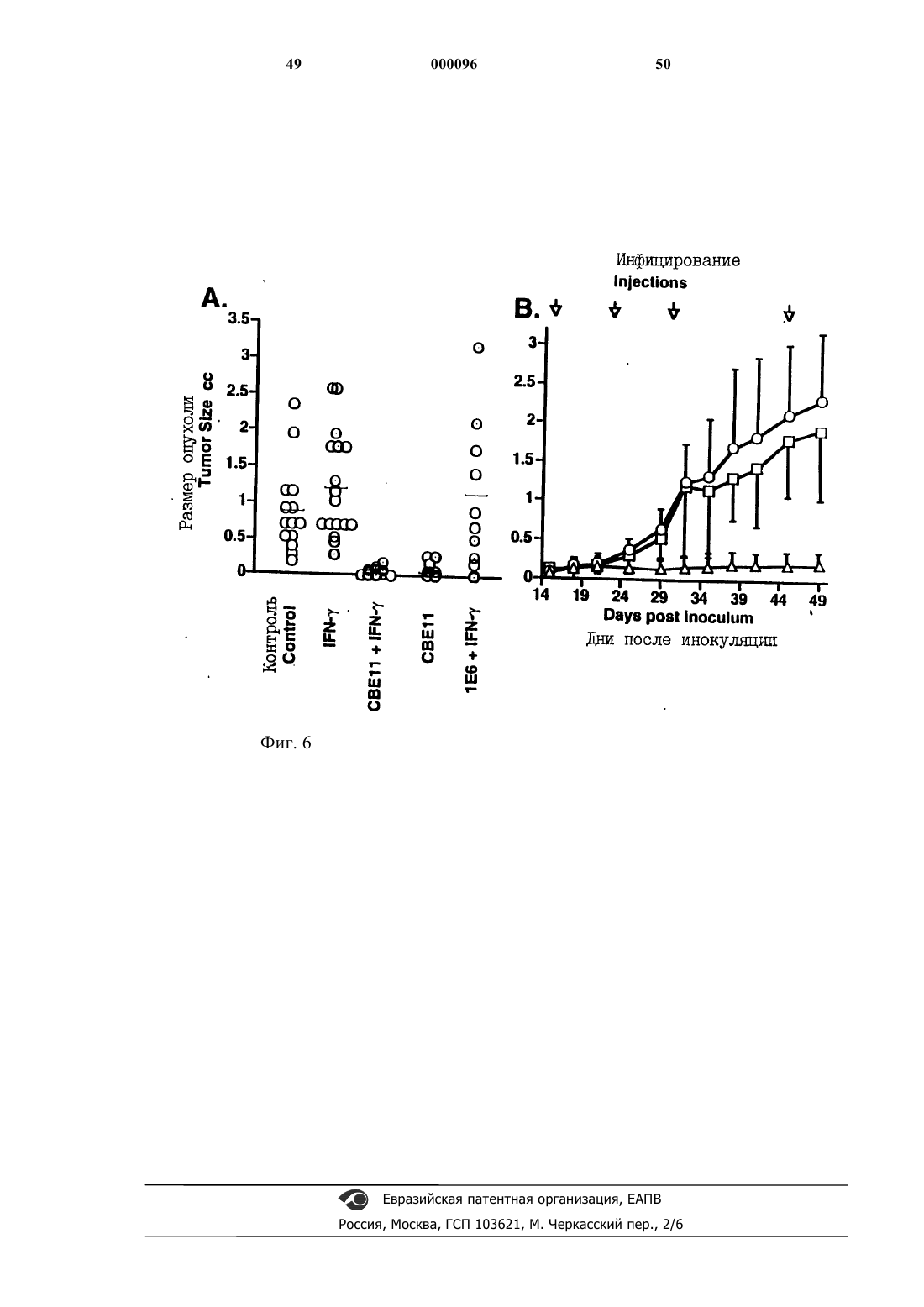
Комплексы лимфотоксина альфа/бета и антител против рецептора лимфотоксина-бета в качестве противоопухолевых агентов
Номер патента: 96
Опубликовано: 27.08.1998
Авторы: Бенджамин Кристофер, Броунинг Джеффри Л., Мейер Вернер
Формула / Реферат
1. Способ лечения или уменьшения прогрессирования, тяжести или эффектов неоплазии, включающий введение терапевтически эффективного количества гетеромерного комплекса лимфотоксина a/b в присутствии терапевтически эффективного количества антитела к рецептору лимфотоксина b и/или g-интерферона.
2. Способ лечения или уменьшения прогрессирования, тяжести или эффектов неоплазии, включающий введение терапевтически эффективного количества антитела к рецептору лимфотоксина b и фармацевтически приемлемого носителя.
3. Способ лечения или уменьшения прогрессирования, тяжести или эффектов неоплазии, включающий стадию введения терапевтически эффективного количества перекрестно-сшитых антител к рецептору лимфотоксина b в присутствии g-интерферона и фармацевтически приемлемого носителя.
4. Фармацевтическая композиция, содержащая терапевтически эффективное количество антитела к рецептору лимфотоксина b.
5. Фармацевтическая композиция, содержащая терапевтически эффективное количество антитела к рецептору лимфотоксина b в отсутствие гетеромерного комплекса лимфотоксина a/b и фармацевтически приемлемый н
Текст
Настоящее изобретение относится к композициям и способам, используемым для активации передачи сигнала рецептором лимфотоксина-, который, в свою очередь, обладает сильным антипролиферативным действием на опухолевые клетки. Более конкретно, настоящее изобретение относится к лимфотоксиновым гетеромерным комплексам, образованным между лимфотоксином- и множественными субъединицами лимфотоксина- и индуцирующим цитотоксическое действие на опухолевые клетки в присутствии агентов, активирующих рецептор лимфотоксина-. Объем настоящего изобретения также включает антитела, направленные против рецептора лимфотоксина-, которые действуют как агенты, активирующие рецептор лимфотоксина-, и которые могут быть использованы как отдельно, так и в сочетании с другими агентами, активирующими рецептор лимфотоксина-, в присутствии или в отсутствие комплексов лимфотоксина-/. Кроме того, рассматривается метод скрининга для отбора указанных антител. Настоящее изобретение также относится к композициям и способам, в которых для потенцирования цитотоксичности по отношению к опухолевым клеткам используются перекрестносшитые антитела против рецептора лимфотоксина- в присутствии других агентов,активирующих рецептор лимфотоксина-. Семейство рецепторов для фактора некроза опухоли (TNF) включает несколько членов,способных передавать сигналы, которые могут индуцировать гибель опухолевых клеток путем некроза или апоптоза ("запрограммированной" гибели клеток). Лиганды TNF и лимфотоксин(LT-, ранее называемый TNF - ) связываются с TNF-рецепторами (р 60 и р 80; обозначаемыми в настоящем описании "TNF-R") и активируют их. Передача сигнала TNF-рецепторами инициирует общую иммунную реакцию на инфекцию или стресс в нормальных клетках, однако такая передача сигнала является цитотоксической по отношению к клеткам с трансформированным фенотипом или по отношению к опухолевым клеткам. Передача сигнала TNFрецептором может приводить к селективному лизису вирусинфицированных клеток. Цитотоксические эффекты TNF-R-опосредованной передачи сигнала опухолевым клеткам усиливаются интерфероном- (IFN-) и рядом известных химиотерапевтических агентов. Указанную антипролиферативную или цитотоксическую активность, индуцированнуюTNF-R-опосредованной передачей сигнала в опухолевые клетки, было бы желательно использовать в терапевтических целях. Однако активация TNF-рецептора оказывает плейотропное действие на ряд иммунорегуляторных реакций, включая инициацию каскада предвоспалительных реакций. Поэтому направить цитотоксические эффекты TNF-R-опосредованных 2 сигналов на опухолевые клетки, не вызывая при этом костимуляции воспалительных реакций,приводящих к общей токсичности организма человека, не представляется возможным. Аналогичным образом, стимуляция другого родственного TNF-рецептора, именуемогоFas-рецептором (FasR), индуцирует цитотоксичность, приводящую к "запрограммированной" гибели клеток как опухолевого, так и неопухолевого типа. Однако было показано, что активация Fas-рецептора приводит к быстрому некрозу печени, что исключает возможность его применения для терапии человека. Недавно был идентифицирован другой рецептор, принадлежащий к семейству TNFрецепторов и названный LTрецептором (LТ-R) (Crowe et al., Science, 264, pp. 707-10(1994. Этот рецептор связывается с гетеромерными лимфотоксиновыми комплексами (LT/), которые состоят из субъединиц LТ-, ассоциированных с другим TNF-родственным полипептидом, называемым лимфотоксином(LT-). Эти LT-/-комплексы являются мембрано-ассоциированными, и большинство из них имеет LT-1/, 2-стехиометрию (Browninget al., Cell, 72, pp. 847-856 (1993); Browning et al.,J. Immunol., 154, pp.33-46 (1995. По аналогии с TNF-рецептором и другими ему подобными рецепторами можно предположить, что активация передачи сигнала LT-рецептором происходит в том случае, когда множественные рецепторы, присутствующие на клеточной поверхности, находятся в непосредственной близости друг от друга (Crowe et al.,Science, 264, pp. 707-710 (1994. Этот процесс называется образованием рецепторных кластеров. Лиганды ТNF и LT представляют собой мультивалентные комплексы, которые могут одновременно связываться с несколькими рецепторами, способствуя, тем самым, их агрегации. Образование рецепторных кластеров как средство активации рецепторов в других системах было хорошо проиллюстрировано, например, для рецепторов с тирозинкиназной активностью (Ullrich Schlessinger, Cell, 61, pp. 203-212(1993. В соответствии с этим, введение лигандов LT-1/2 и/или LTR-активирующих агентов, способных индуцировать образование рецепторных кластеров с последующей передачей сигнала от молекул LTR к поверхности опухолевых клеток-мишеней, можно было бы использовать для непосредственной стимуляции в этих клетках каскада реакций, опосредуемыхLTR. Как и в случае ТNF-рецептора, передача сигнала рецептором LT- может активировать каскад реакций, который, в конечном счете,приведет к цитотоксическому воздействию на опухолевые клетки и к их гибели. При этом важно отметить, что лиганды LT-1/2 не свя 3 зываются с TNF-R с какой-либо заметной аффинностью. Исходя из этого можно ожидать,что направленная активация LTR в опухолевых клетках будет стимулировать цитотоксическое воздействие на эти клетки без индуцирования каскада воспалительных реакций, ассоциируемых с активацией рецептора TNF. Таким образом, обработка агентами, активирующимиLT-1/2, или агентами, активирующими другие LTR , может быть использована для лечения опухолевых заболеваний или для уменьшения возможного усиления, обострения или возникновения онкогенных патологических процессов (неоплазии), не вызывая, при этом,сильных побочных эффектов, продуцируемых в случае активации TNF-R или FasR. Настоящее изобретение позволяет решить вышеуказанные проблемы благодаря разработке фармацевтических композиций и методов лечения опухолевых заболеваний путем индуцирования передачи сигнала LTрецептором без костимуляции TNF-R-ассоциируемых воспалительных реакций. В одном из своих вариантов,настоящее изобретение относится к лимфотоксиновым комплексам, образованным между LT и множеством субъединиц LT- (гетеромерным LT-/-комплексам), и индуцирующим цитотоксическое действие на клетки,несущие LTR, в присутствии LTRактивирующего агента. В этом варианте предпочтительные композиции и способы предусматривают использование LT-1/2-комплексов в присутствии LTR-активирующего агента. Более предпочтительно, если LT-1/2 комплексы присутствуют в растворимой, а не в мембрано-связанной форме, а также предпочтительно, чтобы LTR-активирующим агентом был IFN- (интерферон-). В другом варианте настоящего изобретения в качестве второго LTR-активирующего агента, присутствующего в сочетании с гетеромерным LT-/-комплексом, используется, по крайней мере, одно антитело, направленное против LTR (анти-LTR Ab). Предпочтительные композиции и способы этого варианта отличаются тем, что в них в качестве первого активирующего агента используется LТ-1/2 в присутствии IFN-, а в качестве второго LTRактивирующего агента используется, по крайней мере, одно антитело против LTR (антиLTR Ab). При этом предпочтительно, еслиLT-1/2-комплексы являются растворимыми, а указанное антитело является моноклональным антителом (анти-LTR mAb). В другом варианте настоящего изобретения, по крайней мере, одно антитело против LT-R в присутствии или в отсутствие второго LT-R-активирующего агента используют без эксзогенного гетеромерного LT-/-комплекса. Предпочтительные композиции и способы этого 4 варианта настоящего изобретения предусматривают использование, по крайней мере, двух моноклональных антител против LTR (анти-LT-R mAbs), распознающих неперекрывающиеся антигенные детерминанты LTR, в комбинации с IFN-. В еще одном своем варианте настоящее изобретение относится к фармацевтическим композициям и способам потенциирования цитотоксического действия на опухолевые клетки,отличающимся тем, что в них перекрестносшитые антитела против LTR используют в сочетании со вторым LTR-активирующим агентом. В одном из предпочтительных вариантов изобретения отдельные антитела против LTR иммобилизованы на клеточной поверхности путем перекрестного сшивания. В другом предпочтительном варианте антитела против LТR являются перекрестносшитыми в растворе. Более предпочтительно, если антитела против LT-R являются моноклональными антителами, а вторым LTR-активирующим агентом является интерферон- (IFN-). Кроме того, настоящее изобретение относится к новому способу скрининга, используемому для отбора LTR-активирующих агентов, таких как анти-LTR антитела, которые в сочетании с гетеромернымиLT-/комплексами стимулируют гибель опухолевых клеток. Этот способ предусматривает проведение анализа на цитотоксичность с использованием клеток аденокарциномы человека, обладающих повышенной чувствительностью к гетеромерным LT-/-комплексам в присутствииLTR-активирующих агентов. Ниже проиллюстрирована процедура, которую осуществляют для оценки возможных LTR-активирующих агентов в случае использования антител противLTR, и которая включает следующие стадии: 1) опухолевые клетки (например клетки аденокарциномы НТ 29 человека) культивируют в течение нескольких дней в среде, содержащейIFN- и очищенный LT-1/2, в присутствии или в отсутствие конкретно оцениваемого антитела против LTR; 2) клетки обрабатывают красителем, который окрашивает жизнеспособные клетки; и 3) для каждого образца подсчитывают число окрашенных клеток для того, чтобы определить фракцию опухолевых клеток, погибших в присутствии LT-1/2, IFN- и испытуемого анти-LTR Ab. Альтернативно число выживших клеток может быть определено любым из хорошо известных методов, которые обычно используются для определения жизнеспособности клеток, например таких, как введение 3 Нтимидина в ДНК.LTR-активирующим агентом настоящего изобретения является антитело против LT-R (или комбинация антител), которое способст 5 вует значительному увеличению процентного содержания опухолевых клеток, погибших в процессе вышеописанного анализа. Этот цитотоксический анализ может быть адаптирован для идентификации новыхLT-/комплексами. Краткое описание чертежей. Фиг.1 А - анализ для измерения очищенных форм гетеромерных LT-/-комплексов, выделенных с помощью иммуноаффинной хроматографии, осуществляемой по сродству к ТNF-R иLTR. Очищенные белки анализировали с помощью высокоэффективной жидкостной аффинной хроматографии на смоле TSK 3000 в забуференном фосфатом физиологическом растворе. Указывается положение маркеров различных размеров. Фиг.1 В - ионообменные анализы очищенных форм LT, проведенные на колонке (4,6 мм х 100 мм) с карбоксиметилом POROS с использованием оборудования BioCad (Perceptive Biosystems). 27 мкг каждого образца белка загружали в колонку и элюировали в градиенте О 1MNaCl 20 объемами колонки при скорости 5 мл/мин в Буфере, содержащем 16,66 мкМ Нереs,16,66 мкМ ацетата натрия и 16,66 мкМ буфераMes (рН 6,5). Фиг.2 А - сравнение цитотоксической активности моноклональных антител (СН-11) против Fas-рецептора ; TNF(-o-); LT-;LT-1/2 ; и LT-2/1 по отношению к клеткам аденокарциномы человека НТ 29 в присутствии или в отсутствие 80 Ед./мл IFN-. Фиг.2 В - сравнение способности 5 мкг/млIFN-. Фиг.3 - потенцирование моноклональными антителами против LTR цитотоксического действия LT-1/2 на клетки аденокарциномы человека НТ 29. (А) Цитотоксическое действиеLT-1/2 на клетки НТ 29 потенцируется в присутствии анти-LTR mAb CDH10. ДействиеCDH10. (В) Цитотоксическое действие LT1/2 на клетки НТ 29 ингибируется в присутствии моноклональных антител против LTRBDA8. Действие LT-1/2 измеряли в присутствии 2 мкг/мл контрольного IgG1 или в присутствии моноклональных антител против LT-R BDA8 . Различие между поведением моноклональных антител CDH10 и BDA8 противLTR в данном анализе свидетельствует о том, 6 что они направлены на различные эпитопы LT-R. Фиг.4 - цитотоксичность иммобилизованных моноклональных антител против LTR по отношению к клеткам аденокарциномы человека НТ 29. (А) Моноклональные антитела противLTR оказывают непосредственное цитотоксическое действие в случае, если они иммобилизованы на поверхности. Планшеты сенсибилизировали иммуноглобулинами IgG1 ; моноклональными антителами, направленными против не связанного с поверхностью клетки и присутствующего в избытке антигена НТ 29/26(В). Влияние лишь одного растворимого антиLTR mAb на рост клеток НТ 29. Обозначения такие же, как и на фиг.4 (А). Указанные антиLTR mAb в растворимой форме, введенные отдельно, не оказывают заметного цитотоксического действия на клетки НТ 29. Фиг.5 - репрезентативная количественная оценка повышенной цитотоксичности по отношению к опухолевым клеткам при обработке двумя типами растворимых моноклональных антител против LTR. (А). Цитотоксическое действие на клетки НТ 29 контрольного иммуноглобулина IgG1 (100 нг/мл); анти-LTRmAb ВАН 10 (100 нг/мл); анти-LTR mAb СВЕ 11 (50 нг/мл), ВНА 10 (100 нг/мл) + IgG (100 нг/мл); и ВНА 10 (100 нг/мл) + СВЕ 11 (50 нг/мл). Интерферон- (IFN-) присутствовал в концентрации 80 Ед./мл. (В). Цитотоксическое действие на клетки НТ 29 контрольного IgG1(100 нг/мл) + CBE11 (50 нг/мл). IFN- присутствовал в концентрации 80 Ед./мл. (С) Цитотоксическое действие на клетки НТ 29 контрольногоCDH10 (33 нг/мл) + AGH1 (50 нг/мл). IFNприсутствовал в концентрации 80 Ед./мл. (D) аналогичен (С), за исключением того, что в цитолитическом анализе были использованы клетки аденокарциномы человека WiDr (RaitanoKorc, J. Biol.Chem., 265, pp.10466-472 (1990. Фиг.6 - размер опухоли у мышей SCID,обработанных моноклональным антителом против LTR. (А) Размер опухоли аденокарциномы человека WiDr у мышей SCID через 30 дней после одновременной инокуляции вместе с антителом. На 1 и 2 день после инокуляции мышей обрабатывали физиологическим раствором; лишь одним IFN-, анти-LTR mAb (СВЕ 11) вместе с IFN- или без него, и контрольным моноклональным антителом против LFA-3 человека (1 Е 6) вместе с IFN-. Среднее значение для каждой группы показано поперечной линией. Средние значения, стандартные отклонения и число животных (в скобках) для пяти групп составляют: 0,88 +/- 0,59 (14); 1,21 +/- 0,7 (21); 0,041 +/- 0,52 (16); 0,11 +/- 0,1 (12), и 0,98 +/1,16 (12). (B). Размер опухоли аденокарциномы человека WiDr у мышей SCID в период времени от 14 до 49 дней после инокуляции опухолевых клеток с последующей (через 15 дней) обработкой антителом. Без какой-либо обработки, рост опухолей достигал среднего диаметра 0,53 см(0,076 см 3), а через 15 дней начинали вводить инъекции (i.p.) и введение этих инъекций продолжали, как указано стрелками. Показаны средние значения и стандартные отклонения для группы, состоящей из 12 животных, обработанных либо одним IFN- (1 х 106 ед./инъекция)mAb 1 Е 6 (-о-), либо IFN- вместе с 50 мкг антиLTR mAb СВЕ 11 , либо одним анти-LT-R mAb СВЕ 11 (50 мкг) (не показано). Для более ясного понимания настоящего изобретения ниже приводится подробное определение используемых терминов. Термин "противоопухолевая активность" означает способность вещества или композиции блокировать пролиферацию опухолевых клеток или индуцировать гибель опухолевых клеток,которые вступают во взаимодействие с данным веществом или композицией. Термин "апоптоз" означает процесс "запрограммированной" гибели клеток. Термин "цитотоксическая активность" означает способность вещества или композиции индуцировать гибель клеток, которые вступают во взаимодействие с данным веществом или композицией. Термин "эпитоп" (или антигенная детерминанта) означает часть молекулы, которая вступает во взаимодействие с отдельным антигенсвязывающим сайтом молекулы антитела. Один эпитоп распознается моноклональным антителом (mAb). Многие эпитопы обычно распознаются поликлональными антителами (Аb). Термин "Fc-домен" антитела означает часть молекулы антитела, которая включает области СН 2 и СН 3 и шарнирную область, но в которой отсутствуют антигенсвязывающие сайты. Термин"интерферон-индуцирующий агент" означает любой агент, который обладает способностью непосредственно или опосредованно стимулировать эндогенное продуцирование интерферонов типа I (IFN-, IFN-) или типа II (IFN-). Примерами интерферониндуцирующих агентов могут служить молекулы двухцепочечной ДНК, и ряд растительных или фармацевтически продуцированных соединений. Термины "LTмутеин" и "LT-мутеин" означают LT или LTполипептиды, имеющие, по сравнению с соответствующим нативным полипептидом, одно или 8 несколько изменений в аминокислотной последовательности. Термин "LTR-активирующий агент" означает любой агент, который способен стимулировать связывание лиганда с LTR, образование LTрецепторных кластеров на клеточной поверхности или передачу сигнала LT-рецептором; либо который может оказывать влияние на интерпретацию LTR-сигнала в клетке. ПримерамиLTR-активирующих агентов являются IFN-, IFN-, ТNF, интерферон-индуцирующие агенты, растворимые антитела против LTR, перекрестносшитые антитела против LTR и мультивалентные антитела против LTR. Термин "передача сигнала LTR" означает все молекулярные реакции, ассоциируемые с путем активации LTR, а также последующие молекулярные реакции, происходящие в результате этой активации. Термин "антитело против LTрецептора"LTрецептора" (анти-LTR mAb) означает любое моноклональное антитело, которое распознает и связывается с одним эпитопом LT-рецептора. Термин "перекрестносшитые (моноклональные) антитела против LTR" означает антитела против LTR, которые либо были подвергнуты перекрестному сшиванию друг с другом с образованием агломератов антител в растворе с использованием антитела против LT-R (Аb) или (mAb) в качестве перекрестносшивающего агента; либо были иммобилизованы в непосредственной близости друг от друга на какой-либо поверхности или матриксе. Термин "агент, перекрестно сшивающий анти-LTR Ab (или mAb)" означает любой агент, который способен ковалентно или нековалентно агрегировать анти-LTR Ab в растворе так, что эти антитела могут связываться с рецепторами и потенцировать образование LT-рецепторных кластеров на клеточной поверхности. Такими перекрестносшивающими агентами являются (но не ограничиваются ими) химические перекрестносшивающие агенты, "вторые" антитела, которые реагируют с частями анти-LTR Ab или mAb; и растворимые или связанные с поверхностью Fc-рецепторы (либо эндогенные, либо введенные экзогенно), которые могут связываться с анти-LTR Ab . ТерминыLT-активность", "биологическая LTактивность" и "биологическая LT-/-активность" означают: 1) иммунологическая перекрестная реактивность с антителом, направленным против, по крайней мере, одного эпитопа соответствующей нативной субъединицы или комплекса субъединиц; или 2) способность субъединицы LT или комплекса субъединиц LT конкурировать за лигандсвязывающие сайты наLTR; или 3) способность стимулировать иммунорегуляторный ответ или цитотоксическую активность, сравнимую с соответствующей активностью нативной субъединицы LT или LTкомплекса. Термин "гетеромерный LT- /-комплекс" означает стабильную ассоциацию между, по крайней мере, одной субъединицей LT- и несколькими субъединицами LT-. Ассоциация этих субъединиц может происходить посредством электростатического, вандервальсового или ковалентного взаимодействия. Предпочтительно, если гетеромерный LT-/-комплекс имеет,по крайней мере, две смежные субъединицы LT, и не имеет смежных субъединиц LT-. Наиболее предпочтительно, если комплекс имеет стехиометрию LT-1/2. Термин "мультивалентный лиганд" означает молекулу или комплекс, который имеет более чем один сайт связывания с рецептором и который способен одновременно связываться и вступать в непосредственную близость, по крайней мере, с двумя рецепторными молекулами."Лидерная последовательность 1 типа" представляет собой аминоконцевой участок эукариотического белка, который служит сигнальным пептидом, направляющим белок к мембране эндоплазматического ретикулума(ЭР), а часто вдоль всего "пути" секреции. Лидерная последовательность обычно отщепляется сигнальной пептидазой на мембране ЭР."Сигнальная последовательность" является функциональным эквивалентом эукариотической лидерной последовательности 1 типа в прокариотическом хозяине и направляет транслокацию белков в (или через) липидный бислой мембран бактерии.LT-/-комплекс, содержащий растворимые субъединицы LT-, где аминокислотные последовательности, локализирующие полипептид в мембрану, были делетированы или инактивированы, благодаря чему субъединица LT- стала растворимой. Растворимые гетеромерные LT/-комплексы могут быть секретированы соответствующей клеткой-хозяином, сконструированной так, чтобы она экспрессировала обе субъединицы.LT- и локализованный на клеточной поверхности. Получение мембраносвязанных LT-/комплексов. Поверхностные лимфотоксиновые комплексы были охарактеризованы в СD4+-Тклеточных гибридомах (11-23.D7), которые экспрессируют высокие уровни LT (Browning et al.,J. Immunol., 147, pp. 1230-37 (1991); Androlewiczet al., J. Biol. Chem., 267, pp. 2542-47 (1992. Зрелый LT- не содержит трансмембранный домен и локализуется на клеточной поверхности посредством взаимодействия, по крайней мере,с одной мембраносвязанной субъединицей LT. Мембраносвязанные (поверхностные) гетеромерные LТ-/-комплексы имеют преимущественно LT-1/2-стехиометрию. В процессе синтеза мембранный белок LT связывается с LT-, осуществляя тем самым,"доставку" LT- к клеточной мембране. В отсутствие LT-, LT- секретируется во внеклеточное пространство. Сборка субъединиц в комплекс обычно происходит внутри клетки до переноса белка в мембрану. После того, как субъединицы LT- проникнут в мембрану, они не будут образовывать стабильные комплексы с секретированными LT-. Поэтому, если необходимо получить гетеромерныеLT-/комплексы, то предпочтительно, чтобы коэкспрессия нужных субъединиц LT- и Т- происходила в той же самой клетке. Поверхностный гетеромерный LT-/комплекс может быть реконструирован путем котрансфекции клеток-хозяев генами LT- LT. Поверхностные стабильные LT-комплексы не могут наблюдаться в стабильных клеточных линиях, которые экспрессируют лишь один из двух генов LT. Однако, если клетка-хозяин в нормальных условиях экспрессирует большое количество LT- (например, клетки RРМ 1 1788,см. ниже), то в этом случае, трансфекция геномLT-, кодирующим нужный LTполипептид,была бы достаточной для продуцирования LT/-комплексов, содержащих полноразмерные субъединицы LT-. Совместная экспрессия LT и LT-полипептидов в некоторых эукариотических экспрессирующих системах приводит к их сборке и экспорту в качестве активного лиганда(1994. Системами-хозяевами, которые могут быть использованы в этих целях, являются (но не ограничиваются ими) клетки СНО, клеткиLTсубъединица гетеромерного LT-/комплекса настоящего изобретения может быть выбрана из лимфотоксина-; нативного лимфотоксина- человека или животного; рекомбинантного лимфотоксина-; растворимого лимфотоксина-; секретированного лимфотоксина 11; мутеинов лимфотоксина-, обладающих биологической LТактивностью; или фрагментов любого вышеуказанного лимфотоксина-,имеющих биологическую LTактивность.LTполипептид может быть получен в любой растворимой форме молекулы, включая ее активные фрагменты, которые могут быть продуцированы в эукариотических системах экспрессии, где натуральная лидерная последовательность LT- будет отщепляться. Альтернативно для максимизации секреции LT- в других системах-хозяевах могут быть использованы гибридные последовательности, содержащие зрелую последовательность LT- и присоединенную к ней гетерологичную сигнальную последовательность. Эти сигнальные последовательности выбирают, исходя из используемой клетки-хозяина, и такими последовательностями могут быть последовательности бактерий,дрожжей, вирусов и млекопитающих. Для использования в системах экспрессии, происходящих от млекопитающих, подходящими являются нативная сигнальная последовательность или сигнальная последовательность адгезивной молекулы-1 сосудистых клеток (vСАМ-1).LTполипептиды могут быть также присоединены к полипептидам, имеющим продолжительное время полужизни в плазме, таким как цепи иммуноглобулинов и их фрагменты. Для увеличения времени полужизни в плазме могут быть использованы белки плазмы, включая, сывороточный альбумин, иммуноглобулины, аполипопротеины и трансферрин. Присоединение полиэтиленгликоля (ПЭГ) может способствовать стабилизации полипептида и снижению его иммуногенности. При этом, предпочтительно,чтобы гибридный LTбелок не обладал значительной иммуногенностью для индивидуума,подвергаемого лечению, а также, чтобы белки плазмы, благодаря их нормальной биологической активности, не вызывали нежелательных побочных эффектов у индивидуума.LT- человека гликозилирован по соответствующим остаткам посредством N-связанного и О-связанного олигосахарида и в зависимости от источника обнаруживает значительную микрогетерогенность по сахариду. Олигосахаридный состав конкретного LT-, выбранного для образования LT-комплекса, может повлиять на скорость его выведения in vivo (Fukushima et al.,Arch. Biochem. Biophys., 304, pp.144-153 (1993. Поскольку экспрессия в различных клеткаххозяевах может давать различные варианты гликозилирования, то этот фактор также следует учитывать при выборе источника LT-.LT- может быть выделен из лимфобластоидной линии RРМ 1 1788, которая конститутивно секретирует LT- и которая может после индуцирования путем обработки форболовым эфиром РМА секретировать более высокие уровни LT- (Aggarwal et al., J. Biol. Chem., 259, 12pp. 686-91 (1984. Альтернативно клонированный LTген человека может быть использован для рекомбинантного продуцирования LT-полипептидов в различных системах-хозяевах,включая бактерии (Schoenfeld et al., J. Biol.Chem., 266, pp. 38-69 (1991; бакуловирусинфицированные клетки (Crowe et al., J. Immunol. Methods, 168, pp. 70-89 (1994; и клетки млекопитающих (BrowningRibolini. J. Immunol., 143, pp. 1859-67 (1989); Fukushima et al.,Arch. Biochem. Biophys., 304, pp. 144-53 (1993. Участки LTгена, которые кодируют полипептидные фрагменты, обладающие биологической LTактивностью, могут быть выявлены с использованием рутинного анализа методом скрининга. Подходящим методом скрининга на биологическую LTактивность является стандартный анализ на конкурентное ингибирование с использованием нативного LT-, связанного с ТNF-R, либо стандартный анализ путем прямой или непрямой оценки (посредством ингибирования) способности LT- индуцировать цитотоксичность по отношению к опухолевым клеткам. При этом предпочтительно, чтобы фрагменты LT- вместе с LT- образовывали гетеромерные комплексы, и чтобы эти комплексы были проанализированы на их биологическую LT-/-активность путем конкурентного ингибирования с использованием LT-/, связанного с LTR, или на их способность индуцировать цитотоксичность по отношению к опухолевым клеткам посредством анализов,раскрытых в настоящем описании. Лимфотоксин-, именуемый также р 33,был идентифицирован на поверхности Тлимфоцитов, Т-клеточных линий, В-клеточных линий, и лимфокинактивированных клетоккиллеров. LT- является предметом одновременно рассматриваемых международных заявокPCT/US 91/04588, опубликованной 9 января 1992 г. как WO 92/00329; и PCT/US 93/11669,опубликованной 23 июня 1994 г. как WO 94/13808, которые вводятся в настоящее описание посредством ссылки.LTген кодирует полипептид из 240-244 аминокислот (Browning et al., Cell, 72, pp. 847-56(1993. LT- является мембранным белком 11 типа, имеющим короткий N-концевой цитоплазматический домен, за которым следует мембраносвязывающий домен (так называемый"мембранный якорь"), состоящий из 30 гидрофобных аминокислот. Он имеет один сайт Nсвязанного гликозилирования и лишь один цистеиновый остаток, который, по всей вероятности, не участвует в образовании межсубъединичной дисульфидной связи. Субъединицы LT-, входящие в состав гетеромерных LT-/-комплексов настоящего изобретения, могут быть выбраны из лимфотоксина-, нативного лимфотоксина- человека или животного, рекомбинантного лимфотоксина-,растворимого лимфотоксина-, секретированного лимфотоксина-, мутеинов лимфотоксина-,имеющих биологическую LTактивность; или фрагменты любого из вышеуказанных лимфотоксинов-, имеющие биологическую LT-активность. Как обсуждалось выше, в случае LT-полипептида, LTполипептиды могут быть модифицированы в целях повышения их растворимости или увеличения времени их полужизни с использованием той же самой методики. Аналогичным образом участки гена LT-,которые кодируют полипептидные фрагменты,обладающие биологической LTактивностью,могут быть выявлены с помощью рутинных анализов путем скрининга, как обсуждалось выше для LT-. Продуцирование растворимых комплексов Растворимые (не связанные с мембраной) гетеромерные LT-/-комплексы содержат субъединицыLT-,которые из мембраносвязанной формы были превращены в растворимую форму. Эти комплексы подробно описаны в одновременно рассматриваемой международной заявке (PCT/US93/11669, опубликованной 9 января 1992 г. как WO 94-13808). Растворимые LTпептиды определяются аминокислотной последовательностью лимфотоксина-, которая отщепляется в любой точке между концом трансмембранной области (т.е. примерно аминокислота 44) и первой областью(Cell, 72, pp. 847-56, 1993. Растворимые LTполипептиды могут быть продуцированы путем усечения N-концаLT- для удаления цитоплазматического хвоста и трансмембранной области (Crowe et al., Science, 264, pp. 707-710 (1994. Альтернативно трансмембранный домен может быть инактивирован путем делеции, или путем замены гидрофобных аминокислотных остатков, которые обычно составляют трансмембранный домен,гидрофильными остатками. В любом случае,необходимо создать в основном гидрофильный профиль гидропатии, который будет способствовать снижению сродства к липиду и улучшению водорастворимости. Делеция трансмембранного домена более предпочтительна, чем замена гидрофобных аминокислотных остатков,поскольку она позволяет избежать введения потенциально иммуногенных эпитопов. Делетированный или инактивированный трансмембранный домен может быть заменен лидерной последовательностью типа 1 (например, лидерной последовательностью VCAM-1) или он может быть присоединен к ней, так, чтобы секретировался белок с последовательностью, начинающейся где-то в районе от val40 до рго 88. Растворимые LTполипептиды могут включать любое число хорошо известных лидерных последовательностей на N-конце. Эти последовательности обеспечивают экспрессию пептидов и их транслокацию по соответствующему "пути" секреции в эукариотических системах. См., например, Ernst и др., патент США 5 082 783 (1992). Растворимые гетеромерныеLT-/комплексы могут быть продуцированы путем совместной трансфекции подходящей клеткихозяина ДНК, кодирующей LT- и растворимыйLT- (Crowe et al., J. Immunol. Methods, 168, pp. 79-89 (1994. Растворимый LT-, секретированный в отсутствие LT-, является в высокой степени олигомеризированным. Однако, при совместной экспрессии с LT-, образуется тример-подобная 70 кДа-структура, содержащая оба белка. Растворимые гетеромерные LT1/2-комплексы могут быть также получены путем трансфекции клеточной линии, которая обычно экспрессирует только белок LT- (например, клетки RPM1 1788, упомянутые выше),геном, кодирующим растворимый LT-полипептид.LT- и LTполипептиды могут быть синтезированы отдельно, а затем денатурированы с использованием слабых детергентов, смешаны вместе и ренатурированы путем удаления детергента с образованием смешанных гетеромерных LT-комплексов, которые могут быть выделены (см. ниже). Очистка LT-1/2-комплексов Растворимые гетеромерные LT-1/2 комплексы отделяют от совместно экспрессированных комплексов, имеющих различную стехиометрию субъединиц, с помощью хроматографии с использованием TNF- и LT-рецепторов в качестве реагентов для аффинной очистки. ТNF-рецепторы связываются только в/-карманах LT-комплексов. LTрецептор связывается с высокой степенью аффинности с/-карманами и с более низкой степенью аффинности с /-карманами гетеромерных LT/-комплексов. В соответствии с этим, LT-3 иLT- 2/1 будут связываться с TNF-R. LTR также может связываться с LT-2/1-тримерами(в /-карманах), но не может связываться с LT3. Кроме того, LTR (но не TNF-R) связывается с LT-1/2 и LT- n (точный состав таких препаратов неизвестен, однако они являются крупными агрегатами). Реагенты-рецепторы для аффинной очистки могут быть получены либо в виде растворимого внеклеточного домена (см., например, Loetscher et al., J. Biol. Chem., 266, pp. 18324-29,(1991, либо в виде химерных белков, имеющих внеклеточный лигандсвязывающий домен, присоединенный к Fc-домену иммуноглобулина(1994. Рецепторы связывают с аффинными матрицами посредством химического перекрестного сшивания с использованием стандартной техники. Существуют две схемы, в соответствии с которыми лиганд LT- 1/2 может быть очищен с использованием рецепторов и иммуноаффинной хроматографии. В первой схеме супернатант от соответствующей системы экспрессии, коэкспрессирующей LTи усеченныйLT-, пропускают через колонку с TNF-R. ТNFR связывается с LT-3- и LT- 2/1-тримерами. Сквозной поток, выходящий из колонки с TNFR, будет содержать LT-(n) и LT-1/2. Во второй схеме, все LTсодержащие формы (LT-(n), LT-1/2 и LT-2/1) связывают с колонкой, содержащей LTR, и элюируют с этой колонки, используя классические методы, такие как хаотрофный метод и метод изменения рН. Элюат нейтрализуют, либо удаляют хаотроф, после чего элюат пропускают через колонку с TNF-R, который связывается только с LT-2/1-тримерами. Поток, вытекающий из колонки, будет содержать LT-(n) иLT-1/2-тримеры. В обоих случаях очищенные LT-l/2 тримеры могут быть отделены от LT- путем последующей гель-фильтрации и/или ионообменной хроматографии, хорошо известной специалистам. Альтернативно различные формы гетеромерных LT-/-комплексов могут быть выделены и очищены различными стандартными методами хроматографии. Может также оказаться предпочтительным объединить ряд стандартных схем очистки с одной из вышеописанных стадий иммуноаффинной очистки. Источник антител, направленных противLTR Сыворотку, содержащую поликлональные антитела, направленные против рецептора дляLT- человека, получали с использованием стандартной техники путем подкожной инъекции животным, таким как козы, кролики или мыши, гибридного белка "чел. LTрецептор Fc" (пример 2) в полном адъюванте Фрейнда с последующей внутрибрюшинной или подкожной бустер-инъекцией в полном адъюванте Фрейнда. Поликлональные антисыворотки, содержащие нужные антитела, направленные против LTрецептора, скринировали в соответствии со стандартными процедурами. Мышиные моноклональные антитела(mAb), направленные против гибридного белка"чел. LTрецептор-Fс", получали путем внутрибрюшинных инекций мышам линии RBF гибридного рекомбинантного белка LTрецепторFс (LTR -Fс), полученног в клетках СНО,связанного с гранулами "белок А - сефароза"(Protein A Sepharose) в отсутствие адъюванта. После этого животным вводили последнюю бустер-инъекцию (i.р. и i.v.), проводили слияние с клетками селезенки в соответствии с классической схемой и полученные гибридомы скринировали с помощью анализа ELISA (Ling et al.,J. Interferon and Cytokine Res., 15, pp. 53-59(1995. Затем гибридомы скринировали на их способность блокировать связывание активированной гибридомы 11-23, которая экспрессирует поверхностный(mAb) получали путем очистки (на белок Асефарозе) IgG из супернатантов гибридомной культуры. Различные формы антител против LTR могут быть также получены с помощью стандартной техники рекомбинантных ДНК (Winterand Milstin, Nature, 349, pp. 293-99 (1991. Так например, могут быть получены "химерные" антитела, в которых антигенсвязывающий домен, происходящий от антитела животного, связан с константным доменом человека (см., например, Cabilly и др., патент США 4 816 567;Morrison et al., Proc. Natl. Acad. Sci, U.S.A., 81,pp. 6851-55 (1984. Химерные антитела позволяют ослабить наблюдаемые иммуногенные реакции, индуцируемые антителами животных,используемых в клинической практике для лечения человека. Кроме того, могут быть синтезированы"очеловеченные" рекомбинантные антитела,которые распознают LTR. "Очеловеченные" антитела являются "химерами", состоящими,главным образом, из последовательностей IgG человека, в которые были инсертированы области, ответственные за специфическое связывание с антигеном (см., например, WO 94/04679). Для этого, животных иммунизируют нужным антигеном, затем выделяют соответствующие антитела и удаляют участок последовательности вариабельной области, ответственный за специфическое связывание с антигеном. Затем, эти происходящие от животных антигенсвязывающие области клонируют в соответствующее положение генов антитела человека,из которых были удалены антигенсвязывающие области. "Очеловеченные" антитела позволяют минимизировать использование гетерологичных(межвидовых) последовательностей в человеческих антителах и снизить вероятность индуцирования иммунного ответа у индивидуума, подвергающегося лечению. Получение различных классов рекомбинантных антител против LTR может быть также осуществлено путем конструирования химерных или "очеловеченных" антител, содержащих вариабельные домены против LT-R, и человеческих константных доменов (СН 1,СН 2, СН 3), выделенных из иммуноглобулиновIgM против LTR, имеющие повышенное количество антигенсвязывающих сайтов, могут быть рекомбинантно продуцированы путем клонирования антигенсвязывающего сайта в векторы, несущие константые области -цепи иммуноглобулина человека (Arulanandam et al.,J. Exp. Med., 177, pp. 1439-50 (1993); Lane et al.,Eur. J. Immunol., 22, pp. 2573-78 (1993);Traunecker et al., Nature, 339, pp. 68-70 (1989. Кроме того, стандартная техника рекомбинантных ДНК может быть использована для изменения аффинностей связывания рекомбинантных антител с их антигенами путем замены аминокислотных остатков, находящихся вблизи антигенсвязывающих сайтов. Аффинность связывания с антигеном "очеловеченного" антитела может быть увеличена путем мутагенеза, основанного на молекулярном моделировании(Queen et al., Proc.Natl.Acad. Sci. U.S.A., 86, pp. 10029-33 (1989); WO 94/04679). В зависимости от типа ткани-мишени или от конкретной схемы предусмотренного лечения может оказаться желательным увеличить или уменьшить аффинность антител против LT-R. Так, например, для полупрофилактического лечения может оказаться предпочтительным проводить лечение пациента постоянными уровнями анти-LTR Аb с пониженной способностью передачи сигнала транслокации LT. Аналогичным образом, для кратковременного лечения, направленного на опухоль-мишень,может оказаться предпочтительным использовать анти-LTR антитела с повышенной аффинностью. Скрининг анти-LTR антител на LTRактивирующие агенты Анти-LTR антитела настоящего изобретения могут потенцировать противоопухолевую активность гетеромерных LT-/-комплексов(предпочтительно LT-1/2) в присутствии LT-R активирующего агента, такого, как IFN-. Эти анти-LTR антитела также рассматриваются в настоящем описании как LTRактивирующие агенты. Антитела, которые действуют как LTR-активирующие агенты, отбирают следующим образом: 1) Серию культуральных лунок, содержащих опухолевые клетки, такие как клетки НТ 29,культивируют в течение 3-4 дней в среде, содержащей LTR-активирующий агент, такой как IFN-, и очищенный гетеромерный LT-/(предпочтительно LT-1/2) комплекс, в присутствии или в отсутствие серийных разведений тестируемого анти-LTR антитела; 2) К клеточной смеси добавляют витальный краситель, с помощью которого измеряют митохондриальную функцию, такую как МТТ, и оставляют на несколько часов для прохождения реакции; 18 3) Оптическую плотность смеси в каждой лунке определяют при длине волны 550 нм (ОП 550). ОП 550 обратно пропорциональна числу опухолевых клеток, погибших в присутствии гетеромерногоLT-/-комплекса,LTRактивирующего агента и испытуемого анти-LT-R антитела в каждой лунке. Предпочтительными антителами настоящего изобретения, которые сами действуют какLTRактивирующие агенты в присутствии LT-1/2 и IFN-, являются анти-LTR Аb ВКА 11,СDН 10, ВНА 10 и ВСG6 (см. ниже табл.2). Перекрестное связывание антител противLTR Перекрестносшитые анти-LTR антитела настоящего изобретения действуют отдельно как LTR-активирующие агенты в отсутствие экзогенных гетеромерных LT-/-комплексов и в присутствии второго LTR-активирующего агента, такого как IFN-. Перекрестносшитые анти-LTR антитела, по всей вероятности, связываются с LTрецепторами клеточной поверхности и индуцируют образование рецепторных кластеров, активируя, тем самым, направленнуюLTрецептор-опосредованную гибель клетки мишени. В одном из вариантов настоящего изобретения анти-LTR антитела одного или нескольких типов подвергают перекрестному сшиванию путем иммобилизации на нерастворимом в воде матриксе или поверхности. Для перекрестного сшивания антител с нерастворимым в воде матриксом или поверхностью используют метод дериватизации бифункциональным агентом. Агентами, обычно используемыми для осуществления перекрестного сшивания антител с нерастворимым в воде матриксом или поверхностью, являются 1,1-бис(диазоацетил)-2-фенилэтан,глутиральдегид,сложные эфиры N-гидроксисукцинамида, включая эфиры 4-азидо-салициловой кислоты, гомобифункциональные имидоэфиры, такие как дисукцинимидиловые эфиры, и бифункциональные малеимиды, такие как бис-N-малеимидо 1,8-октан. Дериватизирующие агенты, такие как метил-3-[(п-азидофенил)дитио] пропиоимидат,образуют фотоактивируемые промежуточные соединения, которые могут быть подвергнуты селективному перекрестному сшиванию под стимулирующим действием светового излучения. Для иммобилизации и перекрестного сшивания белка могут быть также использованы реакционноспособные нерастворимые в воде матрицы, такие как углеводы, активированные цианистым бромидом, и субстраты, описанные в патентах США 3 959 080; 3 969 287; 3 691 016; 4 195 128; 4 247 642; 4 229 537; 4 055 635; и 4 330 440. Поверхностями, к которым могут быть присоединены антитела, являются небелковые полимеры, обычно гидрофильные полимеры, 19 происходящие от натуральных или синтетических источников. Могут быть использованы гидрофильные поливиниловые полимеры, такие как поливиниловый спирт (PVA) и поливинилпирролидон (PVP). Могут быть также использованы полиалкиленовые эфиры, такие как полиэтиленгликоль, полипропиленгликоль, полиоксиэтиленовые сложные эфиры или метоксиполиэтиленгликоль, полиоксиалкилены, такие как полиоксиэтилен и полиоксипропилен, блоксополимеры полиоксиэтилена и полиокси пропилена (Pluronics); полиметакрилаты; карбомеры; разветвленные или неразветвленные полисахариды, содержащие мономеры сахаридов,такие как D-манноза, D- и L-галактоза, фукоза,фруктоза,D-ксилоза,L-арабиноза,Dглюкуроновая кислота, сиаловая кислота, Dгалактуроновая кислота, D-маннуроновая кислота (например, полиманнуроновая кислота или альгиновая кислота), D-глюкозамин, Dгалактозамин, D-глюкоза и нейраминовая кислота, включая гомополисахариды и гетерополисахариды, такие как лактоза, амилопектин,крахмал, оксиэтилированный крахмал, амилоза,декстрансульфат, декстран, декстрины, гликоген, или полисахаридная субъединица кислых мукополисахаридов, например гуалуроновая кислота; полимеры этиловых спиртов, такие как полисорбит и полиманнит; а также гепарин или гепарон. Во избежание явлений множественного перекрестного сшивания с антителом используемый полимер до его перекрестного сшивания должен быть предпочтительно водорастворимым и должен содержать лишь специфически реагирующую химическую группу. В любом случае, реакционные условия должны быть оптимизированы в целях снижения уровня перекрестного сшивания и выделения продуктов(либо непосредственно, либо путем последовательной гель-фильтрации или стадии хроматографии), имеющих, в основном, равномерный интервал молекулярных масс. Оптимальная молекулярная масса матрицы, перекрестно сшитой с антителом, может быть определена путем рутинного экспериментирования с использованием анализов на цитотоксичность и связывания с рецептором, как описано в настоящей заявке. Предпочтительно, чтобы конечный конъюгат, полученный после перекрестного сшивания с матрицей, растворялся в физиологических жидкостях, таких как кровь. Причем, полимер в форме конъюгата не должен быть в высокой степени иммуногенным и должен обладать вязкостью, позволяющей вводить внутривенные вливания или инъекции, если таковые предусмотрены для применения. Полимер может быть также нерастворимым в воде. Примерами материалов, которые могут быть использованы в этом случае, являются гидрофильные гели или изделия определенной формы, имеющие поверхности, на кото 20 рых могут быть иммобилизованы антитела, например хирургические трубки, катетеры, или трубки для дренажа. При этом предпочтительно использовать твердые материалы-носители, которые являются биологически совместимыми и инертными по отношению к окружающему физиологическому пространству. Материал считается биологически совместимым, если он, в основном, не стимулирует иммунные реакции,включая воспалительные реакции, или не притягивает фиброзные клетки при попадании внутрь организма пациента. Антитела против LTR могут быть также иммобилизованы на поверхностях, ковалентно или нековалентно сенсибилизированных "вторыми" антителами, которые связываются с"первыми" анти-LTR антителами (например,козьими антителами против мышиных иммуноглобулинов IgG ; см. пример 7). Каждое тестированное отдельно анти-LTR антитело,иммобилизованное на поверхности со "вторыми" антителами, действует как LTRактивирующий агент в присутствии IFN- (фиг.4 и 7). В альтернативном варианте перекрестносшитые анти-LTR антитела в растворе действуют как LTR-активирующие агенты. АнтиLTR Ab могут быть перекрестно сшиты с помощью анти-LTR Аb (или mАb)перекрестносшивающего агента. В соответствии с настоящим изобретением анти-LTR Аb (илиmAb) перекрестносшивающим агентом является любой агент, способный либо ковалентно связываться, либо нековалентно агрегировать антиLTR, Ab (или mAb) в растворе так, чтобы перекрестносшитые анти-LTR антитела (или моноклональные антитела) могли связываться сLTрецептором клеточной поверхности и потенцировать образование кластеров этих рецепторов. Такими анти-LTR Аb (или mAb)перекрестносшивающими агентами являются(но не ограничиваются ими) химические перекрестносшивающие реагенты, которые могут вступать в реакцию с антителами в регулируемых условиях, как описано выше. Альтернативно, для образования агломератов анти-LTR антител в растворе могут быть использованы"вторые" антитела, сефароза, Fc-рецепторы или другие агенты, которые связываются с "первыми" анти-LTR антителами или способствуют их агрегации, не блокируя при этом их активность. Множественные анти-LTR антитела в растворе действуют как LT- -R-активирующие агенты Настоящее изобретение относится к композициям, содержащим множественные антиLTR антитела в растворе, которые действуют как LTR-активирующие агенты путем потенциирования образования поверхностных LT- 21R-кластеров. В этих целях могут быть использованы поликлональные анти-LTR антитела,направленные против различных эпитопов LT-R. Предпочтительными анти- LTR Ab являются моноклональные антитела, направленные против различных и неперекрывающихся эпитопов LTR. Методика использования смешанных антиLTR моноклональных антител для активацииLTрецептора требует объединения двух неперекрывающихся эпитопов. Кроме того, вероятно, что продуктивная агрегация рецепторов может быть достигнута лишь для некоторых эпитопов. Нами было идентифицировано, по крайней мере, четыре уникальных иммунореактивных эпитопа LTрецептора. Дополнительные эпитопы (определенные новыми mAbs) могут быть идентифицированы путем продолжения слияния клеток селезенки иммунизированных мышей, путем иммунизации различных видов животных и путем использования других методов иммунизации. Эпитопы могут быть также непосредственно картированы путем оценки способности различных моноклональных антител конкурировать друг с другом за связывание с LTR с использованием хроматографической техники BIAcore (PharmaciaBIAtechnology Handbook, "Epitope Mapping",Section 6.3.2, (May 1994); см. также, Johne et al.,J. Immunol. Methods, 160, pp. 191-8 (1993. В соответствии со своей способностью кооперироваться в комбинации с другими LT-R mAb в процессе цитотоксического воздействия на опухолевые клетки в цитолитических анализах, отдельные LTR mAb могут быть разделены, по крайней мере, на четыре класса(пример 8; табл.1). Так, например, моноклональные антитела BDA8 в Группе I не действуют в комбинации с моноклональными антителами AGH1 в Группе 1 для стимулирования цитотоксичности по отношению к опухолевым клеткам. Аналогичным образом в анализе на цитотоксичность по отношению к опухолевым клеткам моноклональные антитела ВКА 11 иCDH10 в Группе III не кооперируются друг с другом. На фиг.5 А-С показано воздействие характерных анти-LTR mAb, введенных отдельно и попарно в комбинации, на опухолевые клетки в анализе на цитотоксичность в присутствииIFN- в качестве LTR-активирующего агента. Анти-LTR антитела СВЕ 11 Группы IV, взятые отдельно, оказывали незначительное цитотоксическое действие, которое усиливалось в комбинации с mAb ВНА 10 Группы II (фиг.5 А). Антитела СВЕ 11 оказывали аналогичное действие в комбинации с mAb CDH10 Группы III(фиг.5 В). Цитотоксичность, индуцируемая путем введения комбинации анти-LTR mAb в растворе, не является характерной лишь для опухо 22 левой клеточной линии НТ 29. На фиг.5 С показано, что моноклональные антитела AGH1 Группы 1 и моноклональные антитела CDH10 Группы III оказывают синергическое действие на две различные опухолевые клеточные линии(клетки НТ 29 и клетки mAbs ), происходящие от опухолей аденокарциномы человека. Суммарные характеристики моноклональных антител против LTR Все анти- LTR mAb настоящего изобретения при их перекрестном сшивании путем иммобилизации действуют какLTR-активирующего агента, такого как IFN. Такая способность анти-LTR mAb действовать как LTR-активирующие агенты в присутствии или в отсутствие LT-1/2 в растворе часто варьируется в зависимости от состояния клеток во время теста. В табл. 2 (см. ниже) систематизированы свойства моноклональных антител против LTR, охарактеризованных в настоящем изобретении. Моноклональные антитела BDA8 и AGH1 Группы 1 не функционируют как LTRактивирующие агенты в растворе с LT-1/2. Антитела BDA8 фактически блокируют противоопухолевое действие LT-1/2 (фиг.3 В и табл. 2). В противоположность этому, анти-LT-R mAb BCG6 и ВНА 10 Группы II при их введении с LT-1/2 обладают смешанным агонистическим и антагонистическим действием. Анти-LTR mAb ВКА 11 и CDH10 Группы III являются уникальными по своей способности действовать как LTR-активирующие агенты,которые потенцируют противоопухолевое действие в присутствии LT-1/2 и второго LT-R-активирующего агента, такого как IFN-, не оказывая при этом антагонистического действия, часто наблюдаемого в случае моноклональных антител BCG6 и ВНА 10 Группы II. При этом важно иметь в виду, что классификация моноклональных антител против LT-R, основанная на их способности кооперироваться в анализе на цитотоксичность по отношению к опухолевым клеткам, отражает тот факт, что эти антитела взаимодействуют с различными эпитопами LTрецептора. Однако,моноклональные антитела, составляющие одну группу, необязательно имеют одинаковые аффинности связывания с их распознаваемыми эпитопами. Поэтому различные результаты, полученные при сравнении действия различных моноклональных антител, принадлежащих к одной и той же или разным группам, можно объяснить различием их аффинностей связывания. В соответствии с этим, вероятно, могут быть выделены моноклональные антитела Группы I или Группы IV с более высокой аффинностью связывания с LTR, которые подобно моноклональным антителам Группы IIILTRактивирующий агент в присутствии LT-1/2. Клеточные линии гибридомы или ее субклоны, которые продуцируют моноклональные антитела против LTR , описанные выше, были депонированы 12 января 1995 г. Американской коллекцией типовых культур (АТСС)(Rockville, MD) в соответствии с Будапештским договором и имеют следующие номера допуска АТСС: Клеточная линияHB 11797 Все ограничения на доступность для публики вышеуказанных депозитов ATCC будут окончательно сняты после выдачи патента на эту заявку. Функция моноклональных антител IgM против LTR в качестве LTRактивирующих агентов Моноклональные антитела против LTR,которые имеют более двух антигенсвязывающих сайтов IgG, могут также функционировать в растворе как LTR-перекрестносшивающие агенты, и в соответствии с этим, они подпадают под определение LTR-активирующего агента настоящего изобретения. Антигенсвязывающие сайты анти-LTR mAb могут быть встроены в молекулы IgM (которые имеют десять антигенсвязывающих сайтов) с использованием стандартной техники рекомбинантных ДНК и гибридомной техники (пример 12). Альтернативно может быть осуществлен сбор и обогащение мышей (или другого животного) молекулами IgM, выделенными путем слияния методами гибридомной технологии после одной иммунизации антигеном. Одним из способов обогащения молекулами IgМ является иммунизация мышей, дефицитных по СD40 опосредованной передаче сигнала (Kawabe et al.,Immunity, 1, pp. 167-78 (1994); Xu et al., Immunity, 1, pp, 423-31 (1994. Эти мыши не могут эффективно продуцировать IgG, а поэтому, их ответ на антигенную стимуляцию будет обогащен изотипами IgM. Благодаря своей повышенной валентности антитела IgM против LTR могут способствовать эффективной агрегации молекул LTR на поверхности мембраны и тем самым усилению передачи сигнала LTR по сравнению со своими IgG-эквивалентами, имеющими два антигенсвязывающих сайта. Яркий пример повышенной эффективности мультивалентных антител в образовании рецепторных кластеров на 24 блюдался с использованием антител к Fasрецептору, где IgM-форма оказалась в высокой степени активной, тогда как нормальные бивалентные IgG не обнаружили какой-либо эффективности в растворе ( YoniharaYonihara, J.al., Int. Immunol., 6, pp. 1799-1806 (1994. Аналогичным образом, apo-1 mAb к Fasрецептору являются моноклональными антителами типа IgG3. Эти антитела представляют собой сильнодействующие цитотоксические агенты, действие которых основано на Fcвзаимодействиях, уникальных для подтиповIgG3 и приводящих к агрегации в более крупные поливалентные формы. Удаление Fсобласти приводит к образованию F(аb)2-формы,которая не может ассоциироваться в более крупные агрегаты и которая является неактивной (Dhein et al., J. Immunol. 149, pp. 3166-73(1992. По аналогии с вышеуказанным можно предсказать, что IgM-версии анти-LTR mAb окажутся сильнодействующими противоопухолевыми агентами. Моноклональные антитела против LTR ингибируют рост опухоли у мышей Способность LTR-активирующего агента, такого как анти-LТR mAb, ингибировать рост опухолевых клеток человека in vitro (примеры 6-8 и 13) может служить показателем его противоопухолевой активности in vivo. Эксперименты, проведенные на иммунодефицитных(SCID) мышах, показали, что моноклональные антитела против LTR (СВЕ 11) могут эффективно блокировать образование опухоли клетками аденокарциномы человека WiDr (пример 14; фиг.6). Через две недели после подкожной(s.c.) инокуляции клеток WiDr мышам наблюдалось образование опухолей измеримой величины. При обработке (i.p.) мышей моноклональными антителами СЕВ 11 одновременно с инокуляцией (s.c.) клеток WiDr, рост опухолей был в значительной степени блокирован (фиг.6 А). Противоопухолевое действие анти-LTR mAb СВЕ 11 усиливалось при добавлении интерферона-, однако и без добавления экзогенногоIFN-, у 8-16 животных опухоли совершенно отсутствовали, а у остальных животных наблюдались лишь небольшие узлы, которые не прогрессировали за два месяца. Мыши, обработанные лишь одними антителами СВЕ 11, показали за 30 дней результаты, аналогичные результатам группы СВЕ 11 + IFN-. Однако, в конечном счете у мышей, обработанных лишь одними СВЕ 11, наблюдался медленный рост опухолей. Различия между группами СВЕ 11 (+/-IFN-) и контрольными группами (физиологический раствор; лишь один IFN-; и контрольные анти-чел. LFA-3 mAb (1 Е 6) + IFN-) были статистически значимыми, однако среди контрольных групп статистически значимых различий не наблюдалось. Моноклональные антитела 1 Е 6 иCBE11 являются антителами типа IgG1. 1 Е 6mAb эффективно сенсибилизируют опухолевые клетки, но не блокируют рост опухолей. Таким образом, события, опосредованные комплементом или натуральными клетками-киллерами, не являются единственными факторами, которые лежат в основе противоопухолевой активности анти-LTR mAb CBE11. Эффективность моноклональных антителCBE11 в in vivo-ингибирования роста опухолей в отсутствие IFN- оказалась весьма неожиданной, поскольку для измеряемых LTRопосредованных цитотоксических эффектов invitro наблюдается зависимость от IFN-. В случае in vivo может иметь место некоторый кроссинговер мышиного IFN- в рецепторы IFNчеловека либо могут действовать другие механизмы. Анти-LTR mAb CBE11 могут также ингибировать рост уже развившейся опухоли у мышей (фиг.6 В). Мышам подкожно инокулировали клетки аденокарциномы человека WiDr(день 1), после чего опухоли оставляли на 15 дней для роста (пример 14). У животных, которым вводили i.p. один IFN-, или контрольные анти-чел.LFA-3 mAb (1 Е 6) + IFN-, опухоли продолжали увеличиваться в размерах в течение всего 7-недельного эксперимента. В противоположность этому опухоли, обработанные антиLT- -R mAb CBE11 (+ IFN- или отдельно),прекращали свой рост, а после введения 3 инъекций антитела CBE11 в течение 3-х недельного периода рост опухолей не наблюдался в течение 49 дней после инокуляции, т.е. за время проведения эксперимента вплоть до его окончания(фиг.6 В). Эти эксперименты показали, что моноклональные антитела против LTR, которые активируют передачу сигнала LTрецептором, могут эффективно ингибировать образование опухоли на ранних стадиях, и могут также блокировать рост уже развившейся опухоли на поздних стадиях онкогенеза in vivo. Эти эксперименты также показали, что введение одного LT-R-активирующего агента может быть эффективным для лечения опухолевых заболеваний или для предотвращения возможного прогрессирования, обострения или возникновения онкогенных патологических процессов (неоплазии) у восприимчивых животных. Для идентификацииLTRактивирующих агентов настоящего изобретения, которые отдельно или в комбинации способны ингибировать рост опухолевых клеток invivo, может быть использована методика, описанная в примере 14. При этом предполагается,что другие LTR-активирующие агенты,включая (но не ограничиваясь ими) агенты,идентифицированные в in vitro-анализе на цито 26 токсичность по отношению к опухолевым клеткам, могут обладать аналогичным действием invivo при введении их отдельно или в комбинации человеку или животным. Использование IFN- или других LTRактивирующих агентов Цитотоксическое действие гетеромерныхLT-/-комплексов и перекрестносшитых или множественных анти-LTR антител на опухолевые клетки усиливается в присутствии LT-R-активирующего агента, а в частности IFN-. Ранее было показано, что клетки кишечной аденокарциномы человека (НТ 29) являются чувствительными к передаче сигнала FasR (YoneharaYonehara, J. Exp. Med., 169, pp. 1747-56(1989. Количество LTR-активирующего агента, необходимое для усиления противоопухолевой активности гетеромерныхLT-/комплексов, анти-LTR Аb или других LT-R-активирующих агентов настоящего изобретения, зависит от типа обрабатываемых клеток или ткани, а также от способа обработки и может быть определено эмпирически с использованием стандартной методики. Принимая во внимание вышеуказанные факторы, концентрация или скорость "доставки"LTRактивирующего агента могут быть определены таким образом, чтобы они были эффективными при введении в комбинации с другим LTRактивирующим агентом. Альтернативно, могут быть приняты во внимание эндогенные LTR-активирующие агенты, такие как интерфероны, подобные IFN, которые могут быть продуцированы клетками или тканями, окружающими опухолевые клетки. Обычно эндогенный интерферон- продуцируется при вирусной инфекции, а также обнаруживается в тканях, окружающих опухоли (Dingeet al., Immunity, 1, pp. 447-56 (1994. В группу LTR-активирующих агентов настоящего изобретения входит любой агент,который способен индуцировать интерфероны,предпочтительно IFN-, и который потенцирует цитотоксическое действие гетеромерных LT/-комплексов и моноклональных антител против LTR на опухолевые клетки. Хотя обычно продуцирование IFN- стимулируется вирусной инфекцией, однако, уровни эндогенного IFN- могут быть увеличены и другими агентами (пример 10). Так, например, клинические эксперименты показали, что индуцирование интерферона может быть осуществлено путем обработки двухцепочечной РНК (дцРНК). В соответствии с этим можно утверждать, что полирибогуаниловая/полирибоцитидиловая кислота (poly-rG/rC ) и другие формы дцРНК являются эффективными индукторами интерферона(1992. Для увеличения уровней эндогенного интерферона могут быть также использованы стимулятор интерферона, полученный из Glycyrrhiza glabra (солодка голая) (Acharya et al.,Indian J. Med. Res., 98, pp. 69-74 (1993, и фармацевтические агенты, многие из которых предназначены для перорального введения. Такими индукторами интерферона являются: имихимод(1994. Некоторые из этих интерферониндуцирующих агентов были охарактеризованы как индукторы интерферонов типа I, таких какIFN-. Интерфероны типа I также действуют как LTR-активирующие агенты, но являются менее сильными, чем IFN-. Лечение с использованием LT-/комплексов и LTR-активирующих агентов Для лечения конкретного клинического заболевания композиции настоящего изобретения вводят в эффективной дозе. При определении состава предпочтительной фармацевтической композиции и терапевтически эффективной дозы в соответствии с настоящим изобретением следует принимать во внимание, например, состояние и вес пациента, продолжительность и толерантность пациента к данному лечению. Обычно, человек может выдержать дозу до 100-200 мкг/м 2 TNF перед тем, как будет зарегистрирован уровень высокой токсичности (Schiller et al., Cancer Res., 51, pp.1651-58 (1991. У мышей дозы порядка 1-5 мкг/мышь/день, введенные вместе с 5 х 104 единицами рекомбинантного чел. интерферона-, вызывали уменьшение первичной опухоли (Baikwill et al., CIBAMed. 167, pp. 1067-85 (1988. Исходя из относительной эффективности TNF и LT-1/2, в цитолитическом анализе НТ 29, было установлено,что интервал эффективных терапевтических доз для LT-1/2 составляет приблизительно 5-25 мкг/мышь/день. Если экстраполировать эти дозы для человека, то можно ожидать, что дозыLT-1/2, вводимые в комбинации с LTRактивирующим агентом, таким как IFN-, должны составлять, по крайней мере, 1 мг/м 2. Исторически IFNтерапия проводилась либо при максимально толерантных дозах в пределах 100-250 мкг/м 2, либо при "иммуномодуляторных" дозах в пределах 10-25 мкг/м 2 (см. например, Корр et al., J. Immunother., 13, pp.18190 (1993. Проводилась комбинированная терапия с использованием интерферонов двух типов при дозах 4 х 106 ед./м 2 IFN- и приблизительно 28 250 мкг/м 2 IFN- (Niederle et al., Leuk. Lymphoma, 9, pp. 111-19 (1993. Ожидается, что подходящей отправной точкой для оптимизации терапевтических доз могут служить промежуточные дозы, составляющие около 25-100 мкг/м 2 INF- в комбинации с гетеромерными комплексами LT-/ или очищенными антителами, направленными против LTR и описанными в настоящей заявке. Введение гетеромерныхLT-/комплексов и перекрестносшитых анти-LTR антител настоящего изобретения, включая выделенные и очищенные формы антител и комплексов, а также их соли или фармацевтически приемлемые производные, может быть осуществлено с использованием любых стандартных методов, которые обычно применяются для введения агентов, обладающих противоопухолевой активностью. Фармацевтические композиции, используемые в такой терапии, также могут быть получены в различных формах. Такими формами являются, например, твердые, полутвердые и жидкие лекарственные препараты, такие как таблетки, драже, порошки, жидкие растворы или суспензи суппозитории, и растворы для вливаний и инъекций. Выбор предпочтительной формы зависит от способа введения и терапевтического применения. При этом может быть использовано пероральное, парентеральное,подкожное и внутривенное введение, а также введение в очаг поражения и местное применение. Так, например, гетеромерные LT-/комплексы, IFN- и анти-LTR антитела могут быть введены в стерильные изотонические композиции с добавлением или без добавления кофакторов, стимулирующих поглощение лекарственного средства или обеспечивающих его стабильность. Эта композиция является предпочтительно жидкой, но может быть также изготовлена и в виде лиофилизованного порошка. Так, например, LT-комплексы и/или анти-LT-R антитела и IFN- могут быть разведены буферным составом, содержащим 5,0 мг/мл моногидрата лимонной кислоты, 2,7 мг/мл тринатрийцитрата, 41 мг/мл маннита, 1 мг/мл глицина и 1 мг/мл полисорбата 20. Этот раствор может быть лиофилизован, помещен в морозильную камеру для хранения, а затем, непосредственно перед введением, он может быть разбавлен стерильной водой для инъекций (USP). Кроме того, предпочтительно, если композиции содержат стандартные фармацевтически приемлемые носители, хорошо известные специалистам (см., например, Remington' Pharmaceutical Sciences, 16th Edition, 1980, Mac Publishing Company). Такими фармацевтически приемлемыми носителями могут быть другие лекарственные агенты, носители, генетические носители, адъюванты, наполнители и т.п., на 29 пример сывороточный альбумин человека или препараты плазмы. Указанные композиции предпочтительно изготавливают в виде унифицированной дозы, которую обычно вводят один или несколько раз в день. Фармацевтические композиции настоящего изобретения могут быть также введены с использованием микросфер, липосом, других систем доставки с применением микрочастиц или препаратов пролонгированного высвобождения,помещенных вблизи пораженных тканей или как-нибудь иначе связанных с пораженными тканями или кровотоком. Подходящими примерами носителей для пролонгированного высвобождения являются полупроницаемые полимерные матрицы, изготовленные в виде изделий определенной формы, таких как суппозитории или микрокапсулы. Такими имплантируемыми или микрокапсулярными матрицами для пролонгированного высвобождения являются полилактиды (патент США 3 773 319; EP 58 481),сополимеры L-глутаминовой кислоты и гаммаэтил-L-глутамат (Sidman et al., Biopolymers, 22,pp. 547-56 (1985; поли(2-гидроксиэтилметакрилат) или этиленвинилацетат (Langer etIFN-, могут быть получены хорошо известными методами (см., например, DE 3 218 121; Epstein et al., Proc. Natl .Acad. Sci. U.S.A., 82, pp. 3688-92 (1985); Hwang et al., Proc. Natl.Acad. Sci.U.S.A., 77, pp. 4030-34 (1980); патент США 4 485 045 и 4 544 545). Обычно липосомы представляют собой небольшую (около 200-800 Ангстрем) везикулу с односложной мембраной,в липидный состав которой входит более чем 30 М % холестерина. Содержание холестерина выбирают для регуляции оптимальной скорости высвобождения LT-комплекса и/или анти-LT-R антител и IFN-. Гетеромерные LT-/-комплексы и антиLT- -R антитела настоящего изобретения могут быть также связаны с липосомами, содержащими другие LTR-активирующие агенты, химиотерапевтические агенты или IFN- в дополнение в IFN-, обычно обнаруживаемому в области локализации опухоли. Связывание LTкомплексов и анти-LTR антител с липосомами может быть осуществлено с помощью любого известного перекрестносшивающего агента,такого как гетеробифункциональные перекрестносшивающие агенты, которые широко используются для связывания токсинов или химиотерапевтических агентов с антителами в целях обеспечения направленной доставки препарата к ткани-мишени. Конъюгирование с липосомами может быть также осуществлено с использованием углеводнаправленного перекрестносшивающего реагента, гидразида 4-(4 30 малеимидофенил) масляной кислоты (МРВН)(Duzgunes et al., J. Cell. Biochem. Abst., Suppl. 16E 77 (1992. Преимущества терапевтических композиций, основанных на активации LTрецептора Противоопухолевая терапия, основанная на активации LTрецептора, имеет несколько преимуществ. LTR связывается с гетеромерными LT-/-комплексами с высокой степенью аффинности в /-карманах и с более низкой степенью аффинности в /-карманах, созданных на стыке между субъединицами LT- и LT. В противоположность этому TNF-рецепторы связываются с гетеромернымиLT-/комплексами с высокой степенью аффинности только в /-карманах. В соответствии с этим,очищенные LT-1/2-комплексы связываются с высокой аффинностью с LTрецептором между смежными LTсубъединицами, но они не содержат /-карманы, а поэтому они не будут перекрестно активировать передачу сигнала через TNF-рецепторы. Таким образом, гетеромерные LT-/ комплексы настоящего изобретения не будут стимулироватьTNFассоциированные воспалительные реакции. Введение LT-1/2 даже при относительно высоких уровнях не приводит к изменению эндотелиальных клеток, ассоциированному с воспалительными реакциями. Исходя из этих соображений, можно ожидать, что использование фармацевтических композиций и методов лечения, основанных на активации LTрецептора,позволит решить проблему, связанную с возникновением побочных эффектов в результате активации каскада воспалительных реакций,наблюдаемых при введении TNF.LT-1/2 человека связывается с мышиным LTR, в основном так же хорошо, как и сLTR человека. Инъекция 100 мкг человеческого LT-1/2 на мышь не является летальнойLTR во всем организме животного не приводит к явной токсичности, наблюдаемой в аналогичных экспериментах с активацией FаR или р 60 TNF-R. Использование специфических моноклональных антител про-LTрецептора или комбинации антител в целях стимуляции передачи сигнала у человека может иметь некоторые преимущества по сравнениию с обработкой гетеромерными LT-/-комплексами. Терапия с использованием антител против рецептора является более избирательной, чем лечение с использованием лиганда. Кроме того, рекомбинантные формы моноклонального анти-LTR антитела легче конструировать и продуцировать в больших количествах, чем растворимые гетеромерные LT-/-комплексы. При этом предусматривается, что моноклональные антитела и гетеромерные LT-/ 31 комплексы должны вводиться людям с опухолевыми заболеваниями в сочетании со стандартной противоопухолевой терапией (т.е., лучевой терапией и химиотерапией). Комплексная терапия путем активации LTрецептора в сочетании со стандартной химиотерапией может оказаться исключительно эффективной для индуцирования противоопухолевого эффекта, который с большей вероятностью будет способствовать удалению онкогенных клеток из организма пациента, чем это ожидается с использованием лишь одной стандартной противоопухолевой терапии. Кроме того, этот метод, по всей вероятности, будет давать лишь относительно незначительное число побочных эффектов, а поэтому он может быть применен в полупрофилактических целях, например, для предотвращения возможного метастазирования опухоли, либо для лечения пациентов из семей с генетической предрасположенностью к некоторым видам рака. Ниже приводятся примеры, иллюстрирующие гетеромерные LT-/-комплексы и моноклональные антитела против LTR настоящего изобретения, а также методы, используемые для их характеризации. Эти примеры приводятся лишь в целях иллюстрации и не должны рассматриваться как некое ограничение изобретения, объем которого ограничен лишь формулой изобретения. Пример 1. Получение супернатантов от бакуловирусинфицированных клеток насекомых,содержащих LT-/-формы. Рекомбинантный бакуловирус, кодирующий либо полноразмерный LT-, либо секретированную форму LT-, получали, как описано в работе Crowe и др. (Science, 264, pp. 707-710(1994. Клетки пяти высших насекомых (Invitrogen, San Diego, СА) инокулировали при плотности 2 х 105 кл./мл в 7,2 л бессывороточной среды SF 900-11 (Gibco). Через 48 ч, когда культура достигала плотности 1,8 х 106 кл./мл, ее инфицировали 150 миллилитрами (3 х 108 б.о.е./мл) LT- и 300 миллилитрами LT-бакуловирусного маточного раствора. Через 2 дня культуру собирали и клеточный дебрис удаляли путем центрифугирования. После добавления EDTA и PMSF (с конечной концентрацией 1 мМ EDTA и 150 мкМ PMSF), осветленный супернатант концентрировали (до 10-кратного уменьшения объема) путем ультрафильтрации с использованием спирального картриджаSIYM10 (Amicon). Концентрат разделяли на шесть 120-миллилитровых порций и до очистки аликвоты хранили при -70 С. Пример 2. Получение растворимых LT-рецепторов в виде гибридов с Fc-областью иммуноглобулина. Внеклеточный домен LTR до трансмембранной области амплифицировали из кДНКклона с помощью PCR -реакции с использова 32 нием праймеров, которые вводили сайты рестриктирующих ферментов NotI и Sall на 5'- и 3'концы, соответственно (Browning et al., J. Immunol., 154, pp. 33-46 (1995. Амплифицированный продукт разрезали ферментамиSall-Not I-фрагментом, кодирующим Fс-область иммуноглобулина IgG1 человека. Полученный вектор содержал ген дигидрофолатредуктазы и ген LTR-Fc-химеры, регулируемых отдельными промоторами. Этот вектор вводили вdhfr-клетки СНО путем электропорации и метотрексат-резистентные клоны выделяли с использованием стандартной техники. LTR-Fc секретировался в среду, и для отбора клеточных линий, продуцирующих самые высокие уровни этого химерного белка, использовали анализELISA. Клеточную линию с высоким уровнем продуцирования этого белка культивировали до получения большого количества этих клеток, и кондиционированную среду собирали. Очищенный белок выделяли с помощью аффинной экспресс-хроматографии на белок А-Сефарозе. Пример 3. Аффинная очистка LT-1/2 с использованием TNF-R и LTR. Для получения смолы для аффинной очистки LT-форм, очищенные препараты LTR-Fc(Crowe et al., Science, 264, pp. 707-10 (1994 иммобилизировали на CNBr-сефарозе (Pharmacia) при 5 мг/мл смолы, в основном в соответствии с инструкциями производителя. Перед использованием смолу пропускали через один цикл элюции. Часть (120 мл) SIY10-концентрата пропускали через две последовательные колонки с p60-TNF-R-Fс, которые связываются с LTи LT-2/1. Сквозной поток, который содержалLT-1/2 и LT-, пропускали через колонку сLTR-Fc. Колонку промывали 5 объемами каждого из PBS, PBS с 0,5 М NaCl и PBS, а затемLT и LT-2/1-комплексы элюировали 25 мМ фосфатом натрия, 100 мМ NaCl, рН 3,5. Фракции элюции сразу нейтрализовали 1/20 объема 0,5 М фосфата натрия (рН 8,6) и хранили на льду. Фракции, содержащие белок, идентифицировали по оптической плотности при 280 нм, пиковые фракции собирали и пулы элюции с колонки анализировали с помощью ДСНПААГ, окрашенного кумасси бриллиантовым голубым. После элюирования, как описано выше, получали очищенный LT-1/2 с чистотой более 95%. Пример 4. Характеризация очищенных лигандов LT-1/2. Для того чтобы установить, происходит ли образование тримеров и присутствуют ли агрегаты, определяли размер фракций, полученных,как описано в примере 3, с помощью вытеснительной гель-хроматографии. Для разделения по размерам (с помощью гель-фильтрации (BioRad)(LT-3, LT-2/1 и LT1/2) использовали колонку TSK G3000 swx2 при скорости потока 0,5 мл/мин. На фиг.1 А показано, что очень немногие из LT-1/2-тримеров (если они присутствовали) обнаруживают себя как высокомолекулярные агрегаты. По сравнению со стандартами все три формы были тримерными (т.е., около 50-60 кДа). Исходя из тримерной структуры полученных лигандов, стехиометрию LT LT в очищенных LT-1/2- и LT- 2/1-фракциях оценивали либо путем денситометрии окрашенных кумасси гелей, либо путем анализа высоты двух пиков, полученных в результате проведения обращенно-фазовой ВЭЖХ на С 4. Оба измерения подтверждали идентичность фракций,элюированных с аффинных колонок, как описано выше. Чистоту препаратов дополнительно оценивали с помощью ионообменной хроматографии с использованием оборудования BioCAD и слабой ионообменной смолы при нескольких различных буферных системах для получения рНкарт LT-1/2 и LT-2/1. Этот метод обнаруживает наилучшую способность к точному удерживанию и разделению трех тримеров, введенных в колонку с POROS СМ (карбоксиметил) при скорости пропускания 5 мл/мин с использованием 16,66 мМ MES , 16,66 мМ HEPES,16,66 мМ натрий-ацетатного буфера (рН 6,5) и с элюированием градиентом 1 М NaCl, 20 колоночными объемами. Хроматограммы (BioCAD)LT-1/2 и LT-2/1-комплексов показаны на фиг.1 В. Каждый тример LT-3, LT-2/1 и LT1/2, элюированный при различных концентрациях соли, не обнаруживал перекрестной контаминации более чем 1-2% в различных препаратах. Пример 5. Цитолиз клеток аденокарциномы человека НТ 29, растворенных LT-1/2 комплексами. НТ 29-цитолитический анализ был описан ранее (BrowningRibolini, J. Immunol, 143,pp.1859-67 (1989) ). В типичном анализе были получены серийные разведения LT-1/2 (и других используемых цитокинов) в 0,5 мл в 96 луночных планшетах и добавляли 5000 трипсинизированных клеток НТ 29-14 в 0,05 мл среды,содержащей 0 или 80 ед./мл (антивирусных единиц) интерферона- человека. Клетки НТ 29 получали от субклона исходной линии НТ 29(депонированной в АТСС), которая является более гомогенной. Все результаты, полученные в этих анализах, могут также наблюдаться с использованием оригинальной (полученной из АТСС) линии НТ 29. Через 3-4 дня измеряли митохондиальное восстановление красителяMТТ следующим образом: добавляли 10 л МТТ и через 3 ч восстановленный краситель растворяли 0,09 миллилитрами изопропанола с 10 мМ НС 1, после чего определяли 0.П. при 550 нм. 34 Растворимые формы рецепторов, полученные как описано выше или очищенные IgG человека,добавляли в 10 мкл перед добавлением клеток, в результате чего получали конечную концентрацию 5 мкг/мл. На фиг.2 А проиллюстрирован цитолиз клеток НТ 29 путем обработки моноклональным антителом СН-11, направленным против Fasрецептора (которое стимулирует передачу сигнала, опосредованную Fas-рецептором); TNF,LT-3, LT-1/2 и лигандами LT-2/1 в сочетании с IFN-. Визуальная оценка клеток, обработанных LT-1/2, показала, что этот агент осуществляет цитолиз клеток, а не только блокирует пролиферацию клеток. В отсутствиеIFN-, этого эффекта не наблюдалось, что свидетельствует о необычной способности IFNвлиять на интерпретацию клетками передачи сигнала от TNF-семейства рецепторов. Исходя из количественного определения противовирусной активности, было установлено, что эффективность интерферонов- и - в 100 раз меньше,чем эффективность интерферона-. На фиг.2 В показано, что ингибированиеLTR-Fc, а не р 60-TNF-R-Fc, что свидетельствует о том, что цитотоксичность является специфичной к LT-1/2. Тот факт, что р 60-TNF-RFc не ингибирует цитолиз, указывает на то, что цитотоксическая активность LT-1/2 не может быть объяснена лишь контаминацией LT- (которая, как известно, составляет менее 1%). Пример 6. Моноклональные антитела против LTрецептора потенцируют цитолиз клеток НТ 29 LT-1/2-комплексами. Цитолитический анализ осуществляли как описано в примере 5 за исключением того, что к клеткам при 2-х конечной концентрации добавляли IFN- и моноклональные антитела противLTR (серии 0,01 - 1000 нг/мл), а затем в лунки, содержащие разведенный LT-1/2, добавляли 50 мкл клеточного раствора. Рост клеток оценивали как описано в примере 5. На фиг.3 показаны различные действия двух различных моноклональных антител против LTR, обусловленные их способностью потенцировать цитотоксическую активность LT-1/2. На фиг.3 А показано, что моноклональные антителаCDH10 против LTR потенцируют цитотоксическую активность LT-1/2 дозозависимым способом. На фиг.3 В показано действие другого моноклонального антитела против LTR,BDA8, в том же самом анализе. Моноклональное антитело BDA8 ингибирует цитотоксическую активность LT-1/2 вместо того, чтобы потенцировать гибель опухолевых клеток. Пример 7. Иммобилизованные моноклональные антитела против LTR могут вызвать цитолиз опухолевых клеток НТ 29. Для иммобилизации моноклональных антител против LTR на пластиковой поверхности 96-луночные культуральные планшеты сенсибилизировали 50 микролитрами 10 мкг/мл козьих поликлональных антител против мышиного Fc ( Jackson ImmunoResearch), затем промывали и блокировали 5% FCS в PBS с последующим осуществлением захвата указанных анти-LTR mAb и еще одной промывкой. Клетки НТ 29 засевали вmAb-сенсибилизированные лунки, и проводили цитолитический анализ как описано в примере 5. На фиг.4 А проиллюстрировано цитотоксическое действие иммобилизованных моноклональных анти-LTR антител BDA8 и CDH10 на клетки НТ 29. Каждое отдельное mAb при его иммобилизации на поверхности оказывало цитолитическое действие на опухолевые клетки. На фиг.4 В показано, что те же самые моноклональные антитела BDA8 и CDH10, протестированные отдельно в растворе, не оказывали цитотоксического действия, а поэтому можно сделать вывод,что цитолитическая активность отдельного моноклонального анти-LTR антитела in vitro вероятно обусловлена его иммобилизацией. Пример 8. Комбинация моноклональных анти-LTR антител в растворе, направленных против различных эпитопов, вызывает цитолиз клеток НТ 29. Рост клеток НТ 29 оценивали методом,описанным в примере 5, за исключением того,что питательная среда содержала либо одно,либо два анти-LTR mAb. В табл. 1 проиллю Группа 36 стрировано действие на клетки НТ 29, наблюдаемое в случаях включения в раствор различных анти-LTR mAb (т.е., не иммобилизованных на пластике антител). Анти-LTR mAb могут быть разделены на группы I-IV в соответствии с их относительной способностью "работать" в комбинации друг с другом в НТ 29 цитолитическом анализе. Результаты, полученные для анти-LTR mAb в цитолитических анализах, соответствовали данным связывания с рецептором, что дает основание предположить,что указанные моноклональные антитела в каждой отдельной группе распознают разные эпитопы LTрецептора. Таблиц 1. Комбинации растворимых антиLTR mAb являются цитотоксичными по отношению к клеткам аденокарциномы человека НТ 29. Анти-LTR mAb были разделены на группы I, II, III и IV, исходя из действия в комбинации друг с другом на клетки НТ 29 в цитолитическом анализе. Плюсы (+) означают относительный уровень цитолитического действия комбинации mAb на клетки НТ 29 в присутствии 80 ед./мл IFN-; nr = некорректная комбинация; На фиг.5 А-1 показана количественная оценка действия всех участвующих в НТ 29 цитолитическом анализе характерных попарных комбинаций анти-LTR mAb, направленных против различных эпитопов LTR. На фиг.5 А проиллюстрировано цитотоксическое действие антител ВНА 10 и СВЕ 11; на фиг.5 В проиллюстрировано действие антител CDH10 и CВЕ 11, а на фиг.5 С - действие антител CDH10 и AGH1,взятых отдельно и в комбинации. На фиг.5D проиллюстрировано цитотоксическое действие комбинации моноклональных антител CDH10 иAGH1 по отношению к другой опухолевой клеточной линии, называемой WiDr. В табл.2 систематизированы характеристики характерных моноклональных анти-LT-R антител настоящего изобретения. Таблица 2. Суммарная НТ 29-цитотоксичность мышиных моноклональных антител против LT--R человека Группа+/ ингибирует ингибирует смешанное действие смешанное действие потенцирует не оказывает действия не оказывает действия не оказывает действияFACS- окрашивание клеток СНО, трансфецированных LTR Анализ для определения, блокирует ли антитело связывание растворимого рецептора с активированной Т-клеточной гибридомой 11-23. nd = не проводили.d Неустойчивое частичное ингибирование в некоторых анализах и отсутствие действия в других. Пример 9. Возможность использования эндогенного IFN- для обработки опухолевых клеток. Интерферон-, являющийся предпочтительным LTR-активирующим агентом настоящего изобретения, представляет собой цитокин, обладающий противоопухолевой активностью и хорошо переносимый человеком. Эндогенный IFN-, присутствующий в околоопухолевом пространстве, может иметь достаточно высокую концентрацию, чтобы функционировать как LTR-активирующий агент настоящего изобретения без добавления экзогенного IFN. Концентрация IFN- в околоопухолевом пространстве может быть установлена стандартными методами иммунохимии с использованием образцов ткани, взятых из области вблизи опухоли. Если эндогенная концентрация IFN- является достаточно высокой, чтобы продуциро вать противоопухолевую активность в комбинации с гетеромерными LT-/-комплексами или анти-LTR mAb настоящего изобретения (как было определено в цитолитическом анализе,описанном выше), то в этом случае в композициях или методах настоящего изобретения нет необходимости использовать IFN- в качестве второго LTR-активирующего агента. Пример 10. Индуцирование эндогенногоIFN- в качестве LTR-активирующего агента обработки опухолевых клеток. Соединения, которые могут индуцировать эндогенное продуцирование интерферонов, таких как IFN-, относятся к группе LTRактивирующих агентов настоящего изобретения. Так, например, интерфероны могут быть индуцированы путем обработки двухцепочечными РНК-молекулами, такими как полирибо 39(ро 1 у-G/С). Самкам мышей С 57/b16 (в возрасте 6-8 недель) может быть инъекцировано 18 мг (600 мг/кг) D-галактозамина в целях сенсибилизации мышей для усиления действия TNF и других противоопухолевых агентов. К очищенным LT1/2 (10-100 мкг) добавляли серию концентраций ро 1 у-G/С (Juraskova et al., Eur. J. Pharmacol.,221, pp. 107-11 (1992 в нейтральном физиологическом растворе и полученный раствор вводили мышам посредством внутрибрюшиннойLT-1/2 усиливается в присутствии двухцепочечной РНК poly- rG/rC. Аналогичным образом стимулятор интерферона, полученный из растения Glycyrrhizaglabra (Acharya et al., Indian J.Med. Res., 98, pp. 69-74 (1993, может быть введен внутривенно человеку в дозах 40-100 мл/день. Оптимальная доза, необходимая для активации LTR в присутствии либо гетеромерногоLT-/комплекса, либо анти-LTR антител, может быть определена эмпирически и зависит от таких факторов, как тип опухоли, а также способ и схема введения. Имихимод R-837 (Bernstein et al., Antiviralal., Vopr. Virusol., 39, pp. 125-28(1994 могут быть также введены в качестве LTRактивирующих агентов в сочетании с гетеромерными LT-/-комплексами, анти-LTR антителами или их комбинацией. В каждом случае предпочтительные способы введения и оптимальные дозы могут быть определены эмпирически с использованием опубликованных работ в качестве исходных данных для оптимизации стандартных клинических процедур. Пример 11. Переносимость мышами вводимых им инъекций человеческого LT-1/2. Самкам мышей С 57/b16 (в возрасте 6-8 недель), акклимированным в течение нескольких дней в лабораторных условиях, инъецировали(i.p.) 18 мг (600 мг/кг) D-галактозамина для сенсибилизации мышей к воздействию TNF и других противоопухолевых агентов. Затем животным внутрибрюшинно вводили либо человеческий TNF, либо LT-, либо LT-1/2. В табл. 3 представлены данные по выживанию обработанных животных через 24 ч после инъекции. Таблица 3 Агент Доза (мкг/ Число выживотное) живших животных Физиол. рас 4/4 твор чел. TNF 0,2 0/6 чел. TNF 1,0 0/2 40 чел. TNF 10 0/4 0,2 2/2 чел. LT1,0 2/2 чел. LT10 2/2 чел. LT-1/2 100 2/2 чел. LT-1/2 Пример 12. Конструирование рекомбинантного моноклонального антитела IgM, направленного против LTR. С помощью анализа на противоопухолевую цитотоксичность, описанного выше и проведенного с использованием стандартных моделей роста опухолей у иммунодефицитных мышей, анти-LTR IgG могут быть отобраны на подходящие свойства. Универсальные праймеры, которые гибридизируются с каждым из вариабельных доменов тяжелой и легкой цепей отобранных иммуноглобулинов IgG, направленных против LTR , могут быть использованы для получения ДНК вариабельного домена из РНК, выделенной из секретирующих клеток гибридомы с использованием стандартной методики проведения полимеразной цепной реакции с помощью обратной транскриптазы. Эта методика описана в специальной литературе(1989. Затем амплифицированные продукты встраивают в векторы, содержащие домены цепи СН 1, СН 2 и СН 3. Коэкспрессия двух цепей в одном хозяине приводит к сборке тяжелой и легкой цепей в пентамерную молекулу IgM. Эта молекула представляет собой химерную молекулу, состоящую из мышиных вариабельных областей, соединенных с человеческими константными областями. Альтернативно может быть использована РСR-техника для амплификации ДНК, кодирующей только натуральные антигенсвязывающие участки вариабельных областей. Затем амплифицированную ДНК встраивают в векторы, содержащие все последовательности IgG человека, за исключением реальных аминокислот, участвующих в связывании с антигеном. Такие конструкции называются "очеловеченными" антителами, и методика получения таких конструкций хорошо известна и подробно описана в литературе (например, WO 94/04679). Пример 13. Функция моноклональных антител IgM против LTR как LTRактивирующих агентов. Анти-LTR антитела IgM могут быть получены в рекомбинантной форме, как описано в примере 12. Альтернативно в качестве источника моноклональных анти-LTR антител IgM могут быть использованы полные мышиные иммуноглобулины IgM, выделенные методами гибридомной техники путем первичной иммунизации нормальных мышей или экстенсивной иммунизации мышей, дефицитных по СD40 41(1994. Анти-LTR mAb IgM являются значительно более эффективными в качестве LTRактивирующих агентов, чем их нормальные двухвалентные IgG-эквиваленты, о чем свидетельствует сравнение дозозависимых характеристик, проведенное с помощью НТ 29 цитолитического анализа в присутствии IFN-. Анти-LTR mAb IgM действуют как LTRактивирующие агенты при их иммобилизации и при их введении в растворе. Кроме того, по нашим ожиданиям эти антитела будут усиливать противоопухолевую активность гетеромерныхLT-/ -комплексов. Пример 14. Моноклональные антитела против LTR ингибируют рост опухолевых клеток человека у мышей SCID. Мышам Balb/c SCID (Jackson Labs, BarHarbor, ME) инъецировали подкожно (s.c.) в область спинки 1 х 106 трипсинизированных и промытых клеток аденокарциномы человекаWiDr в объеме 0,2 мл PBS. Инъецированные мышам клетки WiDr образовывали опухоли, и способность анти-LTR mAb ингибировать рост этих опухолей непрерывно контролировалась. В одной серии экспериментов одновременно с инокуляцией (s.c.) клеток WiDr проводили обработку мышей с использованием или без использования моноклональных анти-LT-R антител СВЕ 11, вместе или без IFN- человека(106 антивирусных единиц/мышь) (фиг.6 А). Антитела и IFN- вводили отдельно или вместе путем внутрибрюшинной инъекции (i.p.) в 0,2 мл. Контрольным мышам инъецировали лишь один физиологический раствор, лишь один IFN; или контрольное моноклональное антитело против LFA человека (1 Е 6) вместе с IFN-. Размер каждой образовавшейся опухоли измеряли через 30 дней после инокуляции. Объем опухоли (в см 3) вычисляли по радиусу опухоли, измеренному штангенциркулем в двух направлениях. Животные, обработанные моноклональными антителами СВЕ 11 или 1 Е 6, получали дозу 10 мкг/мышь или 50 мкг/мышь антител (фиг.6 А; кружки с точками в центре и чистые кружки,соответственно). В другой серии экспериментов мышам подкожно инокулировали клетки WiDr и этих мышей оставляли на 15 дней для развития опухолей, после чего их обрабатывали анти-LTRmAb СВЕ 11 (фиг.6 В). На 15-й день (перед обработкой антителом) средний объем опухоли у мышей составлял 0,076 см 3 со средним диаметром 0,53 см. Обработку группы мышей, состоя 42 щей из 12 животных, проводили путем инъекции (i.p.) анти-LTR и mAb СВЕ 11 (50 мкг) без или с IFN- (106 антивирусных единиц/мышь) в 0,2 мл. Инъекции повторяли еще три раза в течение трех недель. Контрольным группам (12 мышей на группу) инъецировали лишь один IFN- (106 антивирусных единиц на мышь) или 50 мкг контрольного моноклонального антитела против LFA-3 человека (1 Е 6) +IFN- (106 антивирусных единиц/мышь). Рост опухолей, зафиксированных на 15-й день, измеряли в течение периода времени от 15 до 49 дней после инокуляции опухолевых клеток. Результаты, представленные на фиг.6 В, были получены в "слепом" формате. Опухоли, обработанные моноклональным антителом СВЕ 11 без или с IFN-, прекращали свой рост. После трех инъекций mAb СВЕ 11 (+/- IFN-), введенных в течение трех недель, рост опухолей прекращался, по крайней мере, на 7 недель после инокуляции, т.е. вплоть до завершения эксперимента. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения или уменьшения прогрессирования, тяжести или эффектов неоплазии, включающий введение терапевтически эффективного количества гетеромерного комплекса лимфотоксина / в присутствии терапевтически эффективного количества антитела к рецептору лимфотоксинаи/или -интерферона. 2. Способ лечения или уменьшения прогрессирования, тяжести или эффектов неоплазии, включающий введение терапевтически эффективного количества антитела к рецептору лимфотоксинаи фармацевтически приемлемого носителя. 3. Способ лечения или уменьшения прогрессирования, тяжести или эффектов неоплазии, включающий стадию введения терапевтически эффективного количества перекрестносшитых антител к рецептору лимфотоксинав присутствии -интерферона и фармацевтически приемлемого носителя. 4. Фармацевтическая композиция, содержащая терапевтически эффективное количество антитела к рецептору лимфотоксина . 5. Фармацевтическая композиция, содержащая терапевтически эффективное количество антитела к рецептору лимфотоксинав отсутствие гетеромерного комплекса лимфотоксина
МПК / Метки
МПК: G01N 33/53, A61K 38/19
Метки: комплексы, против, противоопухолевых, рецептора, лимфотоксина, агентов, антител, качестве, лимфотоксина-бета
Код ссылки
<a href="https://eas.patents.su/26-96-kompleksy-limfotoksina-alfa-beta-i-antitel-protiv-receptora-limfotoksina-beta-v-kachestve-protivoopuholevyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Комплексы лимфотоксина альфа/бета и антител против рецептора лимфотоксина-бета в качестве противоопухолевых агентов</a>
Предыдущий патент: Cпособ получения железо-фосфатного покрытия.
Следующий патент: Композиция для защиты сельскохозяйственных культур
Случайный патент: Гидравлическая или пневматическая машина с вращающими лопатками