Соединения, ингибирующие активность семикарбазид-чувствительной аминооксидазы
Номер патента: 19167
Опубликовано: 30.01.2014
Авторы: Хорган Энн Вьет-Ан, Хиггинботтом Майкл, Сейвори Эдвард, Оливер Кэтрин
Формула / Реферат
1. Соединение формулы (I)
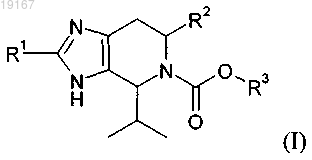
или его фармацевтически приемлемая соль, сольват, гидрат, геометрический изомер, таутомер, оптический изомер или N-оксид, в котором
R1 представляет собой водород;
R2 выбран из:
(a) водорода,
(b) -C(O)NR4AR4B и
(c) -С(О)О-С1-6-алкила;
R3 выбран из:
(a) гало-С1-6-алкила,
(b) С1-6-алкокси-С1-6-алкила,
(c) гало-С1-6-алкокси-С1-6-алкила,
(d) N(R4AR4B)-С1-6-алкила,
(e) фенил-С1-4-алкила,
(f) гетероарил-С1-4-алкила,
(g) фенилокси-С1-4-алкила,
(h) гетероарилокси-С1-4-алкила,
(i) гетероциклила и
(j) гетероциклил-С1-4-алкила,
в котором гетероарил выбран из пиридила, пиразинила, тиазолила и изоксазолила и в котором гетероциклил выбран из пирролидинила, тетрагидрофуранила и оксетанила;
в котором любой фенильный, гетероциклильный или гетероарильный остаток необязательно замещен одним или более заместителями, независимо выбранными из галогена и С1-4-алкила, и в котором каждый из R4A и R4B независимо выбран из:
(a) водорода и
(b) С1-6-алкила,
при условии, что, когда R1 и R2 представляют собой водород, R3 не является бензилом.
2. Соединение по п.1, в котором R2 выбран из водорода, -С(О)О-C1-3-алкила и -C(O)NR4A'R4B' и в котором R4A' и R4B' независимо выбраны из водорода и C1-2-алкила.
3. Соединение по п.1 или 2, в котором R3 выбран из гало-C1-2-алкила, гало-C1-2-алкокси-C1-2-алкила, ди(C1-2-алкил)амино-C1-2-алкила, фенил-C1-2-алкила, фенокси-C1-2-алкила, C5-6-гетероарил-C1-2-алкила, С5-6-гетероарилокси-C1-2-алкила, гетероциклила и гетероциклил-C1-2-алкила и в котором любой фенильный, гетероарильный или гетероциклильный остаток необязательно замещен одним или двумя заместителями, независимо выбранными из галогена и C1-2-алкила.
4. Соединение по п.1, где формула (I) определяет соединение, выбранное из
2,2,2-трихлорэтил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
2-хлор-2,2-дифторэтил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
3-хлорбензил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
4-хлорбензил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
пиридин-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
пиридин-3-илметил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
пиридин-4-илметил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
(5-хлорпиридин-2-ил)метил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
пиразин-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
бензил (4S,6S)-6-(аминокарбонил)-4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо-[4,5-с]пиридин-5-карбоксилата;
бензил (4S,6S)-4-изопропил-6-[(метиламино)карбонил]-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
5-бензил 6-метил (4S,6S)-4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5,6-дикарбоксилата;
2-феноксиэтил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
2-(4-хлорфенокси)этил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
(3S)-тетрагидрофуран-3-ил (4S)-4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
тетрагидрофуран-3-илметил-4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
(3-метилоксетан-3-ил)метил-4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
2-(диметиламино)этил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
(2R)-тетрагидрофуран-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
1,3-тиазол-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
(5-метилизоксазол-3-ил)метил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
[(2S)-1-метилпирролидин-2-ил]метил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо-[4,5-с]пиридин-5-карбоксилата;
(3R)-1-метилпирролидин-3-ил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
оксетан-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
2-(пиридин-3-илокси)этил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата;
2-(2,2,2-трифторэтокси)этил 4-изопропил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-с]пиридин-5-карбоксилата.
5. Фармацевтический состав, содержащий соединение, указанное в любом из пп.1-4 в качестве активного вещества, в комбинации с фармацевтически приемлемым разбавителем или носителем.
6. Фармацевтический состав, содержащий соединение, имеющее формулу (Ia)
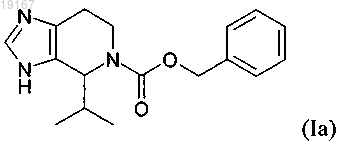
в качестве активного вещества, в комбинации с фармацевтически приемлемым разбавителем или носителем.
7. Применение соединения по любому из пп.1-4 в производстве лекарственного средства для лечения или профилактики воспаления, воспалительного заболевания, иммунологического или аутоиммунного нарушения.
8. Применение соединения, имеющего формулу (Ia)
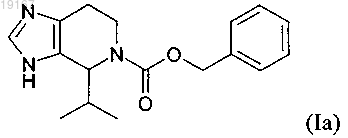
в производстве лекарственного средства для лечения или профилактики воспаления, воспалительного заболевания, иммунологического или аутоиммунного нарушения.
9. Применение по п.7 или 8, в котором воспаление или воспалительное заболевание или иммунологическое или аутоиммунное нарушение является артритом, включая ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит и псориатический артрит, синовитом, васкулитом, состоянием, связанным с воспалением кишечника, включая болезнь Крона, неспецифический язвенный колит, воспалительное заболевание кишечника и синдром раздраженного кишечника, атеросклерозом, рассеянным склерозом, болезнью Альцгеймера, сосудистой деменцией, воспалительным заболеванием легочной ткани, включая астму, хроническое обструктивное заболевание легких и синдром острой дыхательной недостаточности, фиброзным заболеванием, включая идиопатический легочный фиброз, сердечный фиброз и системный склероз, также известный как склеродермия, воспалительным кожным заболеванием, включая контактный дерматит, атопический дерматит и псориаз, синдромом системной воспалительной реакции, заражением крови, воспалительным и/или аутоиммунным состоянием печени, включая аутоиммунный гепатит, первичный биллиарный цирроз, алкогольную болезнь печени, склерозирующий холангит и аутоиммунный холангит, диабетом типа I или II и/или его осложнениями, хронической сердечной недостаточностью, застойной сердечной недостаточностью, ишемическим заболеванием, включая инсульт и травму ишемии, или инфарктом миокарда и/или его осложнениями.
10. Применение по п.7 или 8, в котором воспалительное заболевание является васкулитом.
Текст
СОЕДИНЕНИЯ, ИНГИБИРУЮЩИЕ АКТИВНОСТЬ СЕМИКАРБАЗИДЧУВСТВИТЕЛЬНОЙ АМИНООКСИДАЗЫ а также их фармацевтически приемлемым солям, сольватам, гидратам, геометрическим изомерам,таутомерам, оптическим изомерам или N-оксидам, являющимся ингибиторами активностиSSAO. Изобретение также относится к фармацевтическим композициям, содержащим данные соединения, а также к способам применения данных соединений при лечении и профилактике медицинских показаний, при которых ингибирование активности SSAO имеет благоприятный эффект, аналогичных воспалительным заболеваниям и иммунологическим нарушениям. Область техники, к которой относится изобретение Настоящее изобретение относится к новым 4,5,6,7-тетрагидроимидазол[4,5-с]пиридиновым соединениям формулы (I), являющимся ингибиторами активности семикарбазид-чувствительной аминоксидазы (SSAO) в сыворотки крови. Изобретение также относится к фармацевтическим композициям, содержащим данные соединения, а также к способам применения данных соединений при лечении и профилактике медицинских показаний, при которых ингибирование активности SSAO имеет благоприятный эффект, аналогичных воспалительным заболеваниям и иммунологическим нарушениям. Предпосылки создания изобретения Семикарбазид-чувствительная аминоксидаза (SSAO), также известная как сосудистый адгезивный белок-1 (VAP-1) или медьсодержащая аминоксидаза 3 (АОС 3), является представителем семейства ферментов медьсодержащих аминоксидаз (ЕС.1.4.3.6). Члены данного семейства обладают чувствительностью к ингибированию посредством семикарбазида, а также используют ион меди и кофактор протеинового топа хинона (TPQ) для окислительного дезаминирования с последующим получением альдегидов,перекиси водорода и аммиака посредством следующей реакции: Известные субстраты SSAO человека включают эндогенный метиламин и аминоацетон, а также некоторые ксенобиотические амины, аналогичные бензиламину [Lyles, Int. J. Biochem. Cell Biol. 1996, 28,259-274; Klinman, Biochim. Biophys. Acta 2003, 1647(1-2), 131-137; Mtyus et al., Curr Med. Chem 2004,11(10), 1285-1298; O'Sullivan et al., Neurotoxicology 2004, 25(1-2), 303-315]. Аналогично прочим медьсодержащим аминоксидазам результаты анализа последовательности ДНК и определения структуры указывают на то, что связанная с тканями SSAO человека представляет собой гомодимерный гликопротеин,состоящий из двух 90-100 кДа субъединиц, связанных с клеточной мембраной посредством одного Nтерминального спиралевидного домена мембраны [Morris et al., J. Biol. Chem. 1997, 272, 9388-9392; SmithCrystallogr. D Biol. Crystallogr. 2005, 61 (Pt 11), 1550-1562]. Активность SSAO была обнаружена в ряде различных тканей, включая гладкую мышечную ткань сосудистого и бессосудистого типов, эндотелий, а также жировую ткань [Lewinsohn, Braz. J. Med. Biol.SSAO был обнаружен в плазме крови. Данная растворимая форма SSAO обладает свойствами, аналогичными свойствам SSAO, связанной с тканями [Yu et al., Biochem. Pharmacol. 1994, 47, 1055-1059; Kurkijrvi et al., J. Immunol. 1998, 161, 1549-1557]. He так давно было обнаружено, что SSAO, циркулирующая в крови человека, и SSAO грызунов также происходят из связанной с тканями SSAO [Gktrk et al., Am.J. Pathol. 2003, 163(5), 1921-1928; Abella et al., Diabetologia 2004, 47(3), 429-438; Stolen et al., Circ. Res. 2004, 95(1), 50-57], в то время как SSAO, находящаяся в плазме/сыворотке крови других млекопитающих, также закодирована отдельным геном по названием АОС 4 [Schwelberger, J. Neural. Transm. 2007,114(6), 757-762]. Физиологическая роль данного широко распространенного фермента на данный момент точно не определена, однако имеющиеся данные свидетельствуют о том, что SSAO и ее продукты реакции могут выполнять некоторые функции в системах клеточных сигналов и клеточной регуляции. Например, последние данные указывают на участие SSAO в опосредованном GLUT4 поглощении глюкозы [EnriqueTarancon et al., J. Biol. Chem. 1998, 273, 8025-8032; Morin et al., J. Pharmacol. Exp. Ther. 2001, 297, 563572], а также дифференциации адипоцитов [Fontana et al., Biochem. J. 2001, 356, 169-111; Mercier et al.,Biochem. J. 2001, 358, 335-342]. Кроме того, SSAO принимает участие в воспалительных процессах, выполняя функции адгезивного белка для лейкоцитов [SalmiJalkanen, Trends Immunol. 2001, 22, 211-216;SalmiJalkanen, in "Adhesion Molecules: Functions and Inhibitiol" K. Ley (Ed.), 2007, p. 237-251], а также может принимать участие в формировании и обновлении матрикса соединительной ткани [Langford et al.,Cardiovasc. Toxicol. 2002, 2(2), 141-150; Gokturk et al., Am. J. Pathol. 2003, 163(5), 1921-1928]. Помимо этого недавно была обнаружена связь между SSAO и ангиогенезом [Noda et al., FASEB J. 2008, 22(8),2928-2935]. Ряд исследований с участием человека продемонстрировал повышенную активность SSAO в плазме крови человека при таких заболеваниях, как застойная сердечная недостаточность, сахарный диабет, болезнь Альцгеймера, а также при воспалении [Lewinsohn, Braz. J. Med. Biol. Res. 1984, 17, 223-256;Mtyus et al., Curr. Med. Chem. 2004, 11(10), 1285-1298; O'Sullivan et al., Neurotoxicology 2004, 25(1-2),303-315; del Mar Hernandez et al., Neurosci. Lett. 2005, 384(1-2), 183-187]. Механизмы данных изменений активности ферментов четко не определены. Предполагается, что реактивные альдегиды и перекись водорода, образуемые эндогенными аминоксидазами, способствуют прогрессированию сердечно-1 019167 сосудистых заболеваний, осложнений диабета и болезни Альцгеймера [Callingham et al., Prog. Brain Res. 1995, 106, 305-321; Ekblom, Pharmacol. Res. 1998, 37, 87-92; Yu et al., Biochim. Biophys. Acta 2003, 1647(12), 193-199; Jiang et al., Neuropathol. Appl. Neurobiol. 2008, 34(2), 194-204]. Кроме того, ферментативная активность SSAO способствует процессу экстравазации лейкоцитов в местах воспаления, где наблюдается значительная экспрессия SSAO на сосудистый эндотелий [Salmi et al., Immunity 2001, 14(3), 265-276;SalmiJalkanen, in "Adhesion Molecules: Functions and Inhibitiol" K. Ley (Ed.), 2007, p. 237-251]. В соответствии с представленными данными было выдвинуто предположение о терапевтическом значении ингибирования SSAO при профилактике осложнений диабета и воспалительных заболеваний [Ekblom,Pharmacol. Res. 1998, 37, 87-92; Salmi et al., Immunity 2001, 14(3), 265-276; Salter-Cid et al., J. Pharmacol.Exp. Ther. 2005, 315(2), 553-562]. Животные с нокаутным SSAO являются явно фенотипически нормальными, однако у данных животных наблюдается значительное снижение частоты появления воспалительной реакции в ответ на различные воспалительные стимулы [Stolen et al., Immunity 2005, 22(1), 105-115]. Помимо этого, ингибирование активности SSAO у животных дикого типа, а также у ряда животных моделей заболеваний человека (например, каррагинан-индуцированное воспаление лап, оксазолон-индуцированный колит, липополисахарид-индуцированное воспаление легких, коллаген-индуцированный артрит, эндотоксининдуцированный увеит) посредством применения антител и/или синтетических лекарственных средств способствовало снижению инфильтрации лейкоцитов, степени фенотипа заболевания, а также уровней воспалительных цитокинов и хемокинов [Kirton et al., Eur. J. Immunol. 2005. 35(11), 3119-3130; Salter-Cidet al., J. Pharmacol. Exp. Ther. 2005, 315(2), 553-562; McDonald et al., Annual Reports in Medicinal Chemistry 2007, 42, 229-243; SalmiJalkanen, in "Adhesion Molecules: Functions and Inhibition K. Ley (Ed.), 2007, p. 237-251; Noda et al., FASEB J. 2008 22(4), 1094-1103; Noda et al., FASEB J. 2008, 22(8), 2928-2935]. Данный противовоспалительный эффект, предположительно, не ограничен одним конкретным заболеванием или моделью заболевания, но может быть достигнут в разнообразных моделях воспалительных заболеваний, вызванных различными независимыми механизмами. Таким образом, SSAO может быть ключевым фактором, обеспечивающим контроль воспалительной реакции, вследствие чего ингибиторы SSAO с высокой долей вероятности могут оказаться эффективными противовоспалительными лекарственными средствами при лечении разнообразных заболеваний человека. Представленное изобретение относится к новым тетрагидроимидазол[4,5-с]пиридиновым производным, являющимся новым классом химически отличных ингибиторов SSAO, обладающих биологическими, фармакологическими и фармакокинетическими характеристиками, обеспечивающими применение данных ингибиторов с целью профилактики или лечения разнообразных воспалительных заболеваний человека и иммунологических нарушений. Предполагаемое терапевтическое действие представленного изобретения заключается в блокировании действия ферментов SSAO и, тем самым, снижении уровней провоспалительных ферментных продуктов (альдегиды, перекись водорода и аммиак), а также в снижении адгезивной способности иммуноцитов и соответственно степени их активации и экстравазации. Заболевания, при лечении которых подобная активность может являться терапевтически благоприятной, включают все заболевания, при которых иммуноциты играют значительную роль в процессах возникновения, развития или разрешения патологии (например, рассеянный склероз, артрит и васкулит). Патент WO 00/63208 раскрывает тетрагидроимидазол[4,5-с]пиридиновые производные, обладающие агонистической или антагонистической активностью по отношению к гистаминовым Н 3-рецепторам и предназначенные для лечения нарушений питания, ожирения, диабетов и воспаления. Патент ЕР 531874 содержит описание тетрагидроимидазол[4,5-с]пиридиновых производных, обладающих ингибирующей активностью по отношению к ангиотензину II, которые могут использоваться в качестве гипотензивных средств. Патент US 5091390 содержит описание тетрагидроимидазол[4,5-с]пиридиновых ингибиторов рецептора ангиотензина II, используемых при лечении нарушений ЦНС. В патенте GB 2028798 представлены тетрагидроимидазол[4,5-с]пиридиновые производные, предназначенные для получения противоязвенных и антихолинергических соединений. Патент WO 02/38153 раскрывает способы применения определенных тетрагидроимидазол[4,5-с]пиридиновых производных в качестве ингибиторовSSAO для лечения диабета и сосудистых осложнений. Раскрытие сущности изобретения Совершенно неожиданно было установлено, что ингибирующая активность тетрагидроимидазол[4,5-с]пиридиновых производных по отношению к SSAO значительно повышается в присутствии изопропиловой группы в 4 позиции данных соединений. Следовательно, подобные соединения обладают эффективностью при лечении или профилактике заболеваний, при которых ингибирование активностиSSAO имеет благоприятный эффект. В связи с этим рассматриваемые соединения могут быть потенциально полезны при лечении или профилактике воспалений, воспалительных заболеваний, а также иммунологических или аутоиммунных нарушений. Таким образом, изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, сольвату, гидрату, геометрическому изомеру, таутомеру, оптическому изомеру или N-оксиду, в которых(n) гетероциклил-C1-4-алкила,в котором любой арильный или гетероарильный остаток необязательно замещен одним или более заместителями, независимо выбранными из галогена, гидрокси, циано, нитро, CF3, C1-4-алкила, C1-4 алкокси и -NR4AR4B, а также в котором любой циклоалкильный или гетероциклильный остаток необязательно замещен одним или более заместителями, независимо выбранными из галогена, гидрокси, C1-4 алкила, C1-4-алкокси и -NR4AR4B; Каждый из R4A и R4B независимо выбраны из:(c) C1-6-ацила. В соответствии с предпочтительным вариантом осуществления изобретенияR2 предпочтительно выбран из водорода, -С(О)О-C1-6-алкила и -C(O)NR4AR4B, более предпочтительно R2 выбран из водорода, -С(О)О-С 1-3-алкила и -C(O)NR4A'R4B', в котором R4A' и R4B' независимо выбраны из водорода и С 1-2-алкила; в соответствии с наиболее предпочтительным вариантом осуществления изобретения R2 является водородом, -С(О)ОМе, -С(О)NH2 или -C(O)NHMe;R3 предпочтительно выбран из гало-C1-4-алкила, гало-C1-4-алкокси-C1-4-алкила, ди(C1-4-алкил)аминоC1-4-алкила, C6-10-арил-C1-4-алкила, C6-10-арилокси-C1-4-алкила, гетероарил-C1-4-алкила, гетероарилокси-C14-алкила, гетероциклила и гетероциклил-C1-4-алкила, в котором любой арильный, гетероарильный или гетероциклильный остаток необязательно замещен одним или двумя заместителями, независимо выбранными из галогена и C1-4-алкила. Более предпочтительно R3 выбран из гало-C1-2-алкила, гало-C1-2-алкокси-C1-2-алкила, ди(C1-2 алкил)амино-C1-2-алкила, фенил-C1-2-алкила, фенокси-C1-2-алкила, С 5-6-гетероарил-C1-2-алкила, С 5-6 гетероарилокси-C1-2-алкила, гетероциклила и гетероциклил-C1-2-алкила, а также в котором любой фенильный, гетероарильный или гетероциклильный остаток необязательно замещен одним или двумя заместителями, независимо выбранными из галогена и C1-2-алкила. В соответствии с наиболее предпочтительным вариантом осуществления изобретения R3 является 2,2,2-трихлорэтилом, 2-хлор-2,2-дифторэтилом, 2,2,2-трифторэтоксиэтилом, диметиламиноэтилом, бензилом, пиридинилметилом, пиразинилметилом, тиазолилметилом, изоксазолилметилом, феноксиэтилом,пиридинилоксиэтилом, тетрагидрофуранилом, тетрагидрофуранилметилом, пирролидинилом, пирролидинилметилом или оксетанилметилом, а также в котором любой фенильный, гетероарильный или гетероциклильный остаток необязательно замещен галогеном или метилом. Отдельные предпочтительные соединения формулы (I) включают соединения, выбранные из группы, состоящей из 2,2,2-трихлорэтил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; 2-хлор-2,2-дифторэтил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; бензил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; 3-хлорбензил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; 4-хлорбензил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; пиридин-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; пиридин-3-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; пиридин-4-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата;(3R)-1-метилпирролидин-3-ил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5 карбоксилата; оксетан-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; 2-(пиридин-3-илокси)этил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; а также 2-(2,2,2-трифторэтокси)этил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата. Дополнительным объектом настоящего изобретения является соединение формулы (I), предназначенное для применения в ходе терапии. Представленные выше соединения могут использоваться в качестве ингибиторов активности SSAO при лечении или профилактике состояний и заболеваний, при которых ингибирование активности SSAO имеет благоприятный эффект. Более конкретно, данные соединения полезны при лечении или профилактике воспаления, воспалительных заболеваний иммунологических или аутоиммунных заболеваний. В частности, считается, что соединения формулы (I) могут применяться при лечении или профилактике артрита (например, ревматоидного артрита, ювенильного ревматоидного артрита, остеоартрита и псориатического артрита), синовита, васкулита, а также заболеваний, связанных с воспалением кишечника (например, болезни Крона, неспецифического язвенного колита, воспалительного заболевания кишечника и синдрома раздраженного кишечника), атеросклероза, рассеянного склероза, болезни Альцгеймера, сосудистой деменции, воспалительных заболеваний легочной ткани (например, астмы, хронического обструктивного заболевания легких, а также синдрома острой дыхательной недостаточности),фиброзных заболеваний (включая идиопатический легочный склероз, сердечный фиброз и системный склероз (склеродермию, воспалительных кожных заболеваний (например, контактного дерматита, ато-4 019167 пического дерматита и псориаза), синдрома системной воспалительной реакции, заражения крови, воспалительных и/или аутоиммунных заболеваний печени (например, аутоиммунного гепатита, первичного биллиарного цирроза, алкогольной болезни печени, склеразирующего холангита, а также аутоиммунного холангита), диабета (инсулинозависимого или инсулинонезависимого) и/или его осложнений, хронической сердечной недостаточности, застойной сердечной недостаточности, ишемических заболеваний (например, инсульта и травмы ишемии), а также инфаркта миокарда и/или его осложнений. Считается, что соединения настоящего изобретения особенно полезны при лечении или профилактике васкулита, включая, помимо прочего, гигантоклеточный артериит, неспецифический аортоартериит,узелковый полиартериит, болезнь Кавасаки, некротический неинфекционный гранулематоз, синдром Черджа-Кросса, микроскопическую ангиопатию, пурпура Шенлейна-Геноха, криоглобулинемию, кожный лейкоцитокластический васкулит центральной нервной системы. Таким образом, изобретение включает применение указанных соединений при производстве лекарственных средств для лечения или профилактики указанных выше состояний и заболеваний. Изобретение также включает методы лечения или профилактики данных состояний и заболеваний, предусматривающие прием внутрь млекопитающими, включая человека, нуждающимися в данном лечении, эффективного количества соединения согласно вышеприведенному определению. Методы, описанные в данном патенте, включают методы, содержащие определение субъекта в качестве нуждающегося в определенном лечении. Определение субъекта в качестве нуждающегося в подобном лечении осуществляется на усмотрение самого субъекта или специалиста в области здравоохранения и может быть как субъективным (например, личное мнение), так и объективным (например, осуществляться на основании результатов испытаний или посредством методов диагностики). Представленные в других аспектах изобретения методы включают мониторинг реакции субъекта на принимаемые лекарственные средства. Подобный мониторинг может включать периодический отбор проб тканей, жидкостей, анализов, клеток, белка, химических маркеров, генетических материалов и т.д. субъекта в качестве маркеров или индикаторов схемы лечения. Другие методы предусматривают предварительное определение субъекта как нуждающегося в подобном лечении путем оценки соответствующего маркера или индикатора, определяющего применимость подобного лечения. В одном из примеров осуществления изобретение является методом мониторинга прогресса лечения. Метод включает этап определения уровня диагностического маркера (Маркера) (например, любой мишени или клетки любого типа, описанных в данном документе иподверженных изменению посредством описанного соединения) или диагностического показателя (например, результата теста или анализа) субъекта, страдающего от или подверженного воздействию описанного в данном документе нарушения или его симптомов, в предусматривающий прием субъектом количества указанного соединения, достаточного для лечения заболевания или его симптомов. Определенный в ходе метода уровень Маркера может сравниваться с известными уровнями Маркера, определенными у здоровых нормальных контрольных субъектов или у других страдающих от заболевания субъектов с целью определения статуса заболевания рассматриваемого субъекта. В соответствии с предпочтительными примерами осуществления изобретения второй уровень Маркера субъекта определяется в момент времени, наступивший позднее момента определения первого уровня, после чего оба уровня сравниваются для контроля развития заболевания или эффективности лечения. Согласно определенным предпочтительным примерам определения изобретения исходный уровень Маркера субъекта определяется до начала лечения субъекта в соответствии с настоящим изобретением; данный уровень Маркера затем может сравниваться с уровнем Маркера субъекта, определенным после начла лечения, с целью определения эффективности лечения. В соответствии с определенными примерами осуществления метода определение уровня Маркера или активности Маркера субъекта производится по меньшей мере один раз. Сравнение уровней Маркера,к примеру, с предыдущими или последующими результатами определения уровня Маркера этого же субъекта, другого субъекта или нормального субъекта может быть полезно для определения наличия желаемого эффекта проведения терапии в соответствии с изобретением и, следовательно, позволит сообразно ситуации осуществить изменение уровня применяемой дозировки. Определение уровней Маркера может осуществляться посредством любого подходящего метода отбора проб/анализа проявлений, известного в данной области или описанного в данном документе. Предпочтительным является предварительный отбор проб ткани или жидкости субъекта. Образцы подходящих проб включают пробы крови,мочи, ткани, клеток полости рта, а также волос, включая корни. Прочие варианты подходящих проб,предположительно, должны быть известны специалисту в данной области. Определение уровней белка и/или иРНК (например, уровней Маркера) в образце может осуществляться при помощи любого подходящего метода, известного в данной области, включая, помимо прочего, иммуноферментный анализ,твердофазный иммуноферментный анализ, методы введения радиоактивной метки/количественного анализа, методы блоттинга/хемилюминесценции, ПЦР в режиме реального времени и т.п. Определения Следующие определения используются в спецификации, а также в приложенной к ней формуле изобретения. Если не указано иное термин "C1-6-алкил" означает прямую или разветвленную алкильную группу,включающую от 1 до 6 атомов углерода. Для обозначения подгрупп, составляющих группу "C1-6-алкил",предусмотрены такие термины, как C1-5-алкил, C1-4-алкил, C1-3-алкил, C1-2-алкил, C2-6-алкил, С 2-5-алкил,C2-4-алкил, C2-3-алкил, C3-6-алкил, С 4-5-алкил и т.д. Примеры упомянутого "C1-6-алкила" включают метил,этил, n-пропил, изопропил, n-бутил, изобутил, сек-бутил, t-бутил, а также пентил и гексил с прямой и разветвленной цепью. Если не указано иное, термин "гало-C1-6-алкил" означает прямую или разветвленную C1-6-алкильную группу, включающую один или более атомов галогена. Термин "гало-C1-6-алкил" включает фтор-C1-6-алкил, хлор-C1-6-алкил, бром-C1-6-алкил и йод-C1-6-алкил. Примеры упомянутого "гало-C1-6-алкила" включают 2-фторэтил, фторметил, хлорметил, трифторметил, трихлорметил, 2,2,2 трифторэтил, 2,2,2-трихлорэтил и 2-хлор-2,2-дифторэтил. Если не указано иное, термин "гидрокси-C1-6-алкил" означает прямую или разветвленную C1-6 алкильную группу, атом водорода в составе которой замещен ОН. Примеры упомянутого "гидрокси-C1-6 алкила" включают гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил и 2-гидрокси-2-метилпропил. Термин "C1-6-алкокси" применяется в случае присоединения C1-6-алкильной группы к оставшейся части молекулы посредством атома кислорода и истолковывается соответствующим образом. Для обозначения подгрупп, составляющих группу "C1-6-алкокси", предусмотрены следующие такие термины, какC1-5-алкокси, C1-4-алкокси, C1-3-алкокси, C1-2-алкокси, C2-6-алкокси, C2-5-алкокси, C2-4-алкокси, C2-3 алкокси, C3-6-алкокси, С 4-5-алкокси и т.д. Примеры упомянутого "C1-6-алкокси" включают метокси, этокси, n-пропокси, изопропокси, n-бутокси, изобутокси, сек-бутокси, t-бутокси, а также пенктокси и гексокси с прямой и разветвленной цепью и т.д. Если не указано иное, термин "C1-6-алкокси-C1-6-алкил" означает прямую или разветвленную C1-6-алкоксигруппу, связанную с прямой или разветвленной C1-6 алкильной группой посредством атома кислорода указанной C1-6-алкоксигруппы. Типичные образцы данных групп включают метоксиметил и этоксиэтил. Если не указано иное, термин "гало-C1-6-алкокси-C1-6-алкил" означает C1-6-алкокси-C1-6-алкильную группу, в которой C1-6-алкоксигруппа замещена одним или более атомами галогена. Примеры указанного гало-C1-6-алкокси-C1-6-алкила включают 2,2,2-трифторэтоксиэтил и трифторметоксиэтил. Если не указано иное, термин "C1-6-ацил" означает карбонильную группу, присоединенную посредством входящего в ее состав атома углерода к атому водорода (например, формильная группа) или к прямой или развевленной C1-5-алкильной группе, в которой алкил соответствует указанному выше определению. Для обозначения подгрупп, составляющих группу "C1-6-ацил", предусмотрены такие термины, какC1-5-ацил, C1-4-ацил, C1-3-ацил, C1-2-ацил, C2-6-ацил, C2-5-ацил, С 2-4-ацил, C2-3-ацил, C3-6-ацил, C4-5-ацил и т.д. Типичные ацильные группы включают формил, ацетил, пропаноил, бутаноил, пентаноил, гексаноил. Если не указано иное, термин "C6-10-арил" означает моноциклическую или сочлененную бициклическую углеводородную кольцевую систему, содержащую от 6 до 10 кольцевых атомов, в которой по крайней мере одно кольцо является ароматическим. Примеры C6-10-арильных групп включают фенил,инденил, 2,3-дигидроинденил (инданил), 1-нафтил, 2-нафтил или 1,2,3,4-тетрагидронафтил. Если не указано иное, термин "C6-10-арил-C1-4-алкил" означает C6-10-арильную группу, непосредственно связанную с прямой или разветвленной C1-4-алкильной группой. Образцы подобных групп включают фенилметил(например, бензил) и фенилэтил. Если не указано иное, термин "C6-10-арилокси-C1-4-алкил" означает C6-10-арильную группу, непосредственно связанную с прямой или разветвленной C1-4-алкильной группой посредством мостикового атома кислорода. Образцы подобных групп включают феноксиметил и феноксиэтил. Если не указано иное, термин "гетероарил" означает моноциклическую или сочлененную бициклическую гетероароматическую кольцевую систему, содержащую от 5 до 10 кольцевых атомов, из которых один или более атомов не являются атомами углерода, а являются, например, атомами азота, серы или кислорода. Только одно кольцо системы должно быть ароматическим, а указанная гетероарильная группа может быть связана с оставшейся частью молекулы посредством атома углерода или азота любого из колец. Образцы гетероарильных групп включают фурил, пирролил, тиенил, оксазолил, изоксазолил,имидазолил, тиазолил, изотиазолил, пиридинил, пиримидинил, тетразолил, хиназолинил, индолил, индолинил, изоидолил, изоиндолинил, пиразолил, пиридазинил, пиразинил, хинолинил, хиноксалинил, тиадизолил, бензофуранил, 2,3-дигидробензофуранил, 1,3-бензодиоксолил, 1,4-бензодиоксолил, 2,3-дигидро 1,4-бензодиоксинил, бензотиазолил, бензимидазолил, бензотиадиазолил, бензотриазолил и хроманил. Если не указано иное, термин "гетероарил-C1-4-алкил" означает гетероарильную группу, непосредственно связанную с прямой или разветвленной C1-4-алкильной группой посредством атома углерода или азота. Образцы подобных групп включают пиридинилметил, пиразинилметил, тиазолилметил, а также изоксазолилметил. Если не указано иное, термин "гетероарилокси-C1-4-алкил" означает гетероарильную группу, непосредственно связанную с прямой или разветвленной C1-4-алкильной группой посредством мостикового атома кислорода. Образцы подобных групп включают пиридинилоксиэтил и пиразинилоксиметил. Если не указано иное, термин "C3-8-циклоалкил" означает моно- или бициклическую, насыщенную или частично ненасыщенную углеводородную кольцевую систему, содержащую от 3 до 8 атомов углерода. Бициклическая кольцевая система может быть как сочлененного, так и мостикового типа. В циклоалкильной кольцевой системе мостикового типа два несмежных атома углерода моноциклического кольца связаны алкиленовым мостиком, содержащим от 1 до 3 дополнительных атомов углерода. Образцы указанного C3-8-циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил, циклогептил, циклогептенил и циклооктил, а также бицикло[2.2.1]гептил, бицикло[2.2.2]октил и бицикло[3.2.1]октил. Для обозначения подгрупп, составляющих группу "С 3-8-циклоалкил", предусмотрены такие термины как C3-7-циклоалкил, С 3-6-циклоалкил, С 3-5-циклоалкил, С 3-4-циклоалкил, С 4-8 циклоалкил, С 4-7-циклоалкил, С 4-6-циклоалкил, С 4-5-циклоалкил, С 5-8-циклоалкил, С 5-7-циклоалкил, С 5-6 циклоалкил, С 6-8-циклоалкил и С 6-7-циклоалкил. Если не указано иное, термин "С 3-8-циклоалкил-С 1-4 алкил" означает С 3-8-циклоалкильную группу, непосредственно связанную с прямой или разветвленной С 1-4-алкильной группой. Образцы С 3-8-циклоалкил-С 1-4-алкильных групп включают циклопентилметил и циклогексилэтил. Если не указано иное, термин "гетероциклил" или "гетероциклическое кольцо" означает неароматическую полностью насыщенную или частично ненасыщенную, предпочтительно полностью насыщенную, моноциклическую кольцевую систему, включающую от 4 до 7 кольцевых атомов, по крайней мере один из которых является гетероатомом, подобным О, N или S, в то время как остальные кольцевые атомы являются атомами углерода. Образцы гетероциклических колец включают пиперидинил, тетрагидропиранил, тетрагидрофуранил, оксетанил, азепинил, азетидинил, пирролидинил, морфолинил, имидазолинил, имидазолидинил, тиоморфолинил, пиранил, диоксанил, пиперазинил, гомопипераззинил и 5,6 дигидро-4 Н-1,3-оксазин-2-ил. В случае присутствия атом серы может иметь окисленную форму (например, S=O или O=S=O). Образцы гетероциклических групп, содержащих атом серы в окисленной форме,включают 1,1-диоксидотиоморфолинил и 1,1-диоксидоизотиазолидинил. Если не указано иное, термин "гетероциклил-C1-4-алкил" означает гетероциклическое кольцо, непосредственно связанное с прямой или разветвленной C1-4-алкильной группой посредством атома углерода или азота указанной кольцевой системы. Образцы гетероциклил-C1-4-алкильных групп включают оксетанилметил, тетрагидрофуранилметил и пирролидинилметил. Термин "галоген" означает фтор, хлор, бром или йод. Термин "гидрокси" означает -ОН радикал. Термин "нитро" означает -NO2 радикал. Термин "циано" означает -CN радикал. Термин "необязательный" или "необязательно" означает, что описанное далее явление или обстоятельство может, но не обязательно должно произойти, а также означает, что описание включает примеры, в которых явление или обстоятельство имеет место, и примеры, в которых данное явление или обстоятельство отсутствует. Термин "фармацевтически приемлемый" означает полезность при получении фармацевтической композиции, которая, как правило, является безопасной, нетоксичной, и не является нежелательной с биологической или любой другой точки зрения. Данный термин также включает полезность при применении для лечения человека, а также в ветеринарии. Термин "лечение", используемый в тексте данного патента, включает профилактику указанного нарушения или состояния либо же улучшение или ликвидацию нарушения после его обнаружения. Термин "эффективное количество" означает количество соединения, обеспечивающее терапевтический эффект на проходящего лечение субъекта. Терапевтический эффект может оцениваться объективно(например, путем проведения испытания или контроля маркера) либо субъективно (например, посредством описания субъектом своих ощущений). Термин "пролекарство" относится к соединениям, которые могут быть преобразованы при определенных физиологических условиях или посредством сольволиза в биологически активное соединение изобретения. Пролекарство может быть неактивно при приеме нуждающимся в нем субъектам с последующим преобразованием in vivo в активное соединение изобретения. Как правило, пролекарства достаточно быстро преобразовываются in vivo в исходное соединение изобретения, например, путем гидролиза в крови. Соединение в виде пролекарства обычно обладает такими преимуществами, как растворимости, тканевая совместимость или отсроченное высвобождение в организме млекопитающего (см.(2004), p. 498-549). Пролекарства соединения настоящего изобретения могут быть получены путем изменения функциональных групп, подобных гидрокси-, амино- или меркаптогруппам, входящих в состав соединения настоящего изобретения, таким образом, чтобы измененные функциональные группы расщеплялись посредством стандартной обработки или in vivo до исходного соединения изобретения. Образцы пролекарств включают, помимо прочего, ацетатные, форматные или сукцинатные производные гидроксифункциональных групп или фенилкарбаматные производные аминофункциональных групп. По тексту спецификации и приложенной к ней формулы изобретения указанная химическая формула или название также включают все соли, гидраты, сольваты, N-оксиды и пролекарственные формы соединения. Стереоизомеры включают энантиомеры и диастереомеры. Энантиомеры могут быть представлены в чистой форме либо в виде смеси двух энантиомеров как в равных (рацемическая смесь), так и в неравных количествах. Диастереомеры могут быть представлены в чистой форме либо в виде смеси диастереомеров. Диастереомеры также включают геометрические изомеры, которые могут быть представлены в чистой цис- или трансформе либо в виде смеси изомеров. Соединения формулы (I) могут использоваться "как есть" либо в виде их фармакологически приемлемых солей (соль присоединения кислоты или основания). Фармацевтически приемлемые соли присоединения, указанные ниже, включают терапевтически активные нетоксичные формы солей присоединения кислоты и основания, которые могут образовывать соединения. Соединения, обладающие свойствами оснований, могут быть преобразованы в собственную фармацевтически приемлемую соль присоединения кислоты путем обработки основной формы подходящей кислотой. Типичные кислоты включают неорганические кислоты, такие как хлороводород, бромоводород, йодоводород, серная кислота, фосфорная кислота; органические кислоты, такие как муравьиная кислота, уксусная кислота, пропановая кислота, гидроксиуксусная кислота, молочная кислота, пировиноградная кислота, гликолевая кислота, малеиновая кислота, малоновая кислота, щавелевая кислота, бензолсульфоновая кислота, толуолсульфоновая кислота, метансульфоновая кислота, трифторуксусная кислота, фумаровая кислота, янтарная кислота,яблочная кислота, винная кислота, лимонная кислота, салициловая кислота, p-аминосалициловая кислота, памоевая кислота, бензойная кислота, аскорбиновая кислота и т.п. Типичные соли присоединения основания включают соли натрия, калия, кальция, соли фармацевтически приемлемых аминов, таких как аммиак, алкиламины, бензатин, а также аминокислот, таких как аргинин и лизин. Термин "соль присоединения" в тексте данного патента также включает сольваты, которые могут образовывать соединения и их соли, например гидраты, алкоголяты и т.п. Композиции В клинических условиях соединения настоящего изобретения используются в составе лекарственных средств, применяемых различными способами. Предпочтительным является прием соединений изобретения вместе с физиологически приемлемым носителем, вспомогательным веществом или разбавителем. Фармацевтические композиции изобретения могут применяться любым удобным способом, предпочтительно пероральным, ректальным, назальным, местным (включая буккальный и подъязычный),подъязычным, трансдермальным, интратекальным, трансмукозальным или парентеральным (включая подкожный, внутримышечный, внутривенный и интрадермальный). Прочие составы, как правило, могут быть представлены в виде отдельных единиц дозы, например таблеток и капсул с длительным высвобождением, а также в виде липосом, и могут быть получены любым методом, хорошо известным в фармацевтической области. Получение фармацевтических составов,как правило, осуществляется путем смешивания активного вещества или его фармацевтически приемлемой соли со стандартными фармацевтически приемлемыми носителями, разбавителями или вспомогательными веществами. Образцы вспомогательных веществ включают воду, желатин, аравийскую камедь,лактозу, микрокристаллическую целлюлозу, крахмал, натрия гликолят крахмала, вторичный кислый фосфат кальция, стеарат магния, тальк, коллоидный диоксид кремния и т.п. Данные составы могут также содержать другие фармацевтически активные вещества и добавки, такие как стабилизаторы, увлажняющие компоненты, эмульгаторы, ароматизирующие вещества, буферные вещества и т.п. Как правило, количество активных веществ составляет от 0,1 до 95 мас.% лекарственного средства, предпочтительно от 0,2 до 20 мас.% лекарственного средства для парентерального применения и предпочтительно от 1 до 50 мас.% лекарственного средства для перорального применения. Составы также могут подвергаться обработке в соответствии с известными в области фармацевтики методами, такими как гранулирование, прессование, микроинкапсуляция, покрытие распылением и т.д. Составы могут быть изготовлены посредством стандартных методов в форме таблеток, капсул, гранул,порошка, сиропа, суспензии, суппозитория или раствора для введения. Жидкие лекарственные формы могут быть изготовлены посредством растворения или суспендирования активного вещества в воде или другом подходящем растворителе. На таблетки или гранулы посредством стандартных методов может быть нанесено покрытие. С целью поддержания терапевтически эффективной концентрации в плазме крови на протяжении длительного периода времени соединения изобретения могут входить в состав лекарственнных форм с замедленным высвобождением. Уровень дозы и частота приема каждого отдельного соединения будут различны в зависимости от разнообразных факторов, включающих активность используемого соединения, его метаболическую стабильность и длительность действия, возраст пациента, его массу тела, общее состояние здоровья, пол,режим питания, способ и время применения, скорость выведения, комбинацию принимаемых лекарственных средств, степень тяжести заболевания, а также проходящего терапию пациента. Суточная доза может составлять, например, от приблизительно 0,001 до приблизительно 100 мг на 1 кг массы тела пациента и приниматься однократно или многократно в дозах объемом, например, от приблизительно 0,01 до приблизительно 25 мг каждая. Как правило, подобные дозы принимаются перорально, однако, возможно и парентеральное введение. Получение соединений изобретения Соединения формулы (I), представленной выше, могут быть получены в соответствии или по аналогии со стандартными методами. Получение промежуточных соединений и соединений, соответствующих образцам настоящего изобретения, в частности, может быть разъяснено посредством представленной ниже схемы 1. Определения переменных в составе структур, приведенных на указанной схеме, сопоставимы с определениями соответствующих позиций в представленной в данном патенте формуле. Схема 1. Общий синтетический подход к получению соединений формулы (I) в которых R1, R2 и R3 соответствуют определениям, представленным для формулы (I). Ключевым промежуточным соединением в ходе синтеза соединений изобретения является 4 изопропил-4,5,6,7-тетрагидро-1 Н-имидазо[4,5-с]пиридиновое производное формулы (III), которое может быть получено подходящим образом посредством конденсации соответствующего гистаминового производного (II) изобутилальдегидом. Соединения формулы (I) затем легко могут быть получены путем добавления в данное промежуточное соединение (III) уретанового линкера, содержащего R3. Как правило,получение уретановых линкеров, входящих в соединение (I), осуществляется с применением в качестве активирующего агента 4-нитрофенил хлорформиата, однако применение других активирующих агентов в ходе данного процесса не исключается. Подобные агенты могу включать, помимо прочего, фосген для получения спиртовых хлорформиатов или карбонилдиимидазол (CDI) для получения имидазолкарбоксилатов. В одном процессе приемлемый спирт R3OH активируют путем его преобразования в соответствующее 4-нитрофенил карбонат производное (IV). Затем на промежуточное соединение (III) воздействуют данным карбонатом (IV) в присутствии основания (например, DIPEA, NMM или триэтиламина) и получают желаемое соединение формулы (I). В другом процессе промежуточное соединение (III) сначала преобразуют в соответствующий 4 нитрофенил карбамат при помощи 4-нитрофенилхлороформата. Затем активированный карбамат (V) последовательно обрабатывают подходящим спиртом R3OH и получают соединение формулы (I). Формирование уретанового функционала, как правило, двухэтапный процесс, хотя он также может быть воплощен как одностадийная реакция с образованием активированного промежуточного соединения in situ. При таком процессе спирт R3OH и 4-нитрофенилхлороформат сначала вступают в реакцию в присутствии основания (например, DIPEA, NMM или триэтиламина), после чего в реакционную смесь добавляют промежуточное соединение (III). Все эти альтернативные способы подтверждены примерами в нижеследующем разделе, посвященном экспериментам. Приемлемые условия для отдельно взятых шагов при проведении реакций хорошо известны профильным специалистам. Конкретные условия реакций для примеров получения изобретения также описаны ниже, в разделе об экспериментах. Необходимые исходные материалы для приготовления соединений формулы (I) являются коммерчески доступными либо могут быть получены общеизвестными методами. Процесс, описанный ниже в разделе об экспериментах, может быть использован для получения соединения изобретения в форме нейтрального основания или соли присоединения кислоты. Фармацевтически приемлемая соль присоединения кислоты может быть получена путем растворения нейтрального основания в приемлемом органическом растворителе и обработки этого раствора кислотой согласно общепринятым процедурам получения солей присоединения кислоты из основных соединений. Примеры получения кислот, образующих соли добавления, упоминались выше. Соединения формулы (I) могут иметь один или более хиральных атомов углерода, благодаря чему они могут быть получены в форме оптических изомеров, например в виде чистого энантиомера или смеси энантиомеров (рацемат) либо смеси, содержащей диастереомеры. Способы сепарации смесей оптических изомеров для получения чистых энантиомеров хорошо известны специалистам. Например, можно использовать фракционированную кристаллизацию солей с оптически активными (хиральными) кислотами или хроматографическую сепарацию в хиральной колонке. Химические вещества, использованные в описанных здесь маршрутах синтеза, могут включать растворители, реагенты, катализаторы, а также реагенты защитных и снимающих защиту групп. Примеры защитных групп включают третбутоксикарбонил (Boc), бензил и тритил (трифенилметил). Вышеописанные методы могут также включать дополнительные шаги, предпринимаемые либо до, либо после шагов, описанных здесь, позволяющие добавить или удалить подходящие защитные группы, чтобы в полной мере способствовать синтезу соединений. Кроме того, для получения желаемых соединений различные шаги синтеза могут быть предприняты в другой последовательности или порядке. Химические трансформации при синтезе и методики работы с защитными группами (установка и снятие защиты), необходимые для синтеза подходящих соединений, хорошо известны специалистам и описаны, например, у R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Groups in OrganicSynthesis, 3rd Ed., John Wiley and Sons (1999); L. Fieser and M. Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis,John Wiley and Sons (1995) и в последующих переизданиях этих работ. В данной работе использованы следующие аббревиатуры и сокращения: Ас - ацетат,Aq - водный,d - день,DCM - дихлорметан,DIPEA - диизопропилэтиламин,DMAP - диметиламинопиридин,DMF - N,N'-диметилформамид,EDC - 1-этил-3-(3-диметиламинопропил)карбодиимид,ее - энантиомерный избыток,ES+ - электрораспыление,h - час(ов),HBTU - О-бензотриазол-1-ил-N,N,N',N'-тетраметилуроний гексафторофосфат,HOBt - N-гидроксибензотриазол,HPLC - высокоэффективная жидкостная хроматография (ВЭЖХ),HRMS - масс-спектрометрия высокого разрешения (МСВР),LCMS - жидкостная хроматография-масс-спектрометрия (ЖХМС),М - молярный,[МН+] - протонированный молекулярный ион,мин - минуты,NMM - N-метилморфолин,NMR - ядерно-магнитный резонанс,RP - обращенная фаза,MS - масс-спектрометрия,RT - Время удерживания,sat - насыщенный,sec - секунды,THF - тетрагидрофуран,TFA - трифторуксусная кислота,TMS - тетраметилсилан. Перечисление ряда химических групп в любом определении переменных здесь включает определения этих переменных как в виде единичной группы, так и их комбинаций. Перечисление воплощений изобретения здесь включает как единичные воплощения, так их комбинации с любыми другими воплощениями или частями. Далее изобретение будет проиллюстрировано рядом примеров, хотя оно и не ограничивается ими. Конкретные примеры, приведенные здесь, следует воспринимать как чисто иллюстративные и ни в коей мере не ограничивают выжидательное право настоящей заявки. Без дальнейших пояснений подразумевается, что профильный специалист, основываясь на приведенном здесь описании, сможет реализовать данное изобретение в полной мере. Все ссылки и публикации, упоминаемые здесь, включены путем отсылки в полном объеме. Примеры и промежуточные соединения Экспериментальные методы. Все реагенты принадлежат к коммерческой категории и были использованы в том виде, в котором они были приобретены, без дальнейшей очистки, если прямо не указано иное. Во всех случаях использовались чистые растворители. 1 Н Ядерно-магнитный резонанс (NMR) фиксировался на спектрометреBruker DPX-400 при 400 МГц. Все спектры записывались с использованием остаточного растворителя или тетраметилсилана (TMS) как внутренний стандарт. Аналитическая ЖХМС проводилась на масс- 10019167 спектрометре Waters ZQ, подсоединенном к системе Agilent 1100 HPLC. Аналитическая ВЭЖХ проводилась на системе Agilent 1100. Масс-спектральные данные при высоком разрешении (HRMS) были получены на оборудовании Agilent MSD-TOF, подсоединенном к системе HPLC Agilent 1100. В ходе анализа калибровку проверяли на двух массах и при необходимости автоматически корректировали. Спектры захватывали в позитивном режиме электрораспыления. Полученный диапазон массовых чисел составил м/з (масса/заряд) 100-1100. Применялось профильное обнаружение максимума масс-спектра. Флэшхроматография производилась либо на совместимой системе CombiFlash Companion system, оснащенной колонками с силикагелем RediSep, либо на персональной системе Flash Master Personal system, оборудованной гигаколонками с силикагелем Strata SI-1. Обращенно-фазовая ВЭЖХ проводилась на системеGilson system (Gilson 322 насос с Gilson 321 равновесным насосом и Gilson 215 автодозатором), с колонками Phenomenex Synergi Hydro RP 15010 мм, YMC ODS-A 100/15020 мм или Chirobiotic T 25010 мм. Обращенно-фазовая колоночная хроматография производилась на системе Gilson system (Gilson 321 насос и Gilson FC204 коллектор фракций) с колонками с силикагелем Merck LiChroprep RP-18 (40-63 мкм). Микроволновое облучение выполняли с помощью аппарата Biotage. Соединениям присваивались названия автоматически с использованием ACD 6.0. Все соединения сушили в вакуум-сушильном шкафу в течение ночи. Аналитические данные по ВЭЖХ и ЖХМС получены с помощью: система A: Phenomenex Synergi Hydro RP (С 18, 304,6 мм, 4 мкм), градиент 5-100% CH3CN(+0,085% TFA) в воде (+0,1 % TFA), 1,5 мл/мин, время градиентного элюирования 1,75 мин, 200 нм,30 С; или система В: Phenomenex Synergi Hydro RP (С 18, 1504,6 мм, 4 мкм), градиент 5-100% CH3CN(+0,085% TFA) в воде (+0,1% TFA), 1,5 мл/мин, время градиентного элюирования 7 мин, 200 нм, 30 С. Данные хиральной ВЭЖХ были получены с помощью: система С: Chirobiotic V полярно-ионный режим (1504,6 мм), 70% МеОН в 10 мМ водного формиат аммониевого буфера, 1,0 мл/мин, более 10 мин, 200 нм, 30 С. Промежуточное соединение 1. 4-Изопропил-4,5,6,7-тетрагидро-1 Н-имидазо[4,5-с]пиридин гидрохлорид(125 мл) и МеОН (500 мл) и добавляли изобутиральдегид (61,4 мл, 672 ммоль). Реакционную смесь нагревали с обратным конденсированием при 80 С в течение 24 ч, охлаждали до комнатной температуры,рН доводили до 7 с помощью 1 М водного раствора HCl (250 мл) и растворители удаляли in vacuo. Остаток растворяли в теплом МеОН (300 мл), давали постоять в течение 1 ч, фильтровали и растворители удаляли in vacuo. Остаток перемешивали в МеОН (50 мл) и ацетоне (400 мл) в течение 2 ч и охлаждали до 4 С в течение 2 ч. Полученный осадок фильтровали и промывали ацетоном (100 мл), получая 4 изопропил-4,5,6,7-тетрагидро-1H-имидазо[4,5-с]пиридин гидрохлорид (33,0 г, 48,7%) в виде белого твердого вещества. Аналитическая ЖХМС: чистота 90% (система A, RT = 0,51 мин), ES+: 166,4 [МН]+. Промежуточное соединение 2. 4-Нитрофенил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 сопиридин-5-карбоксилат Промежуточное соединение 1 (2,78 г, 8,28 ммоль, 60% чистоты) и DIPEA (5,27 мл, 30,3 ммоль) растворяли в DCM (100 мл). Реакционную смесь охлаждали до 0 С и добавляли 4-нитрофенилхлороформат(4,07 г, 20,2 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь промывали насыщенным водным раствором NaHCO3 (5100 мл), сушили (MgSO4) и растворители удаляли in vacuo, получая 4-нитрофенил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 с]пиридин-5-карбоксилат (5,28 г, сырой) в виде желтой смолы. Аналитическая ВЭЖХ: чистота 41% (система В, RT = 4,70 мин); аналитическая ЖХМС: чистота 86% (система A, RT = 1,70 мин), ES+: 331,0 [МН]+. Промежуточное соединение 3. (4S,6S)-4-Изопропил-4,5,6,7-тетрагидро-1H-имидазо[4,5-с]пиридин 6-карбоновая кислотаL-гистидин (10,0 г, 43,8 ммоль) растворяли в растворе NaOH (7,73 г, 193 ммоль) в воде (25 мл) и МеОН (100 мл) и добавляли изобутиральдегид (11,8 мл, 129 ммоль). Реакционную смесь нагревали с об- 11019167 ратным конденсированием при 80 С в течение 24 ч. Затем рН доводили до 7 с помощью 1 М водного раствора HCl и растворители удаляли in vacuo. Остаток растворяли в горячем EtOH и охлаждали до комнатной температуры. Осадок удаляли фильтрацией и маточную жидкость концентрировали in vacuo,промывали ацетоном (100 мл) и сушили, получая 4-изопропил-4,5,6,7-тетрагидро-1 Н-имидазо[4,5 с]пиридин-6-карбоновую кислоту в виде бледно-желтого твердого вещества (18,6 г, сырая, 6:1 смесь из(1H, ddd, J 15,8, 8,2 и 0,9 Гц, D2), 2,72 (1 Н, ddd, J 15,4, 11,1 и 2,5 Гц, D1), 2,38 (1H, m, D1) и 2,19 (1H, m,D2). Относительная стереохимия основного диастереоизомера является цис, согласно экспериментам 1 Н ЯМР nOe (ядерный эффект Оверхаузера). Промежуточное соединение 4. (4S,6S)-5-[(Бензилокси)карбонил]-4-изопропил-4,5,6,7-тетрагидро 1H-имидазо[4,5-с]пиридин-6-карбоновая кислотаNaOH (82 мл, 164 ммоль) и реакционную смесь охлаждали до 0 С. Бензил хлороформат (12,9 мл, 90,4 ммоль) добавляли и реакционную смесь подогревали до комнатной температуры на протяжении 16 ч. Добавляли МеОН (50 мл) и реакционную смесь перемешивали в течение 60 ч. Далее рН доводили до 7 с помощью 1 М водного раствора HCl и растворители удаляли in vacuo. Остаток перемешивали в МеОН(50 мл) и полученный белый осадок удаляли фильтрацией. Растворители удаляли in vacuo, получая сырую оранжевую смолу (17,0 г). Далее 11,0 г этого остатка перемешивали в горячем EtOH/EtOAc, охлаждали и полученный осадок удаляли фильтрацией. Растворители удаляли in vacuo и остаток очищали рекристаллизацией из горячего MeOH/Et2O, получая(4S,6S)-5-[(бензилокси)карбонил]-4-изопропил-4,5,6,7 тетрагидро-1 Н-имидазо[4,5-с]пиридин-6-карбоновая кислота (2,50 г, 13,8%) в виде белого твердого вещества. Аналитическая ЖХМС: чистота 95% (система A, RT = 1,53 мин), ES+: 344,6 [МН]+. Пример 1. 2,2,2-Трихлорэтил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5 карбоксилатDIPEA (1,83 мл, 10,5 ммоль) и добавляли 2,2,2-трихлорэтил хлороформат (1,06 мл, 7,70 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь распределяли между DCM (30 мл) и насыщенным водным раствором NaHCO3 (20 мл). Органический слой промывали с помощью насыщенного водного раствора NaHCO3 (220 мл) и воды (20 мл) и концентрировали invacuo. Остаток растворяли в МеОН (20 мл) и добавляли 1 М водного раствора NaOH (10 мл). Реакционную смесь перемешивали в течение 1 ч, рН доводили до 7 с помощью 1 М водного раствора HCl и растворители удаляли in vacuo. Остаток распределяли между DCM (20 мл) и водой (20 мл), органический слой промывали с помощью воды (20 мл), сушили (MgSO4) и концентрировали in vacuo. Остаток очищали обратно-фазовой ВЭЖХ (YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин, градиент от 50 до 70% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая 2,2,2-трихлорэтил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 с]пиридин-5-карбоксилат (97 мг, 8%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 99,6% (система В, RT = 4,88 мин); аналитическая ЖХМС: чистота 99,8% (система В, RT = 5,23 мин), ES+: 342,3 [МН]+; МСВР, вычисленная для C12H16Cl4N3O2: 339,0308,найдено 339,0311. Пример 2. 2-Хлор-2,2-дифторэтил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5 карбоксилат(1,40 мл, 14,5 ммоль) и 4-нитрофенилхлороформат (2,93 г, 14,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли раствор промежуточного соединения 1 (1,87 г,2,97 ммоль, 32% чистоты) и DIPEA (2,52 мл, 14,5 ммоль) в DCM (20 мл) и полученный раствор перемешивали в течение 2 дней. Растворители удаляли in vacuo, остаток растворяли в МеОН (8 мл) и 1 М вод- 12019167 ного раствора NaOH (6 мл) и реакционную смесь перемешивали при комнатной температуре в течение 18 ч и концентрировали in vacuo. Остаток растворяли в EtOAc (100 мл) и органический слой промывали с помощью 1 М водного раствора Na2CO3 (6100 мл), сушили (MgSO4) и концентрировали in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем,DCM (200 мл), с последующим добавлением 2 и 4% МеОН в DCM (200 мл каждого и обратно-фазовой ВЭЖХ (YMC ODS-A 15020 мм, 5 мкм, 15 мл/мин, изократическая перегонка при 55% (более 12 мин),затем 100% (3 мин) МеОН в 10% МеОН/вода), получая 2-хлор-2,2-дифторэтил 4-изопропил-1,4,6,7 тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (13,0 мг, 1,4%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 99,0% (система В, RT = 4,47 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 4,95 мин), ES+: 308,0 [35ClMH]+ и 310,0 [37ClMH]+; МСВР, вычисленная для Бензиловый спирт (0,88 г, 8,10 ммоль) растворяли в DCM (10 мл) и реакционную смесь охлаждали до 0 С. Добавляли NMM (0,89 мл, 8,10 ммоль) и 4-нитрофенилхлороформат (1,63 г, 8,10 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли раствор промежуточного соединения 1 (1,16 г, 3,17 ммоль, 55% чистоты) и DIPEA (2,69 мл, 15,4 ммоль) в DCM (20 мл) и полученный раствор перемешивали в течение 18 ч. Растворители удаляли in vacuo, остаток растворяли в МеОН (10 мл) и 1 М водного раствора NaOH (10 мл) и реакционную смесь перемешивали в течение 2 ч. Растворители удаляли in vacuo, остаток растворяли в EtOAc (120 мл), органический слой промывали с помощью 1 М водного раствора Na2CO3 (4100 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем, от 0 до 5% МеОН в DCM) и обратно-фазовой ВЭЖХ (YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин,градиент от 40 до 100% (более 7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода и YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин, градиент от 0 до 100% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода, получая бензил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (65,8 мг, 6,9%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 100% (система В, RT = 4,74 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 4,99 мин), ES+: 300,0 [МН]+; МСВР, вычисленная для C17H21N3O2: 299,1634, найдено 299,1636. Пример 4. 3-Хлорбензил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат Углекислоты 3-хлорбензил эфир 4-нитрофенил эфир (1,34 г, 4,40 ммоль) растворяли в DCM (10 мл) и охлаждали до 0 С. В раствор промежуточного соединения 1 (1,00 г, 1,79 ммоль, 36% чистоты) и DIPEA(0,70 мл, 6,60 ммоль) добавляли DCM (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель удаляли in vacuo, остаток растворяли в МеОН (8 мл) и 1 М водного раствора NaOH (6 мл) и перемешивали при комнатной температуре в течение 2 ч. Растворители удаляли in vacuo и остаток растворяли в EtOAc. Органический слой промывали с помощью 1 М водного раствора Na2CO3 (850 мл), сушили (MgSO4) и концентрировали in vacuo. Остаток очищали обратнофазовой ВЭЖХ (YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин, градиент от 40 до 100% (7 мин), затем 100%(4-Хлорфенил)метанол (0,51 г, 3,60 ммоль) суспендировали в DCM (10 мл) и NMM (0,35 мл, 3,60 ммоль) и добавляли 4-нитрофенилхлороформат (0,73 г, 3,6 ммоль) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Добавляли раствор промежуточного соединения 1(500 мг, 1,49 ммоль, 60% чистоты) и DIPEA (940 мкл, 5,40 ммоль) в DCM (10 мл) и полученный раствор перемешивали при комнатной температуре в течение 15 ч. Растворители удаляли in vacuo. Остаток растворяли в МеОН (8 мл) и 1 М водного раствора NaOH (6 мл), реакционную смесь перемешивали в тече- 13019167 ние 2 ч и концентрировали in vacuo. Остаток растворяли в EtOAc (100 мл), а органический слой промывали 1 М водного раствора Na2CO3 (650 мл), солевого раствора (250 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали обратно-фазовой ВЭЖХ (YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин, градиент от 50 до 80% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая 4 хлорбензил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (29,5 мг, 5,9%) в виде бесцветной смолы. Аналитическая ВЭЖХ: чистота 98,6% (система В, RT = 5,14 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 5,49 мин), ES+: 334,0 [МН]+; МСВР, вычисленная для C17H20ClN3O2: 333,1244,найдено 333,1237. Пример 6. Пиридин-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5 карбоксилатNaH (0,22 г, 5,0 ммоль, 60% дисперсия в минеральном масле) суспендировали безводным THF (15 мл), суспензию охлаждали до 0 С и добавляли 2-пиридилметанол (0,55 г, 5,0 ммоль). Суспензию перемешивали при 0 С в течение 1 ч и добавляли к перемешанному раствору промежуточного соединения 2(0,66 г, 2,00 ммоль, 70% чистоты) в THF (10 мл) и реакционную смесь перемешивали при комнатной температуре. Дополнительно две такие порции NaH и 2-пиридилметанола в THF добавляли через 18 и 36 ч соответственно. Через 54 ч реакционную смесь гасили водой (10 мл), растворители удаляли in vacuo и остаток растворяли в EtOAc (100 мл), промывали 1 М водного Na2CO3 раствора (4100 мл), сушили(MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем, DCM (200 мл) с последующим 1, 2 и 5% МеОН в DCM(200 мл каждый и обратно-фазовой ВЭЖХ (Phenomenex Synergi, RP-Hydro 15010 мм, 10 мкм, 15 мл/мин, градиент от 0 до 70% (12 мин) и до 100% (3 мин) МеОН в воде (1% муравьиная кислота. Остаток обессоливали с использованием K2CO3 в DCM, получая пиридин-2-илметил 4-изопропил-1,4,6,7 тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (86,4 мг, 14,4%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 100% (система В, RT = 3,16 мин); аналитическая ЖХМС: чистота 97,9% (система В, RT = 3,55 мин), ES+: 301,1 [МН]+; МСВР, вычисленная для C16H20N4O2: 300,1586, найдено 300,1581. Пример 7. Пиридин-3-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5 карбоксилатNaH (0,19 г, 4,80 ммоль, 60% дисперсия в минеральном масле) суспендировали безводным THF (5 мл), суспензию охлаждали до 0 С и добавляли 3-пиридилкарбинол (0,40 мл, 4,00 ммоль). Суспензию перемешивали при 0 С в течение 30 мин и затем добавляли к раствору промежуточного соединения 2 (1,33 г, 4,00 ммоль, 70% чистоты) в THF (10 мл) и реакционную смесь перемешивали при комнатной температуре. Дополнительно две такие порции NaH и 3-пиридилкарбинола в THF добавляли через 7 и 25 ч соответственно. Через 4 дня реакционную смесь гасили водой (10 мл) и растворители удаляли in vacuo. Остаток растворяли в EtOAc (100 мл), промывали 1 М водного раствора Na2CO3 (4100 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г,Strata SI-1, гигаколонка с силикагелем, DCM (200 мл) с последующим 2, 4, 5 и 10% МеОН в DCM (200 мл каждый и обратно-фазовой ВЭЖХ (Phenomenex Synergi, RP-Hydro 15010 мм, 10 мкм, 15 мл/мин,градиент от 0 до 80% (12 мин), до 100% (3 мин) МеОН в воде (1% муравьиная кислота) и PhenomenexSynergi, RP-Hydro 15010 мм, 10 мкм, 15 мл/мин, градиент от 0 до 40% (12 мин), до 100% (3 мин) МеОН в воде (1% муравьиная кислота. Остаток обессоливали с использованием K2CO3 в DCM, получая пиридин-3-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (46,3 мг, 3,8%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 100% (система В, RT = 3,07 мин); аналитическая ЖХМС: чистота 99% (система В, RT = 3,07 мин), ES+: 301,6; МСВР, вычисленная для C16H20N4O2: 300,1586, найдено 300,1579. Пример 8. Пиридин-4-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5 карбоксилат растворяли в DMF (20 мл) и добавляли углекислоты 4-нитрофенил эфир пиридин-4-илметил эфир (1,10 г,4,00 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч и растворители удаляли in vacuo. Остаток растворяли в МеОН (10 мл) и добавляли 1 М водного раствора NaOH (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и растворители удаляли in vacuo. Остаток растворяли в DCM (40 мл) и промывали 1 М водного раствора Na2CO3 (540 мл). Органический слой высушивали (MgSO4) и растворители удаляли in vacuo. Остаток очищали обращеннофазовой колоночной хроматографией LiChroprep RP-18, 40-63 мкм, 46026 мм (100 г), 30 мл/мин, градиент от 0 до 100% (35 мин), МеОН в воде и LiChroprep RP-18, 40-63 мкм, 46026 мм (100 г), 30 мл/мин,градиент от 50 до 100% (35 мин) МеОН в воде и обратно-фазовой ВЭЖХ (YMC ODS-A 15020 мм, 5 мкм, 15 мл/мин, градиент от 0 до 50% (12 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода, получая пиридин-4-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (82 мг,16,5%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 100% (система В, RT = 3,05 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 3,42 мин), ES+: 301,1 [МН]+; МСВР, вычисленная для C16H20N4O2: 300,1586, найдено 300,1568. Пример 9. (5-Хлорпиридин-2-ил)метил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин 5-карбоксилат 5-Хлорпиридин-2-карбоновую кислоту (2,00 г, 12,7 ммоль) растворяли в THF (12 мл) при 0 С и добавляли к раствору боран-THF (19,0 мл, 1 М в THF, 19,0 ммоль). Добавляли THF (10 мл) и реакционную смесь подогревали до комнатной температуры, перемешивали в течение 2 ч и нагревали с обратным конденсированием при 70 С в течение 3 ч. Реакционную смесь охлаждали до 0 С, гасили водным раствором 6 М HCl (4 мл) и перемешивали раствор в течение 2 ч, после чего концентрировали in vacuo. Остаток распределяли между H2O (75 мл) и DCM (75 мл). Водный слой промывали с помощью DCM (375 мл),доводили до рН 9 с помощью 4 М водного NaOH (3 мл) и экстрагировали с помощью DCM (375 мл). Органические слои объединяли, сушили (MgSO4) и концентрировали in vacuo, получая 5-хлорпиридин-2 метанол (0,83 г, 45%) в виде коричневой смолы. Аналитическая ВЭЖХ: чистота 79,5% (система В, RT = 3,04 мин); аналитическая ЖХМС: чистота 85% (система A, RT = 1,15 мин), ES+: 143,97 [35ClMH]+ и 145,98 [МН 37Cl]+.NaH (80,0 мг, 2,00 ммоль, 60% дисперсия в минеральном масле) суспендировали THF (10 мл), суспензию охлаждали до 0 С и добавляли 5-хлорпиридин-2-метанол (0,29 г, 2,00 ммоль). Суспензию перемешивали при 0 С в течение 30 мин, после чего добавляли к раствору промежуточного соединения 2(0,65 г, 2,00 ммоль, 70% чистоты) в THF (10 мл) и реакционную смесь перемешивали при комнатной температуре. Дополнительно две такие порции NaH и 5-хлорпиридин-2-метанола в THF добавляли через 2 и 3 дня соответственно. Через 4 дня реакционную смесь гасили водой (10 мл) и растворители удалялиNa2CO3 раствора (4100 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем, DCM (200 мл) с последующим 2, 4, 5 и 10% МеОН в DCM (200 мл каждый и обратно-фазовой ВЭЖХ (Phenomenex Synergi, RP-Hydro 15010 мм, 10 мкм, 15 мл/мин, градиент от 20 до 80% (12 мин), до 100% (3 мин) МеОН в воде (1% муравьиная кислота. Остаток обессоливали с использованием K2CO3, получая (5 хлорпиридин-2-ил)метил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (7,91 мг, 1,2%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 99,2% (система В, RT = 4,40 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 4,25 мин), ES+: 335,10 [35ClMH]+ и 337,10 [MH 37Cl]+; МСВР, вычисленная дляNaH (0,22 г, 5,60 ммоль, 60% дисперсия в минеральном масле) суспендировали THF (10 мл), охлаждали до 0 С и добавляли пиразин-2-илметанол (0,49 мл, 5,00 ммоль). Суспензию перемешивали при 0 С в течение 30 мин, затем добавляли к раствору промежуточного соединения 2 (0,66 г, 2,00 ммоль, 70% чистоты) в THF (10 мл) и реакционную смесь перемешивали при комнатной температуре. Дополнительно такую порцию NaH и пиразин-2-ил метанол в THF добавляли через 18 ч. Через 2 дня реакционную смесь гасили водой (10 мл) и растворители удаляли in vacuo. Остаток растворяли в МеОН (10 мл) и 1 М водного раствора NaOH (10 мл) и реакционную смесь перемешивали при комнатной температуре в тече- 15019167 ние 2 ч, а затем концентрировали in vacuo. Остаток растворяли в EtOAc (120 мл) и органический слой промывали с помощью 1 М водного раствора Na2CO3 (6100 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали обратно-фазовой ВЭЖХ (Phenomenex Synergi, RP-Hydro 15010 мм, 10 мкм, 15 мл/мин, градиент от 0 до 100% (12 мин), затем 100% (3 мин) МеОН в воде (1% муравьиная кислота. Остаток обессоливали с использованием K2CO3 в DCM, получая пиразин-2-илметил 4 изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (62,9 мг, 10,4%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 99,2% (система В, RT = 3,59 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 3,99 мин), ES+: 302,1 [МН]+; МСВР, вычисленная для C15H19N5O2: 301,1539, найдено 301,1527. Пример 11. Бензил (4S,6S)-6-(аминокарбонил)-4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 с]пиридин-5-карбоксилат Промежуточное соединение 4 (572 мг, 1,67 ммоль) и аммония хлорид (178 мг, 3,33 ммоль) растворяли в DMF (5 мл) и добавляли DIPEA (1,16 мл, 6,66 ммоль), HOBt (338 мг, 2,50 ммоль) и HBTU (948 мг,2,50 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней и концентрировали in vacuo. Остаток распределяли между EtOAc (100 мл) и насыщенным водным раствором NaHCO3 (80 мл). Органический слой промывали с помощью насыщенного водного раствора NaHCO3 (80 мл), сушили (MgSO4) и концентрировали in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем, DCM (200 мл) с последующим 2, 4, 5 и 10% МеОН в DCM (200 мл каждый) и обратно-фазовой ВЭЖХ (YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин,градиент от 40 до 70% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая бензил (4S,6S)-6(аминокарбонил)-4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (163 мг,28,7%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 99,4% (система В, RT = 4,20 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 4,13 мин), ES+: 343,7 [МН]+; МСВР рассчитана для C18H22N4O3: 342,1692, найдено 342,1683. Пример 12. БензилTHF, 1,75 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 дней. Растворители удаляли in vacuo. Остаток распределяли между EtOAc (50 мл) и насыщенным водным раствором NaHCO3 (50 мл). Органический слой промывали с помощью насыщенного водного раствора NaHCO3(YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин, градиент от 30 до 90% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода) и обратно-фазовой ВЭЖХ (YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин, градиент от 40 до 80% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая бензил (4S,6S)-4-изопропил-6[(метиламино)карбонил]-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (5 мг. 2,41%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 98,4% (система В. RT = 4,40 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 4,37 мин), ES+: 357,7 [МН]+; МСВР рассчитана для C19H24N4O3: 356,1848, найдено 356,1843. Пример 13. 5-Бензил 6-метил (4S,6S)-4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин 5,6-дикарбоксилат Промежуточное соединение 3 (1,00 г, 4,80 ммоль) растворяли в МеОН (10 мл) и добавляли концентрированную HCl (10 мл). Реакционную смесь нагревали при 85 С в течение 4 ч. Растворители удалялиTHF (20 мл), реакционную смесь охлаждали до 0 С и добавляли бензил хлороформат (1,37 мл, 9,60 ммоль). Реакционную смесь подогревали до комнатной температуры в течение 16 ч. Реакционную смесь фильтровали и фильтрат концентрировали in vacuo, получая смесь 2:1 из 3,5-дибензил 6-метил (6S)-4 изопропил-6,7-дигидро-3H-имидазо[4,5-с]пиридин-3,5,6(4 Н)-трикарбоксилата и 5-бензил 6-метил (6S)-4 изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5,6-дикарбоксилата (смесь из 4S- и 4Rдиастереомеров; 3,05 г, сырая). Аналитическая ЖХМС: чистота 23% (система A, RT = 1,65 мин), ES+: 358,5 и 66% (RT = 2,24 мин),+DMF (6 мл) и добавляли метиламин (1,22 мл, 2 M в THF, 2,44 ммоль). Реакционную смесь разделяли на 3 равные порции. Первую порцию реакционной смеси перемешивали при комнатной температуре в течение 18 ч. Вторую - нагревали при 60 С в течение 4 ч, добавляли метиламин (0,20 мл, 2 M в THF, 0,41 ммоль) и реакционную смесь нагревали с обратным конденсированием при 80 С в течение 18 ч. Третью порцию нагревали с использованием микроволновой печи Biotage (100 С, высокое поглощение, предварительное перемешивание 20 с) в течение 20 мин, добавляли метиламин (0,20 мл, 2 M в THF, 0,41 ммоль) и реакционную смесь нагревали в микроволновой печи Biotage (120C, высокое поглощение, предварительное перемешивание 20 с) в течение 20 мин. Добавляли метиламин (1,00 мл, 2 M в THF, 2,00 ммоль) и реакционную смесь нагревали в микроволновой печи Biotage (160C, высокое поглощение, предварительное перемешивание 20 с) в течение 20 мин. После этого все 3 порции реакционной смеси объединяли и растворители удаляли in vacuo. Остаток распределяли между EtOAc (30 мл) и насыщенным воднымNaHCO3 раствором (30 мл). Органический слой промывали с помощью насыщенного водного раствораNaHCO3 (30 мл), солевого раствора (30 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем,DCM (200 мл) с последующим 2, 4 и 5% МеОН в DCM (200 мл каждый и обратно-фазовой ВЭЖХ(YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин, градиент от 40 до 90% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая 5-бензил 6-метил (4S,6S-4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 с]пиридин-5,6-дикарбоксилат (46,2 мг, 2,7%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 99,7% (система В, RT = 4,93 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 4,86 мин), ES+: 358,6 [МН]+; МСВР, вычисленная для C19H23N3O4: 357,1689, найдено 357,1687. Пример 14. 2-Феноксиэтил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5 карбоксилат(10 мл), охлаждали до 0 С и добавляли 4-нитрофенилхлороформат (0,72 г, 3,60 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли раствор промежуточного соединения 1 (900 мг, 1,47 моль, 33% чистоты) и DIPEA (940 мкл, 5,40 ммоль) в DCM (20 мл) и полученный раствор перемешивали при комнатной температуре в течение 15 ч, промывали 1 М водного раствораNa2CO3 (6100 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток растворяли в МеОН (8 мл) и 1 М водного раствора NaOH (6 мл) и реакционную смесь перемешивали при комнатной температуре в течение 2 ч, а затем концентрировали in vacuo. Остаток растворяли в EtOAc (100 мл) и органический слой промывали с помощью 1 М водного раствора Na2CO3 (2100 мл), солевого раствора (2100 мл),сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали обратно-фазовой ВЭЖХ (YMC 2-(р-Хлорфенокси)этанол (0,73 г, 4,20 ммоль) и NMM (0,55 мл, 5,70 ммоль) растворяли в DCM (10 мл), охлаждали до 0 С и добавляли 4-нитрофенилхлороформат (1,15 г, 5,70 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли раствор промежуточного соединения 1 (0,70 г, 1,74 ммоль, 50% чистоты) и DIPEA (1,48 мл, 8,50 ммоль) в DCM (20 мл) и полученный раствор перемешивали при комнатной температуре в течение 2 дней. Растворители удаляли in vacuo, остаток растворяли в МеОН (8 мл) и 1 М водного раствора NaOH (6 мл) и реакционную смесь перемешивали при комнатной температуре в течение 3 ч, затем концентрировали in vacuo. Остаток растворяли в EtOAcin vacuo. Остаток очищали обратно-фазовой ВЭЖХ (YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин, градиент от 70 до 100% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая 2-(4-хлорфенокси)этил 4 изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (40,0 мг, 6,3%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 99,7% (система В, RT = 5,21 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 5,54 мин), ES+: 364,0 [МН 35Cl]+ и 366,0 [МН 37Cl]+; МСВР, вычисленная дляNaH (0,40 г, 10,0 ммоль, 60% дисперсия в минеральном масле) суспендировали безводным THF (20 мл), охлаждали до 0 С и добавляли (S)-3-гидрокситетрагидрофуран (0,88 г, 0,68 мл, 10,0 ммоль). Суспензию перемешивали при 0 С в течение 30 мин, затем добавляли к раствору промежуточного соединения 2(3,30 г, 10,0 ммоль, 70% чистоты) в THF (60 мл) и реакционную смесь перемешивали при комнатной температуре. Дополнительно две такие порции NaH и (S)-3-гидрокситетрагидрофурана в THF добавляли через 5 и 29 ч соответственно. Через 2 дня реакционную смесь гасили водой (10 мл) и растворители удаляли in vacuo. Остаток растворяли в EtOAc (100 мл), промывали 1 М водного Na2CO3 раствора (4100 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией(нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем, DCM (200 мл) с последующим 2, 4 и 5% МеОН в DCM (200 мл каждый и обратно-фазовой ВЭЖХ (YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин,градиент от 30 до 60% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая (3S)тетрагидрофуран-3-ил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (34,8 мг, 1,1%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 100% (система В, RT = 3,63 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 4,01 мин), ES+: 280,1 [МН]+.(3S)-Тетрагидрофуран-3-ил-4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (39,91 мг) растворяли в 10 мМ формиат аммониевого буфера и МеОН (2 мл, 1:1) и очищали дважды обратно-фазовой хиральной ВЭЖХ (Chirobiotic T 25010 мм, 3 мл/мин, изократическая перегонка 70% МеОН в 10 мМ формиат аммониевого буфера (40 мин), рН 7,4), получая единичный диастереоизомер,обозначенный как (3S)-тетрагидрофуран-3-ил (4S)-4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 с]пиридин-5-карбоксилат (6,90 мг, 99% э.и.). Аналитическая ВЭЖХ: чистота 100% (система В, RT = 3,63 мин); хиральная ВЭЖХ: чистота 99,5%DCM (10 мл) при 0 С и добавляли 4-нитрофенилхлороформат (1,28 г, 6,40 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Раствор промежуточного соединения 1 (0,50 г,2,48 ммоль) в DCM (20 мл) и DIPEA (2,11 мл, 12,1 ммоль) добавляли к реакционной смеси и полученный раствор перемешивали при комнатной температуре в течение 18 ч. Растворители удаляли in vacuo, остаток растворяли в МеОН (10 мл) и 1 М водного раствора NaOH (10 мл), реакционную смесь перемешивали при комнатной температуре в течение 2 ч и концентрировали in vacuo. Остаток растворяли в EtOAc(120 мл) и органический слой промывали с помощью 1 М водного раствора Na2CO3 (4100 мл), сушили(MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем, DCM (200 мл с последующим 2, 4, 5 и 10% МеОН в от 20 до 100% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода и YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин, градиент от 20 до 80% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая тетрагидрофуран-3-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (37,8 мг,5,2%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 100% (система В, RT = 3,83 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 3,89 мин), ES+: 294,7 [МН]+; МСВР, вычисленная для C15H23N3O3: 293,1739, найдено 293,1744. Пример 18.NaH (0,19 г, 4,80 ммоль, 60% дисперсия в минеральном масле) суспендировали безводным THF (10 мл), охлаждали до 0 С и добавляли 3-метил-3-окситанметанол (0,41 г, 4,00 ммоль). Суспензию перемешивали при 0 С в течение 30 мин, затем добавляли к раствору промежуточного соединения 2 (1,33 г, 4,00 ммоль, 70% чистоты) в THF (10 мл) и реакционную смесь перемешивали при комнатной температуре. Дополнительно две такие порции NaH и 3-метил-3-окситанметанола в THF добавляли через 8 и 32 ч соответственно. Через 50 ч реакционную смесь гасили водой (10 мл) и растворители удаляли in vacuo. Остаток растворяли в EtOAc (100 мл), промывали 1 М водного раствора Na2CO3 (4100 мл), сушили(MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем, DCM (200 мл) с последующим 2, 4, 5, 10 и 20% МеОН в DCM (200 мл каждый и обратно-фазовой ВЭЖХ (YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин, градиент от 20 до 100% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая (3-метилокситан-3 ил)метил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (68,2 мг, 5,8%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 100% (система В, RT = 3,80 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 4,08 мин), ES+: 294,1 [МН]+; МСВР, вычисленная для C15H23N3O3: 293,1739, найдено 293,1740. Пример 19. 2-(Диметиламино)этил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5 карбоксилатNMM (1,40 мл, 14,5 ммоль) и 4-нитрофенилхлороформат (2,93 г, 13,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли раствор промежуточного соединения 1(2,36 г, 3,6 ммоль) и DIPEA (2,53 мл, 14,5 ммоль) в DCM (20 мл) и полученный раствор перемешивали в течение 2 дней. Растворители удаляли in vacuo, остаток растворяли в МеОН (8 мл) и 1 М водного раствора NaOH (6 мл) и реакционную смесь перемешивали в течение 18 ч и концентрировали in vacuo. Остаток растворяли в EtOAc (100 мл) и органический слой промывали с помощью 1 М водного раствора Na2CO3(6100 мл), сушили (MgSO4) и концентрировали in vacuo. Остаток очищали колоночной хроматографией(R)-Тетрагидрофурфуриловый спирт (1,00 г, 9,80 ммоль) растворяли в DCM (10 мл) при 0 С и добавляли NMM (0,99 г, 0,94 мл, 9,80 ммоль) и 4-нитрофенилхлороформат (1,97 г, 9,80 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли раствор промежуточного соединения 1 (1,87 г, 3,6 ммоль) и DIPEA (2,53 мл, 14,5 ммоль) в DCM (20 мл) и полученный раствор перемешивали в течение 2 дней. Растворители удаляли in vacuo, остаток растворяли в МеОН (8 мл) и 1 М водного раствора NaOH (6 мл) и реакционную смесь перемешивали в течение 18 ч и концентрировали invacuo. Остаток растворяли в EtOAc (100 мл) и органический слой промывали с помощью 1 М водногоNa2CO3 раствора (6100 мл), сушили (MgSO4) и концентрировали in vacuo. Остаток очищали обратнофазовой колоночной хроматографией (LiChroprep RP-18, 40-63 мкм, 46026 мм (100 g), 30 мл/мин, градиент от 0 до 20% (5 мин) до 90% (40 мин) МеОН в воде) и обратно-фазовой ВЭЖХ (YMC ODS-A 15020 мм, 5 мкм, 15 мл в мин, градиент от 50 до 65% (12 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая (2R)-тетрагидрофуран-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 с]пиридин-5-карбоксилат (46,7 мг, 4,4%) в виде бесцветной смолы. Аналитическая ВЭЖХ: чистота 99,4% (система В, RT = 3,75 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 4,29 мин), ES+: 294,1 [МН]+; МСВР, вычисленная для C15H23N3O3: 293,1739, найдено 293,1738. Пример 21. 1,3-Тиазол-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5 карбоксилат(0,85 г, 0,81 мл, 8,40 ммоль) и 4-нитрофенилхлороформат (1,70 г, 8,40 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли раствор промежуточного соединения 1(2,18 г, 4,20 ммоль) и DIPEA (1,64 г, 2,21 мл, 12,7 ммоль) в DCM (20 мл) и полученный раствор перемешивали в течение 19 ч. Растворители удаляли in vacuo, остаток растворяли в МеОН (8 мл) и 1 М водного раствора NaOH (6 мл), реакционную смесь перемешивали при комнатной температуре в течение 3 дней и концентрировали in vacuo. Остаток растворяли в EtOAc (100 мл) и органический слой промывали с помощью 1 М водного Na2CO3 раствора (6100 мл), сушили (MgSO4) и концентрировали in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем,DCM (200 мл) с последующим 2% и 4% МеОН в DCM (200 мл каждый и обратно-фазовой ВЭЖХ(YMC ODS-A 15020 мм, 5 мкм, 25 мл/мин, градиент от 20 до 80% (12 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая 1,3-тиазол-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 с]пиридин-5-карбоксилат (51,8 мг, 4,0%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 99,5% (система В, RT = 3,81 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 4,27 мин), ES+: 307,1 [МН]+; МСВР, вычисленная для C14H18N4O2S: 306,1150, найдено 306,1153. Пример 22. (5-Метилизоксазол-3-ил)метил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 с]пиридин-5-карбоксилатNMM (1,47 г, 1,40 мл, 14,5 ммоль) и 4-нитрофенилхлороформат (2,93 г, 14,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли раствор промежуточного соединения 1 (1,87 г, 3,60 ммоль) в DCM (20 мл) и DIPEA (1,87 г, 2,52 мл, 14,5 ммоль), полученный раствор перемешивали в течение 3 дней и концентрировали in vacuo. Остаток растворяли в МеОН (8 мл) и 1 М водного раствора NaOH (6 мл), реакционную смесь перемешивали в течение 18 ч и концентрировали invacuo. Остаток растворяли в EtOAc (100 мл) и органический слой промывали с помощью 1 М водного раствора Na2CO3 (6100 мл), сушили (MgSO4) и концентрировали in vacuo. Остаток очищали обратнофазовой колоночной хроматографией (LiChroprep RP-18, 40-63 мкм, 46026 мм (100 г), 30 мл/мин, градиент от 0 до 20% (5 мин) до 90% (40 мин) МеОН в воде) и обратно-фазовой ВЭЖХ (YMC ODS-A 15020 мм, 5 мкм, 25 мл/мин, градиент от 40 до 80% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая (5-метилизоксазол-3-ил)метил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 с]пиридин-5-карбоксилат (107 мг, 9,7%) в виде бесцветной смолы. Аналитическая ВЭЖХ: чистота 99,5% (система В, RT = 4,09 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 4,51 мин), ES+: 305,2 [МН]+; МСВР, вычисленная для C15H20N4O3: 304,1535, найдено 304,1538. Пример 23. [(2S)-1-Метилпирролидин-2-ил]метил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 с]пиридин-5-карбоксилат и добавляли (S)-N-метилпирролидин-2-метанол (0,47 мл, 4,80 ммоль). Суспензию перемешивали при 0 С в течение 30 мин и добавляли к раствору промежуточного соединения 2 (1,33 г, 4,00 ммоль) в THF (10 мл) и реакционную смесь перемешивали при комнатной температуре. Дополнительно такую порциюNaH и N-метилпирролидин метанола в THF добавляли через 8 ч. Через 18 ч реакционную смесь гасили водой (10 мл) и растворители удаляли in vacuo. Остаток растворяли в EtOAc (100 мл), промывали 1 М водного Na2CO3 раствора (4100 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем, DCM (200 мл) с последующим 2, 4, 5, 10 и 20% МеОН в DCM (200 мл и обратно-фазовой ВЭЖХ (PhenomenexNaH (0,19 г, 5,00 ммоль, 60% дисперсия в минеральном масле) суспендировали THF (10 мл) при 0 С и добавляли (R)-1-метилпирролидин-3-ол (0,47 мл, 4,00 ммоль). Суспензию перемешивали при 0 С в течение 30 мин, добавляли к раствору промежуточного соединения 2 (1,33 г, 4,00 ммоль) в THF (10 мл) и реакционную смесь перемешивали при комнатной температуре. Дополнительно две такие порции NaH и(R)-1-метилпирролидин-3-ол в THF добавляли через 18 и 26 ч соответственно. Через 44 ч реакционную смесь гасили водой (10 мл) и растворители удаляли in vacuo. Остаток растворяли в EtOAc (100 мл), промывали 1 М водного Na2CO3 раствора (4100 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем, DCM (200 мл) с последующим 2, 4, 5, 10 и 20% МеОН в DCM (200 мл и обратно-фазовой ВЭЖХ(0,89 мл, 8,10 ммоль) и 4-нитрофенилхлороформат (1,63 г, 8,10 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли раствор промежуточного соединения 1 (1,16 г,3,90 ммоль) и DIPEA (2,69 мл, 15,4 ммоль) в DCM (20 мл) и полученный раствор перемешивали в течение 18 ч. Растворители удаляли in vacuo, остаток растворяли в МеОН (10 мл) и 1 М водного раствораNaOH (10 мл), реакционную смесь перемешивали в течение 2 ч и концентрировали in vacuo. Остаток растворяли в EtOAc (120 мл), органический слой промывали с помощью 1 М водного раствора Na2CO3(4100 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем, DCM (200 мл) с последующим 2,4 и 5% МеОН в DCM (200 мл и обратно-фазовой ВЭЖХ (YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин,градиент от 20 до 100% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая окситан-2 илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (93,4 мг, 8,7%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 100% (система В, RT = 3,58 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 3,84 мин), ES+: 280,1 [МН]+; МСВР, вычисленная для C14H21N3O3: 279,1583, найдено 279,1594.NMM (0,50 мл, 4,40 ммоль) и 4-нитрофенилхлороформат (0,90 г, 4,40 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Добавляли раствор промежуточного соединения 1(0,35 г, 2,10 ммоль) и DIPEA (1,10 г, 1,50 мл, 8,50 ммоль) в DCM (20 мл) и полученный раствор перемешивали в течение 3 дней. Растворители удаляли in vacuo, остаток растворяли в МеОН (4 мл) и 1 М водного раствора NaOH (4 мл), реакционную смесь перемешивали в течение 2 ч и концентрировали in vacuo. Остаток растворяли в EtOAc (60 мл), органический слой промывали с помощью 1 М водного Na2CO3 раствора (540 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали колоночной хроматографией (нормальная фаза, 20 г, Strata SI-1, гигаколонка с силикагелем, DCM (200 мл) с последующим 2, 4, 5 и 10% МеОН в DCM (200 мл и обратно-фазовой ВЭЖХ (YMC ODS-A 10020 мм, 5 мкм, 25 мл/мин, градиент от 0 до 40% (7 мин), затем 100% (3 мин) МеОН в 10% МеОН/вода), получая 2(пиридин-3-илокси)этил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (7,4 мг, 1%) в виде белого твердого вещества. Аналитическая ВЭЖХ: чистота 99,4% (система В, RT = 3,21 мин); аналитическая ЖХМС: чистота 100% (система В, RT = 3,20 мин), ES+: 331,5 [МН]+; МСВР, вычисленная для C17H22N4O3: 330,1692, найдено 330,1701. Пример 27. 2-(2,2,2-Трифторэтокси)этил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5 с]пиридин-5-карбоксилат 2-(2,2,2-Трифторэтокси)этанол (0,57 мл, 3,60 ммоль) растворяли в THF (5 мл), добавляли NaH (146 мг, 60% дисперсия в минеральном масле, 3,60 ммоль) и реакционную смесь перемешивали в течение 10 мин. Добавляли 4-нитрофенилхлороформат (726 мг, 3,60 ммоль) и реакционную смесь перемешивали в течение 16 ч. Промежуточное соединение 1 (297 мг, 1,80 ммоль) растворяли в THF (5 мл) и добавляли к реакционной смеси, которую перемешивали при комнатной температуре. Дополнительно три такие порции NaH, 2-(2,2,2-трифторэтокси)этанола и 4-нитрофенилхлороформата в THF добавляли через 8, 24 и 32 ч соответственно. Через 104 ч реакционную смесь гасили водой (10 мл) и растворители удаляли in vacuo. Остаток растворяли в МеОН (10 мл) и 1 М водного раствора NaOH (6 мл) и перемешивали в течение 1,5 ч. Растворители удаляли in vacuo и остаток растворяли EtOAc (100 мл). Органический слой промывали с помощью 1 М водного раствора Na2CO3 (650 мл), солевого раствора (250 мл), сушили (MgSO4) и растворители удаляли in vacuo. Остаток очищали обратно-фазовой ВЭЖХ (Phenomenex Synergi, RP-Hydro 15010 мм, 10 мкм, 15 мл/мин, градиент от 0 до 50% (12 мин) до 100% (3 мин) МеОН в воде, получая 2(2,2,2-трифторэтокси)этил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилат (3 мг, 0,5%) в виде бледно-желтой смолы. Аналитическая ВЭЖХ: чистота 99.3% (система В, RT = 4,49 мин). Аналитическая ЖХМС: чистота 97,1% (система В, RT = 4,50 мин), ES+: 336,5 [МН]+; МСВР, вычисленная для C14H20F3N3O3: 335,1457, найдено 335,1467. Биологические тесты Биологический анализ ингибиторов фермента SSAO. Все анализы производились при комнатной температуре с использованием очищенной рекомбинантно экспрессированной человеческой SSAO. Фермент подготавливали в точном соответствии с описанием у Ohman et al. (Protein Expression and Purification 2006, 46, 321-331). Активность фермента измеряли с использованием бензиламина в качестве субстрата и применяли продукцию перекиси водорода для обнаружения. В реакции связывания с пероксидазой хрена (HRP) в результате окисления перекисью водорода 10-ацетил-3,7-дигидроксифеноксазина образовался резоруфин, который является высокофлуоресцентным соединением (Zhout and Panchuk-Voloshina. Analytical Biochemistry 1997, 253, 169-174; Amplex Красная перекись водорода/Набор реактивов для пероксидного анализа, Invitrogen A22188). Вкратце, исследуемые соединения растворяли в диметилсульфоксиде (DMSO) до концентрации 10 мМ. Замеры дозозависимого эффекта оценивались либо путем приготовления последовательных разведений 1:10 в DMSO для построения 7-точечной кривой, либо путем приготовления последовательных разведений 1:3 в DMSO для построения 11-точечных кривых. Максимальные концентрации корректировали в зависимости от активности соединений и последующего разбавления в реакционном буфере (50 мМ фосфата натрия, рН 7,4), с выходом финальной концентрации DMSO2%. Ферменты и соединения предварительно инкубировали в плоскодонных титрационных микропланшетах около 60 мин, а затем начинали реакцию, добавляя смесь из HRP, бензиламина и реагента Amplex. Интенсивность флуорес- 22019167 ценции измеряли в нескольких временных точках (15, 20 и 30 мин), возбуждение при 544 нм и считывание эмиссии при 590 нм. Финальные концентрации реагентов в исследуемых лунках составили SSAO фермент - 2 мкг/мл, бензиламин - 100 мМ, реагент Amplex - 20 мМ, HRP - 0,1 U/мл и переменные концентрации исследуемого соединения. Ингибирование измеряли как процент снижения сигнала по сравнению с контрольным составом без ингибитора (только разбавленного с DMSO). Фоновый сигнал от образца, не содержащего SSAO фермента, вычитали из всех точек данных. Данные были вписаны в логистическую модель с четырьмя параметрами, а значения IC50 рассчитывались с использованием компьютерных программ GraphPad Prism 4 или XLfit 4. Проиллюстрированные в примерах соединения изобретения обычно имели значение IC50 на уровне 1-1000 нН. Полученные значения IC50 для типичных соединений представлены в таблице ниже или его фармацевтически приемлемая соль, сольват, гидрат, геометрический изомер, таутомер, оптический изомер или N-оксид, в котором(j) гетероциклил-С 1-4-алкила,в котором гетероарил выбран из пиридила, пиразинила, тиазолила и изоксазолила и в котором гетероциклил выбран из пирролидинила, тетрагидрофуранила и оксетанила; в котором любой фенильный, гетероциклильный или гетероарильный остаток необязательно замещен одним или более заместителями, независимо выбранными из галогена и С 1-4-алкила, и в котором каждый из R4A и R4B независимо выбран из:(b) С 1-6-алкила,при условии, что, когда R1 и R2 представляют собой водород, R3 не является бензилом. 2. Соединение по п.1, в котором R2 выбран из водорода, -С(О)О-C1-3-алкила и -C(O)NR4A'R4B' и в котором R4A' и R4B' независимо выбраны из водорода и C1-2-алкила. 3. Соединение по п.1 или 2, в котором R3 выбран из гало-C1-2-алкила, гало-C1-2-алкокси-C1-2-алкила,ди(C1-2-алкил)амино-C1-2-алкила, фенил-C1-2-алкила, фенокси-C1-2-алкила, C5-6-гетероарил-C1-2-алкила, С 56-гетероарилокси-C1-2-алкила, гетероциклила и гетероциклил-C1-2-алкила и в котором любой фенильный,гетероарильный или гетероциклильный остаток необязательно замещен одним или двумя заместителями,независимо выбранными из галогена и C1-2-алкила. 4. Соединение по п.1, где формула (I) определяет соединение, выбранное из 2,2,2-трихлорэтил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; 2-хлор-2,2-дифторэтил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; 3-хлорбензил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата;(3R)-1-метилпирролидин-3-ил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; оксетан-2-илметил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; 2-(пиридин-3-илокси)этил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата; 2-(2,2,2-трифторэтокси)этил 4-изопропил-1,4,6,7-тетрагидро-5 Н-имидазо[4,5-с]пиридин-5-карбоксилата. 5. Фармацевтический состав, содержащий соединение, указанное в любом из пп.1-4 в качестве активного вещества, в комбинации с фармацевтически приемлемым разбавителем или носителем. 6. Фармацевтический состав, содержащий соединение, имеющее формулу (Ia) в качестве активного вещества, в комбинации с фармацевтически приемлемым разбавителем или носителем. 7. Применение соединения по любому из пп.1-4 в производстве лекарственного средства для лечения или профилактики воспаления, воспалительного заболевания, иммунологического или аутоиммунного нарушения. 8. Применение соединения, имеющего формулу (Ia) в производстве лекарственного средства для лечения или профилактики воспаления, воспалительного заболевания, иммунологического или аутоиммунного нарушения. 9. Применение по п.7 или 8, в котором воспаление или воспалительное заболевание или иммунологическое или аутоиммунное нарушение является артритом, включая ревматоидный артрит, ювенильный ревматоидный артрит, остеоартрит и псориатический артрит, синовитом, васкулитом, состоянием, связанным с воспалением кишечника, включая болезнь Крона, неспецифический язвенный колит, воспалительное заболевание кишечника и синдром раздраженного кишечника, атеросклерозом, рассеянным склерозом, болезнью Альцгеймера, сосудистой деменцией, воспалительным заболеванием легочной тка- 24019167 ни, включая астму, хроническое обструктивное заболевание легких и синдром острой дыхательной недостаточности, фиброзным заболеванием, включая идиопатический легочный фиброз, сердечный фиброз и системный склероз, также известный как склеродермия, воспалительным кожным заболеванием, включая контактный дерматит, атопический дерматит и псориаз, синдромом системной воспалительной реакции, заражением крови, воспалительным и/или аутоиммунным состоянием печени, включая аутоиммунный гепатит, первичный биллиарный цирроз, алкогольную болезнь печени, склерозирующий холангит и аутоиммунный холангит, диабетом типа I или II и/или его осложнениями, хронической сердечной недостаточностью, застойной сердечной недостаточностью, ишемическим заболеванием, включая инсульт и травму ишемии, или инфарктом миокарда и/или его осложнениями. 10. Применение по п.7 или 8, в котором воспалительное заболевание является васкулитом.
МПК / Метки
МПК: A61K 31/4355, A61P 29/00, A61K 31/444, C07D 471/04, A61K 31/4995
Метки: активность, ингибирующие, соединения, аминооксидазы, семикарбазид-чувствительной
Код ссылки
<a href="https://eas.patents.su/26-19167-soedineniya-ingibiruyushhie-aktivnost-semikarbazid-chuvstvitelnojj-aminooksidazy.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения, ингибирующие активность семикарбазид-чувствительной аминооксидазы</a>






























