Новые фармацевтические соединения
Номер патента: 17329
Опубликовано: 30.11.2012
Авторы: Пюстюнен Ярмо, Алмарк Марко, Тиайнен Эйя, Бякстрем Рейо, Луйро Анне
Формула / Реферат
1. Соединение формулы I
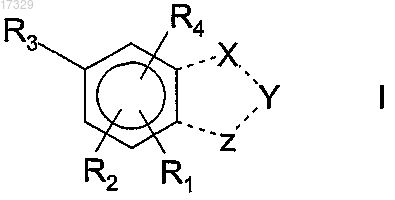
в которой R2 находится в орто-положении к R3 и R1 находится в орто-положении к R2 или
R1 находится в орто-положении к R3 и R4 находится в орто-положении к R1;
R1 представляет циано или нитро;
R2 представляет гидрокси;
R3 представляет гидрокси;
R4 представляет Н, (C1-C6)алкил, галоген(C1-C6)алкил, циано, формил, (C1-C6)алкил-(С=O)-, галоген или нитро;
пунктирная линия представляет одинарную или двойную связь; или
два из X, Y или Z представляют CR5(R6)m и один из X, Y или Z представляет N(R7)n, О или S; или
один из X, Y или Z представляет CR5(R6)m, один из X, Y или Z представляет N(R7)n и один из X, Y или Z представляет S;
m представляет независимо в каждом случае 0 или 1;
n представляет независимо в каждом случае 0, 1 или 2;
R5 представляет независимо в каждом случае Н, (C1-C6)алкил, галоген, галоген(C1-C6)алкил, (C1-C6)алкокси-(С=O)-, карбокси, арил, гетероарил, гетероциклил-(С=O)- или (R8)2N-(С=O)-, где указанные гетероциклил, арил или гетероарил, как сами по себе или как часть еще какой-нибудь группы, являются незамещенными или замещенными 1 или 2 заместителями, каждый из которых независимо представляет (C1-C6)алкил или гидрокси;
R6 представляет независимо в каждом случае Н или
R5 и R6, присоединенные, оба, к одному и тому же кольцевому атому углерода, образуют вместе с кольцевым атомом углерода, к которому они присоединены, -(С=O)-группу;
R7 представляет независимо в каждом случае (C1-C6)алкил или арил, где указанный арил является замещенным 1 заместителем, представляющим галоген;
R8 представляет независимо в каждом случае Н, (C1-C6)алкил, (C1-C6)алкокси, арил или арил(C1-C6)алкил, где указанный арил, как сам по себе или как часть еще какой-нибудь группы, является незамещенным или замещенным 1 или 2 заместителями, каждый из которых независимо представляет (C1-C6)алкил, галоген, гидрокси, карбокси или (C1-C6)алкокси;
или его фармацевтически приемлемая соль или эфир.
2. Соединение по п.1, отличающееся тем, что R2 находится в орто-положении к R3 и R1 находится в орто-положении к R2.
3. Соединение по п.1, отличающееся тем, что R1 находится в орто-положении к R3 и R4 находится в орто-положении к R1.
4. Соединение по любому из пп.1-3, отличающееся тем, что R4 представляет Н, галоген или нитро.
5. Соединение по п.4, отличающееся тем, что R4 представляет Н.
6. Соединение по любому из пп.1-5, отличающееся тем, что R1 представляет циано.
7. Соединение по любому из пп.1-5, отличающееся тем, что R1 представляет нитро.
8. Соединение по любому из пп.1-7, отличающееся тем, что одна из пунктирных линий представляет двойную связь.
9. Соединение по любому из пп.1-8, отличающееся тем, что два из X, Y или Z представляют CR5(R6)m и один из X, Y или Z представляет N(R7)n.
10. Соединение по любому из пп.1-8, отличающееся тем, что один из X, Y или Z представляет CR5(R6)m, один из X, Y или Z представляет N(R7)n и один из X, Y или Z представляет S.
11. Соединение по любому из пп.1-8, отличающееся тем, что два из X, Y или Z представляют CR5(R6)m и один из X, Y или Z представляет О.
12. Соединение по любому из пп.1-8, отличающееся тем, что два из X, Y или Z представляют CR5(R6)m и один из X, Y или Z представляет S.
13. Соединение по любому из пп.1-12, отличающееся тем, что
R5 представляет независимо в каждом случае Н, (C1-C6)алкил, галоген, галоген(C1-C6)алкил, (C1-C8)алкокси-(С=О)-, карбокси, арил, гетероарил, гетероциклил-(С=O)- или (R8)2N-(С=О)-, где указанные гетероциклил, арил или гетероарил, как сами по себе или как часть еще какой-нибудь группы, являются незамещенными или замещенными 1, 2 или 3 заместителями, представляющими, каждый независимо, (C1-C6)алкил или гидрокси;
R6 представляет независимо в каждом случае Н или R5 и R6, присоединенные, оба, к одному и тому же кольцевому атому углерода, образуют вместе с кольцевым атомом углерода, к которому они присоединены, -(С=O)-группу;
R8 представляет независимо в каждом случае (C1-C6)алкил или арил, где указанный арил является незамещенным или замещенным 1 или 2 заместителями, представляющими, каждый независимо, карбокси или (C1-C6)алкокси.
14. Соединение по п.13, отличающееся тем, что
m представляет независимо в каждом случае 0;
R5 представляет независимо в каждом случае Н, галоген, (C1-C8)алкокси-(С=O)-, карбокси, гетероциклил-(С=O)- или (R8)2N-(С=O)-, где указанный гетероциклил как часть еще какой-нибудь группы является незамещенным или замещенным 1, 2 или 3 заместителями, представляющими, каждый независимо, (C1-C6)алкил или гидрокси;
R8 представляет независимо в каждом случае (C1-C6)алкил или арил, где указанный арил является незамещенным или замещенным 1 заместителем, представляющим карбокси или (C1-C6)алкокси.
15. Соединение по п.1, отличающееся тем, что соединением является 2-(4-хлорфенил)-5,6-дигидрокси-4-нитро-2,3-дигидроизоиндол-1-он, 5,6-дигидрокси-7-нитро-3H-изобензофуран-1-он, 7-нитро-2-пиридин-4-илбензотиазол-5,6-диол, метансульфонат, 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновая кислота, этиловый эфир 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты, 3-хлор-5,6-дигидрокси-4-нитробензо[b]тиофен-2-карбоновая кислота, 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен, (3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон, диэтиламид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты, (3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)пиперидин-1-илметанон, фениламид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты, 3-[(3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбонил)амино]бензойная кислота, 4-[(3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбонил)амино]бензойная кислота, (4-метоксифенил)амид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты, 2-метил-7-нитробензотиазол-5,6-диол, (5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон, 5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновая кислота, 5,6-дигидрокси-7-нитробензофуран-2-карбоновая кислота, 5,6-дигидрокси-2-метил-7-нитробензо[d]изотиазол-3-он, (5,6-дигидрокси-3-метил-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон, этиловый эфир 5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты, 5,6-дигидрокси-4-нитроизобензофуран-1,3-дион, 5,6-дигидрокси-4-нитро-3H-изобензофуран-1-он, 5,6-дигидрокси-4,7-динитро-3H-изобензофуран-1-он, 7-нитро-2-фенилбензотиазол-5,6-диол, метиловый эфир 6,7-дигидрокси-5-нитробензо[b]тиофен-2-карбоновой кислоты, 1-(5,6-диметокси-7-нитробензо[b]тиофен-2-ил)нонан-1-он, (3-хлор-5,6-дигидрокси-4,7-динитробензо[b]тиофен-2-ил)морфолин-4-илметанон, (3,4-дихлор-5,6-дигидрокси-7-динитробензо[b]тиофен-2-ил)морфолин-4-илметанон, (3-хлор-5,6-дигидрокси-4-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон, (3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)-(2,6-диметилморфолин-4-ил)метанон, (3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)-(4-гидроксипиперидин-1-ил)метанон, (3-бромметил-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон, 5,6-дигидрокси-3-метил-2-(морфолин-4-карбонил)бензо[b]тиофен-4-карбонитрил или (3-хлор-5,6-дигидрокси-7-цианобензо[b]тиофен-2-ил)морфолин-4-илметанон.
16. Соединение по п.1, отличающееся тем, что соединением является (3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон; диэтиламид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты; (3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)пиперидин-1-илметанон; фениламид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты; 3-[(3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбонил)амино]бензойная кислота; 4-[(3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбонил)амино]бензойная кислота; (4-метоксифенил)амид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты; (3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)-(2,6-диметилморфолин-4-ил)метанон или (3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)-(4-гидроксипиперидин-1-ил)метанон.
17. Применение соединения по пп.1-16 или его фармацевтически приемлемой соли либо эфира в качестве лекарственного средства.
18. Применение соединения по любому из пп.1-16 или его фармацевтически приемлемой соли либо эфира для производства лекарственного средства для лечения заболевания или состояния, при котором показан агент, ингибирующий СОМТ.
19. Применение по п.18, при котором заболеванием является болезнь Паркинсона.
20. Способ лечения заболевания или состояния, при котором показан агент, ингибирующий СОМТ, который включает введение млекопитающему, нуждающемуся в таком лечении, эффективного количества по меньшей мере одного соединения по любому из пп.1-16.
21. Способ по п.20, отличающийся тем, что заболеванием является болезнь Паркинсона.
22. Способ по п.21, в котором усиливается терапевтическое действие леводопы.
23. Фармацевтическая композиция, включающая в качестве активного ингредиента по меньшей мере одно соединение по любому из пп.1-16 или его фармацевтически приемлемую соль либо эфир и фармацевтически приемлемый носитель, разбавитель и/или наполнитель.
24. Фармацевтическая композиция по п.23, отличающаяся тем, что композиция включает по меньшей мере один другой активный ингредиент.
25. Фармацевтическая композиция по п.23 или 24, отличающаяся тем, что композиция включает леводопу ((2S)-2-амино-3-(3,4-дигидроксифенил)пропановую кислоту) и карбидопу ((2S)-3-(3,4-дигидроксифенил)-2-гидразинилметилпропановую кислоту).
Текст
В изобретении описываются соединения формулы I, в которой R1-R4, X, Y и Z имеют значения,определенные в формуле изобретения, которые проявляют СОМТ фермент ингибирующую активность и таким образом полезны в качестве СОМТ ингибиторов. 017329 Область изобретения Настоящее изобретение относится к фармакологически активным бензоконденсированным пятичленным гетероциклам или их фармацевтически приемлемым солям и эфирам, а также к фармацевтическим композициям, содержащим их, и к их применению в качестве ингибиторов фермента катехол-Ометилтрансферазы (СОМТ). Предпосылки изобретения В уровне техники общеизвестно и принято, что ингибиторы СОМТ полезны в лечении болезни Паркинсона. Было показано, что ингибиторы СОМТ являются эффективными при клиническом использовании для лечения болезни Паркинсона в дополнение к терапии с помощью леводопа. Для того чтобы достичь постоянной концентрации леводопа в плазме, желательно, чтобы ингибитор СОМТ имел хорошую биодоступность и длительную продолжительность действия. Однако промышленно доступные ингибиторы СОМТ ассоциируются с довольно краткой продолжительностью действия и их оральная биодоступность ограничена. Было показано также, что ингибиторы СОМТ полезны при лечении, например, гипертензии, сердечной недостаточности и депрессии (см., например, патент США 5446194), а также в качестве ингибиторов для профилактики диабетических сосудистых дисфункций (см. патент США 6207706). Ингибиторы СОМТ описаны также как полезные для лечения или контролирования боли (см. патент США 6723754), а также для лечения синдрома беспокойных ног (RLS), который известен также как синдромEkbom (см. WO 2006/051154). RLS характеризуется непреодолимым побуждением двигать ногами, сопровождаемым другими неприятными ощущениями глубоко в ногах. В уровне техники известны некоторые соединения с ингибирующей СОМТ активностью. Например, производные катехола как ингибиторы СОМТ описаны, например, в патентах США 5389653; 5446194; 6150412; 6512136; WO 01/98250; WO 01/98251; WO 02/02548; патенте США 6903114, WO 2004/112729 и WO 2005/058228. Изофлавоновые производные как ингибиторы СОМТ описаны в патенте США 3973608. Что касается известных бензоконденсированных 5-членных гетероциклов, в работе Любчинской с сотрудниками в Химико-фармацевтическом журнале, 23 (1989), 843 описан 2-бензил-7-бром-6 нитробензофуран-4,5-диол. Краткое содержание изобретения Задачей настоящего изобретения является создание дополнительных ингибиторов фермента катехол-О-метилтрансферазы, которые могут использоваться для лечения заболеваний или состояний, при которых показаны полезными ингибиторы СОМТ. Соответственно задачей настоящего изобретения является создание дополнительных соединений, полезных в качестве агентов, ингибирующих СОМТ, при лечении млекопитающих, включая людей и животных. Кроме того, настоящее изобретение относится к фармацевтическим композициям, содержащим настоящие соединения. Благодаря медленному элиминированию с помощью глюкуронидирования ингибиторы СОМТ настоящего изобретения имеют улучшенную биодоступность и/или пролонгированное действие. В дополнение к сказанному соединения настоящего изобретения обладают более высокими первичными фармакологическими свойствами, т.е. СОМТ ингибирующей активностью. Кроме того, данные соединения не разобщают окислительное фосфорилирование и, таким образом, обладают желаемым профилем безопасности. Подробное описание изобретения Настоящее изобретение относится к новым ингибиторам СОМТ, имеющим общую формулу IR1 представляет циано или нитро;R4 представляет Н, (C1-C6)алкил, галоген(C1-C6)алкил, циано, формил, (C1-C6)алкил-(С=O)-, галоген или нитро; пунктирная линия представляет одинарную или двойную связь; два из X, Y или Z представляют CR5(R6)m и один из X, Y или Z представляет N(R7)n, О или S; или один из X, Y или Z представляют CR5(R6)m, один из X, Y или Z представляет N(R7)n и один изR5 представляет независимо в каждом случае Н, (C1-C6)алкил, галоген, галоген(C1-C6)алкил, (C1-C8) алкокси-(С=O)-, карбокси, арил, гетероарил, гетероциклил-(С=O)- или (R8)2N-(С=O)-, где указанные гетероциклил, арил или гетероарил, как сами по себе или как часть еще какой-нибудь группы, являются незамещенными или замещенными 1 или 2 заместителями, каждый из которых независимо представляетR5 и R6, присоединенные, оба, к одному и тому же кольцевому атому углерода, образуют вместе с кольцевым атомом углерода, к которому они присоединены, -(С=O)-группу;R7 представляет независимо в каждом случае (C1-C6)алкил или арил, где указанный арил является замещенным 1 заместителем, представляющим галоген;R8 представляет независимо в каждом случае Н, (C1-C6)алкил, (C1-C6)алкокси, арил или арил(C1C6)алкил, где указанный арил, как сам по себе или как часть еще какой-нибудь группы, является незамещенным или замещенным 1 или 2 заместителями, каждый из которых независимо представляет (C1C6)алкил, галоген, гидрокси, карбокси или (C1-C6)алкокси; или их фармацевтически приемлемой соли либо эфиру. В возможной подгруппе соединений формулы I R2 находится в орто-положении к R3 и R1 находится в орто-положении к R2. В еще одной возможной подгруппе соединений формулы I R1 находится в орто-положении к R3 и R4 находится в орто-положении к R1. В еще одной возможной подгруппе соединений формулы I R4 представляет Н, галоген или нитро,например Н. В еще одной возможной подгруппе соединений формулы I R1 представляет циано. В еще одной возможной подгруппе соединений формулы I R1 представляет нитро. В еще одной возможной подгруппе соединений формулы I одна из пунктирных линий представляет двойную связь. В дополнительной возможной подгруппе соединений формулы I два из X, Y или Z представляютCR5(R6)m и один из X, Y или Z представляет N(R7)n. В дополнительной возможной подгруппе соединений формулы I один из X, Y или Z представляетCR5(R6)m, один из X, Y или Z представляет N(R7)n и один из X, Y или Z представляет S. В дополнительной возможной подгруппе соединений формулы I два из X, Y или Z представляютCR5(R6)m и один из X, Y или Z представляет О. В дополнительной возможной подгруппе соединений формулы I два из X, Y или Z представляютCR5(R6)m и один из X, Y или Z представляет S. В еще одной возможной подгруппе соединений формулы IR5 представляет независимо в каждом случае Н, (C1-C6)алкил, галоген, галоген(C1-C6)алкил, (C1 С 8)алкокси-(С=O)-, карбокси, арил, гетероарил, гетероциклил-(С=O)- или (R8)2N-(C=O)-, где указанные гетероциклил, арил или гетероарил, как сам по себе или как часть еще какой-нибудь группы, являются незамещенными или замещенными 1, 2 или 3 заместителями, представляющими, каждый независимо,(C1-C6)алкил или гидрокси;R5 и R6, присоединенные, оба, к одному и тому же кольцевому атому углерода, образуют вместе с кольцевым атомом углерода, к которому они присоединены, -(С=O)-группу;R8 представляет независимо в каждом случае (C1-C6)алкил или арил, где указанный арил является незамещенным или замещенным 1 или 2 заместителями, представляющими, каждый независимо, карбокси или (C1-C6)алкокси. В дополнительной возможной подгруппе соединений формулы I соединением является 2-(4 хлорфенил)-5,6-дигидрокси-4-нитро-2,3-дигидроизоиндол-1-он, 5,6-дигидрокси-7-нитро-3H-изобензофуран-1-он, 7-нитро-2-пиридин-4-илбензотиазол-5,6-диол, метансульфонат, 3-хлор-5,6-дигидрокси-7 нитробензо[b]тиофен-2-карбоновая кислота,этиловый эфир 3-хлор-5,6-дигидрокси-7 нитробензо[b]тиофен-2-карбоновой кислоты,3-хлор-5,6-дигидрокси-4-нитробензо[b]тиофен-2 карбоновая кислота,3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен,(3-хлор-5,6-дигидрокси-7 нитробензо[b]тиофен-2-ил)морфолин-4-илметанон,диэтиламид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты, (3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)пиперидин-1 илметанон, фениламид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты, 3-[(3-хлор 5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбонил)амино]бензойная кислота, 4-[(3-хлор-5,6-дигидрокси 7-нитробензо[b]тиофен-2-карбонил)амино]бензойная кислота, (4-метоксифенил)амид 3-хлор-5,6 дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты, 2-метил-7-нитробензотиазол-5,6-диол, (5,6 дигидрокси-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон,5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновая кислота, 5,6-дигидрокси-7-нитробензофуран-2-карбоновая кислота, 5,6-дигидрокси-2 метил-7-нитробензо[d]изотиазол-3-он, (5,6-дигидрокси-3-метил-7-нитробензо[b]тиофен-2-ил)морфолин 4-илметанон, этиловый эфир 5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты, 5,6 дигидрокси-4-нитроизобензофуран-1,3-дион,5,6-дигидрокси-4-нитро-3H-изобензофуран-1-он,5,6-2 017329 дигидрокси-4,7-динитро-3H-изобензофуран-1-он, 7-нитро-2-фенилбензотиазол-5,6-диол, метиловый эфир 6,7-дигидрокси-5-нитробензо[b]тиофен-2-карбоновой кислоты, 1-(5,6-диметокси-7-нитробензо[b]тиофен-2-ил)нонан-1-он,(3-хлор-5,6-дигидрокси-4,7-динитробензо[b]тиофен-2-ил)морфолин-4 илметанон, (3,4-дихлор-5,6-дигидрокси-7-динитробензо[b]тиофен-2-ил)морфолин-4-илметанон, (3-хлор 5,6-дигидрокси-4-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон,(3-хлор-5,6-дигидрокси-7(3-хлор-5,6-дигидрокси-7-нитробеннитробензо[b]тиофен-2-ил)-(2,6-диметилморфолин-4-ил)метанон,зо[b]тиофен-2-ил)-(4-гидроксипиперидин-1-ил)метанон,(3-бромметил-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон, 5,6-дигидрокси-3-метил-2-(морфолин-4-карбонил)бензо[b]тиофен-4-карбонитрил или (3-хлор-5,6-дигидрокси-7-цианобензо[b]тиофен-2-ил)морфолин-4-илметанон. Специалисту в данной области техники очевидно, что в соединениях формулы (I) по меньшей мере одна из двух связей, представленных пунктирной линией и имеющих общий атом, представленный символом X, Y или Z, представляет собой одинарную связь и что сохраняется ароматический характер шестичленного кольца. Применяемые в описании термины имеют следующие значения. Термин "циано", применяемый в описании, относится к -CN группе. Термин "нитро", применяемый в описании, относится к -NO2 группе. Применяемый в описании термин "(C1-C6)алкил", как таковой или как часть какой-нибудь другой группы, относится к насыщенной углеводородной группе с прямой или разветвленной цепью, имеющей 1, 2, 3, 4, 5 или 6 атомов углерода. Характерные примеры (C1-C6)алкила включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил и н-гексил. Применяемый в описании термин "галоид" или "галоген", как таковой или как часть какой-нибудь другой группы, относится к фтору, хлору, брому или йоду. Применяемый в описании термин "галоген(C1-C6)алкил" относится по меньшей мере к одному галогену, определенному в описании, присоединенному к исходному или основному молекулярному фрагменту через (C1-C6)алкильную группу, определенную в описании. Характерные примеры галоген(C1 С 6)алкила включают, но не ограничиваются ими, фторметил, хлорметил, дифторметил, трифторметил, 2 хлорэтил, 3-бромпропил и 2-хлорпропил. Применяемый в описании термин "формил" относится к -СНО группе. Применяемый в описании термин "гидрокси", как таковой или как часть какой-нибудь другой группы, относится к -ОН группе. Применяемый в описании термин "(C1-C6)алкокси", как таковой или как часть какой-нибудь другой группы, относится к (C1-С 6)алкильной группе, определенной в описании, присоединенной к основному молекулярному фрагменту через атом кислорода. Характерные примеры (C1-C6)алкокси включают, но не ограничиваются ими, метокси, этокси, н-пропокси, н-бутокси, изобутокси, втор-бутокси и трет-бутокси. Применяемый в описании термин "(C1-C8)алкокси", как таковойили как часть какой-нибудь другой группы, относится к насыщенной углеводородной группе с прямой или разветвленной цепью, имеющей 1, 2, 3, 4, 5, 6, 7 или 8 атомов углерода, присоединенной к исходному молекулярному фрагменту через атом кислорода. Характерные примеры (C1-C8)алкокси включают, но не ограничиваются ими, метокси,этокси, н-пропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси и н-октокси. Применяемый в описании термин "арил", как таковой или как часть какой-нибудь другой группы,относится к моно- или бициклической ароматической карбоциклической группе, содержащей 6 или 10 атомов углерода. Применяемый в описании термин "арил(C1-C6)алкил" относится к арильной группе, определенной в описании, присоединенной к исходному или основному молекулярному фрагменту через (C1C6)алкильную группу, определенную в описании. Характерные примеры арил(C1-C6)алкила включают,но не ограничиваются ими, фенилметил и нафт-1-илметил. Применяемый в описании термин "гетероциклил", как таковой или как часть какой-нибудь другой группы, относится к 5-, 6- или 7-членной насыщенной циклической группе, содержащей 1 или 2 гетероатома, каждый из которых независимо выбран из N, О и S. Характерные примеры гетероциклила включают, но не ограничиваются ими, пирролидинил, пиперидинил, пиперазинил, морфолинид и азепанил. Применяемый в описании термин "карбокси" относится к -СООН группе. Применяемый в описании термин "гетероарил" относится к 5-, 6- или 7-членной ароматической группе, содержащей 1, 2, 3 или 4 гетероатома, каждый из которых независимо выбран из N, О и S. Характерные примеры гетероарила включают, но не ограничиваются ими, пирролил, фуранил, тиофенил,имидазолил, оксазолил, тиазолил, триазолил, тетразолил, пиразолил, пиридинил, пиримидинил, пиразинил, пиридазинил, пиранил и азепинил. Применяемый в описании термин "(C1-C6)алкокси(C1-C6)алкил", как таковой или как часть какойнибудь другой группы, относится по меньшей мере к одной (C1-C6)алкоксигруппе, определенной в описании, присоединенной к исходному молекулярному фрагменту через (C1-C6)алкильную группу, определенную в описании. Характерные примеры (C1-C6)алкокси (C1-C6)алкила включают, но не ограничиваются ими, метоксиметил, пропоксиметил, 2-этоксиэтил, 2,2-диметоксиэтил, 1-метил-2-пропоксиэтил и 4-3 017329 метоксибутил. Применяемый в описании термин "арил(C1-C6)алкокси", как таковой или как часть какой-нибудь другой группы, относится к арильной группе, определенной в описании, присоединенной к исходному молекулярному фрагменту через (C1-C6)алкоксигруппу, определенную в описании. Характерные примеры арил(C1-C6)алкокси включают, но не ограничиваются ими, фенилметокси, 2-фенилэтокси и 2-нафт-2 илэтокси. Фармацевтически приемлемые соли, например соли металлов и кислотно-аддитивные соли, как с органическими, так и неорганическими кислотами хорошо известны в области фармацевтических продуктов. Характерные примеры фармацевтически приемлемых солей металлов включают, но не ограничиваются ими, соли лития, натрия, калия, кальция, магния, алюминия и цинка. Характерные примеры фармацевтически приемлемых кислотно-аддитивных солей включают, но не ограничиваются ими, хлориды, бромиды, сульфаты, нитраты, фосфаты, сульфонаты, метансульфонаты, формиаты, тартраты, малеаты, цитраты, бензоаты, салицилаты и аскорбаты. Фармацевтически приемлемые сложные эфиры, когда они применимы, могут получаться с помощью известных методов с использованием фармацевтически приемлемых кислот, которые являются общепринятыми в области фармацевтических продуктов и которые сохраняют фармакологические свойства в свободной форме. Неограничивающие примеры данных эфиров включают эфиры алифатических или ароматических спиртов, например метиловые, этиловые, н-пропиловые, изопропиловые, нбутиловые, изобутиловые, втор-бутиловые и трет-бутиловые сложные эфиры. Изобретение включает в свой объем все возможные геометрические изомеры, например Z- и Еизомеры (цис- и транс-изомеры), соединений, также как и все возможные оптические изомеры, например диастереомеры и энантиомеры, соединений. Кроме того, изобретение включает в свой объем как индивидуальные изомеры, так и любые их смеси, например рацемические смеси. Индивидуальные изомеры могут быть получены с использованием соответствующих изомерных форм исходных материалов, или они могут быть выделены после получения конечного соединения в соответствии с общепринятыми способами разделения. Для отделения оптических изомеров, например энантиомеров, из смеси их могут использоваться общепринятые методы расщепления, например фракционная кристаллизация. Соединения формулы I могут быть получены с помощью множества путей синтеза по аналогии или в соответствии с методами, известными в литературе, с использованием подходящих исходных материалов. Производные бензофурана могут быть получены, например, в соответствии с реакционной схемой 1. Схема 1 На схеме 1 метоксизаместители находятся в положении орто по отношению друг к другу, R4 имеет значения, определенные выше, и в положении орто по отношению или к ацильному заместителю, или к гидроксизаместителю в формуле II, и R5 имеет значения, определенные выше. Ацилфенольное соединение алкилируется функционализированным галоидпроизводным при комнатной температуре в присутствии подходящего основания в подходящем растворителе, например карбоната калия в N,Nдиметилформамиде или гидрида натрия в тетрагидрофуране. Активированная метиленовая группа конденсируется с карбонилом с использованием подходящего основания, например этанолята натрия. В дополнение к карбэтоксигруппе метиленовая группа может активироваться любой активирующей метилен группой, такой как нитро, циано, ацил, арил, арилокси, алкилтио или арилтио. Карбэтоксигруппа может затем превращаться при желании в другие функциональные группы. Получение бензофурановых производных дополнительно иллюстрируется в примере 18. 2,3-Дигидроизоиндол-1-оновые производные могут быть получены, например, в соответствии с реакционной схемой 2. На схеме 2 метоксизаместители находятся в положении орто по отношению друг к другу, R4 имеет значения, определенные выше, и в положении орто по отношению или к метоксикарбонильному заместителю, или к CBrR5R6-заместителю в формуле V, и R5, R6 и R7 имеют значения, определенные выше. Кольцо образуется путем нагревания с обратным холодильником соединения формулы V с амином в подходящем растворителе, например толуоле. Получение 2,3-дигидроизоиндол-1-оновых производных дополнительно иллюстрируется в примере 1. Производные бензотиазола могут получаться, например, в соответствии со схемой 3. Схема 3 На схеме 3 метоксизаместители находятся в положении орто по отношению друг к другу, R4 имеет значения, определенные выше, и в 4- или 7-положении в формуле VIII, и R5 представляет, например,арил или гетероарил. Кольцо образуется путем нагревания с обратным холодильником анилина с альдегидом и элементарной серой в подходящем растворителе, например диметилацетамиде. Получение производных бензотиазола дополнительно иллюстрируется в примерах 3, 15 и 25. Производные бензо[b]тиофена могут получаться, например, в соответствии со схемой реакции 4. Схема 4 На схеме 4 метоксизаместители находятся в положении орто по отношению друг к другу, R4 имеет значения, определенные выше, и в 4- или 7-положении в формуле XI, и R5' представляет, например, (C1C8)алкокси, N-содержащий гетероциклил или (R8)2N-, где R8 имеет значения, определенные выше. Бензальдегид конденсируется с малоновой кислотой в подходящем растворителе, например пиридине, давая в результате производное акриловой кислоты. Кольцо образуется с помощью реакции кислоты с тионилхлоридом в подходящем растворителе, например хлорбензоле или толуоле. Еще один путь получения производных бензо[b]тиофена иллюстрируется на схеме 5. Схема 5 На схеме 5 метоксизаместители находятся в положении орто по отношению друг к другу. Бензальдегид конденсируется с роданином XII в подходящем растворителе, например карбоновой кислоте, такой как уксусная кислота, давая в результате промежуточное соединение XIII. С помощью подходящего основания, например гидроксида натрия, промежуточное соединение превращается в производное 2 меркаптоакриловой кислоты. Кольцо образуется с помощью обработки меркаптосоединения, например-5 017329 йодом, в подходящем растворителе, например тетрагидрофуране. Карбоксигруппа при желании может затем превращаться в другие функциональные группы. Получение производных бензо[b]тиофена дополнительно иллюстрируется в примерах 4-14, 16-17,20-21 и 26-35. Деалкилирование получающихся в результате диалкоксипромежуточных соединений, также как и включение заместителя R1, представляющего циано или нитро, описывается в примерах получения конкретных соединений. Специалистам в данной области техники будет очевидно, что любой исходный материал или промежуточное соединение в описанных выше реакциях может при необходимости защищаться способом,хорошо известным в области химии. Защита любой функциональной группы может впоследствии сниматься по способу, известному в технике. Описанные выше способы синтеза предназначены для иллюстрации получения соединений формулы I, и данное получение никоим образом не ограничивается ими, т.е. имеются также другие возможные методы синтеза, которые находятся в объеме общих знаний специалистов в данной области. Соединения формулы I при желании можно превращать в форму их фармацевтически приемлемых солей или эфиров с использованием хорошо известных в технике способов. Настоящее изобретение будет пояснено более подробно с помощью следующих примеров. Данные примеры предназначены только для целей иллюстрации и не ограничивают объем изобретения, определенный в пунктах формулы изобретения. Пример 1. 2-(4-Хлорфенил)-5,6-дигидрокси-4-нитро-2,3-дигидроизоиндол-1-он. 2-(4-Хлорфенил)-5,6-диметокси-2,3-дигидроизоиндол-1-он. Раствор метилового эфира 2-бромметил-4,5-диметоксибензойной кислоты (2,9 г), 4-хлоранилина(1,28 г) и триэтиламина (1,4 мл) нагревали с обратным холодильником в толуоле в течение 6 ч. Затем реакционную смесь перемешивали в ледяной бане, отфильтровывали и промывали 1 М соляной кислотой и водой. Выход: 0,74 г. 1H ЯМР (ДМСО-d6):3,85 (с, 3H, СН 3 О), 3,88 (с, 3H, СН 3 О), 4,89 (с, 2 Н, СН 2), 7,23 (с, 1 Н, ArH),7,24 (с, 1 Н, ArH), 7,48 (д, 2 Н, J=8,9 Гц), 7,91 (д, 2 Н, J=8,9 Гц). 2-(4-Хлорфенил)-5,6-дигидрокси-2,3-дигидроизоиндол-1-он. 2-(4-Хлорфенил)-5,6-диметокси-2,3-дигидроизоиндол-1-он (0,74 г) диметилировали 4 экв. трибромида бора, как описано в примере 8. Выход: 0,79 г (сырой материал использовали как таковой в следующей стадии). 1 Н ЯМР (ДМСО-d6):4,80 (с, 2 Н, СН 2), 6,77 (с, 1 Н, ArH), 6,82 (с, 1 Н, ArH), 7,48 (д, 2 Н, J=9,1 Гц),7,91 (д, 2 Н, J=9,1 Гц). 6-Ацетокси-2-(4-хлорфенил)-3-оксо-2,3-дигидро-1 Н-изоиндол-5-иловый эфир уксусной кислоты. 2-(4-Хлорфенил)-5,6-дигидрокси-2,3-дигидроизоиндол-1-он (0,79 г сырого материала) и уксусный ангидрид (10 мл) перемешивали при 80 С с 1 каплей серной кислоты в качестве катализатора в течение 1 ч. Смесь выливали в ледяную воду, отфильтровывали и перекристаллизовывали из уксусной кислоты. Выход: 0,5 г 1 Н ЯМР (ДМСО-d6):2,29 (с, 3H, СН 3 СОО), 2,34 (с, 3H, CH3COO), 5,04 (с, 2 Н, СН 2), 7,51 (д, 2 Н,J=8,8 Гц), 7,62 (с, 1 Н, ArH), 7,70 (с, 1 Н, ArH), 7,92 (д, 2 Н, J=8,8 Гц). 2-(4-Хлорфенил)-6-гидрокси-3-оксо-2,3-дигидро-1 Н-изоиндол-5-иловый эфир уксусной кислоты. Раствор 6-ацетокси-2-(4-хлорфенил)-3-оксо-2,3-дигидро-1 Н-изоиндол-5-илового эфира уксусной кислоты (0,5 г) в сухом N,N-диметилформамиде (15 мл) обрабатывали морфолином (0,13 мл) при 0-5 С и затем перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь выливали в ледяную воду и отфильтровывали. Выход: 0,34 г. 1H ЯМР (ДМСО-d6):2,29 (с, 3H, СН 3 СОО), 4,92 (с, 2 Н, СН 2), 7,14 (с, 1 Н, ArH), 7,43 (с, 1 Н, ArH),7,48 (д, 2 Н, J=8,9 Гц), 7,90 (д, 2 Н, J=8,9 Гц). 2-(4-Хлорфенил)-6-гидрокси-7-нитро-3-оксо-2,3-дигидро-1 Н-изоиндол-5-иловый эфир уксусной кислоты. Суспензию 2-(4-хлорфенил)-6-гидрокси-3-оксо-2,3-дигидро-1 Н-изоиндол-5-илового эфира уксусной кислоты (0,34 г) в уксусной кислоте (7 мл) обрабатывали 2 М азотной кислотой в дихлорметане (0,6 мл). Через 1 ч реакционную смесь отфильтровывали. Выход: 0,24 г (сырой материал использовали как таковой в следующей стадии). 1 Н ЯМР (ДМСО-d6):2,35 (с, 3H, СН 3 СОО), 5,25 (с, 2 Н, СН 2), 7,50 (д, 2 Н, J=8,8 Гц), 7,89 (с, 1 Н,ArH), 7,93 (д, 2 Н, J=8,8 Гц). 2-(4-Хлорфенил)-5,6-дигидрокси-4-нитро-2,3-дигидроизоиндол-1-он. 2-(4-Хлорфенил)-6-гидрокси-7-нитро-3-оксо-2,3-дигидро-1 Н-изоиндол-5-иловый эфир уксусной кислоты (0,24 г сырого материала) нагревали с обратным холодильником в метаноле (15 мл) с тремя каплями концентрированной хлористо-водородной кислоты в течение 6 ч. Затем реакционную смесь охлаждали и отфильтровывали. Выход: 80 мг. 1 Н ЯМР (ДМСО-d6):5,13 (с, 2 Н, СН 2), 7,34 (с, 1 Н, ArH), 7,48 (д, 2 Н, J=8,7 Гц), 7,91 (д, 2 Н, J=8,7-6 017329 Гц), 10,4-11,5 (ушир., 2 Н, ОН). Пример 2. 5,6-Дигидрокси-7-нитро-3H-изобензофуран-1-он. К раствору 5,6-дигидрокси-3H-изобензофуран-1-она (0,4 г) в серной кислоте при -30 С добавляли раствор 5 М азотной кислоты в серной кислоте (0,55 мл). Реакционной смеси давали возможность нагреться до комнатной температуры и затем выливали в ледяную воду. Продукт отфильтровывали и перекристаллизовывали из уксусной кислоты. Выход: 0,2 г. 1(15 мл) в течение 5 ч. Холодную реакционную смесь выливали в метанол, содержали в условиях ледяной бани в течение 30 мин и отфильтровывали. Продукт промывали метанолом и дисульфидом углерода. Выход: 6,14 г. 1H ЯМР (ДМСО-d6):3,88 (с, 3H, СН 3 О), 3,89 (с, 3H, СН 3 О), 7,67 (с, 1 Н, ArH), 7,76 (с, 1 Н, ArH),7,94 (д, 2 Н, J=6,4 Гц), 8,75 (д, 2 Н, J=6,4 Гц). 5,6-Диметокси-4-нитро-2-пиридин-4-илбензотиазол. К раствору 5,6-диметокси-2-пиридин-4-илбензотиазола (1,1 г) в серной кислоте (10 мл) добавляли нитрат калия (0,5 г). Через 60 мин выдерживания при комнатной температуре смесь выливали в ледяную воду и отфильтровывали. Перекристаллизация из ацетона давала чистый продукт. Выход: 0,8 г. 1 Н ЯМР (ДМСО-d6):4,05 (с, 3H, СН 3 О), 4,07 (с, 3H, СН 3 О), 8,07 (д, 2 Н, J=6 Гц), 8,25 (с, 1 Н, ArH),8,81 (д, 2 Н, J=6 Гц). Метансульфонат 7-нитро-2-пиридин-4-илбензотиазол-5,6-диола. Раствор 5,6-диметокси-4-нитро-2-пиридин-4-илбензотиазола (0,4 г) нагревали с обратным холодильником в 48% растворе HBr (14,5 мл) в течение 2 ч. Кристаллы фильтровались, брались в метансульфоновую кислоту (2 мл), нагреваясь при этом, и разбавлялись метанолом. После перемешивания в ледяной бане соль отфильтровывали. Выход: 0,44 г. Точка плавления: 350 С. 1H ЯМР (ДМСО-d6):2,37 (с, 3H, CH3SO3-), 7,83 (с, 1 Н, ArH), 8,42 (д, 2 Н, J=6,3 Гц), 8,94 (д, 2 Н,J=6,3 Гц). Пример 4. 3-Хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновая кислота. 3-(3,4-Диметоксифенил)акриловая кислота. 3,4-Диметоксибензальдегид (5 г), малоновую кислоту (4,7 г), пиперидин (0,5 мл) и пиридин (15 мл) нагревали с обратным холодильником в течение 6 ч. Реакционную смесь выливали в ледяную воду и подкисляли 6 М хлористо-водородной (соляной) кислотой. Полученное в результате твердое вещество отфильтровывали, промывали водой и сушили в вакууме. 1 Н ЯМР (ДМСО-d6):3,80 (д, 6 Н), 6,44 (д, 1 Н), 7,20 (кв., 1 Н), 7,31 (д, 1 Н), 7,4 (д, 1 Н), 12 (ушир.,1 Н). Метиловый эфир 3-хлор-5,6-диметоксибензо[b]тиофен-2-карбоновой кислоты. 3-(3,4-Диметоксифенил)акриловую кислоту (1,0 г) суспендировали в хлорбензоле (25 мл) и затем добавляли тионилхлорид (1,5 мл). Суспензию перемешивали при комнатной температуре и через 30 мин добавляли пиридин (0,1 мл). Реакционную смесь нагревали с обратным холодильником в течение 24 ч. Полученное в результате твердое вещество отфильтровывали и растворяли в хлорбензоле (20 мл) и метаноле (20 мл). Реакционную смесь нагревали с обратным холодильником в течение 1 ч и затем охлаждали. Твердое вещество отфильтровывали, промывали метанолом и сушили в вакууме. 1 Н ЯМР (ДМСО-d6):3,88 (с, 3H), 3,89 (с, 3H), 3,90 (с, 3H), 7,29 (с, 1 Н), 7,29 (с, 1 Н), 7,68 (с, 1 Н). 3-Хлор-5,6-дигидроксибензо[b]тиофен-2-карбоновая кислота. Метиловый эфир 3-хлор-5,6-диметоксибензо[b]тиофен-2-карбоновой кислоты (0,2 г) суспендировали в дихлорметане (10 мл) в атмосфере азота, охлаждали до -20 С и добавляли трехбромистый бор (0,4 мл). Полученную в результате смесь перемешивали при -20 С в течение 30 мин и затем в холодном состоянии в течение ночи. Смесь выливали в ледяную воду, экстрагировали в этилацетате и выпаривали досуха. Продукт использовали на следующей стадии без какой-либо очистки. 3-Хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновая кислота. 3-Хлор-5,6-дигидроксибензо[b]тиофен-2-карбоновую кислоту растворяли в этилацетате и при 20 С постепенно добавляли раствор азотной кислоты в дихлорметане (2 М, 0,38 мл). Раствор перемешивали в течение 10 мин при комнатной температуре, а затем выливали в ледяную воду и экстрагировали этилацетатом. Органические экстракты объединяли, сушили и выпаривали досуха. Остаток перекристаллизовывали из уксусной кислоты. Выход: 94 мг. Точка плавления: 298-300 С. 1(2 мл) и тионилхлорид (0,16 мл) нагревали с обратным холодильником в течение 4 ч. Этанол выпарива-7 017329 ли. Остаток нагревали с чистым этанолом и горячую смесь отфильтровывали. Продукт сушили в вакууме. Выход: 34 мг. Точка плавления: 215 С. 1 Н ЯМР (ДМСО-d6):1,36 (т, 3H), 4,36 (кв., 2 Н), 7,50 (с, 1 Н). Пример 6. 3-Хлор-5,6-дигидрокси-4-нитробензо[b]тиофен-2-карбоновая кислота. Метиловый эфир 3-хлор-5-бензилокси-6-метоксибензо[b]тиофен-2-карбоновой кислоты. 3-(3-Бензилокси-4-метоксифенил)акриловую кислоту превращали в метиловый эфир 3-хлор-5 бензилокси-6-метоксибензо[b]тиофен-2-карбоновой кислоты путем повторения способа из примера 4, за исключением использования 3-(3-бензилокси-4-метоксифенил)акриловой кислоты вместо 3-(3,4 диметоксифенил)акриловой кислоты. Продукт представлял собой смесь двух соединений, и его использовали в следующей стадии без какой-либо очистки. Метиловый эфир 3-хлор-5-гидрокси-6-метоксибензо[b]тиофен-2-карбоновой кислоты. Метиловый эфир 3-хлор-5-бензилокси-6-метоксибензо[b]тиофен-2-карбоновой кислоты (0,7 г), уксусную кислоту (17,5 мл) и концентрированную хлористо-водородную кислоту (2,1 мл) нагревали с обратным холодильником в течение 6 ч. Смесь охлаждали и выпаривали досуха. Полученную в результате смесь сначала экстрагировали в диэтиловый эфир, а затем в раствор 1 М гидроксида натрия. Водную фазу подкисляли 6 М хлористо-водородной кислотой. Раствор перемешивали в холоде в течение 2 ч и затем отфильтровывали. Твердое вещество промывали водой и сушили в вакууме. Продукт представлял собой смесь двух соединений, и его использовали в следующей стадии без какой-либо очистки. 3-Хлор-5-гидрокси-6-метоксибензо[b]тиофен-2-карбоновая кислота. Метиловый эфир 3-хлор-5-гидрокси-6-метоксибензо[b]тиофен-2-карбоновой кислоты (0,5 г) растворяли в метаноле (10 мл) и добавляли 5 М гидроксид натрия (10 мл). Раствор нагревали с обратным холодильником в течение 2 ч. Метанол выпаривали и полученный в результате раствор подкисляли 2 М хлористо-водородной кислотой. Полученное в результате твердое вещество сушили в вакууме. Продукт использовали на следующей стадии без какой-либо очистки. 3-Хлор-5-гидрокси-6-метокси-4-нитробензо[b]тиофен-2-карбоновая кислота. 3-Хлор-5-гидрокси-6-метоксибензо[b]тиофен-2-карбоновую кислоту (0,28 г) растворяли в этилацетате и при 20 С постепенно добавляли раствор азотной кислоты в дихлорметане (2 М, 0,75 мл). Раствор перемешивали при комнатной температуре в течение 10 мин и затем выливали в ледяную воду, экстрагировали этилацетатом и выпаривали досуха. 1 Н ЯМР (ДМСО-d6):3,98 (с, 3H), 7,90 (с, 1 Н), 10,9 (ушир., 1 Н), 13,4-14,4 (ушир., 1 Н). 3-Хлор-5,6-дигидрокси-4-нитробензо[b]тиофен-2-карбоновая кислота. К раствору 3-хлор-5-гидрокси-6-метокси-4-нитробензо[b]тиофен-2-карбоновой кислоты (0,2 г), пиридина (6,3 мл) в этилацетате (5 мл) постепенно добавляли треххлористый алюминий (0,32 г). Реакционную смесь нагревали с обратным холодильником при 90 С в течение 2 ч. К теплому (60 С) реакционному раствору добавляли смесь концентрированной хлористо-водородной кислоты и льда (1:1). Продукт экстрагировали в этилацетат, сушили и выпаривали. Остаток обрабатывали диэтиловым эфиром и полученное в результате твердое вещество отфильтровывали. Выход: 32 мг. Точка плавления: 215-219 С. 1 Н ЯМР (ДМСО-d6):7,54 (с, 1 Н), 10-12 (ушир., 2 Н), 13,5-14 (ушир., 1 Н). Пример 7. 3-Хлор-5,6-дигидрокси-7-нитробензо[b]тиофен. Метиловый эфир 3-хлор-6-бензилокси-5-метоксибензо[b]тиофен-2-карбоновой кислоты. 3-(4-Бензилокси-3-метоксифенил)акриловую кислоту превращали в метиловый эфир 3-хлор-6 бензилокси-5-метоксибензо[b]тиофен-2-карбоновой кислоты путем повторения способа примера 4, за исключением использования 3-(4-бензилокси-3-метоксифенил)акриловой кислоты вместо 3-(3,4 диметоксифенил)акриловой кислоты. 1 Н ЯМР (ДМСО-d6):3,88 (с, 3H), 3,90 (с, 3H), 5,20 (с, 2 Н), 7,32-7,50 (м, 5 Н), 7,81 (с, 1 Н). 3-Хлор-6-гидрокси-5-метоксибензо[b]тиофен. Метиловый эфир 3-хлор-6-бензилокси-5-метоксибензо[b]тиофен-2-карбоновой кислоты (1,33 г), метанол (27 мл) и 5 М гидроксид натрия (27 мл) нагревали с обратным холодильником в течение 2,5 ч. Метанол выпаривали и полученное в результате твердое вещество отфильтровывали. Твердое вещество растворяли в воде и подкисляли концентрированной хлористо-водородной кислотой. Смесь перемешивали в водно-ледяной бане, отфильтровывали и сушили в вакууме. Полученное в результате твердое вещество,медь (0,17 г) и хинолин (10,6 мл) нагревали при 210 С в течение 1 ч. К охлажденной смеси добавляли 10% хлористо-водородную кислоту (26 мл) и растворяли в этилацетате. Раствор промывали 10% карбонатом натрия и 1 М хлористо-водородной кислотой, а затем выпаривали досуха. Полученный остаток,уксусную кислоту (24 мл) и концентрированную хлористо-водородную кислоту (3,2 мл) нагревали с обратным холодильником в течение 5 ч. Раствор выпаривали досуха. Остаток растворяли в диэтиловом эфире и затем экстрагировали 1 М гидроксидом натрия. Водную фазу подкисляли 6 М хлористоводородной кислотой и экстрагировали в этилацетат. Раствор сушили, выпаривали досуха и затем растирали с диэтиловым эфиром и отфильтровывали. 1-8 017329 3-Хлор-6-гидрокси-5-метокси-7-нитробензо[b]тиофен. 3-Хлор-6-гидрокси-5-метоксибензо[b]тиофен (0,39 г) растворяли в этилацетате (26 мл). К раствору постепенно добавляли раствор азотной кислоты в дихлорметане (2 М, 0,9 мл) при комнатной температуре. Раствор перемешивали при комнатной температуре в течение 10 мин, а затем выливали в ледяную воду, экстрагировали этилацетатом и выпаривали досуха. Продукт очищали колоночной хроматографией с использованием смеси толуол-этилацетат-уксусная кислота 8:1:1 в качестве элюента. 1H ЯМР (ДМСО-d6):4,02 (с, 3H), 7,58 (с, 1 Н), 7,87 (с, 1 Н). 3-Хлор-5,6-дигидрокси-7-нитробензо[b]тиофен. К раствору 3-хлор-6-гидрокси-5-метокси-7-нитробензо[b]тиофена (0,13 г) и пиридина (3,3 мл) постепенно добавляли треххлористый алюминий (0,09 г). Реакционную смесь нагревали при 90 С в течение 2 ч. К теплой (60 С) реакционной смеси добавляли смесь льда и концентрированной хлористоводородной кислоты (1:1). Продукт отфильтровывали, промывали 1 М хлористо-водородной кислотой и водой и сушили в вакууме. Выход: 110 мг. Точка плавления: 182-184 С. 1(3-Хлор-5,6-диметоксибензо[b]тиофен-2-ил)морфолин-4-илметанон. 3-(3,4-Диметоксифенил)акриловая кислота превращалась в (3-хлор-5,6-диметоксибензо[b]тиофен-2 ил)морфолин-4-ил метанон путем повторения способа из примера 4, за исключением использования морфолина вместо метанола. 1 Н ЯМР (ДМСО-d6):3,53 (м, 4 Н), 3,64 (м, 4 Н), 3,85 (с, 3H), 3,88 (с, 3H), 7,21 (с, 1 Н), 7,67 (с, 1 Н).(3-Хлор-5,6-диметоксибензо[b]тиофен-2-ил)морфолин-4-илметанон (8,6 г) суспендировали в дихлорметане (50 мл) в атмосфере азота, охлаждали до -20 С и по каплям обрабатывали раствором 1 М трибромида бора (100 мл) в дихлорметане. Полученную в результате суспензию перемешивали при-20 С в течение 30 мин и затем в охлажденном состоянии в течение ночи. Смесь выливали в ледяную воду и перемешивали в течение 30 мин при комнатной температуре. Продукт отфильтровывали и промывали водой. 1 Н ЯМР (ДМСО-d6):3,40 (ушир., 4 Н), 3,62 (ушир., 4 Н), 7,11 (с, 1 Н), 7,32 (с, 1 Н), 9,5-10,0 (ушир.,2 Н).(3-Хлор-5,6-дигидроксибензо[b]тиофен-2-ил)морфолин-4-илметанон (7,7 г) растворяли в этилацетате (500 мл) и при 20 С постепенно добавляли раствор азотной кислоты в дихлорметане (2 М, 13,6 мл). Раствор перемешивали в течение 30 мин при комнатной температуре, а затем выливали в ледяную воду,полученное в результате твердое вещество отфильтровывали и сушили в вакууме. Продукт перекристаллизовывали из уксусной кислоты. Выход: 4,8 г. Точка плавления: 259 С. 1 Н ЯМР (ДМСО-d6):3,53 (ушир., 4 Н), 3,62 (ушир., 4 Н), 7,51 (с, 1 Н), 10-11 (ушир., 2 Н). Пример 9. Диэтиламид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты. 5,6-Диацетокси-3-хлор-7-нитробензо[b]тиофен-2-карбоновая кислота. 3-Хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновую кислоту (0,32 г) из примера 4, уксусный ангидрид (1,6 мл) и концентрированную серную кислоту (2 капли) нагревали при 50-60 С в течение 1 ч. Реакционную смесь выливали в воду и перемешивали в холоде. Продукт отфильтровывали, промывали холодной водой и сушили в вакууме. 1(3,9 мл) добавляли тионилхлорид (0,11 мл) и N,N-диметилформамид (1 каплю). Раствор нагревали при 80 С в течение 1 ч, а затем выпаривали досуха и сушили в вакууме. Остаток растворяли в дихлорметане(3,9 мл) и добавляли раствор диэтиламина (0,12 мл) и N,N-диизопропиламина (0,5 мл) в дихлорметане(3,9 мл). Реакционный раствор перемешивали при комнатной температуре в течение 3 ч. Его выпаривали досуха и к остатку добавляли метанол (5 мл) и концентрированную хлористо-водородную кислоту (1 мл). Продукт экстрагировали дихлорметаном, затем промывали водой и раствором бикарбоната натрия. Раствор сушили и выпаривали. Продукт использовали на следующей стадии без какой-либо очистки. Диэтиламид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты. Диэтиламид 5,6-диацетокси-3-хлор-7-нитробензо[b]тиофен-2-карбоновой кислоты (0,32 г) растворяли в метаноле (16 мл) и к реакционному раствору добавляли раствор карбоната калия (0,61 г) в воде (3 мл). Смесь перемешивали при комнатной температуре в течение 1 ч. Метанол выпаривали и остаток содержали в холоде и отфильтровывали. Твердое вещество промывали водой и перекристаллизовывали из метанола. Выход: 138 мг. Точка плавления: 202-205 С. 1H ЯМР (ДМСО-d6):1,14 (ушир., 6 Н), 3,41 (ушир., 4 Н), 7,49 (с, 1 Н), 10-12 (ушир., 2 Н). Пример 10. (3-Хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)пиперидин-1-илметанон. Указанное в заголовке соединение получали из продукта примера 4 путем повторения способа при-9 017329 мера 9, за исключением использования пиперидина вместо диэтиламина. Выход: 192 мг. Точка плавления: 254-256 С. 1 Н ЯМР (ДМСО-d6):1,55-1,62 (м, 10H), 7,48 (с, 1 Н), 10-11 (ушир., 2 Н). Пример 11. Фениламид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты. Указанное в заголовке соединение получали из продукта примера 4 путем повторения способа примера 9, за исключением использования анилина вместо диэтиламина. Выход: 100 мг. Точка плавления: 288 С. 1H ЯМР (ДМСО-d6):7,15 (т, 1 Н), 7,38 (т, 2 Н), 7,52 (с, 1 Н), 7,70 (д, 1 Н), 10,37 (с, 1 Н). Пример 12. 3-[(3-Хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбонил)амино]бензойная кислота. Указанное в заголовке соединение получали из продукта примера 4 путем повторения способа примера 9, за исключением использования 3-аминобензойной кислоты вместо диэтиламина. Выход: 53 мг. Точка плавления: 293-294 С. 1H ЯМР (ДМСО-d6):7,50 (д, 1 Н), 7,53 (д, 1 Н), 7,72 (д, 1 Н), 7,95 (д, 1 Н), 8,36 (с, 1 Н), 10,58 (с, 1 Н). Пример 13. 4-[(3-Хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбонил)амино]бензойная кислота. Указанное в заголовке соединение получали из продукта примера 4 путем повторения способа примера 9, за исключением использования 4-аминобензойной кислоты вместо диэтиламина. Выход: 110 мг. Точка плавления: 298-300 С. 1H ЯМР (ДМСО-d6):7,55 (с, 1 Н), 7,84 (д, 2 Н), 7,96 (д, 2 Н), 10,70 (с, 1 Н). Пример 14. (4-Метоксифенил)амид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты. Указанное в заголовке соединение получали из продукта примера 4 путем повторения способа примера 9, за исключением использования 4-метоксианилина вместо диэтиламина. Выход: 94 мг. Точка плавления: 350 С. 1 Н ЯМР (ДМСО-d6):3,74 (с, 3H), 6,88 (с, 1 Н), 6,92 (д, 2 Н), 7,62 (д, 2 Н), 8,46 (ушир., 2 Н), 9,82(ушир., 1 Н). Пример 15. 2-Метил-7-нитробензотиазол-5,6-диол. 1-Бром-4,5-диметокси-2-нитробензол. К раствору 4-бромвератрола (20 г) в уксусной кислоте (50 мл) добавляли 2 М азотную кислоту (48 мл). Все перемешивали при комнатной температуре в течение 30 мин, а затем реакционный раствор выливали в воду. Полученное в результате твердое вещество отфильтровывали, промывали водой и сушили в вакууме. 1H ЯМР (ДМСО-d6):3,85 (с, 3H), 3,90 (с, 3H), 7,38 (с, 1 Н), 7,67 (с, 1 Н). 5,6-Диметокси-2-метилбензотиазол. 1-Бром-4,5-диметокси-2-нитробензол (10 г) суспендировали в этаноле (50 мл). К реакционной смеси добавляли суспензию сульфида натрия (5 г) и серы (0,65 г) в этаноле (12 мл). Реакционную смесь нагревали с обратным холодильником в течение 1,5 ч и затем полученное в результате твердое вещество отфильтровывали и промывали горячей водой и этанолом. Сухое твердое вещество суспендировали с уксусной кислотой (60 мл) и ацетангидридом (35 мл). К суспензии постепенно добавляли цинк (16,6 г) и суспензию перемешивали при комнатной температуре в течение 15 мин перед фильтрацией. Остаток выпаривали досуха. Продукт очищали колоночной хроматографией с использованием смеси толуолэтилацетат-уксусная кислота 8:1:1 в качестве элюента. 1H ЯМР (ДМСО-d6):2,72 (с, 3H), 3,81 (с, 3H), 3,82 (с, 3H), 7,44 (с, 1 Н), 7,56 (с, 1 Н). 2-Метилбензотиазол-5,6-диол. 5,6-Диметокси-2-метилбензотиазол (3,9 г) нагревали с обратным холодильником с 47% бромистоводородной кислотой (40 мл) в течение 4 ч. Твердое вещество отфильтровывали и сушили в вакууме. 1 Н ЯМР (ДМСО-d6):2,66 (с, 3H), 7,21 (с, 1 Н), 7,33 (с, 1 Н), 9,23 (с, 2 Н). 2-Метил-7-нитробензотиазол-5,6-диол. 2-Метилбензотиазол-5,6-диол растворяли в этилацетате и при 20 С постепенно добавляли раствор азотной кислоты в дихлорметане (2 М, 0,38 мл). Раствор перемешивали 10 мин при комнатной температуре, а затем выливали в ледяную воду, экстрагировали в этилацетат и выпаривали. Продукт очищали колоночной хроматографией с использованием смеси толуол-этилацетат-уксусная кислота 8:1:1 в качестве элюента. Выход: 75 мг. Точка плавления: 219 С. 1 Н ЯМР (ДМСО-d6):2,73 (с, 3H), 7,63 (с, 1 Н), 10,1-10,9 (ушир., 2 Н). Пример 16. (5,6-Дигидрокси-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон. 5-[1-(4-Бензилокси-3-метоксифенил)мет-(Z)-илиден]-2-тиоксотиазолидин-4-он. 4-Бензилокси-3-метоксибензальдегид (29 г) растворяли в уксусной кислоте (16 г) и затем добавляли роданин (16 г) и ацетат натрия (36 г). Раствор нагревали с обратным холодильником в течение 1 ч. Реакционный раствор выливали в воду. Твердое вещество отфильтровывали, промывали водой и сушили в вакууме.(Z)-3-(4-Бензилокси-3-метоксифенил)-2-меркаптоакриловая кислота. 5-[1-(4-Бензилокси-3-метоксифенил)мет-(Z)-илиден]-2-тиоксотиазолидин-4-он (38 г) и 2,5 М NaOH нагревали при 80 С в течение 1 ч. Затем раствор охлаждали до 10 С и медленно вливали в 6 М растворHCl (200 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Твердое вещество отфильтровывали, промывали водой и сушили в вакууме. 1H ЯМР (ДМСО-d6):3,80 (с, 3H), 5,14 (с, 2 Н), 7,14-7,16 (д, 1 Н), 7,26-7,46 (м, 6 Н), 7,70 (с, 1 Н). 6-Гидрокси-5-метоксибензо[b]тиофен-2-карбоновая кислота. Смесь (Z)-3-(4-бензилокси-3-метоксифенил)-2-меркаптоакриловой кислоты (21 г) и йода (21 г) в тетрагидрофуране (300 мл) перемешивали при 60 С в течение 15 ч. Затем выливали в воду (1 л) и добавляли 120 г бисульфита натрия. Продукт экстрагировали этилацетатом, а затем его экстрагировали в бикарбонат натрия. Водную фазу подкисляли концентрированной хлористо-водородной кислотой и перемешивали при комнатной температуре в течение 1 ч. Твердое вещество отфильтровывали, промывали водой и сушили в вакууме. 1 Н ЯМР (ДМСО-d6):3,83 (с, 3H), 7,29 (с, 1 Н), 7,45 (с, 1 Н), 7,89 (с, 1 Н), 9,70 (ушир., 1 Н), 12,8-13,3(ушир., 1 Н). 6-Гидрокси-5-метокси-7-нитробензо[b]тиофен-2-карбоновая кислота. 6-Гидрокси-5-метоксибензо[b]тиофен-2-карбоновую кислоту (3,2 г) растворяли в этилацетате (200 мл) и при 0 С к ним постепенно добавляли раствор азотной кислоты в дихлорметане (2 М, 7,7 мл). Раствор перемешивали при комнатной температуре в течение 30 мин, а затем выливали в охлажденную льдом воду и отфильтровывали. Твердое вещество промывали этилацетатом и сушили в вакууме. 1 Н ЯМР (ДМСО-d6):3,96 (с, 3H), 7,95 (с, 1 Н), 8,05 (с, 1 Н), 11,5-12,0 (ушир., 1 Н), 12,8-13,6 (ушир.,1 Н).(45 мл). Добавляли тионилхлорид (1,2 мл) и N,N-диметилформамид (4 капли). Раствор перемешивали при 80 С в течение 2 ч и после этого выпаривали. Остаток растворяли в дихлорметане (45 мл) и добавляли морфолин (1,4 мл) и триэтиламин (1,2 мл). Реакционный раствор перемешивали при комнатной температуре в течение ночи. К раствору добавляли раствор воды и 2 М HCl. Твердое вещество промывали водой и сушили в вакууме. 1 Н ЯМР (ДМСО-d6):3,67 (ушир., 4 Н), 3,69 (ушир., 4 Н), 3,95 (с, 3H), 7,73 (с, 1 Н), 7,87 (с, 1 Н), 11,011,8 (ушир., 1 Н).(6-Гидрокси-5-метокси-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон (1,0 г) растворяли в этилацетате (11 мл) и добавляли пиридин (14 мл). Затем к раствору постепенно добавляли треххлористый алюминий (0,47 г). Реакционную смесь нагревали в течение 2 ч при 110 С. К теплому (60 С) реакционному раствору добавляли смесь льда и концентрированной хлористо-водородной кислоты (1:1), перемешивали его при комнатной температуре в течение 1 ч. Твердое вещество отфильтровывали, промывали водой и обрабатывали диэтиловым эфиром. Выход: 114 мг. Точка плавления: 266 С. 1 Н ЯМР (ДМСО-d6):3,65 (ушир., 4 Н), 3,68 (ушир., 4 Н), 7,64 (с, 1 Н), 7,72 (с, 1 Н), 10-11 (ушир., 2 Н). Пример 17. 5,6-Дигидрокси-7-нитробензо[b]тиофен-2-карбоновая кислота. 4-Бензилокси-3-этоксибензальдегид. К раствору 3-этокси-4-гидроксибензальдегида (83 г) в N,N-диметилформамиде (400 мл) постепенно добавляли 10 М гидроксид натрия (55 мл), а затем при температуре до 40 С добавляли бензилхлорид (60 мл). Смесь перемешивали при комнатной температуре в течение получаса и в течение 2 ч при 60 С. Раствор выливали в охлажденную льдом воду (2 л) и экстрагировали диэтиловым эфиром. Органическую фазу промывали водой и 5 М гидроксидом натрия, а затем сушили и выпаривали. Продукт перекристаллизовывали из смеси толуол-гептан. 1 Н ЯМР (ДМСО-d6):1,34 (т, 3H), 4,12 (кв, 2 Н), 5,24 (с, 2 Н), 7,26 (д, 1 Н), 7,34-7,53 (м, 7 Н), 9,83 (с,1 Н). 4-Бензилокси-5-этокси-2-нитробензальдегид. 4-Бензилокси-3-этоксибензальдегид (20 г) растворяли в дихлорметане (100 мл) и при температуре до 30 С постепенно добавляли раствор азотной кислоты в дихлорметане (2 М, 200 мл). Раствор перемешивали при комнатной температуре в течение 10 мин и затем выливали в охлажденную льдом воду. Органическую фазу промывали 1 М гидроксидом натрия и водой, а затем сушили и выпаривали. 1 Н ЯМР (ДМСО-d6):1,37 (т, 3H), 4,25 (кв, 2 Н), 5,34 (с, 2 Н), 7,36-7,49 (м, 5 Н), 7,82 (с, 1 Н), 10,19 (с,1 Н). 5-Этокси-4-гидрокси-2-нитробензальдегид. 4-Бензилокси-5-этокси-2-нитробензальдегид (23 г) растворяли в уксусной кислоте (93 мл) и концентрированной хлористо-водородной кислоте (10 мл). Реакционную смесь нагревали с обратным холо- 11017329 дильником в течение 24 ч. Затем раствор выпаривали досуха и остаток растворяли в диэтиловом эфире. Продукт экстрагировали 1 М гидроксидом натрия и подкисляли 6 М хлористо-водородной кислотой. Полученное в результате твердое вещество отфильтровывали и сушили в вакууме. 1(ушир., 1 Н). 5-Этокси-4-гидрокси-2,3-динитробензальдегид. 5-Этокси-4-гидрокси-2-нитробензальдегид (1,6 г) растворяли в дихлорметане (30 мл) и при температуре до 30 С постепенно добавляли раствор азотной кислоты в дихлорметане (2 М, 13 мл). Раствор перемешивали при комнатной температуре в течение 10 мин и затем выливали в охлажденную льдом воду. Органическую фазу промывали водой, а затем сушили и выпаривали. 1 Н ЯМР (ДМСО-d6):1,41 (т, 3H), 4,32 (кв, 2 Н), 7,56 (с, 1 Н), 9,93 (с, 1 Н). 4,5-Диэтокси-2,3-динитробензальдегид. 5-Этокси-4-гидрокси-2,3-динитробензальдегид (3,77 г), N,N-диметилформамид (35 мл), K2CO3(3,877 г) и этилбромид (50 мл) нагревали с обратным холодильником в течение 24 ч. К реакционному раствору добавляли диэтиловый эфир (100 мл) и затем промывали водой и 1 М гидроксидом натрия. Раствор сушили и выпаривали. 1H ЯМР (ДМСО-d6):1,26 (т, 3H), 1,43 (т, 3H), 4,36 (м, 6 Н), 7,70 (с, 1 Н), 10,05 (с, 1 Н). Метиловый эфир 5,6-диэтокси-7-нитробензо[b]тиофен-2-карбоновой кислоты. 4,5-Диэтокси-2,3-динитробензальдегид (1,53 г) растворяли в N,N-диметилформамиде (6 мл) и затем добавляли метилтиогликолят (1,36 мл). К реакционному раствору на холоде добавляли триэтиламин (2,6 мл). Смесь перемешивали в течение ночи. Твердое вещество отфильтровывали и промывали N,Nдиметилформамидом. 1 Н ЯМР (ДМСО-d6):1,39 (т, 3H), 1,44 (т, 3H), 4,24 (т, 3H), 4,28 (кв, 3H), 8,08 (с, 1 Н), 8,19 (с, 1 Н). 5,6-Дигидрокси-7-нитробензо[b]тиофен-2-карбоновая кислота. Метиловый эфир 5,6-диэтокси-7-нитробензо[b]тиофен-2-карбоновой кислоты (160 мг), бромистоводородную кислоту (8 мл) и уксусную кислоту (8 мл) нагревали с обратным холодильником в течение 6 ч и перемешивали при комнатной температуре в течение ночи. Твердое вещество отфильтровывали и промывали раствором уксусной кислоты и бромисто-водородной кислоты (1:1) и водой. Продукт перекристаллизовывали из ацетонитрила. Выход: 90 мг. 1H ЯМР (ДМСО-d6):7,71 (с, 1 Н), 8,05 (с, 1 Н), 10-11 (ушир., 2 Н), 13-13,5 (ушир., 1 Н). Пример 18. 5,6-Дигидрокси-7-нитробензофуран-2-карбоновая кислота. 2,4-Дигидрокси-5-метоксибензальдегид. 2,4,5-Триметоксибензальдегид (20 г) растворяли в дихлорметане (20 мл) и небольшими порциями добавляли хлорид алюминия (34,1 г). Полученную в результате смесь перемешивали при комнатной температуре в течение 5 ч, а затем выливали в подкисленную ледяную воду. Дихлорметановый слой отделяли и водную фазу экстрагировали этилацетатом. Объединенные органические слои экстрагировали 1 н.NaOH. Водную фазу подкисляли HCl и осадок отфильтровывали. Продукт перекристаллизовывали из толуола. 1 Н ЯМР (400 МГц, ДМСО-d6):3,74 (с, 3H), 6,41 (с, 1 Н), 7,12 (с, 1 Н), 9,96 (с, 1 Н), 10,4 (ушир., 1 Н),10,52 (ушир., 1 Н). 4-Бензилокси-2-гидрокси-5-метоксибензальдегид. 2,4-Дигидрокси-5-метоксибензальдегид(9,7 г) и 1,8 диазабицикло[5.4.0]ундец-7-ен (8,6 г) в N,N-диметилформамиде (30 мл) нагревали при 100 С в атмосфере азота в течение 5 ч. После охлаждения до комнатной температуры добавляли 1 н. NaOH и смесь промывали этилацетатом. Водную фазу подкисляли HCl и осадок отфильтровывали. 1H ЯМР (400 МГц, ДМСО-d6):3,74 (с, 3H), 5,16 (с, 2 Н), 6,65 (с, 1 Н), 7,17 (с, 1 Н), 7,36-7,47 (м, 5 Н),10,02 (с, 1 Н), 10,68 (с, 1 Н). Этиловый эфир (5-бензилокси-2-формил-4-метоксифенокси)уксусной кислоты. 4-Бензилокси-2-гидрокси-5-метоксибензальдегид (2,9 г), этилбромацетат (2,3 г) и 1,8 диазабицикло[5.4.0]ундец-7-ен (2,1 г) в N,N-диметилформамиде (30 мл) нагревали при 100C в атмосфере азота в течение 5 ч. После охлаждения до комнатной температуры добавляли воду и смесь экстрагировали этилацетатом. Этилацетатную фазу промывали 1 н. NaOH и 1 н. HCl, сушили Na2SO4 и выпаривали досуха. 1 Н ЯМР (400 МГц, ДМСО-d6):1,20 (т, 3H, J=7,2 Гц), 3,76 (с, 3H), 4,15 (кв, 2 Н, J=7,2 Гц), 4,98 (с,2 Н), 5,21 (с, 2 Н), 6,97 (с, 1 Н), 7,19 (с, 1 Н), 7,36-7,47 (м, 5 Н), 10,29 (с, 1 Н). Этиловый эфир 6-бензилокси-5-метоксибензофуран-2-карбоновой кислоты. Этиловый эфир (5-бензилокси-2-формил-4-метоксифенокси)уксусной кислоты (1,5 г), 1,8 диазабицикло[5.4.0]ундец-7-ен (0,33 г) и уксусную кислоту (0,026 г) в N,N-диметилформамиде (8 мл) перемешивали при 100 С в атмосфере азота в течение 5 ч. После охлаждения до комнатной температуры смесь выливали в ледяную воду и осадок отфильтровывали. 1 Н ЯМР (400 МГц, ДМСО-d6):1,32 (т, 3H, J=7,1 Гц), 3,82 (с, 3H), 4,37 (кв, 2 Н, J=7,1 Гц), 5,18 (с,- 12017329 2 Н), 7,25 (с, 1 Н), 7,33-7,50 (м, 6 Н), 7,62 (д, 1 Н, J=0,8 Гц). Этиловый эфир 6-гидрокси-5-метоксибензофуран-2-карбоновой кислоты. Этиловый эфир 6-бензилокси-5-метоксибензофуран-2-карбоновой кислоты (7,3 г), уксусную кислоту (45 мл) и концентрированную HCl (24 мл) перемешивали при 50 С в течение 0,5 ч. Добавляли воду и показатель рН доводили до 3 с помощью NaOH. Смесь экстрагировали этилацетатом. Этилацетатную фазу сушили сульфатом натрия и выпаривали досуха. Продукт перекристаллизовывали из толуола. 1 Н ЯМР (400 МГц, ДМСО-d6):1,32 (т, 3H, J=7,1 Гц), 3,82 (с, 3H), 4,31 (кв, 2 Н, J=7,1 Гц), 7,07 (д,1 Н, J=0,9 Гц), 7,20 (с, 1 Н), 7,58 (д, 1 Н, J=0,9 Гц). Этиловый эфир 6-гидрокси-5-метокси-7-нитробензофуран-2-карбоновой кислоты. Этиловый эфир 6-гидрокси-5-метоксибензофуран-2-карбоновой кислоты (1,5 г) растворяли в дихлорметане (30 мл) и раствор охлаждали до -20 С. Добавляли 1 М HNO3 в дихлорметане (6,4 мл) и через 10 мин смесь выливали в ледяную воду. Дихлорметановый слой отделяли и водную фазу экстрагировали этилацетатом. Объединенные органические фазы сушили сульфатом натрия и выпаривали досуха. 1 Н ЯМР (400 МГц, ДМСО-d6):1,33 (т, 3H, J=7,1 Гц), 3,94 (с, 3H), 4,35 (кв, 2 Н, J=7,1 Гц), 7,57 (с,1 Н), 7,74 (с, 1 Н), 11,3 (ушир., 1 Н). 5,6-Дигидрокси-7-нитробензофуран-2-карбоновая кислота. Этиловый эфир 6-гидрокси-5-метокси-7-нитробензофуран-2-карбоновой кислоты (0,25 г) растворяли в дихлорметане и охлаждали до -5 С. Добавляли раствор 1 М трехбромистого бора в дихлорметане(4,5 мл) и смесь перемешивали при 0 С в течение 24 ч. Смесь выливали в ледяную воду и дихлорметановый слой отделяли. Водную фазу экстрагировали этилацетатом. Объединенные органические фазы сушили сульфатом натрия и выпаривали досуха. Продукт очищали колоночной хроматографией с обратной фазой с использованием (1%) метанола в дихлорметане в качестве элюента. 1 Н ЯМР (400 МГц, CD3OD):7,37 (с, 1 Н), 7,53 (с, 1 Н). Пример 19. 5,6-Дигидрокси-2-метил-7-нитробензо[d]изотиазол-3-он. 2-Меркапто-4,5-диметоксибензойная кислота. К раствору 2-амино-4,5-диметоксибензойной кислоты (10,2 г) в HCl (9 мл концентрированной HCl и 30 мл воды) при 5 С добавляли раствор NaNO2 (3,6 г в 20 мл воды) и перемешивали в течение 2 ч. Диазониевый раствор фильтровали и фильтрат добавляли к холодному раствору Na2S2, полученному из моногидрата сульфида натрия (11,6 г в 20 мл воды) и серы (1,5 г) в растворе NaOH (1,8 г в 20 мл воды). Смесь перемешивали при комнатной температуре в течение ночи, отфильтровывали и подкисляли концентрированной HCl. Осадок отфильтровывали. Продукт представлял собой смесь 2-меркапто-4,5 диметоксибензойной кислоты и димеризованного продукта 4,4',5,5'-тетраметокси-2,2'-дитио-бис(бензойной кислоты) и использовали для следующей стадии без очистки. 1 Н ЯМР (400 МГц, ДМСО-d6):мономер 3,65 (с, 3H), 3,72 (с, 3H), 7,29 (с, 1 Н), 7,36 (с, 1 Н), димеризованный продукт 3,59 (с, 6 Н), 3,78 (с, 6 Н), 7,24 (с, 2 Н), 7,48 (с, 2 Н). 2-Хлорсульфенил-4,5-диметоксибензоилхлорид. 2-Меркапто-4,5-диметоксибензойную кислоту (12,8 г), толуол (50 мл) и тионилхлорид (100 мл) нагревали при 80 С в течение 3 ч. Растворитель и избыток SOCl2 выпаривали. К остатку добавляли толуол и смесь снова выпаривали досуха. Остаток суспендировали в толуоле (50 мл), добавляли хлорид серы(14,3 мл) и смесь нагревали при 65 С в течение 2 ч. Смесь выпаривали досуха и остаток использовали для следующей стадии без очистки. 1 Н ЯМР (400 МГц, ДМСО-d6):3,84 (с, 3H), 3,89 (с, 3H), 7,32 (с, 1 Н), 7,79 (с, 1 Н). 5,6-Диметокси-2-метилбензо[d]изотиазол-3-он. 2-Хлорсульфенил-4,5-диметоксибензоилхлорид (5,0 г) растворяли в пиридине (30 мл) и добавляли гидрохлорид метиламина (6,0 г). Смесь перемешивали при комнатной температуре в течение 2 дней. Добавляли этилацетат и смесь промывали 1 н. HCl и водой. Этилацетат сушили сульфатом натрия и выпаривали досуха. Неочищенный продукт очищали флэш-хроматографией с элюированием смесью гептанэтилацетат (1:9). 1 Н ЯМР (400 МГц, ДМСО-d6):3,30 (с, 3H), 3,83 (с, 3H), 3,85 (с, 3H), 7,26 (с, 1 Н), 7,53 (с, 1 Н). 5,6-Дигидрокси-2-метилбензо[d]изотиазол-3-он. К суспензии 5,6-диметокси-2-метилбензо[d]изотиазол-3-она (0,35 г) в дихлорметане (30 мл) при 40 С добавляли трехбромистый бор (3,1 мл, 1 М раствор в дихлорметане). Смеси давали возможность нагрева до -10 С. На следующий день добавляли метанол (30 мл) и смесь выпаривали досуха. К остатку добавляли раствор сульфита натрия (9 мл, 5% в воде) и солевой раствор (9 мл). После перемешивания при 0 С осадок отфильтровывали. 1H ЯМР (400 МГц, ДМСО-d6):3,24 (с, 3H), 7,13 (с, 1 Н), 7,20 (с, 3H), 9,53 (ушир., 1 Н), 10,0 (ушир.,1 Н). 6-Ацетокси-2-метил-3-оксо-2,3-дигидробензо[d]изотиазол-5-иловый эфир уксусной кислоты. 5,6-Дигидрокси-2-метилбензо[d]изотиазол-3-он (0,23 г) суспендировали в N,N-диметилформамиде и при 0 С добавляли триэтиламин (0,47 г) и ангидрид уксусной кислоты (0,24 г). После перемешивания при комнатной температуре в течение 1 ч смесь выливали в ледяную воду и осадок отфильтровывали. Н ЯМР (400 МГц, ДМСО-d6):2,31 (с, 3H), 2,34 (с, 3H), 3,35 (с, 3H), 7,76 (с, 1 Н), 7,94 (с, 1 Н). 6-Гидрокси-2-метил-3-оксо-2,3-дигидробензо[d]изотиазол-5-иловый эфир уксусной кислоты. К раствору 6-ацетокси-2-метил-3-оксо-2,3-дигидробензо[d]изотиазол-5-илового эфира уксусной кислоты (0,21 г) в диметилформамиде при 0 С добавляли морфолин (0,070 г). Смесь перемешивали при 0 С в течение 1 ч, а затем выливали в ледяную воду. Осажденный продукт отфильтровывали. 1 Н ЯМР (400 МГц, ДМСО-d6):2,27 (с, 3H), 3,27 (с, 3H), 7,44 (с, 1 Н), 7,47 (с, 1 Н), 10,72 (с, 1 Н). 6-Гидрокси-2-метил-7-нитро-3-оксо-2,3-дигидробензо[d]изотиазол-5-иловый эфир уксусной кислоты. К раствору 6-гидрокси-2-метил-3-оксо-2,3-дигидробензо[d]изотиазол-5-илового эфира уксусной кислоты (0,055 г) в уксусной кислоте при 10 С добавляли азотную кислоту (100% 0,015 г) и перемешивали при комнатной температуре в течение 15 мин. Смесь выливали в ледяную воду и экстрагировали этилацетатом. Этилацетат сушили и выпаривали досуха. 1 Н ЯМР (400 МГц, ДМСО-d6):2,29 (с, 3H), 3,29 (с, 3H), 7,73 (с, 1 Н). 5,6-Дигидрокси-2-метил-7-нитробензо[d]изотиазол-3-он. 6-Гидрокси-2-метил-7-нитро-3-оксо-2,3-дигидробензо[d]изотиазол-5-иловый эфир уксусной кислоты (0,046 г) в смеси метанол-HCl (14:1, 7 мл) нагревали при 60 С в течение 3 ч. Смесь выпаривали досуха. Неочищенный продукт очищали флэш-хроматографией с использованием этилацетата в качестве элюента с последующей кристаллизацией из смеси изопропанол-метанол. 1 Н ЯМР (400 МГц, ДМСО-d6):3,30 (с, 3H), 7,49 (с, 1 Н). Пример 20. (5,6-Дигидрокси-3-метил-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон.(3-Хлор-5,6-диметоксибензо[b]тиофен-2-ил)морфолин-4-илметанон (3,0 г) из примера 8, триметилалюминий (3,2 г) и [1,3-бис-(дифенилфосфино)пропан]дихлорникель(II) (1,2 г) в 1,2-диметоксиэтане (100 мл) нагревали с обратным холодильником в атмосфере аргона в течение 10 ч. К холодной смеси соответственно добавляли этанол (50 мл), воду и HCl и смесь экстрагировали этилацетатом. Этилацетат сушили и выпаривали досуха. Неочищенный продукт очищали флэш-хроматографией с элюированием смесью гептан-этилацетат (5:5). 1 Н ЯМР (400 МГц, ДМСО-d6):2,34 (с, 3H), 3,52 (ушир., 4 Н), 3,61 (ушир., 4 Н), 3,83 (с, 3H), 3,85 (с,3H), 7,26 (с, 1 Н), 7,54 (с, 1 Н).(5,6-Дигидрокси-3-метилбензо[b]тиофен-2-ил)морфолин-4-илметанон. К раствору (5,6-диметокси-3-метилбензо[b]тиофен-2-ил)морфолин-4-илметанона (0,80 г) в дихлорметане (8 мл) при 0 С добавляли трехбромистый бор (5,2 мл, 2 М раствор в дихлорметане). Смеси давали возможность нагрева до комнатной температуры. Через 2 ч при комнатной температуре добавляли метанол (16 мл) и растворители выпаривали. К остатку добавляли раствор сульфита натрия (16 мл, 5% в воде) и после перемешивания в течение 0,5 ч осадок отфильтровывали. 1 Н ЯМР (400 МГц, ДМСО-d6):2,24 (с, 3H), 3,51 (ушир., 4 Н), 3,59 (ушир., 4 Н), 7,07 (с, 1 Н), 7,21 (с,1 Н), 9,20 (с, 1 Н), 9,42 (с, 1 Н).(5,6-Дигидрокси-3-метилбензо[b]тиофен-2-ил)морфолин-4-илметанон (0,10 г) растворяли в этилацетате (60 мл). Небольшими порциями при 55 С добавляли азотную кислоту (2 экв., 2 М раствор в дихлорметане). Через 15 мин после последнего добавления смесь охлаждали, промывали водой, сушили сульфатом натрия и концентрировали до меньшего объема. Осажденный продукт отфильтровывали. 1 Н ЯМР (400 МГц, ДМСО-d6):2,31 (с, 3H), 3,53 (ушир., 4 Н), 3,61 (ушир., 4 Н), 7,54 (с, 1 Н), 10,5(ушир., 2 Н). Пример 21. Этиловый эфир 5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты. 5,6-Дигидрокси-7-нитробензо[b]тиофен-2-карбоновую кислоту (50 мг, 0,20 ммоль) из примера 17 и тионилхлорид (130 мкл) в этаноле (2 мл) нагревали с обратным холодильником в течение 1,5 ч, выпаривали досуха и перекристаллизовывали из этанола. Выход: 46 мг. 1 Н ЯМР (ДМСО-d6):8,13 (1 Н, с), 7,72 (1 Н, с), 4,34 (2 Н, кв), 1,34 (3H, т). Пример 22. 5,6-Дигидрокси-4-нитроизобензофуран-1,3-дион. 5,6-Диметокси-3H-изобензофуран-1-он. Смесь 3,4-диметоксибензойной кислоты (10 г) в 37% HCl (150 мл) и формальдегида (25 мл, 37 вес.% раствор в воде) нагревали до 90 С в течение 4 ч и затем нерастворившийся материал удаляли фильтрованием. Фильтрат гасили водой (200 мл) и экстрагировали три раза этилацетатом (200 мл). Объединенные органические слои промывали водным NaOH (40 мл, 2,5 М) и водой (100 мл). Органический растворитель сушили над безводным сульфатом натрия, отфильтровывали и выпаривали досуха. Выход: 8,9 г. 1 Н ЯМР (ДМСО-d6):7,27 (1 Н, с), 7,24 (1 Н, с), 5,28 (2 Н, с), 3,88 (3H, с), 3,84 (3H, с). 4,5-Диметоксифталевая кислота. К смеси 5,6-диметокси-3H-изобензофуран-1-она (4,5 г) и 7% водного NaOH (47 мл) добавлялиKMnO4 (4,0 г), разбавленный в воде (125 мл). Смесь перемешивали при комнатной температуре в тече- 14017329 ние 4 дней. Нерастворившийся материал удаляли фильтрованием. Фильтрат охлаждали с помощью водно-ледяной бани и подкисляли концентрированной HCl. Кислый раствор экстрагировали три раза этилацетатом (300 мл). Объединенные органические слои сушили безводным сульфатом натрия и выпаривали. Выход: 4,8 г. 1 Н ЯМР (ДМСО-d6):7,19 (2 Н, с), 3,83 (6 Н, с). 5,6-Диметокси-4-нитроизобензофуран-1,3-дион. 4,5-Диметоксифталевую кислоту (1,0 г) охлаждали в водно-ледяной бане. По каплям добавляли холодную смесь серной кислоты (3,0 мл) и дымящейся азотной кислоты (3,0 мл). Смесь перемешивали в течение 10 мин и оставляли стоять в течение 10 мин. Добавляли смесь солевого раствора и льда (1:1). Твердое вещество отфильтровывали, промывали водой и перекристаллизовывали из этанола. Выход: 0,46 г. 1H ЯМР (ДМСО-d6):8,19 (1 Н, с), 4,11 (3H, с), 4,05 (3H, с). 5-Гидрокси-6-метокси-4-нитроизобензофуран-1,3-дион. 5,6-Диметокси-4-нитроизобензофуран-1,3-дион (346 мг), 48% бромистый водород (1,5 мл), уксусную кислоту (15 мл) и бензилтриэтиламмонийбромид (37 мг) нагревали при 140 С в течение 3 ч. Уксусную кислоту и воду удаляли в вакууме. Остаток отфильтровывали через силикагель с использованием смеси толуола этилацетата и метанола (8:1:1) в качестве элюента. Соответствующие фракции собирали и выпаривали. Выход: 275 мг. 1 Н ЯМР (ДМСО-d6):7,44 (1 Н, с), 3,85 (3H, с). 5,6-Дигидрокси-4-нитроизобензофуран-1,3-дион. 5-Гидрокси-6-метокси-4-нитроизобензофуран-1,3-дион (115 мг), алюминийхлорид (80 мг) смешивали с этилацетатом (3 мл). По каплям добавляли пиридин (155 мкл) в этилацетате (2 мл). Полученную в результате смесь перемешивали при комнатной температуре в течение 0,5 ч, нагревали до температуры кипения с обратным холодильником в течение 3 ч и затем гасили водой (0,5 мл) и концентрированнойHCl (0,5 мл) при 60 С. Этилацетат и воду удаляли в вакууме. Остаток смешивали с солевым раствором (2 мл) и экстрагировали два раза этилацетатом (15 мл). Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали, выпаривали и растирали с диэтиловым эфиром. Выход: 55 мг. 1 Н ЯМР (ДМСО-d6):7,42 (1 Н, с). Пример 23. 5,6-Дигидрокси-4-нитро-3H-изобензофуран-1-он. 5,6-Дигидрокси-3H-изобензофуран-1-он. 5,6-Диметокси-3H-изобензофуран-1-он (2,91 г) растворяли в дихлорметане (150 мл) с последующим охлаждением до -50 С. В атмосфере азота по каплям добавляли трехбромистый бор (34,9 мл, 1,0 М раствор в дихлорметане). Смеси давали возможность медленно нагреться в течение ночи до комнатной температуры с последующим перемешиванием в течение 3 ч. Реакцию гасили метанолом с последующим выпариванием досуха. Остаток смешивали с 5% водным Na2SO3 (20 мл) и солевым раствором (20 мл) и отфильтровывали. Выход: 2,31 г. 1 Н ЯМР (ДМСО-d6):10,22 (1 Н, ушир.с), 9,70 (1 Н, ушир.с), 7,09 (1 Н, с), 6,93 (1 Н, с), 5,17 (2 Н, с). 6-Ацетокси-3-оксо-1,3-дигидроизобензофуран-5-иловый эфир уксусной кислоты (8). 5,6-Дигидрокси-3H-изобензофуран-1-он (2,26 г), уксусный ангидрид (25 мл) и пиридин (2,31 мл) перемешивали в течение 5 ч при комнатной температуре. Уксусный ангидрид удаляли в вакууме и остаток смешивали с водой (20 мл), отфильтровывали и промывали водой. Выход: 3,35 г. 1 Н ЯМР (ДМСО-d6):7,81 (1 Н, с), 7,64 (1 Н, с), 5,42 (2 Н, с), 2,34 (3H, с), 2,32 (3H, с). 6-Гидрокси-3-оксо-1,3-дигидроизобензофуран-5-иловый эфир уксусной кислоты. 6-Ацетокси-3-оксо-1,3-дигидроизобензофуран-5-иловый эфир уксусной кислоты (5,0 г) растворяли в N,N-диметилформамиде (100 мл) с последующим добавлением морфолина (1,78 мл). Раствор перемешивали при комнатной температуре в течение ночи с последующей концентрацией при пониженном давлении. К остатку добавляли этилацетат (200 мл). Органическую фазу два раза промывали смесью водной HCl (50 мл, 2 М) и солевого раствора (50 мл). Органический растворитель сушили над безводным сульфатом натрия, отфильтровывали и выпаривали досуха. Выход: 3,96 г. 1 Н ЯМР (ДМСО-d6):11,01 (1 Н, ушир.с), 7,51 (1 Н, с), 7,12 (1 Н, с), 5,29 (2 Н, с), 2,28 (3H, с). 6-Гидрокси-7-нитро-3-оксо-1,3-дигидроизобензофуран-5-иловый эфир уксусной кислоты. 6-Гидрокси-3-оксо-1,3-дигидроизобензофуран-5-иловый эфир уксусной кислоты (3,8 г) смешивали с уксусной кислотой (150 мл) с последующим добавлением 65% азотной кислоты (2,5 мл). После растворения смесь перемешивали при комнатной температуре в течение 2 ч с последующим удалением уксусной кислоты и воды в вакууме. Остаток отфильтровывали через силикагель с использованием смеси толуола, этилацетата и метанола (8:1:1) в качестве элюента. Соответствующие фракции собирали и выпаривали досуха. Выход: 4,1 г. 1 Н ЯМР (ДМСО-d6):7,91 (1 Н, с), 5,59 (2 Н, с), 2,33 (3H, c). 5,6-Дигидрокси-4-нитро-3H-изобензофуран-1-он. 6-Гидрокси-7-нитро-3-оксо-1,3-дигидроизобензофуран-5-иловый эфир уксусной кислоты (4,1 г) суспендировали в метаноле (150 мл) и 37% HCl (20 мл) с последующим перемешиванием при комнатной- 15017329 температуре в течение 3 дней. Осадок отфильтровывали и промывали метанолом. Выход: 2,25 г. 1 Н ЯМР (ДМСО-d6):7,32 (1 Н, с), 5,50 (2 Н, с). Пример 24. 5,6-Дигидрокси-4,7-динитро-3H-изобензофуран-1-он. 5,6-Диметокси-4,7-динитро-3H-изобензофуран-1-он. 5,6-Диметокси-3H-изобензофуран-1-он (582 мг) охлаждали в водно-ледяной бане. По каплям добавляли охлажденную смесь серной кислоты (2 мл) и дымящейся азотной кислоты (2 мл). Смесь перемешивали в течение 15 мин и оставляли стоять на 45 мин. Реакцию гасили льдом. Водную фазу экстрагировали три раза этилацетатом (30 мл) и промывали солевым раствором (15 мл). Органический растворитель сушили над безводным сульфатом натрия, отфильтровывали и выпаривали досуха. Выход: 586 мг. 1H ЯМР (ДМСО-d6):5,67 (2 Н, с), 4,12 (3H, с), 4,00 (3H, с). 5-Гидрокси-6-метокси-4,7-динитро-3H-изобензофуран-1-он. 5,6-Диметокси-4,7-динитро-3H-изобензофуран-1-он (450 мг), уксусную кислоту (15 мл) и 37% водную HCl (3 мл) нагревали с обратным холодильником в течение 7,25 ч. Уксусную кислоту и воду выпаривали в вакууме. Остаток очищали колоночной хроматографией (толуол-этилацетат-метанол 8:1:1). Выход: 215 мг. 1H ЯМР (ДМСО-d6):5,48 (2 Н, с), 3,86 (3H, с). 5,6-Дигидрокси-4,7-динитро-3H-изобензофуран-1-он. 5-Гидрокси-6-метокси-4,7-динитро-3H-изобензофуран-1-он (210 мг) растворяли в этилацетате (2,5 мл) с последующим добавлением хлорида алюминия (132 мг) в атмосфере азота. По каплям добавляли пиридин (265 мкл, 3,28 ммоль). Полученную в результате смесь нагревали до температуры кипения с обратным холодильником в течение 2 ч, а затем гасили водой (0,5 мл) и концентрированной HCl (0,5 мл) при 75 С. Добавляли этилацетат (15 мл) и фазы разделяли. Водный слой экстрагировали один раз этилацетатом (15 мл). Объединенные органические слои сушили над безводным сульфатом натрия. Продукт отфильтровывали, выпаривали досуха и перекристаллизовывали из смеси гептан-толуол-этилацетат. Выход: 76 мг. 1 Н ЯМР (ДМСО-d6):5,41 (2 Н, с). Пример 25. 7-Нитро-2-фенилбензотиазол-5,6-диол. Катехолциклогексилиденкеталь. Катехол (55 г), циклогексанон (65 мл), моногидрат п-толуолсульфоновой кислоты (0,50 мл) и толуол (500 мл) нагревали с обратным холодильником с помощью аппарата Дина-Старка в течение 4,5 ч. Реакционную смесь промывали раствором NaOH и водой, сушили и выпаривали досуха. Выход: 90 г. 1 Н ЯМР (ДМСО-d6):1,46 (м, 2 Н), 1,65 (м, 4 Н), 1,85 (т, 4 Н, J=6,2 Гц), 6,75-6,85 (м, 4 Н). 4-Нитрокатехолциклогексилиденкеталь. К раствору катехолциклогексилиденкеталя (87,3 г) в метиленхлориде (900 мл) добавляли раствор азотной кислоты в метиленхлориде (2 М, 250 мл) при такой скорости, чтобы поддерживать температуру около 25 С с использованием водяной бани. Смесь продукта промывали раствором гидроксида натрия (1 М, 500 мл). Органическую фазу отделяли, сушили и выпаривали. Выход: 106 г. 1 Н ЯМР (ДМСО-d6):1,49 (м, 2 Н), 1,67 (м, 4 Н), 1,95 (т, 4 Н, J=6,2 Гц), 7,08 (д, 1 Н, J=8,8 Гц), 7,70 (д,1 Н, J=2,4 Гц), 7,86 (дд, 1 Н, J=2,4 и 8,8 Гц). 4-Аминокатехолциклогексилиденкеталь. 4-Нитрокатехолциклогексилиденкеталь (2 г) гидрогенизировали в этилацетате (12 мл) с Pd-C (0,2 г) в качестве катализатора. Выход: 1,77 г. 1H ЯМР (ДМСО-d6):1,45 (м, 2 Н), 1,60 (м, 4 Н), 1,79 (м, 4 Н), 4,62 (ушир., 2 Н), 5,94 (дд, 1 Н, J=3,1 и 12,2 Гц), 6,14 (д, 1 Н, J=3,1 Гц), 6,48 (д, 1 Н, J=12,2 Гц). 2-Фенилбензотиазол-5,6-диолциклогексилиденкеталь. 4-Аминокатехолциклогексилиденкеталь (1,77 г), бензальдегид (0,82 мл) и серу (0,55 г) нагревали с обратным холодильником в диметилацетамиде (8,6 мл) в течение 2 ч. Реакционную смесь выливали в воду (100 мл) и экстрагировали простым эфиром (100 мл), сушили, выпаривали и перекристаллизовывали из ацетонитрила. Выход: 0,93 г. 1 Н ЯМР (ДМСО-d6):1,49 (м, 2 Н), 1,69 (м, 4 Н), 1,94 (м, 4 Н), 7,50-7,57 (м, 5 Н), 7,99-8,01 (м, 2 Н). 7-Нитро-2-фенилбензотиазол-5,6-диолциклогексилиденкеталь. К раствору 2-фенилбензотиазол-5,6-диолциклогексилиденкеталя (0,93 г) в уксусной кислоте (25 мл) добавляли концентрированную азотную кислоту (1,5 мл). Реакционную смесь отфильтровывали. К фильтрату добавляли воду и осадок отфильтровывали. Последний продукт перекристаллизовывали из ацетонитрила. Выход: 0,40 г. 1(м, 2 Н). 7-Нитро-2-фенилбензотиазол-5,6-диол. 7-Нитро-2-фенилбензотиазол-5,6-диолциклогексилиденкеталь (0,35 г), уксусную кислоту (8,8 мл) и концентрированную соляную кислоту (3,5 мл) нагревали с обратным холодильником в течение 2 ч. Продукт отфильтровывали и промывали уксусной кислотой. Выход: 0,27 г. Точка плавления: 221-224 С. Н ЯМР (ДМСО-d6):7,55-7,58 (м, 3H), 7,79 (с, 1 Н), 8,07-8,09 (м, 2 Н), 10,6 (ушир., 2 Н). Пример 26. Метиловый эфир 6,7-дигидрокси-5-нитробензо[b]тиофен-2-карбоновой кислоты. 4-Гидрокси-3-метокси-5-нитробензальдегид. К раствору концентрированной азотной кислоты (900 мл) и воды (900 мл) добавляли 4-гидрокси-3 метоксибензальдегид (300 г) при температуре до 10 С. После перемешивания в течение 1 ч при 0 С осадок отфильтровывали и промывали водой. 1 Н ЯМР (ДМСО-d6):3,90 (с, 3H), 7,64 (д, 1 Н, J=1,8 Гц), 8,09 (д, 1 Н, J=1,8 Гц), 9,88 (с, 1 Н). 2-Бром-3,4-дигидрокси-5-нитробензальдегид. Продукт предыдущей стадии реакции, концентрированную бромисто-водородную кислоту (2 л) и уксусную кислоту (2 л) нагревали с обратным холодильником в течение 2 дней. Добавляли воду (1 л) и насыщенный раствор Na2SO4 (1 л) и смесь экстрагировали простым эфиром. Органическую фазу сушили сульфатом натрия и выпаривали до меньшего объема. Осажденный продукт отфильтровывали. 1 Н ЯМР (ДМСО-d6):7,92 (с, 1 Н), 10,3 (с, 1 Н). 2-Бром-3,4-диэтокси-5-нитробензальдегид. 2-Бром-3,4-дигидрокси-5-нитробензальдегид(5,2 г), этилбромид (4,5 мл) и N,Nдиизопропилэтиламин (10,5 мл) в N,N-диметилформамиде (50 мл) перемешивали при 70 С в течение 2 дней. Смесь выливали в воду и экстрагировали простым эфиром. Органическую фазу промывали раствором NaOH, сушили сульфатом натрия и выпаривали досуха. 1 Н ЯМР (ДМСО-d6):1,33 (т, 3H, J=8,0 Гц), 1,40 (т, 3H, J=8,0 Гц), 4,15 (кв., 2 Н, J=8,0 Гц), 4,30 (кв.,2 Н, J=8,0 Гц), 8,09 (с, 1 Н), 10,2 (с, 1 Н). Метиловый эфир 6,7-диэтокси-5-нитробензо[b]тиофен-2-карбоновой кислоты. К раствору 2-бром-3,4-диэтокси-5-нитробензальдегида (1,5 г) в N,N-диметилформамиде (5 мл) при 0 С добавляли метилтиогликолят (1,5 г) и триэтиламин (2,2 мл). Перемешивание продолжалось при комнатной температуре в течение ночи. Добавляли 1 М HCl и продукт экстрагировали простым эфиром. Органическую фазу сушили сульфатом натрия и выпаривали. Неочищенный продукт растирали с метанолом. 1 Н ЯМР (ДМСО-d6):1,34 (т, 3H, J=7,8 Гц), 1,39 (т, 3H, J=7,8 Гц), 3,92 (с, 3H), 4,22 (кв, 2 Н, J=7,8 Гц), 4,31 (кв, 2 Н, J=7,8 Гц), 8,30 (с, 1 Н), 8,82 (с, 1 Н). Метиловый эфир 6,7-дигидрокси-5-нитробензо[b]тиофен-2-карбоновой кислоты. Метиловый эфир 6,7-диэтокси-5-нитробензо[b]тиофен-2-карбоновой кислоты (0,77 г), хлорид цинка(5,0 г) и концентрированную HCl (1,3 мл) перемешивали и нагревали при 100 С в течение 2 ч. Реакционную смесь охлаждали. Добавляли воду (20 мл) и осадок отфильтровывали. Неочищенный продукт дважды перекристаллизовывали из метанола. Точка плавления: 216-218 С. 1 Н ЯМР (ДМСО-d6):3,84 (с, 3H), 8,17 (с, 1 Н), 8,21 (с, 1 Н), 10,2 (ушир., 2 Н). Пример 27. 1-(5,6-Диметокси-7-нитробензо[b]тиофен-2-ил)нонан-1-он. 5,6-Дигидрокси-7-нитробензо[b]тиофен-2-карбоновую кислоту (0,1 г) из примера 17,1-октанол (2 мл) и концентрированную серную кислоту (1 каплю) нагревали с обратным холодильником при 120 С в течение 3 ч. Продукт очищали с помощью колоночной хроматографии с использованием смеси толуолэтилацетат-уксусная кислота 8:1:1 в качестве элюента. Точка плавления: 115-117 С. Выход: 62,4 мг. 1 Н ЯМР (ДМСО-d6):0,83-0,87 (м, 3H), 1,26-1,39 (м, 10H), 1,68-1,73 (м, 2 Н), 4,26-4,30 (кв, 2 Н), 7,69(3-Хлор-5,6-дигидроксибензо[b]тиофен-2-ил)морфолин-4-илметанон. Алюминийхлорид (6,62 г) постепенно добавляли в охлажденный ацетонитрил (14,7 мл) при 10 С и затем добавляли иодид натрия (5,57 г). Раствор перемешивали при комнатной температуре в течение 30 мин. Добавляли (3-хлор-5,6-диметоксибензо[b]тиофен-2-ил)морфолин-4-илметанон (2,1 г) из примера 8. Раствор перемешивали при 50 С в течение 5 ч и при комнатной температуре в течение ночи. В холодную реакционную смесь добавляли 2 н. HCl (8,4 мл) и затем добавляли сульфит натрия (1,58 г) и воду (35 мл). Смесь перемешивали при 40 С в течение 30 мин. Продукт отфильтровывали, промывали водой и сушили в вакууме. 1 Н ЯМР (ДМСО-d6):3,52 (м, 4 Н), 3,63 (м, 4 Н), 7,11 (1 Н), 7,32 (1 Н), 9,63 (1 Н), 9,70 (1 Н).(3-Хлор-5,6-дигидроксибензо[b]тиофен-2-ил)морфолин-4-илметанон (1,0 г) суспендировали в метансульфоновой кислоте (20 мл), а затем постепенно добавляли нитрат калия (0,73 г). Реакционную смесь перемешивали при комнатной температуре и через 15 мин выливали в ледяную воду (100 мл). Продукт отфильтровывали, промывали водой и метанолом и сушили в вакууме. Точка плавления: 233235 С. 1 Н ЯМР (ДМСО-d6):3,52 (м, 4 Н), 3,62 (м, 4 Н), 9,6-10,4 (ушир., 2 Н). Пример 29. (3,4-Хлор-5,6-дигидрокси-7-динитробензо[b]тиофен-2-ил)морфолин-4-илметанон.(3-Хлор-5,6-дигидрокси-7-динитробензо[b]тиофен-2-ил)морфолин-4-илметанон (0,5 г) из примера 8, хлорид меди(II) (0,9 г) и хлорид лития (0,3 г) в уксусной кислоте (5 мл) нагревали при кипении с об- 17017329 ратным холодильником в течение 5 ч. К реакционной смеси добавляли воду. Полученное в результате твердое вещество отфильтровывали, промывали водой и сушили в вакууме. Точка плавления: 273-279 С. 1(3-Хлор-5,6-дигидроксибензо[b]тиофен-2-ил)морфолин-4-илметанон (2,0 г) из примера 28 суспендировали в метансульфоновой кислоте (40 мл), а затем постепенно добавляли нитрат калия (0,64 г). Реакционную смесь перемешивали при комнатной температуре и через 15 мин выливали в ледяную воду(100 мл). Твердое вещество отфильтровывали, промывали водой (50 мл) и сушили в вакууме. Полученное в результате твердое вещество растворяли в ДМФА (диметилформамиде) (6,2 мл) и затем добавляли этанол (18,4 мл). Продукт отфильтровывали и промывали метанолом (15 мл). Точка плавления: 216 С. 1 Н ЯМР (ДМСО-d6):3,43 (м, 4 Н), 3,62 (м, 4 Н), 7,59 (с, 1 Н), 10,55 (ушир., 1 Н), 11,21 (ушир., 1 Н). Пример 31.(3-Хлор-5,6-диметоксибензо[b]тиофен-2-ил)-(2,6-диметилморфолин-4-ил)метанон. 3-Хлор-5,6-диметоксибензо[b]тиофен-2-карбонилхлорид (2,0 г) и 2,6-диметилморфолин (1,82 г) суспендировали в тетрагидрофуране (15 мл) и добавляли триэтиламин (0,96 мл) и перемешивание продолжали при комнатной температуре в течение недели. Добавляли воду, рН доводили до 3 с помощью(3-Хлор-5,6-дигидроксибензо[b]тиофен-2-ил)-(2,6-диметилморфолин-4-ил)метанон. Иодид натрия (1,62 г) добавляли к раствору хлорида алюминия (2,16 г) в ацетонитриле (5 мл). Через 30 мин перемешивания добавляли (3-хлор-5,6-диметоксибензо[b]тиофен-2-ил)-(2,6-диметилморфолин-4 ил)метанон и смесь нагревали при 50 С в течение 12 ч. К смеси добавляли 2 н. HCl (4 мл), Na2SO3 (0,68 г) и воду и нагревали при 60 С в течение 30 мин, а затем охлаждали до комнатной температуры. Осадок отфильтровывали. 1 Н ЯМР (400 МГц, ДМСО-d6):1,09 (с, 6 Н), 2,6-4,4 (ушир., 6 Н), 7,11 (с, 1 Н), 7,31 (с, 1 Н), 9,63 (с,1 Н), 9,70 (с, 1 Н).(3-Хлор-5,6-дигидроксибензо[b]тиофен-2-ил)-(2,6-диметилморфолин-4-ил)метанон (0,20 г) растворяли в этилацетате и добавляли 1 н. раствор HNO3 в дихлорметане (0,64 мл). Перемешивание продолжали в течение 4 ч. Смесь концентрировали до меньшего объема, осадок отфильтровывали и промывали водой. Неочищенный продукт перекристаллизовывали из смеси N,N-диметилформамид/этанол (25:75). 1 Н ЯМР (400 МГц, ДМСО-d6):1,09 (с, 6 Н), 2,6-4,5 (ушир., 6 Н), 7,49 (с, 1 Н). Пример 32.(3-Хлор-5,6-диметоксибензо[b]тиофен-2-ил)-(4-гидроксипиперидин-1-ил)метанон. 3-Хлор-5,6-диметоксибензо[b]тиофен-2-карбонилхлорид (2,0 г) и 4-гидроксипиперидин (1,60 г) суспендировали в тетрагидрофуране (15 мл) и добавляли триэтиламин (0,96 мл) и перемешивание продолжали при комнатной температуре в течение 2 ч. Добавляли воду, рН доводили до 3 с помощью HCl и осадок отфильтровывали. 1 Н ЯМР (400 МГц, ДМСО-d6):1,38-1,42 (м, 2 Н), 1,72-1,85 (м, 2 Н), 3,2-3,3 (м, 2 Н), 3,4-4,2 (ушир.,2 Н), 3,7-3,8 (м, 1 Н), 3,85 (с, 3H), 3,88 (с, 3H), 4,81 (д, 1 Н, J=4,1 Гц), 7,21 (с, 1 Н), 7,67 (с, 1 Н).(3-Хлор-5,6-дигидроксибензо[b]тиофен-2-ил)-(4-гидроксипиперидин-1-ил)метанон. Иодид натрия (1,62 г) добавляли к раствору хлорида алюминия (2,52 г) в ацетонитриле (7 мл). Через 30 мин перемешивания добавляли (3-хлор-5,6-диметоксибензо[b]тиофен-2-ил)-(4-гидроксипиперидин-1 ил)метанон (0,96 г) и смесь нагревали при 50 С в течение 12 ч. К смеси добавляли 2 н. HCl (4 мл), Na2SO3(0,68 г) и воду и смесь нагревали при 60 С в течение 30 мин, а затем охлаждали до комнатной температуры. Осадок отфильтровывали. 1 Н ЯМР (400 МГц, ДМСО-d6):1,35-1,45 (м, 2 Н), 1,72-1,82 (м, 2 Н), 3,18-3,30 (м, 2 Н), 3,4-4,2 (ушир.,2 Н), 3,7-3,8 (м, 1 Н), 4,80 (д, 1 Н, J=4,1 Гц), 7,10 (с, 1 Н), 7,31 (с, 1 Н), 9,61 (с, 1 Н), 9,68 (с, 1 Н).(3-Хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)-(4-гидроксипиперидин-1-ил)метанон. Раствор 1 М HNO3 в дихлорметане (0,67 мл) добавляли к раствору (3-хлор-5,6-дигидроксибензо[b]тиофен-2-ил)-(4-гидроксипиперидин-1-ил)метанона (0,17 г) в этилацетате (10 мл). Перемешивание продолжали при 60 С в течение 3 ч, а затем при комнатной температуре в течение ночи. Смесь концентрировали до меньшего объема и осадок отфильтровывали и промывали водой. Неочищенный продукт перекристаллизовывали из смеси N,N-диметилформамид/этанол (25:75). 1 Н ЯМР (400 МГц, ДМСО-d6):1,35-1,45 (м, 2 Н), 1,70-1,85 (ушир., 2 Н), 3,1-4,0 (ушир., 6 Н), 7,49 (с,1 Н).(5,6-Диметокси-3-метилбензо[b]тиофен-2-ил)морфолин-4-илметанон (2,0 г) из примера 20, Nбромсукцинимид (1,18 г) и 2,2'-азо-бис-(2-метилпропионитрил) (40 мг) в тетрахлориде углерода (6 мл) нагревали с обратным холодильником в атмосфере аргона в течение 4 ч. Смесь охлаждали и отфильтровывали и фильтрат выпаривали досуха. Продукт представлял собой смесь (4-бром-5,6-диметокси-3 метилбензо[b]тиофен-2-ил)морфолин-4-илметанона и (3-бромметил-5,6-диметоксибензо[b]тиофен-2 ил)морфолин-4-илметанона. Соединения разделяли флэш-хроматографией с использованием смеси этилацетат/гептан (1:4) в качестве элюента.(3-Бромметил-5,6-дигидроксибензо[b]тиофен-2-ил)морфолин-4-илметанон. Раствор 1 н. трехбромистого бора в дихлорметане (3,4 мл) добавляли к раствору (3-бромметил-5,6 диметоксибензо[b]тиофен-2-ил)морфолин-4-илметанона (0,46 г) в дихлорметане (10 мл) при -20 С. Перемешивание продолжали при 0 С в течение 1 ч. Добавляли метанол и смесь выпаривали досуха. К остатку добавляли 5% раствор Na2SO3 (5 мл), смесь подкисляли и осадок отфильтровывали. 1 Н ЯМР (400 МГц, ДМСО-d6):3,52 (ушир., 4 Н), 3,61 (ушир., 4 Н), 4,78 (с, 2 Н), 7,26 (с, 1 Н), 7,28 (с,1 Н), 9,39 (с, 1 Н), 9,56 (с, 1 Н).(3-Бромметил-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон. Раствор 1 М HNO3 в дихлорметане (1,02 мл) добавляли к раствору (3-бромметил-5,6 дигидроксибензо[b]тиофен-2-ил)морфолин-4-илметанона (0,35 г) в этилацетате (50 мл) и перемешивание продолжали при 60 С в течение 2 ч. Охлажденную смесь промывали водой, сушили и выпаривали досуха. Продукт перекристаллизовывали из ацетона. 1 Н ЯМР (400 МГц, CDCl3):3,68 (ушир., 4 Н), 3,78 (ушир., 4 Н), 4,70 (с, 2 Н), 5,94 (с, 1 Н), 7,78 (с,1 Н), 11,6 (с, 1 Н). Пример 34. 5,6-Дигидрокси-3-метил-2-(морфолин-4-карбонил)бензо[b]тиофен-4-карбонитрил. 5,6-Диметокси-3-метил-2-(морфолин-4-карбонил)бензо[b]тиофен-4-карбонитрил.(4-Бром-5,6-диметокси-3-метилбензо[b]тиофен-2-ил)морфолин-4-илметанон (0,42 г) из примера 33 и цианид меди(I) (2,0 г) в N,N-диметилформамиде (8 мл) подвергали облучению в микроволновой печи при 150 С в течение 1,5 ч. К смеси добавляли воду и продукт экстрагировали этилацетатом. Этилацетат сушили и выпаривали досуха. 1 Н ЯМР (400 МГц, CDCl3):2,66 (с, 3H), 3,5-3,8 (ушир., 8 Н), 3,96 (с, 3H), 4,05 (с, 3H), 7,46 (с, 1 Н).NOESY ЯМР показал цианогруппу в 4 положении. 5,6-Дигидрокси-3-метил-2-(морфолин-4-карбонил)бензо[b]тиофен-4-карбонитрил. Раствор 1 н. трехбромистого бора в дихлорметане (3,4 мл) добавляли к раствору 5,6-диметокси-3 метил-2-(морфолин-4-карбонил)бензо[b]тиофен-4-карбонитрила (0,19 г) в дихлорметане (40 мл) при 0 С. Смесь оставляли стоять при 6 С в течение 2 дней. Добавляли метанол и смесь выпаривали досуха. К остатку добавляли 1 н. HCl и продукт экстрагировали этилацетатом. Этилацетат сушили и выпаривали досуха. Соединение перекристаллизовывали из изопропанола. 1 Н ЯМР (400 МГц, ДМСО-d6):2,49 (с, 3H), 3,51 (ушир., 4 Н), 3,60 (ушир., 4 Н), 7,54 (с, 1 Н). Пример 35. (3-Хлор-5,6-дигидрокси-7-цианобензо [b]тиофен-2-ил)морфолин-4-илметанон.(3-Хлор-5,6-диметоксибензо[b]тиофен-2-ил)морфолин-4-илметанон (11,8 г) из примера 8 суспендировали в дихлорметане (250 мл) и постепенно добавляли хлорид алюминия (33 г). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Затем постепенно добавляли 6 М хлористоводородную кислоту (96 мл). Органический слой сушили сульфатом натрия, выпаривали и сушили в вакууме. Продукт представлял собой смесь двух соединений и использовался для следующей стадии без какой-либо очистки.(3-Хлор-6-гидрокси-5-метоксибензо[b]тиофен-2-ил)морфолин-4-илметанон (6,9 г) суспендировали в уксусной кислоте. Постепенно добавляли раствор брома (3,51 г) в уксусной кислоте (31 мл). Реакционную смесь перемешивали при комнатной температуре и через 15 мин добавляли воду (125 мл). Реакционную смесь перемешивали на холоде в течение 1,5 ч. Твердое вещество отфильтровывали и сушили в вакууме. Продукт представлял собой смесь двух соединений и использовался для следующей стадии без какой-либо очистки.- 19017329 раствор нагревали при 80 С в течение 3 ч. Затем добавляли воду (350 мл). Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Продукт экстрагировали этилацетатом. Органическую фазу промывали 1 М хлористо-водородной кислотой и раствором сульфата натрия, выпаривали и сушили в вакууме. Продукт очищали флэш-хроматографией с использованием смеси гептан-этилацетат в качестве элюента. 1 Н ЯМР (ДМСО-d6):3,46 (ушир., 4 Н), 3,64 (ушир., 4 Н), 3,84 (с, 3H), 3,97 (с, 3H), 7,39 (с, 1 Н).(2,3 г) в N,N-диметилформамиде подвергали облучению в микроволновой печи при 180 С в течение 1,5 ч. К смеси добавляли воду (40 мл) и этилацетат (40 мл). Твердое вещество отфильтровывали, органическую фазу выпаривали и сушили в вакууме. Продукт очищали флэш-хроматографией с использованием смеси гептан-этилацетат в качестве элюента. 1 Н ЯМР (ДМСО-d6):3,65 (ушир., 8 Н), 4,00 (м, 3H), 4,05 (м, 3H), 7,39 (с, 1 Н).(3-Хлор-7-циано-5,6-диметоксибензо[b]тиофен-2-ил)морфолин-4-илметанон (0,05 г) суспендировали в дихлорметане в атмосфере азота, охлаждали до -20 С и обрабатывали по каплям раствором 1 М трехбромистого бора в дихлорметане. Суспензию перемешивали при -20 С в течение 30 мин и оставляли на холоде в течение ночи. Смесь выливали в охлажденную льдом воду и перемешивали при комнатной температуре в течение 30 мин. Продукт отфильтровывали и очищали с помощью препаративной платы(обратная фаза) с использованием смеси толуола, этилацетата и уксусной кислоты (8:1:1) в качестве элюента. 1 Н ЯМР (ДМСО-d6):3,52 (м, 4 Н), 3,63 (ушир., 4 Н), 7,02 (с, 1 Н). Как уже до этого упоминалось, соединения формулы I проявляют интересные фармакологические свойства, а именно они проявляют усиленную ингибирующую активность фермента катехол-Ометилтрансферазы (СОМТ) и имеют улучшенную биодоступность и/или пролонгируют длительность действия благодаря медленному элиминированию через глюкуронидирование. Кроме того, они не разобщают окислительное фосфорилирование. Указанные свойства демонстрируются фармакологическими испытаниями, представленными ниже. Эксперимент 1. Определение СОМТ ингибирующей активности in vitro. Величины Ki определяли с помощью измерения активности СОМТ различными концентрациями лекарственных средств с использованием рекомбинантной человеческой растворимой формы СОМТ (hSCOMT). hS-COMT предварительно инкубировали с 25 мкМ S-аденозил-L-метионина (SAM) и СОМТ ингибитором в 100 мкМ Na2HPO4 буфера (рН 7,4), содержащего 5 мкМ MgCl2 в течение 5 мин при 37 С. Реакцию инициировали добавлением субстрата эскулетина (10 мкМ). Продуцирование Ометилированного эскулетина измеряли с помощью флуоресценции с разрешением во времени (возбуждение при 355 нм, эмиссия при 460 нм) с использованием флюорометра FlexStation (Molecular Probes,США). Анализ выполняли на 96-луночных планшетах. Константу ингибирования плотного связыванияKi определяли по кинетике реакции, наблюдаемой при варьируемых концентрациях ингибитора с использованием программного обеспечения PlateKi (BioKin, США). Результаты показаны в табл. 1. Результаты показывают, что соединения формулы I способны ингибировать СОМТ активность in vitro с эффективностью, лучшей или равной эффективности энтакалона. Таблица 1 СОМТ ингибирующая активность in vitro Эксперимент 2. Определение метаболической стабильности in vitro. Метаболическую стабильность исследовали с помощью инкубирования соединений вместе с микросомами печени человека (Human Biologies Inc.) с использованием уридин-5'-дифосфоглюкуроновой кислоты (UDPGA, Sigma) в качестве кофактора. Инкубирование осуществляли в 100 мМ фосфатном буфере (рН 7,4), содержащем 5 мМ MgCl2. Конечная концентрация испытуемого вещества составляла 100- 20017329 мкМ, а количество микросомального белка - 0,4 мг/мл. После 5-минутной предварительной инкубации начинали реакцию с предварительно подогретой UDPGA, конечная концентрация 5 мМ. Смесь инкубировали в трубках Эппендорфа в течение 60 мин при 37 С и реакцию заканчивали добавлением метанола или смеси перхлорная кислота/метанол (1:9). После осаждения белка образовавшийся глюкуронид отделяли высокоэффективной жидкостной хроматографией (HPLC). Зону глюкуронида на HPLC хроматограмме сравнивали с зоной, образуемой от энтакапона в тех же экспериментальных условиях, с получением относительной величины глюкуронидирования для каждого соединения. Результаты показаны в табл. 2. Результаты показывают, что соединения формулы I обладают повышенной метаболической стабильностью в отношении глюкуронидирования по сравнению с энтакапоном. Было показано, что глюкуронидирование является главным способом элиминирования энтакапона,и, таким образом, соединения формулы I имеют улучшенную биодоступность и/или пролонгированную длительность действия. Таблица 2 Метаболическая стабильность in vitro (относительное глюкуронидирование; энтакапон = 1,00) Эксперимент 3. Определение разобщения окислительного фосфорилирования in vitro. Разобщение окислительного фосфорилирования исследовали на изолированных митохондриях печени крыс путем измерения потребления кислорода с помощью флуоресценции. Препараты митохондриев готовили, как описано в работе Nissinen et al. European Journal of Pharmacology, 340 (1997) 287. Вкратце, крысу обезглавливали, печень вырезали, промывали в охлажденном льдом 0,9% NaCl и резали на кусочки. Ткань помещали в 40 мл гомогенизационного буфера, содержащего 2 мМ Трис-HCl, 0,25 М сахарозу, 0,1 мМ EDTA (этилендиаминтетрауксусная кислота) рН 6,8 (1:4 вес./об.), и гомогенизировали с 5-20 ходами (800 об/мин) в вставленном в среду тефлон-в-стекле гомогенизаторе Брауна. Гомогенат центрифугировали при 1000 g в течение 10 мин при 4 С. Супернатант собирали и центрифугировали при 8200 g в течение 10 мин при 4 С. Супернатант отбрасывали, а осадок промывали дважды 10 мл гомогенизационного буфера. Суспензию центрифугировали при 8200 g в течение 10 мин при 4 С. Супернатант отбрасывали, а осадок суспендировали в 2 мл гомогенизационного буфера и хранили во льду до использования (до 2-6 ч). Измеряли концентрацию белка. Для измерения потребления кислорода митохондриями использовали BD кислородных биосенсорных 96-микролуночных планшет. Микролуночный планшет имеет чувствительное к кислороду флуоресцентное соединение (трис-хлорид 1,7-дифенил-1,10-фенантролинрутения(II, помещенное на газопроницаемое дно лунки. Кислород ингибирует флуоресценцию красителя, так что потребление кислорода митохондриями детектируется в виде увеличения флуоресценции. Испытуемые соединения добавляли на аналитический планшет при различных конечных концентрациях (1, 2,5, 5, 10, 25, 50 мкМ). В качестве ссылочного соединения использовали известный разобщитель митохондриального окислительного фосфорилирования (DNP; 10 мкМ), (см. Hemker Biochimica etBiophysica Acta, 81 (1964) 1, Nissinen et al. European Journal of Pharmacology, 340 (1997) 287). Контроль содержал только 2% ДМСО. Исходный раствор митохондриев (0,72 мл = 4 мг/белок/мл) добавляли в 2,28 мл респираторного буфера (37 С), содержащего 250 мМ сахарозы, 5 мМ Na2HPO4, 2 мМ MgCl2, 1 мМEGTA, 5 мМ сукцината натрия и 10 мМ MOPS pH 7,0. Измерение начинали с добавления в лунки суспензии митохондриев (50 мкл/лунка). Планшет перемешивался в течение 20 с, и измеряли флуоресценцию в лунках в течение 10 мин с использованием 9-секундного интервала, возбуждение при 485 нм, эмиссию при 630 нм и срез эмиссии при 610 нм. Опцию чувствительности фотомножительной трубки устанавливали до "низкой". Определяли фактор наклона измерения каждого потребления кислорода. Средние величины от двух повторений делили на средние значения шести контрольных величин и для соединений определяли пороговые величины разобщения. Соотношения DNP/контроль описывают активность митохондриев. Если угловой коэффициент склона образец/контроль превышал 2, это интерпретировалось как разобщение окислительного фосфорилирования. В качестве контроля качества анализа вычисляли соотношения DNP/контроль, что дает активность митохондриев. Считались приемлемыми и использовались в испытаниях только анализы, в которых соотношение DNP/контроль превышало 4. Результаты показаны в табл. 3. Результаты показывают, что соединения формулы I не разобщают окислительное фосфорилирование. Соединения формулы I, таким образом, обладают желаемым профилем безопасности.- 21017329 Таблица 3 Разобщение окислительного фосфорилирования in vitro Соединения формулы I проявляют СОМТ ингибирующую активность. Настоящее изобретение, таким образом, обеспечивает соединения или их соли или эфиры для использования в качестве лекарственных средств. Кроме того, предоставляется способ лечения заболеваний или состояний, при которых показаны СОМТ ингибирующие агенты. Например, предоставляется способ лечения болезни Паркинсона, такой как потенциирование терапии с помощью левадопа или терапии другим допаминовым предшественником. В указанном способе субъекту, нуждающемуся в таком лечении, вводится терапевтически эффективное количество по меньшей мере одного соединения формулы I. Предоставляется также применение соединений формулы I для производства лекарственного средства для лечения заболеваний или состояний, при которых показаны СОМТ ингибирующие агенты, например болезни Паркинсона. Соединения формулы I могут вводиться, например, энтерально, топически или парентерально в виде любой фармацевтической рецептуры, полезной для указанного введения и содержащей по меньшей мере одно активное соединение формулы I в фармацевтически приемлемых и эффективных количествах вместе с фармацевтически приемлемыми разбавителями, носителями и/или эксципиентами, известными в данной области техники. Терапевтическая доза, даваемая пациенту, нуждающемуся в лечении, будет меняться в зависимости от вводимого соединения, возраста и пола подвергаемого лечению субъекта, конкретного состояния,подвергаемого лечению, а также от пути и способа введения, и легко определяется специалистом в данной области. Соответственно типичная дозировка для перорального введения составляет от 5 мкг/кг до 100 мг/кг в день и для парентерального введения - от 0,5 мкг/кг до 10 мг/кг для взрослого млекопитающего. Соединения согласно данному изобретению даются пациенту как таковые или в сочетании с одним или более другими активными ингредиентами и/или подходящими фармацевтическими наполнителями. Последняя группа включает обычно используемые эксципиенты и рецептурные вспомогательные средства, такие как наполнители, связующие, дезинтегрирующие агенты, смазочные агенты, растворители,гелеобразующие агенты, эмульгаторы, стабилизаторы, красящие агенты и/или консерванты. Соединения формулы I формулируются в дозировочные формы с использованием общеизвестных фармацевтических способов производства. Дозировочными формами могут быть, например, таблетки,капсулы, гранулы, медицинские свечи, эмульсии, суспензии или растворы. В зависимости от пути введения и галеновой формы количество активного агента в рецептуре может обычно варьировать между 0,01 и 100% (вес./вес.). Для лечения болезни Паркинсона соединения формулы I могут даваться вместе с леводопа или другим допаминовым предшественником, каждым в своей собственной композиции или в сочетании в одной композиции. Может присутствовать также ингибитор допадекарбоксилазы (DDC), такой как бензеразид или карбидопа, и/или ингибитор моноаминоксидазы типа В (МАО-В), такой как лазабемид, разагилин,сафинамид или селегилин. Количество леводопа может составлять от 50 до 400 мг, например от 50 до 300 мг, такое как от 50 до 200 мг. Количество карбидопа может составлять от 5 до 200 мг, например от 5 до 100 мг, такое как от 5 до 50 мг. Ингибитор DDC и предшественник допамина, такой как леводопа, обычно вводятся в соотношении от 1:1 до 1:40, например от 1:4 до 1:10. Суточная доза лазабемида составляет обычно от 100 до 800 мг, например от 100 до 200 мг, разделенных на 1-10 отдельных доз, например на 1-2 отдельные дозы. Суточная доза разагилина составляет обычно от 0,1 до 5 мг, например от 0,5 до 2 мг, разделенных на 1-10 отдельных доз, например на 1-2 отдельные дозы. Суточная доза сафинамида составляет обычно от 10 до 600 мг, например от 50 до 150 мг,разделенных на 1-10 отдельных доз, например на 1-2 отдельные дозы. Суточная доза селегилина составляет обычно от 1 до 20 мг, например от 2 до 10 мг, разделенных на 1-10 отдельных доз, например на 1-2 отдельные дозы. Специалисты в данной области, очевидно, понимают, что воплощения изобретения, описанные в данной заявке, могут видоизменяться без отклонения от концепции изобретения. Специалисты в данной области также понимают, что изобретение не ограничивается конкретными описанными воплощениями, а предназначены также для включения модификаций воплощений, которые охватываются сутью и объемом изобретения.R1 представляет циано или нитро;R4 представляет Н, (C1-C6)алкил, галоген(C1-C6)алкил, циано, формил, (C1-C6)алкил-(С=O)-, галоген или нитро; пунктирная линия представляет одинарную или двойную связь; или два из X, Y или Z представляют CR5(R6)m и один из X, Y или Z представляет N(R7)n, О или S; или один из X, Y или Z представляет CR5(R6)m, один из X, Y или Z представляет N(R7)n и один из X, Y или Z представляет S;R5 представляет независимо в каждом случае Н, (C1-C6)алкил, галоген, галоген(C1-C6)алкил, (C1C6)алкокси-(С=O)-, карбокси, арил, гетероарил, гетероциклил-(С=O)- или (R8)2N-(С=O)-, где указанные гетероциклил, арил или гетероарил, как сами по себе или как часть еще какой-нибудь группы, являются незамещенными или замещенными 1 или 2 заместителями, каждый из которых независимо представляетR5 и R6, присоединенные, оба, к одному и тому же кольцевому атому углерода, образуют вместе с кольцевым атомом углерода, к которому они присоединены, -(С=O)-группу;R7 представляет независимо в каждом случае (C1-C6)алкил или арил, где указанный арил является замещенным 1 заместителем, представляющим галоген;R8 представляет независимо в каждом случае Н, (C1-C6)алкил, (C1-C6)алкокси, арил или арил(C1C6)алкил, где указанный арил, как сам по себе или как часть еще какой-нибудь группы, является незамещенным или замещенным 1 или 2 заместителями, каждый из которых независимо представляет (C1C6)алкил, галоген, гидрокси, карбокси или (C1-C6)алкокси; или его фармацевтически приемлемая соль или эфир. 2. Соединение по п.1, отличающееся тем, что R2 находится в орто-положении к R3 и R1 находится в орто-положении к R2. 3. Соединение по п.1, отличающееся тем, что R1 находится в орто-положении к R3 и R4 находится в орто-положении к R1. 4. Соединение по любому из пп.1-3, отличающееся тем, что R4 представляет Н, галоген или нитро. 5. Соединение по п.4, отличающееся тем, что R4 представляет Н. 6. Соединение по любому из пп.1-5, отличающееся тем, что R1 представляет циано. 7. Соединение по любому из пп.1-5, отличающееся тем, что R1 представляет нитро. 8. Соединение по любому из пп.1-7, отличающееся тем, что одна из пунктирных линий представляет двойную связь. 9. Соединение по любому из пп.1-8, отличающееся тем, что два из X, Y или Z представляютCR5(R6)m и один из X, Y или Z представляет N(R7)n. 10. Соединение по любому из пп.1-8, отличающееся тем, что один из X, Y или Z представляетCR5(R6)m, один из X, Y или Z представляет N(R7)n и один из X, Y или Z представляет S. 11. Соединение по любому из пп.1-8, отличающееся тем, что два из X, Y или Z представляютCR5(R6)m и один из X, Y или Z представляет О. 12. Соединение по любому из пп.1-8, отличающееся тем, что два из X, Y или Z представляютCR5(R6)m и один из X, Y или Z представляет S. 13. Соединение по любому из пп.1-12, отличающееся тем, чтоR5 представляет независимо в каждом случае Н, (C1-C6)алкил, галоген, галоген(C1-C6)алкил, (C1C8)алкокси-(С=О)-, карбокси, арил, гетероарил, гетероциклил-(С=O)- или (R8)2N-(С=О)-, где указанные гетероциклил, арил или гетероарил, как сами по себе или как часть еще какой-нибудь группы, являются незамещенными или замещенными 1, 2 или 3 заместителями, представляющими, каждый независимо,(C1-C6)алкил или гидрокси;- 23017329 же кольцевому атому углерода, образуют вместе с кольцевым атомом углерода, к которому они присоединены, -(С=O)-группу;R8 представляет независимо в каждом случае (C1-C6)алкил или арил, где указанный арил является незамещенным или замещенным 1 или 2 заместителями, представляющими, каждый независимо, карбокси или (C1-C6)алкокси. 14. Соединение по п.13, отличающееся тем, чтоR5 представляет независимо в каждом случае Н, галоген, (C1-C8)алкокси-(С=O)-, карбокси, гетероциклил-(С=O)- или (R8)2N-(С=O)-, где указанный гетероциклил как часть еще какой-нибудь группы является незамещенным или замещенным 1, 2 или 3 заместителями, представляющими, каждый независимо,(C1-C6)алкил или гидрокси;R8 представляет независимо в каждом случае (C1-C6)алкил или арил, где указанный арил является незамещенным или замещенным 1 заместителем, представляющим карбокси или (C1-C6)алкокси. 15. Соединение по п.1, отличающееся тем, что соединением является 2-(4-хлорфенил)-5,6 дигидрокси-4-нитро-2,3-дигидроизоиндол-1-он,5,6-дигидрокси-7-нитро-3H-изобензофуран-1-он, 7 нитро-2-пиридин-4-илбензотиазол-5,6-диол,метансульфонат,3-хлор-5,6-дигидрокси-7 нитробензо[b]тиофен-2-карбоновая кислота,этиловый эфир 3-хлор-5,6-дигидрокси-7 нитробензо[b]тиофен-2-карбоновой кислоты,3-хлор-5,6-дигидрокси-4-нитробензо[b]тиофен-2 карбоновая кислота,3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен,(3-хлор-5,6-дигидрокси-7 нитробензо[b]тиофен-2-ил)морфолин-4-илметанон,диэтиламид 3-хлор-5,6-дигидрокси-7 нитробензо[b]тиофен-2-карбоновой кислоты,(3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2 ил)пиперидин-1-илметанон, фениламид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты, 3-[(3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбонил)амино]бензойная кислота, 4-[(3 хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбонил)амино]бензойная кислота,(4 метоксифенил)амид 3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-карбоновой кислоты, 2-метил-7 нитробензотиазол-5,6-диол, (5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон, 5,6 дигидрокси-7-нитробензо[b]тиофен-2-карбоновая кислота,5,6-дигидрокси-7-нитробензофуран-2 карбоновая кислота, 5,6-дигидрокси-2-метил-7-нитробензо[d]изотиазол-3-он, (5,6-дигидрокси-3-метил-7 нитробензо[b]тиофен-2-ил)морфолин-4-илметанон,этиловый эфир 5,6-дигидрокси-7 нитробензо[b]тиофен-2-карбоновой кислоты, 5,6-дигидрокси-4-нитроизобензофуран-1,3-дион, 5,6 дигидрокси-4-нитро-3H-изобензофуран-1-он, 5,6-дигидрокси-4,7-динитро-3H-изобензофуран-1-он, 7 нитро-2-фенилбензотиазол-5,6-диол,метиловый эфир 6,7-дигидрокси-5-нитробензо[b]тиофен-2 карбоновой кислоты, 1-(5,6-диметокси-7-нитробензо[b]тиофен-2-ил)нонан-1-он, (3-хлор-5,6-дигидрокси 4,7-динитробензо[b]тиофен-2-ил)морфолин-4-илметанон,(3,4-дихлор-5,6-дигидрокси-7 динитробензо[b]тиофен-2-ил)морфолин-4-илметанон, (3-хлор-5,6-дигидрокси-4-нитробензо[b]тиофен-2 ил)морфолин-4-илметанон,(3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)-(2,6-диметилморфолин-4-ил)метанон,(3-хлор-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)-(4-гидроксипиперидин-1 ил)метанон, (3-бромметил-5,6-дигидрокси-7-нитробензо[b]тиофен-2-ил)морфолин-4-илметанон, 5,6 дигидрокси-3-метил-2-(морфолин-4-карбонил)бензо[b]тиофен-4-карбонитрил или(3-хлор-5,6 дигидрокси-7-цианобензо[b]тиофен-2-ил)морфолин-4-илметанон. 16. Соединение по п.1, отличающееся тем, что соединением является (3-хлор-5,6-дигидрокси-7 нитробензо[b]тиофен-2-ил)морфолин-4-илметанон; диэтиламид 3-хлор-5,6-дигидрокси-7 нитробензо[b]тиофен-2-карбоновой кислоты;(3-хлор-5,6-дигидрокси-7 нитробензо[b]тиофен-2-ил)-(4-гидроксипиперидин-1-ил)метанон. 17. Применение соединения по пп.1-16 или его фармацевтически приемлемой соли либо эфира в качестве лекарственного средства. 18. Применение соединения по любому из пп.1-16 или его фармацевтически приемлемой соли либо эфира для производства лекарственного средства для лечения заболевания или состояния, при котором показан агент, ингибирующий СОМТ. 19. Применение по п.18, при котором заболеванием является болезнь Паркинсона. 20. Способ лечения заболевания или состояния, при котором показан агент, ингибирующий СОМТ,который включает введение млекопитающему, нуждающемуся в таком лечении, эффективного количества по меньшей мере одного соединения по любому из пп.1-16. 21. Способ по п.20, отличающийся тем, что заболеванием является болезнь Паркинсона. 22. Способ по п.21, в котором усиливается терапевтическое действие леводопы. 23. Фармацевтическая композиция, включающая в качестве активного ингредиента по меньшей мере одно соединение по любому из пп.1-16 или его фармацевтически приемлемую соль либо эфир и фар- 24017329 мацевтически приемлемый носитель, разбавитель и/или наполнитель. 24. Фармацевтическая композиция по п.23, отличающаяся тем, что композиция включает по меньшей мере один другой активный ингредиент. 25. Фармацевтическая композиция по п.23 или 24, отличающаяся тем, что композиция включает леводопу 2S)-2-амино-3-(3,4-дигидроксифенил)пропановую кислоту) и карбидопу 2S)-3-(3,4 дигидроксифенил)-2-гидразинилметилпропановую кислоту).
МПК / Метки
МПК: C07D 333/62, C07D 277/02, A61K 31/343, A61K 31/381, A61K 31/428, A61P 25/16, C07D 307/82
Метки: соединения, новые, фармацевтические
Код ссылки
<a href="https://eas.patents.su/26-17329-novye-farmacevticheskie-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые фармацевтические соединения</a>
Предыдущий патент: Устройство для грозозащиты с пружинными электродами и линия электропередачи, снабженная таким устройством
Следующий патент: Устройство и способ контроля над суспензиями для обратной закачки отходов
Случайный патент: Устройство для каротажа скважин












