Модифицированная реакция пикте-шпенглера и полученные с ее использованием продукты
Номер патента: 8666
Опубликовано: 29.06.2007
Авторы: Челиус Эрик Кристофер, Мартинелли Майкл Джон, Полак Джозеф Мэттью, Доук Кристофер Уильям, Орм Марк У.
Формула / Реферат
Способ получения соединения, имеющего структурную формулу
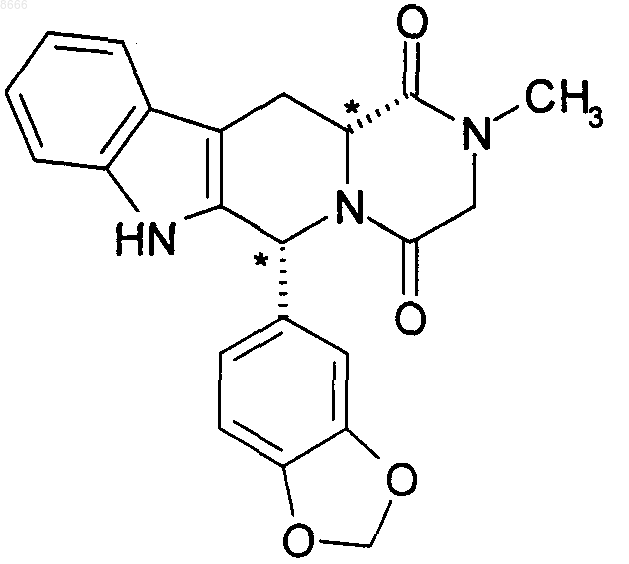
содержащий стадии:
(a) этерификации D-триптофана в метаноле и тионилхлориде с получением гидрохлорида метилового эфира D-триптофана;
(b) реакции гидрохлорида метилового эфира D-триптофана с пипероналем в кипящем с обратным холодильником изопропиловом спирте с образованием метилового эфира цис-1-(1,3-бензодиоксол-5-ил)-2,3,4,9-тетрагидро-1Н-пиридо[3,4-b]индол-3-карбоновой кислоты;
(c) реакции продукта стадии (b) с хлорацетилхлоридом и триэтиламином с образованием метилового эфира цис-1-(1,3-бензодиоксо-5-ил)-2,3,4,9-тетрагидро-1Н-пиридо[3,4-b]индол-3-карбоновой кислоты и
(d) реакции продукта стадии (с) с метиламином с получением указанного выше соединения.
Текст
008666 Настоящее изобретение относится к модифицированной реакции Пикте-Шпенглера для введения второго стереогенного центра в соединение. Более конкретно, настоящее изобретение относится к модифицированной реакции Пикте-Шпенглера, которая обеспечивает получение требуемого цис- или трансдиастереомера полициклического соединения, имеющего два стереогенных центра, с высоким выходом и высокой чистотой. Уровень техники Соединения, которые проявляют биологическую активность, обычно содержат по меньшей мере один асимметричный атом углерода, т.е. по меньшей мере один хиральный центр. Отдельный стереоизомер такого соединения обычно проявляет превосходную биологическую активность, тогда как другие стереоизомеры не проявляют или проявляют слабую биологическую активность. В соответствии с этим авторы изобретения прилагали усилия для синтеза биологически активного стереоизомера при минимизации или исключении синтеза неактивного или менее активного стереоизомера. Стереохимическая чистота является важной в фармацевтической области, где многие из наиболее часто прописываемых лекарственных средств проявляют хиральность. Например, известно, что Lэнантиомер -адренергического блокирующего агента, пропранолола, является в 100 раз более сильнодействующим, чем его D-энантиомер. Кроме того, оптическая чистота является важной в фармацевтической области, поскольку некоторые стереоизомеры обладают вредным воздействием, а не благоприятным или инертным воздействием. Например, считается, что D-энантиомер талидомида является безопасным и эффективным седативным средством, когда его прописывают для устранения утренней тошноты во время беременности, тогда как считается, что его соответствующий L-энантиомер является сильнодействующим тератогенным фактором. Следовательно, стереоселективный синтез делает возможным получение более полезного лекарственного продукта. Например, вводимая доза лекарственного средства может быть снижена, поскольку индивидууму вводят только активный стереоизомер в противоположность смеси, которая содержит большое количество неактивного стереоизомера. Эта пониженная доза активного стереоизомера снижает также отрицательные побочные действия по сравнению с дозой, содержащей смесь стереоизомеров. Кроме того, стереоселективный синтез является более экономичным, так как стадия отделения требуемого стереоизомера от нежелательного стереоизомера упрощается или исключается, и потери и стоимость исходного материала снижаются, поскольку реагенты не расходуются в синтезе нежелательных стереоизомеров. Многие биологически активные соединения содержат два асимметричных атома углерода, т.е. два стереогенных центра, в которых каждый асимметричный атом углерода является членом циклической системы и каждый связан с атомом азота и заместителем, отличающимся от атома водорода. Следовательно, неводородные заместители асимметричных атомов углерода могут иметь цис- или трансконфигурацию. Особенно трудной проблемой, встречающейся в синтезе таких биологически активных соединений, является высокий выход и высокая чистота получаемого определенного стереоизомера, т.е. требуемого диастереомера, в котором неводородные заместители асимметричных атомов углерода имеют цис-конфигурацию или транс-конфигурацию, в зависимости от того, какой диастереомер является более биологически активным. Для таких соединений необходимо разработать синтетический путь, который обеспечивает образование такого стереогенного центра правильной стереохимии и, таким образом, получить требуемый диастереомер. Такой синтетический путь может обеспечить также высокий выход требуемого диастереомера при таком небольшом числе стадий, как возможно, с минимумом очистки и выделения диастереомера. Например, в патенте США 5859006, включенном здесь в качестве ссылки, описан синтез Соединение (I) имеет два асимметричных атома углерода, каждый из которых отмечен звездочкой,где неводородные заместители асимметричных атомов углерода имеют цис-конфигурацию. Соединение(I) может быть получено двумя синтетическими путями, описанными в патенте США 5859006. Соединение (I) является сильнодействующим и селективным ингибитором фермента фосфодиэстеразы PDE5 и имеет различные терапевтические использования, например, при лечении мужской эректильной дис-1 008666 функции. Первый синтетический путь (А), из D-триптофана имеет немного стадий, но выход требуемого диастереомера (т.е. соединения II), является низким и требует применения стадии отделения от трансстереоизомера (соединения IIа). В пути (А) используют также очень коррозионную трифторуксусную кислоту (т.е. TFA или CF3CO2H). Ключевой стадией в пути А является классическая реакция ПиктеШпенглера с использованием метилового эфира D-триптофана и пипероналя для получения замещенных тетрагидрокарболиновых соединений (II) и (IIа). Второй путь (В) обеспечивает лучший выход требуемого соединения I, но для проведения его требуются многочисленные синтетические стадии. В каждом синтетическом пути ключевым промежуточным соединением в синтезе соединения (I) является соединение (II). Соединение (I) затем синтезируют из соединения (II) в две прямые синтетические стадии. Общий выход соединения (I) с использованием синтетического пути (А) или (В) составляет приблизительно от 25% до приблизительно 30%. Путь (В) требует проведения нескольких синтетических стадий и поэтому считается неподходящим. Ключевой стадией в синтезе соединения (I) является получение соединения (II) более коротким синтетическим путем (А). При получении соединения (II) в пути (А) используют циклизацию ПиктеШпенглера между метиловым эфиром D-триптофана и пипероналем в дихлорметане (СН 2 Сl2) под действием двух эквивалентов трифторуксусной кислоты при 4 С, которая дает через пять дней смесь двух диастереоизомеров, т.е. желательного цис-изомера тетрагидрокарболинового соединения (II) 1R,3R и нежелательного транс-изомера тетрагидрокарболинового соединения (IIа) 1S,3R в отношении приблизительно 60/40. Из этой смеси чистый цис-изомер (т.е. соединение (II может быть получено фракционной кристаллизацией с выходом 42% (ее 99%) (хиральная ВЭЖХ. Реакция Пикте-Шпенглера является прямым способом образования циклической системы тетрагидрокарболина, которая присутствует в соединении (I). В общем, в реакции Пикте-Шпенглера используют эфир триптофана и альдегид, получая при этом смесь цис-1,3- и транс-1,3-тетрагидро 3 008666 карболинов, приведенных ниже. R2 обычно представляет собой C1-4-алкил и R1 может быть алифатическим или ароматическим радикалом, см., например, патенты США 5859006 и 5981527, каждый из которых включен здесь в качестве ссылки. цис-1,3-Тетрагидро-бета-карболин транс-1,3-Тетрагидро-бета-карболин. Важным успехом в данной области могла бы быть разработка модифицированной реакции циклизации Пикте-Шпенглера, которая существенно повышает диастереоселективность реакции. В частности,успехом в данной области мог бы быть улучшенный путь А, в котором используют реакцию ПиктеШпенглера между коммерчески доступным метиловым эфиром D-триптофана и пипероналем или другим алифатическим или ароматическим альдегидом в прямом способе получения энантиомерно чистого соединения (II) или подобного тетрагидрокарболина и который преодолевает недостатки классической реакции Пикте-Шпенглера, такие как использование TFA, продолжительное время реакции и трудные разделения продукта. Сущность изобретения Настоящее изобретение относится к способу получения требуемого диастереомера, т.е. цис- или транс-диастереомера, полициклического соединения, имеющего два асимметричных атома углерода кольца. Более конкретно, настоящее изобретение относится к способу получения требуемого диастереомера тетрагидрокарболинового соединения, имеющего два асимметричных атома углерода, с использованием модифицированной реакции Пикте-Шпенглера. До этого исследователи пытались получить требуемый диастереомер полициклической системы,содержащей два асимметричных атома углерода в кольце, посредством выполнения реакции циклизации Пикте-Шпенглера. Эти попытки обычно терпели неудачу, так как реакцию проводили в коррозионной среде, что приводило к получению смесей диастереомеров. которые оказывали неблагоприятное влияние на выход реакции, и для проведения реакции требовалось несколько дней. Настоящий способ обеспечивает получение требуемого диастереомера с хорошим выходом за короткое время реакции и позволяет избежать использование TFA. Более конкретно, настоящее изобретение относится к способу получения требуемого диастереомера тетрагидрокарболинового соединения, имеющего два асимметричных атома углерода, с использованием модифицированной реакции Пикте-Шпенглера, в котором реакцию проводят с использованием растворителя, в котором растворим только один из диастереомеров. В предпочтительных вариантах осуществления желательный диастереомер является нерастворимым в растворителе и нежелательный диастереомер является растворимым. Другим аспектом настоящего изобретения является повышение выхода желательного диастереомера посредством приведения в равновесие нежелательного диастереомера в растворе, чтобы обеспечить образование дополнительного количества желательного диастереомера, который осаждается из раствора,и тем самым повысить выход желательного диастереомера при расходе нежелательного диастереомера. Эти и другие аспекты и новые признаки настоящего изобретения станут очевидными из нижеследующего подробного описания предпочтительных вариантов осуществления. Подробное описание приедпочтительных вариантов осуществления Настоящее изобретение относится к способу получения желательного диастереомера полициклического соединения, имеющего два асимметричных атома углерода в качестве членов циклической системы. В способе используют усовершенствованную реакцию Пикте-Шпенглера, которая обеспечивает получение желательного диастереомера тетрагидрокарболина с высоким выходом, высокой чистотой и за короткое время процесса. Усовершенствованная реакция Пикте-Шпенглера позволяет избежать использования TFA в реакции. Хотя здесь подробно обсуждается синтез соединений (I) и (II), настоящий способ не ограничивается этими соединениями. Настоящий способ можно также использовать для синтеза желательного диастереомера других тетрагидрокарболинов разумным выбором исходного эфира триптофана, например, Dили L-формы, исходного альдегида и растворителей, используемых в настоящей модифицированной реакции циклизации Пикте-Шпенглера. Реакция Пикте-Шпенглера обычно протекает через образование имина в нейтральных условиях, затем осуществление циклизации с использованием трифторуксусной кислоты (TFA) в дихлорметане(СН 2 Сl2) при низкой температуре (4 С). Кроме использования имина в качестве исходного соединения для получения цис-диастереомера часто используют N-замещение аминогруппь(-NH2) триптофана. В реакции Пикте-Шпенглера, описанной в патенте США 5859006, используют такие условия. Как описано выше, стандартная реакция Пикте-Шпенглера имеет в качестве недостатков продолжительное время цикла, низкий выход желательного цис-диастереомера и использование коррозионной TFA. Настоящее изобретение преодолевает проблемы, связанные с классической реакцией ПиктеШпенглера, например, позволяет повысить выход и чистоту желательного диастереомера и использовать более простой синтетический путь. В частности, настоящее изобретение относится к упрощенной реакции Пикте-Шпенглера для образования второго стереогенного центра в кольце, в которой желательный цис- или транс-диастереомер может быть получен с высоким выходом и чистотой проведением реакции в растворителе, в котором желательный диастереомер является нерастворимым, а нежелательный диастереомер является растворимым. В модифицированной реакции Пикте-Шпенглера настоящего изобретения используется также N-незамещенный исходный материал, например, триптофан, в виде гидрохлоридной соли, и исключается использование TFA. Исключение TFA из реакции имеет значительные преимущества, включающие в себя улучшенное выделение/идентификацию гидрохлорида метилового эфира триптофана и отсутствие коррозионных свойств, вызываемых TFA. Выбор подходящего растворителя для использования в настоящей модифицированной реакции Пикте-Шпенглера находится вполне в пределах квалификации специалистов в данной области. Например, было обнаружено, что при получении соединения (II) реакцией циклизации Пикте-Шпенглера изопропиловый спирт растворяет нежелательный транс-диастереомер, тогда как желательный цисдиастереомер осаждается из реакционной смеси. Кроме того, растворенный транс-диастереомер находится в динамическом равновесии с желательным цис-диастереомером. В соответствии с этим, когда в растворе образуется и сразу осаждается цис-диастереомер соединения (II), его концентрация снижается относительно оставшегося транс-диастереомера соединения (IIа), тем самым обеспечивая дифференциал концентрации, который ускоряет наступление равновесия, в результате чего обеспечивается образование дополнительного количества цис-диастереомера. Это непрерывное смещение равновесия реакции повышает как выход, так и чистоту нужного цис-диастереомера. В частности, в настоящем изобретении используют модифицированную реакцию циклизации Пикте-Шпенглера для образования циклической системы тетрагидрокарболина, имеющей два стереогенных центра. Реакцию проводят в растворителе, в котором нужный диастереомер является растворимым при температуре флегмы или более низкой температуре и ненужный диастереомер является нерастворимым при температуре флегмы или более низкой температуре. Это различие в растворимости позволяет быстро и легко отделить нужный диастереомер от ненужного диастереомера. Кроме того, динамическое равновесие цис-транс-изомеров в растворе позволяет проводить более полное превращение исходных материалов в нужный диастереомер и более полное отделение нужного диастереомера от ненужного диастереомера. В соответствии с этим, другим преимуществом настоящего изобретения является снижение в стоимости за счет более эффективного использования реагентов. Как указано выше, выбор растворителя реакции, имеющего требуемые свойства растворимости, находится в пределах компетенции специалиста в данной области. Выбор требует только определения растворимости каждого диастереомера в конкретном растворителе и выбор растворителя, который удовлетворяет указанным выше параметрам растворимости/нерастворимости для двух диастереомеров. Ниже представлен неограничивающий пример настоящего изобретения, иллюстрирующий синтез соединения (II) модифицированной реакцией Пикте-Шпенглера (стадия 2) и последующий синтез соединения (I) из соединения (II) (стадии 3 и 4). В общем, синтез соединения (I) с использованием способа настоящего изобретения включает в себя четырехстадийный синтетический путь. Первой стадией является этерификация в метаноле (МеОН) с использованием тионилхлорида (SO2Cl) при кипячении с обратным холодильником. Продукт кристаллизуют и выделяют фильтрованием. Вторая стадия включает в себя настоящий новый и упрощенный вариант реакции Пикте-Шпенглера, в котором гидрохлорид метилового эфира D-триптофана смешивают с пипероналем в изопропиловом спирте (i-PrOH) и нагревают при кипячении с обратным холодильником с образованием смеси диастереомерных аддуктов. Поскольку нужный цис-диастереомер (соединение (II является по существу нерастворимым в изопропиловом спирте при температуре флегмы и при более низкой температуре, цис-диастереомер кристаллизуется из раствора, оставляя в растворе динамическое цис-транс-равновесие. Когда цис-диастереомер осаждается из изопропилового спирта, равновесие смещается в сторону цис-диастереомера до тех пор, пока концентрация цис-диастереомера не станет достаточно низкой, чтобы этот изомер оставался в растворе. Нужный диастереомер выделяют с выходом выше, чем 90%, кристаллизацией и фильтрованием. Третья стадия включает в себя ацилирование в водном тетрагидрофуране (ТГФ) аминогруппы(NH2) соединения (II) с последующей кристаллизацией и фильтрованием. Замыкание кольца метиламином (MeNH2) завершает образующую кольцо последовательность. После замены растворителя продукт кристаллизуют из водного изопропилового спирта или другого подходящего растворителя, и фильтрование дает соединение (I) с общим выходом приблизительно 77%. В общем, настоящая модифицированная реакция Пикте-Шпенглера может быть использована для получения нужного диастереомера соединений на основе тетрагидрокарболина без ограничения. Например, настоящая модифицированная реакция Пикте-Шпенглера может быть использована для синтеза нужного диастереомера классов соединений, описанных в патентах США 5859006; 5981527; 6001847, в WO 02/28859, WO 02/28865, WO 02/10166, WO 02/36593, WO 01/94345, WO 02/00658, WO 02/00657, WO 02/38563, WO 01/94347, WO 02/94345, WO 02/00656, PCT/US 01/49393, PCT/US 02/13719,PCT/US 02/00017, PCT/US 02/10367, PCT/US 02/13703, PCT/US 02/11791 и PCT/US 02/13897, каждый из которых включен здесь в качестве ссылки, и других замещенных тетрагидрокарболинов. Кроме получения тетрагидрокарболиндикетопиперазинов, подобных соединению (I), настоящий способ может быть использован для получения тетрагидрокарболингидантоинов (III) нужной стереохимии реакцией соединения, такого как соединение (II), с изоцианатом, имеющим формулу R4NCO, гдеR4 представляет собой алифатическую или ароматическую группу. См. патент США 6001847, включенный здесь в качестве ссылки. Ниже описано подробное примерное получение соединения (I) с использованием способа настоящего изобретения.D-Триптофан (50,0 кг, 245 моль) суспендируют в МеОН (270 л), затем добавляют к полученному раствору SOCl2 (67,0 кг, 563 моль) в МеОН (250 л) при температуре окружающей среды в атмосфере азота (N2). Образовавшийся раствор перемешивают при кипячения с обратным холодильником в течение 1-2 ч, затем из реакционной смеси отгоняют МеОН приблизительно до 50% первоначального объема. Добавляют метил-трет-бутиловый простой эфир (МТВЕ) (350 л) и раствор охлаждают до 0-5 С при непрерывном перемешивании в течение 1 ч. Продукт фильтруют, промывают холодным МТВЕ (150 л) и сушат в вакууме при 60 С, получая при этом 57,6 кг (92,4%) гидрохлорида метилового эфира триптофана. 1 Н ЯМР (400 МГц, ДМСО) : 11,15 (1 Н, с), 8,70 (2 Н, обм.), 7,50 (1 Н, д, J = 8,2 Гц), 7,35 (1 Н, д, J = 8,2 Гц), 7,24 (1 Н, с), 7,08-7,05 (1 Н, м), 7,00-6,97 (1 Н, м), 4,18-4,16 (1 Н, м), 3,61 (3 Н, с), 3,36-3,25 (2 Н, м). Детали ВЭЖХ: колонка: SB-Phenyl 4,6 х 250 мм; элюент: изократная смесь 80% (Н 2O + 0,1% TFA)/20% Гидрохлорид метилового эфира D-триптофана (50,0 кг, 196 моль) суспендируют в изопропиловом эфире (500 л) и обрабатывают пипероналем (32,4 кг, 216 моль) при температуре окружающей среды в атмосфере N2 Смесь перемешивают при температуре между 70 С и температурой флегмы (82 С) в тече-7 008666 ние 16-18 ч. В это время реакционная смесь содержит меньше, чем 3% соединения IIа. Реакционную смесь затем охлаждают до 0 С, фильтруют и промывают холодным изопропиловым спиртом (150 мл). Продукт сушат в вакууме при температуре, ниже, чем 60 С, получая при этом 69,8 кг (92%) метилового эфира цис-1-(1,3-бензодиоксол-5-ил)-2,3,4,9-тетрагидро-1 Н-пиридо[3,4-b]индол-3-карбоновой кислотыTFA) температура: 40 С; скорость потока: 1 мл/мин; УФ-детектирование при 285 нм; объем впрыскивания: 20 мкл; разбавитель: 1:1, ACN/H2O; концентрация образца: приблизительно 0,1 мг/мл; время удерживания: 6,0 мин. В предпочтительном способе получения соединения (II) настоящим методом к реакционной смеси перед нагреванием добавляют небольшое затравочное количество соединения (II), т.е. приблизительно от 0,05 до приблизительно 1%, предпочтительно, приблизительно от 0,05 до приблизительно 0,25%, в расчете на массу гидрохлорида метилового эфира D-триптофана. Это затравочное количество индуцирует кристаллизацию цис-карболинового соединения (II) в реакционной смеси. Когда изопропиловый спирт используют в качестве растворителя, предпочтительно, чтобы спирт был безводным, например, содержал 0,1 мас.% воды или меньше, так как заметные количества воды могут отрицательно влиять на скорость реакции. Особенно предпочтительно, чтобы изопропиловый спирт по существу не содержал ацетон, т.е. содержал 0,3 мас.% или меньше ацетона, чтобы избежать образовании нежелательного побочного продукта. Использование более высококипящего растворителя (например, н-пропанола, толуола, диметилформамида, ацетонитрила или уксусной кислоты) приводит к более быстрым временам реакции со сравнимым выходом и чистотой продукта. Другие растворители, применимые при получении соединения (II) с использованием реакции Пикте-Шпенглера (стадия 2) настоящего изобретения включают в себя, но не ограничиваются перечисленным, ароматические растворители (например, толуол, бензол или ксилол), нитрил (например, ацетонитрил или пропионитрил), сложный эфир (например, этилацетат), спирт (например, пропанол или бутанол),простой эфир (например, ТГФ, МТВЕ или диоксан), алифатический углеводород (например, гексан, гептан, органическую кислоту (например, уксусную кислоту), их смеси и их водные растворы.(335 л) и ионизированной воде (84 л) и обрабатывают триэтиламином (Et3N) (57,0 кг, 560 моль) при 020 С в атмосфере N2. Затем добавляют хлорацетилхлорид (ClCH2C(O)Cl) (34,2 кг, 300 моль) в сухом ТГФ(0,6 объемов) при скорости, подходящей для поддержания температуры при 0 С-10 С с последующим перемешиванием реакционной смеси в течение двух часов. Мониторинг реакции для поддержания содержания соединения (II) 4 мас.% или меньше проводят ВЭЖХ. После завершения реакции ацилирования реакционную смесь подвергают дистилляции в вакууме при температуре от -30 до 50 С, чтобы уменьшить объем смеси приблизительно на 30%. Затем добавляют воду (84 л) и изопропиловый спирт(335 л) и реакционную смесь перегоняют во второй раз при пониженном давлении при 30-50 С для уда-8 008666 ления приблизительно 20% объема смеси. Реакционную смесь затем охлаждают до 20-25 С и перемешивают в течение двух часов. Продукт реакции кристаллизуют и фильтруют и промывают изопропиловым спиртом. Продукт реакции сушат в вакууме при 80 С, получая при этом 86,7 кг (95%) хлорацетилкарболина, метилового эфира цис-1-(1,3-бензодиоксол-5-ил)-2,3,4,9-тетрагидро-1 Н-пиридо[3,4-b]индол-3 карбоновой кислоты. 1 Н ЯМР (400 МГц, ДМСО) : 10,86 (1 Н, с), 7,54 (1 Н, д, J = 7,4), 7,27 (1 Н, д, J = 8,0),7,11-6,99 (2 Н, м), 6,81-6,75 (2 Н, м), 6,63 (1 Н, с), 6,45 (1 Н, д, J = 8,2), 5,97 (2 Н, д, J = 5,8), 5,19 (1 Н, д, J = 6,6), 4,83 (1 Н, д, J = 14), 4,43 (1 Н, д, J = 14), 3,45 (1 Н, д, J = 16), 3,10-3,03 (4 Н, м). Альтернативные растворители для стадии 3 включают в себя спирты с низкой молекулярной массой, такие как изопропиловый спирт или н-пропиловый спирт; ацетон и метиленхлорид. К ТГФ (430 л) добавляют хлорацетилкарболин (86,0 кг, 201 моль) и образовавшуюся смесь нагревают до 30-55 С в атмосфере N2 и перемешивают. Образовавшийся раствор затем фильтруют при температуре 45-50 С для удаления нерастворенных частиц. Затем к раствору добавляют метиламин (78,2 кг,1000 моль) при температуре 5-25 С. Реакционную смесь перемешивают при температуре 30-55 С в течение приблизительно 1 ч или до тех пор, пока анализ ВЭЖХ не покажет завершения реакции, т.е. когда останется меньше, чем 1% хлорацетилкарболина. Смесь охлаждают до 0-30 С, затем добавляют изопропиловый спирт (344 л) и воду (175 л) с последующим добавлением 12 М хлористо-водородной кислоты(67 л) для нейтрализации избыточного метиламина, т.е. до рН 2-9,4. После по существу полного удаления ТГФ дистилляцией раствор обрабатывают изопропиловым спиртом (260 л) и водой (75 л) и охлаждают до температуры от -5 до 30 С с последующим перемешиванием в течение двух часов для кристаллизации продукта. Продукт фильтруют и промывают холодным (0-5 С) 50% водным изопропиловым спиртом. Растворитель после промывания отфильтровывают при температуре от -5 до 30 С и продукт сушат в вакууме при 80 С или при более низкой температуре (например, 70-80 С), получая при этом 75 кг (94,6%) соединения (I). Для достижения повышенной чистоты соединение (I) необязательно может быть перекристаллизовано из уксусной кислоты. Ссылочный стандарт получают таким же способом с дополнительной очисткой двойной перекристаллизацией из ледяной уксусной кислоты (НОАс). Соединение (I) растворяют в 13 объемах НОАс при 80 С и раствор концентрируют до одной трети исходного объема и затем охлаждают до температуры окружающей среды. Продукт фильтруют, промывают МТВЕ и сушат в вакууме при 80 С. 1 Н ЯМР (400 МГц, ДМСО) : 11,0 (1 Н, с), 7,52 (1 Н, д, J = 7,3 Гц), 7,28 (1 Н, д, 7,9 Гц), 7,28 (1 Н, д, J = 7,9 Гц), 7,06-6,98 (2 Н, м), 6,85 (1 Н, с), 6,76 (2 Н, с), 6,11 (1 Н. с), 5,91 (2 Н, с), 4,40-4,35 (1 Н, дд, J = 4,27,11,6 Гц), 4,17 (1 Н, д, J = 17.1 Гц), 3,93 (1 Н, д, J = 17,1), 3,54-3,47 (1 Н, дд, J = 4,6, 11,3 Гц), 3,32 (1 Н, с),3,00-2,91 (4 Н, м). Детали ВЭЖХ: колонка: Zorbax SB-Phenyl, 4,6 мм (внутр. диаметр) х 25 мм; частицы: 2,5 мкм; подвижная фаза: ацетонитрил, 0,1% TFA в воде; скорость потока = 1,0 мл/мин; детектирование-9 008666 при длине волны 285 нм; объем впрыскивания = 20 мкл, температура колонки = температуре окружающей среды и время удерживания: 9,0 мин. Очевидно, что могут быть сделаны многие модификации и варианты изобретения, излагаемого выше, не выходящие за пределы существа и объема его, и, следовательно, только такие ограничения могут быть наложены, какие указаны прилагаемой формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ Способ получения соединения, имеющего структурную формулу(a) этерификации D-триптофана в метаноле и тионилхлориде с получением гидрохлорида метилового эфира D-триптофана;(b) реакции гидрохлорида метилового эфира D-триптофана с пипероналем в кипящем с обратным холодильником изопропиловом спирте с образованием метилового эфира цис-1-(1,3-бензодиоксол-5-ил)2,3,4,9-тетрагидро-1 Н-пиридо[3,4-b]индол-3-карбоновой кислоты;(c) реакции продукта стадии (b) с хлорацетилхлоридом и триэтиламином с образованием метилового эфира цис-1-(1,3-бензодиоксо-5-ил)-2,3,4,9-тетрагидро-1 Н-пиридо[3,4-b]индол-3-карбоновой кислоты и(d) реакции продукта стадии (с) с метиламином с получением указанного выше соединения.
МПК / Метки
МПК: C07D 471/14, C07D 471/04
Метки: использованием, модифицированная, реакция, пикте-шпенглера, продукты, полученные
Код ссылки
<a href="https://eas.patents.su/11-8666-modificirovannaya-reakciya-pikte-shpenglera-i-poluchennye-s-ee-ispolzovaniem-produkty.html" rel="bookmark" title="База патентов Евразийского Союза">Модифицированная реакция пикте-шпенглера и полученные с ее использованием продукты</a>
Предыдущий патент: Лекарственные средства для лечения хронического обструктивного заболевания лёгких
Следующий патент: Применение цитокина, способного связывать il-18bp и ингибировать активность второго цитокина
Случайный патент: Новые низкомолекулярные ингибиторы mdm2 и их применение












