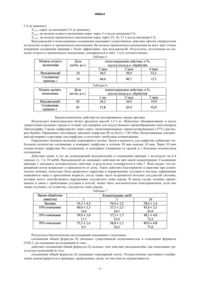
Новые сольваты n-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил) бензолсульфонамида
Номер патента: 8664
Опубликовано: 29.06.2007
Авторы: Зайерне Балаж Мария, Эрдейи Петер, Фодор Тамаш, Фишер Янош, Левай Шандор, Гере Анико, Карпати Эгон, Киш-Варга Иштванне
Формула / Реферат
1. Сольваты N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида формулы (I)
где [solvate] (присоединенный растворитель) представляет воду, (С1-С4)спирт, (C1-С4)алкилэфир (С1-С3) карбоновой кислоты или диоксан.
2. Соединения формулы (I) по п.1, где [solvate] представляет воду.
3. Соединения формулы (I) по п.1, где [solvate] представляет этилацетат.
4. Соединения формулы (I) по п.1, где [solvate] представляет 2-пропанол.
5. Соединения формулы (I) по п.1, где [solvate] представляет диоксан.
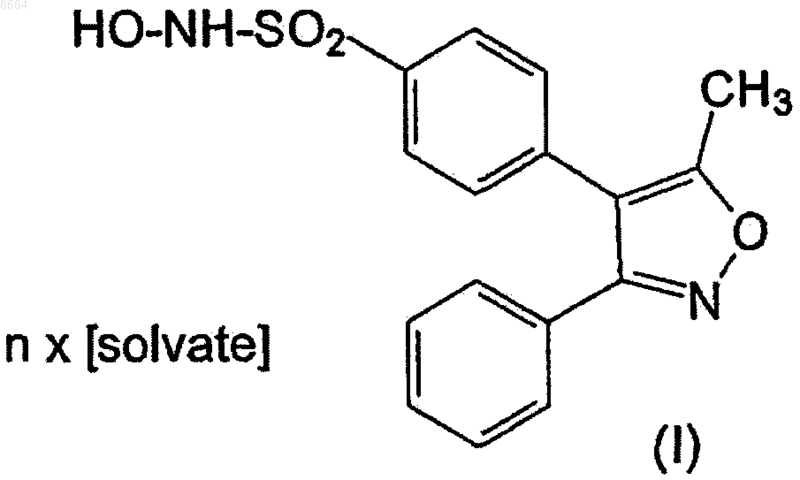
6. Способ получения сольватов N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида формулы (I), где [solvate] представляет (С1-С4)алкилэфир (C1-С3)карбоновой кислоты или диоксан, отличающийся тем, что 3,4-дифенил-5-метилизоксазол формулы (III)
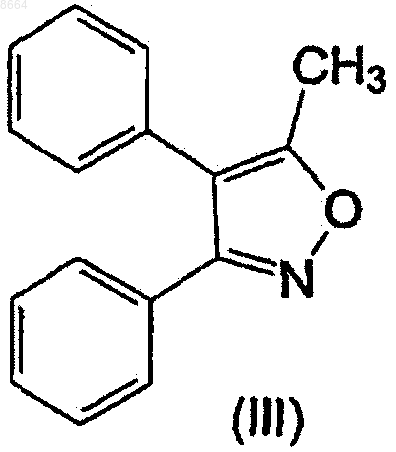
вводят во взаимодействие с хлорсульфоновой кислотой, и продукт реакции 3-фенил-4-(4-хлорсульфонилфенил)-5-метилизоксазол (II)
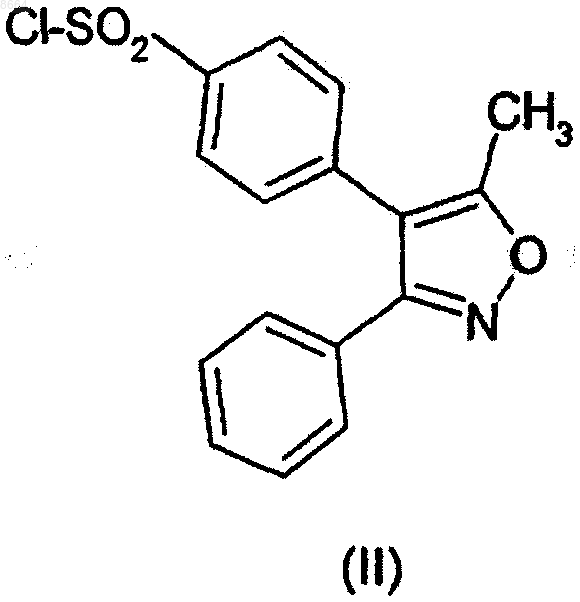
вводят во взаимодействие с гидроксиламином
a) в смеси воды и растворителя, смешивающегося с водой,
b) в смеси растворителя, не смешивающегося с водой, и воды в присутствии межфазного катализатора,
и продукт реакции кристаллизуют из растворителя, выбранного из числа (С1-С4)алкилэфира (С1-С3) карбоновой кислоты или диоксана.
7. Способ по п.6, отличающийся тем, что межфазный катализатор представляет собой гидросульфат тетрабутиламмония.
8. Способ по п.6, отличающийся тем, что перекристаллизацию осуществляют из этилацетата.
9. Способ получения сольватов N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида формулы (I), где [solvate] представляет воду, отличающийся тем, что 3,4-дифенил-5-метилизоксазол формулы (III)
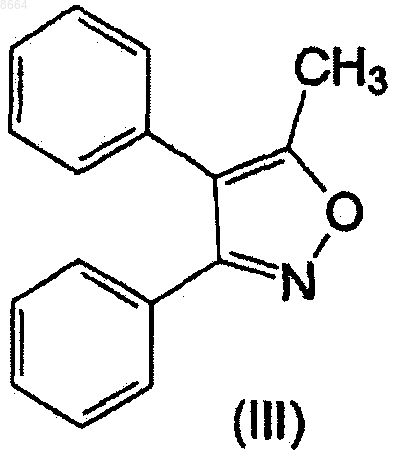
вводят во взаимодействие с хлорсульфоновой кислотой, и продукт реакции 3-фенил-4-(4-хлорсульфонилфенил)-5-метилизоксазол (II)

вводят во взаимодействие с гидроксиламином
a) в смеси воды и растворителя, смешивающегося с водой,
b) в смеси растворителя, не смешивающегося с водой, и воды в присутствии межфазного катализатора,
и продукт реакции кристаллизуют из смеси воды и этанола, необязательно, содержащей аскорбиновую кислоту.
10. Применение соединений формулы (I) по любому из пп.1-5 для получения фармацевтической композиции для лечения остеоартрита и ревматоидного артрита и болей при операции и первичной дисменореи.
11. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-5 и один или несколько терапевтически приемлемых фармацевтических носителей.
12. Фармацевтическая композиция по п.11, отличающаяся тем, что одним из носителей является аскорбиновая кислота.
13. Способ лечения остеоартрита и ревматоидного артрита и болей при операции и первичной дисменореи, включающий лечение нуждающегося в этом пациента терапевтически эффективной дозой соединения формулы (I) по любому из пп.1-5.
14. Способ лечения остеоартрита и ревматоидного артрита и болей при операции и первичной дисменореи, включающий лечение нуждающегося в этом пациента терапевтически эффективной дозой фармацевтической композиции по любому из пп.11-12.
Текст
008664 Настоящее изобретение относится к новым сольватам N-гидрокси-4-(3-фенил-5-метилизоксазол-4 ил)бензолсульфонамида формулы (I) где n равен 0 или 1 моль, [solvate] (присоединенный растворитель) представляет воду, (С 1-С 4)спирт, (С 1 С 4)алкилэфир (С 1-С 3)карбоновой кислоты или диоксан, и смеси сольватированных (где n=1) и несольватированных форм (где n=0). Кроме того, настоящее изобретение относится к способу их получения и их применению для лечения остеоартрита и ревматоидного артрита и болей при операции и первичной дисменореи, основанном на противовоспалительном и аналгезирующем фармакологическом действии, выявленном в экспериментах на моделях. Уровень техники Известно, что профили побочного действия селективных ингибиторов циклооксигеназы-2 значительно благоприятнее профилей нестероидных противовоспалительных лекарственных средств. Это относится, прежде всего, к их активности в желудочно-кишечном тракте. В настоящее время известны два поколения селективных ингибиторов циклооксигеназы-2. Одним из первых ингибиторов циклооксигеназы-2 на рынке стал целекоксиб. Целекоксиб обладает высокой селективностью и существенно снижает побочное действие на желудочно-кишечный тракт, но не устраняет его полностью. Вальдекоксиб, представитель второго поколения ингибиторов фермента СОХ-2, появился в 2002 году для лечения остеоартрита, ревматоидного артрита и болей при первичной дисменореи. Из литературы известно, что побочное действие на желудочно-кишечный тракт также отмечается при введении вальдекоксиба. Следует принять во внимание, что селективные ингибиторы циклооксигеназы-2 также оказывают побочное действие на сердечно-сосудистую систему. Указанные факты отмечены при исследовании другого ингибитора СОХ-2 первого поколения рофекоксиба. (Vigor-study, Bombardier С, Laine L., Reicin A. et al., for the VIGOR Study Group. Comparison ofupper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. N. Engl. J. Med.,343(21): 1520-1528, Nov. 2000.) Возможные причины подробно обсуждались в исследовании D. Mukherjee (Mukherjee D., NissenS.E., Topol. E.J., Risk of cardiovascular events associated with selective COX-2 inhibitors. JAMA 2001; 286:954-959). Для того, чтобы решить вышеуказанные проблемы, исследовались более сильные селективные ингибиторы циклооксигеназы-2. Сущность изобретения Неожиданно авторы изобретения обнаружили, что сольваты N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида формулы (I) (где n=1) и несольватированные формы (где n=0) или их смеси имеют более благоприятный профиль действия, чем вальдекоксиб. В одной из статей (Josh J. Yuan, Dai-Chang Yang, Ji Y. Zjang, Roy Bible Jr., Aziz Karim s John W.A.Findlay: Drag Metabolism and Disposition, Vol.30(No.9), 1013-1021 (2002 сообщается, что несольватированный N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамид выводится из организма с мочой как метаболит вальдекоксиба. Соединение идентифицировано масс-спектроскопией как второстепенный метаболит вальдекоксиба, но о получении, биологических и химических свойствах соединения не сообщается. Соединения общей формулы (I) следует отнести к группе селективных ингибиторов циклооксигеназы-2, поскольку они обладают значительной селективностью в отношении фермента циклооксигеназы-2,как видно из табл.1. Соединения общей формулы (I) в смысле основного действия (противовоспалительного и аналгезирующего) показывают более выгодные свойства, чем вальдекоксиб, поскольку они дают значительно лучшие результаты при испытаниях in vivo, чем вальдекоксиб. Соединения общей формулы (I) в отношении побочного действия имеют более благоприятные профили, чем вальдекоксиб: они повышают скорость кровотока, что благоприятно в практике клинического лечения. Боли артритного характера и перерождение суставов и костные деформации появляются чаще в преклонном возрасте, когда также часто встречаются болезни сосудистой системы, которые могут способствовать нарушениям сосудистого ложа сердца. В таком случае лечение, применяемое в связи с проблемами суставов и костей, может быть исключительно благоприятным, если оно также улучшает, по существу, сосудистое ложе сердца.-1 008664 В процессе получения N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида обнаружено, что свойства сольватированных форм более благоприятные, чем свойства аморфных соединений, поскольку такие формы являются кристаллическими и с ними легко работать. Сольваты формулы(I) содержат 1 моль растворителя как соединения включения (n=1). Сольваты могут содержать один моль воды, один моль (С 1-С 4)-спирта, один моль (С 1-С 4)-алкилэфира карбоновой кислоты или один моль диоксана. Соединения-сольваты общей формулы (I), где n=1, могут утратить некоторое количество их растворителей в условиях получения или выделения. Несольватированная форма соединений общей формулы (I) может образоваться в вакууме при нагревании. Соотношение сольватированной и несольватированной форм можно регулировать, изменяя время нагревания. Исходным веществом для соединений общей формулы (I) является 3-фенил-4-(4-хлорсульфонилфенил)-5-метилизоксазол (II). Его получают из 3,4-дифенил-5-метилизоксазола (III) взаимодействием с хлорсульфоновой кислотой. Получить соединение формулы (III) можно согласно статье P. Bravo, G.Gaudiano, С. Ticozzi в Chim. Ital., 102, 395 (1972). Сульфирование осуществляют в инертном органическом растворителе, предпочтительно, в безводном дихлорметане, а именно, 3,4-дифенил-5-метилизоксазол вводят во взаимодействие с избытком хлорсульфоновой кислоты, предпочтительно, с пятикратным избытком, при нагревании, предпочтительно,при температуре кипения реакционной смеси. Соединение формулы (II) можно ввести в сочетание с гидроксисульфонамидами двумя различными способами. По способу а) хлорсульфонильное производное вводят во взаимодействие с гидроксиламином в смеси водорастворимого растворителя и воды. Время реакции составляет 15-45 мин, предпочтительно,30 мин. Температура реакции 15-25 С. Реакционную смесь добавляют к воде, продукт реакции отфильтровывают и промывают водой. Сырой продукт реакции кристаллизуют из смеси воды и этанола, и конечным продуктом является моногидрат (I, n: 1, сольват Н 2 О) с выходом 70%, чистота 99,8% (ВЭЖХ). По способу b) хлорсульфонильное производное вводят во взаимодействие с гидроксиламином в смеси растворителя, не растворяющегося в воде, предпочтительно, этилацетата, и воды в присутствии межфазного катализатора, предпочтительно, гидросульфата тетрабутиламмония. Реакцию осуществляют при комнатной температуре, время реакции 5-20 ч. Сырой продукт реакции, полученный после синтеза,является кристаллическим, и его перекристаллизовывают из смеси воды и спирта, предпочтительно, из смеси воды и этанола. Выход составляет 60%. Сольватом полученного продукта является продуктом присоединения воды. Получение несольватированного N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида осуществляют нагреванием сольватированных соединений общей формулы (I), предпочтительно,нагреванием моногидрата N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида. Время нагревания составляет 20-40 мин, предпочтительно 25 мин. Биологические испытания Исследования in vitro Определяют активность человеческой рекомбинантной СОХ-2 и овечьей СОХ-1 спектрометрическим анализом с TMPD (K. Glerse, D.D. Hauser, D.P. Creely, CM. Koboldt, S.H. Rangwala, P.C. Isakson andK. Seibert; Expression and selective inhibition of the constitutive and inducible forms of human cycllooxygenase, Biochem. J., 305:479-484 (1995. Принцип измерения Активность человеческой рекомбинантной СОХ-2 и овечьей СОХ-1 измеряют спектрофотометрическим анализом, основанным на окислении N,N,N',N'-тeтpaмeтил-п-фенилендиамина (TMPD). Во время восстановления простагландина G2 (PGG2) до эндопероксида простагландина (PGH2) TMDP окисляется до окрашенного продукта, который можно определить спектрофотометрически при 610 нм. Способ К 156 мкл реакционной смеси (100 мМ натрий-фосфатный буфер, рН 6,5, 1 мкм гематина, 1 мг/мл желатина) добавляют 4 мкл растворов ингибиторов различной концентрации. Затем добавляют 20 мкл раствора 50 единиц фермента человеческой рекомбинантной СОХ-2 или 20 мкл 50 единиц фермента овечьей СОХ-1 (Cayman Chemical, Ann Arbor, USA, кат. 60122 /СОХ-2/, кат. 60100 /СОХ-1/). Смесь для инкубации предварительно инкубируют в течение 15 мин при 25 С в спектрофотометре для прочтения 96-луночных планшетов (Labsystem iEMS Reader MF). После этого добавляют смесь 20 мкл 1 мМ раствора арахидоновой кислоты и 1 мМ раствора TMPD. Смесь встряхивают в течение 10 с, и измеряют поглощение при 610 нм. Результаты суммируются в табл. 1. Таблица 1-2 008664 Исследования in vivo 1. Анализ отека ступней лап у крысы, вызванного каррагинаном. Вызывают отек у самцов крысы Wistar (140-150 г) подкожной инъекцией каррагинана (50 мкл 1% суспензии) в правую заднюю лапу. Образовавшееся воспаление измеряют плетизмометром (Ugo Basile,тип 7150). Обработанную лапу помещают в плетизмометр (заполненный 0,5% физиологическим раствором с 0,3% добавок), и определяют уровень воспаления по объему вытесненного раствора. Полученный объем сравнивают с начальным объемом лапы перед инъекцией. Уровень воспаления (мл) = (объем после обработки СА (мл - (объем до обработки СА (мл. Воспаление, вызванное в обработанной группе, сравнивают с состоянием контрольной группы (получившей только носитель). Материалы образцов и растворитель дозируют перорально через желудочный зонд за 1 ч до обработки СА. Объем обработанной конечности измеряют через 3 и 5 ч после обработки СА. Изменение уровня воспаления вычисляют следующим образом: Проводят проверку в широком интервале доз вальдекоксиба (0,1-0,3-1,3 мг/кг) и соединения примера 1 (n = 6-12 животных на группу). Ингибирующее действие соединений на уровень воспаления определяют в % через 4 и 6 ч после обработки, и вычисляют ED50 ингибирования воспаления. Результаты. Ингибирующее действие вальдекоксиба на отек: через 4 ч после обработки ED50 = 0,2 мг/кг, через 6 ч после обработки ED50 = 0,3 мг/кг. Ингибирующее действие соединения примера 1 на отек: через 4 ч после обработки ED50 = 1,8 мг/кг,через 6 ч после обработки ED50 = 0,8 мг/кг. Ингибирующее действие на отек обоих соединений существенное, как показывают результаты. Ингибирующее действие вальдекоксиба через 4 ч сильнее, чем у соединения примера 1. Однако, профиль действия соединения примера 1 благоприятнее, поскольку оно более эффективно через 6 ч, чем через 4 ч. Результаты суммируются в табл.2. Таблица 2 Ингибирование механической воспалительной аллодинии у крыс, вызванной карригинаном Порог боли у животных измеряют прибором фон Фрея (IIТС, тип 1601 С). Порог раздражения измеряют по непрерывно возрастающей мощности на центральный участок подошвы. Величины регистрируют в моменты отдергивания или подъема. При каждом измерении порог определяют по меньшей мере трижды, и вычисляют среднее из максимальных значений. Используют самцов крыс Sprague-Dawley (массой 250-300 г ) (n = 5-6/группу). В середину лапы инъецируют 100 мкл раствора каррагинана (СА) в физиологическом растворе. После этого измеряют порог раздражения, и завершают обработку с помощью желудочного зонда перорально. Действие веществ определяют через 30, 60, 90 и 120 мин после обработки. Сравнивают действие с картиной в контрольной группе, обработанной носителем (2% раствор твина 80). Действие вычисляют следующим образом: где tx = 30, 60, 90, 120 мин. На модели острой боли аналгезирующее действие вальдекоксиба и соединения примера 1 было значительным при однократной дозе 30 мг/кг, р.о. Ингибирующее действие вальдекоксиба ненамного выше (5-10%) действия соединения примера 1,однако, различие статистически незначимое. Результаты приводятся в табл.3. Таблица 3. Крысиная модель моноартрита, вызванного каррагинаном и каолином (тест на снижение работоспособности (incapacitance)-3 008664 Прибор для определения снижения работоспособности представляет собой прибор для измерения изменений функциональных параметров, вызванных болью, которая может иметь место в задней конечности, количество перемещений и изменение центра тяжести. Коленный сустав задней правой конечности обрабатывают 100 мкл 2% раствора каррагинана и каолином. В течение 3-4 ч после обработки в суставной капсуле обработанной конечности развивается артрит. Такое воспаление существует еще через 24 ч после обработки. Поскольку из-за боли животные ухаживают за обработанными конечностями, нагрузка на нее уменьшается. Изменение массы нагрузки можно измерить прибором для определения снижения работоспособности в граммах. Снижение работоспособности вычисляют следующим образом: Аналгезирующие-противовоспалительные соединения могут повысить порог раздражения коленного сустава, и, следовательно, улучшить функциональные параметры конечности. Меру этого можно рассчитать по уменьшению нагрузки на левую конечность, т.е., в процентах реверсии. Снижение работоспособности, вызванное введением раздражителей в левую лапу, измеряют через 4 ч после инъекции. Затем животным (n = 24-32/группу) дают перорально дозу, 10 мг/кг, вальдекоксиба и испытываемых соединений. Измерения проводят через 1 и 2 ч после обработки. Аналгезирующее действие обоих соединений является существенным через 1 ч и повышается за следующий час. Действие соединения примера 1 в обеих точках на 20% сильнее, чем действие вальдекоксиба. Результаты суммируются в табл.4. Таблица 4 Крысиная модель вызванной каррагинаном воспалительной гипералгезии (метод Randall-Selitto). Вызывают отек инъекцией каррагинана (СА) в подошву правой задней лапы. Используют самцов крыс SPRD (массой 140-190 г; п = 6-8/группу). Затем алгезиметром (Ugo Basile, тип 37215) определяют механический болевой порог воспаленной задней лапы. При таком анализе контролируют снижение болевого порога и зависимость изменения болевого ощущения от времени при механическом раздражении. Аналгезирующие средства могут повысить болевой порог воспаленных конечностей, и такое действие выражают в проценте реверсии. Необработанную правую заднюю лапу сдавливают при постепенно возрастающем давлении. Регистрируют давление (в граммах), когда животное впервые издает звуковой сигнал или делает энергичную попытку извлечь лапу. Полученную величину определяют как базовую линию порога для необработанной лапы (в среднем 80-110 г). После этого животное обрабатывают каррагинаном. После обработки проверяют отек и порог в определенные моменты времени. Уменьшение отека, вызванного СА, наблюдают через 3 ч после инъекции. (Средний болевой порог, появляющийся при воспалении, составляет 2025 г, это означает снижение относительно базовой линии на 65-80%). Модель острого воспаления Через 1 ч после инъекции СА (100 мкл 2% раствора) животных обрабатывают испытываемыми соединениями и вальдекоксибом (10-10 мг/кг, р.о.). Изменение порога определяют через 2 ч после введения. Модель хронического воспаления Хроническую фазу воспаления и снижение порога вызывают более высокой дозой СА. Снижение порога, вызванное воспалением, измеряют через 24 ч после инъекции СА (150 мкл 2% раствора). После этого животных обрабатывают испытываемыми соединениями и вальдекоксибом (30-30 мг/кг, р.о.). Изменение порога определяют через 1 ч, 2 ч и 3 ч после введения лекарственного средства. В случае обеих моделей животным, используемым как контрольные группы, в моменты обработки дают перорально только растворители. В обоих протоколах действие испытываемых соединений вычисляют в процентах реверсии механической гипералгезии. Т 3 час: на модели острого воспаления порог в контрольной группе через 3 ч после инъекции СА (в граммах); Т 24 час: на модели хронического воспаления порог в контрольной группе через 24 ч после инъекции-4 008664 СА (в граммах); Т 0 час: порог до инъекции СА (в граммах); ТXчас: на модели острого воспаления порог через 3 ч после инъекции СА; ТXчас: на модели хронического воспаления порог через 25, 26, 27 ч после инъекции СА. Вальдекоксиб и испытываемые соединения оказывают существенное действие против гипералгезии на моделях острого и хронического воспаления. На модели хронического воспаления во всех трех точках измерения соединение примера 1 более эффективно, чем вальдекоксиб. Результаты, полученные на моделях острого и хронического воспаления, суммируются в табл. 5 и 6, соответственно. Таблица 5 Крадиотоническое действие на изолированное сердце кролика Используют новозеландских белых кроликов массой 1,5-2 кг. Животных обескровливают и после торакотомии иссекают сердца и готовят для аппарата для искусственного кровообращения типа аппарата Лангендорфа. Сердца перфузируют через аорту оксигенированным термостатированным (37 С) раствором Кребса. Применяют постоянное давление перфузии 80 см Н 2O (7,85 кПа). Испытываемые соединения растворяют в растворе для перфузии, и получают требуемые концентрации. Определяют базовую величину коронарного потока. Затем в жидкость для перфузии добавляют небольшое количество соединения, и измеряют перфузию в течение 30 мин каждые 10 мин. Через 30 мин осуществляют перфузию без соединения, и повторяют измерения со средой и с большим количеством соединения. Действие одних и тех же концентраций вальдекоксиба и соединения примера 1 исследуют на 4-4 сердцах (1, 3 и 10 мкМ). Вальдекоксиб не оказывает действия ни при какой концентрации. Соединение примера 1 оказывает положительное действие, и результаты суммируются в табл.7. Ясно видно, что коронарный поток возрастает в зависимости от дозы. Такое действие благоприятно в практике при клиническом лечении, поскольку боли артритного характера и перерождение суставов и костные деформации появляются чаще в преклонном возрасте, когда также часто встречаются болезни сосудистой системы,которые могут способствовать нарушениям сосудистого ложа сердца. В таком случае лечение, применяемое в связи с проблемами суставов и костей, может быть исключительно благоприятным, если оно также улучшает, по существу, сосудистое ложе сердца. Таблица 7 Результаты биологических исследований показывают следующее: соединения общей формулы (I) обладают существенной селективностью в отношении фермента СОХ-2, на основании исследований in vitro,действие соединений общей формулы (I) сильнее, чем действие вальдекоксиба, как показывают результаты испытаний in vivo,соединения общей формулы (I) повышают коронарный поток. Осуществление настоящего изобретения демонстрируется в примерах, приведенных далее, но оно ими не ограничивается.-5 008664 Исследования методом ЯМР осуществляют на спектрометре Varian (300 МГц). Исследования методом ВЭЖХ осуществляют на оборудовании Merck-Hitachi-Lachrom. Пример 1. Моногидрат N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида. А. Суспендируют 6,88 г (0,099 моль) гидрохлорида гидроксиламина в 50 мл диоксана, охлаждают до +10 С, и добавляют раствор 8,1 г (0,099 моль) ацетата натрия в 25 мл воды. Добавляют в течение 30 мин раствор 11 г (0,033 моль) 3-фенил-4-(4-хлорсульфонилфенил)-5-метилизоксазола в 50 мл диоксана. Смесь перемешивают в течение 30 мин, добавляют ее к 500 мл воды, и суспензию встряхивают в течение 2 ч. Сырой продукт реакции растворяют в этилацетате (200 мл), и раствор экстрагируют 5% водным раствором динатриевой соли этилендиаминтетрауксусной кислоты (40 мл), затем водой (40 мл) и, в заключение, рассолом (20 мл). Раствор упаривают в вакууме. Остаток растворяют в этаноле (90 мл), раствор обесцвечивают активированным углем (1 г), фильтруют, и к раствору при 60 С добавляют воду (270 мл),содержащую аскорбиновую кислоту (3 г). Раствор охлаждают (+5 С), выпавший в осадок продукт отфильтровывают, промывают водой и сушат, и получают названное в заголовке соединение (7,8 г; 68%; т.пл. 95-110 С). 1H ЯМР (ДМСОd6, 30 С, тмс 0,00 м.д.): 2,49 с (3 Н); 7,33-7,52 м (7 Н); 8,82-7,88 м (2 Н); 9,67 с (2 Н). Чистота 99,9%, ВЭЖХ. В. В 65 мл этилацетата растворяют 5,4 г (0,016 моль) 3-фенил-4-(4-хлорсульфонилфенил)-5 метилизоксазола. Добавляют 2,3 мл (0,035 моль) 50% водного раствора гидроксиламина и 0,3 г гидросульфата тетрабутиламмония в воде (65 мл). Реакционную смесь перемешивают при комнатной температуре в течение 8-20 ч. К реакционной смеси добавляют этилацетат (150 мл) и воду (150 мл). Органическую фазу отделяют и сушат над сульфатом натрия, и затем раствор упаривают при пониженном давлении. Остаток (4,9 г) растворяют в 70 мл этанола, и, после обесцвечивания активированным углем, раствор фильтруют. К раствору добавляют воду (210 мл), и кристаллический продукт отфильтровывают,промывают водой и сушат. Выход 3,0 г (54%). Пример 2. Моносольват N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида с этилацетатом. Суспендируют 6,88 г (0,099 моль) гидрохлорида гидроксиламина в 50 мл диоксана, охлаждают до+10 С, и добавляют раствор 8,1 г (0,099 моль) ацетата натрия в 25 мл воды. Добавляют в течение 30 мин раствор 11 г (0,033 моль) 3-фенил-4-(4-хлорсульфонилфенил)-5-метилизоксазола в 50 мл диоксана. Смесь перемешивают в течение 30 мин, добавляют ее к 600 мл воды и суспензию встряхивают в течение 2 ч. Суспензию фильтруют и промывают 2 раза 100 мл воды. Выпавшее в осадок вещество растворяют в 300 мл этилацетата, и раствор экстрагируют три раза 50 мл воды. Органический раствор осушают 5 г безводного сульфата магния. После отфильтровывания сульфата магния раствор упаривают при пониженном давлении (40 мбар (100 Па до 80 мл, в то время как продукт кристаллизуется. Полученную суспензию перемешивают в течение 2 ч при -5 С и промывают 10 мл холодного (-10 С) этилацетата. После сушки получают 8,5 г (60%) названного в заголовке соединения (т.пл. 96-100 С, разложение при 108 С). Чистота 99,9%, ВЭЖХ. Пример 3. Моносольват N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида с 2 пропанолом. Растворяют 4 г моносольвата N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида с этилацетатом в 20 мл 2-пропанола при 45 С. Нагревание прекращают, и названное в заголовке соединение выпадает в осадок. Суспензию перемешивают в течение 2 ч при 0 С и фильтруют, и получают названное в заголовке соединение (3,6 г; 96%; т.пл. 100-118 С, разложение при 123 С). Пример 4. Моносольват N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида с диоксаном. Растворяют 100 мг соединения, названного в заголовке примера 3, в 10 мл диоксана, нагревают до 40 С, и добавляют по каплям 10 мл воды. Продукт выпадает в осадок в кристаллической форме при 20 С. Суспензию перемешивают в течение 2 ч, фильтруют и сушат продукт при 25 С. Выход составляет 100 мг (83%); т.пл. 148-153 С. Пример 5. Получение 3-фенил-4-(4-хлорсульфонилфенил)-5-метилизоксазола (II). Растворяют 6,65 г (0,1 моль) хлорсульфоновой кислоты в 50 мл безводного дихлорметана. Раствор охлаждают до 0 С, и добавляют раствор 4,7 г (0,02 моль) 3,4-дифенил-5-метилизоксазола в 20 мл безводного дихлорметана. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре и еще 10 ч при температуре кипения. Растворитель выпаривают, и остаток выливают на 50 г льда. Полученную суспензию дважды экстрагируют 40 мл этилацетата. Объединенную органическую фазу экстрагируют 50 мл воды и сушат над безводным сульфатом магния. Остаток после фильтрации и упаривания растворяют в горячем циклогексане и охлаждают до +15 С для кристаллизации. Выпавший в осадок продукт (4 г) отфильтровывают и перекристаллизовывают из 50 мл циклогексана, и получают названное в заголовке соединение (II) (3,7 г; т.пл. 106-107 С). Пример 6. Получение несольватированного N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида. Греют 21,6 мг моногидрата N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида,полученного по примеру 1, в вакууме (20 мбар (2 кПа при 95 С до плавления. После охлаждения до-6 008664 25 С образуется стекловидный продукт, интервал температуры плавления 83-95 С, разложение при 150 С. Чистота 99,8% (ВЭЖХ). Пример 7. Таблетка, содержащая моногидрат N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида. Состав: 10 мг моногидрата N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида,2 мг стеарата магния,4 мг кросповидона,184 мг кристаллической микроцеллюлозы,всего - 200 мг. Моногидрат N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида и остальные компоненты смешивают и формуют в таблетку прессованием. Пример 8. Капсула, содержащая моногидрат N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида. Состав: 10 мг моногидрата N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида,10 мг аскорбиновой кислоты. Компоненты гомогенизируют и наполняют ими капсулу. Рентгенографические исследования Исследования методом дифракции рентгеновских лучей осуществляют на дифрактометре EnrafNonius CAD4. Способностью N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида является то, что он может образовывать стехиометрические твердофазные ассоциаты с различными растворителями. Лучше всего о таком свойстве говорят кристаллографические данные. Другой важной характеристикой является то, что во всех случаях N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамид, как молекула-хозяин, связывается с более мелкими (гостевыми) молекулами растворителей водородными связями. Например, такие водородные связи характеризуются кристаллической структурой комплекса с водой, где Н-связи отображаются прерывистыми линиями.N-Гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамид с включением воды образует бесцветные, призматические моноклинические кристаллы. Пространственная группа P21/c, параметры решетки при температуре Т=295(2) K: а = 7,659(1) , b = 23,510(1) , с = 9,148(1) ,= 95,65(1), V = 1639,2(3) 3. Вычисленная плотность Dx = 1,412 Мг/м 3. Атом серы характеризуется оригозависимыми относительными атомными координатами 0,23117(9) 0,27700(2) 0,52759(6) (x; y; z) с ошибкой(в скобках) в пределах статистической значимости 3. Комплекс, образованный с изопропанолом в отношении 2:2 (фиг. 2), характеризуется следующими данными: бесцветные, призматические моноклинические кристаллы. Пространственная группа P1, параметры решетки при температуре Т=295(2) K: а = 8,753(1) , b = 10,858(1) , с = 11,457(1) ,= 70,47(1),= 79,83(1),= 83,07(1), V = 1007,9(2) 3. Вычисленная плотность Dx = 1,287 Мг/м 3. Атом серы характеризуется оригозависимыми относительными атомными координатами 0,27950(4) 0,38112(3) 0,90833(3) (x; y; z) с ошибкой(в скобках) в пределах статистической значимости 3. Инклюзия диоксана (фиг. 3) характеризуется следующими данными: бесцветные, призматические моноклинические кристаллы. Пространственная группа P21/c, параметры решетки при температуре Т=295(2) K: а = 11,732(4) , b = 10,171(7) , с = 15,383(13) ,= 95,98(5), V = 1826(2) 3. Вычисленная плотность Dx = 1,362 Мг/м 3. Атом серы характеризуется оригозависимыми относительными атомными координатами 0,60293(4) 0,31230(5) 0,78848(3) (x; y; z) с ошибкой(в скобках) в пределах статистической значимости 3. Кривые порошковой дифракции, вычисленные из параметров решетки и относительных атомных координат вышеуказанных твердых кристаллических комплексов, согласуются с полученными по измерениям. Это означает соответствие кристаллов и макроскопических образцов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Сольваты N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида формулы (I) где [solvate] (присоединенный растворитель) представляет воду, (С 1-С 4)спирт, (C1-С 4)алкилэфир (С 1-С 3) карбоновой кислоты или диоксан. 2. Соединения формулы (I) по п.1, где [solvate] представляет воду.-7 008664 3. Соединения формулы (I) по п.1, где [solvate] представляет этилацетат. 4. Соединения формулы (I) по п.1, где [solvate] представляет 2-пропанол. 5. Соединения формулы (I) по п.1, где [solvate] представляет диоксан. 6. Способ получения сольватов N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида формулы (I), где [solvate] представляет (С 1-С 4)алкилэфир (C1-С 3)карбоновой кислоты или диоксан, отличающийся тем, что 3,4-дифенил-5-метилизоксазол формулы (III) вводят во взаимодействие с хлорсульфоновой кислотой, и продукт реакции 3-фенил-4-(4-хлорсульфонилфенил)-5-метилизоксазол (II) вводят во взаимодействие с гидроксиламиномa) в смеси воды и растворителя, смешивающегося с водой,b) в смеси растворителя, не смешивающегося с водой, и воды в присутствии межфазного катализатора,и продукт реакции кристаллизуют из растворителя, выбранного из числа (С 1-С 4)алкилэфира (С 1-С 3) карбоновой кислоты или диоксана. 7. Способ по п.6, отличающийся тем, что межфазный катализатор представляет собой гидросульфат тетрабутиламмония. 8. Способ по п.6, отличающийся тем, что перекристаллизацию осуществляют из этилацетата. 9. Способ получения сольватов N-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил)бензолсульфонамида формулы (I), где [solvate] представляет воду, отличающийся тем, что 3,4-дифенил-5-метилизоксазол формулы (III) вводят во взаимодействие с хлорсульфоновой кислотой, и продукт реакции 3-фенил-4-(4-хлорсульфонилфенил)-5-метилизоксазол (II) вводят во взаимодействие с гидроксиламиномa) в смеси воды и растворителя, смешивающегося с водой,b) в смеси растворителя, не смешивающегося с водой, и воды в присутствии межфазного катализатора,и продукт реакции кристаллизуют из смеси воды и этанола, необязательно, содержащей аскорбиновую кислоту. 10. Применение соединений формулы (I) по любому из пп.1-5 для получения фармацевтической композиции для лечения остеоартрита и ревматоидного артрита и болей при операции и первичной дис-8 008664 менореи. 11. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-5 и один или несколько терапевтически приемлемых фармацевтических носителей. 12. Фармацевтическая композиция по п.11, отличающаяся тем, что одним из носителей является аскорбиновая кислота. 13. Способ лечения остеоартрита и ревматоидного артрита и болей при операции и первичной дисменореи, включающий лечение нуждающегося в этом пациента терапевтически эффективной дозой соединения формулы (I) по любому из пп.1-5. 14. Способ лечения остеоартрита и ревматоидного артрита и болей при операции и первичной дисменореи, включающий лечение нуждающегося в этом пациента терапевтически эффективной дозой фармацевтической композиции по любому из пп.11-12.
МПК / Метки
МПК: A61K 31/42, C07D 231/12
Метки: сольваты, новые, бензолсульфонамида, n-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил
Код ссылки
<a href="https://eas.patents.su/11-8664-novye-solvaty-n-gidroksi-4-3-fenil-5-metilizoksazol-4-il-benzolsulfonamida.html" rel="bookmark" title="База патентов Евразийского Союза">Новые сольваты n-гидрокси-4-(3-фенил-5-метилизоксазол-4-ил) бензолсульфонамида</a>
Предыдущий патент: Всесезонная порошкообразная добавка к асфальтам, продукт и способы их получения
Следующий патент: Лекарственные средства для лечения хронического обструктивного заболевания лёгких
Случайный патент: Магнитная сталь с неориентированными зернами, способ производства листовой стали и получаемая листовая сталь