Циклоундекадепсипептидные соединения и применение указанных соединений в качестве лекарственного средства
Номер патента: 20896
Опубликовано: 27.02.2015
Авторы: Гаруст Патрик, Лисек Роберт, Новароли Занолари Лаура, Муттер Манфред, Турпин Оливье, Вуагнио Грегуар, Венгер Роланд, Николас Валери, Краббе Рафаэль
Формула / Реферат
1. Циклоундекадепсипептидное соединение формулы (I)
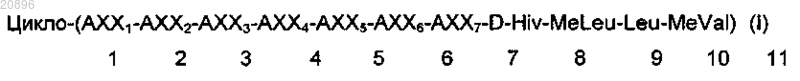
в которой

2. Соединение по п.1, отличающееся тем, что в формуле (I)

3. Соединение по любому из пп.1 или 2, отличающееся тем, что

4. Соединение по любому из пп.1-3, имеющее следующую формулу:

5. Фармацевтическая композиция для предотвращения или лечения инфекций, вызываемых вирусом гепатита С, или вызываемых ВГС расстройств, содержащая соединение по любому из пп.1-4 совместно с одним или более фармацевтически приемлемыми разбавителями или носителями.
6. Фармацевтическая комбинация, содержащая, по меньшей мере, а) первое средство, состоящее из соединения по любому из пп.1-4 или фармацевтической композиции по п.5, и b) второе средство, обладающее способностью противодействовать репликации ВГС.
7. Применение фармацевтической комбинации по п.6 для предотвращения или лечении инфекций, вызываемых вирусом гепатита С, или вызываемых ВГС расстройств.
8. Применение соединения по любому из пп.1-4 в качестве лекарственного средства для подавления репликации вируса гепатита С у нуждающегося в этом пациента.
9. Применение соединения по любому из пп.1-4 в качестве противовирусного средства.
10. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения или предотвращения инфекций, вызываемых вирусом гепатита С, или вызываемых ВГС расстройств.
11. Способ предотвращения или лечения инфекций, вызываемых вирусом гепатита С, или вызываемых ВГС расстройств у нуждающегося в этом субъекта, включающий введение указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-4 или фармацевтической композиции по п.5.
12. Способ подавления репликации ВГС у нуждающегося в этом пациента, включающий введение указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-4 или фармацевтической композиции по п.5.
13. Способ по любому из пп.11, 12, включающий совместное введение одновременно или последовательно терапевтически эффективного количества соединения по любому из пп.1-4 или фармацевтической композиции по п.5 и, по меньшей мере, второго средства, выбранного из средства, обладающего способностью противодействовать репликации ВГС.
14. Способ по п.13, отличающийся тем, что указанное средство, обладающее направленными против ВГС свойствами, выбрано из группы, состоящей из интерферона, такого как интерферон-α-2а или интерферон-α-2b; или интерферона, конъюгированного с водорастворимым полимером или человеческим альбумином; противовирусного средства, такого как рибавирин, ламивудин, NV08 или NM283; ингибитора кодируемых ВГС факторов, например протеазы NS3-4A, хеликазы или РНК-полимеразы; противофиброзного средства, такого как производное N-фенил-2-пиримидинамина; иммуномодулирующего средства, такого как микофеноловая кислота; или агониста рецептора S1P, такого как FTY720 или его необязательно фосфорилированный аналог.
Текст
ЦИКЛОУНДЕКАДЕПСИПЕПТИДНЫЕ СОЕДИНЕНИЯ И ПРИМЕНЕНИЕ УКАЗАННЫХ СОЕДИНЕНИЙ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА Изобретение относится к новым циклоундекадепсипептидным соединениям и применению указанных соединений в качестве лекарственного средства, в частности в качестве противовирусных средств, более конкретно, для предотвращения или лечения инфекций,вызываемых вирусом гепатита С, или вызываемых ВГС расстройств.(71)(73) Заявитель и патентовладелец: ДЕБИО РЕШЕРШ ФАРМАСЕТИК С.А. (CH) Настоящее изобретение относится к циклоундекадепсипептидным соединениям. Изобретение также относится к применению указанных соединений в качестве лекарственного средства, в частности в качестве противовирусных средств, более конкретно, для предотвращения или лечения инфекций, вызываемых вирусом гепатита С или вызываемых вирусом гепатита С (ВГС) расстройств. Уровень техники ВГС был клонирован и охарактеризован около 15 лет назад Ху (Choo) и сотрудниками (см. Science 244, (1989), 359-362). ВГС принадлежит к семейству Flaviviridae и содержит окруженный оболочкой нуклеокапсид и геном в виде одноцепочечной РНК положительной полярности (см. Bartenschlager et al.,Antiviral Res. 60, (2003), 91-102). ВГС передается главным образом через кровь, препараты крови и посредством вертикальной передачи во время беременности. Введение диагностических тестов для скрининга препаратов крови значительно снизило долю новых инфекций. Тем не менее, ВГС остается серьезной медицинской проблемой. В настоящее время около 170 млн людей инфицированы ВГС. Первоначальное течение инфекции обычно легкое. Однако иммунная система зачастую неспособна устранить вирус, и люди с хроническими инфекциями подвержены высокому риску возникновения цирроза печени и гепатоцеллюлярной карциномы (см. Poynard et al., Lancet 349,(1997), 825-832). Вакцины от ВГС не существует, а возможные способы лечения очень ограничены (см. Manns et al.,Indian J. Gastroenterol. 20 (Suppl. 1), (2001), с. 47-51; Tan et al., Nat. Rev. DrugDiscov. 1, (2002), 867-881). Были идентифицированы соединения, которые прочно связываются с циклофилином, но данные соединения обладали иммуносупрессивным действием (Nakawaga M. et al., Biochemical and biophysicalresearch communications, Academic press Inc. Orlando, F.L., US, vol. 313,1, 2, January 2004, p. 42-47,XP004479114). В связи с этим в течение последних 20 лет был проведен ряд исследований в области медицинской химии с целью идентификации неиммуносупрессивных соединений, таких как NIM 811, или других соединений, демонстрирующих также высокую активность в отношении подавления репликации вируса иммунодефицита человека 1 (ВИЧ-1) и, по существу, не обладающих иммуносупрессивной активностью,см. WO 00/01715 (Wenger et al.; DEBIOPHARM SA) и Tetrahedron Lett., 41, (2000), 7193-6. Было обнаружено, что неиммуносупрессивные соединения, которые связывают циклофилин, обладают ингибирующим действием в отношении вируса гепатита С (ВГС). Хроническая инфекция ВГС,которая была идентифицирована как основной возбудитель гепатита, не являющегося гепатитом А или В, как полагают, тесно связана с заболеваниями печени, такими как хронический гепатит, цирроз печени или гепатоцеллюлярная карцинома. Развитие этих заболеваний печени является основной проблемой общественного здравоохранения. Эффективная терапия против ВГС ограничивается терапией интерфероном или комбинацией интерферона и рибавирина. Однако поскольку примерно у половины пациентов с ВГС, которых лечат с помощью указанных известных средств, вирус не уничтожается, по-прежнему существует большая потребность в альтернативных средствах против ВГС. Циклоундекапептиды, обладающие способностью воздействовать на подавление репликации вируса гепатита С (ВГС), уже известны из WO 2005/021028 (Novartis Pharma GMBH) и WO 2006/038088 (DEBIOPHARM SA). В Hanssons M.J. et al. Journal of Bioenergetics and biomembranes, plenum publishing, NewYork, NY, US, vol. 36,4, 1 August 2004, p. 407-413 (XP002330699) сообщается о более высокой эффективности подавления перехода митохондриальной проницаемости (mPT) соединениями, описанными вWO 2006/038088. Однако несмотря на то, что некоторые из этих пептидов в настоящее время проходят клинические испытания, по-прежнему остается потребность в разработке новых противовирусных средств, обладающих удовлетворительной способностью подавлять репликацию, в частности репликацию ВГС, наряду с улучшенным фармакокинетическим профилем (например, профиль подавления переносчика в печени и связанные с этим взаимодействия лекарственных средств) и улучшенным токсикологическим профилем (например, отсутствием иммуносупрессивной активности и возникающих в результате побочных эффектов). Соответственно задачей настоящего изобретения является создание дополнительных неиммуносупрессивных соединений для применения для предотвращения или лечения инфекций, вызываемых вирусом гепатита С, или расстройств, вызываемых ВГС. Данные соединения обладают неожиданным преимуществом в виде снижения либо возможных побочных эффектов, связанных с подавлением переносчиков в печени, либо возможных взаимодействий лекарственных средств, связанных с подавлением переносчиков в печени, либо и того, и другого. Кроме того, задачей настоящего изобретения также является получение соединений, которые легче синтезировать, в частности, в промышленном масштабе. Краткое описание изобретения Таким образом, задачей настоящего изобретения являлось получение новых противовирусных средств, обладающих вышеупомянутыми улучшенными свойствами, и неожиданно было обнаружено,что данным требованиям удовлетворяют циклоундекадепсипептидные соединения, определенные формулой (I) Другой задачей изобретения является получение фармацевтической композиции для предотвращения или лечения инфекций, вызываемых вирусом гепатита С, или расстройств, вызываемых ВГС, содержащей соединение формулы (I) вместе с одним или более фармацевтически приемлемыми разбавителями или носителями. Дополнительной задачей изобретения является получение фармацевтической комбинации, содержащей, по меньшей мере, а) первое средство, состоящее из соединений формулы (I) или фармацевтической композиции, и b) второе средство, обладающее свойствами препятствовать репликации ВГС. Соединения в соответствии с формулой (I) можно применять для получения лекарственного средства для лечения или предотвращения инфекций, вызываемых вирусом гепатита С, или вызываемых ВГС расстройств. Еще одной задачей изобретения является обеспечение способа предотвращения или лечения инфекций, вызываемых вирусом гепатита С, или вызываемых ВГС расстройств у нуждающегося этом субъекта, при этом указанный способ включает введение указанному субъекту терапевтически эффективного количества соединений формулы (I) или фармацевтической композиции в соответствии с изобретением. Альтернативно, также предложен способ подавления репликации ВГС у нуждающегося в этом пациента, включающий введение указанному субъекту терапевтически эффективного количества соединений формулы (I) или фармацевтической композиции согласно изобретению. Краткое описание чертежей С целью лучшего понимания изобретения и для того, чтобы показать, как настоящее изобретение может быть реализовано, в изобретении будут только в качестве примера приведены конкретные варианты реализации, способы и процессы согласно настоящему изобретению со ссылкой на прилагаемый чертеж, на котором иллюстрируется химический синтез соединений согласно изобретению в сравнении с соединением согласно WO 2006/038088, т.е. [D-MeAla]3-[EtVal]4-CsA (Debio 025). Подробное описание изобретения Если не указано иное, все технические и научные термины, используемые в настоящем изобретении, имеют те же значения, которые обычно подразумевает специалист в области техники, к которой принадлежит данное изобретение. Несмотря на то, что методы и материалы, сходные с или эквивалентные тем, которые описаны в настоящем изобретении, могут быть применены на практике или при исследовании настоящего изобретения, подходящие методы и материалы описаны ниже. Полное содержание всех публикаций, заявок на патенты, патентов и других ссылок, упомянутых в настоящем изобретении,включено в настоящее описание во всей полноте посредством ссылки. В случае противоречия настоящее описание, включая определения, является решающим. Кроме того, материалы, методы и примеры являются лишь иллюстративными и не подразумевают ограничения. В настоящем изобретении с целью облегчения понимания настоящего изобретения даны следующие определения. Термин "включать" обычно применяют в смысле "содержать", другими словами, допуская присутствие одного или более признаков или компонентов. Задачей настоящего изобретения является получение циклоундекадепсипептидного соединения Согласно определению, принятому Международным союзом теоретической и прикладной химии(IUPAC), циклодепсипептиды представляют собой природные или синтетические соединения, содержащие последовательности остатков амино- и гидроксилкарбоновых кислот (обычно -амино- и -гидроксикислоты), и остатки замкнуты в кольцо (см. IUPAC Compendium of Chemical Terminology, 2nd Edition(1997). Такие циклодепсипептиды представляют как гетеродетные пептиды, в которых по меньшей мере одна амидная связь заменена на сложноэфирную связь (см. J. Peptide Sci. 10:115-8(2004. Соединения согласно настоящему изобретению содержат одиннадцать остатков, причем десять из них представляют собой -аминокислоты, а один - -гидроксикислоту. Данная -гидроксикислота представляет собой (2R)-2-гидрокси-3-метилбутановую кислоту, также известную как Dгидроксиизовалериановую кислоту и обозначаемую сокращенно как H-D-Hiv-OH. В формуле (I) данная гидроксикислота находится в положении 8. По концевой карбоксильной группе она образует амидную связь с аминогруппой -аминокислоты в положении 9, а именно N-метиллейцина, и за счет гидроксильной группы - сложноэфирную связь с карбоксильной группой -аминокислоты в положении 7, а именно аланина или глицина. Указанные -аминокислоты формулы (I) названы с использованием трехбуквенного кода, обычно используемого для обозначения аминокислот, и их конфигурация является L-конфигурацией, если не указано иное. Нумерация остатков начинается с АХХ 1, представляющего собой N-метил-(4R)-4-[(Е)-2 бутенил]-4-метил-L-треонин или MeBmt и его структурные производные, как определено выше. Когда алкильная группа, такая как метильная группа Me или этильная группа Et, появляется перед аббревиатурой аминокислоты, это означает, что такая алкильная группа присоединена к аминогруппе указанного аминокислотного остатка. Преимущество соединений согласно настоящему изобретению может заключаться во введении сложноэфирной связи внутрь макроциклического остова в сравнении с регулярным циклическим амидным остовом соответствующих циклоундекапептидных соединений, описанных в известном уровне техники. Не углубляясь в теорию, полагают, что замена амидной связи на сложноэфирную между аминокислотой АХХ 7 в положении 7 и D-Hiv в положении 8 позволяет значительно влиять на конформационные и физико-химические свойства, такие как повышенная конформационная гибкость (в P.J. Flory, Statistical Mechanics of Chain Molecules, Hanser Publishers, NY, 1988) и липофильность, а также отсутствие донорной водородной связи. Полагают, что данные структурные особенности трансформируются в выраженные различия в физико-химических, фармакокинетических и биологических свойствах соединений согласно настоящему изобретению по сравнению с классом аналогов, полученных из циклоспорина A (CsA). Возможное разумное объяснение наблюдаемой более высокой устойчивости к заменам аминокислот в систематических исследованиях взаимосвязи структура-активность (SAR) может заключаться в увеличении конформационного пространства в отношении биоактивной конформации (V. Mikol et al., J. Mol. Biol. (1998) 283, 451-461). В противоположность циклоундекапептидным аналогам, известным из уровня техники, единственная или множественные замены в положениях во фрагменте между аминокислотой в положении 2 и аминокислотой в положении 7 природного циклоундекадепсипептида, такого как полученного согласно или патенту США 5116816, пример 2, или WO 02/092033, пример 4, стадия 4-1, приводят к сохранению высокой способности связываться с циклофилином, что очевидно из списка соединений, удовлетворяющих требованиям настоящего изобретения. Прежде всего, наблюдали повышение способностей связываться с циклофилином А (Сур А) до 2-4 раз для соединений согласно изобретению по сравнению с со-3 020896 единением согласно WO 2006/038088, т.е. [D-MeAla]3-[EtVal]4-CsA (Debio 025). Кроме улучшенного активного профиля (см. примеры 5 и 6), новый класс соединений также позволяет предложить улучшенный способ получения, особенно в промышленном масштабе. Изобретение также включает химические модификации соединений формулы (I) с целью продления их времени нахождения в кровотоке. Примеры подходящих производных полиэтиленгликоля, обладающих данным свойством, описаны, например, в заявке на патент США 2005171328 (NEKTAR THERAPEUTICS AL CORP) или патенте США 6713454 (NOBEX CORP). Более предпочтительно соединения согласно настоящему изобретению определены формулой (I), в которой Более предпочтительно соединения формулы (I) определены следующими значениями: В отдельном варианте реализации изобретения соединения формулы (I) определены следующими значениями: В соответствии с одним из наилучших вариантов реализации изобретения соединения формулы (I) представлены следующими формулами: Вышеперечисленные соединения соответствуют полной оптимизации наиболее важных критериев настоящего изобретения, а именно усовершенствованию химического синтеза, фармакологических свойств, фармакокинетических и токсикологических профилей. Примечательно, что указанные соединения показывают намного меньшую эффективность по сравнению с Debio 025, подавления переносчиков в печени, таких как MRP2 или ОАТР 1 В 1. Таким образом,-4 020896 данные соединения, как ожидают, уменьшат или возможные неблагоприятные эффекты (например, гипербилирубинемию), или возможные взаимодействия лекарственных средств (например, с ингибиторами гидроксиметилглутарил-кофермент A (HMG-CoA) редуктазы, такими как аторвастатин), связанные с подавлением переносчиков в печени, или даже и то, и другое. Дополнительные соединения согласно изобретению представляют собой следующие: Другие представляющие интерес соединения определены следующими формулами: Соединения настоящего изобретения могут быть получены с помощью классических пептидных способов (пептидный синтез в растворе или твердофазный синтез в Houben-Weyl, Methods of OrganicChemistry, vol. E 22d, Ed.-in-Chief: M. Goodman, Thieme Verlag, Stuttgart, 2003) и органической химии или биотехнологии, например, применяя химические методы, как описал Wenger в Helv. Chim. Acta, 67, 50225, 1984 или в Helv. Chim. Acta, 66, 2672-702 (1983), и используя HATU в качестве реагента для реакции сочетания, описанного в Rich, D.H. et al., Comparative studies of the coupling of N-methylated, sterically hindered amino acids during SPPS, Tetr. Letters. 35, 5981-5984(1994). Например, одна из возможных общих схем состоит из получения двух фрагментов, а именно фрагмента А и фрагмента В, содержащих подходящие остатки, если необходимо, с подходящими защитными и активирующими группами и на последних стадиях получения связывания их вместе с получением ундекапептида, который затем циклизуют в циклоундекадепсипептид. Например, фрагмент (Ax) может быть следующим:H-AXX2-AXX3-AXX4-AXX5-AXX6-AXX7-OR, (R представляет собой алкильную группу) (Bx),тогда Ax и Bx сочетают в ундекадепсипептид Ax-Bx, H-D-Hiv-MeLeu-Leu-MeVal-AXX1-AXX2AXX3-AXX4-AXX5-AXX6-AXX7-OR (R=алкил, Н),и финальная стадия представляет собой макролактонизацию. Фрагмент А, который содержит остаток -гидроксикислоты D-Hiv, может быть получен разложением природного циклоундекадепсипептида (а именно цикло-(MeBmt-Thr-Sar-MeLeu-Leu-MeLeu-Ala-DHiv-MeLeu-Leu-MeVal), получение указанного циклоундекадепсипептида описано или в патенте США 5116816, пример 2 или в WO 02/092033, пример 4, стадия 4-1. Преимущество соединений согласно изобретению перед известным уровнем техники заключается не только в его активном профиле (см. примеры 5 и 6), но также и в улучшенном способе получения,особенно в промышленном масштабе. 1. При применении в качестве исходных веществ природных соединений (CsA и цикло-(MeBmtThr-Sar-MeLeu-Leu-MeLeu-Ala-D-Hiv-MeLeu-Leu-MeVal), см. чертеж, общие выходы синтеза циклоундекадепсипептидных аналогов превышают 50% по сравнению с 20% для DEBIO 025 ([D-MeAla]3-[EtVal]4CsA, как описано в WO 2006/038088, DEBIOPHARM SA). 2. Синтез дорогого дипептидного производного Boc-D-MeAla-EtVal-OH (включающий 4 химические стадии) не требуется. Кроме того, некоторые из соединений содержат С-концевой глицин (Ia, Ic, If,Ig, Ii, Ik), который облегчает последнюю стадию синтеза (макролактонизация, нет эпимеризации). 3. Стоимости реагентов и исходных соединений значительно ниже в случае соединений согласно изобретению. Следует отметить, что "реагент Меервейна", применяемый для реакции открытия кольцаCsA, не требуется. 4. Фрагмент В (гексапептид АХХ 2-АХХ 7) может быть эффективно получен с помощью стандартного твердофазного пептидного синтеза с применением коммерческих исходных соединений (см. чертеж). 5. При оптимизации получения фрагмента А из исходного природного соединения, также как и конденсации (фрагмента А с фрагментом В), макроциклизации и конечных стадий очистки, общий выход для получения фармакологически интересных соединений может доходить до 80%. 6. В целом указанные аспекты приводят к хорошей эффективности и, следовательно, стоимости продуктов, особенно в отношении синтеза соединений согласно изобретению в промышленном масштабе. Способность соединений согласно настоящему изобретению подавлять репликацию ВГС была показана в анализе с применением репликона, а существенное отсутствие иммуносупрессивной активности оценили в анализе пролиферативной активности Т-клеток (см. примеры 5 и 6)."Неиммуносуппрессивное" соединение согласно настоящему изобретению следует понимать как соединение, которое по меньшей мере в 30 раз менее иммуносупрессивное, чем циклоспорин A (CsA)(определяют как отношение IC50 (половина концентрации, вызывающей максимальное подавление) соединения к IC50 циклоспорина A (IC50 соединения/IC50 CsA, предпочтительно менее чем в 150 раз, менее даже чем в 200 раз и предпочтительно даже менее чем в 300 раз. В идеале, соединения изобретения обладают неиммуносупрессивной активностью in vitro, составляющей по меньшей мере две логарифмические разности с CsA в анализе вызванной Конканавалином А пролиферативной активности Т-клеток. Соответственно соединения согласно настоящему изобретению предложено применять в качестве лекарственного средства, в частности в качестве противовирусного средства, а более конкретно, для предотвращения или лечения инфекций, вызываемых вирусом гепатита С, или расстройств, вызываемых ВГС. Инфекции гепатита С или расстройства, вызываемые ВГС, представляют собой, например, хронический гепатит, цирроз печени или рак печени, например гепатоцеллюлярную карциному. Соединения согласно настоящему изобретению могут также быть применены, например, в качестве профилактического лечения новорожденных, рожденных от инфицированных ВГС матерей, или работников здравоохранения, подверженных действию вируса, или реципиентов трансплантатов, например реципиентов трансплантатов органа или ткани, например трансплантата печени, с целью устранения возможной по-6 020896 вторной инфекции ВГС после трансплантации."Лечение" относится и к терапевтическому лечению, и к профилактическим или предупреждающим мерам. Нуждающиеся в лечении включают тех, кто уже страдает расстройством, также как и тех, у кого заболевание нужно предупредить. Следовательно, млекопитающие, которых нужно лечить согласно настоящему изобретению, могут быть продиагностированы как имеющие расстройство или могут быть предрасположены или восприимчивы к расстройству."Млекопитающее" для целей лечения относится к любому животному, классифицируемому как млекопитающее, включая людей, домашних и сельскохозяйственных животных или домашних питомцев, таких как собаки, лошади, кошки, коровы, обезьяны и т.д. Предпочтительно млекопитающее представляет собой человека. Термин "терапевтически эффективное количество" относится к количеству лекарственного средства, эффективному для лечения заболевания или расстройства у млекопитающего. Соединения согласно настоящему изобретению могут быть применены, например, перорально нуждающимся пациентом, например включены в предварительно концентрированную микроэмульсию. Соединения согласно настоящему изобретению, их фармацевтически приемлемые соли и их пролекарства в соответствующих случаях могут быть применены в форме фармацевтической композиции, в которой они объединены с фармацевтически приемлемым адъювантом, разбавителем или носителем, с целью предотвращения или лечения инфекций, вызываемых вирусом гепатита С, или расстройств, вызываемых ВГС. Согласно настоящему изобретению также предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению или его фармацевтически приемлемую соль, как определено выше в настоящем изобретении, совместно с фармацевтически приемлемым адъювантом, разбавителем или носителем. Что касается подходящих наполнителей, разбавителей и адъювантов, можно сделать ссылку на описывающую их стандартную литературу, например на главу 25.2 т. 5 источника "Comprehensive Medicinal Chemistry", Pergamon Press 1990 и на "Lexikon der Hilfsstoffe fur Pharmazie, Kosmetikund angrenzende Gebiete", автор Н.Р. Fiedler, Editio Cantor, 2002. Соединения согласно настоящему изобретению могут также быть заключены в микрокапсулы, полученные, например, с помощью методов коацервации или межфазной полимеризации, например в микрокапсулы на основе гидроксиметилцеллюлозы или желатина и полиметилметацилатные микрокапсулы,соответственно в коллоидных системах доставки лекарственных средств (например, липосомах, альбуминовых микросферах, микроэмульсиях, наночастицах и нанокапсулах) или в макроэмульсиях. Такие методы предложены в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed (1980). Могут быть получены препараты с замедленным высвобождением. Подходящие примеры препаратов с замедленным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащие соединения согласно настоящему изобретению, матрицы которых находятся в виде изделий определенной формы, например пленок или микрокапсул. Примеры матриц с замедленным высвобождением включают полиэфиры, гидрогели (например, поли(2-гидроксиэтилметакрилат) или поливиниловый спирт), полилактиды (патент США 3773919), сополимеры L-глутаминовой кислоты и[гамма]этил-L-глутамата, неразлагаемый этилен-винилацетат, разлагаемые сополимеры молочной и гликолевой кислот, такие как применяемые для получения лекарственного средства LUPRON DEPOT(TM)(инъекционные микросферы, составленные из сополимера молочной и гликолевой кислот и леупролида ацетата), и поли-(D)-(-)-3-гидроксимасляную кислоту. Суточная доза согласно настоящему изобретению будет при необходимости варьироваться в зависимости от организма, подлежащего лечению, конкретного способа применения и тяжести и вида подвергаемого лечению заболевания. Соответственно оптимальная дозировка может быть определена практикующим врачом, проводящим лечение конкретного пациента. Фармацевтические композиции согласно настоящему изобретению могут быть получены в виде кремов, гелей, растворов, мазей, суспензий или пластырей и т.д. в случае местного применения; для применения путем ингаляции, например, в виде аэрозолей или сухих порошков; для перорального введения,например, в форме таблеток, капсул, гелей, сиропов, суспензий, растворов, порошков или гранул; для ректального или вагинального введения, например, в виде суппозиторий или для парентеральной инъекции (включая внутривенную, подкожную, внутримышечную, внутрисосудистую или вливание) в виде стерильного раствора, суспензии или эмульсии. Активное соединение согласно изобретению может быть введено любым традиционным способом. Оно может быть введено парентерально, например в форме растворов для инъекций или суспензий, или в форме составов-депо для инъекций. Предпочтительно оно может быть введено перорально в форме питьевых растворов или суспензий, таблеток или капсул. Фармацевтические композиции для перорального введения, содержащие циклоундекадепсипептидное соединение согласно изобретению, описаны в примерах. Как представлено в примерах, указанные фармацевтические композиции, как правило, содержат циклоундекадепсипептидное соединение согласно изобретению и одно или более фармацевтически приемлемых веществ-носителей. Как правило, данные композиции являются концентрированными и их необходимо объединить с подходящим разбавителем, например водой перед применением. Фармацевтиче-7 020896 ские композиции для парентерального введения, как правило, также включают один или более наполнителей. Возможные наполнители включают изотонический агент, буфер или другой контролирующий pH агент и консервант. Данные наполнители могут быть добавлены для сохранения композиции и для достижения предпочтительных диапазонов pH (примерно 6,5-7,5) и осмолярности (примерно 300 мосмоль/л). Дополнительные примеры составов для перорального введения можно найти в патентах США 5525590 и 5639724 и заявке на патент США 2003/0104992. При пероральном способе введения указанная дозировка циклоундекадепсипептидного соединения согласно изобретению для введения от раза в сутки до раза в неделю может составлять от примерно 1 до примерно 100 мг/кг, предпочтительно от примерно 1 до примерно 20 мг/кг. При внутривенном способе введения указанная соответствующая дозировка может составлять от примерно 1 до примерно 50 мг/кг, предпочтительно от примерно 1 до примерно 25 мг/кг. Под эффективным количеством циклоундекадепсипептидного соединения согласно изобретению понимают количество, которое при многократном применении в курсе программы лечения к пациенту, нуждающемуся в лечении инфекции ВГС, приводит к объективному клиническому ответу,такому как статистически значимое понижение титра ВГС в сыворотке или значимое понижение активности сывороточной аланинаминотрансферазы (ALT) у пациента. Многочисленные факторы будут приняты во внимание практикующим врачом при определении пробных доз для проверки эффективности фармацевтической композиции, содержащей соединение согласно настоящему изобретению, против инфекции ВГС. Первостепенными среди них являются токсичность и период полувыведения выбранного циклоундекадепсипептидного соединения согласно изобретению. Дополнительные факторы включают вес пациента, возраст пациента, общее состояние пациента(включая значимые системные или обширные заболевания, включая декомпенсированную болезнь печени, тяжелое существующее нарушение функции костного мозга и другие вирусные инфекции), стадию инфекции ВГС (острая в сравнении с хронической), определяемую, например, уровнями сывороточной аланинаминотрансферазы (ALT), специфический генотип ВГС, предыдущую терапию инфекции ВГС,присутствие других лекарственных средств в организме пациента и т.п. Курс лечения потребует многократного применения фармацевтической композиции согласно изобретению. Как правило, соответствующая доза лекарственного средства будет применена 3-7 раз в неделю и длительность лечения может составлять от примерно 4 недель до 6 месяцев, предпочтительно от примерно 4 недель до примерно 12 месяцев. Лечение может сопровождаться определениями ВГС в сыворотке и измерением уровней сывороточной ALT. Конечной точкой лечения является вирусологический ответ, т.е. отсутствие ВГС в конце курса лечения, через несколько месяцев после начала лечения или через несколько месяцев после завершения лечения. ВГС в сыворотке может быть измерен на уровне РНК такими методами, как количественная полимеразная цепная реакция в режиме реального времени (RT-PCR) или нозерн-блоттинг или на уровне белка с помощью иммуноферментного анализа или иммуноанализа с усиленной хемилюминесценцией вирусных белков. Конечная точка может также включать определение уровня сывороточнойALT в нормальном диапазоне. Фармацевтическая композиция согласно настоящему изобретению может содержать один или более других ингредиентов, активных против инфекции ВГС, в дополнение к соединениям согласно настоящему изобретению, таких как, например, другое противовирусное лекарственное средство, например рибавирин или интерферон-. Соединения согласно изобретению и подобные другие активные составляющие могут быть применены совместно как часть одной и той же фармацевтической композиции или могут быть применены по отдельности как часть подходящего режима дозирования, разработанного с целью получения пользы от комбинированного лечения. Подходящий режим дозирования, количество каждой применяемой дозы и специфические интервалы между дозами каждого активного средства будут зависеть от специфической комбинации применяемых активных средств, состояния пациента, подлежащего лечению, и других факторов, обсужденных в предыдущей части. Указанные дополнительные активные составляющие могут, в общем, быть применены в количествах, меньших чем или равных тем, в которых они являются эффективными как отдельные лекарственные средства. Одобренные Федеральным агентством США по контролю за лекарственными средствами (FDA) дозировки для данных активных средств,которые получили одобрение FDA для применения у людей, публично доступны. Соединения согласно изобретению могут быть применены как единственная составляющая или совместно с другими лекарственными средствами, например с лекарственным средством, обладающим активностью против ВГС, например интерфероном, например интерфероном 2 а или интерфероном 2b,например Интроном A (Intron А), Рофероном (Roferon), Авонексом (Avonex), Ребифом (Rebif) или Бетафероном (Betaferon), или интерфероном, соединенным с водорастворимым полимером или человеческим альбумином, например Альбуфероном (Albuferon) (Human Genome Science), противовирусным средством, например рибавирином, ламивудином, NV08 или NM283, ингибитором кодируемых ВГС факторов, таких как сериновая протеаза NS3-4A, хеликаза или РНК-полимераза, или пролекарством данного ингибитора, противофиброзным средством, например производным N-фенил-2-пиримидинамина,например иматинибом, иммуномодулирующим средством, например микофеноловой кислотой, ее солью или пролекарством, например микофенолятом натрия или микофенолята мофетилом, или агонистом ре-8 020896 цептора S1P, например FTY720 или его факультативно фосфорилированным аналогом, например, как описано в ЕР 627406 А 1, ЕР 778263 А 1, ЕР 1002792 А 1, WO 02/18395, WO 02/76995, WO 02/06268,JP2002316985, WO 03/29184, WO 03/29205, WO 03/62252 и WO 03/62248, полное содержание которых включено в настоящее изобретение посредством ссылки. В конкретных вариантах реализации типичный интерферон, применяемый в настоящем изобретении, выбран из группы, состоящей из Интрона A (Intron A); Пегинтрона (PEG-Intron); Роферона (Roferon); Пегасиса (Pegasys); Берофора (Berofor); Sumiferon; Велферона (Wellferon); Инфергена(Infergen); Альферона (Alferon); Вираферона (Viraferon); Альбуферона (Albuferon) (Human Genome Science); Ребифа; Qmniferon; Омеги и их комбинаций. Подразумевается, что конъюгаты интерферона с водорастворимым полимером включают, главным образом, конъюгаты с гомополимерами на основе полиалкилен-оксида, такие как полиэтиленгликоль(ПЭГ) или полипропиленгликоли, полиоксиэтиленированные полиолы, их сополимеры и их блочные сополимеры. В качестве альтернативы полимерам на основе полиалкилен-оксида могут быть эффективно применены неантигеннные материалы, такие как декстран, поливинилпирролидоны, полиакриламиды,поливиниловые спирты, полимеры на основе углеводов и т.п. Подобные конъюгаты интерферона с полимером описаны в патентах США 4766106; 4917888, заявке на европейский патент 0236987, заявке на европейский патент 0510356 и международной публикации заявкиWO 95/13090. Поскольку полимерная модификация достаточно уменьшает антигенные ответы, нет нужды в том, чтобы чужеродный интерферон был полностью аутогенным. Интерферон, применяемый для получения полимерных конъюгатов, может быть получен из экстракта млекопитающих, например интерферон человека, жвачного животного или быка, или произведен рекомбинантным способом. Другие формы интерферонов включают интерферон-, -, - и -, такие как Ребиф (интерферон 1 а), приобретенный в Serono, Omniferon(природный интерферон), приобретенный в Viragen, или Омега Интерферон (Omega Interferon), приобретенный в Boehringer Ingelheim. Пероральные интерфероны, такие как пероральный интерферон-, приобретенный в Amarillo Biosciences. Предпочтительными являются конъюгаты интерферона с полиэтиленгликолем, также известные как пегилированные интерфероны. Особо предпочтительные конъюгаты интерферона представляют собой пегилированные интерфероны, например пегилированный интерферон 2 а, пегилированный интерферон 2b; пегилированный консенсус интерферон иди пегилированный очищенный продукт интерферона-. Пегилированный интерферон 2 а описан, например, в европейском патенте 593868 и коммерчески доступен,например, под торговой маркой Пегасис (PEGASYS) (Hoffmann-La Roche). Пегилированный интерферон 2b описан, например, в европейском патенте 975369 и коммерчески доступен, например, под торговой маркой Пегинтрон (PEG-INTRON A) (Schering Plough). Пегилированный консенсус интерферон описан в WO 96/11953 (полностью включен в настоящее изобретение посредством ссылки). Предпочтительные пегилированные -интерфероны представляют собой пегилированный интерферон 2 а и пегилированный интерферон 2b. Также предпочтительным является пегилированный консенсус интерферон. Суточные дозировки относительно применяемого сопутствующего средства будут варьироваться в зависимости от применяемого соединения, вида организма, способа применения и тяжести состояния,подлежащего лечению. Например, ламивудин может быть применен в суточной дозировке 100 мг. Пегилированный интерферон может быть введен парентерально от одного до трех раз в неделю,предпочтительно один раз в неделю, в общей недельной дозе, составляющей от 2 до 10 млн международных единиц (IU), более предпочтительно от 5 до 10 млн IU, наиболее предпочтительно от 8 до 10 млн IU. Данные значения могут соответствовать от 0,5 до 2,0 мкг/кг в неделю в расчете на еженедельный прием,прием три раза в неделю, прием через день или ежедневный прием. В других вариантах реализации интерферон- представляет собой пегилированный интерферон-2 а и количество применяемого пегилированного интерферона 2 а составляет от 20 до 250 мкг/кг в неделю в расчете на еженедельный прием, прием три раза в неделю, прием через день или ежедневный прием. Предпочтительно пегилированный интерферон 2 а (peg-IFN-2a) применяют в количестве 180 мкг один раз в неделю. Противовирусные средства, обычно применяемые для лечения ВГС, также включены в комбинацию согласно настоящему изобретению. Подобные средства включают соединения или биопрепараты,которые эффективно подавляют образование и/или репликацию вируса в организме млекопитающего. Указанные средства включают такие средства, как рибавирин (1-бета-D-рибофуранозил-1H-1,2,4 триазол-3-карбоксамид), приобретенный в Valeant Pharmaceuticals, Inc., Costa Mesa, CA, Ребетол (Rebetol), приобретенный в Schering-Plough Corporation, Kenilworth, NJ, и Копегус (Copegus), приобретенный в Hoffmann-La Roche, Nutley, NJ, аналоги рибавирина в стадии разработки, такие как Левовирин и Вирамидин, приобретенные в Valeant, и Мизорибина монофосфат. Кроме того, комбинация согласно настоящему изобретению может дополнительно включать применение ингибиторов протеаз, действие которых основано на субстратном ингибировании сериновой протеазы NS3-4A ВГС, ингибиторов протеазы NS3, действие которых не основано на субстратном ингибировании; фенантренхинонов, тиазолидинов и бензанилидов и т.п., которые, как показали, обладают активностью против инфекции, вызываемой ВГС. Ингибиторы протеазы для лечения ВГС предложены, например, в патенте США 6004933 (Spruce(Vertex Pharmaceuticals), полное содержание которых включено в настоящее изобретение посредством ссылки. В качестве примера могут быть применены ингибиторы протеазы NS3, действие которых не основано на субстратном ингибировании, такие как производные 2,4,6-тригидрокси-3-нитробензамида (SudoChemistry and Chemotherapy, 1998, 9, 186), включая RD3-4082 и RD3-4078. Дополнительные экспериментальные средства, которые, как было показано, являются эффективными в терапии ВГС, включают ингибиторы сериновой протеазы NS3-4 А ВГС BILN 2061, приобретенный в Boehringer Ingelheim, VX-950, приобретенный в Vertex, SCH-6, SCH-7 и SCH-351633, приобретенные вSchering-Plough, и другие ингибиторы протеазы ВГС в доклинической и клинической стадии разработки,приобретенные в GlaxoSmithKline, Bristol Myers Squibb, Abbot, Roche, Merck, Pfizer и Gilead. Дополнительные средства, которые находятся в настоящее время в клинической стадии разработки для лечения ВГС и которые могут быть применены в комбинации с изобретением, описанным в настоящем изобретении, включают ТМС 435350 (Tibotec) и ITM-191 (Intermune). Также могут быть применены аналоги нуклеозидов. Примером одного из таких аналогов является телбивудин, приобретенный в Idenix (US 6444652, US 6596700 и WO 0196353). Нуклеозидные или ненуклеозидные ингибиторы РНК-зависимой РНК-полимеразы NS5B ВГС, такие как 2'-С-метил-3'-О-Lвалиновый эфир рибофуранозилцитидина (NM283, Idenix), предложенный в WO 2004/002422, могут также быть применены. Разветвленные нуклеозиды, предложенные в WO 01/90121 и WO 01/92282 (Idenix Pharmaceuticals), могут также быть применены. Полное содержание данных международных заявок на патент включено в настоящее изобретение посредством ссылки. Дополнительные терапевтические соединения могут включать антисмысловые молекулы, направленные против генома ВГС, или антисмысловую последовательность, комплементарную любой из частей генома ВГС, которая повышает эффективность терапии. Также предусмотрены ингибиторы других мишеней в жизненном цикле ВГС, такие как Celgosivir(MBI 3253), ингибитор процессинга гликопротеина, приобретенный в Migenix, ингибитор слияния, приобретенный в Trimeris, ACH-0137171, приобретенный в Achillion. Агонисты рецептора, такие как агонисты Toll-подобного рецептора ("TLR"), включают ANA245, ANA971, ANA975 (US 5041426, 4880784) от(EMPDH), микофеноловую кислоту, ее соль или пролекарство микофенолят натрия или микофенолята мофетил, или Merimebodib (VX-497, приобретенный в Vertex); тимозин -1 (Задаксин или его комбинация, приобретенный в SciClone); SCV-07 (SciClone), Belerofon (улучшенный интерферон- (IFN-), приобретенный в Nautilus); CIVACIR (иммуноглобулин против гепатита С), приобретенный в NABI, или агонист рецептора S1P, например FTY720 или его факультативно фосфорилированный аналог, например,предложенный в ЕР 627406 А 1, ЕР 778263 А 1, ЕР 1002792 А 1, WO 02/18395, WO 02/76995, WO 02/06268,JP2002316985, WO 03/29184, WO 03/29205, WO 03/62252 и WO 03/62248, полные описания которых включены в настоящее изобретение посредством ссылки; Резиквимод [VML 600], приобретенный в 3 МPharmaceuticals, аналог имиквимода, являющийся мощным индуктором интерферона- и других цитокинов. Кроме того, соединения согласно настоящему изобретению могут быть применены в комбинации с Интерлейкином-10 (Shering-Plough), амантадином (Symmetrel), приобретенным в Endo Labs Solvay, ингибитором каспазы IDN-6556, приобретенным в Idun Pharma, ВГС/MF59, приобретенным в Chiron, CEPLENE (гистамина дихлорид), приобретенным в Maxim, IDN-6556, приобретенным в Idun PHARM, T67,ингибитором бета-тубулина, приобретенным в Tularik, FK788, приобретенным в Fujisawa Healthcare, IdBI 016 (Siliphos, пероральная фитосома, содержащая комплекс силибин-фосфатидилхолин), Dication, приобретенным в Immtech, очистителем крови, приобретенным в Aethlon Medical, UT 231 В, приобретенным вRefanalin (миметик фактора роста гепатоцитов (HGF, приобретенным в Angion, R803 (Rigel), JTK-003,JTK-002 и JTK-109 (все приобретенные в Japan Tobacco), ВГС-086 (ViroPharma/Wyeth), ISIS-14803 (ISIS(Pharmasset and Roche), R1626 (Roche). Другие представляющие интерес соединения включают Ursodiol (EP 00269516, Axcan Pharma), НЕ 2000 (аналог дегидроэпиандростерона (DHEA), Colthurst Ltd), EHC-18 (иммуномодулятор, Enzo нитазоксанид (Romark), 1-аминоалкилциклогексаны (патент США 6034134), алкиллипиды (патент США 5922757), витамин Е и другие антиоксиданты (патент США 5922757), желчные кислоты (патент США 5846964), N-(фосфоноацетил)-L-аспарагиновую кислоту (патент США 5830905), бензолдикарбоксамиды (патент США 5633388), производные полиадениловой кислоты (патент США 5496546), 2',3'-дидезоксиинозин (патент США 5026687), бензимидазолы (патент США 5891874),экстракты растений (патент США 5837257; патент США 5725859 и патент США 6056961) и пиперидины (патент США 5830905); N-(фосфоноацетил)-L-аспарагиновую кислоту, бензолдикарбоксамиды, производные полиадениловой кислоты, ингибиторы гликозилирования и неспецифические цитопротективные средства, которые препятствуют повреждению клетки, вызываемому вирусной инфекцией. Соединения согласно изобретению могут также быть применены в комбинации с вакциной или основанными на применении антител подходами к лечению ВГС. Терапевтические вакцины включают вакцины, приобретенные в Intercell (Терапевтическая пептидная вакцина IC41 ВГС), Epimmune/Genecor,Merix, Tripep (Chiron-VacC), иммунотерапию (Therapore), приобретенную в Avant, Т-клеточную терапию,приобретенную в CellExSys, моноклональные антитела XTL-002, приобретенные в STL, ANA 246 и ANA 246, приобретенные в Anadys, терапевтическую вакцину, направленную на белок оболочки Е 2, приобретенную в Innogenetics, моноклональные антитела (mAb) против белка оболочки Е 2, приобретенные вXTL Bio, GI-5005 (GlobeImmune Inc.), InnoVac-C (WO 9967285, Innogenetics), IC-41 (Intercell), интерферонn3 (Interferon Sciences). В соответствии с вышесказанным, согласно настоящему изобретению предложен другой дополнительный аспект, фармацевтическая комбинация, содержащая, по меньшей мере, а) первое средство, состоящее из соединения согласно изобретению, или фармацевтическую композицию согласно настоящему изобретению и b) второе средство, обладающее способностью противодействовать репликации ВГС. В частности, данная фармацевтическая комбинация предназначена для применения в предотвращении или лечении инфекций, вызываемых вирусом гепатита С, или расстройств, вызываемых ВГС. Также настоящее изобретение включает способ предотвращения или лечения инфекций, вызываемых вирусом гепатита С, или вызываемых ВГС расстройств у нуждающегося в этом субъекта, включающий введение указанному субъекту терапевтически эффективного количества соединения согласно изобретению или фармацевтической композиции согласно изобретению. Кроме того, предложен способ подавления репликации ВГС у нуждающегося в этом пациента,включающий введение указанному субъекту терапевтически эффективного количества соединения согласно изобретению или фармацевтической композиции согласно изобретению. Другой задачей изобретения является способ, включающий совместное введение, одновременно или последовательно, терапевтически эффективного количества соединения согласно изобретению или фармацевтической композиции согласно изобретению и сопутствующего средства, выбранного из средств, обладающих свойствами действовать против ВГС. Термины "совместное введение" или "комбинированное введение" или подобные им, используемые в настоящем изобретении, обозначают применение выбранных терапевтических средств к отдельному пациенту и включают схему лечения, в которой средства не обязательно применяют одним и тем же способом применения или в одно и то же время. Введение фармацевтической комбинации согласно изобретению приводит к полезному эффекту,например синергическому терапевтическому эффекту, по сравнению с монотерпией, в случае которой применяют только одну из ее фармацевтически активных составляющих. Предпочтительной синергической комбинацией является комбинация циклоундекадепсипептидного соединения согласно изобретению с интерфероном, факультативно соединенная с полимером. Дополнительная предпочтительная комбинация представляет собой комбинацию соединений формулы (I) согласно изобретению с микофеноловой кислотой, ее солью или пролекарством или с агонистом рецептора S1P, например FTY720. Полное содержание всех патентов, заявок на патент и публикаций, приведенных в настоящем изобретении, включено в настоящее изобретение посредством ссылки. Специалисты в данной области техники примут во внимание, что изобретение, описанное в настоящем изобретении, подлежит изменениям и модификациям, отличным от тех, которые конкретно описаны. Следует понимать, что изобретение включает все подобные изменения и модификации без отклонения от его сущности или основных характеристик. Изобретение также включает все стадии, особенности, композиции и соединения, названные или обозначенные в данном описании, индивидуально или совместно, и любую и все комбинации или любые две или более указанных стадий или особенностей. Таким образом, следует считать, что настоящее описание во всех его аспектах является иллюстративным и не ограничивающим, причем объем изобретения определен прилагаемой формулой изобретения и любые изменения, которые могут быть внесены в пределах сущности и которые являются эквивалентными, считаются включенными в настоящее изобретение. В данном описании приведены различные ссылочные материалы, полное содержание каждого из которых включено в настоящее изобретение посредством ссылки. Для более полного понимания вышеприведенное описание ссылается на следующие примеры. Дан- 11020896 ные примеры, однако, приведены для пояснения способов применения настоящего изобретения и не ограничивают объем изобретения. Примеры Пример 1 а. Получение циклоундекадепсипептида (Ia): цикло-(MeBmt-Abu-D-MeAla-MeVal-Leu-MeLeu-Gly-DHiv-MeLeu-Leu-MeVal) (Ia). 1. Получение фрагмента (Аа), начиная с природного циклоундекадепсипептида: цикло-(MeBmt-ThrSar-MeLeu-Leu-MeLeu-Ala-D-Hiv-MeLeu-Leu-MeVal) (см. US 5116816, пример 2 или в WO 02/092033,пример 4, стадия 4-1): H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-OH (Аа). 1.1. Вариант А. Получение цикло-(MeBmt-Thr-(O-(N-имидазолил)карбонил)Sar-MeLeu-Leu-MeLeu-Ala-D-HivMeLeu-Leu-MeVal) (1A). Раствор цикло-(MeBmt-Thr-Sar-MeLeu-Leu-MeLeu-Ala-D-Hiv-MeLeu-Leu-MeVal) (3,00 г, 2,40 ммоль, 1,0 экв.) (US 5116816, пример 2, или в WO 02/092033, пример 4, стадия 4-1) и 1,1'карбонилдиимидазола (1,17 г, 7,21 ммоль, 3,0 экв.) в 15 мл безводного CH2Cl2 перемешивали при комнатной температуре в течение 2,5 ч. Протекание реакции контролировали с помощью аналитической сверхпроизводительной жидкостной хроматографии (СПЖХ, UPLC). Степень превращения составляла 81,1%. Добавляли дополнительное количество 1,1'-карбонилдиимидазола (0,39 г, 2,40 ммоль, 1,0 экв.) в реакционную смесь. После дополнительного перемешивания в течение 16 ч степень превращения составляла 98,8%. Раствор упаривали при пониженном давлении. Остаток растворяли в AcOEt (45 мл) и промывали последовательно 10%-ной лимонной кислотой (45 мл) и раствором соли (45 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением смеси двух соединений (1 А) и (2 А) в виде белого порошка. СПЖХ-ИЭР-MS (m/z): (1A): 1342,75 [M+H]+ ([C68H117N12O15]+; выч. 1342,73), (2 А): 1274,77 [M+H]+(2A). Раствор соединения (1 А), полученного с помощью предыдущей реакции (3,41 г, 2,40 ммоль) в сухом ДМСО (15 мл), перемешивали и нагревали при 100C в течение 2 ч в атмосфере аргона. Протекание реакции контролировали с помощью аналитической СПЖХ. Достигали полного превращения. Далее смесь растворяли в AcOEt (45 мл) и промывали последовательно 1 М HCl (30 мл) и 23,2%-ным водным раствором NaCl (15 мл), затем 11,6%-ным водным раствором NaCl (45 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением циклоундекадепсипептида цикло-(MeBmt-Thr(O,N-карбонил)-Sar-MeLeu-Leu-MeLeu-Ala-D-Hiv-MeLeu-Leu-MeVal) (2A) в виде белого порошка. СПЖХ-ИЭР-МС (m/z): 1274,65 [M+H]+ ([C65H113N10O15]+; выч. 1274,65). Получение H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-OMe (метиловый эфир фрагмента Аа) (3 А). К раствору циклодепсипептида, полученного с помощью предыдущей реакции, (1,00 г, 0,78 ммоль) в 30 мл МеОН (сухого), охлажденному до 0 С, добавляли одной порцией Са(ОМе)2 (0,24 г, 2,35 ммоль) в атмосфере аргона. Контроль полноты протекания реакции с помощью СПЖХ через 5 ч при 0 С и затем через 1 ч при комнатной температуре показал 98,6% превращения. Раствор охлаждали до 0 С и затем нейтрализовали водным раствором 10%-ной лимонной кислоты. Метанол упаривали. Водную смесь приливали к 100 мл смеси AcOEt/NaCl 23,2% (1:1 об./об.). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью колоночной хроматографии с получением пентапептида H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-OMe (3 А). СПЖХ-ИЭРМС (m/z): 669,16 [M+H]+ ([C35H65N4O8]+; выч. 669,48). Получение фрагмента (Аа) H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-OH (4). Раствор пентапептида (1,15 г, 1,72 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции(3 А) в ТГФ (8,6 мл) и воде (1,1 мл), охлаждали до 0 С в водно-ледяной бане, затем добавляли в течение 20 с 2 М LiOH (1,72 мл, 3,44 ммоль, 2,0 экв.). Охлаждающую баню затем удаляли и смесь (pH 12-13) перемешивали при комнатной температуре в течение примерно 3 ч. Контроль полноты протекания реакции с помощью СПЖХ показал полное превращение. Далее раствор охлаждали до 0 С и нейтрализовали 10%-ной лимонной кислотой. Тетрагидрофуран упаривали при пониженном давлении. Остаток растворяли в AcOEt (50 мл) и промывали 10%-ной лимонной кислотой (3 мл) и 23,2%-ным водным растворомNaCl (50 мл) (pH 3). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении с получением фрагмента (Аа) H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-OH (4) в виде белого порошка. СПЖХ-ИЭР-МС (m/z) 655,21 [M+H]+ ([C34H63N4O8]+; выч. 655,46). 1.2. Вариант В. Получение H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-Thr-Sar-MeLeu-Leu-MeLeu-Ala-OMe. К раствору природного цикло-(MeBmt-Thr-Sar-MeLeu-Leu-MeLeu-Ala-D-Hiv-MeLeu-Leu-MeVal)(3,0 г, 2,40 ммоль) (полученного согласно или US 5116816, пример 2 или WO 02/092033, пример 4, стадия 4-1) в сухом МеОН (90 мл), охлажденному до 0 С, добавляли в атмосфере аргона MeONa (0,519 г, 9,6 ммоль, 4,0 экв.). Контроль полноты протекания реакции с помощью ВЭЖХ через 1 ч при 0 С и затем через 2 ч при комнатной температуре показывает ее завершение. Раствор охлаждали до 0 С, затем нейтрализовали (pH 5-6) водным раствором 10%-ной лимонной кислоты. Метанол упаривали. Водную смесь выливали в 150 мл этилацетата. Органический слой промывали водой (20 мл) и раствором соли (20 мл) и сушили над MgSO4, фильтровали. Упаривание раствора под вакуумом и флэш-хроматография на силикагеле привели к получению чистого H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-Thr-Sar-MeLeu-Leu-MeLeu-AlaOMe. Получение Н-D-Hiv(O-(N-имидазолил)карбонил)-MeLeu-Leu-MeVal-MeBmt-Thr(O-(Nимидазолил)карбонил)-Sar-MeLeu-Leu-MeLeu-Ala-ОМе (1 В). Раствор ундекапептида (2,96 г, 2,31 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции,и 1,1'-карбонилдиимидазола (1,50 г, 9,25 ммоль, 4,0 экв.) в 53 мл безводного CH2Cl2 перемешивали при комнатной температуре в течение 22 ч. Протекание реакции контролировали с помощью аналитической ВЭЖХ и ТСХ. Раствор упаривали при пониженном давлении. Остаток растворяли в 150 мл этилацетата и промывали последовательно 10%-ной лимонной кислотой (30 мл), водой (30 мл) и раствором соли (30 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенный продукт очищали с помощью флэш-хроматографии с получением Н-D-Hiv(О-(Nимидазолил)карбонил)-MeLeu-Leu-MeVal-MeBmt-Thr(O-(N-имидазолил)карбонил)-Sar-MeLeu-LeuMeLeu-Ala-ОМе (1 В) в виде белого порошка. Получение Н-D-Hiv(O-(N-имидазолил)карбонил)-MeLeu-Leu-MeVal-MeBmt-Thr(O,N-карбонил)Sar-MeLeu-Leu-MeLeu-Ala-Оме (2 В). Раствор ундекапептида (3,26 г, 2,22 ммоль), полученного с помощью предыдущей реакции, в сухом ДМСО (40 мл) перемешивали и нагревали при 100C в течение 3,5 ч в атмосфере аргона. Протекание реакции контролировали с помощью ТСХ и аналитической ВЭЖХ. Далее смесь растворяли в AcOEt (200 мл) и промывали последовательно водным раствором 10%-ной лимонной кислоты (2 раза, 30 мл), H2O(130 мл) и насыщенным водным раствором NaCl (130 мл). Органическую фазу сушили над Na2SO4,фильтровали и упаривали при пониженном давлении. Неочищенный продукт очищали с помощью флэшхроматографии. Остаток после упаривания растворителей сушили в высоком вакууме с получением ундекапептидаH-D-Hiv(O-(N-имидазолил)карбонил)-MeLeu-Leu-MeVal-MeBmt-Thr(O,N-карбонил)-SarMeLeu-Leu-MeLeu-Ala-OMe (2B) в виде белого порошка. Получение H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-OMe (3 В). К раствору ундекапептида (2 В) (3,05 г, 2,17 ммоль), полученного с помощью предыдущей реакции,в 100 мл МеОН (сухого), охлажденному до 0 С, добавляли одной порцией MeOK (0,456 г, 6,53 ммоль) в атмосфере аргона. Контроль полноты протекания реакции с помощью ВЭЖХ через 1 ч при 0 С и затем 1 ч при комнатной температуре показал ее завершение. Раствор охлаждали до 0 С и затем нейтрализовали водным раствором 10%-ной лимонной кислоты. Метанол упаривали. Водную смесь выливали в 100 мл смеси AcOEt/H2O (1:1 об./об.). Органический слой промывали H2O (110 мл) и раствором соли (110 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью препаративной ВЭЖХ с получением пентапептида H-D-Hiv-MeLeuLeu-MeVal-MeBmt-ОМе (3 В). Получение H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-OH (4, фрагмент Аа). Раствор пентапептида (1,265 г, 1,88 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции,в ТГФ (18,8 мл) охлаждали до 0 С в водно-ледяной бане, затем добавляли по каплям в течение 20 мин 0,2 М LiOH (18,8 мл, 3,66 ммоль, 2,0 экв.). Охлаждающую баню затем удаляли и смесь (pH 12-13) перемешивали при комнатной температуре в течение примерно 2,5 ч (контроль ТСХ). Далее раствор охлаждали до 0 С и нейтрализовали 0,1 М HCl (pH 2-3). Тетрагидрофуран упаривали при пониженном давлении. Остаток растворяли в AcOEt (100 мл) и промывали 10%-ной лимонной кислотой (120 мл), H2O (120 мл) и раствором соли (120 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью колоночной хроматографии (СС) с получением пентапептида (натриевой соли) H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-ONa в виде белого порошка. HR-MALDI-MC: 677,46 [M+H]+ ([C34H62N4NaO8]+; выч. 677,4465). 2. Получение фрагмента (Ва): H-Abu-D-MeAla-MeVal-Leu-MeLeu-Gly-OMe (Ва). 2.1. Получение Boc-MeLeu-Gly-OMe. К раствору коммерчески доступного H-Gly-OMeHCl (4,0 г, 31,8 ммоль, 1,0 экв.) в сухом ДХМ (240 мл), охлажденному до 0 С, добавляли в атмосфере аргона DIPEA (32,88 мл, 189,0 ммоль, 6,0 экв.). Далее,через 15 мин добавляли одной порцией HATU (15,72 г, 41,34 ммоль, 1,3 экв.) и Boc-MeLeu-OH (7,8 г,31,8 ммоль, 1,0 экв.). Контроль полноты протекания реакции с помощью ТСХ через 15 мин при 0 С и затем 22,45 ч при комнатной температуре показал ее завершение. Реакцию останавливали добавлением 10%-ного NaHCO3 (40 мл) и перемешивали в течение 15 мин. Реакционную смесь разбавляли ДХМ (400 мл) и промывали 10%-ной лимонной кислотой (180 мл), H2O (180 мл) и раствором соли (180 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с получением сложного эфира Boc-MeLeu-Gly-OMe в виде белой маслянистой пены. СПЖХ-ИЭР-МС (m/z) 339,0234 [M+Na]+ ([C15H28N2NaO5]+; выч. 339,1896). 2.2. Получение H-MeLeu-Gly-OMe. Раствор дипептида (9,9 г, 31,29 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в ТФУ/ДХМ (30 мл, 2:3 об./об.) выдерживали в течение 45 мин при 0 С и 2 ч при комнатной температуре и растворители удаляли при пониженном давлении. Неочищенный продукт сушили в высоком вакууме (20 мин). Далее добавляли ДХМ (60 мл) и смесь растирали при 0 С с DIPEA (2,0 мл) до pH 7-8 для нейтрализации избытка ТФУ. После упаривания и высушивания неочищенную аминную соль дипептида НMeLeu-Gly-OMe применяли для следующей стадии сочетания без дополнительной очистки. СПЖХ-ИЭРМС (m/z) 217,0546 [M+H]+ ([C10H21N2O3]+; выч. 217,1552). 2.3. Получение Boc-Leu-MeLeu-Gly-OMe. К раствору дипептида (3,38 г, 15,63 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции,в сухом ДХМ (160 мл), охлажденному до 0 С, добавляли в атмосфере аргона DIPEA (8,08 мл, 46,89 ммоль, 3,0 экв.). Далее, через 10 мин добавляли одной порцией HATU (7,72 г, 20,14 ммоль, 1,3 экв.) иBoc-Leu-OH (3,98 г, 17,19 ммоль, 1,1 экв.). Контроль полноты протекания реакции с помощью ТСХ через 15 мин при 0 С и затем 15,45 ч при комнатной температуре показал ее завершение. Реакцию останавливали добавлением 10%-ного NaHCO3 (36 мл) и перемешивали в течение 15 мин. Реакционную смесь разбавляли ДХМ (240 мл) и промывали 10%-ной лимонной кислотой (160 мл), Н 2 О (160 мл) и раствором соли (160 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью СС с получением сложного эфира Boc-Leu-MeLeuGly-OMe в виде желтоватого масла. СПЖХ-ИЭР-МС (m/z) 430,0120 [M+H]+ ([C21H40N3O6]+; выч. 430,2917). 2.4. Получение H-Leu-MeLeu-Gly-OMe. Раствор трипептида (3,0 г, 6,98 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в ТФУ/ДХМ (12 мл, 1:1 об./об.) выдерживали в течение 1 ч при 0 С и 2 ч при комнатной температуре и растворители удаляли при пониженном давлении. Неочищенный продукт сушили в высоком вакууме (15 мин). Далее добавляли ДХМ (20 мл) и смесь растирали при 0 С с DIPEA до pH 7-8 для нейтрализации избытка ТФУ. После упаривания и высушивания неочищенную аминную соль H-Leu-MeLeu-Gly-OMe применяли для следующей стадии сочетания без дополнительной очистки. СПЖХ-ИЭР-МС (m/z) 330,0227 [M+H]+ ([C16H32N3O4]+; выч. 330,2393); 352,0016 [M+Na]+ ([C16H31N3NaO4]+; выч. 352,4248); 659,1626 [2 М+Н]+ ([C32H63N6O8]+; выч. 659,1626). 2.5. Получение Boc-MeVal-Leu-MeLeu-Gly-OMe. К раствору трипептида (2,3 г, 6,98 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в сухом ДХМ (105 мл), охлажденному до 0 С, добавляли в атмосфере аргона DIPEA (3,61 мл, 20,34 ммоль,3,0 экв.). Далее, через 10 минут добавляли одной порцией HATU (3,45 г, 9,07 ммоль, 1,3 экв.) и BocMeVal-OH (1,78 г, 7,68 ммоль, 1,1 экв.). Контроль полноты протекания реакции с помощью ТСХ через 15 мин при 0 С и затем 15,45 ч при комнатной температуре показал ее завершение. Реакцию останавливали добавлением 10%-ного NaHCO3 (25 мл) и перемешивали в течение 15 мин. Реакционную смесь разбавляли ДХМ (150 мл) и промывали 10%-ной лимонной кислотой (150 мл), H2O (150 мл) и раствором соли(150 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с получением сложного эфира Boc-MeVal-Leu-MeLeu-Gly-OMe в виде желтоватого масла. СПЖХ-ИЭР-МС (m/z) 543,0484 [M+H]+ ([C27H51N4O7]+ выч. 543,3758); 565,0467[М+Na]+ ([C27H50N4NaO7]+; выч. 565,3577). 2.6. Получение H-MeVal-Leu-MeLeu-Gly-OMe. Раствор тетрапептида (3,56 г, 6,56 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в ТФУ/ДХМ (12 мл, 1:1 об./об.) выдерживали в течение 1 ч при 0 С и 2 ч при комнатной температуре и удаляли растворители при пониженном давлении. Неочищенный продукт сушили в высоком вакууме(примерно 15 мин). Далее добавляли ДХМ (45 мл) и смесь растирали при 0 С с DIPEA до pH 7-8 для нейтрализации избытка ТФУ. После упаривания и высушивания неочищенную аминную соль тетрапептида Н-MeVal-Leu-MeLeu-Gly-OMe применяли для следующей стадии сочетания без дополнительной очистки. СПЖХ-ИЭР-МС (m/z) 443,0694 [M+H]+ ([C22H43N4O5]+; выч. 443,3233); 465,0063 [М+Na]+([C22H42N4NaO5]+; выч. 465,3053). 2.7. Получение Boc-D-MeAla-MeVal-Leu-MeLeu-Gly-OMe. К раствору тетрапептида (2,90 г, 6,56 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в сухом ДХМ (110 мл), охлажденному до 0 С, добавляли в атмосфере аргона DIPEA (3,39 мл, 19,68 ммоль, 3,0 экв.). Далее, через 10 мин добавляли одной порцией HATU (3,24 г, 8,53 ммоль, 1,3 экв.) и BocD-MeAla-OH (1,46 г, 7,21 ммоль, 1,1 экв.). Контроль полноты протекания реакции с помощью ТСХ через 15 мин при 0 С и затем 17,45 ч при комнатной температуре показал ее завершение. Реакцию останавливали добавлением 10%-ного NaHCO3 (25 мл) и перемешивали в течение 15 мин. Реакционную смесь разбавляли ДХМ (150 мл) и промывали 10%-ной лимонной кислотой (150 мл), H2O (150 мл) и раствором соли (150 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью СС с получением сложного эфира Boc-D-MeAla- 14020896([C31H57N5NaO8]+; выч. 650,4105). 2.8. Получение H-D-MeAla-MeVal-Leu-MeLeu-Gly-OMe. Раствор пентапептида (1,6 г, 2,55 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в ТФУ/ДХМ (6 мл, 1:1 об./об.) выдерживали в течение 1 ч при 0 С и 2 ч при комнатной температуре и растворители удаляли при пониженном давлении. Неочищенный продукт сушили в высоком вакууме (примерно 15 мин). Далее добавляли ДХМ (20 мл) и смесь растирали при 0 С с DIPEA до pH 7-8 для нейтрализации избытка ТФУ. После упаривания и высушивания неочищенную аминную соль пентапептида HD-MeAla-MeVal-Leu-MeLeu-Gly-OMe применяли для следующей стадии сочетания без дополнительной очистки. СПЖХ-ИЭР-МС (m/z) 528,49 [M+H]+ ([C26H50N5O6]+; выч. 528,3761). 2.9. Получение Boc-Abu-D-MeAla-MeVal-Leu-MeLeu-Gly-OMe. К раствору пентапептида (1,33 г, 2,52 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в сухом ДХМ (60 мл), охлажденному до 0 С, добавляли в атмосфере аргона DIPEA (1,30 мл, 7,56 ммоль, 3,0 экв.). Далее, через 10 мин добавляли одной порцией HATU (1,25 г, 3,28 ммоль, 1,3 экв.) и BocAbu-OH (0,56 г, 2,77 ммоль, 1,1 экв.). Контроль полноты протекания реакции с помощью ТСХ через 15 мин при 0 С и затем в течение ночи при комнатной температуре показал ее завершение. Реакцию останавливали добавлением 10%-ного NaHCO3 (15 мл) и перемешивали в течение 15 мин. Реакционную смесь разбавляли ДХМ (100 мл) и промывали 10%-ной лимонной кислотой (140 мл), H2O (140 мл) и раствором соли (140 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью СС с получением сложного эфира BocAbu-D-MeAla-MeVal-Leu-MeLeu-Gly-ОМе в виде желтоватой пены. СПЖХ-ИЭР-МС (m/z) 713,1513 [M+H]+ ([C35H65N6O9]+; выч. 713,4813); 735,1010 [М+Na]+([C35H64N6NaO9]+; выч. 735,4632). 2.10. Получение H-Abu-D-MeAla-MeVal-Leu-MeLeu-Gly-OMe (Ва). Раствор гексапептида (0,82 г, 1,15 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в ТФУ/ДХМ (6 мл, 1:1 об./об.) выдерживали в течение 1 ч при 0 С и 1 ч при комнатной температуре и растворители удаляли при пониженном давлении. Неочищенный продукт сушили в высоком вакууме (примерно 15 мин). Далее добавляли ДХМ (25 мл) и смесь растирали при 0 С с DIPEA до pH 7-8 для нейтрализации избытка ТФУ. После упаривания и высушивания неочищенную аминную соль гексапептида НAbu-D-MeAla-MeVal-Leu-MeLeu-Gly-OMe применяли для следующей стадии сочетания без дополнительной очистки. СПЖХ-ИЭР-МС (m/z) 613,1925 [M+H]+ ([C30H57N6O7]+; выч. 613,4289). 3. Сочетание фрагмента (Аа) и фрагмента (Ва). 3.1. Получение D-Hiv-MeLeu-Leu-MeVal-MeBmt-Abu-D-MeAla-MeVal-Leu-MeLeu-Gly-OMe. К раствору гексапептида H-Abu-D-MeAla-MeVal-Leu-MeLeu-Gly-OMe (0,7 г, 1,14 ммоль, 1,0 экв.),полученного с помощью предыдущей реакции, в сухом ДХМ (33 мл), охлажденному до 0 С, добавляли в атмосфере аргона DIPEA (0,59 мл, 3,42 ммоль, 3,0 экв.). Далее, через 10 мин добавляли одной порциейHATU (0,56 г, 1,48 ммоль, 1,3 экв.) и пентапептид H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-OH (0,75 г, 1,14 ммоль, 1,0 экв.). Контроль полноты протекания реакции с помощью ТСХ через 15 мин при 0 С и затем 16,45 ч при комнатной температуре показал ее завершение. Реакцию останавливали добавлением 10%ного NaHCO3 (10 мл) и перемешивали в течение 15 мин. Реакционную смесь разбавляли ДХМ (130 мл) и промывали 10%-ной лимонной кислотой (135 мл), H2O (135 мл) и раствором соли (135 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенный продукт очищали с помощью СС с получением ундекапептида D-Hiv-MeLeu-Leu-MeVal-MeBmt-Abu-DMeAla-MeVal-Leu-MeLeu-Gly-OMe в виде белой пены. СПЖХ-ИЭР-МС (m/z) 625,6903 [М/2+Н]+ ([C32H59N5O7]+; выч. 625,4415); 1249,7793 [М+H]+([C64H117N10O14]+; выч. 1249,8751). 3.2. Получение D-Hiv-MeLeu-Leu-MeVal-MeBmt-Abu-D-MeAla-MeVal-Leu-MeLeu-Gly-OH. Раствор ундекадепсипептида (1,30 г, 1,04 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в ТГФ (10,4 мл) охлаждали до 0 С в водно-ледяной бане, затем добавляли по каплям в течение 10 мин 0,2 М LiOH (10,4 мл, 2,08 ммоль, 2,0 экв.). Охлаждающую баню оставляли и смесь (pH 12-13) перемешивали при 0 С в течение примерно 20 и 30 мин при комнатной температуре (контроль ТСХ). Далее раствор охлаждали до 0 С и нейтрализовали водным раствором 10%-ной лимонной кислоты (pH 3-4). Раствор упаривали при пониженном давлении. Остаток растворяли в AcOEt (140 мл) и промывали H2O(130 мл) и раствором соли (130 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенный продукт очищали с помощью СС с получением ундекапептидаMeLeu-Leu-MeVal) (Ia). К раствору DMAP (0,507 г, 4,144 ммоль, 4,0 экв.) и бензотриазол-1-илокситрипирролидинфосфония гексафторфосфата (РуВОР) (1,078 г, 2,071 ммоль, 2,0 экв.) в ДХМ (128 мл) добавляли по каплям в течение 2 ч раствор в ДХМ (20 мл) ундекадепсипептидной кислоты, полученной с помощью предыдущей реакции (1,28 г, 1,036 ммоль, 1,0 экв.). Смесь перемешивали в течение ночи (22 ч) после завершения добавления кислоты; затем смесь переносили в делительную воронку. Общее время реакции равно 24 ч. Раствор промывали 0,1 М HCl (20 мл) и органический слой отделяли и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью СС, таким образом получая циклоундекадепсипептид цикло-(MeBmt-Abu-D-MeAla-MeVal-Leu-MeLeu-Gly-D-HivMeLeu-Leu-MeVal) (Ia) в виде белого твердого остатка. Далее полученное соединение очищали повторно с помощью препаративной ВЭЖХ (с получением цикло-(MeBmt:-Abu-D-MeAla-MeVal-Leu-MeLeu-GlyD-Hiv-MeLeu-Leu-MeVal) в виде белого порошка. Чистота 99,38% (80C, 30 мин). (C63H112N10O13,MW=1217,6226 г/моль). СПЖХ (40C, ACQUITY СПЖХ ВЕН С 18 1,7 мкм, 214 нм 5095%, 7 мин), tR=2,923 мин. СПЖХ. Общий выход при получении ундекадепсипептида цикло-(MeBmt-Abu-D-MeAla-MeVal-Leu-MeLeuGly-D-Hiv-MeLeu-Leu-MeVal), начиная с природного ундекадепсипептида цикло-(MeBmt-Thr-SarMeLeu-Leu-MeLeu-Ala-D-Hiv-MeLeu-Leu-MeVal), составляет более 50%. Пример 1b. Соединения (Ic)-(Ik) могут быть получены с помощью последовательности реакций, аналогичной приведенной в примере 1 а. Пример 2. Получение циклоундекадепсипептида (Ib): цикло-(MeBmt-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-DHiv-MeLeu-Leu-MeVal) (Ib). 2. Получение фрагмента (Bb): H-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe (Bb). 2.1. Получение Boc-MeLeu-Ala-OMe. К раствору коммерчески доступного Н-Ala-ОМеHCl (2,00 г, 14,32 ммоль, 1,0 экв.) в сухом ДХМ(130 мл), охлажденному до 0 С, добавляли в атмосфере аргона DIPEA (14,68 мл, 86,0 ммоль, 6,0 экв.). Далее, через 15 мин добавляли одной порцией HATU (6,52 г, 17,18 ммоль, 1,2 экв.) и Boc-MeLeu-OH(3,512 г, 14,32 ммоль, 1,0 экв.). Контроль полноты протекания реакции с помощью ТСХ через 15 мин при 0 С и затем 48 ч при комнатной температуре (RT=2 дня 15 мин) показал ее завершение. Реакцию останавливали добавлением 10%-ного NaHCO3 (20 мл) и перемешивали в течение 15 мин. Реакционную смесь разбавляли ДХМ (200 мл) и промывали 10%-ной лимонной кислотой (140 мл), H2O (140 мл) и раствором соли (140 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью СС с получением сложного эфира BocMeLeu-Ala-OMe в виде бледного желтоватого масла. Образец (30 мг) очищали повторно с помощью полупрепаративной обращенно-фазовой ВЭЖХ (ОФ-ВЭЖХ, RP-HPLC) и лиофилизировали пептид с получением сложного эфира Boc-MeLeu-Ala-OMe в виде белого порошка. 2.2. Получение H-MeLeu-Ala-OMe. Раствор дипептида (1,70 г, 5,14 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в ТФУ/ДХМ (10 мл, 2:3 об./об.) выдерживали при 0 С в течение 1,5 ч и растворители удаляли при пониженном давлении. Неочищенный продукт сушили в высоком вакууме (20 мин). Далее добавляли ДХМ(10 мл) и смесь растирали при 0 С с DIPEA до pH 7-8 для нейтрализации избытка ТФУ. Далее реакционную смесь разбавляли ДХМ (60 мл) и промывали H2O (110 мл) и раствором соли (110 мл). Органическую фазу фильтровали, сушили (Na2SO4), упаривали и сушили в высоком вакууме. Неочищенную аминную соль H-MeLeu-Ala-OMe применяли для следующей стадии сочетания без дополнительной очистки. 2.3. Получение Boc-Leu-MeLeu-Ala-OMe. К раствору дипептида (2,17 г, 9,42 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции(7), в сухом ДХМ (108 мл), охлажденному до 0 С, добавляли в атмосфере аргона DIPEA (6,45 мл, 37,68 ммоль, 4,0 экв.). Далее, через 10 мин добавляли одной порцией HATU (4,65 г, 12,25 ммоль, 1,3 экв.) иBoc-Leu-OH (2,39 г, 10,63 ммоль, 1,1 экв.). Контроль полноты протекания реакции с помощью ТСХ через 15 мин при 0 С и затем 15 ч при комнатной температуре (15 ч 15 мин) показал ее завершение. Реакцию останавливали добавлением 10%-ного NaHCO3 (10 мл) и перемешивали в течение 15 мин. Реакционную смесь разбавляли ДХМ (50 мл) и промывали 10%-ной лимонной кислотой (120 мл), H2O (120 мл) и раствором соли (120 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью СС с получением трипептида Boc-LeuMeLeu-Ala-OMe в виде желтоватого масла. Образец очищали повторно с помощью полупрепаративной ОФ-ВЭЖХ и лиофилизировали пептид с получением трипептида Boc-Leu-MeLeu-Ala-OMe в виде белого порошка. 2.4. Получение H-Leu-MeLeu-Ala-OMe. Раствор трипептида (2,00 г, 4,50 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в ТФУ/ДХМ (10 мл, 2:3 об./об.) выдерживали при 0 С в течение 2 ч и растворители удаляли при пониженном давлении. Продукт сушили в высоком вакууме (20 мин) с получением неочищенного вещества. Далее добавляли ДХМ (20 мл) и смесь растирали при 0 С с DIPEA до pH 7-8 (по лакмусовой бумаге) для нейтрализации избытка ТФУ. После упаривания и высушивания неочищенный амин H-Leu-MeLeu-AlaOMe применяли для следующей стадии сочетания без дополнительной очистки. Образец (25 мг) очищали повторно с помощью полупрепаративной ОФ-ВЭЖХ и лиофилизировали продукт с получением трипептида H-Leu-MeLeu-Ala-OMe в виде твердого остатка. 2.5. Получение Boc-D-MeAla-EtVal-OH.Boc-D-MeAla-EtVal-OH получали, начиная с Boc-D-MeAla-Val-OMe, применяя BuLi и триэтилоксонийфторборат с последующим гидролизом метилового эфира согласно источнику [Jean Francois.Sciences, Universite De Lausanne, 2001, p. 121-122]. 2.6. Получение Boc-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe. К раствору трипептида H-Leu-MeLeu-Ala-OMe (0,096 г, 0,291 ммоль, 1,0 экв.) в сухом ДХМ (8 мл),охлажденному до -8 С, добавляли в атмосфере аргона DIPEA (0,15 мл, 0,87 ммоль, 3,0 экв.). Далее, через 10 мин добавляли одной порцией HATU (0,13 г, 0,35 ммоль, 1,2 экв.) и дипептид Boc-D-MeAla-EtVal-OH(0,1 г, 0,29 ммоль, 1,0 экв.). Контроль полноты протекания реакции с помощью ВЭЖХ через 10 мин при-8 С и затем 40 мин при комнатной температуре показал ее завершение. Реакцию останавливали добавлением 10%-ного NaHCO3 (1 мл) и перемешивали в течение 15 мин. Реакционную смесь разбавляли ДХМ (20 мл) и промывали 10%-ной лимонной кислотой (15 мл), H2O (15 мл) и раствором соли (15 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью СС с получением пентапептида Boc-D-MeAla-EtVal-Leu-MeLeuAla-OMe в виде масла. Образец очищали повторно с помощью полупрепаративной ОФ-ВЭЖХ и лиофилизировали продукт с получением пентапептида Boc-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe в виде белого порошка. 2.7. Получение H-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe. Раствор пентапептида (0,45 г, 0,69 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в ТФУ/ДХМ (4,0 мл, 2:3 об./об.) выдерживали при 0 С в течение 1,5 ч и растворители удаляли при пониженном давлении. Остаток сушили в высоком вакууме (0,5 ч). Далее добавляли ДХМ (10 мл) и смесь растирали при 0 С с DIPEA до pH 7-8 (по лакмусовой бумаге) для нейтрализации избытка ТФУ. После упаривания и высушивания неочищенную аминную соль пентапептида H-D-MeAla-EtVal-Leu-MeLeuAla-OMe применяли для следующей стадии сочетания без дополнительной очистки. Образец (30 мг) очищали с помощью полупрепаративной ОФ-ВЭЖХ и лиофилизировали пептид с получением свободного амина пентапептида H-D-MeAla-EtVal-Leu-MeLeu-Ala-ОМе в виде белого порошка. 2.8. Получение Boc-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe. К раствору неочищенного пентапептида (0,2 г, 0,36 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в сухом ДХМ (10 мл), охлажденному до 0 С, добавляли в атмосфере аргона DIPEA(0,18 мл, 1,08 ммоль, 3,0 экв.). Далее, через 5 мин, добавляли одной порцией HATU (0,19 г, 0,5 ммоль, 1,4 экв.) и Boc-Abu-OH (0,088 г, 0,42 ммоль, 1,1 экв.). Контроль полноты протекания реакции с помощью ТСХ через 15 мин при 0 С и затем 1,15 ч при комнатной температуре (RT=1,5 ч) показал ее завершение. Реакцию останавливали добавлением 10%-ного NaHCO3 (2 мл) и перемешивали в течение 15 мин. Реакционную смесь разбавляли ДХМ (50 мл) и промывали 10%-ной лимонной кислотой (110 мл), H2O (110 мл) и раствором соли (110 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью СС с получением гексапептида BocAbu-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe в виде желтоватого масла. Образец (30 мг) очищали повторно с помощью полупрепаративной ОФ-ВЭЖХ и лиофилизировали продукт с получением гексапептида BocAbu-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe в виде белого порошка. 2.9. Получение H-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe, фрагмент (Bb). Раствор гексапептида (0,187 г, 0,25 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции,в ТФУ/ДХМ (3,0 мл, 2:3 об./об.) выдерживали при 0 С в течение 1,5 ч и растворители удаляли при пониженном давлении. Неочищенный продукт сушили в высоком вакууме (0,5 ч). Далее добавляли ДХМ (3 мл) и смесь растирали при 0 С с DIPEA до pH 7-8 (по лакмусовой бумаге) для удаления ТФУ. После упаривания и высушивания неочищенный амин H-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe применяли для следующей стадии сочетания без дополнительной очистки. Образец неочищенного продукта (23 мг) очищали повторно с помощью полупрепаративной ОФ-ВЭЖХ и лиофилизировали пептид с получением фрагмента (Ва) H-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe в виде белого порошка. СПЖХ-ИЭР-МС (m/z) 641,259 M+H]+ ([C32H61N6O7]+; выч.641,4602). 3. Связывание фрагмента (Аа) и фрагмента (Bb). 3.1. Получение H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe. К раствору гексапептида H-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe (0,16 г, 0,25 ммоль, 1,0 экв.),полученного с помощью предыдущей реакции, в сухом ДХМ (10 мл), охлажденному до 0 С, добавляли в атмосфере аргона DIPEA (0,214 мл, 1,26 ммоль, 5,0 экв.). Далее, через 5 мин добавляли одной порциейHATU (0,12 г, 0,31 ммоль, 1,25 экв.) и пентадепсипептид H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-OH (4), полученный так, как указано выше (0,16 г, 0,25 ммоль, 1,0 экв.). Контроль полноты протекания реакции с помощью ТСХ через 15 мин при 0 С и затем 1,15 ч при комнатной температуре (RT=1,5 ч) показал ее завершение. Реакцию останавливали добавлением 10%-ного NaHCO3 (3 мл) и перемешивали в течение 15 мин. Реакционную смесь разбавляли ДХМ (40 мл) и промывали 10%-ной лимонной кислотой (18 мл), H2O (18 мл) и раствором соли (18 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью СС с получением ундекапептида H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-OMe в виде белой пены. Аналитический образец (18 мг) очищали повторно с помощью полупрепаративной ОФ-ВЭЖХ и лиофилизировали продукт с получением ундекапептида H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-Abu-DMeAla-EtVal-Leu-MeLeu-Ala-ОМе в виде белого порошка. 3.2. Получение H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-OH. Раствор метилового эфира ундекапептида (0,27 г, 0,21 ммоль, 1,0 экв.), полученного с помощью предыдущей реакции, в ТГФ (2,5 мл) охлаждали до 0 С в водно-ледяной бане, затем добавляли по каплям в течение 10 мин 0,2 М LiOH (2,11 мл, 0,42 ммоль, 2,0 экв.). Охлаждающую баню затем удаляли и смесь (pH 12-13, по лакмусовой бумаге) перемешивали при комнатной температуре в течение 1 ч 20 мин(контроль ТСХ). Далее раствор охлаждали до 0 С и подкисляли 1,0 М HCl до pH 3-4. Раствор упаривали при пониженном давлении. Остаток растворяли в AcOEt (40 мл) и промывали 10%-ной лимонной кислотой (18 мл), H2O (18 мл) и раствором соли (18 мл). Органическую фазу сушили над Na2SO4, фильтровали и упаривали при пониженном давлении. Неочищенную смесь разделяли с помощью СС с получением кислоты H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-OH в виде белого порошка. Образец (40 мг) очищали повторно с помощью полупрепаративной ОФ-ВЭЖХ и лиофилизировали продукт с получением ундекапептида H-D-Hiv-MeLeu-Leu-MeVal-MeBmt-Abu-D-MeAla-EtVal-LeuMeLeu-Ala-OH в виде белого порошка. 4. Макролактонизация: получение цикло-(MeBmt-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-D-HivMeLeu-Leu-MeVal) (Ib). К раствору DMAP (0,048 г, 0,39 ммоль, 4,0 экв.) и бензотриазол-1-илокситрипирролидинфосфония гексафторфосфата (РуВОР) (0,102 г, 0,196 ммоль, 2,0 экв.) в ДХМ (12 мл) добавляли по каплям в течение 1,5 ч раствор в ДХМ (4 мл) ундекапептида, полученного с помощью предыдущей реакции (0,124 г, 0,098 ммоль, 1,0 экв.). После завершения добавления кислоты смесь перемешивали (RT=24 ч), затем переносили в делительную воронку. Раствор промывали 1 М HCl (2 мл) и органический слой отделяли и сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью колоночной хроматографии, таким образом получая циклоундекадепсипептид цикло(MeBmt-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-D-Hiv-MeLeu-Leu-MeVal) (Ia) в виде белого твердого остатка. Образец (77 мг) очищали с помощью полупрепаративной ОФ-ВЭЖХ и лиофилизировали продукт с получением циклоундекадепсипептида цикло-(MeBmt-Abu-D-MeAla-EtVal-Leu-MeLeu-Ala-D-HivMeLeu-Leu-MeVal) (Ib) в виде белого порошка. СПЖХ-ИЭР-МС (m/z) 1245,787 [M+H]+ ([C65H117N10O13]2+; выч. 1245,8802), 623,465 [М/2+Н]2+ (выч. 623,444). Пример 3. Получение цикло-(MeBmt-Val-D-MeAla-EtVal-Leu-MeLeu-Ala-D-Hiv-MeLeu-Leu-MeVal)(Ih). Получение (Ih) проводили аналогично получению соединения, описанному в примере 2. Фрагмент (Bh) получали, применяя условия реакций, аналогичные описанным в примере 2, для получения фрагмента (Bb). Затем фрагмент (Bh) сочетали с фрагментом (Аа), применяя условия реакций,подобные описанным в примере 2. Затем проводили макролактонизацию, применяя условия, аналогичные описанным в примере 2 а, с получением циклоундекадепсипептида цикло-(MeBmt-Val-D-MeAla-EtVal-Leu-MeLeu-Ala-D-Hiv-MeLeuLeu-MeVal) (Ih). СПЖХ-ИЭР-МС (m/z) 1259,888 [M+H]+ ([C66H119N10O13]+; выч. 1259,8958); 1260,788 [М+2H]2+([C66H120N10O13]2+; выч. 1260,9037). Пример 4. Получение цикло-(MeBmt-Abu-D-MeAla-MeVal-Leu-MeLeu-Ala-D-Hiv-MeLeu-LeuMeVal) (Id). Фрагмент H-Abu-D-MeAla-MeVal-Leu-MeLeu-Ala-OMe (Bd) получали, применяя условия реакций,подобные описанным в примере 1 для получения фрагмента (Ва). Затем проводили сочетание с фрагментом (Аа) и макролактонизацию, применяя условия реакций, аналогичные описанным в примере 1, с получением циклоундекадепсипептида цикло-(MeBmt-Abu-D-MeAla-MeVal-Leu-MeLeu-Ala-D-Hiv-MeLeu- 18020896Leu-MeVal) (Id). СПЖХ-ИЭР-МС (m/z) 1261,888 [M+H]+ ([C66H117N10O14]+; выч. 1261,8751) Пример 5. Ингибиторные эффекты в системе репликона ВГС. С целью определения, обладают ли циклоундекадепсипептидные соединения согласно настоящему изобретению активностью против ВГС, были проведены эксперименты, в которых сравнивали ингибирующее действие данных соединений в системе репликона ВГС. Анализы проводили на клетках Huh 9-13, содержащих репликон Con1 вируса гепатита С генотипа 1b (Lohmann et al. 2001. J. Virol. 75: 1437-1449 и Lohmann et al. 1999. Science. 285: 110-113). Клетки пересевали в среду для роста клеток DMEM с добавлением 10% сыворотки эмбрионов крупного рогатого скота (FCS), 1% не являющихся незаменимыми аминокислот, 1% пенициллина/стрептомицина и 2% Geneticin (Invitrogen) в соотношении 1:4-1:5 и культивировали в течение 3-4 дней в культуральных матрасах для тканей площадью 75 см 2 (Techno Plastic Products), клетки собирали и высевали в опытную среду(DMEM, 10% FCS, 1% не являющихся незаменимыми аминокислот, 1% пенициллина/стрептомицина) в концентрации 5000 клеток/лунка (100 мкл/лунка) в 96-луночные титрационные микропланшеты для тканевых культур (Falcon, Beckton Dickinson) для оценки цитостатического/цитотоксического и противовирусного эффекта. Микропланшеты для титрования инкубировали в течение ночи (37C, 5% CO2, относительная влажность 95-99%) с получением неслившегося монослоя клеток. Плотность клеток и цитостатические эффекты оценивали в параллельных культурах в обычных 96 луночных планшетах (Beckton-Dickinson), применяя МТТ-тест (CellTiter 96 AQueous Non-Radioactive CellProliferation Assay, Promega). В данном тесте 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2(4-сульфофенил)-2 Н-тетразолий (MTS) подвергается биологическому восстановлению до формазана,который определяют количественно при 498 нм с помощью спектрофотометра для прочтения планшетов. Выработка формазана прямо связана с количеством живых клеток. Измеряли поглощение на длине волны 498 нм (Safire2, Tecan) и оптические плотности (значения OD) переводили в процентное отношение к необработанным контролям. Соединения растворяли в ДМСО в концентрации 4 ммоль/л. Стоковые растворы немедленно применяли для постановки экспериментов. Соединения были проверены в 24 различных концентрациях в диапазоне от 0,0001 до 100 мкмоль/л. Наивысшая концентрация ДМСО в анализе составляла 2,5% (при конечной концентрации соединения, равной 100 мкМ). Во время постановки анализа процентное содержание ДМСО уменьшали одновременно с уменьшением концентрации соединения. Для оценки противовирусных эффектов среду для проведения анализа удаляли и планшеты с сухим монослоем хранили при -80 С до экстракции. После оттаивания планшетов при комнатной температуре клеточный монослой лизировали с помощью 100 мкл лизирующего буфера для выделения кДНК из клеток (Invitrogen). Лизис клеток продолжали в течение 10 мин при комнатной температуре, после чего всю жидкость переносили в планшет для полимеразной цепной реакции (ПЦР) (Axygen). Планшет для ПЦР инкубировали в течение 15 мин при 75C (Т 3, Biometra). Лизат разбавляли 1:2 водой, не содержащей рибонуклеаз/дезоксирибонуклеаз, после чего 5 мкл переносили в планшет для ПЦР в режиме реального времени (Applied Biosystems). Содержание РНК репликона определяли количественно, применяя метод количественной одностадийной ПЦР в режиме реального времени (RT-q-ПЦР): Low Rox One-Step RT-qPCR master mix, Abgene). В качестве прямого и обратного праймеров использовали 5'-CCAGATCATCCTGATCGACCAG-3' и 5'CCGGCTACCTGCCCATTC-3' соответственно. Флюорогенным зондом был 5'-ACATCGCATCGAGCGAGCACGTAC-3'. Анализы образцов выполняли, применяя SDS7500F (AppliedBiosystems, стандартный термоциклический профиль: 30 мин при 48C, 10 мин при 95C, 40 циклов по 15 с при 95C и 1 мин при 60C), после чего количества РНК репликона переводили в процентное отношение к необработанным контролям.EC50 (значение, полученное из кривой доза-эффект) представляет концентрацию, при которой наблюдают 50%-ное подавление репликации вируса. CC50 (значение, полученное из кривой доза-эффект) представляет концентрацию, при которой метаболическая активность клеток снижена на 50% по сравнению с метаболической активностью необработанных клеток. Результаты данных экспериментов позволили выполнить расчет EC50SD (стандартное отклонение или Std. Dev.), которая представляет собой эффективную концентрацию, требуемую для подавления репликации репликона ВГС на 50%, и СС 50SD (в тех случаях, когда возможно), которая представляет собой концентрацию, требуемую для подавления пролиферации экспоненциально растущих клеток на 50%. Значения EC50 и CC50SD рассчитывали соответственно как среднее значение всех значений EC50 и CC50,полученных из 3 индивидуальных кривых доза-эффект. Показатель селективности (SI), показывающий терапевтическое окно соединения, вычисляли как отношение CC50 и EC50. В табл. 1 показаны результаты сравнения значений EC50, CC50 (мкмоль/л) и SI выбранных соединений в клетках Huh 9-13. Считается, что концентрация соединения вызывает истинный противовирусный эффект в системе репликона ВГС, когда при данной конкретной концентрации эффективность против репликона значительно превышает 70%-ный порог, и наблюдают снижение метаболической активности не более чем на 30%. Как показано в табл. 1, данные результаты, полученные в клетках Huh 9-13, показывают, что указанные соединения селективно ингибируют репликацию репликона вируса гепатита С в клеточной культуре и демонстрируют эффективность от такой же до более высокой, чем у Debio 025, со значениямиEC50 в двузначном наномолярном диапазоне, и показатели селективности от таких же до более высоких. Пример 6. Неиммуносупрессивная активность. С целью определения, обладают ли циклоундекадепсипептидные соединения согласно настоящему изобретению неиммуносупрессивной активностью, были проведены эксперименты, которые сравнивали дозозависимое подавление вызванной Конканавалином А пролиферации Т-клеток (см. табл. 2). Анализы проводили согласно методике, описанной Дайтоном с соавт. (Dayton et al.) (1992. Mol.Pharmacol. 41, 671-676) и Mshell et al. (1980. Cell proliferation in selected methods in cellular immunology, V,XXIX, W.H. Freeman Co., San Francisco, CA. 153-160). IC50 (половина максимальной ингибирующей концентрации) соединений получали из кривой доза-эффект и сравнивали с IC50 CsA (отношение IC50). Таблица 2 В данном исследовании соединения (Ia), (Ib) и (Id), по меньшей мере, обладают приблизительно в 300 раз меньшим иммуносупрессивным действием, чем циклоспорин А (CsA) (в показателе отношенияIC50). Пример 7. Взаимодействия с переносчиками в печени. С целью определения, взаимодействуют ли циклоундекадепсипептидные соединения согласно настоящему изобретению с печеночными переносчиками, проводили эксперименты, которые сравнивали зависимое от концентрации подавление по отношению к белку 2, связанному с множественной лекарственной устойчивостью (MRP2), полипептиду 1 В 1, переносящему органические анионы (ОАТР 1 В 1), насосу, экспортирующему соли желчных кислот (BSEP), и полипептиду, котранспортирующему натриевую соль таурохолевой кислоты (NTCP). Указанные переносчики вовлечены в гепатобилиарную циркуляцию эндогенных соединений, таких как соли желчных кислот или билирубин (для рассмотрения см. С. PauliMagnus et al., J. Hepatology, 2005, 43: 342-357). Некоторые из них также участвуют в устранении ксенобиотиков.frugiperda (Sf9), инфицируя клетки насекомых рекомбинантным бакуловирусом. Подавление транспорта содержащих радиоактивный зонд субстратов (эстрадиол-17-бетаглюкуронид и таурохолат для MRP2 иBSEP соответственно) в переходящие изнутри наружу мембранные пузырьки, содержащие переносчик,измеряли подсчетом сцинтилляций. Анализы ОАТР 1 В 1 и NTCP выполняли с помощью клеток яичников китайского хомяка (СНО), экспрессирующих данные человеческие захватывающие переносчики. Количество переносимого содержащего зонд субстрата (эстрон-3-сульфат и таурохолат для ОАТР 1 В 1 и NTCP соответственно) определяли с помощью жидкостной сцинтилляции или флюоресцентной фотометрии после лизиса клеток.IC50 (определяемую как концентрацию, требуемую для подавления транспорта содержащего зонд субстрата на 50%, половина максимальной ингибиторной концентрации) соединений получали из кри- 20020896MRP2 представляет собой главную движущую силу для потока солей желчных кислот независимо от выделения желчи и переносит широкий спектр органических анионов, включая диглюкуронид билирубина, конъюгаты солей желчных кислот, также как и некоторые лекарственные средства. В табл. 3 показаны результаты взаимодействия выбранных соединений по отношению к данному переносчику. Таблица 3 ОАТР 1 В 1 переносит соли желчных кислот независимым от натрия способом. Кроме того, многочисленные лекарственные средства являются субстратами ОАТР. В табл. 4 показаны результаты взаимодействия выбранных соединений по отношению к ОАТР 1 В 1. Таблица 4BSEP представляет собой основную систему выведения солей желчных кислот, вовлеченную в секрецию холефильных соединений из клетки печени в желчный каналец. В табл. 5 показаны результаты взаимодействия выбранных соединений по отношению к BSEP. Таблица 5NTCP опосредует зависимое от натрия поглощение солей желчных кислот из кровообращения в системе воротной вены, которое необходимо для образования желчи. Табл. 6 показывает результаты взаимодействия выбранных соединений по отношению к NTCP. Таблица 6 Кроме указанных исследований in vitro с участием печеночных переносчиков, циклоундекадепсипептидные соединения согласно настоящему изобретению также оценивали относительно подавления invitro ферментов метаболизма, также как и фармакокинетических свойств у животных in vivo. Как показано в табл. 3-6, результаты экспериментов по переносу in vitro показывают, что данные соединения демонстрируют намного меньшую способность ингибировать некоторые печеночные переносчики по сравнению с Debio 025. В частности, некоторые соединения демонстрируют отсутствие подавления по отношению к MRP2 и/или до 50 раз меньшую активность по отношению к ОАТР 1 В 1. Таким образом, данные соединения, как ожидают, уменьшат или возможные неблагоприятные эффекты (например, гипербилирубинемию), связанные с подавлением переносчиков в печени, или возможные взаимодействия между лекарственными средствами (например, с ингибиторами редуктазы HMG-CoA, такими как аторвастатин), связанные с подавлением переносчиков в печени, или даже и то, и другое. Список сокращенийAbu - Lамино-n-масляная кислота,Ас - ацетил,AcOEt - этилацетат,АсОН - уксусная кислота,Ala - L-аланин,Boc - трет-бутилоксикарбонил,BSEP - насос, экспортирующий соли желчных кислот,t-Bu - трет-бутил,Са(МеО)2 - метоксид кальция,СС - колоночная хроматография,ДХМ - дихлорметан,DIPEA - N,N-диизопропилэтиламин,DMAP - 4-(N,N-диметиламино)пиридин,ДМСО - диметилсульфоксид,экв. - эквивалент,ИЭР-МС - масс-спектрометрия с ионизацией электрораспылением,EtVal - N-этил-L-валин,Fmoc - 9-флуоренилметоксикарбонил,HATU - N-[(диметиламино)-1H-1,2,3-триазол[4,5-b]пиридин-1-илметилен]-N-метилметанаминия гексафторфосфат N-оксид,D-Hiv - D-гидроксиизовалериановая кислота,г - грамм,НСООН - муравьиная кислота,ВЭЖХ - высокоэффективная жидкостная хроматография,HR-MALDI-MS - масс-спектрометрия MALDI-TOF высокого разрешения,HR-Q-TOF-MS - масс-спектрометрия Q-TOF высокого разрешения,Im2CO - N,N-карбонилдиимидазол (CDI),кг - килограмм,KOMe - метоксид калия,MALDI - лазерная десорбция/ионизация образца в матрице,MALDI-TOF - времяпролетная масс-спектрометрия,Me - метил,D-MeAla - N-метил-D-аланин,MeBmt - N-метил-(4R)-4-[(E)-2-бутенил]-4,4-диметил-L-треонин,MeLeu - N-метил-L-лейцин,MeCN - ацетонитрил,MeOH - метанол,MeVal - N-метил-L-валин,мг - миллиграмм,мл - миллилитр,MRP2 - белок 2, связанный с множественной лекарственной устойчивостью,МС - масс-спектрометрия,MtBE - метил-трет-бутиловый эфир,NMR - ядерный магнитный резонанс,NTCP - полипептид, котранспортирующий натриевую соль таурохолевой кислоты,ОАТР 1 В 1 - полипептид 1 В 1, переносящий органические анионы,РуВОР - (бензотриазол-1 илокси)-трис-(пирролидино)фосфония гексафторфосфат,ОФ - обратнофазовый,ОФ-ВЭЖХ - обратнофазовая высокоэффективная жидкостная хроматография,ВР - время реакции,Thr - L-треонин,ТФУ - трифторуксусная кислота,- 22020896tR - время удерживания,ТГФ - тетрагидрофуран,Tj - температура рубашки,ТСХ - тонкослойная хроматография,Tr - температура в реакторе,СПЖХ - сверхпроизводительная жидкостная хроматография,об. - объемы (1 г целевого необработанного вещества означает 1 об.). ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Циклоундекадепсипептидное соединение формулы (I) 3. Соединение по любому из пп.1 или 2, отличающееся тем, что 4. Соединение по любому из пп.1-3, имеющее следующую формулу: 5. Фармацевтическая композиция для предотвращения или лечения инфекций, вызываемых вирусом гепатита С, или вызываемых ВГС расстройств, содержащая соединение по любому из пп.1-4 совместно с одним или более фармацевтически приемлемыми разбавителями или носителями. 6. Фармацевтическая комбинация, содержащая, по меньшей мере, а) первое средство, состоящее из соединения по любому из пп.1-4 или фармацевтической композиции по п.5, и b) второе средство, обла- 23020896 дающее способностью противодействовать репликации ВГС. 7. Применение фармацевтической комбинации по п.6 для предотвращения или лечении инфекций,вызываемых вирусом гепатита С, или вызываемых ВГС расстройств. 8. Применение соединения по любому из пп.1-4 в качестве лекарственного средства для подавления репликации вируса гепатита С у нуждающегося в этом пациента. 9. Применение соединения по любому из пп.1-4 в качестве противовирусного средства. 10. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения или предотвращения инфекций, вызываемых вирусом гепатита С, или вызываемых ВГС расстройств. 11. Способ предотвращения или лечения инфекций, вызываемых вирусом гепатита С, или вызываемых ВГС расстройств у нуждающегося в этом субъекта, включающий введение указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-4 или фармацевтической композиции по п.5. 12. Способ подавления репликации ВГС у нуждающегося в этом пациента, включающий введение указанному субъекту терапевтически эффективного количества соединения по любому из пп.1-4 или фармацевтической композиции по п.5. 13. Способ по любому из пп.11, 12, включающий совместное введение одновременно или последовательно терапевтически эффективного количества соединения по любому из пп.1-4 или фармацевтической композиции по п.5 и, по меньшей мере, второго средства, выбранного из средства, обладающего способностью противодействовать репликации ВГС. 14. Способ по п.13, отличающийся тем, что указанное средство, обладающее направленными против ВГС свойствами, выбрано из группы, состоящей из интерферона, такого как интерферон 2 а или интерферон 2b; или интерферона, конъюгированного с водорастворимым полимером или человеческим альбумином; противовирусного средства, такого как рибавирин, ламивудин, NV08 или NM283; ингибитора кодируемых ВГС факторов, например протеазы NS3-4A, хеликазы или РНК-полимеразы; противофиброзного средства, такого как производное N-фенил-2-пиримидинамина; иммуномодулирующего средства, такого как микофеноловая кислота; или агониста рецептора S1P, такого как FTY720 или его необязательно фосфорилированный аналог.
МПК / Метки
МПК: C07K 7/64, A61K 38/13, C07K 11/02
Метки: применение, лекарственного, средства, циклоундекадепсипептидные, качестве, указанных, соединений, соединения
Код ссылки
<a href="https://eas.patents.su/25-20896-cikloundekadepsipeptidnye-soedineniya-i-primenenie-ukazannyh-soedinenijj-v-kachestve-lekarstvennogo-sredstva.html" rel="bookmark" title="База патентов Евразийского Союза">Циклоундекадепсипептидные соединения и применение указанных соединений в качестве лекарственного средства</a>
Предыдущий патент: Складной велосипед
Следующий патент: Способ определения условий эксплуатации бытового прибора
Случайный патент: Способ и система определения характеристик гидроразрыва с использованием данных о микросейсмических событиях