Фармацевтические составы, содержащие пропиленгликоль-гидрат дапаглифлозина
Номер патента: 20288
Опубликовано: 30.10.2014
Авторы: Дали Мандар В., Биндра Дилбир С., Ватсарадж Нипа, Тао Ли, Пэтел Джатин М., Ву Юнгмей, Параб Пракаш В., Теджвани Равиндра В.
Формула / Реферат
1. Фармацевтический состав с немедленным высвобождением, содержащий:
а) пропиленгликоль-гидрат дапаглифлозина, который содержится в количестве в пределах от 0,1 до 30 вес.% состава;
б) наполнители, включающие лактозу в пределах от 20 до 75 вес.% состава и/или микрокристаллическую целлюлозу в пределах от 20 до 75 вес.% состава, при этом общее количество наполнителя составляет в пределах от 20 до 85 вес.% состава;
в) дезинтегранты, присутствующие в количестве в пределах от 0,25 до 10 вес.% состава, включающие один или более дезинтегрант, выбранный из группы, включающей натриевую соль кросскармеллозы, кросповидон, и натриевую соль гликолята крахмала;
г) агенты, способствующие скольжению и/или препятствующие слипанию, включающие тальк и/или двуокись кремния, где общее количество агента, способствующего скольжению и/или препятствующего слипанию, находится в пределах от 1 до 10 вес.% состава; и
д) смазочный агент, включающий стеарат магния, присутствующий в количестве в пределах от 0,2 до 2 вес.% состава.
2. Состав по п.1, отличающийся тем, что пропиленгликоль-гидрат дапаглифлозина является соединением
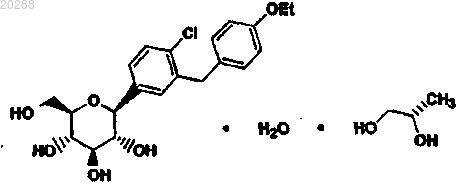
3. Состав по п.1 или 2, отличающийся тем, что он содержит как лактозу, так и микрокристаллическую целлюлозу.
4. Состав по п.1 или 2, дополнительно содержащий связующее, включающее предварительно желатинизированный крахмал в количестве в пределах от 10 до 75 вес.% состава.
5. Состав по п.1 или 2, где дезинтегрант включает один или более дезинтегрант, выбранный из группы, включающей натриевую соль кросскармеллозы в количестве в пределах от 2 до 10 вес.% состава, кросповидон в количестве в пределах от 4 до 10 вес.% состава и натриевую соль гликолята крахмала в количестве в пределах от 2 до 10 вес.% состава.
6. Состав по любому из пп.1-5, отличающийся тем, что он находится в виде исходного гранулята для заполнения капсул или получения таблеток.
7. Состав по любому из пп.1-5, отличающийся тем, что он находится в виде таблетки или капсулы.
8. Состав по п.7, где состав находится в форме таблетки и покрыт внешним слоем защитного покрытия, включающим полимер и необязательно содержащим один или несколько компонентов из пластификатора(ов), противоадгезионного(ых) агента(ов), агента(ов), способствующего(их) скольжению, и красителя(ей), при этом внешний слой защитного покрытия содержится в количестве от 1 до 5вес.% состава.
9. Состав по п.1 или 2, отличающийся тем, что он находится в виде капсулы, заполненной исходным гранулятом, выбранным из составов, содержащих 2,5 и 10 мг этого состава, включающий:
а) пропиленгликоль-гидрат дапаглифлозина в количестве 10 вес.% содержимого капсулы;
б) микрокристаллическую целлюлозу в количестве 68,75 вес.% содержимого капсулы;
в) предварительно желатинизированный крахмал в количестве 15 вес.% содержимого капсулы;
г) натриевую соль гликолята крахмала в количестве 3 вес.% содержимого капсулы;
д) двуокись кремния в количестве 2 вес.% содержимого капсулы и
е) стеарат магния в количестве 1,25 вес.% содержимого капсулы.
10. Состав по п.1 или 2, отличающийся тем, что он находится в виде капсулы, заполненной исходным гранулятом, выбранным из составов, содержащих 100 мг этого состава, включающий:
а) пропиленгликоль-гидрат дапаглифлозина в количестве 22,8 вес.% содержимого капсулы;
б) микрокристаллическую целлюлозу в количестве 55,95 вес.% содержимого капсулы;
в) предварительно желатинизированный крахмал в количестве 15 вес.% содержимого капсулы;
г) натриевую соль гликолята крахмала в количестве 3 вес.% содержимого капсулы;
д) двуокись кремния в количестве 2 вес.% содержимого капсулы и
е) стеарат магния в количестве 1,25 вес.% содержимого капсулы.
11. Состав по п.1 или 2, отличающийся тем, что он находится в виде 2,5 мг таблетки, включающий:
а) пропиленгликоль-гидрат дапаглифлозина в количестве 3,08 мг;
б) микрокристаллическую целлюлозу в количестве 67,11 мг;
в) безводную лактозу в количестве 25 мг;
г) кросповидон в количестве 8,75 мг;
д) натриевую соль кроскармеллозы в количестве 3,75 мг;
е) тальк в количестве 12,5 мг;
ж) двуокись кремния в количестве 2,88 мг и
з) стеарат магния в количестве 1,94 мг.
12. Состав по п.1 или 2, отличающийся тем, что он находится в виде 10 мг таблетки, включающий:
а) пропиленгликоль-гидрат дапаглифлозина в количестве 12,3 мг;
б) микрокристаллическую целлюлозу в количестве 57,89 мг;
в) безводную лактозу в количестве 25 мг;
г) кросповидон в количестве 8,75 мг;
д) натриевую соль кроскармеллозы в количестве 3,75 мг;
е) тальк в количестве 12,5 мг;
ж) двуокись кремния в количестве 2,88 мг и
з) стеарат магния в количестве 1,94 мг.
13. Состав по п.1 или 2, отличающийся тем, что он находится в виде 50 мг таблетки, включающий:
а) пропиленгликоль-гидрат дапаглифлозина в количестве 61,66 мг;
б) микрокристаллическую целлюлозу в количестве 114,09 мг;
в) безводную лактозу в количестве 62,6 мг;
г) кросповидон в количестве 21,91 мг;
д) натриевую соль кроскармеллозы в количестве 9,39 мг;
е) тальк в количестве 31,3 мг;
ж) двуокись кремния в количестве 7,2 мг и
з) стеарат магния в количестве 4,85 мг.
14. Состав по п.1 или 2, отличающийся тем, что он содержит:
а) пропиленгликоль-гидрат дапаглифлозина в количестве от 0,1 до 15 вес.% состава;
б) микрокристаллическую целлюлозу в количестве, которое достаточно для того, чтобы общий вес состава равнялся 100%;
в) лактозу в количестве от 10 до 30 вес.% состава;
г) кросповидон в количестве от 3 до 10 вес.% состава;
д) двуокись кремния в количестве от 1 до 4 вес.% состава и
е) стеарат магния в количестве от 0,5 до 2 вес.% состава.
15. Состав по п.1 или 2, отличающийся тем, что он находится в виде 1,0 мг таблетки, содержащий:
а) пропиленгликоль-гидрат дапаглифлозина в количестве 1,23 мг;
б) микрокристаллическую целлюлозу в количестве от 50 до 90 мг;
в) лактозу в количестве от 10 до 30 мг;
г) кросповидон в количестве от 2 до 10 мг;
д) двуокись кремния в количестве от 0,5 до 4,0 мг;
е) стеарат магния в количестве от 0,5 до 2,0 мг и
ж) антиоксидант и/или хелатирующий агент в количестве от 0 до 0,5 мг.
16. Состав по п.1 или 2, отличающийся тем, что он находится в виде 2,5 мг таблетки, содержащий:
а) пропиленгликоль-гидрат дапаглифлозина в количестве 3,075 мг;
б) микрокристаллическую целлюлозу в количестве от 60 до 115 мг;
в) лактозу в количестве от 12,5 до 38 мг;
г) кросповидон в количестве от 2,5 до 13 мг;
д) двуокись кремния в количестве от 0,6 до 5,0 мг;
е) стеарат магния в количестве от 0,6 до 2,5 мг и
ж) антиоксидант и/или хелатирующий агент в количестве от 0 до 0,6 мг.
17. Состав по п.1 или 2, отличающийся тем, что он находится в виде 5,0 мг таблетки, содержащий:
а) пропиленгликоль-гидрат дапаглифлозина в количестве 6,15 мг;
б) микрокристаллическую целлюлозу в количестве от 60 до 115 мг;
в) лактозу в количестве от 12,5 до 38 мг;
г) кросповидон в количестве от 2,5 до 13 мг;
д) двуокись кремния в количестве от 0,6 до 5,0 мг;
е) стеарат магния в количестве от 0,6 до 2,5 мг и
ж) антиоксидант и/или хелатирующий агент в количестве от 0 до 0,6 мг.
18. Состав по п.1 или 2, отличающийся тем, что он находится в виде 10 мг таблетки, содержащий:
а) пропиленгликоль-гидрат дапаглифлозина в количестве 12,3 мг;
б) микрокристаллическую целлюлозу в количестве от 120 до 230 мг;
в) лактозу в количестве от 25 до 75 мг;
г) кросповидон в количестве от 5 до 25 мг;
д) двуокись кремния в количестве от 1,0 до 10 мг;
е) стеарат магния в количестве от 1,0 до 5 мг и
ж) антиоксидант и/или хелатирующий агент в количестве от 0 до 1,25 мг.
Текст
Предлагаются фармацевтические составы, которые готовятся в виде капсул или таблеток для орального применения и которые включают пропиленгликоль-гидрат дапаглифлозина и фармацевтически приемлемый носитель, при этом этот состав характеризуется немедленным высвобождением. Составы применяют для лечения диабета и родственных болезней. Область техники Данное изобретение предусматривает фармацевтический состав немедленного высвобождения, который включает таблетку или капсулу, содержащую натрийзависимый транспортер глюкозы (SGLT2) дапаглифлозин или его пропиленгликоль-гидрат. Уровень техники По меньшей мере 171 млн людей во всем мире страдает от диабета типа II (NIDDM), который характеризуется гипергликемией из-за избыточного продуцирования глюкозы печенью и периферической устойчивости к инсулину. Гипергликемия считается основным фактором риска развития диабетических осложнений и, по всей видимости, непосредственно способствует ухудшению секреции инсулина, наблюдаемому в случае прогрессирующего NIDDM. Таким образом, постоянный контроль уровня глюкозы в плазме у пациентов с NIDDM может замедлить развитие осложнений при диабете и разрушение бетаклеток, наблюдаемые в случае указанной болезни. Глюкоза плазмы крови обычно фильтруется в гломерулах в почке и активно реабсорбируется в проксимальной трубочке. Оказалось, что SGLT2 является основным транспортером, который ответственен за обратное поглощение глюкозы этим сайтом. Ожидается, что селективный ингибитор натрийзависимого транспортера глюкозы SGLT2 в почке будет нормализовать уровень глюкозы в плазме, способствуя экскреции глюкозы в моче и тем самым повышая чувствительность к инсулину и замедляя развитие осложнений при диабете. Соединение структуры (I) или его фармацевтически приемлемые соли или сольваты (далее дапаглифлозин), орально активный ингибитор SGLT2, описан в патенте США 6515117 (содержание которого включено полностью в качестве ссылки в данную заявку). В заявке США 11/765481, поданной 28 июня 2007 г., опубликованной подUS 2008-0004336 А 1,описан дапаглифлозин в виде его (S)-пропиленгликоль S)-PG)-гидрата и его (R)-пропиленгликоль R)PG)-гидрата. (S)-пропиленгликоль S)-PG)-гидрат обозначают как формулу SC-3, он имеет формулу (Ia)(R)-Пропиленгликоль R)-PG)-гидрат обозначают как формулу SD-3, он имеет формулу (Ib) Способы получения S)-PG)-гидрата и R)-PG)-гидрата дапаглифлозина описаны в заявке США 11/765481, поданной 28 июня 2007 г., опубликованной как US 2008-0004336 А 1 (содержание которой включено полностью в качестве ссылки в данную заявку). Сущность изобретения В соответствии с данным изобретением предусмотрены фармацевтические составы, которые могут быть в виде капсул или таблеток для орального применения, с немедленным высвобождением активного агента и включают в качестве лекарственного вещества дапаглифлозин формулы (I) или его фармацевтически приемлемую соль, сольват, смешанный сольват или комплекс (который описан в патенте США 6515117). По одному из вариантов дапаглифлозин находится в виде его (S)-пропиленгликоль S)-PG)-гидрата получение которого описано в заявке США 11/765481, поданной 28 июня 2007 г., опубликованной какUS 2008-000 4336 A1 и в предварительной заявке США 60/817118, поданной 28 июня 2006 г. По одному варианту изобретения состав немедленного высвобождения по изобретению находится в виде исходного гранулята (например, гранул, сфер или порошков) для загрузки в гранулы или образования таблеток, содержащего:(б) один или несколько наполнителей;(в) возможно, одно или более связующих;(г) возможно, один или более дезинтегрантов;(д) возможно, один или более агентов, способствующих скольжению;(е) возможно, один или более смазывающих агентов. По одному из вариантов исходный гранулят содержит дапаглифлозин и один или более наполнителей. По другому варианту исходный гранулят содержит пропиленгликоль-гидрат дапаглифлозина и один или более наполнителей. Подходящие наполнители включают, например, микрокристаллическую целлюлозу и/или лактозу, а также другие наполнители, указанные в данной заявке и известные из уровня техники. По другим вариантам исходный гранулят может содержать один или более следующих компонентов: (1) одно или более связующих; (2) один или более дезинтегрантов; (3) один или более агентов, способствующих скольжению и/или агентов против прилипания; (4) один или более смазывающих агентов. Подходящие связующие включают, например, предварительно желатинизированный крахмал, а также другие вещества, описанные здесь или известные из уровня техники. Подходящие дезинтегранты включают, например, натриевую соль гликолята крахмала, кросповидон и натриевую соль кроскармеллозы, а также другие вещества, описанные здесь или известные из уровня техники. Подходящие агенты,способствующие скольжению и/или препятствующие слипанию, включают, например, двуокись кремния и тальк, а также другие вещества, описанные здесь или известные из уровня техники. Подходящие смазочные агенты включают, например, стеарат магния, а также другие вещества, описанные здесь или известные из уровня техники. Исходный гранулят по изобретению, описанный выше, и капсулы и таблетки, его содержащие, получают путем смешения вместе дапаглифлозина или пропиленгликоль-гидрата дапаглифлозина и одного или более наполнителей в любом порядке с получением исходного гранулята и заполнения капсул или получения таблеток из желаемых количеств исходного гранулята. Согласно другим вариантам исходный гранулят получают путем смешения вместе дапаглифлозина или пропиленгликоль-гидрата дапаглифлозина, и одного или более наполнителей, и, возможно, одного или более следующих веществ: связующего(щих), дезинтегранта(ов), веществ, способствующих скольжению или препятствующих слипанию, и смазывающего(их) агента(ов) - в любом желаемом порядке с образованием исходного гранулята и заполнения капсул или получения таблеток из желаемых количеств исходного гранулята. Таблетки по изобретению получают путем сжатия исходного гранулята в таблетки. По одному из вариантов таблетки по изобретению получают путем сжатия исходного гранулята, содержащего одно или более связующих. По другому варианту таблетки по изобретению получают путем сжатия исходного состава, содержащего одно или более веществ, способствующих скольжению или препятствующих сли-2 020288 панию. Еще по одному варианту таблетки по изобретению получают путем сжатия исходного гранулята,содержащего: (1) одно или более связующих; (2) один или более дезинтегрантов; (3) один или более агентов, способствующих скольжению, и/или агентов против прилипания; (4) один или более смазывающих агентов. Таблетки и/или капсулы по изобретению могут необязательно включать внешний слой защитного покрытия, который содержит полимер, образующий покрытие, такой как, например, поливиниловый спирт (PVA), гидроксипропилметилцеллюлоза и гидроксипропилцеллюлоза, и пластификатор(ы), и, возможно, краситель(и). Другие возможные компоненты внешнего защитного покрытия включают вещество(вещества), препятствующие слипанию и/или способствующие скольжению, и матирующий(ие) агент(ы). Фармацевтические составы на основе дапаглифлозина или пропиленгликоль-гидрата дапаглифлозина включают исходный гранулят, капсулы, содержащие этот гранулят, и таблетки по изобретению,пригодные для лечения млекопитающих, таких как люди, собаки и кошки, от болезней или расстройств,связанных с активностью SGLT2, например диабета типа I и типа II; ухудшенной переносимости глюкозы; устойчивости к инсулину и осложнений при диабете, таких как нефропатия, ретинопатия, нейропатия и катаракты; гипергликемии; гиперинсулинемии; гиперхолестеринемии; дислипидемии; повышенных уровней свободных жирных кислот или глицерина в крови; гиперлипидемии; гипертриглицеридемии; ожирения; для заживления ран; от тканевой ишемии; атеросклероза; от повышенного давления и от синдрома X или метаболического синдрома. По одному из вариантов данное изобретение предусматривает фармацевтический состав с немедленным высвобождением, содержащий: а) пропиленгликоль-гидрат дапаглифлозина, который содержится в количестве в пределах от 0,1 до 30% от веса состава; б) наполнители, включающие лактозу в пределах от 20 до 75% от веса состава и/или микрокристаллическую целлюлозу в пределах от 20 до 75% от веса состава, при этом общее количество наполнителя составляет в пределах от 20 до 85% от веса состава; в) дезинтегранты, присутствующие в количестве в пределах от 0,25 до 10% от веса состава, включающие один или более натриевую соль кросскармеллозы, кросповидон и натриевую соль гликолята крахмала; г) агенты, способствующие скольжению и/или препятствующие слипанию, включающие тальк и/или двуокись кремния, где общее количество агента, способствующего скольжению и/или препятствующего слипанию, находится в пределах от 1 до 10% от веса состава; и д) смазочный агент, включающий стеарат магния, присутствующий в количестве в пределах от 0,2 до 2% от веса состава. Подробное описание изобретения Данное изобретение предусматривает фармацевтические составы немедленного высвобождения,которые включают, наряду с другими, таблетки и капсулы, содержащие ингибитор натрийзависимого транспортера глюкозы (SGLT2) дапаглифлозин или его пропиленгликоль-гидрат. Применяемый в данной заявке термин "дапаглифлозин" означает соединение формулы I или соединение I. Термин "пропиленгликоль-гидрат дапаглифлозина" относится как к (S)-пропиленгликоль-гидрату дапаглифлозина (формула Ia или соединение Ia), так и к (R)-пропиленгликоль-гидрату дапаглифлозина(формула Ib или соединение Ib). Применяемые термины "фармацевтический состав", "фармацевтический состав по изобретению" и "состав" относятся к составам, содержащим дапаглифлозин, а также к составам, содержащим пропиленгликоль-гидрат дапаглифлозина. Так же термин "лекарственное вещество" в данной заявке относится к дапаглифлозину и пропиленгликоль-гидрату дапаглифлозина. Используемые термины "немедленное высвобождение" и "фармацевтический состав немедленного высвобождения" означают, что фармацевтические составы по изобретению не получают с применением эксципиентов, которые влияют на абсорбцию активного фармацевтического ингредиента, например дапаглифлозина или пропиленгликоль-гидрата дапаглифлозина, при введении млекопитающему или человеку. Фармацевтический состав по изобретению может быть в виде капсул, таблеток, сфер, шариков, гранул или пилюль, все эти формы называют фармацевтическими составами, и все они содержат лекарственное вещество, а именно дапаглифлозин или его пропиленгликоль-гидрат. По одному из вариантов лекарственным веществом является дапаглифлозин. По другому варианту лекарственным веществом является (S)-пропиленгликоль-гидрат дапаглифлозина. Еще по одному варианту лекарственным веществом является (R)-пропиленгликоль-гидрат дапаглифлозина. По одному из вариантов изобретения фармацевтический состав немедленного высвобождения по изобретению находится в виде исходного гранулята (например, гранул, сфер или шариков) для заполнения капсул или формования таблеток. По одному из вариантов дапаглифлозин или его пропиленгликоль-гидрат содержится в количестве в пределах от примерно 0,1 до примерно 30% от веса исходного гранулята. Фармацевтический состав по изобретению может включать фармацевтические эксципиенты, описанные в данном описании, способствующие образованию исходного гранулята в виде гранул, сфер или шариков для заполнения капсул или формования таблеток по изобретению. Согласно одному из вариантов фармацевтический состав находится в виде капсул или таблеток, содержащих исходный гранулят, включающий:(б) один или несколько наполнителей;(в) возможно, одно или более связующих;(г) возможно, один или более дезинтегрантов;(д) возможно, один или более агентов, способствующих скольжению;(е) возможно, один или более смазывающих агентов. В описанных вариантах фармацевтических составов по изобретению количество лекарства (дапаглифлозина или его пропиленгликоль-гидрата) и каждого из эксципиентов выражаются в вес.% в расчете на общий вес исходного гранулята, который эквивалентен весу в % от общего веса таблетки или содержимого капсулы. По одному из вариантов дапаглифлозин или его пропиленгликоль-гидрат содержится в пределах от примерно 0,1 до примерно 30% от веса исходного гранулята, предпочтительно до 15%. По одному из вариантов наполнитель или наполняющий агент содержится в количестве в пределах от примерно 20 до примерно 85% от веса исходного гранулята. По одному из вариантов связующее, если оно содержится, находится в количестве в пределах от примерно 10 до примерно 75% от веса исходного гранулята. По одному из вариантов дезинтегрант, если он содержится, находится в количестве в пределах от примерно 0,25 до примерно 10% от веса исходного гранулята. По одному из вариантов агент, способствующий скольжению и/или препятствующий слипанию, если он есть, содержится в количестве в пределах от примерно 1 до примерно 10% от веса исходного гранулята. По одному из вариантов смазывающий агент, если он есть, содержится в количестве в пределах от примерно 0,2 до примерно 2% от веса исходного гранулята. По одному из вариантов фармацевтический состав находится в виде капсулы или таблетки, содержащей исходный гранулят, содержащий:(б) один или несколько наполнителей;(в) возможно, одно или более связующих;(г) возможно, один или более дезинтегрантов;(д) возможно, один или более агентов, способствующих скольжению;(е) возможно, один или более смазывающих агентов, при этом: а) дапаглифлозин или его пропиленгликоль-гидрат содержится в пределах от примерно 0,1 до примерно 30 вес.%; б) наполняющий агент или наполнитель, если он есть, содержится в количестве от примерно 20 до примерно 85 вес.%; в) связующее, если оно есть, содержится в количестве от примерно 10 до примерно 75 вес.%; г) дезинтегрант, если он есть, содержится в количестве от примерно 0,25 до примерно 10 вес.%; д) агент, способствующий скольжению и/или препятствующий слипанию, если он есть, содержится в количестве от примерно 1 до примерно 10 вес.%; е) смазывающий агент, если он есть, содержится в количестве от примерно 0,2 до примерно 2 вес.%; все эти количества указаны в расчете на вес исходного гранулята. По одному из вариантов лекарственное вещество в фармацевтических составах на 90% состоит из частиц размером менее 200 мкм. По другому варианту 90% частиц лекарственного вещества имеет размер менее 100 мкм. Еще по одному варианту 90% частиц лекарственного вещества имеет размер менее 50 мкм. Дапаглифлозин или его пропиленгликоль-гидрат могут быть перемолоты или микронизированы так, как это необходимо для получения указанных выше характеристик. Примеры наполняющих агентов или наполнителей, пригодных для применения по изобретению,включают, без ограничения, производные целлюлозы, такие как микрокристаллическая целлюлоза или древесная целлюлоза, лактозу, сахарозу, крахмал, предварительно желатинизированный крахмал, декстрозу, маннит, фруктозу, ксилит, сорбит, кукурузный крахмал, модифицированный кукурузный крахмал,неорганические соли, такие как карбонат кальция, фосфат кальция, дикальцийфосфат, сульфат кальция,декстрин/декстраты, мальтодекстрин, сжимаемые сахара и другие известные наполнители или наполняющие агенты и/или смеси двух или более указанных выше наполнителей. Некоторые виды микрокристаллической целлюлозы подходят для применения в составах, описанных выше, например микрокристаллическая целлюлоза, выбранная из группы, состоящей из Avicel: PH101, PH102, PH103, PH105,PH112, PH113, РН 200, РН 301, и другие виды микрокристаллической целлюлозы, такие как силицированная микрокристаллическая целлюлоза. Некоторые виды лактозы подходят для применения в составах по изобретению, например лактоза, выбранная из группы, состоящей из безводной лактозы, моногидрата лактозы, лактозы Fast-flo, кусковой безводной лактозы и модифицированного моногидрата лактозы. По одному из вариантов наполнителем в исходном грануляте является микрокристаллическая целлюлоза и/или лактоза. Лактоза особенно приемлема для формования таблеток. Примеры связующих, приемлемых для использования по изобретению, включают, без ограничения,гидроксипропилцеллюлозу, кукурузный крахмал, предварительно желатинизированный крахмал, модифицированный кукурузный крахмал, поливинилпирролидон (PVP) (типичный молекулярный вес колеб-4 020288 лется от примерно 5000 до примерно 1000000, предпочтительно примерно от 40000 до 50000), гидроксипропилметилцеллюлозу (HPMC), лактозу, смолу акации, этилцеллюлозу, ацетат целлюлозы, а также восковые связующие, такие как карнаубский воск, парафин, спермацет, полиэтилены или микрокристаллический воск, а также другие обычные связующие и/или смеси двух или более указанных связующих. По одному из вариантов связующее, если оно есть в исходном грануляте, представляет собой предварительно желатинизированный крахмал. Примеры дезинтегрантов, пригодных для применения по изобретению, включают, без ограничения,натриевую соль кроскармеллозы, кросповидон, крахмал, картофельный крахмал, предварительно желатинизированный крахмал, кукурузный крахмал, крахмал-гликолят натрия, микрокристаллическую целлюлозу, гидроксипропилциллюлозу с низкой степенью замещения и другие известные дезинтегранты. В составах по изобретению можно применять некоторые специфические виды дезинтегрантов. Например,можно применять любой сорт кросповидона, включая, например, кросповидон XL-10 и вещества, выбранные из группы, состоящей из Kollidon CL, Polyplasdone XL, Kollidon CL-M, Polyplasdone XL-10 и Polyplasdone INF-10. По одному из вариантов дезинтегрант, если он есть, является натриевой солью гликолята крахмала, натриевой солью кроскармеллозы и/или кросповидоном. По одному из вариантов дезинтегрант представляет собой натриевую соль гликолята крахмала. По другому варианту дезинтегрант является натриевой солью кроскармеллозы и/или кросповидоном, которые особенно пригодны для формования таблеток. По одному конкретному варианту дезинтегрантом является кросповидон XL-10 со степенью пероксидирования менее 400 ч./млн (м.д.). Эти вещества называются также нерастворимый поливидон, нерастворимый PVP, сшитый PVP и PVPP. Кросповидон можно заменить натриевой солью кроскармеллозы, натриевой солью гликолята крахмала или предварительно желатинизированным крахмалом (например, при концентрации, равной 5-10%). Примеры смазочных агентов, приемлемых для использования, включают, без ограничения, стеарат магния, стеарат цинка, стеарат кальция, тальк, карнаубский воск, стеариновую кислоту, пальмитиновую кислоту, стеарилфумарат натрия, лаурилсульфат натрия, глицерилпальмитостеарат, пальмитиновую кислоту, миристиновую кислоту и гидрированные растительные масла и жиры, а также другие известные смазочные агенты и/или смеси двух или более таких агентов. По другому варианту смазочный агент, если он есть в исходном грануляте, представляет собой стеарат магния. Примеры веществ, способствующих скольжению и/или препятствующих слипанию, подходящих для применения по изобретению, включают, без ограничения, двуокись кремния, коллоидальную двуокись кремния, силикат магния, трисиликат магния, тальк и другие виды двуокиси кремния, такие как агрегированные силикаты и гидратированная двуокись кремния. По одному из вариантов исходного гранулята наполнителем служит микрокристаллическая целлюлоза и/или моногидрат лактозы, связующее, если оно есть, является предварительно желатинизированным крахмалом, дезинтегрант, если он есть, является натриевой солью гликолята крахмала, натриевой солью кроскармеллозы и/или кросповидоном, смазочный агент, если он есть, является стеаратом магния и агент, способствующий скольжению и/или препятствующий слипанию, является двуокисью кремния и/или тальком. По одному из вариантов таблетка или капсула имеет защитный внешний слой. Защитный внешний слой таблетки или капсулы, если он есть, может включать от примерно 10 до примерно 95% полимера в расчете на вес защитного покрытия и может быть получен с применением обычных способов. По одному из вариантов внешний слой таблетки или капсулы включает от примерно 20 % до примерно 90 % полимера в расчете на вес защитного слоя. Состав может содержать по меньшей мере один защитный слой на основе полимера и растворитель для получения покрытия, например воду, которая применяется для обработки и удаляется путем сушки. Подходящие примеры полимера для защитного слоя включают, без ограничения, гидроксипропилметилцеллюлозу, поливиниловый спирт (PVA), этилцеллюлозу, метакриловые полимеры, гидроксипропилцеллюлозу и крахмал. По одному из вариантов полимер защитного слоя является PVA. По другому варианту полимер защитного слоя представляет собой гидроксипропилцеллюлозу. Применение PVA позволяет достичь определения logo, адгезии пленки и облегчает быстрое нанесение покрытия на лекарство, что может быть важным для составов на основе дапаглифлозина из-за чувствительности этого соединения к нагреванию. Покрытие может также содержать пластификатор в количестве от примерно 0 до примерно 30% в расчете на вес слоя покрытия. По одному из вариантов количество пластификатора равно от примерно 15 до примерно 25% в расчете на вес слоя покрытия. Подходящие пластификаторы включают, без ограничения, триацетин, диэтилфталат, трибутилсебацинат, полиэтиленгликоль (PEG), глицерин, триацетин и триэтилцитрат. По одному из вариантов пластификатором является полиэтиленгликоль с молекулярным весом 200-20000. По другому варианту пластификатором служит полиэтиленгликоль с молекулярным весом 400-4000. Еще по одному варианту пластификатор представляет собой полиэтиленгликоль с молекулярным весом 400. По другому варианту покрытие может также включать агент, препятствующий слипанию или способствующий скольжению, такой как тальк, коллоидная двуокись кремния или стеарат магния. По дру-5 020288 гому варианту покрытие может содержать матирующий агент, такой как, например, двуокись титана. Еще по одному варианту слой покрытия может включать один или более красителей, например краситель(и) на основе окиси железа. Примеры коммерчески доступного материала для покрытия включаютOpadry HP и Opadry II белый. Фармацевтические составы по изобретению могут также включать антиоксиданты и хелатирующие агенты. Например, фармацевтические составы могут содержать бутилированный гидроксианизол (BHA),бутилированный гидрокситолуол (BHT), пропилгаллат (PG), метабисульфит натрия, аскарбилпальмитат,метабисульфит калия, динатриевую соль EDTA (этилендиаминтетрауксусная кислота; известный также как динатрийэдетат), EDTA, винную кислоту, лимонную кислоту, моногидрат лимонной кислоты и сульфит натрия. По одному из вариантов фармацевтические составы содержат указанные выше соединения в количестве от примерно 0,01 до примерно 5% вес./вес. По одному конкретному варианту фармацевтический состав содержит BHA, BHT или PG в количестве от примерно 0,02 до примерно 1% и динатрий-EDTA, лимонную кислоту или моногидрат лимонной кислоты в количестве от примерно 2 до примерно 5%. Согласно предпочтительному варианту фармацевтический состав включает BHA в количестве около 0,05% вес./вес. Фармацевтические составы по изобретению, описанные выше, готовят путем смешения вместе дапаглифлозина или пропиленгликоль-гидрата дапаглифлозина и одного или более желаемых эксципиентов, описанных выше, в любом желаемом порядке с получением исходного гранулята и наполнения капсул этим гранулятом или формования таблеток из желаемого количества исходного гранулята. Исходный гранулят, капсулы и таблетки по изобретению могут быть приготовлены различными способами при различном порядке добавления эксципиентов. Полезность этих составов не ограничена конкретной лекарственной формой или способом приготовления. Например, таблетки из исходного гранулята можно изготовить методом мокрого гранулирования, сухого гранулирования, путем прямого смешения или любым другим фармацевтически приемлемым способом, описанным в данной заявке или известным из уровня техники. Фармацевтические составы по изобретению могут быть в любой упаковке, которая способствует стабильности состава. Например, можно применять герметичные флаконы из полиэтилена высокой плотности (HDPE), содержащие десиккант, гель двуокиси кремния, или алюминиевый блистер со слоемPVC. Применение такой упаковки позволяет контролировать нежелательное окисление продукта при комнатной температуре. Ниже приведены примеры некоторых вариантов составов в виде таблеток и капсул. Таблица I Состав таблетки и капсулыg. s. относится к количеству, достаточному для получения 100% вес./вес. исходного гранулята. Пленочное покрытие для капсул или таблеток по табл. II содержит, например, поливиниловый спирт (PVA), двуокись титана, полиэтиленгликоль, тальк и краситель. Таблетки или капсулы различной концентрации (0,1-50 мг) можно изготовить из различного количества исходного гранулята. Фармацевтический состав в виде таблетки может быть получен способом, включающим стадии: а) смешения неактивных ингредиентов с лекарством (дапаглифлозин или пропиленгликоль-гидрат дапаглифлозина) с применением комбинации стадий смешения и размалывания; б) формования гранул; в) сушки и/или просеивания гранул; г) смешения гранул и д) формования полученной смеси г) с получением таблеток. По одному из вариантов стадия а) способа предусматривает применение оборудования для измельчения и/или рассева. По одному из вариантов гранулы на стадии б) способа получают методом сухого гранулирования, мокрого гранулирования или прямого сжатия. По одному из вариантов гранулы получают путем сухого гранулирования. По одному из вариантов гранулы на стадии г) процесса смешивают с добавкой для таблетирования или со смазочным агентом и наполнителем. Фармацевтический состав в виде капсулы можно получить способом, включающим стадии: а) смешения неактивных ингредиентов с лекарством с применением комбинации стадий смешения и размалывания; б) формования гранул; в) сушки и/или просеивания гранул; г) заполнения гранулами капсул. По одному из вариантов стадия а) способа предусматривает применение оборудования для измельчения и/или рассева. По одному из вариантов гранулы на стадии б) способа получают методом сухого гранулирования, мокрого гранулирования или прямого сжатия. По одному из вариантов гранулы получают путем сухого гранулирования. Дапаглифлозин в виде его пропиленгликоль-гидрата S)-форма и (R)-форма) может быть получен способом, описанным в заявке США 11/765481, поданной 28 июня 2007 г., в патенте США 20080004336 А 1 и в предварительной заявке США 60/817118, поданной 28 июня 2006 г. Например, (S)-пропиленгликоль-гидрат дапаглифлозина (соединение Ia) может быть получен следующим образом: берут соединение A (полученное, как описано в заявке США 10/745075, поданной 23 декабря 2003 г., примеры 17-20) формулы A обрабатывают соединение A спиртовым растворителем, таким как метанол или этанол, и водным основанием, таким как гидроокись натрия, и водой, если необходимо, в инертной атмосфере и при повышенной температуре, если необходимо; добавляют кислоту, такую как соляная кислота, для нейтрализации реакционной смеси с получением соединения I формулы обрабатывают реакционную смесь, содержащую соединение I, органическим растворителем, таким как метил-трет.бутиловый эфир, алкилацетатом, таким как этилацетат, метилацетат, изопропилацетат или бутилацетат, и (S)-пропиленгликолем; возможно добавлять затравку (S)-пропиленгликоль-гидрата Ia(SC-3) к смеси с образованием (S)-пропиленгликоль-гидрата дапаглифлозина, соединение Ia (форма SC-3). В другом примере пропиленгликоль-гидрат дапаглифлозина может быть получен способом, включающим стадию восстановления соединения формулы B для удаления метоксильной группы; обработки соединения B восстановителем, таким как триэтилсилилгидрид, и активатором, который является кислотой Льюиса, такой как BF3Et2O, и органическим растворителем, таким как CH3CN, и водой; выделения соединения формулы I и обработки соединения I (S)-пропиленгликолем в присутствии растворителя, такого как трет.бутилметиловый эфир, и, возможно, зародышами соединения Ia S)-пропиленгликоль-гидратом дапаглифлозина) с образованием суспензии кристаллов соединения Ia S)-пропиленгликоль-гидрата дапаглифлозина). Описанный выше способ осуществляют в одном реакционном сосуде, что сводит к минимуму образование промежуточных соединений, приводит к повышению выхода и преимущественному образованию конечного кристаллического соединения Ia S)-пропиленгликоль-гидрата дапаглифлозина). При проведении способа получения соединения Ia (S)-пропиленгликоль применяется в мольном отношении к соединению I, равном от примерно 0,9:1 до примерно 1,5:1. По одному из вариантов (S)-8 020288 пропиленгликоль применяют в мольном отношении к соединению I, равном от примерно 0,98:1 до примерно 1,2:1.(R)-Пропиленгликоль-гидрат дапаглифлозина (соединение Ib) может быть получен с применением следующих стадий: берут соединение A (полученное, как описано в заявке США 10/745075, поданной 23 декабря 2003 г., примеры 17-20), формулы А обрабатывают соединение A спиртовым растворителем, таким как метанол или этанол, и водным основанием, таким как гидроокись натрия, и водой, если необходимо, в инертной атмосфере и при повышенной температуре, если необходимо; добавляют кислоту, такую как соляная кислота, для нейтрализации реакционной смеси с получением соединение I формулы обрабатывают реакционную смесь, содержащую соединение I, органическим растворителем, таким как метил-трет.бутиловый эфир, алкилацетатом, таким как этилацетат, метилацетат, изопропилацетат или бутилацетат, и (R)-пропиленгликолем; можно добавлять затравку (R)-пропиленгликоль-гидрата, соединение Ib (SD-3), к смеси с образованием (R)-пропиленгликоль-гидрата дапаглифлозина, соединение Ib Активность дапаглифлозина или пропиленгликоль-гидрата дапаглифлозина может быть определена с применением, например, системы анализов, описанных ниже или других известных методов анализа. мРНК последовательность для SGLT2 человека (GenBank M95549) клонируется путем обратной транскрипции и амплификации из мРНК почки человека с применением стандартных методов молекулярной биологии. кРНК последовательность стабильно трансфицируется в клетке CHO, и клоны испытываются на активность SGLT2, в основном, как описано Ryan et al., "HK-2: an immortalized proximal tubule epithelial cell line from normal adult human kidney", Kidney International, 45: 48-57 (1994). Оценка ингибирования активности SGLT2 в клонально отобранной клеточной линии осуществляется, в основном, как описано Ryan et al. (1994), со следующими модификациями. Клетки выращивают в течение 2-4 дней в 96 луночных планшетах до 75000 или 30000 клеток/лунку в питательной смеси F-12 (Ham's F-12), 10%-й фетальной телячьей сыворотки, 300 мкг/мл Geneticin и пенициллин-стрептомицин. В момент слияния клетки промывают дважды 10 мМ Hepes/Tris, pH 7,4, 137 мМ N-метил-D-глюкамина, 5,4 мМ KCl, 2,8 мМCaCl2, 1,2 мМ MgSO4. Затем клетки инкубируют с 10 мкМ [14C] AMG и 10 мкМ ингибитора (конечная концентрация DMSO=0,5%) в 10 мМ Hepes/Tris, pH 7,4, 137 мМ NaCl, 5,4 мМ KCl, 2,8 мМ CaCl2, 1,2 мМMgSO4 при температуре 37C в течение 1,5 ч. Определение поглощения обрывают ледяным 1X PBS, содержащим 0,5 мМ флорицина, затем клетки встряхивают в течение 1 ч и затем количественно определяют [14C] AMG (глюкозный аналог -метил-D-глюкопиранозид) с помощью сцинтилляционного счетчикаTopCount. Контрольные опыты проводят с NaCl и без него. Для определения величины EC50 используют 10 концентраций ингибитора (дапаглифлозина) с интервалами 2 log в соответствующем интервале ответа и определяют величину 3 раза. Фармацевтические составы по изобретению, содержащие дапаглифлозин или его пропиленгликольгидрат, обладают активностью, так как ингибитор натрийзависимых транспортеров глюкозы, обнаруженный в кишечнике и почке млекопитающих, является селективным ингибитором активности почечного SGLT2 и, следовательно, его можно применить при лечении болезней или расстройств, связанных с активностью SGLT2. Соответственно, фармацевтические составы на основе дапаглифлозина или его пропиленгликольгидрата по изобретению можно вводить млекопитающим, предпочтительно людям, для лечения различных состояний и расстройств, связанных с активностью SGLT2, включая, без ограничения, лечение или задержку развития или начало диабета (включая диабет типа I и типа II, ухудшенную переносимость глюкозы, устойчивость к инсулину и осложнения при диабете, такие как нефропатия, ретинопатия, нейропатия и катаракты), гипергликемии, гиперинсулинемии, гиперхолестеринемии, дислипидемии, повышенных уровней свободных жирных кислот или глицерина в крови, гиперлипидемии, гипертриглицеридемии, ожирения, для заживления ран, от тканевой ишемии, атеросклероза и повышенного давления. Составы по изобретению можно также применять для увеличения уровня липопротеина высокой плотности (HDL) в крови. Кроме того, состояния, болезни и нарушения, называемые "синдромом X" или метаболическим синдромом, определенные подробно в Johannsson, J. Clin. Endocrinol. Metab. 82, 727-34(1997), также можно лечить с применением составов по изобретению. Составы по изобретению в виде капсул или таблеток, содержащих дапаглифлозин или пропиленгликоль-гидрат дапаглифлозина, можно вводить в дозах от примерно 0,1 до примерно 750 мг в день в виде единичных или разделенных доз или множественных доз, которые вводятся 1-4 раза в день. По одному из вариантов составы по изобретению в виде капсул или таблеток, содержащих дапаглифлозин или пропиленгликоль-гидрат дапаглифлозина, можно вводить в дозах от примерно 0,2 до примерно 600 мг в день в виде единичных или разделенных доз или множественных доз, которые вводятся 1-4 раза в день. По другому варианту составы по изобретению в виде капсул или таблеток, содержащих дапаглифлозин или пропиленгликоль-гидрат дапаглифлозина, можно вводить в дозах от примерно 0,5 до примерно 100 мг в день в виде единичных или разделенных доз или множественных доз, которые вводятся 1-4 раза в день. Данное изобретение включает фармацевтические составы, содержащие в качестве активного ингредиента терапевтически эффективное количество дапаглифлозина или пропиленгликоль-гидрата дапаглифлозина, одного или в сочетании с фармацевтическим носителем или разбавителем, как описано выше. Составы по изобретению можно применять для отдельного лечения или в комбинации с одним или несколькими другими терапевтическими агентами в одной дозированной форме (фиксированная доза) или в виде отдельных лекарственных форм. Другие терапевтические агенты, пригодные для комбинирования с составами по изобретению,включают, без ограничения, известные терапевтические агенты, используемые при лечении упомянутых выше расстройств, связанных с активностью SGLT2, включая антидиабетические агенты, антигипергликемические агенты, гиполипидемические агенты или агенты, снижающие содержание липидов, агенты от ожирения, гипотензивные средства и подавители аппетита. Примеры подходящих антидиабетических агентов, применяемых в комбинации с составами по изобретению, включают, без ограничения, бигуаниды (например, метформин или фенформин), ингибиторы глюкозидазы (например, акарбозу или миглитол), инсулины (включая стимуляторы инсулина или сенсибилизаторы инсулина), меглитиниды (например, репаглинид), сульфонилмочевины (например, глимепирид, глибурид, гликлазид, хлорпропанид и глипизид), комбинации бигуанида/глибурида (например, Glucovance), тиазолиндионы (например, троглитазон, росиглитазон и пиоглитазон), агонисты PPAR-альфа,агонисты PPAR-гамма, двойные агонисты PPAR-альфа/гамма, ингибиторы гликогенфосфорилазы, ингибиторы белка, связывающего жирные кислоты (aP2), глюкагонподобный пептид-1 (GLP-1) и другие агонисты рецептора GLP-1 и ингибиторы дипептидилпептидазы IV. Другие подходящие тиазолиндионы включают, без ограничения, MCC-55 (описанный в патенте США 5594016, Mitsubishi), фараглитазар (GI-262570, Glaxo-Wellcome), энглитазон (СР-68722, Pfizer) или дарглитазон (СР-86325, Pfizer; исаглитазон, MIT/Johnson and Johnson), реглитазар (JTT-501,JPNT/Pharmacia and Upjohn), ривоглитазон (R119702, Sankyo/WL), лираглутид (NN-2344, Dr. Reddy/NN) и (Z)-1,4-бис-4-[(3,5-диоксо-1,2,4-оксадиазолин-2-ил-метил)]феноксибутен-2-ен (YM-440, Yamanouchi). Примеры агонистов PPAR-альфа, агонистов PPAR-гамма и двойных агонистов PPAR-альфа/гамма включают, без ограничения, мураглитазар, пелиглитазар, тесаглитазар AR-H039242 (Astra/Zeneca), GW501516 (Glaxo-Wellcome), KRP297 (Kyorin Merck), а также соединения, описанные Murakami et al., "AFatty Rats", Diabetes 47, 1841-1847 (1998); WO 01/21602, и в патенте США 6414002, и в патенте США 6653314, содержание которых включено полностью в качестве ссылки в данную заявку, при применении доз, указанных в этих публикациях. По одному из вариантов соединения, указанные в этих ссылках как предпочтительные, являются предпочтительными для применения по изобретению. Подходящие ингибиторы aP2 включают, без ограничения, соединения, описанные в заявке США 09/391053, поданной 7 сентября 1999 г., и в патенте США 6548529, содержание которых включено полностью в качестве ссылки в данную заявку; применяемые дозы указаны в этих ссылках. Подходящие ингибиторы DPP4 включают, без ограничения, ингибиторы, описанные в заявкахet al., Bioorg. and Med. Chem. Lett., Vol. 6, N 22, p.p. 1163-1166 and 2745-2748 (1996), соединение, описанное в заявке США 10/899641, заявке WO 01/68603 и в патенте США 6395767; можно использовать дозы, указанные в этих ссылках; все эти источники включены полностью в качестве ссылок в данную заявку. По одному из вариантов ингибитором DPP4 является саксаглиптин. Другие подходящие меглитиниды включают натеглинид (Novartis) или KAD 1229 (PF/Kissei). Примеры подходящих антигипергликемических агентов для применения в комбинации с составами по изобретению включают, без ограничения, глюкагонподобный пептид-1 (GLP-1), такой как GLP-1 (1-36) амид, GLP-1 (7-36) амид, GLP-1 (7-37) амид (описанные в патенте США 5614495, включенном полностью в качестве ссылки в данную заявку), а также эксенатид (Amylin/Lilly), LY-315902 (Lilly), MK-0431(Merck), лираглютид (NovoNordisk), ZP-10 (Zealand Pharmaceuticals A/S), CJC-1131 (Conjuchem Inc.) и соединения, описанные в заявке WO 03/033671, включенной полностью в качестве ссылки в данную заявку. Примеры подходящих гиполипидемических агентов/агентов, снижающих содержание липидов, для применения в комбинации с составами по изобретению включают один или более ингибиторов MTP,ингибиторов HMG CoA-редуктазы, ингибиторов сквален-синтазы, производные фибриновой кислоты,ингибиторы ACAT, ингибиторы липоксигеназы, ингибиторы абсорбции холестерина, ингибиторыNa+/желчная кислота котранспортера, позитивные регуляторы активности рецептора LDL, секвестранты желчных кислот, белок переноса холестериновых эфиров (например, ингибиторы CETP, такие как торцетрапиб (CP-529414, Pfizer) и JTT-705 (Akros Pharma), агонисты PPAR (как указано выше) и/или никотиновую кислоту и ее производные. Гиполипидемический агент может быть позитивным регулятором активности рецептора LD2, таким как 1-(3 Н)-изобензофуранон-3-(13-гидрокси-10-оксотетрадецил-5,7 диметокси- (MD-700, Taisho Pharmaceutical Co. Ltd.) и холестан-3-ол-4-(2-пропенил)-(3a,4 а,5 а)- (LY 295427, Eli Lilly). Предпочтительные гиполипидемические агенты включают, например, правастатин,ловастатин, симвастатин, аторвастатин, флувастатин, церивастатин, атавастатин и росувастатин (ZD-4522). Примеры ингибиторов MTP, которые можно применять, как описано выше, включают, без ограничения, соединения, описанные в патентах США 5595872, 5739135, 5712279, 5760246, 5827875,5885983 и 5962440, все эти патенты включены полностью в качестве ссылки в данную заявку. Примеры ингибиторов HMG CoA-редуктазы, которые можно применять в комбинации с составами по изобретению, включают, без ограничения, мевастатин и родственные соединения, описанные в патенте США 3983140, ловастатин (мевинолин) и родственные соединения, описанные в патенте США 4231938, правастатин и родственные соединения, такие как описанные в патенте США 4346227,симвастатин и родственные соединения, описанные в патентах США 4448784 и 4450171. Другие подходящие ингибиторы HMG CoA-редуктазы включают, без ограничения, флувастатин, описанный в патенте США 5354772, церивастатин, описанный в патентах США 5006530 и 5177080, аторвастатин, описанный в патентах США 4681893, 5273995, 5385929 и 5686104, атавастатин (Nissan/Sankyo нисвастатин (NK-104, описанный в патенте США 5011930, росувастатин (Shionogy-Astra/Zeneca(ZD-4522, описанный в патенте США 5260440, и родственные статины, описанные в патенте США 5753675, пиразольные аналоги производных мевалонолактона, описанные в заявке WO 86/03488, 6-[2(замещенный пирол-1-ил)алкил]пиран-2-оны и их производные, описанные в патенте США 4647576,Searle's SC-45355 (производные 3-замещенной пентандионовой кислоты) дихлорацетат, имидазольные аналоги меванолактона, описанные в заявке WO 86/07054, производные 3-карбоокси-2-гидроксипропанфосфоновой кислоты, описанные, например, в патенте Франции 2596393, 2,3-дизамещенный пиррол,производные фурана и тиофена, описанные, например, в заявке ЕР 0221025, нафтильные аналоги меванолактона, описанные в патенте США 4686237, октагидронафталины, такие как описанные в патенте США 4499289, кетоаналоги мевинолина (ловастатина), описанные например, в заявке ЕР 0142146 А 1,и производные хинолина и пиридина, описанные, например, в патентах США 5503219 и 5691322. Все указанные выше источники полностью включены в качестве ссылок в данную заявку. Кроме того,соединения фосфиновой кислоты, пригодные для ингибирования HMG CoA-редуктазы, описанные, например, в GB 2205837, также можно применять в комбинации с составами по изобретению. Примеры ингибиторов сквален-синтазы, пригодные для применения по изобретению, включают,без ограничения, -фосфоносульфонаты, описанные в патенте США 5712396, описанные Biller et al.,J. Med. Chem., 1988, Vol. 31, N 10, p.p. 1869-1871, включая изопреноид(фосфинилметил)фосфонаты, а также другие известные ингибиторы сквален-синтазы, например описанные в патентах США 4871721 и 4924024 и в публикации Biller S.A., Neuenschwander, K., Ponpipom, M.М, and Poulter, С.D., CurrentMontellano et al., J. Med. Chem., 1977, 20, 243-249; аналог А фарнезилдифосфата и аналоги пирофосфата пресквалена (PSQ-PP), например описанные Corey and Volante, J. Am. Chem. Soc., 1976, 98, 1291-1293; фосфинилфосфонаты, описанные Mc.Clard, R.W. et al., J.A.C.S., 1987, 109, 5544, и циклопропаны, описанные Capson Т.L., PhD dissertation, June, 1987, Dept. Med. Chem. U of Utah, Abstract, Table of Contents,p.p. 16, 17, 40-43, 48-51, Summary. Все эти указанные выше источники включены полностью в качестве ссылок в данную заявку. Примеры производных фибриновой кислоты, используемых в комбинации с составами по изобретению, включают, без ограничения, фенофибрат, гемфиброзил, клофибрат, безафибрат, ципрофибрат,клинофибрат и т.п., пробукол и родственные соединения, описанные, например, в патенте США 3674836, секвестранты желчных кислот, такие как холестирамин, колестипол и DEAE-Sephadex(Secholex, Policexide), а также липостабил (Rhone-Poulenc), Eisai E-5050 (производные N-замещенного этаноламина), имаксинил (HOE-402), тетрагидролипстатин (THL), истигмастанилфосфорилхолин (SPC,Roche), аминоциклодекстрин (Tanabe Seiyoki), Ajinomoto AJ-814 (производное азулена), мелинамид (Sumitomo), Sandoz 58-035, American Cyanamid CL-277082 и CL-283546 (дизамещенные производные мочевины), никотиновую кислоту, аципимокс, ацифран, неомицин, п-аминосалициловую кислоту, аспирин,поли(диаллилметиламина) производные, такие как описанные в патенте США 4759923, четвертичный амин поли(диаллилдиметиламмонийхлорид) и ионены, такие как описанные в патенте США 4027009, и другие известные агенты, снижающие уровень холестерина в сыворотке. По одному из вариантов производное фибриновой кислоты является пробуколом или гемфиброзилом. Все указанные публикации включены в данную заявку полностью в качестве ссылок. Примеры ингибиторов ACAT, которые можно применять в комбинации с составами по изобретению,включают, без ограничения, соединения, описанные в Drugs of the Future, 24, 9-15 (1999) (Avasimibe);Pharmaceutical Co. Ltd.). Все указанные публикации включены полностью в данную заявку в качестве ссылок. Примеры подходящих ингибиторов абсорбции холестерина, применяемых в комбинации с составами по изобретению, включают, без ограничения, SCH 48461 (Schering-Plough), а также соединения, описанные в Atherosclerosis 115, 45-63 (1995) и в J. Med. Chem. 41, 973 (1998); эти источники включены полностью в качестве ссылок в данную заявку. Примеры подходящих ингибиторов Na+/желчная кислота-транспортеров, применяемых в комбинации с составами по изобретению, включают, без ограничения, соединения, описанные в Drugs in the Future,24, 425-30 (1999); эта статья полностью включена в качестве ссылки в данную заявку. Примеры ингибиторов липоксигеназы включают, без ограничения, ингибиторы 15-липоксигеназы(15-LO), такие как производные бензимидазола, описанные, например, в WO 97/12615, ингибиторы (15LO), описанные, например, в WO 97/12613, изотиазолоны, описанные, например, в WO 96/38144, и ингибиторы (15-LO), описанные, например, в Sendobry et al. "Attenuation of diet-induced atherosclerosis in rabbitsVascular Disease", Current Pharmaceutical Design, 1999, 5, 11-20. Все эти источники полностью включены в данную заявку в качестве ссылок. Примеры подходящих гипотензивных средств для применения в комбинации с составами по изобретению, включают, без ограничения, бета-адренергические блокаторы, блокаторы кальциевых каналов ирбесартан, валсартан), антагонисты ET рецептора (например, ситакссентан, атрсентан и соединения,описанные в патентах США 5612359 и 6043265), двойной антагонист ET/AII (например, соединения, описанные в WO 00/01389), ингибиторы нейтральной эндопептидазы (NEP), ингибиторы вазопепсидазы (двойные ингибиторы NEP-ACE) (например, омапатрилат и гемопатрилат) и нитраты. Все эти источники полностью включены в качестве ссылок в данную заявку. Примеры агентов от ожирения, подходящих для применения в комбинации с составами по изобретению, включают, без ограничения, бета-3-адренергические агонисты, ингибиторы липазы, ингибиторы обратного поглощения серотонина (и допамина), бета-тироидный рецептор, агонисты 5 НТ 2 С (такие, какArena APD-356); антагонисты MCHR1 (такие, как Synaptic SNAP-7941 и Takeda T-226926), агонисты рецептора меланокортина (MC4R), антагонисты рецептора меланин-концентрирующего гормона (MCHR)(такие, как Synaptic SNAP-7941 и Takeda T-226926), модуляторы рецептора галанина, антагонисты орексина, агонисты CCK, антагонисты NPY1 или NPY5, модуляторы NPY2 или NPY4, агонисты кортикотропинвысвобождающего фактора, модуляторы рецептора-3 гистамина (H-3), ингибиторы 11-бета-HSD-1,модуляторы рецептора адинопектина, ингибиторы или высвобождающие агенты ингибиторов обратного поглощения моноамина, цилиарные нейтрофические факторы (CNTF, такой как AXOKINE Regeneron),BDNF (нейтрофический фактор мозга), лептин и модуляторы рецептора лептина, антагонисты рецептора каннабиноида-1 (такие, как SR-141716 (Sanofi) или SLV-319 (Solvay и аноректические средства. Бета-3-адренергические агонисты, применяемые в комбинации с составами по изобретению, включают, без ограничения, AJ9677 (Takeda/Dainippon), L750355 (Merck), CP 331648 (Pfizer) или другие известные бета-3-агонисты, например описанные в патентах США 5541204, 5770615, 5491134,5776983 5488064, включенных полностью в данную заявку в качестве ссылок. Примеры ингибиторов липазы, которые можно применять в комбинации с составами по изобретению, включают, без ограничения, орлистат и ATL-962 (Alizyme). Ингибиторы обратного поглощения серотонина (и допамина) включают, без ограничения, BVT-933(Biovitrum), сибутрамин, топирамат (Johnson and Johnson) и аксокин (Regeneron). Примеры бета-соединений тироидного рецептора, которые можно применять в комбинации с составами по изобретению, включают, без ограничения, лиганды тироидного рецептора, такие как описанные в WO 97/21933 (U. Cal SF), WO 99/00353 (KaroBio) и WO 00/039077 (KaroBio); эти заявки полностью включены в качестве ссылок в данную заявку. Примеры ингибиторов обратного поглощения моноаминов, которые могут применяться в комбинации с составами по изобретению, включают, без ограничения, фенфлурамин, дексфенфлурамин, флуоксетин, пароксетин, сертралин, хлорфентермин, клофорекс, клортермин, пицилорекс, сибутрамин, дексамфетамин, фентермин, фенилпропаноламин и мазиндол. Аноректические средства, которые могут применяться в комбинации с составами по изобретению,включают, без ограничения, топирамат (Johnson and Johnson), дексамфетамин, фентермин, фенилпропаноламин и мазиндол. Все указанные выше патенты и заявки на патент включены в данную заявку в качестве ссылок. В тех случаях, когда составы по изобретению применяются в комбинации с другим(ими) терапевтическим(ими) агентом(ами), этот другой терапевтический(ие) агент(ы) можно использовать в количествах, например, указанных в Physician's Desk Reference, а также в указанных выше патентах и заявках на патент, или известных специалисту и используемых этим специалистом. Когда любой из составов по изобретению применяется в комбинации с другим терапевтическим(ими) агентом(ами), каждое из соединений в этой комбинации может вводиться одновременно или последовательно и в любом порядке, компоненты могут вводиться в отдельности или в виде фиксированной комбинации в терапевтически эффективных количествах, например в виде ежедневных доз. По одному из вариантов изобретения фиксированную комбинацию можно приготовить путем смешения сухого гранулята дапаглифлозина или пропиленгликоль-гидрата дапаглифлозина по изобретению и сухого гранулята другого терапевтического(их) агента(ов) и заполнения капсул желаемого размера, формы,цвета и т.д. этой смесью или формования таблеток путем сжатия этой смеси. Хотя данное изобретение было описано со ссылками на его предпочтительные варианты, специалистам очевидно, что, не выходя за рамки и объем изобретения, определенный формулой изобретения,можно осуществить различные изменения формы и деталей изобретения. Должно быть ясно, что данное изобретение можно осуществить иначе, чем конкретно описано в приведенном выше описании и в примерах. Многочисленные модификации и изменения настоящего изобретения в свете описания к данной заявке входят в объем данного изобретения, определенный формулой изобретения. Следующие ниже примеры приведены для более подробного описания изобретения. Эти примеры,которые отражают лучшую форму осуществления, иллюстрируют и не ограничивают изобретение. Примеры Следующие рабочие примеры иллюстрируют данное изобретение. Все температуры указаны в градусах Цельсия, если не указано иное. Пример 1. Получение дапаглифлозина (соединение I). Получение соединений формулы I, в общем, описано в патенте США 6414126 и конкретно пока- 13020288 зано на схеме 1 и в примере 1 патента США 5515117; обе эти ссылки включены в данную заявку в качестве ссылок. Стабильные формы соединений формулы I могут кристаллизоваться в виде сольватов(например, гидратов) или комплексов. Пример 2 А. Получение (S)-пропиленгликоль-гидрата дапаглифлозина (соединение Ia). Получение соединения формулы Ia описано и схематически отражено ниже. Соединение A может быть получено в примере 1, часть E патента США 6515117. В стеклянный реактор объемом 10 л, снабженный термопарой и отверстием для ввода азота, загружали MeOH (1,25 л), деионизированную воду (3,6 л) с последующим добавлением 50%-го водного раствора NaOH (205,9 мл, 3,899 моль). Остаток раствора NaOH в мерном цилиндре подавали вместе с водой(94 мл) в реакционный сосуд. Добавляли соединение A (503,11 г, 0,872 моль) и смесь перемешивали и нагревали до температуры 68C в течение 1,5 ч. Через час температуру в бане снижали от 80 до 70C; внутренняя температура стала равной 65C. По прошествии общего 3-часового периода HPLC показала, что реакция завершена, AP соединения формулы I 99,5. (HPLC: колонка: YMC ODS-А (С-18) S3, 4,650 мм. Растворитель А: 0,2% водный раствор H3PO4. Растворитель В: 90% CH3CN/10% H2O, в начале %В=0,конечное количество %В=100, время градиента: 8 мин, время задержки: 3 мин. Время остановки: 11,0 мин. Скорость истечения: 2,5 мл/мин. Длина волны УФ света: 220 нм.) После охлаждения смеси до 25C добавляли изопропилацетат (2,5 л). Смесь перемешивали в течение 10 мин, и затем отделяли водный слой (pH 12,5), и органический слой промывали водой (1 л). Во время этой промывки pH двухфазной системы доводили до 6,0 конц. HCl (5,0 мл) и затем отделяли водный слой. Перед разделением фаз проводили нейтрализацию с целью предотвращения загрязнения продукта NaOH. (S)-Пропиленгликольное соединение, полученное без нейтрализации, было слабо основным(рН 8,3 у суспензии, полученной при воздействии ультразвука в воде ( 20 мг/мл. Органический слой собирали в отдельном сосуде. Реактор промывали водой (2 л), MeOH (2 л) и пропускали газообразный азот. Раствор соединения B загружали в реактор и вводили (S)-пропиленгликольS)-PG) (67,03 г, 0,872 моль). Можно на этой стадии добавить затравочные кристаллы (S)-PG Ia. Затравочные кристаллы можно получить путем растворения соединения I в растворителе, таком как MTBE, и обработки полученного раствора (S)-пропиленгликолем, а также дальнейшей обработки, как описано выше, без применения затравки. Мгновенная кристаллизация привела к получению густой суспензии. Через 1 ч перемешивания быстро в течение 10 мин добавляли циклогексан (2,5 л) и продолжали перемешивание в течение 21 ч. Продукт отфильтровывали через фильтровальную бумагу (Whatman 5, воронка Бюхнера диаметром 24 дюйма). Фильтрация была быстрой и заняла около 15 мин. Осадок на фильтре промывали смесью (1:1)MTBE/циклогексан (21 л) и сушили с отсасыванием в течение 0,5 ч. Твердый продукт помещали на поднос из пирекса и сушили под вакуумом (25 мм Hg) в печи при 25-30C в течение 2 дней до тех пор,пока определение содержания воды K.F. не показало образование моногидрата (3,6 вес.%). (S)-PG продукт Ia был получен (0,425 кг, выход 97%) в виде снежно-белого твердого вещества, т.пл. 71C, HPLC AP 99,7 (HPLC: подвижная фаза А: 0,05% TFA в H2O. Подвижная фаза В: 0,05% TFA в CAN. Колонка: YMC(R)-Форму дапаглифлозина можно получить, применяя эти же методы и заменив (S)-пропиленгликоль(R)-пропиленгликолем. Пример 2 В. Получение (S)-пропиленгликоль-гидрата дапаглифлозина (соединение Ia). Соединение Ia иначе может быть получено, как описано и показано схематически ниже. 20 г соединения A загружали в реактор при комнатной температуре и нормальном давлении. В реактор добавляли 30 мл метанола и 49,75 мл 3N NaOH и нагревали реакционную смесь до 80C или с обратным холодильником и выдерживали примерно 2-3 ч для завершения реакции 0,5 AP. Смесь охлаждали до 20C и нейтрализовали до pH 6,0-7,5, применяя 1N уксусную кислоту (1 мл/г подачи). Экстракция: продукт экстрагировали из реакционной смеси в 100 мл изопропилацетата, водную фазу отделяли, а органическую фазу промывали водой до величины проводимости 10 мС (4 мл/г подачи). Водную фазу отделяли. Кристаллизация: 2,8 г (1,05 экв.) (S)-(+)-1,2 пропандиол 96%+ добавляли к реакционной смеси. Добавляли затравку 0,1 г соединения I. Добавляли 160 мл циклогексана и охлаждали смесь до 5C. Продукт перемешивали при 5C по меньшей мере в течение 1 ч перед выделением. Выделение и сушка: выделенный остаток промывали смесью 50/50 по объему изопропилацетат/циклогексан. Продукт сушили при 30C в вакуумной печи в условиях полного вакуума. (Остаток считался сухим, когда KF равнялась 3,6-4,1%). Выход=84% (не скорректирован). Степень чистоты=99,81 AP. Содержание PG=15,1-15,8% (GC). Были приготовлены капсулы, содержащие ингибитор SGLT2 формы I (дапаглифлозин) или формы(пример 5) в виде твердых желатиновых капсул серого цвета размером 0 (2,5 и 10 мг) и размером 00(100 мг). Пример 3. Получение капсулы, содержащей 2,5 мг дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина. Получали 25,0 мг исходного гранулята, содержащего 10% дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, которым заполняли серую непрозрачную оболочку капсулы размером 0. А. Исходный гранулят. Количество дапаглифлозина теоретически эквивалентно 81,29% пропиленгликоль-гидрата дапаглифлозина, поэтому можно использовать любой из них. Действительное количество дапаглифлозина зависит от чистоты. Микрокристаллическая целлюлоза является компенсирующим эксципиентом, количество которого может меняться в зависимости от действительного количества пропиленгликоль-гидрата дапаглифлозина и использованного стеарата магния. Предпочтительное количество стеарата магния равно 1,25% (вес./вес.). Оно может составлять 1,25-1,50% (вес./вес.). Исходный гранулят части А и капсулы по примеру 3 были получены в соответствии со следующей методикой. В. Методика получения исходного гранулята по примеру 3. 1. Рассев дапаглифлозина или пропиленгликоль-гидрата дапаглифлозина. 2. Рассев двуокиси кремния. 3. Смешение двуокиси кремния с дапаглифлозином или пропиленгликоль-гидратом дапаглифлозина в подходящем смесителе. 4. Рассев предварительно желатинизированного крахмала и микрокристаллической целлюлозы, если это необходимо. 5. Добавление ингредиентов со стадии 4 в подходящий смеситель. 6. Добавление смеси со стадии 3 к смеси со стадии 5 и смешение. 7. Рассев натриевой соли гликолята крахмала. 8. Добавление ингредиента со стадии 7 к смеси со стадии 6 и смешение. 9. Рассев смеси со стадии 8 и смешение. 10. Рассев части стеарата магния. 11. Добавление ингредиента со стадии 10 к смеси со стадии 9 и смешение. 12. Уплотнение смеси со стадии 11. 13. Измельчение уплотненной смеси со стадии 12. 14. Рассев оставшейся части стеарата магния. 15. Добавление ингредиента со стадии 14 к грануляту со стадии 13 и смешение. С. Продукт по примеру 3: капсула 2,5 мг, содержащая дапаглифлозин/пропиленгликоль-гидрат дапаглифлозина. 1. Заполнение пустых оболочек капсул достаточным количеством исходного гранулята по примеру 3 (10,0% вес./вес.) (в виде несольватированной формы) с целью получения капсул, содержащих 2,5 мг. 2. Обеспыливание капсул. Пример 4. Получение капсулы, содержащей дапаглифлозин/пропиленгликоль-гидрат дапаглифлозина, 10 мг.A. Состав исходного гранулята. Исходный гранулят был получен, как описано в примере 3 А.B. Методика получения исходного гранулята по примеру 4. Получение исходного гранулята проводили, как описано в примере 3 В.C. Продукт по примеру 4: капсула 10 мг с дапаглифлозином. 1. Заполните оболочки капсул исходным гранулятом для капсул, полученным, как описано в примере 3, часть А, (10,0% вес./вес. в виде несольватированной формы) с целью получения капсул (10 мг). 2. Осуществите обеспыливание гранул. 3. Рассортируйте гранулы по весу. Пример 5. Изготовление капсулы с дапаглифлозином/пропиленгликоль-гидратом дапаглифлозина, 100 мг. Состав: 438,6 мг исходного гранулята на основе дапаглифлозина (пример 5, часть А) (22,8% вес./вес.), помещенного в непрозрачные гранулы серого цвета, размер 0. А. Состав исходного гранулята. Количество дапаглифлозина теоретически эквивалентно 81,29% пропиленгликоль-гидрата дапаглифлозина, поэтому можно использовать любой из них. Действительное количество дапаглифлозина или пропиленгликоль-гидрата дапаглифлозина зависит от степени чистоты продукта. Микрокристаллическая целлюлоза является компенсирующим эксципиентом, количество которого может меняться в зависимости от действительного количества применяемого пропиленгликоль-гидрата дапаглифлозина и стеарата магния. Предпочтительное количество стеарата магния составляло 1,25% (вес./вес.). Можно вводить 1,25-1,50% (вес./вес.) стеарата магния. Исходный гранулят части 5 А и капсулы по примеру 5 были получены в соответствии со следующей методикой.B. Методика получения исходного гранулята. 1. Рассев двуокиси кремния. 2. Смешение двуокиси кремния с дапаглифлозином или пропиленгликоль-гидратом дапаглифлозина в подходящем смесителе. 3. Рассев смеси со стадии 2 и затем снова смешение. 4. Рассев предварительно желатинизированного крахмала и микрокристаллической целлюлозы, если это необходимо. 5. Добавление ингредиентов со стадии 4 к смеси со стадии 3 и смешение. 6. Рассев натриевой соли гликолята крахмала. 7. Добавление ингредиента со стадии 6 к смеси со стадии 5 и смешение. 8. Рассев части стеарата магния. 9. Добавление ингредиента со стадии 8 к смеси со стадии 7 и смешение. 10. Уплотнение смеси со стадии 9. 11. Измельчение уплотненной смеси со стадии 10. 12. Рассев оставшейся части стеарата магния. 13. Добавление ингредиента со стадии 12 к грануляту со стадии 11 и смешение.C. Продукт по примеру 5: капсула на основе дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 100 мг. 1. Заполнение пустых оболочек капсул исходным гранулятом для капсул по примеру 5 (22,8% вес./вес. в виде несольватированной формы). 2. Обеспыливание капсул. 3. Сортировка капсул по весу. Капсулы по примеру 3 (2,5 мг), по примеру 4 (10 мг) и по примеру 5 (100 г) применяли для лечения метаболических нарушений, включая ожирение. Пример 6. Лечение метаболических расстройств. Готовили оральный раствор (0,5 мг/мл) путем растворения дапаглифлозина или пропиленгликольгидрата дапаглифлозина в смеси с полиэтиленгликолем 400, NF и водой (USP или очищенная вода) 30:70% об./об. Оральный раствор был прозрачным и бесцветным. Глюкозурическое действие пропиленгликоль-гидрата дапаглифлозина приводит к значительной потере калорий в моче по сравнению с известным ингибитором SGLT2 (GSK 869682). Оценивались результаты косвенного сравнения, полученные при введении двух единичных уменьшающихся доз ингибиторов SGLT2. Количество выделившейся глюкозы в день у здоровых субъектов, принимавших 50, 100, 200 или 500 мг GSK 869682 составляло, соответственно, 5, 6, 12 и 16 г. Количество глюкозы, выделившейся в день у здоровых субъектов, принимавших 5, 20, 50 или 100 мг пропиленгликоль-гидрата дапаглифлозина, составляло примерно 30, 55, 60 или 70 г, соответственно. Результаты изучения действия пропиленгликоль-гидрата дапаглифлозина были подтверждены 14-дневным опытом со снижающимися дозами и многократным приемом (фаза 2 а) у пациентов, больных диабетом типа II. Пациенты с диабетом типа II получали плацебо, 5 мг пропиленгликоль-гидрата дапаглифлозина, 25 мг пропиленгликоль-гидрата дапаглифлозина или 100 мг пропиленгликоль-гидрата дапаглифлозина. Результаты экскреции глюкозы через 24 ч показывают, что у субъектов, принимавших 5, 25 и 100 мг пропиленгликоль-гидрата дапаглифлозина, наблюдалась значительно большая экскреция глюкозы в моче по сравнению с субъектами, принимавшими плацебо. Ожирение у крыс, вызванное пищей. У самцов крыс Spraque-Dawley (начальный вес=220 г) вызывали ожирение, вызванное ad libitum(свободным) доступом к пище двух видов: нормальная диета (корм Harlan Teklad для крыс; 3,5 ккал/г,5% растительных жиров) и кормом с высоким содержанием сахара и жира (Research Diets D 12327; 46 ккал/г, 40% сахара и 40% растительных жиров). В этих условиях крысы обычно потребляют примерно 30 г/день пищи с высоким содержанием сахара и жира и 2 г/день обычного корма для крыс Harlan Teklad. Крысы с начальным весом, равным 220 г, имевшие доступ к кормам обоих видов, весили примерно 750 г через 10 недель. Изучение острой глюкозурии. Пропиленгликоль-гидрат дапаглифлозина (1, 5 или 10 мг/кг) или плацебо (носитель) давали орально крысам, ожиревшим от корма (DIO), через 24 ч после сбора исходных образцов мочи. Для определения общей потери глюкозы в моче через 24 ч после приема доз измеряли объем мочи и концентрацию глюкозы. Общую концентрацию глюкозы в моче определяли через 24 ч после приема пропиленгликольгидрата дапаглифлозина. Общая потеря глюкозы определялась как объем мочиконцентрация глюкозы. Результаты показали, что общее количество глюкозы, потерянное через 24 ч после приема дозы, значительно возрастает с увеличением доз пропиленгликоль-гидрата дапаглифлозина, т.е. зависит от дозы. Изучение хронической потери веса. Крысы DIO распределялись по группам в зависимости от веса, общего количества килокалорий, потребленных с пищей, и строения тела (при помощи эхо-MRI). В течение 28 дней DIO крысам орально вводили пропиленгликоль-гидрат дапаглифлозина (0,5, 1 или 5 мг/кг) или плацебо. Для оценки значения переедания у животных, получавших лекарство, в подгруппе крыс, которые получили 5 мг/кг пропиленгликоль-гидрата дапаглифлозина, ограничивали прием пищи по сравнению с группой, получавшей плацебо. Вес крыс и вес обоих видов корма определяли ежедневно. Респираторный показатель определяли на 2-й и на 15-й дни опыта, эхо-MRI получали на 22-й день, на 27-й день отбирали образцы крови для быстрого клинического определения. Вводимый продолжительно пропиленгликоль-гидрат дапаглифлозина (ежедневно в течение 25 дней) привел к значительной потере веса (p0,05 по сравнению с приемом носителя) у ожиревших от переедания крыс. Если вызванное приемом соединения переедание предотвращали, потеря веса была больше. Изменение в % рассчитывали по уравнению: вес, определяемый каждый день-вес на день 0100. Потеря веса у пациентов, больных диабетом типа II. Пациентам, больным диабетом типа II, n=389, с неадекватным гликемическим контролем крови и небольшой глюкозурией в исходном состоянии давали орально 1 раз в день пропиленгликоль-гидрат дапаглифлозина (2,5, 5, 10, 20 или 50 мг), метформин XR (750 мг, титрованные до 1500 мг) или плацебо в течение 12 недель. Лечение пропиленгликоль-гидратом дапаглифлозина привело к продолжительному увеличению выделения глюкозы в мочу, средние величины глюкозурии были равны от 51,8 г/день до 85,0 г/день на 12-ю неделю, на исходном уровне эти величины составляли 5,8-10,9 г/день. У крыс, получавших плацебо и метформин, средние величины глюкозурии оставались низкими - 5,7 и 5,6 г/день, соответственно, на 12-ю неделю. Значительная часть пациентов в каждой из групп, получавших пропиленгликоль-гидрат дапаглифлозина, характеризовалась 5%-м уменьшением веса по сравнению с пациентами, получавшими плацебо. Средние величины снижения веса и абсолютные величины изменения массового индекса (BMI) через 12 недель приведены в табл. III. Таблица III Пример 7. Получение таблетки дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 2,5 мг. Таблетки, включающие ингибитор дапаглифлозин или его пропиленгликоль-гидрат, содержали 2,5 мг(пример 7), 10 мг (пример 8) и 50 мг (пример 9) активного вещества, получение их описано ниже. Продукт: таблетка дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 2,5 мг. А. Состав таблетки. Количество дапаглифлозина теоретически эквивалентно 81,29% пропиленгликоль-гидрата дапаглифлозина, можно применять любой ингредиент. Действительное количество пропиленгликоль-гидрата дапаглифлозина зависит от степени чистоты продукта. Микрокристаллическая целлюлоза является компенсирующим эксципиентом, количество которого зависит от действительного количества пропиленгликоль-гидрата дапаглифлозина и стеарата магния. Целевое количество стеарата магния равно 1,94 мг. Можно вводить 1,55-2,33 мг. Исходный гранулят части 7 А и таблетки по примеру 7 получали в соответствии со следующей методикой. В. Получение исходного гранулята. 1. Рассев пропиленгликоль-гидрата дапаглифлозина или дапаглифлозина и стеарата магния с применением разных подходящих сит. 2. Смешение пропиленгликоль-гидрата дапаглифлозина или дапаглифлозина с частью микрокристаллической целлюлозы в подходящем смесителе; измельчение и подача смеси в подходящий смеситель. 3. "Сухая промывка" смесителя, используемого для смешения продукта со стадии 2 с частью микрокристаллической целлюлозы. 4. Добавление смеси со стадии 3 к смеси со стадии 2. 5. Смешение смеси со стадии 4 с оставшейся микрокристаллической целлюлозой, частью кросповидона, частью натриевой соли кроскармеллозы, частью двуокиси кремния и безводной лактозой. 6. Добавление талька и стеарата магния к смеси со стадии 5 и смешение. 7. Сжатие порошковой смеси со стадии 6. 8. Измельчение порошковой смеси со стадии 6. 9. Смешение гранул со стадии 8 с оставшимися количествами кросповидона, натриевой соли кроскармеллозы, двуокиси кремния. 10. Смешение гранул со стадии 9 с оставшейся частью стеарата магния. С. Продукт по примеру 7: таблетка дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 2,5 мг. 1. Подготовка и загрузка устройства для таблетирования. 2. Сжатие исходного гранулята по примеру 7 с получением таблеток. Пример 8. Получение таблетки дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 10 мг. Продукт: таблетка дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 10 мг. А. Состав таблетки. Количество дапаглифлозина теоретически эквивалентно 81,29% пропиленгликоль-гидрата дапа- 19020288 глифлозина, можно применять любой ингредиент. Действительное количество пропиленгликоль-гидрата дапаглифлозина зависит от степени чистоты продукта. Микрокристаллическая целлюлоза является компенсирующим эксципиентом, количество которого зависит от действительного количества пропиленгликоль-гидрата дапаглифлозина и стеарата магния. Целевое количество стеарата магния равно 1,94 мг. Можно вводить 1,55-2,33 мг. Исходный гранулят части 8 А и таблетки по примеру 8 были получены в соответствии со следующей методикой.B. Получение исходного гранулята. 1. Рассев пропиленгликоль-гидрата дапаглифлозина или дапаглифлозина и стеарата магния с применением разных подходящих сит. 2. Смешение микрокристаллической целлюлозы, пропиленгликоль-гидрата дапаглифлозина или дапаглифлозина, части кросповидона, частьи натриевой соли кроскармеллозы, части двуокиси кремния и безводной лактозы с применением разных подходящих сит. 3. Добавление талька и гранулированного стеарата магния к смеси со стадии 2 и смешение в подходящем смесителе. 4. Сжатие порошковой смеси со стадии 3. 5. Измельчение продукта со стадии 4 с получением гранул. 6. Смешение гранул со стадии 5 с оставшимся количеством кросповидона, натриевой соли кроскармеллозы и двуокиси кремния. 7. Смешение гранул со стадии 6 с оставшимся количеством стеарата магния.C. Продукт по примеру 8: таблетка дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 10 мг. 1. Загрузка устройства для таблетирования. 2. Сжатие исходного гранулята из примера 8 с получением таблеток. Пример 9. Получение таблетки дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 50 мг. А. Состав таблетки. Количество дапаглифлозина теоретически эквивалентно 81,29% пропиленгликоль-гидрата дапаглифлозина, можно применять любой ингредиент. Действительное количество пропиленгликоль-гидрата дапаглифлозина зависит от степени чистоты продукта. Микрокристаллическая целлюлоза является компенсирующим эксципиентом, количество которого зависит от действительного количества пропиленгликоль-гидрата дапаглифлозина и стеарата магния. Целевое количество стеарата магния составляет 4,85 мг. Можно вводить примерно 3,76-5,95 мг стеарата магния. Исходный гранулят части 9 А и таблетки по примеру 9 были получены следующим образом.B. Получение исходного гранулята. 1. Смешение пропиленгликоль-гидрата дапаглифлозина или дапаглифлозина, микрокристаллической целлюлозы, безводной лактозы, кросповидона, натриевой соли кроскармеллозы, талька и двуокиси кремния в подходящем смесителе. 2. Подача смеси со стадии 1 в подходящую мельницу. 3. Определение выхода продукта со стадии 1 и расчет требующегося количества стеарата магния. 4. Смешение смеси со стадии 2 в подходящем смесителе. 5. Смешение смеси со стадии 4 со стеаратом магния. 6. Сухое гранулирование порошковой смеси со стадии 5. 7. Рассев гранулята со стадии 6. 8. Определение выхода гранулята со стадии 7. 9. Смешение гранул со стадии 8 с оставшимся количеством кросповидона, натриевой соли кроскармеллозы и двуокиси кремния. 10. Смешение гранул со стадии 9 с оставшимся количеством стеарата магния.C. Продукт по примеру 9: таблетка дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 50 мг. 1. Подготовка и загрузка устройства для таблетирования. 2. Сжатие исходного гранулята по примеру 9 с получением таблеток. Пример 10. Получение таблеток дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 10, 25 и 40 мг. Продукт: таблетки дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 10, 25 и 40 мг. А. Состав гранулята (% вес./вес.). В. Получение исходного гранулята. 1. Смешение пропиленгликоль-гидрата дапаглифлозина или дапаглифлозина с микрокристаллической целлюлозой. 2. Подача смеси со стадии 1 в подходящий измельчитель и измельчение. 3. Смешение смеси со стадии 2 с микрокристаллической целлюлозой, безводной лактозой, кросповидоном и двуокисью кремния. 4. Смешение продукта со стадии 3 со стеаратом магния. 5. Сухое гранулирование порошковой смеси со стадии 4. 6. Рассев гранулята со стадии 5 при помощи подходящего(их) сита (сит). 7. Определение выхода продукта со стадии 6. 8. Смешение гранул со стадии 7 с остальным количеством кросповидона и двуокиси кремния. 9. Смешение гранул со стадии 8 с оставшимся количеством стеарата магния. Таблетки или капсулы с различной концентрацией (8-50 мг) могут быть получены с применением различных количеств этого гранулята и методики получения таблеток, описанной выше. Заполнение капсул и таблетирование осуществляют, как в случае других описанных составов. Пленочное покрытие: гидроксипропилметилцеллюлоза, двуокись титана, полиэтиленгликоль и краситель. Альтернативное пленочное покрытие: поливиниловый спирт (PVA), двуокись титана, полиэтиленгликоль, краситель и тальк. Пример 11. Получение таблеток дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина, 1, 2,5,5 и 10 мг. Продукт: таблетки дапаглифлозина/пропиленгликоль-гидрата дапаглифлозина (1, 2,5, 5 и 10 мг). А. Состав гранулята. 1. Смешение пропиленгликоль-гидрата дапаглифлозина или дапаглифлозина с микрокристаллической целлюлозой. 2. Подача смеси со стадии 1 в подходящий измельчитель и измельчение. 3. Смешение смеси со стадии 2 с микрокристаллической целлюлозой, безводной лактозой, кросповидоном и двуокисью кремния. 4. Смешение продукта со стадии 3 со стеаратом магния. 5. Сухое гранулирование порошковой смеси со стадии 4. 6. Рассев гранулята со стадии 5 при помощи подходящего(их) сита (сит). 7. Определение выхода продукта со стадии 6. 8. Смешение гранул со стадии 7 с оставшимся количеством кросповидона и двуокиси кремния. 9. Смешение гранул со стадии 8 с остальным количеством стеарата магния. Таблетки или капсулы с различной концентрацией (1-20 мг) могут быть получены с применением различных количеств этого гранулята. Заполнение капсул и таблетирование осуществляют, как в случае других описанных составов. Пленочное покрытие: поливиниловый спирт (PVA), двуокись титана, полиэтиленгликоль, тальк и краситель. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтический состав с немедленным высвобождением, содержащий: а) пропиленгликоль-гидрат дапаглифлозина, который содержится в количестве в пределах от 0,1 до 30 вес.% состава; б) наполнители, включающие лактозу в пределах от 20 до 75 вес.% состава и/или микрокристаллическую целлюлозу в пределах от 20 до 75 вес.% состава, при этом общее количество наполнителя составляет в пределах от 20 до 85 вес.% состава; в) дезинтегранты, присутствующие в количестве в пределах от 0,25 до 10 вес.% состава, включающие один или более дезинтегрант, выбранный из группы, включающей натриевую соль кросскармеллозы, кросповидон, и натриевую соль гликолята крахмала; г) агенты, способствующие скольжению и/или препятствующие слипанию, включающие тальк и/или двуокись кремния, где общее количество агента, способствующего скольжению и/или препятствующего слипанию, находится в пределах от 1 до 10 вес.% состава; и д) смазочный агент, включающий стеарат магния, присутствующий в количестве в пределах от 0,2 до 2 вес.% состава. 2. Состав по п.1, отличающийся тем, что пропиленгликоль-гидрат дапаглифлозина является соединением 3. Состав по п.1 или 2, отличающийся тем, что он содержит как лактозу, так и микрокристаллическую целлюлозу. 4. Состав по п.1 или 2, дополнительно содержащий связующее, включающее предварительно желатинизированный крахмал в количестве в пределах от 10 до 75 вес.% состава. 5. Состав по п.1 или 2, где дезинтегрант включает один или более дезинтегрант, выбранный из группы, включающей натриевую соль кросскармеллозы в количестве в пределах от 2 до 10 вес.% состава, кросповидон в количестве в пределах от 4 до 10 вес.% состава и натриевую соль гликолята крахмала в количестве в пределахот 2 до 10 вес.% состава. 6. Состав по любому из пп.1-5, отличающийся тем, что он находится в виде исходного гранулята для заполнения капсул или получения таблеток. 7. Состав по любому из пп.1-5, отличающийся тем, что он находится в виде таблетки или капсулы. 8. Состав по п.7, где состав находится в форме таблетки и покрыт внешним слоем защитного покрытия, включающим полимер и необязательно содержащим один или несколько компонентов из пластификатора(ов), противоадгезионного(ых) агента(ов), агента(ов), способствующего(их) скольжению, и красителя(ей), при этом внешний слой защитного покрытия содержится в количестве от 1 до 5 вес.% состава. 9. Состав по п.1 или 2, отличающийся тем, что он находится в виде капсулы, заполненной исходным гранулятом, выбранным из составов, содержащих 2,5 и 10 мг этого состава, включающий: а) пропиленгликоль-гидрат дапаглифлозина в количестве 10 вес.% содержимого капсулы; б) микрокристаллическую целлюлозу в количестве 68,75 вес.% содержимого капсулы; в) предварительно желатинизированный крахмал в количестве 15 вес.% содержимого капсулы; г) натриевую соль гликолята крахмала в количестве 3 вес.% содержимого капсулы; д) двуокись кремния в количестве 2 вес.% содержимого капсулы и е) стеарат магния в количестве 1,25 вес.% содержимого капсулы. 10. Состав по п.1 или 2, отличающийся тем, что он находится в виде капсулы, заполненной исходным гранулятом, выбранным из составов, содержащих 100 мг этого состава, включающий: а) пропиленгликоль-гидрат дапаглифлозина в количестве 22,8 вес.% содержимого капсулы; б) микрокристаллическую целлюлозу в количестве 55,95 вес.% содержимого капсулы; в) предварительно желатинизированный крахмал в количестве 15 вес.% содержимого капсулы; г) натриевую соль гликолята крахмала в количестве 3 вес.% содержимого капсулы; д) двуокись кремния в количестве 2 вес.% содержимого капсулы и е) стеарат магния в количестве 1,25 вес.% содержимого капсулы. 11. Состав по п.1 или 2, отличающийся тем, что он находится в виде 2,5 мг таблетки, включающий: а) пропиленгликоль-гидрат дапаглифлозина в количестве 3,08 мг; б) микрокристаллическую целлюлозу в количестве 67,11 мг; в) безводную лактозу в количестве 25 мг; г) кросповидон в количестве 8,75 мг; д) натриевую соль кроскармеллозы в количестве 3,75 мг; е) тальк в количестве 12,5 мг; ж) двуокись кремния в количестве 2,88 мг и з) стеарат магния в количестве 1,94 мг. 12. Состав по п.1 или 2, отличающийся тем, что он находится в виде 10 мг таблетки, включающий: а) пропиленгликоль-гидрат дапаглифлозина в количестве 12,3 мг; б) микрокристаллическую целлюлозу в количестве 57,89 мг; в) безводную лактозу в количестве 25 мг; г) кросповидон в количестве 8,75 мг; д) натриевую соль кроскармеллозы в количестве 3,75 мг; е) тальк в количестве 12,5 мг; ж) двуокись кремния в количестве 2,88 мг и з) стеарат магния в количестве 1,94 мг. 13. Состав по п.1 или 2, отличающийся тем, что он находится в виде 50 мг таблетки, включающий: а) пропиленгликоль-гидрат дапаглифлозина в количестве 61,66 мг; б) микрокристаллическую целлюлозу в количестве 114,09 мг; в) безводную лактозу в количестве 62,6 мг; г) кросповидон в количестве 21,91 мг; д) натриевую соль кроскармеллозы в количестве 9,39 мг; е) тальк в количестве 31,3 мг; ж) двуокись кремния в количестве 7,2 мг и з) стеарат магния в количестве 4,85 мг. 14. Состав по п.1 или 2, отличающийся тем, что он содержит: а) пропиленгликоль-гидрат дапаглифлозина в количестве от 0,1 до 15 вес.% состава; б) микрокристаллическую целлюлозу в количестве, которое достаточно для того, чтобы общий вес состава равнялся 100%; в) лактозу в количестве от 10 до 30 вес.% состава; г) кросповидон в количестве от 3 до 10 вес.% состава; д) двуокись кремния в количестве от 1 до 4 вес.% состава и е) стеарат магния в количестве от 0,5 до 2 вес.% состава. 15. Состав по п.1 или 2, отличающийся тем, что он находится в виде 1,0 мг таблетки, содержащий: а) пропиленгликоль-гидрат дапаглифлозина в количестве 1,23 мг; б) микрокристаллическую целлюлозу в количестве от 50 до 90 мг; в) лактозу в количестве от 10 до 30 мг; г) кросповидон в количестве от 2 до 10 мг; д) двуокись кремния в количестве от 0,5 до 4,0 мг; е) стеарат магния в количестве от 0,5 до 2,0 мг и ж) антиоксидант и/или хелатирующий агент в количестве от 0 до 0,5 мг. 16. Состав по п.1 или 2, отличающийся тем, что он находится в виде 2,5 мг таблетки, содержащий: а) пропиленгликоль-гидрат дапаглифлозина в количестве 3,075 мг; б) микрокристаллическую целлюлозу в количестве от 60 до 115 мг; в) лактозу в количестве от 12,5 до 38 мг; г) кросповидон в количестве от 2,5 до 13 мг; д) двуокись кремния в количестве от 0,6 до 5,0 мг; е) стеарат магния в количестве от 0,6 до 2,5 мг и ж) антиоксидант и/или хелатирующий агент в количестве от 0 до 0,6 мг. 17. Состав по п.1 или 2, отличающийся тем, что он находится в виде 5,0 мг таблетки, содержащий: а) пропиленгликоль-гидрат дапаглифлозина в количестве 6,15 мг; б) микрокристаллическую целлюлозу в количестве от 60 до 115 мг; в) лактозу в количестве от 12,5 до 38 мг; г) кросповидон в количестве от 2,5 до 13 мг; д) двуокись кремния в количестве от 0,6 до 5,0 мг; е) стеарат магния в количестве от 0,6 до 2,5 мг и ж) антиоксидант и/или хелатирующий агент в количестве от 0 до 0,6 мг. 18. Состав по п.1 или 2, отличающийся тем, что он находится в виде 10 мг таблетки, содержащий: а) пропиленгликоль-гидрат дапаглифлозина в количестве 12,3 мг; б) микрокристаллическую целлюлозу в количестве от 120 до 230 мг; в) лактозу в количестве от 25 до 75 мг; г) кросповидон в количестве от 5 до 25 мг; д) двуокись кремния в количестве от 1,0 до 10 мг; е) стеарат магния в количестве от 1,0 до 5 мг и ж) антиоксидант и/или хелатирующий агент в количестве от 0 до 1,25 мг.
МПК / Метки
МПК: A61P 3/10, A61K 31/70
Метки: содержащие, пропиленгликоль-гидрат, фармацевтические, дапаглифлозина, составы
Код ссылки
<a href="https://eas.patents.su/25-20288-farmacevticheskie-sostavy-soderzhashhie-propilenglikol-gidrat-dapagliflozina.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические составы, содержащие пропиленгликоль-гидрат дапаглифлозина</a>
Предыдущий патент: Способ удаления азота из потока, содержащего преимущественно метан
Следующий патент: Способ получения углеводородов с2+, система и способ превращения синтез-газа в углеводороды с2+
Случайный патент: Секция вентиляционного воздуховода/дымохода из листового металла и способ ее изготовления












