Неспецифичные иммуностимулирующие агенты
Номер патента: 16033
Опубликовано: 30.01.2012
Авторы: Мозер Кристиан, Каммер Андреас, Цурбригген Ринальдо
Формула / Реферат
1. Применение липидных везикул, содержащих в их липидной мембране по меньшей мере один белок вирусной оболочки, для приготовления лекарства, предназначенного для неспецифической стимуляции иммунной реакции у животного для предотвращения и/или лечения заболевания или расстройства, где липидные везикулы - это пустые липидные везикулы.
2. Применение согласно п.1, где по меньшей мере один белок вирусной оболочки является белком оболочки вируса гриппа.
3. Применение согласно п.2, где по меньшей мере один белок вирусной оболочки представляет собой гемагглютинин (HA) или нейраминидазу (NA).
4. Применение согласно п.2, где белками вирусной оболочки являются гемагглютинин (HA) и нейраминидаза (NA).
5. Применение согласно п.1, где по меньшей мере один белок вирусной оболочки представляет собой белок вирусной оболочки, выбранный из
белка G вируса везикулярного стоматита (ВВС);
белка E1 вируса леса Семлики (ВЛС) и/или
белка F вируса Сендай;
белка E вируса гепатита C (ВГС);
белка F респираторно-синцитиального вируса (РСВ);
белка G респираторно-синцитиального вируса (РСВ).
6. Применение согласно любому из пп. с 1 по 5, где заболевание или расстройство - это инфекционное, неинфекционное, опухолевое, иммунное или метаболическое заболевание или расстройство.
7. Применение согласно п.6, где инфекционное заболевание или расстройство - это вирусное, бактериальное, грибковое, паразитное или прионное заболевание или расстройство.
8. Применение согласно любому из пп. с 1 по 6, где опухолевое заболевание или расстройство - это рак.
9. Применение согласно п.8, где рак - это саркома, лейкоз, лимфома, миелома, меланома, аденома, карцинома, хориокарцинома, гастринома, феохромоцитома, пролактинома, лейкоз/лимфома T-клеток у взрослых или неврома.
10. Применение согласно любому из пп. с 1 по 6, где иммунное заболевание или расстройство - это заболевание или расстройство, характеризуемое иммуносупрессией.
11. Применение согласно любому из пп. с 1 по 10, где лекарственное средство предназначено для неспецифической иммуностимуляции иммунной реакции по меньшей мере на два заболевания или расстройства одновременно.
12. Применение согласно любому из пп.1-11, где животное - это млекопитающее.
13. Применение согласно п.12, где млекопитающее выбрано из человека, шимпанзе, обезьяны циномольгуса, гиббона, низшей (обезьяноподобной) обезьяны, макаки, мыши, крысы, кошки, собаки, лошади, кролика, верблюда, ламы, жвачного животного, свиньи.
14. Применение согласно п.13, где жвачное животное выбрано из коровы, быка, козы, овцы, бизона, буйвола, лани или оленя.
15. Применение согласно любому из пп. с 1 по 14, где лекарство
пригодно для введения внутривенно, внутримышечно, внутрикожно, подкожно, внутрибрюшинно, парентерально, поверхностно, местно, перорально, под язык или путем полоскания; и/или
составлено или смешано как раствор для инъекции, как наклейка, как спрей, как суппозиторий, как раствор для полоскания или как капли.
16. Применение согласно любому из пп. с 1 по 15, где липидные везикулы - это виросомы.
17. Применение согласно п.16, где виросомы - это иммуностимулирующие реконструированные гриппозные виросомы ("гриппозные виросомы") или химерные виросомы.
18. Применение согласно п.17, где гриппозные виросомы или химерные виросомы - это химерные гриппозные виросомы.
19. Липидные везикулы, содержащие в их липидной мембране по меньшей мере один белок вирусной оболочки, предназначенные для неспецифической стимуляции иммунной реакции у животного для предотвращения и/или лечения заболевания или расстройства, где липидные везикулы - это пустые липидные везикулы.
20. Липидные везикулы согласно п.19, где по меньшей мере один белок вирусной оболочки является белком оболочки вируса гриппа.
21. Липидные везикулы согласно п.20, где по меньшей мере один белок вирусной оболочки представляет собой гемагглютинин (HA) или нейраминидазу (NA).
22. Липидные везикулы согласно п.20, где белками вирусной оболочки являются гемагглютинин (HA) и нейраминидаза (NA).
23. Липидные везикулы согласно п.19, где по меньшей мере один белок вирусной оболочки представляет собой белок вирусной оболочки, выбранный из
белка G вируса везикулярного стоматита (ВВС);
белка E1 вируса леса Семлики (ВЛС); и/или
белка F вируса Сендай;
белка E вируса гепатита C (ВГС);
белка F респираторно-синцитиального вируса (РСВ);
белка G респираторно-синцитиального вируса (РСВ).
24. Липидные везикулы согласно любому из пп. с 19 по 23, где заболевание или расстройство - это инфекционное, неинфекционное, опухолевое, иммунное или метаболическое заболевание или расстройство.
25. Липидные везикулы согласно п.24, где инфекционное заболевание или расстройство - это вирусное, бактериальное, грибковое, паразитное или прионное заболевание или расстройство.
26. Липидные везикулы согласно любому из пп. с 19 по 24, где опухолевое заболевание или расстройство - это рак.
27. Липидные везикулы согласно п.26, где рак - это саркома, лейкоз, лимфома, миелома, меланома, аденома, карцинома, хориокарцинома, гастринома, феохромоцитома, пролактинома, лейкоз/лимфома T-клеток у взрослых или неврома.
28. Липидные везикулы согласно любому из пп. с 19 по 24, где иммунное заболевание или расстройство - это заболевание или расстройство, характеризуемое иммуносупрессией.
29. Липидные везикулы согласно любому из пп. с 19 по 28, где липидные везикулы предназначены для неспецифической стимуляции иммунной реакции по меньшей мере на два заболевания или расстройства одновременно.
30. Липидные везикулы согласно любому из пп. с 19 по 29, где животное - это млекопитающее.
31. Липидные везикулы согласно п.30, где млекопитающее выбрано из человека, шимпанзе, обезьяны циномольгуса, гиббона, низшей (обезьяноподобной) обезьяны, макаки, мыши, крысы, кошки, собаки, лошади, кролика, верблюда, ламы, жвачного животного, свиньи.
32. Липидные везикулы согласно п.31, где жвачное животное выбрано из коровы, быка, козы, овцы, бизона, буйвола, лани или оленя.
33. Липидные везикулы согласно любому из пп. с 19 по 32, где липидные везикулы
пригодны для введения внутривенно, внутримышечно, внутрикожно, подкожно, внутрибрюшинно, парентерально, поверхностно, местно, перорально, под язык или путем полоскания; и/или
составлены или смешаны как раствор для инъекции, как наклейка, как спрей, как суппозиторий, как раствор для полоскания или как капли.
34. Липидные везикулы согласно любому из пп. с 19 по 33, где липидные везикулы - это виросомы.
35. Липидные везикулы согласно п.34, где виросомы - это иммуностимулирующие реконструированные гриппозные виросомы ("гриппозные виросомы") или химерные виросомы.
36. Липидные везикулы согласно п.35, где гриппозные виросомы или химерные виросомы - это химерные гриппозные виросомы.
37. Способ неспецифической стимуляции иммунной реакции у животного для лечения или предотвращения заболевания или расстройства, включающий введение указанному животному липидных везикул, содержащих в их липидной мембране по меньшей мере один белок вирусной оболочки, причем липидные везикулы - это пустые липидные везикулы.
38. Способ согласно п.37, где по меньшей мере один белок вирусной оболочки является белком оболочки вируса гриппа.
39. Способ согласно п.38, где по меньшей мере один белок вирусной оболочки представляет собой гемагглютинин (HA) или нейраминидазу (NA).
40. Способ согласно п.38, где белками вирусной оболочки являются гемагглютинин (HA) и нейраминидаза (NA).
41. Способ согласно п.37, где по меньшей мере один белок вирусной оболочки представляет собой белок вирусной оболочки, выбранный из
белка G вируса везикулярного стоматита (ВВС);
белка E1 вируса леса Семлики (ВЛС); и/или
белка F вируса Сендай;
белка E вируса гепатита C (ВГС);
белка F респираторно-синцитиального вируса (РСВ);
белка G респираторно-синцитиального вируса (РСВ).
42. Способ согласно любому из пп. с 37 по 41, где заболевание или расстройство - это инфекционное, неинфекционное, опухолевое, иммунное или метаболическое заболевание или расстройство.
43. Способ согласно п.42, где инфекционное заболевание или расстройство - это вирусное, бактериальное, грибковое, паразитное или прионное заболевание или расстройство.
44. Способ согласно любому из пп. с 37 по 42, где опухолевое заболевание или расстройство - это рак.
45. Способ согласно п.44, где рак - это саркома, лейкоз, лимфома, миелома, меланома, аденома, карцинома, хориокарцинома, гастринома, феохромоцитома, пролактинома, лейкоз/лимфома T-клеток у взрослых или неврома.
46. Способ согласно любому из пп. с 37 по 42, где иммунное заболевание или расстройство - это заболевание или расстройство, характеризуемое иммуносупрессией.
47. Способ согласно любому из пп. с 37 по 46, где способ неспецифически стимулирует иммунную реакцию по меньшей мере на два заболевания или расстройства одновременно.
48. Способ согласно любому из пп. с 37 по 47, где животное - это млекопитающее.
49. Способ согласно п.48, где млекопитающее выбрано из человека, шимпанзе, обезьяны циномольгуса, гиббона, низшей (обезьяноподобной) обезьяны, макаки, мыши, крысы, кошки, собаки, лошади, кролика, верблюда, ламы, жвачного животного, свиньи.
50. Способ согласно п.49, где жвачное животное выбрано из коровы, быка, козы, овцы, бизона, буйвола, лани или оленя.
51. Способ согласно любому из пп. с 37 по 50, где липидные везикулы
пригодны для введения внутривенно, внутримышечно, внутрикожно, подкожно, внутрибрюшинно, парентерально, поверхностно, местно, перорально, под язык или путем полоскания; и/или
составлены или смешаны как раствор для инъекции, как наклейка, как спрей, как суппозиторий, как раствор для полоскания или как капли.
52. Способ согласно любому из пп. с 37 по 51, где липидные везикулы - это виросомы.
53. Способ согласно п.52, где виросомы - это иммуностимулирующие реконструированные гриппозные виросомы ("гриппозные виросомы") или химерные виросомы.
54. Способ согласно п.53, где гриппозные виросомы или химерные виросомы - это химерные гриппозные виросомы.
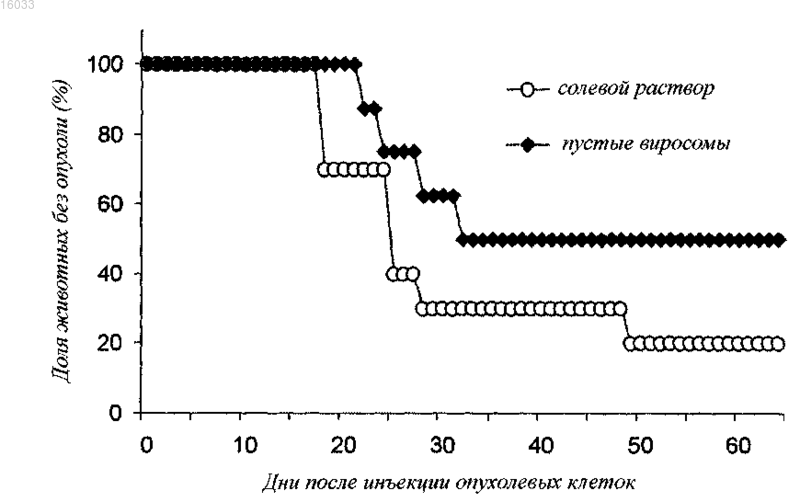
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента Изобретение относится к применению липидных везикул для приготовления лекарства. Далее изобретение относится к способу лечения и/или предотвращения заболевания или расстройства,включающему введение таких липидных везикул нуждающемуся в этом животному.(71)(73) Заявитель и патентовладелец: ПЕВИОН БИОТЕХ АГ (CH) 016033 Область техники, к которой относится изобретение Изобретение относится к применению липидных везикул для приготовления лекарства, предназначенного для неспецифической стимуляции у животного иммунной реакции на заболевание или расстройство. Далее изобретение относится к способу неспецифической стимуляции у животного иммунной реакции, то есть лечения, ликвидации или предотвращения заболевания или расстройства, включающему введение нуждающемуся в этом животному липидных везикул. Липидные везикулы содержат в их липидной мембране по меньшей мере один белок вирусной оболочки. Предшествующий уровень техники Требуется повысить общую устойчивость к заболеваниям, особенно к инфекционным заболеваниям, путм неспецифической стимуляции иммунной системы организма. В то же время стала очевидной и общепризнанной важность иммунной системы для подавления и ликвидации опухолевых заболеваний. Однако механизмы действия основных иммуностимуляторов неизвестны и могут только предполагаться,поскольку они часто имеют сложный состав и многообразно взаимодействуют с системами различных органов. Улучшение понимания взаимосвязи между врожднными защитными механизмами и адаптивным иммунитетом предоставило пригодные объяснения. В частности, открытие в 1990-х гг. колоколоподобных рецепторов (сенсорных систем для сигналов опасности) инициировало новую область исследований, рассматривающих в высокой степени сложные, интегрированные и множественно-избыточные(вырожденные) механизмы защиты от внедряющихся микроорганизмов, что дат приемлемые, хотя и неполные, объяснения повышенной устойчивости к заболеванию. В общем виде иммунную систему можно подразделить на две части: врожднную иммунную систему и адаптивную иммунную систему. Как следует из названия, врожднная иммунная система имеется при рождении и обеспечивает первичную защиту от патогенов, но вс ещ без способности реагировать с любым конкретным патогеном и нейтрализовать его. По этой причине врожднную иммунную систему называют иногда также неспецифической иммунной системой, и е описывают как использующую неклональные защитные механизмы, поскольку для обеспечения е иммунной реакции не требуются индивидуальные клеточные клоны. В то время как врожднная иммунная система включает такие структуры,как кислотное покрытие кожи и самого интактного эпидермиса, она включает также более сложные составляющие, такие как система комплемента, антимикробные ферментные системы, а также неспецифические медиаторы, такие как интерфероны и интерлейкины. С последними связана общая воспалительная реакция, которая также играет роль во врожднном иммунитете. На клеточном уровне (и будучи также частично вовлечена в воспалительную реакцию) врожднная иммунная система включает гранулоциты, систему моноцитов-макрофагов и клетки - естественные убийцы, причм последние составляют часть связи между неспецифическими врожднными и специфическими адаптитвными иммунными реакциями. Одной из отличительных особенностей врожднной иммунной реакции является то, что она сравнительно быстро борется с патогенами, обеспечивая начальную защиту от патогенов в течение начальной фазы, когда более специфические иммунные реакции хозяина активируются или развиваются впервые. Для активации или развития специфической, или адаптивной, иммунной реакции требуется больше времени, поэтому она следует за врожднной иммунной реакцией. В ходе адаптивной иммунной реакции хозяин борется с патогенами, используя прошлый или новый опыт контакта с патогеном, или комбинацию их обоих. Сама по себе адаптивная иммунная реакция может быть клеточной (то есть связанной с цитотоксической активностью клонов специфических клеток, таких как цитотоксические T-клетки(ЦТК или гуморальной (то есть связанной с продукцией антител клонами специфических B-клеток),или может быть комбинацией обоих типов, причм преобладание ветви адаптивной иммунной системы клеточной или гуморальной - частично определяется конкретной смесью высвобождаемых цитокинов. Миграция антиген-предъявляющих клеток (АПК) из периферических тканей в лимфатические органы запускает специфическую иммунную реакцию и ответственна также за функцию последующей памяти,осуществляемую и T-, и B-лимфоцитами, и у каждых из них клоновые популяции размножаются по мере необходимости. Эта функция памяти, которая развивается при первоначальном контакте с антигеном,резко сокращает для адаптивной иммунной системы время, необходимое для формирования в последующем специфической защиты от того же самого антигена. Диаграмма, иллюстрирующая характеристики и взаимоотношения между врожднным и адаптивным иммунитетом, приведена на фиг. 6. В литературе описаны многие потенциальные усилители иммунитета, простирающиеся от небольших синтетических молекул (поли(И)-поли(Ц), левамизол) до живых микроорганизмов (Corynebacteriumparvum) и включающие сложные смеси бактериальных компонентов с минеральными маслами (адъювант Фрейнда) или неорганическими солями (гидроксиды/фосфаты алюминия и магния) и, в последнее время,с модулирующими иммунитет рекомбинантными белками (например, цитокинами, антителами к клеточным рецепторам). Эти вещества преимущественно использовались как адъюванты для вакцин, то есть в комбинации со специфическим антигеном для усиления иммунитета/устойчивости к заболеванию, с которым связаны антигенные компоненты вакцины. Среди большого числа известных иммуностимуляторов только очень немногие являются реально принятыми адъювантами для человеческих вакцин (соли-1 016033 алюминия, виросомы, MF59, RC529). Большинство подходов не были реализованы дальше чисто доклинических исследований, оставляя неразрешенными связанные аспекты - регуляторные (безопасность,токсичность) и экономические (себестоимость производства, характеристики продукта). Другие адъюванты находятся на различных стадиях клинической разработки (например, бактериальные токсины,производные сапонина, производные липополисахарида и липида A, CpG, наночастицы) или разрешены только для применения в ветеринарии (например, ISCOMS, GERBU). Проблема заключается в соблюдении приемлемого баланса между стимулирующим эффектом и реактогенностью, то есть способностью вызывать побочные реакции. Недавно разработанные адъюванты несут дополнительный риск неожиданных побочных эффектов - как, например, наблюдаемых для термолабильного токсина из E. coli в качестве адъюванта для гриппозной вакцины при интраназальном введении. Ни один из адъювантов, разрешнных для применения со специфическими вакцинами, не используется для неспецифической стимуляции устойчивости к заболеванию, например, как единственный продукт. На рынке появляется увеличивающееся число функциональных пищевых продуктов или пищевых добавок, рекламируемых как повышающие устойчивость к заболеваниям, хотя это часто основано на ненаучных доказательствах, а на эзотерических аргументах. Эти продукты продаются в супермаркетах без ограничений и обычно применяются перорально. Их состав может варьировать от хорошо охарактеризованных коктейлей с витаминами или микроэлементами до сложных экстрактов органического происхождения (из растений, микроорганизмов, животных) и включает так называемые пробиотики, которые содержат живые микроорганизмы (например, Actimel, содержащий L. casei defensis). Другую категорию вакциноподобных продуктов (таких как, например, Broncho-Vaxom, Buccalin иUro-Vaxom) составляют зарегистрированные медицинские продукты. Это либо свободно доступные без рецепта лекарственные средства, либо рецептурные лекарства, и они продаются с точными указаниями например, для профилактики и лечения инфекций дыхательных путей и мочевого канала. Они представляют собой специфический коктейль из инактивированных бактерий, которые часто связаны с соответствующими заболеваниями. В отличие от "реальных" профилактических вакцин, пропись воздействия предусматривает ежедневные пероральные введения в течение длительного периода времени - как для предотвращения заболевания, так и для лечения. Продукты проявляют защитное действие в доклинических моделях и имеют документированную активность у людей (активация T-клеток, повышенная продукция интерферона и увеличенное содержание IgA), хотя механизм их действия остатся неясным.Baypamun/Zylexis (Pfizer) - это пример пригодного для инъекции иммуностимулятора для применения в ветеринарии. Продукт содержит в качестве активного ингредиента инактивированный овечий парапоксвирус и рекомендован для предотвращения и лечения инфекционных или индуцированных стрессом заболеваний у домашних и сельскохозяйственных животных. В контролируемых исследованиях на некотороых видах (крупный рогатый скот, лошади, кошки, собаки, свиньи) была установлена эффективность на уровне снижения клинических симптомов. Неспецифический эффект иммуностимуляции объясняется индукцией цитокинов, в частности интерферона. Согласно описанию продукта, иммуностимулирующее действие начинается через несколько часов после инъекции и длится до 14 дней. Эта кинетика идеальна для лечения инфицированных стад в ситуации, когда специфическую иммунопрофилактику проводить слишком поздно. Обнаруженные у животных позитивные эффекты Zylexis привели к его использованию без регистрации у людей, в основном у раковых пациентов, даже невзирая на мнение медицинских властей. Интерфероны широко используются как патоген-неспецифические противовирусные средства, по меньшей мере, с ограниченной эффективностью (при вирусном гепатите). Рекомбинантные белки вводят внутривенно, они усиливают или имитируют одну из многих эффекторных функций природной неспецифической реакции на вирусную инфекцию. Однако применение интерферонов ограничено из-за серьзных побочных эффектов, высокой стоимости и большой длительности лечения. Левамизол (Ergamisol), синтетическое производное имидазотиазола - это антибиотик, применяемый в комбинации с фторурацилом для лечения рака прямой кишки. Он был вначале создан и использовался как противогельминтное средство у человека и животных. Его действие против червей хорошо документировано. В лечении рака прямой кишки его действие хорошо документировано, но механизм совершенно неясен. Было установлено, что левамизол обладает иммуностимулирующими свойствами. Он используется изредка также для лечения меланомы и рака головы и шеи. Патентный документ WO 2006/085983 раскрывает применение вирусных адъювантов для усиления иммунного ответа на иммуноген. Описанные вирусные адъюванты представляют собой реплицирующиеся, но неспособные к развитию вирусные частицы, содержащие вирусный геном либо в модифицированной, либо в немодифицированной форме. Недостаток применения таких вирусных частиц в качестве неспецифических иммуностимуляторов состоит в том, что по меньшей мере части вирусного генома должны быть введены пациенту с непредсказуемыми последствиями. Более того, вводимые пациенту вирусные частицы должны быть репликативно компетентными. Виросомы представляют собой полусинтетические комплексы, состоящие из липидов и по меньшей-2 016033 мере одного белка вирусной оболочки, полученные in vitro. Липиды либо очищены из яиц или растений,либо получены синтетическим путм, а часть липидов происходит из вируса, предоставляющего белок оболочки. Важно, чтобы виросомы представляли собой реконструированные, пустые вирусные оболочки, часто полученные из одного или нескольких вирусов гриппа, лишнные нуклеокапсида, содержащего генетический материал исходного вируса (исходных вирусов). Один из типов виросом представлен иммуностимулирующими реконструированными виросомами гриппа (immunopotentiating reconstituted influenza virosome, "IRIV"), которые содержат гемагглютинин вируса гриппа ("HA") - белок оболочки вируса гриппа, заключнный в его липидной мембране и играющий ключевую роль в слиянии вируса с клетками-мишенями. Виросомы неспособны к репликации, но являются везикулами, способными только к слиянию. По этой причине виросомы, подобно липосомам, обычно используют для доставки вещества(например иммунногенной молекулы, лекарства и/или гена) в клетку-мишень. Однако в отличие от липосом виросомы имеют то преимущество, что они способны эффективно проникать в клетки с последующим высвобождением внутри клеток виросомного содержимого, запускаемым белком вирусной оболочки - например, HA в случае IRIV. Более того, виросомы, благодаря включению в их мембраны активных белков вирусной оболочки, высвобождают сво содержимое в цитоплазму немедленно после их захвата клетками, что предотвращает разрушение терапевтического вещества в кислотном окружении эндосом(патент США 6040167). В отличие от вирусоподобных частиц (ВПЧ) виросомы не образуются спонтанно при рекомбинантной экспрессии белка в подходящей экспрессирующей системе, но являются результатом контролируемого процесса in vitro, что позволяет осуществить крупномасштабное промышленное производство виросом. Получаемые виросомы содержат липидный бислой, состоящий в основном из синтетических липидов, тогда как ВПЧ состоят из клеточных липидов и большей частью не образуют бислов. Кроме того, в случае виросом содержание одиночных компонентов, то есть липидов, вирусных белков, можно варьировать в соответствии с требованиями для конечного продукта. Виросомы были особенно полезны в области вакцинации, где необходимо стимулировать иммунную реакцию на антиген, связанный с конкретным заболеванием или расстройством. В этих случаях антиген обычно инкапсулируют в виросомы или связывают с виросомами, которые затем доставляют этот антиген в иммунную систему подлежащего вакцинации хозяина. В зависимости от конкретного доставляемого антигена, получаемый профилактический и/или терапевтический эффект с неизбежностью специфичен для заболевания или расстройства, с которыми связан антиген. Кроме того, виросомы можно вводить одновременно с несколькими различными эпитопами Bклеток и T-клеток (Pltl-Frank et al. // Clin. Exp. Immunol. 1999. T. 117. C. 496; Moreno et al. // J. Immunol. 1993. T. 151. C. 489), в том числе с универсальными эпитопами хелперных T-клеток (Kumar et al. J. Immunol. 1992. T. 148. C. 1499-1505) и с другими, известными специалистам в данной области. Таким образом, виросомы являются высоко эффективными адъювантами для современной вакцинации, обладающими превосходными свойствами средств доставки антигенов и активным иммуногенным потенциалом и в то же время снижающими до минимума риск побочных эффектов. Виросомы функциональны в том смысле, что их активность в слиянии мембран имитирует хорошо известную, зависящую от низкого pH активность в слиянии мембран у интактного вируса, которая направляется только белком вирусной оболочки. Подобно вирусам, виросомы быстро интернализуются путм опосредованного рецепторами эндоцитоза или опсонизации. В отличие от вирусных систем, виросомы безопасны, поскольку они не содержат инфекционного нуклеокапсида родительского вируса. Поэтому виросомы представляют собой многообещающую транспортную систему для доставки широкого разнообразия различных веществ, либо инкапсулированных в их водной внутренности, или совместно реконструированных в их мембранах. Кроме того, совместное реконструирование различных рецепторов в виросомной мембране позволяет адресованно направлять виросомы на различные клетки или ткани. Виросомы применяют главным образом как вакцины, добавляя антиген на поверхность виросом или инкапсулируя антиген в виросомную полость или в полость липосом, при введении вместе с которыми виросомы проявляют адъювантное действие. Виросомы реконструируют из оболочек вируса гриппа и используют тот же самый опосредованный клеточными рецепторами эндоцитоз, как и их вирусы-партнры (Hernandez et al. // Аппи. Rev. Cell. Dev.Biol. 1996. T. 12. C. 627-661). Известно, что связывание с рецепторами и активность в слиянии мембран вируса гриппа при взаимодействии с эндосомами направляется главным гликопротеином HA вирусной оболочки (Bungener et al. // J. Liposome Res. 2002. T. 12. C 155-163; Huckriede et al. // Vaccine. 2003. T. 21C 925-931). Подобно вирусным векторам, слегка кислотный pH внутренности эндосом запускает слияние виросомной и эндосомной мембран, что приводит к высвобождению инкапсулированного материала такого, как ДНК, РНК или белки, в цитозоль антиген-предъявляющих клеток. Таким образом, экзогенные антигены, инкапсулированные в виросомах, могут включиться в путь класса I главной тканевой совместимости (МНС) без необходимости в синтезе белка de novo. He все виросомы способны сливаться с эндосомными мембранами, и поэтому считается, что их часть становится доступной для пути класса II МНС. Было установлено, что имеющиеся в продаже вакцины против гриппа на основе пустых IRIV (IN-3 016033FLEXAL V) (Glck et al. // Lancet. 1994. T. 344. C. 160-163) являются весьма эффективными и безопасными. Потенциал виросом как систем доставки антигенов, связанных с другими, кроме гриппа, специфическими заболеваниями, был продемонстрирован для вакцин на основе нуклеиновых кислот и пептидов например, против малярии (Pltl-Frank et al. // Clin. Exp. Immunol. 1999. T. 117. C. 496-503) и гепатита A(Holzer et al. // Vaccine. 1996. T. 14. C. 982-986), как с EPAXAL. Последние публикации также заключали, что вакцины на основе синтетических пептидов, вводимые подкожно (п/к) с виросомами, были способны индуцировать сильный иммунитет, связанный с цитотоксическими лимфоцитами (ЦТЛ) (Arnackeret al. // Int. Immunol. 2005. T. 17. C. 695-704). Патентный документ WO 2004/045582 описывает, что при подходящих условиях in vitro можно обеспечить слияние пустых виросом, (то есть виросом, не содержащих и не несущих целевых антигенных молекул) с липосомами, содержащими или несущими такие молекулы. Если ввести хозяину полученные "фузогенные" (то есть обеспечивающие слияние) частицы, содержащие или несущие антигенные молекулы, установленная специфическая иммунная реакция на антигенные молекулы больше, чем если бы эти антигенные молекулы вводились только в липосомах. Подобным же образом, в патентном документе EP 05027624.5 описывается, что комбинация пустых виросом с липосомами, несущими или содержащими антигенные молекулы, причм те и другие существуют в растворе как неслитые, отдельные образования, способна усиливать у хозяина иммунную реакцию в большей степени, чем достигается только с содержащими антиген липосомами. В работе Huckriede et al. // Vaccine. 2005. T. 23, Suppl. 1. C. S1/26-S1/38 приведн обзор примененияIRIV в качестве гриппозных вакцин, а также применение IRIV, в которые инкапсулированы специфические антигены для различных заболеваний, в качестве вакцин против специфических заболеваний, с которыми связаны антигены. В каждом случае эффективность IRIV, предназначенных к применению в качестве вакцины против конкретного заболевания, зависит от присутствия антигена в IRIV или на IRIV,где антиген связан со специфическим заболеванием, против которого должна быть проведена вакцинация. Однако поскольку виросомы являются эффективными в прямой доставке ими антигенных молекул или имеют адъювантную активность в усилении иммунной реакции хозяина на такие антигенные молекулы, активность виросом, как она описана до этого, является по природе своей специфичной, в том смысле, что она сама проявляется в профилактике, лечении и/или ликвидации специфического заболевания или расстройства, которые определяются и лимитируются природой доставляемой антигенной молекулы. В свете сказанного выше существует потребность в новых иммуностимуляторах, которые не включают введение пациентам потенциально опасных вирусных геномов и реплицирующихся вирусных частиц, но которые способны осуществлять широкую, независимую от компартментов, мобилизацию иммунной системы. Такие иммуностимуляторы должны быть безопасными, иметь достоверно установленный механизм действия и быть достоверно активными. Цель настоящего изобретения состоит в удовлетворении этой потребности. Сущность изобретения Неожиданно было обнаружено, что липидные везикулы, содержащие в их липидной мембране по меньшей мере один белок вирусной оболочки, например виросомы, могут быть использованы для стимуляции иммунной системы против заболеваний и расстройств, которые не связаны с исходным вирусом,от которого получен по меньшей мере один белок вирусной оболочки. Это не является ожидаемым, так как такие липидные везикулы не несут и не содержат никаких антигенных молекул, связанных с какимлибо конкретным заболеванием, кроме по меньшей мере одного белка вирусной оболочки или лекарств. Заявители обнаружили ещ, что такие пустые липидные везикулы эффективны в проявлении неспецифического защитного действия даже в отсутствие каких-либо дополнительных лекарств или веществ, связанных с такими заболеваниями. В соответствии с этим, один из аспектов изобретения относится к применению липидных везикул,содержащих в их липидной мембране по меньшей мере один белок вирусной оболочки, для приготовления лекарства, предназначенного для неспецифической стимуляции иммунной реакции у животного,чтобы предотвратить, лечить и/или ликвидировать заболевание или расстройство. Следующий аспект изобретения относится к липидным везикулам, содержащим в их липидной мембране по меньшей мере один белок вирусной оболочки, для применения в неспецифической стимуляции иммунной реакции у животного, чтобы предотвратить, лечить или ликвидировать заболевание или расстройство. Следующий аспект изобретения относится к способу неспецифической стимуляции иммунной реакции у животного, чтобы предотвратить, лечить или ликвидировать заболевание или расстройство, состоящему во введении указанному животному липидных везикул, содержащих в их липидной мембране по меньшей мере один белок вирусной оболочки. Липидные везикулы согласно применению в соответствии с изобретением подробно описаны здесь далее.-4 016033 Не будучи связаны какой-либо теорией, заявители приписывают наблюдаемый неожиданный эффект тому факту, что липидные везикулы согласно настоящему изобретению присутствуют в иммунной системе хозяина вместе со связанными с патогеном молекулярными особенностями ("pathogen-associatedmolecular patterns, PAMP") в форме по меньшей мере одного белка вирусной оболочки. Наличие такихPAMP воздействует на иммунную систему путм стимуляции локальных сенсоров (колоколо-подобных рецепторов и подобных им), что затем приводит к активации врожднной иммунной системы. Оказывается, что эта активация осуществляется способом, не зависящим от какого-либо конкретного заболевания, как обычно ожидалось бы при активации, скажем, специфических клоновых субпопуляций в компартментах T-клеток или B-клеток адаптивной иммунной системы. В результате этой глобальной иммуностимуляции иммунная система приводится во временное состояние боеготовности, сокращая время реакции на микробиологическую атаку, повышая степень неспецифической немедленной (врожденной) реакции, усиливая последующее развитие специфического адаптивного иммунитета и, в случае возникновения системной инфекции, снижая остроту симптомов, связанных с этой инфекцией. Необходимо затем, чтобы липидные везикулы согласно настоящему изобретению функционировали как быстрая иммунологическая общая "побудка", чтобы повысить на ограниченный период времени устойчивость к широкому кругу заболеваний. Как будет здесь далее показано в приведнных примерах, заявители продемонстрировали, что (пустые) липидные везикулы, содержащие в их липидных мембранах по меньшей мере один белок вирусной оболочки, могут быть использованы для снижения остроты заболевания. Конкретно, было показано, что липидные везикулы, содержащие в их липидных мембранах по меньшей мере один белок вирусной оболочки, то есть "голые" липидные везикулы, как они определены здесь, обеспечивают иммуностимулирующее действие только в течение нескольких часов после введения. Это действие начинается очень быстро, и оно определнно намного быстрее, чем мог бы ожидаться любой иммуностимулирующей эффект, возникающий вследствие специфической, то есть адаптивной, иммунной реакции. Далее было установлено, что в случаях, когда заболевание поражает животных, предварительно получивших указанные липидные везикулы, как тяжесть, так и длительность развития этого заболевания снижаются у подвергшихся воздействию животных по сравнению с не подвергшимися воздействию контрольными животными. Наконец, хотя этот эффект был преходящим, он наблюдался для большого числа различных заболеваний, демонстрируя неспецифическую природу иммуностимуляции, достигаемой при использовании таких липидных везикул. Термин "липидная везикула", как он использован здесь, относится к сфере, окруженной липидным бислоем и создающей просвет (полость) с диаметром порядка 20-1000 нм, предпочтительно 20-500 нм,более предпочтительно 80-500 нм, ещ более предпочтительно 100-200 нм. Наиболее предпочтительный диаметр липидной везикулы составляет приблизительно 150 нм. Термин "липидная везикула", как он использован здесь, относится к липидной везикуле по меньшей мере с одним белком вирусной оболочки в е мембране и принадлежит к классу соединений, называемых "протеолипосомами". Фраза "в е липидной мембране", как она использована здесь, относится к физическому присоединению белка вирусной оболочки к липидной везикуле посредством трансмембранного/якорного домена внутри белковой молекулы или посредством ковалентно присоединнной липофильной молекулы, предоставляющей якорную функцию, или посредством нековалентной ассоциации, либо непосредственно с компонентами липидного бислоя, либо с молекулами, заякоренными в липидном бислое, причм белок,как таковой, доступен для связывания с соответствующим рецептором на клетке, с которой может слиться липидная везикула. Термин "белок вирусной оболочки", как он использован здесь, относится к любому белку, кодируемому покрытым оболочкой вирусом, из которого частично или полностью происходит используемая в настоящем изобретении липидная везикула, и имеющемся в его липидной мембране. Во многих случаях(но не всегда) белки вирусной оболочки являются частью внешней поверхности вириона и взаимодействуют с организмами-хозяевами, например, через рецепторы на поверхности клеток или через растворимые молекулы. Хотя "белок вирусной оболочки" может в некоторых случаях представлять собой иммуногенную или антигенную молекулу, связанную с родительским вирусом, белок вирусной оболочки липидной везикулы, используемой в настоящем изобретении, связан не с намерением вызвать какой-либо вид специфической иммунной реакции на этот белок, но скорее с тем, чтобы включить по меньшей мере один промежуточный неспецифический сигнал опасности задолго до того, как сможет развиться специфическая иммунная реакция. Очевидно, что предсуществующий специфический иммунитет к белку вирусной оболочки не исключает функции белка оболочки в смысле настоящего изобретения. Белки вирусной оболочки иногда функционируют как "вирусные белки слияния", что означает существенно то же самое, как и "обеспечивающие слияние вирусные белки", и это значит, что такие белки играют роль в слиянии вирусов или виросом с клетками-мишенями. Термин "иммунная реакция", как он использован здесь, относится к повышенной устойчивости животного по меньшей мере к одному заболеванию или расстройству, включая одновременную устойчивость ко многим заболеваниям или расстройствам. Иммунная реакция - это физиологическая реакция у людей и других высших животных для защиты организма от вторжения чужеродного материала и/или-5 016033 его собственного патологического материала (например, в связи с раком, аутоиммунным заболеванием или расстройством). Термин "неспецифический" и подобные ему, как они использованы здесь, относятся к общей иммуностимулирующей активности липидных везикул по отношению к по меньшей мере одному заболеванию или расстройству, которые не связаны с вирусом или не вызваны вирусом, из которого происходит по меньшей мере один белок вирусной оболочки. Вирус, из которого происходит белок вирусной оболочки в липидной мембране липидной везикулы, называется здесь "родительский вирус" Таким образом,"неспецифическая" иммуностимуляция относится к предотвращению, преодолению и/или ликвидации любого одного или более из многих заболеваний или расстройств, не вызванных родительским вирусом. Отличительный признак описанной здесь неспецифической иммуностимуляции состоит в том, что она начинается очень быстро после введения липидных везикул. Эта преходящая неспецифическая иммуностимуляция обычно длится порядка менее 5 дней, но может развиваться даже в более короткое время,например менее 4 дней, менее 3 дней, менее 2 дней, менее 1 дня, или даже в течение нескольких часов после введения липидных везикул. Наоборот, "специфическая иммуностимулирующая активность относится к стимуляции иммунной системы для предотвращения, преодоления и/или ликвидации конкретного заболевания или расстройства, связанных с родительским вирусом или вызванным родительским вирусом. Начало этой иммуностимуляции медленное, например в течение порядка 2 недель. Как пример, использование липидных везикул, содержащих в их липидных мембранах белок вирусной оболочки из родительского вируса A для приготовления лекарства, предназначенного для достижения иммуностимуляции против заболевания A (связанного с родительским вирусом A или вызванного родительским вирусом A) было бы примером осуществления "специфической" иммуностимулирующей активности. В противоположность этому, использование тех же самых липидных везикул для приготовления лекарства, предназначенного для предотвращения, преодоления (то есть лечения) и/или ликвидации заболевания B (не связанного с родительским вирусом A или не вызванного родительским вирусомA) было бы примером осуществления "неспецифической" иммуностимулирующей активности. Это применимо также к различным штаммам того же вируса. Например, иммуностимуляция против одного конкретного штамма вируса (например, вируса гриппа H1N1), достигаемая липидными везикулами, несущими белок вирусной оболочки другого конкретного штамма (например, H3N2 или H5N1), принадлежащего тому же классу вирусов (здесь вируса гриппа), следует поэтому считать неспецифической иммуностимуляцией. Термины "терапевтический", "терапия" и подобные им, как они использованы здесь, относятся к воздействию, предпринимаемому для подавления по меньшей мере одного заболевания или расстройства, которое уже началось, или которое предположительно уже началось, независимо от того, развились ли уже какие-либо соответствующие симптомы. Как таковые, "терапия" и "терапевтический" относятся к лечению, ликвидации или по меньшей мере ослаблению заболевания или расстройства у индивидуума таким образом, что если симптомы уже наличествуют, они ослабляются, или, если симптомов ещ нет,при возникновении таких симптомов их тяжесть снижается или они вообще исключаются. Термины "профилактический", "профилактика", "предотвращает", "предотвращение" и подобные им, как они использованы здесь, относятся к действию, предпринятому для предотвращения заболевания у индивидуума, когда индивидуум предположительно не имеет ещ заболевания, но когда существует усиленная опасность или ожидание возникновения конкретного заболевания или расстройства в настоящем или будущем. Далее термины относятся к действию, предпринятому для предотвращения у индивидуума любого заболевания, когда индивидуум уже получал вакцинацию/иммунизацию против конкретного заболевания, эффект которого, однако, не является длительным. Как таковое, данное действие может быть с полным правом названо "проофилактическим" или "предотвращающим" постольку, поскольку рассматриваемый индивидуум не имеет никаких симптомов заболевания, но ожидается, что он, возможно, будет иметь конкретное заболевание или расстройство. Действие, которое первоначально правильно называется "профилактическим", может стать "терапевтическим", если оно меняет смысл после по меньшей мере одного первоначального введения липидных везикул, и вместо первоначального отсутствия подозрения в том, что у индивидуума имеется конкретное заболевание или расстройство, на самом деле индивидуум получил конкретное заболевание или расстройство. Наоборот, активность, первоначально правильно названная "терапевтической", может при е продолжении после излечения конкретного заболевания или расстройства стать по своей природе "профилактической" или "предотвращающей". Термин "фармацевтический", как он использован здесь, относится к характеристикам композиций и/или лекарств, которые делают их пригодными для введения живому животному, предпочтительно человеку. Термины "усиливающий", "усиливающий иммунитет", "стимулирующий", "иммуностимулирующий", "иммуностимуляционный" и подобные им, как они использованы здесь, используются как взаимно заменяемые в связи с (пустыми) липидными везикулами, относясь к липидным везикулам или к их воздействию на иммунные функции, которое неспецифично в том смысле, как он определн выше. Термин "виросома", как он использован здесь, относится к реконструированной вирусной оболочке,-6 016033 которая может быть получена из различных вирусов, но которая лишена инфекционных нуклеокапсидов и генетического материала исходного вируса. Виросома является специальным типом липидной везикулы, содержащей в е липидной мембране по меньшей мере один белок вирусной оболочки. Благодаря их составу, такие структуры принадлежат к классу соединений, называемых "протеолипосомами", в которых белки в липидной мембране имеют вирусное происхождение. Это означает, что виросомы состоят из смеси мембранных липидов либо вирусного, либо невирусного происхождения с одним или более из белков вирусной оболочки. Термины "заболевание" и "расстройство", как они использованы здесь, относятся к ненормальному состоянию организма или обозначают то, что вызывает дискомфорт, нарушение функции или недомогание и подразделяются на инфекционные, опухолевые, иммунные или метаболические заболевания или расстройства. Термины "голая" и "пустая", как они использованы здесь, являются взаимно заменяемыми в приложении к липидным везикулам, особенно в отношении виросом. Термины относятся к тому факту, что таким образом охарактеризованные везикулы или виросомы не содержат специфического для заболевания антигена и не содержат никакого антигена в их липидном бислое, но содержат только по меньшей мере один белок вирусной оболочки. Как таковая, "голая" или "пустая" липидная везикула - такая как"голая" или "пустая" виросома, означает, что единственным белком или полипептидом, содержащимся в обозначенной таким образом везикуле/виросоме является по меньшей мере один белок вирусной оболочки, как он определн выше. В связи с этим указывается, что известные процедуры для получения липидных везикул, как они описаны здесь выше, - таких как виросомы, редко позволяют полностью удалить все примеси. Поэтому липидная везикула, например, виросома, может содержать остаточные следы веществ, применяемых при их получении (например, следовые количества детергентов), и е вс ещ правильно следует понимать как "голую" или "пустую" в указанном выше смысле вс то время, пока такие следовые вещества не вызывают никакой иммунной реакции, "специфичной" в указанном выше смысле. Термин "адъювант", как он использован здесь (используемый либо как существительное, либо как прилагательное) обозначает вторичное вещество, которое вводят в комбинации (и не обязательно одновременно) с первичным, активным веществом, ответственным за целевой профилактический/терапевтический эффект. Итак, "адъювантное" вещество само не проявляет профилактического и/или терапевтического действия, но поддерживает, способствует или иным образом усиливает профилактическое и/или терапевтическое действие, оказываемое первичным, активным веществом. Обозначение вещества или действия как "адъювантного" зависит от конкретного контекста, в котором это вещество используется, или от конкретного контекста, в котором проявляется это действие, а не от внутренней природы вещества или действия самих по себе. Таким образом, вещество, которое в одной ситуации может функционировать как "адъювант" в указанном выше смысле, в другой ситуации может функционировать как активный агент, в зависимости от того, какое профилактическое и/или терапевтическое действие ожидается или проявляется. Для целей иллюстрации, хотя липидная везикула (например, виросома), которая содержит в своей липидной мембране по меньшей мере один белок вирусной оболочки, была описана в данной области как адъювант, эту липидную везикулу неправильно называть адъювантом в связи с настоящим изобретением, поскольку этой везикуле приписана неспецифическая иммуностимулирующая активность. Здесь липидная везикула является активным агентом, хотя другое вторичное вещество, поддерживающее, способствующее или иным образом усиливающее неспецифическое профилактическое и/или терапевтическое действие липидной везикулы, может быть правильно названо адъювантом. Липидная везикула, содержащая в своей липидной мембране по меньшей мере один белок вирусной оболочки, полезным образом может быть виросомой. Приготовление виросом хорошо известно специалисту в данной области. Подходящие прописи для приготовления виросом описаны, например, в патентном документе EP 538437 или, в качестве альтернативы, в работе Mischler and Metcalfe // Vaccine. 2002. T. 20. C. B17-В 23. Например, виросомы могут быть реконструированы из липидов исходной вирусной мембраны и гликопротеинов шипов после солюбилизации, например, интактного вируса гриппа монододециловым эфиром октаэтиленгликоля, седиментации нуклеокапсида (вирусные гликопротеины и липиды остаются в надосадочной жидкости) и удаления детергента из надосадочной жидкости с помощью гидрофобной смолы (Bio-Beads SM2) (WO 92/19267). Приготовление виросом, содержащих гемагглютинины (HA) из различных штаммов родительских вирусов, может быть осуществлено с различными количествами, в том числе и с равными количествами,белков из этих родительских вирусов. Удобно, чтобы белки оболочки родительских вирусов -таких, какHA, можно было солюбилизировать неионным детергентом -монододециловым эфиром октаэтиденгликоля. После удаления детергента с помощью Bio-Beads SM2 могут образоваться виросомы, содержащие различные типы белков оболочки. Особенно предпочтительной формой виросом являются иммуностимулирующие реконструированные гриппозные виросомы ("IRIV" или "гриппозные виросомы"). Это сферические, однослойные везику-7 016033 лы со средним диаметром порядка 150 нм, приготовленные из смеси фосфолипидов и поверхностных гликопротеинов вируса гриппа, но не содержащие никаких вирусных нуклеиновых кислот. Гликопротеин мембраны вируса гриппа, гемагглютинин (HA) играет ключевую роль в способе действия гриппозных виросом. Этот основной антиген вируса гриппа представляет собой индуцирующий слияние компонент,который способствует доставке антигена к иммунокомпетентным клеткам. По меньшей мере один белок оболочки вируса может быть с пользой получен из следующих субтипов вируса гриппа: вирус гриппа H1N1, вирус гриппа H1N2, вирус гриппа H2N2, вирус гриппа H3N2,вирус гриппа H3N8, вирус гриппа H5N1, вирус гриппа H5N2, вирус гриппа H5N3, вирус гриппа H5N8,вирус гриппа H5N9, вирус гриппа H7N1, вирус гриппа H7N2, вирус гриппа H7N3, вирус гриппа H7N4,вирус гриппа H7N7, вирус гриппа H9N2 и /или вирус гриппа H10N7. Кроме того, по меньшей мере один белок оболочки вируса может быть с пользой получен из вируса гриппа A/Bangkok/1/79, вируса гриппаB/Jiangsu/10/2003. Гриппозные виросомы имеют сферическую липидную мембрану, по необходимости состоящую из фосфолипида(ов), предпочтительно из фосфатидилхолина(ов) (PC) и/или фосфатидилэтаноламина(ов)(PE). В отличие от липосом гриппозные липосомы содержат функциональные гликопротеины вирусной оболочки HA и/или нейраминидазу ("NA"), интеркалированные в фосфолипидной бислойной мембране. Биологически активный HA не только структурно стабилен и гомогенен по отношению к вирусомным рецептурам, но также вносит существенный вклад в иммунологические свойства, в активность вируса в слиянии. Хотя нельзя исключить, что HA и/или NA могут распознаваться иммунной системой хозяина как чужеродный антиген, любое такое распознавание может лишь запускать иммуностимулирующую реакцию, специфичную для родительского вируса гриппа. Напротив, как указано выше, заявители данного изобретения неожиданно установили, что предоставляя специфическую защиту от родительского вируса, пустые липидные везикулы, например, пустые виросомы, одновременно также запускают неспецифическую реакцию, способную усиливать возможности иммунной системы против заболеваний или расстройств, которые не связаны с родительским вирусом или не вызваны родительским вирусом или родительскими вирусами, в том случае, когда белки вирусной оболочки получены из более чем одного родительского вируса. Гриппозные виросомы действуют как высоко эффективные средства неспецифического усиления иммунной реакции. Известно также, что они в высокой степени безопасны (Schaad et al. // Antimicrob.Agents Chemother. 2000. T. 44. C. 1163-1167; Glck et al/ // J. Infect. Dis. 2000. T. 181. C 1129-1132). Это означает, что они хорошо подходят для использования в лекарствах, предназначенных для неспецифической иммуностимуляции у людей. Гриппозные виросомы могут быть реконструированы из липидов мембран и гликопротеинов шипов исходного вируса после солюбилизации инактивированного вируса гриппа с помощью, например, монододецилового эфира октаэтиленгликоля, седиментации нуклеокапсида (вирусные гликопротеины и липиды остаются в надосадочной жидкости) и удаления детергента из надосадочной жидкости с помощью гидрофобной смолы (Bio-Beads SM2). Методики приготовления гриппозных виросом даны в WO 92/19267, а вообще виросом - в WO 04/071492. Хотя полезно, чтобы по меньшей мере один белок вирусной оболочки происходил из вируса гриппа, используемые в настоящем изобретении липидные везикулы могут содержать, дополнительно или альтернативно, один или более из белков вирусной оболочки из других, кроме вируса гриппа, типов вирусов. Например, липидные везикулы могут содержать один или более из белков вирусной оболочки,выбранных из, например, белка G вируса везикулярного стоматита (ВВС), белка E1 вируса леса Семлики(ВЛС), белка F вируса Сендай, белков F или G респираторно-синцитиального вируса (РСВ) или белка E вируса гепатита C (ВГС). Используемые в настоящем изобретении липидные везикулы могут быть также химерными виросомами. Это означает, что они содержат белки вирусной оболочки - такие как гемагглютинин, по мень-8 016033 шей мере из двух вирусных штаммов, например из штаммов X-31 и A/Sing вируса гриппа или из любых вирусных штаммов, перечисленных выше. Кроме того, для конструирования химерных виросом, способных осуществлять последовательные и раздельные функции слияния, могут быть использованы белки оболочек других известных вирусов среди многих других, таких как белок G вируса везикулярного стоматита (ВВС), белок E1 вируса леса Семлики (ВЛС), белок F вируса Сендай, белки F или G респираторно-синцитиального вируса (РСВ) или белок E вируса гепатита C (ВГС). Используемые в настоящем изобретении липидные везикулы предпочтительно содержат липиды,выбранные из группы, состоящей из катионных липидов, гликолипидов, фосфолипидов, холестерина или из их производных. Фосфолипиды предпочтительно включают фосфатидилхолин, сфингомиелин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилглицерин, фосфатидовую кислоту, кардиолипин и фосфатидилинозитол с различным содержанием жирных кислот. Катионные липиды предпочтительно выбраны из группы, состоящей из DOTMA (N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмонийхлорида), DOTAP (N-[1-(2,3-диолеилокси)]пропил]-N,N,N-триметиламмоний-хлорида), DODAC (N,Nдиолеил-N,N-диметиламмоний-хлорида), DDAB (дидодецил-диметиламмоний-бромида), TC-Chol (холестерил-N-(триметиламмонийэтил)карбамат-хлорида), DC-Chol (холестерил-N-(диметиламмонийэтил) карбамат-хлорида) или других катионных производных холестерина, и стеариламина или других алифатических аминов и подобных им. Они могут быть составлены как малые однослойные липосомы в смеси с фосфатидилхолином (PC) Используемые в настоящем изобретении липидные везикулы могут предпочтительно содержать яичный PC и, более предпочтительно, 1-олеил-3-пальмитоил-рац-глицеро-2 фосфатидилэтаноламин. Предпочтительно, чтобы используемые в настоящем изобретении липидные везикулы содержали мембранные липиды, такие как фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин и/или производные холестерина. В наиболее предпочтительном варианте осуществления изобретения липидные везикулы дополнительно содержат катионные липиды, например катионные липиды, предпочтительно выбранные из группы, состоящей из DOTMA (N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмонийхлорида), DOTAP (N-[1-(2,3-диолеилокси)]пропил]-N,N,N-триметиламмоний-хлорида), DODAC (N,Nдиолеил-N,N-диметиламмоний-хлорида), DDAB (дидодецил-диметиламмоний-бромида), TC-Chol (холестерил-N-(триметиламмонийэтил)карбамат-хлорида), DC-Chol (холестерил-N-(диметиламмонийэтил) карбамат-хлорида) или других катионных производных холестерина, и стеариламина или других алифатических аминов, DPPE (дипальмитоилфосфатидилэтаноламинов), DOGS (диолеил-глицеросукцината),DOSPA(2,3-диолеилокси-N[2-(сперминкарбоксамидо)этил]-N,N-диметил-1-пропанаминиум-трифторацетата), DOSPER (1,3-диолеилокси-2-(6-карбоксиспермил)пропиламида), THDOB (N,N,N',N'тетраметил-N,N'-бис-(2-оксиэтил)-2,3.диолеилокси-1,4-бутандиаммоний-йодида), DOPA (диолеоил-snглицерофосфата), DOTP (диоктил-терефталата), DOSC (диолеил-сукцинилглицерина), DOTB (диолеоил-(4'-триметиаммонио)-бутаноил-sn-глицерина), DOPC (диолеоил-sn-глицеро-фосфохолина) и подобных им. Особенно предпочтительно, чтобы катионный липид был выбран из катионных производных холестерина, таких как TC-Chol (холестерил-N-(триметиламмониоэтил)карбамат или DC-Chol (холестерил-N(диметиламмониоэтил)карбамат). Мембрана в используемых в настоящем изобретении липидных везикулах предпочтительно содержит от 1,9 до 37 мол.% TC-Chol или DC-Chol по отношению к общему содержанию липидов в мембране. В особенно предпочтительном варианте осуществления изобретения содержание TC-Chol или DC-Chol в мембране составляет от 1,9 до 16 мол.% по отношению к общему содержанию липидов в мембране. Остальной состав липидов в мембране представлен предпочтительно фосфолипидами, наиболее предпочтительно фосфатидилхолином и фосфатидилэтаноламином в соотношении 4:1. Кроме того, мембрана может содержать количество HA, достаточное для того, чтобы гарантировать активность липидных везикул в слиянии. Для повышения жсткости и/или герметичности липидных везикул можно также использовать совместно эмульгирующий агент. Примерами совместно эмульгирующих агентов являются заряженные или нейтральные эфиры холестерина, такие как холестерин-сульфат, производные со стерольным скелетом, такие как производные растительного происхождения, например, холестерин, сигмастерол и их смеси. Использованные в настоящем изобретении липидные везикулы могут быть получены, например, по прописи, аналогичной любой из прописей для получения содержащих DOTAP виросом, раскрытых в примерах с 1 по 3 и 6 патентного документа WO 97/41834, с тем исключением, что DOTAP заменн наDOSPER и концентрация DOSPER в окончательной мембране виросомы нужным образом устанавливается так, как раскрыто в WO 97/41834 и, в частности, не превышает 70 вес.% от общего содержания липидов в виросоме. В основном способ приготовления данных липидных везикул может включать следующие этапы: а) приготовление буферного раствора, содержащего неионный детергент и дополнительно содержащего DOSPER и другие липиды и по меньшей мере один белок вирусной оболочки; б) установление концентрации липидов (по отношению к общему содержанию мембранных липидов): от 5 до 30 вес.% DOSPER и для баланса от 95 до 70 вес.% указанных других липидов, включающих-9 016033 фосфатидилхолин (PC) или его производное и, по усмотрению, фосфатидилэтаноламин (PE) и/или другие катионные липиды, отличные от DOSPER; и в) удаление детергента диализом или обработкой раствора гранулами микроносителя, что приводит к образованию указанных липидных везикул. Заболевание или расстройство (по меньшей мере одно) может быть инфекционным, неинфекционным, опухолевым, иммунным или метаболическим заболеванием или расстройством. В одном из вариантов осуществления изобретения содержащееся в изобретении использование охватывает введение используемых в настоящем изобретении липидных везикул здоровым индивидуумам, сталкивающихся с временным усилением воздействия одного или более из инфекционных заболеваний или расстройств,или (вс ещ) здоровым индивидуумам немедленно сразу после того, как они предполагаемо подверглись воздействию одного или более из инфекционных заболеваний или расстройств, но до появления симптомов или подтверждения диагноза. Классификация действия на индивидуума как профилактического или терапевтического обсуждается здесь выше. Содержащееся в изобретении использование может быть также применено к лечению одного или более уже существующих заболеваний или расстройств, по усмотрению, как независимое дополнение специфических курсов лечения таких заболеваний или расстройств. В этой связи заслуживает внимания неспецифичность иммуностимуляции, достигаемая описанными здесь липидными везикулами. Здесь неспецифичность подразумевает, что многие заболевания или расстройства могут быть подавлены, ликвидированы и/или предотвращены одновременно. Более того, число заболеваний и/или расстройств, на которые одновременно осуществляется воздействие, в принципе не ограничено. Это является очевидным преимуществом перед существующими схемами вакцинации, в которых число заболеваний и/или расстройств, которые предотвращаются, лечатся и/или ликвидируются, ограничено числом и типом специфических антигенов, присутствующих в конкретной вакцине или приготовленном вакцинном коктейле. Согласно одному из вариантов осуществления изобретения по меньшей мере одно инфекционное заболевание или расстройство может быть вирусным заболеванием или расстройством, бактериальным заболеванием или расстройством, грибковым заболеванием или расстройством, паразитным заболеванием или расстройством или прионным заболеванием или расстройством. Согласно другому варианту осуществления изобретения вирусное инфекционное заболевание или расстройство может быть полезным образом выбрано из СПИД, связанного со СПИД комплекса, ветряной оспы, простуды, цитомегаловирусной инфекции, клещевой лихорадки Колорадо, лихорадки Денге,геморрагической лихорадки Эбола, эпидемического паротита, генитальных бородавок, ящура, гепатита,простого герпеса, герпеса зостер, вируса папилломы человека (HPV), гриппа, лихорадки Ласса, кори,марбургской геморрагической лихорадки, инфекционного мононуклеоза, свинки, полиомиелита, прогрессирующей многофокусной лейкоэнцефалопатии, бешенства, краснухи, SARS, натуральной оспы,вирусного энцефалита, вирусного гастроэнтерита, вирусного менингита, вирусной пневмонии, болезни Западного Нила, жлтой лихорадки. Эти и другие вирусные инфекционные заболевания или расстройства вызываются вирусом саркомы Рауса, полиовирусами, вирусом краснухи, вирусом Денге, флавивирусами, коронавирусами, реовирусами, вирусом бешенства, парамиксовирусами (например, вирусом эпидемического паротита, вирусом кори, респираторно-синцитиальным вирусом и т.д.), ортомиксовирусами (например, типами A, B и C вируса гриппа и т.д.), вирусом иммунодефицита обезьян (ВИО), вирусом гепатита A, вирусом гепатита B, вирусом гепатита C, вирусом гепатита D вирусом гепатита E, папиломавирусом, вирусом простого герпеса, вирусом иммунодефицита человека, цитомегаловирусом, вирусом Эпштейна-Барр, вирусом полиомы, вирусом оспы, Буньявирусом (например, вирусом Ля Кросс). Согласно дальнейшему варианту осуществления изобретения бактериальное инфекционное заболевание или расстройство может быть полезным образом выбрано из сибирской язвы, бактериального менингита, бруцеллза, кампилобактериоза, болезни чесотки кошек, холеры, дифтерии, эпидемического тифа, гонореи, импетиго - легионеллза, проказы (болезни Хансена), лептоспироза, листериоза, болезни Лайма, мелиоидоза, инфекции MRSA, нокардиоза, коклюша (судорожный кашель), чумы, пневмококковой пневмонии, пситтакоза, лихорадки Q, пятнистой лихорадки Скалистых гор, сальмонеллза, скарлатины, шигеллза, сифилиса, столбняка, трахомы, туберкулза, туляремии, тифоидной лихорадки, тифа,инфекций мочевого тракта. Эти и другие бактериальные инфекционные заболевания или расстройства вызываются Corinebacterium diphtheriae, Clostridium tetani, Bordetella pertussis, Neisseria meningitidis, в том числе серотипами Meningococcus A, B, C, Y и W135, Haemophilus influenza тип B (HiB) и Helicobacterpylori. Согласно другому варианту осуществления изобретения грибковое инфекционное заболевание или расстройство может быть полезным образом выбрано из аспергиллоза, бластомикоза, кандидиаза, коккидиоидомикоза, криптококкоза, гистоплазмоза, ножного дерматомикоза. Согласно другому варианту осуществления изобретения, паразитное инфекционное заболевание или расстройство может быть полезным образом выбрано из африканского трипаносомоза, амбиаза,аскаридоза, бабезиоза, болезни Шагаса, клонорхоза, криптоспородоза, цистицеркоза, дифиллоботриоза,дракункулза, эхинококкоза, энтеробиоза, фасциолза, филяриатоза, амбной инфекции, лямблиоза, гнатостомиоза, гименолепидоза, изоспороза, индийского висцерального лейшманиоза, лейшманиоза, маля- 10016033 рии, метагонимиоза, энтомоза, онхоцеркоза, педикулза, инфекции острицами, чесотки, шистосомоза,тениоза, токсокариоза, токсоплазмоза, трихиннелза, трихоцефалза, трипаносомиоза. Согласно другому варианту осуществления изобретения прионное инфекционное заболевание или расстройство может быть полезным образом выбрано из передающейся губковидной энцефалопатии,губковидной энцефалопатии крупного рогатого скота, болезни Крейтцфельда-Якоба, куру. Согласно другому варианту осуществления изобретения, опухолевым заболеванием или расстройством может быть рак. Рак может быть, например, саркомой, лейкозом, лимфомой, миеломой, меланомой, аденомой, карциномой, хориокарциномой, гастриномой, феохромоцитомой, пролактиномой или невромой. Конкретно, рак может быть полезным образом выбран из острого лимфобластоидного лейкоза взрослых, острого лимфобластоидного лейкоза детей, острого миелоидного лейкоза, адренокортикальной карциномы, детской адренокортикальной карциномы, связанных со СПИД вариантов рака, связанной со СПИД лимфомой, анального рака, базалиомы, рака внепечночных жлчных протоков, рака мочевого пузыря, рака костей, остеосаркомы/злокачественной фиброзной гистиоцитомы, глиомы ствола мозга, опухоли мозга взрослых, рака мозга (например, глиомы ствола мозга, церебральной астроцитомы,церебральной астроцитомы/злокачественной глиомы, эпендимомы, бластомы костного мозга, расположенных над мозжечком примитивных нейроэктадермальных опухолей, глиомы зрительных путей и гипоталамуса), рака груди (у женщин и мужчин), бронхоаденом/карциноидов, лимфомы Беркитта, карциноидной опухоли, желудочно-кишечной карциноидной опухоли, карциномы неизвестного первичного происхождения, первичной лимфомы центральной нервной системы, рака шейки матки, детских типов рака, хронического лимфолейкоза, хронического миелолейкоза, хронических миелопролиферативных расстройств, рака толстой кишки, рака толстой и прямой кишки, лимфомы кожных T-клеток, микозных фунгоидов и синдрома Сезари, внутриматочного рака, эпендимомы, рака пищевода, семейства омобластом, внечерепной опухоли зародышевых клеток), внегонадной опухоли зародышевых клеток, рака внепечночных жлчных протоков, зрительных раков (например, рака глаз типа внутриглазной меланомы и ретинобластомы), рака жлчного пузыря, рака желудка, желудочно-кишечной карциноидной опухоли,желудочно-кишечной опухоли стромы, яичниковой опухоли половых клеток, связанной с беременностью трофобластной опухоли, глиом (например, глиомы ствола мозга, церебральной астроцитомы, глиомы зрительных путей и гипоталамуса), лейкемии волосистых клеток, рака головы и шеи, первичного гепатоклеточного рака печени, лимфомы Ходжкина, рака гортани, внутриглазной меланомы, рака поджелудочной железы (карциномы островковых клеток), саркомы Капоши, рака почки (клеток почки), рака глотки, острых лейкозов (например, лимфобластного лейкоза, острого миелолейкоза, хронического лимфолейкоза, хронического миелоидного лейкоза, лейкемии волосистых клеток), рака губ и ротовой полости, рака печени (первичного и метастазирующего), рака крупных клеток лгких, рака малых клеток лгких, связанной со СПИД лимфомы, лимфомы Беркитта, лимфомы кожных T-клеток, лимфомы Ходжкина, лимфомы не Ходжкина, первичной лимфомы центральной нервной системы, макроглобулинемии(болезни Вальденстрма), злокачественной фиброзной гистиоцитомы костей/остеосаркомы, медуллобластомы, меланомы, внутриглазной (глазной) меланомы, карциномы клеток Меркеля, мезотелиомы, первичного метастазирующего рака сквамозных клеток шеи скрытого происхождения, синдрома множественных эндокринных новообразований, множественной миеломы/новообразований клеток плазмы, ноздреватого микоза, миелодиспластических синдромов, миелодиспластических/миелопролиферативных заболеваний, хронического миелолейкоза, миелоидного лейкоза, множественной миеломы, хронических миелопролиферативных расстройств, рака носовой полости и околоносовых пазух, носоглоточного рака,нейробластомы, рака ротоглотки, остеосаркомы/злокачественной фиброзной гистиоцитомы костей, рака яичников, рака эпителия яичников, опухоли половых клеток яичников, опухоли яичников с низким злокачественным потенциалом, рака поджелудочной железы, рака островковых клеток поджелудочной железы, рака околоносовых пазух и носовой полости, рака паращитовидной железы, рака пениса, феохромоцитоиы, пинеобластомы и расположенных над мозжечком опухолей примитивной нейроэктодермы у детей, опухоли гипофиза, опухоли клеток плазмы/множественной миеломы, плевролгочной бластомы,связанного с беременностью рака груди, связанной с беременностью лимфомы и лимфомы Ходжкина,первичной лимфомы центральной нервной системы, рака простаты, ректального рака, переносимого рака клеток почечных лоханок и мочеточников, ретинобластомы, рабдомиосаркомы, рака слюнных желз,семейства омобластом, саркомы мягких тканей, саркомы матки, синдрома Сезари, рака кожи (не меланомного), рака кожи (меланомного), карциномы клеток Меркеля кожи, рака малых клеток лгких, рака тонкого кишечника, саркомы мягких тканей, метастазирующей карциномы сквамозных клеток, рака сквамозных клеток шеи с неясным происхождением, рака желудка, опухолей расположенной над желудочком примитивной нейроэктодермы, лимфомы кожных T-клеток, рака яичек, тимомы, тимомы и карциномы тимуса, рака щитовидной железы, связанной с беременностью трофобластной опухоли, карциномы с неизвестной первичной локализацией, рака с неизвестной первичной локализацией, необычных видов рака у детей, рака мочеиспускательного канала, внутриматочного рака матки, рака влагалища, рака вульвы, макроглобулинемии Вальденстрма, опухоли Вильма и различных типов рака у женщин. Согласно другому варианту осуществления изобретения животное является млекопитающим. Мле- 11016033 копитающее - это предпочтительно человек, шимпанзе, обезьяна циномольгус, гиббон, низшая (обезьяноподобная) обезьяна, обезьяна макака, мышь, крыса, кошка, собака, лошадь, кролик, верблюд, лама,жвачное животное или свинья. Предпочтительным жвачным животным может быть корова, бык, коза,овца, бизон, буйвол, лань или олень. В дальнейшем варианте осуществления изобретения лекарственное средство пригодно для введения внутримышечно, внутрикожно, внутривенно (например, путм инъекции), подкожно, внутрибрюшинно,парентерально, поверхностно, внутритрахейно, внутрь ушной раковины, внутрисуставно, внутриглазным образом, местно, с помощью наклейки (например, кожной наклейки), путм распыления (например, с помощью носоглоточного спрея), перорально (например, в виде таблеток, капсул, капель, драже), с помощью суппозитория (например, ректального суппозитория или вагинального суппозитория), капельно(например, в виде глазных капель) или в слизистую оболочку (например, интраназально, под язык, путм полоскания или рассасывания таблетки). В соответствии с этим лекарственное средство может быть составлено или смешано как раствор для инъекции, наклейка, спрей, суппозиторий, раствор для полоскания, таблетка или капли. Введение можно осуществлять в одной дозе или, согласно необходимости, в нескольких дозах с промежутками времени между ними, которые считает подходящими наблюдающий врач. Предпочтительны внутрикожное, внутримышечное, подкожное, внутривенное и внутрислизистое введение, при этом особенно предпочтительно внтрикожное введение. Согласно другому варианту осуществления изобретения, описанные здесь выше липидные везикулы готовят в форме, которая делает возможным повторное введение пациенту. Комбинация липидных везикул согласно настоящему изобретению с другими соединениями (например, адъювантами или иммуностимуляторами) может синергидным образом усилить общее действие. Общее действие определяется количеством и типом липидных везикул, местом стимуляции и совместно стимулирующими сигналами (инфекции, воздействие аллергенов и т.д.). Действие кратковременно, в течение времени порядка от нескольких часов до нескольких недель. Длительность достигнутого действия зависит от выбранных величины дозы, временного режима дозировок, пути введения, а также от состава вводимого лекарства. В одном из вариантов осуществления изобретения липидные везикулы, как они описаны здесь выше, готовят в форме, которая позволяет вводить их многократно перед и/или после воздействия патогена на индивидуума. В идеале требуется приготовление липидных везикул в форме, обеспечивающей многократное введение в интервале времени для введения, равном 3-7 дней до и/или после воздействия патогена, причм предпочтительно, чтобы форма приготовления обеспечивала многократное введение в интервале времени для введения ("окне введения"), равном 5 дней до и/или после воздействия патогена. Особенно предпочтительна форма приготовления липидных везикул, обеспечивающая многократное введение в окне введения и в течение 5 дней до воздействия, и в течение 5 дней после воздействия патогена, иными словами всего в течение 10 дней. Однако на практике это окно трудно оценить, так как точный момент воздействия редко известен с определнностью. В таких случаях окно введения может быть рассчитано по отношению к предполагаемому или ожидаемому воздействию патогена. В другом варианте осуществления изобретения рецептура липидных везикул такова, чтобы обеспечить введение один раз в день в пределах окна (окон) введения до и/или после воздействия патогена. Однако рецептура липидных везикул может быть подобрана таким образом, чтобы обеспечить, при необходимости, более частые или более редкие введения в пределах окна (окон) введения. Например, липидные везикулы можно вводить один раз, два раза, три раза, четыре раза или пять раз в день в пределах окна(окон) введения до и/или после воздействия патогена. Подобным же образом, возможны также комбинации этих частот введения в разные дни в пределах окна (окон) введения до и/или после воздействия патогена. Лекарство, содержащее описанные здесь выше липидные везикулы, входит в состав фармацевтически приемлемых препаратов. Такие препараты могут обычно содержать фармацевтически приемлемые концентрации солей, буферных агентов, консервантов, совместимых носителей, вспомогательных иммуностимулирующих средств - таких как адъюванты и цитокины, и, по усмотрению, других терапевтических средств. Предпочтительное количество подлежащих введению липидных везикул зависит от подлежащего предотвращению, лечению и/или ликвидации заболевания или расстройства. Обычно считаются эффективными дозы в диапазоне от приблизительно 1 нг/кг до приблизительно 100 мг/кг, причм указанные килограммы относятся к весу тела подвергающегося лечению животного. Считается, что предпочтительный диапазон составляет от приблизительно 10 нг/кг до приблизительно 10 мкг/кг. Абсолютное значение будет зависеть от многих факторов, в том числе от выбранной для введения композиции, от того, осуществляется ли введение в одной дозе или в нескольких дозах (см. выше), и от параметров конкретного пациента, в том числе от возраста, физического состояния, размера, веса и стадии заболевания. Путь и режим введения будут различными в зависимости от стадии или тяжести подлежащего предотвращению, лечению и/или ликвидации заболевания или расстройства и должны определяться опытным практикующим врачом. Содержащее описанные здесь выше липидные везикулы лекарство обычно пригодно для парентерального введения. В этом случае лекарство содержит липидные везикулы, растворнные или суспендированные в приемлемом носителе, предпочтительно в водном носителе Могут быть использованы различные водные носители: например, вода, забуференная вода, 0,4% солевой физиоло- 12016033 гический раствор, 0,3% глицерин, гиалуроновая кислота и подобные им. Эти композиции могут быть стерилизованы с помощью обычных, хорошо известных методов стерилизации или могут быть подвергнуты стерилизующему фильтрованию. Полученные водные растворы могут быть упакованы для использования в таком же виде или могут быть лиофилизованы, причм лиофилизованный препарат соединяют со стерильным раствором перед введением. Лекарство, содержащее липидные везикулы, как они описаны здесь выше, может дополнительно содержать фармацевтически приемлемые вспомогательные вещества, которые необходимы для соответствия физиологическим условиям, такие, как необходимые для установления pH и буферные агенты, регулирующие тонус агенты, увлажняющие агенты и подобные им. Среди многих других это могут быть,например, ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, сорбитанмонолаурат, триэтаноламин-олеат. Реальные методы приготовления пригодных для парентерального введения соединений должны быть известны или очевидны опытным специалистам в данной области и более подробно описаны, например, в издании Remington: The Science and Practice of Pharmacy ("Remington's Pharmaceutical Sciences"). Под ред. Gennaro A.R. 20th edition; WilliamsWilkins PA, USA. Лекарство, содержащее липидные везикулы, как они описаны здесь выше, может быть составлено таким образом, чтобы обеспечить введение в пероральных дозировочных формах - например, в виде таблеток, капсул (каждые из них включают рецептуры с регулируемым по времени высвобождением и с замедленным высвобождением), пилюль, порошков, гранул, эликсиров, настоек, растворов, суспензий,сиропов и эмульсий, или введение путм инъекции. Например, при пероральном введении в форме таблеток или капсул активный лекарственный компонент можно комбинировать с пероральным нетоксичным, фармацевтически приемлемым инертным носителем - таким, как этанол, глицерин, вода и подобные им. Подобно этому, лекарство, содержащее липидные везикулы, как они описаны здесь выше, может быть составлено таким образом, чтобы обеспечить введение внутривенно (либо болюсной инъекцией или путм вливания), внутрибрюшинно, подкожно, поверхностно (с перекрытием или без перекрытия) или внутримышечно. В предпочтительных вариантах осуществления изобретения лекарство, приготовленное согласно заявляемому применению, вводят внутримышечно, подкожно, внутрикожно, в слизистую оболочку или черезкожно. Все эти формы хорошо известны специалистам с обычным опытом в фармацевтической области. Режим дозировки, согласно которому может быть введено лекарство, содержащее липидные везикулы, как они описаны здесь выше, выбирают в соответствии с различными факторами, в том числе, например, видом, возрастом, весом, полом и медицинским состоянием пациента, стадией и тяжестью подлежащего предотвращению или лечению заболевания или расстройства и конкретного типа применнных липидных везикул. Врач с обычным опытом в данной области может легко определить и прописать эффективное количество лекарственного средства, требуемое для предотвращения, противодействия развитию или прекращения развития злокачественного образования или инфекционного заболевания или расстройства. Для оптимальной точности в достижении концентрации лекарственного средства в интервале, который обеспечивает эффективность либо без токсичности, либо с приемлемой токсичностью,необходим режим, основанный на кинетике достижения липидными везикулами мест назначения. Этот процесс включает учт распределения, равновесия и удаления липидных везикул, соответствует квалификации опытного практического врача, и для него достаточно обычного опытного исследования. Ежедневную дозу лекарства, содержащего липидные везикулы, как они описаны здесь выше, можно варьировать в интервале от 10 нг/кг до приблизительно 10 мкг/кг липидных везикул на одного взрослого в день. Для перорального введения лекарственное средство, приготовленное согласно заявленному в изобретении применению, предпочтительно предоставляют в форме таблеток, содержащих липидные везикулы в количестве от 0,001 до 1,000 мг, предпочтительно 0,001, 0,01, 0,05, 0,1, 0,5, 1, 2,5, 10, 20, 50,100 мг для симптоматического установления дозировки согласно признакам и симптомам пациента в ходе лечения. Эффективное количество липидных везикул в лекарственном средстве, приготовленном согласно варианту осуществления заявленного в изобретении применения, обычно вносят на уровне дозировки от приблизительно 0,0001 мг/кг до приблизительно 50 мг/кг в день в расчете на вес тела. Более конкретно, диапазон составляет от приблизительно 0,0001 до 7 мг/кг в день в расчете на вес тела. Кроме того, лекарство, содержащее липидные везикулы, как они описаны здесь выше, может быть составлено таким образом, чтобы обеспечить введение в интраназальной форме или с использованием черезкожных путей, известных специалистам с обычным опытом в данной области. Если рецептура обеспечивает введение в форме черезкожной системы доставки, дозировку введения в пределах дозировочного режима подбирают плавно, а не ступенчато. Приготовленное согласно заявленному в изобретении применению лекарственное средство может быть соединено с классом биодеструктируемых полимеров, пригодных для обеспечения контролируемого высвобождения лекарства. Это могут быть, например, поли(молочная кислота), поли(-капролактон),поли(оксимасляная кислота), полиортоэфиры, полиацетали, полидигидропираны, полицианоакрилаты и сшитые или амфипатические блочные сополимеры или гидрогели. Подходящая рецептура приготовленного согласно заявленному в изобретении применению лекар- 13016033 ственного средства для поверхностного введения может быть, например, в форме рецептуры раствора,крема, мази, геля, лосьона, шампуня или аэрозоля, приспособленной для нанесения на кожу. Эти фармацевтические композиции для поверхностного применения, содержащие приготовленное согласно заявленному в изобретении применению лекарственное средство, обычно включают активное соединение, то есть липидные везикулы, в количестве приблизительно от 0,02 до 5% по весу, в смеси с фармацевтически приемлемым носителем. Обычно лекарственное средство, содержащее липидные везикулы, как они описаны здесь выше,может содержать липидные везикулы в количестве по весу главным образом 0,02, 0,05, 0,08, 1, от 1 до 2,2, от % до 3, 3, от 3 до 4, 4, от 4 до 5 или 5%. Независимо от пути, которым вводится приготовленное согласно заявленному в изобретении применению лекарственное средство, его следует вводить в эффективном количестве. Эффективным количеством является такое количество, фармацевтического препарата, которое, само по себе или вместе с другими дозировками, стимулирует желательную неспецифическую иммуностимулирующую реакцию. Кроме того, если желательно или необходимо, в приготовленное согласно заявленному в изобретении применению лекарство могут вводиться подходящие связывающие вещества, смазки, разрыхляющие агенты и красители. Подходящие связывающие вещества включают (без ограничения ими) крахмал, желатин, природные сахара - такие как глюкоза или бета-лактоза, подслащивающие вещества из зерновых культур, природные и синтетические камеди - такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и подобные им. Используемые в таких дозировочных формах смазки включают (без ограничения ими) олеат натрия, стеарат натрия, стеарат магния,бензоат натрия, ацетат натрия, хлорид натрия и подобные им. Разрыхлители включают (без ограничения ими) крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и подобные им. Жидкая форма приготовленного согласно заявленному в изобретении применению лекарства может быть подходящим образом ароматизирована суспендирующими или диспергирующими агентами - такими, как синтетические и природные камеди (например, трагакант, аравийская камедь, метилцеллюлоза и подобные им). Могут быть применены другие диспергирующие агенты: глицерин и подобные ему. Для парентерального введения необходимы стерильные суспензии и растворы. Если необходимо внутривенное введение, применяют изотонические препараты, которые обычно содержат подходящие консерванты. Препараты для поверхностного применения, содержащие активный лекарственный компонент, могут быть смешаны с различными материалами-носителями, хорошо известными в данной области, - такими,как, например, спирты, гель алоэ вера, аллатоин, глицерин, масла с витаминами A или E, минеральное масло, PPG2 миристоил-пропионат и подобные им, чтобы получить, например, спиртовые растворы, поверхностные очистители, очищающие кремы, гели для кожи, лосьоны для кожи и шампуни в рецептурах для кремов или гелей. В одном из вариантов осуществления приготовленное согласно заявленному в изобретении применению лекарство может дополнительно содержать по меньшей мере один адъювант, усиливающий и/или направляющий иммунную реакцию, например врожднную иммунную реакцию, реакцию Th1 или Th2. Подходящие адъюванты могут усиливать иммунологическую реакцию путм активации макрофагов и/или стимуляции специфических наборов лимфоцитов. Подходящим адъювантом может быть любой лиганд, пригодный для активации рецептора распознавания патогена (pathogen recognition receptor, PRR). Усиливающие иммунную реакцию соединения можно классифицировать (разделить) на адъюванты (в определнном здесь выше смысле) или цитокины. Адъюванты могут усиливать иммунологическую реакцию, предоставляя резервуар антигенов (внеклеточный или внутри макрофагов), активирующих макрофаги и стимулирующих специфические наборы лимфоцитов. Многие типы адъювантов хорошо известны в данной области; конкретные примеры включают адъювант Фрейнда (полный и неполный), микобактерии, такие как BCG, M. vaccae или Corynebacteriumparvum, холерный токсин или токсин столбняка, термочувствительный токсин E. coli, смеси quil с сапонином - такие, как QS-21 (SmithKline Beecham), MF59 (Chiron) и различные масляно-водные эмульсии(например, IDEC-AF). Другие адъюванты, которые можно использовать, включают (но не ограничиваются ими): минеральные соли или минеральные гели, такие как гидроокись алюминия, фосфат алюминия и фосфат кальция; поверхностно-активные вещества, такие как лизолецитин, полиолы плюроника, полианионы, пептиды, гемоцианины входного отверстия моллюска "блюдечка" и динитрофенол, иммуностимулирующие молекулы - такие как сапонины, дипептидные и трипептидные производные мурамила,короткие тяжи нуклеиновой кислоты -такие, как динуклеотиды CpG, олигонуклеотиды CpG, монофосфорил-липид A и полифосфазоцены, гранулированные и микрогранулированные адъюванты - такие как эмульсии, липосомы, липидные носители "cochleates", или комплексные иммуностимулирующие адъюванты. Полезны также цитокины, благодаря их свойствам стимулировать лимфоциты. Многие полезные для таких целей цитокины должны быть известны специалисту с обычным опытом в данной области,включая интерлейкин-2 (IL-2), IL-12, GM-CSF и многие другие. Пригодны также другие лиганды из семейства хемокинов - такие как RANTES (Regulated upon Activation Normal T cell Expressed and Secreted,т. е. регулируемые путм активации нормальных T-клеток, экспрессируемые и секретируемые), липопро- 14016033 теин грам-положительных бактерий, компонент клеточных стенок дрожжей, двунитевая РНК, липополисахарид грам-отрицательных бактерий, флагеллин, богатая урацилами однонитевая вирусная РНК, супрессорный цитокин 6f, сигнальная малая интерферирующая РНК (SOCS siRNA), эпитоп Pan DR (PADRE) и их смеси. Для предотвращения, лечения и/или ликвидации видов рака и/или метастазов содержащее липидные везикулы, как они описаны здесь выше, лекарственное средство может быть приготовлено таким образом чтобы обеспечить введение в комбинации с фармацевтически приемлемым носителем, приспособленным для местного введения. Дополнительно, для предотвращения, лечения и/или ликвидации рака, опухолей и/или метастазов или вирусных инфекций приготовленное для предусмотренного изобретением применения лекарственное средство может быть использовано вместе с другими средствами, известными как пригодные для лечения таких злокачественных новообразований. Для комбинационного лечения более чем одним активным средством, если активные средства могут вводиться совместно, активные средства можно вводить совместно, или же они могут вводиться по отдельности в ступенчатые моменты времени. Следует понимать, что элементы различных вариантов осуществления изобретения, представленные здесь выше, могут свободно комбинироваться друг с другом в пределах любого конкретного аспекта изобретения, а также между одним и более аспектами изобретения. Например, хотя элементы конкретного варианта осуществления изобретения могут формально обсуждаться в связи с применением липидных везикул для приготовления лекарственного средства, легко понять, что элементы этого варианта осуществления изобретения можно свободно комбинировать с элементами других вариантов осуществления изобретения, обсуждаемыми в связи с этим применением. Краткое описание рисунков Фиг. 1 - действие "голых" виросом на рост опухолей у мышей. Рисунок показывает результаты мониторинга роста опухолей у мышей, которым была произведена инъекция клеток опухоли и затем еженедельно вводили один из двух образцов: физиологический раствор в качестве контроля (пустые кружки) и пустые виросомы (зачерннные ромбы). Результаты показывают, что инъекция голых (то есть пустых) виросом дат значительно большее число не имеющих опухоли мышей к концу периода опыта по сравнению с контрольной инъекцией. Фиг. 2 - защитное действие пустых виросом на развитие вируса Ля Кросс (La Crosse). Мышам до заражения вирусом вводили инъекцией один из четырх образцов: виросом, в которые была инкапсулирована ДНК, кодирующая гликопротеины вируса La Crosse (пустые треугольники); пустые виросомы(зачерннные ромбы); только ДНК-вектор, причм указанный вектор содержал ДНК, экспрессирующую гликопротеины вируса La Crosse (пустые квадраты); только ДНК-вектор, причм указанный вектор не содержал ДНК, экспрессирующую гликопротеины вируса La Crosse (пустые кружки). Результаты показывают, что обработка пустыми виросомами приводила к повышению выживаемости животных по сравнению с контролем, где мышам вводили ДНК-вектор, не содержащий ДНК, экспрессирующую гликопротеины вируса La Crosse. Фиг. 3 А, 3 Б - защитное действие пустых виросом на развитие инфекции Leptospira interrogans. На рисунке показан результат мониторинга выживаемости песчанок, заражнных бактериями Leptospira interrogans. Животным до заражения бактериями вводили инъекцией пустые гриппозные виросомы (заштрихованные ромбы). В качестве негативного контроля были заражены песчанки, которым не вводили виросомы (пустые кружки). Фиг. 4 - схема опыта с заражением вирусом простого герпеса 2-го типа (HSV-2). На рисунке показано, что пустые виросомы вводили несколько раз и внутрикожно, и интраназально как до, так и после заражения смертельной дозой HSV-2. Фиг. 5 А - влияние пустых виросом на общую выживаемость при развитии инфекции HSV-2 по сравнению с мышами, которым вводили забуференный фосфатом солевой раствор (PBS) (контроль) и вакцину против HSV. Группы по 10 мышей заражали в день 0 штаммом G HSV-2, вводя его во влагалище. Пустые виросомы вводили и внутрикожно (в/к, пустые треугольники), и интраназально (и/н, пустые кружки). Выживаемость контрольных мышей, получавших PBS, обозначена зачерннными ромбами, а выживаемость мышей, получивших вакцину против HSV за 34 и 20 дней до заражения, обозначена зачерннными квадратами. Результаты показывают, что введение пустых виросом приводит к повышению выживаемости по сравнению с контрольными мышами, получившими PBS. Неожиданно было установлено, что наблюдавшаяся выживаемость у мышей, которым внутрикожно вводили пустые виросомы,была равна выживаемости мышей, которые до заражения получали HSV-специфическую вакцинацию. Кроме того, выживаемость мышей, которым вводили пустые виросомы интраназально, была на 25-й день лишь на 10% ниже, чем выживаемость мышей, которые до заражения получали HSV-специфическую вакцинацию. Фиг. 5 Б - влияние пустых виросом на клинические симптомы развития инфекции HSV-2 по сравнению с мышами, которым вводили контрольный PBS и вакцину против HSV. Группы по 10 мышей заражали в день 0 штаммом G HSV-2, вводя его во влагалище. Пустые виросомы вводили и внутрикожно(в/к, пустые треугольники), и интраназально (и/н, пустые кружки). Степень развития клинических сим- 15016033 птомов у контрольных мышей, получавших PBS, обозначена зачерннными ромбами, а степень развития клинических симптомов у мышей, получивших вакцину против HSV-2 за 34 и 20 дней до заражения,обозначена зачерннными квадратами. Результаты показывают, что у мышей, которым были введены пустые виросомы, симптомы заболевания были менее тяжлыми, чем у контрольных мышей, которым вводили PBS и затем заражали вирусом HSV-2. Примечательно, что тяжесть симптомов заболевания у мышей, которым были введены пустые виросомы внутрикожно, была лишь слегка выше, чем у мышей,которые до заражения получали HSV-специфическую вакцину. Фиг. 6 - обзорная диаграмма, показывающая некоторые характеристики врожднной и адаптивной ветвей иммунной системы и взаимоотношения между ними. Конкретные варианты осуществления изобретения и нижеследующие примеры предназначены,чтобы продемонстрировать эффективность заявляемого изобретения, но не должны быть интерпретированы как ограничивающие область охвата изобретения. В той мере, как упоминаются конкретные материалы, это делается в целях иллюстрации и не должно рассматриваться как ограничивающее данное изобретение. Если не указано иное, используются методы биохимии и молекулярной биологии - такие как приведнные в изданиях: Voet, "Biochemistry", Wiley, 1990; Stryer, "Biochemistry", Freeman, 1995; Bodanszky, "Peptide Chemistry. A Practical Textbook", 2nd ed., Springer-Verlag, Berlin, 1993; Sambrook et al. "Molecular Cloning", Cold Spring Harbor Laboratory, 2001; "Current Protocols in Molecular Biology", под ред.Ausubel et al., John WileySons, 2000. Специалист в данной области может разработать примы или реагенты без проявления изобретательского потенциала и без выхода за пределы охвата настоящего изобретения. Следует понимать, что описанные здесь композиции и способы могут быть изменены, но так что при этом они останутся в рамках настоящего изобретения. Пример 1 (пример приготовления). Используемые при приготовлении реагенты и рабочие образцы. Реагенты: октаэтиленгликоль-моно-(н-додециловый)эфир (OEG, C12E8) получен от фирмы FlukaChemie GmbH (Buchs, Switzerland). Сахароза (квалификации, соответствующей Европейской фармакопее) от фирмы Merck (Dietikon, Switzerland). Яичный фосфатидил-холин (PC) от фирмы Lipoid (Cham,Switzerland). 1-Олеил-3-пальмитоил-рац-глицеро-2-фосфоэтаноламин от фирмы Bachem (Bubendorf,Switzerland). Био-гранулы Bio-Beads SM2 поставлены фирмой Bio-Rad Laboratories (Glattbrugg, Switzerland). Холестерил-N-(триметиламмонийэтил)карбамат-хлорид (TC-Chol) получен от фирмы Merck Eprova(Schaffhausen, Switzerland). Вирусы гриппа: штамм A/Singapore/6/86 (A/Sing) и другие штаммы вируса гриппа A, размноженные в аллантойной полости яиц с развивающимися эмбрионами (Gerhard W. // J. Exp. Med. 1976. T. 144. C. 985-995) были получены от Berna Biotech AG (Bern, Switzerland) и очищены, как описано в работе Skehel(Bottcher et al. // Anal. Chim. Ada. 1961. T. 24. C 203), a количественное определение HA после электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE) проводили с помощью метода экстракции с кумасси, как описано Ball (Ball et al. II Anal. Biochem. T. 155. C 23). Пример 2 (пример приготовления). Приготовление стандартных виросом как гриппозных виросом. Для получения конечного объма 4 мл 32 мг яичного PC и 8 мг OPPE растворяли в 3 мл PBS с 100 мМ OEG (PBS/OEG). 2 мг HA инактивированного вируса гриппа A/Singapore/6/86 или другого штамма вируса гриппа A центрифугировали при 100000 g в течение 1 ч при 4C и осадок растворяли в 1 млPBS/OEG. Смешивали растворнные в детергенте фосфолипиды и вирусы и обрабатывали ультразвуком в течение 1 мин. Смесь центрифугировали при 100000 g в течение 1 ч при 18C. Виросомы получали путм удаления детергента двукратной обработкой 1,5 г влажных биогранул SM2 Bio-Beads, каждый раз в течение 1 ч при комнатной температуре со встряхиванием. Затем свежеполученные виросомы подвергали стерилизующему фильтрованию (размер пор 0,22 мкм). Пример 3 (пример приготовления). Приготовление виросом. содержащих TC-Chol. Содержащие TC-Chol виросомы готовят методом удаления детергента. Для получения конечного объма 4 мл 32 мг яичного PC, 8 мг OPPE и 5 мг холестерил-N-(триметиламмониоэтил)карбамат-хлорида(TC-Chol) растворяли в 2,6 мл PBS с 100 мМ OEG (PBS/OEG). 2 мг HA инактивированного вируса гриппа A/Singapore/6/86 или другого штамма вируса гриппа A центрифугировали при 100000 g в течение 1 ч при 4C и осадок растворяли в 1 мл PBS/OEG. Растворнные в детергенте фосфолипиды и вирусы смешивали с 0,4 мл 50% (вес к объму) сахарозы и обрабатывали ультразвуком в течение 1 мин. Смесь центрифугировали при 100000 g в течение 1 ч при 18C. Виросомы получали путм удаления детергента двукратной обработкой 1,5 г влажных биогранул SM2 Bio-Beads, каждый раз в течение 1 ч при комнатной температуре со встряхиванием. Затем свежеполученные виросомы подвергали стерилизующему фильтрованию (размер пор 0,22 мкм) и расфасовывали в стерильные стеклянные флаконы. Закрытые флаконы замораживали при -70C и затем лиофилизовали при -40C в течение 20 ч и при 10C в течение 2 ч. Закрытые флаконы до использования хранили замороженными. Пример 4 (рабочий пример). Неспецифическая иммуностимуляция пустыми виросомами снижает возникновение опухолей у мышей.- 16016033 Следующий опыт был проведн в связи с разработкой противораковой вакцины для терапевтического применения. Вакцина предназначена к применению на той стадии, когда опухоль уже развилась в тканях тела. Ожидается, что иммунизация виросомами усиливает специфическую иммунную реакцию на опухоль до уровня, достаточного для полного удаления клеток растущей опухоли. Самок мышей линии C57BI/6 в возрасте от 8 до 10 недель предварительно иммунизировали инактивированным вирусом гриппа, содержащим 1 мкг гемагглютинина, чтобы имитировать ситуацию у предварительно иммунизированных людей, которые были естественным образом заражены гриппом в какойто более ранний период жизни. Через 3 недели мышам подкожно вводили 10000 опухолевых клеток B16. Через 2 дня начинали иммунизацию приблизительно 1-25 мг пустых виросом на 1 кг веса тела и продолжали это с недельными интервалами в течение 9 недель. В опыте были 2 группы для воздействия. Мыши в каждой соответственной группе получали следующее: Группа 1: забуференный фосфатом солевой раствор ("солевой раствор" на фиг. 1; пустые кружки). Группа 2: стандартные (пустые) виросомы, образованные яичными фофолипидами и солюбилизированными вирусными оболочками ("пустые виросомы" на фиг. 1; зачерннные ромбы). В течение периода воздействия у животных постоянно наблюдали развитие опухолей. Мышей, у которых развивались пальпируемые опухоли, забивали. В соответствии с этим, результатом исследования было число мышей без опухоли в группе за период наблюдения. Результаты представлены на фиг. 1. Как видно из фиг. 1, 50% мышей, получавших пустые виросомы, были достоверно защищены (зачерннные ромбы на фиг. 1; "пустые виросомы"), тогда как из контрольных мышей, получавших солевой раствор, только 20% остались без опухолей (пустые кружки на фиг. 1; "солевой раствор"). Заключение: введение голых виросом приводит к ликвидации опухоли у значительного числа мышей с инициированным развитием опухоли. Пример 5 (рабочий пример). Неспецифическая иммуностимуляция голыми виросомами повышает выживаемость у мыши, инфицированных вирусом La Crosse.Первоначально был проведн опыт для проверки виросом как носителей для доставки основанной на ДНК вакцине против вируса La Crosse. Плазмидную ДНК, кодирующую вирусные гликопротеины вируса La Crosse (VR1012-G1G2), упаковывали в виросомы, чтобы усилить проникновение плазмиды в клетки и экспрессию вирусных антигенов. В одном из контролей вводили голые виросомы. Генетически модифицированные мыши, у которых отсутствует рецептор для интерферонов типа I(мыши IFNAR-I -/-) более восприимчивы к вирусным инфекциям и поэтому являются подходящей моделью для инфекции вирусом La Crosse. Мыши были предварительно иммунизированы против вируса гриппа, чтобы имитировать ситуацию для предварительно иммунизированных людей, которые были естественным образом заражены гриппом в какой-то более ранний период жизни, и через 10 дней им вводили одиночную дозу прототипа вакцины La Crosse (или контрольные рецептуры, как указано ниже). Через 4 недели проводили заражение вирусом в дозе 200 000 инфекционных единиц. Выживаемость животных регистрировали через 24 дня после заражения В опыте были следующие группы: 1 ДНК-вектор, экспрессирующий гликопротеины вируса La Crosse, объединнный с виросомами("виросомы с ДНК-вакциной" на фиг. 2; пустые треугольники); 2. Виросомы без ДНК ("пустые виросомы" на фиг. 2; зачерннные ромбы); 3. Только ДНК-вектор, вектор, экспрессирующий гликопротеины вируса La Crosse ("только ДНКвакцина" на фиг. 2, пустые квадраты); 4. Только ДНК-вектор, не экспрессирующий гликопротеины вируса La Crosse ("пустой ДНКвектор" на фиг. 2, пустые кружки). Результаты исследования приведены на фиг. 2. Как видно из фиг 2, пустые виросомы предоставляют столь же хорошую защиту, как и ДНК-вектор, экспрессирующий гликопротеины вируса La Crosse,когда он введн один. В каждом случае были защищены 60% животных. В сравнении с этим, в группе,получившей ДНК-вектор вместе с виросомами, степень защиты была 70%. В качестве негативного контроля вводили ДНК-вектор, не экспрессирующий гликопротеины вируса La Crosse. Он вс же давал степень защиты 30%. Интервал в 3 недели между иммунизацией и заражением может быть необходим для развития адаптивного иммунитета, но похоже, что он субоптимален для достижения неспецифического защитного действия, проявляемого голыми виросомами. Однако, несмотря на такое субоптимальное введение, первоначальная иммунизация голыми (то есть пустыми) виросомами, хотя и не была столь же эффективной,как с виросомами, в которые была инкапсулирована происходящая из вируса La Crosse ДНК, вс же обеспечивала неспецифическое иммуностимулирующее действие, достаточное для повышения выживаемости приблизительно на 30% по сравнению с контролем. Пример 6 (рабочий пример). Неспецифическая иммунизация голыми виросомами повышает выживаемость песчанок, заражнных бактериями Leptospira interrogans. Опыты были проведены в связи с разработкой профилактической вакцины против Leptospira interrogans. Были использованы две различные дозы заражения Leptospira interrogans. Виросомы были приготовлены, как описано в примере 2 ("пустые гриппозные виросомы").- 17016033 Песчанок иммунизировали за 2 недели до заражения живыми бактериями. Заражение проводили различными дозами патогена, как указано на отдельных фиг. 3 А и фиг. 3 Б. 1. Негативный контроль: животные без воздействия ("нег. контроль" на фиг. 3 А и 3 Б; пустые кружки); 2. Пустые виросомы ("пустые гриппозные виросомы" на фиг. 3 А и 3 Б; заштрихованные ромбы); Результаты представлены на фиг. 3 А и 3 Б. Как видно из фиг. 3 А и 3 Б, хотя никто из животных не выжил при бактериальном заражении, длительность жизни у животных, которые предварительно получили пустые виросомы, была больше, чем у контрольных животных, не подвергнутых воздействию. Пример 7 (рабочий пример). Неспецифическая иммунизация голыми виросомами увеличивает выживаемость и снижает тяжесть заболевания у мышей, заражнных вирусом простого герпеса 2 ("HSV2"). Этот опыт был проведн, чтобы получить и подтвердить неспецифическое защитное действие гриппозных виросом против инфекционных заболеваний, не имеющих никакого отношения к антигенным компонентам виросом. В данном опыте в качестве заражающего патогена был использован HSV-2. Протоколы опытов были основаны на предварительно разработанных на мышах моделях заражения вирусом простого герпеса 2-го типа (HSV-2). Во всех опытах использовали мышей-самок линии Balb/C в возрасте 6-8 недель к моменту начала опыта. Использованные в этом опыте виросомы были приготовлены, как описано выше в примере 2. Регистрация в опытах состояла в ежедневной оценке клинических симптомов и определении выживаемости. Защитное действие виросом определяли путм сравнения получавших виросомы групп с группами, получавшими в качестве контроля забуференный фосфатом солевой раствор ("PBS"). Кроме того, при заражении HSV-2 добавляли группу позитивного контроля, которая получала обычную живую аттенуированную вакцину, созданную для индукции специфического (адаптивного) иммунитета с известным защитным действием. В разработке специфической вакцины было неоднократно показано, что адъювантное действие виросом существенно возрастает при предсуществующем иммунитете. Поэтому было решено во всех опытах использовать предварительно иммунизированных животных. В итоге животных иммунизировали за 4 недели до заражения путм внутримышечной инъекции очищенного, инактивированного вируса гриппа,содержащего 1 мкг HA, ресуспендированного в PBS. Как объяснено выше в примере 4, мыши в данном опыте были также предварительно иммунизированы инактивированным вирусом гриппа, содержащим 1 мкг гемагглютинина, чтобы имитировать ситуацию у предварительно иммунизированных людей, которые были естественным образом заражены гриппом в какой-то более ранний период жизни. Расписание введения виросом было основано на предположении, что неспецифическое защитное действие виросом, скорее всего, кратковременно. Поэтому для обнаружения неспецифического действия наиболее оправданным подходом было проведение повторных введений незадолго до и после зараженияHSV-2. В то же самое время интервал времени между введением виросом и заражением HSV-2 (5 дней или менее) был выбран таким, чтобы он был явно слишком коротким для полноценного ударного стимулирования специфического иммунитета к гриппу (7-14 дней), таким путм отсеивая возможность при последующем анализе того, что наблюдаемый эффект мог бы быть приписан специфической иммунизации против гриппа виросомными белками HA. Применнные дозы виросом были в диапазоне от 20 до 40 мкг HA и представляли собой дозы, близкие к максимальным, технически возможным для выбранных путей введения. Живую аттенуированную вакцину для контрольных вакцинированных мышей вводили согласно установленным ранее режимам и дозировкам. Мышей иммунизировали дважды внутрикожно в подушечку подошвы правой лапы аттенуированным штаммом HSV KOS - первый раз 8000 бляшкообразующих единиц (БОЕ) в день 0 (начало исследования) и бустерно 400000 БОЕ на 14-й день. Этих животных не иммунизировали предварительно против гриппа, чтобы избежать возможной интерференции со специфической вакцинацией. За одну неделю до заражения все группы получали подкожную инъекцию 5 мг медроксипрогестерон-ацетата (Depo Provera 150, Pfizer), чтобы заблокировать их менструальный цикл. На 34-й день всех мышей заражали летальной дозой вируса (1000 БОЕ штамма G HSV-2), вводя его во влагалище в объме 10 мкл, затем ежедневно регистрировали клинические симптомы и выживаемость. Общая картина воздействия виросомами или контрольным PBS представлена на фиг. 4. Как показано на фиг. 4, мыши получали всего 5 доз пустых виросом или контрольного PBS и до, и после самого заражения HSV-2. Конкретно пустые виросомы или контрольный PBS вводили один раз до зараженияHSV-2, а остальные 4 введения осуществляли после заражения. Интраназальное введение проводили под успокаивающим действием кселазина (0,3 мг на животное), в каждую ноздрю вводили 10 мкл, в результате общая доза в каждом интраназальном введении составляла 20 мкг HA. Каждое внутрикожное введение представляло собой инъекцию 40 мкг HA в объме 40 мкл. После заражения животных наблюдали ежедневно, для каждого животного клинические симптомы оценивали согласно опубликованной схеме обследования (Natuk et al. // Journal ov Virology. 2006. T. 80.9. C 4447-4457). Схема оценки клинических симптомов приведена ниже в табл. 1, причм более высо- 18016033 кие оценки клинических симптомов соответствуют более тяжлым симптомам заболевания, а более низкие оценки клинических симптомов соответствуют менее тяжлым симптомам заболевания. Таблица 1 Схема оценки клинических симптомов согласно Natuk et al Больных животных с параличом умерщвляли. Животных наблюдали в течение 25 дней после заражения. Предварительные данные затем анализировали на наличие различий между группами по выживаемости и ежедневным оценкам клинических симптомов. Статистический анализ проводили с помощью теста ранжирования сумм Вилкоксона, как описано, например, в Hsler J.Zimmermann H. "StatistischeHuber, Hogrefe AG, Bern, PP. 116-121. Результаты оценки выживаемости в следующих группах мышей в дни с 0 по 25 после заражения приведены на фиг. 5 А. 1. Мыши, получавшие контрольный PBS ("PBS" на фиг. 5 А; зачерннные ромбы). 2. Мыши, получавшие живую аттенуированную HSV-аттенуированную вакцину ("вакцина (HSVKOS)" на фиг. 5; зачерннные квадраты). 3. Мыши, получавшие пустые виросомы через внутрикожный путь введения ("виросомы в/к" на фиг. 5; пустые треугольники). 4. Мыши, получавшие пустые виросомы через интраназальный путь введения ("виросомы и/н" на фиг. 5 А, пустые кружки). На фиг. 5 А ясно видно, что выживаемость на 25-й день после заражения HSV у контрольных мышей, получавших PBS, была равна лишь 50%, тогда как выживаемость получивших вакцину против HSV мышей составила 100%. Неожиданно оказалось, что введение голых виросом внутрикожным путм на 25-й день после заражения HSV составила 100%, что было эквивалентно защите, достигаемой при HSVспецифической предварительной иммунизации. Защита, которую обеспечивали пустые виросомы, вводимые интраназальным путм, была только немногим меньше и составила 90%. Таким образом, можно в общем заключить, что пустые/голые виросомы способны обеспечить защиту от заболеваний, которые не связаны с белком (белками) вирусной оболочки, содержащимся (содержащимися) в/на виросомах; то есть пустые/голые виросомы способны обеспечить иммуностимуляцию, которая является неспецифической. Более того, степень достигаемой иммуностимуляции такая же, как и достигаемая при специфической предварительной иммунизации. На фиг. 5 Б представлены результаты, относящиеся к степени клинических симптомов для тех же самых групп мышей, как они описаны выше в связи с фиг. 5 А. На фиг. 5 Б ясно видно, что степень тяжести клинических симптомов на 25-й день после заражения HSV у контрольных мышей, получавших PBS,была 3,5 (то есть более тяжлые), а в группе, где мыши получили вакцину против HSV, степень тяжести клинических симптомов была слегка выше 1 (то есть менее тяжлые). Важно, что вводимые внутрикожно пустые виросомы снижали тяжесть симптомов заболевания по сравнению с получавшими PBS контрольными мышами почти до уровня, соответствующего мышам, которые предварительно получилиHSV-специфическую вакцину. В противоположность этому, у мышей, получавших интраназально пустые виросомы, развивались симптомы заболевания, лишь ненамного менее тяжлые, чем у получавших контрольный PBS мышей. Таким образом, оказывается, что внутрикожное введение пустых виросом имеет более сильное иммуностимулирующее действие, чем интраназальное введение пустых виросом. В итоге можно заключить, что и внутрикожное, и интраназальное введение пустых виросом повышает выживаемость у мышей при заражении HSV, а также снижает тяжесть протекания этой инфекции у мышей по сравнению с мышами, также заражнными HSV, но получавшими вместо голых виросом контрольный PBS. Это неспецифическое защитное действие было более сильным по обоим параметрам при внутрикожном введении пустых виросом, чем при их внутриназальном введении, причм достигаемое при внутрикожном введении виросом защитное действие эквивалентно или только слегка меньше, чем достигаемое с помощью специфической вакцины к HSV. Эта защита является неспецифической, так как вводимые пустые виросомы несут белки вирусной оболочки (HA) вируса гриппа, но не имеют HSVспецифических антигенов. Наконец, следует отметить, что использованная в изложенном выше опыте доза заражения соответствует 1 ЛД 50 ("50%-ная летальная доза", обозначающая дозу, при которой ожидается гибель 50% животных). При более высокой дозе заражения или более высокой вирулентности заражающего штамма результаты могут быть более впечатляющими. Кроме того, дозировка и режим- 19016033 введения пустых виросом были выбраны умозрительно. По этой причине наблюдаемые защитные эффекты могут не отражать полного защитного потенциала пустых виросом. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение липидных везикул, содержащих в их липидной мембране по меньшей мере один белок вирусной оболочки, для приготовления лекарства, предназначенного для неспецифической стимуляции иммунной реакции у животного для предотвращения и/или лечения заболевания или расстройства,где липидные везикулы - это пустые липидные везикулы. 2. Применение согласно п.1, где по меньшей мере один белок вирусной оболочки является белком оболочки вируса гриппа. 3. Применение согласно п.2, где по меньшей мере один белок вирусной оболочки представляет собой гемагглютинин (HA) или нейраминидазу (NA). 4. Применение согласно п.2, где белками вирусной оболочки являются гемагглютинин (HA) и нейраминидаза (NA). 5. Применение согласно п.1, где по меньшей мере один белок вирусной оболочки представляет собой белок вирусной оболочки, выбранный из белка G вируса везикулярного стоматита (ВВС); белка E1 вируса леса Семлики (ВЛС) и/или белка F вируса Сендай; белка E вируса гепатита C (ВГС); белка F респираторно-синцитиального вируса (РСВ); белка G респираторно-синцитиального вируса (РСВ). 6. Применение согласно любому из пп. с 1 по 5, где заболевание или расстройство - это инфекционное, неинфекционное, опухолевое, иммунное или метаболическое заболевание или расстройство. 7. Применение согласно п.6, где инфекционное заболевание или расстройство - это вирусное, бактериальное, грибковое, паразитное или прионное заболевание или расстройство. 8. Применение согласно любому из пп. с 1 по 6, где опухолевое заболевание или расстройство - это рак. 9. Применение согласно п.8, где рак - это саркома, лейкоз, лимфома, миелома, меланома, аденома,карцинома, хориокарцинома, гастринома, феохромоцитома, пролактинома, лейкоз/лимфома T-клеток у взрослых или неврома. 10. Применение согласно любому из пп. с 1 по 6, где иммунное заболевание или расстройство - это заболевание или расстройство, характеризуемое иммуносупрессией. 11. Применение согласно любому из пп. с 1 по 10, где лекарственное средство предназначено для неспецифической иммуностимуляции иммунной реакции по меньшей мере на два заболевания или расстройства одновременно. 12. Применение согласно любому из пп. с 1 по 11, где животное - это млекопитающее. 13. Применение согласно п.12, где млекопитающее выбрано из человека, шимпанзе, обезьяны циномольгуса, гиббона, низшей (обезьяноподобной) обезьяны, макаки, мыши, крысы, кошки, собаки, лошади, кролика, верблюда, ламы, жвачного животного, свиньи. 14. Применение согласно п.13, где жвачное животное выбрано из коровы, быка, козы, овцы, бизона,буйвола, лани или оленя. 15. Применение согласно любому из пп. с 1 по 14, где лекарство пригодно для введения внутривенно, внутримышечно, внутрикожно, подкожно, внутрибрюшинно,парентерально, поверхностно, местно, перорально, под язык или путм полоскания; и/или составлено или смешано как раствор для инъекции, как наклейка, как спрей, как суппозиторий, как раствор для полоскания или как капли. 16. Применение согласно любому из пп. с 1 по 15, где липидные везикулы - это виросомы. 17. Применение согласно п.16, где виросомы - это иммуностимулирующие реконструированные гриппозные виросомы ("гриппозные виросомы") или химерные виросомы. 18. Применение согласно п.17, где гриппозные виросомы или химерные виросомы - это химерные гриппозные виросомы. 19. Липидные везикулы, содержащие в их липидной мембране по меньшей мере один белок вирусной оболочки, предназначенные для неспецифической стимуляции иммунной реакции у животного для предотвращения и/или лечения заболевания или расстройства, где липидные везикулы - это пустые липидные везикулы. 20. Липидные везикулы согласно п.19, где по меньшей мере один белок вирусной оболочки является белком оболочки вируса гриппа. 21. Липидные везикулы согласно п.20, где по меньшей мере один белок вирусной оболочки представляет собой гемагглютинин (HA) или нейраминидазу (NA). 22. Липидные везикулы согласно п.20, где белками вирусной оболочки являются гемагглютинин(HA) и нейраминидаза (NA). 23. Липидные везикулы согласно п.19, где по меньшей мере один белок вирусной оболочки представляет собой белок вирусной оболочки, выбранный из белка G вируса везикулярного стоматита (ВВС); белка E1 вируса леса Семлики (ВЛС); и/или белка F вируса Сендай; белка E вируса гепатита C (ВГС); белка F респираторно-синцитиального вируса (РСВ); белка G респираторно-синцитиального вируса (РСВ). 24. Липидные везикулы согласно любому из пп. с 19 по 23, где заболевание или расстройство - это инфекционное, неинфекционное, опухолевое, иммунное или метаболическое заболевание или расстройство. 25. Липидные везикулы согласно п.24, где инфекционное заболевание или расстройство - это вирусное, бактериальное, грибковое, паразитное или прионное заболевание или расстройство. 26. Липидные везикулы согласно любому из пп. с 19 по 24, где опухолевое заболевание или расстройство - это рак. 27. Липидные везикулы согласно п.26, где рак - это саркома, лейкоз, лимфома, миелома, меланома,аденома, карцинома, хориокарцинома, гастринома, феохромоцитома, пролактинома, лейкоз/лимфома Tклеток у взрослых или неврома. 28. Липидные везикулы согласно любому из пп. с 19 по 24, где иммунное заболевание или расстройство - это заболевание или расстройство, характеризуемое иммуносупрессией. 29. Липидные везикулы согласно любому из пп. с 19 по 28, где липидные везикулы предназначены для неспецифической стимуляции иммунной реакции по меньшей мере на два заболевания или расстройства одновременно. 30. Липидные везикулы согласно любому из пп. с 19 по 29, где животное - это млекопитающее. 31. Липидные везикулы согласно п.30, где млекопитающее выбрано из человека, шимпанзе, обезьяны циномольгуса, гиббона, низшей (обезьяноподобной) обезьяны, макаки, мыши, крысы, кошки, собаки,лошади, кролика, верблюда, ламы, жвачного животного, свиньи. 32. Липидные везикулы согласно п.31, где жвачное животное выбрано из коровы, быка, козы, овцы,бизона, буйвола, лани или оленя. 33. Липидные везикулы согласно любому из пп. с 19 по 32, где липидные везикулы пригодны для введения внутривенно, внутримышечно, внутрикожно, подкожно, внутрибрюшинно,парентерально, поверхностно, местно, перорально, под язык или путм полоскания; и/или составлены или смешаны как раствор для инъекции, как наклейка, как спрей, как суппозиторий, как раствор для полоскания или как капли. 34. Липидные везикулы согласно любому из пп. с 19 по 33, где липидные везикулы - это виросомы. 35. Липидные везикулы согласно п.34, где виросомы - это иммуностимулирующие реконструированные гриппозные виросомы ("гриппозные виросомы") или химерные виросомы. 36. Липидные везикулы согласно п.35, где гриппозные виросомы или химерные виросомы - это химерные гриппозные виросомы. 37. Способ неспецифической стимуляции иммунной реакции у животного для лечения или предотвращения заболевания или расстройства, включающий введение указанному животному липидных везикул, содержащих в их липидной мембране по меньшей мере один белок вирусной оболочки, причм липидные везикулы - это пустые липидные везикулы. 38. Способ согласно п.37, где по меньшей мере один белок вирусной оболочки является белком оболочки вируса гриппа. 39. Способ согласно п.38, где по меньшей мере один белок вирусной оболочки представляет собой гемагглютинин (HA) или нейраминидазу (NA). 40. Способ согласно п.38, где белками вирусной оболочки являются гемагглютинин (HA) и нейраминидаза (NA). 41. Способ согласно п.37, где по меньшей мере один белок вирусной оболочки представляет собой белок вирусной оболочки, выбранный из белка G вируса везикулярного стоматита (ВВС); белка E1 вируса леса Семлики (ВЛС); и/или белка F вируса Сендай; белка E вируса гепатита C (ВГС); белка F респираторно-синцитиального вируса (РСВ); белка G респираторно-синцитиального вируса (РСВ). 42. Способ согласно любому из пп. с 37 по 41, где заболевание или расстройство - это инфекционное, неинфекционное, опухолевое, иммунное или метаболическое заболевание или расстройство. 43. Способ согласно п.42, где инфекционное заболевание или расстройство - это вирусное, бактериальное, грибковое, паразитное или прионное заболевание или расстройство.- 21016033 44. Способ согласно любому из пп. с 37 по 42, где опухолевое заболевание или расстройство - это рак. 45. Способ согласно п.44, где рак - это саркома, лейкоз, лимфома, миелома, меланома, аденома,карцинома, хориокарцинома, гастринома, феохромоцитома, пролактинома, лейкоз/лимфома T-клеток у взрослых или неврома. 46. Способ согласно любому из пп. с 37 по 42, где иммунное заболевание или расстройство - это заболевание или расстройство, характеризуемое иммуносупрессией. 47. Способ согласно любому из пп. с 37 по 46, где способ неспецифически стимулирует иммунную реакцию по меньшей мере на два заболевания или расстройства одновременно. 48. Способ согласно любому из пп. с 37 по 47, где животное - это млекопитающее. 49. Способ согласно п.48, где млекопитающее выбрано из человека, шимпанзе, обезьяны циномольгуса, гиббона, низшей (обезьяноподобной) обезьяны, макаки, мыши, крысы, кошки, собаки, лошади,кролика, верблюда, ламы, жвачного животного, свиньи. 50. Способ согласно п.49, где жвачное животное выбрано из коровы, быка, козы, овцы, бизона, буйвола, лани или оленя. 51. Способ согласно любому из пп. с 37 по 50, где липидные везикулы пригодны для введения внутривенно, внутримышечно, внутрикожно, подкожно, внутрибрюшинно,парентерально, поверхностно, местно, перорально, под язык или путм полоскания; и/или составлены или смешаны как раствор для инъекции, как наклейка, как спрей, как суппозиторий, как раствор для полоскания или как капли. 52. Способ согласно любому из пп. с 37 по 51, где липидные везикулы - это виросомы. 53. Способ согласно п.52, где виросомы - это иммуностимулирующие реконструированные гриппозные виросомы ("гриппозные виросомы") или химерные виросомы. 54. Способ согласно п.53, где гриппозные виросомы или химерные виросомы - это химерные гриппозные виросомы.
МПК / Метки
МПК: A61K 39/145
Метки: агенты, иммуностимулирующие, неспецифичные
Код ссылки
<a href="https://eas.patents.su/25-16033-nespecifichnye-immunostimuliruyushhie-agenty.html" rel="bookmark" title="База патентов Евразийского Союза">Неспецифичные иммуностимулирующие агенты</a>












