Новые соединения имидазолина, способ их получения и содержащие их фармацевтические композиции
Номер патента: 4536
Опубликовано: 24.06.2004
Авторы: Лякост Жан-Мишель, Ньюмен-Танкреди Адриан, Гобер Алан, Корди Алекс, Миллан Марк
Формула / Реферат
1. Соединения формулы (I)
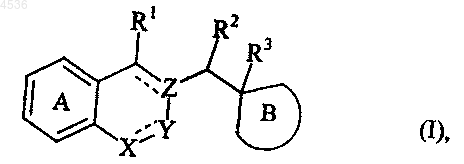
где A представляет кольцо бензола, незамещенное или замещенное 1-4 одинаковыми или различными группами, выбранными из неразветвленного или разветвленного (C1-C6)алкила, неразветвленного или разветвленного (C1-C6)алкокси, гидрокси, полигалоген (C1-C6)алкила, у которого алкильная часть не разветвлена или разветвлена, циано, нитро, амино, алкиламино, диалкиламино, тиоалкила, сульфонилалкила, сульфинилалкила, карбокси, алкоксикарбонила, алкилкарбонилокси, формила, карбамоила, карбоксамида, фенила, бензила и атомов галогена,
B представляет кольцо имидазолина, представленное формулой (Ia) или (Ib)
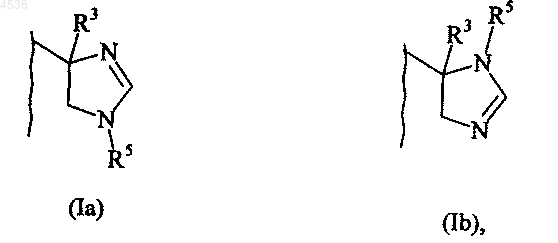
X представляет
группу CR6 или CR6R7 (где каждый из R6 и R7, которые могут быть одинаковыми или разными, представляет атом водорода или неразветвленную либо разветвленную (C1-C6)алкильную группу),
атом азота или группу NR8 (где R8 представляет атом водорода, или неразветвленную либо разветвленную (C1-C6)алкильную группу, или бензильную группу),
атом кислорода,
атом серы или группу SO или SO2,
Y представляет группу CH или CH2 или простую связь (в этом случае кольцо, содержащее X, Y и Z, представлено формулой (Ic)
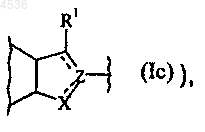
Z представляет атом углерода или группу CR4, где R4 представляет атом водорода или неразветвленную либо разветвленную (C1-C6)алкильную группу,
R1, R2, R3, которые могут быть одинаковыми или различными, представляют собой, каждый, атом водорода или неразветвленную либо разветвленную (C1-C6)алкильную группу, причем группы (R2 и R4) или (R1 и R4) могут образовывать циклопропановую группу,
R5 представляет атом водорода, или неразветвленную либо разветвленную (C1-C6)алкильную группу, или бензильную группу,
символ ---- означает, что эти связи могут быть простыми или двойными, причем подразумевается, что имеет место соответствие валентности атомов,
где алкил означает неразветвленную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода,
их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
2. Соединение формулы (I) по п.1, где R5 представляет атом водорода, их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
3. Соединения формулы (I) по п.1, где R1, R2 и R3 одновременно представляют собой атом водорода, а Z представляет атом углерода или группу CH, их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
4. Соединения формулы (I) по п.1, где R1 и R2 одновременно представляют атом водорода, а R3 или R4 представляет метильную группу, их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
5. Соединения формулы (I) по п.1, где (R1 и R4) или (R2 и R4) представляют циклопропановую группу, их таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
6. Соединения формулы (I) по п.1, где циклическая система
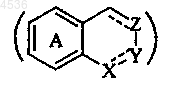
представляет 3,4 дигидронафталин, 1,2,3,4-тетрагидронафталин, индан, инден или бензофуран, их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
7. Соединения формулы (I) по п.1, где циклическая система
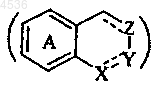
представляет 3,4-дигидронафталин, 1,2,3,4-тетрагидронафталин, индан, инден или бензофуран, причем эти циклические системы не замещены, их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
8. Соединения формулы (I) по п.1, где циклическая система
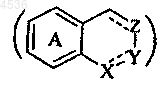
представляет 3,4-дигидронафталин, 1,2,3,4-тетрагидронафталин, индан, инден или бензофуран, причем эти циклические системы замещены одним или несколькими одинаковыми или различными заместителями, выбранными из атомов галогена и групп метил, метокси и CF3, их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
9. Соединение формулы (I) по п.1, которое представляет собой 4-(3,4-дигидро-2-нафтилметил)-4,5-дигидро-1H-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
10. Соединение формулы (I) по п.1, которое представляет собой 4-[(8-хлор-3,4-дигидро-2-нафтил)метил]-4,5-дигидро-1H-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
11. Соединение формулы (I) по п.1, которое представляет собой 4-[(8-метокси-3,4-дигидро-2-нафтил)метил]-4,5-дигидро-1H-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
12. Соединение формулы (I) по п.1, которое представляет собой 4-(бензо[b]фуран-2-илметил)-4,5-дигидро-1H-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
13. Соединения формулы (I) по п.1, которые представляют собой 4-{спиро[циклопропан-2:2'-(1',2',3',4'-тетрагидронафт)]-1-ил}-4,5-дигидро-1H-имидазол (изомер 1) и 4-{спиро [циклопропан-2:2'-(1',2',3',4'-тетрагидронафт)]-1-ил}-4,5-дигидро-1H-имидазол (изомер 2), их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
14. Соединения формулы (I) по п.1, которые представляют собой 4-[1,2,3,4-тетрагидро-2-нафтилметил]-4,5-дигидро-1H-имидазол (изомер 1), 4-[1,2,3,4-тетрагидро-2-нафтилметил]-4,5-дигидро-1H-имидазол (изомер 2), 4-[1,2,3,4-тетрагидро-2-нафтилметил]-4,5-дигидро-1H-имидазол (изомер 3), 4-[1,2,3,4-тетрагидро-2-нафтилметил]-4,5-дигидро-1H-имидазол (изомер 4), их таутомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
15. Соединение формулы (I) по п.1, которое представляет собой 4-(1,3-дигидро-1H-2-инденилметил)-4,5-дигидро-1H-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
16. Соединение формулы (I) по п.1, которое представляет собой 4-[(3,4-дигидро-4,4-диметил-2-нафтил)метил]-4,5-дигидро-1H-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
17. Соединение формулы (I) по п.1, которое представляет собой 4-[(7-фтор-3,4-дигидро-2-нафтил)метил]-4,5-дигидро-1H-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
18. Соединение формулы (I) по п.1, которое представляет собой 4-[(8-хлор-2-нафтил) метил]-4,5-дигидро-1H-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
19. Соединения формулы (I) по п.1, которые представляют сосющ 4-{спиро[циклопропан-2':2"-(5",6"-дифториндан)]-1'-ил}-4,5-дигидро-1H-имидазол(диастереоизомер 1), 4-{спиро[циклопропан-2':2"-(5",6"-дифториндан)]-1'-ил}-4,5-дигидро-1H имидазол (диастереоизомер 2), их таутомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
20. Соединение формулы (I) по п.1, которое представляет собой 4-[(5-фтор-2,3-дигидро-1H-инден-2-ил)метил]-4,5-дигидро-1H-имидазол, его таутомеры энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
21. Соединение формулы (I) по п.1, которое представляет собой 4-[(5,6-дифтор-2,3-дигидро-1H-инден-2-ил)метил]-4,5-дигидро-1H-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
22. Способ получения соединений формулы (I) по п.1, характеризующийся тем, что в качестве исходного вещества используют соединение формулы (II)
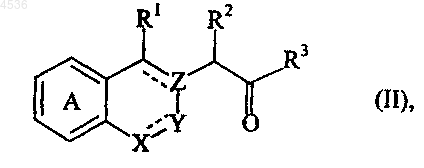
где A, X, Y, Z, R1, R2, R3 и символ ---- определены как указано выше, которое подвергают либо воздействию условий реакции Стрекера (KCN, NH4Cl), либо воздействию амина RaNH2 (где Ra представляет атом водорода или затрудненную защитную группу, позволяющую получить, где это применимо, лучшее разделение образованных диастереоизомеров) и триметилсилилцианида с получением соединения формулы (III)
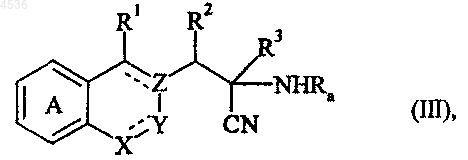
где A, X, Y, Z, R1, R2, R3, Ra и символ ---- определены как указано выше, причем соединение формулы (III), где Ra представляет атом водорода, может быть альтернативно получено, исходя из соединения формулы (IV)
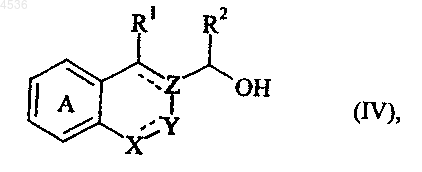
где A, X, Y, Z, R1, R2 и символ ---- определены как указано выше, которое подвергают воздействию галогенирующего агента, получая соединение формулы (V)
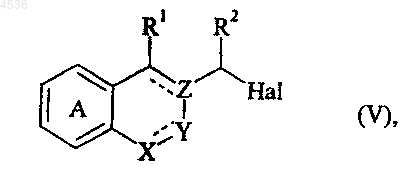
где A, X, Y, Z, R1, R2 и символ ----определены как указано выше, и Hal представляет атом галогена, которое конденсируют с соединением формулы (VI)
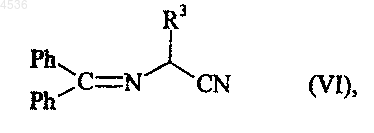
где R3 определен как указано выше, получая соединение формулы (VII)
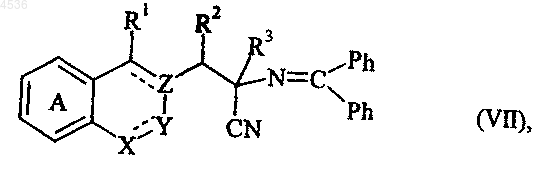
где A, X, Y, Z, R1, R2, R3 и символ ---- определены как указано выше, которое подвергают кислотному гидролизу, получая соединение формулы (III/a), частный случай соединений формулы (III)
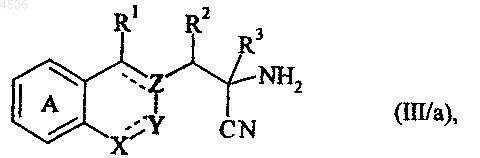
где A, X, Y, Z, R1, R2, R3 и символ ---- определены как указано выше, и указанное соединение формулы (III) подвергают действию восстановителя, такого как LiAlH4, AlH3, или каталитическому гидрированию, например, с получением соединения формулы (VIII)
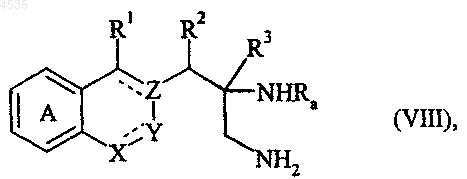
где A, X, Y, Z, R1, R2, R3, Ra и символ ---- определены как указано выше, у которого в случае, когда Ra не является атомом водорода, снимают защитную группу в кислотной или в восстановительной среде, например, с получением соединения формулы (IX)
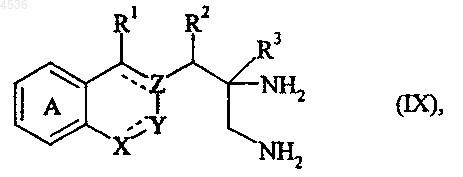
где A, X, Y, Z, R1, R2, R3 и символ ---- определены как указано выше, которое подвергают взаимодействию с формамидинацетатом или с метилортоформиатом, получая соединение формулы (I/a), частный случай соединений формулы (I)
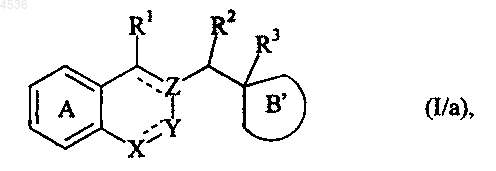
где A, X, Y, Z, R1, R2, R3 и символ ---- определены как указано выше и B' представляет кольцо незамещенного имидазолина, как представлено формулой (Ia/a) или (Ib/a)

которое можно подвергнуть в присутствии основной системы воздействию соединения формулы (X)
R5a - J (X),
где R5a представляет неразветвленную или разветвленную (C1-C6)алкильную группу или бензильную группу, а J представляет уходящую группу, такую как атом галогена или тозильная группа, с получением соединения формулы (I/b), частного случая соединений формулы (I)
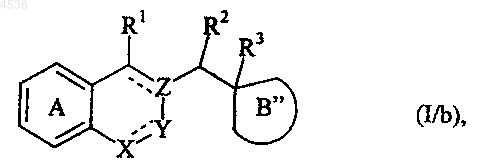
где A, X, Y, Z, R1, R2, R3 и символ ---- определены как указано выше, а B" представляет кольцо замещенного имидазолина, как представлено формулой (Ia/b) или (Ib/b)
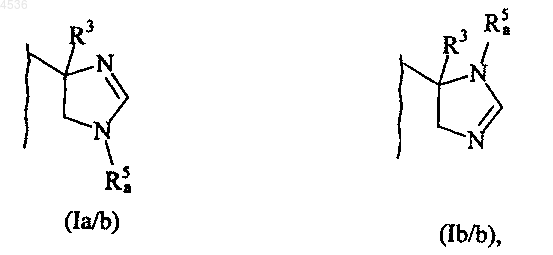
где R5a определено как указано выше, причем соединения (I/a) и (I/b) составляют в совокупности соединений формулы (I) и могут быть очищены по общепринятой методике разделения, и, если нужно, их превращают в аддитивные соли с фармацевтически приемлемой кислотой или основанием и разделяют, где это целесообразно, на их изомеры по общепринятой методике разделения.
23. Способ получения соединений формулы (I/a) по п.22, характеризующийся тем, что в качестве исходного вещества используют соединение формула (II')
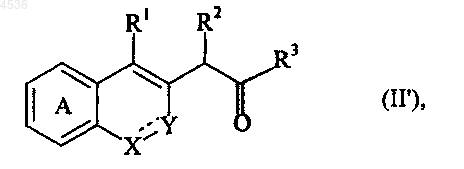
где A, X, Y, R1, R2, R3 и символ ---- определены как указано выше, которое конденсируют с хиральным соединением класса аминов формулы (XI)
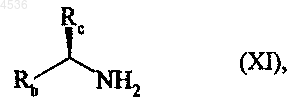
где Rb и Rc, которые являются различными, представляют алкильную или арильную группу,
с получением соединения формулы (XII)
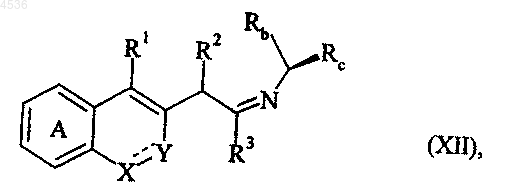
где A, X, Y, R1, R2, R3, Rb, Rc и символ ---- определены как указано выше, которое подвергают действию N-1-изоцианоциклогексена и бензойной кислоты, получая соединение формулы (XIII)
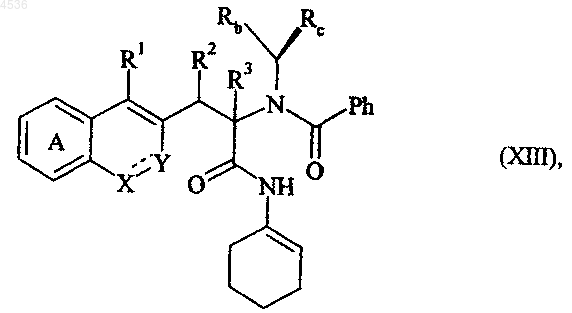
где A, X, Y, R1, R2, R3, Rb, Rc и символ ---- определены как указано выше, полученное соединение формулы (XIII) хроматографируют на диоксиде кремния, получая диастереоизомеры формул (XIIIa) и (XIIIb)
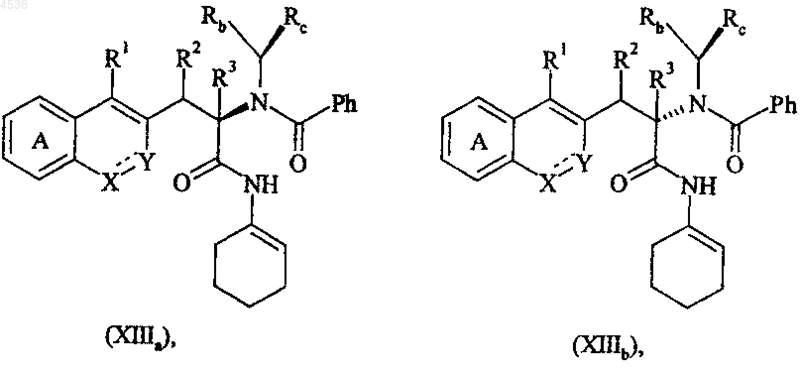
где A, X, Y, R1, R2, R3, Rb, Rc и символ ---- определены как указано выше, соединение формулы (XIIIa) подвергают воздействию H3O+ с получением соединения формулы (XIVa):
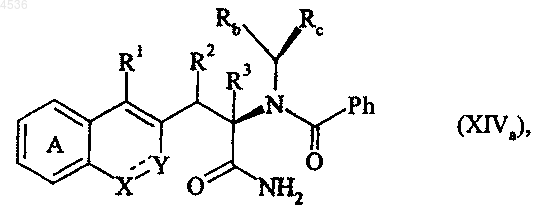
где A, X, Y, R1, R2, R3, Rb, Rc и символ ---- определены как указано выше, которое подвергают каталитическому гидрированию, получая соединение формулы (XVa)
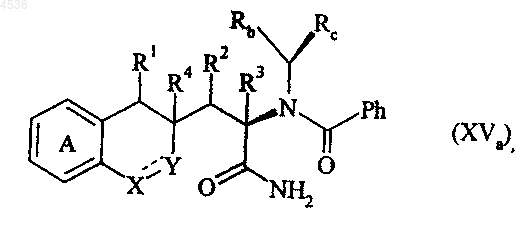
где A, X, Y, R1, R2, R3, R4, Rb, Rc и символ ---- определены как указано выше, полученное соединение формулы (XVa) хроматографируют на диоксиде кремния, получая диастереоизомеры формул (XVa') и (XVa")
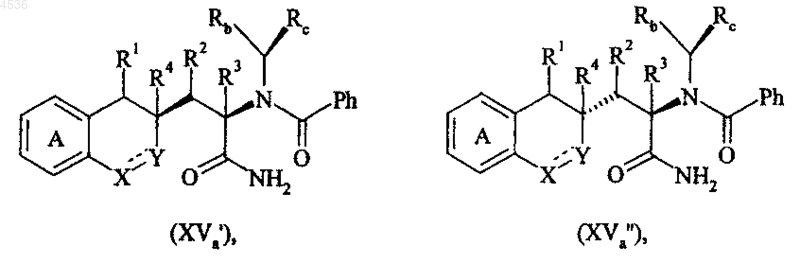
где A, X, Y, R1, R2, R3, R4, Rb, Rc и символ ---- определены как указано выше, и соединение формулы (XVa') последовательно подвергают воздействию восстановителя, такого как BH3, а затем гидрогенолизу, получая соединение формулы (XVIa')
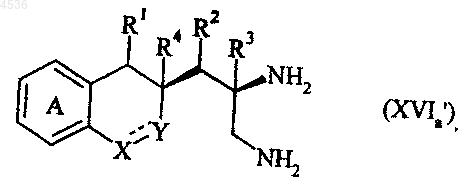
где A, X, Y, R1, R2, R3, R4 и символ ---- определены как указано выше, которое подвергают реакции с формамидинацетатом или метилортоформиатом, получая соединение формулы (XVIIa'), частный случай соединений формулы (I/a)
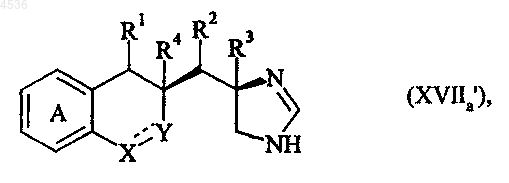
где A, X, Y, R1, R2, R3, R4 и символ ---- определены как указано выше, причем, используя такую же последовательность реакций можно получить соединение формулы (XVIIa"), частный случай соединений формулы (I/a), получаемое, исходя из диастереоизомера (XVa")
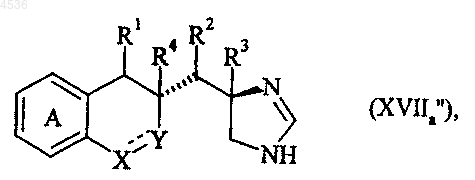
где A, X, Y, R1, R2, R3, R4 и символ ---- определены как указано выше, соединение формулы (XVIIb'), частный случай соединений формулы (I/a), получаемое, исходя из диастереоизомера (XIIIb)
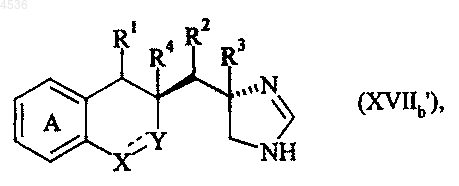
где A, X, Y, R1, R2, R3, R4 и символ ---- определены как указано выше, соединение формулы (XVIIb"), частный случай соединений формулы (I/a), полученное, исходя из диастереоизомера (XIIIb)

где A, X, Y, R1, R2, R3, R4 и символ ---- определены как указано выше, или соединение формулы (XIVa) последовательно подвергают воздействию восстановителя, такого как BH3, и затем гидрогенолизу, получая соединение формулы (XVIIIa)
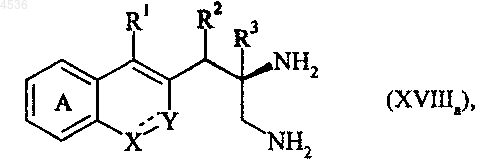
где A, X, Y, R1, R2, R3 и символ ---- определены как указано выше, которое подвергают взаимодействию с формамидинацетатом или метилортоформиатом, получая соединение формулы (XIXa), частный случай соединений формулы (I/a)
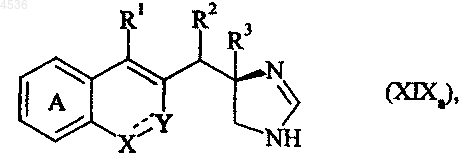
где A, X, Y, R1, R2, R3 и символ ---- определены как указано выше, причем, используя такую же последовательность реакций, можно получить соединение формулы (XIXb), частный случай соединений формулы (I/a), полученное, исходя из соответствующего соединения (XIVb)
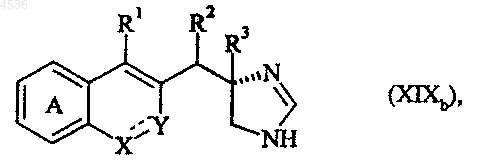
где A, X, Y, R1, R2, R3 и символ ---- определены как указано выше, и указанные соединения формул (XVIIa'), (XVIIa"), (XVIIb'), (XVIIb"), (XIXa) и (XIXb) могут быть очищены по общепринятой методике разделения и превращены, если нужно, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием.
24. Фармацевтическая композиция, содержащая в качестве активного ингредиента по меньшей мере одно соединение формулы (I) по любому из пп.1-21 или его аддитивную соль с фармацевтически приемлемой кислотой или основанием в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями.
25. Фармацевтическая композиция по п.24 для использования при изготовлении лекарственного средства для лечения депрессии, ожирения, панических атак, тревожных состояний, обсессивно-компульсивных растройств, расстройств познавательной способности, фобий, импульсивных нарушений, связанных со злоупотреблением лекарственными средствами и синдромом их отмены, половых дисфункций и болезни Паркинсона.
Текст
1 Данное изобретение относится к новым соединениям ряда имидазолина, способу их получения и содержащим их фармацевтическим композициям, а также к их применению в качестве 2-адренергических антагонистов и блокаторов повторного поглощения моноамина (серотонина и/или норадреналина). Адренергическая нервная система играет важную роль на уровне различных систем организма, например, артериальной, венозной, сердечной и почечной систем на уровне центральной и периферической вегетативных нервных систем. Соединения, способные взаимодействовать с адренергическими рецепторами, могут,таким образом, индуцировать большое число физиологических реакций, таких как сужение кровеносных сосудов, расширение кровеносных сосудов, возрастание или снижение сердечного ритма, изменение силы сокращения сердечной мышцы и изменение в метаболической активности. Ранее для модификации этих и других физиологических реакций уже нашли применение различные адренергические соединения. В дополнение к тому, что соединения, списанные в данном изобретении являются новыми,они имеют профиль 2-адренергических антагонистов и блокаторов повторного поглощения моноамина, что позволяет использовать их при лечении депрессии (Drug News and Perspective, 4(4), 1991). Основная проблема, возникающая при использовании антидепрессантов, состоит в том, что требуется продолжительное время для того, чтобы проявилось их воздействие, что связано с их особым способом действия. Исследования показали, что объединение 2 адренергического антагониста с ингибитором повторного поглощения моноамина делает возможным сокращение этого периода времени(Commun. Psychopharmacol, 4, pp. 95-100, 1980). Комбинация этих двух эффектов в одном соединении могла бы создать новую генерацию значительно более эффективных антидепрессантов. Среди таких соединений напамезол(США, 5017584) описывается в качестве соединения, обладающего как активностью 2 адренергического рецептора, так и активностью блокатора повторного поглощения моноамина. Соединения данного изобретения, которые имеют новые структуры, имеют профиль селективного 2-адренергического антагониста и обладают способностью ингибировать повторное поглощение моноамина, которая в неожиданной степени превосходит такую способность напамезола. Более конкретно, настоящее изобретение относится к соединениям формулы (I) 2 где А представляет кольцо бензола, незамещенное или замещенное 1-4 одинаковыми или разными группами,выбранными из неразветвленного или разветвленного (C1-С 6) алкила, неразветвленного или разветвленного (C1 С 6)алкокси, гидрокси, полигалоген(C1-С 6)алкила, у которого алкильная часть не разветвлена или разветвлена, циано, нитро, амино, алкиламино, диалкиламино, тиоалкила, сульфонилалкила, сульфинилалкила, карбокси, алкоксикарбонила, алкилкарбонилокси, формила, карбамоила, карбоксамида, фенила, бензила и атомов галогена; В представляет кольцо имидазолина, представленное формулой (Iа) или (Ib)R , которые могут быть одинаковыми или разными, представляет атом водорода или неразветвленную либо разветвленную (C1-С 6)алкильную группу),том азота или группу NR8 (где R8 представляет атом водорода, или неразветвленную либо разветвленную (C1-С 6)алкильную группу или бензильную группу),атом кислорода,атом серы или группу SO или SO2,Y представляет группу СН или СН 2, или простую связь (в этом случае кольцо, содержащее X, Y и Z, представлено формулой (Iс)Z представляет атом углерода или группуCR4, где R4 представляет атом водорода или неразветвленную либо разветвленную (C1-С 6) алкильную группу,R1, R2, R3, которые могут быть одинаковыми или различными, представляют собой, каждый, атом водорода или неразветвленную либо разветвленную (C1-С 6)алкильную группу, причем группы (R2 и R4) или (R1 и R4) могут образовать циклопропановую группу,R5 представляет атом водорода, или неразветвленную либо разветвленную (C1-C6) алкильную группу, или бензильную группу,символозначает, что эти связи могут быть простыми или двойными, причем подразумевается соответствующая валентность атомов,где подразумевается, что алкил означает неразветвленную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода,их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фарма 3 цевтически приемлемой кислотой или основанием. Среди фармацевтически приемлемых кислот здесь могут быть упомянуты, не имея при этом в виду какого-либо ограничения, хлористоводородная (соляная) кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, уксусная кислота, трифторуксусная кислота, молочная кислота, пировиноградная кислота, малоновая кислота, янтарная кислота,глутаровая кислота, фумаровая кислота, винная кислота, малеиновая кислота, лимонная кислота,аскорбиновая кислота, метансульфоновая кислота, камфорная кислота и так далее. Среди фармацевтически приемлемых оснований здесь могут быть упомянуты, не имея в виду какого-либо ограничения, гидроксид натрия, гидроксид калия, триэтиламин, третбутиламин и так далее. Предпочтительными соединениями этого изобретения являются соединения формулы (I),где R5 представляет атом водорода. Предпочтительными кольцами В являются кольца, представленные формулой (Iа). Изобретение, преимущественно, относится к соединениям формулы (I), где R1 и R2, каждый одновременно, представляют атом водорода, R3 представляет атом водорода или метильную группу, Z представляет атом углерода или группу СН или С-СН 3 или (R1 и R4) либо (R2 и R4) представляют циклопропановую группу. Предпочтительные циклические системы представляют 3,4-дигидронафталин, 1,2,3,4 тетрагидронафталин, индан, инден или бензофуран. Более конкретно, данное изобретение относится к соединениям ряда 3,4-дигидронафталина, 1,2,3,4-тетрагидронафталина, индана, индена или бензофурана, незамещенным или замещенным одним или несколькими одинаковыми или разными заместителями, выбранными из атомов галогена и групп метил, метокси иCF3. Еще более предпочтительно, изобретение относится к соединениям формулы (I), которые представляют собой 4-(3,4-дигидро-2-нафтилметил)-4,5-дигидро-1 Н-имидазол,4-[(8-хлор-3,4-дигидро-2-нафтил)метил]4,5-дигидро-1 Н-имидазол,4-(бензо[b]фуран-2-илметил)-4,5-дигидро 1 Н-имидазол,4-спиро[циклопропан-2:2'-(1',2',3',4'-тетрагидронафт)]-1-ил-4,5-дигидро-1 Н-имидазол 4 4-[1,2,3,4-тетрагидро-2-нафтилметил]-4,5 дигидро-1 Н-имидазол (изомер 2),4-[1,2,3,4-тетрагидро-2-нафтилметил]-4,5 дигидро-1 Н-имидазол (изомер 3),4-[1,2,3,4-тетрагидро-2-нафтилметил]-4,5 дигидро-1 Н-имидазол(изомер 4),4-(1,3-дигидро-1 Н-2-инденилметил)-4,5 дигидро-1 Н-имидазол,4-[(5-фтор-2,3-дигидро-1 Н-инден-2-ил)метил]-4,5-дигидро-1 Н-имидазол,4-[(5,6-дифтор-2,3-дигидро-1 Н-инден-2 ил)метил]-4,5-дигидро-1 Н-имидазол,4-[(7-фтор-3,4-дигидро-2-нафтил)метил]4,5-дигидро-1 Н-имидазол,4-[(8-метокси-3,4-дигидро-2-нафтил)метил]-4,5-дигидро-1 Н-имидазол,4-[(3,4-дигидро-4,4-диметил-2-нафтил) метил]-4,5-дигидро-1 Н-имидазол,4-[(8-хлор-2-нафтил)метил]-4,5-дигидро 1 Н-имидазол,4-спиро[циклопропан-2':2-(5,6-дифториндан)]-1'-ил-4,5-дигидро-1 Н-имидазол (диастереоизомер 1),4-спиро[циклопропан-2';2-(5,6-дифториндан)]-1'-ил-4,5-дигидро-1 Н-имидазол (диастереоизомер 2). Таутомеры, энантиомеры и диастереоизомеры и аддитивные соли с фармацевтически приемлемой кислотой или основанием предпочтительных соединений этого изобретения образуют неотъемлемую часть изобретения. Данное изобретение относится также к способу получения соединений формулы (I),характеризующемуся тем, что в нем в качестве исходного материала используют соединение формулы (II) где А, X, Y, Z, R1, R2 , R3 и символопределены как указано ранее, которое подвергают либо воздействию условий реакции Стрекера(KCN, NH4 Сl), либо воздействию амина RaNH2(где Ra представляет атом водорода или затрудненную защитную группу, позволяющую получить, где это применимо, лучшее разделение образованных диастереоизомеров) и триметилсилилцианида с получением соединения формулы (III): где А, X, Y, Z, R1, R2, R3, R4 и символ определены как указано ранее, причем соединение формулы (III), где Ra представляет атом водорода, может быть альтернативно получено,исходя из соединения формулы (IV) где А, X, Y, Z, R1 , R2 и символопределены как указано ранее, которое подвергают воздействию галогенирующего агента, получая соединение формулы (V) где А, X, Y, Z, R , R и символопределены как указано ранее, и Hal представляет атом галогена, которое конденсируют с соединением формулы (VI) где R3 определен как указано ранее, получая соединение формулы (VII) где А, X, Y, Z, R , R , R и символопределены как указано ранее, которое подвергают кислотному гидролизу, получая соединение формулы (III/а), частный случай соединений формулы (III), где А, X, Y, Z, R1, R2, R3 и символопределены как указано ранее, и указанное соединение формулы (III) подвергают действию восстановителя, такого как LiAlH4, АlН 3, или каталитическому гидрированию, например, с получением соединения формулы (VIII) где А, X, Y, Z, R1, R2, R3, Ra и символопределены как указано ранее, у которого в случае,когда Ra не является атомом водорода, снимают защитную группу в кислотной или в восстановительной среде, например, с получением соединения формулы (IX) где А, X, Y, Z, R , R , R и символопределены как указано ранее, которое подвергают взаимодействию с формамидинацетатом или с метилортоформиатом, получая соединение формулы(I/а), частный случай соединений формулы (I) где А, X, Y, Z, R1, R2, R3 и символопределены как указано ранее, и В' представляет кольцо незамещенного имидазолина, как представлено формулой (Iа/а) или (Ib/a) которое можно подвергнуть в присутствии основной системы воздействию соединения формулы (X) где R5 а представляет неразветвленную или разветвленную (C1-С 6)алкильную группу или бензильную группу и J представляет уходящую группу, такую как атом галогена или тозильная группа, с получением соединения формулы(I/b), частного случая соединений формулы (I) где А, X, Y, Z, R1, R2, R3 и символопределены как указано ранее, и В представляет кольцо замещенного имидазолина, как представлено формулой (Ia/b) или (Ib/b) где R5a определено как указано ранее, причем соединения (I/a) и (I/b) составляют в совокупности соединения формулы (I) и могут быть очищены по общепринятой методике разделения, и,если нужно, их превращают в аддитивные соли с фармацевтически приемлемой кислотой или основанием и разделяют, где это целесообразно,на их изомеры по общепринятой методике разделения. Данное изобретение относится также к способу получения соединений формулы (I/a),характеризующемуся тем, что в качестве исходного материала используют соединение формулы (II') где А, X, Y, R1, R2 , R3 и символопределены как указано ранее, которое конденсируют с хиральным соединением класса аминов формулы где Rb и Rc, которые являются различными,представляют алкильную или арильную группу,с получением соединения формулы (XII) 7 где А, X, Y, R1, R2, R3, Rb, Rc и символопределены как указано ранее, которое подвергают действию N-1-изоцианоциклогексена и бензойной кислоты, получая соединение формулы где А, X, Y, R , R , R , Rb, Rc и символопределены как указано ранее, и соединение формулы (XIII) хроматографируют на диоксиде кремния, получая диастереоизомеры формул (ХIIIа) и где А, X, Y, R1, R2, R3, Rbf Rc и символопределены как указано ранее, и соединение формулы (ХIIIа) подвергают воздействию Н 3O+ с получением соединения формулы (XIVa) где А, X, Y, R1, R2, R3, Rb, Rc и символопределены как указано ранее, которое подвергают каталитическому гидрированию, получая соединение формулы (XVa) где А, X, Y, R1, R2, R3, R4, Rb, Rc и символ определены как указано ранее, и соединение формулы (XVa) хроматографируют на диоксиде кремния, получая диастереоизомеры формул где А, X, Y, R1 , R2, R3, R4, Rb, Rc и символ определены как указано ранее, и соединение формулы (XVa') последовательно подвергают воздействию восстановителя, такого как ВН 3, а затем гидрогенолизу, получая соединение формулы (XVIa') 8 где А, X, Y, R1, R2, R3, R4 и символопределены как указано ранее, которое подвергают реакции с формамидинацетатом или метилортоформиатом, получая соединение формулы(XVIIa'), частный случай соединений формулы где А, X, Y, R1 , R2, R3, R4 и символопределены как указано ранее, причем, с использованием такой же последовательности реакций можно получить: соединение формулы (XVIIa),частный случай соединений формулы (I/а), полученное, исходя из диастереоизомера (XVa) где А, X, Y, R1, R2, R3, R4 и символопределены как указано ранее, соединение формулы(XVIIb'), частный случай соединений формулы где А, X, Y, R1, R2, R3, R4 и символопределены как указано ранее, соединение формулы(XVIIb), частный случай соединений формулы где А, X, Y, R1, R2/ R3, R4 и символопределены как указано ранее, или соединение формулы (XIVa) последовательно подвергают воздействию восстановителя, такого как ВН 3, и затем гидрогенолизу, получая соединение формулы где А, X, Y, R1, R2, R3 и символопределены как указано ранее, которое подвергают взаимодействию с формамидинацетатом или метилортоформиатом, получая соединение формулы(ХIХа), частный случай соединений формулы где А, X, Y, R1, R2, R3 и символопределены как указано ранее, причем с использованием такой же последовательности реакций можно получить соединение формулы (ХIХb) , частный 9 случай соединений формулы (I/а), полученное,исходя из соответствующего соединения (XIVb) где А, X, Y, R1, R2, R3 и символопределены как указано ранее, при этом соединения формул(ХIХb) можно очистить по общепринятой методике разделения и превратить, если это желательно, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. Соединения формул (II) и (II') получают,например, исходя из соединения формулы (XX) 10 где А, X, Y и символопределены как указано ранее, которое конденсируют в основной среде с диэтилхлорфосфатом, с получением соединения формулы (XXVI) где А, X, Y и символопределены как указано ранее, которое конденсируют с соединением формулы (XXVII) с получением соединения формулы (XXVIII) где А, X, Y, R и символопределены как указано ранее, которое подвергают реакции Виттига-Хорнера с необязательным последующим восстановлением, получая соединение формулы где А, X, Y и символопределены как указано ранее, которое подергают воздействию восстановительной системы, получая соединение формулы (XXIX) где А, X, Y, Z, R1, R2 и символопределены как указано ранее, которое подвергают восстановлению, получая соединение формулы (XXII),частный случай соединений формулы (II) где А, X, Y и символопределены как указано ранее, которое можно гидролизовать в условиях реакции или выделить и гидролизовать в последующей стадии с получением соединения формулы (XXX) где А, X, Y, Z, R1, R2 и символопределены как указано ранее, или которое подвергают реакции Виттига с необязательным последующим восстановлением, получая соединение формулы(XXIII), частный случай соединений формулы где А, X, Y и символопределены как указано ранее, или соединение формулы (XXV) подвергают воздействию этил-2-[(диэтоксифосфорил)окси]акрилата в основной среде с получением соединения формулы (XXXI) где А, X, Y, Z, R1, R2 и символопределены как указано ранее, a R'3 представляет неразветвленную или разветвленную(C1-С 6)алкильную группу, или исходя из соединения формулы (XXIV) где А, X, Y и символопределены как указано ранее, которое циклизуют (после превращения в соответствующий хлорангидрид кислоты) в присутствии АlСl3, получая соединение формулы (XXV) где А, X, Y и символопределены как указано ранее, которое выдерживают в присутствии восстановителя, такого как NaBH3CN, и кислоты Льюиса, такой как иодид цинка, с получением соединения формулы (XXXII) где А, X, Y и символопределены как указано ранее, которое подвергают воздействию восстановителя, такого как LiAlH4, с получением соединения формулы (XXVIII), которое окисляют, получая соединение формулы (XXXIII),частный случай соединений формулы (II) 11 где А, X, Y и символопределены как указано ранее. Было показано, что соединения изобретения и содержащие их фармацевтические композиции применимы для лечения депрессии. Фактически, соединения данного изобретения являются специфическими 2-адренергическими антагонистами и действуют также в качестве сильнодействующих ингибиторов повторного поглощения саротонина и норадреналина. Как таковые, они могут находить терапевтическое применение при лечении депрессии,ожирения, панической атаки, тревожных состояний,обсессивно-компульсивных расстройств, расстройств познавательной способности, фобий, импульсивных нарушений, связанных со злоупотреблением лекарственными средствами и синдромом отмены их, половых дисфункций и болезни Паркинсона. Данное изобретение относится также к фармацевтическим композициям, содержащим по меньшей мере одно соединение формулы (I) само по себе или по меньшей мере одно такое соединение в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями. Среди фармацевтических композиций согласно данному изобретению здесь могут быть упомянуты особенно те композиции, которые подходят для перорального, парентерального,назального, под- или чрескожного, ректального,перлингвального введения, введения через глаза или через дыхательные пути, и, особенно, таблетки или драже, сублингвальные таблетки, саше, пакеты, желатиновые капсулы, глоссеты,лепешки, суппозитории, кремы, мази, кожные гели и годные для питья и инъекций композиции в ампулах . Используемые дозы варьируются в соответствии с полом, возрастом и массой пациента,путем введения, природой терапевтического показания и любых сопутствующих лечений и составляют от 1 до 1000 мг на 24 ч при одном или нескольких введениях. Следующие примеры иллюстрируют данное изобретение, но никоим образом не ограничивают его. По номенклатуре, принятой для следующих примеров, кольцо имидазолина замещено в 4-положении, но примеры включают также таутомеры, замещенные в 5-положении. Так, например, соединение примера 1 (фумарат 4-(3,4 дигидро-2-нафтилметил)-4,5-дигидро-1 Нимидазола) может также быть названо фумаратом 5-(3,4-дигидро-2-нафтилметил)-4,5-дигидро-1 Н-имидазола. Пример 1. Фумарат 4-(3,4-дигидро-2 нафтилметил)-4,5-дигидро-1 Н-имидазола. Стадия 1. Этил-2-(3,4-дигидронафт-2-ил) ацетат. 12 Раствор 56 г (0,25 моль) триэтилфосфоноацетата в 70 мл тетрагидрофурана (ТГФ) добавляют по каплям к суспензии 6 г (0,25 моль) NaH в 600 мл безводного ТГФ, температуру которой поддерживают равной 0 С, в атмосфере азота. Смесь затем перемешивают при 10 С в течение 30 мин, охлаждают до 0 С и затем обрабатывают раствором 36,52 г (0,25 моль) -тетралона в 50 мл безводного ТГФ, добавляя его по каплям. После перемешивания в течение 3 ч при 20 С смесь гидролизуют при 0 С 200 мл воды. Растворитель испаряют при пониженном давлении и остаток экстрагируют дихлорметаном(CH2Cl2) (3 х 200 мл). Объединенные органические фазы промывают насыщенным растворомNaCl, сушат и концентрируют, получая маслянистый коричневый остаток. Перегонка под пониженным давлением позволяет получить указанное в заголовке соединение в форме бесцветной жидкости. Точка кипения (0,03 мм Нg) 88-91 С. Элементный микроанализ:(0,086 моль) полученного в стадии 1 сложного эфира в 360 мл СН 2 Сl2 обрабатывают молярным раствором гидрида диизобутилалюминия в СН 2 Сl2 (170 мл), добавляя его по каплям. После перемешивания в течение 2 ч при -60 С смесь гидролизуют при этой температуре последовательным добавлением 10% NH4Cl (35 мл) и 1 н. НСl (42 мл). Температуру смеси повышают до 20 С в течение 1 ч и образованный осадок затем отсасывают и промывают CH2Cl2. Фильтрат промывают водой, затем насыщенным раствором NaCl, сушат и выпаривают. Полученный маслянистый остаток хроматографируют на диоксиде кремния,элюируя смесью циклогексан/EtOAc, 95/5. Предполагаемое соединение выделяют в форме бесцветного масла и в таком виде используют для последующей реакции. Стадия 3. 2-Амино-3-(3,4-дигидронафт-2 ил)пропионитрил. К раствору 3,44 г (20 ммоль) полученного в стадии 2 альдегида в 100 мл CH2Cl2 последовательно добавляют при 20 С 0,25 г ZnI2, а затем медленно 2,18 г (22 ммоль) триметилсилилцианида. После перемешивания в течение 20 ч при 20 С смесь концентрируют в вакууме. Полученный остаток обрабатывают 200 мл раствора NH3 в СН 3 ОН (7 н.); смесь перемешивают в течение 4 ч в закрытом резервуаре и затем концентрируют в вакууме. Остаток переносят в 1 н. НСl и суспензию промывают 50 мл Et2O; водную фазу подщелачивают 6 н. NaOH и экстрагируют СН 2 Сl2 (3 х 50 мл). Объединенные органические фазы промывают насыщенным раство 13 ром NаСl, сушат и концентрируют, получая ожидаемое соединение в форме масла, которое непосредственно используют для следующей реакции. Стадия 4. 3-(3,4-Дигидро-2-нафтил)пропан-1,2-диамин. Смесь, состоящую из 2,57 г (13 ммоль) нитрила, полученного в стадии 3, 120 мл СН 3 ОН, 2 г никеля Ренея и 50 мл раствора NH3 в СН 3 ОН (7 н.), гидрируют под давлением в одну атмосферу в течение 16 ч. После фильтрования через целит раствор концентрируют и остаток хроматографируют на диоксиде кремния при элюировании смесью CH2Cl2/CH3OH/NH4OH конц. = 90/10/1, получая ожидаемое соединение в форме бесцветного масла. Элементный микроанализ:(2,75 ммоль) формамидинацетата в 20 мл EtOH перемешивают при 20 С в течение 16 ч. После испарения растворителя остаток поглощают 10 мл CH2Cl2; смесь обрабатывают 5 мл 2 н. NaOH и экстрагируют СН 2 Сl2 г (3 х 20 мл). Объединенные органические фазы сушат и концентрируют; остаточное масло растворяют в 10 млEtOH и смесь обрабатывают раствором 0,2 9 г(2,5 ммоль) фумаровой кислоты в 5 мл EtOH. Указанное в заголовке соединение выделяют после перекристаллизации. Точка плавления 165-166 С. Элементный микроанализ:%N Теоретический 65,84 6,14 8,53 Найдено 66,01 6,13 8,41 Соединения примеров 2 и 3 получают после разделения соединения, полученного в стадии 4 примера 1, при помощи (+)-дибензоил-Dвинной кислоты или (-)-дибензоил-L-винной кислоты посредством последовательных перекристаллизации из МеОН и затем нейтрализацией соли 1 н. NaOH и экстракцией CH2Cl2, а затем обработкой, как в стадии 5 примера 1. Пример 2. Фумарат (4R)-4-(3,4-дигидро-2 нафтилметил)-4,5-дигидро-1 Н-имидазола. Стадия 1. (2R)-3-(Дигидро-2-нафтил)пропан-1,2-диамин. Стадия 2. Фумарат (4R)-4-(3,4-дигидро-2 нафтилметил)-4,5 -дигидро-1 Н-имидазола. Точка плавления 164-165 оС. Элементный микроанализ:%N Теоретический 61,81 5,49 8,48 Найдено 61,57 5,60 8,50 Пример 14. Фумарат 4-(3,4-дигидро-2 нафтилметил)-4-метил-4,5-дигидро-1 Н-имидазола. Стадия 1. 2-Амино-2-метил-3-(3,4-дигидронафт-2-ил)пропионитрил. К раствору 6,50 г (35 ммоль) 1-(3,4 дигидронафт-2-ил)пропан-2-она в смеси 41 мл СН 3 ОН и 20 мл воды последовательно добавляют, каждое вещество в один прием, 2,34 г(3 х 40 мл). Объединенные водные фазы подщелачивают 6 н. NaOH и затем экстрагируютCH2Cl2 (3 х 50 мл). После cушки и концентрирования органических фаз указанное в заголовке соединение получают в форме желтого масла,которое используют непосредственно для следующей реакции. Стадия 2. 3-(3,4-Дигидронафт-2-ил)-2 метилпропан-1,2-диамин. Раствор 5 г (23,6 ммоль) полученного в предыдущей стадии соединения в 20 мл безводного ТГФ добавляют по каплям к суспензии 1,90 г (50 ммоль) LiAlH4 в 50 мл безводного ТГФ, поддерживая температуру ниже 10 С. После перемешивания в течение 1 ч при 20 С смесь охлаждают до 0 С и гидролизуют последовательным добавлением 11 мл изопропанола и 11 мл насыщенного раствора NaCl. Образованный осадок отсасывают и ополаскивают ТГФ; фильтрат концентрируют в вакууме и остаток поглощают 1 н. НСl (50 мл) и затем промывают эфиром (10 мл). Водную фазу подщелачивают при помощи 6 н. NaOH и экстрагируютCH2Cl2 (3 х 50 мл). Органические фазы сушат и концентрируют и полученный остаток хроматографируют на диоксиде кремния с использованием смеси CH2Cl2/CH3OH/NH4OH конц.= 90/10/1, в качестве элюента. Указанное в заголовке соединение выделяют в форме масла. Стадия 3. Фумарат 4-(3,4-дигидро-2-нафтилметил)-4-метил-4,5-дигидро-1 Н-имидазола. Методика такая же, как в стадии 5 примера 1, исходя из соединения, полученного в стадии 2. Точка плавления 146-148 С. Элементный микроанализ:Pd/C в 250 мл EtOH гидрируют под давлением 1 бар (100 кПа) при 20 С в продолжении ночи. После отделения катализатора фильтрованием и промывания этанолом фильтрат концентрируют в вакууме, получая ожидаемое соединение в форме бесцветного масла. Точка кипения (0,02 мм Нg) 90-94 С. Элементный микроанализ:(8,50 ммоль) тритилхлорида последовательно добавляют при 20 С к раствору полученного в примере 16 (стадия 4) соединения в форме свободного амина (1,80 г, 8,40 ммоль) в 50 мл бен 004536 20 зола, в атмосфере азота. После перемешивания в течение 15 ч при 20 С смесь промывают Н 2 О и органическую фазу сушат и концентрируют в вакууме, получая маслянистый остаток. Хроматография на хиральной колонке, разделяющей хиральные изомеры, при элюировании раствором триэтиламина в толуоле (0,5%) дает 4 изомера, которые выделяют в форме белых твердых продуктов. Стадия 2. Фумарат 4-[1,2,3,4-тетрагидро-2 нафтилметил]-4,5-дигидро-1 Н-имидазола (изомер 1). Раствор одного из изомеров, полученных в стадии 1 (550 мг, 1,2 ммоль) в смеси АсОН/Н 2 О,90/1, нагревают при кипячении с обратным холодильником в течение 2 ч 30 мин. После охлаждения смесь концентрируют в вакууме; остаток поглощают CH2Cl2 (10 мл) и обрабатывают 1 н. раствором NaOH. Органическую фазу промывают насыщенным раствором NaCl, сушат и выпаривают, получая маслянистый остаток, который хроматографируют на диоксиде кремния,элюируя смесью CH2Cl2/CH3OH/NH4OH, 90/10. Полученное масло (170 мг, 0,8 ммоль) растворяют в EtOH и обрабатывают 93 мг (0,8 ммоль) фумаровой кислоты, растворенной в 5 мл EtOH. После концентрирования раствора и перекристаллизации из изо-PrOH указанное в заголовке соединение получают в форме бесцветных призматических кристаллов. Точка плавления 155-156 С. Элементный микроанализ:%N Теоретический 65,44 6,71 8,48 Найдено 65,24 6,92 8,53 Соединения примеров с 18 по 20 получали по той же методике, что в стадии 2 примера 17,исходя из других изомеров. Пример 18. Фумарат 4-[1,2,3,4-тетрагидро 2-нафтилметил]-4,5-дигидро-1 Н-имидазола%N Теоретический 69,75 7,04 10,85 Найдено 69,79 6,69 10,73 Пример 23. Фумарат 4-(бензо[b]фуран-2 илметил)-4,5-дигидро-1 Н-имидазола. Стадия 1. 2-(Бромметил)бензо[b]фуран. 36,40 г (139 ммоль) трифенилфосфина добавляют в один прием при энергичном перемешивании к охлажденному до 0 С раствору 10,40 г (70 ммоль) 2-гидроксиметилбензо[b]фурана и 46 г (139 ммоль) СВr4 в 220 мл эфира. После перемешивания в течение 4 ч при 20 С образованный осадок отсасывают и промывают Et2O; фильтрат сушат и концентрируют, и остаток затем хроматографируют на диоксиде кремния при элюировании смесью циклогексан/ СН 2 Сl2,80/20, получая ожидаемое соединение в форме масла. Элементный микроанализ:%Вr Теоретический 51,22 3,34 37,86 Найдено 50,98 3,25 38,02 Стадия 2. 2-Амино-3-бензо[b]фуран-2 илпропаннитрил. 4,40 г (22 ммоль) соединения,полученного в стадии 1, добавляют по каплям и,атмосфере азота к охлажденному до 0 С раствору, содержащему 4 г (18 ммоль) N-(дифенилметилен)аминоацетонитрила и 0,53 г (1,6 ммоль) бромида тетрабутиламмония в смеси 55 мл толуола и 4,40 г 40% NaOH. После перемешивания в продолжение ночи при 20 С смесь разбавляют водой и экстрагируютCH2Cl2 (3 х 80 мл); объединенные органические фазы промывают Н 2 О, и затем насыщенным раствором NaCl и концентрируют в вакууме. Остаток поглощают 100 мл эфира и при энергичном перемешивании обрабатывают 100 мл 1 н. НС 1. Смесь перемешивают в течение 12 ч при 20 С и затем разделяют; водную фазу подщелачивают 6 н.NaOH и затем экстрагируют CH2Cl2 (3 х 50 мл) и органическую фазу промывают насыщенным раствором NaCl, сушат и концентрируют. Указанное в заголовке соединение получают в форме коричневого масла, которое используют для следующей реакции без очистки.%N Теоретический 60,76 5,10 8,86 Найдено 60,54 5,19 8,82 Соединения примеров 24 и 25 получают по той же методике, что в примере 23. Пример 24. Полуфумарат 4-[(5-хлор-2,3 дигидро-1 Н-2-инденил)метил]-4,5-дигидро-1 Нимидазола. Элементный микроанализ:%N Теоретический 66,25 5,56 8,58 Найдено 65, 97 5,65 8,44 Пример 26. Фумарат-4-[1 а,2,3,7b-тетрагидро-1 Н-циклопропа[а]нафт-1-илметил]-4,5 дигидро-1-Н-имидазола. Стадия 1. Этил-1-(1 а,2,3,7b-тетрагидро-1 Нциклопропа[а]нафт-1-ил)ацетат. 200 мл (20 ммоль) раствора диэтилцинка в гексане (1 М) и раствор 71 г (400 ммоль) хлориодметана в 125 мл 1,2-дихлорэтана добавляют,последовательно и по каплям, к охлажденному до -25 С раствору 7,20 г (33 ммоль) полученного в примере 1 (стадия 1) соединения в 75 мл 1,2-дихлорэтана. Температуру смеси повышают до 10 С и перемешивание поддерживают при этой температуре в течение 4 ч. После охлаждения до 0 С смесь обрабатывают 50 мл насыщенного NH4Cl и затем 100 мл воды и экстрагируют Et2O (3 х 200 мл) . Объединенные органические фазы промывают насыщенным раствором NaCl, сушат и концентрируют в вакууме,получая указанное в заголовке соединение в форме масла. Элементный микроанализ:%Н Теоретический 83,83 7,58 Найдено 83,72 7,63 Стадия 3. Фумарат-4-[1 а,2,3,7b-тетрагидро-1 Н-циклопропа[а]нафт-1-илметил]-4,5 дигидро-1 Н-имидазола. Методика такая же, как в стадиях 1,2 и 3 примера 14, исходя из альдегида, полученного в стадии 2. После реакции с формамидинацетатом соединение, полученное в примере 26, состоит из смеси диастереоизомеров (50/50), которую разделяют хроматографией на диоксиде кремния, элюируя смесью CH2Cl2/CH3OH/NH4OH,95/5/0,5. Каждый выделенный диастереоизомер превращают в соль общепринятым способом с использованием фумаровой кислоты и перекристаллизуют из смеси ацетон/изопропиловый спирт. Пример 27. Фумарат (4R)-4-[(laR,7bR)1a,2,3,7b-тетрагидро-1 Н-циклопропа[а]нафт-1 илметил]-4,5-дигидро-1 Н-имидазола и фумарат%N Теоретический 70,61 6,96 9,47 Найдено 70,74 7,01 9,47 Пример 29. Фумарат 4-спиро[циклопропан-2:2'-(1',2',3',4'-тетрагидронафт)]-1-ил-4,5 дигидро-1 Н-имидазола (изомер 1). Стадия 1. Диэтил-(1-оксо-1,2,3,4-тетрагидро-2-нафтил) фосфонат. Раствор -тетралона (10 г, 68 ммоль) в безводном ТГФ (120 мл) добавляют по каплям к 1 М раствору диизопропиламида лития (75 ммоль, 75 мл), перемешиваемому при -65 С в атмосфере азота. После перемешивания в течение 45 мин к образовавшемуся еноляту добавляют диэтилхлорфосфат (12,90 г, 75 ммоль) и температуру смеси постепенно повышают до 0C в течение 50 мин. После охлаждения до-70 С смесь переносят в 2 М раствор диизопропиламида лития (150 ммоль, 75 мл). Полученный раствор перемешивают в течение 2 ч при 10 С и затем обрабатывают уксусной кислотой(272 ммоль, 15,5 мл) в эфире (250 мл). Смесь фильтруют и фильтрат концентрируют. Указанное в заголовке соединение получают очисткой 24 на флэш-колонке (элюент: циклогексан/EtOAc,60/40). Стадия 2. 2'-(Тетрагидропиран-2-илоксиметил)спиро[1'-2]циклопропан-3,4-дигидро-1 оксонафталин. Раствор полученного на стадии 1 соединения (27 г, 95 ммоль) в толуоле (60 мл) добавляют к суспензии NaH (4,40 г, 109,2 ммоль) в толуоле (160 мл) при 20 С в атмосфере азота. Смесь перемешивают при комнатной температуре в течение 1 ч и затем добавляют 30 г (190 ммоль) 2-оксиранилметокситетрагидропирана. Реакционную смесь нагревают при кипячении с обратным холодильником в течение 4 дней, и смесь затем охлаждают, гидролизуют водой и экстрагируют эфиром. Органическую фазу промывают раствором NaCl, сушат над MgSO4 и концентрируют в вакууме. Полученный остаток хроматографируют на флэш-колонке (элюент : циклогексан/EtOAc, 80/20), что позволяет выделить указанное в заголовке соединение в форме бледно-красного масла. Элементный микроанализ:%Н Теоретический 75,50 7,74 Найдено 75,43 7,82 Стадия 3. Спиро[циклопропан-2:2'-(1',2',3',4'-тетрагидронафт)]-1-илметанол. Твердый иодид цинка (4,16 г, 13 ммоль) и цианоборогидрид натрия (4,10 г, 62,2 ммоль) добавляют к раствору соединения, полученного в стадии 2 (2,50 г, 8,7 ммоль) в 1,2-дихлорэтане(45 мл) при комнатной температуре в атмосфере азота. Реакционную смесь нагревают при 8085 С в течение 3 ч и затем охлаждают и выливают на охлажденный льдом насыщенный раствор NH4C1, содержащий 10% по объему 5 н. НСl (180 мл). Смесь экстрагируют 3 раза AcOEt и органические фазы сушат над MgSO4 и выпаривают. Указанный в заголовке спирт очищают хроматографией на флэш-колонке (элюент : циклогексан/EtOAc, 70/30) и выделяют в форме бесцветного масла. Стадия 4. Спиро[циклопропан-2:2'-(l',2',3',4'-тетрагидронафт)]-1-илкарбоксальдегид. 11,6 г (116,2 ммоль) СrО 3 добавляют к раствору пиридина (226,5 ммоль, 18,5 мл) в CH2Cl2(360 мл) при 0 С в атмосфере азота. После перемешивания в течение 1 ч при комнатной температуре добавляют полученный в стадии 3 спирт (3,64 г, 19,4 ммоль), растворенный вCH2Cl2 (80 мл); смесь перемешивают в течение последующих 2 ч при комнатной температуре и затем фильтруют, и фильтрат выпаривают при пониженном давлении. Остаток разбавляют эфиром, промывают 1 н. NaOH, 1 н. НСl и насыщенным раствором NaCl, затем сушат надMgSO4 и испаряют при пониженном давлении,получая указанный в заголовке альдегид в форме масла. Стадия 5. Спиро[циклопропан-2:2'-(1',2',3',4'-тетрагидронафт)]-1-иламиноацетонитрил. 25 760 мг (14,2 ммоль) KCN и 920 мг (14,2 ммоль) NH4Cl добавляют последовательно к энергично перемешиваемому в атмосфере азота раствору, содержащему 2,63 г (14,1 ммоль) соединения, полученного в стадии 4,430 мл МеОН и 20 мл воды. После перемешивания в течение 12 ч при 20 С раствор разбавляют СН 2 Сl2 и экстрагируют 3 раза СН 2 Сl2. Органическую фазу промывают насыщенным раствором NaCl, сушат над MgSO4 и концентрируют. Полученный остаток обрабатывают 30 мл 7 н. раствора аммиака в метаноле и перемешивают в закрытой системе в течение 12 ч при 20 С. После выпаривания при пониженном давлении указанное и заголовке соединение получают в форме коричневого масла. Стадия 6. 1-Спиро[циклопропан-2:2'(1',2',3',4'-тетрагидронафт)]-1-илэтан-1,2-диамин. Раствор полученного в стадии 5 соединения (2,90 г, 13,7 ммоль) в безводном ТГФ (60 мл) добавляют по каплям к суспензии LiAlH4(570 мг, 15 ммоль) в 60 мл ТГФ при -20 С в атмосфере азота. Смесь перемешивают в течение 2 ч при -10 С и затем гидролизуют последовательным добавлением Н 2 О (3,5 мл), 35% NaOH(7 мл) и Н 2 О (7,3 мл). Полученную суспензию фильтруют и фильтрат испаряют. Полученное масло очищают хроматографией на флэшколонке и получают смесь 2 диастереоизомеров,которые разделяют при помощи ВЭЖХ (кромасил 100,5 С 18-265 мм-CH3OH/ H2O/CF3COOH,350/650/5) . Стадия 7. Фумарат 4-спиро[циклопропан 2:2'-(1',2',3',4'-тетрагидронафт)]-1-ил-4,5-дигидро-1 Н-имидазола (изомер 1). Смесь, содержащую один из двух диастереоизомеров, полученных в стадии 6 (170 кг, 0,8 ммоль), и формамидинацетат (94 мг, 0,9 ммоль) в этаноле (5 мл), перемешивают при 20 С в атмосфере азота в течение 12 ч. Растворитель затем испаряют и остаток растворяют в 1 н. НСl. Кислотную фазу промывают Et2O и делают основной при помощи раствора гидроксида натрия. Смесь экстрагируют CH2Cl2 и органическую фазу промывают, сушат над MgSО 4 и выпаривают. Полученный твердый остаток растворяют в ацетоне (10 мл) и обрабатывают раствором фумаровой кислоты (81,5 мг, 0,7 ммоль) в изопропаноле (4 мл). После испарения и перекристаллизации из смеси ацетон/изопропанол указанное в заголовке соединение получают в форме белого порошка. Точка плавления 149 С. Пример 30. Фумарат 4-спиро[циклопропан-2:2'-(1',2',3',4'-тетрагидронафт)]-1-ил 4,5-дигидро-1 Н-имидазола (изомер 2). Методика такая же, как в стадии 7 примера 29, исходя из другого диастереоизомера, выделенного на стадии 6 примера 29. Точка плавления 164 С.%N Теоретический 66,65 6,48 8,18 Найдено 66,59 6,65 8,22 Пример 31. Фумарат 4-[(8-хлор-1,2,3,4 тетрагидро-2-нафтил)-метил]-4,5-дигидро-1 Нимидазола. Методика такая же, как в примере 16, исходя из этил 2-(8-хлор-3,4-дигидро-2-нафтил) ацетата. Точка плавлении 230-233 С. Элементный микроанализ:%N Теоретический 57,49 4,52 8,38 Найдено 57,51 4,68 8,27 Пример 37. 1,5-(Полуторный)фумарат 4(3,4-дигидро-2-нафтилметил)-1-метил-4,5 дигидро-1 Н-имидазола. 0,205 мл (1,5 ммоль) триэтиламина и затем 0,165 мл (1,75 ммоль) диметилсульфата добавляют последовательно к раствору 320 мг (1,5 ммоль) полученного в примере 1 (после нейтрализации соли посредством 2 н. NaOH) ) соединения в 10 мл СН 2 Сl2, охлажденному до -60 С. Температуру затем повышают до 20 С, и смесь перемешивают при этой температуре в течение 12 ч. Смесь промывают 0,1 н. NaOH (5 мл) и затем насыщенным раствором NaCl. После сушки и выпаривания растворителя остаток хроматографируют на диоксиде кремния, элюируя смесью CH2Cl2/CH3OH/NEt3, 90/10/0,5. Начальную фракцию растворяют в 5 мл EtOH и затем обрабатывают раствором 71 мг (0,61 ммоль) фумаровой кислоты в 5 мл EtOH. После концентрирования указанное в заголовке соединение выделяют перекристаллизацией. Точка плавления 190-192 С. Элементный микроанализ:%N Теоретический 62,99 6,05 7,00 Найдено 63,22 6,10 6,97 Пример 38. Фумарат 4-[(7-фтор-1,2,3,4 тетрагидро-2-нафтил)метил]-4,5-дигидро-1 Нимидазола (диастереоизомер 1). Стадия 1. N-2-(1-Циклогексен-1-иламино)-1-[(7-фтор-3,4-дигидро-2-нафтил)метил]-2 оксоэтил-N-(1R)-1-фенилэтил]бензамид. Раствор 15 г (78 ммоль) 7-фтор-3,4 дигидро-2-нафталинкарбоксальдегида (получен по такой же методике, как в стадиях 1 и 2 примера 1, исходя из 7-фтор-1,2,3,4-тетрагидронафталин-2-она) и 9,45 г (78 ммоль) (1R)-1 фенилэтиламина в 150 мл метанола перемешивают при 20 С в атмосфере азота в течение 1 ч. Затем последовательно добавляют 9,76 г (80 ммоль) бензойной кислоты и 8,56 г (80 ммоль) 1-циклогексенилизонитрила; смесь затем перемешивают при 20 С в течение 15 ч. После концентрирования в вакууме остаток поглощаютEtOAc (300 мл); раствор промывают 0,1 н. водным NaOH, затем 0,1 н. водным НСl и, наконец,насыщенным водным NaCl. Органическую фазу концентрируют в вакууме; хроматография маслянистого остатка с элюированием смесью циклогексан/EtOAc, 80/20, позволяет выделить 2 диастереоизомера (1 и 2) указанного в заголовке соединения в форме масел.Rf (1) = 0,25, Rf (2) = 0,15. Стадия 2. N-2-Амино-1-[(7-фтор-3,4-дигидро-2-нафтил)метил]-2-оксоэтил-N-[(1R)-1 фенилэтил]бензамид. Раствор 3,50 г (6,70 ммоль) диастереоизомера 2 из стадии 1 в 50 мл ТГФ обрабатывают 1,20 мл концентрированной НСl. После пере 004536 28 мешивания в течение 1 ч при 20 С смесь нейтрализуют добавлением твердого NаНСО 3,фильтруют и концентрируют в вакууме. Хроматография на SiO2 с элюированием смесью циклогексан/EtOAc, 40/60, позволяет получить указанное в заголовке соединение в форме пены. Элементный микроанализ:EtOH гидрируют при давлении одна атмосфера в течение 12 ч. После отделения катализатора фильтрованием растворитель испаряют в вакууме. Полученный остаток хроматографируют на SiО 2 с элюированием раствором циклогексан/EtOAc, 40/60, получая указанное в заголовке соединение в форме 2 диастереоизомеров. Диастереоизомер 1: Точка плавления 145-146 С. Элементный микроанализ:%N Теоретический 75,65 6,58 6,30 Найдено 75,46 6,62 6,48 Стадия 4. N-2-Амино-1-[(7-фтор-1,2,3,4 тетрагидро-2-нафтил)метил]этил-N-бензил-N[(1R)-1-фенилэтил]амин. 7 мл (7 ммоль) молярного раствора ВН 3/ТГФ добавляют по каплям при энергичном перемешивании к сохраняемому в атмосфере азота раствору 1,20 г (2,70 ммоль) соединения,полученного в стадии 3 (диастереоизомер 1) в 30 мл безводного ТГФ. Смесь затем нагревают при 70 С в течение 1 ч и затем охлаждают, обрабатывают 8 мл СН 3 ОН и перемешивают при 20 С в течение 1 ч. После концентрирования в вакууме остаток хроматографируют на диоксиде кремния с элюированием растворомCH2Cl2/CH3OH, 95/5, получая указанное в заголовке соединение в форме масла. Стадия 5. 3-(7-Фтор-1,2,3,4-тетрагидро-2 нафтил)-1,2-пропандиамин. 0,45 г формиата аммония добавляют к энергично перемешиваемой суспензии 0,35 г(0,84 ммоль) соединения, полученного в стадии 4, и 0,25 г 10% Pd/C в 25 мл СН 3 ОН. После перемешивания в течение 1 ч при кипячении с обратным холодильником смесь охлаждают и фильтруют; катализатор промывают СН 3 ОН и объединенные фильтраты концентрируют в вакууме, получая указанное в заголовке соединение в форме масла, которое используют без очистки в следующей реакции. Стадия 6. Фумарат 4 -[(7-фтор-1,2,3,4 тетрагидро-2-нафтил)метил-4,5-дигидро-1 Нимидазола (диастереоизомер 1). 29 Методика такая же, как в стадии 5 примера 1, исходя из соединения, полученного перед этим на стадии 5 данного примера. Точка плавления 174-175 С. Элементный микроанализ:%N Теоретический 62,79 4,98 8,14 Найдено 62,41 5,08 8,11 Пример 43. Фумарат 4-метил-4-(1,2,3,4 тетрагидро-2-нафтилметил)-4,5-дигидро-1 Нимидазола (диастереоизомер 1). Стадия 1. 3-(3,4-Дигидро-2-нафтил)-2 метил-2-[(1-фенилэтил)амино]пропаннитрил. Раствор 9,50 г (51 ммоль) (3,4 дигидронафт-2-ил)пропан-2-она, 6,17 г (51 ммоль) Rметилбензиламина и 0,095 г (0,5 ммоль) п-толуолсульфоновой кислоты в 250 мл толуола нагревают с обратным холодильником в условиях азеотропной перегонки смеси во 004536 30 да/толуол в течение 8 ч. После охлаждения и выпаривания растворителя остаток растворяют в 450 мл СН 2 Сl2; к получаемой смеси в атмосфере азота добавляют по частям 5,50 г (55 ммоль) триметилсилилцианида, охлаждают до-35 С смесь концентрируют в вакууме, получая указанное в заголовке соединение в форме масла, которое используют для следующей реакции без очистки. Стадия 2. N-[2-Амино-1-(3,4-дигидро-2 нафтилметил)-1-метилэтил]-N-(1-фенилэтил) амин. Раствор 16 г полученного в стадии 1 соединения в 200 мл ТГФ по каплям добавляют к сохраняемой в атмосфере азота суспензии 2,28 г(60 ммоль) LiAlH4 в 200 мл ТГФ. Температуру смеси затем повышают до 20 С и перемешивание продолжают при этой температуре в течение 3 ч. Смесь снова охлаждают до 0 С и гидролизуют последовательным добавлением 20 мл изо-PrOH и 25 мл насыщенного раствора NaCl. Образованный осадок отсасывают и промывают ТГФ; фильтрат концентрируют в вакууме и остаток хроматографируют на диоксиде кремния с элюированием смесью CH2Cl2/CH3OH/NH4OH,97/3/0,3, получая указанное в заголовке соединение в форме 2 диастереоизомеров: диастереоизомер 1: масло - Rf = 0,18; диастереоизомер 2: масло - Rf = 0,15. Стадия 3. N-[2-Амино-1-метил-1-(1,2,3,4 тетрагидро-2-нафтилметил)этил]-N-(1-фенилэтил)амин. Суспензию 0,52 г (1,62 ммоль) соединения,полученного в стадии 2 (диастереоизомер 1) и 0,1 г Рd/А 12O3 в 60 мл EtOH гидрируют при 20 С при давлении 1 бар (100 кПа) в течение 16 ч. Смесь затем фильтруют и концентрируют в вакууме, получая указанное в заголовке соединение в форме пены. Стадия 4. 2-Метил-3-(1,2,3,4-тетрагидро-2 нафтил)-1,2-пропандиамин. Суспензию 0,50 г (1,55 ммоль) соединения,полученного в стадии 3, и 0,14 г Pd(OH)2 в смеси 0,8 мл уксусной кислоты и 50 мл EtOH гидрируют при 20 С под давлением 1 бар (100 кПа) в течение 20 ч. После фильтрования смеси и концентрирования в вакууме остаток поглощают 1 н. водным NaOH (10 мл) и экстрагируют СН 2 Сl2 (3 х 10 мл); объединенные органические фазы промывают насыщенным водным NaCl,сушат и концентрируют, получая указанное в заголовке соединение в форме масла, которое используют в следующей реакции без дальнейшей очистки. Стадия 5. Фумарат 4-метил-4-(1,2,3,4 тетрагидро-2-нафтилметил)-4,5-дигидро-1 Нимидазола (диастереоизомер 1). Методика такая же, как в стадии 5 примера 1, исходя из соединения, полученного в стадии 4. Точка плавления 118 С.NaH (3,43 г, 140 ммоль) добавляют по частям к раствору 5,6-дифтор-1-инданона (20 г, 120 ммоль) и этил-2-[(диэтоксифосфорил)окси] акрилата (36 г, 140 ммоль) в ТГФ (260 мл) таким образом, чтобы температура не превышала 35 С. В конце добавления колбу погружают в масляную баню при 50 С и температуру реакционной смеси повышают до 60 С. Когда температура возвращается к 45 С,перемешивание продолжают в течение одного часа при этой температуре. Реакционную смесь выливают на смесь льда (1 л) и 1 н. хлористоводородной кислоты (1 л) и продукт экстрагируют этилацетатом (3 х 600 мл); органический раствор сушат над MgSO4 и выпаривают. Указанное в заголовке соединение очищают хроматографией на силикагеле (элюент:циклогексан/ этилацетат, 93/7). Стадия 2. Этиловый эфирспиро[циклопропан-2:2'-(5',6'дифториндан)]-1-илкарбоновой кислоты. Продукт, полученный в стадии 1 (24,2 г, 90 ммоль), вводят в колбу объемом 1 л, снабженную механической мешалкой и содержащую 500 мл 1,2-дихлорэтана, NaBH3CN (42,7 г, 680 ммоль) и ZnI2 (41,5 г, 130 ммоль). Суспензию нагревают с обратным холодильником при перемешивании в течение 14 ч. Соли затем отделяют фильтрованием; раствор гидролизуют смесью 10% NH4C1 (1 л) и 6 н. НСl (180 мл), через полчаса органическую фазу отделяют и водную фазу экстрагируют этилацетатом (2 х 500 мл). Соли гидролизуют в той же самой водной фазе,которую снова экстрагируют этилацетатом (2 х 300 мл). Объединенные органические фазы промывают Nа 2 СО 3 (500 мл) и NaCl (500 мл),сушат над MgSO4 и концентрируют в вакууме. Указанное в заголовке соединение очищают хроматографией на силикагеле (элюент: циклогексан/этилацетат, 95/5). 32 Стадия 3. Спиро[циклопропан-2:2'-(5',6'дифториндан)-1-илкарбинол. Продукт, полученный в стадии 2 (13,9 г, 53 ммоль) и растворенный в ТГФ (250 мл), добавляют по каплям к суспензии LiAlH4 (3,1 г, 82 ммоль) в ТГФ (250 мл) при -18 С. Смесь перемешивают в течение 3 ч при комнатной температуре и разлагают последовательным добавлением воды (3,1 мл), 1 н. NaOH (3,1 мл) и воды(6,2 мл). Суспензию перемешивают в течение ночи, твердую часть отдаляют фильтрованием и фильтрат испаряют, получая указанное в заголовке соединение, которое используют в следующей стадии без дополнительной очистки. Стадия 4. Спиро[циклопропан-2:2'-(5',6'дифториндан)]-1-илкарбоксальдегид. Продукт, полученный в стадии 3 (14,3 г, 68 ммоль) и растворенный в 140 мл CH2Cl2, добавляют по каплям при комнатной температуре к суспензии хромата пиридиния, полученного при 0 С, исходя из пиридина (68 мл, 670 ммоль) и СrО 3 (42 г, 420 ммоль), в 1 л CH2Cl2. Суспензию перемешивают в течение 5 ч, фильтруют и осадок промывают эфиром; фильтрат выпаривают досуха, поглощают эфиром (1 л) и нерастворимый материал отделяют фильтрованием. Органическую фазу промывают последовательно 1 н.(2 х 500 мл) и NaCl (500 мл), сушат над MgSO4 и выпаривают, получая указанное в заголовке соединение, которое используют в следующей стадии без дополнительной стадии очистки. Стадия 5. 2-Ди-(4-метоксифенил) метиламино-2-спиро[циклопропан-2':2-(5,6-дифториндан)]-1'-илацетонитрил. Продукт, полученный в стадии 4 (12 г, 58 ммоль), перемешивают в 250 мл CH2Cl2 в течение 2 ч в присутствии ди-(4-метоксифенил) метиламина (14 г, 58 ммоль) и молекулярного сита 4(18 г). Затем добавляют 6,3 г (СН 3)3SiCN (64 ммоль) и раствор перемешивают при комнатной температуре в течение 14 ч. Твердую часть отделяют фильтрованием, органическую фазу промывают 0,1 н. NaOH (500 мл) и NaCl (250 мл), сушат над MgSO4 и испаряют, получая указанное в заголовке соединение, которое используют в следующей стадии без дополнительной очистки. Стадия 6. 2-Ди-(4-метоксифенил)метиламино-2-спиро[циклопропан-2':2-(5,6-дифториндан)]-1'-илэтиламин (диастереоизомер 1). Продукт, полученный в стадии 5 (26,7 г, 68 ммоль) и растворенный в ТГФ (125 мл), добавляют по каплям при -10 С к суспензии LiAlH4(3,3 г, 87 ммоль) в ТГФ (500 мл). В конце добавления температуру повышают и суспензию перемешивают в течение 1 ч, после чего ее разлагают последовательным добавлением воды (3,3 мл), 1 н. NaOH (3,3 мл) и воды (6,6 мл). После добавления эфира (300 мл) суспензию перемешивают в течение 45 мин, твердую часть отде 33 ляют фильтрованием и фильтрат выпаривают. Диастереоизомеры разделяют хроматографией на силикагеле, элюируя с градиентом аммиака(10% в абсолютном этаноле) в CH2Cl2. Стадия 7. 2-Амино-2-спиро[циклопропан 2':2-(5,6-дифториндан)]-1'-илэтиламин (диастереоизомер 1). Продукт, полученный в стадии 6 (диастереоизомер 1) (3,12 г, 6,7 ммоль), растворяют в смеси АсОН/Н 2 О (80/20, 200 мл) и раствор погружают в масляную баню при 90 С на 45 мин. Уксусную кислоту затем испаряют. Полученный сироп растворяют в 1 н. НСl (100 мл) и раствор промывают эфиром (3 х 75 мл). Водную фазу нейтрализуют 35% NaOH (20 мл), экстрагируют СН 2 Сl2 (3 х 75 мл), сушат над K2 СО 3 и испаряют. Указанное в заголовке соединение очищают хроматографией на силикагеле (элюент: CH2Cl2/MeOH/NH4OH, 90/9/1). Стадия 8. Фумарат 4-спиро[циклопропан 2':2-(5,6-дифториндан)]-1'-ил-4,5-дигидро 1 Н-имидазола (диастереоизомер 1). Ацетат формамидина (654 мг, 6,3 ммоль) добавляют к раствору соединения, полученного в стадии 7 (1,5 г, 6,3 ммоль), в EtOH (100 мл). После перемешивания в течение 14 ч при комнатной температуре этанол выпаривают и белый твердый продукт поглощают ацетоном (75 мл) и изопропанолом (10 мл). Раствор фильтруют и добавляют фумаровую кислоту (694 мг, 6,3 ммоль), предварительно растворенную при нагревании в ацетоне (25 мл) и изопропаноле (10 мл). Указанное в заголовке соединение получают в форме твердого продукта, который фильтруют и сушат в вакууме. Точка плавления 220 С (разложение). Элементный микроанализ:%N Теоретический 59,34 4,98 7,69 Найдено 59,43 5,17 7,58 Пример 46. Фумарат 4-спиро[циклопропан-2':2-(5",6'-дифториндан)]-1'-ил-4,5 дигидро-1 Н-имидазола (диастереоизомер 2). Методика такая же, как в стадиях 7 и 8 примера 45, исходя из второго диастереоизомера, выделенного на стадии 6. Точка плавления 240 С (разложение). Элементный микроанализ:%С 1 Теоретический 60,56 5,62 7,43 9,41 Найдено 60,24 5,61 7,48 9,41 Пример 51. Фумарат 4-спиро[циклопропан-2':2-l",2",3",4"-тетрагидронафт)]-1'-ил-4,5 дигидро-1 Н-имидазола (энантиомер 1 продукта примера 30). Второй диастереоизомер со стадии 6 примера 29 растворяют в этаноле в присутствии одного эквивалента R-(-)-миндальной кислоты. Твердую часть, которая кристаллизуется, перекристаллизуют из этанола. Соль разлагают путем нейтрализации водным раствором 1 н.NaOH, затем раствор экстрагируют дихлорметаном, сушат над K2 СО 3 и выпаривают в вакууме. Остаток обрабатывают, как в стадии 7 примера 29, получая указанное в заголовке соединение. Точка плавления 173,6 С. Элементный микроанализ:%N Теоретический 66,65 6,48 8,18 Найдено 66,35 6,48 8,14 Пример 52. Фумарат 4-спиро[циклопропан-2':2-(1',2",3",4"-тетрагидронафт)]-1'ил-4,5-дигидро-1 Н-имидазола (энантиомер 2 продукта примера 30). Второй диастереоизомер со стадии 6 примера 29 растворяют в этаноле в присутствии одного эквивалента S (+)-миндальной кислоты. Твердую часть, которая кристаллизуется, перекристаллизуют из этанола. Соль разлагают путем нейтрализации водным раствором 1 н.NaOH; раствор затем экстрагируют дихлорметаном, сушат над K2 СО 3 и испаряют в вакууме. Остаток обрабатывают, как в стадии 7 примера 29, получая указанное в заголовке соединение. Точка плавления 172,5 С Элементный микроанализ:%N Теоретический 66,26 7,02 8,13 Найдено 66,22 7,36 8,27 Фармакологическое исследование Пример А. Определение аффинности для 2-адренергических рецепторов у крысы. Аффинность определяют экспериментами на конкуренцию с [3 Н]-RX 821,002. Мембраны получают из коры головного мозга крысы и инкубируют в тройном повторе с 0,4 нМ [3 Н]-RX 821,002, причем соединение испытывают в конечном объеме 1,0 мл, в течение 60 мин при 22 С. Инкубационный буфер содержит 50 нМ ТРИС-НСl (рН 7,5), 1 мМ ЭДТК и 100 мкМGppNHp. Неспецифическое связывание определяют с использованием 10 мкМ фентоламина. Анализ данных По окончании инкубации инкубационную среду фильтруют через фильтры WHATMANGF/B, пропитанные 0,1% полиэтиленимина, и промывают три раза 5 мл охлажденного буфера. Радиоактивность, удержанную на фильтрах,определяют подсчетом (импульсов) в жидкой фазе. Изотермы связывания анализируют нелинейной регрессией. Результат Соединения согласно изобретению проявляют специфическую активность антагонистов(2-адренергического рецептора, причем соединение примера 22, например, имеет pKi 8,8. 36 Пример В. Определение аффинности для сайтов повторного поглощения норадреналина у крысы. Аффинность определяют экспериментами на конкуренцию с использованием [3 Н]низоксетина. Мембраны получают из коры головного мозга крысы и инкубируют в тройном повторе с 0,2 нМ [3 Н]-низоксетином, причем соединение испытывают в конечном объеме 0,5 мл, в течение 4 ч при 4 С. Инкубационный буфер содержит 50 нМ ТРИС-НС 1 (рН 7,4), 120 мМ NaCl и 5 мМ KСl. Неспецифическое связывание определяют с использованием 10 мкМ дезипрамина. Анализ данных По окончании инкубации инкубационную среду фильтруют через фильтры WHATMANGF/B, пропитанные 0,1% полиэтиленимином и промывают три раза 5 мл охлажденного буфера. Радиоактивность, удержанную на фильтрах,определяют подсчетом импульсов в жидкой фазе. Изотермы связывания анализируют при помощи нелинейной регрессии. Результат Соединения согласно настоящему изобретению проявляют очень хорошее сродство для сайтов повторного поглощения норадреналина. Так, например, pKi соединения примера 2 составляет 7,8. Пример С. Определение аффинности для сайтов повторного поглощения серотонина у крысы. Аффинность определяют экспериментами на конкуренцию с использованием [3 Н]пароксетина. Мембраны получают из коры головного мозга крысы и инкубируют в тройном повторе с 0,25 нМ [3 Н]-пароксетина, причем соединение испытывают в конечном объеме 0,4 мл, в течение 2 ч при 25 С. Буфер для инкубации содержит 50 нМ ТРИС-НСl (рН 7,4), 120 мМ NaCl и 5 мМ KСl. Неспецифическое связывание определяют с использованием 10 мкМ циталопрама. Анализ данных По окончании инкубации инкубационную среду фильтруют через фильтры WHATMANGF/B, пропитанные 0,1% полиэтиленимином, и промывают три раза 5 мл охлажденного буфера. Радиоактивность на фильтрах, определяют подсчетом импульсов в жидкой фазе. Изотермы связывания анализируют при помощи нелинейной регрессии. Результат Соединения согласно настоящему изобретению проявляют очень хорошее сродство для сайтов повторного поглощения серотонина. Так,например, pKi соединения примера 12 составляет 7,8. Пример D. Фармацевтическая композиция: таблетки. где А представляет кольцо бензола, незамещенное или замещенное 1-4 одинаковыми или различными группами, выбранными из неразветвленного или разветвленного (C1-С 6)алкила, неразветвленного или разветвленного (С 1-С 6)алкокси, гидрокси, полигалоген (C1-С 6)алкила, у которого алкильная часть не разветвлена или разветвлена, циано, нитро, амино, алкиламино,диалкиламино, тиоалкила, сульфонилалкила,сульфинилалкила, карбокси, алкоксикарбонила,алкилкарбонилокси, формила, карбамоила, карбоксамида, фенила, бензила и атомов галогена,В представляет кольцо имидазолина, представленное формулой (Iа) или (Ib)R , которые могут быть одинаковыми или разными, представляет атом водорода или неразветвленную либо разветвленную (C1-C6)алкильную группу),атом азота или группу NR8 (где R8 представляет атом водорода, или неразветвленную либо разветвленную (C1-С 6)алкильную группу,или бензильную группу),атом кислорода,атом серы или группу SO или SO2,Y представляет группу СН или СН 2 или простую связь (в этом случае кольцо, содержащее X, Y и Z, представлено формулой (Iс)Z представляет атом углерода или группуCR4, где R4 представляет атом водорода или неразветвленную либо разветвленную (C1-С 6) алкильную группу,R1, R2, R3, которые могут быть одинаковыми или различными, представляют собой, каж 004536 38 дый, атом водорода или неразветвленную либо разветвленную (C1-С 6)алкильную группу, причем группы (R2 и R4) или (R1 и R4) могут образовывать циклопропановую группу,R5 представляет атом водорода, или неразветвленную либо разветвленную (C1-С 6)алкильную группу, или бензильную группу,символозначает, что эти связи могут быть простыми или двойными, причем подразумевается, что имеет место соответствие валентности атомов,где алкил означает неразветвленную или разветвленную алкильную группу, содержащую от 1 до 6 атомов углерода,их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 2. Соединение формулы (I) по п.1, где R5 представляет атом водорода, их таутомеры,энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 3. Соединения формулы (I) по п.1, где R1,2R и R3 одновременно представляют собой атом водорода, a Z представляет атом углерода или группу СН, их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 4. Соединения формулы (I) по п.1, где R1 и 2R одновременно представляют атом водорода,a R3 или R4 представляет метильную группу, их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 5. Соединения формулы (I) по п.1, где (R1 4 и R ) или (R2 и R4) представляют циклопропановую группу, их таутомеры, энантиомеры и диастереоизомеры и их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 6. Соединения формулы (I) по п.1, где циклическая система представляет 3,4 дигидронафталин, 1,2,3,4-тетрагидронафталин, индан, инден или бензофуран, их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 7. Соединения формулы (I) по п.1, где циклическая система представляет 3,4-дигидронафталин, 1,2,3,4 тетрагидронафталин, индан, инден или бензофуран, причем эти циклические системы не замещены, их таутомеры, энантиомеры и диасте 39 реоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 8. Соединения формулы (I) по п.1, где циклическая система представляет 3,4-дигидронафталин, 1,2,3,4- тетрагидронафталин, индан, инден или бензофуран, причем эти циклические системы замещены одним или несколькими одинаковыми или различными заместителями, выбранными из атомов галогена и групп метил, метокси и CF3,их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 9. Соединение формулы (I) по п.1, которое представляет собой 4-(3,4-дигидро-2-нафтилметил)-4,5-дигидро-1 Н-имидазол, его таутомеры,энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 10. Соединение формулы (I) по п.1, которое представляет собой 4-[(8-хлор-3,4-дигидро 2-нафтил)метил]-4,5-дигидро-1 Н-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 11. Соединение формулы (I) по п.1, которое представляет собой 4-[(8-метокси-3,4 дигидро-2-нафтил)метил]-4,5-дигидро-1 Нимидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 12. Соединение формулы (I) по п.1, которое представляет собой 4-(бензо[b]фуран-2 илметил)-4,5-дигидро-1 Н-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 13. Соединения формулы (I) по п.1, которые представляют собой 4-спиро[циклопропан-2:2'-(1',2',3',4'-тетрагидронафт)]-1-ил-4,5 дигидро-1 Н-имидазол (изомер 1) и 4-спиро[циклопропан-2:2'-(1',2',3',4'-тетрагидронафт)]-1 ил-4,5-дигидро-1 Н-имидазол (изомер 2), их таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 14. Соединения формулы (I) по п.1, которые представляют собой 4-[1,2,3,4-тетрагидро 2-нафтилметил]-4,5-дигидро-1 Н-имидазол (изомер 1), 4-[1,2,3,4-тетрагидро-2-нафтилметил]4,5-дигидро-1 Н-имидазол (изомер 2), 4-[1,2,3,4 тетрагидро-2-нафтилметил]-4,5-дигидро-1 Нимидазол (изомер 3), 4-[1,2,3,4-тетрагидро-2 нафтилметил]-4,5-дигидро-1 Н-имидазол (изомер 4), их таутомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 40 15. Соединение формулы (I) по п.1, которое представляет собой 4-(1,3-дигидро-1 Н-2 инденилметил)-4,5-дигидро-1 Н-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 16. Соединение формулы (I) по п.1, которое представляет собой 4-[(3,4-дигидро-4,4 диметил-2-нафтил)метил]-4,5-дигидро-1 Нимидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 17. Соединение формулы (I) по п.1, которое представляет собой 4-[(7-фтор-3,4-дигидро 2-нафтил)метил]-4,5-дигидро-1 Н-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 18. Соединение формулы (I) по п.1, которое представляет собой 4-[(8-хлор-2-нафтил) метил]-4,5-дигидро-1 Н-имидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 19. Соединения формулы (I) по п.1, которые представляют собой 4-спиро[циклопропан-2':2"-(5",6"-дифториндан)]-1'-ил-4,5-дигидро-1 Н-имидазол(диастереоизомер 1), 4-спиро[циклопропан-2':2"-(5",6"-дифториндан)]-1'-ил 4,5-дигидро-1 Н имидазол (диастереоизомер 2),их таутомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 20. Соединение формулы (I) по п.1, которое представляет собой 4-[(5-фтор-2,3-дигидро 1 Н-инден-2-ил)метил]-4,5-дигидро-1Hимидазол, его таутомеры энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 21. Соединение формулы (I) по п.1, которое представляет собой 4-[(5,6-дифтор-2,3 дигидро-1 Н-инден-2-ил)метил]-4,5-дигидро-1 Нимидазол, его таутомеры, энантиомеры и диастереоизомеры, а также их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 22. Способ получения соединений формулы (I) по п.1, характеризующийся тем, что в качестве исходного вещества используют соединение формулы (II) где А, X, Y, Z, R1, R2 , R3 и символопределены как указано выше, которое подвергают либо воздействию условий реакции Стрекера(KCN, NH4Cl), либо воздействию амина RaNH2(где Ra представляет атом водорода или затрудненную защитную группу, позволяющую полу 41 чить, где это применимо, лучшее разделение образованных диастереоизомеров) и триметилсилилцианида с получением соединения формулы (III) где А, X, Y, Z, R1, R2, R3, Ra и символопределены как указано выше, причем соединение формулы (III), где Ra представляет атом водорода, может быть альтернативно получено, исходя из соединения формулы (IV) где А, X, Y, Z, R1 , R2 и символопределены как указано выше, которое подвергают воздействию галогенирующего агента, получая соединение формулы (V) где А, X, Y, Z, R1, R2 и символ определены как указано выше, и Hal представляет атом галогена, которое конденсируют с соединением формулы (VI) где R3 определен как указано выше, получая соединение формулы (VII) где А, X, Y, Z, R1, R2 , R3 и символопределены как указано выше, которое подвергают кислотному гидролизу, получая соединение формулы (III/а), частный случай соединений формулы (III) где А, X, Y, Z, R1, R2, R3 и символопределены как указано выше, и указанное соединение формулы (III) подвергают действию восстановителя, такого как LiAlH4, AlH3, или каталитическому гидрированию, например, с получением соединения формулы (VIII) где А, X, Y, Z, R1, R2, R3, Ra и символопределены как указано выше, у которого в случае,когда Ra не является атомом водорода, снимают защитную группу в кислотной или в восстано 004536 42 вительной среде, например, с получением соединения формулы (IX) где А, X, Y, Z, R1, R2, R3 и символопределены как указано выше, которое подвергают взаимодействию с формамидинацетатом или с метилортоформиатом, получая соединение формулы(I/а), частный случай соединений формулы (I) где А, X, Y, Z, R1, R2, R3 и символопределены как указано выше, и В' представляет кольцо незамещенного имидазолина, как представлено формулой (Ia/а) или (Ib/a) которое можно подвергнуть в присутствии основной системы воздействию соединения формулы (X)R5a - J 5 где R a представляет неразветвленную или разветвленную (C1-С 6)алкильную группу или бензильную группу, a J представляет уходящую группу, такую как атом галогена или тозильная группа, с получением соединения формулы(I/b), частного случая соединений формулы (I) где А, X, Y, Z, R1, R2, R3 и символопределены как указано выше, а В" представляет кольцо замещенного имидазолина, как представлено формулой (Ia/b) или (Ib/b) где R5a определено как указано выше, причем соединения (I/a) и (I/b) составляют в совокупности соединений формулы (I) и могут быть очищены по общепринятой методике разделения, и,если нужно, их превращают в аддитивные соли с фармацевтически приемлемой кислотой или основанием и разделяют, где это целесообразно,на их изомеры по общепринятой методике разделения. 23. Способ получения соединений формулы (I/a) по п.22, характеризующийся тем, что в качестве исходного вещества используют соединение формула (II') где А, X, Y, R , R , R и символопределены как указано выше, которое конденсируют с хиральным соединением класса аминов формулы где Rb и Rc, которые являются различными,представляют алкильную или арильную группу,с получением соединения формулы (XII) где А, X, Y, R1, R2, R3, Rb, Rc и символопределены как указано выше, которое подвергают действию N-1-изоцианоциклогексена и бензойной кислоты, получая соединение формулы где А, X, Y, R1, R2, R3, R4, Rb, Rc и символ определены как указано выше, полученное соединение формулы (XVa) хроматографируют на диоксиде кремния, получая диастереоизомеры формул (XVa') и (XVa") где А, X, Y, R1, R2, R3, R4, Rb, Rc и символ определены как указано выше, и соединение формулы (XVa') последовательно подвергают воздействию восстановителя, такого как ВН 3, а затем гидрогенолизу, получая соединение формулы (XVIa') где А, X, Y, R1, R2, R3, R4 и символопределены как указано выше, которое подвергают реакции с формамидинацетатом или метилортоформиатом, получая соединение формулы(XVIIa'), частный случай соединений формулы(I/а) где А, X, Y, R1, R2, R3, Rb, Rc и символопределены как указано выше, полученное соединение формулы (XIII) хроматографируют на диоксиде кремния, получая диастереоизомеры формул (ХIIIа) и (ХIIIb) где А, X, Y, R1, R2, R3, Rb, Rc и символопределены как указано выше, соединение формулы(ХIIIа) подвергают воздействию Н 3 О+ с получением соединения формулы (XIVa): где А, X, Y, R1, R2, R3, Rb, Rc и символопределены как указано выше, которое подвергают каталитическому гидрированию, получая соединение формулы (XVa) где А, X, Y, R1, R2, R3, R4 и символопределены как указано выше, причем, используя такую же последовательность реакций можно получить соединение формулы (XVIIa"), частный случай соединений формулы (I/а), получаемое,исходя из диастереоизомера (XVa") где А, X, Y, R1, R2, R3, R4 и символопределены как указано выше, соединение формулы(XVIIb'), частный случай соединений формулы где А, X, Y, R1, R2, R3, R4 и символопределены как указано выше, соединение формулы(XVIIb"), частный случай соединений формулы где А, X, Y, R1, R2, R3, R4 и символопределены как указано выше, или соединение формулы (XIVa) последовательно подвергают воздействию восстановителя, такого как ВН 3, и затем гидрогенолизу, получая соединение формулы где А, X, Y, R1 , R2 , R3 и символопределены как указано выше, которое подвергают взаимодействию с формамидинацетатом или метилортоформиатом, получая соединение формулы(ХIХа), частный случай соединений формулы где А, X, Y, R1, R2, R3 и символопределены как указано выше, причем, используя такую же последовательность реакций, можно получить соединение формулы (ХIХb), частный случай соединений формулы (I/а), полученное, исходя из соответствующего соединения (XIVb) где А, X, Y, R1, R2, R3 и символопределены как указано выше, и указанные соединения формул (XVIIа'), (XVIIa"), (XVIIb'), (XVIIb"),(XIXa) и (XIXb) могут быть очищены по общепринятой методике разделения и превращены,если нужно, в их аддитивные соли с фармацевтически приемлемой кислотой или основанием. 24. Фармацевтическая композиция, содержащая в качестве активного ингредиента по меньшей мере одно соединение формулы (I) по любому из пп.1-21 или его аддитивную соль с фармацевтически приемлемой кислотой или основанием в комбинации с одним или несколькими фармацевтически приемлемыми наполнителями. 25. Фармацевтическая композиция по п.24 для использования при изготовлении лекарственного средства для лечения депрессии, ожирения, панических атак, тревожных состояний,обсессивно-компульсивных растройств, расстройств познавательной способности, фобий,импульсивных нарушений, связанных со злоупотреблением лекарственными средствами и синдромом их отмены, половых дисфункций и болезни Паркинсона.
МПК / Метки
МПК: A61P 25/24, A61K 31/4164, C07D 233/06
Метки: имидазолина, способ, фармацевтические, соединения, получения, содержащие, композиции, новые
Код ссылки
<a href="https://eas.patents.su/24-4536-novye-soedineniya-imidazolina-sposob-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения имидазолина, способ их получения и содержащие их фармацевтические композиции</a>




























