Нуклеозидный ингибитор для вгс (hcv)
Номер патента: 18935
Опубликовано: 29.11.2013
Авторы: Смит Дэвид Бернард, Калаянов Генадий, Йоханссон Нильс Гуннар, Мартин Джозеф Армстронг, Винквист Анна
Формула / Реферат
1. Соединение формулы I
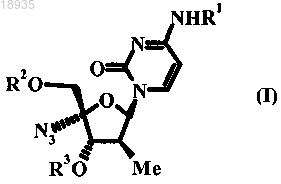
в которой
R1 представляет собой водород;
R2 и R3 независимо выбраны из группы, состоящей из водорода, COR4 и С(=O)CHR5NHR6; или R1 и R3 означают Н и R2 представляет собой монофосфатный, дифосфатный или трифосфатный сложный эфир;
R4 независимо выбран из группы, состоящей из C1-10 неразветвленного или разветвленного алкила;
R5 представляет собой изопропил, изобутил или втор-бутил;
R6 представляет собой водород;
или его фармацевтически приемлемые соли.
2. Соединение по п.1, в котором каждый R1, R2 и R3 представляет собой водород.
3. Соединение по п.1, в котором R1 представляет собой водород, R2 и R3 представляют собой COR4 и R4 представляет собой неразветвленный или разветвленный C1-10алкил, или его фармацевтически приемлемые соли.
4. Соединение по п.3, в котором R4 выбран из метила, этила, изопропила или трет-бутила, или его фармацевтически приемлемые соли.
5. Соединение по п.4, представляющее собой 3',5'-О-бис(изобутирил)-4'-азидо-2'-β-С-метил-2'-деоксицитидин.
6. Соединение по п.1, в котором R3 представляет собой водород или С(=O)CHR5NHR6R1 и R2 представляет собой C(=O)CHR5NHR6.
7. Соединение по п.1, в котором R5 представляет собой изопропил, изобутил или втор-бутил.
8. Соединение по п.1, в котором R5 имеет стереохимию L-аминокислоты.
9. Соединение по п.1, выбираемое из группы, состоящей из
3',5'-О-бис(изобутирил)-4'-азидо-2'-β-С-метил-2'-деоксицитидина,
3',5'-О-бис(L-валинил)-4'-азидо-2'-β-С-метил-2'-деоксицитидина,
4'-азидо-3'-О-(L-валинил)-2'-β-С-метил-2'-деоксицитидина,
4'-азидо-3'-O-изобутирил-2'-β-С-метил-2'-деоксицитидина,
5'-О-(L-валинил)-4'-азидо-2'-β-С-метил-2'-деоксицитидина,
5'-O-изобутирил-4'-азидо-2'-β-С-метил-2'-деоксицитидина;
или его фармацевтически приемлемая соль.
10. Применение соединения по п.1 для лечения или приготовления лекарственного средства для лечения заболевания, опосредованного вирусом гепатита С (ВГС).
11. Фармацевтическая композиция, ингибирующая вирус гепатита С, содержащая терапевтически эффективное количество соединения по п.1 и по меньшей мере один фармацевтически приемлемый носитель, разбавитель или эксципиент.
12. Фармацевтическая композиция, ингибирующая вирус гепатита С, содержащая терапевтически эффективное количество соединения по п.1 и а) по меньшей мере один фармацевтически приемлемый носитель, разбавитель или эксципиент и b) по меньшей мере один модулятор иммунной системы и/или по меньшей мере одно противовирусное средство, которое ингибирует репликацию ВГС.
Текст
НУКЛЕОЗИДНЫЙ ИНГИБИТОР ДЛЯ ВГС (HCV) 4-Амино-1-2R,3S,4S,5R)-5-азидо-4-гидрокси-5-гидроксиметил-3-метилтетрагидрофуран-2 ил)-1 Н-пиримидин-2-он (22) представляет собой ингибитор полимеразы вируса гепатита С (ВГС/HCV). Также раскрыты композиции и способы ингибирования ВГС и лечения заболеваний,опосредованных ВГС, способы изготовления соединений и синтетических промежуточных продуктов, использованных в осуществлении способа. Йоханссон Нильс-Гуннар, Калаянов Генадий (SE), Мартин Джозеф Армстронг (GB), Смит Дэвид Бернард Данное изобретение относится к нуклеозидным соединениям и некоторым их производным, которые являются ингибиторами РНК-зависимой РНК-полимеразы вируса. Данные соединения представляют собой ингибиторы РНК-зависимой репликации РНК вируса и применимы для лечения РНК-зависимой РНК вирусной инфекции. Они особенно применимы в качестве ингибиторов NS5B полимеразы вируса гепатита С ВГС (HCV), в качестве ингибиторов репликации ВГС и для лечения инфекции гепатита С. Соединение относится к нуклеозидным ингибиторам репликации РНК репликона ВГС. В частности,изобретение связано с применением пиримидиновых нуклеозидных соединений в качестве ингибиторов субгеномной репликации РНК ВГС и фармацевтических композиций, содержащих указанные соединения. Вирус гепатита С является главной причиной хронического заболевания печени во всем мире.(Boyer, N. et al. J. Hepatol. 2000 32:98-112). Пациенты, инфицированные посредством ВГС, представляют собой группу риска по развитию цирроза печени и последующей гепатоцеллюларной карциномы и, следовательно, ВГС является главным указанием для трансплантации печени. ВГС был классифицирован как представитель семейства вирусов Flaviviridae, которое включает род флавивирусов, пестивирусов и гепацивирусов, из которых последний включает вирусы гепатита С (Rice С.М., Flaviviridae: The viruses and their replication, in: Fields Virology, Editors: Fields, B.N., Knipe, D.M., andHowley, P.M., Lippincott-Raven Publishers, Philadelphia, Pa., Chapter 30, 931-959, 1996). ВГС представляет собой вирус в оболочке, содержащий геном однонитевой РНК положительной полярности из приблизительно 9,4 т.п.н. Вирусный геном состоит из 5'-нетранслируемой области (UTR), длинной открытой рамки считывания, кодирующей полипротеиновый предшественник из приблизительно 3011 аминокислот, и короткой 3' UTR. 5' UTR является самой высокосохраняемой частью генома ВГС и важна для начала и контроля полипротеиновой трансляции. Генетический анализ HCV идентифицировал шесть главных генотипов, которые отличаются более чем 30% последовательности ДНК. Было произведено различение более чем 30 подтипов. В США приблизительно 70% инфицированных индивидуумов имеют инфекцию типа 1a и 1b. Тип 1b является самым преобладающим подтипом в Азии. (X. Forns and J. Bukh, Clinics in Liver Disease 1999 3:693-716; J. Bukh etal., Semin Liv. Dis. 1995 15:41-63). К сожалению, инфекции типа 1 являются более устойчивыми к терапии, чем типа 2 или генотипов 3 (N.N. Zein, Clin. Microbiol. Rev., 2000 13:223-235). Вирусные структурные белки включают нуклеокапсидный кор-белок (С) и два оболочечных гликопротеида, Е 1 и Е 2. ВГС также кодирует две протеазы, цинкзависимую металлопротеиназу, кодированную NS2-NS3 областью, и серинпротеазу, кодированную в NS3 области. Данные протеазы требуются для расщепления определенных областей предшественника-полипротеина в настоящие пептиды. Карбоксильная половина неструктурного белка 5, NS5B, содержит РНК-зависимую РНК полимеразу. Функция остальных неструктурных белков, NS4A и NS4B, и функция NS5A (аминоконцевая половина неструктурного белка 5) остаются неизвестными. Предполагают, что большинство неструктурных белков, кодированных посредством РНК генома ВГС, включены в репликацию РНК. В настоящее время имеется ограниченное число апробированных терапий, доступных для лечения ВГС инфекции. Новые и существующие терапевтические подходы к лечению ВГС и ингибированиюNS5B полимеразы ВГС рассмотрены в публикациях: R.G. Gish, Sem. Liver. Dis., 1999 19:5; Di Besceglie,A.M. and Bacon, B.R., Scientific American, October: 1999 80-85; G. Lake-Bakaar, Current and Future Therapy Рибавирин (1a; амид 1-2R,3R,4S,5R)-3,4-дигидрокси-5-гидроксиметилтетрагидрофуран-2-ил)-1H[1,2,4]триазол-3-карбоновой кислоты; виразол) представляет собой неинтерферон-индуцирующий противовирусный нуклеозидный аналог широкого спектра. Рибавирин обладает активностью in vitro против некоторых ДНК и РНК вирусов, включающих Flaviviridae (Gary L. Davis, Gastroenterology 2000 118:S104S114). При монотерапии рибавирин снижает сывороточные уровни аминотрансферазы до нормальных у 40% пациентов, но он не снижает сывороточных уровней ВГС-РНК. Рибавирин также проявляет значительную токсичность и, как известно, снижает анемию. Вирамидин 1b является пролекарством, превращаемым в 1 а в гепатоцитах. Интерфероны (IFNs) использовались для лечения хронического гепатита в течение почти десяти лет. IFNs представляют собой гликопротеиды, производимые иммунными клетками в ответ на вирусную инфекцию. Рассматривают два разных типа интерферонов: тип 1 включает несколько интерферонов 's и один интерферон , тип 2 включает интерферон . Интерфероны типа 1 производятся главным образом инфицированными клетками и защищают соседние клетки от новой (de novo) инфекции. IFNs ингибируют вирусную репликацию многих вирусов, включая ВГС, и при применении в качестве единственного лечения против инфекции гепатита С IFN подавляет сывороточную ВГС-РНК до неопределяемых уровней. Кроме того, IFN нормализует сывороточные уровни аминотрансферазы. К сожалению, эффекты IFN являются временными. Прекращение терапии дает 70% показатель рецидивов, и только 10-15% проявляют длительный вирологический ответ с нормальными сывороточными уровнями аланинтрансферазы.(L.-B. Davis, см. выше). Одно ограничение ранней IFN терапии состояло в быстром выведении белка из крови. Получение химических производных IFN с полиэтиленгликолем (PEG) привело к белкам с существенно улучшенными фармакокинетическими свойствами. PEGASYS представляет собой сопряженный интерферон 2 а и 40 kD разветвленный монометокси-PEG, и PEG-INTRON представляет собой конъюгат интерферона -2b и 12 kD монометокси-PEG. (В.A. Luxon et al., Clin. Therap. 2002 24 (9):1363-1383; A. Kozlowskiand J.M. Harris, J. Control. Release, 2001 72:217-224). Комбинированная терапия в отношении ВГС с рибавирином и -интерфероном в настоящее время представляет собой оптимальную терапию. Объединение рибавирина и PEG-IFN (см. ниже) дает пролонгированный ответ на вирус у 54-56% пациентов. SVR приближается к 80% для типа 2 и 3 ВГС. (Walker,см. выше). К сожалению, комбинация также дает побочные эффекты, которые ставят клинические проблемы. Депрессия, симптомы, подобные симптомам гриппа, и кожные реакции связаны с подкожнымIFN-, и гемолитическая анемия связана с продолжительным лечением рибавирином. В последующем был идентифицирован ряд потенциальных молекулярных мишеней для разработки лекарственных средств в качестве терапии против ВГС, включающих, но без ограничения только ими,NS2-NS3 аутопротеазу, N3 протеазу, N3 хеликазу и NS5B полимеразу. РНК-зависимая РНК полимераза является, безусловно, основной для репликации генома однонитевой РНК положительной полярности. Данный фермент вызвал значительный интерес среди химиков, связанных с медициной. Как нуклеозидные, так и ненуклеозидные ингибиторы NS5B известны. Нуклеозидные ингибиторы могут действовать либо как прерыватель цепи, либо как конкурирующий ингибитор, который препятствует присоединению нуклеотида к полимеразе. Для функционирования в качестве прерывателя цепи нуклеозидный аналог должен поглощаться клеткой и превращаться invivo в трифосфат, чтобы конкурировать за полимеразный нуклеотидный связывающий сайт. Данная конверсия в трифосфат обычно опосредована клеточными киназами, которая диктует дополнительные структурные требования к потенциальному нуклеозидному ингибитору полимеразы. Кроме того, это ограничивает прямую оценку нуклеозидов как ингибиторов репликации ВГС по анализу на клетках, допускающему фосфорилирование in situ. В документе WO 0190121, опубликованном 29 ноября 2001 г., J.-Р. Sommadossi и P. Lacolla раскрывают и показывают анти-ВГС полимеразную активность 1'-алкил- и 2'-алкилнуклеозидов формул 2 и 3. В документе WO 01/92282, опубликованном 6 декабря 2001 г., J.-P. Sommadossi и P. Lacolla раскрывают и показывают лечение против флавивирусов и пестивирусов 1'-алкил- и 2'-алкилнуклеозидами формул 2 и 3. В документах WO 03/026675 и WO 03/026589 - оба опубликованы 3 апреля 2003 г., G. Gosselin et al. раскрывают 4'-алкилнуклеозиды 4 и методы применения 4'-алкилнуклеозидов для лечения против флавивирусов и пестивирусов. В документах WO 2004003000 и WO 2004002999 - оба опубликованы 8 января 2004 г., J.-P. Sommadossi et al. раскрывают пролекарства 1'-, 2'-, 3'- и 4'-замещенных -D и -L нуклеозидов. В документе WO 04/002422, опубликованном 8 января 2004 г., J.-P. Sommadossi et al. раскрывают 3'-O-L-валиновый сложный эфир 2'-С-метилрибофуранозил цитидина и его применение в лечении против ВГС. Фирма Idenix опубликовала клинические опыты по родственному соединению NM283, которое представляет собой валиновый сложный эфир 5 цитидинового аналога 2 (В=цитозин). Кроме того, IdenixPharmaceuticals, Ltd. также раскрывает в документе WO 04/046331 мутации Flaviviridae, вызванные биологически активными 2'-разветвленными -D или -L нуклеозидами или их фармацевтически приемлемой солью или пролекарством. В документе WO 02/057425, опубликованном 25 июля 2002 г., S.S. Carroll et al. раскрывают нуклеозидные ингибиторы РНК-зависимой РНК полимеразы, где карбогидратная субъединица химически модифицирована. В документе WO 02/05787, опубликованном 25 июля 2002 г., S.S. Carroll et al. раскрывают производные, родственные 2-метил и 2-метилрибозе, в которых основа представляет собой необязательно замещенный 7 Н-пирроло[2,3-d]пиримидиновый радикал 6. Та же заявка раскрывает один пример 3 метилнуклеозида. S.S. Carroll et al. (J. Biol. Chem. 2003 278(14):11979-11984) раскрывают ингибирование полимеразы ВГС посредством 2'-О-метилцитидина (6 а). В документе U.S. Publication2004/0259934,опубликованном 23 декабря 2004 г., D.В. Olsen et al. раскрывают методы ингибирования репликации вируса Coronaviridae и лечения инфекции вируса Coronaviridae нуклеозидными соединениями.et al. раскрывают 4'-замещенные нуклеозидные производные, которые проявляют активность против ВГС. Четыре соединения, идентифицированные подробно, включают 4'-азидосоединение 7 а, 4'этинилсоединение 7b, 4'-этоксисоединение 7 с и 4'-ацетилсоединение 7d. Представленные модификации группировки рибозы включают 2'-деоксипроизводное 8 а, 3'-деоксипроизводное 8b, 3'-метоксипроизводное 8 е, 3'-фторпроизводное 8 с и 2',2'-дифторпроизводное 8d. В документе WO 2004/046159, опубликованном 3 июня 2004 г. (US 2004121980), J.A. Martin et al. раскрывают пролекарства 7 а, применимые для лечения заболеваний, опосредованных ВГС. Обе заявки США включены в описание ссылкой в полном объеме. Заявка США 10/167106, зарегистрированная 11 июня 2002 г. под заголовком "4'-Substituted Nucleoside Derivatives as Inhibitors of HCV RNA Replication", и заявка США 10/717260, зарегистрированная 19 ноября 2003 г., раскрывают соединения, родственные данному изобретению. Обе заявки включены в настоящее описание в полном объеме в качестве ссылки.G.S. Jeon and V. Nair (Tetrahedron 1996 52 (39):12643-50) раскрывают синтез 4'-азидометил-2',3'деоксирибонуклеозидов 10 (В=аденин, тимин и урацил) как ингибиторов обратной транскриптазы ВГС. Было опубликовано несколько расчетных исследований 4'-азидонуклеозидов: D. Galisteo et al., J.I. Sugimoto et al. раскрыли синтез и ВГС и Н. simplex биоанализ 4'-этинил-2'-деоксицитидина (11) и других заместителей с двумя атомами углерода в 4'-положении (Nucleosides and Nucleotides. 183. Synthesis of 4'-(3-Branched Thymidines as a New Type of Antiviral Agent, Bioorg. Med. Chem. Lett. 1999 9:385-88).T. Wada et al. (Nucleosides and Nucleotides 1996 15 (1-3):287-304) раскрывают синтез и активность против ВГС 4'-С-метилнуклеозидов. В документе WO 01/32153, опубликованном 10 мая 2001 г., R. Storer раскрывают методы лечения или профилактики вирусной инфекции от представителей семейства Flaviviridae введением диоксолановых аналогов нуклеозидов. В документе WO 02/18404, опубликованном 7 марта 2002 г., R. Devos et al. раскрывают новые и известные пуриновые и пиримидиновые нуклеозидные производные и их применение в качестве ингибиторов субгеномной репликации ВГС и фармацевтические композиции, содержащие указанные нуклеозидные производные. Раскрытые соединения состоят из нуклеозидов с замещенными пуриновыми и пиримидиновыми основаниями. ЕРА No. 0352248 раскрывает широкий класс L-рибофуранозилпуриновых нуклеозидов для лечения ВГС, герпеса и гепатита. Такое же описание изобретения находится в заявке WO 88/09001, поданной фирмой Aktiebolaget Astra. К. Kitano et al. (Tetrahedron 1997 53 (39):13315-13322) раскрывает синтез 4'-фторметил-2-деокси-Dэритро-, рибо- и арабино-пентофуранозилцитозинов и противоопухолевую активность. Ненуклеозидные аллостерические ингибиторы обратной транскриптазы ВГС проявили эффективную терапию сами по себе и в комбинации с нуклеозидными ингибиторами и с ингибиторами протеазы. Были описаны некоторые классы ненуклеозидных ингибиторов NS5B ВГС и в настоящее время находятся на разных стадиях разработки, причем они включают бензимидазолы, (Н. Hashimoto et al. WO 01/47833, H. Hashimoto et al. WO 03/000254, P.L. Beaulieu et al. WO 03/020240 A2; P.L. Beaulieu et al. US 6448281 B1; P.L. Beaulieu et al. WO 03/007945 A1); индолы (Р.L. Beaulieu et al. WO 03/0010141 A2); бензотиадиазины, например 1 (D. Dhanak et al. WO 01/85172 A1, зарегистрированная 5/10/2001; D. Chai et al.,WO 2002098424, зарегистрированная 6/7/2002, D. Dhanak et al. WO 03/037262 A2, зарегистрированная 10/28/2002; K.J. Duffy et al. WO 03/099801 A1, зарегистрированная 5/23/2003, M.G. Darcy et al. WO 2003059356, зарегистрированная 10/28/2002; D. Chai et al., WO 2004052312, зарегистрированная 6/24/2004, D. Chai et al., WO 2004052313, зарегистрированная 12/13/2003; D.M. Fitch et al., WO 2004058150, зарегистрированная 12/11/2003; D.K. Hutchinson et al. WO 2005019191, зарегистрированная 8/19/2004; J.K. Pratt et al. WO 2004/041818 A1, зарегистрированная 10/31/2003); тиофены, например 2, (С. Ингибиторы протеазы ВГС, требуемой для вирусной репликации, также были раскрыты (F. McPheeet al., Drugs of the Future 2003 28 (5):465-488; Y.S. Tsantrizos et al., Angew. Chem. Int. Ed. Eng. 2003 42 (12): 1356-1360). Нуклеозидное соединение данного изобретения можно применять в комбинации с этими и другими ингибиторами полимеразы и протеазы. Результаты этих попыток были рассмотрены (J.Z. Chen and Z. Hong, Targeting NS5B RNA-DependentRNA Polymerase for Anti-HCV Chemotherapy, Curr. Drug Targ. Inf. Dis. 2003 3(3): 207-219). Ненуклеозидные ингибиторы не имеют отношения к данному изобретению. Цель данного изобретения состоит в том, чтобы предложить новые нуклеозидные соединения, способы и композиции для лечения хозяина, инфицированного вирусом гепатита С. В настоящее время отсутствует профилактическая обработка вируса гепатита С (ВГС), и принятые в настоящее время терапии, которые существуют только против ВГС, являются ограниченными. Создание и разработка новых фармацевтических соединений является важной. Неожиданно было установлено, что 2'-деокси-2'метил-4'-азидоцитидин или его сложные эфиры применимы в лечении против ВГС и проявляют меньшую токсичность после введения хозяину. Данное изобретение также относится к фармацевтическим композициям из соединения и по меньшей мере одно-4 018935 го фармацевтически приемлемого носителя, эксципиента или разбавителя. Комбинированная терапия оказалась полезной для лечения вирусного заболевания и новых соединений, синергистических с другой принятой и исследованной терапией против ВГС, и данное изобретение относится к обработке ВГС нуклеозидами общей формулы, раскрытой выше, или фармацевтически приемлемой солью в комбинации или чередованием с одним или несколькими другим(и) эффективным(и) противовирусным(и) средством(ами) или иммуномодуляторами, необязательно включающими по меньшей мере один фармацевтически приемлемый носитель, эксципиент или разбавитель. Данное изобретение относится к нуклеозиду формулы I или его фармацевтически приемлемой соли и к применению таких соединений для лечения хозяина, инфицированного посредством ВГС,где R1 представляет собой водород;R2 и R3 независимо выбраны из группы, состоящей из водорода, COR4 и С(=O)CHR5NHR6; или R1 и 3R означают Н и R2 представляет собой монофосфатный, дифосфатный или трифосфатный сложный эфир;R4 независимо выбран из группы, состоящей из C1-10 неразветвленного или разветвленного алкила;R6 представляет собой водород; или его фармацевтически приемлемые соли. В предпочтительном варианте изобретение относится к соединению, в котором каждый R1, R2 и R3 представляют собой водород. В более предпочтительном варианте изобретение относится к соединению, в котором R1 представляет собой водород, R2 и R3 представляют собой COR4 и R4 представляет собой неразветвленный или разветвленный C1-10 алкил или его фармацевтически приемлемые соли. В еще более предпочтительном варианте изобретение относится к соединению, в котором R4 выбран из метила, этила, изопропила или трет-бутила или его фармацевтически приемлемые соли. В наиболее предпочтительном варианте изобретение относится к 3',5'-O-бис(изобутирил)-4'-азидо 2'С-метил-2'-деоксицитидину. В другом варианте изобретение относится к соединению, в котором R3 представляет собой водород или С(=O)CHR5NHR6R1, и R2 представляет собой С(=O)CHR5NHR6. В предпочтительном варианте изобретение относится к соединению, в котором R5 представляет собой изопропил, изобутил или вторбутил. В более предпочтительном варианте изобретение относится к соединению, в котором R5 имеет стереохимию L-аминокислоты. В наиболее предпочтительном варианте изобретение относится к соединению, выбранному из группы, состоящей из 3',5'-O-бис(изобутирил)-4'-азидо-2'С-метил-2'-деоксицитидина,3',5'-O-бис(L-валинил)-4'-азидо-2'С-метил-2'-деоксицитидина,4'-азидо-3'-О-(L-валинил)-2'С-метил-2'-деоксицитидина,4'-азидо-3'-O-изобутирил-2'С-метил-2'-деоксицитидина,5'-О-(L-валинил)-4'-азидо-2'С-метил-2'-деоксицитидина,5'-O-изобутирил-4'-азидо-2'С-метил-2'-деоксицитидина; или его фармацевтически приемлемая соль. Данное изобретение также относится к применению соединения формулы I или фармацевтически приемлемой соли, необязательно, в комбинации с другим эффективным противовирусным средством(ами) и необязательно с включением по меньшей мере одного фармацевтически приемлемого носителя, эксципиента или разбавителя для лечения инфекции ВГС в изготовлении лекарственного средства для лечения и профилактики ВГС у хозяина. В предпочтительном варианте изобретение относится к применению соединения формулы I для лечения или приготовления лекарственного средства для лечения заболевания, опосредованного вирусом гепатита С (ВГС). Без привлечения теории предполагают, что соединения по изобретению последовательно фосфорилируются в клетках человека киназами до 5'-О-монофосфата, 5'-О-дифосфата и, в конечном счете, до 5'О-трифосфата, который представляет собой активный против вируса метаболит. Следующий аспект изобретения, следовательно, относится к этим 5'-О-фосфорилированным видам, т.е. к соединениям формулы ный сложный эфир. Противовирусная активность нуклеозидного ингибитора обычно представляет собой совместный результат поглощения нуклеозида в клетки хозяина, превращения нуклеозида в активный трифосфат,внутриклеточной устойчивости трифосфата и способности трифосфата влиять на активность синтеза РНК вирусной полимеразы. Как представлено в биологических примерах ниже, соединения изобретения легко фосфорилируются in vivo до активного трифосфата и имеют долгий период полураспада внутриклеточного трифосфата, тем самым допускают пролонгированные и высокие концентрации продуктов,активных против вирусов.II. Фармацевтическая композиция ингибирующая вирус гепатита С, содержащая терапевтически эффективное количество соединения по п.1, и остаток, содержащий по меньшей мере один фармацевтически приемлемый носитель, разбавитель или эксципиент. В другом варианте осуществления данного изобретения предлагается фармацевтическая композиция, ингибирующая вирус гепатита С, содержащая терапевтически эффективное количество соединения формулы I, и остаток, содержащий а) по меньшей мере один фармацевтически приемлемый носитель,разбавитель или эксципиент и b) по меньшей мере один модулятор иммунной системы и/или по меньшей мере одно противовирусное средство, которое ингибирует репликацию ВГС. В предпочтительном варианте осуществления данного изобретения предлагается фармацевтическая композиция, представляющая собой прессованную таблетку массой 500-1500 мг, содержащую 35-75 мас.% соединения формулы I, в которой R1, R2, R3, R4, R5 и R6 принимают значения, определенные в настоящем описании выше; или его фармацевтически приемлемую соль, и остаток, включающий по меньшей мере один фармацевтически приемлемый носитель, разбавитель или эксципиент. В другом варианте осуществления данного изобретения предлагается фармацевтическая композиция, представляющая собой прессованную таблетку массой 500-1500 мг, содержащую 40-60 мас.% соединения формулы I, в которой R1, R2, R3, R4, R5 и R6 принимают значения, определенные в настоящем описании выше; или его фармацевтически приемлемую соль, и остаток, включающий по меньшей мере один фармацевтически приемлемый носитель, разбавитель или эксципиент. Фраза "определенные/как определено в настоящем описании выше" относится к первому определению для каждой группы, данной в определении формулы I. Термины "необязательный" или "необязательно", как используются в настоящем описании, означают, что описанное явление или обстоятельство может происходить или не происходить и что данное описание включает примеры, где указанное явление или обстоятельство имеет место, и примеры, в которых оно отсутствует. Например, "необязательно замещенный фенил" означает, что фенил может быть или может не быть замещенным и что описание включает как незамещенный фенил, так и фенил, где есть замещение. Соединения данного изобретения могут иметь асимметрические центры на боковой цепи сложного карбоксильного эфира, амида или карбонатной группировки, которые образуют диастереомеры при присоединении к нуклеозиду. Все стереоизомеры боковой цепи соединений данного рассматриваемого изобретения обсуждены как в смесях, так и в чистом или в основном в чистом виде. Определение соединений согласно изобретению охватывает все как выделенные оптические изомерные энантиомеры, так и их смеси, включающие рацемическую форму. Чистый оптический изомер можно приготовить стереоспецифическим синтезом из -D-рибозы, или рацемическую форму можно разделить физическими методами,такими как, например, фракционированная кристаллизация, отделение или кристаллизация диастереомерных производных или отделение хиральной колоночной хроматографией. Отдельно взятые оптические изомеры можно получить из рацематов обычными методами, такими как, например, образование соли с оптически активной кислотой с последующей кристаллизацией. Термин "алкил", как используется в настоящем описании, означает углеводородный остаток с неразветвленной или разветвленной цепью, содержащий от 1 до 18 атомов углерода. Термин "низший алкил" означает углеводородный остаток с неразветвленной или разветвленной цепью, содержащий от 1 до 6 атомов углерода. Иллюстративные группы с низшим алкилом включают метил, этил, пропил, изопропил, н-бутил, изобутил, грет-бутил или пентил. Когда термин "алкил" использован как суффикс после другого термина, как в "фенилалкиле" или"гидроксиалкиле", это предназначено для отсылки к алкильной группе, определенной выше, которая замещена одним-двумя заместителями, выбираемыми из другой конкретно названной группы. Таким образом, например, "фенилалкил" относится к алкильной группе, имеющей один-два фенильных заместителя,и, таким образом, включает бензил, фенилэтил и бифенил. "Алкиламиноалкил" представляет собой алкильную группу, имеющую один-два алкиламиновых заместителя. Термин "галогеналкил", как используется в настоящем описании, означает алкильную группу с неразветвленной или разветвленной цепью, определенную выше, в которой 1, 2, 3 или более атомов водорода замещены галогеном. Примеры представляют собой 1-фторметил, 1-хлорметил, 1-бромметил, 1 иодметил, трифторметил, трихлорметил, трибромметил, трииодметил, 1-фторэтил, 1-хлорэтил, 1 бромэтил, 1-иодэтил, 2-фторэтил, 2-хлорэтил, 2-бромэтил, 2-иодэтил, 2,2-дихлорэтил, 3-бромпропил или 2,2,2-трифторэтил. Термин "циклоалкил", как используется в настоящем описании, означает насыщенное карбоциклическое кольцо, содержащее 3-8 атомов углерода, т.е. циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил. Термин "циклоалкилалкил", как используется в настоящем описании, относится к радикалу R'R-, в котором R' представляет собой циклоалкильный радикал, определенный в настоящем описании, и R представляет собой алкиленовый радикал, определенный в настоящем описании, с пониманием того, что точка присоединения циклоалкилалкильной группировки будет находиться на алкиленовом радикале. Примеры циклоалкилалкильных радикалов включают, но без ограничения только ими, циклопропилметил, циклогексилметил, циклопентилэтил. C3-7 циклоалкил-С 1-3 алкил относится к радикалу R'R, где R' представляет собой C3-7 циклоалкил и R представляет собой алкиленовый радикал, определенный в настоящем описании. Термин "алкилен", как используется в настоящем описании, означает дивалентный насыщенный нормальный углеводородный радикал из 1-8 атомов углерода или разветвленный насыщенный дивалентный углеводородный радикал из 3-8 атомов углерода, если не указано иное. Примеры алкиленовых радикалов включают, но без ограничения только ими, метилен, этилен, пропилен, 2-метилпропилен, бутилен,2-этилбутилен. Термин "алкенил", как используется в настоящем описании, означает незамещенный [или замещенный] углеводородный цепочечный радикал, имеющий от 2 до 18 атомов углерода, предпочтительно от 2 до 4 атомов углерода, и имеющий одну или две олефиновые двойные связи, предпочтительно одну олефиновую двойную связь. Примеры представляют собой винил, 1-пропенил, 2-пропенил (аллил) или 2 бутенил (кротил). Термин "алкинил", как используется в настоящем описании, означает незамещенный углеводородный цепочечный радикал, имеющий от 2 до 18 атомов углерода [предпочтительно от 2 до 4 атомов углерода] и имеющий одну или, где возможно, две тройные связи [предпочтительно одну тройную связь]. Примеры представляют собой этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил или 3-бутинил. Термин "алкокси", как используется в настоящем описании, означает алкоксигруппу с ненасыщенной неразветвленной или разветвленной цепью, где "алкильная" часть принимает значения, как определено выше, а именно метокси, этокси, н-пропилокси, изопропилокси, н-бутилокси, изобутилокси, третбутилокси, пентилокси, гексилокси, гептилокси, включая их изомеры. "Низшая алкокси", как используется в настоящем описании, означает алкоксигруппу с "низшей алкильной" группой, определенной ранее. Термин "алкилтио" или "тиоалкил", как используется в настоящем описании, означает (алкил)Sгруппу, в которой "алкильная" часть принимает значения, как определено выше. Примеры представляют собой метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио или трет-бутилтио. Термины "алкилсульфинил" или "арилсульфинил", как используются в настоящем описании, означают группу формулы -S(=O)R, в которой R представляет собой алкил или арил соответственно, и алкил и арил принимают значения, определенные в настоящем описании. Термины "алкилсульфонил" или "арилсульфонил", как используются в настоящем описании, означают группу формулы -S(=O)2R, в которой R представляет собой алкил или арил соответственно, и алкил и арил принимают значения, определенные в настоящем описании. Термин "арил", как используется в настоящем описании, означает необязательно замещенную моноциклическую или полициклическую ароматическую группу, содержащую атомы углерода и водорода. Примеры подходящих арильных групп включают, но без ограничения только ими, фенил и нафтил (например, 1-нафтил или 2-нафтил). Подходящие заместители для арила выбраны из группы, состоящей из алкила, алкенила, алкинила, арилокси, циклоалкила, ацила, ациламино, алкокси, амино, алкиламино, диалкиламино, галогена, галогеналкила, гидрокси, нитро и циано. Термин "ацил" ("алкилкарбонил"), как используется в настоящем описании, означает группу формулы -C(=O)R, в которой R представляет собой водород, неразветвленный или разветвленный алкил,содержащий 1-7 атомов водорода, или фенильную группу. Термины "алкоксикарбонил" и "арилоксикарбонил", как используются в настоящем описании, означают группу формулы -C(=O)R, в которой R представляет собой алкил или арил соответственно, и алкил и арил принимают значения, определенные в настоящем описании. Термин галоген имеет силу для фтора, хлора, брома или иода, предпочтительно для фтора, хлора,брома. Термин "ацилирующий агент", как используется в настоящем описании, относится либо к ангидриду, ацилгалогениду, либо к другому активированному производному карбоновой кислоты. Термин "ангидрид", как используется в настоящем описании, относится к соединениям общей формулы RC(О)-OС(О)R, где R принимает значения, определенные в предыдущем разделе. Термин "ацилгалогенид", как используется в настоящем описании, относится к группе RC(O)X, в которой X представляет собой бром или хлор. Термин "активированное производное" соединения, как используется в настоящем описании,относится к переходной реакционноспособной форме первоначального соединения, которая предоставляет соединение, активное в требуемой химической реакции, в которой первоначальное соединение яв-7 018935 ляется только умеренно реакционноспособным или нереакционноспособным. Активация достигается образованием производного или химической группировки внутри молекулы с более высоким содержанием свободной энергии, чем энергия первоначального соединения, и это помогает активированной форме быть более чувствительной к взаимодействию с другим реагентом. В контексте данного изобретения активация карбоксильной группы является особенно важной. Термин ацилирующий агент, как используется в настоящем описании, дополнительно включает реагенты, которые образуют сложные эфиры карбонатов OC(=O)OR4, где R4 принимает значения, определенные в настоящем описании выше. Термин "защитная группа", как используется в настоящем описании, обозначает химическую группу, которая (а) предохраняет реакционноспособную группу от участия в нежелательной химической реакции и (b) может быть легко удалена после того, как защита реакционной группы больше не требуется. Например, триалкилсилил представляет собой защитную группу для первичной гидроксильной функциональной группы и ацетонид представляет собой защитную группу для вицинального диола. В графическом представлении соединений, раскрытых в этой заявке, связь в виде утолщенного конусообразного клина указывает заместитель, который находится перед плоскостью кольца, которому принадлежит асимметрический углерод (также обозначенный ), и пунктирная конусообразная, имеющая форму клина связь указывает заместитель, который находится за плоскостью кольца, которому принадлежит асимметрический углерод (также обозначенный ). Термин "комбинация" или "комбинированная терапия", как используется в настоящем описании,относится к введению многих лекарственных средств в лечебную схему одновременным или последовательным внесением лекарственных средств в одно и то же время или в разные периоды времени. Термин "интерферон, полученный химическим путем", как используется в настоящем описании,относится к молекуле интерферона, ковалентно присоединенной к полимеру, который изменяет физические и/или фармакокинетические свойства интерферона. Неограничивающий перечень таких полимеров включает гомополимеры полиалкиленоксида, такие как полиэтиленгликоль (PEG) и полипропиленгликоль (PPG), полиоксиэтиленированные полиолы, их сополимеры и их блок-сополимеры, при условии,что поддерживается водная растворимость блок-сополимеров. Специалист в данной области будет осведомлен о разных подходах к связыванию полимера и интерферона (например, см. A. Kozlowski and J.M.Harris J. Control. Release 2001 72(1-3): 217-24). Неограничивающий перечень химически полученногоIFN, рассмотренного в данном патенте, включает пегинтерферон 2 а (PEGASYS) и пегинтерферон-2b (PEGINTRON). Соединения формулы I проявляют таутомерию. Таутомерные соединения могут существовать в виде двух или более взаимопревращаемых формах. Прототропные таутомеры получаются от миграции ковалентно связанного водородного атома между двумя атомами. Таутомеры обычно существуют в равновесии и попытки выделить отдельно взятые таутомеры обычно дают смесь, химические и физические свойства которой соответствуют смеси соединений. Положение равновесия зависит от химических образований внутри молекулы. Например, во многих алифатических альдегидах и кетонах, таких как ацетальдегид, кетоформа преобладает, в то время как в фенолах преобладает енольная форма. Обычные прототропные таутомеры включают кето/енольные (-С(=О)-СН-С(-ОН)=СН-), кислотные амид/имидные (-C(=O)-NH-C(-OH)=N-) и амидиновые (-C(=NR)-NH-C(-NHR)=N-) таутомеры. Последние два типа особенно свойственны для гетероарильных и гетероциклических колец, и данное изобретение охватывает все таутомерные формы соединений. Обычно используемые сокращения включают ацетил (Ас), азо-бис-изобутирилнитрил (AIBN), атмосферы (Atm), трет-бутоксикарбонил (Boc), ди-трет-бутилпирокарбонат или boc ангидрид (ВОС 2 О),бензил (Bn), бутил (Bu), бензилоксикарбонил (CBZ или Z), карбонилдиимидазол (CDI), 1,4 диазабицикло[2.2.2]октан (DABCO), 1,5-диазабицикло[4.3.0]нон-5-ен (DBN), 1,8-диазабицикло[5.4.0] ундец-7-ен (DBU), N,N'-дициклогексилкарбодиимид (DCC), 1,2-дихлорэтан (DCE), дихлорметан (DCM),диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD), диизобутилалюминийгидрид(ДМСО/DMSO), 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид (EDCI, этил (Et), этилацетат (EtOAc), этанол (EtOH), этиловый эфир 2-этокси-2 Н-хинолин-1-карбоновой кислоты (EEDQ), диэтиловый эфир (Et2O), О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфатуксусная кислота (HATU), (НОАс), 1-N-гидроксибензотриазол (HOBt), высокоэффективная жидкостная хроматография (ВЭЖХ/HPLC), литийгексаметилдисилазан (LiHMDS), метанол (МеОН), температура плавления хроматография (TCX/TLC), тетрагидрофуран (ТГФ/THF), триметилсилил или Me3Si (TMS), птолуолсульфоновая кислота моногидрат (TsOH или pTsOH), 4-Me-C6H4SO2- или тозил (Ts), N-уретан-Nкарбоксиангидрид (UNCA). Общепринятые названия, включающие префиксы нормальный (n), изо (i-),вторичный (sec-), третичный (tert-) и нео/nec, имеют их обычное значение при применении с алкильной группировкой. (J. Rigaudy and D.P. Klesney, Nomenclature in Organic Chemistry, IUPAC 1979 PergamonPress, Oxford). Соединения данного изобретения можно делать разными способами, изображенными в иллюстративных схемах реакций синтеза, показанных и описанных ниже. Исходные продукты и реагенты, использованные в приготовлении данных соединений, обычно либо доступны от коммерческих поставщиков,таких как Aldrich Chemical Co., либо приготовлены способами, известными специалистам в данной области, по процедурам, представленным в ссылках, таких как Fieser and Fieser's Reagents for Organic Synthesis; WileySons: New York, Volumes 1-21; R.C. LaRock, Comprehensive Organic Transformations, 2ndPergamon, Oxford 1996, vol. 1-11; и Organic Reactions, WileySons: New York, 1991, Vol. 1-40. Следующие схемы реакций синтеза являются только иллюстративными по некоторым способам, посредством которых можно синтезировать соединения данного изобретения, и разные модификации данных схем реакций синтеза могут быть сделаны и будут предложены специалисту в данной области, имеющей отношение к раскрытию, содержащемуся в данной заявке. Исходные продукты и промежуточные продукты схем реакций синтеза можно выделять и очищать,если требуется, используя общепринятые процедуры, включающие, но без ограничения только ими,фильтрование, перегонку, кристаллизацию, хроматографию и тому подобное. Такие продукты можно характеризовать, используя обычные средства, включающие физические константы и спектральные данные. Если не указано иное, реакции, описанные здесь, предпочтительно проводят в инертной атмосфере при атмосферном давлении и в интервале температур реакции от примерно -78 до примерно 150 С,предпочтительнее от примерно 0 до примерно 125 С и наиболее предпочтительно и удобно при примерно комнатной температуре (или окружающей среды), например примерно 20 С. Хотя химические модификации 2' и 3' положений нуклеозидов были изучены, модификация 4' положения была менее установленной больше всего из-за дополнительных синтетических проблем, связанных с их синтезом. Maag et al. (Anti-HIV Activity of 4'-Azido and 4'-Methoxynucleosides, J. Med. Chem. 1992 35: 1440-1451) раскрывают синтез 4'-азидо-2-деоксирибонуклеозидов и 4-азидонуклеозидов. С.О.Yang et al. (Tetrahedron Lett. 1992 33(1): 37-40 и 33(1): 41-44) раскрывают синтез 4'-циано, 4'гидроксиметил- и 4'-формилнуклеозидных производных замещенных нуклеозидов. Данные соединения были оценены в качестве соединений против ВГС. Maag et al. (см. выше) показали, что 4'азидонуклеозиды 16 с можно приготовить добавлением азида иода к 5-метилентетрагидрофуран-2-ил нуклеозидам 15, где В означает тимин, урацил, аденин или гуанозин. В U.S. Patent Pub.20050038240, опубликованном 17 февраля 2005 г., Т.J. Connolly et al. раскрывают улучшенную процедуру для приготовления 4'-азидонуклеозидов. В WO 02/100415 R. Devos et al. раскрывают новые 4'-замещенные нуклеозидные производные, которые ингибируют участок NS5B вирусной ДНК полимеразы ВГС. Добавление азида иода наиболее эффективно выполнено на уридинах 15(В=урацил), которые могут быть превращены в соответствующий цитидин при применении метода, описанного A.D. Borthwick et al. (J. Med. Chem. 1990 33(1): 179; см. также K.J. Divakar and C. B. Reese J.Iribarren, EP547008 A1, озаглавленный "Preparation of new (2'R)- and (2'S)-2'-deoxy-2'-C-hydroxycarbyl antisense oligonucleotides useful in scientific research, therapeutics and diagnostics", опубликованный 16 июня 1993 г.), применяя процедуру Maag et al. (см. выше) (схема А). 4-Амино-1-(5-азидо-4-гидрокси-5 гидроксиметил-3-метилтетрагидрофуран-2-ил)-1 Н-пиримидин-2-он (22) проявляет хорошую активность в клетке на основе анализа репликона по активности полимеразы ВГС (табл. I). Кроме того, соединения обладают низкими уровнями цитотоксичности в анализе. Таблица I Нуклеозидные производные часто являются потенциальными противовирусными (например, HIV,HCV, простой герпес, CMV) и противораковыми химиотерапевтическими средствами. К сожалению, их практическое применение часто ограничено двумя факторами. Во-первых, слабые фармакокинетические свойства часто ограничивают абсорбцию нуклеозида из кишки и внутриклеточную концентрацию нуклеозидных производных и, во-вторых, субоптимальные физические свойства ограничивают выборы композиций, которые могли бы использоваться для усиления доставки активного ингредиента.Albert ввел термин пролекарство, чтобы описать соединение, которому не хватает внутренней биологической активности, но которое способно к метаболическому превращению в активное лекарственное средство (A. Albert, Selective Toxicity Chapman and Hall, London, 1951). Пролекарства были рассмотрены в последнее время (P. Ettmayer et al., J. Med. Chem. 2004 47 (10): 2393-2404; K. Beaumont et al., Curr. Drug.groups and chemical entities in Design of Prodrugs, H. Bundgaard (ed) Elsevier Science Publishers, Amersterdam 1985; G.M. Pauletti et al. Adv. Drug Deliv. Rev. 1997 27:235-256; R.J. Jones and N. Bischofberger, Antiviral Res. 1995 27: 1-15 и С.R. Wagner et al., Med. Res. Rev. 2000 20: 417-45). В то время как метаболическое превращение может катализироваться определенными ферментами, большей частью гидролазами,активное соединение может также регенерироваться неспецифическими химическими процессами. Фармацевтически приемлемые пролекарства относятся к соединению, которое метаболизируется,например, гидролизуется или окисляется в хозяине с образованием соединения данного изобретения. Биоконверсия должна происходить в обход образования фрагментов с токсикологическими склонностями. Типичные примеры пролекарств включают соединения, которые имеют биологически лабильные защитные группы, присоединенные к функциональной группировке активного соединения. Алкилирование, ацилирование или другие липофильные модификации гидроксигрупп(ы) на группировке сахара были использованы в создании пронуклеотидов. Данные пронуклеотиды могут гидролизоваться или деалкилироваться in vivo с получением активного соединения. Факторы, ограничивающие пероральную биодоступность, часто представляют собой абсорбцию из желудочно-кишечного тракта и рано происходящее выделение кишечной стенкой и печенью. Оптимизация внутриклеточной абсорбции через GI тракт требует D(7,4) больше чем 0. Оптимизация коэффициен- 10018935 та распределения, однако, не обеспечивает успех. Пролекарство может избежать активной утечки транспортеров в энтероците. Внутриклеточный метаболизм в энтероците может приводить к пассивному транспорту или активному транспорту метаболита посредством насосов для оттока обратно в кишечную полость. Пролекарство должно также противостоять нежелательной биотрансформации в крови перед тем, как реагировать с целевыми клетками или рецепторами. Хотя предполагаемые пролекарства иногда можно создать рационально на основе химических функциональных групп, присутствующих в молекуле, химическая модификация активного соединения производит полностью новый молекулярный объект, который может проявлять нежелательные химические и биологические свойства, отсутствующие в исходном соединении. Регулирующие требования для идентификации метаболитов могут создать проблемы, если кратные пути метаболизма ведут ко множеству метаболитов. Таким образом, идентификация пролекарств остается неопределенным и проблемным осуществлением. Кроме того, оценка фармакокинетических свойств потенциальных пролекарств представляет собой проблемную и дорогостоящую попытку. Фармакокинетические результаты от животных моделей могут быть трудными для экстраполяции на людей. В патенте США 6846810, выданном 25 января 2005 г., J.А. Martin et al. показали, что ацилированные 4'-азидонуклеозиды, как установлено, были эффективными пролекарствами. Диацильные производные 23 соединения 22 можно приготовить ацилированием исходного нуклеозида 22. Соединения данного изобретения в подходящем случае готовят в одну стадию ацилированием соединения 22 в водном органическом растворителе. Растворитель может представлять собой либо гомогенный водный раствор, либо двухфазный раствор. рН водного органического растворителя устанавливают выше 7,5 добавлением основания, чтобы нейтрализовать кислоту, образованную ацилированием. Основание может представлять собой либо щелочь или гидроксид щелочного металла, либо третичный амин. Реакцию проводят в присутствии DMAP, который, как известно в данной области, является катализатором ацилирования. Преимущество данного способа состоит в том, что требуемый продукт можно получить без ацилирования гетероциклического основания. В альтернативном случае ацилирование удобным образом проводят с помощью соответствующего ацилгалогенида или ангидрида в растворителе, таком как DCM, хлороформ, четыреххлористый углерод,диэтиловый эфир, ТГФ, диоксан, бензол, толуол, MeCN, ДМФА, раствор гидроксида натрия или сульфолан необязательно в присутствии неорганического или органического основания при температуре от -20 до 200 С, но предпочтительно при температуре от -10 до 160 С. Реакцию ацилирования можно также проводить по Шоттен-Бауману в бифазной водно-органической среде в присутствии межфазного катализатора и DMAP. Может быть достигнуто селективное ацилирование гидроксигрупп. В альтернативном случае Nацильную группу N,O,O-триацилнуклеозида можно селективно разложить с помощью бромида цинка с получением защищенного диацильного соединения (R. Kierzek et al. Tetrahedron Lett. 1981 22(38): 376264). Селективное ацилирование определенных гидроксильных групп на карбогидратном радикале может быть выполнено в удобном случае с помощью фермента, катализирующего ацилирование или деацилирование. Ферментативный катализ обеспечивает мягкие селективные условия для органических преобразований. S.М. Roberts рассмотрел препаративные биологические преобразования (J. Chem. Soc.Perkin 1, 2001, 1475; 2000, 611; 1999, 1 и 1998, 157). М. Mahmoudian et al. (Biotechnol. Appl. Biochem. 1999 29: 229-233) сообщил о селективном ацилировании 5'-положения 2-амино-9D-арабинфуранозил-6 метокси-9 Н-пурина с помощью новоцима 435, иммобилизированного препарата из липазы Candida antarctica. Другие опубликованные ферменты со способностью селективно ацилировать 5'-гидроксил включают протеазу из Bacillus licheniformis, липоцим IM (липазу из Mucor miehei, CLEC-BL (протеазу из В.licheniformis), савиназу (протеазу из Bacillus sp.), новоцим-243 (протеазу из Bacillus licheniformis), липазу из Alcaligenes sp. и липолазу (ново). Ферментный препарат липолаза (липаза из Thermomyces lanuginosus, Sigma каталогL 0777) была выявлена для того, чтобы селективно гидролизовать 5'-ацильную группу триацилпроизводных для предоставления 2',3'-диацильных соединений. В WO 2004043894, G.G. Heraldsson et al. раскрывают применение липазы из Т. lanuginosus для эстерификации жиров из морских организмов. N. Weber et al. (Eur.J. of Lipid Sci. and Technol. 2003 105 (10): 624-626) раскрывают трансэстерификацию метилолеата, катализируемую с помощью T. lanuginosus. V. Bodai et al. (Adv. Synth. Cat. 2003 345(6 и 7): 811-818) описывают новые гидролазы из термофильных нитевидных грибов, которые можно использовать для селективных биологических преобразований. Другие сообщения о региоселективном ферментативном гидролизе сложного эфира включают следующие публикации: R. Hanson et al., Bioorg. and Med. Chem. 2000, 2681-2687 (Synthesis of a lobucavirGoodhue et al. WO 9403625 (Regioselective process for resolution of carbohydrate monoesters); N.W. Boaz,WO 9115470 (Separation of alcohol-ester mixture by selective enzymatic hydrolysis); Y.S. Sanghvi et al. US 2002142307 (Regioselective hydrolysis of 3',5'-di-O-levulinylnucleosides); J. Garcia et al. J. Org. Chem. 2002,4513-4519 (Regioselective hydrolysis 3',5'-di-O-levulinylnucleosides); O. Kirk et al. Biocat and Biotransformation (1995) 91-7 (Lipase catalyzed regioselective acylation and deacylation of glucose derivatives). Специалист в данной области будет осознавать, что селективную эстерификацию можно выполнить с помощью стандартной химической методологии. Была описана селективная защита 5'-гидроксильной группы, которая создаст возможность для прямой эстерификации 2'-гидроксила или, в альтернативном случае, включения второй защитной группы, которая позволит удаление защиты и селективное ацилирование первичного спирта. Соединения данного изобретения могут быть приготовлены в широком разнообразии лекарственных форм для перорального введения и носителей. Пероральное введение может быть в форме таблеток,таблеток в оболочке, твердых и мягких желатиновых капсул, растворов, эмульсий, сиропов или суспензий. Соединения данного изобретения являются эффективными при введении посредством внесения суппозиториев, наряду с другими путями введения. Самый удобный способ введения обычно является пероральным, при этом используется удобная суточная схема приема лекарственного средства, которую можно корректировать согласно тяжести заболевания и реакции пациента на противовирусное медикаментозное лечение. Соединение или соединения данного изобретения, а также их фармацевтически применимые соли вместе с одним или несколькими общепринятыми эксципиентами, носителями или разбавителями могут быть помещены в форму фармацевтических композиций и стандартных дозировок. Фармацевтические композиции и стандартные лекарственные формы могут быть составлены из традиционных ингредиентов в общепринятых пропорциях, с или без дополнительных активных соединений, и стандартные лекарственные формы могут содержать любое подходящее эффективное количество активного ингредиента,соразмерное с предполагаемым интервалом суточной дозы, предназначенным для использования. Фармацевтические композиции можно применять в виде твердых частиц, таких как таблетки или наполненные капсулы, полутвердые частицы, порошки, композиции с пролонгированным высвобождением действующего вещества, или в виде жидкостей, таких как суспензии, эмульсии, или наполненные капсулы для перорального применения; или в форме суппозиториев для ректального или вагинального введения. Типичный препарат будет содержать от примерно 5 до примерно 95% активного соединения или соединений (мас./мас.). Термин "препарат" или "лекарственная форма" предназначен для включения как твердых, так и жидких композиций активного соединения, и специалист в данной области оценит, что активный ингредиент может существовать в разных препаратах в зависимости от требуемой дозы и фармакокинетических параметров. Термин "эксципиент", как используется в настоящем описании, относится к соединению, которое применяется для приготовления фармацевтической композиции и вообще безопасно, нетоксично и ни биологически, ни иным образом не востребовано, и включает эксципиенты, приемлемые для использования в ветеринарии, а также для фармацевтического использования человеком. Соединения данного изобретения можно вводить сами по себе, но большей частью будут вводиться в смеси с одним или несколькими подходящими фармацевтическими эксципиентами, разбавителями или носителями, выбираемыми относительно пути введения и стандартной фармацевтической практики."Фармацевтически приемлемая солевая" форма активного ингредиента вначале может также предоставлять активному ингредиенту требуемые фармакокинетические свойства, которые отсутствуют в несолевой форме, и могут даже положительно влиять на фармакодинамику активного ингредиента, что касается его терапевтической активности в организме. Фраза "фармацевтически приемлемая соль" соединения, как используется в настоящем описании, означает соль, которая является фармацевтически приемлемой и которая обладает требуемой фармакологической активностью исходного соединения. Такие соли включают: (1) кислотно-аддитивные соли, образованные с неорганическими кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и тому подобное; или образованные с органическими кислотами, такими как гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, яблочная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, 3-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2 этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, 4 хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 4-толуолсульфоновая кислота, камфорсульфоновая кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, салициловая кислота, муконовая кислота и тому подобное. Следует понимать, что все ссылки на фармацевтически приемлемые соли включают формы присоединения растворителя (сольваты) или кристаллические формы (полиморфы), определенные в настоящем описании, той же самой кислотно-аддитивной соли. Препараты в твердой форме включают порошки, таблетки, пилюли, капсулы, суппозитории и диспергируемые гранулы. Твердый носитель может представлять собой одно или несколько веществ, кото- 12018935 рые могут также действовать в качестве разбавителей, ароматизаторов, веществ, придающих растворимость, замасливателей, суспендирующих средств, связывающих средств, консервантов, таблеточных диспергаторов или инкапсулирующего материала. В порошках носитель обычно представляет собой тонкоизмельченное твердое вещество, которое находится в смеси с тонкоизмельченным активным компонентом. В таблетках активный компонент обычно смешан с носителем, обладающим необходимой связывающей способностью в подходящих пропорциях, и уплотнен в требуемой форме и размере. Подходящие носители включают, но без ограничения только ими, карбонат магния, стеарат магния, тальк,сахар, лактозу, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлозу, натрия карбоксиметилцеллюлозу, низкоплавкий воск, масло какао и тому подобное. Препараты в твердой форме могут содержать кроме активного компонента окрашивающие вещества, вкусовые добавки, стабилизаторы, буферные средства, искусственные и природные подсластители, диспергаторы, загустители, средства, способствующие растворению и тому подобное. Жидкие композиции также подходят для перорального введения и включают жидкую композицию,включающую эмульсии, сиропы, эликсиры и водные суспензии. Они включают препараты в твердой форме, которые предназначены для того, чтобы превращаться в препараты в жидкой форме незадолго перед применением. Эмульсии могут быть приготовлены в растворах, например в водных растворах пропиленгликоля, или могут содержать эмульгаторы, такие как лецитин, сорбитанмоноолеат или аравийская камедь. Водные суспензии можно приготовить диспергированием тонкоизмельченного активного компонента в воде с вязким продуктом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, натрия карбоксиметилцеллюлоза и другие хорошо известные суспендирующие средства. Соединения данного изобретения могут быть приготовлены для введения в виде суппозиториев. Низкоплавкий воск, такой как смесь глицеридов жирных кислот, или масло какао сначала расплавляют и активный компонент гомогенно диспергируют, например, перемешиванием. Расплавленную гомогенную массу затем выливают в формы по размеру, дают возможность охлаждаться и затвердевать. Соединения данного изобретения могут быть приготовлены для вагинального введения. Пессарии,тампоны, кремы, гели, пасты, пены или спреи, содержащие кроме активного ингредиента такие носители, как известные в данной области, являются уместными. Подходящие композиции наряду с фармацевтическими носителями, разбавителями и эксципиентами описаны в издании Remington: The Science and Practice of Pharmacy 1995, edited by E.W. Martin, MackPublishing Company, 19th edition, Easton, Pennsylvania. Специалист по технологии приготовления лекарственных средств может модифицировать композиции в пределах рекомендаций описания, чтобы иметь разные композиции для конкретного способа введения. Модификации данных соединений для представления их более растворимыми в воде или другом наполнителе, например, можно легко осуществить посредством незначительных изменений (например,солевая композиция), которые по силам обычному специалисту в данной области. Обычному специалисту в данной области также по силам модифицировать путь введения и схему приема лекарственного средства из определенного соединения, чтобы управлять фармакокинетикой данных соединений для максимального полезного эффекта в пациентах. Термин "терапевтически эффективное количество", как используется в настоящем описании, означает количество, требуемое для уменьшения симптомов заболевания в индивидууме. Доза будет устанавливаться по индивидуальным потребностям в каждом конкретном случае. Данная дозировка может меняться в широких пределах, причем зависит от многих факторов, таких как тяжесть заболевания,предназначенного для лечения, возраста и общего состояния здоровья пациента, других лекарственных средств, которыми лечат пациента, пути и формы введения и предпочтений и опыта привлеченного практикующего врача. Для перорального введения суточная дозировка от примерно 0,1 до примерно 10 г в сутки будет целесообразной в монотерапии и/или в комбинированной терапии. Предпочтительная суточная дозировка равна от примерно 0,5 до примерно 7,5 г в сутки, более предпочтительная от 1,5 до примерно 6,0 г в сутки. Обычно лечение начинается с большой исходной "нагрузочной дозы", чтобы быстро снизить или устранить вирус, с последующим снижением дозы до уровня, достаточного для предотвращения возврата инфекции. Обычный специалист в лечении заболеваний, представленных в настоящем описании, будет способен, без чрезмерного экспериментирования и основываясь на личных знаниях,опыте и раскрытиях данной заявки, определить терапевтически эффективное количество соединений данного изобретения для данного заболевания и пациента. Терапевтическая эффективность может быть установлена из оценок функционирования печени,включающих, но без ограничения только ими, уровни белков, а именно, сывороточных белков (например, альбумина, факторов свертывающей системы крови, щелочной фосфатазы, аминотрансферазы (например, аланинтрансаминазы, аспартаттрансаминазы), 5'-нуклеозидазы, глутаминилтранспептидазы и т.д.), синтез билирубина, синтез холестерина и синтез желчных кислот; метаболическую функцию печени, включающую, но без ограничения только этим, карбогидратный метаболизм, метаболизм аминокислот и аммиака. В альтернативном случае терапевтическую эффективность можно контролировать измерением ВГС-РНК. Результаты данных тестов позволят оптимизировать дозу. В вариантах осуществления изобретения активное соединение или соль можно вводить в комбина- 13018935 ции с другим противовирусным средством, таким как рибавирин, другим нуклеозидным ингибитором полимеразы ВГС, ненуклеозидным ингибитором полимеразы ВГС, ингибитором протеазы ВГС, ингибитором хеликазы ВГС или ингибитором фузии ВГС. Когда активное соединение или его производное или соль вводят в комбинации с другим противовирусным средством, активность может повышаться при сравнении с активностью исходного соединения. Когда лечение представляет собой комбинированную терапию, такое введение может быть одновременным или последовательным в отношении введения нуклеозидных производных. "Одновременное введение", как используется в настоящем описании, таким образом, включает введение средств в одно и то же время или в разные времена. Введение двух или более средств в одно и то же время может быть достигнуто посредством отдельной композиции, содержащей два или более активных ингредиентов, или, в основном, совместным введением двух или более лекарственных форм с одним активным средством. Будет подразумеваться, что отсылки данного описания к лечению простираются к профилактике, а также к лечению существующих состояний. Кроме того, термин "лечение" инфекции ВГС, как используется в настоящем описании, также включает лечение или профилактику, связанную с или опосредованную инфекцией ВГС, или ее клинических симптомов. Пример 1. Стадия 1. Раствор 18 а (2,17 г, 8,96 ммоль, 1 экв.), имидазола (732 мг, 10,7 ммоль, 1,2 экв.) и Ph3P(2,82 г, 10,7 ммоль, 1,2 экв.) в сухом ТГФ (30 мл) охлаждали на водяной бане со льдом и к данному раствору добавляли по каплям в течение 10 мин раствор иода (2,50 г, 9,85 ммоль, 1,1 экв.) в сухом ТГФ (10 мл). Реакционную смесь перемешивали при 0-5 С в течение следующих 10 мин. Водяную баню со льдом удаляли и реакционную смесь перемешивали при комнатной температуре в течение 70 ч. Реакционную смесь разбавляли с помощью DCM (200 мл) и промывали с помощью 0,5 М Na2S2O3 в насыщенном водном NaHCO3 (150 мл). Водный слой промывали DCM (450 мл). Объединенные органические экстракты сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали SiO2 хроматографией, применяя ступенчатое градиентное элюирование с помощью MeOH/DCM (1-5% об./об. МеОН) с получением 1,75 г(дд, 1 Н), 3,79 (м, 1 Н), 3,65 (м, 1 Н), 3,57 (дд, 1 Н), 3,47 (дд, 1 Н), 2,69 (м, 1 Н), 2,13 (д, 1 Н), 1,00 (д, 3H). Стадия 2. Раствор 18b (1,84 г, 5,22 ммоль) и 0,4 М метоксида натрия в МеОН (81 мл) перемешивали при 60 С в течение 5 ч и затем охлаждали на водяной бане со льдом. Пиридиниевую форму DOWEX Н+(приготовлена обработкой DOWEX Н+ пиридином (10 мл/г полимера), фильтрованием и промыванием с помощью МеОН перед применением) добавляли порциями, пока рН раствора не стала нейтральной (всего 5-6 г). Водяную баню со льдом удаляли и реакционную смесь перемешивали при комнатной температуре в течение 5 мин. Полимер удаляли фильтрованием и промывали с помощью МеОН (100 мл). Остаток суспендировали в 6% EtOH/DCM и вносили в колонку с SiO2 и элюировали EtOH/DCM градиентом(6-7% об./об. EtOH) с получением 0,942 г (80%) соединения 19, достаточно чистого для использования на следующей стадии. Стадия 3. Хлорид бензилтриэтиламмония (1,91 г, 8,4 ммоль, 2 экв.) и азид натрия (546 мг, 8,4 ммоль, 2 экв.) суспендировали в сухом MeCN (32 мл) и обрабатывали ультразвуком в течение нескольких минут. Полученную тонкую суспензию перемешивали при к.т. в течение 3 ч и затем фильтровали в атмосфере N2 в сухой ТГФ раствор (30 мл) соединения 19 (942 мг, 4,2 ммоль, 1 экв.). К данной смеси добавляли NMM (140 мкл, 0,106 ммоль, 0,3 экв.) и полученный раствор охлаждали на водяной бане со льдом и к нему добавляли по каплям в течение 1 ч раствор иода (1,81 г, 7,14 ммоль, 1,7 экв.) в сухом ТГФ(39 мл). Полученную реакционную смесь перемешивали при 0-5 С в течение дополнительных 2 ч. Добавляли N-ацетил-L-цистеин (69 мг, 0,035 ммоль, 0,1 экв.) и раствор перемешивали до тех пор, пока не исчезало выделение пузырьков. Добавляли NMM (2,31 мл, 21,0 ммоль, 5 экв.) и DMAP (513 мг, 4,2 ммоль, 1 экв.) с последующим капельным добавлением бензоилхлорида (1,1 мл, 9,24 ммоль, 2,2 экв.). Реакционную смесь перемешивали при 0-5 С в течение 30 мин, затем хранили в холодильнике в продолжение ночи. Как ТСХ, так и ЖХ-МС анализ показали завершение реакции. Добавляли МеОН (5 мл) и через несколько минут растворитель концентрировали на роторном испарителе до половины объема и затем при перемешивании добавляли раствор 0,1 М Na2S2O3 в насыщенном водном NaCO3 (300 мл) и смесь нагревали до комнатной температуры. Смесь экстрагировали с помощью DCM (150 мл) и водный слой дважды экстрагировали с помощью DCM (50 мл). Объединенные органические экстракты сушили(Na2SO4), фильтровали и концентрировали. Органическую фазу затем экстрагировали 5% лимонной кислотой и водную фазу промывали дважды с помощью DCM (250 мл). DCM экстракты сушили (Na2SO4),фильтровали и концентрировали в вакууме. Остаток очищали SiO2 хроматографией, применяя ступенчатое градиентное элюирование с помощью EtOH/DCM (0, 0,5, 0,75, 1,0, 1,5 и 2% EtOH) с получением 1,72 г (83%) соединения 20 а: 1 Н-ЯМР данные (CDCl3, 25 С):8,22-7,46 (7 Н), 6,49-6,39 (1 Н), 5,84 (дд, 1 Н),5,55-5,47 (1 Н), 3,85 (д, 1 Н), 3,74 (д, 1 Н), 3,18 (м, 1 Н), 1,09 (д, 3H). Стадия 4. Раствор соединения 20 а (1,72 г, 3,47 ммоль, 1 экв.) в DCM (155 мл) объединяли со смесьюBu4NHSO4 (825 мг, 2,43 ммоль, 0,7 экв.) и м-бензойной кислоты (359 мг, 2,29 ммоль, 0,66 экв.) в 1,75 М водном K2HPO4 (55 мл). Двухфазную систему интенсивно перемешивали при комнатной температуре и к ней добавляли в продолжение интервала в 1,5 ч две порции коммерчески доступной смеси реагентов,содержащей 55% МСРВА, 10% м-хлорбензойной кислоты и 35% Н 2 О (23,57 г, соответствующие 216,5 ммоль или 23,28 экв. МСРВА и 23,3 ммоль или 20,66 экв. м-хлорбензойной кислоты). Смесь интенсивно перемешивали при комнатной температуре в течение дополнительных 18 ч. ЖХ-МС анализ показал 96% протекание реакции. Добавляли раствор Na2S2O35H2O (35 г) в насыщенном водном NaHCO3(500 мл) и смесь интенсивно перемешивали при комнатной температуре в течение 30 мин. Органический слой отделяли и водный слой промывали с помощью DCM (210 мл). Объединенные органические слои промывали насыщенным водным NaHCO3 (40 мл). Водный NaHCO3 слой промывали с помощью DCM(210 мл). Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали. Остаток очищали SiO2 хроматографией, применяя градиентное элюирование с помощью EtOH/DCM (1-2% об./об.EtOH) с получением 1 г (56%) соединения 20b: 1H-ЯМР данные (CDCl3, 25 С):8,19 (ушир.с, 1 Н), 8,077,88 (4 Н), 7,65-7,36 (6 Н), 6,57-6,45 (1 Н), 5,64 (дд, 1 Н), 5,51-5,42 (1 Н), 4,80 (м, 2 Н), 3,24 (м, 1 Н), 1,09 (д,3H). Стадия 5. Сложный диэфир 20b (100 мг, 0,19 ммоль, 1 экв.) и 1,2,4-триазол (131 мг, 1,9 ммоль, 10 экв.) упаривали совместно из сухого пиридина и перерастворяли в сухом пиридине (1 мл). Раствор охлаждали на водяной бане со льдом и к нему добавляли по каплям в течение нескольких мин раствор POCl3(44 мкл, 0,475 ммоль, 2,5 экв.) в MeCN (0,5 мл). Реакционную смесь перемешивали при 0-5 С в течение следующих 5 мин и затем перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали до половины объема на роторном испарителе и затем обрабатывали насыщенным NH3 в этаноле (20 мл) и полученный раствор перемешивали при комнатной температуре в продолжение ночи. Остаток после упаривания очищали SiO2 хроматографией, применяя ступенчатое градиентное элюирование с помощью EtOH/DCM (6, 10, 15 и 20% об./об. EtOH) с получением 0,036 г (66%) соединения 22,которое было 98% чистоты по данным ЖХМС (2,0% контаминанта 2'-изомера). Данную реакцию повторяли с 900 мг соединения 20b с получением 270 мг (54%, 97% чистота) соединения 22 после хроматографии: 1 Н-ЯМР данные (ДМСО-d6, 25 С):7,69 (д, 1 Н), 7,14 (д, 2 Н), 6,32 (ушир.с, 1 Н), 5,72 (д, 1 Н), 5,78(2R,3S,4S,5R)-5-(4-Амино-2-оксо-2 Н-пиримидин-1-ил)-2-изобутирилоксиметил-4 метилтетрагидрофуран-3-иловый эфир изомасляной кислоты (25) рН Раствора соединения 22 (0,700 г, 2,48 ммоль) в ТГФ (7 мл) и разбавленного солевого раствора (7 мл) устанавливают до приблизительно 11 с помощью разбавленного водного KOH. В охлаждаемую льдом перемешиваемую бифазную реакционную смесь медленно (по каплям) добавляют изобутирилхлорид (1,0 г), в то время как рН устанавливают равным примерно 11 добавлением разбавленного водногоKOH, как требуется. Степень протекания реакции контролируют с помощью ВЭЖХ. Добавленный дополнительный 1 экв. изобутирилхлорида по данным ВЭЖХ указывает на почти полную конверсию. Реакционной смеси позволяют выдерживаться в течение ночи при комнатной температуре. Раствор разбавляют с помощью EtOAc (50 мл) и рН водной фазы устанавливают до значения приблизительно 7,5 с помощью конц. HCl. Фазы отделяют и органическую фазу промывают три раза водой и упаривают досуха с получением соединения 25. Пример 3. (2R,3S,4S,5R)-5-(4-Амино-2-оксо-2 Н-пиримидин-1-ил)-2-азидо-4-гидрокси-2-гидроксиметилтетрагидрофуран-3-иловый эфир пентановой кислоты (27) К суспензии дипентаноатного сложного эфира 26 (R=H-C4H9, 1,9 г, 3,46 ммоль) в МТВЕ (13 мл) и фосфатного буфера (15 мл, 5 мМ фосфата натрия и 0,1 М NaCl, установленный до рН примерно 6,5) до- 15018935 бавляют (примерно 2 мл) липолазы (липазы из Thermomyces lanuginosus, номер Sigma каталога L 0777). Реакционную смесь нагревают до 35 С и перемешивают в течение 2 ч. рН Реакционной смеси устанавливают при 6,5 добавлением NaHCO3. После 2 ч реакция доходит до 8% завершения. Добавляют дополнительные 2 мл липолазы и перемешивание продолжают в течение 6 ч, после чего добавляют дополнительную 2 мл аликвоту фермента и реакционную смесь перемешивают в течение еще 24 ч. К раствору добавляют ацетон (10 мл), МТВЕ (20 мл) и насыщенный солевой раствор (10 мл) и реакционную смесь нагревают до 50 С. Фазы отделяют и органическую фазу дважды экстрагируют теплым МТВЕ. Объединенные органические фазы дважды промывают горячим насыщенным солевым раствором, сушат(Na2SO4), фильтруют и концентрируют в вакууме. Пример 4. (2R,3S,4S,5R)-5-(4-Амино-2-оксо-2 Н-пиримидин-1-ил)-2-азидо-3-бутирилокси-4-метилтетрагидрофуран-2-илметиловый эфир тетрадекановой кислоты (28) Суспензию соединения 29 (1,0 г, 3,52 ммоль), винилмиристата (1,2 г, 4,57 ммоль), липазы из Candida antartica, иммобилизированной на поликрилатном полимере (0,30 г; Sigma каталогL4 777 от Novosome) и ТГФ (20 мл) нагревают при 60 С в продолжение ночи. ВЭЖХ показывает, что реакция является завершенной на 33%, и к смеси добавляют еще 2,4 мл винилмиристата и 0,3 г липазы. Через дополнительные 48 ч реакция является завершенной на 50%, и к смеси добавляют еще 0,3 г фермента и 3 мл винилмиристата. После приблизительно 80 ч (общее время реакции) превращение в моноэфир завершено. Сырую реакционную смесь фильтруют через целит и слой на фильтре промывают ТГФ. Объединенную органическую фазу упаривают. Остаток растворяют в МеОН (50 мл) и экстрагируют гексаном (220 мл). Метанольный раствор упаривают и остаток растворяют в EtOAc и промывают с помощью NaHCO3 иEtOAc, фазу сушат (Na2SO4), фильтруют и упаривают с получением 0,930 г соединения 28 (R=C13H27),которое очищают хроматографией на SiO2 с градиентным элюированием с помощью MeOH/DCM (0-10% МеОН). Пример 5. 3',5'-О-бис (L-валинил)-4'-азидо-2'C-метил-2'-деоксицитидин (34)N4-[(Диметиламино)метилен]-4'-азидо-2'С-метил-2'-деоксицитидин (32). Раствор соединения 22 (1,81 г, 6,42 ммоль) в ДМФА (30 мл) обрабатывают диметилацеталем диметилформамида (8,2 мл, 61,73 ммоль) и перемешивают в течение 1,5 ч при комнатной температуре. Раствор упаривают при пониженном давлении и совместно упаривают с этанолом. Кристаллизация из смеси этанол/простой эфир дает указанное в заголовке соединение 32. 3',5'-О-бис[N-(трет-Бутоксикарбонил)-L-валинил]-N4-[(диметиламино)метилен]-4'-азидо-2'Cметил-2'-деоксицитидин (33). К раствору соединения 32 (1,26 г, 3,74 ммоль) в смеси сухого ацетонитрила (30 мл) и ДМФА (15 мл) последовательно добавляют Boc-Val-OH (1,62 г, 7,48 ммоль), EDC (1,43 г, 7,48 ммоль), TEA (1,04 мл,7,48 ммоль) и DMAP (0,1 г). Полученную смесь перемешивают при комнатной температуре. Протекание реакции контролируют с помощью ВЭЖХ и в реакционную смесь повторно загружают Boc-Val-OH (0,63 г), EDC (0,72 г), TEA (0,52 мл) и DMAP (0,05 г). После того как исходный продукт полностью израсходован, растворитель удаляют при пониженном давлении. Остаток поглощают этилацетатом и промывают водой и насыщенным солевым раствором. Очистка колоночной хроматографией на силикагеле (градиент 5-40% EtOAc в гексане) дает указанное в заголовке соединение 33. 3',5'-О-бис(L-валинил)-4'-азидо-2'С-метил-2'-деоксицитидин (тригидрохлоридная соль, 34). К концентрированному раствору соединения 33 (1,6 г, 2,17 ммоль) в EtOAc медленно добавляют 13 мл 1 М HCl в EtOH. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре и разбавляют эфиром. Осадок фильтруют и промывают эфиром с получением указанного в заголовке соединения 34 в виде тригидрохлоридной соли. Пример 6. Альтернативное получение 3',5'-О-бис(изобутирил)-4'-азидо-2'С-метил-2'-деоксицитидина. 2R,3S,4S,5R)-2-(4-Амино-2-оксо-2 Н-пиримидин-1-ил)-2-изобутирилоксиметил-4-метилтетрагидрофуран-3-иловый эфир изомасляной кислоты) (25) 3',5'-О-бис(изобутирил)-4'-азидо-2'С-метил-2'-деоксицитидин (25). К раствору соединения 22 (1,26 г, 3,74 ммоль) в сухом пиридине (25 мл) добавляют ангидрид изомасляной кислоты (1,77 г, 11,2 ммоль) при 0 С. Реакционную смесь контролируют с помощью ВЭЖХ и при окончании гасят водой для разложения избытка ангидрида изомасляной кислоты и удаления N4 защиты. Растворители выпаривают при пониженном давлении и совместно выпаривают с этанолом. Остаток растворяют в этилацетате и промывают NaHCO3, насыщенным солевым раствором. Очистка колоночной хроматографией на силикагеле (градиент 10-40% EtOAc в гексане) дает указанное в заголовке соединение 25. Пример 7. 4'-Азидо-3'-О-(L-валинил)-2'С-метил-2'-деоксицитидин (37)N4,5'-О-бис(монометокситритил)-4'-азидо-2'С-метил-2'-деоксицитидин (35). Смесь соединения 22 (2,82 г, 10 ммоль) и MMTrCl (9,15 г, 30 ммоль) в пиридине (50 мл) перемешивают в продолжение ночи при 80 С. После добавления МеОН (5 мл) и перемешивания в течение еще 2 ч растворитель выпаривают и остаток распределяют между этилацетатом и водой. Органическую фазу промывают водой, насыщенным солевым раствором и упаривают. Очистка колоночной хроматографией на силикагеле (0-5% МеОН в DCM) дает указанное в заголовке соединение 35.N4,5'-О-бис(монометокситритил)-4'-азидо-3'-[N-(трет-бутоксикарбонил)-L-валинил]-2'C-метил-2'деоксицитидин (36). К раствору соединения 35 (3,09 г, 3,74 ммоль) в смеси сухого ацетонитрила (30 мл) и ДМФА (15 мл) последовательно добавляют Boc-Val-OH (0,81 г, 3,74 ммоль), EDC (0,72 г, 3,74 ммоль), TEA (0,52 мл,3,74 ммоль) и DMAP (0,07 г). Полученную смесь перемешивают при комнатной температуре. Протекание реакции контролируют с помощью ВЭЖХ и в реакционную смесь повторно загружают Boc-Val-OH(0,4 г), EDC (0,36 г), TEA (0,26 мл) и DMAP (0,04 г). После того как исходный продукт полностью израсходован, растворитель удаляют при пониженном давлении. Остаток поглощают этилацетатом и промывают водой и насыщенным солевым раствором. Очистка колоночной хроматографией на силикагеле 4'-Азидо-3'-О-(L-валинил)-2'С-метил-2'-деоксицитидин (дигидрохлоридная соль, 37). К концентрированному раствору соединения 36 (2,4 г, 2,34 ммоль) в EtOH медленно добавляют 13 мл 1 М HCl в EtOH. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре и разбавляют эфиром. Осадок фильтруют и промывают эфиром с получением указанного в заголовке соединения (37) в виде дигидрохлоридной соли. Пример 8. 4'-Азидо-3'-O-изобутирил-2'С-метил-2'-деоксицитидин (38) 4'-Азидо-3'-O-изобутирил-2'С-метил-2'-деоксицитидин (38). К раствору соединения 35 (3,09 г, 3,74 ммоль) в сухом пиридине (25 мл) добавляют ангидрид изомасляной кислоты (0,89 г, 5,61 ммоль) при 0 С. Реакционную смесь контролируют с помощью ВЭЖХ и при окончании гасят водой для разложения избытка ангидрида изомасляной кислоты. Растворители выпаривают при пониженном давлении и совместно выпаривают с этанолом. Остаток растворяют в этилацетате, промывают NaHCO3, насыщенным солевым раствором и упаривают. Сырое, защищенноеMMTr-группами 3'-изобутирильное производное растворяют в 80% АсОН и перемешивают при 50 С до полного удаления MMTr-групп. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (0-20% МеОН в DCM) с получением указанного в заголовке соединения 38. Пример 9. 5'-О-(L-валинил)-4'-азидо-2'С-метил-2'-деоксицитидин (43) 5'-О-трет-Бутилдиметилсилил-4'-азидо-2'С-метил-2'-деоксицитидин (39). К раствору соединения 22 (2,82 г, 10 ммоль) в ДМФА (5 мл) добавляют имидазол (1,02 г, 15 ммоль) и TBSCl (1,95 г, 13 ммоль). После того как исходный продукт израсходован, реакционную смесь гасят с помощью МеОН (1 мл) и распределяют между этилацетатом и водой. Органическую фазу промывают водой, насыщенным солевым раствором и упаривают. Остаток очищают колоночной хроматографией на силикагеле (0-20% МеОН в DCM) с получением указанного в заголовке соединения 39. 5'-О-трет-Бутилдиметилсилил-4'-азидо-N4,3'-O-бис(монометокситритил)-2'С-метил-2'деоксицитидин (40). Смесь соединения 39 (3,7 г, 9,34 ммоль) и MMTrCl (8,63 г, 28 ммоль) в сухом пиридине (50 мл) пе- 18018935 ремешивают в течение ночи при 80 С. После добавления МеОН (5 мл) и перемешивания в течение еще 2 ч растворитель выпаривают и остаток распределяют между этилацетатом и водой. Органическую фазу промывают водой, насыщенным солевым раствором и упаривают. Очистка колоночной хроматографией на силикагеле (0-5% МеОН в DCM) дает указанное в заголовке соединение 40. 4'-Азидо-N4,3'-О-бис(монометокситритил)-2'С-метил-2'-деоксицитидин (41). Раствор соединения 40 (5,3 г, 5,64 ммоль) в ТГФ (20 мл) обрабатывают 1 М TBAF в ТГФ (5,7 мл, 5,7 ммоль) и перемешивают в течение 2 ч при комнатной температуре. Реакционную смесь разбавляют этилацетатом, промывают водой, насыщенным солевым раствором и упаривают. Хроматография на силикагеле (0-5% этилацетат в CHCl3) дает указанное в заголовке соединение 41. 5'-[N-(трет-Бутоксикарбонил)-L-валинил]-N4,3'-O-бис(монометокситритил)-4'-азидо-2'С-метил 2'-деоксицитидин (42). К раствору соединения 41 (3,09 г, 3,74 ммоль) в смеси сухого ацетонитрила (30 мл) и ДМФА (15 мл) последовательно добавляют Boc-Val-OH (0,81 г, 3,74 ммоль), EDC (0,72 г, 3,74 ммоль), TEA (0,52 мл,3,74 ммоль) и DMAP (0,07 г). Полученную смесь перемешивают при комнатной температуре. Протекание реакции контролируют с помощью ВЭЖХ и в реакционную смесь повторно загружают Boc-Val-OH(0,4 г), EDC (0,36 г), TEA (0,26 мл) и DMAP (0,04 г). После того как исходный продукт полностью израсходован, растворитель удаляют при пониженном давлении. Остаток поглощают этилацетатом и промывают водой и насыщенным солевым раствором. Очистка колоночной хроматографией на силикагеле(градиент 5-40% EtOAc в гексане) дает указанное в заголовке соединение 42. 5'-О-(L-валинил)-4'-азидо-2'С-метил-2'-деоксицитидин (дигидрохлоридная соль 43). К концентрированному раствору соединения 42 (2,4 г, 2,34 ммоль) в EtOH медленно добавляют 13 мл 1 М HCl в EtOH. Реакционную смесь перемешивают в течение 4 ч при комнатной температуре и разбавляют эфиром. Осадок фильтруют и промывают эфиром с получением указанного в заголовке соединения 43 в виде дигидрохлоридной соли. Пример 10. 5'-O-изобутирил-4'-азидо-2'С-метил-2'-деоксицитидин (44) 5'-O-изобутирил-4'-азидо-2'С-метил-2'-деоксицитидин (44). К раствору соединения 41 (3,09 г, 3,74 ммоль) в сухом пиридине (25 мл) добавляют ангидрид изомасляной кислоты (0,89 г, 5,61 ммоль) при 0 С. Реакционную смесь контролируют с помощью ВЭЖХ и при окончании гасят водой для разложения избытка ангидрида изомасляной кислоты. Растворители выпаривают при пониженном давлении и совместно выпаривают с этанолом. Остаток растворяют в этилацетате, промывают NaHCO3, насыщенным солевым раствором и упаривают. Сырое, защищенноеMMTr-группами 3'-изобутирильное производное растворяют в 80% АсОН и перемешивают при 50 С до полного удаления MMTr-групп. Растворитель выпаривают и остаток очищают колоночной хроматографией на силикагеле (0-20% МеОН в DCM) с получением указанного в заголовке соединения 44. Пример 11. Анализ с люциферазой Renilla. Данный анализ измеряет способность соединений формулы I ингибировать репликацию РНК ВГС и, следовательно, их потенциальную применимость для лечения инфекций ВГС. Анализ использует репортер для простого считывания внутримолекулярного уровня репликона РНК ВГС. Ген люциферазыRenilla вводили в первую открытую рамку считывания репликоновой конструкции NK5.1 (Krieger et al.,J. Virol. 75:4614), непосредственно после внутренней последовательности рибосомного сайта вхождения(IRES), и сливали с геном неомицин фосфотрансферазы (NPTII) через самоотщепляющийся пептид 2 А вируса ящура (RyanDrew, EMBO Vol.13:928-933). После in vitro транскрипции РНК электропорировали в Huh7 клетки гепатомы человека, G418-резистентные колонии выделяли и увеличивали в объеме. Отобранные стабильные клеточные линии 2209-23 содержат репликативную субгеномную РНК ВГС, и активность люциферазы Renilla, экспрессируемая репликоном, отражает уровень его РНК в клетках. Анализ выполняли на двух экземплярах планшетов, один в непрозрачном белом и один в прозрачном,чтобы измерять противовирусную активность и цитотоксичность химического соединения в параллели,гарантирующей, что наблюдаемая активность не является результатом уменьшенной клеточной пролиферации. Клетки с содержанием репликона ВГС и люциферазы из Renilla (2209-23), культивированные вDulbecco's MEM (GibcoBRL cat31966-021) с 5% фетальной сыворотки крупного рогатого скота (FCS,- 19018935GibcoBRL cat.10106-169), помещали в 96-луночный планшет в количестве 5000 клеток на лунку и инкубировали в продолжение ночи. Спустя 24 ч различные разбавления химических соединений в среде для роста добавляли к клеткам, которые затем дополнительно инкубировали при 37 С в течение трех дней. В конце инкубационного периода клетки в белых планшетах собирали и активность люциферазы измеряли применением набора для проведения люциферазной реакции (Dual-Luciferase reporter assay system, Promega catE1960). Все реагенты, описанные в следующем разделе, были включены в комплект изготовителя, и инструкции изготовителя были применены для приготовления реагентов. Клетки промывали дважды с помощью 200 мкл фосфатно-солевого буферного раствора (рН 7,0) (PBS) на лунку и подвергали лизированию с помощью 25 мкл 1 пассивного лизисного буфера перед инкубацией при комнатной температуре в течение 20 мин. В каждую лунку добавляли одну сотню микролитров Lar II реагента. Затем планшет вставляли в LB 96V микропланшетный люминометр (MicroLumatPlus, Berthold), и 100 мкл StopGlo реагента вводили инъекцией в каждую лунку и измеряли сигнал, применяя 10 секундную программу измерения с 2-секундной задержкой. IC50, концентрация лекарственного средства,требуемая для снижения репликонового уровня на 50% по отношению к величине контроля из необработанных клеток, может быть вычислена из графика зависимости процентного снижения активности люциферазы от концентрации лекарственного средства. Для анализа цитотоксичности применяли WST-1 реагент от фирмы Roche Diagnostic (cat1644807). Десять микролитров WST-1 реагента добавляли в каждую лунку, включая лунки, которые содержат только среду, в качестве пустых опытов. Затем клетки инкубировали в течение 1-1,5 ч при 37 С и измеряли OD величину посредством считывающего устройства для 96-луночного планшета при 450 нм(эталонный фильтр при 650 нм). И в этом случае CC50, концентрация лекарственного средства, требуемая для снижения пролиферации клеток на 50% по отношению к величине контроля из необработанных клеток, может быть вычислена из графика зависимости процентного снижения WST-1 величины от концентрации лекарственного средства. Пример 12. МТ 4/ХТТ анализ. Соединения данного изобретения могут быть также тестированы по активности против сопутствующих инфекций. Например, индивидуумы с риском инфекций, передаваемых с кровью, таких как ВГС, иногда совместно инфицированы посредством ВИЧ/HIV. Соединения могут быть тестированы по активности против ВИЧ, например, применением кратных определений с ХТТ в МТ-4 клетках (Weislow et al., J. Nat. Cancer Inst. 1989, vol. 81 no 8, 577 et seg), предпочтительно включающих определения в присутствии 40-50% сыворотки человека, чтобы показать вклад белкового связывания. Вкратце обычный ХТТ анализ использует МТ 4 клетки Т клеточной линии человека, выращенные в RPMI 1640 среде, дополненной 10% фетальной сывороткой крупного рогатого скота(или 40-50% сывороткой человека, как целесообразно), пенициллином и стрептомицином, посеянные в 96-луночные микропланшеты (2104 клетки/лунка), инфицированные посредством 10-20 TCID50 на лунку с HIV-1IIIB (дикий тип) или мутантным вирусом, таким как вирусы, несущие RT I1 е 100, Cys 181 или Asn 103 мутации. Серийно разбавленные тестируемые соединения добавляли в соответствующие лунки и культуру инкубировали при 37 С в атмосфере, обогащенной CO2, и определяли жизнеспособность клеток на пятые или десятые сутки с помощью жизненно важного ХТТ красителя. Результаты обычно представляют в виде ED50 мкМ. Соединение примера 1 показывает ED50 около 0,6 мкМ в ХТТ анализе. Пример 13. Внутримолекулярная концентрация трифосфата и период полураспада. Предполагаемая активная разновидность соединений изобретения представляет собой -D-2'деокси-2'С-метил-4'-азидоцитидинтрифосфат. Устойчивость трифосфата определяют в свежих человеческих первичных гепатоцитах (методики прямо на клетках (CellzDirect) или in vitro), предварительно инкубированных с исходным соединением, меченным тритием. Гепатоциты культивируют на 6 луночных покрытых коллагеном планшетах (BD Biosciences), обычно при 1,5 миллиона клеток на лунку,используя полную среду, содержащую сыворотку (методики прямо на клетках (CellzDirect) или in vitro)/37C/5%CO2. Различные штаммы гепатоцитов являются доступными, такие как Hu497, MHL-091806 и Hu504, и поэтому полезно тестировать такие штаммы параллельно и вычислять средние величины от ряда штаммов. Предварительная инкубация имеет место обычно в течение 24 ч с 2 мкМ меченного тритием образца при 10 мкКи/мл. При t0 монослой клеток промывали клеточной культуральной средой, чтобы удалить внеклеточное исходное соединение, и культуры клеток повторно инкубировали со свежей клеточной культуральной средой. Концентрацию внутримолекулярного трифосфата количественно определяли в разных временных точках вплоть до 72 ч. Подходящие временные точки представляли собой 0, 0,5, 1, 2,4, 6, 8, 24, 48 и 72 ч со вторым экземпляром клеточных культур для каждой временной точки. В соответствующий момент времени клетки собирали посредством аспирации клеточной культуральной среды и промывания клеток холодным PBS. Клетки счищали в среду для экстракции, а именно,в 1 мл предварительно охлажденного 60% (об./об.) метанола, экстрагировали в метанол в течение 24 ч при -20 С. Экстрагированные образцы центрифугировали, чтобы удалить отходы. Супернатант удаляли в свежие пробирки, упаривали и хранили в жидком азоте для анализа. Высушенные пеллеты клеточного экстракта растворяли в воде и подвергали нанофильтрованию (например, наноразделительное центрифужное устройство, Pall Life Sciences). Перед ВЭЖХ анализом образцы снабжали немеченными эталонными стандартами для исходной формы, ее монофосфатной, дифосфатной и трифосфатной форм. Типичная ВЭЖХ система использует ионообменную ВЭЖХ с Whatman Partisil 10SAX (4,6250 мм) колонкой в сочетании с радиометрическим детектором (таким как -RAM, IN/US Systems Inc.) и обычным линейным градиентом мобильной фазы от 0% водного буфера до 100% фосфатного буфера (например,0,5 М KH2PO4/0,8 М KCl) при скоростях потока, таких как 1 мл/мин. Для обнаружения радиомеченных видов в (3-RAM, можно использовать 5:1 отношение FloScint IV или UltimaFloAP (Perkin Elmer) к элюенту колонки. Исходные и внутриклеточные метаболиты идентифицируют сравнением времен удерживания внутриклеточных видов на радиохроматограмме с удерживанием нерадиоактивных эталонных стандартов, добавленных в образцы клеточных экстрактов и обнаруженных путем УФ-абсорбции, обычно при 270 нм. Временной курс поглощения и фосфорилирования измеряют аналогичным образом, при помощи которого первичные гепатоциты человека инкубируют с соединением изобретения, меченным тритием,например, 2 мкМ или 10 мкКи/мл. Подходящий временной курс представляет собой добавление к дублированным культурам соединения за 72, 48, 24, 16, 6 и 1 ч до сбора клеток. Для определения зависимости доза-эффект фосфорилирования соединений изобретения первичные гепатоциты человека инкубировали с тест-соединением, меченным тритием, например, при 0,2, 10, 25, 50, 100 и 250 мкМ в течение 24 ч. Конечную концентрацию достигали дополнением нерадиомеченным тест-соединением. Дублированные клеточные культуры собирали обычно после 24 ч инкубации. В таких анализах средний период полураспада соединений изобретения составлял 21,4 ч (стандартное отклонение 4,22 ч). Уровень трифосфата в устойчивом состоянии за 24 ч при 2 мкМ составляет около 15 пМ/миллион клеток. При использовании 3 мкл в качестве среднего объема печеночных паренхиматозных клеток человека данная концентрация трифосфата соответствует величине, по существу, превышающую Ki исходного соединения. Долгий период полураспада трифосфата и высокая концентрация означает, что активные против вирусов концентрации активных представителей будут присутствовать в клетках, зараженных ВГС, в течение продолжительных периодов времени после ведения дозы. Это, в свою очередь, означает, что минимальные суточные глубинные уровни будут оставаться высокими даже при QD дозировании, тем самым минимизируются возможности для субоптимальной экспозиции лекарственным средством, приводящие к разработке лекарственного средства для устранения мутантов. В противоположность длинному периоду полураспада трифосфата данного изобретения трифосфатный период полураспада аналогичного 2'С метилпроизводного PSI-6130 (-D-2'-деокси-2'-фтор 2'-С-метилцитидина (представленного ниже составлял только 4,7 ч с концентрацией трифосфата в устойчивом состоянии в течение 24 ч, равной только 1,3 пМ/миллион клеток. Пример 14. Фармацевтические композиции рассматриваемых соединений для введения несколькими путями готовили, как описано в данном примере. Композиция для перорального введения (А). Ингредиенты смешивают и распределяют в капсулы, причем каждая содержит примерно от 500 до 1000 мг. Композиция для перорального введения (В). Ингредиенты объединяют и гранулируют, используя растворитель, такой как метанол. Композицию затем сушат и формуют в таблетки (содержащие примерно 20 мг активного соединения) соответствующей машиной для изготовления таблеток. Композиция для перорального введения (С). Ингредиенты смешивают для образования суспензии для перорального введения. Парентеральная композиция (D). Активный ингредиент растворяют в порции воды для инъекции. Затем добавляют с перемешиванием достаточное количество хлорида натрия, чтобы изготовить изотонический раствор. Раствор доводят до массы остатком воды для инъекции, фильтруют через 0,2 микронный мембранный фильтр и упаковывают в стерильных условиях. Композиция для суппозитория (Е). Ингредиенты расплавляют вместе и перемешивают на паровой бане и выливают в формы, содержащие 2,5 г общей массы. Вышепредставленное изобретение было описано довольно подробно посредством иллюстрации и примера для ясности и понимания. Специалисту в данной области будет ясно, что изменения и модификации можно практиковать в рамках охвата прилагаемой формулы изобретения. Следовательно, следует понимать, что вышеприведенное описание предназначено для того, чтобы быть иллюстративным и неограничительным. Охват изобретения поэтому должен определяться не ссылкой на вышеприведенное описание, но вместо этого должен определяться ссылкой на пункты формулы изобретения вместе с полным охватом эквивалентов, на которые такие пункты правомочны. Все патенты, патентные заявки и публикации, цитируемые в данной заявке, таким образом, включены ссылкой в полном объеме.R2 и R3 независимо выбраны из группы, состоящей из водорода, COR4 и С(=O)CHR5NHR6; или R1 и 3R означают Н и R2 представляет собой монофосфатный, дифосфатный или трифосфатный сложный эфир;R4 независимо выбран из группы, состоящей из C1-10 неразветвленного или разветвленного алкила;R6 представляет собой водород; или его фармацевтически приемлемые соли. 2. Соединение по п.1, в котором каждый R1, R2 и R3 представляет собой водород. 3. Соединение по п.1, в котором R1 представляет собой водород, R2 и R3 представляют собой COR4 4 и R представляет собой неразветвленный или разветвленный C1-10 алкил, или его фармацевтически приемлемые соли. 4. Соединение по п.3, в котором R4 выбран из метила, этила, изопропила или трет-бутила, или его фармацевтически приемлемые соли. 5. Соединение по п.4, представляющее собой 3',5'-О-бис(изобутирил)-4'-азидо-2'С-метил-2'деоксицитидин. 6. Соединение по п.1, в котором R3 представляет собой водород или С(=O)CHR5NHR6R1 и R2 представляет собой C(=O)CHR5NHR6. 7. Соединение по п.1, в котором R5 представляет собой изопропил, изобутил или втор-бутил. 8. Соединение по п.1, в котором R5 имеет стереохимию L-аминокислоты. 9. Соединение по п.1, выбираемое из группы, состоящей из 3',5'-О-бис(изобутирил)-4'-азидо-2'С-метил-2'-деоксицитидина,3',5'-О-бис(L-валинил)-4'-азидо-2'С-метил-2'-деоксицитидина,4'-азидо-3'-О-(L-валинил)-2'С-метил-2'-деоксицитидина,4'-азидо-3'-O-изобутирил-2'С-метил-2'-деоксицитидина,5'-О-(L-валинил)-4'-азидо-2'С-метил-2'-деоксицитидина,5'-O-изобутирил-4'-азидо-2'С-метил-2'-деоксицитидина; или его фармацевтически приемлемая соль. 10. Применение соединения по п.1 для лечения или приготовления лекарственного средства для лечения заболевания, опосредованного вирусом гепатита С (ВГС). 11. Фармацевтическая композиция, ингибирующая вирус гепатита С, содержащая терапевтически эффективное количество соединения по п.1 и по меньшей мере один фармацевтически приемлемый носитель, разбавитель или эксципиент. 12. Фармацевтическая композиция, ингибирующая вирус гепатита С, содержащая терапевтически эффективное количество соединения по п.1 и а) по меньшей мере один фармацевтически приемлемый носитель, разбавитель или эксципиент и b) по меньшей мере один модулятор иммунной системы и/или по меньшей мере одно противовирусное средство, которое ингибирует репликацию ВГС.
МПК / Метки
МПК: A61K 31/513, A61P 31/12, C07H 19/073
Метки: hcv, вгс, нуклеозидный, ингибитор
Код ссылки
<a href="https://eas.patents.su/24-18935-nukleozidnyjj-ingibitor-dlya-vgs-hcv.html" rel="bookmark" title="База патентов Евразийского Союза">Нуклеозидный ингибитор для вгс (hcv)</a>
Предыдущий патент: Каталитический комплекс и способ получения полиолефинов с мультимодальным молекулярно-массовым распределением
Следующий патент: Ингибиторы с-fms киназы
Случайный патент: Способ спектрального элементного анализа вещества и устройство для его осуществления












