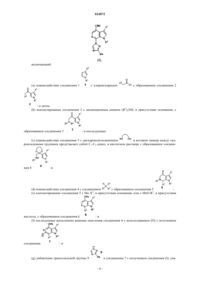
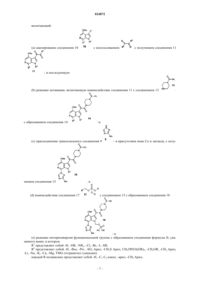
Способы получения пиперазинового пролекарства – ингибитора приcоединения вич
Номер патента: 24872
Опубликовано: 31.10.2016
Авторы: Симпсон Джеймс Х., Истгейт Мартин Д., Фанфэйр Дейн Дастан, Фокс Ричард Дж., Трипп Джонатан Клайв, Рисатти Кристина Энн, Соумеиллант Максим С., Чен Ке, Сяо И, Ла Круз Томас Е., Мадрик Богуслав М., Балтмэн Майкл С.
Формула / Реферат
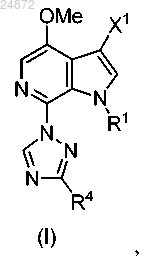
1. Способ получения соединения
включающий:
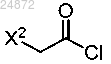
(a) взаимодействие соединения 1
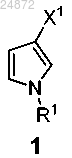 с хлорангидридом
с хлорангидридом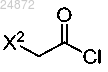
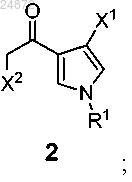
с образованием соединения 2
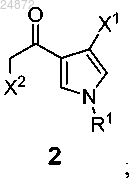
и затем
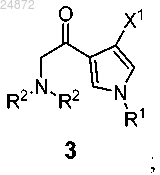
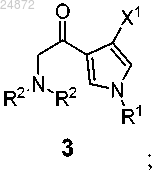
(b) контактирование соединения 2 с дизамещенным амином (R2)2NH, в присутствии основания, с образованием соединения 3

и последующее
(c) взаимодействие соединения 3 с дигидроксисоединением
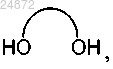
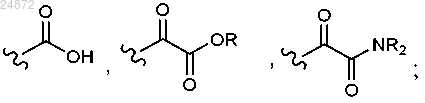
в котором линкер между гидроксильными группами представляет собой C1-C6 алкил, в кислотном растворе с образованием соединения 4

(d) взаимодействие соединения 4 с соединением
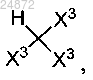
в присутствии кислоты с образованием соединения 5
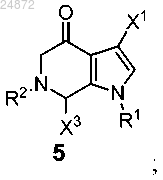
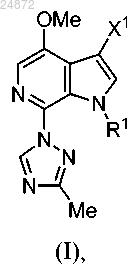
(e) контактирование соединения 5 с Me-X4 в присутствии основания или с MeO-R3 в присутствии кислоты с образованием соединения 6
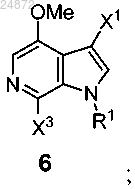
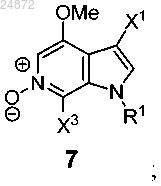
(f) последующее выполнение реакции окисления соединения 6 с использованием [O] с получением соединения 7
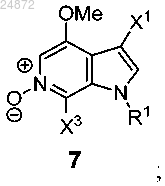
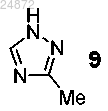
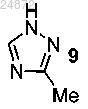
(g) добавление триазолильной группы
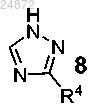
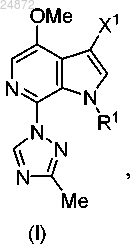
к соединению 7, и последующее выполнение реакции интерконверсии функциональной группы с получением соединения (I), указанного выше, в котором
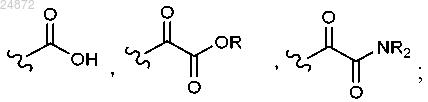
R1 представляет собой -H, -Boc, -Piv, -SO2 арил, -CH2S арил, -CH2OP(O)(OR)2, -CH2OR, -CH2 арил;
каждый R2 независимо представляет собой -H, -CO2R, -SO2 арил, -CHO;
каждый R3 и R4 независимо представляет собой -H, -CO2R, -CH2SR, -CH2OR, -CH(OR)2, -CH(OR)(NR2), -CH(NR2)2, (C1-C6) алкил;
каждый R независимо представляет собой -H, -С1-С6 алкил, -арил, -CH2 арил;
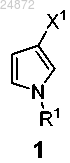
X1 представляет собой -H, -Cl, -Br, -I,
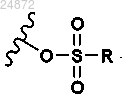
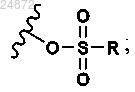
X2 представляет собой -Cl, -Br, -I, -N(R2)2, -OSO2R,
каждый X3 независимо представляет собой -H, -OR, -NR2, -Cl, -Br, -I, -SR, -SO2R, -SO3R, -SR2+,
X4 представляет собой -Cl, -Br, -I, OTs, +NR3, -пиридий и
2. Способ по п.1, отличающийся тем, что R1 представляет собой -SO2 арил.
3. Способ по п.2, отличающийся тем, что X1 представляет собой -H.
4. Способ по п.3, отличающийся тем, что X3 представляет собой -H.
5. Способ получения соединения
включающий:
(a) взаимодействие соединения 1
с хлорангидридом

с образованием соединения 2

и затем
(b) контактирование соединения 2 с дизамещенным амином (R2)2NH в присутствии основания с образованием соединения 3
и последующее
(c) взаимодействие соединения 3 с дигидроксисоединением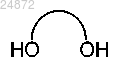
в кислотном растворе с образованием соединения 4
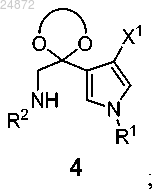
(d) взаимодействие соединения 4 с соединением

в присутствии кислоты, с образованием соединения 5
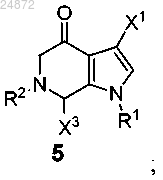
(e) контактирование соединения 5 с Me-X4 в присутствии основания или с MeO-R3 в присутствии кислоты с образованием соединения 6

(f) последующее выполнение реакции окисления соединения 6 с использованием [O] с получением соединения
(g) добавление триазолильной группы 9
к соединению 7 с получением соединения (I), указанного выше, в котором
R1 представляет собой -H, -Boc, -Piv, -SO2 арил, -CH2S арил, -CH2OP(O)(OR)2, -CH2OR, -CH2 арил;
каждый R2 независимо представляет собой -H, -CO2R, -SO2 арил, -CHO;
R3 представляет собой -H, -CO2R, -CH2SR, -CH2OR, -CH(OR)2, -CH(OR)(NR2), -CH(NR2)2;
каждый R независимо представляет собой -H, -C1-C6 алкил, -арил, -CH2 арил;
X1 представляет собой -H, -Cl, -Br, -I,
X2 представляет собой -Cl, -Br, -I, -N(R2)2;
каждый X3 независимо представляет собой -H, -OR, -NR2 Cl, -Br, -I, -SR, -SO2R, -SO3R, -SR2+;
X4 представляет собой -Cl, -Br, -I, -OTs, +NR3, -пиридий и

6. Способ по п.5, отличающийся тем, что R1 представляет собой -SO2 арил.
7. Способ по п.6, отличающийся тем, что X1 представляет собой -H.
8. Способ по п.7, отличающийся тем, что X3 представляет собой -H.
9. Способ получения соединения
включающий:
(a) взаимодействие соединения 1
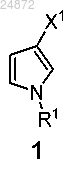
с хлорангидридом
с образованием соединения 2
и затем
(b) контактирование соединения 2 с дизамещенным амином (R2)2NH в присутствии основания с образованием соединения 3
и последующее
(c) взаимодействие соединения 3 с дигидроксисоединением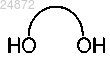
в кислотном растворе с образованием соединения 4
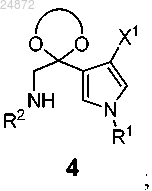
(d) взаимодействие соединения 4 с соединением

в присутствии кислоты с образованием соединения 5
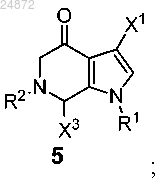
(e) контактирование соединения 5 с Ме-Х4 в присутствии основания или с MeO-R3 в присутствии кислоты с образованием соединения 6
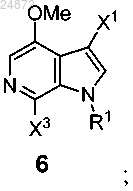
и последующее
(f) выполнение реакции окисления соединения 6 с использованием [O] с получением соединения 7
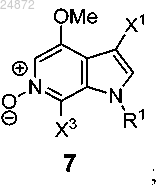
(g) реакцию активации с образованием соединения 10
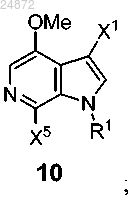
и последующее
(h) добавление триазолильной группы 9
к соединению 10, в присутствии Cu и лиганда, с получением соединения формулы (I), указанного выше, в котором
R1 представляет собой -H, -Boc, -Piv, -SO2 арил, -CH2S арил, -CH2OP(O)(OR)2, -CH2OR, -CH2 арил;
R2 представляет собой -H, -CO2R, -SO2 арил, -CHO;
каждый R3 независимо представляет собой -H, -CO2R, -CH2SR, -CH2OR, -CH(OR)2, -CH(OR)(NR2), -CH(NR2)2;
каждый R независимо представляет собой -H, -С1-С6 алкил, -арил, -CH2 арил;
X1 представляет собой -H, -Cl, -Br, -I,
X2 представляет собой -Cl, -Br, -I, -N(R2)2;
каждый X3 и X5 независимо представляет собой -H, -OR, -NR2 -Cl, -Br, -I, -SR, -SO2R, -SO3R, -SR2+
и X4 представляет собой -Cl, -Br, -I, -OTs, +NR3, пиридий и
и указанный лиганд выбран из группы, состоящей из 1,2-диаминоциклогексана, транс-1,2-диаминоциклогексана, цис-/транс-диаминоциклогексана, цис-N,N'-диметил-1,2-диаминоциклогексана, транс-N,N'-диметил-1,2-диаминоциклогексана, цис-/транс-N,N'-диметил-1,2-диаминоциклогексана, 1,2-диаминоэтана, N,N'-диметил-1,2-диаминоэтана, 1,10-фенантролина, 4,7-дифенил-1,10-фенантролина, 5-метил-1,10-фенантролина, 5-хлор-1,10-фенантролина и 5-нитро-1,10-фенантролина.
10. Способ по п.9, отличающийся тем, что R1 представляет собой -SO2 арил.
11. Способ по п.10, отличающийся тем, что X1 представляет собой -H.
12. Способ по п.11, отличающийся тем, что X3 представляет собой -H.
13. Способ получения соединения
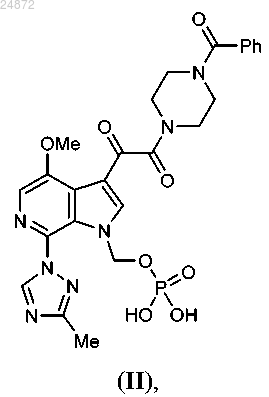
включающий:
(a) ацилирование соединения 10
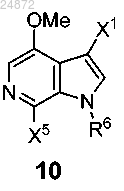 с использованием
с использованием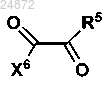
с получением соединения 11
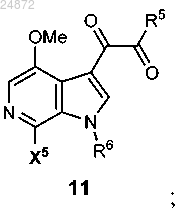
и последующую
(b) реакцию активации, включающую взаимодействие соединения 11 с соединением 13
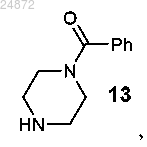
с образованием соединения 14
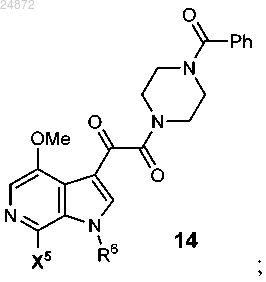
(c) присоединение триазолильного соединения 9
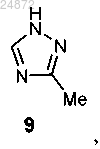
в присутствии иона Cu и лиганда с получением соединения 15

(d) взаимодействие соединения 17
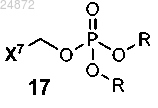
с соединением 15 с образованием соединения 18
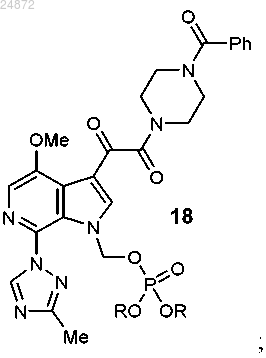
(e) реакцию интерконверсии функциональной группы с образованием соединения II, указанного выше, в котором
R5 представляет собой -H, -OR, -NR2, -Cl, -Br, -I, -SR;
R6 представляет собой -H, -Boc, -Piv, -SO2 арил, -CH2S арил, -CH2OP(O)(OR)2, -CH2OR, -CH2 арил, -Li, Na, K, Ca, Mg, TMG;
каждый R независимо представляет собой -H, -C1-C6 алкил, -арил, -CH2 арил;
X1 представляет собой -H, -Cl, -Br, -I,
X5 представляет собой -H, -OR, -NR2 -Cl, -Br, -I, -SR;
X6 представляет собой -H, -OR, -NR2, -Cl, -Br, -I, -SR, -SO2R, -SR2+, -OSO2R, -OSO3R,
X7 представляет собой -Cl, -Br, -I, -OSO2R.
14. Способ по п.13, отличающийся тем, что R представляет собой транс-бутил, R6 и X1 представляют собой -H.
15. Способ по п.13, отличающийся тем, что R5 представляет собой -ОМе.
16. Способ получения соединения III
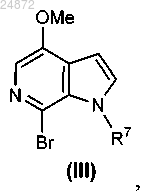
включающий:
(1) взаимодействие соединения
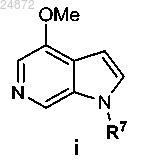
с фталевым ангидридом, H2O2 и дихлорметаном с образованием соединения
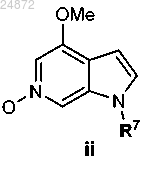
(2) реакцию PyBroP-бромирования, включающую взаимодействие соединения ii с PyBroP, с образованием соединения III:
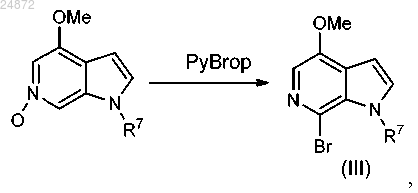
где R7 представляет собой -H, алкил, арил, -SO2R, -C(O)OR и -C(O)NR2,
где R представляет собой -H, C1-C6 алкил, -арил, -CH2 арил.
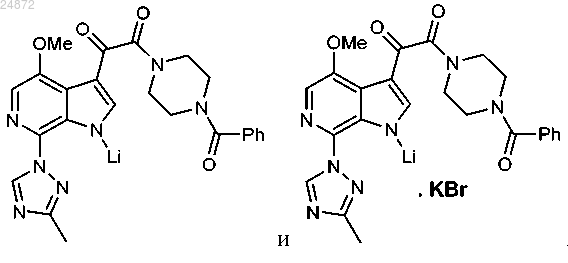
17. Соединение, включая его фармацевтически приемлемые соли, которое выбрано из следующей группы:
18. Способ получения соединения
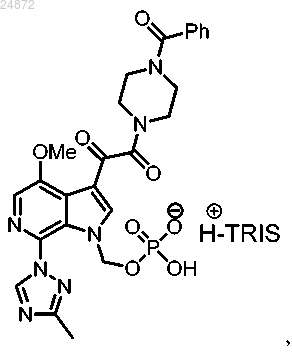
включающий
(1) удаление трет-бутильных групп у соединения
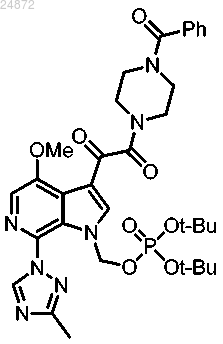
с использованием первого растворителя, в присутствии воды, с получением соединения
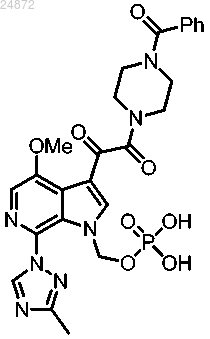
(2) взаимодействие соединения
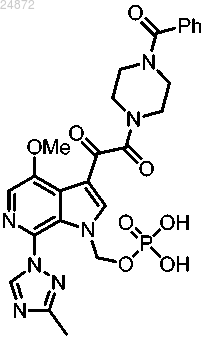
с TRIS и необязательно со вторым растворителем с образованием соединения
19. Способ по п.18, отличающийся тем, что указанный первый растворитель выбран из группы, состоящей из NMP, ДМСО, MeCN, MeOH, ацетона и карбоновой кислоты.
20. Способ по п.18, отличающийся тем, что указанный второй растворитель выбран из группы, состоящей из алкилкетона, гептана, толуола и этилацетата.
21. Способ по п.18, отличающийся тем, что первый растворитель представляет собой уксусную кислоту и указанный второй растворитель представляет собой ацетон.
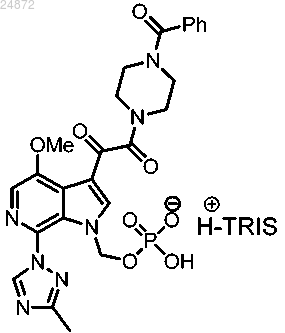
22. Способ получения соединения 13а
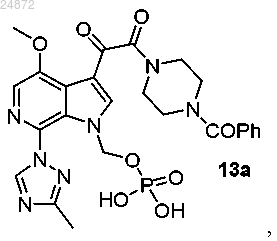
включающий:
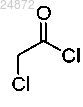
(1) взаимодействие соединения 1a с хлорангидридом 2-хлоруксусной кислоты
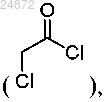
в присутствии треххлористого алюминия (AlCl3), с образованием соединения 2а
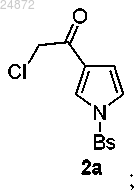
(2) последующее превращение соединения 2а в аминокетон 3а
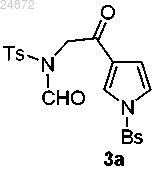
путем замещения 2-хлоркетоновой группировки натриевой солью N-формилсульфонамида в присутствии тетраалкиламмония галогенида;
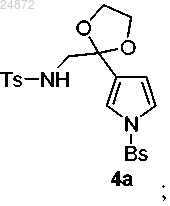
(3) взаимодействие соединения 3 с
в присутствии серной кислоты, с образованием соединения 4а
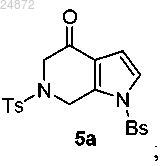
(4) циклизацию Пикте-Шпенглера с формальдегидом в присутствии трифторуксусной кислоты в качестве катализатора, с образованием кетона 5а
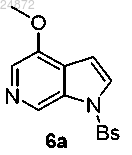
(5) обработку соединения 5а триметилортоформиатом (TMOF) и кислотой в присутствии радикального инициатора, с получением 6-азаиндольного соединения 6а
 ;
;
(6) окисление азота пиридина в соединении 6а с использованием перекиси водорода (H2O2) и фталевого ангидрида с получением N-оксидного соединения 7а
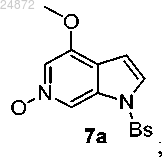
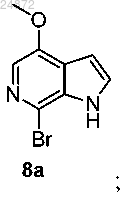
(7) обработку соединения 7а PyBroP, в присутствии оснований K3PO4 и NaOH с получением бром-азаиндольного соединения 8а
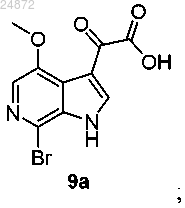
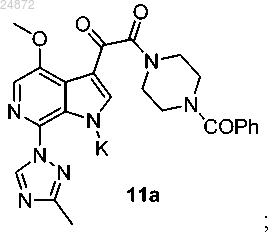
(8) последующее ацилирование соединения 8а в C3-позиции индольной группы с получением оксалатного соединения 9а
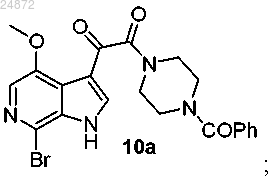
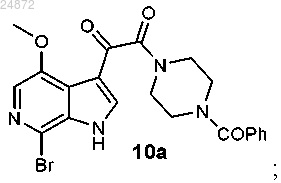
(9) взаимодействие соединения 9а с N-бензоилпиперазином с образованием амидного соединения 10а
(10) добавление триазольной группы
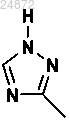
к соединению 10а с использованием катализа ионами меди, в присутствии лиганда и основания, с получением соединения 11а
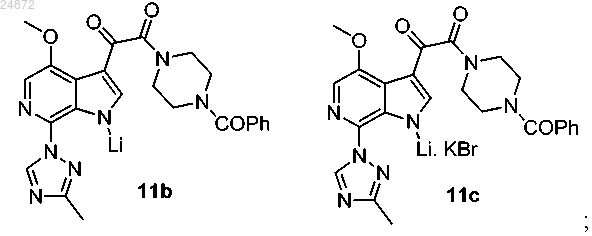
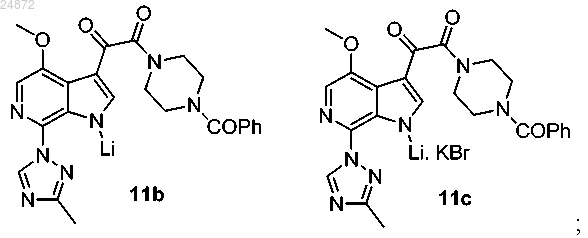
(11) необязательное получение из соединения 11а соединения 11b или 11с:
(12) алкилирование индольного азота соединения 11a, 11b или 11с с использованием хлор-фосфатного соединения
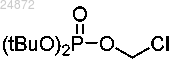
с получением фосфатного эфира 12а
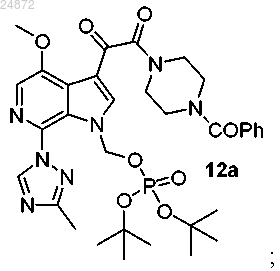
(13) сольволиз трет-бутильных групп соединения 12а с образованием конечного соединения 13а.
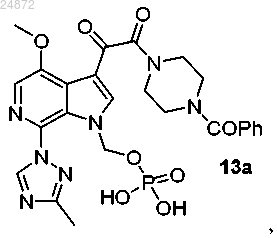
23. Способ получения соединения 13а
включающий:
(1) взаимодействие соединения 1а
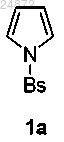
с хлорангидридом 2-хлоруксусной кислоты
с образованием соединения 2а
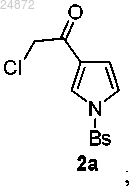
(2) последующее превращение соединения 2а в аминокетон 3а
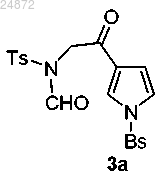
путем замещения 2-хлоркетоновой группировки натриевой солью N-формилсульфонамида;
(3) взаимодействие соединения 3а с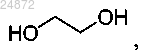
в присутствии кислоты, с образованием соединения 4а
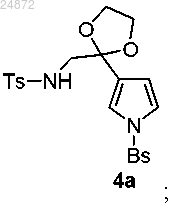
(4) циклизацию Пикте-Шпенглера с формальдегидом в присутствии кислоты в качестве катализатора с образованием кетона 5а
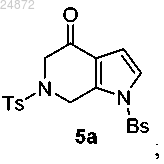
(5) обработку соединения 5а триметилортоформиатом (TMOF) и кислотой в присутствии радикального инициатора с получением 6-азаиндольного соединения 6а
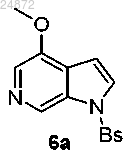 ;
;
(6) окисление азота пиридина в соединении 6 с получением N-оксидного соединения 7а
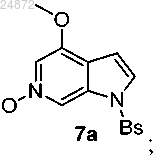
(7) обработку соединения 7а PyBroP с получением бром-азаиндольного соединения 8а
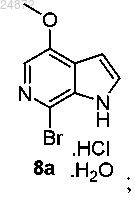
и
(8) последующее ацилирование соединения 8а в C3-позиции индольной группы с получением оксалатного
соединения 9а
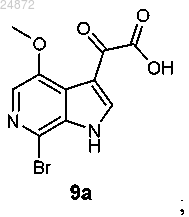
(9) взаимодействие соединения 9а с N-бензоилпиперазином с образованием амидного соединения 10а
(10) добавление триазольной группы
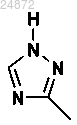
к соединению 10а с использованием катализа в присутствии лиганда и основания с получением соединения 11а
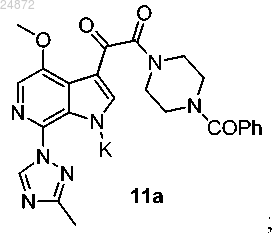
(11) необязательное получение из соединения 11а соединения 11b или 11с
(12) алкилирование индольного азота соединения 11a, 11b или 11с с использованием хлорфосфатного соединения
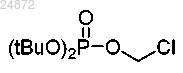
с получением фосфатного эфира 12а
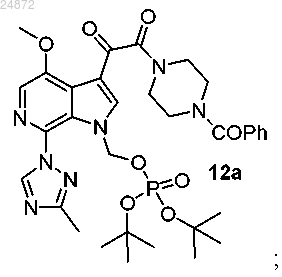
(13) сольволиз трет-бутильных групп соединения 12а с образованием конечного соединения 13а.
Текст
СПОСОБЫ ПОЛУЧЕНИЯ ПИПЕРАЗИНОВОГО ПРОЛЕКАРСТВА - ИНГИБИТОРА ПРИСОЕДИНЕНИЯ ВИЧ Описан способ получения соединения Истгейт Мартин Д., Балтмэн Майкл С., Чен Ке, Фанфейр Дэйн Дастан,Фокс Ричард Дж., Ла Круз Томас Е., Мадрик Богуслав М., Рисатти Кристина Энн, Симпсон Джеймс Х., Соумеиллант Максим С., Трипп Джонатан Клайв, Сяо И (US) Перекрестная ссылка на родственную заявку Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США 61/596362, поданной 8 февраля 2012 г. Область техники Данное изобретение относится к способам получения соединений, являющихся ингибиторами прикрепления ВИЧ, которые могут быть использованы в качестве противовирусных средств, и в частности к способам получения пиперазинового пролекарства, соединения 1-бензоил-4-[2-[4-метокси-7-(3-метил 1H-1,2,4-триазол-1-ил)-1-[(фосфоноокси)метил]-1H-пирроло[2,3-с]пиридин-3-ил]-1,2-диоксоэтил]пиперазин. Изобретение также относится к соединениям, включая промежуточные соединения, получаемым указанными способами. Уровень техники ВИЧ-1 (вирус иммунодефицита человека 1) инфекция остается серьезной медицинской проблемой; по данным на конец 2011 г. в мире были инфицированы десятки миллионов людей. Количество случаев ВИЧ-инфицирования и СПИД (синдрома приобретенного иммунного дефицита) быстро увеличивается. В 2005 г., например, было зарегистрировано приблизительно 5,0 миллионов новых случаев инфицирования и 3,1 миллиона людей умерли от СПИД. Современные лекарства, подходящие для лечения ВИЧ,включают нуклеозидные ингибиторы обратной транскриптазы (RT) или одобренные однотаблеточные комбинации, содержащие данные ингибиторы: зидовудин (или AZT, или Ретровир), диданозин (или Видекс), ставудин (или Зерит), ламивудин (или 3TC, или Эпивир), залцитабин (или DDC, или Хивид), абакавира сукцинат (или Зиаген), тенофовира дизопроксила фумарат (или Виреад), эмтрицитабин (или FTC, или Эмтриву), Комбивир (содержит 3TC плюс AZT), Тризивир (содержит абакавир, ламивудин и зидовудин), Эпзиком (содержит абакавир и ламивудин), Труваду (содержит Виреад и Эмтриву); ненуклеозидные ингибиторы обратной транскриптазы: невирапин (или Вирамун), делавирдин (или Рескриптор) и эфавиренз (или Суставу), Атриплу (Трувада + Сустава) и этравирин; и пептидомиметические ингибиторы протеазы или одобренные препараты, содержащие данные ингибиторы: саквинавир, индинавир, ритонавир, нелфинавир, ампренавир, лопинавир, Калетру (лопинавир и Ритонавир), дарунавир, атазанавир (Реатаз) и типранавир (Аптивус); и ингибиторы интегразы, такие как ралтегравир (Исентресс); и ингибиторы проникновения в клетку, такие как энфувиртид (Т-20) (Фузеон) и маравирок (Селзентри). Кроме того, ингибиторы прикрепления ВИЧ представляют собой новый подкласс противовирусных соединений, которые связываются с поверхностным гликопротеином gp120 вируса иммунодефицита человека (ВИЧ) и мешают взаимодействию поверхностного белка gp120 с рецептором CD4 клетки-хозяина. Тем самым данные соединения препятствуют прикреплению ВИЧ к CD4-Т-клеткам человека и блокируют репликацию ВИЧ на первой стадии жизненного цикла ВИЧ. Усилия, направленные на получение соединений, обладающих максимальной полезностью и эффективностью при их использовании в качестве противовирусных агентов, позволили создать ингибиторы прикрепления ВИЧ с улучшенными свойствами. В частности, показано, что один из ингибиторов прикрепления ВИЧ обладает значительной эффективностью в отношении ВИЧ. Данное соединение, 1-(4-бензоилпиперазин-1-ил)-2-[4-метокси-7-(3-метил-[1,2,4]триазол-1-ил)-1H-пиррало[2,3-с]пиридин-3-ил]этан-1,2-дион предложено и описано в патенте США 7354924, который включен в данное описание во всей своей полноте. Указанное выше соединение является исходным соединением пролекарства, известного как 1 бензоил-4-[2-[4-метокси-7-(3-метил-1H-1,2,4-триазол-1-ил)-1-[(фосфоноокси)метил]-1H-пирроло[2,3 с]пиридин-3-ил]-1,2-диоксоэтил]пиперазин, предложенного и описанного в патенте США 7745625,который включен в данное описание посредством ссылки во всей своей полноте. Данное соединение представлено структурной формулой Для получения данного пролекарства предложены различные методики, включая методики, подробно описанные в указанном выше патенте '625. В частности, указанный выше патент '625 включает различные методики ацилирования, алкилирования и фосфорилирования. В другом патенте, U.S.S.N. 13/359708 "METHODS OF MAKING HIV ATTACHMENT INHIBITOR PRODRUG COMPOUND ANDINTERMEDIATES", поданном 27 января 2012, также подробно описаны различные методики получения данного пиперазинового пролекарства. Данные методики включают многостадийный процесс, в котором в качестве исходного вещества использовано соединение которое подвергают бромированию и затем нитрованию. Далее к соединению добавляют триазолильную группировку и затем присоединяют пиперазиновую группировку, которая отделена от соединения двумя карбонильными группами. В настоящее время в данной области техники существует необходимость в новых методиках получения пиперазинового пролекарства, которое может быть использовано в борьбе с ВИЧ. Данные методики должны обеспечивать дополнительные всесторонние и эффективные средства получения молекулы пролекарства, как с точки зрения выхода в целом, так и производительности. Сущность изобретения Согласно первому варианту осуществления в изобретении предложен способ получения соединения формулы I(c) взаимодействие соединения 3 с дигидроксисоединением в котором линкер между гидроксильными группами представляет собой C1-C6 алкил, в кислотном растворе с образованием соедине в присутствии кислоты, с образованием со единения 5(f) последующее выполнение реакции окисления соединения 6 с использованием [O] с получением(g) добавление триазолильной группы интерконверсии функциональной группы с получением соединения (I), указанного выше, в которомR1 представляет собой -H, -Boc, -Piv, -SO2 Арил, -CH2S Арил, -CH2OP(O)(OR)2, -CH2OR, -CH2 Арил; каждый R2 независимо представляет собой -H, -CO2R, -SO2 Арил, -CHO; каждый R3 и R4 независимо представляет собой -H, -CO2R, -CH2SR, -CH2OR, -CH(OR)2,-CH(OR)(NR2), -CH(NR2)2, (C1-C6) алкил; каждый R независимо представляет собой -H, -C1-C6 алкил, -арил, -CH2 Арил;X1 представляет собой -H, -Cl, -Br, -I,X2 представляет собой -Cl, -Br, -I, -N(R2)2, -OSO2R; каждый X3 независимо представляет собой -H, -OR, -NR2, -Cl, -Br, -I, -SR, -SO2R, -SO3R, -SR2+ и X4 представляет собой -Cl, -Br, -I, OTs (тозилатную группу), +NR3, -пиридий и В данном варианте осуществления изобретения R1 представляет собой предпочтительно -SO2 Арил. При этом арил представляет собой предпочтительно фенил. Кроме того, X1 представляет собой предпочтительно -H. Дополнительно X3 представляет собой предпочтительно -H. Кроме того, дигидроксисоединение представляет собой предпочтительно этиленгликоль. Другой вариант осуществления изобретения относится к способу получения соединения формулы I в котором линкер между гид(c) взаимодействие соединения 3 с дигидроксисоединением роксильными группами представляет собой С 1-С 6 алкил, в кислотном растворе с образованием соедине ния 4(f) последующее выполнение реакции окисления соединения 6 с использованием [O] с получением(g) добавление триазолильной группы 9R1 представляет собой -H, -Boc, -Piv, -SO2 Арил, -CH2S Арил, -CH2OP(O)(OR)2, -CH2OR, -CH2 Арил; каждый R2 независимо представляет собой -H, -CO2R, -SO2 Арил, -CHO;R3 представляет собой -H, -CO2R, -CH2SR, -CH2OR, -CH(OR)2, -CH(OR)(NR2), -CH(NR2)2; каждый R независимо представляет собой -H, -С 1-С 6 алкил, -арил, -CH2 Арил;X1 представляет собой -H, -Cl, -Br, -I,X2 представляет собой -Cl, -Br, -I, -N(R2)2, -OSO2R; каждый X3 независимо представляет собой -H, -OR, -NR2, Cl, -Br, -I, -SR, -SO2R, -SO3R, -SR2+ и X4 представляет собой -Cl, -Br, -I, -OTs, +NR3, -пиридий и В данном варианте осуществления изобретения R1 представляет собой предпочтительно -SO2 Арил. При этом арил представляет собой предпочтительно фенил. Кроме того, X1 представляет собой предпочтительно -H. Дополнительно X3 представляет собой предпочтительно -H. Кроме того, дигидроксисоединение представляет собой предпочтительно этиленгликоль. Согласно другому варианту осуществления изобретения предложен способ получения соединения формулы I(c) взаимодействие соединения 3 с дигидроксисоединением в котором линкер между гидроксильными группами представляет собой С 1-С 6 алкил, в кислотном растворе с образованием соедине ния 4(f) выполнение реакции окисления соединения 6 с использованием [O] с получением соединения 7 к соединению 10, в присутствии иона Cu и лиганда,(h) добавление триазолильной группы 9 с получением соединения Формулы (I), указанного выше, в которомR1 представляет собой -H, -Boc, -Piv, -SO2 Арил, -CH2S Арил, -CH2OP(O)(OR)2, -CH2OR, -CH2 Арил; каждый R2 независимо представляет собой -H, -CO2R, -SO2 Арил, -CHO;R3 представляет собой -H, -CO2R, -CH2SR, -CH2OR, -CH(OR)2, -CH(OR)(NR2), -CH(NR2)2; каждый R независимо представляет собой -H, -С 1-С 6 алкил, -арил, -CH2 Арил;X1 представляет собой -H, -Cl, -Br, -I,X2 представляет собой -Cl, -Br, -I, -N(R2)2, -OSO2R; каждый X3 и X5 независимо представляет собой -H, -OR, -NR2, -Cl, -Br, -I, -SR, -SO2R, -SO3R, -SR2+ и X4 представляет собой -Cl, -Br, -I, -OTs, +NR3, пиридий и Указанный лиганд выбран из группы, состоящей из 1,2-диаминоциклогексана, транс-1,2-диаминоциклогексана, цис-/транс-диаминоциклогексана, цис-N,N'-диметил-1,2-диаминоциклогексана, трансN,N'-димотил-1,2-диаминоциклогексана, цис-/транс-N,N'-диметил-1,2-диаминоциклогексана, 1,2-диаминоэтана, N,N'-диметил-1,2-диаминоэтана, 1,10-фенантролина, 4,7-дифенил-1,10-фенантролина, 5-метил 1,10-фенантролина, 5-хлор-1,10-фенантролина и 5-нитро-1,10-фенантролина. В данном варианте осуществления изобретения R1 представляет собой предпочтительно -SO2 Арил. При этом арил представляет собой предпочтительно фенил. Кроме того, X1 представляет собой предпочтительно -H. Дополнительно X3 представляет собой предпочтительно -H. В настоящем изобретении также предложен способ получения соединения формулы II(b) реакцию активации, включающую взаимодействие соединения 11 с соединением 13(c) присоединение триазолильного соединения 9(e) реакцию интерконверсии функциональной группы с образованием соединения формулы II, указанного выше, в которомR6 представляет собой -H, -Boc, -Piv, -SO2 Арил, -CH2S Арил, CH2OP(O)(OR)2, -CH2OR, -CH2 Арил,-Li, -Na, -K, -Ca, -Mg, TMG (тетраметил гуанидин); каждый R независимо представляет собой -H, -C1-C6 алкил, -арил, -CH2 Арил;X7 представляет собой -Cl, -Br, -I, -OSO2R. В данном варианте осуществления изобретения лиганд может быть выбран из группы, описанной выше. Кроме того, R представляет собой предпочтительно трет-бутил, R6 и X1 представляют собой предпочтительно -Н и R5 представляет собой предпочтительно -OMe. При этом арил представляет собой предпочтительно фенил. Согласно другому варианту осуществления изобретения предложен способ получения соединения формулы III с фталевым ангидридом, Н 2 О 2 и дихлорметаном с обра зованием соединения и(2) реакцию PyBroP-бромирования, включающую взаимодействие соединения ii с PyBroP, с образованием соединения III где R7 представляет собой -H, алкил, арил, -SO2R, -C(O)OR и -C(O)NR2, и где R представляет собой -H, -C1-C6 алкил, арил, -CH2 Арил, и где PyBroP представляет собой сшивающий агент для пептидного синтеза бром-трис-пирролидинофосфония гексафторфосфат. При этом арил представляет собой предпочтительно фенил. Кроме того, настоящее изобретение также относится к соединению, включая его фармацевтически приемлемые соли и смеси, которое выбрано из следующей группы: Данное изобретение также относится к способу получения соединения с TRIS (трис(гидроксиметил)аминометаном) и не обязательно со вторым растворителем с образованием соединения В соответствии с данным способом первый растворитель выбран из группы, состоящей из карбоновой кислоты, NMP (N-метил-2-пирролидона), ДМСО, MeCN, MeOH и ацетона. Указанная кислота выбрана из группы, состоящей из H2SO4, HNO3, HCl, фосфоновых и карбоновых кислот. Второй растворитель выбран из группы, состоящей из воды, алкилкетона, гептана, толуола, этилацетата, ДМСО, MeCN,MeOH и ацетона. Более предпочтительно, когда указанная кислота представляет собой уксусную кислоту и второй растворитель представляет собой ацетон. Настоящее изобретение направлено на решение перечисленных задач, другие важные задачи изобретения описаны ниже. Подробное описание изобретения Если прямо не указано иное, для удобства многие реагенты в данном описании идентифицированы с использованием общепринятых в данной области техники аббревиатур. Кроме того, если прямо не указано иное, термины, используемые в данном описании, имеют указанные ниже значения. Группа "алкил" означает насыщенный алифатический углеводород и включает группы с нормальной цепью и разветвленной цепью. Предпочтительно алкильная группа содержит от 1 до 20 атомов углерода (имеется в виду любая область числовых значений; например, "1-20" в данном описании означает,что группа, в данном случае алкильная группа, может содержать 1 атом углерода, 2 атома углерода, 3 атома углерода и так далее до 20 атомов углерода включительно). Более предпочтительно алкильная группа представляет собой алкил средних размеров, содержащий от 1 до 10 атомов углерода. Наиболее предпочтительно алкильная группа представляет собой низший алкил, содержащий от 1 до 4 атомов углерода. Алкильная группа может быть замещенной или незамещенной. Термин "C1-6 алкил" в контексте данного описания и в формуле изобретения означает алкильные группы с нормальной или разветвленной цепью, содержащие до 6 атомов углерода включительно, такие как метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, амил, гексил и тому подобное. Группа "арил" "Арил" или "Ar" означает любую моноциклическую или состоящую из конденсированных колец (то есть из колец, которые имеют общие пары атомов углерода) полициклическую группу,содержащую в качестве кольцевых атомов только атомы углерода и имеющую полностью конъюгированную пи-электронную систему. Примеры арильных групп включают фенил, нафталинил и антраценил,но не ограничены ими. Арильная группа может быть замещенной или незамещенной Согласно предпочтительному варианту осуществления изобретения синтез пиперазинового пролекарства может быть описан следующей схемой: Далее описана более предпочтительная схема синтеза пиперазинового пролекарства с использованием в качестве исходного соединения N-сульфонилированного пиррола 1 а. Ацилирование по ФриделюКрафтсу с использованием хлорангидрида 2-хлоруксусной кислоты, в присутствии треххлористого алюминия, приводит к образованию 3-акрилпирролового производного 2 а. Замещение 2-хлоркетона натриевой солью N-формил сульфонамида, в присутствии тетраалкиламмония галогенида, предпочтительно бромида, предпочтительно тетрабутиламмония бромида, приводит к образованию аминокетона 3 а. Кетальная защита данного кетона, в присутствии гликоля и кислоты, приводит к отщеплению N-формилзащитной группы и образованию диоксалана 4 а. Циклизация Пикте-Шпенглера с формальдегидным эквивалентом, в присутствии кислоты в качестве катализатора, приводит к образованию кетона 5 а, который обрабатывают ортомуравьиной кислоты триметиловым эфиром (TMOF) и кислотой, в присутствии радикального инициатора, такого как AlBN или гидропероксид кумена, с получением 6-азаиндола 6 а. Окисление азота пиридина приводит к образованию N-оксида 7 а, который затем обрабатывают, в присутствии основания, PyBroP (бромтриспирролидинофосфония гексафторфосфатом), который бромируетC7-позицию, с получением, после гидролиза сульфонильной защитной группы, бром-азаиндола 8 а. Второе ацилирование по Фриделю-Крафтсу в C3-позиции индола приводит к образованию оксалата 9 а, который подвергают взаимодействию с N-бензоил пиперазином с получением амида 10 а. Присоединение триазола, катализируемое ионом меди, в присутствии подходящего лиганда и основания, приводит к образованию индола 11 с, который выделяют в виде литиевой соли (или, необязательно, в виде ко-соли сKBr). Алкилирование индольного азота хлор-фосфатом 14 а приводит к образованию фосфатного эфира 12 а, и последующий сольволиз трет-бутильных групп приводит к образованию конечного соединения 13 а. Соответственно, получение пиперазинового пролекарства может быть представлено более точно следующим образом: Следует понимать, что данное описание является исключительно иллюстративным и никоим образом не ограничивает объем или основные принципы настоящего изобретения. Действительно, в свете приведенных выше примеров и описания изобретения специалистам в данной области техники должно быть понятно, что кроме модификаций, описанных в данной заявке, возможны другие модификации изобретения. Предполагается, что такие модификации также входят в объем прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения(c) взаимодействие соединения 3 с дигидроксисоединением в котором линкер между гидроксильными группами представляет собой C1-C6 алкил, в кислотном растворе с образованием соедине ния 4 в присутствии кислоты с образованием со единения 5(e) контактирование соединения 5 с Me-X4, в присутствии основания или с MeO-R3 в присутствии(f) последующее выполнение реакции окисления соединения 6 с использованием [O] с получением(g) добавление триазолильной группы к соединению 7, и последующее выполнение реакции интерконверсии функциональной группы с получением соединения (I), указанного выше, в которомR1 представляет собой -H, -Boc, -Piv, -SO2 арил, -CH2S арил, -CH2OP(O)(OR)2, -CH2OR, -CH2 арил; каждый R2 независимо представляет собой -H, -CO2R, -SO2 арил, -CHO; каждый R3 и R4 независимо представляет собой -H, -CO2R, -CH2SR, -CH2OR, -CH(OR)2,-CH(OR)(NR2), -CH(NR2)2, (C1-C6) алкил; каждый R независимо представляет собой -H, -С 1-С 6 алкил, -арил, -CH2 арил;X1 представляет собой -H, -Cl, -Br, -I,X2 представляет собой -Cl, -Br, -I, -N(R2)2, -OSO2R,каждый X3 независимо представляет собой -H, -OR, -NR2, -Cl, -Br, -I, -SR, -SO2R, -SO3R, -SR2+; в кислотном растворе с обра зованием соединения 4 в присутствии кислоты, с образованием со единения 5(e) контактирование соединения 5 с Me-X4 в присутствии основания или с MeO-R3 в присутствии(f) последующее выполнение реакции окисления соединения 6 с использованием [O] с получением(g) добавление триазолильной группы 9 к соединению 7 с получением соединения (I),указанного выше, в которомR1 представляет собой -H, -Boc, -Piv, -SO2 арил, -CH2S арил, -CH2OP(O)(OR)2, -CH2OR, -CH2 арил; каждый R2 независимо представляет собой -H, -CO2R, -SO2 арил, -CHO;R3 представляет собой -H, -CO2R, -CH2SR, -CH2OR, -CH(OR)2, -CH(OR)(NR2), -CH(NR2)2; каждый R независимо представляет собой -H, -C1-C6 алкил, -арил, -CH2 арил;X1 представляет собой -H, -Cl, -Br, -I,X2 представляет собой -Cl, -Br, -I, -N(R2)2; каждый X3 независимо представляет собой -H, -OR, -NR2 Cl, -Br, -I, -SR, -SO2R, -SO3R, -SR2+;(e) контактирование соединения 5 с Ме-Х 4 в присутствии основания или с MeO-R3 в присутствии(f) выполнение реакции окисления соединения 6 с использованием [O] с получением соединения 7(h) добавление триазолильной группы 9 получением соединения формулы (I), указанного выше, в которомR2 представляет собой -H, -CO2R, -SO2 арил, -CHO; каждый R3 независимо представляет собой -H, -CO2R, -CH2SR, -CH2OR, -CH(OR)2, -CH(OR)(NR2),-CH(NR2)2; каждый R независимо представляет собой -H, -С 1-С 6 алкил, -арил, -CH2 арил;X1 представляет собой -H, -Cl, -Br, -I,X2 представляет собой -Cl, -Br, -I, -N(R2)2; каждый X3 и X5 независимо представляет собой -H, -OR, -NR2 -Cl, -Br, -I, -SR, -SO2R, -SO3R, -SR2+ и X4 представляет собой -Cl, -Br, -I, -OTs, +NR3, пиридий и и указанный лиганд выбран из группы, состоящей из 1,2-диаминоциклогексана, транс-1,2-диаминоциклогексана, цис-/транс-диаминоциклогексана, цис-N,N'-диметил-1,2-диаминоциклогексана, транс-N,N'-диметил-1,2-диаминоциклогексана, цис-/транс-N,N'-диметил-1,2-диаминоциклогексана, 1,2-диаминоэтана, N,N'-диметил-1,2-диаминоэтана, 1,10-фенантролина, 4,7-дифенил-1,10-фенантролина, 5-метил-1,10-фенантролина, 5-хлор-1,10-фенантролина и 5-нитро-1,10-фенантролина. 10. Способ по п.9, отличающийся тем, что R1 представляет собой -SO2 арил. 11. Способ по п.10, отличающийся тем, что X1 представляет собой -H. 12. Способ по п.11, отличающийся тем, что X3 представляет собой -H. 13. Способ получения соединения(b) реакцию активации, включающую взаимодействие соединения 11 с соединением 13(c) присоединение триазолильного соединения 9(e) реакцию интерконверсии функциональной группы с образованием соединения II, указанного выше, в которомR6 представляет собой -H, -Boc, -Piv, -SO2 арил, -CH2S арил, -CH2OP(O)(OR)2, -CH2OR, -CH2 арил,-Li, Na, K, Ca, Mg, TMG; каждый R независимо представляет собой -H, -C1-C6 алкил, -арил, -CH2 арил;X6 представляет собой -H, -OR, -NR2, -Cl, -Br, -I, -SR, -SO2R, -SR2+, -OSO2R, -OSO3R,и X7 представляет собой -Cl, -Br, -I, -OSO2R. 14. Способ по п.13, отличающийся тем, что R представляет собой транс-бутил, R6 и X1 представляют собой -H. 15. Способ по п.13, отличающийся тем, что R5 представляет собой -ОМе. 16. Способ получения соединения III с фталевым ангидридом, H2O2 и дихлорметаном с об разованием соединения и(2) реакцию PyBroP-бромирования, включающую взаимодействие соединения ii с PyBroP, с образованием соединения III: где R7 представляет собой -H, алкил, арил, -SO2R, -C(O)OR и -C(O)NR2,где R представляет собой -H, C1-C6 алкил, -арил, -CH2 арил. 17. Соединение, включая его фармацевтически приемлемые соли, которое выбрано из следующей группы: с TRIS и необязательно со вторым растворителем с образованием соединения 19. Способ по п.18, отличающийся тем, что указанный первый растворитель выбран из группы, состоящей из NMP, ДМСО, MeCN, MeOH, ацетона и карбоновой кислоты. 20. Способ по п.18, отличающийся тем, что указанный второй растворитель выбран из группы, состоящей из алкилкетона, гептана, толуола и этилацетата. 21. Способ по п.18, отличающийся тем, что первый растворитель представляет собой уксусную кислоту и указанный второй растворитель представляет собой ацетон. 22. Способ получения соединения 13 а вии треххлористого алюминия (AlCl3), с образованием соединения 2 а(2) последующее превращение соединения 2 а в аминокетон 3 а путем замещения 2 хлоркетоновой группировки натриевой солью N-формилсульфонамида, в присутствии тетраалкиламмония галогенида; в присутствии серной кислоты с образованием со единения 4 а(4) циклизацию Пикте-Шпенглера с формальдегидом в присутствии трифторуксусной кислоты в(5) обработку соединения 5 а триметилортоформиатом (TMOF) и кислотой в присутствии радикаль ного инициатора с получением 6-азаиндольного соединения 6 а(6) окисление азота пиридина в соединении 6 а с использованием перекиси водорода (H2O2) и фта левого ангидрида с получением N-оксидного соединения 7 а и(7) обработку соединения 7 а PyBroP, в присутствии оснований K3PO4 и NaOH с получением бром азаиндольного соединения 8 а(8) последующее ацилирование соединения 8 а в C3-позиции индольной группы с получением окса(9) взаимодействие соединения 9 а с N-бензоилпиперазином с образованием амидного соединения 10 а(11) необязательное получение из соединения 11 а соединения 11b или 11 с:(12) алкилирование индольного азота соединения 11a, 11b или 11 с с использованием хлор фосфатного соединения с получением фосфатного эфира 12 а(13) сольволиз трет-бутильных групп соединения 12 а с образованием конечного соединения 13 а. 23. Способ получения соединения 13 а включающий:(2) последующее превращение соединения 2 а в аминокетон 3 а хлоркетоновой группировки натриевой солью N-формилсульфонамида; и путем замещения 2 в присутствии кислоты, с образованием соедине ния 4 а(5) обработку соединения 5 а триметилортоформиатом (TMOF) и кислотой в присутствии радикаль ного инициатора, с получением 6-азаиндольного соединения 6 а(6) окисление азота пиридина в соединении 6 с получением N-оксидного соединения 7 а(8) последующее ацилирование соединения 8 а в C3-позиции индольной группы с получением окса латного соединения 9 а к соединению 10 а с использованием катализа в присут ствии лиганда и основания с получением соединения 11 а(11) необязательное получение из соединения 11 а соединения 11b или 11 с:(12) алкилирование индольного азота соединения 11a, 11b или 11 с с использованием хлорфосфат ного соединения с получением фосфатного эфира 12 а(13) сольволиз трет-бутильных групп соединения 12 а с образованием конечного соединения 13 а.
МПК / Метки
МПК: C07D 471/04
Метки: способы, получения, приcоединения, ингибитора, пролекарства, пиперазинового, вич
Код ссылки
<a href="https://eas.patents.su/23-24872-sposoby-polucheniya-piperazinovogo-prolekarstva-ingibitora-pricoedineniya-vich.html" rel="bookmark" title="База патентов Евразийского Союза">Способы получения пиперазинового пролекарства – ингибитора приcоединения вич</a>
Предыдущий патент: Жгуты с высоким денье на волокно и низким общим денье
Следующий патент: Терапевтическое средство при дислипидемии
Случайный патент: Маркировочное устройство и способ маркировки