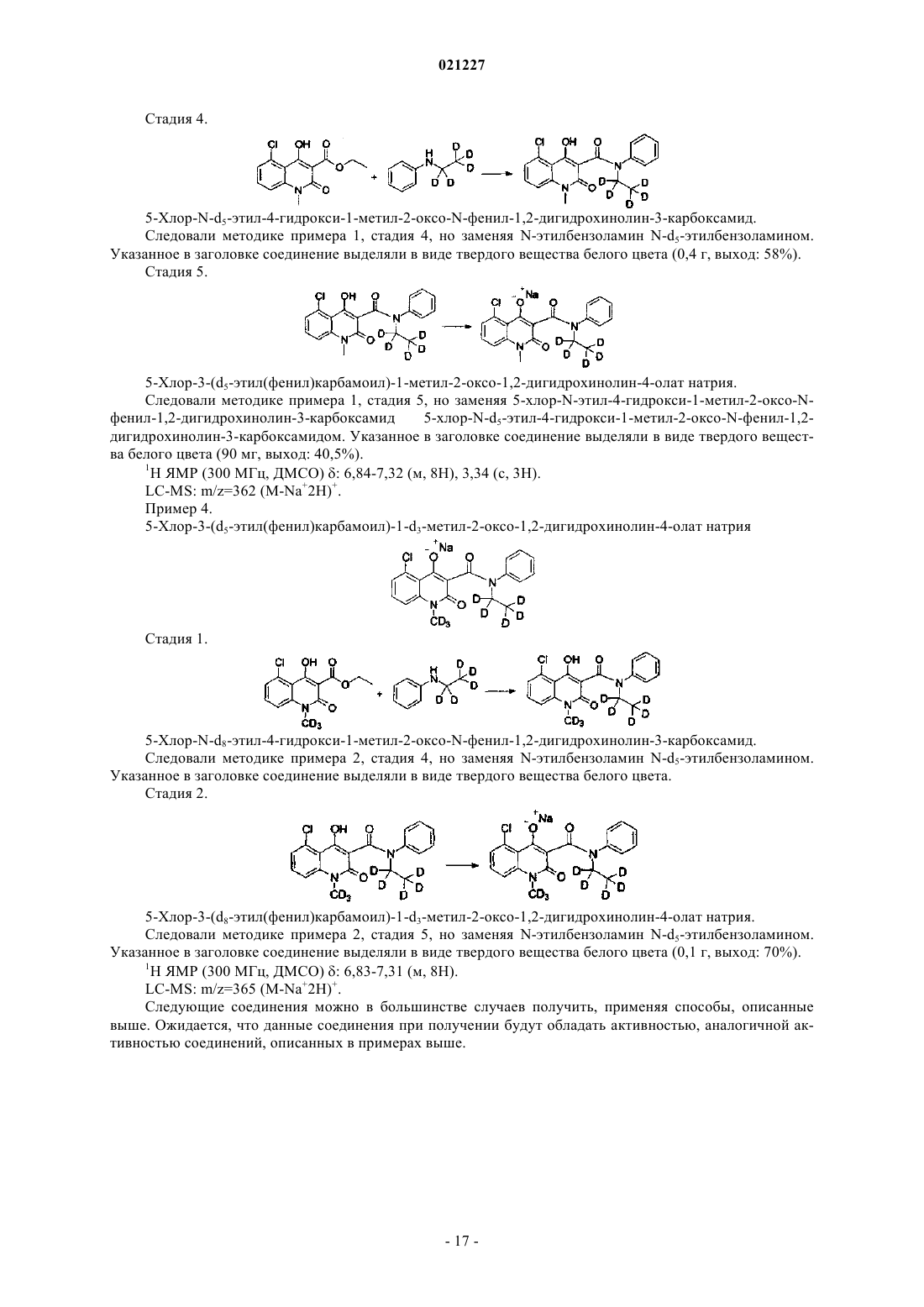
2-оксо-1,2-дигидрохинолиновые модуляторы иммунной функции
Формула / Реферат
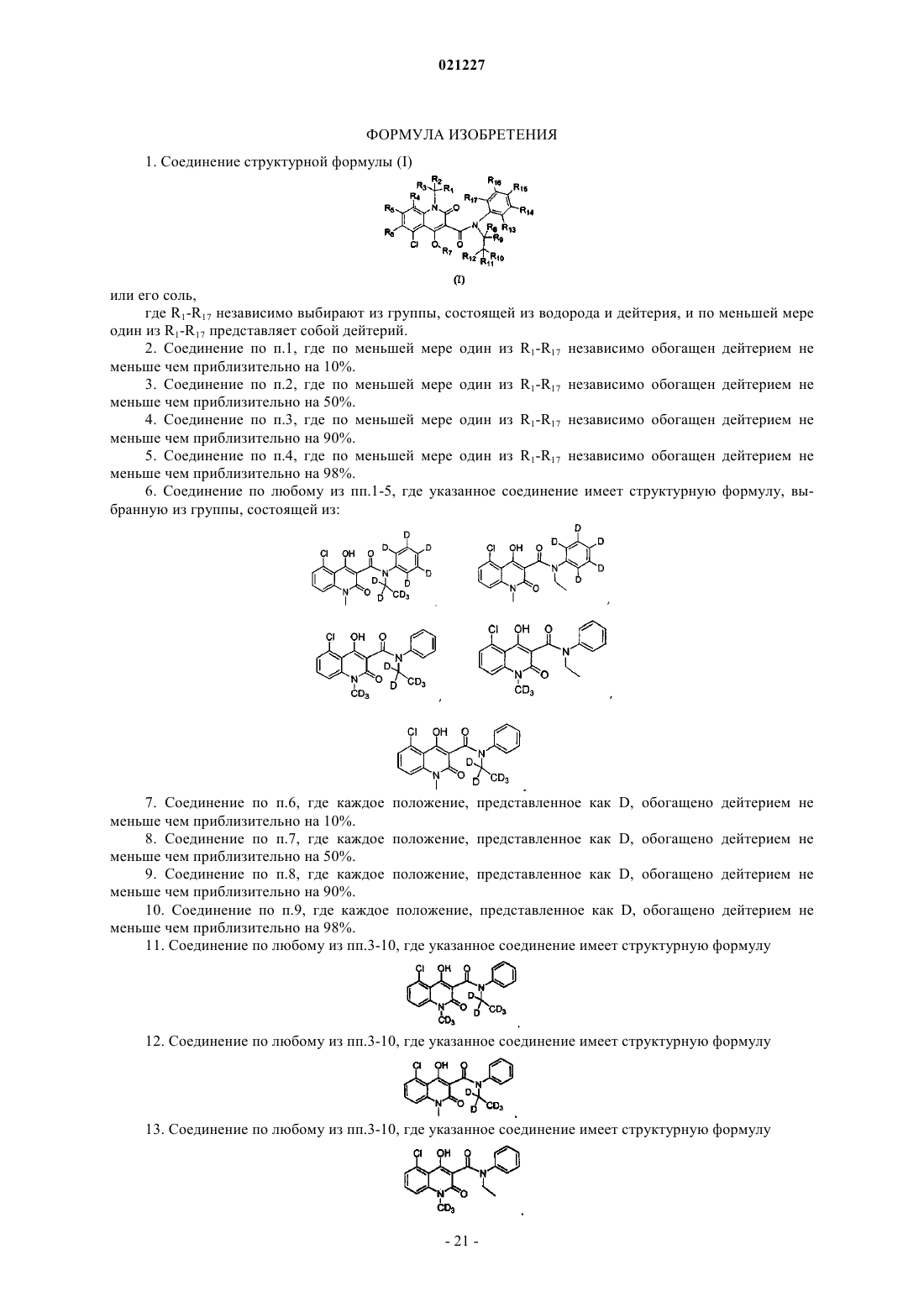
1. Соединение структурной формулы (I)
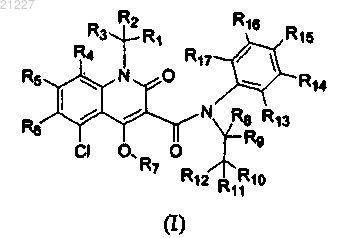
или его соль,
где R1-R17 независимо выбирают из группы, состоящей из водорода и дейтерия, и по меньшей мере один из R1-R17 представляет собой дейтерий.
2. Соединение по п.1, где по меньшей мере один из R1-R17 независимо обогащен дейтерием не меньше чем приблизительно на 10%.
3. Соединение по п.2, где по меньшей мере один из R1-R17 независимо обогащен дейтерием не меньше чем приблизительно на 50%.
4. Соединение по п.3, где по меньшей мере один из R1-R17 независимо обогащен дейтерием не меньше чем приблизительно на 90%.
5. Соединение по п.4, где по меньшей мере один из R1-R17 независимо обогащен дейтерием не меньше чем приблизительно на 98%.
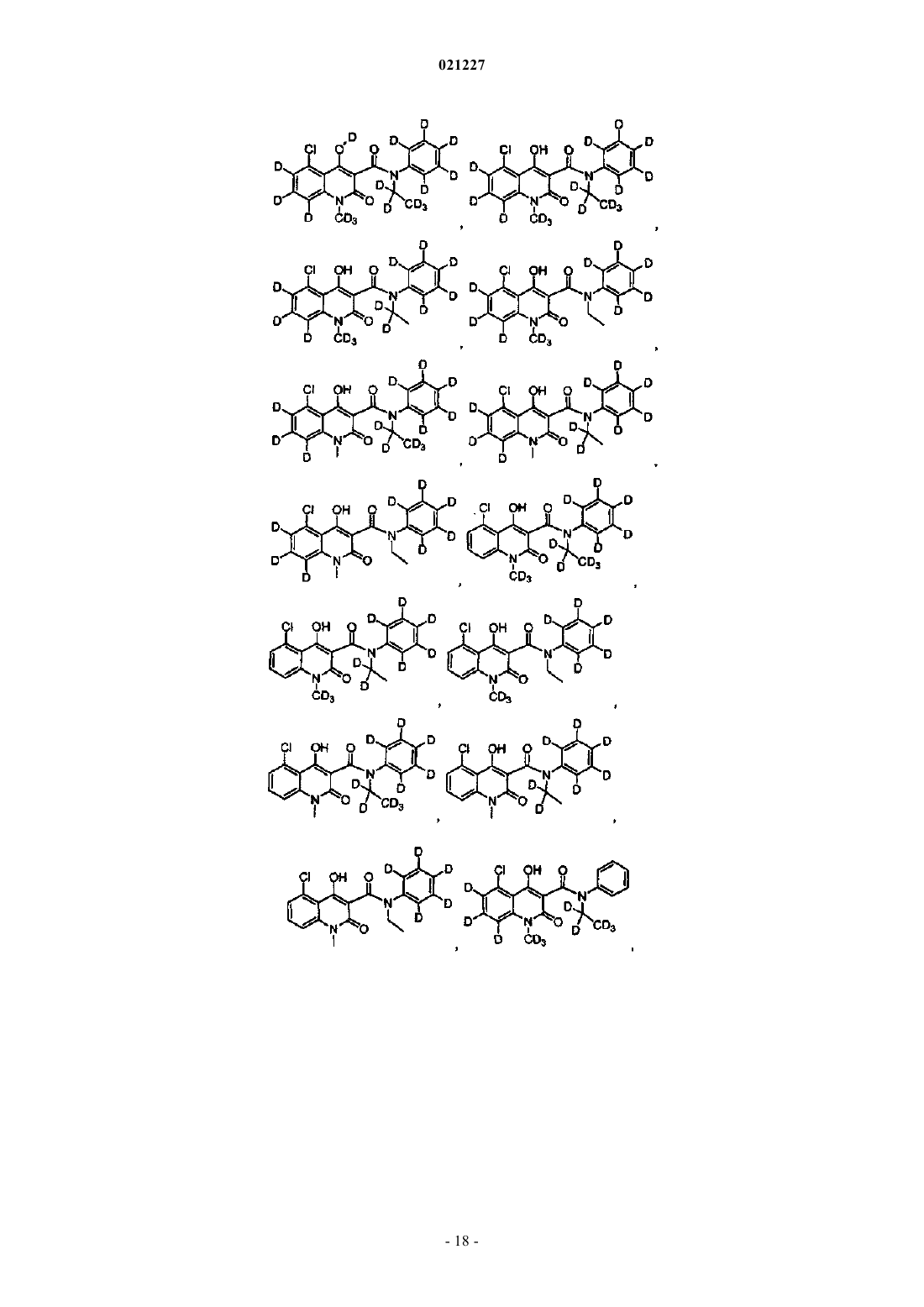
6. Соединение по любому из пп.1-5, где указанное соединение имеет структурную формулу, выбранную из группы, состоящей из:
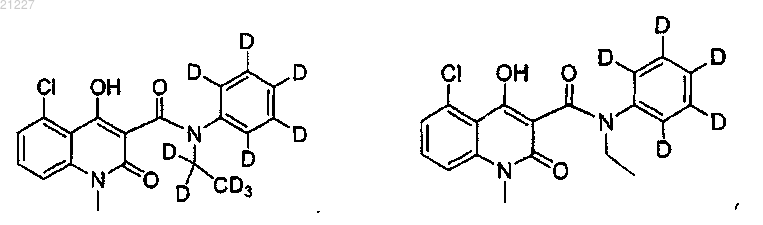
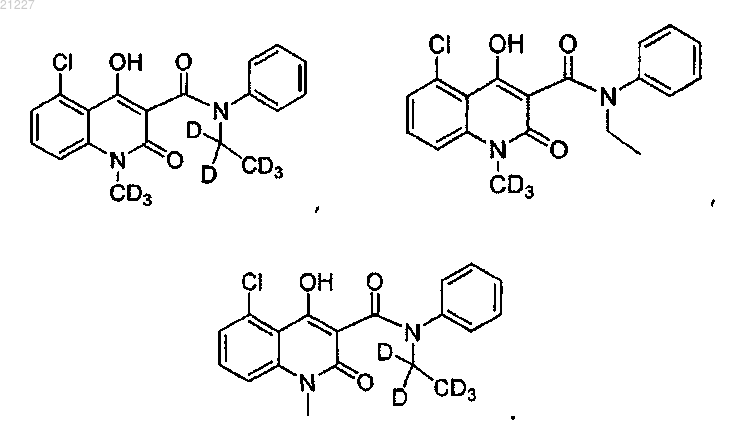
7. Соединение по п.6, где каждое положение, представленное как D, обогащено дейтерием не меньше чем приблизительно на 10%.
8. Соединение по п.7, где каждое положение, представленное как D, обогащено дейтерием не меньше чем приблизительно на 50%.
9. Соединение по п.8, где каждое положение, представленное как D, обогащено дейтерием не меньше чем приблизительно на 90%.
10. Соединение по п.9, где каждое положение, представленное как D, обогащено дейтерием не меньше чем приблизительно на 98%.
11. Соединение по любому из пп.3-10, где указанное соединение имеет структурную формулу
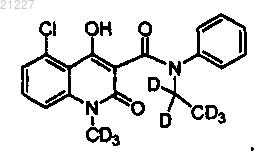
12. Соединение по любому из пп.3-10, где указанное соединение имеет структурную формулу
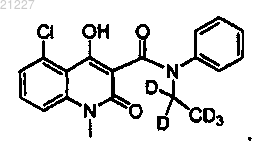
13. Соединение по любому из пп.3-10, где указанное соединение имеет структурную формулу
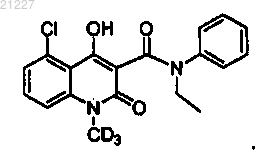
14. Фармацевтическая композиция, содержащая соединение по любому из пп.1-13 вместе с фармацевтически приемлемым носителем.
15. Применение соединения по любому из пп.1-13 при лечении пациента, страдающего заболеванием, опосредованным иммунной функцией.
16. Применение по п.15, где указанное заболевание представляет собой множественный склероз и аутоиммунные заболевания.
17. Применение соединения по любому из пп.1-13 в качестве лекарственного средства для лечения заболевания, опосредованного иммунной функцией.
18. Применение соединения по любому из пп.1-13 при предотвращении или лечении заболевания, облегчаемого модулированием иммунной функции.
Текст
Изобретение относится к новым 2-оксо-1,2-дигидрохинолиновым модуляторам иммунной функции формулы I где R1-R17 независимо выбирают из группы, состоящей из водорода и дейтерия; и по меньшей мере один из R1-R17 представляет собой дейтерий, к их фармацевтическим композициям и способам их применения.(71)(73) Заявитель и патентовладелец: ТЕВА ФАРМАСЬЮТИКАЛ ИНДАСТРИЗ ЛТД. (IL) По заявке на данное изобретение испрашивается приоритет согласно предварительной заявке США 61/093943, поданной 3 сентября 2008 г., описание которой вводится в настоящее изобретение с помощью ссылки, как если бы она была описана в настоящем изобретении полностью. Настоящее изобретение относится к новым замещенным 2-оксо-1,2-дигидрохинолиновым соединениям, полученным из них фармацевтическим композициям и способам регулирования активности иммунной функции у субъекта для лечения заболеваний, таких как рассеянный склероз и аутоиммунные заболевания. Лаквинимод (ABR 215062; SAIK-MS; ABR-215062; SAIKMS; CAS248281-84-7), этилфениламид 5-хлор-4-гидрокси-1-метил-2-оксо-1,2-дигидрохинолин-3-карбоновой кислоты, представляет собой модулятор иммунной функции. Лаквинимод в настоящее время исследуется для лечения рассеянного склероза (Burton et al., Curr. Neurol.Neurosc. Reports, 2007, 7(3), 223-30; Tuvesson et al., Xenobiotica, 2005,35(3), 293-304; Cohen et al., Int. J. Clin. Pract. 2007, 61(11), 1922-30). Лаквинимод также является перспективным для лечения аутоиммунных заболеваний (Tuvesson et al., Xenobiotica, 2005, 35(3), 293-304). Лаквинимод подвергается исчерпывающему окислительному метаболизму цитохром Р 450 ферментами, в частности CYP3A4 (Tuvesson et al., Drug Metab.Disp. 2005, 33(6), 866-72). Первичные метаболиты включают метаболиты, образованные при гидроксилировании хинолина в различных положениях,деметилировании хинолина, деэтилировании анилина и гидроксилировании анилина в пара-положении(Tuvesson et al., Xenobiotica, 2005, 35(3), 293-304). Кинетический изотопный эффект дейтерия. Для того чтобы удалить инородные вещества, такие как терапевтические агенты, организм животного синтезирует различные ферменты, такие как цитохром Р 450 ферменты (CYP), эстеразы, протеазы,редуктазы, дегидрогеназы и моноаминоксидазы, для реакции с и для превращения данных инородных веществ в более полярные промежуточные соединения или метаболиты для выведения с мочой. Данные метаболические реакции часто включают окисление углерод-водородной (С-Н) связи до или углеродкислородной (С-О) или углерод-углеродной (С-С) -связи. Полученные в результате метаболиты могут быть стабильными или нестабильными в физиологических условиях и могут иметь в значительной степени различные фармакокинетические, фармакодинамические профили и профили острой и долгосрочной токсичности по сравнению с исходными соединениями. Для большинства лекарственных средств данное окисление является обычно быстрым и в конечном счете ведет к введению большого количества или высоких дневных доз. Соотношение между энергией активации и скоростью реакции можно рассчитать количественно с помощью уравнения Аррениуса, k=Ae-Eact/RT. Уравнение Аррениуса утверждает, что при заданной температуре скорость химической реакции экспоненциально зависит от энергии активации (Eact). Переходное состояние в реакции представляет собой кратковременное состояние в ходе реакции, в течение которого первоначальные связи напряжены до предела. По определению, энергия активации Eact для реакции представляет собой энергию, требуемую для достижения переходного состояния данной реакции. При достижении переходного состояния молекулы могут или превратиться обратно в исходные реагирующие вещества, или образовать новые связи, приводя к продуктам реакции. Катализатор облегчает протекание реакции за счет снижения энергии активации, приводящей к переходному состоянию. Ферменты являются примерами биологических катализаторов. Сила углерод-водородной связи прямо пропорциональна абсолютной величине колебательной энергии основного состояния связи. Данная колебательная энергия зависит от массы атомов, которые образуют связь, и увеличивается по мере увеличения массы одного или обоих атомов, образующих связь. Поскольку дейтерий (D) имеет массу, в два раза большую массы протия (1 Н), C-D связь является более прочной, чем соответствующая С-1 Н связь. Если С-1 Н связь разрывается в процессе определяющей скорость реакции стадии в химической реакции (т.е. стадии с самой высокой энергией переходного состояния), то замещение данного протия дейтерием будет вызывать снижение скорости реакции. Данный феномен известен как кинетический изотопный эффект дейтерия (DKIE). Величину DKIE можно выразить как соотношение между скоростями указанной реакции, в которой расщепляется С-1H связь, и той же самой реакции, в которой протий замещен дейтерием. DKIE может находиться в диапазоне от приблизительно 1 (отсутствие изотопного эффекта) до очень больших значений, таких как 50 или более. Замещение водорода тритием приводит в результате к еще большей силе связи, чем дейтерий, и дает численно большие изотопные эффекты. Дейтерий (2 Н или D) представляет собой стабильный и нерадиоактивный изотоп водорода, который имеет приблизительно в два раза большую массу, чем протий (1 Н), наиболее распространенный изотоп водорода. Оксид дейтерия (D2O или "тяжелая вода") выглядит и имеет аналогичный H2O вкус, но имеет другие физические свойства. Когда грызунам дают чистую D2O, она легко поглощается. Количество дейтерия, требуемое для того, чтобы вызвать токсичность, является крайне высоким. При замещении приблизительно 0-15% воды организма D2O животные остаются здоровыми, но не способны набирать вес так быстро, как в контрольной (необработанной) группе. При замещении приблизительно 15-20% воды организма D2O животные становятся возбужденными. При замещении приблизительно 20-25% воды организма D2O животные становятся настолько возбужденными, что они впадают в частые конвульсии при стимулировании. Появляются нарушения кожи, язвы на лапах и мордочке и некроз хвоста. Животные также становятся очень агрессивными. При замещении приблизительно 30% воды организма D2O животные отказываются принимать пищу и становятся неподвижными. Вес их тела резко падает, и их скорость метаболизма падает значительно ниже нормы, причем смерть наблюдается приблизительно при замещении 30-35% D2O. Данные эффекты являются обратимыми, если не больше чем 30% предшествующего веса тела потеряно благодаря D2O. Исследования также показали, что применение D2O может задерживать рост раковых клеток и увеличивать цитотоксичность определенных противоопухолевых препаратов. Дейтерирование лекарственных препаратов для улучшения фармакокинетических (PK), фармакодинамических (PD) профилей и профилей токсичности было продемонстрировано ранее с некоторыми классами лекарственных средств. Например, DKIE применяют для снижения гепатотоксичности галотана, предположительно за счет ограничения синтеза реакционноспособных частиц, таких как трифторацетилхлорид. Однако данный способ не может быть приемлемым для всех классов лекарственных средств. Например, введение дейтерия может приводить к метаболическому переключению. Метаболическое переключение происходит, когда ксеногены, изолированные ферментами фазы I, временно связываются и повторно связываются в ряде конформаций перед химической реакцией (например, окислением). Метаболическое переключение делается возможным благодаря относительно большому размеру связывающих карманов у многих ферментов фазы I и низкой селективности многих метаболических реакций. Метаболическое переключение может приводить к различным соотношениям известных метаболитов, а также к совершенно новым метаболитам. Данные новые метаболические профили могут придавать большую или меньшую токсичность. Такие подводные камни не являются очевидными и предсказуемыми заранее для любого класса лекарственных средств. Лаквинимод представляет собой модулятор иммунной функции. Углерод-водородные связи лаквинимода включают наблюдаемое в природе распределение изотопов водорода, а именно 2 Н или протия(приблизительно 99,9844%), 2 Н или дейтерия (приблизительно 0,0156%) и 3H или трития (в диапазоне от приблизительно 0,5 до 67 атомов трития на 1018 атомов протия). Увеличенное число атомов дейтерия может вызывать обнаруживаемый кинетический изотопный эффект дейтерия (DKIE), который может влиять на фармакокинетические, фармакологические и/или токсикологические профили лаквинимода по сравнению с лаквинимодом, содержащим природное количество атомов дейтерия. На основании открытий, сделанных в лаборатории авторов изобретения, а также принимая во внимание литературные данные, лаквинимод метаболизируется у людей при хинолиновом кольце,N-метильной группе, N-этильной группе и фенильной группе. Настоящий подход обладает потенциалом предотвратить метаболизм в этих положениях. Другие положения в молекуле могут также подвергаться превращениям, приводящим к метаболитам пока еще с неизвестной фармакологией/токсикологией. Ограничение продуцирования данных метаболитов обладает потенциалом снижать опасность введения данных лекарственных средств и может даже позволить повысить дозу и/или эффективность. Все данные превращения могут происходить при участии полиморфно-экспрессируемых ферментов, усиливая межиндивидуальные различия. Кроме того, некоторые заболевания лечатся наилучшим образом, когда субъекта лечат лекарственным средством постоянно или в течение продолжительного периода времени. По всем вышеизложенным причинам терапия с большим периодом полужизни может приводить в результате к большей эффективности и экономии затрат. Различные дейтерированные образцы можно применять для (а) снижения или удаления нежелательных метаболитов; (b) увеличения времени полужизни исходного лекарственного средства; (с) снижения числа доз, необходимых для достижения требуемого эффекта; (d) снижения количества дозы, требуемого для достижения требуемого эффекта; (е) усиления образования активных метаболитов, если они образуются; (f) замедления синтеза вредных метаболитов в специфических тканях и/или (g) для создания более эффективного лекарственного средства и/или более безопасного лекарственного средства против полипрогмазии, является ли полипрогмазия преднамеренной или нет. Подход с применением дейтерия обладает большим потенциалом замедления метаболизма лаквинимода и уменьшения межиндивидуальных различий. Были получены новые соединения и фармацевтические композиции, для некоторых из которых было найдено, что они регулируют иммунную функцию, и были разработаны способы получения и применения данных соединений, включая способы лечения заболеваний, опосредованных иммунной функцией, у пациентов введением данных соединений. В определенных вариантах осуществления настоящее изобретение относится к соединению структурной формулы I или его соли, сольвату или пролекарству,где R1-R17 независимо выбирают из группы, состоящей из водорода и дейтерия, и по меньшей мере один из R1-R17 представляет собой дейтерий. Определенные соединения, описанные в настоящем изобретении, могут обладать пригодной активностью, регулирующей иммунную функцию, и их можно применять для лечения или профилактики заболевания, при котором иммунная функция играет активную роль. Таким образом, определенные варианты осуществления также относятся к фармацевтическим композициям, содержащим одно или более соединений, описанных в настоящем изобретении, вместе с фармацевтически приемлемым носителем, а также способам получения и применения данных соединений и композиций. Определенные варианты осуществления относятся к способам регулирования иммунной функции. Другие варианты осуществления относятся к способам лечения заболевания, опосредованного иммунной функцией, у нуждающегося в данном лечении пациента, включающим введение упомянутому субъекту терапевтически эффективного количества соединения или композиции согласно настоящему изобретению. Настоящее изобретение также относится к применению определенных соединений, описанных в настоящем изобретении, для применения в получении лекарственного средства для предотвращения или лечения заболевания, облегчаемого регулированием иммунной функции. Соединения, как описано в настоящем изобретении, могут также содержать менее распространенные изотопы других элементов, включая, но не ограничиваясь этим, 13 С или 14 С для углерода, 33S, 34S или 36S для серы, 15N для азота и 17O или 18O для кислорода. В определенных вариантах осуществления соединение, описанное в настоящем изобретении, может оказывать воздействие на пациента максимум приблизительно 0,000005% D2O или приблизительно 0,00001% DHO, предполагая, что все C-D связи в соединении, как описано в настоящем изобретении,метаболизируются и высвобождаются в виде D2O или DHO. В определенных вариантах осуществления показано, что концентрация D2O, вызывающая токсичность у животных, является гораздо большей, чем даже максимальный предел воздействия, вызванный введением соединения, обогащенного дейтерием,как описано в настоящем изобретении. Таким образом, в определенных вариантах осуществления соединение, обогащенное дейтерием, описанное в настоящем изобретении, не должно вызывать никакой дополнительной токсичности в результате образования D2O или DHO после метаболизма лекарственного средства. В определенных вариантах осуществления дейтерированные соединения, описанные в настоящем изобретении, сохраняют полезные свойства соответствующих изотопно необогащенных молекул, в то же время значительно увеличивая максимальную переносимую дозу, уменьшая токсичность, увеличивая время полужизни (T1/2), снижая максимальную концентрацию в плазме (Cmax) минимальной эффективной дозы (MED), снижая эффективную дозу и, таким образом, снижая токсичность, не связанную с механизмом действия, и/или снижая возможность взаимодействия лекарственных средств между собой. Все публикации и ссылки, приводимые в настоящем изобретении, ясно вводятся полностью в настоящее изобретение с помощью ссылки. Однако, что касается любых аналогичных или идентичных терминов, имеющихся во введенных публикациях или ссылках, и терминов, предложенных в явной форме или определенных в данном документе, определения или значения терминов, предложенные в явной форме, должны быть определяющими во всех аспектах. Как применяют в настоящем изобретении, термины ниже имеют показанные значения. Формы, представленные в единственном числе, могут относиться к формам во множественном числе, если специально не указано обратное. Предполагается, что термин "приблизительно", как применяют в настоящем изобретении, относится к численным величинам, которые оно изменяет, обозначая данную величину как переменную с допустимой погрешностью или в пределах ошибки. Когда допустимая погрешность или предел ошибки, такой как стандартное отклонение от средней величины, данный на графике или в таблице данных, не перечисляется, следует понимать, что термин "приблизительно" обозначает данный диапазон, который мог бы включать приведенную величину, и диапазон, который мог бы быть включен округлением в большую или меньшую сторону цифры, а также принимая во внимание значащие цифры. При описании диапазонов величин и при использовании обозначений "от n1 до n2" или "n1-n2, где n1 и n2 представляют собой числа, если не указано особо, предполагается, что данное обозначение включает сами числа и диапазон между ними. Данный диапазон может быть составным или непрерывным и вклю-3 021227 чать предельные величины. Термин "обогащение дейтерием" относится к процентам введенного дейтерия в указанном положении в молекуле вместо водорода. Например, обогащение дейтерием 1% в данном положении обозначает то, что 1% молекул в данном образце содержит дейтерий в конкретном положении. Поскольку природное распространение дейтерия составляет приблизительно 0,0156%, обогащение дейтерием в любом положении в соединении, полученном с применением необогащенных исходных соединений, составляет приблизительно 0,0156%. Обогащение дейтерием можно определить, применяя подходящие аналитические способы, известные специалистам в данной области техники, включая масс-спектрометрию и спектроскопию ядерного магнитного резонанса. Термин "представляет собой/представляют собой дейтерий" при применении для описания указанного положения в молекуле, такого как R1-R17, или символ "D" при применении для обозначения указанного положения в изображении молекулярной структуры обозначают, что указанное положение обогащено дейтерием выше встречающегося в природе распространения дейтерия. В одном варианте осуществления обогащение дейтерием составляет не меньше чем приблизительно 1%, в другом не меньше чем приблизительно 5%, в другом не меньше чем приблизительно 10%, в другом не меньше чем приблизительно 20%, в другом не меньше чем приблизительно 50%, в другом не меньше чем приблизительно 70%, в другом не меньше чем приблизительно 80%, в другом не меньше чем приблизительно 90% или в другом не меньше чем приблизительно 98% дейтерия в конкретном положении. Термин "изотопно обогащенный" относится к проценту введения менее распространенного изотопа элемента в указанное положение в молекуле вместо более распространенного изотопа элемента. Термин "изотопно необогащенный" относится к молекуле, в которой процентное содержание различных изотопов является практически таким же, как процент, встречающийся в природе. В соединениях, описанных в настоящем изобретении, имеются асимметрические центры. Данные центры обозначаются символами "R" или "S," в зависимости от конфигурации заместителей вокруг хирального атома углерода. Ясно, что настоящее изобретение включает все стереохимически изомерные формы, включая диастереомерные, энантиомерные и эпимерные формы, а также D-изомеры и L-изомеры и их смеси. Отдельные стереоизомеры соединений можно получить синтетически из имеющихся в продаже исходных соединений, которые содержат хиральные центры, или получением смесей энантиомерных продуктов с последующим разделением, таким как превращение в смесь диастереомеров, с последующим разделением или перекристаллизацией, хроматографическими методиками, прямым разделением энантиомеров на хиральных хроматографических колонках или любым другим подходящим способом, известным в данной области техники. Исходные соединения конкретной стереохимии или имеются в продаже, или их можно получить и разделить способами, хорошо известными в данной области техники. Кроме того, соединения, описанные в настоящем изобретении, могут существовать в виде геометрических изомеров. Настоящее изобретение включает все цис-, транс-, син-, анти, entgegen (Е) (напротив) иzusammen (Z) (вместе) изомеры, а также их подходящие смеси. Кроме того, соединения могут существовать в виде таутомеров; все таутомерные изомеры включены в настоящее изобретение. Кроме того, соединения, описанные в настоящем изобретении, могут существовать в несольватированной, а также в сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и подобные. В общем, сольватированные формы считаются эквивалентами несольватированным формам. Термин "связь" относится к ковалентному соединению между двумя атомами, или две группы, когда атомы соединены связью, считаются частью большой подструктуры. Связь может быть одинарной,двойной или тройной, если не указано особо. Пунктирная линия между двумя атомами в изображении молекулы показывает, что дополнительная связь может присутствовать или отсутствовать в данном положении. Предполагается, что термин "расстройство", как применяют в настоящем изобретении, является общим синонимом, и его применяют взаимозаменяемо с терминами "заболевание" и "состояние" (как при медицинском показании), в том смысле, что все, отражающее ненормальное состояние организма человека или животного или одной из его частей, что нарушает нормальное функционирование, обычно проявляется отличительными признаками и симптомами. Подразумевается, что термины "лечить" и "лечение" включают облегчение или устранение заболевания или одного, или более симптомов, связанных с заболеванием; или облегчение или искоренение причины (причин) самого заболевания. Как применяют в настоящем изобретении, предполагается, что ссылка на "лечение" заболевания включает предотвращение. Термины "предотвратить" и "предотвращение" относятся к способу замедления или предотвращения возникновения заболевания и/или сопутствующих его симптомов, предотвращая приобретение субъектом заболевания или снижая риск приобретения субъектом заболевания. Термин "терапевтически эффективное количество" относится к количеству соединения, которое при введении является достаточным для предотвращения развития или облегчения до некоторой степени одного или более симптомов заболевания, которое лечат. Термин "терапевтически эффективное количество" также относится к количеству соединения, которое является достаточным для того, чтобы вызвать биологический или медицинский ответ клетки, ткани, системы, животного или человека, который стре-4 021227 мится получить исследователь, ветеринарный врач, лечащий врач или практикующий врач. Термин "субъект" относится к животному, включая, но не ограничиваясь этим, примата (например,человека, обезьяну, шимпанзе, гориллу и подобные), грызунов (например, крыс, мышей, песчанок, хомяков, хорьков и подобных), зайцеобразных, свиней (например, свиней, миниатюрных свиней), лошадь,собаку, кошку и подобные. Термины "субъект" и "пациент" применяют взаимозаменяемо в настоящем изобретении относительно, например, субъекта, являющегося млекопитающим, такого как пациент человек. Термин "комбинированная терапия" относится к введению двух или более терапевтических агентов для лечения заболевания, поддающегося терапевтическому лечению, описанному в настоящем изобретении. Данное введение включает совместное введение данных терапевтических агентов в практически одновременном режиме, таком как в одной капсуле, содержащей фиксированное соотношение активных ингредиентов, или в нескольких отдельных капсулах для каждого активного ингредиента. Кроме того,данное введение также включает применение каждого типа терапевтического агента в последовательном режиме. В обоих случаях режим лечения будет оказывать благоприятное действие комбинации лекарственных средств при лечении заболеваний, описанных в настоящем изобретении. Термин "иммунная функция" относится к серии механизмов в организме, которые защищают его от заболевания. Данные механизмы включают макрофаги, Т-лимфоциты и В-лимфоциты и их соответствующие активности. Термин "заболевание, опосредованное иммунной функцией" относится к заболеванию, которое характеризуется нарушением иммунной функции. Заболевание, опосредованное иммунной функцией, может полностью или частично быть опосредовано регулированием иммунной функции у субъекта. В частности, заболевание, опосредованное иммунной функцией, представляет собой заболевание, при котором регулирование иммунной функции приводит в результате к некоторому действию на лежащее в основе заболевание, например введение модулятора иммунной функции приводит в результате к некоторому улучшению, по меньшей мере, некоторых из пациентов, которых лечат. Термин "модулятор иммунной функции" относится к способности соединения, описанного в настоящем изобретении, изменять активность иммунной функции. Модулятор иммунной функции может стимулировать активность иммунной функции, может активировать или ингибировать активность иммунной функции в зависимости от концентрации соединения, воздействующей на субъекта, или может ингибировать активность иммунной функции. Данная активация или ингибирование может зависеть от частоты конкретного события, такого как активация пути сигнальной трансдукции, и/или может проявляться только в конкретных типах клеток. Например, соединения, описанные в настоящем изобретении,могут регулировать иммунную функцию ингибированием инфильтрации и CD4+ Т-клеток и макрофагов в тканях центральной нервной системы и изменением популяции Т-лимфоцитов в пользу клеток, экспрессирующих Th2/Th3 цитокиновые интерлейкины (IL)-4, IL-10 и трансформирующий ростовой фактор бета. В некоторых вариантах осуществления регулирование иммунной функции может быть оценено,применяя способ, описанный в Karussis et al., Ann. Neurol. 1993, (34), 654-660; Yang, et al., Journal ofNeuroimmunology, 2004, 156(1-2), 3-9; Brunmark et al., J. Neuroimmunol. 2002, 130, 163-172 и Jonsson et al.,J. Med. Chem. 2004, 47, 2075-88. Термин "терапевтически приемлемый" относится к тем соединениям (или солям, пролекарствам,таутомерам, цвиттерионным формам и т.д.), которые являются пригодными для применения в контакте с тканями пациента без чрезмерной токсичности, раздражения, аллергического ответа, иммуногенности,действие которых соразмерно с приемлемым отношением риск/польза, и которые являются эффективными для их предполагаемого применения. Термин "фармацевтически приемлемый носитель", "фармацевтически приемлемый эксципиент","физиологически приемлемый носитель" или "физиологически приемлемый эксципиент" относится к фармацевтически приемлемому веществу, композиции или среде, таким как жидкий или твердый наполнитель, разбавитель, эксципиент, растворитель или инкапсулирующее вещество. Каждый компонент должен представлять собой "фармацевтически приемлемый", в смысле быть совместимым с другими ингредиентами фармацевтических составов. Он должен также подходить для применения в контакте с тканью или органом людей и животных без чрезмерной токсичности, раздражения, аллергического ответа, иммуногенности или других проблем или осложнений, и иметь соразмерное приемлемое отношение риск/польза. См. Remington: The Science and Practice of Pharmacy, 21st Edition; Lippincott WilliamsFormulation, Gibson Ed., CRC Press LLC: Boca Raton, FL, 2004). Термины "активный ингредиент", "активное соединение" и "активное вещество" относятся к соединению, которое вводят отдельно или в комбинации с одним или более фармацевтически приемлемыми эксципиентами или носителями субъекту для лечения, предотвращения или облегчения одного или более симптомов заболевания. Термины "лекарственное средство", "терапевтический агент" и "химиотерапевтический агент" относятся к соединению или его фармацевтической композиции, которые вводят субъекту для лечения,предотвращения или облегчения одного или более симптомов заболевания. Термин "эксципиент, контролирующий высвобождение" относится к эксципиенту, чья основная функция заключается в изменении продолжительности или места высвобождения активного вещества из дозированной формы по сравнению с обычной дозированной формой с немедленным высвобождением. Термин "эксципиент, не контролирующий высвобождение" относится к эксципиенту, чья основная функция не включает изменение продолжительности или места высвобождения активного вещества из дозированной формы по сравнению с обычной дозированной формой с немедленным высвобождением. Термин "пролекарство" относится к функциональному производному соединения, как описано в настоящем изобретении, которое легко превращается в исходное соединение in vivo. Пролекарства часто являются полезными, так как в некоторых ситуациях их можно легче вводить, чем исходное соединение. Например, они могут быть биодоступными при пероральном введении, тогда как исходное соединение нет. Пролекарство может также обладать повышенной растворимостью в фармацевтической композиции по сравнению с исходным соединением. Пролекарство может превращаться в исходное соединение различными механизмами, включая ферментативные процессы и метаболический гидролиз. Соединения, описанные в настоящем изобретении, могут существовать в виде терапевтически приемлемых солей. Термин "терапевтически приемлемая соль", как применяют в настоящем изобретении,представляет соли или цвиттерионные формы соединений, описанных в настоящем изобретении, которые являются терапевтически приемлемыми, как описано в настоящем изобретении. Соли можно получить в процессе заключительного выделения и очистки соединений или отдельно реакцией подходящего соединения с подходящей кислотой или основанием. Терапевтически приемлемая соль включает адди-6 021227 тивные соли кислоты и основания. Что касается более полного рассмотрения получения и выбора солей,см. "Handbook of Pharmaceutical Salts, Properties, and Use," Stah and Wermuth, Ed. (Wiley-VCH and VHCA,Zurich, 2002) и Berge et al., J. Pharm. Sci. 1977, 66, 1-19. Подходящие кислоты для применения при получении фармацевтически приемлемых солей включают, но не ограничиваются этим, уксусную кислоту, 2,2-дихлоруксусную, ацилированные аминокислоты, адипиновую, альгиновую, аскорбиновую, L-аспарагиновую, бензолсульфоновую,бензойную,4-ацетамидобензойную,борную,(+)-камфорную,камфорсульфоновую,(+)-(1S)-камфор-10-сульфоновую, каприновую, капроновую, каприловую, коричную, лимонную,цикламиновую, циклогексансульфаминовую, додецилсульфокислоту, этан-1,2-дисульфоновую, этансульфоновую, 2-гидроксиэтансульфоновую, муравьиную, фумаровую, галактаровую, гентизиновую,глюкогептоновую, D-глюконовую, D-глюкуроновую, L-глутаминовую, -оксоглутаровую, гликолевую,гиппуровую, бромисто-водородную, хлористо-водородную, йодисто-водородную, (+)-L-молочную,-DL-молочную,лактобионовую,лауриновую,малеиновую,(-)-L-яблочную,малоновую,-DL-миндальную, метансульфоновую, нафталин-2-сульфоновую, нафталин-1,5-дисульфоновую,1-гидрокси-2-нафтойную, никотиновую, азотную, олеиновую, оротовую, щавелевую, пальмитиновую,памовую,перхлорную,фосфорную,L-пироглютаминовую,сахарную,салициловую,4-аминосалициловую, себациновую, стеариновую, янтарную, серную, дигалловую, (+)-L-винную, тиоциановую, п-толуолсульфоновую, ундеценовую и валериановую кислоты. Подходящие основания для применения при получении фармацевтически приемлемых солей включают, но не ограничиваются этим, неорганические основания, такие как гидроксид магния, гидроксид кальция, гидроксид калия, гидроксид цинка или гидроксид натрия; и органические основания, такие как первичные, вторичные, третичные и четвертичные алифатические и ароматические амины, включаяL-аргинин, бенетамин, бензатин, холин, деанол, диэтаноламин, диэтиламин, диметиламин, дипропиламин, диизопропиламин, 2-(диэтиламино)этанол, этаноламин, этиламин, этилендиамин, изопропиламин,N-метилглюкамин, гидрабамин, 1 Н-имидазол, L-лизин, морфолин, 4-(2-гидроксиэтил)морфолин, метиламин, пиперидин, пиперазин, пропиламин, пирролидин, 1-(2-гидроксиэтил)пирролидин, пиридин, хинуклидин, хинолин, изохинолин, вторичные амины, триэтаноламин, триметиламин, триэтиламин,N-метил-D-глюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол и трометамин. Когда можно вводить соединения настоящего изобретения в виде отдельного химического соединения, также можно предоставлять их в виде фармацевтической композиции. Соответственно, настоящее изобретение относится к фармацевтическим композициям, которые содержат одно или более определенных соединений, описанных в настоящем изобретении, или одну или более их фармацевтически приемлемых солей, пролекарств или сольватов вместе с одним или более фармацевтически приемлемыми носителями и необязательно одним или более другими терапевтическими ингредиентами. Правильный состав зависит от выбранного пути введения. Любую из хорошо известных методик, носителей и эксципиентов можно применять в качестве подходящих и известных в данной области техники, например вRemington's Pharmaceutical Sciences. Фармацевтические композиции, описанные в настоящем изобретении, можно получать любым способом, известным в данной области техники, например посредством общепринятого способа смешения, растворения, гранулирования, получения драже, выщелачивания,эмульгирования, инкапсулирования, включения или прессования. Фармацевтические композиции можно также составлять в виде дозированных форм с модифицированным высвобождением, включая дозированные формы с отсроченным, растянутым, пролонгированным, замедленным, пульсирующим, контролируемым, ускоренным и быстрым, нацеленным и программируемым высвобождением и задержкой в желудке. Данные дозированные формы можно получить согласно общепринятым способам и методикам,известным специалистам в данной области техники (см., Remington: The Science and Practice of Pharmacy,supra; Modified-Release Drug Deliver Technology, Rathbone et al., Eds., Drugs and the Pharmaceutical Science,Marcel Dekker, Inc.: New York, NY, 2002; Vol. 126). Композиции содержат композиции для перорального, парентерального (включая подкожное, внутрикожное, внутримышечное, внутривенное, внутриартериальное и интрамеддулярное), внутрибрюшинного, трансмукозального, трансдермального, ректального и местного (включая кожное, буккальное, сублингвальное и внутриглазное) введения, хотя наиболее подходящий путь может зависеть, например, от состояния и заболевания реципиента. Композиции удобно предоставлять в виде единичной дозированной форме и их можно получить любым из способов, хорошо известных в области фармации. Обычно данные способы включают стадию смешения соединения настоящего изобретения или его фармацевтической соли, пролекарства или сольвата ("активный ингредиент") с носителем, который составляют один или более дополнительных ингредиентов. В общем, композиции получают путем равномерного и тщательного смешения активного ингредиента с жидкими носителями или мелкоизмельченными твердыми носителями или обоими и затем, в случае необходимости, придания продукту требуемой формы. Препараты соединений, описанных в настоящем изобретении, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, крахмальные капсулы или таблетки, причем каждая форма содержит предварительно определенное количество активного ин-7 021227 гредиента; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или неводной жидкости либо в виде жидкой эмульсии масла в воде или жидкой эмульсии вода в масле. Активный ингредиент можно также предоставить в виде болюса, электуария или пасты. Фармацевтические препараты, которые можно применять перорально, включают таблетки, капсулы с забивкой, полученные из желатина, а также мягкие герметичные капсулы, полученные из желатина и пластификаторов, таких как глицерин или сорбит. Таблетки можно получить прессованием или формовкой, необязательно с одним или более дополнительными ингредиентами. Прессованные таблетки можно получить прессованием в подходящей машине активного ингредиента в свободнотекучей форме, такой как порошок или гранулы, необязательно смешанного со связующими, инертными разбавителями или лубрикантами, поверхностно-активными веществами или диспергирующими агентами. Формованные таблетки можно получить формованием в подходящей машине смеси порошкообразного соединения,смоченного инертным жидким разбавителем. На таблетки можно необязательно наносить покрытие или наносить на них риски и можно составлять таким образом, чтобы обеспечить медленное или контролируемое высвобождение активного ингредиента. Все препараты для перорального введения должны быть в дозах, подходящих для данного введения. Капсулы с забивкой могут содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующими, такими как крахмал, и/или лубрикантами, такими как тальк или стеарат магния, и необязательно стабилизаторами. В мягких капсулах активные соединения можно растворять или суспендировать в подходящих жидкостях, таких как жирные масла,жидкий парафин или жидкие полиэтилегликоли. Кроме того, можно добавлять стабилизаторы. Ядра драже обеспечивают подходящим покрытием. Для этих целей можно применять концентрированные растворы сахаров, которые могут необязательно содержать аравийскую камедь, тальк, поливинилпирролидон, карбопол гель, полиэтиленгликоль и/или диоксид титана, глазуревые растворы и подходящие органические растворители или смеси растворителей. Красящие вещества или пигменты можно добавлять к таблеткам или веществам для покрытия драже для идентификации или характеристики различных комбинаций доз активных соединений. Соединения можно составлять в композиции для парентерального введения инъекцией, например болюсной инъекцией или непрерывной инъекцией. Препараты для инъекции могут быть представлены в единичной дозированной форме, например в ампулах, или в емкостях с несколькими дозами с добавленным консервантом. Композиции могут принимать такую форму, как суспензии, растворы или эмульсии в маслянистой или водной среде, и могут содержать агенты для формулирования, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Препараты можно предоставить в емкости с единичной дозой или множественными дозами, например герметичные ампулы и пробирки, и их можно хранить в порошковой форме или в лиофилизированном состоянии, требующем только добавления стерильного жидкого носителя, например солевого раствора или стерильной апирогенной воды, немедленно перед применением. Растворы и суспензии для немедленной инъекции можно получить из стерильных порошков, гранул и таблеток типа, описанного ранее. Препараты для парентерального введения включают водные и неводные (маслянистые) стерильные инъецируемые растворы активных соединений, которые могут содержать антиоксиданты, буферы, бактериостаты и растворители, которые придают препарату изотоничность крови предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители. Подходящие липофильные растворители или среды включают жирные масла, такие как кунжутное масло, или синтетические эфиры жирных кислот, такие как этилолеат, или триглицериды, или липосомы. Водные суспензии для инъекций могут содержать вещества, которые увеличивают вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Необязательно суспензия может также содержать подходящие стабилизаторы или агенты, которые увеличивают растворимость соединений, позволяя получить высококонцентрированные растворы. В добавление к препаратам, описанным ранее, соединения можно также составлять в виде депопрепарата. Данные долгодействующие препараты можно вводить имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Таким образом, например, соединения можно составлять с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменной смолой, или в виде умеренно-растворимых производных, например в виде умеренно-растворимых солей. Для буккального или сублингвального введения композициям можно придавать форму таблеток,таблеток для рассасывания, пастилок или гелей, полученных общепринятым способом. Данные композиции могут содержать активный ингредиент в ароматизированной основе, такой как сахароза и камедь или трагакант. Соединения можно также формулировать в ректальные композиции, такие как суппозитории или удерживающие клизмы, например, содержащие общепринятые основы для суппозиторий, такие как масло какао, полиэтиленгликоль или другие глицериды. Определенные соединения, описанные в настоящем изобретении, можно вводить местно, т.е. не общим введением. Это включает нанесение соединения, описанного в настоящем изобретении, внешне на эпидермис или в полость рта и введение данного соединения в ухо, глаз и нос, так что соединение незначительно попадает в кровяной поток. Напротив, общее введение относится к пероральному, внутривенному, внутрибрюшинному и внутримышечному введению. Препараты, подходящие для местного введения, включают жидкие или полужидкие препараты,подходящие для проникновения через кожу к месту воспаления, такие как гели, линименты, лосьоны,кремы, мази или пасты, и капли, подходящие для введения в глаз, ухо или нос. Для введения ингаляцией соединения можно доставлять из инсуффляторов, аэрозольных баллонов,находящихся под давлением, или других общепринятых средств доставки аэрозольного спрея. Баллоны,находящиеся под давлением, могут содержать подходящий пропеллент, такой как дихлордифторметан,трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. В случае аэрозоля, находящегося под давлением, единичную дозу можно определять присоединением клапана для доставки измеренного количества. Альтернативно, для введения ингаляцией или инсуффляцией соединениям согласно настоящему изобретению можно придавать форму композиции в виде сухого порошка, например, порошковой смеси соединения и подходящей порошковой основы, такой как лактоза или крахмал. Порошковая композиция может быть предоставлена в виде единичной дозированной формы, например в капсулах, картриджах,желатиновой или блистерной упаковках, из которых порошок можно вводить с помощью ингаляции или инсуффляции. Предпочтительные препараты для единичной дозы представляют собой препараты, содержащие эффективную дозу, как перечислено ниже в настоящем изобретении, или ее подходящую часть, активного ингредиента. Соединения можно вводить перорально или инъекцией с дозой от 0,1 до 500 мг/кг в день. Диапазон доз для взрослых людей составляет обычно от 5 мг до 2 г/день. Таблетки или другие формы препаратов,предоставленные в дискретных единичных формах, могут удобно содержать количество одного или более соединений, которое является эффективным при данной дозе, или в виде нескольких, например, тех же единичных форм, содержащих 5-500 мг, обычно около 10-200 мг. Количество активного ингредиента, которое можно комбинировать с веществами, являющимися носителями, для получения единичной дозированной формы, будет зависеть от лечимого реципиента и конкретного способа введения. Соединения можно вводить различными способами, например перорально, местно или инъекцией. За точное количество соединения, вводимое пациенту, будет ответственен лечащий врач. Конкретная доза для конкретного пациента будет зависеть от ряда факторов, включая активность конкретного применяемого соединения, возраста, веса тела, общего состояния здоровья, пола, питания, времени введения, пути введения, скорости выведения, комбинации лекарственных средств, точного лечимого заболевания и тяжести лечимого заболевания. Кроме того, путь введения может сильно зависеть от заболевания и его тяжести. В случае, когда состояние пациента не улучшается, по усмотрению лечащего врача введение соединений можно осуществлять постоянно, т.е. в течение продолжительного периода времени, включая всю продолжительность жизни пациента, для того, чтобы облегчить или, иначе, контролировать или ограничить симптомы заболевания пациента. В случае, когда состояние пациента не улучшается, по усмотрению лечащего врача введение соединений может осуществляться непрерывно или временно, приостанавливая введение на определенный период времени (т.е. "лекарственные каникулы"). Когда происходит улучшение состояния пациента, в случае необходимости вводят поддерживающую дозу. Впоследствии дозу или частоту введения или оба этих параметра можно снизить как функцию симптомов до степени, при которой сохраняется улучшенное состояние заболевания. Однако пациенты могут нуждаться в прерывистом лечении на продолжительной основе при любом рецидиве симптомов. Описанными в настоящем изобретении являются способы лечения заболевания, опосредованного иммунной функцией, включающие введение субъекту, имеющему или подозреваемому в том, что он имеет данное заболевание, терапевтически эффективного количества соединения, как описано в настоящем изобретении, или его фармацевтически приемлемой соли, сольвата или пролекарства. Заболевания, опосредованные иммунной функцией, включают, но не ограничиваются этим, рассеянный склероз и аутоиммунные заболевания и/или любое заболевание, которое можно сгладить, облегчить или предотвратить введением модулятора иммунной функции. В определенных вариантах осуществления способ лечения заболевания, опосредованного иммунной функцией, включает введение субъекту терапевтически эффективного количества соединения, как описано в настоящем изобретении, или его фармацевтически приемлемой соли, сольвата или пролекарства, чтобы:(1) снизить межличностные различия в концентрации соединения или его метаболита в плазме;(2) увеличить среднюю концентрацию соединения в плазме или снизить среднюю концентрацию в плазме по меньшей мере одного метаболита соединения на одну дозированную дозу;(3) снизить ингибирование и/или замедлить метаболизм по меньшей мере одной изоформой цитохрома Р 450 или моноаминоксидазы у субъекта;(4) замедлить метаболизм посредством по меньшей мере одной полиморфно-экспрессируемой изоформы цитохрома Р 450 у субъекта;(5) улучшить по меньшей мере один статистически значимый улучшенный ожидаемый результат заболевание-контроль и/или заболевание-ликвидация;(6) улучшить клинический эффект в процессе лечения заболевания;(7) предотвратить рецидив или замедлить ухудшение или проявление аномальных пищевых или действующих на печень параметров в качестве основного клинического лечения или(8) снизить или устранить вредные изменения при любом диагностическом ожидаемом результате,относящемся к гепатобилиарной функции, по сравнению с соответствующими изотопно необогащенными соединениями. В определенных вариантах осуществления межличностные различия в концентрациях соединений или его метаболитов в плазме, как описано в настоящем изобретении, сглаживаются; средние концентрации соединения, как описано в настоящем изобретении, в плазме увеличиваются; средние концентрации метаболита соединения, как описано в настоящем изобретении, в плазме снижаются; ингибирование изоформы цитохрома Р 450 или моноаминоксидазы соединением, как описано в настоящем изобретении,уменьшается или метаболизм соединения, как описано в настоящем изобретении, по меньшей мере одной полиморфно-экспрессируемой изоформой цитохрома Р 450 замедляется больше чем приблизительно на 5%, больше чем приблизительно на 10%, больше чем приблизительно на 20%, больше чем приблизительно на 30%, больше чем приблизительно на 40%, или больше чем приблизительно на 50% по сравнению с соответствующим изотопно необогащенным соединением. Концентрации соединения в плазме, как описано в настоящем изобретении, или его метаболитов можно измерить, применяя способы, описанные в Li et al. Rapid Communications in Mass Spectrometry 2005, 19, 1943-1950; Sennbro, et al., Rapid Communications in Mass Spectrometry 2006, 20(22), 3313-3318;Edman, et al., Journal of Chromatography, B: Analytical Technologies in the Biomedical and Life Sciences 2003, 785(2) и в любых ссылках, приводимых в настоящем изобретении и в соответствующих полученных модификациях. Примеры изоформ цитохрома Р 450 у субъекта, являющегося млекопитающим, включают, но не ограничиваются этим: Примеры изоформ моноаминоксидазы у субъекта, являющегося млекопитающим, включают, но не ограничиваются этим, MAOA и MAOB. Ингибирование изоформы цитохрома Р 450 измеряют способом Ko et al., British Journal of ClinicalPharmacopsychiatry, 1998, 31, 187-192. Примеры полиморфно-экспрессируемых изоформ цитохрома Р 450 у субъекта, являющегося млекопитающим, включают, но не ограничиваются этим, CYP2C8, CYP2C9, CYP2C19 и CYP2D6. Метаболические активности микросом печени, изоформ цитохрома Р 450 и изоформ моноаминоксидазы измеряют способами, описанными в настоящем изобретении. Примеры улучшенных клинических результатов заболевание-контроль и/или заболеваниеликвидация или улучшенных клинических эффектов включают, но не ограничиваются этим, суммарное число активных повреждений, наблюдаемых на 24 неделю, суммарное и активное число активных и усиливаемых гадолинием повреждений на MRI каждые 8 недель, частоте рецидивов, комплексную функциональную оценку при рассеянном склерозе, короткую оценку качества жизни с 36 вопросами (Burtonet al., Curr. Neurol.Neurosc. Reports, 2007, 7(3), 223-30). Примеры диагностически ожидаемых результатов, относящихся к гепатобилиарной функции,включают, не ограничиваются, аланинаминотрансферазу ("ALT"), сывороточную глутаматпируваттрансаминазу ("SGPT"), аспартатаминотрансферазу ("AST" или "SGOT"), ALT/AST соотношения, альдолазу сыворотки крови, щелочную фосфатазу ("ALP"), концентрацию аммиака, билирубин, гаммаглутамилтранспептидазу ("GGTP," "-GTP" или "GGT"), лейцинаминопептидазу ("LAP"), биопсию печени, ультразвуковую эхографию печени, ядерное сканирование печени, 5'-нуклеотидазу и белок крови. Гепатобилиарный ожидаемый результат сравнивают с установленным нормальным уровнем, как представлено в "Diagnostic and Laboratory Test Reference", 4th edition, Mosby, 1999. Данные анализы проводят- 10021227 ся аккредитованными лабораториями согласно стандартному протоколу. Кроме пригодности для лечения людей, определенные соединения и препараты, описанные в настоящем изобретении, могут также быть пригодны для ветеринарного лечения домашних животных, экзотических животных и сельскохозяйственных животных, включая млекопитающих, грызунов и подобных. Более предпочтительные животные включают лошадей, собак и кошек. Комбинированная терапия. Соединения, описанные в настоящем изобретении, можно также комбинировать или применять в комбинации с другими агентами, пригодными для лечения заболеваний, опосредованных иммунной функцией. Или посредством только примера терапевтическая эффективность одного из соединений, описанных в настоящем изобретении, может увеличиваться введением адъюванта (т.е. сам адъювант может обладать только минимальным терапевтическим полезным эффектом, но в комбинации с другим терапевтическим агентом суммарный полезный терапевтический эффект на пациента усиливается). Данные другие агенты, адъюванты или лекарственные средства можно вводить путем и в количестве, обычно применяемом для этого, одновременно или последовательно с соединением, как описано в настоящем изобретении. При применении соединения, как описано в настоящем изобретении, одновременно с одним или более другими лекарственными средствами можно использовать фармацевтические композиции, содержащие данные другие лекарственные средства в добавление к соединению, описанному в настоящем изобретении, но необязательно. В определенных вариантах осуществления соединения, описанные в настоящем изобретении, можно комбинировать с одним или более иммуномодуляторами, стероидными лекарственными средствами или циклоспоринами. В определенных вариантах осуществления соединения, относящиеся к настоящему изобретению,можно комбинировать с одним или более иммуномодуляторами, известными в данной области техники,включая, но не ограничиваясь этим, филграстим, молграмостим, сарграмостим, ленограстим, анцестим,пегфилграстим, интерферон гамма, интерферон альфа-2 а, интерферон альфа-2b, интерферон альфа-n1,интерферон бета-1 а, интерферон бета-1b, интерферон альфакон-1, пегинтерферон альфа-2b, пегинтерферон альфа-2 а, интерферон омега, альдеслейкин, опрелвекин, лентинан, рохинимекс, BCG вакцину, пегадемазу, пидотимод, поли I:C, поли ICLC, тимопентин, иммуноцианин, тазонермин, вакцину против меланомы, глатирамерацетат, дигидрохлорид гистамина, мифамуртид, плериксафор, муромонаб-CD3, антилимфоцитный иммуноглобулин (лошадиный), антитимоцитный иммуноглобулин (кролика), микофеноловую кислоту, сиролимус, лефлуномид, алефацепт, эверолимус, гусперимус, эфализумаб, абетимус,натализумаб, абатацепт, экулизумаб, этанерцепт, инфликсимаб, афелимомаб, адалимумаб, цертолизумаб пегол, даклизумаб, бациликсимаб, анакинра, циклоспорин, такролимус, азатиоприн, талидомид, метотрексат и леналидомид. Соединения, описанные в настоящем изобретении, можно также вводить в комбинации с другими классами соединений, включая, но не ограничиваясь этим: ингибиторы обратного захвата норэпинефрина (NRI), такие как атомоксетин; ингибиторы обратного захвата допамина (DARI), такие как метилфенидат; ингибиторы обратного захвата серотонин-норэпинефрина (SNRI), такие как милнаципран; седативные средства, такие как диазепам; ингибиторы обратного захвата норэпинефрин-допамина (NDRI), такие как бупропион; ингибиторы обратного захвата серотонин-норэпинефрин-допамина (SNDRI), такие как венлафаксин; ингибиторы моноаминоксидазы, такие как селегилин; гипоталамические фосфолипиды; ингибиторы эндотелин-конвертирующего фермента (ЕСЕ), такие как фосфороамидон; опиоиды, такие как трамадол; антагонисты тромбоксановых рецепторов, такие как ифетробан; активаторы калиевых каналов; ингибиторы тромбина, такие как хирудин; гипоталамические фосфолипиды; ингибиторы факторов роста, такие как модуляторы PDGF активности; антагонисты фактора активации тромбоцитов (PAF); антитромбоцитные средства, такие как GPIIb/IIIa блокаторы (например, абдксимаб, эптифибатид и тирофибан), P2Y(AC) антагонисты (например, клопидогрел, тиклопидин и CS-747) и аспирин; антикоагулянты, такие как варфарин; низкомолекулярные гепарины, такие как эноксапарин; ингибиторы фактора VIIa и ингибиторы фактора Xa; ингибиторы ренина; ингибиторы нейтральной эндопептидазы (NEP); ингибиторы вазопептидазы (двойные NEP-ACE ингибиторы), такие как омапатрилат и гемопатрилат; ингибиторы HMG СоА редуктазы, такие как правастатин, ловастатин, аторвастатин, симвастатин,NK-104 (известный также под именем итавастатин, нисвастатин или нисбастатин) и ZD-4522 (также известный как розувастатин или атавастатин или визастатин); ингибиторы скваленсинтетазы; фибраты; секвестранты желчных кислот, такие как квестран; ниацин; антиатеросклеротические средства, такие как АСАТ ингибиторы; МТР ингибиторы; блокаторы кальциевых каналов, такие как безилат амлодипина; активаторы калиевых каналов; альфа-мускариновые агенты; бета-мускариновые агенты, такие как карведилол и метопролол; антиаритмические средства; диуретики, такие как хлортиазид, гидрохлортиазид, флуметиазид, гидрофлуметиазид, бендрофлуметиазид, метилхлортиазид, трихлорметиазид, политиазид, бензотиазид, этакриновую кислоту, трикринафен, хлорталидон, фуросенилд, музолимин, буметанид, триамтерен, амилорид и спиронолактон; тромболитические агенты, такие как тканевый активатор плазминогена (tPA), рекомбинантный tPA,стрептокиназу, урокиназу, проурокиназу и анизоилированный активатор комплекса стрептокиназы и плазминогена (APSAC); противодиабетические агенты, такие как бигуанидин (например, метформин), ингибиторы глюкозидазы (например, акарбоза), инсулины, меглитиниды (например, репаглинид), сульфонилмочевины (например, глимепирид, глибурид и глипизид), тиозолидиндионы (например, троглитазон, розиглитазон и пиоглитазон) и агонисты PPAR-гамма; антагонисты минералокортикоидных рецепторов, такие как спиронолактон и эплеренон; стимуляторы секреции соматротропного гормона; аР 2 ингибиторы; ингибиторы фосфодиэстеразы, такие как PDE III ингибиторы (например, цилостазол) и PDE V ингибиторы (например, силденафил, тадалафил, варденафил); ингибиторы протеинтирозинкиназы; противовоспалительные агенты; антипролиферативные агенты, такие как метотрексат, FK506 (такролимус, Програф), мофетил микофенолата; химиотерапевтические агенты; иммуносупрессанты; противораковые агенты и цитотоксичные агенты (например, алкилирующие агенты, такие как азотистые иприты, алкилсульфонаты, нитрозомочевины, этиленимины и триазены); антиметаболиты, такие как фолатные антагонисты, аналоги пурина и аналоги пиридина; антибиотики, такие как антрациклины, блеомицины, митомицин, дактиномицин и пликамицин; ферменты, такие как L-аспарагиназа; ингибиторы фарнезил-протеин трансферазы; гормональные агенты, такие как глюкокортикоиды (например, кортизон), эстрогены/антиэстрогены,андрогены/антиандрогены, прогестины и антагонисты гормона, высвобождающего лютеинизирующий гормон, и ацетат октреотида; разрушающие микротрубочки агенты, такие как эктеинасцидины; стабилизирующие микротрубочки агенты, такие как пацитаксел, доцетаксел и эпотилоны A-F; вещества, полученные из растений, такие как алкалоиды барвинка, эпиподофиллотоксины и таксанены; ингибиторы топоизомеразы; ингибиторы фенил-протеин трансферазы; циклоспорины; стероиды, такие как преднизон и дексаметазон; цитотоксические лекарственные средства, такие как азатиприн и циклофосфамид;TNF-альфа ингибиторы, такие как тенидап; анти-TNF антитела или растворимый TNF рецептор, такой как этанерцепт, рапамицин и лефлунимид; ингибиторы циклооксигеназы-2 (СОХ-2), такие как целекоксиб и рофекоксиб; прочие агенты, такие как гидроксимочевина, прокарбазин, митотан, гексаметилмеламин, соединения золота, координационные комплексы платины, такие как цисплатина, сатраплатина и карбоплатина. Таким образом, в другом аспекте определенные варианты осуществления относятся к способам лечения заболеваний, опосредованных иммунной функцией, у нуждающегося в данном лечении субъекта,являющегося животным или человеком, включающим введение упомянутому субъекту количества со- 12021227 единения, описанного в настоящем изобретении, эффективного для того, чтобы ослабить или предотвратить упомянутое заболевание у субъекта, в комбинации по меньшей мере с одним дополнительным агентом для лечения упомянутого заболевания, известного в данной области техники. В родственном аспекте определенные варианты осуществления относятся к терапевтическим композициям, содержащим по меньшей мере одно соединение, описанное в настоящем изобретении, в комбинации с одним или более дополнительными агентами для лечения заболевания, опосредованного иммунной функцией. Общие способы синтеза для получения соединений. Изотопный водород можно вводить в соединение, как описано в настоящем изобретении, синтетическими способами, в которых применяют дейтерированные реагенты, посредством чего предварительно определяют степень введения; и/или обменными методиками, в которых степень введения определяется условиями равновесия, и они могут сильно изменяться в зависимости от условий реакции. Синтетические способы, в которых тритий или дейтерий непосредственно и точно вводится тритилированными или дейтерированными реагентами известного изотопного содержания, могут давать большой избыток трития или дейтерия, но могут быть ограничены требуемыми химическими реакциями. Обменные способы,с другой стороны, могут давать меньший процент введения трития или дейтерия, причем часто изотоп распределен между различными положениями в молекуле. Соединения, как описано в настоящем изобретении, можно получить способами, известными специалистам в данной области техники, и их стандартными модификациями, и/или следующими методиками, аналогичными методикам, описанным в разделе с примерами, и их стандартными модификациями,и/или методиками, находящимися в Wennerberg et al., Org. Proc. Res.Dev. 2007, 11(4), 674-80; Wang etUS 2005/192315; US 2004/034227; WO 2005/74899; WO 2003106424; и WO 1999/55678, которые вводятся в настоящее изобретение полностью, и в ссылках, упоминаемых в настоящем изобретении, и их стандартными модификациями. Соединения, как описано в настоящем изобретении, можно также получить,как показано в любой из следующих схем и их стандартными модификациями. Следующие схемы можно применять для осуществления на практике настоящего изобретения. Любое положение, показанное в виде водорода, можно необязательно замещать дейтерием. Схема I Соединение 1 реагирует с эквивалентом соответствующего хлорформиата или фосгена, такого как изопропилкарбонохлоридат, в присутствии подходящего дегидратирующего агента, такого как ацетилхлорид, в подходящем растворителе, таком как 1,4-диоксан, при повышенной температуре для получения соединения 2. Соединение 2 реагирует с соединением 3 в присутствии подходящего основания, такого как гидрид натрия, в подходящем растворителе, таком как диметилформамид, в инертной атмосфере, такой как азот,для получения соединения 4. Соединение 4 реагирует с подходящим малонатным производным, таким как диэтилмалонат, в присутствии подходящего основания, такого как гидрид натрия, в подходящем растворителе, таком как диметилформамид, при повышенной температуре, для получения соединения 5. Соединение 5 реагирует с соединением 6 в подходящем растворителе, таком как н-гептан, при повышенной температуре, для получения соединения 7 формулы I. Дейтерий можно вводить в различные положения синтетически, согласно синтетическим способам,как показано на схеме I, применяя подходящие дейтерированные промежуточные соединения. Например,- 13021227 для введения дейтерия в одно или более положений R4-R6 можно применять соединение 1 с соответствующими замещениями дейтерием. Для введения дейтерия в одно или более положений R1-R3 можно применять соединение 3 с соответствующими замещениями дейтерием. Для введения дейтерия в одно или более положений R8-R17 можно применять соединение 6 с соответствующими замещениями дейтерием. Дейтерий можно вводить в различные положения, содержащие способный обмениваться протон,такие как гидроксил O-Н, посредством равновесного обмена протон-дейтерий. Например, для введения дейтерия в R7 данный протон можно замещать дейтерием селективно или неселективно с помощью способа обмена протон-дейтерий, известного в данной области техники. Настоящее изобретение дополнительно иллюстрируется следующими примерами. Все IUPAC названия получали, применяя ChemDraw 10.0 CambridgeSoft. Пример 1. 5-Хлор-3-(этил(фенил)карбамоил)-1-метил-2-оксо-1,2-дигидрохинолин-4-олат натрия 5-Хлор-1 Н-бензо[d][1,3]оксазин-2,4-дион. В атмосфере азота добавляли по каплям к суспензии 2-амино-6-хлорбензойной кислоты (20 г,116,56 ммоль, 1,00 экв.) в 1,4-диоксане (150 мл) изопропилкарбонохлоридат (50 мл, 4,50 экв.). Полученный в результате раствор выдерживали приблизительно при 90C в течение 30 мин и затем охлаждали до приблизительно 50C. Добавляли одной порцией ацетилхлорид (50 мл, 6,00 экв.) и раствор выдерживали приблизительно при 50C в течение 30 мин. Полученный в результате твердый остаток собирали фильтрованием и очищали хроматографией на силикагеле (этилацетат/петролейный эфир 10:1) для получения указанного в заголовке соединения в виде твердого вещества серо-белого цвета (17,6 г, выход: 76%). Стадия 2. 5-Хлор-1-метил-1 Н-бензо[d][1,3]оксазин-2,4-дион. В атмосфере азота 5-хлор-1 Н-бензо[d][1,3]оксазин-2,4-дион (10 г, 50,61 ммоль, 1,00 экв.) растворяли в N,N-диметилформамиде (100 мл) приблизительно при 5 С. Затем добавляли гидрид натрия (2,8 г,121,5 ммоль, 2,4 экв.) и метилйодид (5,7 мл, 2 экв.) и полученную в результате смесь перемешивали при температуре окружающей среды в течение 16 ч. Смесь продували азотом в течение 1 ч для получения указанного в заголовке соединения в виде твердого вещества желтого цвета, которое применяли непосредственно в следующей стадии без какой-либо очистки. Стадия 3. Этил 5-хлор-4-гидрокси-1-метил-2-оксо-1,2-дигидрохинолин-3-карбоксилат. Добавляли несколькими порциями к смеси 5-хлор-1-метил-1 Н-бензо[d][1,3]оксазин-2,4-диона вN,N-диметилформамиде из стадии 2 гидрид натрия (1,9 г, 79,17 ммоль, 1,60 экв.). Затем добавляли по каплям к перемешиваемой смеси в течение приблизительно 30 мин диэтилмалонат (7,7 г, 48,07 ммоль,1,00 экв.). Полученный в результате раствор перемешивали приблизительно при 85C в течение 1 ч, добавляли воду (800 мл) и pH раствора доводили до 2 раствором хлористо-водородной кислоты (5 моль/л). Полученный в результате неочищенный продукт собирали фильтрованием и затем перекристаллизовывали из этанола для получения указанного в заголовке соединения в виде твердого вещества светложелтого цвета (2,5 г, выход: 18% на 2 стадии). Стадия 4.N-Этилбензоламин (430 мг, 3,55 ммоль, 2,00 экв.) добавляли по каплям к этил 5-хлор-4-гидрокси-1 метил-2-оксо-1,2-дигидрохинолин-3-карбоксилату (500 мг, 1,78 ммоль, 1,00 экв.), растворенному в гептане (10 мл). Полученную в результате смесь грели приблизительно при 100 С и летучие компоненты удаляли перегонкой в течение приблизительно 7 ч. После охлаждения до температуры окружающей среды полученные в результате кристаллы собирали фильтрованием, промывали гептаном и очищали хроматографией на силикагеле (этилацетат/петролейный эфир 1:3) для получения указанного в заголовке соединения в виде твердого вещества белого цвета (0,38 г, выход: 60%). Стадия 5. 5-Хлор-3-(этил(фенил)карбамоил)-1-метил-2-оксо-1,2-дигидрохинолин-4-олат натрия. Величину pH раствора 5-хлор-N-этил-4-гидрокси-1-метил-2-оксо-N-фенил-1,2-дигидрохинолин-3 карбоксамида (170 мг, 0,4 8 ммоль, 1,00 экв.) в этаноле (5 мл) доводили до 9-10 раствором 5 М гидроксида натрия. Затем смесь перемешивали в течение 30 мин при температуре окружающей среды. Полученное в результате твердое вещество собирали фильтрованием и промывали этанолом для получения указанного в заголовке соединения в виде твердого вещества белого цвета (70 мг, выход: 39%). 1 Н ЯМР (300 МГц, ДМСО) : 6,84-7,31 (м, 8 Н), 3,68 (кв, 2 Н), 3,34 (с, 3H), 1,02 (т, 3H).d3-Этил 5-хлор-4-гидрокси-1-метил-2-оксо-1,2-дигидрохинолин-3-карбоксилат. Следовали методике примера 1, стадия 2, но заменяли метилйодид d3-метилйодидом. Полученный в результате продукт, твердое вещество желтого цвета, применяли непосредственно на следующей стадии без какой-либо очистки. Стадия 2.d3-Этил 5-хлор-4-гидрокси-1-метил-2-оксо-1,2-дигидрохинолин-3-карбоксилат. Следовали методике примера 1, стадия 3, но заменяли этил 5-хлор-4-гидрокси-1-метил-2-оксо-1,2 дигидрохинолин-3-карбоксилатd3-этил 5-хлор-4-гидрокси-1-метил-2-оксо-1,2-дигидрохинолин-3 карбоксилатом. Указанное в заголовке соединение выделяли в виде твердого вещества желтого цветаd3-5-Хлор-N-этил-4-гидрокси-1-метил-2-оксо-N-фенил-1,2-дигидрохинолин-3-карбоксамид. Следовали методике примера 1, стадия 4, но заменяли этил 5-хлор-4-гидрокси-1-метил-2-оксо-1,2 дигидрохинолин-3-карбоксилатd3-этил 5-хлор-4-гидрокси-1-метил-2-оксо-1,2-дигидрохинолин-3 карбоксилатом. Указанное в заголовке соединение выделяли в виде твердого вещества белого цвета 5-Хлор-3-(этил(фенил)карбамоил)-1-d3-метил-2-оксо-1,2-дигидрохинолин-4-олат натрия. Следовали методике примера 1, стадия 5, но заменяли 5-хлор-N-этил-4-гидрокси-1-метил-2-оксо-Nфенил-1,2-дигидрохинолин-3-карбоксамидd3-5-хлор-N-этил-4-гидрокси-1-метил-2-оксо-N-фенил-1,2 дигидрохинолин-3-карбоксамидом. Указанное в заголовке соединение выделяли в виде твердого вещества белого цвета (0,17 г, выход: 80%). 1 Н ЯМР (300 МГц, ДМСО) : 6,83-7,32 (м, 8 Н), 3,68 (кв, 2 Н), 1,03 (т, 3H). трет-Бутилфенилкарбамат. Анилин (2,3 г, 25 ммоль, 1 экв.) растворяли в тетрагидрофуране (25 мл) приблизительно при 5 С. Добавляли к раствору раствор ди-трет-бутилдикарбоната (6,0 г, 27,5 ммоль) в тетрагидрофуране (10 мл) и полученную в результате смесь кипятили с обратным холодильником в течение 2 ч. Растворитель удаляли в вакууме и полученный в результате остаток растворяли в этилацетате (50 мл). Полученный в результате раствор промывали 1 М раствором лимонной кислоты (250 мл) и солевым раствором(150 мл). Органическую фазу сушили над сульфатом натрия и упаривали в вакууме для получения указанного в заголовке соединения в виде белого твердого вещества (4,3 г, выход: 83%). Стадия 2.N,N-диметилформамиде (100 мл). Полученную в результате смесь перемешивали приблизительно при 55 С в течение 16 ч и затем добавляли оксид дейтерия (10 мл). Затем pH смеси доводили до приблизительно 6-7 1 н. хлористо-водородной кислотой. Стандартная обработка с экстракцией этилацетатом давала указанный в заголовке продукт в виде неочищенного твердого вещества, которое применяли на следующей стадии без дополнительной очистки. Стадия 3.N-d5-Этилбензоламин. В течение 1 ч и при поддержании температуры в районе 25 С в трет-бутиловый эфир d5 этилфенилкарбаминовой кислоты, растворенный в этилацетате (5 мл), вводили газообразный хлороводород. Затем pH раствора доводили до 6-7 раствором гидроксида натрия (10 моль/л). Стандартная обработка с экстракцией этилацетатом давала указанное в заголовке соединение в виде масла желтого цвета 5-Хлор-N-d5-этил-4-гидрокси-1-метил-2-оксо-N-фенил-1,2-дигидрохинолин-3-карбоксамид. Следовали методике примера 1, стадия 4, но заменяя N-этилбензоламин N-d5-этилбензоламином. Указанное в заголовке соединение выделяли в виде твердого вещества белого цвета (0,4 г, выход: 58%). Стадия 5. 5-Хлор-3-(d5-этил(фенил)карбамоил)-1-метил-2-оксо-1,2-дигидрохинолин-4-олат натрия. Следовали методике примера 1, стадия 5, но заменяя 5-хлор-N-этил-4-гидрокси-1-метил-2-оксо-Nфенил-1,2-дигидрохинолин-3-карбоксамид 5-хлор-N-d5-этил-4-гидрокси-1-метил-2-оксо-N-фенил-1,2 дигидрохинолин-3-карбоксамидом. Указанное в заголовке соединение выделяли в виде твердого вещества белого цвета (90 мг, выход: 40,5%). 1 5-Хлор-N-d8-этил-4-гидрокси-1-метил-2-оксо-N-фенил-1,2-дигидрохинолин-3-карбоксамид. Следовали методике примера 2, стадия 4, но заменяя N-этилбензоламин N-d5-этилбензоламином. Указанное в заголовке соединение выделяли в виде твердого вещества белого цвета. Стадия 2. 5-Хлор-3-(d8-этил(фенил)карбамоил)-1-d3-метил-2-оксо-1,2-дигидрохинолин-4-олат натрия. Следовали методике примера 2, стадия 5, но заменяя N-этилбензоламин N-d5-этилбензоламином. Указанное в заголовке соединение выделяли в виде твердого вещества белого цвета (0,1 г, выход: 70%). 1 Н ЯМР (300 МГц, ДМСО) : 6,83-7,31 (м, 8 Н).LC-MS: m/z=365 (M-Na+2H)+. Следующие соединения можно в большинстве случаев получить, применяя способы, описанные выше. Ожидается, что данные соединения при получении будут обладать активностью, аналогичной активностью соединений, описанных в примерах выше. Изменения в метаболических свойствах соединений, описанных в настоящем изобретении, по сравнению с их изотопно необогащенными аналогами можно показать, применяя следующие анализы. Ожидается, что соединения, перечисленные выше, которые еще не получены и/или не испытаны, также будут иметь измененные метаболические свойства, как показано одним или более из данных анализов. Анализы на биологическую активность. Анализ стабильности соединений при действии микросомальных белков печени in vitro. Анализы на стабильность соединений при действии микросомальных белков печени проводят при 2 мг на 1 мл микросомального белка печени с NADPH-генерирующей системой в 2% бикарбонате натрия(2,2 мМ NADPH, 25,6 мМ глюкоза-6-фосфат, 6 ед. на 1 мл глюкоза-6-фосфат дегидрогеназы и 3,3 мМ хлорид магния). Испытуемые соединения получают в виде растворов в 20% смеси ацетонитрил-вода и добавляют к смеси для анализа (конечная концентрация для анализа 5 мкм/мл) и выдерживают при 37C. Конечная концентрация ацетонитрила при анализе должна быть 1%. Отбирают аликвоты (50 мкл) через 0, 30, 60, 90 и 120 мин и разбавляют охлажденным до 0 С ацетонитрилом (200 мкл) для остановки реакции. Образцы центрифугируют при 12000 об/мин в течение 10 мин для осаждения белков. Надосадочную жидкость переносят в микроцентрифужные пробирки и хранят для LC/MS/MS анализа периода полуразрушения испытуемых соединений. Периоды полуразрушения примеров 1-4 (лаквинимод и изотопно обогащенные лекарственные средства) показаны в табл. 1. Таблица 1 Результаты анализа на стабильность соединений при действии микросомальных белков печени человека (HLM) in vitroIn vitro метаболизм с использованием человеческих цитохром Р 450 ферментов показан в табл. 2. Цитохром P450 ферменты экспрессируют из соответствующей человеческой цДНК, применяя бакуловирусную систему экспрессии (BD Biosciences, San Jose, CA). 0,25 мл реакционной смеси, содержащей 0,8 мг на 1 мл белка, 1,3 мМ NADP+, 3,3 мМ глюкоза-6-фосфат, 0,4 мкм/мл глюкоза-6 фосфатдегидратазы, 3,3 мМ хлорид магния и 0,2 мМ соединение формулы I, соответствующее изотопно необогащенное соединение или стандарт или контрольное соединение в 100 мМ фосфате калия (pH 7,4) выдерживают при 37 С в течение 20 мин. После выдерживания реакцию прекращают добавлением подходящего растворителя (например, ацетонитрил, 20% трихлоруксусная кислота, 94% ацетонитрил/6% ледяная уксусная кислота, 70% перхлорная кислота, 94% ацетонитрил/6% ледяная уксусная кислота) и центрифугируют (10000g) в течение 3 мин. Надосадочную жидкость анализируют ВЭЖХ/MS/MS.In vitro метаболизм с использованием человеческих цитохром Р 450 ферментов Ингибирование и окислительный оборот моноаминоксидазы А. Методику выполняли, применяя способы, описанные Weyler, Journal of Biological Chemistry, 1985,260, 13199-13207, которая вводится в настоящее изобретение полностью с помощью ссылки. Активность моноаминоксидазы А измеряют спектрофотометрически контролированием увеличения поглощения при 314 нм при окислении кинурамина с образованием 4-гидроксихинолина. Измерения проводят при 30C в 50 мМ натрийфосфатном буфере, pH 7,2, содержащем 0,2% Triton X-100 (буфер для анализа моноаминоксидазы), плюс 1 мМ кинурамин и требуемое количество фермента в 1 мл суммарного объема. Ингибирование и окислительный оборот моноаминоксидазы В. Методику проводят, как описано в Uebelhack, Pharmacopsychiatry, 1998, 37(5), 187-192, которая вводится в настоящее изобретение полностью с помощью ссылки. Определение лаквинимода в плазме жидкостной хроматографией с парными колонками с детекцией ультрафиолетового поглощения. Методику проводят, как описано в Edman, et al., Journal of Chromatography, B: AnalyticalTechnologies in the Biomedical and Life Sciences, 2003, 785(2), которая вводится в настоящее изобретение полностью с помощью ссылки. Определение лаквинимода в плазме человека жидкостной хроматографией/тандемной массспектрометрией. Методику проводят, как описано в Sennbro, et al., Rapid Communications in Mass Spectrometry, 2006,20(22), 3313-3318, которая вводится в настоящее изобретение полностью с помощью ссылки. Измерение влияния лаквинимода на Th1/Th2 баланс и продуцирование Th3 цитокина и TGF- цитокина у крыс Lewis. Методику проводят, как описано в Yang, et al., Journal of Neuroimmunology, 2004, 156(1-2), 3-9, которая вводится в настоящее изобретение полностью с помощью ссылки. Модель экспериментального аутоиммунного энцефаломиелита. Методику проводят, как описано в Karussis et al., Ann. Neurol. 1993, 34, 654-660, которая вводится в настоящее изобретение полностью с помощью ссылки. Из предшествующего описания специалист в данной области техники может определить основные характеристики настоящего изобретения и, не выходя за пределы объема и сущности настоящего изобретения, может производить различные изменения и модификации настоящего изобретения для приспособления его к различным применениям и условиям. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение структурной формулы (I) или его соль,где R1-R17 независимо выбирают из группы, состоящей из водорода и дейтерия, и по меньшей мере один из R1-R17 представляет собой дейтерий. 2. Соединение по п.1, где по меньшей мере один из R1-R17 независимо обогащен дейтерием не меньше чем приблизительно на 10%. 3. Соединение по п.2, где по меньшей мере один из R1-R17 независимо обогащен дейтерием не меньше чем приблизительно на 50%. 4. Соединение по п.3, где по меньшей мере один из R1-R17 независимо обогащен дейтерием не меньше чем приблизительно на 90%. 5. Соединение по п.4, где по меньшей мере один из R1-R17 независимо обогащен дейтерием не меньше чем приблизительно на 98%. 6. Соединение по любому из пп.1-5, где указанное соединение имеет структурную формулу, выбранную из группы, состоящей из: 7. Соединение по п.6, где каждое положение, представленное как D, обогащено дейтерием меньше чем приблизительно на 10%. 8. Соединение по п.7, где каждое положение, представленное как D, обогащено дейтерием меньше чем приблизительно на 50%. 9. Соединение по п.8, где каждое положение, представленное как D, обогащено дейтерием меньше чем приблизительно на 90%. 10. Соединение по п.9, где каждое положение, представленное как D, обогащено дейтерием меньше чем приблизительно на 98%. 11. Соединение по любому из пп.3-10, где указанное соединение имеет структурную формулу 12. Соединение по любому из пп.3-10, где указанное соединение имеет структурную формулу 13. Соединение по любому из пп.3-10, где указанное соединение имеет структурную формулу- 21 не не не не 14. Фармацевтическая композиция, содержащая соединение по любому из пп.1-13 вместе с фармацевтически приемлемым носителем. 15. Применение соединения по любому из пп.1-13 при лечении пациента, страдающего заболеванием, опосредованным иммунной функцией. 16. Применение по п.15, где указанное заболевание представляет собой множественный склероз и аутоиммунные заболевания. 17. Применение соединения по любому из пп.1-13 в качестве лекарственного средства для лечения заболевания, опосредованного иммунной функцией. 18. Применение соединения по любому из пп.1-13 при предотвращении или лечении заболевания,облегчаемого модулированием иммунной функции.
МПК / Метки
МПК: C07D 215/58, A61P 37/08, C07D 215/227, A61K 31/198, A61K 31/47
Метки: 2-оксо-1,2-дигидрохинолиновые, модуляторы, функции, иммунной
Код ссылки
<a href="https://eas.patents.su/23-21227-2-okso-12-digidrohinolinovye-modulyatory-immunnojj-funkcii.html" rel="bookmark" title="База патентов Евразийского Союза">2-оксо-1,2-дигидрохинолиновые модуляторы иммунной функции</a>