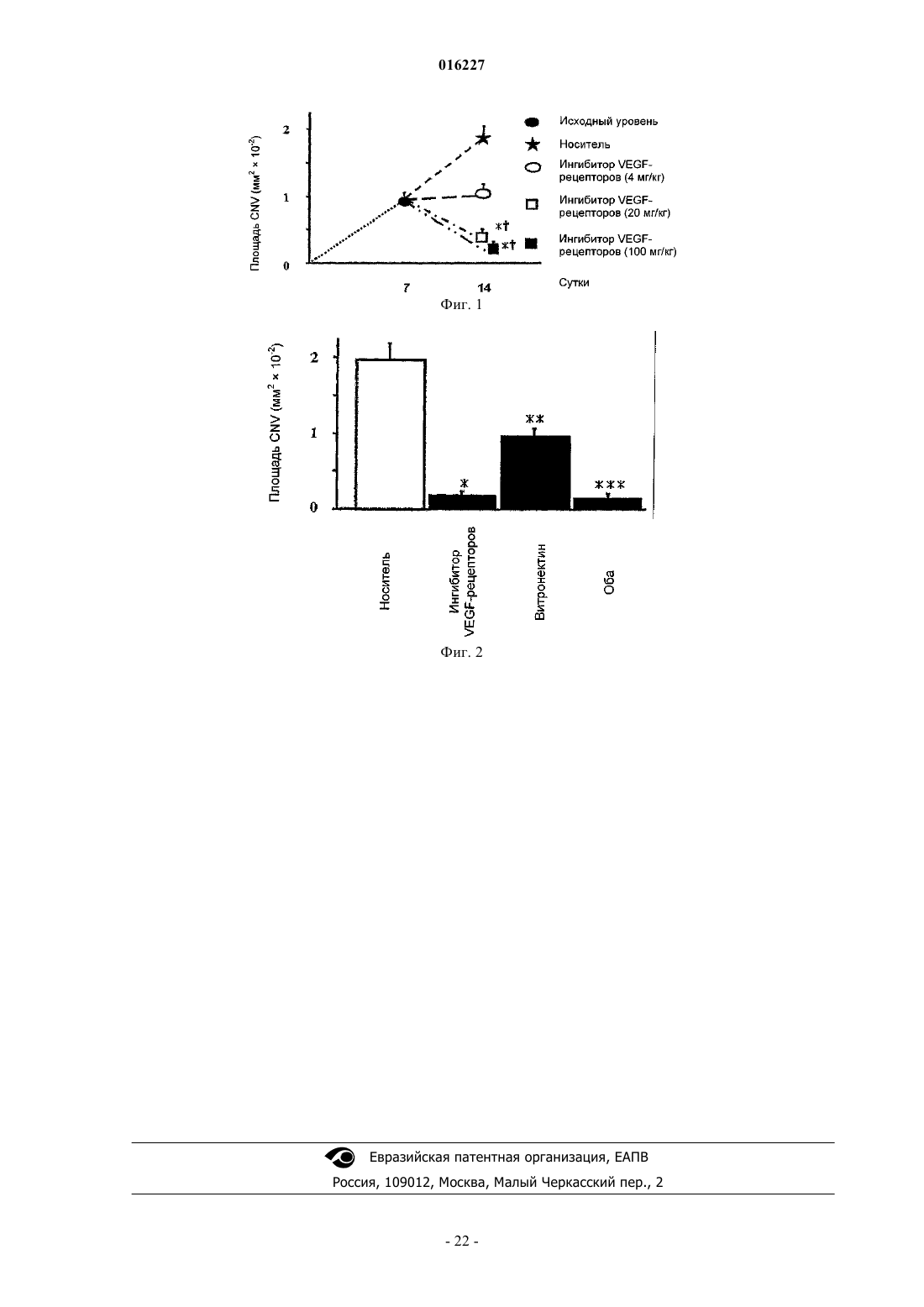
Способ лечения офтальмологических неоваскулярных расстройств
Номер патента: 16227
Опубликовано: 30.03.2012
Авторы: Миллер Уилльям Генри, Левик Марк, Бриганди Ричард Энтони
Формула / Реферат
1. Способ лечения расстройства, выбранного из группы, состоящей из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки, увеита и макулярного отека, у млекопитающего, включающий введение указанному млекопитающему соединения формулы (I)
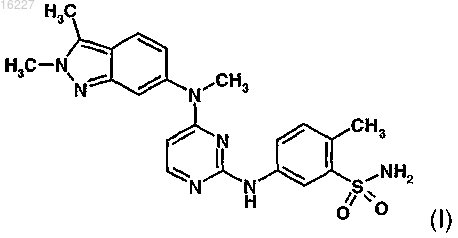
или его соли или сольвата.
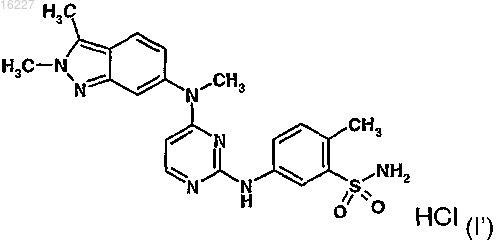
2. Способ по п.1, где указанное соединение представляет собой соединение формулы (I')
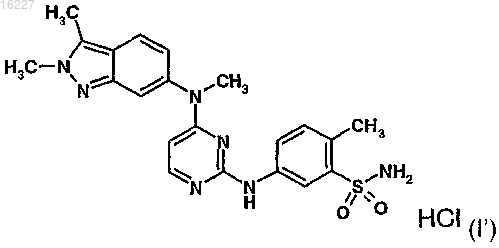
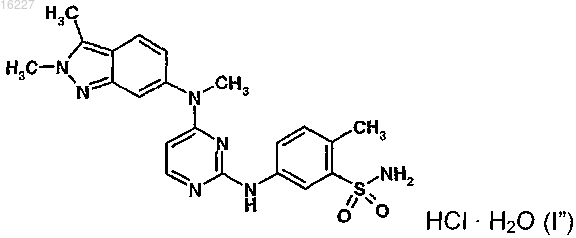
3. Способ по п.1, где указанное соединение представляет собой соединение формулы (I")
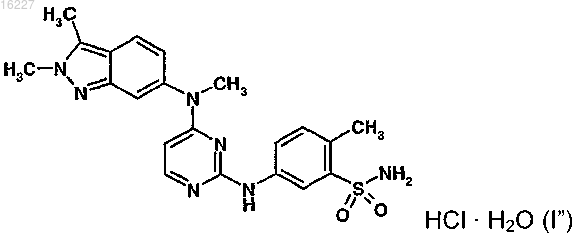
4. Способ по п.1, где указанное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна.
5. Способ по п.1, где указанное расстройство представляет собой макулярный отек.
6. Применение соединения формулы (I) или его соли или сольвата для изготовления лекарственного средства, полезного в лечении расстройства, выбранного из группы, состоящей из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки, увеита и макулярного отека.
7. Применение по п.6, где указанное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна.
8. Применение по п.6, где указанное расстройство представляет собой макулярный отек.
9. Фармацевтический препарат для местного применения, содержащий соединение формулы (I)
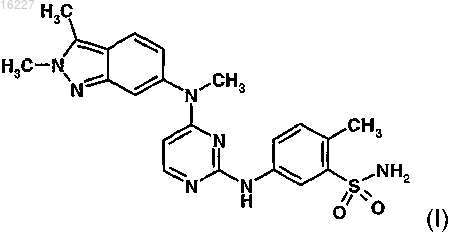
или его соль или сольват, предназначенный для использования в лечении офтальмологических неоваскулярных расстройств путем непосредственного введения в глаз.
10. Препарат для местного применения по п.9, где указанное соединение представляет собой соединение формулы (I')
11. Препарат для местного применения по п.10, где указанное соединение представляет собой соединение формулы (I'')
12. Препарат для местного применения по любому из пп.9-11 в форме глазных капель, где соединение формул I, I' или I" растворено или суспендировано в подходящем носителе.
13. Препарат для местного применения по любому из пп.9-12 для введения в сочетании с одним или более чем одним дополнительным терапевтическим агентом для лечения неоваскулярных расстройств.
14. Препарат для местного применения по п.13, где указанные один или более дополнительных терапевтических агентов представляют собой пегаптаниб и/или ранибизумаб.
15. Препарат для местного применения по п.13 или 14, где указанные один или более дополнительных терапевтических агентов вводят отдельно.
16. Препарат для местного применения по п.15, где указанные один или более дополнительных терапевтических агентов вводят различными путями.
17. Способ лечения офтальмологического неоваскулярного расстройства у пациента, нуждающегося в этом, включающий местное введение препарата для местного применения по любому из пп.9-16 непосредственно в глаз указанного пациента.
18. Способ по п.17, где указанное офтальмологическое неоваскулярное расстройство представляет собой ретинальное неоваскулярное расстройство.
19. Способ по п.17, где указанное офтальмологическое неоваскулярное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна (AMD), ангиоидные полосы сетчатки, патологическую миопию, синдром гистоплазмоза глаз, разрывы в оболочке Бруха, макулярный отек (включая диабетический макулярный отек), саркоидоз, увеит, атрофическую AMD, кератоконус, синдром Шегрена, миопию, глазные опухоли, отторжение трансплантата роговицы, поражение роговицы, неоваскулярную глаукому, изъязвление роговицы, рубцевание роговицы, пролиферативную витреоретинопатию, ретинопатию недоношенных, ретинальную дегенерацию, хроническую глаукому, отслойку сетчатки или серповидно-клеточную ретинопатию.
20. Способ по п.17, где указанное офтальмологическое неоваскулярное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна (AMD).
21. Способ по любому из пп.17-20, где лечение офтальмологических неоваскулярных расстройств представляет собой их предотвращение.
22. Способ по любому из пп.17-20, где лечение офтальмологических неоваскулярных расстройств представляет собой выздоровление.
23. Способ по любому из пп.17-20, где лечение представляет собой снижение скорости развития указанного расстройства.
Текст
СПОСОБ ЛЕЧЕНИЯ ОФТАЛЬМОЛОГИЧЕСКИХ НЕОВАСКУЛЯРНЫХ РАССТРОЙСТВ Бриганди Ричард Энтони, Левик Марк, Миллер Уилльям Генри (US) Поликарпов А.В., Борисова Е.Н. (RU) Изобретение относится к способам лечения расстройства, выбранного из группы, состоящей из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки, увеита и макулярного отека, у млекопитающего, включающим введение указанному млекопитающему соединения формулы (I), а также к применению соединения формулы (I) для изготовления лекарственного средства, полезного в лечении таких расстройств. Также предложены фармацевтический препарат для местного применения, содержащий соединение формулы (I),предназначенный для использования в лечении офтальмологических неоваскулярных расстройств путем непосредственного введения в глаз, и способ лечения офтальмологических неоваскулярных расстройств путем местного введения такого препарата.(71)(73) Заявитель и патентовладелец: СМИТКЛАЙН БИЧЕМ КОРПОРЕЙШН (US) 016227 Область изобретения Настоящее изобретение относится к способам лечения офтальмологических неоваскулярных расстройств у млекопитающего и фармацевтическим препаратам для местного применения, предназначенным для использования в лечении таких расстройств. Предшествующий уровень техники Неоваскуляризация, также называемая ангиогенезом, представляет собой процесс образования новых кровеносных сосудов. Неоваскуляризация происходит во время нормального развития, а также играет важную роль в заживлении ран после повреждения ткани. Однако неоваскуляризация также вовлечена, как важная причина, в ряд патологических состояний, включая, например, рак, ревматоидный артрит,атеросклероз, псориаз и болезни глаза. Глазные болезни, связанные с просачиванием из сосудов и/или неоваскуляризацией, являются причиной подавляющего большинства случаев заболеваний органов зрения и слепоты в развитых странах(Campochiaro (2004) Expert Opin. Biol. Ther. 4:1395-402). Одним примером такого расстройства служит диабетическая ретинопатия, частое осложнение у лиц с сахарным диабетом и пятая по счету основная причина новых случаев слепоты. Наиболее важными факторами, способствующими развитию диабетической ретинопатии, являются гипергликемия и гипоксемия, которые ведут к повышенной проницаемости сосудов, пролиферации эндотелиальных клеток и патологической неоваскуляризации (ChorostowskaWynimko et al. J. Phisiol. Pharmacol. (2005) 56 Suppl 4:65-70). Эти сосудистые аномалии приводят к просачиванию жидкости в желтое пятно сетчатки, что может приводить к прогрессирующей потере зрения. Другое глазное расстройство, при котором неоваскуляризация играет роль, представляет собой возрастную дегенерацию желтого пятна (AMD), которая является главной причиной тяжелой потери зрения у пожилых людей. Потеря зрения при AMD происходит из-за хориоидальной неоваскуляризации (CNV). Неоваскуляризация происходит от хориоидальных кровеносных сосудов, которые прорастают через оболочку Бруха обычно в множестве мест в субретинальный слой пигментного эпителия и/или сетчатку (см.,например, Campochiaro et al. (1999) Mol. Vis. 5:34). Просачивание и кровотечение из этих новых кровеносных сосудов приводит к потере зрения. Глазные расстройства, связанные с офтальмологической неоваскуляризацией, являются главной причиной потери зрения и слепоты. Следовательно, сохраняется необходимость в новых способах лечения офтальмологических неоваскулярных расстройств. Краткое изложение сущности изобретения Изобретение относится к новым способам лечения офтальмологических неоваскулярных расстройств. В данном изобретении предложен способ лечения расстройства, выбранного из группы, состоящей из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки, увеита и макулярного отека, у млекопитающего, включающий введение указанному млекопитающему соединения формулы (I) или его соли или сольвата. В конкретном воплощении способа лечения указанное соединение представляет собой соединение формулы (I') В еще одном конкретном воплощении способа лечения указанное соединение представляет собой соединение формулы (I): В одном аспекте способа лечения указанное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна. В другом аспекте способа лечения указанное расстройство представляет собой макулярный отек.-1 016227 Кроме того, в данном изобретении предложено применение соединения формулы (I) или его соли или сольвата для изготовления лекарственного средства, полезного в лечении расстройства, выбранного из группы, состоящей из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки, увеита и макулярного отека. В одном аспекте применения указанное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна. В другом аспекте применения указанное расстройство представляет собой макулярный отек. Согласно данному изобретению, также предложен фармацевтический препарат для местного применения, содержащий соединение формулы (I) или его соль или сольват, предназначенный для использования в лечении офтальмологических неоваскулярных расстройств путем непосредственного введения в глаз. В частности, предложен препарат для местного применения, где указанное соединение представляет собой соединение формулы (I') В частности, предложен препарат для местного применения, где указанное соединение представляет собой соединение формулы (I) В одном воплощении препарат для местного применения представлен в форме глазных капель, где соединение формулы I, I' или I" растворено или суспендировано в подходящем носителе. В другом воплощении препарат для местного применения предназначен для введения в сочетании с одним или более чем одним дополнительным терапевтическим агентом для лечения неоваскулярных расстройств. В частности, предложен препарат для местного применения, где указанные один или более дополнительных терапевтических агентов представляют собой пегаптаниб и/или ранибизумаб. В одном воплощении препарата для местного применения указанные один или более дополнительных терапевтических агентов вводят отдельно. В другом воплощении препарата для местного применения указанные один или более дополнительных терапевтических агентов вводят различными путями. Согласно данному изобретению, также предложен способ лечения офтальмологического неоваскулярного расстройства у пациента, нуждающегося в этом, включающий местное введение препарата для местного применения по изобретению непосредственно в глаз указанного пациента. В одном воплощении способа лечения указанное офтальмологическое неоваскулярное расстройство представляет собой ретинальное неоваскулярное расстройство. В частности, предложен способ лечения, где указанное офтальмологическое неоваскулярное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна (AMD), ангиоидные полосы сетчатки, патологическую миопию, синдром гистоплазмоза глаз, разрывы в оболочке Бруха, макулярный отек (включая диабетический макулярный отек), саркоидоз, увеит, атрофическуюAMD, кератоконус, синдром Шегрена, миопию, глазные опухоли, отторжение трансплантата роговицы,поражение роговицы, неоваскулярную глаукому, изъязвление роговицы, рубцевание роговицы, пролиферативную витреоретинопатию, ретинопатию недоношенных, ретинальную дегенерацию, хроническую глаукому, отслойку сетчатки или серповидно-клеточную ретинопатию. В частности, предложен способ лечения, где указанное офтальмологическое неоваскулярное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна (AMD).-2 016227 В одном воплощении указанного способа лечение офтальмологических неоваскулярных расстройств представляет собой их предотвращение. В другом воплощении указанного способа лечение офтальмологических неоваскулярных расстройств представляет собой выздоровление. В еще одном воплощении указанного способа лечение представляет собой снижение скорости развития указанного расстройства. Краткое описание графических материалов На фиг. 1 показан эффект ингибитора VEGF-рецепторов (рецепторов фактора роста сосудистого эндотелия), описанного в примере 1, в регрессионной модели хориоидальной неоваскуляризации (CNV) у мышей. В этой регрессионной модели CNV индуцировали у мышей прижиганием лазером заднего полюса сетчатки. Через семь суток после поражения, вызванного лазером, у мышей начинался режим, при котором они получали либо только носитель, либо 5-4-[(2,3-диметил-2 Н-индазол-6-ил)метиламино]-2 пиримидинил]амино]-2-метилбензолсульфонамид в указанных дозах. Через семь суток после начала этого режима производили количественную оценку размера CNV поражений. Результаты графически суммированы на фиг. 1. См. раздел "Примеры" для дополнительной информации. На фиг. 2 показан эффект предварительного лечения ингибитором VEGF-рецепторов, описанным в примере 1, антагонистом рецепторов витронектина, описанным в примере 3, или их комбинацией на вызванную повреждением CNV у мышей в превентивной модели CNV. Результаты графически суммированы на фиг. 2. См. раздел "Примеры" для дополнительной информации. Подробное описание изобретения Согласно настоящему изобретению предложены новые способы лечения офтальмологических неоваскулярных расстройств у млекопитающих. Эти способы включают стадию введения млекопитающему производных пиримидина, производных бензодиазепинила и фармацевтических композиций, содержащих их. Согласно одному аспекту соединение для введения представляет собой пазопаниб 5-(4[(2,3-диметил-2 Н-индазол-6-ил)(метил)амино]пиримидин-2-иламино)-2-метилбензолсульфонамид) или его соль или сольват. Авторы настоящего изобретения продемонстрировали, что мыши, которых лечат пазопанибом после вызванного лазером поражения сетчатки, проявляют уменьшение размера полученных в результате хориоидальных неоваскулярных повреждений по сравнению с мышами, не подвергнутыми лечению. Кроме того, авторы изобретения показали, что мыши, подвергнутые лечению пазопанибом, (S)-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-2 бензазепин-4-уксусной кислотой или комбинацией этих соединений до вызванного лазером поражения сетчатки, проявляют уменьшение размера полученных в результате хориоидальных неоваскулярных повреждений. Таким образом, авторы изобретения продемонстрировали, что пазопаниб, (S)-3-оксо-8-[3(пиридин-2-иламино)-1-пропилокси]-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4 уксусная кислота и их производные, соли и сольваты являются полезными в качестве терапевтических агентов для лечения расстройств, связанных с неоваскуляризацией глаза. В одном аспекте согласно изобретению предложен способ лечения расстройства, выбранного из группы, состоящей из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки, увеита и макулярного отека, у млекопитающего, включающий введение указанному млекопитающему соединения формулы (I) или его соли или сольвата. В конкретном воплощении согласно изобретению предложен способ лечения расстройства, выбранного из группы, состоящей из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки, увеита и макулярного отека, у млекопитающего, включающий введение млекопитающему соединения формулы (I') В другом воплощении изобретение включает способ лечения расстройства, выбранного из группы,состоящей из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки,увеита и макулярного отека, у млекопитающего, включающий введение указанному млекопитающему соединения формулы (I") или его соли или сольвата. В другом аспекте изобретение включает применение соединения формулы (I) или его соли или сольвата для изготовления лекарственного средства, полезного в лечении расстройства, выбранного из группы, состоящей из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки, увеита и макулярного отека. Также предложены фармацевтический препарат для местного применения, содержащий соединение формулы (I) или его соль или сольват, предназначенный для использования в лечении офтальмологических неоваскулярных расстройств путем непосредственного введения в глаз, и способ лечения офтальмологических неоваскулярных расстройств путем местного введения такого препарата. В некоторых воплощениях изобретения офтальмологическое неоваскулярное расстройство представляет собой хориоидальное неоваскулярное расстройство или ретинальное неоваскулярное расстройство. В конкретных воплощениях офтальмологическое неоваскулярное расстройство выбрано из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки, увеита и макулярного отека. Термин "офтальмологическое неоваскулярное расстройство", использованный здесь, означает расстройство, при котором в глазу патологическим образом формируются новые кровеносные сосуды. Офтальмологические неоваскулярные расстройства, которые можно лечить согласно способам по изобретению, включают расстройства, характеризующиеся просачиванием из сосудов. Офтальмологические неоваскулярные расстройства могут приводить к частичной или полной потере зрения. Неоваскулярные расстройства для лечения способами по изобретению могут возникать в любой части глаза, включая,например, роговицу, радужную оболочку, сетчатку, стекловидное тело и сосудистую оболочку глаза. Термин "хориоидальное неоваскулярное расстройство", использованный здесь, означает расстройство, характеризующееся прорастанием новых кровеносных сосудов через оболочку Бруха, самый внутренний слой сосудистой оболочки глаза. Термин "ретинальное неоваскулярное расстройство", использованный здесь, относится к расстройству, связанному с ростом новых кровеносных сосудов, происходящих из ретинальных вен и распространяющихся вдоль витреальной поверхности сетчатки. Неограничивающие примеры офтальмологических неоваскулярных расстройств, которые можно лечить согласно способам по изобретению, включают экссудативную форму возрастной дегенерации желтого пятна (AMD), ангиоидные полосы сетчатки, патологическую миопию, синдром гистоплазмоза глаз, разрывы в оболочке Бруха, макулярный отек (включая диабетический макулярный отек), саркоидоз и увеит. Дополнительные примеры расстройств, которые можно лечить раскрытыми способами, включают атрофическую AMD, кератоконус, синдром Шегрена, миопию, глазные опухоли, отторжение трансплантата роговицы, поражение роговицы, неоваскулярную глаукому, изъязвление роговицы, рубцевание роговицы, пролиферативную витреоретинопатию, ретинопатию недоношенных, ретинальную дегенерацию, хроническую глаукому, отслойку сетчатки и серповидно-клеточную ретинопатию. Согласно изобретению предложены способы лечения офтальмологических неоваскулярных расстройств. Использованный здесь термин "лечение" означает любой способ, при котором один или более чем один симптом, связанный с расстройством, изменяется благоприятным образом. Соответственно,термин включает в себя выздоровление, предотвращение или уменьшение интенсивности симптома или побочного эффекта расстройства или снижение скорости развития расстройства. Согласно способам по изобретению лечение офтальмологического неоваскулярного расстройства можно осуществлять посредством введения эффективного количества одного или более чем одного терапевтического агента субъекту, которого нужно лечить. Использованный здесь термин "эффективное количество" означает количество терапевтического агента, которое является достаточным для лечения,предотвращения и/или уменьшения интенсивности одного или более чем одного симптома расстройства. Использованный здесь термин "сольват" относится к комплексу вариабельной стехиометрии, образуемому растворенным веществом (в этом изобретении соединения формулы (I) или их соли) и растворителем. Такие растворители для цели изобретения не могут повлиять на биологическую активность растворенного вещества. Примеры подходящих растворителей включают воду, метанол, этанол и уксусную кислоту, но не ограничиваются ими. Предпочтительно используемый растворитель является фармацевтически приемлемым растворителем. Примеры подходящих фармацевтически приемлемых растворителей включают, без ограничения,воду, этанол и уксусную кислоту. В конкретном воплощении используемый растворитель представляет-4 016227 собой воду. В одном воплощении способы предотвращения или лечения офтальмологических неоваскулярных расстройств, раскрытые здесь, включают введение соединения формулы (I) или его соли или сольвата. В конкретном воплощении соль соединения формулы (I) представляет собой гидрохлорид. В одном из конкретных воплощений соль соединения формулы (I) представляет собой моногидрохлорид, как проиллюстрировано формулой (I'). Моногидрохлорид соединения формулы (I) имеет химическое название моногидрохлорид 5-4-[(2,3-диметил-2 Н-индазол-6-ил)метиламино]-2-пиримидинил]амино]-2 метилбензолсульфонамида. В другом воплощении соль соединения формулы (I) представляет собой сольват, моногидрат моногидрохлорида соединения формулы (I). Сольват, моногидрат моногидрохлорида соединения формулы (I),имеет химическое название моногидрат моногидрохлорида 5-(4-[(2,3-диметил-2 Н-индазол-6-ил)метиламино]-2-пиримидиниламино)-2-метилбензолсульфонамида, как проиллюстрировано в формуле (I"). Свободное основание, соли и сольваты соединения формулы (I) могут быть получены, например,согласно методикам по международной заявке на патентPCT/US 01/49367, поданной 19 декабря 2001 года и опубликованной 1 августа 2002 года как WO 02/059110, и международной заявке на патентPCT/US 03/19211, поданной 17 июня 2003 года и опубликованной 24 декабря 2003 года как WO 03/106416, или согласно способам, предложенным здесь. Типично соли по настоящему изобретению представляют собой фармацевтически приемлемые соли. Соли, включенные в термин "фармацевтически приемлемые соли", относятся к нетоксичным солям соединений по этому изобретению. Соли соединений по настоящему изобретению могут включать соли присоединения кислот, образованные по азоту в заместителе соединения по настоящему изобретению. Типичные соли включают следующие соли: ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат,битартрат, борат, бромид, эдетат кальция, камсилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдетат, эдизилат, эстолат, эзилат, фумарат, глюцептат, глюконат, глутамат, гликоллиларсанилат,гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид, изэтионат, лактат,лактобионат, лаурат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, мономалеат калия, мукат, напсилат, нитрат, N-метилглюкамин, оксалат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, калия, салицилат, натрия, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодид, триметиламмония и валерат. Другие соли, которые не являются фармацевтически приемлемыми, могут быть полезны в получении соединений по этому изобретению, и они образуют дополнительный аспект изобретения. Соединения, использованные в способах по изобретению, можно вводить отдельно или их можно вводить в фармацевтической композиции. Таким образом, согласно изобретению дополнительно предложено применение фармацевтических композиций в способах лечения по настоящему изобретению. Фармацевтические композиции включают соединение формулы (I) и их соли или сольваты и один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент. Носитель(и), разбавитель(и) или эксципиент(ы) должны быть приемлемыми в смысле совместимости с другими ингредиентами лекарственного препарата и безопасными для их реципиента. Фармацевтические препараты могут быть представлены в виде стандартных лекарственных форм,-5 016227 содержащих заданное количество активного ингредиента на единицу дозировки. Такая единица может содержать, например, от 1 мкг до 1 г, а именно от 5 мкг до 500 мкг, от 10 мкг до 250 мкг, от 0,5 мг до 700 мг, от 2 мг до 350 мг или от 5 мг до 100 мг соединения формулы (I) или их солей или сольватов, в зависимости от состояния, которое лечат, пути введения и возраста, массы тела и состояния пациента, или фармацевтические препараты могут быть представлены в виде стандартных лекарственных форм, содержащих заданное количество активного ингредиента на единицу дозировки. В конкретных воплощениях стандартными лекарственными препаратами являются те, которые содержат суточную дозу или субдозу, как изложено здесь выше, или ее соответствующую часть, активного ингредиента. Кроме того,такие фармацевтические препараты могут быть приготовлены любым из способов, хорошо известных в области фармации. Соединение формулы (I) или его соль или сольват можно вводить любым подходящим путем. Подходящие пути введения включают пероральный, ректальный, назальный, местный (включая трансбуккальный, сублингвальный и глазной), вагинальный и парентеральный (включая подкожный, внутримышечный, внутривенный, внутрикожный, экстраокулярный, интраокулярный (включая, например, интравитреальный, субретинальный, субсклеральный, интрахориоидальный и субконъюнктивальный), интратекальный и эпидуральный. Следует понимать, что предпочтительный путь введения может варьировать в зависимости от, например, состояния реципиента. Способы по настоящему изобретению можно также применять в комбинации с другими способами для лечения офтальмологических неоваскулярных расстройств. В некоторых воплощениях способы по изобретению включают комбинированную терапию, в которой соединение формулы (I) или его соль или сольват вводят в сочетании с одним или более чем одним дополнительным терапевтическим агентом для лечения неоваскулярных расстройств. Неограничивающие примеры дополнительных терапевтических агентов, которые можно использовать в комбинированной терапии, включают пегаптаниб, ранибизумаб,РКС 412, непафенак и антагонисты рецепторов интегрина (включая агонисты рецепторов витронектина). См., например, Takahashi et al. (2003) Invest. Ophthalmol. Vis. Sci. 44: 409-15, Campochiaro et al. (2004)Invest. Ophthalmol. Vis. Sci. 45:922-31, van Wijngaarden et al. (2005) JAMA 293:1509-13, патент США 6825188 Callahan et al. и патент США 6881736 Manley et al.; каждый из которых включен в данное описание посредством ссылки на их основные положения, касающиеся этих соединений. Когда применяют комбинированную терапию, терапевтические агенты можно вводить вместе или отдельно. Те же самые методы введения можно использовать для более чем одного терапевтического агента комбинированной терапии; альтернативно, различные терапевтические агенты комбинированной терапии можно вводить посредством различных методов. Когда терапевтические агенты вводят отдельно, их можно вводить одновременно или последовательно в любом порядке, как быстро один за другим,так и отдаленно во времени. Количества соединения формулы (I) и другого фармацевтически активного агента или агентов и относительные сроки введения нужно выбирать так, чтобы достичь желаемого комбинированного терапевтического эффекта. Фармацевтические препараты, предназначенные для перорального введения могут быть представлены в виде отдельных единиц, таких как капсулы или таблетки; порошки или гранулы; растворы или суспензии в водных или неводных жидкостях; пищевые пены или взбитые массы; или жидкие эмульсии типа масло-в-воде или жидкие эмульсии типа вода-в-масле. Например, для перорального введения в форме таблетки или капсулы активный компонент лекарства можно объединять с пероральным нетоксическим фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и тому подобное. Порошки можно приготовить посредством измельчения соединения до тонких частиц подходящего размера и смешивания с аналогично измельченным фармацевтическим носителем, таким как пищевой углевод, как, например, крахмал или маннит. Ароматизатор, консервант, диспергирующий агент и краситель также могут присутствовать. Капсулы можно изготавливать посредством получения порошкообразной смеси, как описано выше,и заполнением сформированных желатиновых оболочек. Скользящие вещества и смазывающие вещества, такие как коллоидный диоксид кремния, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль, можно добавлять к порошкообразной смеси перед операцией заполнения. Также можно добавлять разрыхлитель или солюбилизатор, такой как агар-агар, карбонат кальция или карбонат натрия,для улучшения доступности лекарства при проглатывании капсулы. Кроме того, когда желательно или необходимо, подходящие связующие вещества, смазывающие вещества, разрыхлители и красители также можно включать в смесь. Подходящие связующие вещества включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, кукурузу, подсластители, природные и синтетические камеди, такие как аравийская камедь, трагакант или альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль, воски и тому подобное. Смазывающие вещества,используемые в этих лекарственных формах, включают олеат натрия, стеарат натрия, стеарат магния,бензоат натрия, ацетат натрия, хлорид натрия и тому подобное. Разрыхлители включают, без ограничения, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и тому подобное. Таблетки можно приготовить, например, посредством получения порошкообразной смеси, гранулирования или агрегирования, добавления смазывающего вещества и разрыхлителя и прессования в таблетки. Порошкообразную-6 016227 смесь получают посредством смешивания соединения, измельченного соответствующим образом, с разбавителем или основой, как описано выше, и возможно со связующим веществом, таким как карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как парафин, ускорителем реабсорбции, таким как соль четвертичного основания, и/или абсорбирующим агентом, таким как бентонит, каолин или гидрофосфат кальция. Порошкообразную смесь можно гранулировать посредством смачивания связующим веществом, таким как сироп, крахмальный клейстер,клейковина акации или растворы целлюлозных или полимерных материалов, и продавливания через сито. В качестве альтернативы гранулированию, порошкообразную смесь можно прессовать на таблеточной машине, а получившиеся в результате недостаточно сформированные заготовки дробить на гранулы. Гранулы можно смазывать для предотвращения прилипания к образующему таблетки пресс-инструменту посредством добавления стеариновой кислоты, стеарата, талька или минерального масла. Смазанную смесь затем спрессовывают в таблетки. Соединения по настоящему изобретению также можно объединять со свободнотекущим инертным носителем и непосредственно спрессовывать в таблетки, не прибегая к стадиям гранулирования или агрегирования. Также можно наносить прозрачное или непрозрачное защитное покрытие, состоящее из изолирующего слоя шеллака, слоя сахара или полимера и гладкого слоя воска. В эти слои можно добавлять красители, чтобы различать различные единицы дозировки. Пероральные жидкости, такие как растворы, сиропы и эликсиры, могут быть получены в стандартной лекарственной форме, так что определенное количество содержит заданное количество соединения. Сиропы можно приготовить посредством растворения соединения в подходящем ароматизированном водном растворе, тогда как эликсиры можно приготовить при использовании нетоксичного спиртового носителя. Суспензии можно приготовить посредством диспергирования соединения в нетоксичном носителе. Также можно добавлять солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты, эфиры полиоксиэтиленсорбита, консерванты и ароматизаторы, такие как мятное масло или природные подсластители или сахарин или другие искусственные подсластители и тому подобное. Когда это целесообразно, стандартные лекарственные препараты для перорального введения могут быть микроинкапсулированными. Лекарственный препарат также может быть приготовлен, чтобы отсрочить или продлить высвобождение, например, посредством нанесения покрытия или заключения сыпучего материала в полимеры, воск или тому подобное. Агенты для применения согласно настоящему изобретению также можно вводить в форме липосомальных систем доставки, таких как малые моноламеллярные везикулы, большие моноламеллярные везикулы и мультиламеллярные везикулы. Липосомы могут быть образованы из различных фосфолипидов,таких как холестерин, стеариламин или фосфатидилхолины. Агенты для применения согласно настоящему изобретению также можно доставлять путем использования моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть присоединены к растворимым полимерам как нацеленным носителям лекарственных средств. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидфенол, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный остатками пальмитоила. Кроме того, соединения могут быть присоединены к классу биоразлагаемых полимеров, полезных для достижения контролируемого высвобождения лекарственного средства, например, полимолочной кислоте, полиэпсилонкапролактону, полигидроксимасляной кислоте, сложным полиортоэфирам, полиацеталям, полидигидропиранам, полицианоакрилатам и поперечно-сшитым или амфипатическим блоксополимерам гидрогелей. Фармацевтические препараты, предназначенные для трансдермального введения, могут быть представлены в виде отдельных пластырей, предназначенных для того, чтобы находиться в тесном контакте с эпидермисом реципиента в течение длительного периода времени. Например, активный ингредиент может быть доставлен из пластыря посредством ионофореза, как в общих чертах описано в PharmaceuticalResearch, 3(6), 318 (1986). Фармацевтические препараты, предназначенные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для лечения глаза или других поверхностных тканей, например ротовой полости и кожи, препараты можно применять в виде местной мази или крема. Когда он приготовлен в виде мази, активный ингредиент можно использовать либо с парафиновой, либо с водорастворимой мазевой основой. Альтернативно,активный ингредиент может быть приготовлен в виде крема с кремовой основой типа масло-в-воде или основой типа вода-в-масле. Фармацевтические препараты, предназначенные для местного введения в глаз, включают в себя глазные капли, в которых активный ингредиент растворен или суспендирован в подходящем носителе,особенно водном растворителе. Препараты для введения в глаз должны иметь офтальмически совместимое рН и осмотическое давление. Один или более чем один офтальмически приемлемый регулирующий рН агент и/или буферный агент может быть включен в композицию по изобретению, включая кислоты,такие как уксусная, борная, лимонная, молочная, фосфорная и соляная кислоты; основания, такие как гидроксид натрия, фосфат натрия, борат натрия, цитрат натрия, ацетат натрия и лактат натрия; и буфер-7 016227 ные растворы, такие как цитрат/декстроза, бикарбонат натрия и хлорид аммония. Такие кислоты, основания и буферные растворы могут быть включены в количество, требуемое для поддержания рН композиции в офтальмически приемлемом диапазоне. Одна или более чем одна офтальмически приемлемая соль может быть включена в композицию в количестве, достаточном для приведения осмотического давления композиции в офтальмически приемлемые диапазоны. Такие соли включают соли, имеющие катионы натрия, калия или аммония и хлоридные, цитратные, аскорбатные, боратные, фосфатные, бикарбонатные, сульфатные, тиосульфатные или бисульфитные анионы. Фармацевтические препараты, предназначенные для местного введения в ротовую полость, включают лепешки, пастилки и жидкости для полоскания полости рта. Фармацевтические препараты, предназначенные для назального введения, в которых носитель является твердым, включают крупный порошок, имеющий размер частиц, например, в пределах от 20 до 500 мкм, который вводят способом, при котором производится вдыхание через нос, то есть посредством быстрой ингаляции через носовой ход из контейнера с порошком, поднесенного близко к носу. Подходящие препараты, в которых носитель является жидкостью, для введения в виде назального спрея или в виде капель в нос включают водные или масляные растворы активного ингредиента. Фармацевтические препараты, предназначенные для введения посредством ингаляции, включают тонкодисперсные порошки для ингаляций и туманы, которые можно генерировать посредством различных типов дозированных аэрозолей под давлением, небулайзеров или инсуффляторов. Фармацевтические препараты, предназначенные для парентерального введения, включают водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферные растворы, бактериостатические агенты и растворенные вещества, которые делают препарат изотоническим по отношению к крови назначенного реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Препараты могут быть представлены в однодозовых или многодозовых контейнерах, например запаянных ампулах и флаконах, и могут храниться в сублимированном (лиофилизированном) состоянии, требуя лишь добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед использованием. Инъекционные растворы и суспензии экстемпорального изготовления можно приготовить из стерильных порошков,гранул и таблеток. В некоторых воплощениях настоящего изобретения фармацевтические препараты предназначены для интраокулярного введения посредством интраокулярной инъекции или другого устройства доставки в глаза. Примеры устройств для глазного введения, которые могут быть использованы в способах по изобретению, включают устройства для периокулярного или интравитреального введения, контактные линзы и липосомы. См., например, патенты США 3416530; 3828777; 4014335; 4300557; 4327725; 4853224; 4946450; 4997652; 5147647; 5164188; 5178635; 5300114; 5322691; 5403901; 5443505; 5466466; 5476511; 5516522; 5632984; 5679666; 5710165; 5725493; 5743274; 5766242; 5766619; 5770592; 5773019; 5824072; 5824073; 5830173; 5836935; 5869079; 5902598; 5904144; 5916584; 6001386; 6074661; 6110485; 6126687; 6146366; 6251090; 6299895; 6331313; 6416777; 6649184; 6719750; 6660960; и публикациях заявок на патенты США 2003/0064088, 2004/0247645 и 2005/0113806; каждый из которых включен в данное описание посредством ссылки на их основные положения, касающиеся устройств для глазного введения. Устройство доставки в глаза может быть разработано для контролируемого высвобождения одного или более чем одного терапевтического агента с различными определенными скоростями высвобождения и непрерывной кинетикой дозирования и проницаемостью. Контролируемое высвобождение может быть достигнуто путем разработки полимерных матриц, объединяющих различные варианты и свойства биоразлагаемых/биоразрушаемых полимеров (например, поли(этиленвинил)ацетат (EVA), супергидролизованный PVA (поливинилацетат), гидроксиалкилцеллюлоза (НРС), метилцеллюлоза (МС), гидроксипропилметилцеллюлоза (НРМС), поликапролактон, поли(гликолевая) кислота, поли(молочная) кислота,полиангидрид, молекулярные массы полимеров, кристалличность полимеров, соотношения сополимеров,условия обработки, качество обработки поверхности, конфигурация, введение эксципиентов и полимерные покрытия, которые будут усиливать диффузию, эрозию, растворение и осмос лекарственного средства. Препараты для доставки лекарственного средства с использованием глазных устройств могут объединять один или более чем один активный агент и адъювант, соответствующий указанному пути введения. Например, активные агенты могут быть смешаны с любым фармацевтически приемлемым эксципиентом, таким как лактоза, сахароза, крахмальный порошок, сложные эфиры целлюлозы и алкановых кислот, стеариновая кислота, тальк, стеарат магния, оксид магния, натриевые и кальциевые соли фосфорной и серной кислот, аравийская камедь, желатин, альгинат натрия, поливинилпирролидин и/или поливиниловый спирт, таблетированы или инкапсулированы для традиционного введения. Альтернативно,соединения можно растворять в полиэтиленгликоле, пропиленгликоле, коллоидных растворах карбоксиметилцеллюлозы, этаноле, кукурузном масле, арахисовом масле, хлопковом масле, кунжутном масле,трагакантовой камеди и/или различных буферных растворах. Соединения также могут быть смешаны с композициями как биоразлагаемых, так и бионеразлагаемых полимеров и носителем или разбавителем,-8 016227 который обладает свойством задержки по времени. Типичные примеры биоразлагаемых композиций могут включать в себя альбумин, желатин, крахмал, целлюлозу, декстраны, полисахариды, поли(D,Lлактид), поли(D,L-лактид-ко-гликолид), поли(гликолид), поли(гидроксибутират), поли(алкилкарбонат) и поли(ортоэфиры) и их смеси. Типичные примеры бионеразлагаемых полимеров могут включать сополимеры EVA, силиконовый каучук и поли(метилакрилат) и их смеси. Фармацевтические композиции для доставки в глаза также включают образующую гель in situ водную композицию. Такая композиция включает гелеобразующий агент в концентрации, эффективной для стимулирования гелеобразования при контакте с глазом или слезной жидкостью. Подходящие гелеобразующие агенты включают термореактивные полимеры, но не ограничиваются ими. Термин "образующий гель in situ", как он использован здесь, включает не только жидкости с низкой вязкостью, которые образуют гели при контакте с глазом или слезной жидкостью, но также включает более вязкие жидкости, такие как полужидкие и тиксотропные гели, которые проявляют значительно повышенную вязкость или жесткость геля при введении в глаз. См., например, Ludwig (2005) Adv. Drug Deliv. Rev. 3;57:1595-639,включенную в данное описание посредством ссылки на ее основные положения, касающиеся примеров полимеров для применения при доставке лекарственного средства в глаз. Специалистам в данной области техники будет понятно, что кроме ингредиентов, особо упомянутых выше, препараты могут включать другие традиционные для данной области техники агенты, учитывая тип данного препарата. Например, препараты, подходящие для перорального введения, могут включать ароматизатор. Согласно способам по изобретению специфическое соединение формулы (I) вводят млекопитающему. Типично, количество одного из вводимых агентов по настоящему изобретению будет зависеть от ряда факторов, включая, например, возраст и массу млекопитающего, точно установленное состояние,требующее лечения, тяжесть состояния, природа препарата и путь введения. В конечном счете, количество будет выбрано по усмотрению лечащего врача или ветеринара. Типично, соединение формулы (I) или его соль или сольват будут введены в диапазоне от 0,1 до 100 мг/кг массы тела реципиента (млекопитающего) в сутки и более обычно в диапазоне от 1 до 10 мг/кг массы тела в сутки. В конкретных воплощениях соединение вводят местно (например, в глаз), а общее количество вводимого соединения может составлять от 1 мкг до 10 мг, а именно от 5 мкг до 500 мкг или от 10 мкг до 250 мкг. Следующие примеры предназначены только для иллюстрации и никоим образом не предназначены для ограничения объема изобретения. Примеры Использованные здесь символы и условные обозначения, которые используют в этих процессах,схемах и примерах, согласуются с теми, которые используются в современной научной литературе, например Journal of the American Chemical Society или Journal of Biological Chemistry. Стандартные однобуквенные или трехбуквенные аббревиатуры обычно используют для обозначения аминокислотных остатков, которые, как предполагают, находятся в L-конфигурации, если не оговорено особо. Если не оговорено особо, все исходные вещества получали от торговых поставщиков и использовали без дополнительной очистки. В частности, следующие сокращения могут быть использованы в примерах и повсеместно в описании: 150 мМ NaCl, 50 мМ трис-HCl, рН 7,5, 0,25% (мас./об.) - дезоксихолат, 1% детергент NP-40, 5 мМ ортованадат натрия, 2 мМ фторид натрия и коктейль ингибиторов протеаз. Если не оговорено особо, все температуры выражены в С (градусы Цельсия). Все реакции проводили в атмосфере инертного газа при комнатной температуре, если не оговорено особо. Следующие примеры описывают синтезы промежуточных соединений, особенно полезных в синтезе соединений формулы (I) и (II). Промежуточный пример 1. Получение 2,3-диметил-6-нитро-2 Н-индазола Способ 1. К перемешиваемому раствору 18,5 г (0,11 моль) 3-метил-6-нитро-1 Н-индазола в 350 мл ацетона при комнатной температуре добавляли 20 г (0,14 моль) тетрафторбората триметилоксония. Затем раствор оставляли для перемешивания в атмосфере аргона в течение 3 ч, растворитель удаляли при пониженном давлении. К полученному твердому веществу добавляли насыщенный водный NaHCO3 (600 мл) и смесь хлороформ-изопропанол 4:1 (200 мл), смесь перемешивали и разделяли слои. Водную фазу промывали дополнительным количеством смеси хлороформ-изопропанол (4200 мл) и объединенную органическую фазу сушили (Na2SO4). Фильтрация и удаление растворителя дали желтовато-коричневое твердое вещество. Твердое вещество промывали эфиром (200 мл) с получением 2,3-диметил-6-нитро-2 Н-индазола в виде желтого твердого вещества (15,85 г, 73%). 1 Н ЯМР (300 МГц, DMSO-d6)8.51 (s, 1 Н); 7.94 (d, J=9,1 Гц, 1 Н); 7.73 (d, J=8,9 Гц, 1 Н); 4.14 (s, 3 Н); 2.67 (s, 3 Н). MS (ES+, m/z) 192 (М+Н). Способ 2. Триметилортоформиат (11 ммоль; 1,17 г) добавляли за 2-минутный период к раствору эфирата трифторида бора (12,5 ммоль; 1,77 г в метиленхлориде (2,0 мл, который был охлажден до -30 С. Смесь нагревали до 0 С в течение 15 мин и затем охлаждали до -70 С. Нитроиндазол (10 ммоль; 1,77 г) суспендировали в метиленхлориде (30 мл) и добавляли все сразу к охлажденной смеси. Смесь перемешивали при -70 С в течение 15 мин и при температуре окружающей среды в течение 17 ч. Через 17 ч смесь становилась красной и гетерогенной. Реакционную смесь гасили насыщенным раствором бикарбоната натрия (20 мл) и органический слой отделяли. Водный слой экстрагировали метиленхлоридом (30 мл). Метиленхлоридные слои объединяли и экстрагировали водой (30 мл). Метиленхлоридный слой перегоняли при пониженном давлении до остатка 10 мл. Добавляли пропанол (10 мл) и остаток метиленхлорида удаляли при пониженном давлении, получая в результате желтую суспензию. Продукт выделяли посредством фильтрации с получением 2,3-диметил-6-нитро-2 Н-индазола (65%; 7 ммоль; 1,25 г) в виде светложелтого порошка. 1 Н ЯМР (300 МГц, DMSO-d6)8.51 (s, 1H); 7.94 (d, J=9,1 Гц, 1 Н); 7.73 (d, J=8,9 Гц,1 Н); 4.14 (s, 3 Н); 2.67 (s, 3 Н). MS (ES+, m/z) 192 (М+Н). Способ 3. В круглодонной колбе на 25 мл растворяли 3-метил-6-нитроиндазол (7,27 ммоль; 1,28 г) при перемешивании в DMSO (4,0 мл) и обрабатывали концентрированной серной кислотой (7,27 ммоль; 0,73 г) с получением густой суспензии. Суспензию обрабатывали диметилсульфатом (21,1 ммоль; 2,66 г). Смесь нагревали в атмосфере азота при 50 С в течение 72 ч. Через 72 ч получали густую желтую суспензию. Суспензию охлаждали и медленно обрабатывали насыщенным раствором бикарбоната натрия (10 мл). Смесь экстрагировали метиленхлоридом (220 мл). Метиленхлоридные слои объединяли и подвергали обратной экстракции водой (20 мл). Метиленхлоридный слой обрабатывали пропанолом (10 мл) и метиленхлорид удаляли посредством перегонки при пониженном давлении. Твердое вещество выделяли посредством фильтрации и желтое твердое вещество промывали гептаном (5 мл) и сушили на воздухе. Продукт 2,3-диметил-6-нитро-2 Н-индазол (70%; 0,97 г) получили в виде светло-желтого твердого вещества. 1 Н ЯМР (300 МГц, DMSO-d6)8.51 (s, 1 Н); 7.94 (d, J=9,1 Гц, 1 Н); 7.73 (d, J=8,9 Гц, 1 Н); 4.14 (s, 3 Н); 2.67 (s, 3 Н). MS (ES+, m/z) 192 (М+Н).- 10016227 Способ 4. В 3-горлую круглодонную колбу на 250 мл помещали сернокислую соль 3-метил-6-нитро-1 Ниндазола (5,0 г; 18,2 ммоль) и метиленхлорид (25 мл). Смесь перемешивали при 25 С и обрабатывалиDMSO (5 мл). Диметилсульфат (6,7 г; 5,0 мл; 53,0 ммоль) добавляли с помощью шприца и реакционную смесь нагревали с обратным холодильником в бане на 70 С. Через 7 ч ЖХВД-анализ показал 9% исходного вещества. На этой стадии нагревание прекращали и начинали обработку. Насыщенный раствор бикарбоната натрия (35 мл) добавляли к реакционной смеси при комнатной температуре. Слои оставляли для разделения и водный слой экстрагировали метиленхлоридом (25 мл). Метиленхлоридные слои объединяли и промывали водой (225 мл). Метиленхлоридный слой перегоняли при пониженном давлении до тех пор, пока не оставалась половина объема. Добавляли пропанол (25 мл) и продолжали перегонку при пониженном давлении до полного удаления метиленхлорида. Получили желтую суспензию, которую оставляли для перемешивания при 25 С в течение 1 ч. Продукт выделяли фильтрацией и полученное желтое твердое вещество промывали гептаном (10 мл). Получили 2,3-диметил-6-нитро-2 Н-индазол (70%; 2,43 г) в виде желтого твердого вещества. 1 Н ЯМР (300 МГц, DMSO-d6)8.51 (s, 1 Н); 7.94 (d, J=9,1 Гц,1 Н); 7.73 (d, J=8,9 Гц, 1 Н); 4.14 (s, 3 Н); 2.67 (s, 3 Н). MS (ES+, m/z) 192 (М+Н). Промежуточный пример 2. Получение 2,3-диметил-6-амино-2 Н-индазола. Способ 1. К перемешиваемому раствору 2,3-диметил-6-нитро-2H-индазола (1,13 г) в 2-метоксиэтиловом эфире (12 мл) при 0 С добавляли по каплям раствор 4,48 г хлорида олова(II) в 8,9 мл концентрированнойHCl в течение 5 мин. После окончания добавления ледяную баню убирали и раствор оставляли для перемешивания в течение дополнительных 30 мин. Приблизительно 40 мл диэтилового эфира добавляли к реакционной смеси, получая в результате образование осадка. Полученный осадок выделяли посредством фильтрации и промывали диэтиловым эфиром и получали желтое твердое вещество (1,1 г; 95%), солянокислую соль 2,3-диметил-2 Н-индазол-6-амина. 1 Н ЯМР (300 МГц, DMSO-d6)7.77 (d, J=8,9 Гц, 1 Н); 7.18 (s, 1H); 7.88 (m, 1H); 4.04 (s, 3 Н); 2.61 (s, 3 Н). MS (ES+, m/z) 162 (М+Н). Способ 2. 3-горлую круглодонную колбу на 2 л оборудовали системой подачи и отвода азота и механическим перемешивающим устройством. Инициировали подачу умеренного потока азота и в реактор загружали 10% Pd/C (50% увлажненный водой; 6,0 г). Начинали перемешивание и в реактор загружали метанол(750 мл) и продукт промежуточного примера 1 (50 г). Формиат аммония (82,54 г) растворяли в воде (120 мл). Водный раствор формиата аммония добавляли к реакционному раствору со скоростью прибавления,которая поддерживала температуру реакции при или между 25 и 30 С. Реакции давали протекать при 25 С. Через 6 ч делали вывод об окончании реакции на основании ЖХВД-анализа. Смесь фильтровали и катализатор промывали метанолом (50 мл). Метанольные слои объединяли и растворитель удаляли при пониженном давлении. Остаток растворяли в воде (200 мл) и экстрагировали метиленхлоридом (3250 мл). Метиленхлоридные слои объединяли и растворитель удаляли под вакуумом с удалением приблизительно половины растворителя. Добавляли гептан (400 мл) и продолжали вакуумную перегонку до тех пор, пока не оставалось приблизительно 300 мл суспензии реакционного продукта. Продукт выделяли посредством фильтрации и сушили под вакуумом при 50 С в течение 4 ч с получением 2,3-диметил-6 амино-2 Н-индазола в виде свободного основания (40,76 г; 96,7%). 1 Н ЯМР (300 МГц, DMSO-d6)7.31 (d,J=8,9 Гц, 1 Н);6.45 (d, J=8,9 Гц, 1H); 6.38 (s, 1 Н); 4.95 (s, уширенный, 2 Н); 3.85 (s, 3 Н); 2.44 (s, 3H). MS Способ 1. К перемешиваемому раствору продукта промежуточного примера 2 (2,97 г; 0,015 моль) и NaHCO3(5,05 г; 0,06 моль) в THF (15 мл) и этаноле (60 мл) добавляли 2,4-дихлорпиримидин (6,70 г; 0,045 моль) при комнатной температуре. Затем реакционную смесь перемешивали в течение четырех часов при 85 С,суспензию охлаждали до комнатной температуры, фильтровали и тщательно промывали этилацетатом. Фильтрат концентрировали при пониженном давлении и полученное твердое вещество растирали с этилацетатом с получением N-(2-хлорпиримидин-4-ил)-2,3-диметил-2 Н-индазол-6-амина (89%; 3,84 г). 1 Н ЯМР (400 МГц, DMSO-d6)7.28 (d, J=9,0 Гц, 1 Н); 6.42 (d, J=8,8 Гц, 1 Н); 6.37 (s, 1H); 5.18 (уширенный s,1H); 3.84 (s, 3 Н); 2.43 (s, 3 Н). MS (ES+, m/z) 274 (М+Н).- 11016227 Способ 2. В 3-горлую колбу на 1 л, оборудованную механической мешалкой с пневматическим приводом,термометром и системой подачи/отвода азота, загружали раствор продукта промежуточного примера 2(32,89 г; 0,204 моль; 1,0 эквив.) в 425 мл (13 объемов) смеси EtOH/THF (4/1), бикарбонат натрия (51,42 г; 0,612 моль; 3,0 эквив.) и затем 2,4-дихлорпиримидин (45,59 г; 0,306 моль; 1,5 эквив.). Содержимое колбы нагревали до 75 С и выдерживали при 74-76 С в течение 6-7 ч. Протекание реакции проверяли посредством ЖХВД (продукт промежуточного примера 2 2%). Реакционную смесь охлаждали до 20-25 С в течение 30 минут и выдерживали при 20-25 С в течение 30 мин. Затем реакционную смесь дополнительно охлаждали до 10-12 С в течение 30 мин и выдерживали при этой температуре в течение дополнительных 10 мин. Содержимое отфильтровывали и осадок на фильтре промывали EtOAc (2100 мл; 3,0 объема) и деионизированной водой (514 мл; 15,6 объемов). Осадок на фильтре затем сушили в вакуумной печи при 35 С в течение ночи с получением 44,75 г требуемого продукта в виде белого твердого вещества (80,1%). 1 Н ЯМР (400 МГц, DMSO-d6)7.28 (d, J=9,0 Гц, 1 Н); 6.42 (d, J=8,8 Гц, 1 Н); 6.37 (s, 1H); 5.18 (уширенныйs, 1H); 3.84 (s, 3 Н); 2.43 (s, 3 Н). MS (ES+, m/z) 274 (М+Н). Способ 3. В реактор на 2 л с рубашкой загружали IMS (промышленный метилированный спирт) (1000 мл),продукт промежуточного примера 2 (100 г; 0,620 моль; 1 эквив.), гидрокарбонат натрия (107 г; 1,27 моль; 2,05 эквив.) и 2,4-дихлорпиримидин (101 г; 0,682 моль; 1,1 эквив.). Раствор перемешивали и нагревали до температуры дефлегмации при температуре в рубашке 85 С в течение 8 ч. Полученную суспензию затем охлаждали до 50 С и добавляли воду (500 мл) для поддержания температуры между 40 и 50 С. Реакционную смесь затем перемешивали при температуре внутри аппарата 50 С в течение 1 ч и затем охлаждали до 20 С. Твердый продукт собирали посредством фильтрации, промывали водой (750 мл 2) с последующим промыванием EtOAc (450 мл 1). После сушки в течение ночи под вакуумом при 60 С получали 135 г (80%) N-(2-хлорпиримидин-4-ил)-2,3-диметил-2 Н-индазол-6-амина. Промежуточный пример 4. Получение N-(2-хлорпиримидин-4-ил)-N,2,3-триметил-2 Н-индазол-6 амина Способ 1. К перемешиваемому раствору продукта промежуточного примера 3 (7,37 г) в DMF (50 мл) добавляли CS2CO3 (7,44 г; 2 эквив.) и подметан (1,84 мл; 1,1 эквив.) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь выливали в водяную баню со льдом и осадок собирали фильтрацией и промывали водой. Осадок сушили на воздухе с получениемN-(2-хлорпиримидин-4-ил)-N,2,3-триметил-2 Н-индазол-6-амина в виде желтоватого твердого вещества(М+Н). Способ 2. В 3-горлую колбу на 3 л, оборудованную механической мешалкой с пневматическим приводом,термометром, воронкой для введения добавок и системой подачи/отвода азота, загружали при перемешивании DMF (272 мл; 5 объемов) и продукт промежуточного примера 3 (54,4 г; 0,20 моль; 1,0 эквив.). В реакционную смесь затем добавляли карбонат цезия (194,5 г; 0,60 моль; 3,0 эквив.), поддерживая температуру реакции между 20 и 25 С. Реакционную смесь перемешивали при 2025 С в течение 10 мин. Подметан (45,1 г; 0,32 моль; 1,6 эквив.) загружали в течение 10 мин, поддерживая температуру 2030 С. Реакционную смесь перемешивали при 2030 С (типично, реакция заканчивается за 12 ч). Добавляли деионизированную Н 2 О (925 мл; 17 объемов) в течение 30 мин, поддерживая температуру 2540 С. Реакционную смесь перемешивали при 2025 С в течение 40 мин. Продукт выделяли посредством фильтрации и затем осадок на фильтре промывали смесью H2O/DMF (6:1; 252 мл; 4,6 объема). Влажный осадок сушили под вакуумом при 4045 С и выделяли N-(2-хлорпиримидин-4-ил)-N,2,3 триметил-2 Н-индазол-6-амин (51,7 г; 90,4%) в виде желтого твердого вещества. 1 Н ЯМР (400 МГц,DMSO-d6)7.94 (d, J=6,0 Гц, 1 Н); 7.80 (d, J=7,0 Гц, 1 Н); 7.50 (d, J=1,0 Гц, 1 Н); 6.88 (m, 1 Н); 6.24 (d, J=6,2 Гц, 1 Н); 4.06 (s, 3 Н); 3.42 (s, 3 Н); 2.62 (s, 3 Н). MS (ES+, m/z) 288 (М+Н). Способ 3. В реактор на 2 л с рубашкой загружали DMF (383 мл), диметилкарбонат (192 мл), продукт промежуточного примера 3 (115 г; 0,420 моль; 1 эквив.), карбонат калия (174 г; 1,26 моль; 3 эквив.). Суспензию перемешивали и нагревали до температуры дефлегмации при температуре в рубашке 135 С в течение 6 ч. Полученную суспензию затем охлаждали до 60 С и медленно добавляли воду (1150 мл), поддерживая- 12016227 температуру реакции между 50 и 65 С. Реакционную смесь затем охлаждали до 20 С и перемешивали при температуре внутри аппарата 20 С в течение 2 ч и затем охлаждали до 10 С и выдерживали в течение ночи, после чего отфильтровывали. Твердое вещество промывали водой (230 мл 2) при комнатной температуре и промывали смесью IMS:вода (1:1) (230 мл 1). После сушки в течение ночи под вакуумом при 60 С получили 101 г (83%) N-(2-хлорпиримидин-4-ил)-N,2,3-триметил-2 Н-индазол-6-амина. Промежуточный пример 5. Получение 5-амино-2-метилбензолсульфонамида Способ 1. К перемешиваемому раствору 2-метил-5-нитробензолсульфонамида (4,6 г; 0,021 моль) в 2 метоксиэтиловом эфире (43 мл) при 0 С добавляли по каплям раствор 16,1 г хлорида олова(II) в 32 мл концентрированной HCl в течение 15 мин. После окончания добавления ледяную баню убирали и раствор оставляли для перемешивания в течение дополнительных 30 мин. Приблизительно 130 мл диэтилового эфира добавляли к реакционной смеси. Смесь интенсивно перемешивали в течение 1 ч. Смесь подщелачивали раствором NaOH и NaHCO3 и экстрагировали этилацетатом (3). Объединенные этилацетатные слои сушили над безводным MgSO4, фильтровали и концентрировали с получением неочищенного продукта. Растирание неочищенного продукта с метанолом дало 2,4 г чистого 5-амино-2 метилбензолсульфонамида в виде светло-коричневого твердого вещества. 1 Н ЯМР (300 МГц, DMSO-d6)7.11-7.10 (m, 3 Н); 6,95 (d, J=8,1 Гц, 1 Н); 6.60 (dd, J=8,1 и 2,4 Гц, 1 Н); 5.24 (s, 2 Н); 2.36 (s, 3 Н). MS (ES+,m/z) 187 (М+Н). Промежуточный пример 6. Получение 4-[(метилсульфонил)метил]анилина Способ 1. Объединяли 4-нитробензилбромид (40 г; 0,185 моль) и натриевую соль метансульфиновой кислоты(19,5 г; 1 эквив.) в этаноле (460 мл; 0,4 М). Смесь перемешивали и нагревали до 80 С с обратным холодильником. Через 3 ч реакционную смесь охлаждали до комнатной температуры и фильтровали, собирая желтоватое твердое вещество. Твердое вещество дважды промывали EtOH и сушили на воздухе с получением 37 г метил-4-нитробензилсульфона. 1 Н ЯМР (300 МГц, DMSO-d6)8.27 (d, J=8,6 Гц, 2 Н); 7.69 (d,J=8,6 Гц, 2 Н); 4.71 (s, 2 Н); 2.96 (s, 3 Н). MS (ES+, m/z) 216 (М+Н). Объединяли метил-4-нитробензилсульфон (9,5 г; 0,044 моль) и 10% Pd/C (0,95 г; 0,1 мас./мас.) в этилацетате (220 мл; 0,2 М). Смесь помещали во встряхивающий аппарат Парра под давлением газообразного водорода 40 ф/кв дюйм (275,8 кПа). Через 3 ч реакционную смесь выливали в 50% смесь МеОН/EtOAc (400 мл) и интенсивно перемешивали в течение 30 мин. Смесь фильтровали через набивку из целита и силикагеля. Черное вещество на поверхности набивки удаляли и помещали в 80% смесь МеОН/EtOAc (200 мл) и интенсивно перемешивали в течение 30 мин. Смесь снова фильтровали через набивку из целита и силикагеля. Этот процесс повторяли дважды. Объединяли все фильтраты. Упаривали и сушили. Растирание с EtOAc дало чистый 4-[(метилсульфонил)метил]анилин. 1 Н ЯМР (300 МГц, DMSOd6)7.03 (d, J=8,4 Гц, 2 Н); 6.54 (d, J=8,6 Гц, 2 Н); 5.20 (s, 2H); 4.20 (s, 2H); 2.79 (s, 3H). MS (ES+, m/z) 186(М+Н). Способ 2. В круглодонную колбу (1,0 л), оборудованную магнитной мешалкой и обратным холодильником,загружали 4-нитробензилбромид (40 г; 0,185 моль; 1,0 эквив.), натриевую соль метансульфиновой кислоты (21,7 г; 0,213 моль; 1,15 эквив.) и этанол (400 мл; крепость 200; 10 объемов). Смесь перемешивали и нагревали до 80 С с обратным холодильником в течение 2 ч. Контролировали протекание реакции посредством быстрой ЖХВД (реакция считается завершенной, когда ЖХВД показывает содержание 4 нитробензилбромида 0,5%). Смесь охлаждали до комнатной температуры. Фильтровали и осадок промывали этанолом (40 мл). Влажный осадок (15 г; 46,2 ммоль) использовали на следующей стадии гидрирования без дополнительной сушки. В колбу для гидрирования на 500 мл загружали вышеуказанный влажный осадок, метил-4 нитробензилсульфон (15 г; 46,2 ммоль; используемый "как есть"), 10% Pd/C (0,1 г; 1% мас./мас.) и этанол(120 мл; крепость 200) и воду (40 мл). Подкачивали в атмосферу реактора водород (3 раза). Встряхивали реактор под давлением Н 2 (65 ф/кв. дюйм (448,2 кПа при комнатной температуре в течение 30 минут и при 50 С в течение двух часов. Контролировали протекание реакции посредством ЖХВД (реакция считается завершенной, когда ЖХВД показывает содержание метил-4-нитробензилсульфона 0,2%). Смесь нагревали до 80 С. Фильтровали горячий раствор через набивку из целита (2,0 г) и промывали набивкуEtOH (10 мл). Переносили фильтрат в круглодонную колбу для кристаллизации (500 мл). Перегоняли суспензию под вакуумом при 60 С, пока не оставался объем 60 мл. Охлаждали суспензию до 0 С около 1- 13016227 ч. Выделяли кристаллы посредством вакуумной фильтрации и промывали сосуд и кристаллы этанолом(10 мл). Сушили продукт под вакуумом при 50 С до постоянной массы. Получили желтоватое твердое вещество (7,3 г). Выход составляет 85% для двух объединенных стадий с 99% чистотой продукта, определенной посредством ЖХВД. Промежуточный пример 7. Получение 4-[(изопропилсульфонил)метил]фениламина К раствору 1-(бромметил)-4-нитробензола (3,0 г; 17,4 ммоль) в этаноле (50 мл) добавляли 2 тиопропоилат натрия (2,7 г; 17,4 ммоль). Через 12 часов растворитель удаляли при пониженном давлении, оставшийся остаток разбавляли EtOAc и фильтровали для удаления остаточных солей. Растворитель сушили над MgSO4 и удаляли при пониженном давлении и продукт использовали далее без дополнительной очистки. Затем сульфид разбавляли CH2Cl2 (50 мл) и порциями добавляли метахлорпероксибензойную кислоту (70%) (6,6 г; 38,4 ммоль). Делали вывод об окончании реакции на основании ТСХ и растворитель удаляли при пониженном давлении. Оставшийся остаток разбавляли EtOAc и промывали 1 М NaOH (2100 мл). Растворитель сушили над MgSO4 и удаляли при пониженном давлении, и продукт использовали далее без дополнительной очистки. Затем остаток разбавляли диметоксиэтаном (8,0 мл) и по каплям добавляли раствор SnCl2 (13,8 г; 69 ммоль) в HCl (8,0 мл). Раствор оставляли для перемешивания в течение 2 ч и восстановление считали законченным на основании ТСХ. Реакционную смесь разбавляли Et2O, что приводило к осаждению продукта в виде соли HCl. Твердое вещество собирали и промывали Et2O (2100 мл) с получением чистого анилина (2,4 г; 65%). 1 Н ЯМР (300 МГц,d6DMSO+NaHCO3)7.37 (d, J=8,4 Гц, 2 Н); 7.21 (d, J=8,4 Гц, 2 Н); 4.41 (s, 2H); 3.18-3.09 (m, 1H); 1.21 (d,J=6,9 Гц, 6 Н). Промежуточный пример 8. Получение 4-[2-(метилсульфонил)этил]анилина К раствору 1-(бромэтил)-4-нитробензола (3,0 г; 13,0 ммоль) в этаноле (70 мл) добавляли тиометоксид натрия (1,0 г; 14,0 ммоль). Через 12 ч растворитель удаляли при пониженном давлении, оставшийся остаток разбавляли EtOAc и фильтровали для удаления остаточных солей. Растворитель сушили надMgSO4 и удаляли при пониженном давлении и продукт использовали далее без дополнительной очистки. Затем сульфид разбавляли CH2Cl2 (100 мл) и порциями добавляли мета-хлорпероксибензойную кислоту(70%) (8,2 г; 48,8 ммоль). Делали вывод об окончании реакции на основании ТСХ и растворитель удаляли при пониженном давлении. Оставшийся остаток разбавляли EtOAc и промывали 1 М NaOH (2100 мл). Растворитель сушили над MgSO4 и удаляли при пониженном давлении и продукт использовали далее без дополнительной очистки. Затем остаток добавляли к суспензии палладия на угле (10 мол.%) вEtOAc (50 мл) во встряхивающем сосуде Парра. Реакционную смесь затем помещали под давление 40 атм (40530 кПа) газообразного водорода. Раствор оставляли для встряхивания в течение 2 ч и восстановление считали законченным на основании ТСХ. Реакционную смесь фильтровали через набивку из целита и промывали EtOAc, а растворитель удаляли при пониженном давлении с получением неочищенного твердого вещества. Смесь перекристаллизовывали из горячего EtOAc с получением чистого анилинаCH2Cl2 (100 мл) по каплям добавляли метансульфонилхлорид (1,7 мл; 21,0 ммоль). Делали вывод об окончании реакции на основании ТСХ через 1 ч и ее останавливали насыщенным водным NaHCO3. Реакционную смесь разбавляли EtOAc и органический слой отделяли, сушили над MgSO4 и растворитель удаляли при пониженном давлении. Полученный остаток растворяли в этаноле (100 мл) и порциями добавляли тиометоксид натрия (1,5 г; 21,0 ммоль). Через 12 ч растворитель удаляли при пониженном давлении, оставшийся остаток разбавляли EtOAc и фильтровали для удаления остаточных солей. Растворитель сушили над MgSO4 и удаляли при пониженном давлении и продукт использовали далее без дополнительной очистки. Затем сульфид разбавляли CH2Cl2 (100 мл) и порциями добавляли метахлорпероксибензойную кислоту (70%) (10,8 г; 62 ммоль). Делали вывод об окончании реакции на основании ТСХ и растворитель удаляли при пониженном давлении. Оставшийся остаток разбавляли EtOAc и промывали 1 М NaOH (2100 мл). Растворитель сушили над MgSO4 и удаляли при пониженном давлении- 14016227 и продукт использовали далее без дополнительной очистки. Затем остаток добавляли к суспензии палладия на угле (10 мол. %) в EtOAc (50 мл) во встряхивающем сосуде Парра. Реакционную смесь затем помещали под давление 40 атм (40530 кПа) газообразного водорода. Раствор оставляли для встряхивания в течение 2 ч и восстановление считали законченным на основании ТСХ. Реакционную смесь фильтровали через набивку из целита и промывали EtOAc, а растворитель удаляли при пониженном давлении с получением неочищенного твердого вещества. Смесь перекристаллизовывали из горячего EtOAc с получением чистого анилина (2,0 г; 57%). 1 Н ЯМР (300 МГц, d6DMSO+NaHCO3)7.06 (d, J=8,5 Гц, 2 Н); 6.53 (d,J=8,5 Гц, 2 Н); 5.21 (s, 2 Н); 4.23 (q, J=7,1 Гц, 1 Н); 2.70 (s, 3 Н); 1.21 (d, J=7,1 Гц, 3 Н). Промежуточный пример 10. Получение 4-[1-метил-1-(метилсульфонил)этил]анилина К перемешиваемому раствору трет-бутоксида (5,76 г; 0,051 моль) в THF добавляли метил-4 нитробензилсульфон (5 г; 0,023 моль) с последующим добавлением подметана (2,89 мл; 0,046 моль). Смесь перемешивали при комнатной температуре в течение 1 ч. Добавляли дополнительное количество трет-бутоксида (2,9 г) и подметана (0,5 мл). Смесь перемешивали при комнатной температуре в течение еще 1 ч. Смесь разбавляли EtOAc и подкисляли 6 н. HCl. Смесь экстрагировали этилацетатом (3). Объединенные этилацетатные слои сушили над безводным MgSO4, фильтровали и упаривали. Твердое вещество растирали с этанолом с получением чистого 1-[1-метил-1-(метилсульфонил)этил]-4-нитробензола. К перемешиваемому раствору 1-[1-метил-1-(метилсульфонил)этил]-4-нитробензола (3,32 г; 0,014 моль) в 2-метоксиэтиловом эфире (70 мл) при 0 С по каплям добавляли раствор 10,35 г хлорида олова(II) в 20,5 мл концентрированной HCl в течение 15 мин. После окончания добавления ледяную баню убирали и раствор оставляли для перемешивания в течение дополнительных 30 мин. Приблизительно 70 мл диэтилового эфира добавляли к реакционной смеси. Смесь интенсивно перемешивали в течение 1 ч. Образовывался осадок, и его собирали фильтрацией. Твердое вещество растворяли в CH2Cl2 и промывали 1 н.NaOH. Смесь экстрагировали CH2Cl2 (3). Объединенные CH2Cl2 слои сушили над безводным MgSO4,фильтровали и упаривали с получением 4-[1-метил-1-(метилсульфонил)этил]анилина в виде желтоватого твердого вещества. 1 Н ЯМР (300 МГц, DMSO-d6)7.21 (d, J=8,6 Гц, 2 Н); 6.55 (d, J=8,6 Гц, 2 Н); 5.23 (s,2H); 2.58 (s, 3 Н); 1.64 (s, 6H). Пример 1. Получение пазопаниба, (5-(4-[(2,3-диметил-2 Н-индазол-6-ил)(метил)амино]пиримидин 2-иламино)-2-метилбензолсульфонамида), и его солей и сольватов. Пример 1 а. Получение 5-(4-[(2,3-диметил-2H-индазол-6-ил)(метил)амино]пиримидин-2-иламино)-2-метилбензолсульфонамида Способ 1. К раствору соединения промежуточного примера 4 (200 мг; 0,695 ммоль) и 5-амино-2 метилбензолсульфонамида (129,4 мг; 0,695 ммоль) в изопропаноле (6 мл) добавляли 4 капли конц. HCl. Смесь нагревали до температуры дефлегмации в течение ночи. Смесь охлаждали до комнатной температуры и разбавляли эфиром (6 мл). Осадок собирали фильтрацией и промывали эфиром. Выделяли гидрохлорид 5-(4-[(2,3-диметил-2 Н-индазол-6-ил)(метил)амино]пиримидин-2-иламино)-2-метилбензолсульфонамида в виде беловатого твердого вещества. 1 Н ЯМР (400 МГц, d6DMSO+NaHCO3)9.50 (уширенный s, 1 Н); 8.55 (уширенный s, 1 Н); 7.81 (d, J=6,2 Гц, 1 Н); 7.75 (d, J=8,7 Гц, 1 Н); 7.69 (m, 1 Н); 7.43 (s, 1 Н); 7.23 (s, 2 Н); 7.15 (d, J=8,4 Гц, 1 Н); 6.86 (m, 1 Н); 5.74 (d, J=6,1 Гц, 1 Н); 4.04 (s, 3H); 3.48 (s, 3H); 2.61 (s,3H); 2.48 (s, 3H). MS (ES+, m/z) 438 (М+Н). Способ 2. В 3-горлую колбу на 250 мл, оборудованную магнитной мешалкой, термометром, обратным холодильником и системой подачи/отвода азота, загружали этанол (60 мл; 10 объемов), продукт промежуточного примера 4 (6,00 г; 20,85 ммоль; 1,0 эквив.) и 5-амино-2-метилбензолсульфонамид (4,00 г; 21,48 ммоль; 1,03 эквив.) при перемешивании. Реакционную смесь нагревали до 70 С. После перемешивания реакционной смеси при 68-72 С в течение 3 ч загружали 4 М HCI в диоксане (0,11 мл; 0,44 ммоль; 0,02 эквив.) в течение приблизительно 2 мин. Реакционную смесь перемешивали при 68-72 С до тех пор, пока не оставалось 1,5% по площади исходного продукта промежуточного примера 4, определенного посредством ЖХВД-анализа (типично, эта реакция заканчивается через 8 часов). Реакционную смесь охлаждали до 20 в течение приблизительно 30 минут и перемешивали при 20-22 С в течение 40 мин. Затем продукт выделяли посредством фильтрации и осадок на фильтре промывали этанолом (20 мл; 3,3- 15016227 объема). Осадок на фильтре сушили под вакуумом при 45-50 С. Выделяли моногидрохлорид 5-(4-[(2,3 диметил-2H-индазол-6-ил)(метил)амино]пиримидин-2-иламино)-2-метилбензолсульфонамида в виде белого твердого вещества. 1 Н ЯМР (400 МГц, d6DMSO+NaHCO3)9.50 (уширенный s, 1H); 8.55 (уширенный s, 1H); 7.81 (d, J=6,2 Гц, 1 Н); 7.75 (d, J=8,7 Гц, 1 Н); 7.69 (m, 1H); 7.43 (s, 1H); 7.23 (s, 2H); 7.15 (d,J=8,4 Гц, 1 Н); 6.86 (m, 1 Н); 5.74 (d, J=6,1 Гц, 1 Н); 4.04 (s, 3 Н); 3.48 (s, 3 Н); 2.61 (s, 3 Н); 2.48 (s, 3 Н). MS(ES+, m/z) 438 (М+Н). Способ 3. К перемешиваемой суспензии продукта промежуточного примера 4 (1,1 г; 3,8 ммоль) в 14 мл МеОН добавляли 5-амино-2-метилбензолсульфонамид (0,78 г; 4,2 ммоль; 1,1 эквив.) при комнатной температуре. Реакционную смесь нагревали с обратным холодильником в течение 3 ч, затем добавляли 4 М HCl в 1,4-диоксане (19 мкл; 0,076 ммоль) одной порцией. Через 4 часа суспензию охлаждали до комнатной температуры и фильтровали. Полученное твердое вещество промывали 10 мл МеОН и сушили под вакуумом с получением 1,3 г (72%) моногидрохлорида 5-(4-[(2,3-диметил-2 Н-индазол-6-ил)метиламино]2-пиримидиниламино)-2-метилбензолсульфонамида в виде белого твердого вещества. 1 Н ЯМР (DMSOd6, 400 МГц)10.95 (s, 1H); 8.36 (s, 1 Н); 7.86 (d, J=8,8 Гц, 2 Н); 7.64-7.59 (m, 2H); 7.40 (m, 3 Н); 6.93 (dd, J= 8,8, 2,0 Гц, 1 Н); 5.92 (s, 1H); 4.08 (s, 3 Н); 3.57 (s, 3 Н); 2.65 (s, 3 Н); 2.56 (s, 3 Н). Способ 4. К перемешиваемой суспензии продукта промежуточного примера 4 (1,1 г; 3,7 ммоль) в 10 мл THF добавляли 5-амино-2-метилбензолсульфонамид (0,70 г; 3,8 ммоль; 1,0 эквив.) при комнатной температуре. Реакционную смесь нагревали с обратным холодильником в течение 3 ч, затем добавляли 4 М HCl в 1,4-диоксане (18 мкл; 0,072 ммоль) одной порцией. Через 5 ч суспензию охлаждали до комнатной температуры и фильтровали. Полученное твердое вещество промывали 16 мл THF и сушили на воздухе с получением 1,6 г (92%) моногидрохлорида 5-(4-[(2,3-диметил-2 Н-индазол-6-ил)метиламино]-2 пиримидиниламино)-2-метилбензолсульфонамида в виде светло-желтого твердого вещества. Способ 5. К перемешиваемой суспензии продукта промежуточного примера 4 (1,0 г; 3,6 ммоль) в 10 млCH3CN добавляли 5-амино-2-метилбензолсульфонамид (0,70 г; 3,8 ммоль; 1,0 эквив.) при комнатной температуре. Реакционную смесь нагревали с обратным холодильником в течение 3 ч, затем добавляли 4 М HCl в 1,4-диоксане (18 мкл; 0,076 ммоль) одной порцией. Через 20 ч суспензию охлаждали до комнатной температуры и фильтровали. Полученное твердое вещество промывали 10 мл CH3CN и сушили на воздухе с получением 1,3 г (73%) моногидрохлорида 5-(4-[(2,3-диметил-2 Н-индазол-6-ил)метиламино]2-пиримидиниламино)-2-метилбензолсульфонамида в виде беловатого твердого вещества. Способ 6. В реактор на 2 л с рубашкой загружали МеОН (1005 мл), продукт промежуточного примера 4 (84 г; 0,292 моль; 1 эквив.) и 5-амино-2-метилбензолсульфонамид (60 г; 0,320 моль; 1,1 эквив.). Раствор перемешивали и нагревали до 50 С и добавляли 4 М HCl в диоксане (1,46 мл; 2 мол.%). Затем раствор перемешивали и нагревали до температуры дефлегмации при температуре в рубашке 85 С в течение 10 ч. Полученную суспензию затем охлаждали до 20-25 С и фильтровали. Отфильтрованное твердое вещество промывали ацетонитрилом (293 мл 2) при комнатной температуре. После сушки в течение ночи под вакуумом при 60 С получали 116 г (81%) моногидрохлорида 5-(4-[(2,3-диметил-2 Н-индазол-6 ил)метиламино]-2-пиримидиниламино)-2-метилбензолсульфонамида. Пример 1 б. Получение моногидрата моногидрохлорида 5-(4-[(2,3-диметил-2H-индазол-6 ил)метиламино]-2-пиримидиниламино)-2-метилбензолсульфонамида В круглодонную колбу добавляли 2,6 г моногидрохлорида из примера 1 а, способ 1, в любой форме. Затем добавляли 39 мл изопропанола (15 объемов). Смесь нагревали до 75 С на масляной бане, затем добавляли 14 мл 0,05 н. водной HCl (5,4 объема). Прозрачный раствор охлаждали до 65 С, затем вводили затравку моногидрата моногидрохлорида из примера 1, способ 1 (0,05-0,1 мас.%). Мутный раствор перемешивали при 65 С в течение 60 мин, затем охлаждали до 0 С при скорости 0,25-0,5 С/мин. Полученное белое твердое вещество отфильтровывали и сушили до постоянного веса под вакуумом при комнатной температуре с получением 88% выхода моногидрата моногидрохлорида 5-(4-[(2,3-диметил-2Hиндазол-6-ил)метиламино]-2-пиримидиниламино)-2-метилбензолсульфонамида. Пример 1 в. Получение ангидрата моногидрохлорида 5-(4-[(2,3-диметил-2H-индазол-6 ил)метиламино]-2-пиримидиниламино)-2-метилбензолсульфонамида В реактор на 1 л с рубашкой загружали ацетонитрил (563 мл), воду (188 мл) и моногидрохлорид из примера 1, способ 6 (50 г; 0,105 моль). Раствор перемешивали и нагревали до температуры в рубашке 85 С и получали прозрачный раствор. Раствор затем охлаждали до 45 С и выдерживали в течение 90 мин, чтобы вызвать кристаллизацию гидрата. Через 90 мин выдержки раствор охлаждали до 0 С, выдерживали в течение часа и затем фильтровали через осушитель фильтра. Отфильтрованные твердые вещества затем промывали ацетонитрилом (200 мл 1) при 0 С. Твердые вещества продували азотом в осушителе фильтра при 25 С, до тех пор пока LOD (нижний предел чувствительности) не составил менее чем 25%. Ацетонитрил загружали к твердым веществам на осушителе фильтра и перемешивали при 60 С в течение по меньшей мере 8 ч или до тех пор, пока превращение формы не было закончено (не оставалось моногидрата), как отмечено в DATR (отчт об испытаниях, проводимых с целью одобрения), с образованием ангидрата моногидрохлорида 5-(4-[(2,3-диметил-2H-индазол-6-ил)метиламино]-2-пиримидинил амино)-2-метилбензолсульфонамида. Содержимое осушителя фильтра охлаждали до 30 С и фильтрат продавливали, используя давление азота. Осадок на фильтре продували азотом при 60 С под вакуумом,до тех пор пока LOD не составил менее чем 0,5%. Содержимое охлаждали до 20 С, получая 37,5 г (75%) ангидрата моногидрохлорида 5-(4-[(2,3-диметил-2H-индазол-6-ил)метиламино]-2-пиримидиниламино)-2-метилбензолсульфонамида. Пример 2. Получение N4-(2,3-диметил-2 Н-индазол-6-ил)-N4-метил-N2-4-[(метилсульфонил)метил] фенилпиримидин-2,4-диамина Соединение примера 2 получали согласно общему способу, изложенному выше в примере 1, с использованием соединения промежуточного примера 4 и соответствующего анилина. Соответствующие анилины получали при использовании способов, подобных способам, описанным для промежуточных Примеров 5-10. 1 Н ЯМР (300 МГц, d6DMSO+NaHCO3)9.37 (bs, 1 Н); 7.88 (d, J=6,1 Гц, 1 Н); 7.78 (m, 3 Н); 7.47 (s, 1 Н); 7.22 (d, J=8,5 Гц, 2 Н); 6.91 (dd, J=8,8, 1,5 Гц, 1 Н); 5.84 (d, J=6,1 Гц, 1 Н); 4.37 (s, 2H); 4.09 (s,3 Н); 3.51 (s, 3 Н); 2.88 (s, 3 Н); 2.65 (s, 3H). MS (ES+, m/z) 437(M+H), 435 (M-H). Пример 3. Получение (S)-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2-(2,2,2-трифторэтил)2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-уксусной кислоты Получение 1. Получение метилового эфира -8-гидрокси-2-метил-3-оксо-2,3,4,5-тетрагидро-1 Н-2 бензазепин-4-уксусной кислоты. а) 3-[N-(трет-Бутоксикарбонил)-N-метиламино]метил-4-броманизол 40% водный метиламин (49 мл; 563 ммоль) быстро добавляли к раствору 4-бром-3-бромметиланизола (15,76 г; 56,29 ммоль) в THF (280 мл) при комнатной температуре. Через 2,5 ч реакционную смесь концентрировали и остаток распределяли между Et2O (560 мл) и 1,0 н. NaOH (100 мл). Слои разделяли и органический слой сушили (MgSO4) и концентрировали до желтого масла: ТСХ (5% MeOH/CHCl3) Rf 0,32. Масло растворяли в CHCl3 (280 мл) и добавляли ди-трет-бутилдикарбонат (1,29 г; 56,29 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 45 мин, затем концентрировали. Хроматография на силикагеле (5%(m, 2H); 4.40-4.55 (m, 2H); 3.77 (s, 3 Н); 2.81-2.97 (m, 3 Н); 1.37-1.60 (m, 9 Н); MS (ES) m/e 352/354 (M+Na)+. б) Метил 3-карбометокси-4-[2-[N-(трет-бутоксикарбонил)-N-метиламино]метил-4-метоксифенил]бутаноат. Раствор 3-[N-(трет-бутоксикарбонил)-N-метиламино]метил-4-броманизола (4,95 г; 15 ммоль), диметилитаконата (3,08 г; 19,5 ммоль), ацетата палладия (168 мг; 0,75 ммоль), три-орто-толилфосфина (457 мг; 1,5 моль) и диизопропилэтиламина (5,2 мл; 30 ммоль) в пропионитриле (75 мл) нагревали до темпе- 17016227 ратуры дефлегмации в течение 45 мин, затем концентрировали на роторном испарителе. Остаток разбавляли Et2O (150 мл) и смесь фильтровали через celite для удаления нерастворимых веществ. Фильтрат концентрировали и остаток повторно концентрировали из ксилолов. Хроматография на силикагеле (градиент: 20% EtOAc/гексаны, затем 1:1 EtOAc/гексаны) удаляла фосфин и исходные вещества; все другие вещества с Rf 0,40-0,70 собирали вместе и концентрировали с получением мутного желтого масла: ТСХ(30% EtOAc/гексаны) Rf 0,41 (основной продукт). Масло растворяли в МеОН (75 мл) и осторожно добавляли 10% Pd/C. Смесь встряхивали в атмосфере водорода (50 ф/кв дюйм (344,75 кПа в течение 2,5 ч, затем фильтровали через celite для удаления катализатора. Фильтрат концентрировали и остаток повторно вводили в эту реакцию. Еще через 2,5 ч смесь фильтровали через celite для удаления катализатора и фильтрат концентрировали с получением светло-желтого масла. Его повторно концентрировали из смеси CHCl3/гексаны, затем хроматографировали на силикагеле (градиент: 20% EtOAc/гексаны, затем 1:1 EtOAc/гексаны) с получением указанного в заголовке соединения (4,53 г; 74%) в виде светло-желтого масла: ТСХ (30% EtOAc/толуол) Rf 0,46. 1 Н ЯМР (400 МГц, CDCl3) смесь ротамеров;7.03 (d, J=8,2 Гц, 1 Н); 6.65-6.80 (m, 2H); 4.46 (уширенный s,2 Н); 3.77 (s, 3 Н); 3.64 (s, 3 Н); 3.63 (s, 3 Н); 2.62-3.12 (m, 7 Н); 2.35-2.50 (m, 1 Н); 1.47 (уширенный s, 9H);TFA (трифторуксусную кислоту) (55 мл) всю сразу добавляли к раствору метил 3 карбометокси-4-[2-[N-(трет-бутоксикарбонил)-N-метиламино]метил-4-метоксифенил]бутаноата (4,53 г; 11,06 ммоль) в безводном CH2Cl2 (55 мл) при 0 С и реакционную смесь нагревали до комнатной температуры. Через 1 ч реакционную смесь концентрировали и остаток повторно концентрировали из толуола(11,06 ммоль) и диизопропилэтиламина (5,8 мл; 33,18 ммоль) в толуоле (110 мл) нагревали с обратным холодильником в течение 25 ч, перемешивали при комнатной температуре в течение 4 суток, затем нагревали с обратным холодильником в течение дополнительных 24 ч. Концентрирование и хроматография на силикагеле (5% МеОН в 1:1 EtOAc/CHCl3) дала указанное в заголовке соединение (2,88 г; 94%) в виде светло-желтого твердого вещества: ТСХ (5% МеОН в 1:1 EtOAc/CHCl3) Rf 0,63. 1 Н ЯМР (250 МГц,CDCl3)7.02 (d, J=8,4 Гц, 1 Н); 6.78 (dd, J=8,4, 2,7 Гц, 1 Н); 6.63 (d, J=2,7 Гц, 1 Н); 5.29 (d, J=16,3 Гц, 1 Н); 3.50-3.90 (m, 2H); 3.79 (s, 3H); 3.71 (s, 3 Н); 2.73-3.16 (m, 3 Н); 3.04 (s, 3 Н); 2.41 (dd, J=16,7, 5,4 Гц, 1 Н); MS(ES) m/e 300 (M+Na)+, 278 (М+Н)+. д) Метил 8-гидрокси-2-метил-3-оксо-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ацетат. Безводный хлорид алюминия (1,35 г; 10,15 ммоль) весь сразу добавляли к раствору метил 8 метокси-2-метил-3-оксо-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ацетата (562 мг; 2,03 ммоль) и этантиола(0,75 мл; 10,15 ммоль) в безводном CH2Cl2 (20 мл) при 0 С в атмосфере аргона. Смесь нагревали до комнатной температуры и перемешивали в течение 4,5 ч, затем повторно охлаждали до 0 С. Добавляли ледяную воду (20 мл) и смесь быстро перемешивали в течение 5 мин, затем экстрагировали CHCl3 (320 мл). Объединенные CHCl3 слои сушили (MgSO4) и концентрировали с получением остатка. Водный слой фильтровали на вакуум-фильтре, собирая твердый осадок. Этот осадок и остаток от CHCl3 слоя объединяли в МеОН/CHCl3 1:1 и раствор концентрировали с получением беловатого твердого вещества. Его растирали с горячим МеОН, и смесь оставляли для охлаждения до комнатной температуры. Твердое вещество собирали посредством вакуум-фильтрации и последовательно промывали холодным МеОН иEt2O. Сушка под глубоким вакуумом при 40 С дала указанное в заголовке соединение (467,9 мг; 88%) в виде бесцветного твердого вещества: ТСХ (5% MeOH/CHCl3) Rf 0,17. 1 Н ЯМР (250 МГц, DMSO-d6)9.29 (s, 1 Н); 6.89 (d, J=8,1 Гц, 1 Н); 6.50-6.70 (m, 2H); 5.16 (d, J=16,4 Гц, 1 Н); 3.84 (d, J=16,4 Гц, 1 Н); 3.603.85 (m, 1H); 3.56 (s, 3 Н); 2.30-3.00 (m, 4 Н); 2.86 (s, 3 Н); MS (ES) m/e 286 (M+Na)+, 264 (М+Н)+. Получение 2. Разделение посредством ЖХВД энантиомеров метил 8-гидрокси-3-оксо-2,3,4,5 тетрагидро-1 Н-2-бензазепин-4-ацетата. а) Метил-(R)-(+)-8-гидрокси-3-оксо-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ацетат и метил-(S)-(-)-8 гидрокси-3-оксо-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ацетат. Метил 8-гидрокси-3-оксо-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ацетат разделяли на энантиомеры посредством хиральной ЖХВД при использовании следующих условий: колонка Diacel Chiralpak= 39,1 мин. Получение 3. Получение (S)-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-уксусной кислоты. а) Метил-(S)-3-оксо-8-[3-(1-оксопиридин-2-иламино)-1-пропилокси]-2-(2,2,2-трифторэтил)-2,3,4,5- 18016227 тетрагидро-1 Н-2-бензазепин-4-ацетат. К перемешиваемому раствору метил-(S)-8-гидрокси-2-метил-3-оксо-2,3,4,5-тетрагидро-1 Н-2 бензазепин-4-ацетата (19 г; 57,4 ммоль) в безводном THF (400 мл) и безводном DMF (200 мл) в атмосфере аргона добавляли N-оксид 2-(3-гидроксипропиламино)пиридина (11,6 г; 69 ммоль) и трифенилфосфин(18,0 г; 69 ммоль). После того как все твердые вещества полностью растворились (30 мин), реакционную смесь охлаждали до 0 С в ледяной бане и добавляли диизопропилазодикарбоксилат (14,3 мл; 69 ммоль) с помощью шприца. Реакционную смесь оставляли для медленного нагревания до комнатной температуры и перемешивали в течение 18 ч. Концентрирование и флэш-хроматография на силикагеле(8:2:1 CHCl3/EtOAc/EtOH) дала указанное в заголовке соединение (20,83 г; 75%) в виде твердой пены. Дополнительные 5,73 г продукта можно получить посредством повторного использования исходного вещества, регенерированного из вышеуказанной реакционной смеси, с получением суммарно 26,56 г(500 мл) добавляли 10% палладий на активированном угле (8 г; 7,5 ммоль; предварительно тщательно смоченный изопропанолом в атмосфере аргона) и циклогексен (55,7 мл; 550 ммоль). Затем реакционную смесь нагревали до температуры дефлегмации в атмосфере аргона на масляной бане, установленной на 90 С. Через 6 ч добавляли дополнительное количество 10% палладия на активированном угле (8 г; 7,5 ммоль; предварительно тщательно смоченный изопропанолом в атмосфере аргона) и циклогексена (55,7 мл; 550 ммоль). Через дополнительные 18 ч реакционную смесь подвергали горячей фильтрации черезcelite и фильтровальную набивку промывали смесью МеОН/CHCl3 1:1 (400 мл). Фильтрат концентрировали под вакуумом и остаток очищали посредством флэш-хроматографии на силикагеле (CHCl3/МеОН 95:5) с получением указанного в заголовке соединения (19,50 г; 76%) в виде белой клейкой пены: ТСХ(S)-3-Оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2-(2,2,2-трифторэтил)-2,3,4,5-тетрагидро 1 Н-2-бензазепин-4-уксусная кислота. К перемешиваемому раствору метил-(S)-3-оксо-8-[3-(пиридин-2-иламино)-1-пропилокси]-2-(2,2,2 трифторэтил)-2,3,4,5-тетрагидро-1 Н-2-бензазепин-4-ацетата (19,50 г; 42 ммоль) в диоксане (150 мл) добавляли водный 1 н. NaOH (75 мл; 75 ммоль). Мутную реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем полученный гомогенный раствор нейтрализовали водным 1 н. HCl (75 мл; 75 ммоль). Раствор концентрировали почти досуха посредством роторного испарения до выпадения продукта в осадок. Декантировали надосадочную жидкость и оставшееся вязкое твердое вещество повторно растворяли в метаноле. Прозрачный раствор затем повторно концентрировали посредством роторного испарения. Оставшееся твердое вещество растирали с небольшим объемом воды, фильтровали и сушили под вакуумом с получением указанного в заголовке соединения (16,38 г; 86%) в виде белого порошка. ЖХВД (колонка Hamilton PRP-1, 25% смесь CH3CN/H2O, содержащая 0,1% TFA) k'=3,1; []D112,3 (с, 1.0, МеОН); MS (ES) m/e 452,3 (М+Н)+; 1 Н ЯМР (400 МГц, DMSO-d6)7.95 (dd, 1 Н); 7.34 (dt,1 Н); 7.02 (d, J=9,2 Гц, 1 Н); 6.81 (m, 2H); 6.58 (t, 1H); 6.47 (m, 2 Н); 5.30 (d, J=16,5 Гц, 1 Н); 4.27-4.13 (m,2 Н); 4.15 (d, J=16,5 Гц, 1 Н); 4.02 (t, 1 Н); 3.78 (m, 1H); 3.37 (m, 2H); 3.00 (dd, 1H); 2.69 (dd, 1H); 2.65 (dd,1H); 2.41 (dd, 1 Н); 1.96 (ddd, 2H). Аналитически подсчитано для C22H24F3N3O4: С 58,53; Н 5,36; N 9,31. Обнаружено: С 58,37; Н 5,42; N 9,20. Биологические данные Действие соединений, описанных в примерах 1 и 3, на хориоидальную неоваскуляризацию (CNV) в мышиной модели CNV. Мышей в следующих примерах лечили в соответствии с положением ARVO (Ассоциация исследований в области зрения и офтальмологии) по использованию животных в исследованиях в области офтальмологии и зрения. Пример 4. Регрессионная модель CNV. Мышей анестезировали и расширяли им зрачки. Наносили ожоги на сетчатку путем фотокоагуляции криптоновым лазером. Введение соединения, описанного в примере 1, начинали через семь суток после вызванного лазером повреждения. Пероральные дозы либо только носителя, либо носителя, содержащего соединение формулы (I) (обозначенное как VEGF-рецептор на фиг. 1), в дозировке либо 4 мг/кг, 20 мг/кг, либо 100 мг/кг вводили дважды в сутки в течение семи суток. Через семь суток лечения- 19016227 мышам проводили перфузию меченным флюоресцеином декстраном и измеряли площадь хориоидальной неоваскуляризации. Пазопаниб уменьшал площадь CNV дозозависимым образом. См. фиг. 1. Пример 5. Превентивная модель CNV. В этом эксперименте соединение, описанное в примере 1 (обозначенное как VEGF-рецептор на фиг. 2), примере 3 (обозначенное как витронектин на фиг. 2), или комбинацию соединений, описанных в примере 1 и примере 3 (обозначенную как "оба" на фиг. 2), вводили каждой мыши, начиная за сутки до проведения прижигания сетчатки, согласно способам, описанным в примере 4. Соединения вводили перорально дважды в сутки в дозировке 100 мг/кг для соединения примера 1 или 45 мг/кг для соединения примера 3. Через четырнадцать суток после прижигания сетчатки измеряли площадь CNV, как описано выше. Результаты показаны на фиг. 2. Хотя конкретные воплощения настоящего изобретения подробно проиллюстрированы и описаны здесь, изобретение этим не ограничивается. Вышеприведенные подробные описания предложены в качестве иллюстрирующих настоящее изобретение и не должны толковаться как создающие какое-либо ограничение изобретения. Модификации будут очевидны специалистам в данной области техники, и все модификации, которые не выходят за пределы сущности изобретения, предназначены для включения в объем прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения расстройства, выбранного из группы, состоящей из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки, увеита и макулярного отека, у млекопитающего, включающий введение указанному млекопитающему соединения формулы (I) или его соли или сольвата. 2. Способ по п.1, где указанное соединение представляет собой соединение формулы (I') 3. Способ по п.1, где указанное соединение представляет собой соединение формулы (I") 4. Способ по п.1, где указанное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна. 5. Способ по п.1, где указанное расстройство представляет собой макулярный отек. 6. Применение соединения формулы (I) или его соли или сольвата для изготовления лекарственного средства, полезного в лечении расстройства, выбранного из группы, состоящей из экссудативной формы возрастной дегенерации желтого пятна, ангиоидных полос сетчатки, увеита и макулярного отека. 7. Применение по п.6, где указанное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна. 8. Применение по п.6, где указанное расстройство представляет собой макулярный отек. 9. Фармацевтический препарат для местного применения, содержащий соединение формулы (I) или его соль или сольват, предназначенный для использования в лечении офтальмологических неоваскулярных расстройств путем непосредственного введения в глаз.- 20016227 10. Препарат для местного применения по п.9, где указанное соединение представляет собой соединение формулы (I') 11. Препарат для местного применения по п.10, где указанное соединение представляет собой соединение формулы (I) 12. Препарат для местного применения по любому из пп.9-11 в форме глазных капель, где соединение формул I, I' или I" растворено или суспендировано в подходящем носителе. 13. Препарат для местного применения по любому из пп.9-12 для введения в сочетании с одним или более чем одним дополнительным терапевтическим агентом для лечения неоваскулярных расстройств. 14. Препарат для местного применения по п.13, где указанные один или более дополнительных терапевтических агентов представляют собой пегаптаниб и/или ранибизумаб. 15. Препарат для местного применения по п.13 или 14, где указанные один или более дополнительных терапевтических агентов вводят отдельно. 16. Препарат для местного применения по п.15, где указанные один или более дополнительных терапевтических агентов вводят различными путями. 17. Способ лечения офтальмологического неоваскулярного расстройства у пациента, нуждающегося в этом, включающий местное введение препарата для местного применения по любому из пп.9-16 непосредственно в глаз указанного пациента. 18. Способ по п.17, где указанное офтальмологическое неоваскулярное расстройство представляет собой ретинальное неоваскулярное расстройство. 19. Способ по п.17, где указанное офтальмологическое неоваскулярное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна (AMD), ангиоидные полосы сетчатки, патологическую миопию, синдром гистоплазмоза глаз, разрывы в оболочке Бруха, макулярный отек(включая диабетический макулярный отек), саркоидоз, увеит, атрофическую AMD, кератоконус, синдром Шегрена, миопию, глазные опухоли, отторжение трансплантата роговицы, поражение роговицы,неоваскулярную глаукому, изъязвление роговицы, рубцевание роговицы, пролиферативную витреоретинопатию, ретинопатию недоношенных, ретинальную дегенерацию, хроническую глаукому, отслойку сетчатки или серповидно-клеточную ретинопатию. 20. Способ по п.17, где указанное офтальмологическое неоваскулярное расстройство представляет собой экссудативную форму возрастной дегенерации желтого пятна (AMD). 21. Способ по любому из пп.17-20, где лечение офтальмологических неоваскулярных расстройств представляет собой их предотвращение. 22. Способ по любому из пп.17-20, где лечение офтальмологических неоваскулярных расстройств представляет собой выздоровление. 23. Способ по любому из пп.17-20, где лечение представляет собой снижение скорости развития указанного расстройства.
МПК / Метки
МПК: A61P 27/02, A61K 31/506, A61K 31/55
Метки: лечения, способ, неоваскулярных, расстройств, офтальмологических
Код ссылки
<a href="https://eas.patents.su/23-16227-sposob-lecheniya-oftalmologicheskih-neovaskulyarnyh-rasstrojjstv.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения офтальмологических неоваскулярных расстройств</a>
Предыдущий патент: Редокс-активные терапевтические соединения для лечения митохондриальных заболеваний
Следующий патент: Способ каталитического крекинга со взвешенным катализатором
Случайный патент: Гидравлический регулирующий клапан для потока текучей среды