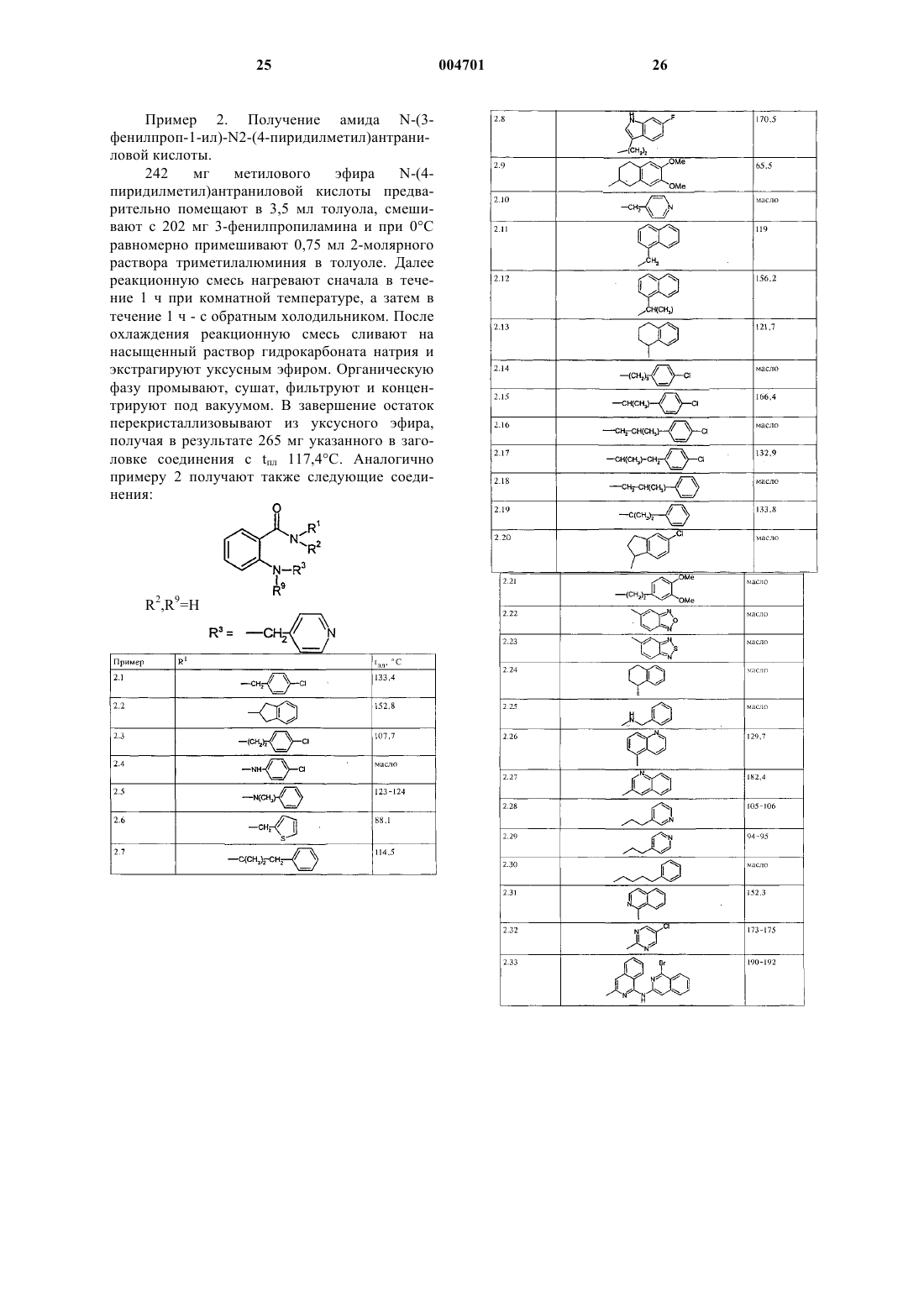
Амиды антраниловой кислоты и их применение в качестве лекарственных средств
Номер патента: 4701
Опубликовано: 24.06.2004
Авторы: Местан Юрген, Оттов Эккхард, Тираух Карл-Хайнц, Зайдельманн Дитер, Манли Пол Уилльям, Хут Андреас, Ширнер Михаэль, Кругер Мартин, Менрад Андреас, Феррари Стефано, Фуре Паскаль, Брюгген Йозе, Больд Гуидо, Вуд Жанетта Маржори
Формула / Реферат
1. Соединения общей формулы I
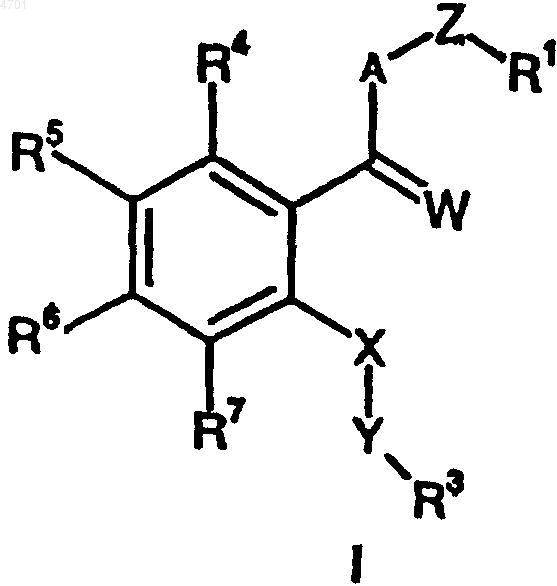
в которой
A обозначает группу -NR2-,
W обозначает кислород,
Z обозначает группу
или A, Z и R1 вместе образуют группу
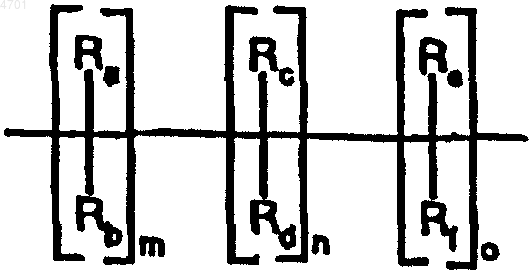
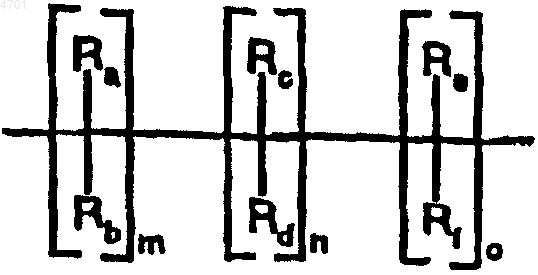
m, n и o обозначают 0-3,
Ra, Rb, Rc, Rd, Re, Rf, каждый независимо друг от друга, обозначает водород, метил,
X обозначает группу -NR9-,
Y обозначает группу -CH2,
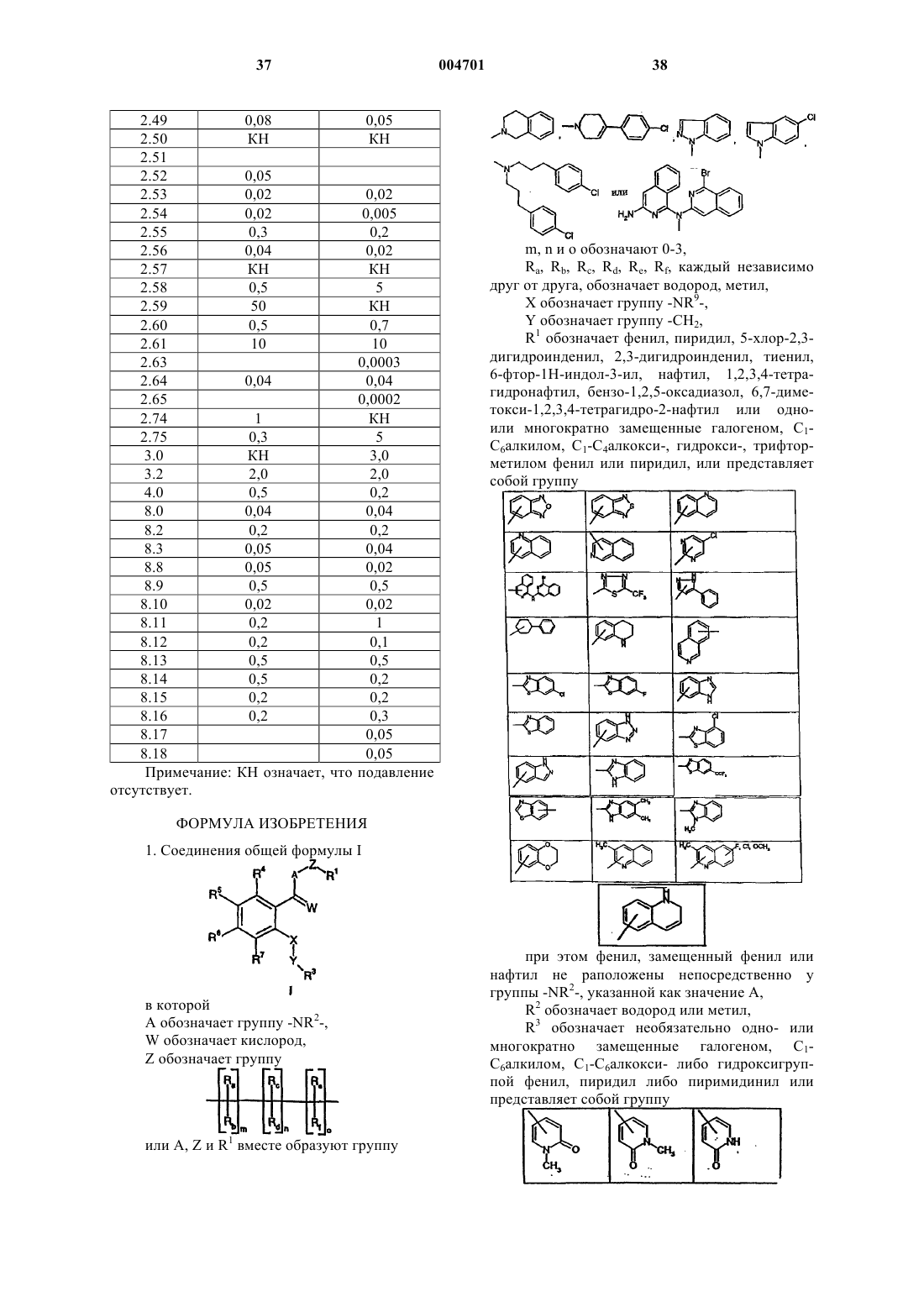
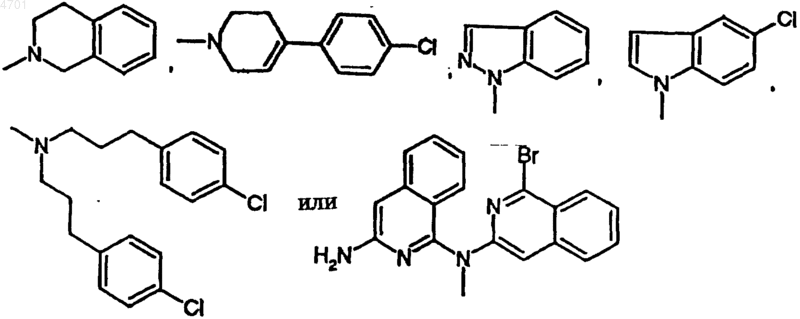
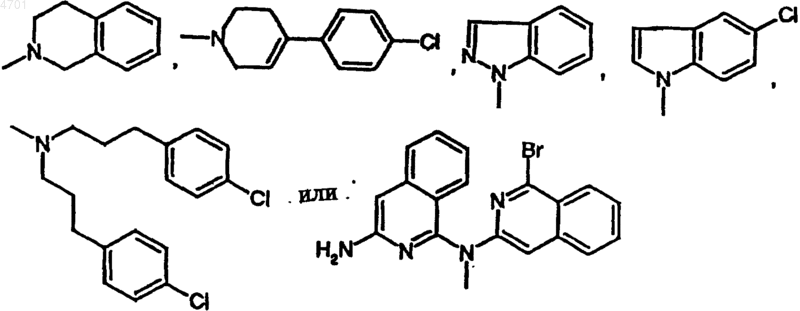
R1 обозначает фенил, пиридил, 5-хлор-2,3-дигидроинденил, 2,3-дигидроинденил, тиенил, 6-фтор-1H-индол-3-ил, нафтил, 1,2,3,4-тетрагидронафтил, бензо-1,2,5-оксадиазол, 6,7-диметокси-1,2,3,4-тетрагидро-2-нафтил или одно- или многократно замещенные галогеном, C1-C6алкилом, C1-C4алкокси-, гидрокси-, трифторметилом фенил или пиридил, или представляет собой группу
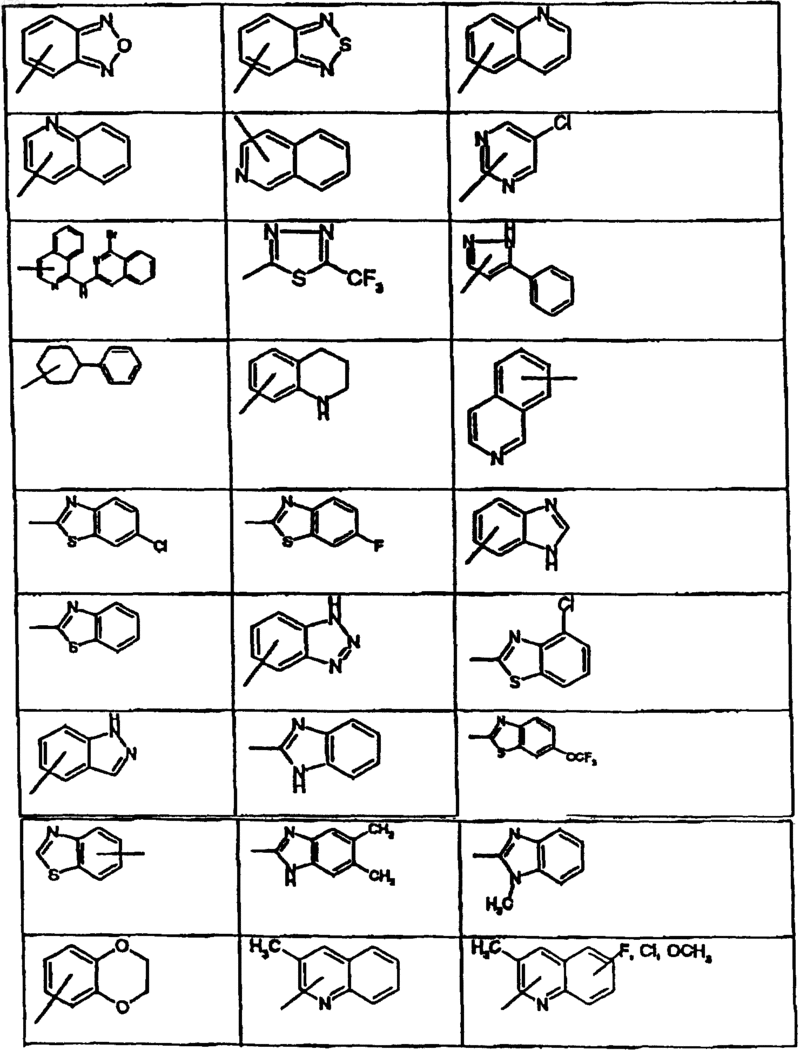
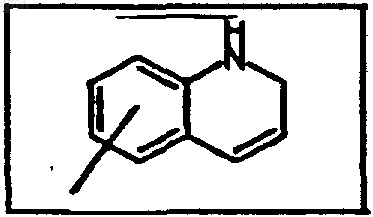
при этом фенил, замещенный фенил или нафтил не раположены непосредственно у группы -NR2-, указанной как значение A,
R2 обозначает водород или метил,
R3 обозначает необязательно одно- или многократно замещенные галогеном, C1-C6алкилом, C1-C6алкокси- либо гидроксигруппой фенил, пиридил либо пиримидинил или представляет собой группу
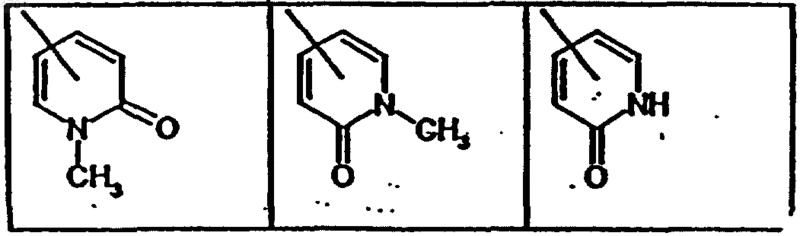
R4, R5, R6 и R7, каждый независимо друг от друга, обозначает водород, галоген или незамещенные либо необязательно одно- или многократно замещенные галогеном C1-C6алкоксигруппу, C1-C6алкил, C1-C6карбоксиалкил, или
R5 и R6 вместе образуют группу
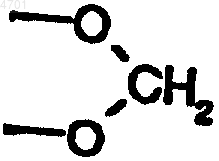
R8, R9 и R10, каждый независимо друг от друга, обозначает водород или C1-C6алкил, а также их изомеры и соли,
при этом если R2 представляет собой водород, R9 представляет собой водород, Y представляет собой группу -CH2- и R1 представляет собой пиридил, или если R1 представляет собой фенил либо замещенный метилом, хлором или бромом фенил и Z представляет собой метил или этил, то R3 не может обозначать пиридил, фенил либо замещенный метилом, хлором или бромом фенил.
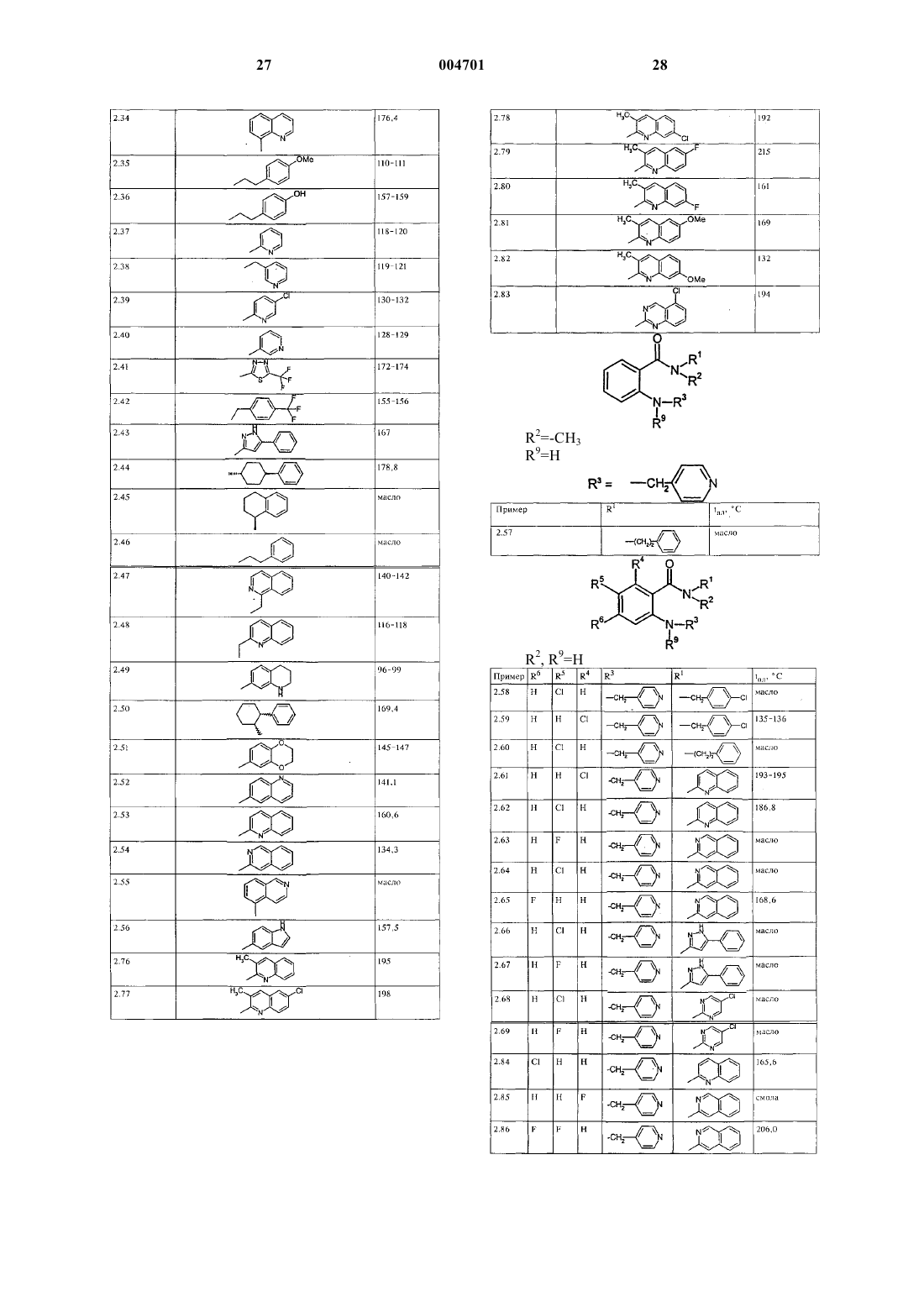
2. Соединения общей формулы I по п.1, в которой
A обозначает группу -NR2-,
W обозначает кислород,
Z обозначает группу
или A, Z и R1 вместе образуют группу
m, n и o обозначают 0-3,
Ra, Rb, Rc, Rd, Re, Rf, каждый независимо друг от друга, обозначает водород, метил,
X обозначает группу -NR9-,
Y обозначает группу -CH2-,
R1 обозначает фенил, пиридил, 5-хлор-2,3-дигидроинденил, 2,3-дигидроинденил, тиенил, 6-фтор-1H-индол-3-ил, нафтил, 1,2,3,4-тетрагидронафтил, бензо-1,2,5-оксадиазол или 6,7-диметокси-1,2,3,4-тетрагидро-2-нафтил или одно- либо многократно замещенные C1-C4алкилом, C1-C4алкокси-, гидроксигруппой, галогеном, трифторметилом, фенил или пиридил, либо представляет собой группу
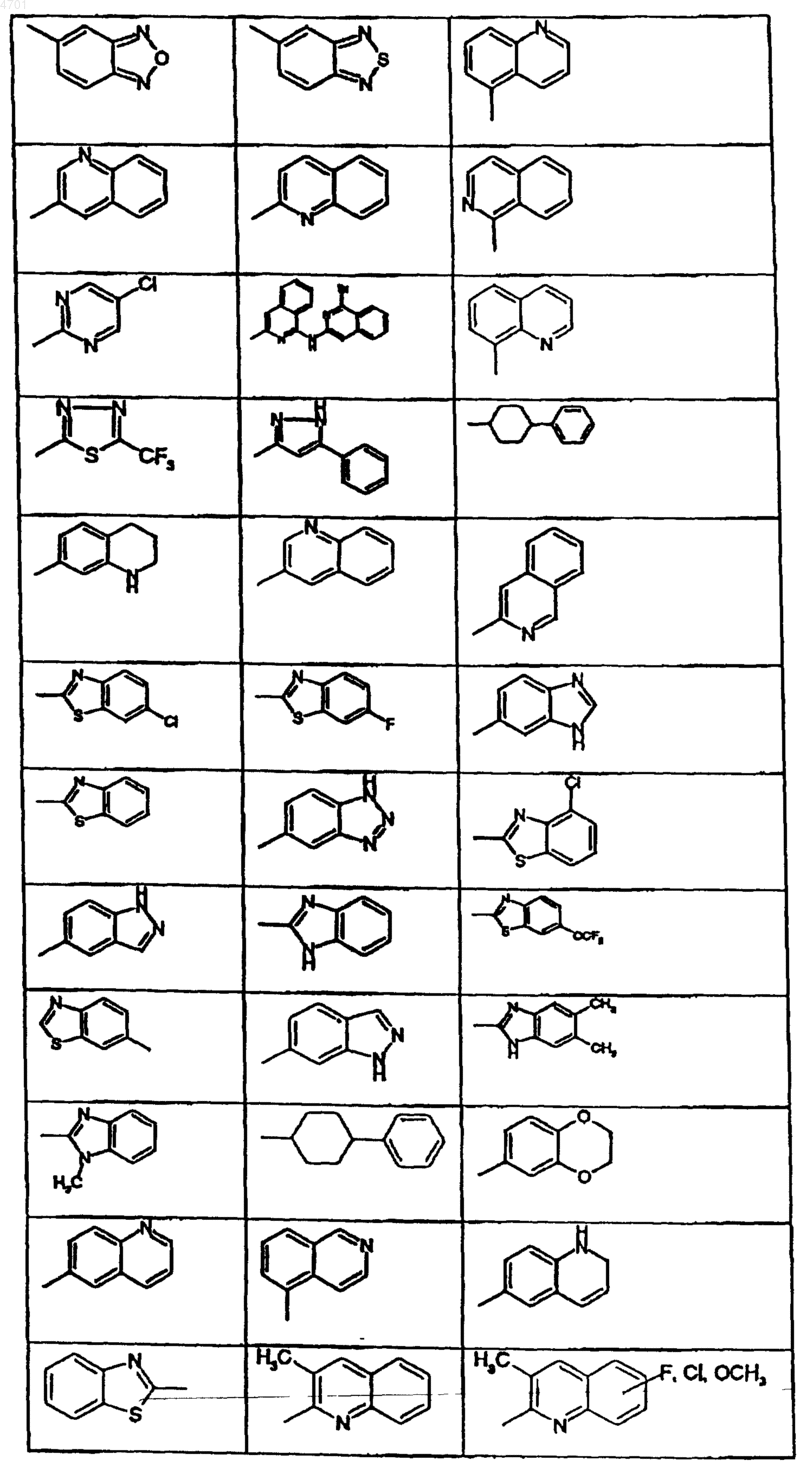
при этом фенил, замещенный фенил или нафтил не расположены непосредственно у группы -NR2-, указанной как значение A,
R2 обозначает водород или метил,
R3 обозначает пиридил или одно- или многократно замещенные гидроксигруппой, галогеном, метилом или метоксигруппой фенил или пиридил или представляет собой группу
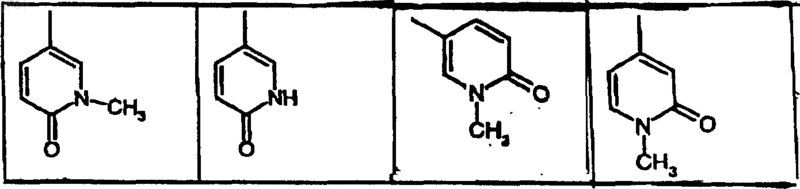
R5 и R6, каждый независимо друг от друга, обозначает водород, галоген, метил, метоксигруппу или трифторметил,
R4 и R7, каждый независимо друг от друга, обозначает водород или галоген,
R9 обозначает водород,
R10 обозначает водород или метил, а также их изомеры и соли,
при этом если R2 представляет собой водород, R1 означает фенил, и если R1 представляет собой фенил либо однозамещенный метилом, хлором или бромом фенил и Z представляет собой метил или этил, то R3 не может обозначать пиридил, фенил либо однозамещенный метилом, хлором или бромом фенил.
3. Применение соединений общей формулы I по п.1 или 2 для получения фармацевтического препарата, обладающего ингибирующим действием в отношении тирозинкиназ KDR и FLT.
4. Фармацевтический препарат, содержащий в своем составе по меньшей мере одно соединение по любому из пп.1 или 2.
5. Фармацевтический препарат по п.4 для ингибирования тирозинкиназ KDR и FLT.
6. Соединения по любому из пп.1 или 2 и фармацевтические препараты по пп.4 и 5, используемые совместно с вспомогательными веществами и носителями для получения соответствующих композиций.
7. Применение соединений формулы I по любому из пп.1 или 2 в качестве ингибиторов тирозинкиназ KDR и FLT.
8. Применение соединений общей формулы I по любому из пп.1 или 2 в форме фармацевтического препарата для энтерального, парентерального и орального введения.
Текст
1 Настоящее изобретение относится к амидам антраниловой кислоты и к их применению в качестве лекарственных средств для лечения заболеваний, вызываемых персистирующим ангиогенезом, а также к промежуточным продуктам для получения этих амидов антраниловой кислоты. Персистирующий ангиогенез может являться причиной различных заболеваний, таких как псориаз, артрит, в частности ревматоидный артрит, гемангиома, ангиофиброма, глазные болезни, такие как диабетическая ретинопатия,неоваскулярная глаукома, заболевания почек,такие как гломерулонефрит, диабетическая нефропатия, злокачественный нефросклероз,синдромы тромботической микроангиопатии,отторжение трансплантата и гломерулопатия,фиброзные заболевания, такие как цирроз печени, заболевания, связанные с пролиферацией мезангиальных клеток и артериосклероз, или может привести к прогрессированию названных болезней. Прямое или косвенное ингибирование рецептора VEGF (васкулярного эндотелиального ростового фактора - основного индуктора ангиогенеза) может использоваться для лечения названных болезней, равно как и иных форм патологического ангиогенеза, индуцированныхVEGF, и для предупреждения условий, способствующих их проявлению, таких, в частности,как васкуляризация опухолей. Так, например,известно, что благодаря растворимым рецепторам и антителам к VEGF можно подавлять рост опухолей. Персистирующий ангиогенез индуцируется VEGF-фактором через его рецептор. С целью обеспечить VEGF возможность проявлять свои биологические эффекты необходимо, чтобыVEGF связывался с рецептором и способствовал фосфорилированию тирозина. Известны производные фенилантраниламидов, которые применяют в качестве антагонистов ангиотензина II (см. заявку ЕР 564356), а также в качестве ингибиторов воспалений и противоязвенных соединений (см. патент US 3409668). Объектом настоящего изобретения являются соединения общей формулы Im, n и о обозначают 0-3,Ra, Rb, Rc, Rd, Re, Rf, каждый независимо друг от друга, обозначает водород, метил,Х обозначает группу -NR9-,Y обозначает группу -СН 2,R1 обозначает фенил, пиридил, 5-хлор-2,3 дигидроинденил, 2,3-дигидроинденил, тиенил,6-фтор-1H-индол-3-ил,нафтил,1,2,3,4 тетрагидронафтил, бензо-1,2,5-оксадиазол, 6,7 диметокси-1,2,3,4-тетрагидро-2-нафтил или одно- или многократно замещенные галогеном,С 1-С 6 алкилом, С 1-С 4 алкокси-, гидрокси-, трифторметилом фенил или пиридил, или представляет собой группу при этом фенил, замещенный фенил или нафтил не расположены непосредственно у группы -NR2-, указанной как значение А,R2 обозначает водород или метил, R3 обозначает необязательно одно- или многократно замещенные галогеном, С 1-С 6 алкилом, С 1 С 6 алкокси- либо гидроксигруппой фенил, пиридил либо пиримидинил, или представляет собой группуR4, R5, R6 и R7, каждый независимо друг от друга, обозначает водород, галоген или незамещенные либо необязательно одно- или многократно замещенные галогеном С 1 С 6 алкоксигруппу,С 1-С 6 алкил,С 1 С 6 карбоксиалкил, илиR8, R9 и R10, каждый независимо друг от друга, обозначает водород или С 1-С 6 алкил,а также их изомеры и соли,при этом если R2 представляет собой водород, R9 представляет собой водород, Y представляет собой группу -СН 2- и R1 представляет собой пиридил, или если R1 представляет собой фенил либо замещенный метилом, хлором или бромом фенил и Z представляет собой метил или этил, то R3 не может обозначать пиридил,фенил либо замещенный метилом, хлором или бромом фенил. Кроме того, при проведении исследований было установлено, что соединения общей формулы I в которой А обозначает группу -NR2-,W обозначает кислород, серу, два атома водорода или группу =NR8, Z обозначает группу-NR10- или -N(R10)-(CH2)q-, разветвленный либо неразветвленный С 1-С 6 алкил или группу 4 ветственно содержащий до 3 С-атомов мостик кR1 либо к R2,Х обозначает группу -NR9Y oбозначает группу -(СН 2)p,р обозначает 1-4,R1 обозначает незамещенный либо необязательно одно- или многократно замещенный галогеном, С 1-С 6 алкилом, одно- или многократно замещенными галогеном С 1-С 6 алкилом или алкоксигруппой арил либо гетероарил, за исключением соединений, в которых арил непосредственно связан с группой -NR2-, указанной как значение А,R2 обозначает водород или С 1-С 6 алкил либо вместе с Ra-Rf образует от Z или к R1 содержащий до 3 членов мостик,R3 обозначает незамещенный либо необязательно одно- или многократно замещенный галогеном, С 1-С 6 алкилом, С 1-С 6 алкоксигруппой либо гидроксигруппой моноциклической или бициклической арил либо гетероарил,R4, R5, R6 и R7, каждый независимо друг от друга, обозначает водород, галоген или незамещенные либо необязательно одно- или многократно замещенные галогеном С 1-С 6 алкоксигруппу, С 1-С 6 алкил, С 1-С 6 карбоксиалкил, илиR8, R9 и R10, каждый независимо друг от друга, обозначает водород или С 1-С 6 алкил,а также их изомеры и соли, и указанные соединения подавляют фосфорилирование тиразина, соответственно персистирующий ангиогенез и препятствуют тем самым росту и распространению опухолей. Если R2 образует мостик к R1, то образуются гетероциклы, с которыми R1 сконденсирован. В качестве примеров можно назвать следующие:m, n и о обозначают 0-3,q обозначает 1-6,Ra, Rb, Rc, Rd, Re, Rf, каждый независимо друг от друга, обозначает водород, С 1-С 4 алкил,и/или Ra и/или Rb с Rc и/или Rd или Rc с Re и/илиRf могут образовывать связь, или до двух радикалов из числа Ra-Rf могут образовывать соот Если Ra, Rb, Rc, Rd, Re и Rf каждый независимо друг от друга представляет собой водород или С 1-С 4 алкил, то Z образует алкильную цепь. Если Ra и/или Rb с Rc и/или Rd или Rc и/илиRd с Re и/или Rf образуют связь, то Z обозначает алкенильную или алкинильную цепь. Если Ra-Rf образуют мостик между собой,то Z представляет собой циклоалкильную или циклоалкенильную группу. 5 Если два из радикалов Ra-Rf образуют содержащий до 3 С-атомов мостик к R1, то Z вместе с R1 представляет собой бензо- или гетарилсконденсированный (Аr) циклоалкил. В качестве примеров можно назвать Если один из радикалов Ra-Rf образует мостик к R2, то образуется азотный гетероцикл,который может быть отделен от R1 соответствующей группой. В качестве примеров можно назвать Под понятием "алкил" имеются в виду соответственно прямоцепочечный либо разветвленный алкильный радикал, такой, например,как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, пентил, изопентил или гексил, предпочтительными при этом являются С 1 С 4 алкильные радикалы. Под понятием "циклоалкил" имеются в виду соответственно циклопропил, циклобутил,циклопентил, циклогексил или циклогептил. Под понятием "циклоалкенил" имеются в виду соответственно циклобутенил, циклопентенил, циклогексенил или циклогептенил, при этом присоединение может происходить как двойной связью, так и простыми связями. Под понятием "галоген" имеются в виду фтор, хлор, бром или иод. Алкенильные и алкинильные заместители являются соответственно прямоцепочечными либо разветвленными и содержат 2-6, предпочтительно 2-4 С-атома. В качестве примеров можно назвать следующие радикалы: винил,пропен-1-ил, пропен-2-ил, бут-1-ен-1-ил, бут-1 ен-2-ил,бут-2-ен-1-ил,бут-2-ен-2-ил,2 метилпроп-2-ен-1-ил,2-метилпроп-1-ен-1-ил,бут-1-ен-3-ил, этинил, проп-1-ин-1-ил, бут-1-ин 1-ил, бут-2-ин-1-ил, бут-3-ен-1-ил, аллил. В качестве арильного радикала, содержащего соответственно 6-12 атомов углерода, 004701 6 можно назвать, например, нафтил, бифенил и прежде всего фенил. Гетероарильный радикал может быть соответственно бензосконденсирован. В качестве примеров можно назвать такие 5-членные гетероароматические соединения, как тиофен, фуран, оксазол, тиазол, имидазол, пиразол и их бензопроизводные, и такие 6-членные гетероароматические соединения, как пиридин, пиримидин, триазин, хинолин, изохинолин и их бензопроизводные, при этом в случае бензосконденсированных гетероарильных радикалов связь может осуществляться как у гетероцикла, так и у бензойного кольца. Арильный и гетероарильный радикал может быть соответственно одно-, дву- или тризамещенным идентичными либо разными заместителями, а именно, галогеном, С 1-С 4 алкокси-,нитрогруппой, трифторметилом, трифторметокси-, цианогруппой, SОqR5 или С 1-С 4 алкилом,при этом q обозначает 0-2. При наличии кислотной функциональной группы в качестве солей пригодны физиологически приемлемые соли органических и неорганических оснований, например, такие как легко растворимые соли щелочных и щелочноземельных металлов, а также N-метилглюкамин,диметилглюкамин, этилглюкамин, лизин, 1,6 гексадиамин, этаноламин, глюкозоамин, саркозин, серинол, трисгидроксиметиламинометан,аминопропандиол, основание Совака, 1-амино 2,3,4-бутантриол. При наличии оснoвной функциональной группы пригодными являются физиологически приемлемые соли органических и неорганических кислот, таких как соляная кислота, серная кислота, фосфорная кислота, лимонная кислота,винная кислота и др. Особенно эффективными, как было установлено, являются такие соединения общей формулы I, в которой А обозначает группу -NR2-,W обозначает кислород, серу, два атома водорода или группу =NR8,Z обозначает группу -NR10- или -N(R10)(CH2)q-, разветвленный либо неразветвленный С 1-С 6 алкил или группуm, n и о обозначают 0-3, q обозначает 1-6,Ra, Rb, Rc, Rd, Re, Rf, каждый независимо друг от друга, обозначает водород, С 1-С 4 алкил, 7 Х обозначает группу -NR9-,Y обозначает группу -(СН 2)p-,р обозначает 1-4,R1 обозначает фенил, пиридил, 5-хлор-2,3 дигидроинденил, 2,3-дигидроинденил, тиенил,6-фтор-1H-индол-3-ил, нафтил, 1,2,3,4-тетрагидронафтил, бензо-1,2,5-оксадиазол, 6,7-диметокси-1,2,3,4-тетрагидро-2-нафтил или однолибо многократно замещенный С 1-С 4 алкилом,С 1-С 4 алкокси-, гидроксигруппой, галогеном,трифторметилом, фенил или пиридил или представляет собой группуR4, R5, R6 и R7, каждый независимо друг от друга, обозначает водород, галоген или незамещенные либо необязательно одно- или многократно замещенные галогеном С 1-С 6 алкоксигруппу или С 1-С 6 алкил, или R5 и R6 вместе образуют группуR8, R9 и R10, каждый независимо друг от друга, обозначает водород или С 1-С 6 алкил,а также их изомеры и соли. К особенно предпочтительным относятся также соединения общей формулы I в которой А обозначает группу -NR2-,W обозначает кислород, серу или два атома водорода,Z обозначает группу -NR10-, -N(R10)(СН 2)q- или группу при этом фенил, замещенный фенил или нафтил не расположены непосредственно у группы NR2-, указанной как значение А,R2 обозначает водород либо С 1-С 6 алкил или вместе с Ra-Rf oбразует содержащий до 3 членов кольца мостик от Z или к R1, R3 обозначает незамещенный либо необязательно одноили многократно замещенный галогеном, С 1 С 6 алкилом, С 1-С 6 алкокси- или гидроксигруппой моноциклический либо бициклический арил или моноциклический либо бициклический гетероарил,m, n и о обозначают 0-3,q обозначает 1-6,Ra, Rb, Rc, Rd, Re, Rf, каждый независимо друг от друга, обозначает водород либо метил,Х обозначает группу -NR9-,Y обозначает группу -СH2-,R1 обозначает фенил, пиридил, 5-хлор-2,3 дигидроинденил, 2,3-дигидроинденил, тиенил,6-фтор-1H-индол-3-ил,нафтил,1,2,3,4 тетрагидронафтил, бензо-1,2,5-оксадиазол, 6,7 диметокси-1,2,3,4-тетрагидро-2-нафтил либо одно- или многократно замещенный С 1 С 4 алкилом, С 1-С 4 алкокси-, гидроксигруппой,галогеном, трифторметилом фенил или пиридил либо представляет собой группуm, n и о обозначает 0-3,q обозначает 1-6,Ra, Rb, Rc, Rd, Re, Rf, каждый независимо друг от друга, обозначает водород либо метил,Х обозначает группу -NR9-,Y обозначает группу -СН 2-,R1 обозначает фенил, пиридил, 5-хлор-2,3 дигидроинденил, 2,3-дигидроинденил, тиенил,6-фтор-1 Н-индол-3-ил,нафтил,1,2,3,4 тетрагидронафтил, бензо-1,2,5-оксадиазол или 6,7-диметокси-1,2,3,4-тетрагидро-2-нафтил либо одно- или многократно замещенный С 1 С 4 алкилом, С 1-С 4 алкокси-, гидроксигруппой,галогеном, трифторметилом фенил или пиридил либо представляет собой группу при этом фенил или замещенный фенил либо нафтил не расположены непосредственно у группы -NR2-, указанной как значение А, R2 обозначает водород или метил, R3 обозначает пиридил или замещенный гидроксигруппой,галогеном, метилом либо метоксигруппой фенил, пиридил или 1,2,3,4-тетрагидронафтил или представляет собой группуR5 и R6, каждый независимо друг от друга,обозначает водород, галоген, метил, метоксигруппу или трифторметил,R4 и R7, каждый независимо друг от друга,обозначает водород или галоген,R9 обозначает водород,R10 обозначает водород или метил,а также их изомеры и соли. Наиболее эффективными, как было установлено, являются такие соединения общей формулы I, в которой А обозначает группу -NR2-, 11 при этом фенил или замещенный фенил либо нафтил не расположены непосредственно у группы -NR2-, указанной как значение А,R2 обозначает водород или метил,R3 обозначает пиридил либо одно- или многократно замещенный гидроксигруппой,галогеном, метилом или метоксигруппой фенил,пиридил или 1,2,3,4-тетрагидронафтил либо представляет собой группуR5 и R6, каждый независимо друг от друга,обозначает водород, галоген, метил, метоксигруппу или трифторметил,R4 и R7, каждый независимо друг от друга,обозначает водород и галоген, R9 обозначает водород,R10 обозначает водород или метил, а также их изомеры и соли. Наиболее эффективными зарекомендовали себя также, такие соединения общей формулы I,в которой А обозначает группу -NR2-,W обозначает серу,Z обозначает группу -NR10-, -N(R10)-(СН 2)q или группуm, n и о обозначают 0-3,q обозначает 1-6,Ra, Rb, Rc, Rd, Re, Rf, каждый независимо друг от друга, обозначает водород либо метил. Х обозначает группу -NR9-,Y обозначает группу -СН 2-,R1 обозначает фенил, пиридил, 5-хлор-2,3 дигидроинденил, 2,3-дигидроинденил, тиенил,6-фтор-1H-индол-3-ил,нафтил,1,2,3,4 тетрагидронафтил, бензо-1,2,5-оксадиазол или 6,7-диметокси-1,2,3,4-тетрагидро-2-нафтил либо одно- или многократно замещенный С 1 С 4 алкилом, С 1-С 4 алкокси-, гидроксигруппой,галогеном, трифторметилом фенил или пиридил либо представляет собой группу при этом фенил или замещенный фенил либо нафтил не расположены непосредственно у группы -NR2-, указанной как значение А,R2 обозначает водород или метил,R3 обозначает пиридил либо одно- или многократно замещенный гидроксигруппой,галогеном, метилом или метоксигруппой фенил,пиридил или 1,2,3,4-тетрагидронафтил либо представляет собой группуR1 обозначает фенил, пиридил, 5-хлор-2,3 дигидроинденил, 2,3-дигидроинденил, тиенил,6-фтор-1 Н-индол-3-ил,нафтил,1,2,3,4 тетрагидронафтил, бензо-1,2,5-оксадиазол или 6,7-диметокси-1,2,3,4-тетрагидро-2-нафтил либо одно- или многократно замещенный С 1 С 4 алкилом, С 1-С 4 алкокси-, гидроксигруппой,галогеном, трифторметилом фенил или пиридил либо представляет собой группуR5 и R6, каждый независимо друг от друга,обозначает водород, галоген, метил, метоксигруппу или трифторметил,R4 и R7, каждый независимо друг от друга,обозначает водород и галоген,R9 обозначает водород,R10 обозначает водород или метил,а также их изомеры и соли. К наиболее эффективным наряду с вышеуказанными относятся, как было установлено,также такие соединения общей формулы I, в которой А обозначает группу -NR2-,W обозначает два атома водорода,Z обозначает группу -NR10-, -N(R10)(CH2)q- или группуm, n и о обозначают 0-3,q обозначает 1-6,Ra, Rb, Rc, Rd, Re, Rf, каждый независимо друг от друга, обозначает водород либо метил,Х обозначает группу -NR9-,Y обозначает группу -СН 2-, при этом фенил или замещенный фенил либо нафтил не расположены непосредственно у группы -NR2-, указанной как значение А,R2 обозначает водород или метил,R3 обозначает пиридил либо одно- или многократно замещенный гидроксигруппой,галогеном, метилом или метоксигруппой фенил,пиридил или 1,2,3,4-тетрагидронафтил либо представляет собой группуR4 и R7, каждый независимо друг от друга,обозначает водород, галоген, метил, метоксигруппу или трифторметил,R5 и R6, каждый независимо друг от друга,обозначает водород и галоген,R9 обозначает водород,R10 обозначает водород или метил,а также их изомеры и соли. Предлагаемые в изобретении соединения препятствуют фосфорилированию, иными словами, с их помощью возможно селективное ингибирование определенных тирозинкиназ, при этом можно подавлять персистирующий ангиогенез. Тем самым можно предотвращать, например, рост и распространение опухолей. Соединения общей формулы I по изобретению содержат также возможные таутомерные формы и включают Е- либо Z-изомеры или, при наличии хирального центра, также рацематы и энантиомеры. Соединения формулы I, равно как и их физиологически приемлемые соли благодаря их ингибирующей активности по отношению к фосфорилированию VEGF-рецептора могут применяться в качестве лекарственных средств. Этот механизм действия обеспечивает возможность применения предлагаемых соединений для лечения заболеваний, обусловленных персистирующим ангиогенезом. Поскольку соединения формулы I идентифицированы как ингибиторы тирозинкиназыKDR и FLT, они пригодны прежде всего для лечения таких заболеваний, которые обусловлены вызываемым VEGF-фактором персистирующим ангиогенезом или повышением проницаемости сосудов. Объектом настоящего изобретения является также применение предлагаемых соединений в качестве ингибиторов тирозинкиназ KDR иFLT. Еще одним объектом настоящего изобретения являются в соответствии с этим лекарственные средства, для лечения опухолей. Соединения по изобретению могут применяться либо как таковые, либо в составе соответствующей лекарственной композиции, пред 004701 16 назначенной для лечения опухолей, псориаза,артрита, в частности ревматоидного артрита,гемангиомы, ангиофибромы, глазных болезней,таких как диабетическая ретинопатия, неоваскулярная глаукома, заболеваний почек, таких как гломерулонефрит, диабетическая нефропатия, злокачественный нефросклероз, синдромы тромботической микроангиопатии, отторжение трансплантатов и гломерулопатия, фиброзных заболеваний, таких как цирроз печени, заболеваний, связанных с пролиферацией мезангиальных клеток, артериосклероза и повреждений нервной ткани. Соединения по изобретению могут применяться также с целью ингибировать реокклюзию сосудов после баллонной дилатации, при протезировании сосудов или после применения механических устройств для сохранения просвета сосудов, таких как стенты. При лечении поврежденной нервной ткани с помощью предлагаемых в изобретении соединений можно предотвратить быстрое рубцевание поврежденных мест, т.е. предотвратить образование рубцов до того момента, когда аксоны восстановят связь друг с другом. Тем самым удалось бы облегчить реконструкцию нервных связей. Далее, с помощью соединений по изобретению можно подавить образование у пациентов асцита. Равным образом может подавляться и образование отеков, обусловленных VEGFфактором. Лекарственные средства такого типа, содержащие их в своем составе композиции и их применение также являются объектом настоящего изобретения. Изобретение относится далее к применению соединений общей формулы I для получения соответствующего лекарственного средства,предназначенного для лечения опухолей, псориаза, артрита, в частности ревматоидного артрита, геманангиомы, ангиофибромы, глазных болезней, таких как диабетическая ретинопатия,неоваскулярная глаукома, заболеваний почек,таких как гломерулонефрит, диабетическая нефропатия, злокачественный нефросклероз,синдромы тромботической микроангиопатии,отторжение трансплантатов и гломерулопатия,фиброзных заболеваний, таких как цирроз печени, заболеваний, связанных с пролиферацией мезангиальных клеток, артериосклероза, повреждений нервной ткани, для подавления реокклюзии сосудов после баллонной дилатации, при протезировании сосудов или после введения механических устройств для сохранения просвета сосудов, например, таких как стенты. Для применения соединений формулы I в качестве лекарственных средств из них изготавливают соответствующие препаративные формы, которые наряду с активным веществом содержат пригодные для энтерального или парентерального введения фармацевтические, орга 17 нические или неорганические инертные носители, например, такие как вода, желатин, гуммиарабик, молочный сахар, крахмал, стеарат магния, тальк, масла растительного происхождения, полиалкиленгликоли и т.п. Фармацевтические препараты могут изготавливаться в твердой форме, например в виде таблеток, драже,суппозиториев, капсул, либо в жидкой форме,например в виде растворов, суспензий или эмульсий. При необходимости они могут содержать, кроме того, вспомогательные вещества, такие как консерванты, стабилизаторы, смачиватели или эмульгаторы, соли для регулирования осмотического давления или буферы. Для парентерального применения предназначаются прежде всего инъекционные растворы или суспензии, в частности водные растворы активных соединений в полигидроксиэтоксилированном касторовом масле. В качестве носителей можно использовать поверхностно-активные вспомогательные вещества, такие как соли желчных кислот или фосфолипиды животного либо растительного происхождения, равно как и их смеси, а также липосомы либо их компоненты. Для орального применения предназначаются прежде всего таблетки, драже или капсулы с тальком и/или углеводородными носителями либо связующими, как, например, лактоза, кукурузный или картофельный крахмал. Вводить препараты можно и в жидкой форме, например в виде микстуры, при необходимости с добавками подслащивающих веществ. Дозировка активных веществ в каждом случае может варьироваться в зависимости от методики введения, возраста и веса пациента,вида и степени тяжести заболевания, для которого предназначена данная терапия, и других подобных факторов. Суточная доза составляет от 0,5 до 1000 мг, предпочтительно от 50 до 200 мг, при этомее можно назначать для одноразового приема или же разделять на 2 и более приемов. Описанные выше композиции и формы применения также являются объектом настоящего изобретения. Предлагаемые в изобретении соединения получают по известным методам. Так, например, соединения формулы I можно получать следующим образом: а) соединение формулы II в которой R4-R7 имеют указанные выше значения, а Т обозначает Н или защитную группу и А обозначает галоген или OR13, где R13 обозначает атом водорода, С 1-С 4 алкил либо С 1 С 4 ацил или образует с Т кольцо, сначала N 004701 18 алкилируют, а затем СОА переводят в амид,после чего при необходимости отщепляют защитные группы, либо сначала переводят в амид,а затем N-алкилируют, или б) соединение формулы III в которой R4-R7 имеют указанные выше значения, а Т обозначает Н или защитную группу, орто- металлируют и затем за счет улавливания электрофилом переводят в амид, после чего отщепляют защитную группу и аминогруппу алкилируют, или в) соединение формулы IV в которой R4-R7 имеют указанные выше значения, а Т обозначает Н или защитную группу и В обозначает галоген или О-трифлат, Отозилат либо О-мезилат, переводят в амид, после чего отщепляют защитную группу и аминогруппу алкилируют. Последовательность описанных операций во всех трех случаях можно варьировать. Образование амида осуществляют по методам, известным из литературы. Так, например, при образовании амида можно исходить из соответствующего сложного эфира. Этот эфир согласно Journ. Org. Chem., стр. 8414 (1995) подвергают взаимодействию с триметилалюминием и соответствующим амином в растворителях, таких как толуол, при температурах в интервале от 0 С до температуры кипения растворителя. Этот метод можно применять и в случае незащищенных эфиров антраниловой кислоты. Если в молекуле содержатся две сложноэфирные группы, то обе переводят в один и тот же амид. При использовании вместо сложного эфира нитрилов в аналогичных условиях получают амидины. Для образования амидов наряду с вышеназванными могут использоваться также способы,известные из химии пептидов. Так, в частности,соответствующую кислоту можно подвергать в апротонных полярных растворителях, например диметилформамиде, через активированное производное кислоты, получаемое, например, реакцией с гидроксибензотриазолом и карбодиимидом, таким как диизопропилкарбодиимид, или же с реагентами-предшественниками, такими как ГАТУ (гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония) (Chem.Comm. 1994, стр. 201) либо БТУ (бензилтиоурацил), при температурах в интервале от 0 С до температуры кипения растворителя, предпочтительно при 80 С, взаимодействию с амином в случае HATU, предпочтительно при комнатной температуре. Эту методику можно использовать и в случае незащищенных антраниловых кислот. Для образования амида можно применять также способ, осуществляемый через смешанный ангидрид кислоты, имидазолид или азид. Предварительная защита аминогруппы, например в качестве амида, не во всех случаях является обязательной, оказывая даже положитель 19 ное воздействие на реакцию. Особым исходным материалом является ангидриды изатокислоты,при использовании которых одновременно защищают аминогруппу и активируют кислотную функцию. Если амин переводить предварительно в соединение с БОК-защищенной группой, то в орто-положении его можно металлировать взаимодействием с металлоорганическими соединениями, например, такими как нбутиллитий и затем по реакции захвата с помощью изоцианатов или изотиоцианатов получать антраниламиды, соответственно антранилтиоамиды. Бром- или иодзаместитель в этом ортоположении за счет замещения галогена на металл облегчают орто-металлирование. В качестве растворителей в этих целях пригодны простые эфиры, такие как диэтиловый эфир либо тетрагидрофуран, или углеводороды, такие как гексан, а также их смеси. Целесообразным может оказаться и добавление комплексообразователей, таких как тетраметилэтилендиамин(ТМЭДА). Диапазон температур находится в интервале от -78 С до комнатной температуры. Расщепление БОК-амидов осуществляют путем обработки кислотами, такими как трифторуксусная кислота, без растворителей либо в растворителях, таких как метиленхлорид, при температурах в интервале от 0 С до температуры кипения растворителя, или водной соляной кислотой, предпочтительно 1 н. соляной кислотой,в растворителях, таких как этанол или диоксан,при температурах в интервале от комнатной температуры до температуры кипения используемого растворителя. Амидогруппу можно вводить также путем карбонилирования. При этом исходят из соответствующих соединений формулы IV (о-иод-,о-бром- или о-трифлилоксианилинов), которые подвергают взаимодействию с моноксидом углерода при нормальном или же повышенном давлении и с амином в присутствии катализаторов переходных металлов, например хлорида палладия (II) либо ацетата палладия (II) или палладийтетракистрифенилфосфина, в растворителях, таких как диметилформамид. Целесообразным может оказаться добавление лиганда,такого как трифенилфосфин, и добавление основания, такого как трибутиламин (см., например, Journ. Org. Chem. (1974), стр. 3327; Journ.(1997), стр. 367; Tetr. Lett. (1998), стр. 2835). Если предусматривается ввести в молекулу различные амидогруппы, то необходимо,например вторую сложноэфирную группу вводить в молекулу после образования первой амидогруппы и затем ее амидировать либо при наличии молекулы, в которой одна группа представлена в виде сложного эфира, а другая в виде кислоты, последовательно амидируют обе группы с помощью различных методов. 20 Тиоамиды могут быть получены из антраниламидов взаимодействием с дифосфадитианами согласно Bull. Soc. Chem. Belg. 87, стр. 229(1978) либо взаимодействием с пентасульфидом фосфора в растворителях, таких как пиридин,или же без растворителей при температурах в интервале от 0 до 200 С. Продукты, представляющие собой богатые электронами ароматические соединения, могут подвергаться также электрофильному ароматическому замещению. Замещение в этих случаях осуществляют в орто- либо пара-положении с получением в результате аминогруппы или одной из аминогрупп. Так, в частности, ацилирование можно проводить по реакции ФриделяКрафтса с использованием хлорангидридов кислоты в присутствии катализаторов указанной реакции Фриделя-Крафтса, например трихлорида алюминия, в растворителях, таких как нитрометан, сероуглерод, метиленхлорид или нитробензол, при температурах в интервале от 0 С до температуры кипения соответствующего растворителя, предпочтительно при комнатной температуре. По известным из литературы методам, например, с помощью нитрующей кислоты, азотной кислоты в различной концентрации, без использования растворителей или с помощью нитратов металлов, например нитрата меди (II) либо нитрата железа (III), в полярных растворителях, таких как этанол или ледяная уксусная кислота, или же в ацетангидриде можно вводить одну либо несколько нитрогрупп. Галогены вводят по известным из литературы методам, например взаимодействием с бромом, N-бром- либо N-иодсукцинимидом или с гидротрибромидом уротропина в полярных растворителях, таких как тетрагидрофуран, ацетонитрил, метиленхлорид, ледяная уксусная кислота или диметилформамид. Восстановление нитрогруппы проводят в полярных растворителях при комнатной либо повышенной температуре. В качестве катализаторов восстановления пригодны металлы, такие как никель Ренея или катализаторы на основе благородных металлов, такие как палладий или платина или же гидроксид палладия, необязательно на носителях. Вместо водорода возможно также использование по известной технологии, например, формиата аммония, циклогексена или гидразина. В качестве восстановителей наряду с хлоридом олова (II) или хлоридом титана (III) можно применять также комплексные гидриды металлов, необязательно в присутствии солей тяжелых металлов. В качестве восстановителя приемлемо и железо. В этих случаях реакцию осуществляют в присутствии кислоты,например уксусной кислоты, либо хлорида аммония, необязательно с добавлением растворителя, такого как вода, метанол и т.п При большей продолжительности реакции в этом вариан 21 те может произойти ацилирование аминогруппы. Если предусматривается алкилирование аминогруппы, то этот процесс можно проводить по известным методам, например с помощью алкилгалогенидов, или согласно варианту Митцунобы (Mitsunobu), в котором осуществляют взаимодействие со спиртом в присутствии, например, трифенилфосфина и эфира азодикарбоновой кислоты. В равной степени амин можно подвергать восстановительному алкилированию альдегидами или кетонами, работая при этом в присутствии восстановителя, такого как цианоборогидрид натрия, в соответствующем инертном растворителе, например этаноле, при температурах в интервале от 0 С до температуры кипения растворителя. Если исходить из первичной аминогруппы, то реакцию можно осуществлять при необходимости с последовательным использованием двух различных карбонильных соединений, получая в результате смешанные производные [литература: например, Verardo и др., Synthesis (1993), стр. 121;(1985), стр. 701; Micovic и др., Synthesis (1991),стр. 1043]. Целесообразным может оказаться образование сначала шиффова основания взаимодействием альдегида с амином в растворителях,таких как этанол или метанол, необязательно с добавлением вспомогательных веществ, таких как ледяная уксусная кислота, и лишь после этого добавлять восстановитель, например цианоборогидрид натрия. Гидрирование алкеновых или алкиновых групп в молекуле осуществляют по обычной технологии, например с помощью каталитически инициированного водорода. В качестве катализаторов могут использоваться тяжелые металлы, такие как палладий либо платина, необязательно на носителе, или никель Ренея. В качестве растворителей приемлемы спирты, например этанол. Работают при температурах в интервале от 0 С до температуры кипения соответствующего растворителя и при давлении до 20 бар, предпочтительно, однако, при комнатной температуре и нормальном давлении. Благодаря применению катализаторов, например,таких как катализатор Линдлара, тройные связи можно частично гидрировать до двойных связей, при этом предпочтительно образуется Zформа. Ацилирование аминогруппы осуществляют по обычной технологии, например с помощью галогенангидрида кислоты либо ангидрида кислоты, необязательно в присутствии основания, такого как диметиламинопиридин, в растворителях, таких как метиленхлорид, тетрагидрофуран или пиридин, а в варианте по реакции Шоттена-Баумана в водном растворе при слабощелочном значении рН, или взаимодействием с ангидридом в ледяной уксусной кислоте. 22 Вводить галогены хлор, бром, иод или азидогруппу через аминогруппу можно и иным образом, например по реакции Зандмейера, подвергая образующиеся с помощью нитритов в качестве промежуточных продуктов соли диазония взаимодействию с хлоридом меди (I) либо бромидом меди (I) в присутствии соответствующей кислоты, такой как соляная кислота либо бромисто-водородная кислота, или с иодидом калия. При использовании эфира органической азотистой кислоты галогены можно вводить,например, добавляя метилениодид или тетрабромметан в растворителе, таком как диметилформамид. Удаление аминогруппы можно проводить либо взаимодействием с эфиром органической азотистой кислоты в тетрагидрофуране,либо диазотированием и восстановительной вываркой соли диазония, например, с использованием фосфористой кислоты, необязательно с добавлением оксида меди (I). Вводить фтор можно, например, по реакции Бальца-Шимана разложением тетрафторбората диазония или согласно Journ. Fluor. Chem. 76, (1996), стр. 59-62, диазотированием в присутствии НFхпиридина и последующей вываркой, необязательно в присутствии источника ионов фторида, такого как фторид тетрабутиламмония. Вводить азидогруппу предпочтительно после диазотирования взаимодействием с азидом натрия при комнатной температуре. Отщепление простых эфиров осуществляют по методам, известным из литературы. При этом при наличии в молекуле нескольких групп возможно и селективное отщепление. В этих случаях эфир обрабатывают, например, трибромидом бора в растворителях, таких как дихлорметан, при температурах в интервале от -100 С до температуры кипения используемого растворителя, предпочтительно при -78 С. Другой возможностью отщепления эфира является обработка тиометилатом натрия в растворителях,таких как диметилформамид. Эту реакцию можно проводить при температуре в интервале от комнатной температуры до температуры кипения растворителя, предпочтительно при 150 С.N- или O-алкилирование амидов, таких как пирид-2-он, соответственно 2-гидроксипиридин,предпочтительно осуществляют по методам,известным из литературы. Так, в частности, с помощью оснований, таких как гидрид натрия или карбонат калия, в растворителях, таких как диметилформамид, и алкилированием алкилгалогенидами, такими как метилиодид, удается достичь эффективное N-алкилирование. Что касается O-алкилирования, то его можно осуществлять с помощью оснований, таких как карбонат серебра, в растворителях, таких как тетрагидрофуран или толуол, либо предпочтительно с использованием их смесей с алкилгалогенида 23 ми, такими как метилиодид. Равным образом Oалкилирование можно проводить взаимодействием с тетрафторборатом триалкилоксония в инертных растворителях, таких как метиленхлорид. При взаимодействии с диазометаном или триметилсилилдиазометаном в растворителях, таких как метанол или толуол, предпочтительно в их смесях, при температурах, близких температуре кипения растворителей, предпочтительно, однако, при комнатной температуре,получают смеси N- и O-алкильных производных. Вышеуказанные методы обеспечивают возможность селективного алкилирования пиридона в отличие от амида бензойной кислоты. Смеси изомеров по обычным методам, таким как кристаллизация, хроматография или образование солей, можно разделять на энантиомеры, соответственно на E/Z-изомеры. Соли получают по обычной технологии, а именно: к раствору соединения формулы I примешивают эквивалентное количество либо избыток основания или кислоты, необязательно в растворенном виде, и выпавший осадок отделяют или же раствор перерабатывают обычным образом. Если в описании отсутствуют пояснения касательно получения исходных соединений, то подразумевается, что они известны либо могут быть получены аналогично известным соединениям или же по описанным в данной заявке способам. Объектом настоящего изобретения являются также производные изатокислоты общей формулы V в которой R3-R7, X, Y и W имеют значения,указанные в общей формуле I, и в которой А обозначает группу -NR2- или кислород, а Z и R1 вместе образуют связанную с Х=С=О-группу, а также их изомеры и соли, в качестве ценных промежуточных продуктов для получения предлагаемых соединений общей формулы I. Особенно ценными являются такие промежуточные продукты общей формулы V, в которой А и W обозначают кислород,Z и R1 вместе образуют связанную с Х=С=О-группу,Х обозначает группу -NR9-,Y обозначает группу -СН 2-,R3 обозначает пиридил или замещенный гидроксигруппой, бромом, метилом либо ме 004701 24 токсигруппой фенил или 1,2,3,4-тетрагидронафтил,R5 и R6 обозначают водород, хлор, метил,метоксигруппу или трифторметил,R4 и R7 обозначают водород, R9 обозначает водород,а также их изомеры и соли. Указанные промежуточные продукты сами частично являются активными и могут тем самым также применяться для получения соответствующего лекарственного средства, предназначенного для лечения опухолей, псориаза,артрита, в частности ревматоидного артрита,гемангиомы, ангиофибромы, глазных болезней,таких как диабетическая ретинопатия, неоваскулярная глаукома, заболеваний почек, таких как гломерулонефрит, диабетическая нефропатия, злокачественный нефросклероз, синдромы тромботической микроангиопатии, отторжение трансплантатов и гломерулопатия, фиброзных заболеваний, таких как цирроз печени, заболеваний, связанных с пролиферацией мезангиальных клеток, артериосклероза, повреждений нервной ткани, для подавления реокклюзии сосудов после баллонной дилатации, при протезировании сосудов или после введения механических устройств для сохранения просвета сосудов, например, таких как стенты. Ниже получение предлагаемых соединений более подробно поясняется на примерах,которые никоим образом не ограничивают объем изобретения. Пример 1. Получение метилового эфира N(4-пиридилметил)антраниловой кислоты. В атмосфере азота к смеси из 7,5 г метилового эфира антраниловой кислоты и 8,6 г пиридин-4-карбальдегида в 300 мл метанола примешивают 3 мл уксусной кислоты и в течение 12 ч перемешивают при комнатной температуре. Затем к реакционной смеси примешивают 5,7 г цианоборогидрида натрия (85%-ного) и продолжают перемешивание еще в течение 3 ч при комнатной температуре. По истечении этого промежутка времени повторно добавляют 1,14 г цианоборогидрида натрия (85%-ного) и продолжают перемешивание в течение последующих 12 ч при комнатной температуре. Затем реакционную смесь концентрируют, остаток растворяют в уксусном эфире и промывают насыщенным раствором гидрокарбонатанатрия и насыщенным раствором хлорида натрия. Высушенную органическую фазу упаривают и остаток очищают посредством колоночной хроматографии на силикагеле с использованием гексана/уксусного эфира в соотношении 1:1. В результате, получают 10,2 г указанного в заголовке соединения с tпл 85,6 С.N-(4 пиридилметил)антраниловой кислоты предварительно помещают в 3,5 мл толуола, смешивают с 202 мг 3-фенилпропиламина и при 0 С равномерно примешивают 0,75 мл 2-молярного раствора триметилалюминия в толуоле. Далее реакционную смесь нагревают сначала в течение 1 ч при комнатной температуре, а затем в течение 1 ч - с обратным холодильником. После охлаждения реакционную смесь сливают на насыщенный раствор гидрокарбоната натрия и экстрагируют уксусным эфиром. Органическую фазу промывают, сушат, фильтруют и концентрируют под вакуумом. В завершение остаток перекристаллизовывают из уксусного эфира,получая в результате 265 мг указанного в заголовке соединения с tпл 117,4 С. Аналогично примеру 2 получают также следующие соединения: Пример 3. Получение N-(4-хлорбензил)N2-(4-метоксибензил)антраниламида. 425 мг ангидрида N-(4-метоксибензил) изатокислоты растворяют в 20 мл тетрагидрофурана с чистотой для анализа, смешивают с 234 мг 4-хлорбензиламина и в течение 4 ч нагревают с обратным холодильником. Затем реакционную смесь концентрируют под вакуумом, растворяют в уксусном эфире, промывают,сушат, фильтруют и повторно концентрируют под вакуумом. В завершение остаток перекристаллизовывают из этилового спирта, получая в результате указанное в заголовке соединение сtпл 130,5 С. Аналогичным путем получают следующие соединения: Пример 4. Получение N-[2-(4-хлорфенил) этил]-N2-(4-гидроксибензил)антраниламида. 71 мг N-[2-(4-хлорфенил)этил]-N2-(4-метоксибензил)антраниламида растворяют в атмосфере азота в 2 мл абсолютного диметилформамида и смешивают с 76 мг тиометилата натрия. Затем реакционную смесь в течение 1,5 ч нагревают с обратным холодильником. После охлаждения примешивают 30 мл воды и затем экстрагируют уксусным эфиром. Органическую фазу промывают, сушат, фильтруют и концентрируют досуха под вакуумом. Остаток хроматографируют на силикагеле с использованием гексана/уксусного эфира (в соотношении 7:3) в качестве элюентов. В результате, получают 23 мг 30 указанного в заголовке соединения с tпл 103105 С. Пример 5. Получение амида 2-(2-хлорпиридин-4-ил)метил]амино]-N-(изохинолин-3 ил)бензойной кислоты. 300 мг амида 2-[амино]-N-(изохинолин-3 ил)бензойной кислоты смешивают в 6 мл метанола с 0,06 мл ледяной уксусной кислоты и 523 мг 39%-ного раствора 2-хлор-4-пиридинкарбальдегида в метиленхлориде и уксусном эфире и в течение 20 ч перемешивают при комнатной температуре в атмосфере аргона. Затем добавляют 96 мг цианоборогидрида натрия и в течение 6 ч продолжают перемешивание при комнатной температуре. После концентрирования под вакуумом остаток растворяют в 30 мл разбавленного раствора гидрокарбоната натрия в воде и экстрагируют уксусным эфиром. Уксусно-эфирную фазу промывают водой, сушат,фильтруют и концентрируют. Остаток хроматографируют на силикагеле, используя в качестве элюента уксусный эфир. После объединения и концентрирования соответствующих фракций получают 56 мг амида 2-(2-хлорпиридин-4 ил)метил]амино]-N-(изохинолин-3-ил)бензойной кислоты. Аналогичным путем получают также следующие соединения: Пример 6. Получение амида 2-(1,2-дигидро-1-метил-2-оксопиридин-4-ил)метил]амино]N-(изохинолин-3-ил)бензойной кислоты. 80 мг амида 2-(1,2-дигидро-2-оксопиридин-4-ил)метил]амино]-N-(изохинолин-3-ил) бензойной кислоты в 20 мл диметилформамида смешивают в атмосфере аргона с 10 мг гидрида натрия (80%-ного) и нагревают в течение 30 мин до 60 С. Затем по каплям добавляют 0,015 мл метилиодида в 0,5 мл диметилформамида и в течение 1 ч нагревают до 60 С. После охлаждения смесь сливают в раствор гидрокарбоната натрия и экстрагируют уксусным эфиром. Уксусно-эфирную фазу промывают, сушат и концентрируют и остаток хроматографируют на силикагеле, используя в качестве элюентов метиленхлорид/этанол в соотношении 97:3. В результате, получают 30 мг амида 2-(1,2 дигидро-1-метил-2-оксопиридин-4-ил)метил] амино]-N-(изохинолин-3-ил)бензойной кислоты. Аналогичным путем получают также следующие соединения: 32 Пример 7. Получение амида 2-(2-метоксипиридин-4-ил)метил]амино]-N-(изохинолин 3-ил)бензойной кислоты и амида 2-(1,2-дигидро-1-метил-2-оксопиридин-4-ил)метил]амино]-N-(изохинолин-3-ил)бензойной кислоты. 130 мг амида 2-(1,2-дигидро-2-оксопиридин-4-ил)метил]амино]-N-(изохинолин-3-ил) бензойной кислоты предварительно помещают в 4 мл смеси из толуола и метанола в соотношении 1:3,5, затем примешивают 0,2 мл 2 молярного раствора триметилсилилдиазометана в гексане и в течение 8 ч перемешивают при комнатной температуре. После повторного добавления 0,2 мл раствора триметилсилилдиазометана и перемешивания в течение 1 ч смесь концентрируют досуха и хроматографируют на силикагеле, используя в качестве элюентов метиленхлорид/этанол в соотношении 97:3. В результате, получают 20 мг амида амида 2-(2 метоксипиридин-4-ил)метил]амино]-N-(изохинолин-3-ил)бензойной кислоты и 10 мг амида 2(1,2-дигидро-1-метил-2-оксопиридин-4-ил) метил]амино]-N-(изохинолин-3-ил)бензойной кислоты. Аналогичным путем получают также следующие соединения: Пример 8. Получение амида N-(индазол-5 ил)-N2-(4-пиридилметил)антраниловой кислоты. 228 мг N-(4-пиридилметил)антраниловой кислоты предварительно помещают в 10 мл диметилформамида в атмосфере аргона и исключая доступ влаги. После этого добавляют 266 мг 5-аминоиндазола, 0,27 мл метилморфолина и 456 мг гексафторфосфата О-(7-азабензотриазол 1-ил)-N,N,N',N'-тетраметилурония (ГАТУ). Затем смесь в течение 4 ч перемешивают при комнатной температуре. Далее примешивают разбавленный раствор гидрокарбоната натрия и трижды экстрагируют уксусным эфиром. Объе 33 диненные органические фазы промывают водой,сушат, фильтруют и концентрируют под вакуумом. Остаток хроматографируют на силикагеле,используя в качестве элюента уксусный эфир. В результате размешивания с ацетоном получают 245 мг указанного в заголовке соединения с tпл 209,8 С. Аналогичным путем получают также следующие соединения: 34 На приведенных далее примерах, которые не ограничивают объем изобретения, подробнее поясняется получение предлагаемых промежуточных продуктов. Пример 9. Получение ангидрида N-(4 метоксибензил)изатокислоты в качестве промежуточного продукта для получения соответствующих конечных продуктов по изобретению. В атмосфере азота раствор из 5 г ангидрида изатокислоты и 100 мл(приблизительно 60%-ного в масле). Затем реакционную смесь в течение 30 мин перемешивают при комнатной температуре и продолжают перемешивание еще в течение 30 мин при температуре бани 60 С. После охлаждения до комнатной температуры по каплям добавляют при перемешивании 5 мл 4-метоксибензальдегида и в течение ночи перемешивают при комнатной температуре. Затем реакционную смесь концентрируют под вакуумом и сливают на 100 мл льда/воды. Выпавший осадок отделяют, растворяют в 50 мл метиленхлорида, промывают, сушат, фильтруют и концентрируют под вакуумом. Остаток перекристаллизовывают из спирта, получая в результате 3,4 г указанного в заголовке соединения с tпл 143 С. Аналогичным путем получают также следующие соединения: Пример 10. Получение N-(4-пиридилметил)антраниловой кислоты в качестве промежуточного продукта для получения соответствующих конечных продуктов по изобретению. 2 г метилового эфира N-(4-пиридилметил)антраниловой кислоты растворяют в 15 мл метанола, примешивают 16 мл 1 н. едкого натра и в течение 1 ч нагревают с обратным холодильником. После охлаждения метанол отгоняют под вакуумом и остаток смешивают с 20 мл воды и 20 мл 1 н. раствора лимонной кислоты. Выпавшие кристаллы отфильтровывают с помощью вакуум-фильтра, промывают водой и сушат. В результате получают 1,7 г указанного в заголовке соединения с tпл 208,0 С. Пример 11. Получение амида N-(индазол 5-ил)-5-хлорантраниловой кислоты в качестве промежуточного продукта для получения соответствующих конечных продуктов по изобретению. 35 171 мг 7-хлорантраниловой кислоты в атмосфере аргона и исключая доступ влаги предварительно помещают в 10 мл диметилформамида, затем последовательно примешивают 253 мг N-метилморфолина, 266 мг 5-аминоиндазола и 456 мг гексафторфосфата O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (ГАТУ) и в течение 4 ч перемешивают при комнатной температуре. После выдержки в течение ночи примешивают 50 мл воды и экстрагируют 30 мл уксусного эфира. Органическую фазу промывают водой, сушат, фильтруют и концентрируют. Остаток хроматографируют на силикагеле,используя в качестве элюента уксусный эфир. В результате, получают 266 мг амида N-(индазол 5-ил)-5-хлорантраниловой кислоты. На приведенных ниже примерах, которые никоим образом не ограничивают объем изобретения, более подробно поясняются биологическое действие предлагаемых соединений и их применение. В опытах использовали следующие растворы: Исходные растворы исходный раствор А: 3 мМ АТФ в воде, рН 7,0 (-70 С) исходный раствор Б: g-33 Р-АТФ 1 мКи/100 мкл исходный раствор В: поли(Glu4 Туr) 10 мг/мл в воде Раствор для разведений растворитель субстратов: 10 мМ ДТТ (дитиотреитол), 10 мМ хлорид марганца, 100 мМ хлорид магния раствор фермента: 120 мМ трис/HCl, рН 7,5, 10 мкМ оксид натрия-ванадия Пример 1 по применению. Подавление активности киназ KDR и FLT-1 в присутствии соединений по изобретению. На ромбовидный микротитрационный планшет (без связывания протеина) помещают 10 мкл смеси субстратов (10 мкл содержащего АТФ исходного раствора А + 25 мкКи g-33 РАТФ (приблизительно 2,5 мкл исходного раствора Б) + 30 мкл содержащего поли(Glu4 Туr) исходного раствора В + 1,21 мл растворителя субстратов), 10 мкл ингибирующего раствора(субстанции в соответствующих разведениях, в качестве контроля - 3% ДМСО в растворителе субстратов) и 10 мкл раствора фермента (11,25 мкг исходного раствора фермента (KDR- илиFLT-1-киназа) разбавляют при 4 С в 1,25 мл раствора фермента). После тщательного перемешивания инкубируют в течение 10 мин при комнатной температуре. Затем добавляют 10 мкл раствора, прекращающего реакцию (250 мМ ЭДТК, рН 7,0), перемешивают и 10 мкл раствора переносят на фосфоцеллюлозный фильтр типа Р 81. После этого несколько раз промывают в 0,1 М фосфорной кислоте. Фильтровальную бумагу сушат, покрывают слоем Meltilex и из 004701 36 меряют радиоактивность с помощью микросчетчика -излучения. Значения IC50 определяют на основании концентрации ингибитора, которая требуется для подавления внедрения фосфата на 50% от его внедрения в неингибированном состоянии за вычетом фонового значения (обусловленного реакцией, прекращенной введением ЭТДК). Результаты ингибирования киназы (значение IC50 в мкМ) представлены в нижеследующей таблице. ПримерVEGFR I (FLT) VEGFR II (KDR) 2.0 0,05 0,05 2.1 0,01 0,3 2.2 0,1 0,5 2.3 0,02 0,02 2.4 0,02 0,1 2.5 1 10 2.6 0,2 2 2.8 0,5 0,1 2.9 5 1 2.10 3 10 2.11 0,02 0,2 2.12 0,7 3 2.13 0,7 3 2.14 0,5 0,3 2.15 1,0 КН 2.16 0,1 0,2 2.17 0,4 0,5 2.18 0,3 0,5 2.19 10 10 2.20 4 КН 2.21 2 0,3 2.23 0,02 0,67 2.24 0,5 1 2.25 0,3 0,2 2.26 0,2 0,2 2.27 0,02 0,02 2.28 1 2 2.29 2 3 2.30 0,005 0,02 2.31 0,1 0,27 2.32 0,02 0,02 2.33 1 2 2.34 2 0,1 2.35 0,098 0,02 2.36 0,05 0,2 2.37 0,2 2.38 7 0,2 2.39 0,05 0,03 2.40 0,5 2.41 1 0,3 2.42 0,5 0,1 2.43 0,02 0,05 2.44 0,3 0,2 2.45 0,1 1 2.46 0,04 0,05 2.47 0,02 1 2.48 0,1 0,5m, n и о обозначают 0-3,Ra, Rb, Rc, Rd, Re, Rf, каждый независимо друг от друга, обозначает водород, метил,Х обозначает группу -NR9-,Y обозначает группу -СН 2,R1 обозначает фенил, пиридил, 5-хлор-2,3 дигидроинденил, 2,3-дигидроинденил, тиенил,6-фтор-1H-индол-3-ил, нафтил, 1,2,3,4-тетрагидронафтил, бензо-1,2,5-оксадиазол, 6,7-диметокси-1,2,3,4-тетрагидро-2-нафтил или одноили многократно замещенные галогеном, C1 С 6 алкилом, С 1-С 4 алкокси-, гидрокси-, трифторметилом фенил или пиридил, или представляет собой группу ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы I при этом фенил, замещенный фенил или нафтил не раположены непосредственно у группы -NR2-, указанной как значение А,R2 обозначает водород или метил,R3 обозначает необязательно одно- или многократно замещенные галогеном, C1 С 6 алкилом, C1-С 6 алкокси- либо гидроксигруппой фенил, пиридил либо пиримидинил или представляет собой группуR4, R5, R6 и R7, каждый независимо друг от друга, обозначает водород, галоген или незамещенные либо необязательно одно- или многократно замещенные галогеном C1-С 6 алкоксигруппу, C1-С 6 алкил, C1-С 6 карбоксиалкил, илиR8, R9 и R10, каждый независимо друг от друга, обозначает водород или C1-С 6 алкил, а также их изомеры и соли,при этом если R2 представляет собой водород, R9 представляет собой водород, Y представляет собой группу -СН 2- и R1 представляет собой пиридил, или если R1 представляет собой фенил либо замещенный метилом, хлором или бромом фенил и Z представляет собой метил или этил, то R3 не может обозначать пиридил,фенил либо замещенный метилом, хлором или бромом фенил. 2. Соединения общей формулы I по п.1, в которой А обозначает группу -NR2-,W обозначает кислород,Z обозначает группуm, n и о обозначают 0-3,Ra, Rb, Rc, Rd, Re, Rf, каждый независимо друг от друга, обозначает водород, метил,Х обозначает группу -NR9-,Y обозначает группу -СН 2-,R1 обозначает фенил, пиридил, 5-хлор-2,3 дигидроинденил, 2,3-дигидроинденил, тиенил,6-фтор-1 Н-индол-3-ил,нафтил,1,2,3,4 тетрагидронафтил, бензо-1,2,5-оксадиазол или 6,7-диметокси-1,2,3,4-тетрагидро-2-нафтил или одно- либо многократно замещенные C1 С 4 алкилом, C1-С 4 алкокси-, гидроксигруппой,галогеном, трифторметилом, фенил или пиридил, либо представляет собой группу при этом фенил, замещенный фенил или нафтил не расположены непосредственно у группы -NR2-, указанной как значение А,R2 обозначает водород или метил,R3 обозначает пиридил или одно- или многократно замещенные гидроксигруппой, галогеном, метилом или метоксигруппой фенил или пиридил, или представляет собой группуR5 и R6, каждый независимо друг от друга,обозначает водород, галоген, метил, метоксигруппу или трифторметил,R4 и R7, каждый независимо друг от друга,обозначает водород или галоген,R9 обозначает водород,R10 обозначает водород или метил, а также их изомеры и соли,при этом если R2 представляет собой водород, R1 означает фенил, и если R1 представляет собой фенил либо однозамещенный метилом,хлором или бромом фенил и Z представляет собой метил или этил, то R3 не может обозначать пиридил, фенил либо однозамещенный метилом, хлором или бромом фенил. 3. Применение соединений общей формулы I по п.1 или 2 для получения фармацевтического препарата, обладающего ингибирующимFLT. 4. Фармацевтический препарат, содержащий в своем составе по меньшей мере одно соединение по любому из пп.1 или 2. 5. Фармацевтический препарат по п.4 для ингибирования тирозинкиназ KDR и FLT. 6. Соединения по любому из пп.1 или 2 и фармацевтические препараты по пп.4 и 5, используемые совместно с вспомогательными ве 42 ществами и носителями для получения соответствующих композиций. 7. Применение соединений формулы I по любому из пп.1 или 2 в качестве ингибиторов тирозинкиназ KDR и FLT. 8. Применение соединений общей формулы I по любому из пп.1 или 2 в форме фармацевтического препарата для энтерального, парентерального и орального введения.
МПК / Метки
МПК: A61P 17/00, A61K 31/4409, C07D 213/38, C07C 237/30
Метки: качестве, антраниловой, средств, кислоты, лекарственных, амиды, применение
Код ссылки
<a href="https://eas.patents.su/22-4701-amidy-antranilovojj-kisloty-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Амиды антраниловой кислоты и их применение в качестве лекарственных средств</a>
Предыдущий патент: Фармацевтические композиции, содержащие белок плазмы
Следующий патент: Сульфированные сахариды
Случайный патент: Мебельная конструкция, такая как убирающаяся кровать с убирающимися ножками