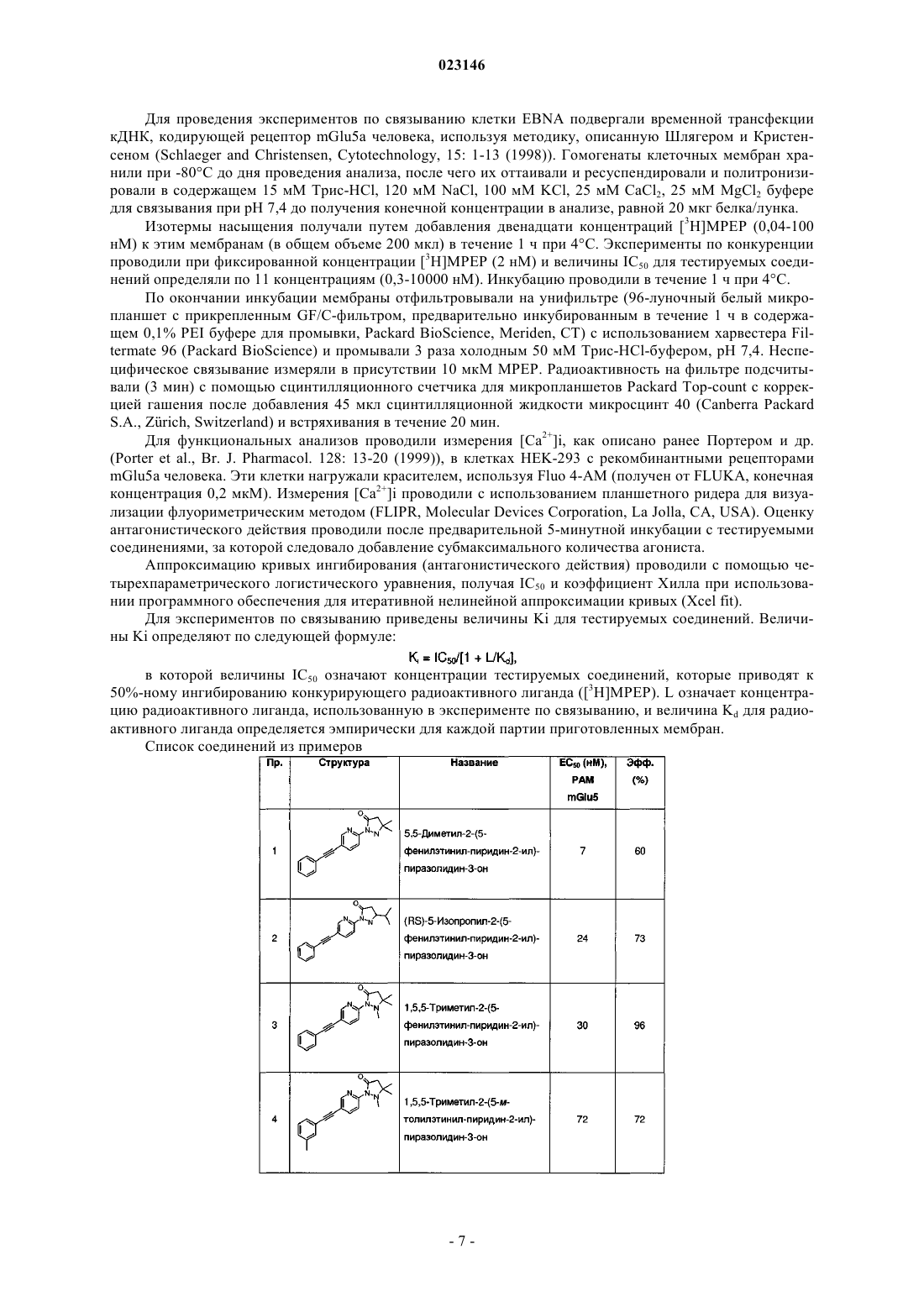
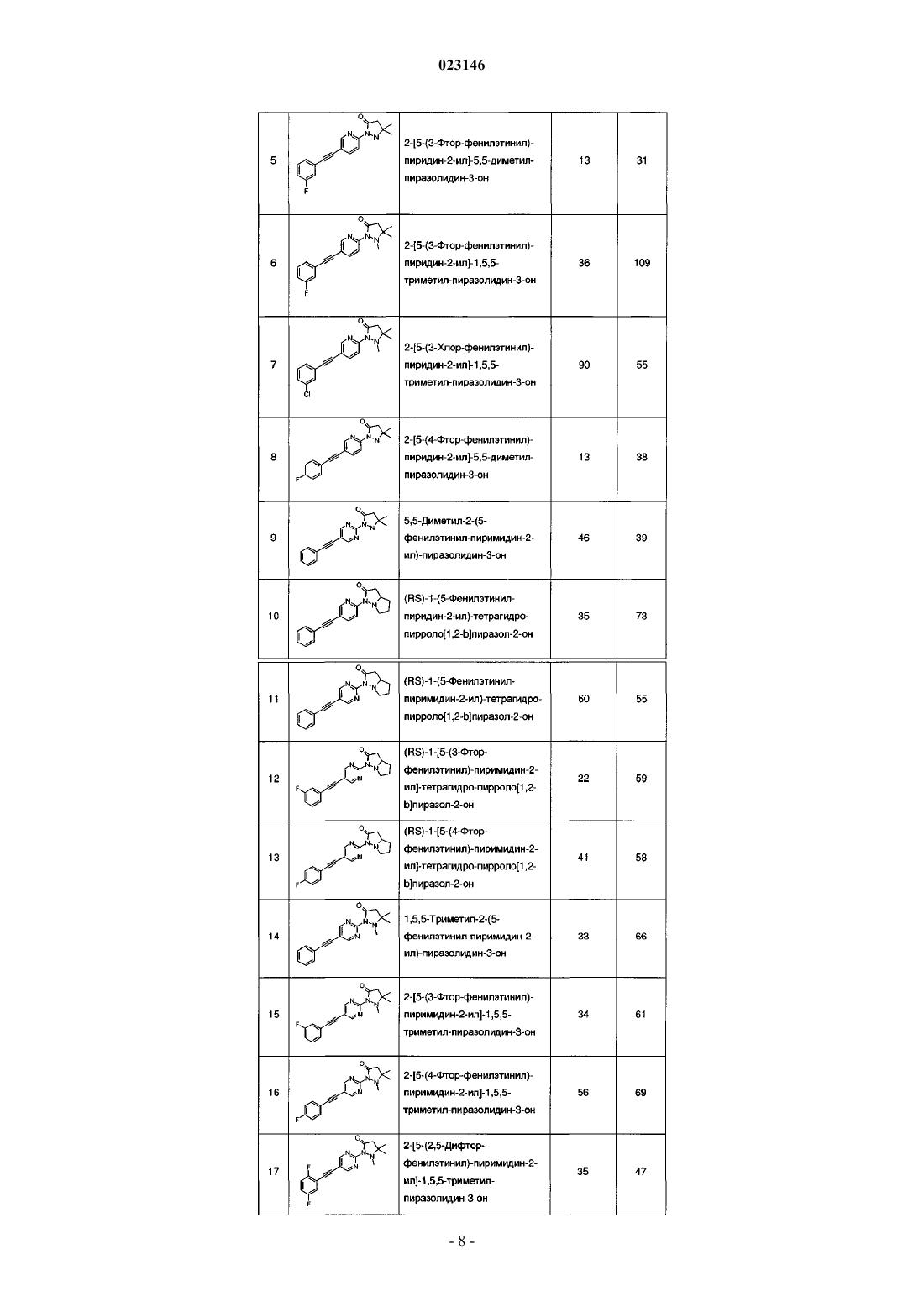
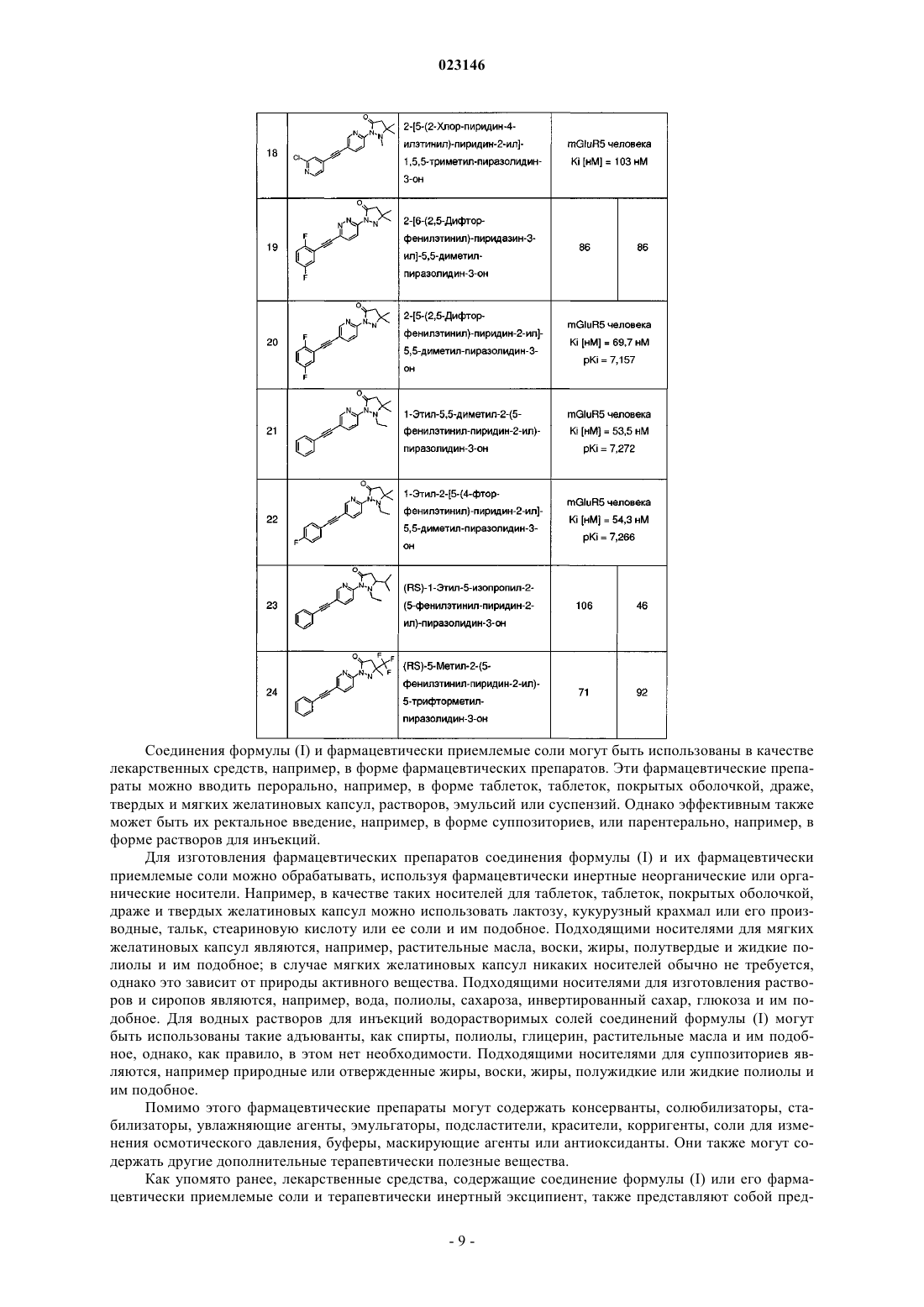
Производные пиразолидин-3-она
Номер патента: 23146
Опубликовано: 29.04.2016
Авторы: Ешке Георг, Рюхер Даниэль, Линдеманн Лотар, Штадлер Хайнц, Риччи Антонио, Виейра Эрик, Жолидон Синиз
Формула / Реферат
1. Соединение формулы
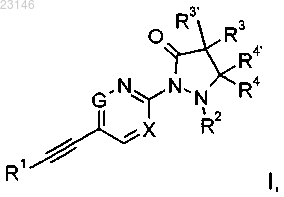
где X представляет собой N или СН;
G представляет собой N или СН;
при условии, что только один из X или G может представлять собой азот;
R1 представляет собой фенил или пиридил, которые возможно замещены атомом галогена или С1алкилом;
R2 представляет собой водород, С1-2алкил или может образовывать вместе с R4 С3-С5-циклоалкил;
R3/R3'/R4/R4' независимо друг от друга представляют собой водород, C1-3алкил или CF3.
2. Соединение формулы IA по п.1
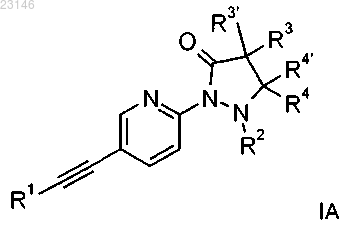
где R1 представляет собой фенил или пиридил, которые возможно замещены атомом галогена или С1алкилом;
R2 представляет собой водород, С1-2алкил или может образовывать вместе с R4 С3-С5-циклоалкил;
R3/R3'/R4/R4' независимо друг от друга представляют собой водород, С1-3алкил или CF3.
3. Соединение формулы IA по любому из пп.1, 2, представляющее собой
5,5-диметил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,
(RS)-5-изопропил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,
1,5,5-триметил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,
1,5,5-триметил-2-(5-м-толилэтинилпиридин-2-ил)пиразолидин-3-он,
2-[5-(3-фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,
2-[5-(3-фторфенилэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он,
2-[5-(3-хлорфенилэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он,
2-[5-(4-фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,
(RS)-1-(5-фенилэтинилпиридин-2-ил)тетрагидропирроло[1,2-b]пиразол-2-он,
2-[5-(2-хлорпиридин-4-илэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он,
2-[5-(2,5-дифторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,
1-этил-5,5-диметил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,
1-этил-2-[5-(4-фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,
(RS)-1-этил-5-изопропил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он или
(RS)-5-метил-2-(5-фенилэтинилпиридин-2-ил)-5-трифторметил-пиразолидин-3-он.
4. Соединение формулы IB по п.1
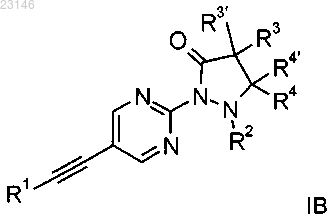
где R1 представляет собой фенил, которые возможно замещены атомом галогена или С1алкилом;
R2 представляет собой водород, С1алкил или может образовывать вместе с R4 С3-С5-циклоалкил;
R3/R3'/R4/R4' независимо друг от друга представляют собой водород или С1алкил.
5. Соединение формулы IB по любому из пп.1 и 4, представляющее собой
5,5-диметил-2-(5-фенилэтинилпиримидин-2-ил)пиразолидин-3-он,
(RS)-1-(5-фенилэтинилпиримидин-2-ил)тетрагидропирроло[1,2-b]пиразол-2-он,
(RS)-1-[5-(3-фторфенилэтинил)пиримидин-2-ил]тетрагидропирроло[1,2-b]пиразол-2-он,
(RS)-1-[5-(4-фторфенилэтинил)пиримидин-2-ил]тетрагидропирроло[1,2-b]пиразол-2-он,
1,5,5-триметил-2-(5-фенилэтинилпиримидин-2-ил)пиразолидин-3-он,
2-[5-(3-фторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он,
2-[5-(4-фторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он или
2-[5-(2,5-дифторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он.
6. Соединение формулы IC по п.1
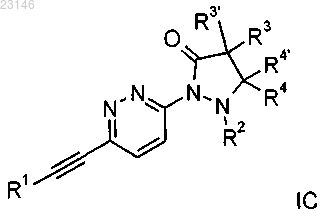
где R1 представляет собой фенил, замещенный атомом галогена;
R2 представляет собой водород;
R3/R3'/R4/R4' независимо друг от друга представляют собой водород или С1алкил.
7. Соединение формулы IC по любому из пп.1 и 6, представляющее собой
2-[6-(2,5-дифторфенилэтинил)пиридазин-3-ил]-5,5-диметилпиразолидин-3-он.
8. Применение соединения по любому из пп.1-7 в качестве положительного аллостерического модулятора mGluR5.
9. Фармацевтическая композиция для положительного аллостерического модулирования mGluR5, содержащая соединение по любому из пп.1-7 и терапевтически активный носитель.
10. Применение соединения по любому из пп.1-7 для лечения шизофрении или когнитивных заболеваний.
11. Применение соединения по любому из пп.1-7 для изготовления лекарственного средства для лечения шизофрении или когнитивных заболеваний.
12. Способ лечения шизофрении или когнитивных заболеваний, включающий введение эффективного количества соединения, которое определено в любом из пп.1-7.
Текст
Изобретение относится к этинильным производным формулы I, где X представляет собой N или СН; G представляет собой N или СН; при условии, что максимально один из X или G может представлять собой азот; R1 представляет собой фенил или пиридил, которые возможно замещены атомом галогена, низшим алкилом или низшим алкокси; R2 представляет собой водород, низший алкил или вместе с R4 может образовывать С 3-С 6-циклоалкил; R3/R3'/R4/R4' независимо друг от друга представляют собой водород, низший алкил или CF3; или к фармацевтически приемлемой соли присоединения кислоты, к рацемической смеси или к ее соответствующему энантиомеру и/или их оптическому изомеру и/или стереоизомеру. Теперь неожиданно было обнаружено, что соединения общей формулы I представляют собой положительные аллостерические модуляторы Изобретение относится к этинильным производным формулы IG представляет собой N или СН; при условии, что максимально один из X или G может представлять собой азот;R1 представляет собой фенил или пиридил, которые возможно замещены атомом галогена, низшим алкилом или низшим алкокси;R2 представляет собой водород, низший алкил или вместе с R4 может образовывать С 3-С 6 циклоалкил;R3/R3'/R4/R4' независимо друг от друга представляют собой водород, низший алкил или CF3; или к фармацевтически приемлемой соли присоединения кислоты, к рацемической смеси или к ее соответствующему энантиомеру и/или их оптическому изомеру и/или стереоизомеру. Теперь неожиданно было обнаружено, что соединения общей формулы I являются положительными аллостерическими модуляторами (РАМ) метаботропного глутаматного рецептора, подтипа 5(mGluR5). В центральной нервной системе (ЦНС) передача сигналов осуществляется путем взаимодействия нейромедиатора, высвобождающегося из нейрона, с нейрорецептором. Глутамат является главным возбуждающим нейромедиатором в головном мозге и играет уникальную роль в целом ряде процессов в центральной нервной системе (ЦНС). Глутаматзависимые рецепторы,участвующие в передаче сигналов, подразделяют на две основные группы. Первую основную группу, а именно группу ионотропных рецепторов, образуют лигандзависимые ионные каналы. Метаботропные глутаматные рецепторы (mGluR, от metabotropic glutamate receptors) принадлежат ко второй основной группе и, кроме того, принадлежат семейству G-белок-связанных рецепторов. В настоящее время известно восемь разных типов этих mGluR, и некоторые из них еще разделены на подтипы. На основании гомологии их последовательностей, механизмов передачи сигналов и селективности к агонистам эти восемь типов рецепторов могут быть подразделены на три подгруппы: mGluR1 и mGluR5 принадлежат к группе I, mGluR2 и mGluR3 принадлежат к группе II и mGluR4, mGluR6,mGluR7 и mGluR8 принадлежат к группе III. Лиганды метаботропных глутаматных рецепторов, принадлежащих к первой группе, могут быть использованы для лечения или предупреждения острых и/или хронических неврологических расстройств, таких как психоз, эпилепсия, шизофрения, болезнь Альцгеймера, когнитивные расстройства и нарушения памяти, а также хроническая и острая боль. Другие показания, которые можно лечить при этом, представляют собой ограниченную функцию головного мозга, вызванную операциями шунтирования или использованием трансплантатов, недостаточным кровоснабжением головного мозга, травмами спинного мозга, травмами головы, гипоксией по причине беременности, остановкой сердца и гипогликемией. Также показаниями, поддающимися лечению, являются ишемия, хорея Гентингтона, боковой амиотрофический склероз (ALS), деменция, вызванная СПИДом, травмы глаз, ретинопатия, идиопатический паркинсонизм или паркинсонизм, вызванный лекарственными средствами, а также состояния, которые приводят к функциям, ассоциируемым с глутаматной недостаточностью, таким, например, как мышечные спазмы, судороги, мигрень, недержание мочи, никотиновая зависимость, опиатная зависимость, тревога, рвота, дискинезия и депрессии. Расстройствами, которые полностью или частично опосредованы mGluR5, являются, например,острые, травматические и хронические дегенеративные процессы нервной системы, такие как болезнь Альцгеймера, сенильная деменция, болезнь Паркинсона, хорея Гентингтона, боковой амиотрофический склероз и множественный склероз, психиатрические заболевания, такие как шизофрения и тревога, депрессия, боль и наркотическая зависимость (Expert Opin. Ther. Patents (2002), 12, (12. Новая возможность для разработки селективных модуляторов лежит в идентификации соединений,которые действуют через аллостерический механизм, модулируя данный рецептор посредством связывания с сайтом, отличающимся от высококонсервативного ортостерического сайта связывания. Положительные аллостерические модуляторы mGluR недавно предстали в качестве новых фармакологических структур, обещающих эту привлекательную альтернативу. Положительные аллостерические модуляторы описаны, например в WO 2008/151184, WO 2006/048771, WO 2006/129199 и WO 2005/044797 и в Molecular Pharmacology, 40, 333-336, 1991; The Journal of Pharmacology and Experimental Therapeutics, Vol. 313, 1, 199-206, 2005. Положительными аллостерическими модуляторами являются соединения, которые сами непосредственно не активируют рецепторы, но заметно усиливают стимулированные агонистами ответы, повышают активность и до максимальной степени эффективность. Связывание этих соединений повышает аффинность агониста глутаматраспознающего сайта к внеклеточному N-концевому сайту связывания его рецептора. Таким образом, положительное аллостерическое модулирование представляет собой привлекательный механизм усиления активации соответствующих физиологических рецепторов. Существует дефицит селективных положительных аллостерических модуляторов рецептора mGluR5. Растворимость в воде традиционных модуляторов рецептора mGluR5 обычно не соответствует требованиям, и они демонстрируют слабую пероральную биодоступность. Таким образом, сохраняется потребность в соединениях, которые преодолевают эти недостатки и которые представляют собой эффективные селективные положительные аллостерические модуляторы рецептора mGluR5. Соединения формулы I отличаются полезными терапевтическими свойствами. Они могут быть использованы в лечении или предупреждении расстройств, связанных с положительными аллостерическими модуляторами рецептора mGluR5. Наиболее предпочтительными показаниями для лечения соединениями, представляющими собой положительные аллостерические модуляторы, являются шизофрения и расстройство познавательной способности. Настоящее изобретение относится к соединениям формулы I и их фармацевтически приемлемым солям, к указанным соединениям как фармацевтически активным веществам, к способам их получения, а также к применению в лечении или предупреждении расстройств, связанных с положительными аллостерическими модуляторами рецептора mGluR5, таких как шизофрения, туберозный склероз и расстройство познавательной способности, и к фармацевтическим композициям, содержащим соединения формулы I. Следующие далее определения общих терминов, использованных в описании настоящего изобретения, применяются независимо от того, встречаются ли рассматриваемые термины по отдельности или в комбинации. Использованный в данном описании термин "низший алкил" означает насыщенную, т.е. алифатическую углеводородную группу, в том числе прямую или разветвленную углеродную цепь из 1-4 атомов углерода. Примерами для "алкила" являются метил, этил, н-пропил и изопропил. Термин "алкокси" означает группу -O-R' где R' представляет собой низший алкил, который определен выше. Термин "галоген" означает фторо, хлоро, бромо или иодо. Термин "фармацевтически приемлемая соль" или "фармацевтически приемлемая соль присоединения кислоты" охватывает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и им подобные. Одним из воплощений изобретения являются соединения формулы IA где R1 представляет собой фенил или пиридил, которые возможно замещены атомом галогена, низшим алкилом или низшим алкокси;R2 представляет собой водород, низший алкил или вместе с R4 может образовывать С 3-С 6 циклоалкил;R3/R3'/R4/R4' независимо друг от друга представляют собой водород, низший алкил или CF3; или фармацевтически приемлемая соль присоединения кислоты, рацемическая смесь или ее соответствующий энантиомер и/или их оптический изомер и/или стереоизомер, например, следующие соединения: 5,5-диметил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,(RS)-5-изопропил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,1,5,5-триметил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,1,5,5-триметил-2-(5-м-толилэтинилпиридин-2-ил)-пиразолидин-3-он,2-[5-(3-фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,2-[5-(3-фторфенилэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он,2-[5-(3-хлорфенилэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он,2-[5-(4-фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,(RS)-1-(5-фенилэтинилпиридин-2-ил)тетрагидропирроло[1,2-b]пиразол-2-он,2-[5-(2-хлорпиридин-4-илэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он,2-[5-(2,5-дифторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,1-этил-5,5-диметил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,1-этил-2-[5-(4-фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,-2 023146(RS)-5-метил-2-(5-фенилэтинилпиридин-2-ил)-5-трифторметилпиразолидин-3-он. Одним из следующих воплощений изобретения являются соединения формулы IB где R1 представляет собой фенил или пиридил, которые возможно замещены атомом галогена, низшим алкилом или низшим алкокси;R2 представляет собой водород, низший алкил или может образовывать вместе с R4 С 3-С 6 циклоалкил;R3/R3'/R4/R4' независимо друг от друга представляют собой водород, низший алкил или CF3; или фармацевтически приемлемая соль присоединения кислоты, рацемическая смесь или ее соответствующий энантиомер и/или их оптический изомер и/или стереоизомер, например следующие соединения: 5,5-диметил-2-(5-фенилэтинилпиримидин-2-ил)пиразолидин-3-он,(RS)-1-(5-фенилэтинилпиримидин-2-ил)тетрагидропирроло[1,2-b]пиразол-2-он,(RS)-1-[5-(3-фторфенилэтинил)пиримидин-2-ил]тетрагидропирроло[1,2-b]пиразол-2-он,(RS)-1-[5-(4-фторфенилэтинил)пиримидин-2-ил]тетрагидропирроло[1,2-b]пиразол-2-он,1,5,5-триметил-2-(5-фенилэтинилпиримидин-2-ил)пиразолидин-3-он,2-[5-(3-фторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он,2-[5-(4-фторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он или 2-[5-(2,5-дифторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он. Одним из следующих воплощений изобретения являются соединения формулы 1 СG представляет собой N или СН; при условии, что максимально один из X или G может представлять собой азот;R1 представляет собой фенил или пиридил, которые возможно замещены атомом галогена, низшим алкилом или низшим алкокси;R2 представляет собой водород, низший алкил или вместе с R4 может образовывать С 3-С 6 циклоалкил;R3/R3'/R4/R4' независимо друг от друга представляют собой водород, низший алкил или CF3; или фармацевтически приемлемая соль присоединения кислоты, рацемическая смесь или ее соответствующий энантиомер и/или их оптический изомер и/или стереоизомер, например следующее соединение: 2-[6-(2,5-дифторфенилэтинил)пиридазин-3-ил]-5,5-диметилпиразолидин-3-он. Одним из следующих воплощений изобретения являются этинильные производные формулы IIG и А независимо представляют собой N или СН; при условии, что максимально один из X, G или А может представлять собой азот;R1 представляет собой фенил или гетероарил, которые возможно замещены атомом галогена, низшим алкилом или низшим алкокси;R2 представляет собой водород, низший алкил или вместе с R4 может образовывать С 3-С 6 циклоалкил;R3/R3'/R4/R4' независимо друг от друга представляют собой водород, низший алкил, СН 2-низший алкокси; или фармацевтически приемлемая соль присоединения кислоты, рацемическая смесь или ее соответствующий энантиомер и/или их оптический изомер и/или стереоизомер. Получение соединений формулы I по настоящему изобретению может быть осуществлено путем последовательного или конвергентного синтезов. Пути синтеза соединений по изобретению показаны на следующей далее схеме 1. Знания, необходимые для проведения данной реакции и очистки полученных продуктов, известны специалистам в данной области. Заместители и индексы, использованные в следующем далее описании способов, имеют значение, приведенное в данном описании ранее. Соединения формулы I могут быть получены приведенными ниже способами, способами, приведенными в примерах, или аналогичными способами. Соответствующие реакционные условия для отдельных стадий реакции известны специалисту в данной области. Последовательность реакций не ограничивается последовательностью, показанной на схемах, однако в зависимости от исходных веществ и соответствующей им реакционной способности последовательность стадий реакции можно менять по своему усмотрению. Исходные вещества либо имеются в продаже, либо могут быть получены способами, аналогичными способам, приведенным ниже, способами, описанными в ссылках, приведенных в описании или в разделе примеры, или способами, известными в данной области техники. Соединения формулы I по настоящему изобретению и их фармацевтически приемлемые соли могут быть получены способами, известными в данной области, например с использованием вариантов способа, описанных ниже, причем способ включает: а) приведение во взаимодействие соединения формулы где заместители описываются выше, илиb) приведение во взаимодействие соединения формулы с соединением формулы где X' представляет собой Br или I,с образованием соединения формулы где заместители описываются выше, или с) приведение во взаимодействие соединения формулы где заместители описываются выше, или при желании, превращение полученных соединений в фармацевтически приемлемые соли присоединения кислоты. Получение соединений формулы I описано более подробно далее на схемах 1-4 и в примерах 1-24. Схема 1 Соединение этинилпиридина или этинилпиримидина формулы I-1 может быть получено, например,посредством взаимодействия соответствующей ненасыщенной кислоты 1 с бензотриазолом 2 в присутствии хлорирующего агента, такого как SOCl2, в растворителе типа дихлорметана с получением соответствующего бензотриазоламида 3. После взаимодействия бензотриазоламида 3 с гетероциклическим 5 иод- или 5-бром-2-гидразиносодержащим производным 4 в присутствии основания, такого как триэтиламин, в растворителе типа THF, получают соответствующие производные пиразолидин-3-она 5. В результате осуществления сочетания по Соногаширу производных пиразолидин-3-она 5 с соответствующим образом замещенным арилацетиленом 6 получают желаемые этинильные соединения общей формулы I-1 (схема 1). Схема 2 Соединение этинилпиридина или этинилпиримидина формулы I-2 может быть получено, например,посредством взаимодействия этинильного соединения общей формулы I-1 с соответствующим замещенным алкилирующим агентом в присутствии основания, такого как K2CO3, в растворителе типа ацетонитрила (ACN), с образованием желаемых этинильных соединений общей формулы I-2 (схема 2). Схема 3 Этинильное соединение формулы I также может быть получено посредством замещения соответствующего парадигалогенозамещенного гетероциклического производного 7, такого как 2-бром-5 иодпиридин, 5-иод-2-фторпиридин, 5-иод-2-бромпиримидин, 2-хлор-5-иодпиридазин или 2-бром-5 иодпиразин или им подобные, и соответствующего пиразолидин-3-она 8 в присутствии основания, такого как карбонат цезия (X = Cl, F), или с использованием условий катализируемого сочетания палладием(X = Br, I) с соответствующими лигандами, такими как ксантфос и Pd2(dba)3, в растворителе типа толуола с получением соответствующих производных 2-гетероарилпиразолидин-3-она 9. В результате осуществ-5 023146 ления сочетания по Соногаширу соединения 9 с соответствующим образом замещенным арилацетиленом 6 образуются желаемые этинильные соединения общей формулы I (схема 3). Вообще говоря, в некоторых случаях последовательность стадий, используемых для синтеза соединений формулы I-1, I-2 или I, также может быть модифицирована, например, за первым осуществлением сочетания Соногашира с образованием соответствующим образом замещенного арил- или гетероарилэтинильного производного 10 следует взаимодействие с пиразолидин-3-оном 8 с использованием методик, аналогичных описанным на схемах 1-3 (схема 4). Схема 4 Биологический анализ и данные Анализ мобилизации внутриклеточного Са 2+. Была создана линия моноклональных клеток HEK-293, стабильно трансфицированная с использованием кДНК, кодирующей рецептор mGlu5a человека; для работы с mGluR5-положительными аллостерическими модуляторами (РАМ) отбирали клеточную линию с низкими уровнями экспрессии рецепторов и с низкой активностью конститутивных рецепторов, чтобы иметь возможность различать агонистическую активность и активность РАМ. Клетки культивировали согласно стандартным протоколам(Freshney, 2000) в модифицированной Дульбекко среде Игла с высоким содержанием глюкозы, дополненной 1 мМ глутамином, 10% (об./об.) инактивированной нагреванием телячьей сыворотки, пенициллином/стрептомицином, гигромицином (50 мкг/мл) и бластицидином (15 мкг/мл) (все реагенты для культивирования клеток и антибиотики из Invitrogen, Basel, Switzerland). Примерно за 24 ч до начала эксперимента производили посев с плотностью 5104 клеток/лунка в покрытые поли-D-лизином 96-луночные черные планшеты с прозрачным дном. Клетки нагружали, используя 2,5 мкМ Fluo-4AM в загрузочном буфере (1HBSS, 20 мМ HEPES), в течение 1 ч при 37 С и промывали пять раз загрузочным буфером. Клетки переносили в систему функционального скрининга лекарственных средств 7000 (Hamamatsu, Paris, France), добавляли 11 полулогарифмических серийных разведений тестируемого соединения при 37 С и клетки инкубировали в течение 10-30 мин с онлайнрегистрацией флуоресценции. По окончании этой стадии преинкубации к клеткам добавляли агонист Lглутамат в концентрации, соответствующей ЕС 20 (обычно около 80 мкМ), с онлайн-регистрацией флуоресценции; для того чтобы учесть суточные колебания в отвечаемости клеток, величину ЕС 20 для глутамата определяли непосредственно перед каждым экспериментом посредством записи полной кривой зависимости ответа от дозы глутамата. Ответы измеряли в виде увеличения пиков флуоресценции за вычетом базовой линии (т.е. флуоресценции без добавления L-глутамата), отнесенного к максимальному стимулирующему эффекту, полученному при использовании насыщающих концентраций L-глутамата. Строили графики для % максимального стимулирующего эффекта, используя XLfit, программу аппроксимации кривых по точкам, которая итерационно строит графики по данным с помощью алгоритма Левенберга-Марквардта. Применяли следующее уравнение анализа конкуренции для одного сайта у=А+B-A)/(1+x/C)D, где у обозначает % максимального стимулирующего эффекта, А обозначает минимальное значение у, В обозначает максимальное значение у, С обозначает ЕС 50. x обозначает log10 концентрации конкурирующего соединения, a D обозначает наклон кривой (коэффициент Хилла). Из этих кривых рассчитывали ЕС 50 (концентрацию, при которой достигалась половина максимальной стимуляции), коэффициент Хилла, а также максимальный ответ в % от максимального стимулирующего эффекта, полученного при использовании насыщающих концентраций L-глутамата. Положительные сигналы, полученные в процессе предварительной инкубации с РАМ тестируемыми соединениями (т.е. до внесения L-глутамата в концентрации, равной ЕС 20), указывали на наличие агонистической активности, отсутствие таких сигналов являлось демонстрацией отсутствия агонистической активности. Ослабление сигнала, наблюдаемое после добавления L-глутамата в концентрации, равной ЕС 20, указывало на наличие ингибирующей активности у тестируемого соединения. В приведенной ниже таблице показаны полученные соединения 1-24 со своими соответствующими данными (ЕС 50 в нМ). Соединения из примеров 18, 20-22 протестированы в отношении рецептора mGluR5 с использованием следующего метода. Для проведения экспериментов по связыванию клетки EBNA подвергали временной трансфекции кДНК, кодирующей рецептор mGlu5a человека, используя методику, описанную Шлягером и Кристенсеном (Schlaeger and Christensen, Cytotechnology, 15: 1-13 (1998. Гомогенаты клеточных мембран хранили при -80 С до дня проведения анализа, после чего их оттаивали и ресуспендировали и политронизировали в содержащем 15 мМ Трис-HCl, 120 мМ NaCl, 100 мМ KCl, 25 мМ CaCl2, 25 мМ MgCl2 буфере для связывания при рН 7,4 до получения конечной концентрации в анализе, равной 20 мкг белка/лунка. Изотермы насыщения получали путем добавления двенадцати концентраций [3 Н]МРЕР (0,04-100 нМ) к этим мембранам (в общем объеме 200 мкл) в течение 1 ч при 4 С. Эксперименты по конкуренции проводили при фиксированной концентрации [3 Н]МРЕР (2 нМ) и величины IC50 для тестируемых соединений определяли по 11 концентрациям (0,3-10000 нМ). Инкубацию проводили в течение 1 ч при 4 С. По окончании инкубации мембраны отфильтровывали на унифильтре (96-луночный белый микропланшет с прикрепленным GF/C-фильтром, предварительно инкубированным в течение 1 ч в содержащем 0,1% PEI буфере для промывки, Packard BioScience, Meriden, СТ) с использованием харвестера Filtermate 96 (Packard BioScience) и промывали 3 раза холодным 50 мМ Трис-HCl-буфером, рН 7,4. Неспецифическое связывание измеряли в присутствии 10 мкМ МРЕР. Радиоактивность на фильтре подсчитывали (3 мин) с помощью сцинтилляционного счетчика для микропланшетов Packard Top-count с коррекцией гашения после добавления 45 мкл сцинтилляционной жидкости микросцинт 40 (Canberra PackardS.A., Zrich, Switzerland) и встряхивания в течение 20 мин. Для функциональных анализов проводили измерения [Ca2+]i, как описано ранее Портером и др.mGlu5a человека. Эти клетки нагружали красителем, используя Fluo 4-AM (получен от FLUKA, конечная концентрация 0,2 мкМ). Измерения [Ca2+]i проводили с использованием планшетного ридера для визуализации флуориметрическим методом (FLIPR, Molecular Devices Corporation, La Jolla, CA, USA). Оценку антагонистического действия проводили после предварительной 5-минутной инкубации с тестируемыми соединениями, за которой следовало добавление субмаксимального количества агониста. Аппроксимацию кривых ингибирования (антагонистического действия) проводили с помощью четырехпараметрического логистического уравнения, получая IC50 и коэффициент Хилла при использовании программного обеспечения для итеративной нелинейной аппроксимации кривых (Xcel fit). Для экспериментов по связыванию приведены величины Ki для тестируемых соединений. Величины Ki определяют по следующей формуле: в которой величины IC50 означают концентрации тестируемых соединений, которые приводят к 50%-ному ингибированию конкурирующего радиоактивного лиганда ([3 Н]МРЕР). L означает концентрацию радиоактивного лиганда, использованную в эксперименте по связыванию, и величина Kd для радиоактивного лиганда определяется эмпирически для каждой партии приготовленных мембран. Список соединений из примеров Соединения формулы (I) и фармацевтически приемлемые соли могут быть использованы в качестве лекарственных средств, например, в форме фармацевтических препаратов. Эти фармацевтические препараты можно вводить перорально, например, в форме таблеток, таблеток, покрытых оболочкой, драже,твердых и мягких желатиновых капсул, растворов, эмульсий или суспензий. Однако эффективным также может быть их ректальное введение, например, в форме суппозиториев, или парентерально, например, в форме растворов для инъекций. Для изготовления фармацевтических препаратов соединения формулы (I) и их фармацевтически приемлемые соли можно обрабатывать, используя фармацевтически инертные неорганические или органические носители. Например, в качестве таких носителей для таблеток, таблеток, покрытых оболочкой,драже и твердых желатиновых капсул можно использовать лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и им подобное. Подходящими носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и им подобное; в случае мягких желатиновых капсул никаких носителей обычно не требуется,однако это зависит от природы активного вещества. Подходящими носителями для изготовления растворов и сиропов являются, например, вода, полиолы, сахароза, инвертированный сахар, глюкоза и им подобное. Для водных растворов для инъекций водорастворимых солей соединений формулы (I) могут быть использованы такие адъюванты, как спирты, полиолы, глицерин, растительные масла и им подобное, однако, как правило, в этом нет необходимости. Подходящими носителями для суппозиториев являются, например природные или отвержденные жиры, воски, жиры, полужидкие или жидкие полиолы и им подобное. Помимо этого фармацевтические препараты могут содержать консерванты, солюбилизаторы, стабилизаторы, увлажняющие агенты, эмульгаторы, подсластители, красители, корригенты, соли для изменения осмотического давления, буферы, маскирующие агенты или антиоксиданты. Они также могут содержать другие дополнительные терапевтически полезные вещества. Как упомято ранее, лекарственные средства, содержащие соединение формулы (I) или его фармацевтически приемлемые соли и терапевтически инертный эксципиент, также представляют собой пред-9 023146 мет настоящего изобретения, равно как и способ изготовления таких лекарственных средств, который включает внесение одного или более чем одного соединения формулы I или одной или более чем одной их фармацевтически приемлемой соли и, при желании, одного или более чем одного другого терапевтически полезного вещества в лекарственную форму в виде галенова препарата вместе с одним или более чем одним терапевтически инертным носителем. Как еще упоминалось ранее, применение соединений формулы (I) для изготовления лекарственных средств, полезных в предупреждении и/или лечении перечисленных выше заболеваний, также представляет собой предмет настоящего изобретения. Дозировка может варьировать в широких пределах и, несомненно, в каждом конкретном случае должна быть подобрана с учетом индивидуальных потребностей. В общем случае эффективная дозировка для перорального или парентерального введения составляет 0,01-20 мг/кг/сутки, причем для всех описанных показаний дозировка 0,1-10 мг/кг/сутки является предпочтительной. Суточная дозировка для взрослого человека массой 70 кг соответственно лежит в диапазоне 0,7-1400 мг в сутки, предпочтительно от 7 до 700 мг в сутки. Изготовление фармацевтических композиций, содержащих соединения по изобретению Пример А. Таблетки следующего состава готовили традиционным способом 1 Н-Бензотриазол (2,14 г; 18,0 ммоль; 4 экв.) растворяли в дихлорметане (25 мл) и добавляли тионилхлорид (330 мкл; 4,5 ммоль; 1 экв.) при комнатной температуре. Добавляли 3-метил-бут-2-еновую кислоту [CAS 541-47-9] (450 мг; 4,5 ммоль) и смесь перемешивали в течение 2 ч при комнатной температуре. Суспензию фильтровали и фильтрат один раз экстрагировали 2 н. раствором NaOH и дважды дихлорметаном. Органические экстракты объединяли, сушили над сульфатом натрия и упаривали досуха. Неочищенный продукт очищали флэш-хроматографией на колонке силикагеля, элюируя градиентом этилацетат:циклогексан (от 0:100 до 50:50). Желаемый 1-бензотриазол-1-ил-3-метил-бут-2-ен-1-он (810 мг; выход 90%) получали в виде светло-желтого твердого вещества, MS: m/e = 202,1 (М+Н+). Стадия 2. 2-(5-Бромпиридин-2-ил)-5,5-диметилпиразолидин-3-он 1-Бензотриазол-1-ил-3-метил-бут-2-ен-1-он (пример 1, стадия 1) (400 мг; 2,0 ммоль), (5-бромпиридин-2-ил)гидразин (410 мг; 2,2 ммоль; 1,1 экв.) и Et3N (1,95 мл; 14,0 ммоль; 7 экв.) растворяли вместе в THF (2 мл) и перемешивали в течение 90 мин при температуре дефлегмации. Реакционную смесь охлаждали и экстрагировали насыщенным раствором Na2CO3 и два раза этилацетатом. Органические экстракты экстрагировали рассолом, сушили над сульфатом натрия и упаривали досуха. Неочищенный продукт очищали флэш-хроматографией на колонке силикагеля, элюируя градиентом этилацетат:циклогексан от 0:100 до 50:50. Желаемый 2-(5-бромпиридин-2-ил)-5,5-диметилпиразолидин-3-он Дихлорид бис-(трифенилфосфин)палладия(II) (27 мг; 39 мкмоль; 0,05 экв.) растворяли в 2 мл THF. При комнатной температуре добавляли 2-(5-бромпиридин-2-ил)-5,5-диметилпиразолидин-3-он (пример 1, стадия 2) (210 мг; 770 мкмоль) и фенилацетилен (130 мг; 1,24 ммоль; 1,6 экв.). Добавляли триэтиламин(325 мкл; 2,33 ммоль; 3 экв.), трифенилфосфин (6 мг; 23,3 мкмоль; 0,03 экв.) и иодид меди(I) (4 мг; 23,3 мкмоль; 0,03 экв.) и смесь перемешивали в течение 16 ч при 65 С. Реакционную смесь охлаждали и экстрагировали насыщенным раствором NaHCO3 и два раза небольшим объемом дихлорметана. Неочищенный продукт очищали флэш-хроматографией, непосредственно нанося слои в дихлорметане на колонку силикагеля, элюируя градиентом этилацетат:гептан от 0:100 до 100:0. Желаемый 5,5-диметил-2-(5 фенилэтинил-пиридин-2-ил)-пиразолидин-3-он (102 мг; выход 45%) получали в виде белого твердого вещества, MS: m/e = 292,1 (М+Н+). Пример 2. (RS)-5-Изопропил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он Указанное в заголовке соединение получали в виде бесцветной жидкости, MS: m/e = 215 (М+Н+),используя химические реакции, аналогичные описанным в примере 1, стадия 1, из 4-метилпент-2-еновой кислоты [CAS 10321-71-8] и 1 Н-бензотриазола. Стадия 2. (RS)-2-(5-Бромпиридин-2-ил)-5-изопропилпиразолидин-3-он Указанное в заголовке соединение получали в виде светло-желтого масла, MS: m/e = 284,0/286,0 Указанное в заголовке соединение получали в виде светло-желтого масла, MS: m/e = 306,1 (М+Н+),используя химические реакции, аналогичные описанным в примере 1, стадия 3, из (RS)-2-(5 бромпиридин-2-ил)-5-изопропилпиразолидин-3-она (пример 2, стадия 2) и фенилацетилена. Пример 3. 1,5,5-Триметил-2-(5-фенилэтинил-пиридин-2-ил)пиразолидин-3-он 5,5-Диметил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он (35 мг; 120 мкмоль) (пример 1, стадия 4) растворяли в ACN (2 мл). Добавляли K2CO3 (33 мг; 240 мкмоль; 2 экв.) и иодметан (22 мг; 156 мкмоль; 1,3 экв.) и смесь перемешивали в течение 16 ч при 80 С. Реакционную смесь упаривали, экстрагировали водой и два раза этилацетатом. Органические слои экстрагировали рассолом, сушили с использованием сульфата натрия и упаривали досуха. Неочищенный продукт очищали обращенно-фазовой колоночной хроматографией. Желаемый 1,5,5-триметил-2-(5-фенилэтинил-пиридин-2-ил)-пиразолидин-3 он (18 мг; выход 49%) получали в виде бесцветного масла, MS: m/e = 306,2 (М+Н+). Указанное в заголовке соединение получали в виде коричневого масла, MS: m/e = 306,2 (М+Н+),используя химические реакции, аналогичные описанным в примере 1, стадия 3, из 2-(5-бромпиридин-2 ил)-5,5-диметилпиразолидин-3-она (пример 1, стадия 2) и м-толилацетилена. Стадия 2. 1,5,5-Триметил-2-(5-м-толилэтинилпиридин-2-ил)пиразолидин-3-он Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 320,2 Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 310,2 (М+Н+), используя химические реакции, аналогичные описанным в примере 1, стадия 3, из 2-(5 бромпиридин-2-ил)-5,5-диметилпиразолидин-3-она (пример 1, стадия 2) и 1-этинил-3-фторбензола. Пример 6. 2-[5-(3-Фторфенилэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он Указанное в заголовке соединение получали в виде бесцветного масла, MS: m/e = 324,2 (М+Н+), используя химические реакции, аналогичные описанным в примере 3, из 2-[5-(3-фторфенилэтинил) пиридин-2-ил]-5,5-диметилпиразолидин-3-она (пример 5). Пример 7. 2-[5-(3-Хлорфенилэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e = 326,1/328,1 (М+Н+), используя химические реакции, аналогичные описанным в примере 1, стадия 3, из 2(5-бромпиридин-2-ил)-5,5-диметилпиразолидин-3-она (пример 1, стадия 2) и 1-этинил-3-хлорбензола. Стадия 2. 2-[5-(3-Хлорфенилэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 340,1/342,1 (М+Н+), используя химические реакции, аналогичные описанным в примере 3, из 2-[5-(3 хлорфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-она (пример 7, стадия 1). Пример 8. 2-[5-(4-Фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 310,1 Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 271,2/273,1 (М+Н+), используя химические реакции, аналогичные описанным в примере 1, стадия 2, из 1 бензотриазол-1-ил-3-метилбут-2-ен-1-она (пример 1, стадия 1) и (5-бромпиримидин-2-ил)гидразина. Стадия 2. 5,5-Диметил-2-(5-фенилэтинилпиримидин-2-ил)пиразолидин-3-он Указанное в заголовке соединение получали в виде светло-серого твердого вещества, MS: m/e = 293,2 (М+Н+), используя химические реакции, аналогичные описанным в примере 1, стадия 3, из 2-(5 бромпиримидин-2-ил)-5,5-диметилпиразолидин-3-она (пример 9, стадия 1) и фенилацетилена. Пример 10. (RS)-1-(5-Фенилэтинилпиридин-2-ил)-тетрагидропирроло[1,2-b]пиразол-2-он Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 258/260 2-Бром-5-фенилэтинилпиридин (150 мг; 0,58 ммоль) (пример 10, стадия 1) растворяли в толуоле (2 мл) и добавляли (RS)-тетрагидропирроло[1,2-b]пиразол-2-он [CAS 1159091-93-6] (73 мг; 0,58 ммоль; 1,0 экв.), карбонат цезия (280 мг; 0,87 ммоль; 1,5 экв.), ксантфос [CAS 161265-03-8] (14 мг; 0,02 ммоль; 0,04 экв.) и Pd2(dba)3 (11 мг; 0,01 ммоль; 0,02 экв.) в атмосфере азота. Смесь перемешивали в течение 3 ч при 100C. Неочищенный продукт очищали флэш-хроматографией, непосредственно нанося смесь в толуоле на колонку силикагеля и элюируя градиентом этилацетатхептан от 0:100 до 100:0. Желаемый (RS)-1-(5 фенилэтинилпиридин-2-ил)тетрагидропирроло[1,2-b]пиразол-2-он (17 мг; выход 9%) получали в виде светло-коричневого твердого вещества, MS: m/e = 304,1 (М+Н+). Пример 11. (RS)-1-(5-Фенилэтинилпиримидин-2-ил)тетрагидропирроло[1,2-b]пиразол-2-он Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 259,0/261,0 (М+Н+), используя химические реакции, аналогичные описанным в примере 1, стадия 3, из 2 бром-5-иодпиримидина (CAS 905856-70-4) и фенилацетилена. Стадия 2. (RS)-1-(5-Фенилэтинилпиримидин-2-ил)тетрагидропирроло[1,2-b]пиразол-2-он Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e = 305,1 (М+Н+), используя химические реакции, аналогичные описанным в примере 10, стадия 2, из 2 бром-5-фенилэтинилпиримидина (пример 11, стадия 1) и (RS)-тетрагидропирроло[1,2-b]пиразол-2-она Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e = 283,0/285,0 (М+Н+), используя химические реакции, аналогичные описанным в примере 10, стадия 2, из 2-иод-5-бромпиримидина и (RS)-тетрагидропирроло[1,2-b]пиразол-2-она (CAS 1159091-93-6). Стадия 2. (RS)-1-[5-(3-Фторфенилэтинил)пиримидин-2-ил]тетрагидропирроло[1,2-b]пиразол-2-он Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 323,1 (М+Н+), используя химические реакции, аналогичные описанным в примере 1, стадия 3, из (RS)-1(5-бромпиримидин-2-ил)тетрагидропирроло[1,2-b]пиразол-2-она (пример 12, стадия 1) и 3 фторфенилацетилена. Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e = 323,1 Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e = 307,2 (М+Н+), используя химические реакции, аналогичные описанным в примере 3, из 5,5-диметил-2-(5 фенилэтинилпиримидин-2-ил)пиразолидин-3-она (пример 9, стадия 2) и иодметана. Пример 15. 2-[5-(3-Фторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 215,2 Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e = 371,1/373,0 (М+Н+), используя химические реакции, аналогичные описанным в примере 10, стадия 2, из 2-иод-5-бромпиримидина и 5,5-диметил-3-оксопиразолидин-1-карбоновой кислоты трет-бутилового эфира (пример 15, стадия 1). Стадия 3. 2-[5-(3-Фторфенилэтинил)пиримидин-2-ил]-5,5-диметил-3-оксопиразолидин-1 карбоновой кислоты трет-бутиловый эфир Указанное в заголовке соединение получали в виде коричневого твердого вещества, MS: m/e = 411,2 (М+Н+), используя химические реакции, аналогичные описанным в примере 1, стадия 3, из 2-(5 бромпиримидин-2-ил)-5,5-диметил-3-оксопиразолидин-1-карбоновой кислоты трет-бутилового эфира 2-[5-(3-Фторфенилэтинил)пиримидин-2-ил]-5,5-диметил-3-оксопиразолидин-1-карбоновой кислоты трет-бутиловый эфир (118 мг; 0,29 ммоль) (пример 15, стадия 3) растворяли в дихлорметане (2 мл), добавляли TFA (0,55 мл; 7,2 ммоль; 25 экв.) при комнатной температуре и перемешивали в течение 16 ч. Реакционную смесь экстрагировали насыщенным раствором Na2CO3 и небольшим количеством дихлорметана. Органический экстракт загружали непосредственно на колонку силикагеля. Неочищенный продукт очищали флэш-хроматографией на колонке силикагеля, элюируя градиентом этилацетатгептан от 0:100 до 100:0. Желаемый 2-[5-(3-фторфенилэтинил)пиримидин-2-ил]-5,5-диметилпиразолидин-3-он (61 мг; выход 69%) получали в виде светло-желтого твердого вещества, MS: m/e = 311,2 (М+Н+). Стадия 5. 2-[5-(3-Фторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он Указанное в заголовке соединение получали в виде светло-коричневого 5 твердого вещества, MS: Указанное в заголовке соединение получали в виде оранжевого твердого вещества, MS: m/e = 411,2 Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 311,2 (М+Н+), используя химические реакции, аналогичные описанным в примере 15, стадия 4, из 2-[5(4-фторфенилэтинил)пиримидин-2-ил]-5,5-диметил-3-оксопиразолидин-1-карбоновой кислоты третбутилового эфира (пример 16, стадия 1). Стадия 3. 2-[5-(4-Фторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 325,3 (М+Н+), используя химические реакции, аналогичные описанным в примере 3, из 2-[5-(4 фторфенилэтинил)пиримидин-2-ил]-5,5-диметилпиразолидин-3-она (пример 16, стадия 2) и иодметана. Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e = 271,1/273,1 (М+Н+), используя химические реакции, аналогичные описанным в примере 10, стадия 2, из 2-иод-5-бромпиримидина и 5,5-диметилпиразолидин-3-она (CAS 24572-33-6). Стадия 2. 2-(5-Бромпиримидин-2-ил)-1,5,5-триметилпиразолидин-3-он Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 285,0/286,9 (М+Н+), используя химические реакции, аналогичные описанным в примере 3, из 2-(5-бромпиримидин-2-ил)-5,5-диметилпиразолидин-3-она (пример 17, стадия 1) и иодметана. Стадия 3. 2-[5-(2,5-Дифторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 343,3 Указанное в заголовке соединение, желтое твердое вещество, MS: m/e = 293,2/295,2 (М+Н+), может быть получено с использованием химических реакций, аналогичных описанным в примере 1, стадия 3, из 2-бром-5-иодпиридина и 2-хлор-4-этинил-пиридина (CAS 945717-09-9). Стадия 2. 2-(5-(2-Хлорпиридин-4-илэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он Указанное в заголовке соединение получали в виде желтого твердого вещества, MS: m/e = 327,4/329,4 (М+Н+), используя химические реакции, аналогичные описанным в примере 10, стадия 2, из 2-бром-5-фенилэтинилпиримидина (пример 18, стадия 1) и 5,5-диметилпиразолидин-3-она (CAS 2457233-6). Стадия 3. 2-[5-(2-Хлорпиридин-4-илэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 341,4/343,3 (М+Н+), используя химические реакции, аналогичные описанным в примере 3, из 2-[5-(2 хлор-пиридин-4-илэтинил)-пиридин-2-ил]-5,5-диметилпиразолидин-3-она (пример 18, стадия 2) и иодметана. Пример 19. 2-[6-(2,5-Дифторфенилэтинил)пиридазин-3-ил]-5,5-диметилпиразолидин-3-он Указанное в заголовке соединение получали в виде желтого масла, MS: m/e = 227,1/229,3 (М+Н+),используя химические реакции, аналогичные описанным в примере 1, стадия 2, из 1-бензотриазол-1-ил 3-метилбут-2-ен-1-она (пример 1, стадия 1) и (6-хлорпиридазин-3-ил)гидразина (CAS 17284-97-8). Стадия 2. 2-[6-(2,5-Дифторфенилэтинил)пиридазин-3-ил]-5,5-диметилпиразолидин-3-он Указанное в заголовке соединение получали в виде светло-желтого твердого вещества, MS: m/e = 329,2 (М+H+), используя химические реакции, аналогичные описанным в примере 1, стадия 3, из 2-(6 хлорпиридазин-3-ил)-5,5-диметилпиразолидин-3-она (пример 19, стадия 1) и 2,5-дифторфенилацетилена Указанное в заголовке соединение, коричневое масло, MS: m/e = 328,1 (М+Н+), может быть получено с использованием химических реакций, аналогичных описанным в примере 1, стадия 3, из 2-(5 бромпиридин-2-ил)-5,5-диметилпиразолидин-3-она (пример 1, стадия 2) и 2,5-дифторфенилацетилена Указанное в заголовке соединение получали в виде желтого масла, MS: m/e = 320,4 (М+Н+), используя химические реакции, аналогичные описанным в примере 10, стадия 2, из 2-бром-5-фенилэтинилпиридина (пример 10, стадия 1) и 1-этил-5,5-диметилпиразолидин-3-она (CAS 26485-97-2). Пример 22. 1-Этил-2-[5-(4-фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он 2-Фтор-5-иодпиридин (200 мг; 0,90 ммоль) растворяли в толуоле (1 мл) и в атмосфере азота добавляли 1-этил-5,5-диметилпиразолидин-3-он [CAS 26485-97-2] (128 мг; 0,90 ммоль; 1,0 экв.) и карбонат цезия (440 мг; 1,35 ммоль; 1,5 экв.). Смесь перемешивали в течение 4 ч при 100C. Неочищенный продукт очищали флэш-хроматографией, непосредственно нанося смесь в толуоле на колонку силикагеля и элюируя градиентом этилацетаттептан от 0:100 до 50:50. Желаемый 1-этил-2-(5-иодпиридин-2-ил)-5,5 диметилпиразолидин-3-он (88 мг; выход 28%) получали в виде желтого масла, MS: m/e = 346,3 (М+Н+). Стадия 2. 1-Этил-2-[5-(4-фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он Указанное в заголовке соединение получали в виде белого твердого вещества, MS: m/e = 338,4 Указанное в заголовке соединение получали в виде светло-желтого масла, MS: m/e = 334,4 (М+Н+),используя химические реакции, аналогичные описанным в примере 10, стадия 2, из 2-бром-5 фенилэтинилпиридина (пример 10, стадия 1) и (RS)-1-этил-5-изопропилпиразолидин-3-она (CAS 1185083-91-3). Пример 24. (RS)-5-Метил-2-(5-фенилэтинилпиридин-2-ил)-5-трифторметилпиразолидин-3-он 4,4,4-Трифтор-3-метил-бут-2-еновой кислоты этиловый эфир (CAS 24490-03-7) (300 мг; 1,65 ммоль) растворяли в этаноле (3 мл), добавляли гидразина моногидрат (64%-ный в этаноле; 0,13 мл; 1,73 моль; 1,05 экв.) при комнатной температуре и перемешивали в герметично закрытой пробирке в течение 16 ч при 80 С. Реакционную смесь упаривали досуха. Желаемый (RS)-5-метил-5-трифторметилпиразолидин 3-он (280 мг; колич.) получали в виде белого твердого вещества, MS: m/e = 169,2 (М+Н+). Стадия 1. (RS)-5-Метил-2-(5-фенилэтинилпиридин-2-ил)-5-трифторметилпиразолидин-3-он Указанное в заголовке соединение получали в виде желтого масла, MS: m/e = 346,4 (М+Н+), используя химические реакции, аналогичные описанным в примере 10, стадия 2, из 2-бром-5-фенилэтинилпиридина (пример 10, стадия 1) и (RS)-5-метил-5-трифторметилпиразолидин-3-она (пример 24, стадия 1).G представляет собой N или СН; при условии, что только один из X или G может представлять собой азот;R1 представляет собой фенил или пиридил, которые возможно замещены атомом галогена или С 1 алкилом;R2 представляет собой водород, С 1-2 алкил или может образовывать вместе с R4 С 3-С 5-циклоалкил;R3/R3'/R4/R4' независимо друг от друга представляют собой водород, C1-3 алкил или CF3. 2. Соединение формулы IA по п.1 где R1 представляет собой фенил или пиридил, которые возможно замещены атомом галогена или С 1 алкилом;R2 представляет собой водород, С 1-2 алкил или может образовывать вместе с R4 С 3-С 5-циклоалкил;R3/R3'/R4/R4' независимо друг от друга представляют собой водород, С 1-3 алкил или CF3. 3. Соединение формулы IA по любому из пп.1, 2, представляющее собой 5,5-диметил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,(RS)-5-изопропил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,1,5,5-триметил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,1,5,5-триметил-2-(5-м-толилэтинилпиридин-2-ил)пиразолидин-3-он,2-[5-(3-фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,2-[5-(3-фторфенилэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он,2-[5-(3-хлорфенилэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он,2-[5-(4-фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,(RS)-1-(5-фенилэтинилпиридин-2-ил)тетрагидропирроло[1,2-b]пиразол-2-он,2-[5-(2-хлорпиридин-4-илэтинил)пиридин-2-ил]-1,5,5-триметилпиразолидин-3-он,2-[5-(2,5-дифторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,1-этил-5,5-диметил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он,1-этил-2-[5-(4-фторфенилэтинил)пиридин-2-ил]-5,5-диметилпиразолидин-3-он,(RS)-1-этил-5-изопропил-2-(5-фенилэтинилпиридин-2-ил)пиразолидин-3-он или где R1 представляет собой фенил, которые возможно замещены атомом галогена или С 1 алкилом;R2 представляет собой водород, С 1 алкил или может образовывать вместе с R4 С 3-С 5-циклоалкил;R3/R3'/R4/R4' независимо друг от друга представляют собой водород или С 1 алкил. 5. Соединение формулы IB по любому из пп.1 и 4, представляющее собой 5,5-диметил-2-(5-фенилэтинилпиримидин-2-ил)пиразолидин-3-он,(RS)-1-(5-фенилэтинилпиримидин-2-ил)тетрагидропирроло[1,2-b]пиразол-2-он,(RS)-1-[5-(3-фторфенилэтинил)пиримидин-2-ил]тетрагидропирроло[1,2-b]пиразол-2-он,(RS)-1-[5-(4-фторфенилэтинил)пиримидин-2-ил]тетрагидропирроло[1,2-b]пиразол-2-он,1,5,5-триметил-2-(5-фенилэтинилпиримидин-2-ил)пиразолидин-3-он,2-[5-(3-фторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он,2-[5-(4-фторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он или 2-[5-(2,5-дифторфенилэтинил)пиримидин-2-ил]-1,5,5-триметилпиразолидин-3-он.R3/R3'/R4/R4' независимо друг от друга представляют собой водород или С 1 алкил. 7. Соединение формулы IC по любому из пп.1 и 6, представляющее собой 2-[6-(2,5-дифторфенилэтинил)пиридазин-3-ил]-5,5-диметилпиразолидин-3-он. 8. Применение соединения по любому из пп.1-7 в качестве положительного аллостерического модулятора mGluR5. 9. Фармацевтическая композиция для положительного аллостерического модулирования mGluR5,содержащая соединение по любому из пп.1-7 и терапевтически активный носитель. 10. Применение соединения по любому из пп.1-7 для лечения шизофрении или когнитивных заболеваний. 11. Применение соединения по любому из пп.1-7 для изготовления лекарственного средства для лечения шизофрении или когнитивных заболеваний. 12. Способ лечения шизофрении или когнитивных заболеваний, включающий введение эффективного количества соединения, которое определено в любом из пп.1-7.
МПК / Метки
МПК: C07D 487/04, A61P 25/00, C07D 401/04, C07D 403/04, A61K 31/45
Метки: пиразолидин-3-она, производные
Код ссылки
<a href="https://eas.patents.su/22-23146-proizvodnye-pirazolidin-3-ona.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиразолидин-3-она</a>
Предыдущий патент: Диаминные соединения и их применение для обратной пенной флотации силиката из железных руд
Следующий патент: Трансдермальный пластырь для лечения мигрени
Случайный патент: Система очистки и оздоровления воздуха (варианты)