Аккумуляция омега-7 жирных кислот в семенах растений
Номер патента: 22985
Опубликовано: 29.04.2016
Авторы: Уиттл Эдвард Дж., Уолш Теренс А., Нгуйен Там Хуу, Шанклин Джон, Пидкович Марк С.
Формула / Реферат
1. Молекула нуклеиновой кислоты, кодирующая Δ9 десатуразный фермент, где молекула нуклеиновой кислоты включает нуклеотидную последовательность, по меньшей мере на 60% идентичную SEQ ID NO:1, функционально связанную с регуляторным элементом гена.
2. Молекула нуклеиновой кислоты по п.1, где регуляторный элемент гена представляет собой промотор фазеолина или промотор LTP170.
3. Δ9 десатуразный фермент, включающий аминокислотную последовательность, по меньшей мере на 80% идентичную SEQ ID NO:2, включающую серин в положении, аналогичном положению 114 в SEQ ID NO:2; аргинин в положении, аналогичном положению 117 в SEQ ID NO:2; цистеин в положении, аналогичном положению 118 в SEQ ID NO:2; лейцин в положении, аналогичном положению 179 в SEQ ID NO:2; и/или треонин в положении, аналогичном положению 188 в SEQ ID NO:2.
4. Δ9 десатуразный фермент по п.3, где аминокислотная последовательность включает серин в положении, аналогичном положению 114 в SEQ ID NO:2; аргинин в положении, аналогичном положению 117 в SEQ ID NO:2; цистеин в положении, аналогичном положению 118 в SEQ ID NO:2; лейцин в положении, аналогичном положению 179 в SEQ ID NO:2; и треонин в положении, аналогичном положению 188 в SEQ ID NO:2.
5. Способ увеличения количества w-7 жирных кислот в растительном материале, причем способ включает трансформацию растительного материала молекулой нуклеиновой кислоты по п.1, с тем чтобы количество w-7 жирных кислот в указанном растительном материале увеличивалось.
6. Способ по п.5, дополнительно включающий трансформацию растительного материала дополнительными молекулами нуклеиновой кислоты по п.1.
7. Способ по п.5, где растительный материал включает средство повышения уровней 16:0-АПБ в растительном материале.
8. Способ по п.7, где средство повышения уровней 16:0-АПБ в растительном материале представляет собой экспрессию внепластидной десатуразы.
9. Способ по п.7, где средство повышения уровней 16:0-АПБ в растительном материале представляет собой подавление KASII.
10. Способ по п.9, где подавление KASII обеспечивается введением мутации в ген fab1.
11. Способ по п.7, где средство повышения уровней 16:0-АПБ в растительном материале представляет собой снижение элонгации жирных кислот 16:0 в растительном материале.
12. Способ по п.11, где снижение элонгации жирных кислот 16:0 в растительном материале обеспечивается введением мутации в ген fae1.
13. Способ по п.5, где растительный материал получают из растения, выбранного из рода, выбранного из группы, включающей Arabidopsis, Borago, канолу, Ricinus, Theobroma, Zea, Gossypium, Crambe, Cuphea, Linum, Lesquerella, Limnanthes, Linola, Tropaeolum, Oenothera, Olea, Elaeis, Arachis, рапс, Carthamus, Glycine, Soja, Helianthus, Nicotiana, Vernonia, Triticum, Hordeum, Oryza, Avena, Sorghum, Secale или другие представители Gramineae.
14. Способ по п.5, где растительный материал включает два средства повышения уровней 16:0-АПБ в растительном материале.
15. Способ по п.14, где первое средство повышения уровней 16:0-АПБ в растительном материале представляет собой подавление KASII и где второе средство повышения уровней 16:0-АПБ в растительном материале представляет собой снижение элонгации жирных кислот 16:0 в растительном материале.
16. Способ по п.5, где растительный материал включает три средства повышения уровней 16:0-АПБ в растительном материале.
17. Способ по п.16, где первое средство повышения уровней 16:0-АПБ в растительном материале представляет собой подавление KASII, где второе средство повышения уровней 16:0-АПБ в растительном материале представляет собой снижение элонгации жирных кислот 16:0 в растительном материале и где третье средство повышения уровней 16:0-АПБ в растительном материале представляет собой экспрессию внепластидной десатуразы.
18. Способ по п.8, где внепластидная десатураза представляет собой LnΔ9D или AnΔ9 десатуразу.
19. Способ создания генетически сконструированного растения, содержащего повышенное количество w-7 жирных кислот в растении по сравнению с растением дикого типа, причем способ включает
трансформацию растительного материала молекулой нуклеиновой кислоты по п.1; и
культивирование трансформированного растительного материала с получением растения.
20. Способ по п.19, где растение выбрано из рода, выбранного из группы, включающей Arabidopsis, Borago, канолу, Ricinus, Theobroma, Zea, Gossypium, Crambe, Cuphea, Linum, Lesquerella, Limnanthes, Linola, Tropaeolum, Oenothera, Olea, Elaeis, Arachis, рапс, Carthamus, Glycine, Soja, Helianthus, Nicotiana, Vernonia, Triticum, Hordeum, Oryza, Avena, Sorghum, Secale или другие представители Gramineae.
21. Растение, полученное способом по п.19.
22. Растительный материал, полученный из растения по п.21.
23. Растительный материал по п.22, где растительный материал представляет собой семена.

Текст
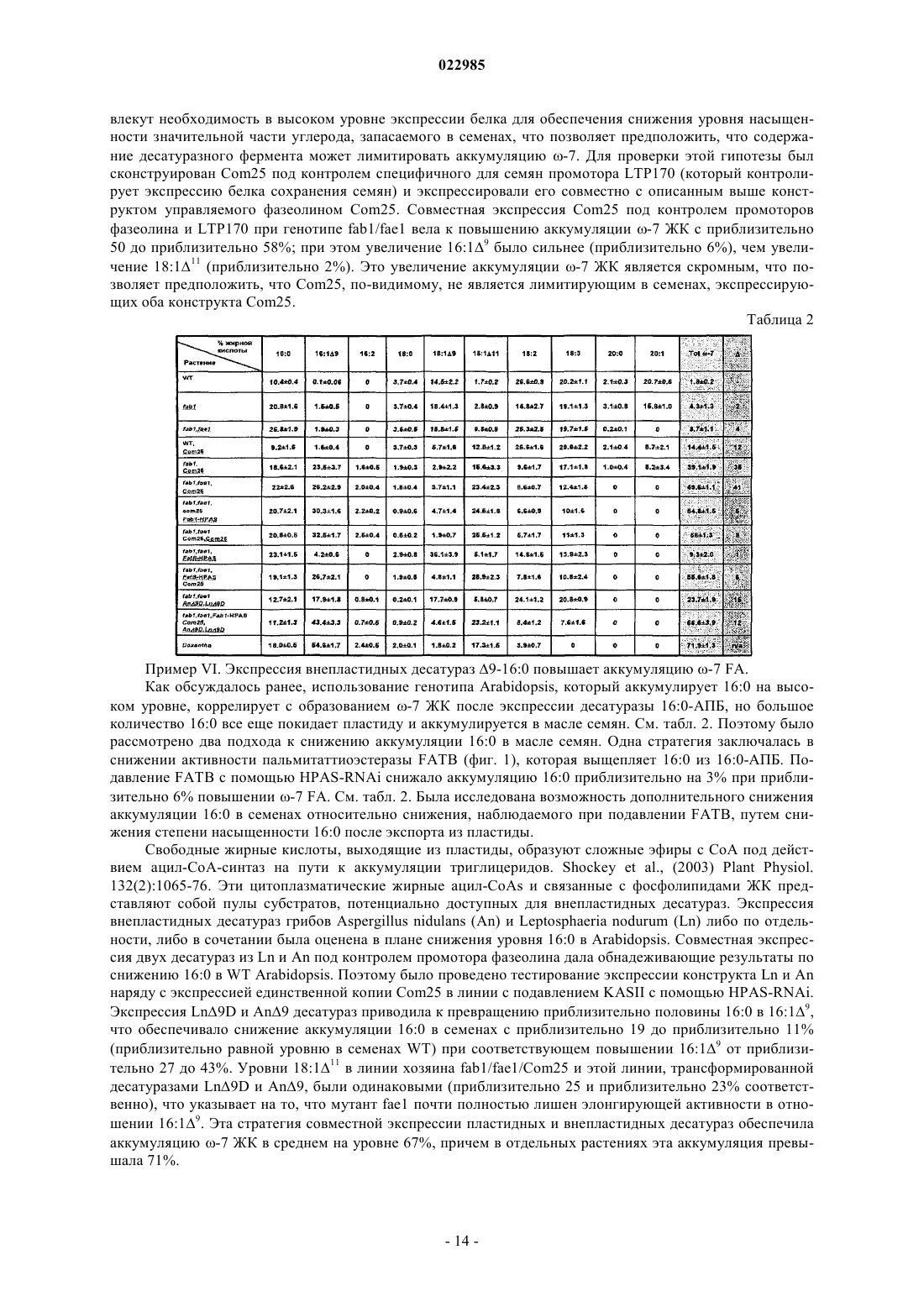
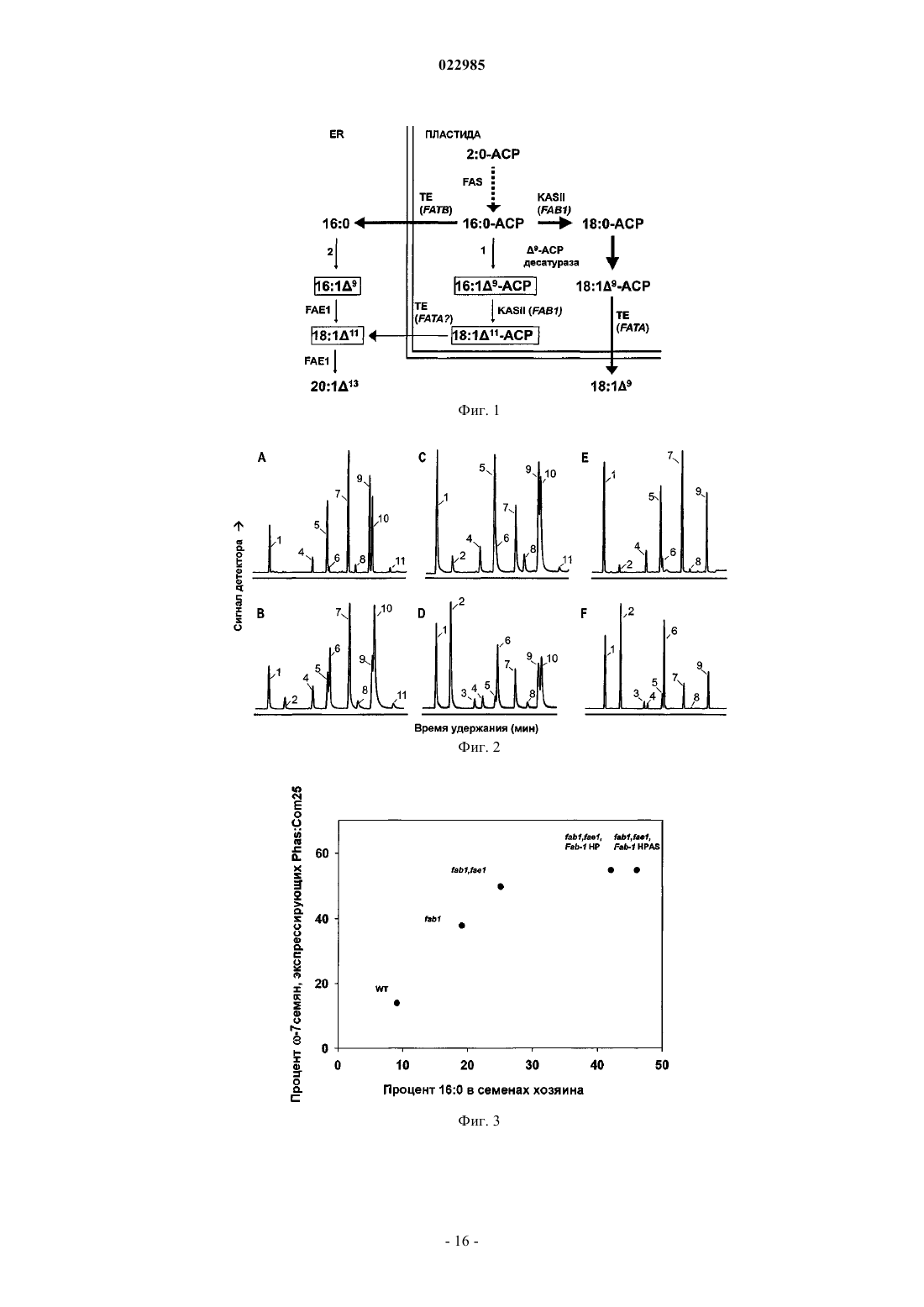
Композиции и способы включают генетическое кодирование и экспрессию новой десатуразы 9-18:0 АПБ в растительных клетках. В некоторых вариантах осуществления молекулы нуклеиновой кислоты кодируют новую десатуразу 9-18:0 АПБ. В других вариантах осуществления аминокислотные последовательности обладают 9-18:0 АПБ десатуразной активностью. Способы могут включать экспрессию десатуразы 9-18:0 АПБ в клетках растений, растительных материалах и целых растениях с целью повышения количества необычных жирных кислот в целых растениях,семенах растений и растительных материалах, например семенах. Изобретение создано на основе CRADA (С-05-11) между Dow AgroScience LLC и Brookhaven Sciences Associates, LLC, работающих на энергетический департамент Соединенных Штатов. Правительство имеет определенные права на это изобретение. Требование приоритета По настоящей заявке испрашивается приоритет даты подачи предварительной патентной заявки Соединенных Штатов с порядковым номером 61/358318, зарегистрированной 24 июня 2010 г. как "Аккумуляция N-7 жирных кислот в семенах растений". Область техники, к которой относится изобретение В конкретных вариантах осуществления изобретение относится к новой мутантной 9-18:0-АСР десатуразе Ricinus, обозначаемой Com25, которая работает в качестве 9-16:0-АСР десатуразы. Другой вариант осуществления относится к способам метаболического конструирования для манипулирования точками метаболического перехода у растений, например, для перенаправления углерода в -7 жирные кислоты. В определенных вариантах осуществления изобретение относится к способам экспрессииCom25 как части стратегии метаболического конструирования, так что углерод перенаправляется в -7 жирные кислоты в семенах растений. Известный уровень техники Было подсчитано, что в природе может существовать свыше 1000 структур жирных кислот. Millar etal., (2000) Trends Plant Sci 5(3):95-101. Многие из этих жирных кислот синтезируются путем дериватизации жирных кислот с помощью набора вариантов прототипных десатураз. Первой из этих вариантов десатураз,подвергшихся выделению, была олеатгидроксилаза Ricinus из эндосперма клещевины, фермент, отвечающий за синтез рицинолевой кислоты. Van de Loo et al., (1995) Proc. Natl. Acad. Sci. USA 92(15):6743-6747. За этим последовали гены, кодирующие линолеатэпоксидазу Vernonia и олеатацетиленазу Crepis. Lee et al.,(1998) Science 280(5365):915-18. Выделение этих генов привело к представлению о том, что их гетерологичная экспрессия в масличных растениях может облегчить аккумуляцию соответствующих необычных жирных кислот. Broun et al., (1997) Plant Journal 13:201-10. Однако результирующая аккумуляция необычных жирных кислот была постоянно более низкой, чем обнаруживаемая в природном растительном источнике, из которого был выделен ген. Napier J.A. (2007) Annu. Rev. Plant Biol. 58:295-319. Профили специфической активности вариантов десатуразных ферментов, которые были выделены из тканей, аккумулирующих необычные жирные кислоты, согласуются с их ролью в продукции соответствующих необычных жирных кислот. Однако они проявляют очень слабую специфическую активность по сравнению со всеми десатуразами стеароил-АПБ, описанными к настоящему времени, и, как доказано, являются неэффективными при получении измененных фенотипов жирных кислот при гетерологичной экспрессии. Cahoon et al., (1994) Prog. Lipid Res. 33: 155-63. Например, специфичная для семян экспрессия гидроксилазы клещевины под контролем сильного специфичного для семян промотора в модельном растении Arabidopsis приводила к аккумуляции только приблизительно 17% рицинолевой кислоты, слишком малой по сравнению с приблизительно 90%, обнаруживаемыми в семени клещевины.Broun and Somerville (1997) Plant Physiol. 113:933-42. Сходно сообщалось о неутешительных результатах для эпокси- и ацетиленовой жирных кислот, которые, как показано, аккумулировались в количестве от 15 до 25% соответственно при гетерологичной экспрессии эпоксигеназы и ацетиленазы в Arabidopsis.Lee et al., (1998) Science 280(5365):915-18. В дополнение к показанным низким активностям варианты десатураз имели тенденцию образовывать нерастворимые агрегаты при очистке. Низкая стабильность и плохие скорости каталитической активности являются свойствами, проявляемыми многими недавно эволюционирующими ферментами, которые возникли в результате событий дупликации генов, в которых селекция на стабильность и/или обновление разблокирована, тогда как мутации аккумулируются, что в конечном итоге ведет к изменению функции. Govindarajan and Goldstein (1998) Proc. Natl. Acad. Sci. USA 95:5545-49; Goldstein (2001) in Protein Folding, Evolution and Design (Broglia R.A., Shakhnovich E.I. andTiana G., eds.) CXLIVVols., I.O.S. Press, Amsterdam. Было выдвинуто много возможных объяснений низких уровней аккумуляции целевых жирных кислот. Napier J.A. (2007) Annu. Rev. Plant Biol. 58:295-319. Есть основание полагать, что специальные ферменты могут играть ключевую роль во включении необычной жирной кислоты в триацилглицериды. Например, аккумуляция лаурата в семенах трансгенной Brassica napus повышалась от 50 до 60% при коэкспрессии ацилтрансферазы лизофосфатидной кислоты кокоса совместно с тиоэстеразой средних цепей калифорнийского лавра. Knutzon et al., (1999) Plant Physiol. 120(3):739-46. Недавно было показано, что коэкспрессия ацил-коэнзим А:диацилглицеролацилтрансферазы типа 2 (RcDGAT2) совместно с гидроксилазой клещевины повышала аккумуляцию рицинолевой кислоты с приблизительно 17 до приблизительно 30%. Burgal et al., (2008) Plant Biotechnol. J. 6(8):819-31. До сих пор не была описана аккумуляция высоких уровней необычных жирных кислот в трансгенных растениях, эквивалентная аккумуляции, обнаруживаемой в природных видах. Так как необычные жирные кислоты весьма желательны для разнообразных видов производства и типов применения, существует необходимость в более сильной экспрессии необычных жирных кислот в трансгенных растениях,создаваемых для их продукции. Раскрытие изобретения В настоящем описании раскрываются нуклеотидные последовательности, кодирующие новый вариант десатуразы, обозначаемой Com25, и ее аминокислотная последовательность. Раскрываются также способы экспрессии Com25 в растительной клетке для получения преимущества в повышении десатуразной активности фермента Com25 относительно 9-18:0 десатуразы WT клещевины, так что процентный состав необычных жирных кислот в семенах растения повышается. В некоторых вариантах осуществления способы включают экспрессию Com25 в Arabidopsis. В определенных вариантах осуществления необычные жирные кислоты, повышенные в семенах растения, представляют собой -7 жирные кислоты. В этих вариантах осуществления -7 жирные кислоты могут представлять собой 16:19- и/или 18:111. Предлагаются также способы экспрессии Com25 в растительной клетке, где растительная клетка характеризуется ухудшенной элонгацией жирных кислот в пластидах и вне пластид, так что процентный состав необычных жирных кислот в семенах растения повышается. В некоторых вариантах осуществления способы включают экспрессию Com25 в Arabidopsis. В определенных вариантах осуществления необычные жирные кислоты, повышенные в семенах растения, представляют собой -7 жирные кислоты. В этих вариантах осуществления -7 жирные кислоты могут представлять собой 16:19- и/или 18:111. Предлагаются дополнительные способы экспрессии Com25 в растительной клетке, когда KASII ингибируется в растительной клетке так, что процентный состав необычных жирных кислот в семенах растения повышается. В некоторых вариантах осуществления способы включают экспрессию Com25 в Arabidopsis. В определенных вариантах осуществления необычные жирные кислоты, повышенные в семенах растения, представляют собой -7 жирные кислоты. В этих вариантах осуществления -7 жирные кислоты могут представлять собой 16:19- и/или 18:111. Предлагаются также способы экспрессии Com25 в растительной клетке, в которых в растительной клетке ингибируются KASII и элонгация жирных кислот в пластидах и вне пластид, так что процентный состав необычных жирных кислот в семенах растения повышается. В некоторых вариантах осуществления способы включают экспрессию Com25 в Arabidopsis. В определенных вариантах осуществления необычные жирные кислоты, повышенные в семенах растения, представляют собой -7 жирные кислоты. В этих вариантах осуществления -7 жирные кислоты могут представлять собой 16:19-и/или 18:111. Указанные выше и другие особенности должны стать более понятными из последующего подробного описания некоторых вариантов осуществления, которое представлено со ссылкой на сопровождающие фигуры. Краткое описание чертежей На фиг. 1 схематически изображен синтез жирных кислот и их модификация в пластиде и эндоплазматическом ретикулуме Arabidopsis. Указаны реакции, опосредуемые десатуразами 16:0:1: десатураза 9-16:0-АПБ; 2: внепластидная десатураза 9-16:0-АПБ. -7 ЖК, т.е. 16:19 и/или 18:111 заключены в прямоугольники; на фиг. 2 изображено иллюстративное разделение с помощью газовой хроматографии FAMEs при экспрессии Com25 в Arabidopsis с различным генетическим фоном. Панели А и В, WT; С и D, fab1; Е иV, fab1/fae1. Панели А, С и Е, нетрансформированные; В, D и F, трансформированные Phas:Com25. Указаны пики FAME: 16:0 (1), 16:19 (2), 16:2 (3), 18:0 (4), 18:19 (5), 18:111 (6), 18:2 (7), 20:0 (8), 20:111 (6),18:2 (7), 20:0 (8), 20:111 (9), 18:3+20:113 (10) и 22:1 (11); на фиг. 3 показано отношение между 16:0 в семенах хозяина и аккумуляцией -7 (в виде мол%); на фиг. 4 изображено иллюстративное разделение с помощью газовой хроматографии FAMEs при экспрессии Com25 в Arabidopsis с различным генетическим фоном. Панель А: лучшие трансформированные линии fab1/fae1, Phas:Com25, Fab1-HPAS, An9DS, Ln9DS; панель В: семена Doxantha. Обозначения пиков описаны на фиг. 2; на фиг. 5 представлена схематическая организация элементов ДНК в конкретных вариантах осуществления конструкта по изобретению. Способ(ы) осуществления изобретенияI. Обзор некоторых вариантов осуществления. В настоящем описании раскрываются молекулы нуклеиновой кислоты, кодирующие 9 десатуразный фермент, включающие нуклеотидную последовательность, по меньшей мере на 60% идентичнуюSEQ ID NO:1. Молекулы нуклеиновой кислоты могут дополнительно включать регуляторный элемент гена. В некоторых вариантах осуществления регуляторный элемент гена может представлять собой промотор фазеолина. Раскрываются также ферменты десатуразы 9, включающие аминокислотную последовательность,по меньшей мере на 80% идентичную SEQ ID NO:2. Ферменты десатуразы 9 по настоящему изобретению, у которых аминокислотная последовательность по меньшей мере на 80% идентична SEQ ID NO:2,могут дополнительно включать серин в положении, аналогичном положению 114 в SEQ ID NO: 2; аргинин в положении, аналогичном положению 117 в SEQ ID NO: 2; цистеин в положении, аналогичном положению 118 в SEQ ID NO: 2; лейцин в положении, аналогичном положению 179 в SEQ ID NO: 2; и/или треонин в положении, аналогичном положению 188 в SEQ ID NO: 2. Молекулы нуклеиновой кислоты и десатуразные ферменты 9 по настоящему изобретению могут экспрессироваться в растительном материале, клетках, тканях или в целых растениях для повышения количества необычных жирных кислот в растительном материале, клетках, тканях или в целых растениях относительно количества, выявляемого в растении дикого типа того же вида. Альтернативные варианты осуществления изобретения включают способы повышения количества необычных жирных кислот в растительном материале, клетках, тканях или в целых растениях, включающие трансформацию растительного материала, клеток, тканей или целых растений молекулой нуклеиновой кислоты с SEQ ID NO:1,так что количество необычных жирных кислот в указанных растительном материале, клетках, тканях или в целых растениях повышается. В предпочтительных вариантах осуществления растительный материал, клетки, ткани или целые растения, которые трансформируются с помощью раскрытых способов, дополнительно включают одно или более средств повышения уровней 16:0-АПБ в растительном материале, клетках, тканях или в целых растениях. В определенных вариантах осуществления средства повышения уровней 16:0-АПБ в растительном материале, клетках, тканях или в целых растениях могут представлять собой: экспрессию внепластидной десатуразы; подавление KASII, например, путем введения мутации в ген fab1; и/или снижение элонгации 16:0 жирных кислот, например, путем введения мутации в ген fae1. Раскрытые в настоящем описании способы могут быть осуществлены, например, на растениях или растительном материале, происходящих от растений рода Arabidopsis. Конкретный вариант осуществления выработан для способов создания или регенерации генетически модифицированного растения,включающего повышенные количества необычных жирных кислот в растении по сравнению с растением дикого типа того же вида, включающих трансформацию растительного материала молекулой нуклеиновой кислоты с SEQ ID NO:1; и культивирование трансформированного растительного материала для получения растения. Раскрываются также растения, растительные материалы, растительные клетки и семена, получаемые указанными выше способами.FAME - метиловый эфир жирной кислоты;III. Термины. Жирная кислота. При применении в настоящем описании термин "жирная кислота" относится к длинноцепочечным алифатическим кислотам (алкановым кислотам) с варьирующими длинами цепей от приблизительно С 12 до С 22, хотя известны кислоты как с более длинными, так и с более короткими длинами цепей. Структуру жирной кислоты представляют с помощью обозначений х:уz, где "х" представляет собой суммарное количество углеродных (С) атомов в конкретной жирной кислоте, а "у" представляет собой количество двойных связей в углеродной цепи в положении "z" при подсчете с карбоксильного конца кислоты. Необычная жирная кислота. В плане настоящего изобретения необычные жирные кислоты представляют собой кислоты, чей синтез в природных системах инициируется путем модификации промежуточного продукта FAS с помощью варианта десатуразного фермента. Метаболический путь. Термин "метаболический путь" относится к сериям химических реакций,возникающих в клетке, катализируемых ферментами, для достижения либо образования метаболического продукта, либо инициации другого метаболического пути. Метаболический путь может включать несколько или много стадий и может конкурировать с другим метаболическим путем за специфические субстраты реакций. Сходно, продукт одного метаболического пути может представлять собой субстрат другого метаболического пути. Метаболическое конструирование. В плане настоящего изобретения "метаболическое конструирование" относится к конструктивной разработке стратегий изменения одного или более метаболических путей в клетке, так что поэтапно достигается модификация исходного вещества в продукт, имеющий желаемую точную химическую структуру в пределах общей схемы всех метаболических путей, задействованных в клетке. Десатураза. При применении в настоящем описании термин "десатураза" относится к полипептиду,который может уменьшать насыщенность (т.е. вводить двойную связь) в одну или более жирных кислот с получением интересующей жирной кислоты или предшественника. Растворимые растительные ферменты десатуразы жирных кислот вводят двойную связь региоспецифично в насыщенный ацил-АПБ субстрат. Реакция включает активацию молекулярного кислорода с помощью центра с восстановленным двумя электронами двухвалентным железом, который координирован узлом из четырех спиралей, что формирует каркас структуры десатуразы. Особый интерес в настоящем описании представляют десатуразы 9. Десатураза 9-18:01 необходима для всех растений для поддержания текучести мембран. Наряду с тем, что этот фермент в первую очередь снижает насыщенность стеароил-АПБ, он также в меньшей степени активен на пальмитоил-АПБ. Вариант десатуразы. При применении в настоящем описании термин "вариант десатуразы" охватывает те десатуразы, которые проявляют профили специфической активности, согласующиеся с их ролью в продукции необычных жирных кислот. Вариант десатуразы может быть выделен из организма или сконструирован с помощью программы направленной эволюции. Растение-потомок. В целях настоящего изобретения "растение-потомок" относится к любому растению или полученному из него растительному материалу, которое может быть получено с помощью методов селекции растений. Методы селекции растений хорошо известны в данной области техники и включают природную селекцию, искусственную селекцию, избирательную селекцию, включающую анализ молекулярных маркеров ДНК, трансгенные методы и коммерческую селекцию. Растительный материал. При применении в настоящем описании термин "растительный материал" относится к любой клетке или ткани, полученной из растения. Молекула нуклеиновой кислоты: Полимерная форма нуклеотидов, которая включает как смысловую, так и антисмысловую цепи РНК, кДНК, геномной ДНК и синтетические формы, и смешанные формы указанного выше. Нуклеотид относится к рибонуклеотиду, дезоксинуклеотиду или модифицированной форме любого типа нуклеотида. При применении в настоящем описании "молекула нуклеиновой кислоты" является синонимом "нуклеиновой кислоты" и "полинуклеотида". Термин включает одно- и двухцепочечную формы ДНК. Молекула нуклеиновой кислоты может включать любые природные и модифицированные нуклеотиды или оба типа нуклеотидов, связанные друг с другом природными и/или неприродными нуклеотидными связями. Молекулы нуклеиновой кислоты могут быть модифицированы химически или биохимически или могут содержать неприродные или дериватизированные нуклеотидные основания, как должно быть с легкостью понято специалистами в данной области техники. Такие модификации включают, например,промечивание, метилирование, замену одного или более природных нуклеотидов аналогом, межнуклеотидные модификации, такие как незаряженные связи (например, метилфосфонаты, фосфотриэфиры,фосфорамидаты, карбаматы и т.д.), заряженные связи (например, фосфоротиоаты, фосфородитиоаты и т.д.), свисающие части (например, пептиды), интеркаляторы (например, акридин, псорален и т.д.), хелаторы, алкилирующие агенты и модифицированные связи (например, альфа-аномерные нуклеиновые кислоты и т.д.). Термин "молекула нуклеиновой кислоты" включает также любую топологическую конформацию, включая одноцепочечную, двухцепочечную, частично дуплексную, триплексную,шпильковую, круговую конформации и конформацию висячего замка. Функционально связанная. Первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, когда первая последовательность нуклеиновой кислоты имеет функциональную связь со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. При рекомбинантном получении функционально связанные последовательности нуклеиновой кислоты обычно являются примыкающими и при необходимости объединяют две кодирующие белок области в одной и той же рамке считывания. Однако для функционального связывания нуклеиновым кислотам не обязательно быть примыкающими. Регуляторный элемент. При применении в настоящем описании термин "регуляторный элемент" относится к молекуле нуклеиновой кислоты, обладающей регуляторной активностью в отношении гена; т.е. к молекуле, которая обладает способностью влиять на транскрипцию или трансляцию функционально связанной молекулы нуклеиновой кислоты. Регуляторные элементы, такие как промоторы, лидирующие последовательности, интроны и области терминации транскрипции, представляют собой некодирующие молекулы нуклеиновой кислоты, обладающие регуляторной активностью в отношении гена,которые играют интегративную роль в суммарной экспрессии гена в живых клетках. Выделенные регуляторные элементы, которые функционируют в растениях, являются, следовательно, пригодными для модификации фенотипов растений с помощью методов молекулярной инженерии. Под "регуляторным элементом" подразумеваются последовательности нуклеотидов, которые определяют, будет ли, когда и на каком уровне экспрессироваться конкретный ген. Регуляторные последовательности ДНК специфически взаимодействуют с регуляторными белками или с другими белками. При применении в настоящем описании термин "регуляторная активность в отношении гена" относится к молекуле нуклеиновой кислоты, способной влиять на транскрипцию или трансляцию функционально связанной молекулы нуклеиновой кислоты. Выделенная молекула нуклеиновой кислоты, обладающая регуляторной активностью в отношении гена, может обеспечить временной или зависящей от местоположения экспрессией или модулировать уровни и скорости экспрессии функционально связанной молекулы нуклеиновой кислоты. Выделенная молекула нуклеиновой кислоты, обладающая регуляторной активностью в отношении гена, может включать промотор, интрон, лидирующую последовательность или 3'-область терминации транскрипции. Промоторы. При применении в настоящем описании термин "промотор" относится к молекуле нуклеиновой кислоты, которая вовлечена в узнавание и связывание РНК-полимеразы II или других белков,таких как транскрипционные факторы (трансдействующие белковые факторы, которые регулируют транскрипцию), для инициации транскрипции функционально связанного гена. Сами промоторы могут содержать субэлементы, такие как цис-элементы или энхансерные домены, которые влияют на транскрипцию функционально связанных генов. "Растительный промотор" представляет собой природный или неприродный промотор, который функционирует в растительных клетках. Растительный промотор может использоваться как 5'-регуляторный элемент для модуляции экспрессии функционально связанного гена или генов. Растительные промоторы могут быть определены по их зависящему от времени, местоположения или стадии онтогенеза паттерну экспрессии. Молекулы нуклеиновой кислоты, описанные в настоящем документе, могут включать последовательности нуклеиновой кислоты, включающие промоторы. Идентичность последовательностей. Сходство между двумя последовательностями нуклеиновой кислоты или между двумя аминокислотными последовательностями выражается в терминах степени идентичности последовательностей, имеющейся между последовательностями. Идентичность последовательностей обычно выражается в виде процента идентичности; чем выше этот процент, тем более сходны две последовательности. Способы выравнивания последовательностей для их сравнения подробно описаны ниже. Аналогичное положение в аминокислотной последовательности. Последовательности нуклеиновой кислоты и аминокислотные последовательности могут быть выровнены с помощью методов, описанных в последующих параграфах. При выравнивании положение в одной последовательности является "аналогичным положением" в отношении положения в выравниваемой последовательности, если положения являются идентичными в пределах консенсусной последовательности. Методы выравнивания последовательностей для сравнения хорошо известны в данной области техники. Различные программы и алгоритмы выравнивания описаны в: Smith and Waterman, Adv. Appl.Biosciences 8:155-65, 1992; Pearson et al., Methods in Molecular Biology 24:307-31, 1994; Tatiana et al.,FEMS Microbiol. Lett., 174:247-50, 1990. Altschul et al., J. Mol. Biol. 215:403-10, 1990 (подробное рассмотрение методов выравнивания последовательностей и расчетов гомологии). Программа Basic Local Alignment Search Tool (BLAST) национального центра биотехнологической информации (NCBI) доступна по Интернету (сайт blast.ncbi.nlm.nih.gov/Blast.cgi) для использования в сочетании с программами анализа последовательностей, например blastp и blastn. Описание того, как определить идентичность последовательностей с использованием этой программы, доступно по Интернету через NCBI на сайте blast.ncbi.nlm.nih.gov/Blast.cgiCMD=WebPAGETYPE=BlastDocs. Для сравнения аминокислотных последовательностей применяется функция "Blast 2 sequences" программы BLAST (bl2seq) с использованием параметров по умолчанию. Конкретные параметры могут быть доведены в пределах свободы действия специалистом в данной области техники, например для предоставления штрафа за отсутствие совпадения или вознаграждения за совпадение. Трансформированный. При применении в настоящем описании термин "трансформированный" относится к клетке, ткани, органу или организму, в которые введена чужеродная молекула нуклеиновой кислоты, такая как конструкт. Введенная молекула нуклеиновой кислоты может быть интегрирована в геномную ДНК реципиентных клетки, ткани, органа или организма, так что введенная полинуклеотидная молекула наследуется последующим поколением. "Трансгенная" или "трансформированная" клетка или организм также включает потомков клетки или организма и потомство, полученное путем программы селекции, применяющей такое трансгенное растение в качестве родительского, например, при скрещивании, и проявляющее альтернативный фенотип в результате присутствия чужеродной молекулы нуклеиновой кислоты.IV. Систематические подходы к метаболическому конструированию для аккумуляции необычных жирных кислот в клетке-, ткани- или организме-хозяине. А. Общие представления. Вариант осуществления изобретения включает систематический подход к метаболическому конструированию -7 жирных кислот (ЖК), состоящих из пальмитолеиновой (16:19) и вакценовой (18:111) кислот, например, в семенах растений. Для иллюстрации методов перевода потока вновь синтезированных жирных кислот в пластидах, Com25, десатуразу 16:0-АПБ, полученную в результате программы направленной эволюции для увеличения 16:0-десатуразной активности десатуразы 9-18:0 клещевины,-5 022985 экспрессировали под контролем специфичного для семян промотора фазеолина. В раскрытых в настоящем документе вариантах осуществления может быть использован любой специфичный для семян промотор. При этом подходе повышалась аккумуляция -7 ЖК от менее 2% в диком типе до приблизительно 14% в трансформантах Com25. В дополнительных иллюстративных подходах экспрессия Com25 в двойном мутанте fab1/fae1, у которого ухудшена элонгация пластидных и внепластидных жирных кислот соответственно, приводила к повышению аккумуляции -7 ЖК до приблизительно 50%. Более того, введение дополнительногоCom25 под контролем промотора LTP170 повышало аккумуляцию -7 ЖК до приблизительно 58%, что предполагает предел десатуразной активности, вероятно в результате преодоления ее низкого коэффициента оборачиваемости. Конструкт фазеолин:Com25 экспрессировали в сериях генотинов, дефицитных поKASII, и обнаружили содержание -7 ЖК, повышающееся пропорционально содержанию 16:0 до приблизительно 30% с суммарной аккумуляцией -7 ЖК до приблизительно 55%. Интересно, что трансгенные растения, аккумулирующие 56% -7 ЖК, все еще содержали приблизительно 19% 16:0, в два раза больше чем в растениях WT. Исследовали экспрессию внепластидных десатураз 16:0 для перевода потока по 16:0 ен-пути, ведущего к триацилглицериду. Совместная экспрессия пластидных и внепластидных десатураз параллельно с подавлением KASII у генотипа двойного мутанта fab1/fae1 приводила к повышенной аккумуляции -7 ЖК от приблизительно 2% у WT до приблизительно 71% у наилучшим образом сконструированной линии, что эквивалентно аккумуляции, обнаруживаемой в семенах Doxantha.-7 ЖК были выбраны в качестве мишени, так как их синтез в природных системах, подобных системам для других необычных ЖК, инициируется путем модификации промежуточного продукта FAS вариантом десатуразного фермента. Cahoon et al., (1997) Plant Mol. Biol. 33:1105-10; и Cahoon et al.,(1998) Plant Physiol. 117 (2): 593-8. Кроме того, 7 ЖК обладают потенциальными коммерческими вариантами применения в качестве полимерного сырья для промышленности, поскольку имеют физические свойства, сходные с природными ненасыщенными жирными кислотами. Исследования метаболического конструирования были начаты введением ранее не описанной десатуразы, Com25, 9-16:0-ацилпереносящего белка (АПБ) в растительную модель Arabidopsis под контролем специфичного для семян промотора. Исследовались подходы к переводу потока углерода в сторону-7 ЖК с помощью выбора мутантных генотипов, которые содержат повышенные уровни 16:0, и с помощью совместной экспрессии конструктов, созданных для перевода потока углерода в сторону жирной кислоты-мишени путем влияния на конкуренцию за субстрат. Экспрессировали внепластидные десатуразные ферменты, чтобы снизить насыщенность остаточных 16:0 после экспорта из пластиды. Совместная экспрессия пластидных и внепластидных десатураз параллельно с подавлением KASII вfab1/fae1 генотипе приводила к повышенной аккумуляции -7 ЖК до приблизительно 71% по сравнению с менее 2% в WT, более высокой, чем обнаруживаемая в Asclepias и эквивалентной, обнаруживаемой в семенах Doxantha. 16:0-АПБ, предшественник -7 жирных кислот, находится в первой точке ветвления пути биосинтеза жирных кислот, конкурируя за тиоэстеразу FatB и элонгазу KASII; и введение десатуразы 16:0-АПБ делает эту конкуренцию трехсторонней. Подавление KASII и FATB создает эффективные пути для снижения конкуренции за субстрат и повышения аккумуляции -7 ЖК. Повышение аккумуляции -7 ЖК является насыщаемым при приблизительно 30% в линии хозяина, поскольку при превышении этого уровня десатураза не является лимитирующим фактором. Повышение дозы Com25 путем экспрессии второй копии под контролем специфичного для семян промотора дополнительно повышало аккумуляцию -7 жирных кислот. Однако семена с высокой аккумуляцией -7 ЖК также содержали уровни 16:0 в диапазоне приблизительно 20%, предоставляя возможность снижения насыщенности внепластидных 16:0. Экспрессия двух внепластидных десатураз повышала аккумуляцию -7 ЖК, приводя приблизительно к 50% снижению 16:0 в зрелых семенах. Как более подробно описано ниже, систематическое метаболическое конструирование может быть успешной стратегией для конструирования уровней аккумуляции необычных жирных кислот, сравнимых с уровнями, обнаруживаемыми в природных источниках, так как самые лучшие линииfab1/fae1/Com25/Ln9D и An9D аккумулируют 71% -7 ЖК, существенно более высокие уровни, чем вAsclepias и эквивалентные уровням, обнаруживаемым в семенах Doxantha. В. Нуклеиновые кислоты. Последовательности нуклеиновых кислот в некоторых вариантах осуществления настоящего изобретения характеризуются повышенным процентом идентичности при выравнивании с SEQ ID NO:1. Специфичные последовательности нуклеиновых кислот в пределах этих и других вариантов осуществления могут включать последовательности, обладающие, например по меньшей мер, 60, 65, 70, 75, 80, 81,82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 100% идентичностью с SEQ ID NO:2. Специалистам в данной области техники понятно, что молекулы нуклеиновых кислот могут быть модифицированы, по существу, без изменения аминокислотной последовательности кодируемого полипептида, например, в соответствии с разрешенными нуклеотидными заменами в соответствии с вырожденностью кодонов. В некоторых вариантах осуществления молекулы нуклеиновой кислоты по настоящему изобретению включают промоторы. Промоторы могут быть выбраны на основе клеточного типа, в который будет вставлен векторный конструкт. Промоторы, которые функционируют в бактериях, дрожжах и растениях,хорошо известны в данной области техники. Промоторы могут быть также выбраны на основе их регуляторных характеристик. Примеры таких характеристик включают повышение транскрипционной активности, индуцибельность, тканевую специфичность и специфичность в отношении стадии развития. У растений описаны промоторы, которые являются индуцибельными, промоторы вирусного или синтетического происхождения, конститутивно активные, регулируемые во времени и регулируемые в пространственном отношении промоторы (например, см. Poszkowski, et al., (1989) EMBO J. 3:2719; Odell etal., (1985) Nature 313:810; Chau et al., (1989) Science 244:174-81). Часто используемые конститутивные промоторы включают, например, CaMV 35S промотор, усиленный CaMV 35S промотор, промотор вируса мозаики норичника, промотор маннопинсинтазы, промотор норалинсинтазы и промотор октопинсинтазы. Пригодные индуцибельные промоторы включают, например, промоторы, индуцируемые салициловой кислотой или полиакриловыми кислотами, индуцируемые нанесением антидотов (замещенных бензолсульфонамидных гербицидов), промоторы, индуцируемые тепловым шоком, промотор, индуцируемый нитратами, происходящий от транскрибируемой последовательности молекулы нуклеиновой кислоты нитратредуктазы шпината, и промоторы, индуцируемые светом, связанные с малой субъединицей карбоксилазы RuBP и семействами LHCP. Примеры пригодных тканеспецифических, регулируемых на стадиях развития промоторов включают промотор 7S -конглицинина и промоторы, специфичные для семян растений. Функционирующие в растениях промоторы, пригодные для предпочтительной экспрессии в пластидах семян, включают промоторы для белков, вовлеченных в биосинтез жирных кислот в семенах масличных культур, и для запасающих белков растений. Примеры таких промоторов включают 5'-регуляторные области таких транскрибируемых последовательностей молекул нуклеиновых кислот как последовательности фазеолина, напина, зеина, ингибитора трипсина сои, АПБ, десатуразы стеароил-АПБ и олеозина. Другим примером тканеспецифического промотора является промотор лектина, который специфичен для ткани семян. Другие пригодные промоторы включают промоторы нопалинсинтазы, маннопинсинтазы и октопинсинтазы, которые переносятся на индуцирующие опухоли плазмиды Agrobacterium tumefaciens; промоторы 19S и 35S вируса мозаики цветной капусты (CaMV); усиленный промотор 35S CaMV; промотор 35S вируса мозаики норичника; индуцируемый светом промотор малой субъединицы рибулозо-1,5 бисфосфаткарбоксилазы (ssRUBISCO); промотор EIF-4A табака (Mandel et al., (1995) Plant Mol. Biol. 29:995-1004); промотор синтетазы сахарозы кукурузы; промотор алкогольдегидрогеназы I кукурузы; промотор светособирающего комплекса кукурузы; промотор белка теплового шока кукурузы; промотор хитиназы из Arabidopsis; промоторы LTP (переносящего липиды белка); промотор халконизомеразы петуньи; промотор обогащенного глицином белка 1 бобов; промотор пататина картофеля; промотор убиквитина и промотор актина. Пригодные промоторы предпочтительно являются селективными для семян,селективными для ткани или индуцибельными. Специфичная для семян регуляция обсуждается, например, в патенте ЕР 0255378.C. Аминокислотные последовательности. Аминокислотные последовательности по некоторым вариантам осуществления настоящего изобретения характеризуются повышенным процентом идентичности при выравнивании с SEQ ID NO:2. Специфичные аминокислотные последовательности в пределах этих и других вариантов осуществления могут включать последовательности, обладающие, например, по меньшей мере, 70, 75, 80, 81, 82, 83, 84, 85,86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 100% идентичностью с SEQ ID NO:2. Во многих вариантах осуществления аминокислотная последовательность, характеризующаяся указанной выше идентичностью последовательности при выравнивании с SEQ ID NO:2, кодирует пептид с ферментативной активностью десатуразы 9-18:0-АПБ.D. Изменение Com25: 5 мутаций. Аспекты настоящего изобретения касаются новых, сконструированных с помощью генной инженерии десатураз, происходящих от родительской десатуразы клещевины. В конкретных вариантах осуществления генный конструкт десатуразы представляет собой Com25. Com25 отличается от родительской десатуразы клещевины в следующих пяти положениях аминокислот: M114S, T117R, L118C, P179L иG188T (при нумерации в соответствии с записью 1AFR в PDB зрелой десатуразы клещевины). В дополнительных вариантах осуществления генный конструкт десатуразы может включать одну или более из этих 5 мутаций в Com25. Например, генный конструкт десатуразы может отличаться от родительской десатуразы клещевины по следующим положениям: M114S; T117R; L118C; P179L; G188T; M114S иE. Хозяева с повышенным уровнем жирных кислот 16:0. В предпочтительных вариантах осуществления клетки-хозяева или материалы, трансформированные Com25, могут проявлять повышенный уровень жирных кислот 16:0. Клетки-хозяева могут проявлять повышенный уровень жирных кислот 16:0, например, благодаря ослабленному метаболизму 16:0-АПБ в этих клетках-хозяевах. Для повышения уровня жирных кислот 16:0 в клетках-хозяевах могут быть использованы другие методы, и такие методы могут быть выбраны по усмотрению специалиста в данной области техники. Примеры методов повышения уровня жирных кислот 16:0 в клетке-хозяине включают,но не ограничиваются этим: 1) экспрессию внепластидной десатуразы в клетке-хозяине; 2) подавлениеKASII в клетке-хозяине, например, путем введения мутации в ген fab1; и 3) снижение элонгации жирных кислот 16:0, например, путем введения мутации в ген fae1.F. Методы генетической трансформации генетического материала. Настоящее изобретение направлено также на методы получения трансформированных клеток, которые включают одну или более молекул нуклеиновой кислоты, включающих последовательность нуклеиновой кислоты, по меньшей мере на 60% идентичную SEQ ID NO:1. Такие молекулы нуклеиновой кислоты могут также включать, например, некодирующие регуляторные элементы, такие как промоторы. Наряду с некодирующими регуляторными элементами и транскрибируемыми последовательностями молекулы нуклеиновой кислоты в клетку также могут быть введены другие последовательности. Эти другие последовательности могут включать 3' терминаторы транскрипции, сигналы 3' полиаденилирования, другие нетранслируемые последовательности, переносящие или направляющие последовательности,маркеры селекции, энхансеры и операторы. Метод трансформации обычно включает стадии отбора подходящей клетки-хозяина, трансформации клетки-хозяина рекомбинантным вектором и получения трансформированной клетки-хозяина. Техника введения ДНК в клетки хорошо известна специалистам в данной области техники. Эти методы обычно можно разделить на пять категорий: (1) химические методы (Graham and Van der Eb (1973)Virology 54(2):536-9; Zatloukal et al., (1992) Ann. N.Y. Acad. Sci. 660:136-53); (2) физические методы, такие как микроинъекция (Capechi (1980) Cell 22 (2): 479-88), электропорация (Wong and Neumann,Biochim. Biophys. Res. Commun. (1982) 107(2):584-7; Fromm et al., (1985) Proc. Natl. Acad. Sci. USA 82(17):5824-8; патент США No. 5384253), и ускорение частиц (Johnston and Tang (1994) Methods Cell Biol. 43(A):353-65; Fynan et al., (1993) Proc. Natl. Acad. Sci. USA 90(24):11478-82; (3) вирусные векторы(Clapp (1993) Clin. Perinatol. 20(1): 155-68; Lu et al., (1993) J. Exp. Med. 178 (6) :2089-96; Eglitis and Anderson (1988) Biotechniques 6 (7): 608-14); (4) опосредуемые рецепторами механизмы (Curiel et al., (1992)Hum. Gen. Ther. 3(2):147-54; Wagner et al., (1992) Proc. Natl. Acad. Sci. USA 89(13):6099-103); и (5) опосредуемые бактериями механизмы, такие как при использовании Agrobacterium. Альтернативно, нуклеиновые кислоты могут быть введены непосредственно в пыльцу путем прямой инъекции в репродуктивные органы растения (Zhou et al., (1983) Methods in Enzymology 101:433; Hess (1987) Intern. Rev. Cytol. 107:367; Luo et al., (1988) Plant Mol. Biol. Reporter 6:165; Pena et al., (1987) Nature 325:274). Другие методы трансформации включают, например, трансформацию протопласта, как продемонстрировано в патенте США No. 5508184. Молекулы нуклеиновой кислоты могут быть также инъецированы в незрелые зародыши (Neuhaus et al., (1987) Theor. Appl. Genet. 75:30). Наиболее часто используемыми методами трансформации растительных клеток являются опосредуемый Agrobacterium процесс переноса ДНК (Fraley et al., (1983) Proc. Natl. Acad. Sci. USA 80:4803) (как проиллюстрировано в патенте США No. 5824877; патенте США No. 5591616; патенте США No. 5981840; и патенте США No. 6384301) и биолистический, или опосредуемый бомбардировкой процесс микроинъекции (т.е. генной пушкой) (такой как описанный в патенте США No. 5550318; патенте США No. 5538880; патенте США No. 6160208; патенте США No. 6399861; и патенте США No. 6403865). Обычно желательна трансформация ядра, но когда желательна избирательная трансформация пластид, таких как хлоропласты или амилопласты, пластиды растения могут быть трансформированы с помощью опосредуемой микробомбардировкой доставки желаемой молекулы нуклеиновой кислоты в случае некоторых видов растений, таких как Arabidopsis, табак, картофель и виды Brassica. Опосредуемая Agrobacterium трансформация достигается посредством использования генетически сконструированной почвенной бактерии, относящейся к роду Agrobacterium. Несколько видов Agrobacterium опосредуют перенос специфической ДНК, известной как "T-DNA", которая может быть генетически сконструирована для переноса желаемого фрагмента ДНК во многие виды растений. Основными событиями, характерными для процесса опосредуемого T-DNA патогенеза, являются: индукция генов вирулентности, процессинг и перенос TDNA. Этот процесс рассмотрен во многих обзорах (Ream (1989) Ann. Для селекции или подсчета трансформированных растительных клеток введенная в клетку ДНК,независимо от метода трансформации, может содержать ген, который действует в регенерирующей ткани растения с образованием соединения, придающего ткани растения устойчивость к токсичному в других условиях соединению. Интересующие гены для использования в качестве маркеров селекции, скрининга или подсчета включают, но не ограничиваются этим, гены GUS, зеленого флуоресцентного белка(GFP), люциферазы и устойчивости к антибиотику или гербициду. Примеры генов устойчивости к антибиотику включают гены, придающие устойчивость к пенициллинам, канамицину (и неомицину, G418,блеомицину); метотрексату (и триметоприму); хлорамфениколу; и тетрациклину. Например, устойчивость к глифосату может обеспечиваться геном устойчивости к гербициду. Della-Cioppa et al., (1987)Bio/Technology 5:579-84. Могут быть использованы и другие средства селекции, включая, но не ограничиваясь этим, толерантность к фосфинотрицину, биалафосу, и механизмы позитивной селекции, Joersbroet al., (1998) Mol. Breed. 4: 111-7, которые рассматриваются как входящие в объем настоящего изобретения. Трансформированным клеткам, идентифицированным с помощью селекции или скрининга и культивированным в подходящей среде, которая поддерживает регенерацию, далее может быть предоставлена возможность развития в растения. Раскрытые в настоящем описании методы могут быть применены к любой трансформируемой растительной клетке или ткани. Применяемые в настоящем описании трансформируемые растительные клетки или ткани включают, но не ограничиваются этим, те клетки или ткани, которые способны к последующему размножению, дающему в итоге растение. Специалистам в данной области техники понятно, что ряд растительных клеток или тканей являются трансформируемыми, когда после введения экзогенной ДНК и в подходящих условиях культивирования растительные клетки или ткани могут перестраиваться в дифференцированное растение. Ткани, пригодные для этих целей, могут включать, но не ограничиваются этим, незрелые зародыши, щитковую ткань, суспензионные клеточные культуры, незрелое соцветие, меристему побегов, узловые экспланты, ткань наплыва, ткань гипокотиля, семядоли, корни и листья. Регенерация, развитие и культивирование растений из трансформированного протопласта или эксплантов растений известны в данной области техники. Weissbach and Weissbach (1988) Methods for PlantMolecular Biology, (Eds.) Academic Press, Inc., San Diego, CA; Horsch et al., (1985) Science 227:1229-31. Этот процесс регенерации и выращивания обычно включает стадии селекции трансформированных клеток и культивирования этих клеток с прохождением обычных стадий зародышевого развития через стадию проростка с корнями. Сходным образом регенерируют трансгенные зародыши и семена. При данном способе трансформанты обычно культивируют в присутствии селективных сред, которые обеспечивают отбор успешно трансформированных клеток и индуцируют регенерацию ростков растения. Fraley et al.,(1993) Proc. Natl. Acad. Sci. USA 80:4803. Эти ростки обычно получают в пределах от двух до четырех месяцев. После этого полученные трансгенные ростки с корнями высаживают в подходящую среду для выращивания растения, такую как почва. Клетки, которые выживают при экспозиции с агентом селекции, или клетки, которые были определены как позитивные при тестирующем скрининге, можно культивировать в средах, которые поддерживают регенерацию растений. После этого ростки могут быть перенесены в подходящую среду, индуцирующую рост корней и содержащую агент селекции и антибиотик для предотвращения бактериального роста. У многих ростков обычно развиваются корни. Затем их переносят в почву или другие среды для обеспечения последующего развития корней. Кратко описанный выше метод обычно должен варьировать в зависимости от конкретного используемого штамма растения,и, следовательно, особенности методологии находятся в компетенции специалиста в данной области техники. Регенерированные трансгенные растения могут быть самоопыляющимися с получением гомозиготных трансгенных растений. Альтернативно, пыльца с регенерированных трансгенных растений может быть скрещена с растениями без трансгена, предпочтительно с инбредными линиями важных для сельского хозяйства видов. И наоборот, пыльца от растений без трансгена может быть использована для опыления регенерированных трансгенных растений. Трансгенное растение может передавать последовательность трансформированной нуклеиновой кислоты своим потомкам. Трансгенное растение предпочтительно является гомозиготным в отношении последовательности трансформированной нуклеиновой кислоты и передает эту последовательность всем своим потомкам при половом размножении. Потомство может быть выращено из семян, продуцированных трансгенным растением. Эти дополнительные растения затем могут быть подвергнуты самоопылению с получением действительно размноженной линии растений. Потомство этих растений может быть оценено, наряду с прочим, на предмет экспрессии гена. Генная экспрессия может быть определена несколькими общепринятыми способами, такими как иммуноблоттинг, нозерн-блоттинг, иммунопреципитация и ELISA (твердофазный иммуноферментный анализ). Трансформированные растения можно также анализировать на наличие введенной ДНК и уровень экспрессии и/или профиль жирных кислот, придаваемый молекулами нуклеиновой кислоты или аминокислотными молекулами по настоящему изобретению. Специалистам в данной области техники известны многочисленные методы, пригодные для анализа трансформированных растений. Например, методы анализа растений включают, но не ограничиваются этим, саузерн-блоттинг или нозерн-блоттинг, подходы на основе ПЦР, биохимические анализы, методы скрининга фенотипа, оценки в поле и иммунодиагностические тесты. Методы специфической трансформации двудольных хорошо известны специалистам в данной области техники. Трансформация и регенерация растения с использованием этих методов были описаны для ряда сельскохозяйственных культур, включая, но не ограничиваясь этим, представителей рода Arabidopsis, хлопчатник (Gossypium hirsutum), сою (Glycine max), арахис (Arachis hypogaea) и представители рода Brassica. Методы трансформации двудольных, главным образом путем использования Agrobacterium tumefaciens, и получения трансгенных растений были описаны для хлопчатника (патент США No. 5004863; патент США No. 5159135; патент США No. 5518908); сои (патент США No. 5569834; патент США No. 5416011; McCabe et al., (1988) Biotechnology 6:923; Christou et al., (1988) Plant Physiol. 87:671-4;Brassica (патент США No. 5463174); арахиса (Cheng et al., (1996) Plant Cell Rep. 15:653-7; McKently et al.,(1995) Plant Cell Rep. 14:699-703; папайи; и гороха (Grant et al., (1995) Plant Cell Rep. 15:254-8). Методы трансформации однодольных растений также хорошо известны в данной области техники. Трансформация и регенерация растения с использованием этих методов были описаны для ряда сельскохозяйственных культур, включая, но не ограничиваясь этим, ячмень (Hordeum vulgarae); маис (Zea mays); овес (Avena sativa); траву фруктового сада (Dactylis glomerata); рис (Oryza sativa, включая индийскую и японскую разновидности); сорго (Sorghum bicolor); сахарный тростник (Saccharum sp.); высокую овсяницу (Festuca arundinacea); виды газонной травы (например, Agrostis stolonifera, Poa pratensis, Stenotaphrumsecundatum); пшеницу (Triticum aestivum); и люцерну (Medicago sativa). Специалистам в данной области техники ясно, что ряд методов трансформации может быть использован и модифицирован для получения стабильных трансгенных растений для любого количества интересующих целевых сельскохозяйственных культур. Для использования в методах, раскрытых в настоящем описании, может быть выбрано любое растение. Предпочтительные растения для модификации по настоящему изобретению включают Arabidopsisspp.), Lesquerella и Limnanthes spp., Linola, настурцию (Tropaeolum spp.), Oenothera spp., оливу (Olea spp.),пальму (Elaeis spp.), арахис (Arachis spp.), рапс, сафлор (Carthamus spp.), сою (Glycine и Soja spp.), подсолнечник (Helianthus spp.), табак (Nicotiana spp.), Vernonia spp., пшеницу (Triticum spp.), ячмень (Hordeum spp.), рис (Oryza spp.), овес (Avena spp.) сорго (Sorghum spp.), рожь (Secale spp.) или другие представители Gramineae. Специалистам в данной области техники ясно, что ряд методов трансформации может быть использован и модифицирован для получения стабильных трансгенных растений из любого количества интересующих целевых сельскохозяйственных культур.G. Трансгенные семена. В некоторых вариантах осуществления изобретения трансгенное семя содержит полипептид, включающий аминокислотную последовательность, по меньшей мере на 90% идентичную SEQ ID NO:2. В этих и других вариантах осуществления трансгенное семя содержит последовательность нуклеиновой кислоты, по меньшей мере на 60% идентичную SEQ ID NO:1. В определенных вариантах осуществления семена по настоящему изобретению проявляют повышенные уровни необычных жирных кислот, например, -7 жирных кислот, таких как 16:19 и/или 18:111. Семена могут быть собраны с плодоносящих трансгенных растений и использованы для выращивания поколений потомков трансформированных растений по данному изобретению, включая гибридные линии растений, содержащие последовательность нуклеиновой кислоты по данному изобретению и другой интересующий ген или конструкт нуклеиновой кислоты. Следующие примеры предлагаются для иллюстрации определенных конкретных особенностей и/или вариантов осуществления. Эти примеры не следует толковать как ограничение изобретения описанными конкретными особенностями или вариантами осуществления. Примеры Пример I. Материалы и методы. Выращивание растения и трансформация. Растения Arabidopsis выращивали в почве при непрерывной экспозиции при 300 микроэйнштейнов света (1 микроэйнштейн = 1 моль света) в камерах для выращивания в контролируемой среде Е 7/2(Conviron). Растения трансформировали по методу Clough и Bent, Clough and Bent (1998) Plant J. 16(6):735-43, с использованием штамма GV3101 Agrobacterium tumefaciens. Заявители идентифицировали индивидуальные семена Т 1, несущие трансгены, по эмитированной флуоресценции, Stuitje et al.,(2003) Plant Biotechnol. J. 1(4): 301-9, при освещении зеленым светом от импульсной лампы Х 5 LED ский микроскоп WILD M3Z, снабженный системой освещения Olympus U-LH100HG, с применением фильтров FITC 535 и FITC 515 соответственно. Специфичная для семян экспрессия была достигнута помещением конструктов под контроль промотора сохраняющего семена белка фазеолина или промотораCom25 представляет собой вариант десатуразы 9-18:0-АПБ Ricinus communis, который появился в результате осуществления программы комбинаторного насыщающего мутагенеза/селекции, предназначенной для выявления вариантов с улучшенной активностью в отношении ацильных цепей с длиной менее 18 С. Whittle and Shanklin (2001) J. Biol. Chem. 276(24):21500-5. Com25 отличается от исходной десатуразы клещевины по следующим 5 положениям аминокислот: M114S, T117R, L118C, P179L и G188T(нумерация в соответствии со зрелой десатуразой клещевины, PDB ввод 1AFR). Плазмидные конструкты.Phas:Com25. Всю открытую рамку считывания варианта Com25 клещевины, сконструированного так, чтобы он содержал аутентичный транспортный пептид и был окружен 5' Pad и 3' XhoI сайтами рестрикции, клонировали в соответствующие сайты плазмиды pDs-Red-Phas, Pidkowich et al., (2007) Proc.Phas:Com25, LTP170:Com25. Промотор LTP170 амплифицировали из геномной ДНК Arabidopsis с использованием праймеров Р 17-5'BamHI (GGGATCCCCGGGTTGACATTTTTA ССТТТТТ; SEQ IDpGEMT-Easy перед выделением фрагмента BamHI-PacI, который клонировали в соответствующие сайты плазмиды pDs-Red-Phas:Com25 (описанной выше) для создания pDs-Red-LTP170:Com25. Фрагмент, содержащий Com25 вместе терминатором фазеолина, вырезали с помощью BamHI и EcoRV и клонировали в сайты рестрикции BamHI и SmaI вектора pDs-Red-LTP170-Com25 с созданиемPhas:Fab1-HPAS. Этот конструкт был создан в две стадии; сначала был сконструирован Phas:FatBHP, а затем была произведена вставка антисмысловой части гена FatB с заменой части интрона Fad2,разделяющего смысловую и антисмысловую части гена FatB, включающего шпильку. С этой целью 150 п.н. из FatB 3'UTR Arabidopsis амплифицировали из геномной ДНК и в смысловой (с использованием праймеров FatB-hps-5'PstI GGGCTGCAGAAACAAGTTTCGGCCACCAACC С; SEQ ID NO:5 и FatB-hps3'XhoI CCCCTCGAGACATCAGAATTCGTAATGAT; SEQ ID NO: 6), ив антисмысловой (с использованием праймеров FatB-hpa-5'NheI GGGGCTAGCAAGTTTCGGCCACCAAC CC; SEQ ID NO:7 и FatB-hpa3'Pad CCCTTAATTAAACATCAGAATTCGTAATGAT; SEQ ID NO:8) ориентациях. Эти фрагменты вырезали с помощью PstI/XhoI и NheI/PacI и использовали для замены 5'UTR смысловой и антисмысловой частей FabI в pGEM-T-Easy-HTM3, Pidkowich et al., (2007) Proc. Natl. Acad. Sci. USA 104(11): 4742-7, по их эквивалентным сайтам с созданием промежуточной плазмиды pGEM-T-Easy-HTM4. Для создания антисмысловой части из 300 п.н. кодирующей области гена FatB фрагмент амплифицировали с помощью праймеров FatB-Exon-5'Sp-Bam (CCACTAGTGGATCCACCTCTGCTACGTCGTCATT; SEQ ID NO:9) иFatB-Exon-3'Bg-Sal (GGAGATCTGTCGACGTAGTTATAGCAGCAAGA AG; SEQ ID NO: 10), и фрагмент, вырезанный с помощью BamHI и SalI, использовали для замены части интрона Fad2 после рестрикции с помощью BglII и SpeI с созданием pGEM-T-Easy-HTM5. Собранный фрагмент HPAS вырезали с помощью Pad и XhoI и клонировали в эквивалентные сайтыpZs-Green-Phas:Com25 (плазмиды pDs-Red-Phas:Com25, описанной выше, в которой флуоресцентный маркер pCVMV:Ds-Red был заменен маркером зеленого флуоресцентного белка pCVMV:Zs-GreenPhas:AnD9d, Phas:LnD9D. Две ацил-СоА D9 десатуразы грибов были объединены в плазмидеpDAB7318, причем оба гена находились под управлением специфичного для семян промотора Phas изPhaseolus vulgaris. Первый ген в конструкте представлял собой ацил-СоА 9-десатуразу из Aspergillusnidulans, который был переконструирован и синтезирован для оптимальной экспрессии в растениях (патентная заявка США 20080260933 А 1) и соединен с 3' нетранслируемой областью и 3' MAR из гена фазеолина Phaseolus vulgaris. Второй ген десатуразы в этом конструкте представлял собой ацил-СоА 9 десатуразу из Leptosphaeria nodorum, который также был переконструирован и синтезирован для экспрессии в растениях и соединен с ORF23 3' нетранслируемой области Agrobacterium tumefaciens. Эта десатураза была идентифицирована при поиске гомологии геномной последовательности S. nodorum, проявляемой Leptosphaeria nodorum. Sequencing Project, Broad Institute of Harvard and MIT(http://www.broad.mit.edu). Было показано, что она проявляет предпочтительность в отношении снижения насыщенности пальмитата, дополняя действие мутантного ole1 Saccharomyces cerevisiae. Phas:Fab1HPAS-Phas:Com25. Для упрощения экспериментов по укладке генов была сконструирована плазмидаPhas:Fab1/HPAS-Phas:Com25 с сочетанной экспрессией Com 25 и KASII. С этой целью был выделен терминатор фазеолина из Phas:Com25 и клонирован в промежуточный вектор pBL с фрагментом EcoRVEcoRV, содержащим управляемый промотором фазеолина Com25, с созданием pBL-Phas:Com25-PhasTer. Эту экспрессионную кассету Com25 вырезали с использованием фланкирующих сайтов рестрикцииEcoRI-EcoRI и клонировали в соответствующий сайт в Phas:Fab1-HPAS с созданием Phas:Fab1-HPASPhas-Com25. См. фиг. 5. Анализ жирных кислот. Для анализа жирных кислот одиночных семян были получены метиловые сложные эфиры жирных кислот (FAMEs) путем инкубации семян с 0,2 М гидроксидом триметилсульфония в метаноле. Butte et al.,(1982) Anal. Lett. 15 (10):841-50. Для сходного анализа большого количества семян FAMEs получали инкубацией семян в 0,5 мл BCl3 в течение 1 ч при 80 С, их экстракцией 1 мл гексана и последующего высушивания в атмосфере N2. FAMEs анализировали с помощью либо НР 6890 газового хроматографадетектора пламенной ионизации (Agilent Technologies), либо НР 5890 газового хроматографа-массспектрометра (Hewlett-Packard), снабженного капиллярными колонками 60-м 250-мкм SP-2390(Supelco). Температуру нагревателя повышали во время анализа с 100 до 240 С со скоростью 15/мин при скорости потока 1,1 мл/мин. Масс-спектрометрию проводили с помощью избирательного по массе детектора НР 5973 (Hewlett-Packard). Заявители определяли положения двойной связи в мононенасыщенных FAMEs путем диметилсульфидной дериватизации. Yamamoto et al., (1991) Chem. and Phys. Lipids 60(l):39-50. Пример II. Экспрессия Com25 в WT Arabidopsis. Сообщалось, что несколько растений, включая Asclepias, Hopkins and Chisholm (1961) Can. J. Biochem. Physiol. 39:829-35, и Doxantha, Chisholm and Hopkins (1965) J. Am. Oil Chem. Soc. 42:49-50, аккумулируют -7 ЖК в семенах. Были выделены гены, кодирующие десатуразные ферменты, ответственные за синтез пальмитолеата. Активность соответствующих рекомбинантных десатуразных ферментов, Cahoonet al., (1997) Plant Mol. Biol. 33:1105-10; Cahoon et al., (1998) Plant Physiol. 117(2):593-8, как и активность многих вариантов десатураз, была ниже активности, сообщавшейся для исходных стеароил-АПБ десатураз. Whittle and Shanklin (2001) J. Biol. Chem. 276 (24) :21500-5. Заявители сравнили эффекты экспрессии в Arabidopsis десатураз Asclepias и Doxantha и нескольких вариантов десатуразы клещевины, включая десатуразу из разновидности 5.2 клещевины и Com25, которая возникла в результате экспериментов по направленной эволюции, предназначенных для повышения 16:0-десатуразной активности 9-18:0 десатуразы клещевины, Whittle and Shanklin (2001) J. Biol. Chem. 276(24):21500-5. В этих экспериментахCom25 превосходила другие десатуразные ферменты, Bondaruk et al., (2007) Plant Breeding 126:186-94,повышая аккумуляцию 16:19 и продукт ее элонгации, 18:111 в WT Arabidopsis с едва определимого уровня в нетрансформированных растениях до приблизительно 2 и приблизительно 12% соответственно; с суммарным выходом 14% -7 жирных кислот в трансформантах Com25, фиг. 1 А, 2 В. В табл. 1 показано, что хотя Com25 имеет значительно улучшенную kcat (11,1 мин-1) по сравнению сWT клещевины (2,8 мин-1) в отношении субстрата 16:0-АПБ, она уступает сообщавшейся величине для варианта клещевины 5.2 (25,3 мин-1). Whittle and Shanklin (2001) J. Biol. Chem. 276(24):21500-5. ОднакоKm Com25 в отношении 16:0-АПБ (0,12 мкМ) в 4,6 раза ниже величины Km варианта клещевины 5.2(0,55) и в 42 раза ниже величины Km WT клещевины (5,0). В результате коэффициент специфичности в отношении субстрата 16:0-АПБ, равный для Com25 91 мкМ-1-мин-1, приблизительно в два раза превышает этот показатель для варианта клещевины 5.2 и в 163 раза превышает этот показатель для WT клещевины. Действительно, коэффициент специфичности Com25 в отношении 16:0-АПБ эквивалентен данному показателю WT клещевины в отношении ее природного субстрата 18:0-АПБ (92 мкМ-1-мин-1). Улучшенная Km Com25 в отношении 16:0-АПБ по сравнению с вариантом клещевины 5.2 позволяет предполагать, что этот фермент более эффективно конкурирует с FatB и KASII за субстрат, что позволяет объяснить, почему его экспрессия способствует большей аккумуляции -7 ЖК по сравнению с вариантом клещевины 5.2, несмотря на его более низкую Kcat. Таблица 1. Кинетические параметры десатуразы клещевины и ее вариантов с разными субстратами Пример IV. Экспрессия Com25 в хозяевах с повышенным уровнем 16:0. В WT Arabidopsis жирные кислоты синтезируются de novo no пути АПБ до первой точки ветвления на уровне 16:0-АПБ. Фиг. 1. При действии на этот субстрат FATB, пальмитоилтиоэстеразы, свободная жирная кислота 16:0 выделяется из пластиды в цитоплазму, где эта жирная кислота образует эфир с СоА и затем переносится на фосфолипиды системы внутренних мембран. Альтернативно, -кетоацил-АПБ- 12022985 синтаза II (KASII) удлиняет большинство 16:0-АРС до 18:0-АРС, после чего этот субстрат подвергается снижению степени насыщенности под действием 9-стеароил-АПБ-десатуразы с образованием олеоилАПБ. FATA, олеоил-АПБ-тиоэстераза, высвобождает олеиновую кислоту, которая покидает пластиду и,подобно пальмитату, активируется до СоА-тиоэфира и переносится на фосфолипиды. В ER олеат может быть удлинен до 10:111 благодаря действию элонгазы жирных кислот (FAE)I или подвергнут последовательному снижению степени насыщенности под действием FAD2 и FAD3 с образованием линоленовой и линоленовой кислот соответственно. 16:0-АПБ является наиболее ранним метаболитом на пути синтеза FA, который может быть сопряжен с продукцией -7 путем снижения насыщенности жирной кислоты до 16:19-АПБ. С этой целью исследовали возможность экспрессии специфичной в отношении 9-16:1-АПБ десатуразы пластид под контролем специфичного для семян промотора (см. фиг. 1 (реакция 1. Как описано выше, -кетоацил-АПБ-синтаза II (KASII) удлиняет 16:0-АРС до 18:0-АРС. Поэтому полагали, что линии со сниженной активностью KASII должны сдержать повышенный уровень субстрата 16:0. На фиг. 2 показаны типичные ГХ-профили сложных метиловых эфиров FA. Несмотря на неоднократный скрининг мутагенезом, имеется сообщение лишь об одном мутанте fab1, James and Dooner(1990) Theor. Apple Genet. 80:241-45, который проявлял повышенный уровень 16:0 в листьях и семенах,которые содержали приблизительно 21% 16:0 по сравнению приблизительно с 10% в WT, как показано на фиг. 2 С и в табл. 2. Биохимические данные показали, что повреждение fab1 находится в KASII, поскольку активность этого фермента была снижена у мутанта. Carlsson et al., (2002) Plant J. 29 (6):761-70. Экспрессия Com25 в fab1 повышала аккумуляцию 16:19 и 18:111 до приблизительно 23% и приблизительно 16%, соответственно, с суммарным выходом 39% W-7 FA. Фиг. 2D и табл. 2. Это значительное повышение -7 ЖК после экспрессии Com25 при генотипе fab1 коррелирует с увеличением суммарной аккумуляции 16:0 в зрелых семенах и, по-видимому, является результатом сниженной конкуренцииKASII за субстрат 16:0-АПБ. Заявители также соединили мутацию fab1 с fae1 благодаря тому, что недостаточность фермента во внепластидной элонгации жирных кислот с С 18 до С 20 дополнительно увеличивает количество 16:0 жирных кислот и упрощает анализ. Нетрансформированный двойной мутант содержит приблизительно 9% -7 жирных кислот, что, вероятно, отражает усиленное повышение уровня ненасыщенности 16:0 АПБ под действием 9-18:0-АПБ-десатуразы в условиях повышенного уровня субстрата 16:0-АПБ. Фиг. 2 Е и табл. 2. Экспрессия Com25 в fab1/fae1 приводила к повышению 16:19 и 18:111 до приблизительно 26 и приблизительно 23%, соответственно, с повышением -7 ЖК до приблизительно 50%. Фиг. 2F и табл. 2. Из представленных выше результатов следует, что аккумуляция 16:1 в fab1 и fab1/fae1 коррелирует с 16:0, и поэтому заявители предприняли поиск линий для экспрессии Com25, в которых уровень 16:0 превышает этот уровень в двойном мутанте fab1/fae1. Недавно появились сообщения о двух таких мутантах, в которых был подавлен Fab1, в одном случае с помощью шпильковой (HP)RNAi, Pidkowich etal., (2007) Proc. Natl. Acad. Sci. USA 104(11): 4742-7, а в другом с помощью нового метода подавления,названного шпильковой-антисмысловой (HPAS)RNAi, Nguyen and Shanklin (2009) Journal of the AmericanOil Chemists Society 86:41-9. В этих линиях значительно повышен уровень аккумуляции 16:0 до 42% и 46% соответственно. Фиг. 3. Трансформация с помощью Com25 привела к дополнительному повышению приблизительно на 5% -7 ЖК в обоих случаях. Табл. 2. Таким образом, повышение аккумуляции 16:0 при низких уровнях 16:0 позволяет предсказывать повышение степени ненасыщенности под действиемCom25, как это следует из пропорционального повышения аккумуляции -7 FA, но этот ответ, повидимому, насыщаем при уровне, немного превышающем 30%, поскольку не было разницы в степени аккумуляции -7 ЖК у хозяев, аккумулирующих либо 42, либо 46% 16:0. Фиг. 3. Вне связи с какой-либо теорией, возможно, что лимитирующими в этих трансгенных организмах становятся факторы, отличные от субстрата, т.е. количество десатуразы и/или доступность восстановителя. Недавно был описан нокаутный аллель T-DNA, fab1-2, при котором у гетерозигот был повышен уровень 16:0; однако было показано, что у гомозигот эта мутация летальна для зародышей. Pidkowich etal., (2007) Proc. Natl. Acad. Sci. USA 104(11): 4742-7. Заявители предположили, что летальный фенотип является следствием снижения ненасыщенных жирных кислот, и предсказали, что экспрессия Com25 в этой линии может обеспечить жизнеспособность. Напротив, двойной мутант fab1/fae1 жизнеспособен в гомозиготном состоянии и неотличим по росту и развитию от WT. Поэтому заявители использовали двойной мутант fab1/fae1 в качестве экспериментального хозяина для последующих экспериментов. Пример V. Увеличение дозы гена Com25 ведет к повышенной аккумуляции -7. Исходная десатураза 9-18:0-АПБ клещевины имеет kcat, равную 42 мин-1, Whittle and Shanklin(2001) J. Biol. Chem. 276(24):21500-5, которая в несколько раз превышает сообщавшиеся величины для десатураз 9-16:0-АПБ. Cahoon et al., (1997) Plant Mol. Biol. 33:1105-10; и Cahoon et al., (1998) Plant Physiol. 117(2) : 593-8. Хотя этот оборот сопоставим с оборотом сходных зависимых от Fe реакций окисления,таких как катализируемые цитохромами Р 450, эти скорости ниже (во многих случаях на порядки величин) по сравнению со скоростями многих ферментов метаболизма. Низкие скорости оборота десатураз влекут необходимость в высоком уровне экспрессии белка для обеспечения снижения уровня насыщенности значительной части углерода, запасаемого в семенах, что позволяет предположить, что содержание десатуразного фермента может лимитировать аккумуляцию -7. Для проверки этой гипотезы был сконструирован Com25 под контролем специфичного для семян промотора LTP170 (который контролирует экспрессию белка сохранения семян) и экспрессировали его совместно с описанным выше конструктом управляемого фазеолином Com25. Совместная экспрессия Com25 под контролем промоторов фазеолина и LTP170 при генотипе fab1/fae1 вела к повышению аккумуляции -7 ЖК с приблизительно 50 до приблизительно 58%; при этом увеличение 16:19 было сильнее (приблизительно 6%), чем увеличение 18:111 (приблизительно 2%). Это увеличение аккумуляции -7 ЖК является скромным, что позволяет предположить, что Com25, по-видимому, не является лимитирующим в семенах, экспрессирующих оба конструкта Com25. Таблица 2 Пример VI. Экспрессия внепластидных десатураз 9-16:0 повышает аккумуляцию -7 FA. Как обсуждалось ранее, использование генотипа Arabidopsis, который аккумулирует 16:0 на высоком уровне, коррелирует с образованием -7 ЖК после экспрессии десатуразы 16:0-АПБ, но большое количество 16:0 все еще покидает пластиду и аккумулируется в масле семян. См. табл. 2. Поэтому было рассмотрено два подхода к снижению аккумуляции 16:0 в масле семян. Одна стратегия заключалась в снижении активности пальмитаттиоэстеразы FATB (фиг. 1), которая выщепляет 16:0 из 16:0-АПБ. Подавление FATB с помощью HPAS-RNAi снижало аккумуляцию 16:0 приблизительно на 3% при приблизительно 6% повышении -7 FA. См. табл. 2. Была исследована возможность дополнительного снижения аккумуляции 16:0 в семенах относительно снижения, наблюдаемого при подавлении FATB, путем снижения степени насыщенности 16:0 после экспорта из пластиды. Свободные жирные кислоты, выходящие из пластиды, образуют сложные эфиры с СоА под действием ацил-СоА-синтаз на пути к аккумуляции триглицеридов. Shockey et al., (2003) Plant Physiol. 132(2):1065-76. Эти цитоплазматические жирные ацил-CoAs и связанные с фосфолипидами ЖК представляют собой пулы субстратов, потенциально доступных для внепластидных десатураз. Экспрессия внепластидных десатураз грибов Aspergillus nidulans (An) и Leptosphaeria nodurum (Ln) либо по отдельности, либо в сочетании была оценена в плане снижения уровня 16:0 в Arabidopsis. Совместная экспрессия двух десатураз из Ln и An под контролем промотора фазеолина дала обнадеживающие результаты по снижению 16:0 в WT Arabidopsis. Поэтому было проведено тестирование экспрессии конструкта Ln и An наряду с экспрессией единственной копии Com25 в линии с подавлением KASII с помощью HPAS-RNAi. Экспрессия Ln9D и An9 десатураз приводила к превращению приблизительно половины 16:0 в 16:19,что обеспечивало снижение аккумуляции 16:0 в семенах с приблизительно 19 до приблизительно 11%(приблизительно равной уровню в семенах WT) при соответствующем повышении 16:19 от приблизительно 27 до 43%. Уровни 18:111 в линии хозяина fab1/fae1/Com25 и этой линии, трансформированной десатуразами Ln9D и An9, были одинаковыми (приблизительно 25 и приблизительно 23% соответственно), что указывает на то, что мутант fae1 почти полностью лишен элонгирующей активности в отношении 16:19. Эта стратегия совместной экспрессии пластидных и внепластидных десатураз обеспечила аккумуляцию -7 ЖК в среднем на уровне 67%, причем в отдельных растениях эта аккумуляция превышала 71%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Молекула нуклеиновой кислоты, кодирующая 9 десатуразный фермент, где молекула нуклеиновой кислоты включает нуклеотидную последовательность, по меньшей мере на 60% идентичную SEQ IDNO:1, функционально связанную с регуляторным элементом гена. 2. Молекула нуклеиновой кислоты по п.1, где регуляторный элемент гена представляет собой промотор фазеолина или промотор LTP170. 3. 9 десатуразный фермент, включающий аминокислотную последовательность, по меньшей мере на 80% идентичную SEQ ID NO:2, включающую серин в положении, аналогичном положению 114 в SEQNO:2; и/или треонин в положении, аналогичном положению 188 в SEQ ID NO:2. 4. 9 десатуразный фермент по п.3, где аминокислотная последовательность включает серин в положении, аналогичном положению 114 в SEQ ID NO:2; аргинин в положении, аналогичном положению 117 в SEQ ID NO:2; цистеин в положении, аналогичном положению 118 в SEQ ID NO:2; лейцин в положении, аналогичном положению 179 в SEQ ID NO:2; и треонин в положении, аналогичном положению 188 в SEQ ID NO:2. 5. Способ увеличения количества -7 жирных кислот в растительном материале, причем способ включает трансформацию растительного материала молекулой нуклеиновой кислоты по п.1, с тем чтобы количество -7 жирных кислот в указанном растительном материале увеличивалось. 6. Способ по п.5, дополнительно включающий трансформацию растительного материала дополнительными молекулами нуклеиновой кислоты по п.1. 7. Способ по п.5, где растительный материал включает средство повышения уровней 16:0-АПБ в растительном материале. 8. Способ по п.7, где средство повышения уровней 16:0-АПБ в растительном материале представляет собой экспрессию внепластидной десатуразы. 9. Способ по п.7, где средство повышения уровней 16:0-АПБ в растительном материале представляет собой подавление KASII. 10. Способ по п.9, где подавление KASII обеспечивается введением мутации в ген fab1. 11. Способ по п.7, где средство повышения уровней 16:0-АПБ в растительном материале представляет собой снижение элонгации жирных кислот 16:0 в растительном материале. 12. Способ по п.11, где снижение элонгации жирных кислот 16:0 в растительном материале обеспечивается введением мутации в ген fae1. 13. Способ по п.5, где растительный материал получают из растения, выбранного из рода, выбранного из группы, включающей Arabidopsis, Borago, канолу, Ricinus, Theobroma, Zea, Gossypium, Crambe,Cuphea, Linum, Lesquerella, Limnanthes, Linola, Tropaeolum, Oenothera, Olea, Elaeis, Arachis, рапс, Carthamus, Glycine, Soja, Helianthus, Nicotiana, Vernonia, Triticum, Hordeum, Oryza, Avena, Sorghum, Secale или другие представители Gramineae. 14. Способ по п.5, где растительный материал включает два средства повышения уровней 16:0-АПБ в растительном материале. 15. Способ по п.14, где первое средство повышения уровней 16:0-АПБ в растительном материале представляет собой подавление KASII и где второе средство повышения уровней 16:0-АПБ в растительном материале представляет собой снижение элонгации жирных кислот 16:0 в растительном материале. 16. Способ по п.5, где растительный материал включает три средства повышения уровней 16:0-АПБ в растительном материале. 17. Способ по п.16, где первое средство повышения уровней 16:0-АПБ в растительном материале представляет собой подавление KASII, где второе средство повышения уровней 16:0-АПБ в растительном материале представляет собой снижение элонгации жирных кислот 16:0 в растительном материале и где третье средство повышения уровней 16:0-АПБ в растительном материале представляет собой экспрессию внепластидной десатуразы. 18. Способ по п.8, где внепластидная десатураза представляет собой Ln9D или An9 десатуразу. 19. Способ создания генетически сконструированного растения, содержащего повышенное количество -7 жирных кислот в растении по сравнению с растением дикого типа, причем способ включает трансформацию растительного материала молекулой нуклеиновой кислоты по п.1; и культивирование трансформированного растительного материала с получением растения. 20. Способ по п.19, где растение выбрано из рода, выбранного из группы, включающей Arabidopsis,Borago, канолу, Ricinus, Theobroma, Zea, Gossypium, Crambe, Cuphea, Linum, Lesquerella, Limnanthes, Linola, Tropaeolum, Oenothera, Olea, Elaeis, Arachis, рапс, Carthamus, Glycine, Soja, Helianthus, Nicotiana,Vernonia, Triticum, Hordeum, Oryza, Avena, Sorghum, Secale или другие представители Gramineae. 21. Растение, полученное способом по п.19. 22. Растительный материал, полученный из растения по п.21. 23. Растительный материал по п.22, где растительный материал представляет собой семена.
МПК / Метки
МПК: C12N 15/53, C12N 9/02, A01H 5/00, C12N 15/82
Метки: кислот, растений, жирных, аккумуляция, омега-7, семенах
Код ссылки
<a href="https://eas.patents.su/22-22985-akkumulyaciya-omega-7-zhirnyh-kislot-v-semenah-rastenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Аккумуляция омега-7 жирных кислот в семенах растений</a>
Предыдущий патент: Конструкты, связывающиеся с ron, и способы их использования
Следующий патент: Композиция для ухода за полостью рта
Случайный патент: Соединительная головка для сцепки рельсового транспортного средства