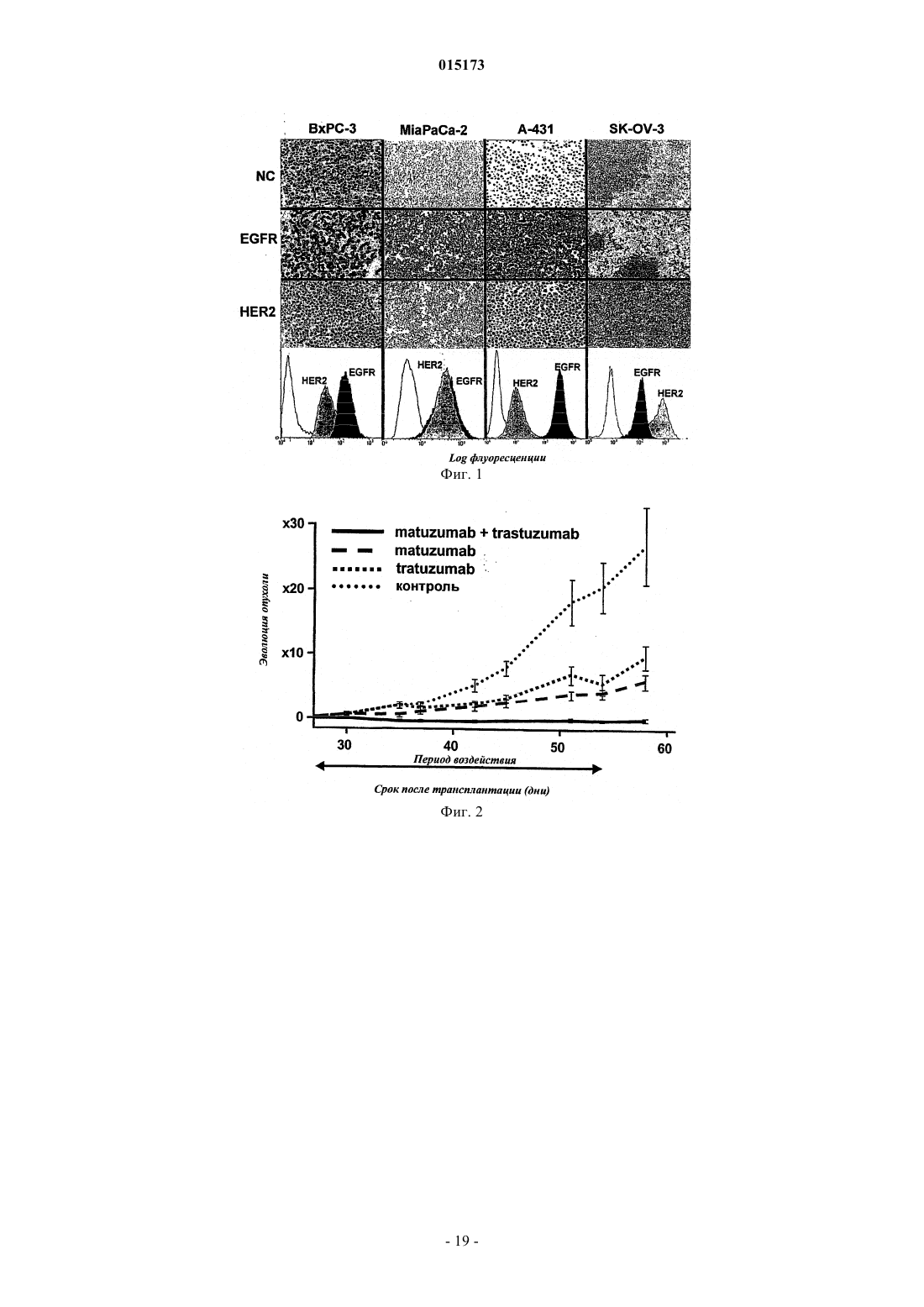
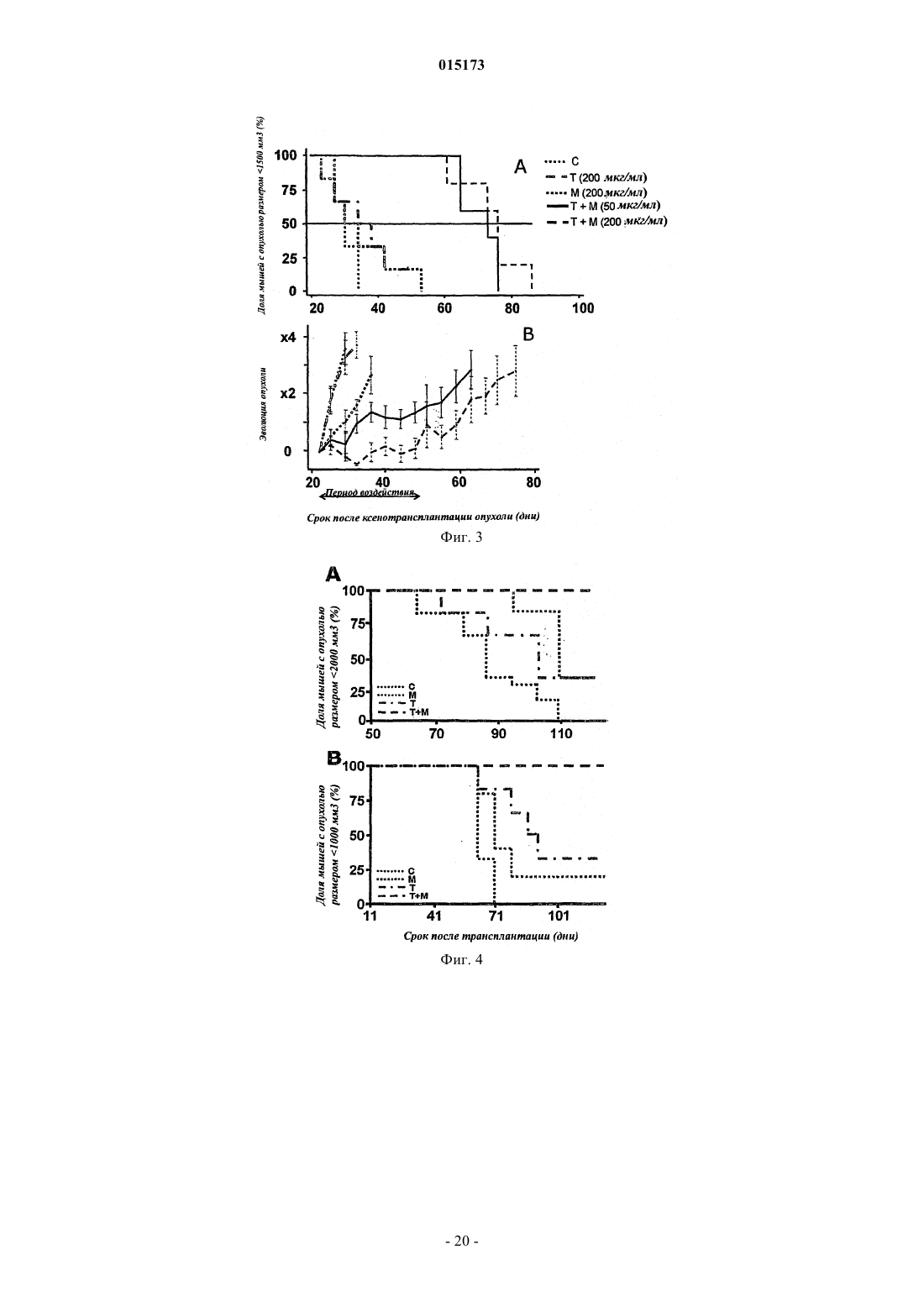
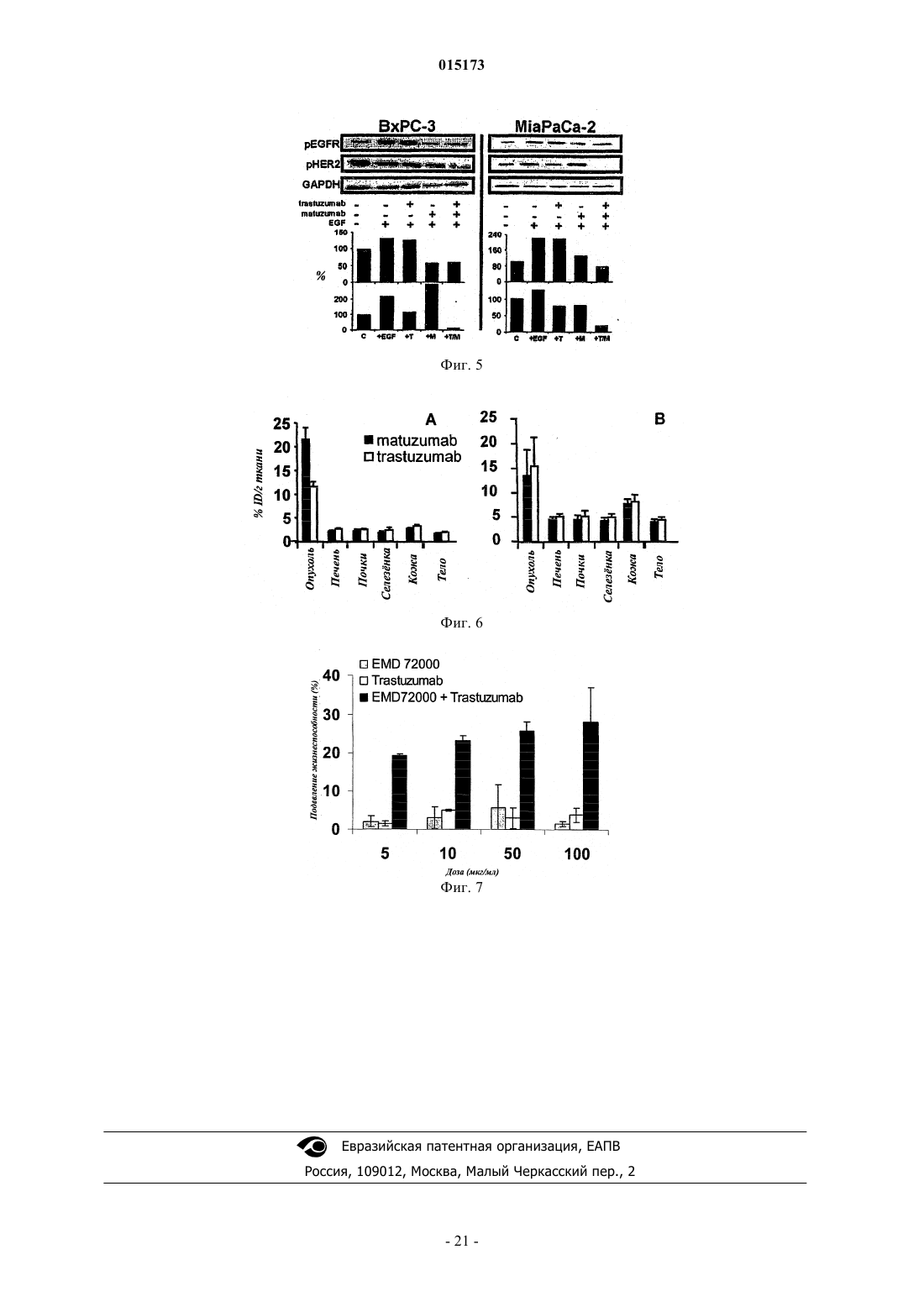
Комбинированная терапия с использованием антител к egfr и her2
Номер патента: 15173
Опубликовано: 30.06.2011
Авторы: Ларбуре Кристель, Азрия Давид, Джиллиз Стефен Д., Пелегрин Андре
Формула / Реферат
1. Применение полного антитела к HER2 в комбинации с полным антителом к EGFR для производства лекарства, предназначенного для лечения рака у пациента, где:
(i) указанный рак у указанного пациента сверхэкспрессирует EGFR, но не сверхэкспрессирует HER2 или экспрессирует HER2 на уровнях, которые недостаточны для значительной реакции на лечение только антителами к HER2;
(ii) указанные антитела к HER2, если они вводятся одни, не ингибируют или незначительно ингибируют димеризацию HER2 и/или гетеродимеризацию HER2/EGFR и
(iii) указанные антитела к EGFR, если они вводятся одни, значительно ингибируют димеризацию EGFR и/или гетеродимеризацию EGFR/HER2.
2. Применение по п.1, где указанные антитела к HER2 - это мышиные, химерные или гуманизированные моноклональные антитела mAb 4D5 (trastuzumab).
3. Применение по п.1, где указанные антитела к EGFR - это мышиные, химерные или гуманизированные моноклональные антитела mAb 425 (matuzumab).
4. Применение по п.1, где указанные антитела к HER2 - это мышиные, химерные или гуманизированные моноклональные антитела mAb 4D5 (trastuzumab), а указанные антитела к EGFR - это мышиные, химерные или гуманизированные моноклональные антитела mAb 425 (matuzumab).
5. Применение по п.1, где указанный рак - это рак поджелудочной железы.
6. Применение по п.1 дополнительно в комбинации с цитотоксическим средством, выбранным из группы, состоящей из цисплатина, доксорубицина, гемцитабина, доцетакселя, паклитакселя, блеомицина и иринотекана.
7. Применение по п.1, где одно или оба из указанных антител слиты на своем С-конце с биологически эффективным пептидом, полипептидом или белком, возможно через линкерный пептид, образуя таким путем иммуноцитокин.
8. Способ лечения рака, который экспрессирует HER2 и EGFR, у пациента, причем указанный рак экспрессирует HER2 на уровнях, которые недостаточны для значительной реакции на лечение указанными антителами к HER2, если они вводятся пациенту одни, при этом способ включает введение пациенту (i) полного антитела к HER2, которое, если вводится одно, не ингибирует или незначительно ингибирует димеризацию HER2 и/или гетеродимеризацию HER2/EGFR у указанного пациента; и (ii) полного антитела к EGFR, которое, если вводится одно, значительно ингибирует димеризацию EGFR и/или гетеродимеризацию EGFR/HER2 у указанного пациента.
9. Способ по п.8, где указанный рак - это рак поджелудочной железы.
10. Способ по п.8, где указанные антитела к HER2 - это мышиные, химерные или гуманизированные моноклональные антитела mAb 4D5 (trastuzumab).
11. Способ по п.8, где указанные антитела к EGFR - это мышиные, химерные или гуманизированные моноклональные антитела mAb 425 (matuzumab).
12. Способ по п.8, где указанные антитела к HER2 - это мышиные, химерные или гуманизированные моноклональные антитела mAb 4D5 (trastuzumab), а указанные антитела к EGFR - это мышиные, химерные или гуманизированные моноклональные антитела mAb 425 (matuzumab).
13. Способ по п.8, где дополнительно вводят цитотоксическое средство, выбранное из группы, состоящей из цисплатина, доксорубицина, гемцитабина, доцетакселя, паклитакселя, блеомицина и иринотекана.
14. Способ по п.8, где одно или оба из указанных антител слиты на своем С-конце с биологически эффективным пептидом, полипептидом или белком, возможно через линкерный пептид, образуя таким путем иммуноцитокин.
Текст
Изобретение относится к комбинированному применению антител к EGFR и антител к HER2 для лечения рака, особенно подходящему для рака, экспрессирующего высокие уровни EGFR и низкие уровни HER2. Изобретение имеет отношение, в частности, к моноклональным антителам"trastuzumab" (HERCEPTIN), нацеленным на рецепторы HER2, эффективность которых может быть значительно повышена in vivo путм комбинирования с моноклональными антителами"matuzumab" (hmAb 425, EMD 72000), нацеленными на рецепторы EGF. Комбинационное лечение пригодно для пациентов, страдающих раком, имеющим указанные характеристики экспрессии рецепторов, предпочтительно раком поджелудочной железы.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE); ЮНИВЕРСИТИ ОФ МОНПЕЛЬЕ 1; Л'ИНСТИТУТ НАСИОНАЛЬ ДЕ ЛЯ САНТЕ ЭТ ДЕ ЛЯ РЕШЕРШ МЕДИКАЛЬ; СЕНТР РЕЖИОНАЛЬ ДЕ ЛЮТТ КОНТР ЛЕ КАНСЕР 015173 Область техники, к которой относится изобретение Настоящее изобретение относится к комбинированному применению антител к рецептору фактора роста эпидермиса (epidermal growth factor receptor, EGFR) (ErbB1) и антител к HER2 (ErbB2) для лечения рака. Далее изобретение относится к лечению указанными антителами рака у индивидуума, причм опухолевые клетки экспрессируют высокие уровни EGFR и низкие или незначительные уровни HER2. В частности, изобретение относится к комбинационному лечению с применением моноклональных антител"trastuzumab" (HERCEPTIN), нацеленных на рецептор HER2, и "matuzumab" (hmAb 425, EMD 72000),нацеленных на рецептор фактора роста эпидермиса (рецептор EGF), или других антител к рецепторуEGF. Комбинационное лечение предпочтительно годится для больных раком пациентов, в тканях которых нет сверхэкспрессии HER2 или же которые экспрессируют HER2 в малых количествах, но сверхэкспрессируют EGFR. Предшествующий уровень техники Подкласс I суперсемейства тирозинкиназных рецепторов (ТКР) состоит из рецепторов ErbB и имеет четырх представителей: EGFR/ErbB1, HER2/ErbB2, ErbB3 и ErbB4. Все представители имеют внеклеточный связывающийся с лигандами участок, один, пронизывающий мембрану участок и цитоплазматический домен, содержащий тирозинкиназу. Тирозинкиназы - это класс ферментов, катализирующих перенос конечного фосфата аденозинтрифосфата на остатки тирозина в белковых субстратах. Рецепторы ErbB экспрессируются в различных тканях эпителия, мезенхимы и нейронов. При нормальных условиях активация рецепторов ErbB контролируется пространственной и временной экспрессией их лигандов, которые являются представителями семейства EGF факторов роста. Связывание лигандов с рецепторами ErbB индуцирует образование гомо- и гетеродимеров рецепторов и активацию внутреннего киназного домена, результатом чего является фосфорилирование специфических остатков тирозина в цитоплазматическом хвосте. Эти фосфорилированные остатки служат центрами присоединения для различных белков, вовлечение которых в процесс приводит к активации внутриклеточных сигнальных путей. Известно, что рецепторы EGFR и HER2 играют важную роль в регулировании пролиферации и дифференцировки клеток. Они имеют сильную склонность к соединению в ходе связывания с внеклеточным фактором роста с другими рецепторами HER в гомо- и/или гетеродимеры, что приводит к активации различных форм путей передачи сигнала, следствием чего является либо апоптоз, либо выживание клеток, либо их пролиферация. Очевидность такой сборки позволяет предположить, что в поведении опухолей играет ключевую роль не только экспрессия или сверхэкспрессия рецепторов, но также и связь между рецепторами HER (Kumagai et al. // PNAS. 1999. Vol. 98, p. 5526). В частности, связывание имеющих сродство к рецепторам лигандов с эктодоменом рецептора EGF часто приводит к мобилизацииHER2 в качестве предпочтительного партнра в процессе гетеродимеризации (см., например, Klapper etal. // PNAS. 1999. Vol. 96, p. 4995). Поскольку HER2 является единственным представителем семействаHER, не связывающимся с известным специфическим лигандом, то очевидно, что основная сигнальная функция в роли переносчика сигнала вытекает из его участия в образовании гетеродимерных рецепторных комплексов с рецептором EGF или другими рецепторами HER (см., например, Копеспу et al. //Cancer Res. 2006. Vol. 96, p. 1630). Недавние исследования (J. Schlessinger // Cell. 2002. Vol. 110, p. 669) показывают, что димеризация рецепторов направляется взаимодействиями рецептор-рецептор, в которых димеризации и активации рецепторов способствует выпячивание петель из соседних рецепторов. Димеризация рецепторов необходима для стимуляции имманентной каталитической активности и для самофосфорилирования рецепторов фактора роста по остаткам тирозина. Следует отметить, что тирозинкиназы белковых рецепторов способны претерпевать как гомо-, так и гетеродимеризацию, причм гомодимерные комбинации рецепторов обладают меньшим митогенным и транформирующим действием (отсутствие инициирования или слабое инициирование сигнальной активности), чем соответствующие гетеродимерные комбинации. Наиболее активными комплексами являются гетеродимеры, содержащие ErbB2 (Yarden and Sliwkowski // Nature Reviews, Molecular Cell Biology. 2001. Vol. 2, p. 127-137; Tzahar and Yarden // BBA. 1998. Vol. 1377, p. М 25-М 37). В клинике используют два важных типа ингибиторов ErbB: химерные, "очеловеченные" или полностью человеческие антитела к внеклеточному домену рецептора EGF или ErbB2 и низкомолекулярные ингибиторы тирозинкиназ (ИТК), конкурирующие с АТФ в тирозинкиназном домене рецептора. Поэтому оказывается целесообразным использовать для разработки новых стратегий противораковой терапии моноклональные антитела (mAb), которые с высоким сродством связываются с этими двумя представителями семейства ErbB (HER), а именно с рецептором EGF и с HER, что может эффективно подавлять димеризацию рецепторов. Однако до настоящего времени каждое из этих двух mAb использовали в противораковой терапии по отдельности в сочетании с различными химиотерапевтическими лекарствами (Slamon et al. // New Emgl. J. Med. 2001. Vol. 344, p. 783; BaseIga et al. // J. Clin. Oncol. 2000.Vol. 18, p. 904) или с недавнего времени в сочетании с различными лекарствами, обладающими свойством ингибировать тирозинкиназные рецепторы (см., например, Normanno et al. // Ann. Oncol. 2002. Vol. 13, p. 65). Однако действие малых молекул ингибиторов тирозинкиназ несравнимо с возможной биоло-1 015173 гической активностью, индуцируемой связыванием молекулы антитела с высоким молекулярным весом. Механизм противоопухолевой активности индивидуальных mAb к рецепторам ErbB/HER не вполне ясен. На основании экспериментальных результатов у мышей KO для рецепторов Fc можно с вескими основаниями предположить, что противоопухолевое действие в наибольшей степени связано с мобилизацией эффекторных клеток NK (естественные киллеры) по механизму зависящей от антител опосредованной клетками цитотоксичности (ADCC). Однако наличие ингибирования фосфорилирования и интернализации рецепторов, индуцируемых в опухолевых клетках mAb к рецепторам ErbB/HER свидетельствует в пользу передаваемого через рецептор сигнала к апоптозу или цитостатичности (Friedman et al. //PNAS. 2005. Vol. 102, p. 1915). Несколько антител к HER/ErbB проходят клинические испытания, они уже разрешены к применению и имеются в продаже. Это, например, matuzumab, cetuximab, panitumumab и trastuzumab. Очеловеченные моноклональные антитела 425, носящие также название matuzumab (hmAb 425, патент США 5558864; патент ЕР 0531472), и химерные моноклональные антитела 225 (cmAb 225), оба типа специфичны к рецептору EGF, проявили свою эффективность в клинических испытаниях. Было показано, что антитела с 225 (cetuximab, ERBITUX) ингибируют опосредованный EGF рост опухолевых клеток in vitro и ингибируют опухоли толстой и прямой кишки человека in vivo. Разрешение на их применение было получено в 2003 г. Было установлено, что эти антитела, так же как и вообще все антитела к рецептору EGF, действуют, помимо всего прочего, синергидно с некоторыми химиотерапевтическими средствами (например, с доксорубицином, адриамицином, таксолом и цисплатином), устраняяin vivo человеческие опухоли в мышиных моделях с ксенотрансплантацией (см., например, патент ЕР 0667165). Кроме того, можно показать, что комбинация антител с 225 к рецептору EGF со вторыми антителами к рецептору EGF matuzumab проявляют синергидное действие в моделях in vitro, и это указывает на то, что эти два типа антител, специфичных к одному и тому же рецептору, связываются с разными эпитопами на EGFR (WO 2004/032960). Далее было установлено, что мышиные антитела 4D5, специфичные к HER2/ErbB2, сенсибилизируют экспрессирующие ErbB2 линии клеток рака груди к цитотоксическому действию TNF- (патент США 5677171). Рекомбинантная очеловеченная версия, обозначаемая как humAb4D5-8, rhumAbHER2, trastuzumab или HERCEPTIN (патент США 5821337), проявляет клиническую активность у пациентов со сверхэкспрессирующим ErbB2 метастазирующим раком груди, которые перед этим получали экстенсивную противораковую терапию (Baselga et al. // J. Clin. Oncol. 1996. Vol. 14, p. 737-744).HERCEPTIN получил в 1998 г. разрешение на продажу для лечения пациентов с метастазирующим раком груди, у которых опухоли сверхэкспрессировали белок ErbB2. Хотя, как указано выше, терапевтическая эффективность trastuzumab при карциноме груди была наджно установлена, она весьма ограничена и проявляется лишь у 30% пациентов с раком груди, чьи опухоли сверхэкспрессируют HER2. Остальные 70% пациентов с раком груди не реагируют или слабо реагируют на trastuzumab, так как их собственные опухоли не сверхэкспрессируют или недостаточно экспрессируют HER2. При других типах рака или в индивидуальных случаях рака HER2 сверхэкспрессируется в значительной доле случаев в диапазоне от 43 до 69%, тогда как число случаев с сверхэкспрессией рецептора EGF обычно составляет от 45 до 95%. Однако, как правило, уровни экспрессии HER2 принципиально низки в большинстве опухолей. Кроме того, сверхэкспрессия EGFR и HER2 часто вызвана амплификацией кодирующего гена (Hynes et al. // Nat. Rev. Cancer. 2005. Vol. 5, p. 341). Таким образом, в настоящее время все согласны, что mAb к HER2 не действуют на опухоли с низким уровнем экспрессии HER2 или с недостаточной сверхэкспрессией, что имеет место, например, в клинике большинства карцином поджелудочной железы (см., например, Saxby et al. // J. Surg. Pathol. 2005. Vol. 29, p. 1125).Panitumumab (VECTIBIX) - это полностью человеческие антитела к EGFR, они недавно получили разрешение на применение в США (Schwartz et al. // Proc. Am. Soc. Clin. Oncol. 2002. Vol. 21, p. 24). Аденокарциномы поджелудочной железы остаются одним из типов злокачественных новообразований, наиболее трудно поддающихся лечению. Частота возникновения в течение последних 40 лет постоянно повышалась, и прогнозы остаются неутешительными, несмотря на потрясающие успехи в ранней диагностике и терапии. К моменту установления диагноза большинство пациентов (80-90%) имеют локализованные или метастазирующие опухоли. Даже в случае их полного хирургического удаления менее 20% пациентов живут в течение 5 лет (Wagner et al. // Br. J. Surg. 2004. Vol. 91 p. 586-594). Обычные способы лечения в сочетании с хирургией и одной только радиотерапией или с радиотерапией, комбинированной с химиотерапией, умеренно эффективны в ограничении и уменьшении локальной опухоли, но не дают реального эффекта в повышении времени жизни пациентов (Azria et al. // Bull. Cancer. 2002. Vol. 89, p. 369-379; Azria et al. // Pancreas. 2002. Vol. 25, p. 360-365; Li et al. // Lancet. 2004. Vol. 363,p. 1049-1057). Поэтому для лечения карциномы поджелудочной железы человека срочно необходимы новые подходы.-2 015173 Хорошо документировано, что аденокарциномы и дисплазии поджелудочной железы часто сверхэкспрессируют тирозинкиназные рецепторы. Сверхэкспрессия рецепторов EGF в панкреатическом раке связана с развитым заболеванием при описании состояния и с уменьшенным средним временем жизни. Значение экспрессии/сверхэкспрессии HER2 для прогноза панкреатического рака не столь ясно. Действительно, не было отмечено никакой корреляции между степенью дифференцировки опухоли и уровнем экспрессии HER2 в образцах из поджелудочной железы человека (Dugan et al. // Pancreas. 1997. Vol. 14,p. 229-236). Это можно объяснить, напомнив, что уровень содержания HER2 сам по себе не определяет митогенеза и что должна активироваться гетеродимеризация. Концепция блокирования EGFR и HER2 в принципе известна и применялась в других моделях, экспрессирующих высокие уровни EGFR и/или HER2. Был продемонстрирован аддитивный, но не синергидный эффект уменьшения пролиферации клеток in vitro при использовании комбинированного воздействия либо химерными моноклональными антителами к EGFR mAb 225 (cetuximab) с очеловеченными антителами к HER2 4D5 (trastuzumab) на линию клеток рака яичников человека OVCAR 420 (Ye et al. //Oncogene. 1999. Vol. 18, p. 731), либо trastuzumab с мышиным вариантом mAb 225 на линии клеток зависящего от EGFR рака прямой и толстой кишки (Kuwada et al. // Int. J. Cancer. 2004. Vol. 109, p. 291-301). Кроме того, различные группы исследователей применяли одновременное воздействие на HER1 иHER2, объединяя химический ингибитор киназы рецептора EGF ZD1839 (Iressa) с trastuzumab (Normannoet al. // Ann. Oncol. 2002. Vol. 13, p. 65-72), и установили, что в линиях клеток SK-BR-3 и ВТ-474 комбинация этих двух последних соединений индуцирует лучшее антипролиферативное действие, чем два компонента, применяемые порознь, особенно в смысле индукции апоптоза. Однако имеется скудная информация относительно эффективности антител и реальной функцииEGFR и HER2 в специфической раковой ткани, экспрессирующей низкие уровни по меньшей мере одного из этих рецепторов (например, при раке поджелудочной железы), при воздействии специфическими антителами к ErbB, и до настоящего времени ни в каких клинических исследованиях не была установлена эффективность совместного воздействия на эти два рецептора в этих опухолях соответствующими моноклональными антителами. На основании отсутствия эффективной терапии и данных об участии рецепторов EGFR и HER2 в специфических типах рака, экспрессирующих низкие уровни по меньшей мере одного из этих двух типов рецепторов, есть основания блокировать одновременно EGFR и HER2 в специфической модели рака, где преимущественно осуществляется высокая экспрессия EGFR, а экспрессия HER2 несущественна или происходит на низком уровне, причм указанный характер экспрессии установлен с помощью иммуноцитохимического анализа или с помощью метода проточной цитометрии. Сущность изобретения Согласно предлагаемому изобретению можно показать, что комбинация антител к HER2, таких какin vivo или по меньшей мере уменьшает и/или задерживает рост опухоли in vivo, однако предпочтительна только в раковых и опухолевых тканях, которые экспрессируют незначительные или низкие уровниHER2 и предпочтительно высокие уровни EGFR. Такой различный характер экспрессии указанных рецепторов ErbB можно обнаружить у многих типов рака, таких как рак поджелудочной железы. Различный характер экспрессии для специфической опухолевой ткани может быть также свойством индивидуума. Иными словами, возможно, что конкретная опухоль имеет различный характер экспрессии в отношении указанных рецепторов HER/ErbB у разных индивидуумов/пациентов, имеющих данную опухоль. Неожиданно оказалось, что комбинированное применение антител к HER2, таких как trastuzumab, с подходящими антителами к рецептору EGF, такими как matuzumab, для противораковой терапии в значительной степени синергидно, если в подвергаемом лечению типе рака сверхэкспрессируется рецепторEGF, но не HER2 или если в этом типе рака нет существенной экспрессии HER2 (уровень экспрессии низок), а уровни экспрессии EGFR выше, чем в соответствующей нормальной (не опухолевой) ткани. Эффективность такого комбинированного воздействия синергидно возрастает, если при этом используемые антитела к HER2 не имеют способности или имеют незначительную способность ингибировать димеризацию HER2, но используемые антитела к EGFR обладают способностью значительно ингибировать димеризацию EGFR. Эти находки являются новыми и непредсказуемыми даже с точки зрения принципиально известной концепции блокирования (взаимодействия) EGFR и HER2 или EGFR и EGFR различными эпитопами, как описано выше. Синергидное действие комбинации проявляется чрезвычайно сильно, если в конкретном виде рака нет сверхэкспрессии HER2, но имеется сверхэкспрессия EGFR. Описанное согласно настоящему изобретению синергидное действие на рост опухоли антителами,например trastuzumab (Herceptin) и matuzumab (EMD72000), можно объяснить, не связывая себя какойлибо теорией или гипотезой, различными механистическими воздействиями каждого из антител на гетеродимеризацию EGFR/HER2. Согласно настоящему изобретению полагают, что trastuzumab, как и любое потенциально подобное функционально антитело к HER2, связывается с доменом IV таким способом,что оно не ингибирует димеризацию, но вместо этого оказывается, что оно усиливает эндоцитоз рецеп-3 015173 тора HER2 и его исчезновение из клеточной мембраны. В противоположность этому, полагают, что EMD72000, как и любое потенциально подобное функционально антитело к EGFR, непосредственно ингибирует димеризацию EGFR. Natha et al. (// Cancer Res. 2004. Vol. 64, p. 2343-2346) установили, что trastuzumab и другое антитело к HER2, носящее названиеpertuzumab, действуют синергидно. Поскольку известно, что pertuzumab ингибирует димеризацию HER2,антитело к EGFR matuzumab, как и любое потенциально подобное функционально антитело к EGFR, может непредсказуемо играть согласно настоящему изобретению аналогичную роль в димеризации EGFR. Открытия настоящего изобретения показывают и подтверждают важность связи между различными рецепторами HER/ErbB. Было установлено, что HER2 действует как преимущественный партнррецептор в сочетании с другими представителями семейства HER, повышая сигнальный потенциал своего партнра по димеризации на нескольких уровнях. Согласно результатам настоящего изобретения стратегия одновременного воздействия на EGFR иHER2 подходящими моноклональными антителами может приводить при специфических предпосылках к терапевтическому успеху, обеспечивая синергидную эффективность в биологических системах с низким уровнем экспрессии рецептора HER2 в патологических условиях. Согласно настоящему изобретению воздействие и эффективность подходящих комбинируемых моноклональных антител к EGFR/HER2 зависит, по-видимому, не только от соответствующей экспрессии рецепторов, но также и от их способности воспринимать потенциал клеток в гомо- и/или гетеродимеризации. Эти результаты являются новыми и непредсказуемыми, даже если их рассматривать в связи с известной концепцией блокирования взаимодействия между EGFR и HER2 или между EGFR и EGFR через различные эпитопы (см. выше). В свете данной демонстрации синергидного терапевтического действия двух моноклональных антител к EGFR и HER2 на две линии клеток карциномы поджелудочной железы с умеренной экспрессиейHER2 и на одну линию клеток карциномы яичников, сверхэкспрессирующую оба рецептора HER, рассматривается степень того, насколько эти экспериментальные результаты могут иметь влияние на лечение карциномы поджелудочной железы и другие типы карцином. Известно, что в карциноме поджелудочной железы в значительном проценте случаев экспрессируются и EGFR, и HER2 (см., например,Tobita et al. // Int. J. Mol. Med. 2003. Vol. 11, p. 305), и было установлено, что экспрессия этих рецепторов участвует в инициации и развитии этой опухоли. Таким образом, в свете токсичности и весьма умеренных результатов по применению наиболее разработанных и интенсивных режимов химиотерапии и радиотерапии в случае данного типа рака (см., например, Czito et al. // J. Clin. Oncol. 2006. Vol. 24, p. 656), может оказаться необходимым рассмотреть комбинационное лечение моноклональными антителами к EGFR и HER2 пациентов с карциномами, экспрессирующими даже низкие уровни по меньшей мере одного из двух рецепторов HER. Для моноклональных антител к HER было тврдо установлено, что клинические успехи ограничиваются опухолями с заметной сверхэкспрессией рецептора (Slamon et al. // Semin. Oncol. 2001. Vol. 28, p. 13), тогда как в приведнных здесь опытах был продемонстрирован синергизм действия специфических антител к HER2 и специфических антител к EGFR в двух карциномах поджелудочной железы с экспрессией HER2 от низкой до умеренной. В различных линиях клеток карциномы было установлено, что воздействие малыми молекулами,ингибирующими тирозинкиназные рецепторы, такими как Iressa для EDFR (Normanno et al. // Ann. Oncol. 2002. Vol. 13, p. 65), или двойственным ингибитором киназ lapatinib (Konecny et al. // Cancer Res. 2006.Vol. 66, p. 1630) может обладать синергидным эффектом с воздействием моноклональными антителами кHER2. Однако синергидное действие может быть продемонстрировано в основном in vitro и исключительно в линиях клеток-мишеней карциномы, сверхэкспрессирующих HER2. Кроме того, действие малой молекулы со свойством ингибировать тирозинкиназы не может рассматриваться как идентичное действию большой молекулы антитела, связывающейся с внешним доменом рецепторов. В течение многих лет несколько групп представили исследования in vitro на суспензиях опухолевых клеток, которые показали, что одновременная инкубация с двумя типами моноклональных антител кEGFR и HER2 индуцирует более эффективное ингибирование фосфорилирования рецепторов и/или специфической интернализации рецепторов, чем инкубация только с одним из типов моноклональных антител [21-24]. Однако только одна из групп [23] провела ограниченные исследования in vivo, но не смогла продемонстрировать никакого синергизма в действии двух моноклональных антител. Таким образом, приведнные здесь результаты представляют первую экспериментальную демонстрацию in vivo давно ожидаемого нового усовершенствования противораковой терапии на основе синергидного действия двух типов моноклональных антител к EGFR и HER2. Кроме того, на основании приведнных здесь результатов можно предположить, что у пациента с карциномой груди с умеренной экспрессией HER2, которого не удатся лечить моноклональными антителами к HER2, можно достигнуть успеха синергидным применением двух типов моноклональных антител к HER/ErbB при условии, что опухоль экспрессирует также EGFR.-4 015173 В настоящее время исследуются три других способа лечения рака, основанные на синергидном действии двух моноклональных антител с различными специфичностями. Во-первых, проводится 1-я фаза клинических исследований для лечения лимфомы не типа Ходжкина комбинацией моноклональных антител к CD20 и CD22 (Leonard et al. // J. Clin. Oncol. 2005. Vol. 23, p. 5044). Однако распознаваемые этими двумя моноклональными антителами антигены сильно различаются и не способны к гетеродимеризации, которая характерна для двух рецепторов HER, являющихся мишенями для антител в представленных заявителями исследованиях. Во-вторых, в исключительно экспериментальных исследованиях используются моноклональные антитела к рецептору инсулиноподобного фактора роста (IGF-IR), который, как было показано, обладает в модели с пересадкой карциномы груди и лгких синергидным противоопухолевым действием при применении либо с химиотерапевтическим средством (vinorelbine), либо с антителами к EGFR (Goetsch et al.// Int. J. Cancer. 2005. Vol. 113, p. 316). Однако IGF-IR не принадлежит к семейству рецепторов HER и в смысле потенциального лечения применение IGF-IR менее ограничено типом опухоли, чем рецепторHER2. Третье экспериментальное исследование включает применение моноклональных антител к EGFR иVEGFR в модели с пересадкой карциномы поджелудочной железы (Tonra // Clin. Cancer Res. 2006.Vol. 12, p. 2197). Эти два использованных в данных исследованиях типа моноклональных антител не нацелены на одни и те же опухолевые клетки-мишени. Действительно, моноклональные антитела к VEGFR связываются с рецепторами, которые экспрессируются в клетках эндотелия, но не в клетках карциномы поджелудочной железы. Поэтому оказывается, что механизм действия двух моноклональных антител в этих исследованиях связан с параметрами васкуляризации опухоли и отличается от связывания двух моноклональных антител с двумя рецепторами HER/ErbB, расположенными на одних и тех же опухолевых клетках-мишенях, что определяет, по-видимому, представленное здесь синергидное противооопухолевое действие. В совокупности настоящее изобретение относится к следующему. Фармацевтическая композиция, содержащая антитела к EGFR и антитела к HER2(ErbB2) или их иммунологически эффективные фрагменты в эффективном количестве, возможно вместе с фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом, причм антитела кEGFR - это мышиные, химерные или очеловеченные mAb 425 (matuzumab, EMD72000), а антитела кHER2 - это мышиные, химерные или очеловеченные mAb 4D5 (trastuzumab, HERCEPTIN), предпочтительно очеловеченные варианты каждого типа из указанных антител. Соответствующая фармацевтическая композиция, причм указанные антитела к EGFR связываются с опухолевыми клетками, в которых рецептор EGF умеренно или в высокой степени экспрессируется или сверхэкспрессируется. Соответствующая фармацевтическая композиция, причм указанные антитела к HER2 связываются с опухолевыми клетками, в которых экспрессия рецептора HER2 низка или ниже, чем экспрессия EGFR. Соответствующая фармацевтическая композиция, причм опухолевые клетки - это клетки опухоли поджелудочной железы. Соответствующая фармацевтическая композиция, содержащая дополнительно цитотоксическое средство. Соответствующая фармацевтическая композиция, где цитотоксическое средство - это химиотерапевтическое средство, предпочтительно выбранное из группы, состоящей из цисплатина, доксорубицина,гемцитабина, доцетакселя, пацитакселя, блеомицина и иринотекана. Соответствующая фармацевтическая композиция, причм цитотоксическое средство - это ингибитор третьего рецептора ErbB, ингибитор рецептора VEGF, ингибитор тирозинкиназы, ингибитор протеин-киназы А, антиангиогенное средство или цитокин. Соответствующая фармацевтическая композиция, причм одно или каждое из указанных антител слито на свом С-конце с биологически эффективным пептидом, полипептидом или белком, по усмотрению через пептидный мостик, с образованием иммуноконъюгата, предпочтительно иммуноцитокина. Фармацевтический набор, включающий в себя (i) первую упаковку, содержащую антитела к EGFR или иммуноконъюгат с участием антител к EGFR, как они определены выше, или их иммунологически эффективную часть; и (ii) вторую упаковку, содержащую антитела к HER2 или иммуноконъюгат с участием антител к HER2, как они определены выше, или их иммунологически эффективную часть. Соответствующий фармацевтический набор, включающий в себя (iii) третью упаковку, содержащую цитотоксическое средство, как оно определено выше. Применение фармацевтической композиции, как она определена выше, для производства лекарства для лечения опухолей, экспрессирующих рецепторы ErbB. Соответствующее применение указанной фармацевтической композиции, причм указанная опухоль не сверхэкспрессирует HER2 или экспрессирует HER2 лишь в меньших количествах, чем EGFR. Соответствующее применение указанной фармацевтической композиции, причм указанные опухолевые клетки сверхэкспрессируют EGFR, но не HER2.-5 015173 Применение всех фармацевтических композиций, как они описаны здесь, для производства лекарства, нацеленного на рак, в комбинации с радиотерапией и/или химиотерапией. Фармацевтическая композиция, содержащая любые антитела к EGFR и любые антитела к HER2 в соответствии с общим аспектом и принципом настоящего изобретения, причм указанные антитела сами по себе не ингибируют гетеродимеризацию EGFR и HER2, но делают это при введении в комбинации. Соответствующая фармацевтическая композиция, причм антитела к EGFR связываются с подлежащими воздействию опухолевыми клетками, которые сверхэкспрессируют EGFR, а антитела к HER2 связываются с подлежащими воздействию опухолевыми клетками, которые не сверхэкспрессируютHER2 или экспрессируют HER2 в меньших или умеренных количествах в сравнении с указанной сверхэкспрессией EGFR. Соответствующая фармацевтическая композиция, причм указанные антитела к EGFR выбраны из группы мышиных, химерных или очеловеченных mAb 425 (matuzumab), а указанные антитела к HER2 выбраны из группы мышиных, химерных или очеловеченных mAb 4D5 (trastuzumab). Антитела с двойной специфичностью, содержащие первый центр (сайт) связывания с антигеном,связывающийся с EGFR, который предпочтительно происходит из мышиных, химерных или очеловеченных mAb 425 (matuzumab), и второй центр связывания с антигеном, связывающийся с HER2, который предпочтительно происходит из мышиных, химерных или очеловеченных mAb 4D5 (trastuzumab). Применение фармацевтической композиции, содержащей антитела к HER2 и антитела к EGFR для производства лекарства, предназначенного для лечения рака у индивидуума, причм указанный рак у указанного индивидуума экспрессирует EGFR и HER2, где HER2 экспрессируется на низких уровнях или таких уровнях, которые недостаточны для значительной реакции на лечение только антителами к HER2. Соответствующее применение, причм указанные антитела к HER2, если они вводятся одни, не ингибируют или ингибируют незначительно димеризацию HER2 и/или гетеродимеризацию HER2/EGFR, а указанные антитела к EGFR, если они вводятся одни, существенно ингибируют димеризацию EGFR и/или гетеродимеризацию EGFR/HER2. Соответствующее применение, причм указанный рак не сверхэкспрессирует HER2 и/или не сверхэкспрессирует EGFR. Соответствующее применение, причм указанные антитела к HER2 - это мышиные, химерные или очеловеченные mAb 4D5 (trastuzumab). Соответствующее применение, причм указанные антитела к EGFR - это мышиные, химерные или очеловеченные mAb 425 (matuzumab). Соответствующее применение, причм указанные антитела к HER2 - это мышиные, химерные или очеловеченные mAb 4D5 (trastuzumab), а указанные антитела к EGFR - это мышиные, химерные или очеловеченные mAb 425 (matuzumab). Соответствующее применение, причм указанный рак - это рак поджелудочной железы или рак груди. Соответствующее применение, причм указанные антитела - это иммунологически эффективные фрагменты, такие как фрагменты Fab'-(Fab')2. Соответствующее применение, причм дополнительно вводят цитотоксическое средство, предпочтительно выбранное из группы, состоящей из цисплатина, доксорубицина, гемцитабина, доцетакселя,пацитакселя, блеомицина и иринотекана, или из ингибитора рецептора VEGF, низкомолекулярного ингибитора тирозинкиназы, антиангиогенного средства или цитокина. Соответствующее применение, причм одно или оба из указанных антител слиты предпочтительно на свом С-конце с биологически эффективным пептидом, полипептидом или белком, по усмотрению через пептидный мостик, с образованием иммуноконъюгата. Соответствующее применение, причм указанный иммуноконъюгат является иммуноцитокином. Соответствующее применение, включающее антитела с двойной специфичностью, имеющие специфичность двух типов антител, как они определены выше и далее. Применение фармацевтической композиции, содержащей антитела к HER2 и антитела к EGFR для производства лекарства, предназначенного для повышения эффективности лечения рака у индивидуума указанными антителами к HER2, причм указанный рак у указанного индивидуума экспрессирует HER2 на низких уровнях или на уровнях, которые недостаточны для значительной реакции на лечение только указанными антителами к HER2, и экспрессирует EGFR на уровнях, достаточных для значительной реакции на антитела к EGFR. Соответствующее применение, причм указанные антитела к HER2, если они вводятся одни, не ингибируют или ингибируют незначительно димеризацию HER2 и/или гетеродимеризацию HER2/EGFR, а указанные антитела к EGFR, если они вводятся одни, существенно ингибируют димеризацию EGFR и/или гетеродимеризацию EGFR/HER2. Соответствующее применение, причм в указанном типе рака HER2 не сверхэкспрессируется, a-6 015173 Соответствующее применение, причм указанные антитела к HER2 - это мышиные, химерные или очеловеченные mAb 4D5 (trastuzumab), а указанные антитела к EGFR - это мышиные, химерные или очеловеченные mAb 425 (matuzumab). Соответствующее применение, причм указанный рак - это рак поджелудочной железы или рак груди. Способ лечения рака у индивидуума, который экспрессирует HER2 и EGFR, причм указанный рак у указанного индивидуума экспрессирует HER2 на уровнях, которые недостаточны для значительной реакции на антитела к HER2, когда они вводятся индивидууму одни, причм способ включает введение индивидууму антител к HER2, которые, если вводятся одни, не ингибируют или не ингибируют существенно димеризацию HER2 и/или гетеродимеризацию HER2/EGFR, и антител к EGFR, которые, если вводятся одни, существенно ингибируют димеризацию EGFR и/или гетеродимеризацию EGFR/HER2. Соответствующий способ, причм HER2 не сверхэкспрессируется и/или EGFR сверхэкспрессируется. Соответствующий способ, причм указанные антитела к HER2 - это мышиные, химерные или очеловеченные mAb 4D5 (trastuzumab). Соответствующий способ, причм указанные антитела к EGFR - это мышиные, химерные или очеловеченные mAb 425 (matuzumab). Соответствующий способ, причм указанные антитела к HER2 - это мышиные, химерные или очеловеченные mAb 4D5 (trastuzumab), а указанные антитела к EGFR - это мышиные, химерные или очеловеченные mAb 425 (matuzumab). Соответствующий способ, причм указанный рак - это рак поджелудочной железы или рак груди. Способ повышения эффективности лечения рака, который экспрессирует HER2 и предпочтительно сверхэкспрессирует EGFR, антителами к HER2, причм указанный рак не сверхэкспрессирует HER2 или экспрессирует HER2 на низких уровнях или таких уровнях, которые недостаточны для значительной реакции на лечение одними только указанными антителами к HER2; причм способ включает введение индивидууму антител к HER2, которые, если вводятся одни, не ингибируют или не ингибируют существенно димеризацию HER2 и/или гетеродимеризацию HER2/EGFR, и антител к EGFR, которые, если вводятся одни, существенно ингибируют димеризацию EGFR и/или гетеродимеризацию EGFR/HER2. Соответствующий способ, причм указанные антитела к HER2 - это мышиные, химерные или очеловеченные mAb 4D5 (trastuzumab), и/или указанные антитела к EGFR - это мышиные, химерные или очеловеченные mAb 425 (matuzumab). Соответствующий способ, причм рак - это рак поджелудочной железы или рак груди. Детальное описание Экспрессия EGFR и рецептора HER2 на поверхности клеток Иммуноцитохимический анализ клеток карциномы поджелудочной железы человека BxPC-3 показал высокий уровень EGFR (классифицирован как ), но отсутствие обнаружимых уровней экспрессии рецептора HER2 в сравнении с клетками карциномы яичников человека SK-OV-3 и клеток сравнения карциномы эпителия А-431, где уровни классифицированы на основании того же анализа соответственно какдля HER2 идля EGFR (фиг. 1). Вторая линия клеток рака поджелудочной железы MiaPaCa-2 также классифицирована как негативная для HER2 идля EGFR. Напротив, при использовании более чувствительной техники проточной цитометрии (Mimura et al.// Clin. Cancer Res. 2005. Vol. 11, p. 4898) в клетках BxPC-3 и MiaPaCa-2 может быть обнаружена умеренная экспрессия HER2 в сравнении с клетками SK-OV-3. Может быть подтверждена сверхэкспрессия EGFR клетками BxPC-3, но со слегка меньшим уровнем, чем в референсных клетках А-431. В клетках MiaPaCa-2 обнаружена умеренная и равная экспрессия рецепторов и EGFR, и HER2. В клетках SK-OV-3 установлена умеренная экспрессия EGFR и высокая экспрессия HER2 (фиг. 1). На основании весьма низкого уровня экспрессии HER2 в опухолевых клетках BxPC-3 и полученных результатов по биологическому распределению следует ожидать умеренной противоопухолевой активности trastuzumab in vitro и in vivo. Действительно, сверхэкспрессия HER2 является хорошо установленным диагностическим средством для определения чувствительности пациентов с раком груди к терапииtrastuzumab (Slamon et al. // Semin. Oncol. 2001. Vol. 28, p. 13), поэтому только пациенты с установленным иммуногистохимическим способом уровнем экспрессии 3+ HER2 в опухоли успешно реагируют на эту адресованную терапию. Маловероятная экспрессия HER2/neu может объяснить, почему trastuzumab не используется в настоящее время в клиниках для лечения рака поджелудочной железы. Исследования подтвердили неэффективность монотерапии trastuzumab в замедлении роста опухолей, проявляющих низкую экспрессиюHER2. Следует заметить, что использованные в этих исследованиях дозы trastuzumab были в 3-12 раз выше, чем дозы, использованные в опытах согласно настоящему изобретению.-7 015173 Противоопухолевая активность matuzumab и/или trastuzumab по отношению к двум ксенотрансплантатам карциномы поджелудочной железы и ксенотрансплантату карциномы яичников Вначале была испытана терапевтическая эффективность моноклональных антител к EGFR и HER2 по отдельности или в комбинации на ксенотрансплантатах BxPC-3 в мышах nude. Чтобы оценить эффективность действия различных форм терапии mAb на опухолевые ксенотрансплантаты различного размера, были проанализированы две серии представительных экспериментальных результатов: первая для опухолей относительно малого объма (7749 мм 3, опыт S), а вторая для более крупных опухолей(503205 мм 3, опыт L). Результаты из опыта S (фиг. 2), полученные в группах из 8 мышей, получавших 50 мкг каждого из типов антител 2 раза в неделю в течение 4 недель, показали значительно более высокий уровень ингибирования роста опухолей в группах с комбинацией антител по сравнению с группами,получавшими только один тип антител (Р=0,002). Дальнейший анализ тех же экспериментальных результатов показал, что коэффициенты увеличения опухолей к концу лечения значительно выше у мышей,получавших только mAb к EGFR или только mAb к HER2 (соответственно 4,92,1 и 6,44,4), по сравнению с группой с комбинацией mAb (0,70,5) (табл. 1, верхняя часть). Более того, только комбинированное введение mAb индуцировало два случая полной ремиссии опухолей. Результаты дополнительного опыта на мышах с ксенотрансплантатами BxPC-3 такого же размера, получавших в 4 раза большие дозы каждого из типов антител (200 мкг) по отдельности или в комбинации, полностью подтвердили предыдущие результаты, с коэффициентами увеличения опухолей намного большими для введения одиночных антител по сравнению с комбинированной терапией mAb (табл. 1, нижняя часть). Таблица 1 Коэффициент увеличения объма ксенотрансплантата В добавление к этому, полная ремиссия опухоли у 3 из 5 мышей наблюдалась к концу лечения только в группе с комбинированной терапией. Сопоставление результатов лечения с различными дозами антител, приведнное в табл. 1, показывает, что 50 мкг каждого из типов антител в комбинации индуцировало значительное снижение коэффициента увеличения опухолей (0,7+0,5) по сравнению с полученными у мышей, которые получали в 4 раза более высокие дозы одного типа антител (4,3 и 5,5). При сопоставлении лечения дозами 50 и 200 мкг не было отмечено никакой зависимости от дозы, что позволяет предположить, что синергизм связывания двух типов антител с двумя рецепторами HER важнее, чем абсолютные количества антител. Это наблюдение ясно свидетельствует в пользу синергидного,а не аддитивного действия. Результаты для ксенотрансплантатов опухолей BxPC-3 большего размера(опыт L), полученные в 4 группах по 6 мышей, которым вводили 200 мкг каждого типа антител, представленные адаптированными кривыми Kaplan-Meier (фиг. 3 А), что средняя задержка роста опухолей до достижения объма 1500 мм 3 значительно более длительная (73 дня) у мышей, получавших комбинацию антител, по сравнению с мышами, получавшими только один тип антител (антитела к HER2 - 30 дней,антитела к EGFR - 34 дня), Р=0,001. Кривые протяжнности времени роста опухоли для того же опыта(фиг. 3B) подтверждают, что время достижения 3-кратного размера опыта значительно больше (Р 0,001) для группы с комбинированным лечением, чем для двух групп с лечением одним типом антител. Интересно, что в дополнительной группе из 6 мышей с опухолями большого размера, получавшими только 50 мкг каждого типа антител в комбинации, время (70 дней) достижения опухолью объма 1500 мм 3 значительно больше, чем для опухолей в группах, получавших 200 мкг каждого из типов антител порознь(30 и 34 дня) (фиг. 3 А). Это подтверждает, что для опухолей большего размера двойная специфичность двух типов антител более эффективна, чем абсолютные дозы антител, и что больший эффект действия на опухоли обусловлен синергидным, а не аддитивным действием двух типов антител. Способность ингибировать рост опухоли для комбинации антител к EGFR и к HER2 была далее испытана для ксенотрансплантатов второй линии карциномы поджелудочной железы человека MiaPaCa-2, которые также экспрессируют низкие уровни HER2. В группах по 6 мышей проводили инъекции дважды в неделю 50 мкг каждого из типов антител по отдельности или в комбинации, начиная с достижения опухолями объма 64+5 мм 3 и продолжая их в течение 4 недель. Животных забивали, когда опухоль достигала объма-8 015173 2000 мм 3. Адаптированные кривые выживания для опухолей, достигающих такого объма, показывают(фиг. 4 А), что к 120-му дню в группе с введением комбинации антител не наблюдалось ни одной опухоли размером больше 2000 мм 3, тогда как 4 из 6 мышей в обеих группах, получавших один тип антител,имели опухоли такого размера (Р=0,0072). Более того, полную ремиссию опухоли можно было наблюдать только в группе с терапией комбинацией антител. Интересно, что в отдельном опыте воздействие на ксенотрансплантаты MiaPaCa-2 такого же размера (656 мм 3) всего лишь 25 мкг каждого из типов антител в комбинации было эффективно в противоопухолевом действии, в то время как инъекции одиночных типов антител почти не подавляли рост опухолей. Для этого типа опухоли результаты также подтверждают важную роль воздействия двумя типами антител, специфичными к различным рецепторам HER. Чтобы проверить, может ли терапевтический успех комбинированного действия двух типов моноклональных антител к рецепторам HER, наблюдавшийся в двух линиях клеток карциномы поджелудочной железы, иметь место также и для другого типа карциномы, подобное сравнение инъекций одиночных типов антител и их комбинации было проведено в референсной линии карциномы яичников SK-OV-3,которые, как известно, сверхэкспрессируют и рецептор EGF, и рецептор HER2. Терапию, состоящую во введении 200 мкг либо mAb к EGFR, либо mAb к HER2, либо комбинации двух типов mAb, начинали в 4 группах по 6 мышей (имелся ещ контроль без воздействия), когда ксенотрансплантаты SK-OV-3 имели средний объм 424 мм 3. Как и ожидалось на основании сверхэкспрессии обоих рецепторов HER в этих опухолевых клетках, наблюдалась терапевтическая активность каждого из одиночных типов антител с 1 и 2 полными ремиссиями в группах мышей, получавших соответственно антитела к EGFR и антитела кHER2. Однако инъекция обоих типов антител вызвала намного большее ингибирование роста опухолей у всех мышей, включая три полных ремиссии. Представление результатов в адаптированных кривых выживания для опухолей до достижения ими объма 1000 мм 3 (фиг. 4B) показывает, что опухоли всех 6 мышей, получавших комбинацию mAb, не достигали объма 1000 мм 3 в течение периода наблюдения 120 дней, в то время как для 50% мышей задержка в достижении этого объма опухоли составляла 69 дней и 85 дней в группах мышей, получавших соответственно антитела к EGFR и к HER2 (Р=0,0001). Эти результаты подтверждают терапевтический синергизм действия двух типов мышиных mAb к рецепторам HER на ксенотрансплантаты карциномы яичников человека и позволяют предположить, что комбинированная инъекция этих двух mAb может быть полезна для лечения многих типов карцином, экспрессирующих рецепторы EGFR и HER2. Ингибирование автофосфорилирования рецепторов. Способность антител matuzumab или trastuzumab, используемых по отдельности или в комбинации,ингибировать in vitro тирозинкиназную активность EGFR и HER2 в клетках BxPC-3 и MiaPaCa-2 можно оценить с помощью вестерн-блотирования с количественным определением фосфорилированных белков с применением денситометрии и прибора для визуализации NIH imager 6.3 (фиг. 5). Результаты анализа двух линий клеток карциномы поджелудочной железы сравнивали после инкубации в течение 48 ч с двумя типами mAb либо по отдельности, либо в комбинации с последующей 10-минутной активацией фактором EGF. Прежде всего следует отметить, что обе линии клеток проявляют относительно высокий фоновый уровень фосфорилирования для рецепторов EGFR и HER2. Как и ожидалось, обработка экзогенным EGF индуцирует высокий уровень автофосфорилирования тирозина у EGFR и HER2 в обеих линиях клеток. Интересно, что инкубация с антителами в комбинации приводит намного к большему ингибированию фосфорилирования HER2 в обеих линиях клеток, чем это наблюдается при воздействии только mAb к HER2. Для EGFR ингибирование фосфорлирования двумя типами mAb менее противоречиво; оно почти идентично и в клетках MiaPaCa-2 и BxPC-3 лишь слегка выше по сравнению с ингибированием, получаемым при введении mAb только к EGFR. Эти результаты, а также приведнные в литературе результаты более обширных исследований in vitro [22-24] могут объяснить описанный здесь поразительный терапевтический синергизм действия in vivo двух типов моноклональных антител к рецепторам HER на ксенотрансплантаты карциномы человека. Несмотря на высокий уровень экспрессии EGFR в линии клеток поджелудочной железы BxPC-3,антитела matuzumab (EMD72000) неэффективны или только слабо эффективны в ингибировании роста опухоли, если они используются одни в дозе 50 или 200 мкг на инъекцию, что подтверждает корреляцию между экспрессией EGFR и лечебной эффективностью антител к EGFR. Это можно проиллюстрировать на второй модели in vivo рака поджелудочной железы (MiaPaCa-2), где мышам вводили инъекцией 50 мкг антител EMD72000 дважды в неделю в течение 4 недель. Однако противоопухолевая активность комбинации намного выше незначительной противоопухолевой активности антител, используемых поодиночке в качестве единственного компонента. Что касается уменьшенного объма опухолей и исследования жизнеспособности in vitro, действие объединнных антител в модели BxPC-3 явно синергидно и ни в коей мере не представляет собой аддитивный эффект, вычисленный на основании эффективностей одиночных компонентов. Этот эффект особенно поразителен на протяжении 4-недельного периода лечения, когда в группе с комбинированным лечением не наблюдается никакой прогрессии опухолей. Подобную эффективность такого лечения можно видеть как у малых, так и у больших опухолей поджелудочной железы.-9 015173 Принцип комбинационного лечения моноклональными антителами, имеющими различную специфичность к антигенным структурам одних и тех же или различных рецепторов, описан здесь в качестве примера для лечения позитивных по EGFR и HER2 опухолей поджелудочной железы. Однако этот принцип не ограничивается раком поджелудочной железы и может быть распространн на другие типы рака,имеющие такие же или подобные характеристики экспрессии рецепторов. Если не указано иное, используемые в настоящем изобретении термины и фразы имеют такие значения и определения, как указано далее. Кроме того, эти определения и значения описывают изобретение более подробно, включая предпочтительные варианты осуществления. По определению, термин "сверхэкспрессируется" означает согласно настоящему изобретению, что соответствующий рецептор экспрессируется на поверхности опухолевых клеток с более высокой, предпочтительно значительно более высокой, скоростью и/или в больших количествах, чем на поверхности нормальных неопухолевых клеток, предпочтительно происходящих из той же самой ткани. Обычно EGFR и HER2 экспрессируются с очень малой или малой скоростью на многих клетках нормальных тканей в зависимости от конкретной ткани и конкретного образца. В опухолевой ткани или на опухолевой ткани эти скорости, как правило, значительно выше, особенно для EGFR. Что касается,например, рака груди, HER2 существенно сверхэкспрессируется по меньшей мере у 30% пациентов и экспрессируется до более высокого уровня, чем EGFR. Для рака поджелудочной железы ситуация, как правило, противоположна. Во многих случаях ситуация, по-видимому, также зависит от генетической предрасположенности подлежащего лечению индивидуума. Поэтому термины "умеренная экспрессия","значительная экспрессия" и т.д. являются относительными терминами и должны рассматриваться в контексте конкретной ситуации. Однако в общем случае согласно настоящему изобретению термин "низкая экспрессия" означает, если иное не определено, отсутствие "сверхэкспрессии" в том смысле, как это указано выше. Термин "умеренная экспрессия" или "значительная экспрессия" означает, если не указано иное, что "сверхэкспрессия" происходит с более низкой/умеренной или значительной/более высокой скоростью. "Значительно" означает в этом контексте, что соответствующие опухолевые клетки экспрессируют рецептор в количествах, которые измеримо выше, чем делают это нормальные неопухолевые клетки конкретного индивидуума."Рецептор" или "молекула рецептора" - это растворимый или связанный/ассоциированный с мембраной белок или гликопротеин, содержащий один домен или более доменов, с которыми связывается лиганд, образуя комплекс рецептор-лиганд. При связывании лиганда, который может быть агонистом или антагонистом, рецептор активируется или инактивируется и может запускать или блокировать путь передачи сигнала."Рецептор ErbB" - это рецепторный белок тирозинкиназа, который принадлежит, как уже было определено выше, к семейству рецепторов ErbB и включает рецепторы EGFR/HER1 (ErbB1), HER2 (ErbB2),ErbB3 и ErbB4 и других представителей этого семейства, которые могут быть идентифицированы в будущем. Рецептор ErbB, как правило, имеет внеклеточный домен, который может связывать лиганд ErbB; липофильный трансмембранный домен; консервативный внутриклеточный тирозинкиназный домен и расположенный на карбоксильном конце сигнальный домен, содержащий несколько остатков тирозина,которые могут быть фосфорилированы. Рецептор ErbB может иметь "нативную последовательность" аминокислот рецептора ErbB или его "вариант аминокислотной последовательности". Предпочтительно рецептор ErbB имеет нативную последовательность человеческого рецептора ErbB. Обозначения"ErbB1" и "HER1" и "EGFR" используются здесь как взаимозаменяемые и относятся к человеческому белку HER1. Обозначения "ErbB2" и "HER2" используются здесь как взаимозаменяемые и относятся к человеческому белку HER2. Рецепторы ErbB1 (EGFR) предпочтительны согласно настоящему изобретению. Термин "антагонист/ингибитор рецептора ErbB" относится к биологически эффективной молекуле,которая связывается с рецептором ErbB и блокирует или ингибирует его. Так, блокируя рецептор, антагонист предотвращает связывание лиганда (агониста) ErbB и активацию комплекса агониста/лиганда с рецептором. Антагонисты ErbB могут быть нацелены на HER1 (ErbB1, EGFR), HER2 (ErbB2), ErbB3 иErbB4. Предпочтительными антителами согласно настоящему изобретению являются антитела к HER1 и(cetuximab, ERBITUX). Наиболее предпочтительными антителами к HER2 являются антителаHERCEPTIN, поставляемые фирмой Genentech/Roche. Термин "антагонист/ингибитор тирозинкиназы" согласно настоящему изобретению относится к природным или синтетическим агентам, которые способны ингибировать или блокировать тирозинкиназы, в том числе рецепторы тирозинкиназ. Так, термин включает как таковые антагонисты/ингибиторы рецептора ErbB, как они определены выше. Кроме упомянутых выше и далее антител к рецепторам ErbB,наиболее предпочтительными агентами - антагонистами тирозинкиназ согласно этому определению являются химические соединения, которые показали свою эффективность в лекарственной монотерапии- 10015173 рака груди и простаты. В этом контексте одним из наиболее перспективных противораковых агентов является gefitinib (IRESSA, Astra Zeneca), который, как описано, проявляет выдающуюся терапевтическую активность и превосходную переносимость у пациентов с раком крупных клеток лгких (non-smallcell lung cancer, NSCLC), а также с развитым раком головы и шеи. Предпочтительно доза химических ингибиторов тирозинкиназ, как они определены выше, составляет от 1 пг/кг до 1 г/кг в день в расчте на вес тела. Более предпочтительно доза ингибиторов тирозинкиназ составляет от 0,01 до 100 мг/кг в день в расчте на вес тела. Изобретение относится не только к антителам к HER/ErbB, как было указано, но также к их биологически активным фрагментам и иммуноконъюгатам, как они определены выше, особенно к иммуноцитокинам. Интактные антитела, в зависимости от аминокислотной последовательности их константных участков, могут принадлежать к различным "классам антител (иммуноглобулинов)". Существуют 5 основных классов интактных антител: IgA, IgD, IgE, IgG и IgM, некоторые из них могут быть далее подразделены на "подклассы" (изотипы), например IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжлой цепи, которые соответствуют различным классам антител, обозначаются соответственно , , ,и . Предпочтительным основным классом антител согласно настоящему изобретению является IgG, более детально IgG1 и IgG2. Термин "моноклональные антитела", как он использован здесь, относится к антителам, полученным из популяции в основном гомогенных антител, т.е. составляющие популяцию индивидуальные антитела идентичны, за исключением возможных естественным образом возникающих мутаций, которые могут присутствовать в минимальных количествах. Моноклональные антитела высокоспецифичны, так как нацелены на единственный антигенный сайт. Более того, в противоположность поликлональным антителам, препараты которых включают различные антитела, нацеленные на различные детерминанты (эпитопы), каждое моноклональное антитело нацелено на единственный детерминант антигена. Методы получения моноклональных антител включают метод гибридом, описанный Kohler and Milstein // Nature. 1975. Vol. 256, p. 495 и в "Monoclonal Antibody Technology, The Production and Characterization of RodentBurdon et al. Elsevier Science Publishers, Amsterdam, 1985), или они могут быть получены с помощью хорошо известных методов на основе рекомбинантных ДНК (см., например, патент США 4816567). Моноклональные антитела можно также выделить из фаговых библиотек антител с использованием техники, описанной, например, в работах Clackson et al. // Nature. 1991. Vol. 352, p. 624-628 иMarks et al. // J. Mol. Biol. 1991. Vol. 222, p. 581-597. Термин "химерные антитела" означает антитела, в которых часть тяжлой и/или лгкой цепи идентична или гомологична соответствующим последовательностям в антителах, происходящих из определнного вида или принадлежащих к определнному классу или подклассу антител, тогда как остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, происходящих из другого вида или принадлежащих к другому классу или подклассу антител, а также фрагментам таких антител, поскольку они проявляют необходимую биологическую активность (например: патент США 4816567; Morrison et al. // Proc. Nat. Acad. Sci. USA. 1984. Vol. 81, p. 6851-6855). Методы получения химерных и очеловеченных антител также известны в данной области. Например, методы получения химерных антител включают методы, описанные в патентах Boss (Celltech) и Cabilly"Очеловеченные антитела" - это формы не человеческих (например, от грызунов) химерных антител, которые содержат минимальную последовательность, происходящую из иммуноглобулина не человеческого происхождения. В своей большей части очеловеченные антитела представляют собой человеческие иммуноглобулины (реципиентные антитела), в которых остатки из гипервариабельного участка(CDR) реципиента заменены остатками из гипервариабельного участка донорного антитела, имеющего необходимую специфичность, аффинность и активность, происходящего от животного, не являющегося человеком, такого как мышь, крыса, кролик или примат, не являющийся человеком. В некоторых случаях остатки области разветвления (framework region, FR) человеческого иммуноглобулина заменены соответствующими участками не человеческого происхождения. Кроме того, очеловеченные антитела могут содержать остатки, которые отсутствуют в реципиентном антителе или в донорном антителе. Эти модификации делают, чтобы дополнительно усовершенствовать конструкцию антител. Как правило, очеловеченное антитело содержит в основном все или по меньшей мере один, а обычно два вариабельных домена, в которых все или в основном все из гипервариабельных петель соответствуют петлям не человеческого иммуноглобулина, а все или в основном все из FR имеют последовательности человеческого иммуноглобулина. По усмотрению, очеловеченные антитела могут содержать также часть константного участка иммуноглобулина (Fc), обычно участка человеческого иммуноглобулина. Методы создания очеловеченных антител описаны, например, Winter (патент США 5225539) и Boss (Celltech, патент США 4816397)."Фрагменты антител" содержат часть интактного антитела, предпочтительно представляющую собой его антигенсвязывающий или вариабельный участок. Примеры фрагментов антител включают Fab,Fab', F(ab')2, фрагменты Fv и Fc, "diabodies", линейные антитела, однонитевые молекулы антител; а также многоспецифические антитела, собранные из фрагментов антител. "Интактное" антитело - это антитело,которое содержит антигенсвязывающий вариабельный участок, а также константный домен лгкой цепи(CL) и константные домены тяжлой цепи СН 1, СН 2 и СН 3. Предпочтительно, чтобы интактное антитело имело одну или более из эффекторных функций. Расщепление антител папаином дат два идентичных антигенсвязывающих фрагмента, называемых фрагментами "Fab", каждый из которых содержит один антигенсвязывающий сайт, участки CL и СН 1 и остаточный фрагмент "Fc", чь название отражает его способность легко кристаллизоваться. Участок "Fc" антител содержит, как правило, СН 2, СН 3 и шарнирный участок из представителей основного класса антител IgG1 или IgG2. Шарнирный участок представляет собой группу из приблизительно 15 аминокислотных остатков, которые соединяют участок СН 1 с участком СН 2-СН 3. Обработка пепсином дат фрагмент "F(ab')2", который содержит два антигенсвязывающих сайта и ещ способен к перекрстному связыванию антигена. "Fv" - это минимальный фрагмент антитела, который содержит полные сайты распознавания и связывания антигена. Этот участок представляет собой димер одного вариабельного домена тяжлой цепи и одного вариабельного домена лгкой цепи в тесной нековалентной ассоциации. Именно в такой конфигурации три гипервариабельных участка(CDR) каждого вариабельного домена взаимодействуют, определяя антигенсвязывающий сайт на поверхности димера VH-VL. Все вместе 6 гипервариабельных участков придают антителу специфичность в связывании антигена. Однако даже одиночный вариабельный домен (или половина Fv, содержащая только 3 специфических для антигена гипервариабельных участка) способеа распознавать и связывать антиген, хотя и с меньшим сродством, чем полный связывающий сайт. Фрагмент "Fab" также содержит константный домен лгкой цепи и первый константный домен(СН 1) тяжлой цепи и имеет только один антигенсвязывающий сайт. Фрагменты "Fab'" отличаются от фрагментов Fab добавлением нескольких аминокислотных остатков на карбоксильном конце домена СН 1 тяжлой цепи, в том числе одного цистеина или нескольких цистеинов из шарнирного участка антитела. Фрагменты антитела F(ab')2 изначально были получены как пары фрагментов Fab' с цистеинами шарнирного участка между ними. Известны также другие химические сшивки фрагментов антител (см.,например, Hermanson "Bioconjugate Techniques". Academic Press, 1996; патент США 4342566). Фрагменты антител "однонитевой Fv", или "scFv", содержат домены V антитела, причм эти домены находятся в одной полипептидной цепи. Предпочтительно полипептид Fv дополнительно содержит полипептидный мостик между доменами VH и VL, что позволяет scFv образовать необходимую структуру для связывания антигена. Однонитевые антитела Fv известны, например из источников: Pluckthun "The Pharmacology of Monoclonal Antibodies". Vol. 113. Rosenburg and Moore, Springer-Verlag, New York, 1994, p. 269315; WO 93/16185; патент США 5571894; патент США 5587458; Huston et al. II Proc. Natl. Acad. Sci."Антитела с двойной специфичностью" ("биспецифические антитела") (Bab) - это одиночные, бивалентные антитела (или их иммунотерапевтически эффективные фрагменты), которые имеют два антигенсвязывающих сайта с различной специфичностью. Согласно настоящему изобретению Bab характеризуют как Bab mAb1, mAb2, где mAb1 и mAb2 обозначают антигенсвязывающие сайты из mAb1 иmAb2. Например, первый антигенсвязывающий сайт нацелен на рецептор ангиогенеза (например, интегрин или рецептор VEGF), тогда как второй антигенсвязывающий сайт нацелен на рецептор ErbB (например, EGFR или HER2). Биспецифические антитела могут быть получены с помощью химической методики (Kranz et al. // Proc. Natl. Acad. Sci. USA. 1981. Vol. 78, p. 5807), с помощью техники "polydoma" (см. патент США 4474893) или с помощью техники рекомбинантной ДНК, все из которых известны сами по себе. Дополнительные методы описаны в WO 91/00360, WO 92/05793 и WO 96/04305. Биспецифические антитела могут быть также приготовлены из одноцепочечных антител (см., например, Huston et al. //Proc. Natl. Acad. Sci. USA. 1988. Vol. 85, p. 5879; Skerra and Pluckthun // Science. 1988. Vol. 240, p. 1038). Они представляют собой аналоги вариабельных участков антител, полученные в виде одиночной полипептидной цепи. Чтобы приготовить связывающий агент с двойной специфичностью, одноцепочечные антитела можно соединить вместе химически или с помощью известных в данной области методов генетической инженерии. Можно также получить биспецифические антитела согласно настоящему изобретению с помощью последовательностей лейциновой "застжки" (zipper). Применяемые для этого последовательности происходят из участков лейциновых застжек факторов транскрипции Fos и Jun (Landschulzet al. // Science. 1988. Vol. 240, p. 1759; для обзора см. Maniatis and Abel // Nature. 1989. Vol. 341, p. 24). Лейциновые застжки представляют собой специфические аминокислотные последовательности длиной приблизительно 20-40 остатков с лейцином обычно в каждом седьмом остатке. Такие последовательности застжки образуют амфипатические -спирали с расположенными в линию на гидрофобной стороне остатками лейцина для образования димера. Пептиды, соответствующие лейциновым застжкам белковFos и Jun, преимущественно образуют гетеродимеры (O'Shea et al. // Science. 1989. Vol. 245, p. 646). Содержащие застжку биспецифические антитела и методы их получения раскрыты также в WO 92/10209 и- 12015173 Термин "иммуноконъюгат" относится к слитому белку и обозначает антитело или иммуноглобулин или их иммунологически эффективный фрагмент, который слит с помощью ковалентной связи с молекулой, не обладающей иммунологической эффективностью. Предпочтительно этот партнр по слиянию это пептид или белок, который может быть гликозилирован. Указанная молекула, не являющаяся антителом, может быть присоединена к С-концу константного участка тяжлой цепи антитела или к N-концу вариабельного участка лгкой и/или тяжлой цепи. Партнр по слиянию может быть присоединн через молекулу-мостик, которая, как правило, представляет собой пептид, содержащий 3-15 аминокислотных остатков. Иммуноконъюгаты согласно настоящему изобретению представляют собой слитые белки, состоящие из иммуноглобулина или его иммунотерапевтически активного фрагмента, нацеленного на рецептор ErbB, и предпочтительно цитокина, такого как TNF-, IFN- или IL-2, или другого токсического агента. Предпочтительно, чтобы эти молекулы на основе пептида или белка были присоединены своимN-концом к С-концу указанного иммуноглобулина, который является его Fc частью. Термин "цитокин" это общее название для белков, высвобождаемых одной популяцией клеток и действующих на другие клетки как межклеточные медиаторы (посредники). Примерами таких цитокинов являются лимфокины,монокины и традиционные полипептидные гормоны. В числе цитокинов находится гормон роста, такой как человеческий гормон роста, N-метионилированный гормон роста человека и гормон роста крупного рогатого скота; паратироидный гормон; тироксин; инсулин; проинсулин; релаксин; прорелаксин; гликопротеиновые гормоны, такие как фолликуло-стимулирующий гормон (FSH), тироид-стимулирующий гормон (TSH) и лютеинизирующий гормон (LH); фактор роста печени; фактор роста фибробластов; пролактин; лактоген плаценты; мышиный ассоциированный с гонадотропином пептид; ингибин; активин; фактор роста эндотелия сосудов (VEGF); интегрин; тромбопоэтин (ТРО); факторы роста нервов, такие как NGF; фактор роста тромбоцитов; трансформирующие факторы роста (TGF), такие как TGF иTGF; эритропоэтин (ЕРО); интерфероны, такие как IFN-, IFN- и IFN-; факторы стимуляции роста колоний, такие как М-CSF, GM-CSF и G-CSF; интерлейкины, такие как IL-1,IL-1 а, IL-2, IL-3, IL-4, IL-5,IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12; и TNF- или TNF-. Предпочтительными цитокинами согласно настоящему изобретению являются интерфероны, TNF- и IL-2. Термин "иммунотерапевтически или иммунобиологически эффективный" относится к биологическим молекулам, которые вызывают у млекопитающего иммунный ответ. Более конкретно, термин относится к молекулам, которые могут распознавать и связывать антиген. Обычно иммунотерапевтически эффективными являются антитела, фрагменты антител и слитые белки с участием антител, имеющие их антигенсвязывающие сайты (определяющие комплементарность участки, CDR). Терапевтическое применение настоящего изобретения включает в качестве конкретного варианта осуществления введение дополнительных терапевтически эффективных средств, которые усиливают требуемый эффект, например токсичность для опухоли или цитостатическую эффективность, или снижают или предотвращают нежелательные побочные эффекты. Так, изобретение включает комбинацию таких средств с фармацевтической композицией, определнной и заявленной выше и далее, причм указанные средства могут быть другими антагонистами рецепторов ErbB, антагонистами рецепторов VEGF,цитокинами, иммуноконъюгатами с цитокинами, антиангиогенными средствами, антигормональными средствами или вообще цитотоксическими средствами. Целью настоящего изобретения является также комбинация композиций, как они здесь определены, с радиотерапией в соответствии с известными методами. Термин "цитотоксическое средство", как он использован в данном контексте, определн очень широко и относится к веществу, которое ингибирует или предотвращает функцию клеток, и/или вызывает разрушение клеток (гибель клеток), и/или проявляет противоопухолевое/противопролиферативное действие, например предотвращает прямо или опосредованно развитие, созревание или распространение новообразованных опухолевых клеток. Термин включает также многообразно такие средства, которые обладают цитостатическим действием и ни в коей мере не обладают цитотоксическим действием. Термин "химиотерапевтическое средство" является частным случаем термина "цитотоксическое средство" и обозначает конкретно химические агенты, обладающие антинеопластическим действием,предпочтительно непосредственно на опухолевые клетки, а менее прямо через механизмы, такие как модификация биологической реакции. Подходящие химиотерапевтические средства согласно настоящему изобретению - это предпочтительно природные или синтетические химические соединения. Большое количество антинеопластических химических агентов имеются в продаже, подвергаются клиническим исследованиям и доклинической оценке, и они могут быть включены в настоящее изобретение для лечения опухолей/новообразований путм комбинационной терапии вместе с антагонистами рецепторов, как заявлено и описано в настоящем изобретении. Термин включает, главным образом, средства, как они определены выше, а также следующее: другие антагонисты ErbB (такие как антитела к ErbB), антиангиогенные средства, ингибиторы тирозинкиназ, ингибиторы протеинкиназы А, члены семейства цитокинов,радиоактивные изотопы и токсины, такие как токсины с ферментативной активностью бактериального,грибного, растительного или животного происхождения. Предпочтительными химиотерапевтическими средствами являются амифостин (этиол), цисплатин, дакарбазин (DTIC), дактиномицин, мехлорэтамин(дауноксом), прокарбазин, митомицин, цитарабин, этопозид, метотрексат, 5-фторурацил (5-FU), винбластин, винкристин, блеомицин, пацитаксель (таксол), доцетаксель (таксотер), альдеслейкин, аспарагиназа,бисульфан, карбоплатин, кладрибин, камптотецин, СРТ-11, 10-окси-7-этил-камптотецин (CN38), гефитиниб (Iressa), дакарбазин, флоксуридин, флударабин, оксимочевина, ифосфамид, идарубицин, месна, интерферон-, интерферон-, иринотекан, митоксантрон, топотекан, лейпролид, мегестрол, мелфалан, меркаптопурин, пликамицин, митотан, пегаспаргаза, пентостатин, пипоброман, пликамицин, стрептозоцин,тамоксифен, тенипозид, тестолактон, тиогуанин, тиотера, горчичный урацил, винорелбин, хлорамбуцил и их комбинации. Наиболее предпочтительными химиотерапевтическими средствами согласно настоящему изобретению являются цисплатин, гемцитабин, доксорубицин, пацитаксель (таксол) и блеомицин. Термины "рак" и "опухоль" относятся к физиологическому состоянию у млекопитающих или описывают это состояние, которое в основном характеризуется нерегулируемым ростом клеток. С помощью фармацевтических композиций согласно настоящему изобретению можно лечить опухоли, такие как опухоли груди, сердца, лгких, тонкого кишечника, прямой кишки, селезнки, почек, мочевого пузыря,головы и шеи, яичников, простаты, мозга, поджелудочной железы, кожи, костей, костного мозга, крови,тимуса, матки, яичек, шейки матки и печени. Опухоли, которые предпочтительно могут подвергаться лечению молекулами антител согласно настоящему изобретению, это тврдые опухоли или метастазы опухолей, которые в больших количествах экспрессируют рецепторы ErbB, особенно рецепторы ErbB1,такие как рак груди, рак простаты, рак головы и шеи, SCLC, рак поджелудочной железы, но и экспрессируют также в меньших количествах рецепторы ErbB2 (HER2). Термин "биологически/функционально эффективное" или "терапевтически эффективное (количество)" относится к лекарству/молекуле, которое приводит к возникновению биологической функции или к изменению биологической функции in vivo или in vitro и которое эффективно в конкретном количестве для лечения заболевания или расстройства у млекопитающего, предпочтительно человека."Радиотерапия". Согласно настоящему изобретению на опухоли можно дополнительно воздействовать радиацией или радиоактивными фармацевтическими средствами. Источник радиации может быть по отношению к подлежащему лечению пациенту либо внешним, либо внутренним. Если источник внешний по отношению к пациенту, такая терапия известна как радиационная терапия внешним пучком (EBRT). Если источник радиации внутренний для пациента, лечение называют брахитерапией (ВТ). Некоторые типичные радиоактивные атомы, которые использовались, включают радий, цезий-137, иридий-192, америций-241,золото-198, кобальт-57, медь-67, технеций-99, йод-123, йод-131 и индий-111. Можно также пометить агенты согласно настоящему изобретению радиоактивными изотопами. В настоящее время радиационная терапия является стандартным методом для воздействия на неудалимые или неоперабельные опухоли и/или на метастазы опухолей. Лучшие результаты наблюдались пи комбинации радиотерапии с химиотерапии."Фармацевтическое воздействие". Средства согласно настоящему изобретению могут вводиться парентерально путм инъекции или путм постепенного вливания в течение какого-то периода времени. Хотя подлежащая воздействию ткань обычно доступна в организме при системном введении и поэтому чаще всего на них воздействуют внутривенным введением терапевтических композиций, рассматриваются также и другие ткани и способы доставки, если есть основания считать, что целевая ткань содержит молекулу-мишень. Поэтому средства согласно настоящему изобретению могут вводиться внутриглазным путм, внутривенно, внутрибрюшинно, внутримышечно, подкожно, в полости, чрескожно, ортотопически и вливанием и могут также доставляться перистальтическими способами. Терапевтические композиции согласно настоящему изобретению содержат физиологически переносимый носитель вместе с имеющим отношение к делу средством, как оно описано здесь, растворнным или диспергированным в нм в качестве активного ингредиента. Термин "фармацевтически приемлемый", как он использован здесь, относится к композициям, носителям, разбавителям и реагентам, которые представляют собой материалы, которые можно вводить млекопитающему без возникновения нежелательных физиологических эффектов, таких как тошнота,головокружение, желудочное расстройство и т.п. Приготовление фармацевтической композиции, содержащей растворнные или диспергированные активные ингредиенты, хорошо известно в данной области и не нуждается в обосновании или формулировке. Обычно такие композиции готовят как инъекционные препараты или как жидкие растворы или суспензии. Однако могут быть также приготовлены тврдые формы, пригодные для растворения или суспендирования в жидкости перед использованием. Препарат может быть также эмульгированным. Активный ингредиент может быть смешан с наполнителями, которые фармацевтически приемлемы и совместимы с активным ингредиентом, в количествах, подходящих для применения в описанных здесь терапевтических методах. Подходящими наполнителями являются,например, вода, солевой физиологический раствор, декстроза, глицерин, этанол или подобные им и их- 14015173 комбинации. Кроме того, если необходимо, композиция может содержать небольшие количества вспомогательных веществ, таких как увлажняющие или эмульгирующие агенты, буферные агенты для поддержания рН и подобные им для повышения эффективности активного ингредиента. Терапевтическая композиция согласно настоящему изобретению может включать фармацевтически приемлемые соли содержащихся в ней компонентов. Фармацевтически приемлемые соли включают соли, полученные добавлением кислоты (образующиеся с участием свободных аминогрупп полипептида), которые образуются с помощью неорганических кислот, таких как, например, соляная или фосфорная кислота, или органических кислот, таких как, например, уксусная, винная, миндальная и подобные кислоты. Соли, образующиеся с участием свободных карбоксильных групп, могут быть получены с помощью неорганических оснований, таких как, например, гидроокиси натрия, калия, аммония, кальция или железа, и таких органических оснований, как изопропиламин, триэтиламин, 2-этиламино-этанол, гистидин, прокаин и подобные им. Физиологически переносимые носители известны в данной области. Примерами жидких носителей являются стерильные водные растворы, не содержащие материалов, кроме активных ингредиентов и воды, или содержащие буфер, такой как фосфат натрия при физиологическом значении рН, физиологический солевой раствор или оба из них, т.е. забуференный фосфатом физиологический солевой раствор. Кроме того, водные носители могут содержать более одной буферной соли, а также соли, такие как хлориды натрия и калия, декстрозу, полиэтиленгликоль и другие растворители. Жидкие композиции могут содержать также жидкие фазы, добавляющиеся к воде или исключающие воду. Примерами таких дополнительных жидких фаз являются глицерин, растительные масла, такие как масло семян хлопчатника, и водно-масляные эмульсии. Обычно терапевтически эффективное количество иммунотерапевтического агента, например в форме блокирующих рецепторы ErbB (ErbB1, ErbB2) антител или конъюгатов с соответствующими антителами, - это такое количество, которое при введении в составе физиологически переносимой композиции достаточно для достижения концентрации в плазме от приблизительно 0,01 мкг/мл до приблизительно 100 мкг/мл, предпочтительно от приблизительно 1 до приблизительно 5 мкг/мл и обычно около 5 мкг/мл. Установленная иначе дозировка может варьировать от приблизительно 0,1 мг/кг до приблизительно 300 мг/кг, предпочтительно от приблизительно 0,2 до приблизительно 200 мг/кг, наиболее предпочтительно от приблизительно 0,5 до приблизительно 20 мг/кг в одном или более введении в день в течение от одного до нескольких дней. Если иммунотерапевтическое средство находится в форме фрагментов моноклональных антител или конъюгатов, количество легко установить на основании массы фрагмента/конъюгата по отношению к массе целого антитела. Предпочтительная молярная концентрация антитела-антагониста в плазме составляет от приблизительно 2 мкМ/л до приблизительно 5 мМ/л, предпочтительно от приблизительно 100 мкМ до приблизительно 1 мМ. Типичная дозировка активного средства, которым предпочтительно является химическое цитотоксическое или химиотерапевтическое средство согласно настоящему изобретению (это не иммунотерапевтическое средство и не пептид/белок, не являющийся иммунотерапевтическим), составляет от 10 до 1000 мг, предпочтительно от приблизительно 20 до приблизительно 200 мг, наиболее предпочтительно от 50 до 100 мг в день на 1 кг веса тела. Фармацевтические композиции согласно настоящему изобретению могут содержать средства, которые позволяют ослабить побочные эффекты или избежать побочных эффектов, связанных с комбинированной терапией согласно настоящему изобретению ("вспомогательная терапия"). Такие средства включают (но не ограничиваются ими) такие средства, например, которые снижают токсическое действие противоопухолевых лекарств (например, ингибиторы рассасывания костей, средства сердечной защиты). Такие вспомогательные средства предотвращают или уменьшают частоту возникновения тошноты, рвоты, связанных с химиотерапией, радиотерапией или хирургической операцией, или снижают частоту возникновения инфекции, связанной с введением миелосупрессивных противораковых лекарств. Вспомогательные средства хорошо известны в данной области. Иммунотерапевтические средства согласно настоящему изобретению могут вводиться с добавлением адъювантов, подобных BCG, и стимуляторов иммунной системы. Кроме того, композиции могут включать иммунотерапевтические средства или химиотерапевтические средства, которые содержат цитотоксически эффективные радиоактивные изотопы или другие цитотоксические средства, такие как цитотоксические пептиды (например, цитокины) или цитотоксические лекарства, и подобные им. Источник линий клеток Линии клеток и условия культивирования. Линии человеческих клеток карциномы поджелудочной железы (BxPC-3 и MiaPaCa-2), яичников (SK-OV-3) и эпидермоида вульвы (А-431) были получены из коллекции American Type Culture Collection (ATCC; Rockville, MD, USA). Линию клеток BxPC-3 культивировали в среде RPMI-1640 (Gibco, Paisley, UK); линии клеток MiaPaCa-2, SK-OV-3 и А-431 культивировали в среде DMEM (Gibco). Культуральные среды имели добавки в соответствии с рекомендациями АТСС.- 15015173 Краткое описание чертежей Фиг. 1. Иммуноцитохимический анализ и анализ методом проточной цитометрии экспрессии EGFR и HER2 в двух линиях клеток карциномы поджелудочной железы (BxPC-3 и MiaPaCa-2) и в двух референсных линиях клеток (А-431 и SK-OV-3), использованных как позитивные контроли соответственно для EGFR и HER2.NC (негативные контроли): ткани инкубировали только с иммунопероксидазным конъюгатом. При анализе методом проточной цитометрии зачерннные и заштрихованные пики обозначают окрашивание клеточной поверхности антителами соответственно к EGFR и к HER2. Белые пики представляют контроли, полученные с клетками, инкубированными только с мечеными FITC вторичными антителами. Фиг. 2. Действие trastuzumab и matuzumab одних или в комбинации на рост ксенотрансплантатовBxPC-3 малого размера в мышах nude (опыт S). Средний объм опухолей перед воздействием составлял 7749 мм 3. Мыши (по 8 в группе) получали внутрибрюшинные инъекции 50 нг каждого из типов mAb дважды в неделю в течение 4 недель. Результаты представлены как показатель прогрессирования опухоли:[(конечный объм)-(начальный объм)]/(начальный объм). С: контроль; Т: trastuzumab; M: matuzumab; T+M: trastuzumab+matuzumab. Фиг. 3. Действие trastuzumab и matuzumab одних или в комбинации на рост ксенотрансплантатовBxPC-3 большого размера в мышах nude (опыт L). Средний объм опухолей перед воздействием составлял 502205 мм 3. Мыши (по 5 в группе) получали внутрибрюшинные инъекции 50 или 200 нг каждого из типов mAb дважды в неделю в течение 4 недель. А: кривые выживаемости Kaplan-Meier, представленные как функция времени и адаптированные для роста первичных опухолей до достижения объма 1500 мм 3. С: контроль; Т: trastuzumab (200 мкг на инъекцию); М: matuzumab (200 мкг на инъекцию); T+M: trastuzumab+matuzumab (50 или 200 мкг каждого из типов антител на инъекцию).B: результаты таких же опытов, представленные в виде кривых прогрессирования опухолей. Стрелки с двумя остриями обозначают период воздействия. Фиг. 4. Действие trastuzumab и matuzumab одних или в комбинации на рост ксенотрансплантатовMiaPaCa-2 в мышах nude. Средний объм опухолей (по 6 мышей в группе) перед воздействием составлял 645 мм 3. Мыши получали внутрибрюшинные инъекции 50 мкг каждого из типов mAb дважды в неделю в течение 4 недель начиная с 15- и до 43-го дня. А: кривые выживаемости Kaplan-Meier, представленные как функция времени и адаптированные для роста первичных опухолей до достижения объма 2000 мм 3. С: контроль; Т: trastuzumab; М: matuzumab; T+M: trastuzumab+matuzumab.B: Действие trastuzumab и matuzumab одних или в комбинации на рост ксенотрансплантатовSK-OV-3 в мышах nude. Средний объм опухолей (по 6 мышей в группе) перед воздействием составлял 424 мм 3. Мыши получали внутрибрюшинные инъекции 200 мкг каждого из типов mAb дважды в неделю в течение 4 недель, начиная с 11- и до 40-го дня. Кривые выживаемости Kaplan-Meier, представленные как функция времени и адаптированные для роста первичных опухолей до достижения объма 1000 мм 3. С: контроль; Т: trastuzumab; M: matuzumab; T+M: trastuzumab+matuzumab. Фиг. 5. Действие in vitro trastuzumab и matuzumab одних или в комбинации на фосфорилированиеEGFR и HER2 на линиях клеток BxPC-3 и MiaPaCa-2. Клетки инкубировали с 10 нг/мл каждого из типов mAb в течение 48 ч с последующей обработкой в течение 10 мин. 100 нг/мл EGF (или без EGF). Верхняя часть: анализ вестерн-блотированием, GAPDH - контроль нанесения. Нижняя часть: количественное определение фосфорилирования рецепторов, выраженного как процент от контроля и представленного в виде гистограммы, показывает ингибирование, индуцированное воздействием при указанных условиях. С: контроль; Т: trastuzumab; M: matuzumab;T+M: trastuzumab+matuzumab. Фиг. 6. Локализация опухолей и биологическое распределение радиоактивно меченых антителmatuzumab и trastuzumab в бестимусных мышах NMRI с ксенотрансплантатами человеческой карциномы поджелудочной железы BxPC-3 (А) или MiaPaCa-2 (B). Мыши получали внутривенные инъекции совместно 125I-matuzumab и 131I-trastuzumab. Мышей забивали через 48 ч после инъекции. Опухоли и все нормальные органы взвешивали и измеряли дифференциальную радиоактивность в двухканальном сцинтилляционном счтчике. Результаты представлены как процентная доля введнной дозы радиоактивности на 1 г ткани (% ID/г). Фиг. 7. Ингибирование in vitro роста клеток BxPC-3, обработанных trastuzumab и matuzumab одними или в комбинации. Клетки BxPC-3 высевали в количестве 10000 клеток на ячейку в планшет с 96 ячейками и оставляли для прикрепления на ночь. На следующий день клетки обрабатывали trastuzumab и matuzumab одними или в комбинации с фиксированным соотношением 1:1. Через 5 дней проводили анализ MTS, как описа- 16015173 но в разделе "Материалы и методы". Каждая величина представлена как среднее значениестандартное отклонение (n=6). Примеры Пример 1. Исследование ингибирования опухолей in vivo. Все опыты in vivo проводили в соответствии с существующими во Франции нормативами для экспериментальных исследованиях на животных (AgreementВ 34-172-27). Мыши nude, самки в возрасте 6-8 недель бестимусных мышей NMRI и бестимусных мышей BALB/c получали соответственно от(3,5106), MiaPaCa-2 (5106) и SK-OV-3 (5106) вводили подкожной инъекцией в правый бок бестимусных мышей nude NMRI (модель BxPC-3) и BALB/c (MiaPaCa-2 и SK-OV-3). Клетки MiaPaCa-2 были суспендированы в 50% культуральной среды и 50% Matrigel (BD Biosciences, Le Pont De Claix, France). Мыши с опухолями были случайным образом распределены по различным группам для воздействия, когда опухоли достигли приблизительного объма, указанного в каждом опыте. Для модели BxPC-3 действие антител исследовали на опухолях малого размера (опыт S) и на опухолях большого размера (опыт L). Мыши получали внутрибрюшинные инъекции 0,9% NaCl, trastuzumab, matuzumab или обоих типов mAb в соотношении 1:1. Количество каждого из типов введнных инъекцией mAb было 50 или 200 нг на инъекцию, в зависимости от опыта, дважды в неделю в течение 4 недель подряд. Размеры опухолей измеряли дважды в неделю с помощью кронциркуля, их объмы рассчитывали по формулеD1D2D3/2. Развитие опухолей рассчитывали по формуле[(конечный объм)-(начальный объм)]/(начальный объм). Результаты представляли также в виде адаптированных кривых выживания Kaplan-Meier, вводя время, необходимое опухоли для достижения установленного объма 1000 мм 3 для ксенотрансплантатовSK-OV-3, 1500 мм 3 для ксенотрансплантатов BxPC-3 и 2000 мм 3 для ксенотрансплантатов MiaPaCa-2, в зависимости от скорости роста опухолей. Среднюю задержку определяли как время, в которое 50% мышей имели опухоль, достигшую установленного объма. Для опыта S в модели BxPC-3 коэффициент прироста в течение периода воздействия рассчитывали, разделив объм опухоли к концу воздействия(55-й день) на объм к началу воздействия (27-й день). Пример 2. Иммуноцитохимические анализы. Экспрессию рецепторов анализировали в залитых парафином клетках, фиксированных AFA (формолуксусная кислота). Анализ экспрессии EGFR проводили с использованием набора EGFR pharmDx kit(DakoCytomation, Carpinteria, CA, USA) согласно рекомендациям поставщика. В качестве хромогена использовали диаминобензидин (Dakocytomation), секции слегка контрастировали гематоксилином. В качестве первичных антител для детектирования HER2 использовали кроличьи поликлональные антитела(Dakocytomation). Пример 3. Анализ с помощью иммуноблотирования. Клетки BxPC-3 и MiaPaCa-2, высеянные в количестве 106 клеток на 24 ч в чашки Петри, подвергали голоданию в течение 2 дней в среде без факторов роста (среда SM) и обрабатывали 10 нг/мл trastuzumab,matuzumab или обоих типов антител при фиксированном соотношении 1:1 (имелся контроль без антител). После инкубации в течение 48 ч клетки инкубировали в течение 10 мин в среде SM в присутствии или без 100 нг/мл EGF, дважды промывали и лизировали буфером (CliniSciences SA, Montrouge, France),содержащим 100 нМ PMSF, 100 мМ фторид натрия, 1 мМ ортованат натрия и одну таблетку полной смеси ингибиторов протеаз (Sigma, St. Louis, МО). После электрофореза в 8% полиакриламидном геле с додецилсульфатом натрия в условиях отсутствия восстановления белки переносили на мембраны поливинилиден-дифторида (Millipore Co., Bedford, MA), насыщенные PBS с 0,1% Твин 20 и 5% обезжиренного сухого молока, затем инкубировали с антителами к фосфорилированным формам EGFR и HER2, полученными от фирмы Cell Signaling Technology (Beverley, MA). Чтобы обеспечить равный перенос, иммуноблоты также анализировали с помощью антител к GAPDH (глицеральдегид-3-фосфат-дегидрогеназа)(Chemicon International, Australia). Пример 4. Анализ выживаемости клеток. Действие trastuzumab и/или EMD72000 на выживаемость клеток оценивали путм анализа с применением соли тетразолия (MTS) и реагента на электронное сопряжение (PMSF). Вкратце, клетки BxPC-3 высевали в планшет для микротитрования с 96 ячейками в количестве 10000 клеток на ячейку в 100 мкл среды. Через 24 ч клетки обрабатывали антителами при концентрациях в диапазоне от 5 до 100 нг/мл. После инкубации в течение 96 ч клетки контактировали с реагентом MTS (3-(4,5-диметилтиазол-2-ил)-5(3-карбокси-метоксифенил)-2-(4-сульфофенил)-2 Р-тетразолий) и инкубировали при 37 С в течение 2 ч. Оптическое поглощение измеряли при 490 нм, процент ингибирования выживаемости рассчитывали как процент пролиферирующих клеток по отношению к не подвергавшимся воздействию контролями. Все опыты были выполнены в 3 повторах.- 17015173 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение полного антитела к HER2 в комбинации с полным антителом к EGFR для производства лекарства, предназначенного для лечения рака у пациента, где:(i) указанный рак у указанного пациента сверхэкспрессирует EGFR, но не сверхэкспрессируетHER2 или экспрессирует HER2 на уровнях, которые недостаточны для значительной реакции на лечение только антителами к HER2;(ii) указанные антитела к HER2, если они вводятся одни, не ингибируют или незначительно ингибируют димеризацию HER2 и/или гетеродимеризацию HER2/EGFR и(iii) указанные антитела к EGFR, если они вводятся одни, значительно ингибируют димеризациюEGFR и/или гетеродимеризацию EGFR/HER2. 2. Применение по п.1, где указанные антитела к HER2 - это мышиные, химерные или гуманизированные моноклональные антитела mAb 4D5 (trastuzumab). 3. Применение по п.1, где указанные антитела к EGFR - это мышиные, химерные или гуманизированные моноклональные антитела mAb 425 (matuzumab). 4. Применение по п.1, где указанные антитела к HER2 - это мышиные, химерные или гуманизированные моноклональные антитела mAb 4D5 (trastuzumab), а указанные антитела к EGFR - это мышиные,химерные или гуманизированные моноклональные антитела mAb 425 (matuzumab). 5. Применение по п.1, где указанный рак - это рак поджелудочной железы. 6. Применение по п.1 дополнительно в комбинации с цитотоксическим средством, выбранным из группы, состоящей из цисплатина, доксорубицина, гемцитабина, доцетакселя, паклитакселя, блеомицина и иринотекана. 7. Применение по п.1, где одно или оба из указанных антител слиты на свом С-конце с биологически эффективным пептидом, полипептидом или белком, возможно через линкерный пептид, образуя таким путм иммуноцитокин. 8. Способ лечения рака, который экспрессирует HER2 и EGFR, у пациента, причм указанный рак экспрессирует HER2 на уровнях, которые недостаточны для значительной реакции на лечение указанными антителами к HER2, если они вводятся пациенту одни, при этом способ включает введение пациенту (i) полного антитела к HER2, которое, если вводится одно, не ингибирует или незначительно ингибирует димеризацию HER2 и/или гетеродимеризацию HER2/EGFR у указанного пациента; и (ii) полного антитела к EGFR, которое, если вводится одно, значительно ингибирует димеризацию EGFR и/или гетеродимеризацию EGFR/HER2 у указанного пациента. 9. Способ по п.8, где указанный рак - это рак поджелудочной железы. 10. Способ по п.8, где указанные антитела к HER2 - это мышиные, химерные или гуманизированные моноклональные антитела mAb 4D5 (trastuzumab). 11. Способ по п.8, где указанные антитела к EGFR - это мышиные, химерные или гуманизированные моноклональные антитела mAb 425 (matuzumab). 12. Способ по п.8, где указанные антитела к HER2 - это мышиные, химерные или гуманизированные моноклональные антитела mAb 4D5 (trastuzumab), а указанные антитела к EGFR - это мышиные,химерные или гуманизированные моноклональные антитела mAb 425 (matuzumab). 13. Способ по п.8, где дополнительно вводят цитотоксическое средство, выбранное из группы, состоящей из цисплатина, доксорубицина, гемцитабина, доцетакселя, паклитакселя, блеомицина и иринотекана. 14. Способ по п.8, где одно или оба из указанных антител слиты на свом С-конце с биологически эффективным пептидом, полипептидом или белком, возможно через линкерный пептид, образуя таким путм иммуноцитокин.
МПК / Метки
МПК: A61K 39/395, A61P 35/00
Метки: использованием, терапия, комбинированная, антител
Код ссылки
<a href="https://eas.patents.su/22-15173-kombinirovannaya-terapiya-s-ispolzovaniem-antitel-k-egfr-i-her2.html" rel="bookmark" title="База патентов Евразийского Союза">Комбинированная терапия с использованием антител к egfr и her2</a>
Предыдущий патент: Новые липазы и их применение
Следующий патент: Диаминопиримидины в качестве фунгицидов
Случайный патент: Способ спектрального элементного анализа вещества и устройство для его осуществления