Цитотоксические депсипептиды
Номер патента: 10585
Опубликовано: 30.10.2008
Авторы: Малет Лейре, Фернандо Рейес Хосе, Куэвас Кармен, Каньедо Либрада Мария, Ромеро Пако
Формула / Реферат
1. Соединение общей формулы I
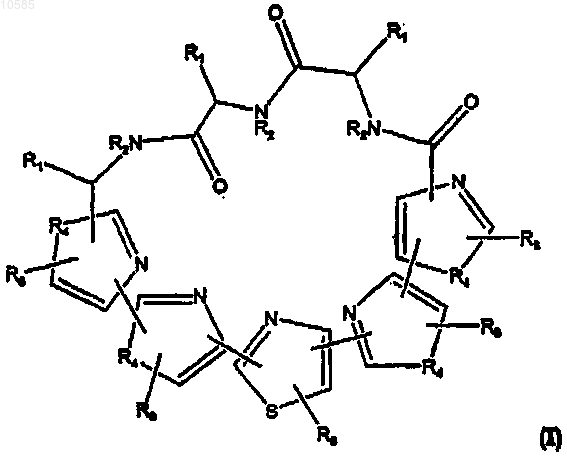
где
каждая из групп R1 независимо выбрана из группы, состоящей из водорода, незамещенного С1-С4алкилидена, замещенного или незамещенного С1-С4алкила, где, в случае замещенных производных, заместитель представляет собой OR', где R' представляет собой С(=O)С1-С4алкил или С1-С4алкил;
R2 представляет собой водород;
каждая из групп R3 независимо выбрана из группы, состоящей из водорода, галогена, гидроксила, замещенного или незамещенного С1-С4алкила, или замещенного или незамещенного C6-C18арила, где в случае замещенных производных заместитель представляет галоген или гидроксил; и
каждая из групп R4 независимо выбрана из NR2, О и S,
или его фармацевтически приемлемая соль, производное, пролекарство или стереоизомер.
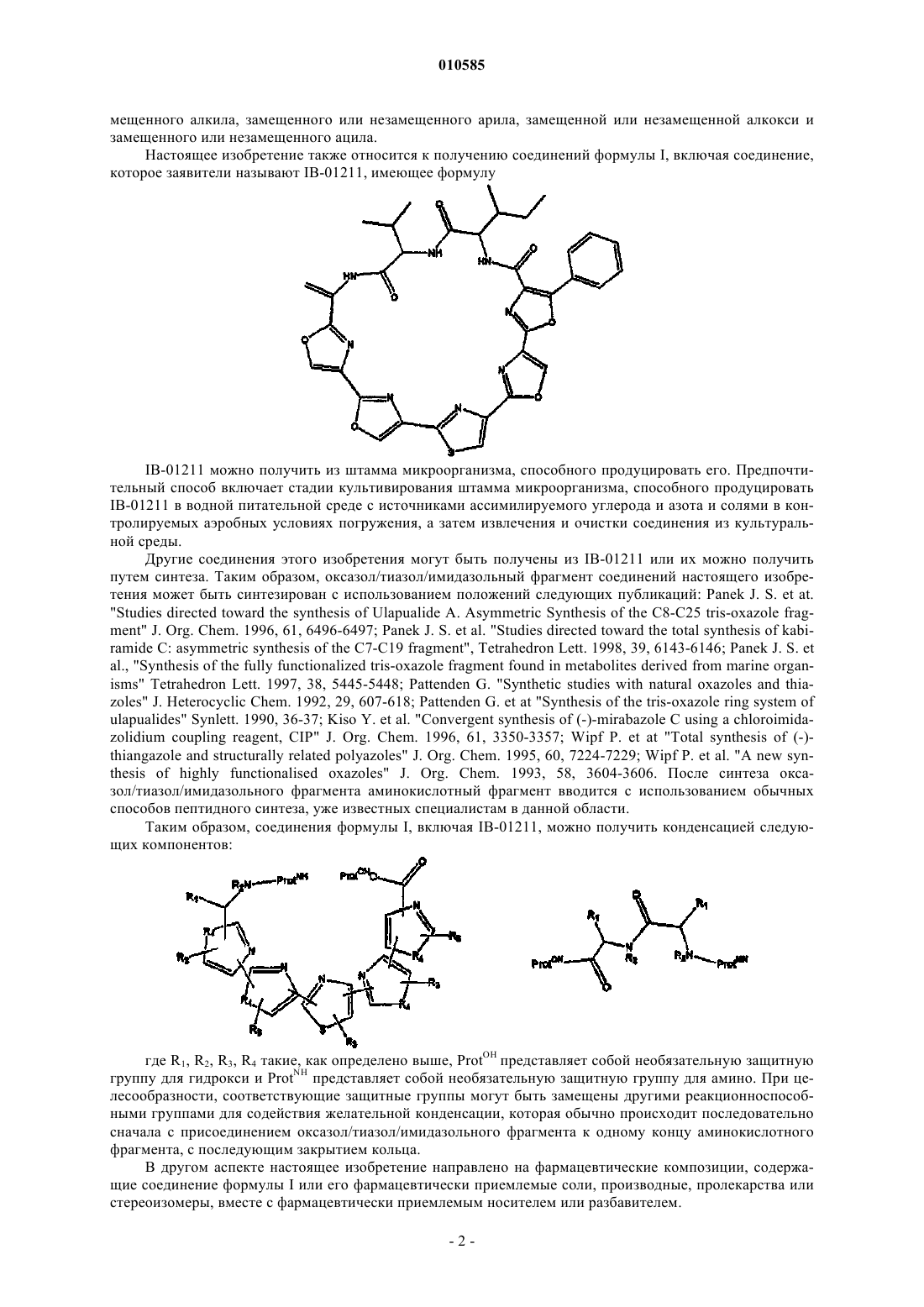
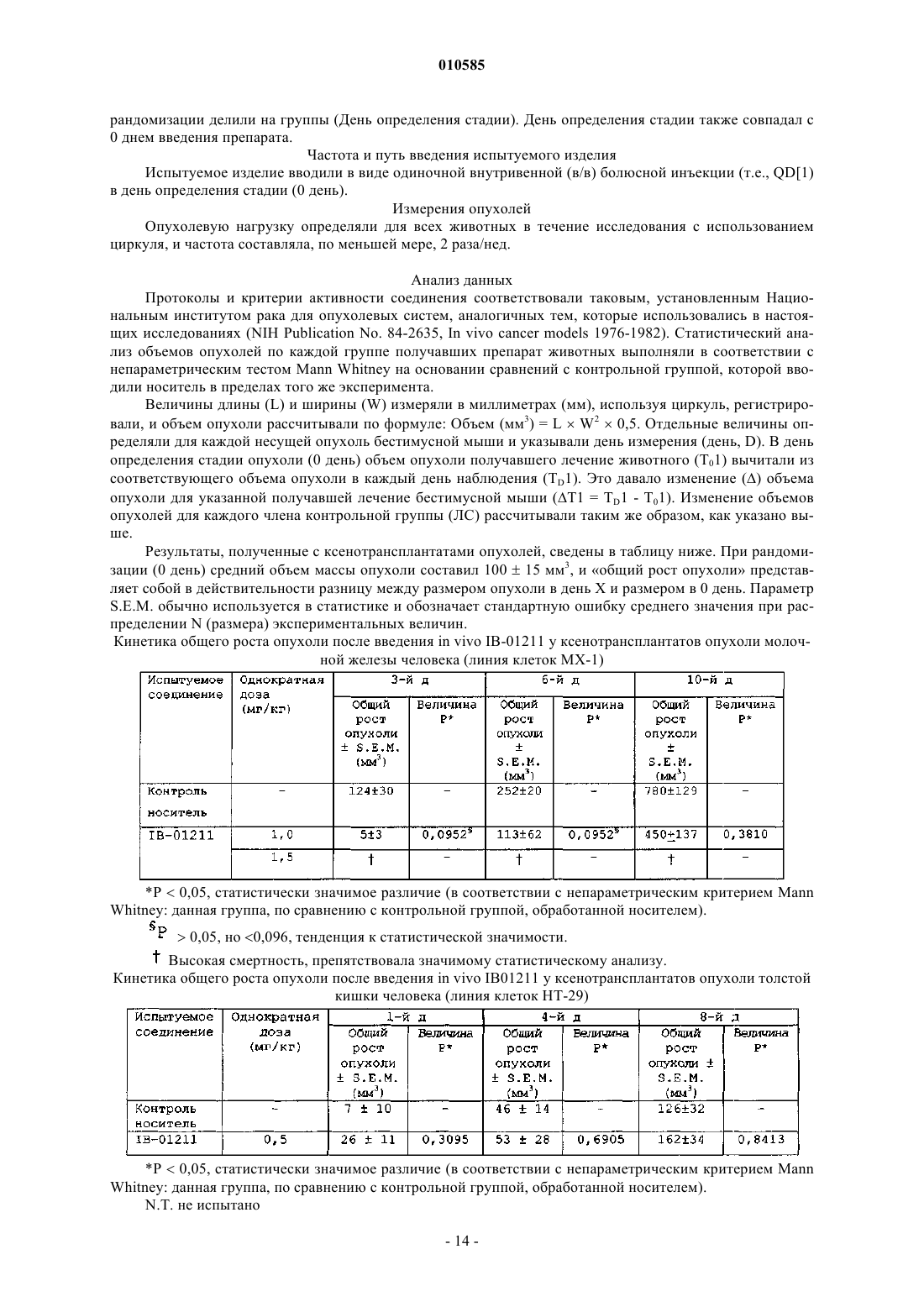
2. Соединение по п.1, имеющее следующую формулу II:
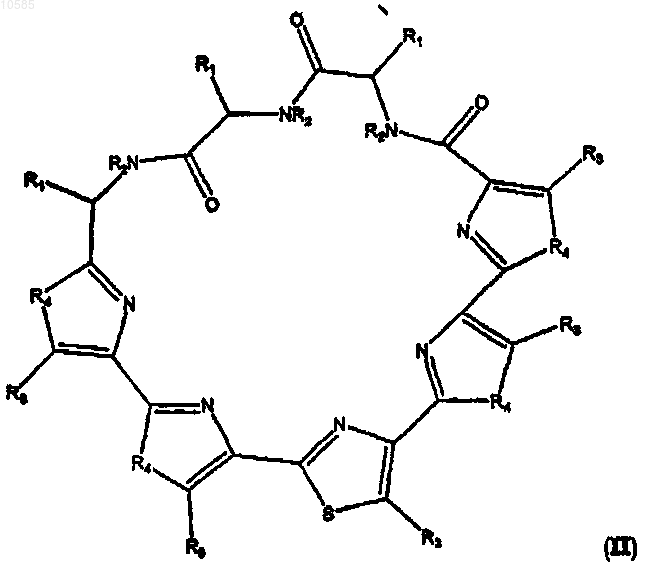
где R1, R2, R3, R4 такие, как определено в п.1.
3. Соединение по п.1 или 2, где каждая из групп R1 независимо выбрана из незамещенного С1-С4алкила и незамещенного С1-С4алкилидена.
4. Соединение по любому из предыдущих пунктов, где каждая из групп R3 независимо выбрана из Н и замещенного или незамещенного С6-С18арила, где в случае замещенных производных, заместитель представляет галоген или гидроксил.
5. Соединение по любому из предыдущих пунктов, где каждая из групп R4 представляет собой О.
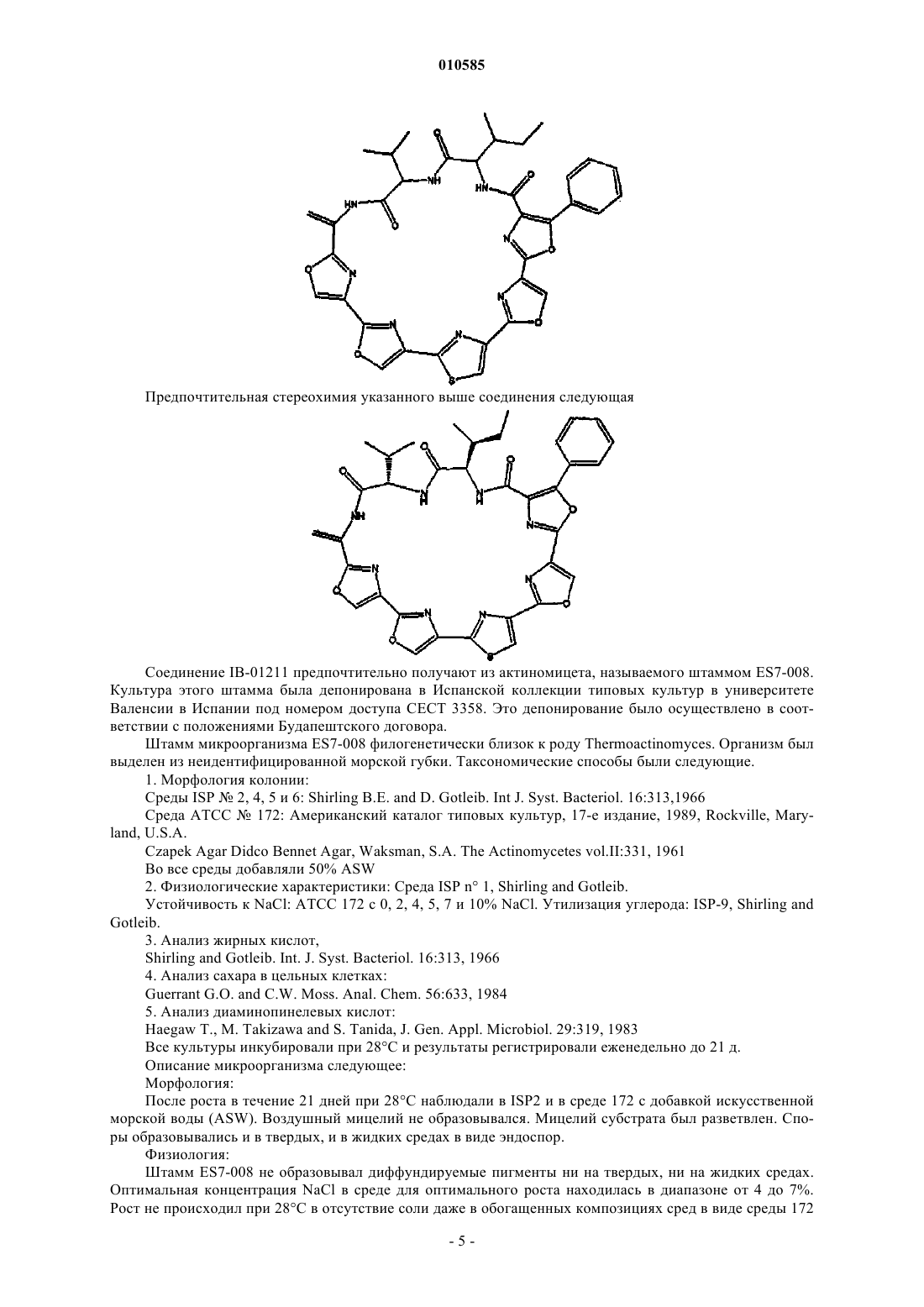
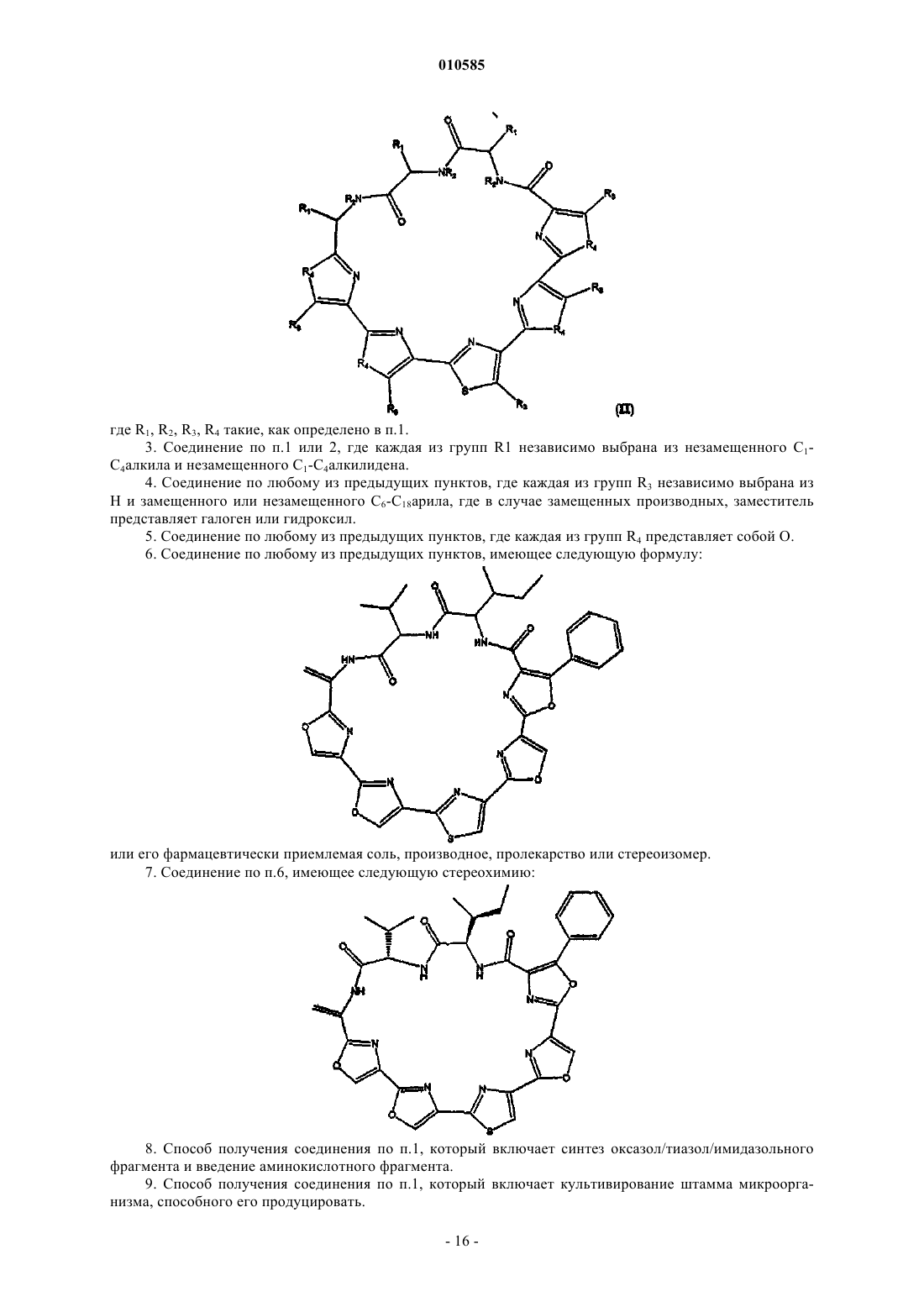
6. Соединение по любому из предыдущих пунктов, имеющее следующую формулу:
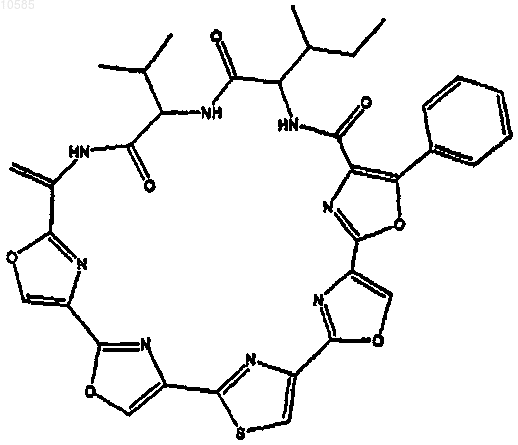
или его фармацевтически приемлемая соль, производное, пролекарство или стереоизомер.
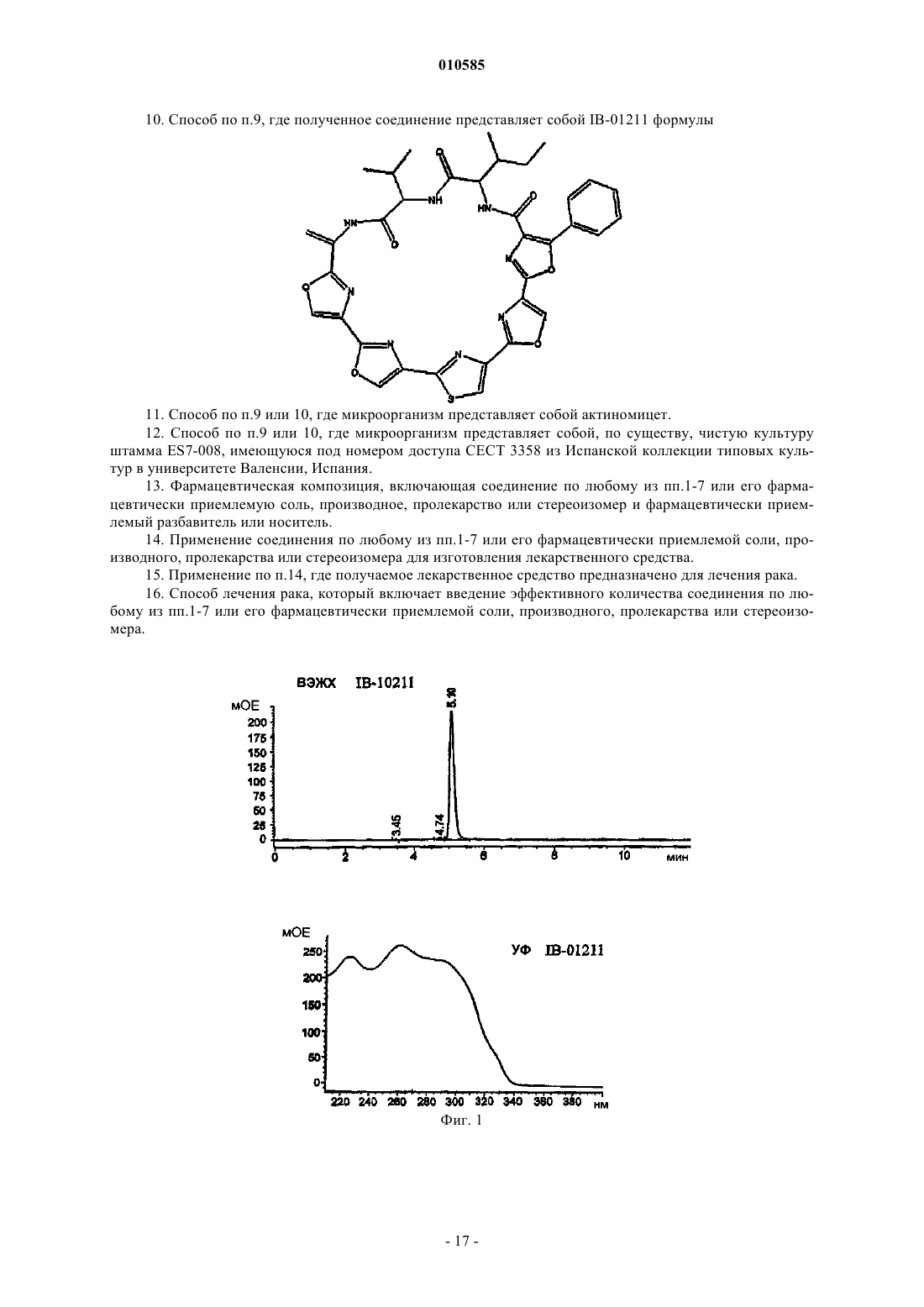
7. Соединение по п.6, имеющее следующую стереохимию:
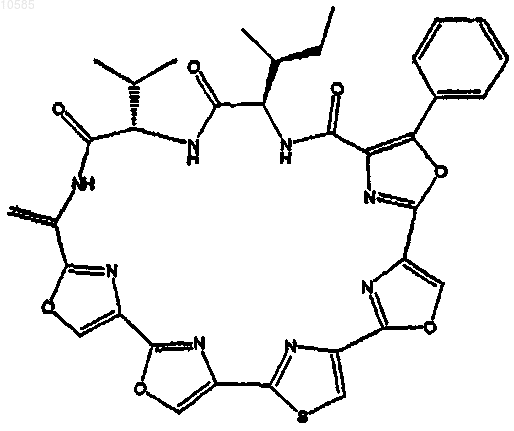
8. Способ получения соединения по п.1, который включает синтез оксазол/тиазол/имидазольного фрагмента и введение аминокислотного фрагмента.
9. Способ получения соединения по п.1, который включает культивирование штамма микроорганизма, способного его продуцировать.
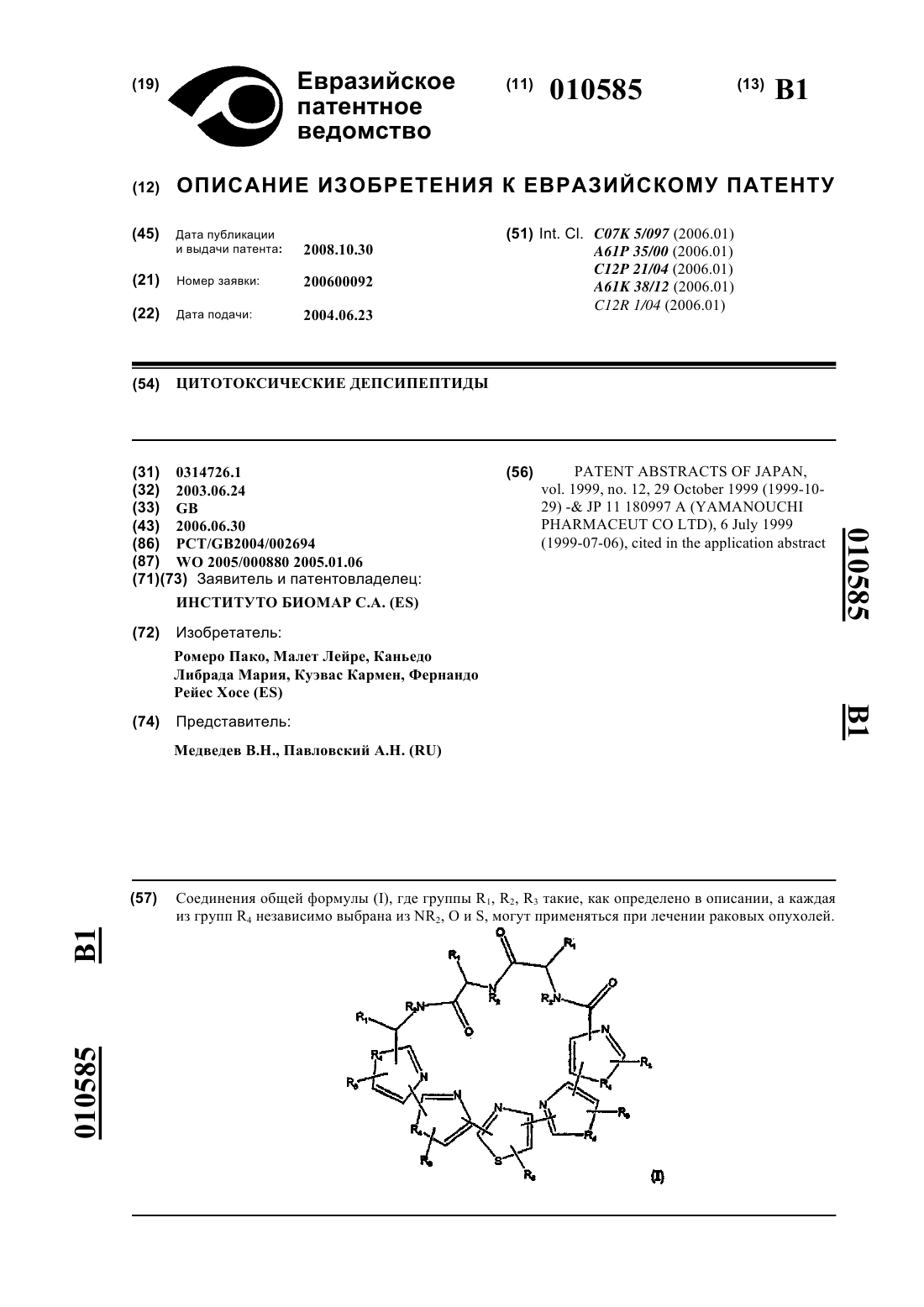
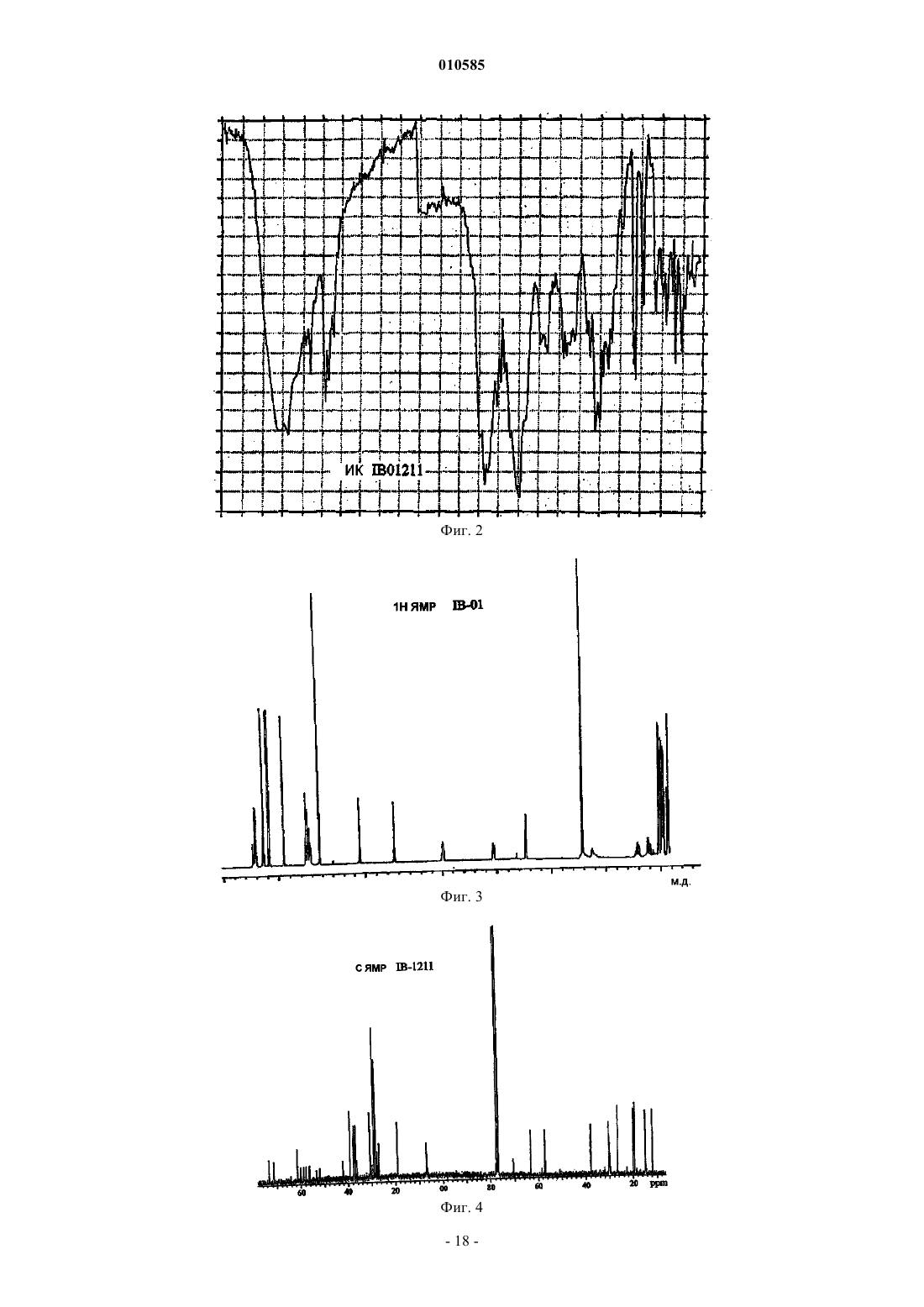
10. Способ по п.9, где полученное соединение представляет собой IB-01211 формулы
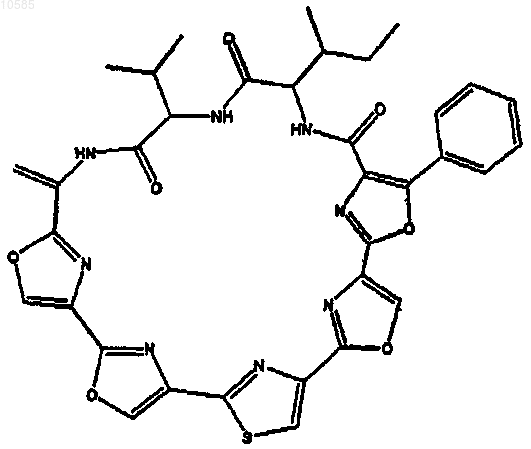
11. Способ по п.9 или 10, где микроорганизм представляет собой актиномицет.
12. Способ по п.9 или 10, где микроорганизм представляет собой, по существу, чистую культуру штамма ES7-008, имеющуюся под номером доступа СЕСТ 3358 из Испанской коллекции типовых культур в университете Валенсии, Испания.
13. Фармацевтическая композиция, включающая соединение по любому из пп.1-7 или его фармацевтически приемлемую соль, производное, пролекарство или стереоизомер и фармацевтически приемлемый разбавитель или носитель.
14. Применение соединения по любому из пп.1-7 или его фармацевтически приемлемой соли, производного, пролекарства или стереоизомера для изготовления лекарственного средства.
15. Применение по п.14, где получаемое лекарственное средство предназначено для лечения рака.
16. Способ лечения рака, который включает введение эффективного количества соединения по любому из пп.1-7 или его фармацевтически приемлемой соли, производного, пролекарства или стереоизомера.
Текст
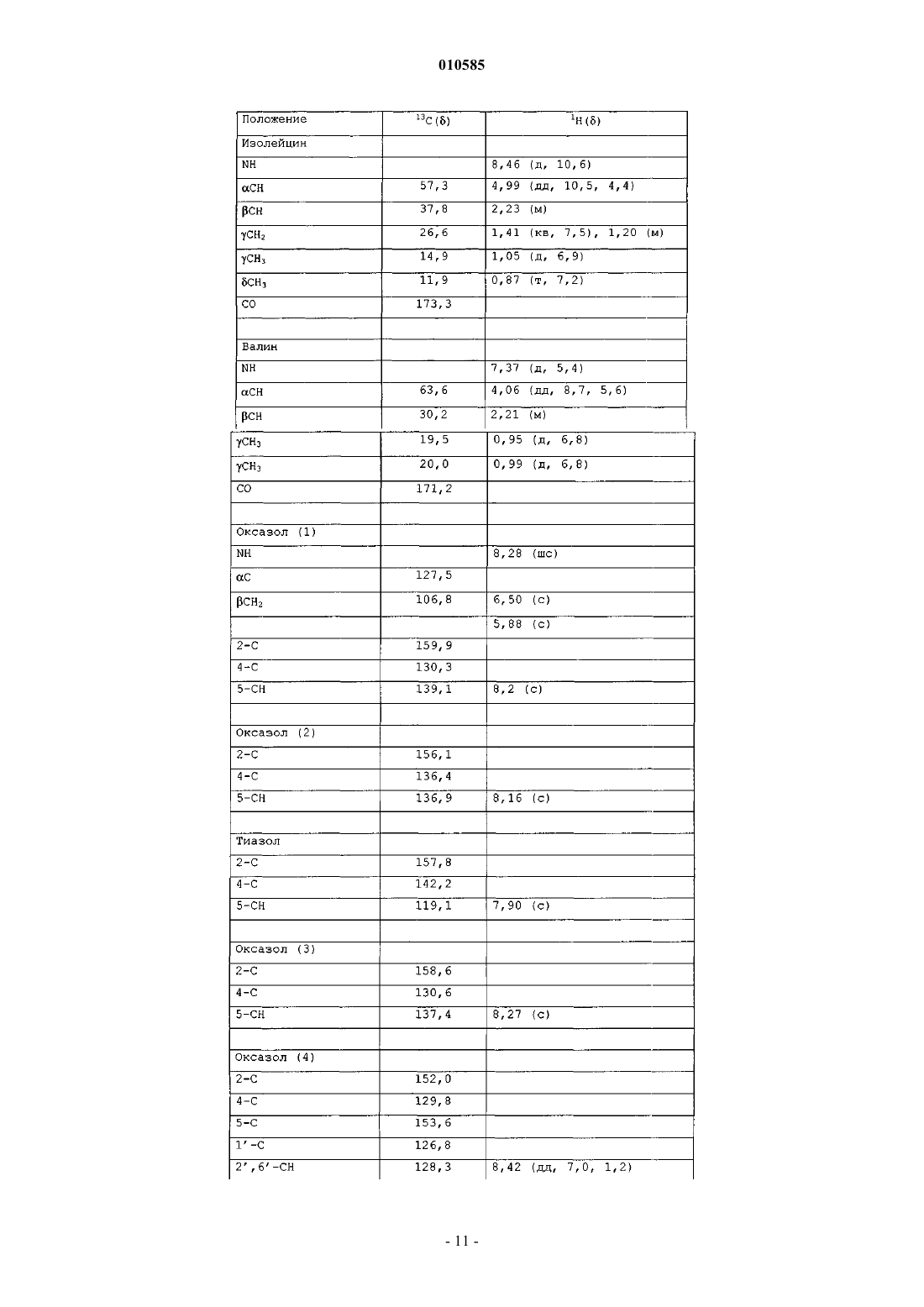
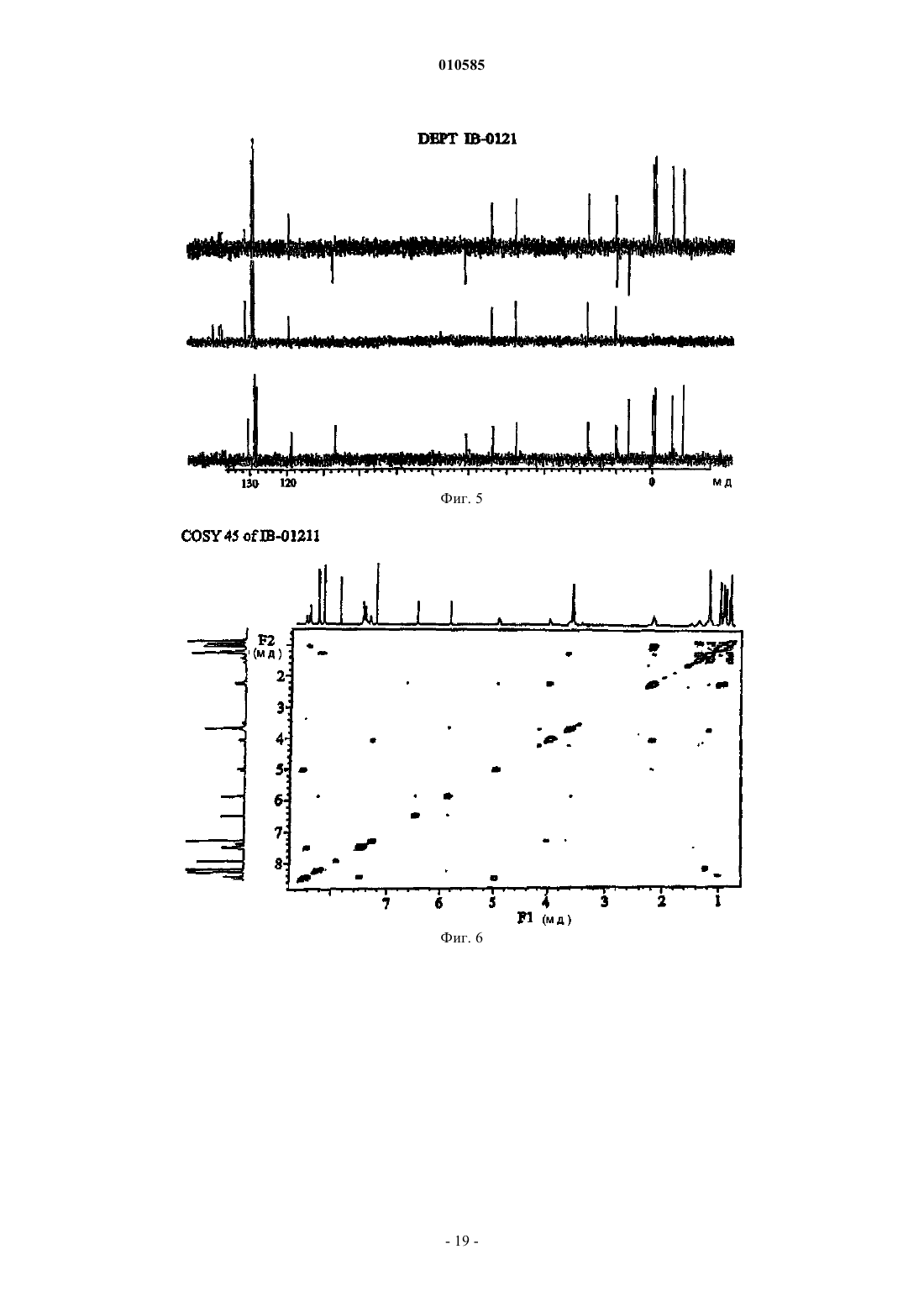
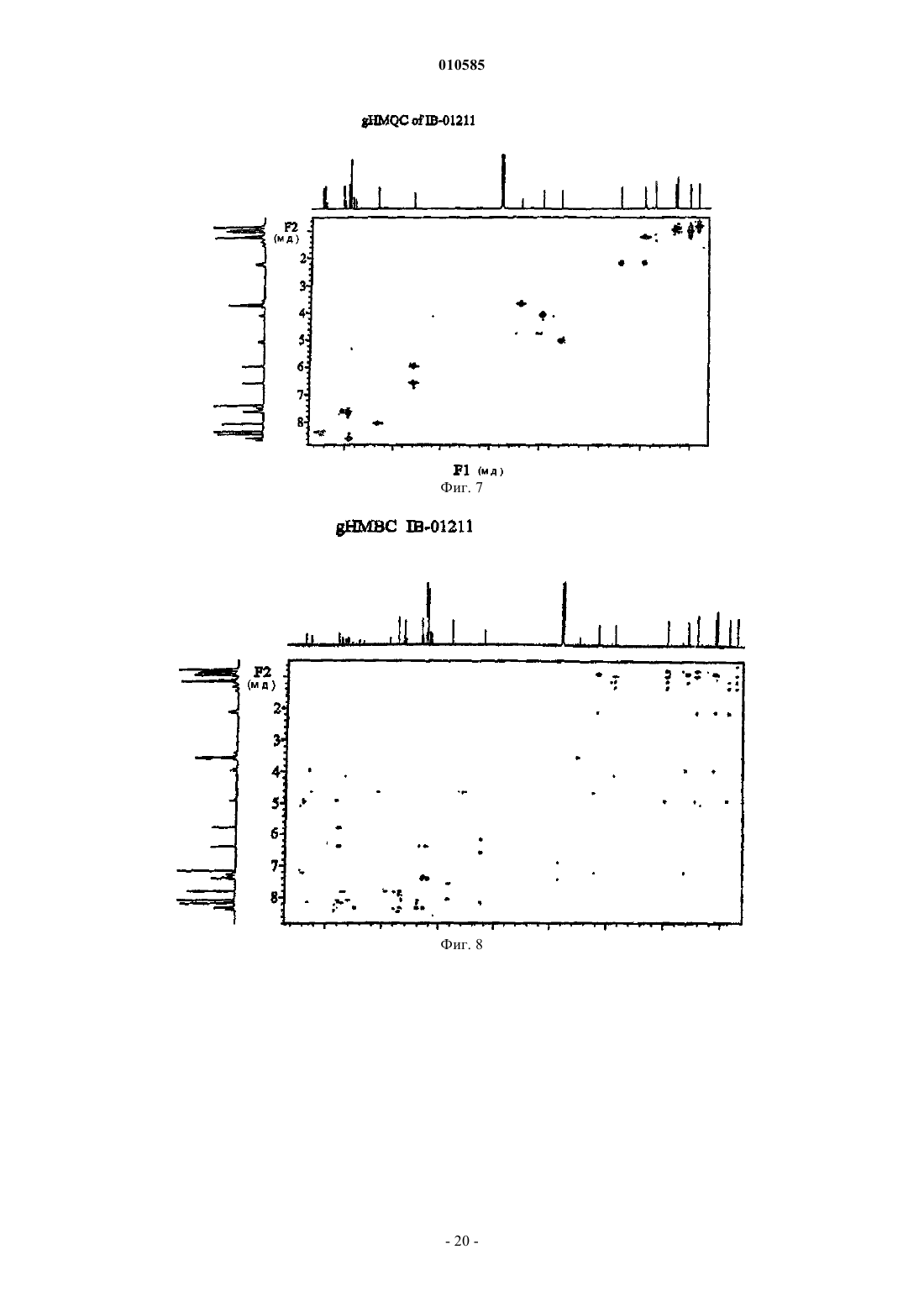
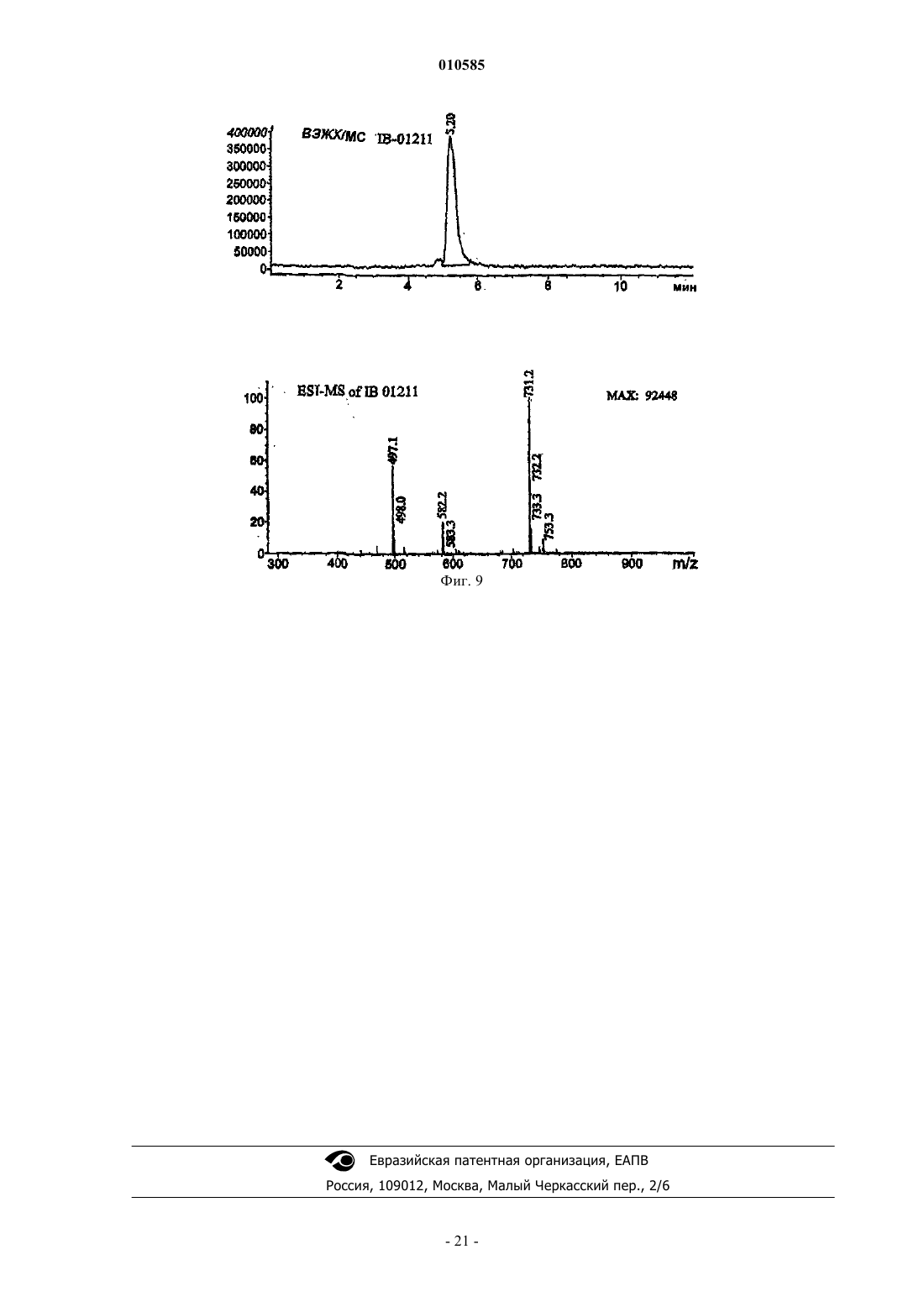
010585 Область техники Настоящее изобретение относится к новым депсипептидным соединениям, фармацевтическим композициям, содержащим их, и их применению в качестве противоопухолевых средств. Уровень техники Были раскрыты несколько циклических пептидов, полученных из морских организмов (см., например, Rudi A. Et al., J. Nat. Prod., 2003, 66, 575-577: "Didmolamide A and B, two new cyclic hexapeptides fromthe marine Ascidian Didemnum molle"). В патенте JP 11180997 раскрыто противоопухолевое соединение формулы которое получено из Streptomyces nobilis. Его IC50 на клетках Hela S3 составляет 14 нМ. Рак представляет собой основную причину смерти у животных и людей. Несколько усилий предпринималось и еще предпринимается для получения противоопухолевого средства, которое активное и безопасно для введения пациентам, страдающим раком. Проблема, которую предстоит решить настоящим изобретением, представляет собой предоставление соединения, которые можно использовать при лечении рака. Краткое изложение сущности изобретения Настоящее изобретение направлено на соединения общей формулы I или их фармацевтически приемлемые соли, производные, пролекарства или стереоизомеры где каждая из групп R1 независимо выбрана из группы, состоящей из водорода, галогена, циано, гидроксила, нитро, азидо, замещенного или незамещенного алкила, замещенного или незамещенного алкилидена, замещенного или незамещенного алкенила, замещенного или незамещенного алкинила, замещенной или незамещенной алкокси, замещенного или незамещенного арила, замещенной или незамещенной гетероциклической группы и замещенного или незамещенного ацила; каждая из групп R3 независимо выбрана из группы, состоящей из водорода, галогена, циано, гидроксила, нитро, азидо, замещенного или незамещенного алкила, замещенного или незамещенного алкенила, замещенного или незамещенного алкинила, замещенной или незамещенной алкокси, замещенного или незамещенного арила, замещенной или незамещенной гетероциклической группы и замещенного или незамещенного ацила; каждая из групп R4 независимо выбрана из NR2, О и S; и каждая из групп R2 независимо выбрана из группы, состоящей из водорода, замещенного или неза-1 010585 мещенного алкила, замещенного или незамещенного арила, замещенной или незамещенной алкокси и замещенного или незамещенного ацила. Настоящее изобретение также относится к получению соединений формулы I, включая соединение,которое заявители называют IB-01211, имеющее формулуIB-01211 можно получить из штамма микроорганизма, способного продуцировать его. Предпочтительный способ включает стадии культивирования штамма микроорганизма, способного продуцироватьIB-01211 в водной питательной среде с источниками ассимилируемого углерода и азота и солями в контролируемых аэробных условиях погружения, а затем извлечения и очистки соединения из культуральной среды. Другие соединения этого изобретения могут быть получены из IB-01211 или их можно получить путем синтеза. Таким образом, оксазол/тиазол/имидазольный фрагмент соединений настоящего изобретения может быть синтезирован с использованием положений следующих публикаций: Panek J. S. et at.ulapualides" Synlett. 1990, 36-37; Kiso Y. et al. "Convergent synthesis of (-)-mirabazole С using a chloroimidazolidium coupling reagent, CIP" J. Org. Chem. 1996, 61, 3350-3357; Wipf P. et at "Total synthesis of (-)thiangazole and structurally related polyazoles" J. Org. Chem. 1995, 60, 7224-7229; Wipf P. et al. "A new synthesis of highly functionalised oxazoles" J. Org. Chem. 1993, 58, 3604-3606. После синтеза оксазол/тиазол/имидазольного фрагмента аминокислотный фрагмент вводится с использованием обычных способов пептидного синтеза, уже известных специалистам в данной области. Таким образом, соединения формулы I, включая IB-01211, можно получить конденсацией следующих компонентов: где R1, R2, R3, R4 такие, как определено выше, ProtOH представляет собой необязательную защитную группу для гидрокси и ProtNH представляет собой необязательную защитную группу для амино. При целесообразности, соответствующие защитные группы могут быть замещены другими реакционноспособными группами для содействия желательной конденсации, которая обычно происходит последовательно сначала с присоединением оксазол/тиазол/имидазольного фрагмента к одному концу аминокислотного фрагмента, с последующим закрытием кольца. В другом аспекте настоящее изобретение направлено на фармацевтические композиции, содержащие соединение формулы I или его фармацевтически приемлемые соли, производные, пролекарства или стереоизомеры, вместе с фармацевтически приемлемым носителем или разбавителем.-2 010585 В другом аспекте настоящее изобретение также направлено на применение соединений формулы I или их фармацевтически приемлемых солей, производных, пролекарств или стереоизомеров при лечении рака, или для изготовления лекарственного средства для лечения рака. Краткое описание чертежей фиг. 1 - ВЭЖХ/УФ хроматограмма и УФ спектр очищенного IB-01211; фиг. 2 - инфракрасный спектр очищенного IB-01211; фиг. 3 - 1 Н ЯМР спектр очищенного IB-01211; фиг. 4 - 13 С ЯМР спектр очищенного IB-01211; фиг. 5 - DEPT спектр очищенного IB-01211; фиг. 6 - COSY 45 спектр очищенного IB-01211; фиг. 7 - HMQC спектр очищенного IB-01211; фиг. 8 - НМВС спектр очищенного IB-01211; фиг. 9 - ВЭЖХ/МС хроматограмма и ESI-MS спектр очищенного IB-01211 Подробное описание изобретения Настоящее изобретение относится к соединениям общей формулы I, как определено выше. В этих соединениях заместители могут быть выбраны в соответствии со следующим руководством: Алкильная и алкоксигруппы предпочтительно имеют от 1 до 12 атомов углерода. Один более предпочтительный класс алкильных групп имеет от 1 до примерно 8 атомов углерода, еще предпочтительнее,от 1 до примерно 6 атомов углерода, а наиболее предпочтительно 1, 2, 3 или 4 атома углерода. Метил,этил, пропил, включая изопропил и бутил, включая изобутил, втор-бутил и трет-бутил представляют собой особенно предпочтительные алкильные группы в соединениях настоящего изобретения. Используемый в настоящем описании термин алкил, если он не модифицирован другим образом, относится и к циклическим, и не циклическим группам, хотя циклические группы включают по меньшей мере 3 члена углеродного кольца. Алкилиденовые группы могут быть разветвленными или неразветвленными и предпочтительно имеют от 1 до 12 атомов углерода. Один более предпочтительный класс алкилиденовых групп имеет от 1 до примерно 8 атомов углерода, еще предпочтительнее от 1 до примерно 6 атомов углерода, а наиболее предпочтительно 1, 2, 3 или 4 атома углерода. Метилиден, этилиден и пропилиден, включая изопропилиден, представляют собой особенно предпочтительные алкилиденовые группы в соединениях настоящего изобретения. Предпочтительные алкенильные и алкинильные группы в соединениях настоящего изобретения имеют одну или несколько ненасыщенных связей и от 2 до примерно 12 атомов углерода, предпочтительнее от 2 до примерно 8 атомов углерода, еще предпочтительнее от 2 до примерно 6 атомов углерода,еще предпочтительнее 1, 2, 3 или 4 атома углерода. Используемые в настоящем описании термины алкенил и алкинил относятся и к циклическим, и к не циклическим группам, хотя в целом предпочтительнее прямые или разветвленные не циклические группы. В общем смысле, заявители включают алкилиден в пределы алкенила, причем они оба являются заместителями с двойной связью. Подходящие арильные группы в соединениях настоящего изобретения включают соединения с одним и несколькими кольцами, включая соединения с несколькими кольцами, которые содержат отдельные и/или конденсированные арильные группы. Типичные арильные группы содержат от 1 до 3 отдельных или конденсированных колец и от 6 до примерно 18 углеродных кольцевых атомов. Особенно предпочтительные арильные группы включают замещенный или незамещенный фенил, нафтил, бифенил,фенантрил и антрацил. Подходящие ацильные группы включают алканоильные группы, которые имеют от 2 до примерно 12 атомов углерода, предпочтительнее от 2 до примерно 8 атомов углерода, еще предпочтительнее от 2 до примерно 6 атомов углерода, еще предпочтительнее 2 атома углерода. Другие ацильные группы включают алкенилацил, алкинилацил, арилацил, гетероциклилацил. Подходящие гетероциклические группы включают гетероароматические и гетероалициклические группы. Подходящие гетероароматические группы в соединениях настоящего изобретения содержат 1, 2 или 3 гетероатома, выбранные из атомов N, О или S, и включают, например, кумаринил, включая 8 кумаринил, хинолинил, включая 8-хинолинил, пиридил, пиразинил, пиримидил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, индолил, бензофуранил и бензотиазол. Подходящие гетероалициклические группы в соединениях настоящего изобретения содержат 1, 2 или 3 гетероатома, выбранные из атомов N, О или S, и включают, например, тетрагидрофуранильные, тетрагидропиранильные, пиперидинильные, морфолино и пирролидинильные группы. Указанные выше группы могут быть замещены в одном или нескольких доступных положениях одной или несколькими подходящими группами, такими как OR', SR', SOR', SO2R', NO2, NHR', N(R')2,NHCOR', N(COR')2, NHSO2R', CN, галоген, C(=O)R', CO2R', OC(=O)R', где каждая из групп R' независимо выбрана из группы, состоящей из Н, ОН, NO2, NH2, SH, CN, галогена, C(=O)H, С(=O)алкила, CO2H, замещенного или незамещенного C1-C18 алкила, замещенного или незамещенного C2-C18 алкенила, замещенного или незамещенного C2-C18 алкинила и замещенного или незамещенного арила. Подходящие галогеновые заместители в соединениях настоящего изобретения включают F, Cl, Br и I.-3 010585 Термин фармацевтически приемлемые соли, производные, пролекарства относится к любой фармацевтически приемлемой соли, сложному эфиру, сольвату, гидрату или любому другому соединению,которое после введения пациенту способно обеспечить (прямо или косвенно) соединение, как описано в настоящем описании. Однако следует понимать, что не фармацевтически приемлемые соли также включены в пределы объема изобретения, поскольку их можно использовать при получении фармацевтически приемлемых солей. Получение солей, пролекарств и производных может проводиться способами, известными в данной области. Например, фармацевтически приемлемые соли предоставленных в настоящем описании соединений синтезируются из исходного соединения, которое содержит основной или кислотный остаток, обычными химическими способами. В целом, такие соли, например, получают взаимодействием форм свободной кислоты или основания этих соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе, или в их смеси. В целом, предпочтительны неводные среды, подобные эфиру, этилацетату, этанолу, изопропанолу или ацетонитрилу. Примеры кислотно-аддитивных солей включают соли присоединения минеральных кислот, такие как, например,гидрохлорид, гидробромид, гидройодид, сульфат, нитрат, фосфат, и соли присоединения органических кислот, такие как, например, ацетат, малеат, фумарат, цитрат, оксалат, сукцинат, тартрат, малат, манделат, метансульфонат и п-толуолсульфонат. Примеры основно-аддитивных солей включают неорганические соли, такие как, например, соли натрия, калия, кальция и аммония, и соли с органическими основаниями, такими как, например, этилендиамин, этаноламин, N,N-диалкиленэтаноламин, триэтаноламин и соли основных аминокислот. Соединения изобретения могут быть в кристаллической форме в виде свободных соединений или в виде сольватов (например, гидратов), и предполагается, что обе формы находятся в пределах объема настоящего изобретения. Способы сольватации в целом известны в данной области. Любое соединение, которое представляет собой пролекарство соединения формулы I, находится в пределах объема и сущности изобретения. Термин пролекарство используется в его самом широком смысле и охватывает те производные, которые превращаются in vivo в соединения изобретения. Такие производные могли бы быть легко получены специалистами в данной области, и они включают, например, соединения, где свободная гидрокси группа превращена в сложноэфирное производное. Соединения настоящего изобретения, представленные описанной выше формулой I, могут включать энантиомеры, в зависимости от их асимметрии, или диастереоизомеры. Одиночные изомеры и смеси изомеров входят в объем настоящего изобретения. Предпочтительные соединения изобретения представляют собой соединения общей формулы II где группы R1, R2, R3, R4 имеют такое же значение, как определено выше. Предпочтительные группы R1 представляют собой замещенный или незамещенный алкил и замещенный или незамещенный алкилиден, более предпочтительными являются замещенный или незамещенный C1-C6 алкил или замещенный, или незамещенный C1-C6 алкилиден, еще более предпочтительными являются изопропил, втор-бутил и метилен. Предпочтительные группы R2 представляют собой Н и замещенный или незамещенный алкил, и более предпочтительным является Н. Предпочтительные группы R3 представляют собой Н и замещенный или незамещенный арил, и более предпочтительными являются Н и фенил. Предпочтительная группа R4 представляет собой О. Одно особенно предпочтительное соединение формулы I представляет собой соединение IB-01211 Предпочтительная стереохимия указанного выше соединения следующая Соединение IB-01211 предпочтительно получают из актиномицета, называемого штаммом ES7-008. Культура этого штамма была депонирована в Испанской коллекции типовых культур в университете Валенсии в Испании под номером доступа СЕСТ 3358. Это депонирование было осуществлено в соответствии с положениями Будапештского договора. Штамм микроорганизма ES7-008 филогенетически близок к роду Thermoactinomyces. Организм был выделен из неидентифицированной морской губки. Таксономические способы были следующие. 1. Морфология колонии: Среды ISP2, 4, 5 и 6: Shirling B.E. and D. Gotleib. Int J. Syst. Bacteriol. 16:313,1966 Среда АТСС 172: Американский каталог типовых культур, 17-е издание, 1989, Rockville, Maryland, U.S.A.Czapek Agar Didco Bennet Agar, Waksman, S.A. The Actinomycetes vol.II:331, 1961 Во все среды добавляли 50% ASW 2. Физиологические характеристики: Среда ISP n 1, Shirling and Gotleib. Устойчивость к NaCl: АТСС 172 с 0, 2, 4, 5, 7 и 10% NaCl. Утилизация углерода: ISP-9, Shirling andHaegaw Т., M. Takizawa and S. Tanida, J. Gen. Appl. Microbiol. 29:319, 1983 Все культуры инкубировали при 28C и результаты регистрировали еженедельно до 21 д. Описание микроорганизма следующее: Морфология: После роста в течение 21 дней при 28 С наблюдали в ISP2 и в среде 172 с добавкой искусственной морской воды (ASW). Воздушный мицелий не образовывался. Мицелий субстрата был разветвлен. Споры образовывались и в твердых, и в жидких средах в виде эндоспор. Физиология: Штамм ES7-008 не образовывал диффундируемые пигменты ни на твердых, ни на жидких средах. Оптимальная концентрация NaCl в среде для оптимального роста находилась в диапазоне от 4 до 7%. Рост не происходил при 28 С в отсутствие соли даже в обогащенных композициях сред в виде среды 172-5 010585 АТСС. Оптимальный диапазон температуры роста составил от 28 до 40 С. Штамм ES7-008 может утилизировать глюкозу, мелибиозу, ксилозу и этанол в качестве источников углерода. Рост был слабым на фруктозе, сахарозе, рамнозе и галактозе. Микроорганизм не рос на арабинозе, маннозе или мио-инозите. Химический состав: Аминокислоты: Мезо-2,6-диаминопимеловая кислота присутствовала в цельной гидролизированной клетке штаммаES7-008 Состав жирных кислот: Основные жирные кислоты были идентифицированы как i-15:0, а-15:0, 15:0, i-16:0, i-17:1, i-17:0 и а 17:0. Состав жирных кислот штамма ES7-008 и других штаммов актиномицетов представлен в следующей таблице, где состав представлен в виде процентной доли от общего содержания жирных кислот.-7 010585 Сахар: Тип сахара в цельной клетке не проявил специфического профиля Филогенетический анализ: Определение частичной последовательности 16S рДНК проводили в соответствии со стандартными процедурами. ДНК микроорганизма экстрагировали после гомогенизации под жидким азотом. Ген 16S рДНК амплифицировали полимеразной цепной реакцией, используя эубактериальные праймеры 27f и 1492r. Частичные последовательности были получены с использованием праймеров 357r, 926r и 1492r. Все праймеры, использованные в этой работе, были описаны Lane, D.J. Nucleic acid techniques in bacterialsystematics: 115, 1991. Полученная частичная последовательность представляла собой: Эту последовательность сопоставляли с депозитарием Gene Bank, используя алгоритм Blastn. Филогенетические исследования выполняли, используя пакет Phylip, разработанную Felsenstein, J. Cladistics 5:164, 1989. Согласованное филогенетическое дерево было сконструировано после кондиционирования образца. Штамм ES7-008 группировали с группой Thermoactinomyces. Отличительным признаком штамма ES7-008 от Thermoactinomyces является отсутствие воздушного мицелия и необходимость соли для роста. Ферментация:ES7-008 продуцирует соединение IB-01211, когда его культивируют в контролируемых условиях в подходящей среде. Этот штамм предпочтительно выращивается в водной питательной среде в аэробных и мезофильных условиях, предпочтительно при 28-40 С и при рН в диапазоне от 6,0 до 8,0. Широкое разнообразие жидких культуральных сред можно использовать для культивирования микроорганизма. Подходящими средами являются те, которые включают источник ассимилируемого углерода, такой как крахмал, декстрин, сахарные мелассы, глюкоза, источник ассимилируемого азота, такой как белок, гидролизированный белок, обезжиренные питательные вещества, кукурузный экстракт и пригодные неорга-8 010585 нические анионы и катионы, такие как натрий, магний, калий, аммоний, сульфат, хлорид, фосфат, карбонат. Можно также добавить микроэлементы. Аэрация предпочтительно достигается подачей воздуха в среду ферментации. Перемешивание обеспечивается механической крыльчаткой. Было обнаружено, что обычные ферментационные резервуары хорошо подходят для проведения культивации этого микроорганизма. Добавление питательных веществ и агентов, регулирующих рН, а также агентов против пенообразования в течение различных этапов ферментации может потребоваться для увеличения продукции и во избежание пенообразования. Соединение IB-01211 можно получить, исходя из замороженного лиофилизированного мицелияES7-008. Мицеллярную массу получают культивированием исходных клеток во встряхиваемых колбах в культуральной среде, содержащей некоторые из ингредиентов, описанных выше, при мезофильных температурах и в аэробных условиях. При необходимости, эту стадию можно повторить несколько раз, и собранный материал использовать в качестве посевного материала для высевания в один или несколько ферментационных резервуаров с соответствующей культуральной средой. Если желательно, эти резервуары можно использовать для роста посевного материала или для стадии продукции, в зависимости от необходимого объема среды. Иногда среда продукции может отличаться от сред, используемых для роста посевного материала. Описанные типичные среды, которые можно использовать для роста посевного материала и для продукции IB-01211, представлены в следующей таблице. Продукцию IB-01211 можно контролировать анализом активности цельной среды против мышиного лейкоза Р-388 или ВЭЖХ. Соединение IB-01211 можно выделить из мицеллярного слоя экстракцией подходящей смесью растворителей, такой как CHCl3:СН 3 ОН: H2O. Активность сконцентрирована в нижнем слое. Экстракты из двух повторных экстракций можно объединить и выпарить досуха в вакууме. Выделение и очистку IB-01211 из неочищенного, активного экстракта можно выполнить, используя соответствующую комбинацию обычных хроматографических методик. Разделение на фракции можно проводить по принципу антиопухолевой активности фракций с помощью ТСХ, с визуализацией ванилином в концентрированной H2SO4 или аналитической ВЭЖХ с фотодиодным набором и детектором MS. Анализ ВЭЖХ выполняли при комнатной температуре, используя аналитическую колонку Symmetry C18 (5 мкм) и подвижную фазу МеОН:H2O:НОАс 95:5:1 при скорости потока 0,3 мл/мин, и строили график при 260 нм. В этих условиях время удерживания IB-01211 составляет 5,1 мин, как показано на фиг. 9. Важным признаком описанных выше соединений является их биологическая активность и, в частности, их цитотоксическая активность. Настоящим изобретением заявители предоставляют новые фармацевтические композиции этих соединений, которые обладают цитотоксической активностью, и их применение в качестве противоопухолевых средств. Таким образом, настоящее изобретение, кроме того,предоставляет фармацевтические композиции, включающие соединение настоящего изобретения или его фармацевтически приемлемую соль, производное, пролекарство или стереоизомер с фармацевтически приемлемым носителем.-9 010585 Примеры фармацевтических композиций включают любые твердые (таблетки, пилюли, капсулы,гранулы и т.д.) или жидкие (растворы, суспензии или эмульсии) композиции, подходящие для перорального, местного или парентерального введения. Фармацевтические композиции, содержащие соединения изобретения, могут быть доставлены инкапсулированием в липосомы или наносферы, в композициях пролонгированного высвобождения или другими стандартными средствами доставки. Введение соединений или композиций настоящего изобретения может осуществляться любым подходящим способом, таким как внутривенное вливание, пероральные препараты, внутрибрюшинное и внутривенное введение. Предпочтительно, чтобы использовалось время вливания до 24 ч, предпочтительнее 1-12 ч, причем наиболее предпочтительно 2-6 ч. Особенно желательна короткая продолжительность вливания, которая обеспечивает возможность его проведения без ночного пребывания в стационаре. Однако, если требуется, вливание может продолжаться от 12 до 24 ч или даже дольше. Вливание можно проводить через подходящие интервалы пребывания от 1 до 4 нед. Правильная дозировка соединений будет варьироваться в зависимости от конкретной композиции,способа применения и конкретной локализации опухоли, хозяина и подлежащей лечению опухоли. Также следует принимать во внимание другие факторы, подобные возрасту, массе тела, полу, рациону питания, времени введения, скорости выведения, состоянию хозяина, комбинациям препаратов, чувствительности реакции и тяжести заболевания. Введение можно проводить непрерывно или периодически в пределах максимальной переносимой дозы. Соединения и композиции изобретения можно использовать с другими препаратами для обеспечения комбинированного лечения. Другие препараты могут составлять часть той же композиции, или они могут быть предоставлены в виде отдельной композиции для введения в то же самое время или в другое время. Примеры изобретения Пример 1. Получение IB-01211 Получение посевного материала: замороженную культуру ES7-008 или достаточно выросшую культуру на скошенной среде (5 об.%) используют для засевания 100 мл среды для посева, как описано в табл. 1, которая содержится во встряхиваемой колбе емкостью 250 мл. Колбу инкубируют в течение 48 ч. В 2-литровую колбу Эрленмейера с 500 мл той же среды засевают 10 об.% посевного материала первой стадии. Колбу инкубируют в течение 48 ч. Стадия ферментации: на 50 л среды продукции, как описано в табл. 1, содержащейся в 75-литровом ферментационном резервуаре, высевают 2,5 л посевного материала второй стадии. Ферментацию проводят в течение 96 ч при перемешивании со скоростью 400 об./мин и в воздушном потоке 0,5 об./об.м. Пример 2. Выделение IB-01211 8,5 л цельной собранной среды фильтровали для отделения биомассы и других твердых веществ. Слой мицелия экстрагировали дважды смешанным растворителем (2,4 л) CHCl3: СН 3 ОН: H2O (2:1:1). Активность была сконцентрирована в нижнем слое. Органический растворитель концентрировали и выпаривали досуха в вакууме для получения 4,8 г неочищенного экстракта. Экстракт наносили на силикагель для VFC (вакуумной флэш-хроматографии) системы, используя смесь н-гексана-EtOAc и EtOAc-MeOH в качестве элюирующих растворителей. Фракции с противоопухолевой активностью, содержащие IB-01211 (900 мг), элюировали EtOAc-MeOH 1:1, EtOAc-MeOH 1:3 и метанолом. Активные фракции хроматографировали дважды на колонке из силикагеля, используя смесиCHCl3-МеОН и EtOAc-MeOH в качестве элюирующих растворителей. Цитотоксическую активность выявляли во фракциях, элюированных CHCl3-МеОН 96:4 при первой хроматографии (200 мг чистого соединения IB-01211) и фракциях, элюированных EtOAc-МеОН 85:15-8:2 при второй хроматографии (60 мг чистого соединения IB-01211). Дальнейшая очистка С 18 хроматографией с обращенной фазой дала 22 мг чистого соединения IB-01211, элюированного МеОН. На основании детального анализа различных спектральных характеристик, чистое соединение было идентифицировано как IB-01211. УФ спектр показывает поглощение при 225 нм, 265 нм и 290 нм, как показано на фиг. 1. Спектр поглощения инфракрасного излучения показан на фиг. 2 сопровождающих чертежей. Спектры 1 Н-ЯМР, 13 С-ЯМР и DEPT IB-01211 представлены соответственно на фиг. 3, 4 и 5. Данные экспериментов двухмерного ЯМР COSY, HMQC и НМВС представлены соответственно на фиг. 6, 7 и 8. Как показано на фиг. 9, спектр ES-MS IB-01211 содержит пик (M+Na) при 731. Данные 1 Н и 13 СЯМР соединения IB-01211 суммированы в следующей таблице. Пример 3. Биологическая активность in vitro Биологические испытания для скрининга на противоопухолевую активность Результат этих испытаний состоит в прерывании роста культуры опухолевых клеток "in vitro" посредством продолжительного контакта клеток с подлежащим тестированию образцом. Использовали следующие линии клеток человека: Линии клеток Ингибирование клеточного роста по данным подсчета клеток Анализ MTS (мазка измельченной ткани) с тетразолием основан на снижении метаболизма MTS солюбилизированными кристаллами формазана метаболически активными митохондриями живых клеток. По этой причине эта методология включает подсчет линий клеток на основании окрашивания, определяющего жизнеспособность, для обеспечения коррекции концентраций клеток для обеспечения возможности помещения 100% живых клеток в каждую лунку вместо подсчета по Coulter или оценки разведений на основании стандартных кривых роста.- 12010585 Среду, содержащую соединение, удаляли в конце обработки, и культуральные планшеты промывали один раз PBS (фосфатно-буферным раствором). Затем клетки инкубировали в 200 мкл свободной от соединения среды до истечения 72 ч. После соответствующего времени инкубации 25 мкл раствораMTS+PMS добавляли в каждую лунку титровального микропланшета и инкубировали в течение 4 ч при 37 С. Затем планшеты удаляли из инкубатора и помещали на планшетный шейкер на 5 мин (покрытые для защиты от света). Показания оптической плотности снимали при 490 нм на спектрофотометрическом считывающем устройстве. Данные анализировали, используя программное обеспечение Softmax. Данные представлены в виде показателей активности IC50, рассчитанных по многочленным кривым регрессии 3-го порядка, используя программу Microsoft Excel, и затем интерполировали вручную. Следующая таблица иллюстрирует данные по биологической активности соединений настоящего изобретения. Цитотоксическая активность (моль/л) IB-01211 Пример 4: Биологическая активность in vivo Анализ IB-01211 IN VIVO на ксенотрансплантатах опухолей молочной железы, толстой кишки и не-мелкоклеточной опухоли легких человека Имплантация опухоли В различные моменты времени 3 линии клеток опухолей человека, соответственно МХ-1 (молочная железа), НТ-29 (толстая кишка) и LX-1 (не-мелкоклеточная опухоль легкого), имплантировали подкожно отдельным группам реципиентов, самкам бестимусных мышей, в виде небольших имплантатов объемом приблизительно 2-3 мм 3. Затем каждому типу опухоли давали возможность роста внутри животного для достижения группового среднего размера 10015 мм 3, и в это время мышей, несущих опухоли, методом- 13010585 рандомизации делили на группы (День определения стадии). День определения стадии также совпадал с 0 днем введения препарата. Частота и путь введения испытуемого изделия Испытуемое изделие вводили в виде одиночной внутривенной (в/в) болюсной инъекции (т.е., QD[1) в день определения стадии (0 день). Измерения опухолей Опухолевую нагрузку определяли для всех животных в течение исследования с использованием циркуля, и частота составляла, по меньшей мере, 2 раза/нед. Анализ данных Протоколы и критерии активности соединения соответствовали таковым, установленным Национальным институтом рака для опухолевых систем, аналогичных тем, которые использовались в настоящих исследованиях (NIH Publication No. 84-2635, In vivo cancer models 1976-1982). Статистический анализ объемов опухолей по каждой группе получавших препарат животных выполняли в соответствии с непараметрическим тестом Mann Whitney на основании сравнений с контрольной группой, которой вводили носитель в пределах того же эксперимента. Величины длины (L) и ширины (W) измеряли в миллиметрах (мм), используя циркуль, регистрировали, и объем опухоли рассчитывали по формуле: Объем (мм 3) = LW20,5. Отдельные величины определяли для каждой несущей опухоль бестимусной мыши и указывали день измерения (день, D). В день определения стадии опухоли (0 день) объем опухоли получавшего лечение животного (Т 01) вычитали из соответствующего объема опухоли в каждый день наблюдения (TD1). Это давало изменениеобъема опухоли для указанной получавшей лечение бестимусной мыши (Т 1 = TD1 - Т 01). Изменение объемов опухолей для каждого члена контрольной группы (ЛС) рассчитывали таким же образом, как указано выше. Результаты, полученные с ксенотрансплантатами опухолей, сведены в таблицу ниже. При рандомизации (0 день) средний объем массы опухоли составил 10015 мм 3, и общий рост опухоли представляет собой в действительности разницу между размером опухоли в день X и размером в 0 день. ПараметрS.E.M. обычно используется в статистике и обозначает стандартную ошибку среднего значения при распределении N (размера) экспериментальных величин. Кинетика общего роста опухоли после введения in vivo IB-01211 у ксенотрансплантатов опухоли молочной железы человека (линия клеток МХ-1) Р 0,05, статистически значимое различие (в соответствии с непараметрическим критерием MannWhitney: данная группа, по сравнению с контрольной группой, обработанной носителем).0,05, но 0,096, тенденция к статистической значимости. Высокая смертность, препятствовала значимому статистическому анализу. Кинетика общего роста опухоли после введения in vivo IB01211 у ксенотрансплантатов опухоли толстой кишки человека (линия клеток НТ-29) Р 0,05, статистически значимое различие (в соответствии с непараметрическим критерием Mann- 14010585 Кинетика общего роста опухоли после введения in vivo IB01211 у ксенотрансплантатов немелкоклеточной опухоли легких человека (линия клеток LX-1) Р 0,05, статистически значимое различие (в соответствии с непараметрическим критерием MannWhitney: данная группа, по сравнению с контрольной группой, обработанной носителем).0,05, но 0,006, тенденция к статистической значимости. В заключение, соединение IB01211 с соответствующей максимальной переносимой дозой (MTD) 3,5 мг/кг у обычных мышей CD-1 продемонстрировало значимый противоопухолевой эффект in vivo против не-мелкоклеточной опухоли легкого человека в дозе 0,43 MTD и проявило тенденцию к значимости против опухоли молочной железы в дозе 0,29 MTD, но не против опухоли толстой кишки в дозе 0,14MTD. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы I где каждая из групп R1 независимо выбрана из группы, состоящей из водорода, незамещенного С 1 С 4 алкилидена, замещенного или незамещенного С 1-С 4 алкила, где, в случае замещенных производных,заместитель представляет собой OR', где R' представляет собой С(=O)С 1-С 4 алкил или С 1-С 4 алкил;R2 представляет собой водород; каждая из групп R3 независимо выбрана из группы, состоящей из водорода, галогена, гидроксила,замещенного или незамещенного С 1-С 4 алкила, или замещенного или незамещенного C6-C18 арила, где в случае замещенных производных заместитель представляет галоген или гидроксил; и каждая из групп R4 независимо выбрана из NR2, О и S,или его фармацевтически приемлемая соль, производное, пролекарство или стереоизомер. 2. Соединение по п.1, имеющее следующую формулу II: где R1, R2, R3, R4 такие, как определено в п.1. 3. Соединение по п.1 или 2, где каждая из групп R1 независимо выбрана из незамещенного С 1 С 4 алкила и незамещенного С 1-С 4 алкилидена. 4. Соединение по любому из предыдущих пунктов, где каждая из групп R3 независимо выбрана из Н и замещенного или незамещенного С 6-С 18 арила, где в случае замещенных производных, заместитель представляет галоген или гидроксил. 5. Соединение по любому из предыдущих пунктов, где каждая из групп R4 представляет собой О. 6. Соединение по любому из предыдущих пунктов, имеющее следующую формулу: или его фармацевтически приемлемая соль, производное, пролекарство или стереоизомер. 7. Соединение по п.6, имеющее следующую стереохимию: 8. Способ получения соединения по п.1, который включает синтез оксазол/тиазол/имидазольного фрагмента и введение аминокислотного фрагмента. 9. Способ получения соединения по п.1, который включает культивирование штамма микроорганизма, способного его продуцировать.- 16010585 10. Способ по п.9, где полученное соединение представляет собой IB-01211 формулы 11. Способ по п.9 или 10, где микроорганизм представляет собой актиномицет. 12. Способ по п.9 или 10, где микроорганизм представляет собой, по существу, чистую культуру штамма ES7-008, имеющуюся под номером доступа СЕСТ 3358 из Испанской коллекции типовых культур в университете Валенсии, Испания. 13. Фармацевтическая композиция, включающая соединение по любому из пп.1-7 или его фармацевтически приемлемую соль, производное, пролекарство или стереоизомер и фармацевтически приемлемый разбавитель или носитель. 14. Применение соединения по любому из пп.1-7 или его фармацевтически приемлемой соли, производного, пролекарства или стереоизомера для изготовления лекарственного средства. 15. Применение по п.14, где получаемое лекарственное средство предназначено для лечения рака. 16. Способ лечения рака, который включает введение эффективного количества соединения по любому из пп.1-7 или его фармацевтически приемлемой соли, производного, пролекарства или стереоизомера.
МПК / Метки
МПК: C12P 21/04, A61K 38/12, A61P 35/00, C12R 1/04, C07K 5/097
Метки: цитотоксические, депсипептиды
Код ссылки
<a href="https://eas.patents.su/22-10585-citotoksicheskie-depsipeptidy.html" rel="bookmark" title="База патентов Евразийского Союза">Цитотоксические депсипептиды</a>
Предыдущий патент: Способ снижения содержания ацетальдегида в формованных из расплава полиэфирах, изделие из полиэфира, способ его изготовления и композиция для его изготовления
Следующий патент: Иммуногенные композиции, содержащие циклические пептиды, полученные из бета-амилоидного пептида
Случайный патент: Применение вторичных производных 8-оксихинолин-7-карбоксамида в качестве противогрибковых агентов