Пептиды и соединения, которые связываются с рецептором
Номер патента: 9286
Опубликовано: 28.12.2007
Авторы: Вейс Джеффери Кеннет, Юрков Эдвард Джон, Макдональд Брайан Р.
Формула / Реферат
1. Пептидное соединение, которое связывается с рецептором тромбопоэтина, где указанное пептидное соединение включает (Н-IEGPTLRQ (2-Nal) LAARX10)2K-NH2, где Х10 выбран из группы, состоящей из саркозина или b-аланина.
2. Пептидное соединение по п.1, где указанное пептидное соединение ковалентно связано с гидрофильным полимером.
3. Пептидное соединение по п.2, в котором указанный гидрофильный полимер имеет среднюю молекулярную массу в диапазоне от приблизительно 500 до приблизительно 40000 Да.
4. Пептидное соединение по п.2, в котором указанный гидрофильный полимер имеет среднюю молекулярную массу в диапазоне от приблизительно 5000 до приблизительно 20000 Да.
5. Пептидное соединение по п.2, в котором указанный полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, полимолочной кислоты и полигликолевой кислоты.
6. Пептидное соединение по п.5, где указанное пептидное соединение ковалентно связано с полиэтиленгликолем.
7. Пептидное соединение по п.1, в котором каждая из димерных субъединиц указанного пептидного соединения ковалентно связана с гидрофильным полимером.
8. Фармацевтическая композиция, содержащая пептидное соединение по п.1 в сочетании с фармацевтически приемлемым носителем.
9. Способ лечения пациента, страдающего расстройством, которое чувствительно к лечению агонистами тромбопоэтина, включающий введение пациенту терапевтически эффективной дозы или количества пептидного соединения по п.1.
10. Физиологически активная в основном неиммуногенная водорастворимая полипептидная композиция, содержащая пептидное соединение по п.1, связанное при помощи связывающего агента по крайней мере с одним полимером, имеющим молекулярную массу от приблизительно 500 до приблизительно 20000 Да, выбранным из группы, состоящей из полиэтиленгликоля и полипропиленгликоля, где указанный полимер является незамещенным или замещенным алкокси- или алкильными группами и указанные алкокси- или алкильные группы имеют в своем составе менее 5 атомов углерода.
11. Полипептидная композиция по п.10, в которой указанный полимер имеет молекулярную массу от приблизительно 750 до приблизительно 15000 Да.
12. Полипептидная композиция по п.10, в которой указанный полимер имеет молекулярную массу от приблизительно 5000 до приблизительно 10000 Да.
13. Полипептидная композиция по п.10, в которой указанный полимер представляет собой полиэтиленгликоль.
14. В основном, неиммуногенная водорастворимая полипептидная композиция, содержащая пептидное соединение по п.10 и фармацевтически приемлемый носитель.
15. Способ активации рецептора тромбопоэтина в клетке, включающий введение указанной клетки в контакт с эффективным количеством пептидного соединения, которое включает (Н-IEGPTLRQ(2-Nal)LAARX10)2K-NH2, где Х10 выбран из группы, состоящей из саркозина или b-аланина.
16. Способ по п.15, в котором указанные клетки включают мегакариоциты, тромбоциты или клетки CD34+ человека.
17. Способ по п.15, в котором указанные клетки включают TPO-зависимые клетки.
18. Способ лечения тромбоцитопении у пациента, включающий:
(a) получение популяции клеток указанного пациента, включающей клетки-предшественники мегакариоцитов;
(b) обработку указанных клеток в соответствии со способом по п.15 и
(c) введение указанных обработанных клеток указанному пациенту с целью увеличения количества мегакариоцитов, имеющихся у указанного пациента, по сравнению с тем количеством, которое имелось бы без такого лечения.
19. Способ по п.18, где указанная тромбоцитопения является следствием химиотерапии.
20. Способ по п.19, в котором указанную популяцию клеток получают до проведения указанной химиотерапии.
21. Способ по п.18, где указанная тромбоцитопения является следствием радиационной терапии.
22. Способ по п.21, в котором указанную популяцию клеток получают до проведения указанной радиационной терапии.
23. Способ лечения пациента, страдающего тромбоцитопенией, включающий введение указанному пациенту терапевтически эффективной дозы пептидного соединения, которое включает (Н-IEGPTLRQ(2-Nal)LAARX10)2K-NH2, где Х10 выбран из группы, состоящей из саркозина или b-аланина.
24. Способ по п.23, где указанная тромбоцитопения является следствием химиотерапии или радиационной терапии.
25. Способ по п.24, в котором указанному пациенту перед проведением указанной химиотерапии или радиационной терапии вводят антагонист TPO.
26. Способ по п.23, где указанная тромбоцитопения являетсяследствием пересадки костного мозга.
27. Способ профилактического воздействия на пациента, для которого существует опасность возникновения тромбоцитопении, включающий введение указанному пациенту профилактически эффективного количества пептидного соединения, которое включает (H-IEGPTLRQ(2-Nal)LAARX10)2K-NH2, где Х10 выбран из группы, состоящей из саркозина или b-аланина.
28. Способ по п.27, в котором указанное пептидное соединение вводят перед пересадкой костного мозга, химиотерапией или радиационной терапией.
29. Пептидное соединение, которое связывается с рецептором тромбопоэтина, где указанное соединение имеет:
(1) молекулярную массу менее приблизительно 8000 Да и
(2) сродство к связыванию с рецептором тромбопоэтина, выраженное через IC50 не более приблизительно 100 мкМ, где указанное соединение содержит следующую последовательность аминокислот:
X9 X8 G X1 Х2 Х3 Х4 X5 Х6 Х7
где X9 представляет собой А, С, Е, G, I, L, М, Р, R, Q, S, Т или V; Х8 представляет собой А, С, D, Е, K, L, Q, R, S, Т или V; X1 представляет собой С, L, M, P, Q, V; Х2 представляет собой F, K, L, N, Q, R, S, Т или V; Х3 представляет собой С, F, I, L, М, R, S, V или W; Х4 представляет собой любую из 20 генетически кодируемых L-аминокислот; Х5 представляет собой A, D, E, G, K, М, Q, R, S, Т, V или Y; Х7 представляет собой С, G, I, K, L, М, N, R или V; и Х6 представляет собой b-(2-нафтил)аланин.
30. Пептидное соединение по п.29, в котором указанная последовательность аминокислот циклизована.
31. Пептидное соединение по п.29, в котором указанная последовательность аминокислот димеризована.
32. Способ активации рецептора тромбопоэтина в клетке, включающий введение указанной клетки в контакт с эффективным количеством пептида, имеющего молекулярную массу менее приблизительно 8000 Да, где указанное соединение содержит следующую последовательность аминокислот:
X9 X8 G X1 Х2 Х3 Х4 Х5 X6 X7
где Х9 представляет собой А, С, Е, G, I, L, М, Р, R, Q, S, Т или V; Х8 представляет собой А, С, D, Е, K, L, Q, R, S, Т или V; X1 представляет собой С, L, M, P, Q, V; Х2 представляет собой F, K, L, N, Q, R, S, Т или V; Х3 представляет собой С, F, I, L, М, R, S, V или W; Х4 представляет собой любую из 20 генетически кодируемых L-аминокислот; X5 представляет собой A, D, E, G, K, М, Q, R, S, Т, V или Y; Х7 представляет собой С, G, I, K, L, М, N, R или V; и Х6 представляет собой b-(2-нафтил)аланин.
33. Пептидное соединение по п.32, в котором указанная последовательность аминокислот циклизована.
34. Пептидное соединение по п.32, в котором указанная последовательность аминокислот димеризована.
35. Способ активации рецептора тромбопоэтина в клетке, включающий введение указанной клетки в контакт с эффективным количесттюь пептидного соединения, ковалентно связанного с гидрофильным полимером, где указанное соединение содержит последовательность аминокислот IEGPTLRQ (2-Nal) LAAR (Sar).
36. Способ по п.35, в котором указанный гидрофильный полимер имеет среднюю молекулярную массу в диапазоне от приблизительно 500 до приблизительно 40000 Да.
37. Способ по п.35, в котором указанный гидрофильный полимер имеет среднюю молекулярную массу в диапазоне от приблизительно 5000 до приблизительно 20000 Да.
38. Способ по п.35, в котором указанный полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, полимолочной кислоты и полигликолевой кислоты.
39. Способ по п.38, в котором указанное пептидное соединение ковалентно связано с полиэтиленгликолем.
40. Способ по п.35, в котором указанные клетки представляют собой клетки in vivo.
41. Способ по п.35, в котором указанные клетки представляют собой клетки in vitro.
42. Способ по п.35, в котором указанные клетки включают мегакариоциты, тромбоциты или клетки CD34+ человека.
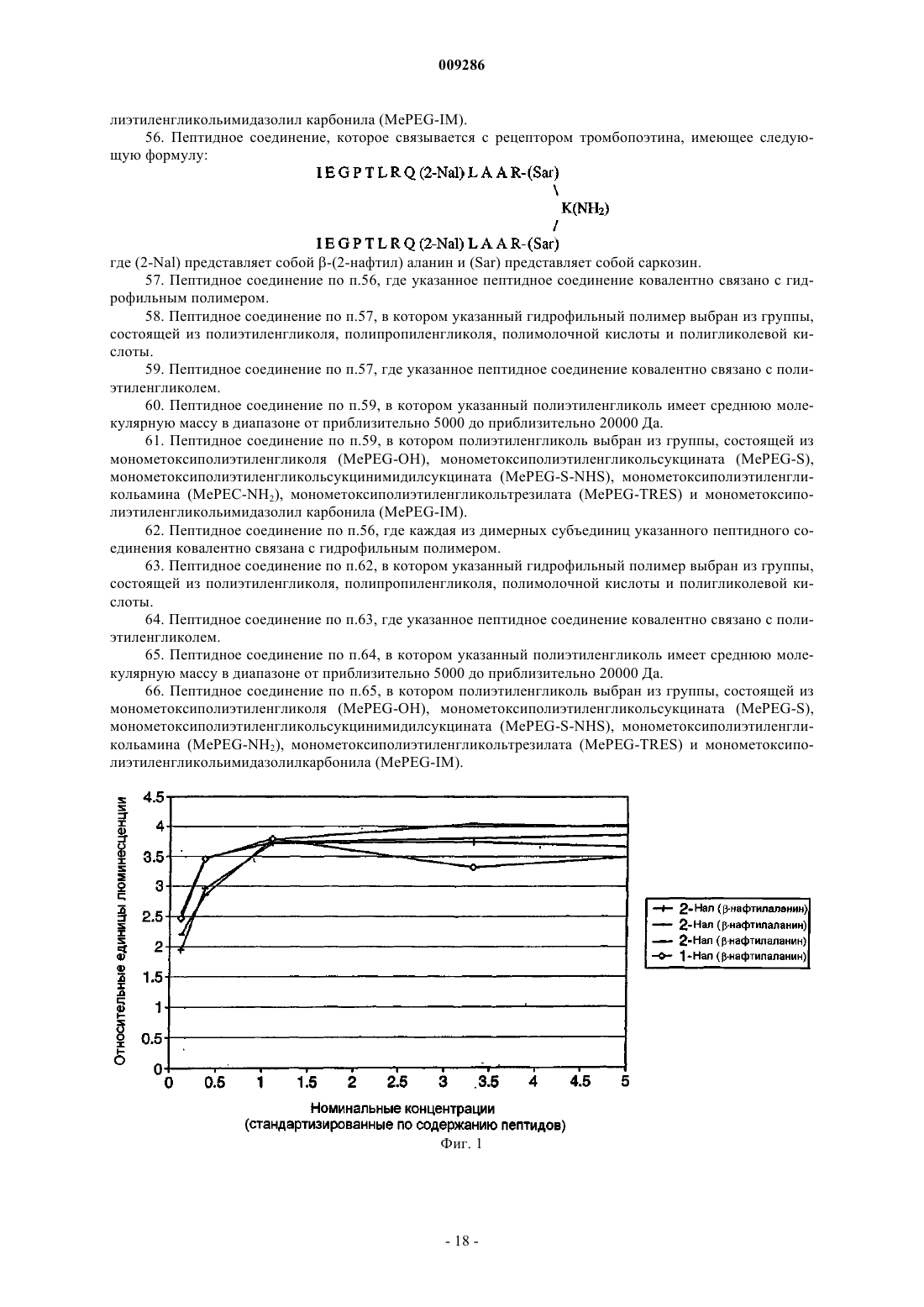
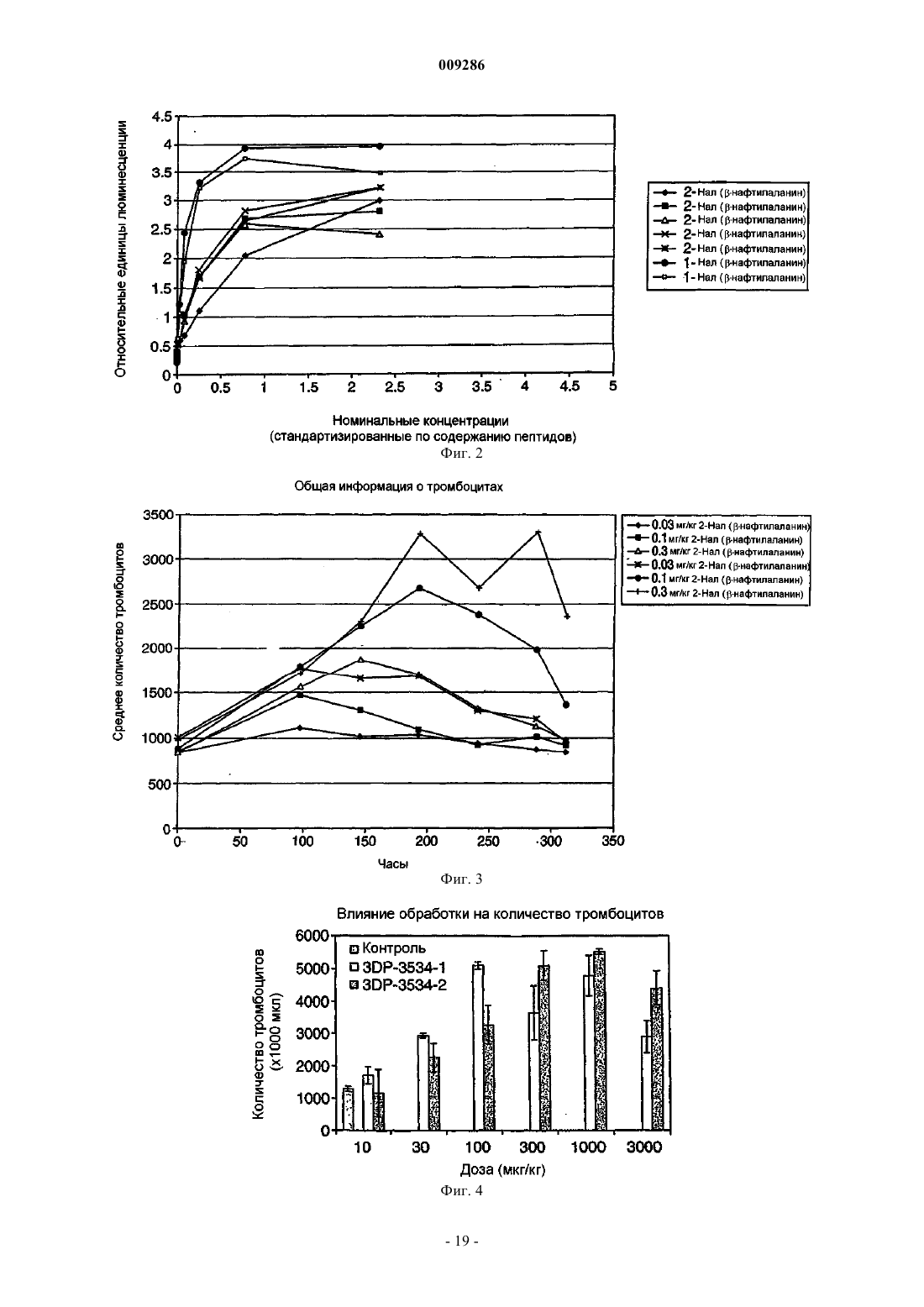
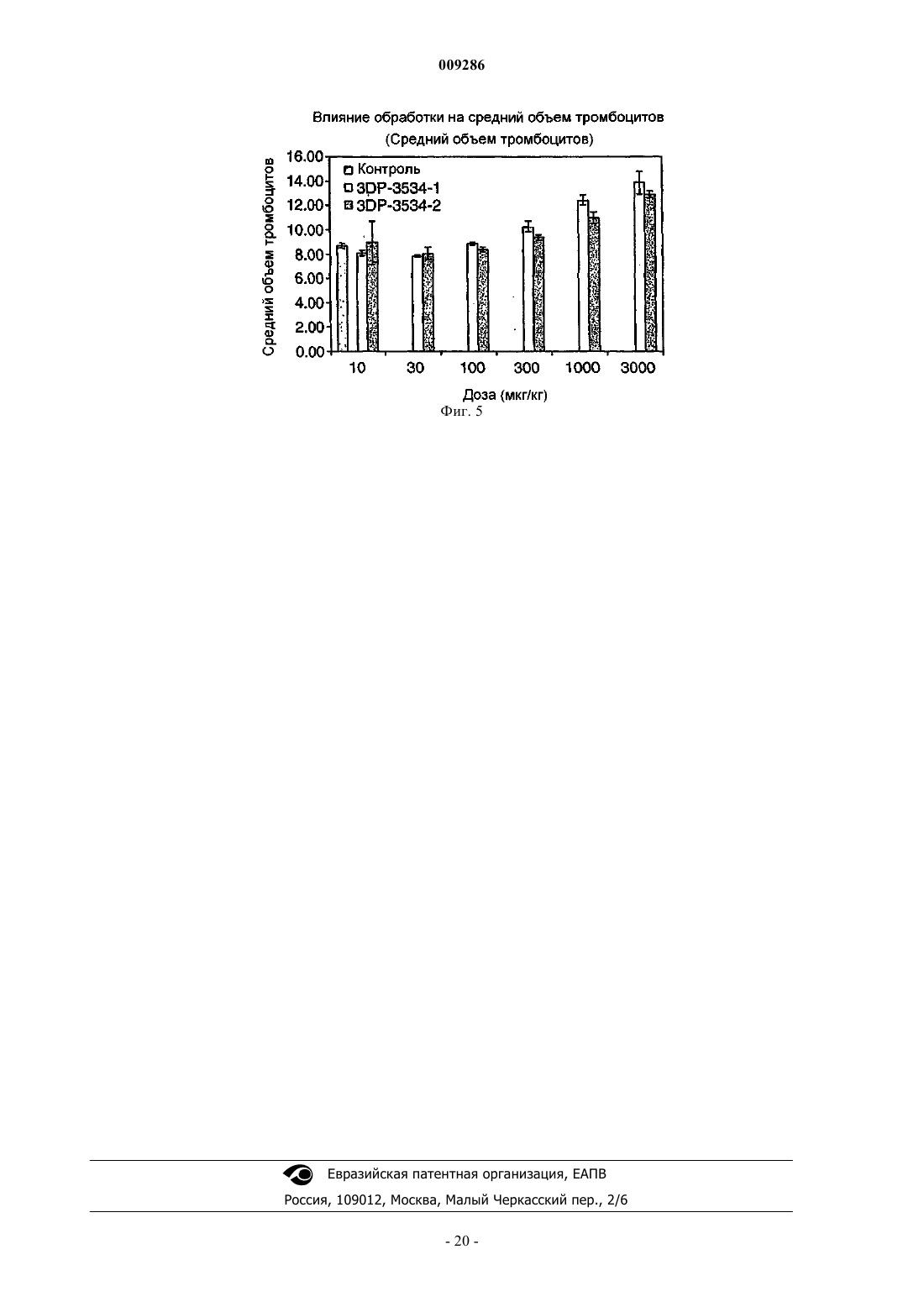
43. Способ по п.35, в котором указанные клетки включают TPO-зависимые клетки.
44. Способ лечения тромбоцитопении у пациента, включающий:
(a) получение популяции клеток указанного пациента, включающей клетки-предшественники мегакариоцитов;
(b) обработку указанных клеток в соответствии со способом по п.35 и
(c) введение указанных обработанных клеток указанному пациенту с целью увеличения количества мегакариоцитов, имеющихся у указанного пациента, по сравнению с тем количеством, которое имелось бы без такого лечения.
45. Способ по п.44, где указанная тромбоцитопения является следствием химиотерапии.
46. Способ по п.45, в котором указанную популяцию клеток получают до проведения указанной химиотерапии.
47. Способ по п.44, где указанная тромбоцитопения является следствием радиационной терапии.
48. Способ по п.47, в котором указанную популяцию клеток получают до проведения указанной радиационной терапии.
49. Пептидное соединение по п.29, где пептидное соединение содержит следующую последовательность аминокислот: IEGPTLRQ (2-Nal) LAAR (Sar).
50. Пептидное соединение, которое связывается с рецептором тромбопоэтина, где указанное соединение включает (H-IEGPTLRQ(2-Nal)LAAR(Sar))2K-NH2.
51. Пептидное соединение по п.50, где указанное пептидное соединение ковалентно связано с полимером.
52. Пептидное соединение по п.51, в котором указанный гидрофильный полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, полимолочной кислоты и полигликолевой кислоты.
53. Пептидное соединение по п.52, где указанное пептидное соединение ковалентно связано с полиэтиленгликолем.
54. Пептидное соединение по п.53, в котором указанный полиэтиленгликоль имеет среднюю молекулярную массу в диапазоне от приблизительно 5000 до приблизительно 20000 Да.
55. Пептидное соединение по п.53, в котором полиэтиленгликоль выбран из группы, состоящей из монометоксиполиэтиленгликоля (MePEG-OH), монометоксиполиэтиленгликольсукцината (MePEG-S), монометоксиполиэтиленгликольсукцинимидилсукцината (MePEG-S-NHS), монометоксиполиэтиленгликольамина (MePEG-NH2), монометоксиполиэтиленгликольтрезилата (MePEG-TRES) и монометоксиполиэтиленгликольимидазолил карбонила (MePEG-IM).
56. Пептидное соединение, которое связывается с рецептором тромбопоэтина, имеющее следующую формулу:
где (2-Nal) представляет собой b-(2-нафтил) аланин и (Sar) представляет собой саркозин.
57. Пептидное соединение по п.56, где указанное пептидное соединение ковалентно связано с гидрофильным полимером.
58. Пептидное соединение по п.57, в котором указанный гидрофильный полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, полимолочной кислоты и полигликолевой кислоты.
59. Пептидное соединение по п.57, где указанное пептидное соединение ковалентно связано с полиэтиленгликолем.
60. Пептидное соединение по п.59, в котором указанный полиэтиленгликоль имеет среднюю молекулярную массу в диапазоне от приблизительно 5000 до приблизительно 20000 Да.
61. Пептидное соединение по п.59, в котором полиэтиленгликоль выбран из группы, состоящей из монометоксиполиэтиленгликоля (MePEG-OH), монометоксиполиэтиленгликольсукцината (MePEG-S), монометоксиполиэтиленгликольсукцинимидилсукцината (MePEG-S-NHS), монометоксиполиэтиленгликольамина (МеРЕС-NH2), монометоксиполиэтиленгликольтрезилата (MePEG-TRES) и монометоксиполиэтиленгликольимидазолил карбонила (MePEG-IM).
62. Пептидное соединение по п.56, где каждая из димерных субъединиц указанного пептидного соединения ковалентно связана с гидрофильным полимером.
63. Пептидное соединение по п.62, в котором указанный гидрофильный полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, полимолочной кислоты и полигликолевой кислоты.
64. Пептидное соединение по п.63, где указанное пептидное соединение ковалентно связано с полиэтиленгликолем.
65. Пептидное соединение по п.64, в котором указанный полиэтиленгликоль имеет среднюю молекулярную массу в диапазоне от приблизительно 5000 до приблизительно 20000 Да.
66. Пептидное соединение по п.65, в котором полиэтиленгликоль выбран из группы, состоящей из монометоксиполиэтиленгликоля (MePEG-OH), монометоксиполиэтиленгликольсукцината (MePEG-S), монометоксиполиэтиленгликольсукцинимидилсукцината (MePEG-S-NHS), монометоксиполиэтиленгликольамина (MePEG-NH2), монометоксиполиэтиленгликольтрезилата (MePEG-TRES) и монометоксиполиэтиленгликольимидазолилкарбонила (MePEG-IM).
Текст
009286 Перекрестные ссылки на родственные заявки По настоящей заявке испрашивается приоритет заявки США порядковый 60/498740, поданной 28 августа 2003 г. Область техники, к которой относится изобретение Настоящее изобретение относится к пептидным соединениям, которые связываются с рецептором тромбопоэтина (c-mpl или TPO-R) и активируют его или каким-либо иным образом действуют как агонисты TPO. Применения настоящего изобретения относятся к областям биохимии и химии лекарственных средств, и в частности изобретение относится к агонистам TPO, предназначенным для применения в лечении заболеваний человека. Уровень техники Мегакариоциты представляют собой клетки, вырабатываемые костным мозгом, которые несут ответственность за выработку тромбоцитов, участвующих в кровообращении. Хотя их содержание в большинстве образцов не превышает 0,25% клеток костного мозга, их объем более чем в 10 раз превосходит объем типичных клеток костного мозга. См. Kuter, et al., Proc. Natl. Acad. Sci. USA 91: 11104-11108(1994). Мегакариоциты подвергаются процессу, известному как эндомитоз, в результате которого происходит репликация их ядер, но они не способны подвергаться клеточному делению, что приводит к появлению полиплоидных клеток. В ответ на уменьшение количества тромбоцитов возрастает скорость эндомитоза, формируются мегакариоциты с более высокой плоидностью и их количество может возрастать вплоть до 3 раз. См. Harker, J. Clin. Invest., 47: 458-465 (1968). В противоположность этому, в ответ на возрастание числа тромбоцитов скорость эндомитоза уменьшается, формируются мегакариоциты с более низкой плоидностью и их количество может уменьшаться на 50%. Не известен точный механизм физиологической обратной связи, за счет которого масса участвующих в кровообращении тромбоцитов регулирует скорость эндомитоза и число мегакариоцитов костного мозга. В настоящее время считается, что циркулирующим тромбопоэтическим фактором, который вовлечен в опосредование данного цикла обратной связи, является тромбопоэтин (TPO). Более конкретно,было показано, что тромбопоэтин является основным гуморальным регулятором в состояниях, относящихся к тромбоцитопении. См., например, Metcalf, Nature, 369: 519-520 (1994). В нескольких исследованиях было показано, что TPO увеличивает количество тромбоцитов, размер тромбоцитов, а также увеличивает захват изотопов тромбоцитами у животных-реципиентов. Конкретно считается, что TPO воздействует на мегакариоцитопоэз несколькими путями: (1) вызывает увеличение размеров и числа мегакариоцитов; (2) вызывает увеличение содержания ДНК в мегакариоцитах в форме полиплоидий; (3) увеличивает эндомитоз мегакариоцитов; (4) приводит к увеличенному созреванию мегакариоцитов и (5) обеспечивает повышение процентного содержания клеток-предшественников в костном мозге в форме небольших ацетилхолинэстеразаположительных клеток. Тромбоциты необходимы для свертывания крови. Если их число слишком мало, имеется серьезная опасность смерти пациента от катастрофического кровотечения. Следовательно, TPO обладает потенциально полезным применением как для диагностики, так и для лечения различных гематологических расстройств, например заболеваний, которые первоначально возникают из-за дефектов тромбоцитов. Продолжающиеся клинические исследования TPO показали, что его введение пациентам безопасно. Кроме того, современные исследования обеспечили основу для прогнозирования эффективности тромбопоэтиновой терапии в лечении тромбоцитопении, и в частности тромбоцитопении, которая является следствием химиотерапии, радиационной терапии или трансплантации костного мозга при лечении рака или лимфомы. См., например, McDonald, Am. J. Ped. Hematology/Oncology, 14: 8-21 (1992). Были клонированы и охарактеризованы гены, кодирующие TPO. См. Kuter, et al., Proc. Natl. Acad.Sci. USA, 91: 11104-11108 (1994); Barley, et al., Cell 77: 1117-1124 (1994); Kaushansky et al., Nature 369: 568-571 (1994); Wendling, et al., Nature, 369: 571-574 (1994); и Sauvage et al., Nature 369: 533-538 (1994). Тромбопоэтин представляет собой гликопротеин, у которого имеются по меньшей мере две формы со средними молекулярными массами 25 и 31 кДа, с общей N-концевой последовательностью аминокислот. См. Bartley, et al., Cell, 77: 1117-1124 (1994). По-видимому, тромбопоэтин имеет две различные области,разделенные потенциальным сайтом расщепления Arg-Arg. Аминоконцевая область является высоко консервативной у человека и мыши, причем она обладает определенной гомологией с эритропоэтином, а также интерфероном- и интерфероном-. Карбоксиконцевая область демонстрирует значительные видовые расхождения. Были описаны последовательности ДНК и кодируемые пептидные последовательности TPO-R человека (известного также как c-mpl). См. Vigon, et al., Proc. Natl. Acad. Sci. USA, 89: 5640-5644 (1992).TPO-R является членом семейства рецепторов гематопоэтинового фактора роста, т.е. семейства, характеризующегося общей структурной схемой внеклеточного домена, включающего четыре консервативных С-остатка в N-концевой части и фрагмент WSXWS (SEQ ID NO: 1), расположенный вблизи трансмембранной области. См. Bazan, Proc. Natl. Acad. Sci. USA, 87: 6934-6938 (1990). Доказательства того, что этот рецептор играет функциональную роль в гематопоэзе, включают наблюдения, согласно которым его экспрессия ограничена селезенкой, костным мозгом или печенью плода у мышей (см. Souyri, et al., Cell 63: 1137-1147 (1990 и мегакариоцитами, тромбоцитами и клетками CD34+ у человека (см. Methia, et al.,-1 009286Blood 82: 1395-1401 (1993. Более того, воздействие на клетки CD34+ синтетических олигонуклеотидов,являющихся антисмысловыми по отношению к РНК mpl, значительно тормозит появление колоний мегакариоцитов, не оказывая влияния на образование эритроидных или миелоидных колоний. Некоторые исследователи постулируют, что рецептор функционирует в виде гомодимера подобно тому, как это имеет место в случае рецепторов G-CSF и эритропоэтина. Доступность клонированных генов TPO-R облегчает поиск агонистов этого важного рецептора. Доступность рекомбинантного белка рецептора дает возможность осуществлять исследования взаимодействия рецептор-лиганд в широком круге случайных или полуслучайных систем генерации разнообразных пептидов. Эти системы раскрыты в патентах США 6251864, 6083913, 6121238, 5932546,5869451, 6506362 и 6465430, а также Cwirla et al., Proc. Natl. Acad. Sci. USA 87: 6378-6382 (1990), причем каждый из этих источников включен в настоящую заявку с помощью ссылки. Медленное восстановление уровней тромбоцитов у пациентов, страдающих тромбоцитопенией, представляет собой серьезную проблему, что придает актуальность поискам агонистов факторов роста крови,способных ускорить регенерацию тромбоцитов. Настоящее изобретение относится к такому агонисту. Сущность изобретения Настоящее изобретение направлено на определенные пептидные соединения низкой молекулярной массы, которые обладают способностью прочно связываться с TPO-R, способны активировать TPO-R и обеспечивают потенциально уменьшенные побочные эффекты по сравнению с известными агонистамиTPO. Соответственно, эти данные пептидные соединения могут применяться для терапевтических целей при лечении состояний, опосредуемых TPO (например, тромбоцитопении, которая является следствием химиотерапии, радиационной терапии или пересадки костного мозга), а также для диагностических целей, при исследовании механизма гематопоэза и для размножения in vitro мегакариоцитов и коммитированных клеток-предшественников. Пептидные соединения, которые подходят для терапевтических и/или диагностических целей,имеют IC50 приблизительно 2 мМ или менее, что определяют, например, анализом сродства к связыванию, который описан в примере 3 патента США 5869451, причем более низкие значения IC50 соответствуют более сильному сродству к связыванию с TPO-R. Анализ, описанный в патенте США 5869451,заключается в следующем: сродство пептидных соединений к связыванию измеряют с помощью анализа конкурентного связывания. Лунки микротитровального планшета покрывают 1 мг стрептавидина, блокированного PBS/1% BSA, затем 50 нг биотинилированного иммобилизованного антитела против рецептора (Ab179). Затем лунки обрабатывают растворимым сбором TPO-R в разбавлении 1:10. Пептидные соединения в различных концентрациях смешивают с постоянным количеством укороченной формыTPO, состоящей из остатков 1-156, объединенных с С-концевой областью белка, связывающего мальтозу(MBP-TPO156). Смеси пептид-МВР-TPO156 добавляют в лунки, покрытые TPO-R, инкубируют в течение 2 ч при 4 С и затем промывают PBS. Количество МВР-TPO156, которое связано в равновесном состоянии,измеряют путем добавления кроличьей антисыворотки против МВР, с последующим добавлением козьего антикроличьего IgG, конъюгированного со щелочной фосфатазой. Затем количество щелочной фосфатазы в каждой лунке определяют стандартными способами. Анализ выполняют для ряда концентраций пептидного соединения и результаты наносят на график, так что ось "у" отображает количество связанного MBP-TPO156 и ось "х" отображает концентрацию пептидного соединения. После этого можно определить концентрацию, при которой пептидное соединение уменьшит количество МВР-TPO156, связанного с иммобилизованным TPO-R, на 50% (IC50). При использовании этих условий анализа константа диссоциации (Kd) для пептидного соединения должна быть аналогична измеренной величине IC50. Для фармацевтических целей пептидные соединения предпочтительно имеют IC50 не более приблизительно 100 мкМ,более предпочтительно не более 500 нМ. В предпочтительном варианте осуществления молекулярная масса пептидного соединения составляет от приблизительно 250 до приблизительно 8000 Да. Если пептидные соединения по настоящему изобретению олигомеризованы, димеризованы и/или образуют производные с гидрофильным полимером, как описано в настоящей заявке, молекулярные массы таких пептидных соединений будут существенно выше и могут принимать любое значение в диапазоне от приблизительно 500 до приблизительно 120000 Да, более предпочтительно от приблизительно 8000 до приблизительно 80000 Да. При использовании в диагностических целях пептидные соединения по настоящему изобретению предпочтительно помечены обнаруживаемой меткой, и, соответственно, пептидные соединения без подобной метки служат промежуточными соединениями при получении меченых пептидных соединений. Пептидные соединения, удовлетворяющие указанным критериям молекулярной массы и сродства к связыванию с TPO-R, содержат 9 или более аминокислот, причем аминокислоты являются природными или синтетическими (неприродными) аминокислотами. Соответственно, предпочтительные пептидные соединения включают соединения, имеющие:(1) молекулярную массу менее приблизительно 5000 Да и(2) сродство к связыванию с TPO-R, выраженное величиной IC50, не более приблизительно 100 мкМ,в которых от ни одной до всех связей -C(O)NH- пептидного соединения замещены связями, выбранными из группы, состоящей из связи -СН 2 ОС(О)NR-; фосфонатной связи; связи -CH2S(О)2NR-; связи-CH2NR-; связи -C(O)NR6-; и связи -NHC(O)NH-, где R представляет собой водород или низший алкил иR6 представляет собой низший алкил,причем помимо этого N-концевая область указанных пептидных соединений выбрана из группы, состоящей из группы -NRR1; группы -NRC(O)R; группы -NRC(O)OR; группы -NRS(O)2R; группы -NHC(O)NHR; сукцинимидной группы; группы бензилоксикарбонил-NH-; и группы бензилоксикарбонил-NH-, имеющей от 1 до 3 заместителей в фенильном кольце, выбранных из группы, состоящей из низшего алкила,низшего алкокси, хлора и брома, причем R и R1 независимо выбраны из группы, состоящей из водорода и низшего алкила,и, кроме этого, С-концевая область указанных пептидных соединений имеет формулу -C(O)R2, где 2R выбран из группы, состоящей из гидрокси, низшего алкокси и -NR3R4, где R3 и R4 независимо выбраны из группы, состоящей из водорода и низшего алкила, и где атом азота группы -NR3R4 может необязательно входить в аминогруппу N-концевой области, формируя таким образом циклический пептид,а также физиологически приемлемые соли указанных соединений. В одном из вариантов осуществления изобретение направлено на меченые пептидные соединения, в число которых входят описанные выше пептидные соединения, содержащие ковалентно присоединенную к ним обнаруживаемую метку. В одном из вариантов осуществления основное пептидное соединение содержит последовательность аминокислот (SEQ ID NO: 2): Х 9 Х 8 G X1 X2 Х 3 X4 X5 Х 6 Х 7 где Х 9 представляет собой А, С, Е, G, I, L, М, Р, R, Q, S, Т или V; и Х 8 представляет собой А, С, D, Е, K,L, Q, R, S, Т или V; и Х 6 представляет собой остаток -(2-нафтил)аланина (называемый в настоящей заявке 2-Nal). Более предпочтительно Х 9 представляет собой А или I; и Х 8 представляет собой D, Е илиK. Далее, X1 представляет собой С, L, M, P, Q, V; Х 2 представляет собой F, K, L, N, Q, R, S, Т или V; Х 3 представляет собой С, F, I, L, M, R, S, V или W; Х 4 представляет собой любую из 20 генетически кодируемых L-аминокислот; Х 5 представляет собой A, D, E, G, K, М, Q, R, S, Т, V или Y; и Х 7 представляет собой С, G, I, K, L, M, N, R или V. Особенно предпочтительное пептидное соединение включает последовательность аминокислот(Sar) представляет собой саркозин. В другом варианте осуществления пептидные соединения по настоящему изобретению предпочтительно димеризованы или олигомеризованы для увеличения сродства и/или активности соединений. Пример предпочтительного димерного пептидного соединения включает, не ограничиваясь этим, следующее соединение: где Х 10 представляет собой остаток саркозина или -аланина (SEQ ID NO: 7). Приведенное выше соединение также может быть представлено следующей структурной формулой: (H-IEGPTLRQ(2-Nal)LAARX10)2K-NH2,где Х 10 представляет собой саркозин, причем соединение имеет следующую структуру: где (2-Nal) представляет собой -(2-нафтил)аланин и (Sar) представляет собой саркозин (SEQ ID NO: 7). Данное пептидное соединение, которое также может быть представлено структурной формулой (HIEGPTLRQ(2-Nal)LAAR(Sar2K-NH2, в тексте настоящей заявки называется TPO соединение 1. Еще в одном варианте осуществления предпочтительные пептидные соединения, предназначенные для применения в настоящем изобретении, включают пептидные соединения, которые ковалентно присоединены к одному или нескольким соединениям из числа гидрофильных полимеров. Подходящие гидрофильные полимеры включают, не ограничиваясь перечисленным, полиалкилэфиры, примерами которых служат полиэтиленгликоль и полипропиленгликоль, полимолочную кислоту, полигликолевую кислоту, полиоксиалкены, поливиниловый спирт, поливинилпирролидон, целлюлозу и производные целлюлозы, декстран и производные декстрана и т.д., как описано в патенте США 5869451, все содержание которого включено в настоящую заявку с помощью ссылки. Описанные в настоящей заявке пептидные соединения применимы для профилактики и лечения заболеваний, опосредованных TPO, и в частности для лечения гематологических расстройств, включая, но не ограничиваясь этим, тромбоцитопению, являющуюся следствием химиотерапии, радиационной тера-3 009286 пии или пересадки костного мозга. Таким образом, настоящее изобретение также относится к способу лечения, в котором пациент, страдающий расстройством, которое чувствительно к лечению агонистамиTPO, получает или же ему осуществляют введение терапевтически эффективной дозы или количества пептидного соединения по настоящему изобретению. Кроме этого изобретение относится к фармацевтическим композициям, содержащим одно или несколько пептидных соединений, описанных в настоящей заявке, а также физиологически приемлемый носитель. Эти фармацевтические композиции могут быть представлены в разнообразных формах, включая лекарственные формы для перорального приема, а также порошки и растворы для ингаляций и растворы для инъекций и инфузий. Краткое описание чертежей На фиг. 1 показана активность TPO-соединения 1 и проведено сравнение с пептидным соединением, известным в предшествующей технике (которое во всем тексте настоящей заявки называют пептидное соединение известного уровня техники). Различие между TPO-соединением 1 и пептидным соединением известного уровня техники заключается в том, что в структуру последнего входит -(1 нафтил)аланин (1-Nal) в том месте, где в TPO-соединении 1 имеется (2-Nal). На фиг. 2 показана активность ПЭГилированного TPO-соединения 1 и проведено сравнение с ПЭГилированным пептидным соединением известного уровня техники. На фиг. 3 показано изменение количества тромбоцитов in vivo у крыс и проведено сравнение, демонстрирующее относительную эффективность ПЭГилированного TPO-соединения 1 по отношению к ПЭГилированному пептидному соединению известного уровня техники. На фиг. 4 и 5 показаны и проведено сравнение, соответственно, количества и объема циркулирующих тромбоцитов в зависимости от дозы при применении ПЭГилиированного пептидного соединения известного уровня техники и применении ПЭГилированного TPO-соединения 1. Описание конкретных вариантов осуществленияI. Определения и общие параметры. Следующие определения приведены для того, чтобы иллюстрировать и определить значение и область применения различных терминов, которые использованы для описания изобретения в настоящей заявке. Термин агонист относится к биологически активному лиганду, который связывается с комплементарным ему активным рецептором и активирует последний либо для того, чтобы вызвать биологическую реакцию в рецепторе, либо для улучшения уже существующей биологической активности рецептора. Термин пептидное соединение относится к молекуле, которая при гидролизе расщепляется на аминокислоты, и/или производные аминокислот, и/или заменители аминокислот. Термин фармацевтически приемлемые соли относится к нетоксичным солям щелочных металлов,щелочно-земельных металлов и аммония, которые обычно используют в фармацевтической промышленности, включая натриевые, калиевые, литиевые, кальциевые, магниевые, бариевые, аммониевые и протаминцинковые соли, которые получают способами, хорошо известными в технике. Кроме этого данный термин включает нетоксичные кислотно-аддитивные соли, которые, в основном, получают реакциями соединений по настоящему изобретению с подходящими органическими или неорганическими кислотами. В число типичных солей входят гидрохлориды, гидробромиды, сульфаты, бисульфаты, ацетаты, оксалаты, валераты, олеаты, лаураты, бораты, бензоаты, лактаты, фосфаты, тозилаты, цитраты, малеаты,фумараты, сукцинаты, тартраты, напсилаты и т.п. Термин фармацевтически приемлемая кислотно-аддитивная соль относится к таким солям, которые сохраняют биологическую эффективность и свойства свободных оснований, не являются нежелательными с биологической или какой-либо иной точки зрения и образованы неорганическими кислотами, такими как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., а также органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота,малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота,этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и т.п. Описание фармацевтически приемлемых кислотно-аддитивных солей в качестве пролекарств см. Bundgaard, H., выше. Термин фармацевтически приемлемый сложный эфир относится к таким эфирам, которые при гидролизе сложноэфирной связи сохраняют биологическую эффективность и свойства карбоновой кислоты или спирта и не являются нежелательными с биологической или какой-либо иной точки зрения. Описание фармацевтически приемлемых сложных эфиров в качестве пролекарств смотрите Bundgaard, H.,ed., Design of Prodrugs, Elsevier Science Publishers, Amsterdam (1985). Эти сложные эфиры, как правило,образованы соответствующей карбоновой кислотой и спиртом. В основном, сложные эфиры могут быть получены при помощи стандартных синтетических методик (см., например, March, Advansed OrganicChemistry, 4th Ed., John WileySons, New-York (1992), 393-396 и приведенные там ссылки, а также Mark,et al., Encyclopedia of Chemical Technology, John WileySons, New-York (1980. Спиртовой компонент сложного эфира, как правило, включает (i) алифатический спирт С 2-С 12, который может содержать или-4 009286 не содержать одну или несколько двойных связей, а также может содержать или не содержать разветвленные группы, или (ii) ароматические или гетероароматические спирты С 7-С 12. Кроме этого в настоящем изобретении рассматривают применение таких структур, которые в одно и то же время являются сложными эфирами, описанными в настоящей заявке, и их фармацевтически приемлемыми кислотноаддитивными солями. Термин фармацевтически приемлемый амид относится к таким амидам, которые при гидролизе амидной связи сохраняют биологическую эффективность и свойства карбоновой кислоты или амина и не являются нежелательными с биологической или какой-либо иной точки зрения. Описание фармацевтически приемлемых амидов в качестве пролекарств см. Bundgaard, H., ed., Design of Prodrugs, Elsevier SciencePublishers, Amsterdam (1985). Эти амиды, как правило, образованы соответствующей карбоновой кислотой и амином. В основном, амиды могут быть получены при помощи стандартных синтетических методик (см., например, March, Advansed Organic Chemistry, 4th Ed., John WileySons, New-York (1992), 393 и Mark, et al., Encyclopedia of Chemical Technology, John WileySons, New-York (1980. Кроме этого в настоящем изобретении рассматривают применение таких структур, которые в одно и то же время являются амидами, описанными в настоящей заявке, и их фармацевтически приемлемыми кислотноаддитивными солями. Термин фармацевтически или терапевтически приемлемый носитель относится к несущей среде,которая не влияет на эффективность и биологическую активность действующего начала, а также не является токсичной по отношению к реципиенту или пациенту. Термин стереоизомер относится к химическому соединению, которое имеет молекулярную массу, химический состав и строение, как у другого соединения, при этом его атомы расположены подругому. Т.е. конкретные идентичные химические фрагменты имеют другую ориентацию в пространстве, и, следовательно, чистый стереоизомер обладает способностью вращать плоскость поляризации света. Однако некоторые чистые стереоизомеры могут иметь настолько незначительное оптическое вращение, что его нельзя обнаружить имеющейся аппаратурой. Соединения по настоящему изобретению могут иметь один или несколько асимметрических атомов углерода и, следовательно, включать различные стереоизомеры. Все стереоизомеры входят в объем настоящего изобретения. Термин терапевтически или фармацевтически эффективное количество в применении к композициям по настоящему изобретению относится к количеству композиции, которое достаточно для того,чтобы вызвать желаемый биологический результат. Этот результат может заключаться в ослаблении признаков, симптомов или причин заболевания или в любом другом желаемом изменении биологической системы. В настоящем изобретении результат, как правило, включает уменьшение иммунологической и/или воспалительной реакции на инфекцию или поражение ткани. Для обозначения аминокислотных остатков в пептидах применены следующие сокращения: фенилаланин обозначен Phe или F; лейцин - Leu или L; изолейцин - Ile или I; метионин - Met или М; валин Val или V; серин - Ser или S; пролин - Pro или Р; треонин - Thr или T; аланин - Ala или А; тирозин - Tyr или Y; гистидин - His или Н; глутамин - Gln или Q; аспарагин - Asn или N; лизин - Lys или K; аспарагиновая кислота - Asp или D; глутаминовая кислота - Glu или Е; цистеин - Cys или С; триптофан - Trp илиW; аргинин - Arg или R; и глицин обозначен Gly или G. Кроме этого трет-BuO означает трет-бутилокси,Bzl означает бензил, СНА означает циклогексиламин, Ас означает ацетил, Me означает метил, Pen означает пеницилламин, Aib означает аминоизомасляную кислоту, Nva означает норвалин, Abu означает аминомасляную кислоту, Thi означает тиенилаланин, OBn означает О-бензил и hyp означает гидроксипролин. В фармацевтической промышленности распространено применение аналогов пептидов в качестве непептидных лекарственных средств со свойствами, которые аналогичны свойствам матричного пептида. Эти типы непептидных соединений называют миметиками пептидов, или имитаторами пептидов,или пептидомиметиками (Luthman, et al., A Textbook of Drug Design and Development, 14: 386-406, 2nd(1994); Fauchere, J., Adv. Drug Res., 15: 29 (1986); Veber and Freidinger TINS, p. 392 (1985); и Evans, et al.,J. Med. Chem. 30: 1229 (1987), которые включены в настоящую заявку посредством ссылки). Миметики пептидов, которые подобны терапевтически полезным пептидам с точки зрения структуры, могут применяться для достижения эквивалентного или лучшего терапевтического или профилактического эффекта. Пептидомиметики, в основном, структурно подобны полипептиду, который служит образцом (т.е. полипептиду, обладающему биологической или фармакологической активностью), как, например, природному полипептиду, связывающемуся с рецептором, но одна или несколько пептидных связей в их структуре необязательно заменены другими связями, такими как -CH2NH-, -CH2S- и т.д., с помощью известных в технике способов, дополнительно описанных в следующих ссылках: Spatola, A.F. в Chemistry-5 009286 2533 (1982); Szelke, et al., European Appln. EP 45665 (1982); Holladay, et al., Tetrahedron Lett., 24: 44014404 (1983); и Hruby, Life Sci., 31: 189-199 (1982), причем каждый из источников включен в настоящую заявку с помощью ссылки. Особенно предпочтительной непептидной связью является -CH2NH-. Подобные миметики пептидов могут иметь значительные преимущества по сравнению с пептидными вариантами осуществления, включающие, например, более экономичное получение, более высокую химическую стабильность, лучшие фармакологические свойства (период полужизни, абсорбцию, эффективность и т.д.), другую специфичность (например, широкий спектр биологических воздействий), меньшую антигенность и т.д. Получение меченых пептидомиметиков, как правило, включает ковалентное присоединение одной или нескольких меток, непосредственно или через спейсер (например, амидную группу),в такое положение (положения) молекулы пептидомиметика, которое не мешает проявлению его активности, причем это положение прогнозируют с помощью количественных данных по структурной активности и/или моделированием молекул. Такими немешающими положениями, в основном, являются положения, которые не образуют непосредственных контактов с макромолекулой (макромолекулами) (например, молекулами надсемейства иммуноглобулина), связывание с которой обеспечивает терапевтический эффект пептидомиметика. Получение производных (например, мечение) пептидомиметиков не должно существенно влиять на желаемую биологическую или фармакологическую активность этих соединений. Как правило, миметики связывающихся с рецептором пептидов, связываются с рецептором с высоким сродством и обладают обнаруживаемой биологической активностью (например, проявляют агонизм или антагонизм по отношению к одному или нескольким фенотипическим изменениям, которые опосредованы рецептором). Для получения более стабильных пептидов может быть использовано систематическое замещение одной или нескольких аминокислот консенсусной последовательности D-аминокислотами того же типа(например, D-лизин вместо L-лизина). Кроме этого, способами, известными в технике, могут быть получены ограниченные пептиды, содержащие консенсусную последовательность или, в основном, идентичный вариант консенсусной последовательности (Rizo, et al., Ann. Rev. Biochem., 61: 387 (1992), причем источник включен в настоящую заявку с помощью ссылки); например, путем включения внутренних остатков цистеина, способных образовывать межмолекулярные дисульфидные мостики, образование которых приводит к циклизации пептида. Термин обнаруживаемая метка относится к веществам, которые при ковалентном прикреплении к пептидным соединениям по настоящему изобретению делают возможным обнаружение пептидных соединений in vivo у пациента, которому эти пептидные соединения были введены. Подходящие обнаруживаемые метки хорошо известны в технике и, в качестве примеров, включают радиоактивные изотопы,флуоресцентные метки (например, флуоресцеин) и т.п. Не столь важно, какую конкретно обнаруживаемую метку используют, и выбор метки осуществляют, исходя из количества метки, которое следует применить, а также из токсичности используемого количества метки. Выбор метки с учетом этих факторов является правильным при наличии квалификации в данной области техники. Ковалентное прикрепление обнаруживаемой метки к пептидным соединениям проводят стандартными способами, хорошо известными в технике. Например, если в качестве обнаруживаемой метки применяют радиоактивный изотоп 125I, ковалентное прикрепление 125I к пептидному соединению может быть достигнуто за счет включения в пептидное соединение аминокислоты тирозина с последующим йодированием пептидного соединения (см., например, Weaner, et al., Synthesis and Application of Isotopically LabelledCompounds, стр. 137-140 (1994. Включение тирозина в N- или С-концевую область пептидного соединения может быть достигнуто хорошо известными химическими реакциями. Аналогично, изотоп 32 Р может быть включен в пептидное соединение в виде фосфатного фрагмента с применением общеизвестных химических реакций, например, через гидроксильную группу пептидного соединения.II. Общий обзор. В настоящем изобретении разработаны пептидные соединения, которые связываются с TPO-R и активируют этот рецептор или каким-либо иным образом проявляют себя как агонисты TPO. Эти пептидные соединения включают в себя исходные пептидные соединения и производные пептидные соединения, причем последние сконструированы таким образом, чтобы иметь ту же самую или сходную молекулярную структуру или конфигурацию, как и исходные пептидные соединения, при этом отличаясь от них либо в отношении чувствительности к гидролизу и протеолизу, и/или в отношении других биологических свойств, таких как увеличение сродства к рецептору. Кроме этого, в настоящем изобретении разработаны композиции, содержащие эффективное количество пептидного соединения, и более конкретно пептидного соединения, которое применимо для лечения гематологических расстройств, и в частности тромбоцитопении, связанной с химиотерапией, радиационной терапией или пересадками костного мозга. Найдено, что основное пептидное соединение может содержать последовательность аминокислот(SEQ ID NO: 2) Х 9 Х 8 G X1 X2 Х 3 Х 4 Х 5 Х 6 Х 7, где Х 6 может представлять собой остаток -(2 нафтил)аланина и где Х 9 представляет собой А, С, Е, G, I, L, М, Р, R, Q, S, Т или V; и X8 представляет собой А, С, D, Е, K, L, Q, R, S, Т или V; Х 8 представляет собой А, С, D, Е, K, L, Q, R, S, Т или V. Более предпочтительно Х 9 представляет собой А или I; и Х 8 представляет собой D, Е или K. Далее, X1 пред-6 009286 ставляет собой С, L, M, P, Q, V; Х 2 представляет собой F, K, L, N, Q, R, S, Т или V; Х 3 представляет собой С, F, I, L, M, R, S, V или W; Х 4 представляет собой любую из 20 генетически кодируемых L-аминокислот; Х 5 представляет собой A, D, E, G, K, М, Q, R, S, Т, V или Y; и Х 7 представляет собой С, G, I, K, L,M, N, R или V. Однако, как указано далее в настоящей заявке, было обнаружено, что при замене Х 6 -(2-нафтил) аланином образуется соединение, свойства которого отличаются от соединения, содержащего -(1 нафтил)аланин. Соответственно, особенно предпочтительный пептид включает последовательность аминокислот (SEQ ID NO: 7): IEGPTLRQ (2-Nal) LAA R (Sar). В другом варианте осуществления пептидные соединения по настоящему изобретению предпочтительно димеризованы или олигомеризованы для увеличения сродства и/или активности соединений. Пример предпочтительного димерного пептидного соединения включает, не ограничиваясь этим, следующее соединение: где Х 10 представляет собой остаток саркозина или -аланина (SEQ ID NO: 7). Следует отметить, что один из остатков Х 10 может являться саркозином и другой остаток может являться -аланином. Приведенная выше структура также может быть представлена следующей формулой: (Н-IEGPTLRQ(2-Nal)LAARX10)2K-NH2. Предпочтительное пептидное соединение представлено следующей формулой: где (2-Nal) является -(2-нафтил)аланином и (Sar) является саркозином (SEQ ID NO: 7). Это пептидное соединение в тексте настоящей заявки называется TPO соединение 1. Пептидные соединения, имеющие IC50 более приблизительно 100 мМ, не обладает достаточно эффективным связыванием для применения как в диагностическом, так и в терапевтическом аспекте настоящего изобретения. Предпочтительно для диагностических целей пептидные соединения имеют IC50 приблизительно 2 мМ или менее, и для фармацевтических целей пептидные соединения имеют IC50 приблизительно 100 мкМ или менее. На фиг. 1 показано сравнение активности трех различных образцов ТРО соединения 1 с одним образцом пептидного соединения из известного уровня техники с применением стандартной методики анализа относительных единиц люминесценции. В анализе используют мышиные клетки, разработанные для стабильного экспрессирования человеческого рецептора TPO, и конструкт репортера люциферазы,стимулируемый промотором fos. Различие между TPO соединением 1 и пептидным соединением из известного уровня техники заключается в том, что пептидное соединение из известного уровня техники содержит -(1-нафтил)аланин (1-Nal) в том месте молекулы, где в TPO соединении 1 имеется (2-Nal). На фиг. 1 TPO соединение 1 носит название 2-Nal и пептидное соединение из известного уровня техники называется 1-Nal (известный уровень техники). Как видно из фиг. 1, каждое из соединений обладает сходной активностью. На фиг. 2 показано сравнение активности нескольких различных образцов ПЭГилированного TPO соединения 1 (ПЭГилирование соединений по настоящему изобретению более подробно описано ниже) с несколькими образцами ПЭГилированных пептидных соединений из известного уровня техники. Оба образца ПЭГилированных пептидных соединений из известного уровня техники демонстрируют высокую активность примерно того же уровня, как и неПЭГилированные пептидные соединения из известного уровня техники. Остальные кривые показывают активность различных образцов ПЭГилированного TPO соединения 1. Как показано на фиг. 2, последние имеют меньшую активность по сравнению с ПЭГилированными пептидными соединениями из известного уровня техники. На фиг. 2 ПЭГилированное TPO соединение 1 носит название ПЭГ-2-Nal и ПЭГилированное пептидное соединение из известного уровня техники называется ПЭГ-1-Nal (известный уровень техники). На фиг. 3 показана относительная эффективность ПЭГилированного пептидного соединения из известного уровня техники и ПЭГилированного TPO соединения 1. На примере крысиной модели фиг. 3 демонстрирует in vivo изменение количества тромбоцитов после введения ПЭГилированного пептидного соединения из известного уровня техники и ПЭГилированного TPO соединения 1. Как видно из фиг. 3,наивысшая доза ПЭГилированного TPO соединения 1 обладает такой же активностью, как наиболее низкая доза ПЭГилированного пептидного соединения из известного уровня техники. Соединение с меньшей эффективностью может явиться менее энергичным раздражителем целевой клетки, что могло бы снизить риск побочных эффектов, вызванных избыточной стимуляцией целевой клетки, таких как-7 009286 обострение тромбоцитопении, следующее за повторным циклом химиотерапии. На фиг. 3 ПЭГилированное TPO соединение 1 носит название ПЭГ-2-Nal и ПЭГилированное пептидное соединение из известного уровня техники называется ПЭГ-1-Nal (известный уровень техники). На фиг. 4 и 5 показаны результаты параллельных исследований отклика у нормальной мыши на вводимую дозу ПЭГилированного пептидного соединения из известного уровня техники и ПЭГилированного TPO соединения 1. На фиг. 4 и 5 ПЭГилированное TPO соединение 1 носит название ПЭГ 2-Nal и ПЭГилированное пептидное соединение из известного уровня техники называется ПЭГ-1-Nal(известный уровень техники). На фиг. 4 показано увеличение уровней тромбоцитов, и на фиг. 5 - средний объем тромбоцитов спустя шесть (6) дней после эксперимента. Величина дозы находится в пределах 103000 мкг/кг. Оба пептидных соединения увеличивают количество циркулирующих тромбоцитов, причем рост зависит от дозы, и прирост относительно контрольной группы наблюдается для обоих соединений даже при такой низкой концентрации, как 30 мкг/кг. При максимальном отклике эти пептидные соединения увеличивают количество тромбоцитов до уровня, который превосходит контрольное значение более чем в 4 раза. Кривые доза-отклик для обоих пептидных соединений являются очень близкими, и это показывает, что для этой модели, по существу, нет разницы между двумя испытанными соединениями с точки зрения данного конечного результата.IV. Получение пептидных соединений. А. Твердофазный синтез. Пептидные соединения по настоящему изобретению могут быть получены классическими способами, известными из уровня техники, например, при использовании стандартных твердофазных методик. Стандартные способы включают исключительно твердофазный синтез, методики частично твердофазного синтеза, конденсацию фрагментов, классический синтез в растворе и даже технологию рекомбинантной ДНК. См., например, Merrifield, J. Am. Chem. Soc., 85: 2149 (1963), включенную в настоящую заявку с помощью ссылки. Синтез на твердой фазе начинают, как правило, с С-конца пептида, используя альфааминозащищенную смолу. Подходящие исходные вещества могут быть получены, например, присоединением требуемой альфа-аминокислоты к хлорметилированной смоле, гидроксиметилированной смоле или бензгидриламиновой смоле. Одна из таких хлорметилированных смол выпускается твердой под торговым наименованием BIO-BEADS SX-1 Bio. Rad. Laboratories, Richmond, CA, и получение гидроксиметилированной смолы описано Bodonszky, et al., Chem. Ind. (London), 38: 1597 (1966). Бензгидриламиновая смола (ВНА) была описана Pietta и Marshall, Chem. Commun., 650 (1970), и она коммерчески доступна в гидрохлоридной форме у Beckman Instruments, Inc., Palo Alto, Calif. Таким образом, пептидные соединения по настоящему изобретению могут быть получены присоединением альфа-аминозащищенных аминокислот к хлорметилированной смоле при содействии катализатора, например бикарбоната цезия, в соответствии с методикой, описанной Gisin, Helv. Chim. Acta., 56: 1467 (1973). После первичного присоединения альфа-аминозащитную группу удаляют одним из ряда реагентов, включая растворы трифторуксусной кислоты (ТФА) или хлористо-водородной кислоты (HCl) в органических растворителях при комнатной температуре. Альфа-аминозащитными группами являются группы, которые, как известно, применяются в технике последовательного синтеза пептидов. К ним относятся защитные группы ацильного типа (например,формил, трифторацетил, ацетил), защитные группы типа ароматических уретанов (например, бензилоксикарбонил (Cbz) и замещенный Cbz), алифатические уретановые защитные группы (например, т-бутилоксикарбонил (Boc), изопропилоксикарбонил, циклогексилоксикарбонил) и защитные группы алкильного типа (например, бензил, трифенилметил). Boc и Fmoc являются предпочтительными защитными группами. Защитные группы боковых цепей не затрагиваются в процессе связывания пептидов, кроме этого,они не отщепляются в ходе удаления аминоконцевых защитных групп и при связывании. При завершении синтеза конечного пептида должна иметься возможность удаления защитных групп боковых цепей,причем условия реакции не должны приводить к изменению целевого пептида. Защитные группы боковых цепей для Tyr включают тетрагидропиранил, трет-бутил, тритил, бензил, Cbz, Z-Br-Cbz и 2,5-дихлорбензил. Защитные группы боковых цепей для Asp включают бензил, 2,6 дихлорбензил, метил, этил и циклогексил. Защитные группы боковых цепей для Thr и Ser включают ацетил, бензоил, тритил, тетрагидропиранил, бензил, 2,6-дихлорбензил и Cbz. Защитной группой боковых цепей для Thr и Ser является бензил. Защитные группы боковых цепей для Arg включают нитро, тозил(Tos), Cbz, адамантилоксикарбонил, мезитоилсульфонил (Mts) или Boc. Защитные группы боковых цепей для Lys включают Cbz, 2-хлорбензилоксикарбонил (2-Cl-Cbz), 2-бромбензилоксикарбонил (2-BrCbz), Tos или Boc. После удаления альфа-аминозащитной группы остающиеся защищенные аминокислоты последовательно связывают в желаемом порядке. В основном, используют избыток каждой из защищенных аминокислот с применением подходящего активатора карбоксильной группы, такого как дициклогексилкарбодиимид (DCC) в виде раствора, например, в смесях метиленхлорида (CH2Cl2) и диметилформамида(ДМФА). После того, как создание желаемой последовательности аминокислот завершено, желаемый пептид отделяют от полимерного носителя обработкой такими реагентами, как трифторуксусная кислота или-8 009286 фтористый водород (HF), которые не только отщепляют пептид от смолы, но кроме этого отщепляют и защитные группы боковых цепей. При использовании хлорметилированной смолы обработка фтористым водородом приводит к получению свободных пептидов в виде кислот. При использовании бензгидриламиновой смолы обработка фтористым водородом приводит непосредственно к свободным пептидам в виде амидов. С другой стороны, при использовании хлорметилированной смолы пептиды с защитой боковых цепей могут быть отделены обработкой смолы с пептидом аммиаком, что приводит к желаемому амиду с защищенными боковыми цепями, или алкиламином, что позволяет получить алкиламид или диалкиламид с защищенными боковыми цепями. Затем защиту боковых цепей удаляют обычным образом,обработкой фтористым водородом, получая свободные амиды, алкиламиды или диалкиламиды. Эти методики твердофазного синтеза пептидов хорошо известны в технике и дополнительно описаныJohn Morrow Stewart и Janis Dillaha Young, Solid Phase Peptide Syntheses (2nd Ed., Pierce Chemical Company,1984). В. Синтетические аминокислоты. Описанные методики также могут применяться для синтеза пептидов, в которых аминокислоты, отличающиеся от 20 природных генетически кодируемых аминокислот, замещают одно, два или несколько положений любого из соединений по настоящему изобретению. Можно заменить природные боковые цепи 20 генетически кодируемых аминокислот (или D-аминокислот) другими боковыми цепями, например такими группами, как алкил, низший алкил, циклический 4-, 5-, 6- и 7-членный алкил, амид, низший алкиламид, ди(низший алкил)амид, низший алкокси, гидрокси, карбокси и низшие сложноэфирные производные перечисленных групп, а также 4-, 5-, 6- и 7-членными гетероциклическими заместителями. В частности, могут использоваться аналоги пролина, в которых размер цикла пролинового остатка изменен от 5-членного до 4-, 6- или 7-членного. Циклические группы могут быть насыщенными или ненасыщенными и, будучи ненасыщенными, могут быть ароматическими или неароматическими. Гетероциклические группы предпочтительно содержат один или несколько гетероатомов азота, кислорода и/или серы. Примеры таких групп включают фуразанил, фурил, имидазолидинил, имидазолил,имидазолинил, изотиазолил, изоксазолил, морфолинил (например, морфолино), оксазолил, пиперазинил(например, 1-пиперазинил), пиперидил (например, 1-пиперидил, пиперидино), пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридил, пиримидинил, пирролидинил (например,1-пирролидинил), пирролинил, пирролил, тиадиазолил, тиазолил, тиенил, тиоморфолинил (например,тиоморфолино) и триазолил. Эти гетероциклические группы могут быть замещенными или незамещенными. Если группа является замещенной, заместителем может быть алкил, алкокси, галоген, кислород или замещенный или незамещенный фенил. Кроме этого пептиды по настоящему изобретению можно легко модифицировать фосфорилированием (см., например, W. Bannwarth, et al., Biorganic and Medical Chemistry Letters, 6 (17): 2141-2146(1996, причем другие способы, предназначенные для получения производных пептидных соединений по настоящему изобретению, описаны в Hruby, et al., Biochem. J., 268 (2): 249-262 (1990). Таким образом,пептидные соединения по настоящему изобретению служат также основой для получения миметиков пептидов со сходной биологической активностью. С. Концевые модификации. Специалист в данной области техники понимает, что существует большое количество методик,применимых для конструирования пептидных соединений с той же самой или сходной биологической активностью, как и у данного пептидного соединения, но имеющих по сравнению с этим пептидным соединением предпочтительные свойства в отношении растворимости, стабильности, а также чувствительности к гидролизу и протеолизу. См., например, Morgan, et al., Ann. Rep. Med. Chem., 24: 243-252 (1989). Далее описаны способы получения пептидных соединений, модифицированных по N-концевой аминогруппе, С-концевой карбоксильной группе и/или с заменой одной или нескольких амидосвязей в пептиде на неамидосвязи. Очевидно, что в структуре одного пептидного соединения могут сочетаться две или несколько подобных модификаций (например, модификация С-концевой карбоксильной группы и включение карбаматной связи -СН 2- между двумя аминокислотами в пептидном соединении). 1. N-Концевые модификации. Как правило, пептидные соединения синтезируют в виде свободных кислот, но, как отмечено выше,они могут быть легко получены в виде амидов или сложных эфиров. Кроме этого, можно модифицировать амино- и/или карбоксиконцевые фрагменты пептидных соединений по настоящему изобретению для получения других соединений по настоящему изобретению. Модификации аминоконцевой области включают метилирование, ацетилирование, присоединение бензилоксикарбонильной группы или блокирование концевой аминогруппы любой блокирующей группой, содержащей карбоксилатный функциональный фрагмент, который имеет формулу RCOO-, где R выбран из группы, состоящей из нафтила, акридинила, стероидила и подобных групп. Модификации карбоксиконцевого фрагмента включают замену свободной кислоты карбоксамидной группой или образование на карбоксиконце циклического лактама для введения структурных ограничений. Модификации аминоконцевой области соответствуют перечисленному выше и включают алкилирование, ацетилирование, присоединение карбобензоильной группы, образование сукцинимидной груп-9 009286 пы и т.д. (См., например, Murray, et al., Burger's Medicinical Chemistry and Drug Discovery, 5th ed., Vol. 1,Manfred E. Wolf, edd., John Wiley and Sons, Inc. (1995. Конкретно, N-концевую аминогруппу можно затем ввести в реакцию следующим образом:(а) реакцией с галогенангидридом кислоты или симметричным ангидридом получить амидную группу формулы RC(O)NH-, где R определен выше. Как правило, реакцию можно провести воздействием приблизительно эквимолярного или избыточного количества (например, приблизительно 5 экв.) галогенангидрида кислоты на пептид в инертном разбавителе (например, дихлорметане), предпочтительно содержащем избыток (например, около 10 экв.) третичного амина, такого как диизопропилэтиламин, для удаления кислоты, выделяющейся в ходе реакции. Во всем остальном условия реакции являются стандартными (например, при комнатной температуре в течение 30 мин). Алкилирование концевой аминогруппы для осуществления N-замещения низшим алкилом с последующей реакцией с галогенангидридом кислоты, как описано выше, приведет к получению N-алкиламидогруппы формулы RC(O)NR-;(b) реакцией с ангидридом янтарной кислоты получить сукцинимидную группу. Как и в предыдущем случае, может быть использовано практически эквимолярное количество или избыток ангидрида янтарной кислоты (например, приблизительно 5 экв.), и аминогруппу превращают в сукцинимид с помощью методик, хорошо известных в технике, включая применение избытка (например, 10 экв.) третичного амина, такого как диизопропилэтиламин в подходящем инертном разбавителе (например, дихлорметане). См., например, Wollenberg, et al., патент США 4612132, который полностью включен в настоящую заявку с помощью ссылки. Следует понимать, что фрагмент янтарной кислоты может быть замещен, например, алкилом или заместителем -SR, причем эти группы вводят стандартным способом для получения замещенного сукцинимида у N-конца пептида. Подобные алкильные заместители вводят реакцией низшего олефина с малеиновым ангидридом способом, описанным Wollenberg и соавторами(c) получить бензилоксикарбонил-NH- или замещенную (бензилоксикарбонил-NH-)группу реакцией с приблизительно эквивалентным количеством или избытком CBZ-Cl (т.е. бензилоксикарбонилхлорида) или замещенным CBZ-Cl в подходящем инертном разбавителе (например, дихлорметане), предпочтительно содержащем третичный амин для поглощения кислоты, выделяющейся в ходе реакции;(d) получить сульфонамидную группу реакцией с эквивалентным количеством или избытком (например, 5 экв.) R-S(O)2Cl в подходящем инертном разбавителе (дихлорметане) для превращения концевой аминогруппы в сульфонамид, причем заместитель R определен выше. Инертный разбавитель предпочтительно содержит избыток (например, 10 экв.) третичного амина, такого как диизопропилэтиламин,для поглощения выделяющейся в ходе реакции кислоты. Остальные условия реакции являются стандартными (например, 30 мин при комнатной температуре);(e) получить карбаматную группу реакцией с эквивалентным количеством или избытком (например, 5 экв.) R-OC(O)Cl или R-OC(О)OC6H4-n-NO2 в подходящем инертном разбавителе (например, дихлорметане), чтобы превратить концевую аминогруппу в карбамат, где заместитель R определен выше. Инертный разбавитель предпочтительно содержит избыток (например, около 10 экв.) третичного амина,такого как диизопропилэтиламин, для поглощения выделяющейся в ходе реакции кислоты. В остальном условия реакции являются стандартными (например, 30 мин при комнатной температуре); и(f) получить карбамидную группу реакцией с эквивалентным количеством или избытком (например, 5 экв.) R-N=C=O в подходящем инертном разбавителе (например, дихлорметан) для превращения концевой аминогруппы в карбамидную (т.е. RNHC(О)NH-) группу, где заместитель R определен выше. Предпочтительно инертный разбавитель содержит избыток (например, около 10 экв.) третичного амина,такого как диизопропилэтиламин. В остальном условия реакции являются стандартными (например, 30 мин при комнатной температуре). 2. С-Концевые модификации. При получении пептидных соединений, в которых С-концевой карбоксил заменен сложноэфирной группой (т.е. -С(О)OR, где заместитель R определен выше), применяют смолы, используемые для получения пептидов в виде кислот, и пептиды с защитой боковой цепи отщепляют основанием и подходящим спиртом, например метанолом. Затем для получения желаемого эфира защитные группы боковых цепей удаляют обычным образом, т.е. обработкой фтористым водородом. При получении пептидных соединений, в которых С-концевой карбоксил заменен амидной группой-C(O)NR3R4, в качестве твердой основы для синтеза пептида используют бензгидриламиновую смолу. После завершения синтеза обработка фтористым водородом отделяет пептид от основы, что непосредственно приводит к получению свободного пептида в виде амида (т.е. С-концевая группа представляет собой -C(O)NH2). С другой стороны, применение в ходе синтеза пептида хлорметилированной смолы сопровождается реакцией с аммиаком для отщепления от основы пептида с защищенными боковыми цепями, что дает свободный пептид в виде амида, а также реакцией с алкиламином или диалкиламином,что дает алкиламид или диалкиламид с защищенными боковыми цепями (т.е. С-концевая группа представляет собой -C(O)NRR1, где R и R1 определены выше). Затем для получения свободных амидов, алкиламидов или диалкиламидов защиту боковых цепей удаляют обычным образом, т.е. обработкой фтори- 10009286 стым водородом. Кроме этого имеется возможность циклизовать пептидные соединения по настоящему изобретению или присоединить по концам пептидного соединения остатки, не являющиеся амино- или карбоксильными группами, с тем, чтобы соединение не имело концевых амино- или карбоксильных групп, для уменьшения чувствительности к протеазам или для ограничения возможных конформаций пептидного соединения. С-Концевые функциональные группы пептидных соединений по настоящему изобретению включают амиды, низшие алкиламиды, ди(низший алкил)амиды, низшие алкокси, гидрокси и карбокси, а также их низшие эфирные производные и их фармацевтически приемлемые соли. В дополнение к описанным выше N-концевым и С-концевым модификациям пептидные соединения по настоящему изобретению, включая пептидомиметики, могут быть успешно модифицированы или ковалентно связаны с одним или несколькими соединениями из широкого спектра гидрофильных полимеров. Было найдено, что при получении производных пептидных соединений с гидрофильным полимером возрастают их растворимость и время полужизни в кровотоке и маскируется их иммуногенность. Все это может происходить с небольшим, если вообще присутствующим, уменьшением активности связывания. Небелковые полимеры, подходящие для применения по настоящему изобретению, включают, не ограничиваясь перечисленным, полиалкилэфиры, примерами которых служат полиэтиленгликоль и полипропиленгликоль, полимолочную кислоту, полигликолевую кислоту, полиоксиалкены, поливиниловый спирт,поливинилпирролидон, целлюлозу и производные целлюлозы, декстран и производные декстрана и т.д. В основном, такие гидрофильные полимеры имеют среднюю молекулярную массу в диапазоне от приблизительно 500 до приблизительно 100000 Да, более предпочтительно от приблизительно 2000 до приблизительно 40000 Да и еще более предпочтительно от 5000 до 20000 Да. В предпочтительных вариантах осуществления такие гидрофильные полимеры имеют среднюю молекулярную массу около 5000, 10000 и 20000 Да. Производные пептидных соединений по настоящему изобретению или продукты их сочетания с такими полимерами могут быть получены при использовании любого из способов, изложенных в Zallipsky,S., Bioconjugate Chem., 6: 150-165 (1995); Monfardini, C., et al., Bioconjugate Chem., 6: 62-69 (1995); патенте США 4640835; патенте США 4496689; патенте США 4301144; патенте США 4670417; патенте США 4791192; патенте США 4179337 или WO 95/34326, причем все указанные источники включены в настоящую заявку во всей их полноте при помощи ссылки. В предпочтительном на данный момент варианте осуществления получают производное пептидного соединения по настоящему изобретению с полиэтиленгликолем (ПЭГ). ПЭГ представляет собой линейный водорастворимый полимер, состоящий из повторяющихся единиц оксида этилена с двумя концевыми гидроксильными группами. ПЭГи классифицируют по их молекулярной массе, которая, как правило, находится в диапазоне от приблизительно 500 до приблизительно 40000 Да. В предпочтительном на данный момент варианте осуществления изобретения применяют ПЭГ, который обладает молекулярной массой, находящейся в диапазоне от 5000 до приблизительно 20000 Да. ПЭГ, присоединенный к пептидным соединениям по настоящему изобретению, может быть либо разветвленным, либо неразветвленным(см., например, Monfardini, С., et al., Bioconjugate Chem., 6: 62-69 (1995. ПЭГи коммерчески доступны уShearwater Polymers, Inc. (Huntsville, Ala.) (в настоящее время подразделение Nektar Therapeutics (San(MePEG-S), монометоксиполиэтиленгликольсукцинимидилсукцинат (MePEG-S-NHS), монометоксиполиэтиленгликольамин (MePEG-NH2), монометоксиполиэтиленгликольтрезилат (MePEG-TRES) и монометоксиполиэтиленгликольимидазолилкарбонил (MePEG-IM). Вкратце, в одном из вариантов осуществления используемый гидрофильный полимер, например ПЭГ, защищают с одного конца нереакционноспособной группой, такой как метокси- или этоксигруппа. После этого с другого конца полимер активируют реакцией с подходящим активирующим реагентом,таким как галогенангидриды циануровой кислоты (например, хлорангидрид, бромангидрид или фторангидрид циануровой кислоты), диимидазол, ангидридные реагенты (например, дигалогенангидриды янтарной кислоты, такие как дибромангидрид янтарной кислоты), ацилазид, п-диазонийбензиловый эфир,3-(п-диазонийфенокси)-2-гидроксипропиловый эфир и т.п. Затем активированный полимер вводят в реакцию с пептидным соединением по настоящему изобретению для получения производного пептидного соединения и полимера. С другой стороны, для реакции с полимером может быть активирована функциональная группа в пептидных соединениях по настоящему изобретению, или эти две группы могут быть объединены в согласованной реакции сочетания при использовании известных способов сочетания. Легко принять во внимание, что производные пептидных соединений по настоящему изобретению и ПЭГ могут быть получены с применением большого числа других реакций, которые известны специалистам в данной области техники и используются ими. При получении производных пептидных соединений с гидрофильными полимерами их растворимость и время полужизни в кровотоке увеличиваются, а их иммуногенность уменьшается. Эти изменения могут осуществляться при небольшой, если вообще имеющейся, потере биологической активности. В предпочтительных вариантах осуществления производные пептидов обладают активностью, которая со- 11009286 ставляет от 0,1 до 0,01-кратной активности немодифицированных пептидов. В более предпочтительных вариантах осуществления производные пептидов обладают активностью от 0,1 до 1-кратной активности немодифицированных пептидов. В еще более предпочтительных вариантах осуществления производные пептидов обладают активностью, которая превышает активность немодифицированных пептидов.D. Модификации остова. Другие способы получения производных пептидных соединений по настоящему изобретению описаны в Hruby, et al., Biochem. J., 268 (2): 249-262 (1990), причем этот источник включен в настоящую заявку с помощью ссылки. Таким образом, пептидные соединения по настоящему изобретению также служат структурными моделями для непептидных соединений со сходной биологической активностью. Специалисты в данной области техники осознают, что существует большое количество методик, которые пригодны для конструирования соединений, обладающих той же самой или сходной желаемой биологической активностью, как и исходное пептидное соединение, но имеющих по сравнению с ним более предпочтительные свойства с точки зрения растворимости, стабильности и чувствительности к гидролизу и протеолизу. См. Morgan, et al., Ann. Rep. Med. Chem., 24: 243-252 (1989), включенную в настоящую заявку с помощью ссылки. Эти методики включают замену пептидного остова остовом, образованным фосфонатами, амидатами, карбаматами, сульфонамидами, вторичными аминами и N-метиламинокислотами. Подходящие реагенты включают, например, аналоги аминокислот, в которых карбоксильная группа аминокислоты заменена фрагментом, который подходит для образования одной из упомянутых выше связей. Аналогично, замена амидной связи в пептиде фосфонатной связью может быть достигнута способом, изложенным в патентах США 5359115 и 5420328, причем сведения, раскрытые в указанных патентах, включены в настоящую заявку во всей их полноте при помощи ссылки. Е. Образование дисульфидной связи. Соединения по настоящему изобретению могут существовать в циклической форме с внутримолекулярной дисульфидной связью между тиольными группами входящих в их состав цистеиновых остатков, если они присутствуют в соединениях. С другой стороны, образование внутримолекулярных дисульфидных связей между тиольными группами цистеинов может быть использовано для получения димерных соединений (или олигомеров с более высокой степенью полимеризации). Один или несколько цистеиновых остатков также могут быть замещены гомоцистеином.V. Применимость. Пептидные соединения по настоящему изобретению могут быть использованы in vitro как уникальные средства для понимания биологической роли TPO, включая оценку многих факторов, которые, как считается, влияют или подвергаются влиянию выработки TPO и процесса связывания с рецептором. Кроме этого пептидные соединения по настоящему изобретению могут быть использованы для разработки других соединений, которые связываются с TPO-R и активируют его, поскольку пептидные соединения по настоящему изобретению предоставляют важную информацию о связи между структурой и активностью, которая должна облегчить подобные разработки. Пептидные соединения также применимы в качестве конкурентно связывающихся веществ в анализах, предназначенных для отбора новых агонистов рецептора TPO. В таких аналитических вариантах осуществления могут применяться пептидные соединения по настоящему изобретению без модификаций, или же они могут быть модифицированы различными способами; например мечением, таким как ковалентное или нековалентное присоединение фрагмента, который прямо или косвенно обеспечивает обнаруживаемый сигнал. В случае любого из таких анализов материалы для него должны быть помечены либо прямо, либо косвенно. Возможности прямого мечения включают группы, являющиеся метками,такими как радиоактивные метки, как, например, 125I, ферментами (патент США 3645090), как, например, пероксидазой и щелочной фосфатазой, и флуоресцентными метками (патент США 3940475),дающими возможность наблюдения за изменением интенсивности флуоресценции, сдвига длины волны или поляризации флуоресценции. Варианты косвенного мечения включают биотинилирование одного из компонентов с последующим связыванием с авидином, присоединенным к одной из указанных выше метящих групп. Пептидные соединения также могут включать спейсеры или линкеры в случаях, когда пептидные соединения должны быть присоединены к твердой основе. Кроме того, на основании способности пептидных соединений по настоящему изобретению связываться с рецептором TPO они могут применяться в качестве реагентов для обнаружения рецепторов TPO в живых клетках, фиксированных клетках, в биологических жидкостях, в гомогенатах тканей, в очищенных природных биологических материалах и т.д. Например, мечением таких пептидных соединений можно идентифицировать клетки, несущие TPO-R на своей поверхности. Помимо этого на основании способности пептидных соединений по настоящему изобретению связываться с рецептором TPO они могут использоваться при окрашивании in situ, FASC (сортировке клеток на основе флуоресцентного сигнала), вестерн-блоттинге, ELISA и т.д. В дополнение к перечисленному, на основании способности пептидных соединений по настоящему изобретению связываться с рецептором TPO они могут использоваться при очистке рецептора или при очистке клеток, экспрессирующих рецепторы TPO на своей поверхности (или в объеме клеток с нарушенной поверхностью мембраны).- 12009286 Пептидные соединения по настоящему изобретению также могут использоваться в качестве коммерческих реагентов для различных медицинских исследовательских и диагностических целей. Такое применение включает, не ограничиваясь перечисленным: (1) применение в качестве калибровочного стандарта для количественного определения активностей кандидатов на роль агонистов TPO в различных функциональных анализах; (2) применение для поддержания пролиферации и роста TPO-зависимых линий клеток; (3) применение в структурном анализе рецептора TPO путем сокристаллизации; (4) применение для исследования механизма передачи сигнала/активации рецептора TPO; и (5) применение в других исследовательских и диагностических приложениях, в которых рецептор TPO предпочтительно активирован и эта активация удобным образом калибрована по отношению к известному количеству агониста TPO и т.п. Пептидные соединения по настоящему изобретению могут использоваться для in vitro увеличения количества мегакариоцитов и их коммитированных клеток-предшественников, как в сочетании с дополнительными цитокинами, так и сами по себе. См., например, DiGiusto, et al., публикация РСТ 95/05843,которая включена в настоящую заявку с помощью ссылки. Химиотерапия и радиационная терапия вызывают тромбоцитопению за счет уничтожения быстроделящейся более зрелой популяции мегакариоцитов. Однако такие способы терапии могут также снизить количество и жизнеспособность незрелых, менее митотически активных клеток-предшественников мегакариоцитов. Таким образом, улучшение состояния при тромбоцитопении под действием TPO или пептидных соединений по настоящему изобретению может быть ускорено инфузией пациентам после химиотерапии или радиационной терапии популяции их собственных клеток, обогащенных мегакариоцитами и незрелыми клетками-предшественниками, культивированными in vitro. Кроме этого, пептидные соединения по настоящему изобретению могут вводиться теплокровным животным, включая человека, для активации TPO-R in vivo. Таким образом, настоящее изобретение охватывает способы терапевтического лечения связанных с TPO расстройств, которые включают введение пептидного соединения по настоящему изобретению в количестве, достаточном для имитации действияTPO или TPO-R in vivo. Например, пептидные соединения по настоящему изобретению могут вводиться для лечения широкого круга гематологических расстройств, включая, но не ограничиваясь этим, расстройства, связанные с тромбоцитами, и тромбоцитопению, в частности, когда она связана в пересадкой костного мозга, радиационной терапией и химиотерапией. В некоторых вариантах осуществления настоящего изобретения пациентам, подвергающимся химиотерапии или радиационной терапии, предпочтительно, в первую очередь, вводятся антагонисты TPO и затем осуществляется введение агонистов TPO по настоящему изобретению. Активность пептидных соединений по настоящему изобретению может быть оценена либо in vitro,либо in vivo в рамках одной из многочисленных моделей, описанных в McDonald, Am. J. of PediatricHematology/Oncology, 14: 8-21 (1992), причем эта работа включена в настоящую заявку с помощью ссылки. В соответствии с одним из вариантов осуществления композиции по настоящему изобретению могут быть использованы для лечения тромбоцитопении, связанной с пересадкой костного мозга, радиационной терапией или химиотерапией. Пептидные соединения, как правило, вводят профилактически, до проведения химиотерапии, радиационной терапии или трансплантации костного мозга, или после подобного воздействия. Соответственно, настоящее изобретение также относится к фармацевтическим композициям, содержащим в качестве действующего начала по крайней мере одно из пептидных соединений по настоящему изобретению в сочетании с фармацевтическим носителем или разбавителем. Пептидные соединения по изобретению могут вводиться такими путями, как пероральный, легочный, парентеральный(внутримышечные, интраперитонеальные, внутривенные (IV) или подкожные инъекции), ингаляции (с помощью рецептур в виде тонкодисперсных порошков), трансдермальный, назальный, вагинальный,ректальный или сублингвальный, и они могут быть включены в состав лекарственных форм, подходящих для каждого из путей введения. См., например, Bernstein, et al., патентная публикация РСТWO 93/25221; Pitt, et al., патентная публикация РСТWO 94/17784; и Pitt, et al., европейская заявка на патент 613683, причем каждая из этих заявок включена в настоящую заявку с помощью ссылки. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли,порошки и гранулы. В таких твердых лекарственных формах действующее пептидное соединение смешано по крайней мере с одним инертным фармацевтически приемлемым носителем, таким как сахароза,лактоза или крахмал. Такие лекарственные формы в качестве обычной практики также могут содержать дополнительные вещества, отличающиеся от инертных разбавителей, например смазывающие средства,такие как стеарат магния. В случае капсул, таблеток и пилюль лекарственные формы могут также содержать буферирующие средства. Таблетки и пилюли дополнительно могут быть получены с растворимыми в кишечнике покрытиями. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы с эликсирами, содержащими обычно используемые в технике инертные разбавители, как, например, воду. Помимо этого инертного разбавителя в состав композиций также могут входить вспомогательные вещества, такие как смачивающие агенты, эмульсифицирующие и- 13009286 суспендирующие агенты, а также подсластители, вкусовые добавки и отдушки. Препараты для парентерального введения по настоящему изобретению включают стерильные водные или неводные растворы, суспензии или эмульсии. Примерами неводных растворителей или носителей служат пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло или кукурузное масло, желатин и пригодные для инъекции органические сложные эфиры, как, например,этилолеат. Такие лекарственные формы могут также содержать вспомогательные вещества, такие как консервирующие, смачивающие, эмульгирующие и диспергирующие агенты. Они могут быть стерилизованы, например, фильтрованием через фильтры, задерживающие бактерии, введением в композиции стерилизующих агентов, облучением композиций или их нагреванием. Кроме этого композиции могут производиться непосредственно перед использованием, с применением стерильной воды или некоторых других стерильных сред, предназначенных для инъекций. Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые помимо действующего вещества могут содержать наполнители, такие как масло какао или воск для суппозиториев. Композиции для назального или сублингвального введения также получают с применением стандартных наполнителей, хорошо известных в технике. Композиции, содержащие пептидные соединения, могут вводиться в целях профилактического и/или терапевтического лечения. При терапевтическом применении композиции вводят пациентам, уже страдающим указанными выше заболеваниями, в количестве, достаточном для излечения или, по крайней мере, частичного купирования симптомов заболевания и его осложнений. Количество, достаточное для осуществления этих целей, определяют как терапевтически эффективная доза. Эффективные для подобного применения количества будут зависеть от тяжести заболевания, а также от массы тела и общего состояния пациента. Кроме этого композиции по настоящему изобретению могут быть подвергнуты микрокапсулированию, например, способом Tice и Bibi (в Treatise on Controlled Drug Delivery, ed. A. Kudonieus, MarcelDekker, New York (1992), стр. 315-339). При профилактическом применении композиции, содержащие пептидные соединения по настоящему изобретению, вводят пациенту, восприимчивому или каким-либо другим образом подверженному риску возникновения определенного заболевания. Такое количество определяют как профилактически эффективную дозу. В этом применении точная дозировка снова зависит от состояния здоровья и массы тела пациента. Количества пептидного соединения, необходимые для эффективной терапии, будут зависеть от многих различных факторов, включая способы введения, целевой участок, физиологическое состояние пациента и другие вводимые ему лекарственные препараты. Таким образом, лечебные дозировки должны определяться с учетом достижения максимальной безопасности и эффективности. Как правило, дозировки,использованные in vitro, могут обеспечить полезный ориентир в отношении количеств, применимых дляin situ введения данных реагентов. Тестирование на животных эффективных доз для лечения определенных расстройств обеспечит дополнительные прогностические указания в отношении дозировки для человека. Различные мнения описаны, например, в Gilman et al. (ред.), Goodman and Gilman's: The PharmacologicalPublishing Co., Easton, Pa. (1985); причем каждое из этих изданий включено в настоящую заявку с помощью ссылки. Пептидные соединения по настоящему изобретению эффективны в лечении состояний, опосредованных TPO, при введении в диапазоне дозировок от приблизительно 0,001 до приблизительно 10 мг/кг массы тела в день. Конкретная применяемая дозировка регулируется конкретным состоянием, которое подвергается лечению, путем введения, а также решением лечащего клинициста в зависимости от таких факторов, как тяжесть заболевания, возраст и общее состояние пациента и т.п. Пример 1. Твердофазный синтез пептидов. Можно синтезировать пептидные соединения по настоящему изобретению, используя, например,методики твердофазного синтеза Merrifield (см. Stewart и Young, Solid Phase Peptide Synthesis, 2d. edition,Pierce Chemical, Rockford, Ill. (1984) и Merrifield, J. Am. Chem. Soc., 85: 2149 (1963 или синтезатор пептидов Applied Biosystems Inc. Model 431A или 433 А. Сборка пептидных соединений может быть осуществлена с использованием стандартных протоколов Applied Biosystems Inc. Synth Assist 1.0.0 или SynthAssist 2.0.2. Каждое сочетание может быть выполнено в течение 2x30 мин с применением HBTU (гексафторфосфата 2-(1 Н-бензатриазол-1-ил)-1,1,3,3-тетраметилурония) и HOBt (1-гидроксибензотриазола). Используемая смола может представлять собой НМР смолу (п-гидроксиметилфеноксиметил)полистирольную смолу или PAL (Milligen/Biosearch), которая представляет собой поперечно-сшитую полистирольную смолу с 5-(4'-Fmoc-аминометил-3,5'-диметоксифенокси)валериановой кислотой в качестве линкера. Использование смолы PAL приводит к получению концевой амидной функциональной группы при отщеплении пептида от смолы. НМР смола после отщепления позволяет получить на С-конце конечного продукта карбоксильный кислотный фрагмент. Большинство реагентов, смол и защищенных аминокислот (свободных или прикрепленных к смоле) можно приобрести у Millipore или Applied Biosystems Inc.- 14009286 Для защиты аминогруппы в процессе сочетания может быть использована группа Fmoc. Защита первичной аминогруппы аминокислот может быть выполнена с помощью Fmoc и защитных групп боковых цепей, таких как трет-бутил для серина, тирозина, глутаминовой кислоты и треонина; тритил для глутамина; Pmc (2,2,5,7,8-пентаметилхроман-6-сульфонила) для аргинина; N-трет-бутоксикарбонил для триптофана; N-тритил для гистидина и S-тритил для цистеина. Отщепление пептидных соединений от смолы и одновременное снятие защиты функциональных групп боковых цепей может быть выполнено обработкой реагентом K либо его близкими модификациями. С другой стороны, при синтезе таких пептидов с амидированным карбоксиконцом полностью собранный пептид может быть отщеплен смесью 90% трифторуксусной кислоты, 5% этандитиола и 5% воды при температуре, равной вначале 4 С и постепенно повышающейся до комнатной. Пептидные соединения со снятой защитой могут быть осаждены диэтиловым эфиром. Очистка может осуществляться препаративной хроматографией, хроматографией с обращенными фазами, высокоэффективной жидкостной хроматографией на колонке с C18 связанным силикагелем с применением градиента ацетонитрил/вода в 0,1% трифторуксусной кислоте. Гомогенные пептидные соединения могут быть охарактеризованы масс-спектрометрией с бомбардировкой ускоренными атомами или масс-спектрометрией с ионизацией электрораспылением, также применим аминокислотный анализ. В предпочтительном варианте осуществления пептидные соединения по настоящему изобретению димеризуют, используя стандартные синтетические методики, которые известны специалистам в данной области техники и используются ими. Следуя этим схемам синтеза, специалист в данной области техники может легко получить димерные пептидные соединения по настоящему изобретению. Кроме этого,специалист в данной области техники без труда поймет, что можно легко связать димерные субъединицы, используя известные методики и линкеры. Пример 2. ПЭГилирование пептидных соединений. ПЭГилирование пептидных соединений по настоящему изобретению может быть выполнено с помощью хорошо известных методик. Например, пептидное соединение по настоящему изобретению может быть растворено в 100 мМ bicine pH 8,0 (bicine=N,N-бис(2-оксиэтил)глицин) с концентрацией 10 мг/мл,добавлено к 1,25-кратному молярному избытку порошкообразного ПЭГ 2 (коммерчески доступного уShearwater Polymers, Inc. (Huntsville, Ala. и полученная смесь перемешана при комнатной температуре до завершения реакции, как правило, 1-2 ч. За ходом реакции следят с помощью обращенно-фазовой ВЭЖХ, используя 40-65% градиент ацетонитрила на колонке с YMC ODS AQ. После завершения реакции раствор второй раз добавляют к 1,25-кратному избытку порошкообразного ПЭГ 2 и этот процесс повторяют 4 раза, используя, в общей сложности, 5 моль ПЭГ 2 на каждый моль полипептида. Раствор разбавляют PBS в 2 раза для снижения вязкости и вводят в колонку superdex 200 (Pharmacia), предварительно приведенную в равновесие и промытую PBS. Фракции из эксклюзионной колонки можно анализировать обращенно-фазовой ВЭЖХ. Фракции, содержащие ди-ПЭГ-пептидное соединение, которые элюируются до любого из моно-ПЭГ-пептидных соединений, могут быть объединены и сохранены при 5 С или лиофилизованы. Хотя выше конкретно описаны только предпочтительные варианты осуществления изобретения,следует иметь в виду, что возможны модификации и варианты настоящего изобретения без отступления от сути и предполагаемого объема изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пептидное соединение, которое связывается с рецептором тромбопоэтина, где указанное пептидное соединение включает (Н-IEGPTLRQ (2-Nal) LAARX10)2K-NH2, где Х 10 выбран из группы, состоящей из саркозина или -аланина. 2. Пептидное соединение по п.1, где указанное пептидное соединение ковалентно связано с гидрофильным полимером. 3. Пептидное соединение по п.2, в котором указанный гидрофильный полимер имеет среднюю молекулярную массу в диапазоне от приблизительно 500 до приблизительно 40000 Да. 4. Пептидное соединение по п.2, в котором указанный гидрофильный полимер имеет среднюю молекулярную массу в диапазоне от приблизительно 5000 до приблизительно 20000 Да. 5. Пептидное соединение по п.2, в котором указанный полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, полимолочной кислоты и полигликолевой кислоты. 6. Пептидное соединение по п.5, где указанное пептидное соединение ковалентно связано с полиэтиленгликолем. 7. Пептидное соединение по п.1, в котором каждая из димерных субъединиц указанного пептидного соединения ковалентно связана с гидрофильным полимером. 8. Фармацевтическая композиция, содержащая пептидное соединение по п.1 в сочетании с фармацевтически приемлемым носителем. 9. Способ лечения пациента, страдающего расстройством, которое чувствительно к лечению агонистами тромбопоэтина, включающий введение пациенту терапевтически эффективной дозы или количест- 15009286 ва пептидного соединения по п.1. 10. Физиологически активная в основном неиммуногенная водорастворимая полипептидная композиция, содержащая пептидное соединение по п.1, связанное при помощи связывающего агента по крайней мере с одним полимером, имеющим молекулярную массу от приблизительно 500 до приблизительно 20000 Да, выбранным из группы, состоящей из полиэтиленгликоля и полипропиленгликоля, где указанный полимер является незамещенным или замещенным алкокси- или алкильными группами и указанные алкокси- или алкильные группы имеют в своем составе менее 5 атомов углерода. 11. Полипептидная композиция по п.10, в которой указанный полимер имеет молекулярную массу от приблизительно 750 до приблизительно 15000 Да. 12. Полипептидная композиция по п.10, в которой указанный полимер имеет молекулярную массу от приблизительно 5000 до приблизительно 10000 Да. 13. Полипептидная композиция по п.10, в которой указанный полимер представляет собой полиэтиленгликоль. 14. В основном, неиммуногенная водорастворимая полипептидная композиция, содержащая пептидное соединение по п.10 и фармацевтически приемлемый носитель. 15. Способ активации рецептора тромбопоэтина в клетке, включающий введение указанной клетки в контакт с эффективным количеством пептидного соединения, которое включает (Н-IEGPTLRQ(2Nal)LAARX10)2K-NH2, где Х 10 выбран из группы, состоящей из саркозина или -аланина. 16. Способ по п.15, в котором указанные клетки включают мегакариоциты, тромбоциты или клеткиCD34+ человека. 17. Способ по п.15, в котором указанные клетки включают TPO-зависимые клетки. 18. Способ лечения тромбоцитопении у пациента, включающий:(a) получение популяции клеток указанного пациента, включающей клетки-предшественники мегакариоцитов;(b) обработку указанных клеток в соответствии со способом по п.15 и(c) введение указанных обработанных клеток указанному пациенту с целью увеличения количества мегакариоцитов, имеющихся у указанного пациента, по сравнению с тем количеством, которое имелось бы без такого лечения. 19. Способ по п.18, где указанная тромбоцитопения является следствием химиотерапии. 20. Способ по п.19, в котором указанную популяцию клеток получают до проведения указанной химиотерапии. 21. Способ по п.18, где указанная тромбоцитопения является следствием радиационной терапии. 22. Способ по п.21, в котором указанную популяцию клеток получают до проведения указанной радиационной терапии. 23. Способ лечения пациента, страдающего тромбоцитопенией, включающий введение указанному пациенту терапевтически эффективной дозы пептидного соединения, которое включает (Н-IEGPTLRQ(2Nal)LAARX10)2K-NH2, где Х 10 выбран из группы, состоящей из саркозина или -аланина. 24. Способ по п.23, где указанная тромбоцитопения является следствием химиотерапии или радиационной терапии. 25. Способ по п.24, в котором указанному пациенту перед проведением указанной химиотерапии или радиационной терапии вводят антагонист TPO. 26. Способ по п.23, где указанная тромбоцитопения является следствием пересадки костного мозга. 27. Способ профилактического воздействия на пациента, для которого существует опасность возникновения тромбоцитопении, включающий введение указанному пациенту профилактически эффективного количества пептидного соединения, которое включает (H-IEGPTLRQ(2-Nal)LAARX10)2K-NH2,где Х 10 выбран из группы, состоящей из саркозина или -аланина. 28. Способ по п.27, в котором указанное пептидное соединение вводят перед пересадкой костного мозга, химиотерапией или радиационной терапией. 29. Пептидное соединение, которое связывается с рецептором тромбопоэтина, где указанное соединение имеет:(1) молекулярную массу менее приблизительно 8000 Да и(2) сродство к связыванию с рецептором тромбопоэтина, выраженное через IC50 не более приблизительно 100 мкМ, где указанное соединение содержит следующую последовательность аминокислот:V; Х 3 представляет собой С, F, I, L, М, R, S, V или W; Х 4 представляет собой любую из 20 генетически кодируемых L-аминокислот; Х 5 представляет собой A, D, E, G, K, М, Q, R, S, Т, V или Y; Х 7 представляет собой С, G, I, K, L, М, N, R или V; и Х 6 представляет собой -(2-нафтил)аланин. 30. Пептидное соединение по п.29, в котором указанная последовательность аминокислот циклизована.- 16009286 31. Пептидное соединение по п.29, в котором указанная последовательность аминокислот димеризована. 32. Способ активации рецептора тромбопоэтина в клетке, включающий введение указанной клетки в контакт с эффективным количеством пептида, имеющего молекулярную массу менее приблизительно 8000 Да, где указанное соединение содержит следующую последовательность аминокислот:V; Х 3 представляет собой С, F, I, L, М, R, S, V или W; Х 4 представляет собой любую из 20 генетически кодируемых L-аминокислот; X5 представляет собой A, D, E, G, K, М, Q, R, S, Т, V или Y; Х 7 представляет собой С, G, I, K, L, М, N, R или V; и Х 6 представляет собой -(2-нафтил)аланин. 33. Пептидное соединение по п.32, в котором указанная последовательность аминокислот циклизована. 34. Пептидное соединение по п.32, в котором указанная последовательность аминокислот димеризована. 35. Способ активации рецептора тромбопоэтина в клетке, включающий введение указанной клетки в контакт с эффективным количеством пептидного соединения, ковалентно связанного с гидрофильным полимером, где указанное соединение содержит последовательность аминокислот IEGPTLRQ (2-Nal)LAAR (Sar). 36. Способ по п.35, в котором указанный гидрофильный полимер имеет среднюю молекулярную массу в диапазоне от приблизительно 500 до приблизительно 40000 Да. 37. Способ по п.35, в котором указанный гидрофильный полимер имеет среднюю молекулярную массу в диапазоне от приблизительно 5000 до приблизительно 20000 Да. 38. Способ по п.35, в котором указанный полимер выбран из группы, состоящей из полиэтиленгликоля, полипропиленгликоля, полимолочной кислоты и полигликолевой кислоты. 39. Способ по п.38, в котором указанное пептидное соединение ковалентно связано с полиэтиленгликолем. 40. Способ по п.35, в котором указанные клетки представляют собой клетки in vivo. 41. Способ по п.35, в котором указанные клетки представляют собой клетки in vitro. 42. Способ по п.35, в котором указанные клетки включают мегакариоциты, тромбоциты или клеткиCD34+ человека. 43. Способ по п.35, в котором указанные клетки включают TPO-зависимые клетки. 44. Способ лечения тромбоцитопении у пациента, включающий:(a) получение популяции клеток указанного пациента, включающей клетки-предшественники мегакариоцитов;(b) обработку указанных клеток в соответствии со способом по п.35 и(c) введение указанных обработанных клеток указанному пациенту с целью увеличения количества мегакариоцитов, имеющихся у указанного пациента, по сравнению с тем количеством, которое имелось бы без такого лечения. 45. Способ по п.44, где указанная тромбоцитопения является следствием химиотерапии. 46. Способ по п.45, в котором указанную популяцию клеток получают до проведения указанной химиотерапии. 47. Способ по п.44, где указанная тромбоцитопения является следствием радиационной терапии. 48. Способ по п.47, в котором указанную популяцию клеток получают до проведения указанной радиационной терапии. 49. Пептидное соединение по п.29, где пептидное соединение содержит следующую последовательность аминокислот: IEGPTLRQ (2-Nal) LAAR (Sar). 50. Пептидное соединение, которое связывается с рецептором тромбопоэтина, где указанное соединение включает (H-IEGPTLRQ(2-Nal)LAAR(Sar2K-NH2. 51. Пептидное соединение по п.50, где указанное пептидное соединение ковалентно связано с полимером. 52. Пептидное соединение по п.51, в котором указанный гидрофильный полимер выбран из группы,состоящей из полиэтиленгликоля, полипропиленгликоля, полимолочной кислоты и полигликолевой кислоты. 53. Пептидное соединение по п.52, где указанное пептидное соединение ковалентно связано с полиэтиленгликолем. 54. Пептидное соединение по п.53, в котором указанный полиэтиленгликоль имеет среднюю молекулярную массу в диапазоне от приблизительно 5000 до приблизительно 20000 Да. 55. Пептидное соединение по п.53, в котором полиэтиленгликоль выбран из группы, состоящей из монометоксиполиэтиленгликоля (MePEG-OH), монометоксиполиэтиленгликольсукцината (MePEG-S),монометоксиполиэтиленгликольсукцинимидилсукцината (MePEG-S-NHS), монометоксиполиэтиленгликольамина (MePEG-NH2), монометоксиполиэтиленгликольтрезилата (MePEG-TRES) и монометоксипо- 17009286 лиэтиленгликольимидазолил карбонила (MePEG-IM). 56. Пептидное соединение, которое связывается с рецептором тромбопоэтина, имеющее следующую формулу: где (2-Nal) представляет собой -(2-нафтил) аланин и (Sar) представляет собой саркозин. 57. Пептидное соединение по п.56, где указанное пептидное соединение ковалентно связано с гидрофильным полимером. 58. Пептидное соединение по п.57, в котором указанный гидрофильный полимер выбран из группы,состоящей из полиэтиленгликоля, полипропиленгликоля, полимолочной кислоты и полигликолевой кислоты. 59. Пептидное соединение по п.57, где указанное пептидное соединение ковалентно связано с полиэтиленгликолем. 60. Пептидное соединение по п.59, в котором указанный полиэтиленгликоль имеет среднюю молекулярную массу в диапазоне от приблизительно 5000 до приблизительно 20000 Да. 61. Пептидное соединение по п.59, в котором полиэтиленгликоль выбран из группы, состоящей из монометоксиполиэтиленгликоля (MePEG-OH), монометоксиполиэтиленгликольсукцината (MePEG-S),монометоксиполиэтиленгликольсукцинимидилсукцината (MePEG-S-NHS), монометоксиполиэтиленгликольамина (МеРЕС-NH2), монометоксиполиэтиленгликольтрезилата (MePEG-TRES) и монометоксиполиэтиленгликольимидазолил карбонила (MePEG-IM). 62. Пептидное соединение по п.56, где каждая из димерных субъединиц указанного пептидного соединения ковалентно связана с гидрофильным полимером. 63. Пептидное соединение по п.62, в котором указанный гидрофильный полимер выбран из группы,состоящей из полиэтиленгликоля, полипропиленгликоля, полимолочной кислоты и полигликолевой кислоты. 64. Пептидное соединение по п.63, где указанное пептидное соединение ковалентно связано с полиэтиленгликолем. 65. Пептидное соединение по п.64, в котором указанный полиэтиленгликоль имеет среднюю молекулярную массу в диапазоне от приблизительно 5000 до приблизительно 20000 Да. 66. Пептидное соединение по п.65, в котором полиэтиленгликоль выбран из группы, состоящей из монометоксиполиэтиленгликоля (MePEG-OH), монометоксиполиэтиленгликольсукцината (MePEG-S),монометоксиполиэтиленгликольсукцинимидилсукцината (MePEG-S-NHS), монометоксиполиэтиленгликольамина (MePEG-NH2), монометоксиполиэтиленгликольтрезилата (MePEG-TRES) и монометоксиполиэтиленгликольимидазолилкарбонила (MePEG-IM).
МПК / Метки
МПК: A61K 38/03, C07K 7/00
Метки: рецептором, связываются, пептиды, которые, соединения
Код ссылки
<a href="https://eas.patents.su/21-9286-peptidy-i-soedineniya-kotorye-svyazyvayutsya-s-receptorom.html" rel="bookmark" title="База патентов Евразийского Союза">Пептиды и соединения, которые связываются с рецептором</a>
Предыдущий патент: Композиция конъюгированного лекарственного средства
Следующий патент: Получение l-аскорбиновой кислоты в результате микробиологического процесса
Случайный патент: Иммуномодулирующие пептиды, полученные из белков теплового шока, и их применение