1-аминоалкилциклогексановые антагонисты рецепторов nmda
Номер патента: 2254
Опубликовано: 28.02.2002
Авторы: Калвиньш Иварс, Йиргенсонс Айгарс, Каусс Валерьянс, Парсонс Кристофер Грахам Рафаэль, Даныш Войцех, Гольд Маркус
Формула / Реферат
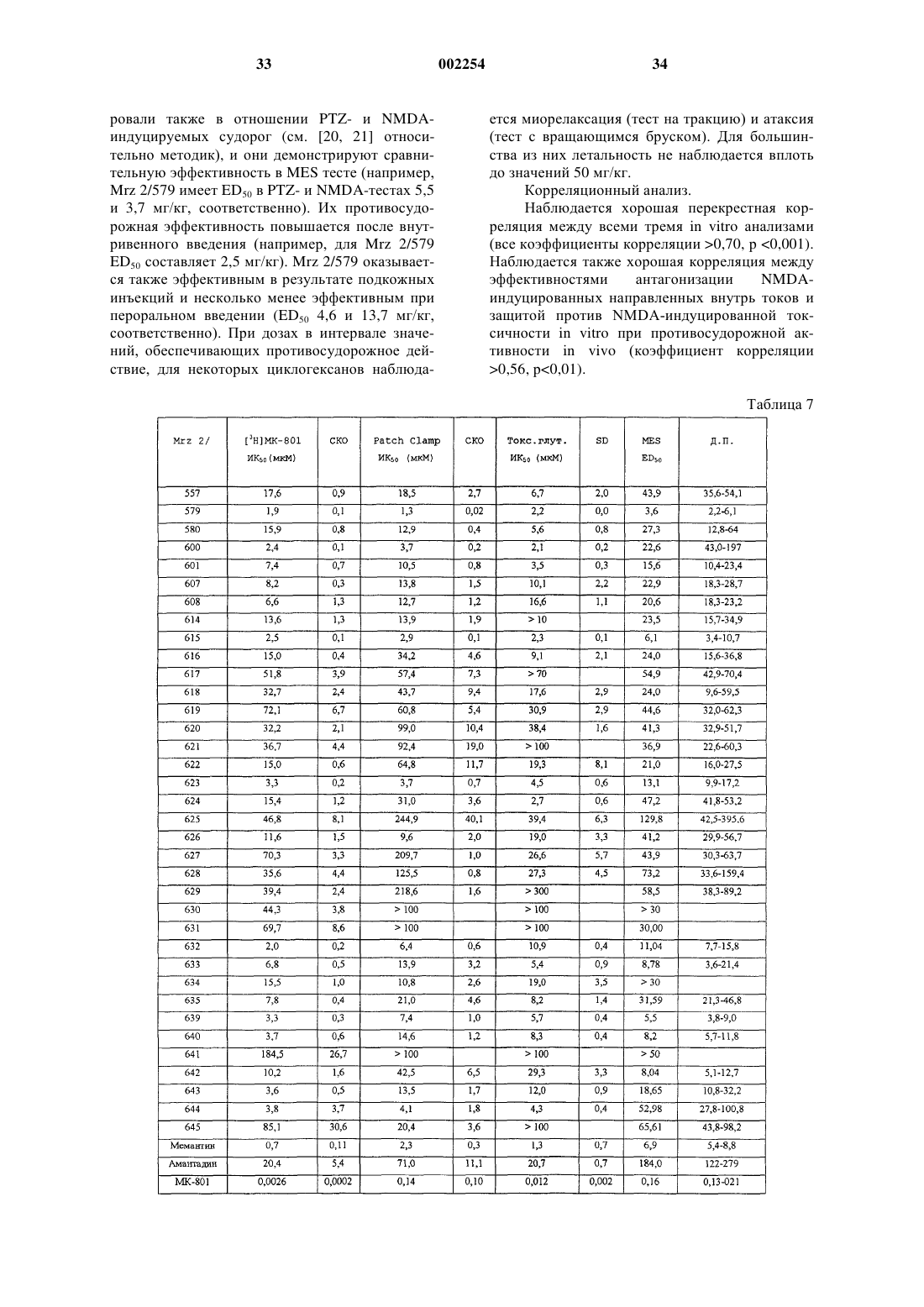
1. Соединение 1-аминоалкилциклогексана, выбранное из соединений формулы

где R* представляет -(CH2)n-(CR6R7)m-NR8R9,
где n+m=0, 1 или 2;
где R1-R9 независимо выбирают из водорода, C1-6 алкила, причем, по крайней мере, R1, R4 и R5 представляют C1-6 алкил,
и его фармацевтически приемлемых солей,
при условии, что указанное соединение 1-аминоалкилциклогексана не является 1-метиламино-1,3,3,5-тетраметилциклогексаном.
2. Соединение по п.1, где R1-R5 представляют метил.
3. Соединение по п.1, где R1 представляет этил.
4. Соединение по п.1, где R2 представляет этил.
5. Соединение по п.1, где R3 представляет этил.
6. Соединение по п.1, где R4 представляет этил.
7. Соединение по п.1, где R5 представляет этил.
8. Соединение по п.1, где R5 представляет пропил.
9. Соединение по п.1, где R6 или R7 представляет метил.
10. Соединение по п.1, где R6 или R7 представляет этил.
11. Соединение по п.1, где соединение выбирают из группы, состоящей из
1-амино-1,3,3,5,5-пентаметилциклогексана,
1-амино-1,3,5,5-тетраметил-3-этилциклогексана,
1-амино-1,5,5-триметил-3,3-диэтилциклогексана,
1-амино-1,5,5-триметил-цис-3-этилциклогексана,
1-амино-1,5,5-триметил-транс-3-этилциклогексана,
1-амино-1-этил-3,3,5,5-тетраметилциклогексана,
1-амино-1-пропил-3,3,5,5-тетраметилциклогексана,
N-метил-1-амино-1,3,3,5,5-пентаметилциклогексана и
N-этил-1-амино-1,3,3,5,5-пентаметилциклогексана, и
фармацевтически приемлемых солей любого из вышеперечисленных.
12. Способ облегчения состояний, которые могут быть улучшены введением антагониста NMDA рецепторов, проявляющим, в частности иммуномодуляторную или противомалярийную активности, а также активность против вируса Воrnа или против гепатита С, включающий введение животному эффективного количества производного 1-аминоалкилциклогексана, выбранного из соединений формулы
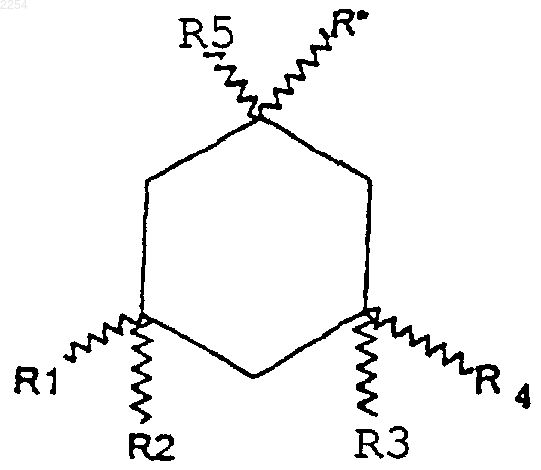
где R* представляет -(CH2)n-(CR6R7)m-NR8R9,
где n+m=0, 1 или 2;
где R1-R9 независимо выбирают из водорода и С1-6 алкила, и его фармацевтически приемлемых солей.
13. Способ по п.12, где R1-R5 представляют метил.
14. Способ по п.12, где R1 представляет этил.
15. Способ по п.12, где R2 представляет этил.
16. Способ по п.12, где R3 представляет этил.
17. Способ по п.12, где R4 представляет этил.
18. Способ по п.12, где R5 представляет этил.
19. Способ по п.12, где R5 представляет пропил.
20. Способ по п.12, где R6 или R7 представляет метил.
21. Способ по п.12, где R6 или R7 представляет этил.
22.Способ по п.12, где соединение выбирают из группы, состоящей из
1-амино-1,3,3,5,5-пентаметилциклогексана,
1-амино-1,3,5,5-тетраметил-3-этилциклогексана,
1-амино-1,5,5-триметил-3,3-диэтилциклогексана,
1-амино-1,5,5-триметил-цис-3-этилциклогексана,
1-амино-1,5,5-триметил-транс-3-этилциклогексана,
1-амино-1-этил-3,3,5,5-тетраметилциклогексана,
1-амино-1-пропил-3,3,5,5-тетраметилциклогексана,
N-метил-1-амино-1,3,3,5,5-пентаметилциклогексана и
N-этил-1-амино-1,3,3,5,5-пентаметилциклогексана, и
фармацевтически приемлемых солей любого из вышеперечисленных.
23. Способ по п.12, при котором соединение вводят в форме фармацевтической композиции, включающей это соединение в комбинации с одним или более фармацевтически приемлемыми разбавителями, эксципиентами или носителями.
24. Фармацевтическая композиция, включающая антагонистически эффективное в отношении NMDA рецепторов или иммуномодуляторное, противомалярийное, противовирусное в отношении вируса Воrnа или гепатита С количество производного 1-аминоалкилциклогексана, выбранного из соединений формулы
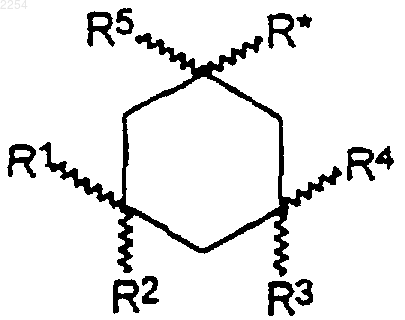
где R* представляет -(CH2)n-(CR6R7)m-NR8NR9;
где n+m=0, 1 или 2;
где R1-R9 независимо выбирают из водорода и С1-6 алкила, причем, по крайней мере, R1, R4 и R5 представляют С1-6 алкил, и его фармацевтически приемлемых солей, в сочетании с одним или более фармацевтически приемлемыми разбавителями, эксципиентами или носителями.
25. Фармацевтическая композиция по п.24, где R1-R5 представляют метил.
26. Фармацевтическая композиция по п.24, где R1 представляет этил.
27. Фармацевтическая композиция по п.24, где R2 представляет этил.
28. Фармацевтическая композиция по п.24, где R3 представляет этил.
29. Фармацевтическая композиция по п.24, где R4 представляет этил.
30. Фармацевтическая композиция по п.24, где R5 представляет этил.
31. Фармацевтическая композиция по п.24, где R5 представляет пропил.
32. Фармацевтическая композиция по п.24, где R6 или R7 представляет метил.
33. Фармацевтическая композиция по п.24, где R6 или R7 представляет этил.
34. Фармацевтическая композиция по п.24, где соединение выбирают из группы, состоящей из
1-амино-1,3,3,5,5-пентаметилциклогексана,
1-амино-1,3,5,5-тетраметил-3-этилциклогексана,
1-амино-1,5,5-триметил-3,3-диэтилциклогексана,
1-амино-1,5,5-триметил-цис-3-этилциклогексана,
1-амино-1,5,5-триметил-транс-3-этилциклогексана,
1-амино-1-этил-3,3,5,5-тетраметилциклогексана,
1-амино-1-пропил-3,3,5,5-тетраметилциклогексана,
N-метил-1-амино-1,3,3,5,5-пентаметилциклогексана и
N-этил-1-амино-1,3,3,5,5-пентаметилциклогексана, и
фармацевтически приемлемых солей любого из вышеперечисленных.
Текст
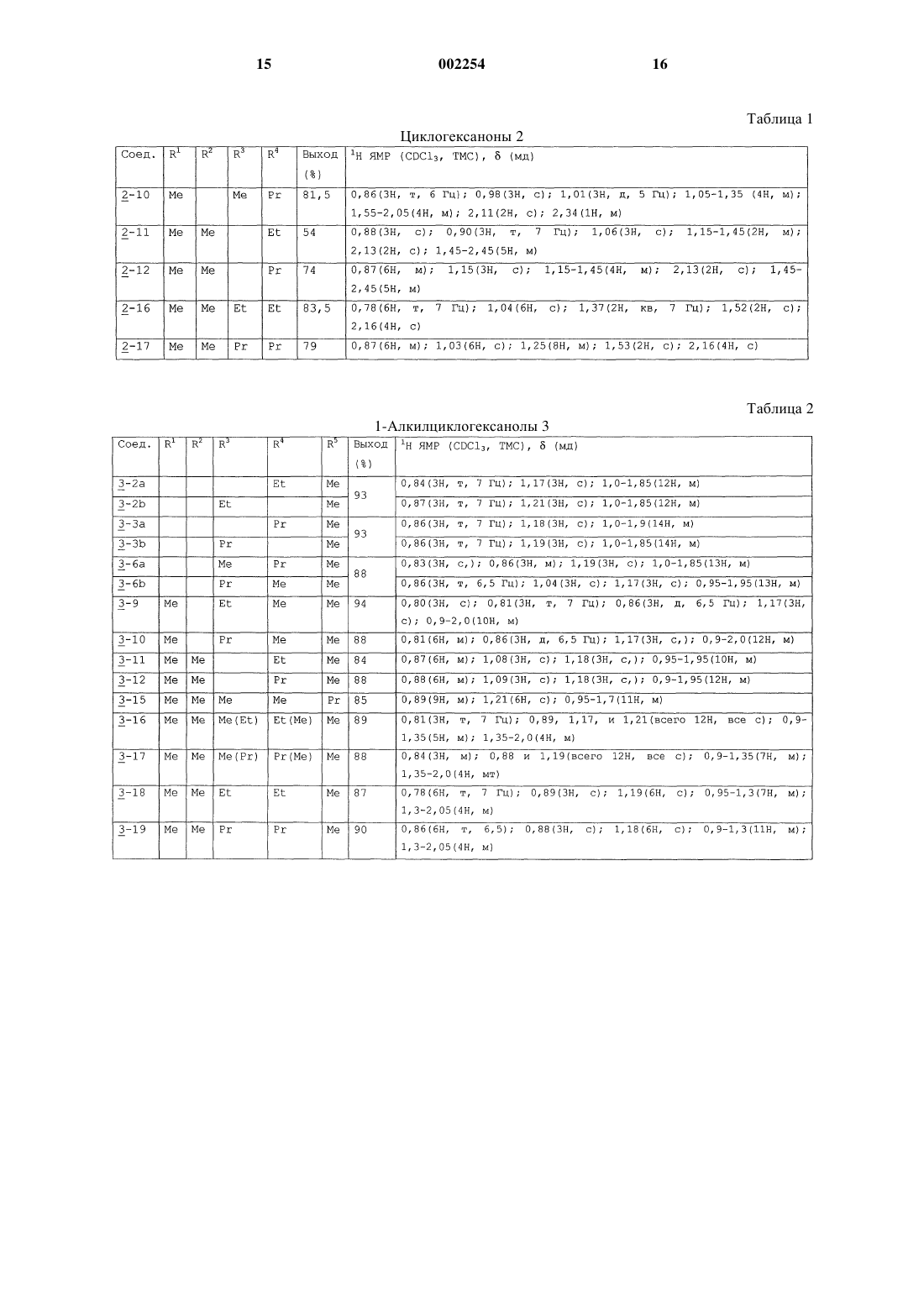
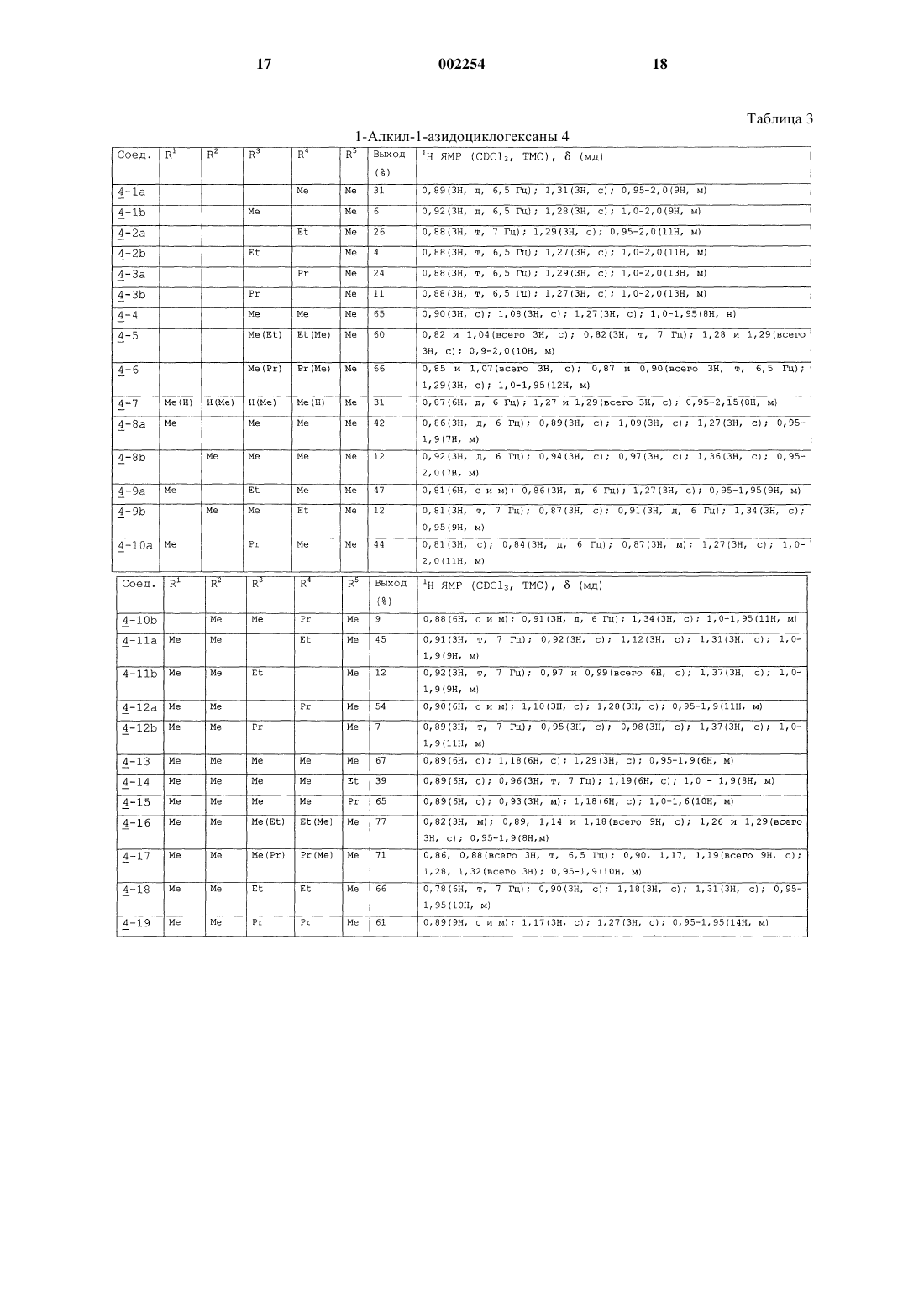
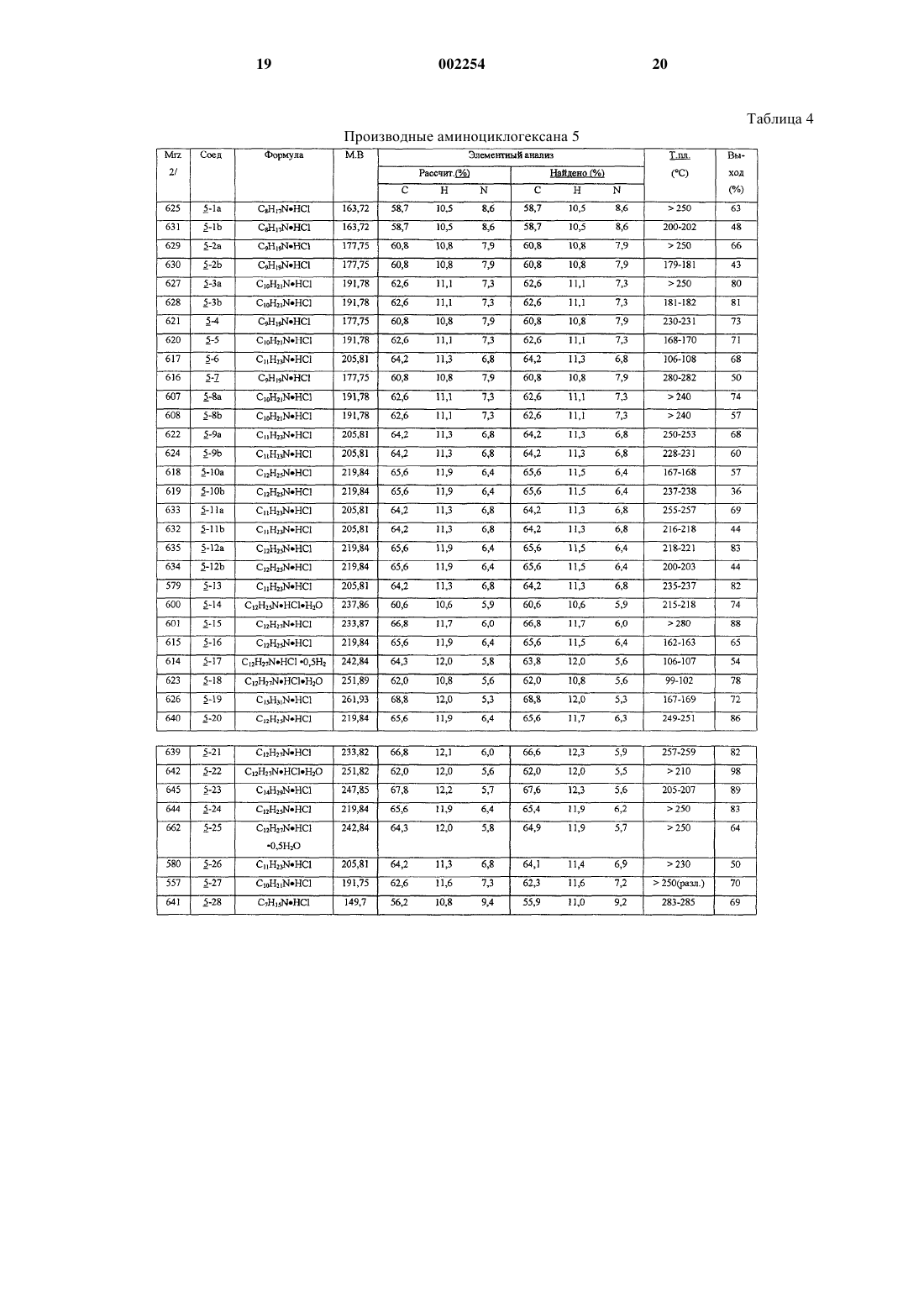
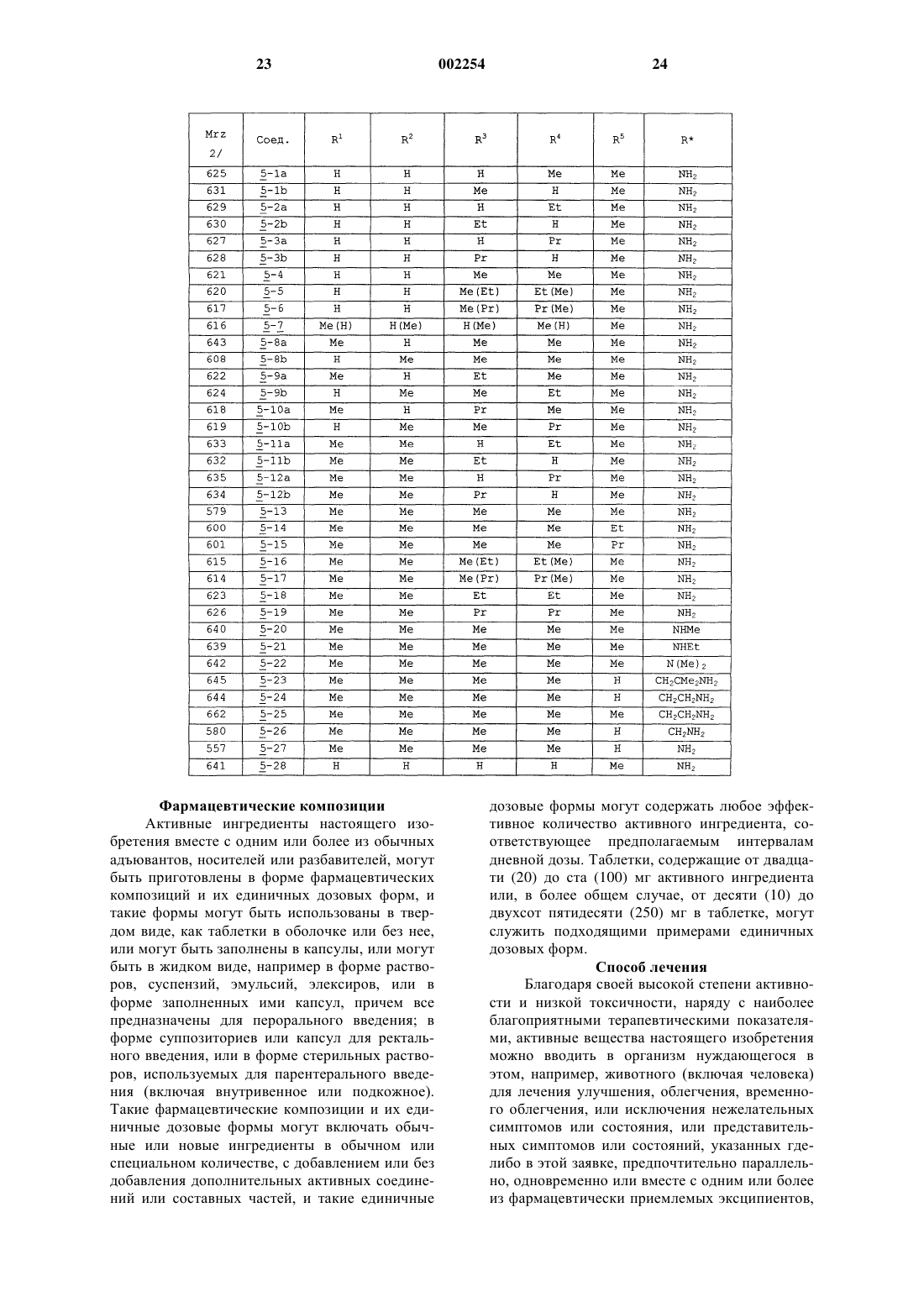
1 Предпосылки изобретения 1. Область изобретения. Соединения 1-аминоалкилциклогексана,которые являются системно активными в качестве антагонистов NMDA рецепторов, включающие их фармацевтические композиции, способы их получения и способы лечения нарушений ЦНС, которые связаны с нарушениями глутаматергической передачи. 2. Известный уровень. Антагонизм рецепторов глутамата типа Nметил-D-аспартата (NMDA) имеет потенциально широкий круг терапевтических применений(19). Функционального ингибирования NMDA рецепторов можно достичь путем воздействия на различные сайты распознавания, такие как первичный трансмиттерный сайт, невосприимчивый к стрихнину глициновый сайт (глицинв),полиаминовый сайт и фенилциклидиновый сайт, расположенные внутри катионных канальцев. Блокаторы каналов NMDA рецепторов функционируют в неконкурирующей "зависимой от использования" манере, что означает,что они обычно только блокируют каналы в открытом состоянии. Многие интерпретируют такую зависимость от использования как то, что более сильная активация рецептора должна привести к большей степени антагонизма. Далее было высказано предположение, что в результате указанного типа действия такой класс антагонистов может оказаться особенно полезным в том случае, когда можно ожидать сверхактивацию NMDA рецепторов, что бывает в случае эпилепсии, ишемии и при травмах. Однако первоначальные клинические опыты с селективным, с высоким сродством, в значительной степени зависящим от использования, неконкурирующим антагонистом NMDA рецепторов (+)-5 метил-10,11-дигидро-5 Н-дибензоциклогептен 5,10-имин малеатом +)-МК-801), оказались разочаровывающими. А именно, терапевтическая эффективность в случае эпилепсии оказалась незначительной, тогда как при введении терапевтических доз наблюдались некоторые психотропные побочные эффекты. Эти наблюдения, наряду с тем фактом, что лица, злоупотребляющие фенилциклидином, испытывают аналогичные психотропные симптомы, привели к заключению, что неконкурирующий антагонизм NMDA рецепторов не может быть обещающим терапевтическим подходом. Однако использование более тщательно разработанных электрофизиологических методов показывает, что не существует равенства между различными неконкурирующими антагонистами, так как такие факторы, как скорость блокады рецепторов (кинетики "включениявыключения") и зависимость от напряжения этого эффекта могут определять как фармакодинамические характеристики in vivo, так и терапевтическую безопасность. Парадоксально,но могут оказаться предпочтительными агенты 2 с низкой или умеренной, а не высокой степенью сродства. Эти открытия вызвали пересмотр концепции неконкурирующего антагонизма NMDA рецепторов при создании лекарств [19, 22]. В настоящее время многие такие агенты находятся на различных стадиях разработки, например, к ним относятся карведиол, ADCI, TS 242S, ремацемид, фелбамат и бадипин. С другой стороны,неконкурирующие антагонисты NMDA рецепторов, такие как амантадин и мемантин, которые удовлетворяют вышеприведенным критериям, уже использовались клинически в течение ряда лет для лечения болезни Паркинсона и деменции, соответственно, и действительно редко вызывают побочные эффекты при приеме терапевтических доз, используемых при соответствующих для них показаниях. С учетом вышеуказанного авторы разработали ряд новых неконкурирующих антагонистовNMDA рецепторов на основе структуры 1 аминоалкилциклогексана. Настоящее исследование посвящено сравнению антагонистических свойств производных 1-аминоалкилциклогексана в отношении NMDA рецепторов в анализах связывания с рецептором, patch clamp экспериментах, экситотоксичности in vitro, трех моделей судорог и двух моделей нарушения моторики. Заместители этих 1-аминоалкилциклогексанов представлены в табл. 6. Настоящее изобретение Теперь было обнаружено, что некоторые 1 аминоалкилциклогексаны обладают выраженной и непредсказуемой антагонистической активностью в отношении NMDA рецепторов. Обладая вышеуказанным свойством, эти вещества подходят для лечения широкого круга нарушений ЦНС, которые связаны с нарушением глутаматергической передачи предпочтительно в форме их фармацевтических композиций, в которых они присутствуют вместе с одним или более из фармацевтически приемлемых разбавителей, носителей или эксципиентов. Цели изобретения Целью настоящего изобретения является создание новых фармацевтических соединений,которые являются 1-аминоалкилциклогексановыми антагонистами NMDA рецепторов, и их фармацевтических композиций. Следующей целью данного изобретения является создание нового способа лечения, исключения, облегчения, временного облегчения, или улучшения нежелательных нарушений ЦНС, которые связаны с нарушениями глутаматергической передачи, за счет использования такого соединения настоящего изобретения или содержащей его фармацевтической композиции. Другой целью изобретения является предложение способа получения указанных активных соединений 1 аминоалкилциклогексана. Другие дополнительные цели станут ясны далее, и еще дополнительные цели будут очевидны специалистам. 3 Краткое содержание изобретения Авторы изобретения считают, что содержание настоящего изобретения можно суммировать inter alia следующим образом. Соединение 1-аминоалкилциклогексана,выбранное из соединений формулы где R представляет -(CH2)n-(СR6R7)m-NR8R9,где n+m=0, 1 или 2; где R1-R9 независимо выбирают из водорода и низшего (C1-C6) алкила, причем, по крайней мере, R1, R4 и R5 представляют низший алкил; таких как соединения, в которых R1-R5 представляет метил; таких как соединения, в которых R1 представляет этил; таких как соединения, в которых R2 представляет этил; таких как соединения, в которых R3 представляет этил; таких как соединения, в которых R4 представляет этил; таких как соединения, в которых R5 представляет этил; таких как соединения, в которых R5 представляет пропил; таких как соединения, в которых R6 или R7 представляет метил; таких как соединения, в которых R6 или R7 представляет этил; и таких как соединения, в которых соединения выбирают из группы, состоящей из 1-амино-1,3,3,5,5-пентаметилциклогексана,1-амино-1,3,5,5-тетраметил-3-этилциклогексана,1-амино-1,5,5-триметил-3,3-диэтилциклогексана,1-амино-1,5,5-триметил-цис-3-этилциклогексана,1-амино-1,5,5-триметил-транс-3-этилциклогексана,1-амино-1-этил-3,3,5,5-тетраметилциклогексана,1-амино-1-пропил-3,3,5,5-тетраметилциклогексана,N-метил-1-амино-1,3,3,5,5-пентаметилциклогексана иN-этил-1-амино-1,3,3,5,5-пентаметилциклогексана и фармацевтически приемлемых солей любого из вышеперечисленных. Кроме того, способ лечения живых животных для облегчения состояния, которое улучшается с помощью антагониста NMDA рецепторов, включающий стадию введения указанному живому животному такого количества соедине 002254 4 ния 1-аминоалкилциклогексана, выбранного из соединений формулы где R представляет -(CH2)n-(CR6R7)m-NR8N9,где n+m=0, 1 или 2; где R1-R9 независимо выбирают из водорода и низшего (C1-С 6) алкила, которое эффективно для облегчения указанного состояния; такой способ, в котором R1-R5 представляет метил; такой способ, в котором R1 представляет этил; такой способ, в котором R2 представляет этил; такой способ, в котором R3 представляет этил; такой способ, в котором R4 представляет этил; такой способ, в котором R5 представляет этил; такой способ, в котором R5 представляет пропил; такой способ, в котором R6 или R7 представляет метил; такой способ, в котором R6 или R7 представляет этил; и такой способ, в котором соединение выбирают из группы, состоящей из 1-амино-1,3,3,5,5-пентаметилциклогексана,1-амино-1,3,5,5-тетраметил-3-этилциклогексана,1-амино-1,5,5-тетраметил-3,3-диэтилциклогексана,1-амино-1,5,5-триметил-цис-3-этилциклогексана,1-амино-1,5,5-триметил-транс-3-этилциклогексана,1-амино-1-этил-3,3,5,5-тетраметилциклогексана,1-амино-1-пропил-3,3,5,5-тетраметилциклогексана,N-метил-1-амино-1,3,3,5,5-пентаметилциклогексана иN-этил-1-амино-1,3,3,5,5-пентаметилциклогексана, и фармацевтически приемлемых солей любого из вышеперечисленных, и такой способ, при котором соединение вводят в форме его фармацевтической композиции, включающей это соединение в комбинации с одним или более фармацевтически приемлемыми разбавителями, эксципиентами или носителями. Далее, фармацевтическая композиция,включающая антагонист NMDA рецепторов в антагонистически эффективном в отношенииNMDA рецепторов количестве, или эффектив 5 ном иммуномодуляторном, противомалярийном, эффективном против вируса Воrnа, или эффективном против гепатита С количестве соединения 1-аминоалкилциклогексана, выбранного из соединений формулы где R представляет -(CH2)n-(СR6R7)m-NR8R9,где n+m=0, 1 или 2; где R1-R9 независимо выбирают из водорода и низшего (C1-C6) алкила, причем, по крайней мере, R1, R4 и R5 представляют низший алкил, в сочетании с одним или более фармацевтически приемлемыми разбавителями, эксципиентами или носителями; такая фармацевтическая композиция, в которой R1-R5 представляет метил; такая фармацевтическая композиция, в которой R1 представляет этил; такая фармацевтическая композиция, в которой R2 представляет этил; такая фармацевтическая композиция, в которой R3 представляет этил; такая фармацевтическая композиция, в которой R4 представляет этил; такая фармацевтическая композиция, в которой R5 представляет этил; такая фармацевтическая композиция, в которой R5 представляет пропил; такая фармацевтическая композиция, в которой R6 или R7 представляет метил; такая фармацевтическая композиция, в которой R6 или R7 представляет этил; такая фармацевтическая композиция, в которой соединение выбирают из группы, состоящей из 1-амино-1,3,3,5,5-пентаметилциклогексана,1-амино-1,3,5,5-тетраметил-3-этилциклогексана,1-амино-1,5,5-триметил-3,3-диэтилциклогексана,1-амино-1,5,5-триметил-цис-3-этилциклогексана,1-амино-1,5,5-триметил-транс-3-этилциклогексана,1-амино-1-этил-3,3,5,5-тетраметилциклогексана,1-амино-1-пропил-3,3,5,5-тетраметилциклогексана,N-метил-1-амино-1,3,3,5,5-пентаметилциклогексана иN-этил-1-амино-1,3,3,5,5-пентаметилциклогексана, и фармацевтически приемлемых солей любого из вышеперечисленных. Подробное описание изобретения Нижеследующее подробное описание и подробные примеры представлены только с це 002254 6 лью иллюстрации, и ни коим образом их не следует рассматривать как ограничивающие. Методы Химия Получение 3-пропил-5,5-диметил-2-циклогексен-1-она (1-7). Раствор 3-этокси-5,5-диметил-2-циклогексен-1-она [1] (5,04 г, 30 ммоль) в эфире добавляют по каплям к перемешиваемому раствору пропилмагниййодида, полученному из 90 мг магния и 90 ммоль 1-йодопропана в 60 мл эфира. После перемешивания в течение 1 ч при комнатной температуре реакционную смесь обрабатывают 5% раствором H2SO4. Органическую фазу выделяют, промывают рассолом, сушат над сульфатом магния и упаривают, получая сырое масло, которое разделяют на колонке с силикагелем, элюируя смесью гексанэтилацетат. Циклогексанон (1-7) получают в виде бесцветного масла (2,0 г, 70%). 1(1 Н, т, J=1,5 Гц) Такие известные циклогексаноны 1 используют для получения соединений 2: 1-1 [R1=R2=R3=H) (коммерчески доступен),1-2 (R3=Me) (коммерчески доступен),1-3 (R2=R3=Me) (коммерчески доступен),1-4 (R1=R2=Me) [2],1-5 (R1=R2=R3=Me) (коммерчески доступен),1-6 (R1=R2=Me, R3=Et) [3].Rn=H, если опущен. Другие исходные материалы получают таким же или аналогичным способом. 7 Общий способ получения циклогексанонов 2. Безводный хлорид меди (1) (7,5 ммоль) добавляют к охлажденному раствору алкилмагниййодида (15-18 ммоль) в эфире. Полученную смесь перемешивают в инертной атмосфере в течение 5 мин, и по каплям добавляют раствор 2-циклогексен-1-она 1 (10 ммоль), поддерживая температуру ниже -5 С. После того, как завершается добавление кетона, реакционную смесь перемешивают в течение 1 ч и осторожно нейтрализуют насыщенным водным растворомNH4Cl. В результате традиционной обработки для реакции Гриньяра получают сырой материал, который разделяют на колонке с силикагелем, элюируя смесью петролейный эфирэтилацетат. Циклогексаноны 2 получают в виде масел. Выходы и спектральные данные 1H ЯМР для соединений 2 представлены в табл. 1. Такие известные циклогексаноны 2 используют для получения соединений 3. 2-1 (R4=Me) (коммерчески доступен),2-2 (R4=Et) [4],2-3 (R4=Pr) [5],2-4 (R3=R4=Me) [6],2-5 (R3=Me, R4=Et) [7],2-6 (R3=Me, R4=Pr) [8],2-7 (R1=R4=Me) [9],2-8 (R2=R3=R4=Me) [10],2-9 (R2=R3=Me, R4=Et) [11],2-13 (R1=R2=R3=R4=Me) (коммерчески доступен),2-14 (R1=R2=R3=Me, R4=Et) [10],2-15 (R1=R2=R3=Me, R4=Pr) [10]Rn=H, если опущен. Другие промежуточные циклогексаноны 2 получают таким же или аналогичным способом. Циклогексаноны 2 используют для получения соединений 3. Общий способ получения алкилциклогексанолов 3. Эфирный раствор алкилмагниййодида (3-4 эквивалента) добавляют по каплям к охлажденному раствору циклогексанона 2 в эфире. Смесь перемешивают в течение 1 ч при комнатной температуре и осторожно разрушают насыщенным водным раствором аммонийхлорида. В результате традиционной обработки для реакций Гриньяра получают смеси диастереоизомерных спиртов 3, которые разделяют на колонке с силикагелем, элюируя смесью петролейный эфирэтилацетат. Выходы и результаты спектральных исследований 1H ЯМР соединений 3 представлены в табл. 2. Такие известные циклогексаноны 3 используют для получения соединений 4. 3-1 R3)(R4)=R5=Me) [9], т.е. R3 или R4 и 5Rn=H, если опущен. Другие промежуточные циклогексанолы 3 получают таким же или аналогичным способом. Общий способ получения 1-алкил-1 азидоциклогексанов 4. Спирт 3 смешивают с 1,7-2 н. раствором азотисто-водородной кислоты (10-13 эквивалентов) в хлороформе, и охлаждают на бане со льдом. По каплям добавляют раствор TiCl4 (1,2 эквивалента) в хлороформе, поддерживая при этом температуру ниже 5 С. Полученную смесь перемешивают при комнатной температуре в течение 24 ч и вводят в колонку с окисью алюминия, элюируя хлороформом. В результате упаривания растворителя получают диастереоизомерные азиды 4, которые очищают с помощью флэш-хроматографии на силикагеле,элюируя легким петролейным эфиром. Выходы и результаты спектральных исследований 1 Н ЯМР соединений 4 представлены в табл. 3. Другие промежуточные 1-алкил-1-азидоциклогексаны 4 получают таким же или аналогичным способом. Получение 1-нитрометил-3,3,5,5-тетраметилциклогексена (6). Раствор 3,3,5,5-тетраметилциклогексанона(2-13) (1,54 г, 10 ммоль) и этилендиамина (60 мг) в нитрометане (45 мл) кипятят с обратным холодильником в атмосфере аргона в течение 25 ч. Затем избыток нитрометана удаляют в вакууме, а остаток очищают с помощью флэшхроматографии на силикагеле, элюируя смесью гексан-этилацетат (6:1). Получают 1,2 г (61%) соединения 6 в виде масла. 1(2 Н, с, 4-СН 2), 1,82 (2 Н, шир.с, 6-СН 2), 4,80 (2 Н,с, CH2NO2) и 5,64 (1 Н, шир.с, С=С-Н). Получение этил 3,3,5,5-тетраметилциклогексилиденацетата (7). К перемешиваемому раствору триэтилфосфоноацетата (49,32 г, 0,22 моль) в сухом ТГФ (180 мл) в атмосфере аргона небольшими порциями добавляют NaH (8,8 г, 0,22 моль, 60% суспензия в минеральном масле), при охлаждении ледяной водой. Перемешивание продолжают в течение 1 ч при комнатной температуре, а затем в течение 10 мин добавляют раствор 3,3,5,5-тетраметилциклогексанона (2-13) (30,85 г, 0,2 моль), и полученную смесь кипятят с обратным холодильником в течение 22 ч. Затем ее выливают на лед (400 г), продукт экстрагируют эфиром (4150 мл) и полученный раствор сушат над сульфатом магния. После концентрирования в вакууме маслянистый остаток перего 9 няют при 145 С (11 мм рт.ст.), получая 36,8 г(3 Н, т, СН 3-этил); 1,33 (2 Н, м, циклогексан 4 СН 2); 1,95 и 2,65 (всего 4 Н, оба с, циклогексан 2,6-СН 2); 4,14 (2 Н, кв, СН 2-этил) и 5,69 (1 Н, с,=С-Н). Получение этил 3,3,5,5-тетраметилциклогексилацетата (8). Этил 3,3,5,5-тетраметилциклогексилиденацетат (7) (4,48 г, 20 ммоль) в этаноле (100 мл) гидрируют над 10% Pd/C (0,22 г, 5 вес.%) при давлении 10 атм в течение 18 ч. В результате фильтрования через Celitetm и упаривания получают 4,28 г (95%) соединения 8 в виде масла. 1(3 Н, т, J=7 Гц, СН 3-этил); 0,6-1,55 (7 Н, м, протоны кольца); 2,13 (2 Н, м, 2-СН 2); и 4,12 (2 Н, кв,J=7 Гц, СН 2-этил). Получение 2-метил-(3,3,5,5-тетраметилциклогексил)пропан-2-ола (9). Раствор этил 3,3,5,5-тетраметилциклогексилацетата (8) (2,26 г, 10 ммоль) в эфире (20 мл) добавляют по каплям к 2 М раствору метилмагниййодида в эфире (20 мл) в течение 15 мин при охлаждении ледяной водой. Полученную смесь кипятят с обратным холодильником в течение 2 ч, охлаждают и гасят насыщенным водным NH4Cl. После традиционной обработки продукт очищают на колонке с силикагелем,элюируя смесью гексан-этилацетат (20:1), получая 1,7 г (80%) соединения 9 в виде масла. 1(6 Н, с, -СН 3); 1,36 (2 Н, д, J=5 Гц, -СН 2-); 0,62,04 (8 Н, м, протоны кольца и ОН). Получение 2-метил-(3,3,5,5-тетраметилциклогексил)-пропил-2-азида (10). Эфират трехфтористого бора (0,77 г, 0,69 мл, 5,44 ммоль) добавляют по каплям к перемешиваемому раствору 2-метил-(3,3,5,5-тетраметилциклогексил)пропан-2-ола (9) (0,96 г, 4,53 ммоль) и триметилсилилазида (0,63 г, 0,72 мл,5,44 ммоль) в бензоле (10 мл). После перемешивания в течение 24 ч при комнатной температуре смесь выливают в воду (20 мл). Органическую фазу выделяют и промывают насыщенным водным бикарбонатом натрия (10 мл) и рассолом (10 мл). Полученный раствор сушат над сульфатом магния, фильтруют и концентрируют. Сырой продукт очищают на колонке с силикагелем, элюируя гексаном, получая 0,56 г 10 Получение 2-(3,3,5,5-тетраметилциклогексил)этанола (11). Раствор этил 3,3,5,5-тетраметилциклогексилацетата 8 (1,8 г, 8,0 ммоль) в эфире (30 мл) добавляют по каплям к перемешиваемой суспензии литийалюминийгидрида (0,9 г, 24,0 ммоль) в эфире (30 мл), которую охлаждают на бане со льдом. Реакционную смесь кипятят с обратным холодильником в течение 3 ч, охлаждают и оставшийся литийалюминийгидрид разрушают водой. Водный слой выделяют и дважды экстрагируют эфиром. Объединенные эфирные фазы промывают рассолом, сушат над сульфатом магния, фильтруют и упаривают. Сырой продукт очищают с помощью флэшхроматографии на силикагеле, элюируя смесью гексан-этилацетат (4:1), получая 1,2 г (79%) соединения 11 в виде масла. 1(1,1 г, 6,0 ммоль) и триэтиламина (1,2 г, 1,7 мл,12 ммоль) в бензоле (40 мл), при охлаждении в бане со льдом. Реакционную смесь перемешивают при комнатной температуре в течение 3 ч,затем фильтруют через короткую колонку с силикагелем, элюируя бензолом. В результате упаривания растворителя получают 1,48 г (94%) соединения 12 в виде масла. 1(2 Н, кв, J=7 Гц, 2-СН 2); 0,65-2,0 (7 Н, м, протоны кольца), 3,0 (3 Н, с, СН 3-SO2) и 4,29 (2 Н, т, J=7 Гц, СН 2 О). Получение 2-(3,3,5,5-тетраметилциклогексил)этилазида (13). Смесь азида натрия (2,27 г, 34,2 ммоль), 2(3,3,5,5-тетраметилциклогексил) этилметансульфоната (12) (1,46 г, 5,57 ммоль) и диметилсульфоксида (20 мл) перемешивают при комнатной температуре в течение 48 ч, разбавляют водой (50 мл) и экстрагируют эфиром (330 мл). Органическую фазу промывают рассолом(30 мл), сушат над сульфатом магния, фильтруют и упаривают. Сырой продукт очищают с помощью флэш-хроматографии на силикагеле,элюируя гексаном, и получая 0,93 г (80%) соединения 13 в виде масла. 1 Н ЯМР (CDCl3, ТМС)(мд): 0,87 и 0,99N-формил-1,3,3,5,5-пентаметилциклогексанамина (14-1). К интенсивно перемешиваемому раствору 1,3,3,5,5-пентаметилциклогексанола (3-13) (2,7 г, 15,6 ммоль) и триметилсилилцианида (2,36 г,23,8 ммоль) в уксусной кислоте (2,5 мл) в атмосфере аргона добавляют 98% серную кислоту(4,66 г, 47,6 ммоль), поддерживая температуру ниже -5 С. Полученную смесь перемешивают при комнатной температуре в течение 22 ч, затем выливают на лед (100 г), нейтрализуют 50% раствором NaOH до рН примерно 7, и экстрагируют эфиром (330 мл). Объединенные эфирные фазы промывают рассолом (50 мл), сушат над сульфатом магния и упаривают. Слегка желтый кристаллический остаток обрабатывают небольшим количеством ацетонитрила и отфильтровывают, получая 2,5 г (80%) соединения 14-1 в виде кристаллов белого цвета. Т. плавления 104-106 С. 1(2 Н, м, 2,6-СНэкв); 1,13 и 1,15 (всего 6 Н, оба с,3,5-СН 3 акс); 1,25 (2 Н, м, 4-CH2); 1,32 и 1,38 (всего 3 Н, оба с, 1-СН 3); 1,70 и 2,12 (всего 2 Н, оба д,14,7 Гц, 2,6-СНакс); 5,30 и 5,60 (всего 1 Н, оба шир с, NH); 8,05 и 8,30 (всего 1 Н, оба д, 2,0 и 12,7 Гц, соответственно, НСО). Получение N-ацетил-1,3,3,5,5-пентаметилциклогексамина (14-2). К интенсивно перемешиваемому раствору 1,3,3,5,5-пентаметилциклогексанола (3-13) (3,0 г, 17,65 ммоль) в ацетонитриле (20 мл) по каплям добавляют (6 мл) дымящейся НNO3, поддерживая при этом температуру ниже 45 С. Полученную смесь перемешивают при 45-50 С в течение 6 ч, затем ее охлаждают, выливают в воду (30 мл) и нейтрализуют водным NН 3. Водную фазу экстрагируют эфиром (330 мл). Объединенные эфирные фазы промывают рассолом (30 мл), сушат над сульфатом магния,фильтруют и упаривают. В результате кристаллизации сырого продукта из холодного ацетонитрила получают 2,23 г (60%) соединения 14-2 в виде кристаллов белого цвета. Т. плавления 110 С. 1(всего 12 Н, оба с, 3,5-СН 3); 1,33 (3 Н, с, 1-СН 3); 1,88 (3 Н, с, СН 3 С=O); 0,75-2,25 (6 Н, м, протоны кольца) и 5,3 (1 Н, шир с, NH). Получение N-метоксикарбонил-N,1,3,3,5,5 гексаметилциклогексанамина (15). Метилхлорформиат (0,97 г, 0,8 мл, 10,3 ммоль) добавляют в виде одной порции к суспензии гидрохлорида N,1,3,3,5,5-гексаметилциклогексанамина (5-20) (1,13 г, 5,13 ммоль) и карбоната натрия (1,63 г, 15,4 ммоль) в тетрагидрофуране (30 мл). Полученную смесь перемешивают при комнатной температуре в течение 6 ч, затем разбавляют водой (50 мл) и экстрагируют эфиром (330 мл). Объединенные 12 органические фазы промывают 10% K2SO4, рассолом, сушат над сульфатом магния, фильтруют и упаривают. Сырой продукт очищают с помощью флэш-хроматографии, элюируя смесью гексан-этилацет (6:1), и получая 0,90 г (78%) соединения 15 в виде масла. 1(1,93 г, 17 ммоль), уксусной кислоты (0,2 мл) и ацетата аммония (0,2 г) в бензоле (6,4 мл) кипятят с обратным холодильником в установке Дина-Старка в течение 10 ч. К этому добавляют бензол (30 мл) и рассол (30 мл), органический слой выделяют, сушат над сульфатом натрия,фильтруют и упаривают. Сырой продукт очищают с помощью флэш-хроматографии, элюируя гексаном и получая 2,0 г (50%) соединения 16 в виде масла. 1H ЯМР (CDCl3, ТМС)(мд): 1,01 (6 Н, с,3,5-СНэкв); 1,05 (6 Н, с, 3,5-СН 3 акс); 1,34 (3 Н, т,J=7 Гц, этил-СН 3); 1,42 (2 Н, с, 4-СН 2); 2,46 и 2,79 (всего 4 Н, оба с, 2,6-СН 2) и 4,29 (2 Н, кв, J=7 Гц, CH2 О). Получение этил (1,3,3,5,5-пентаметилциклогексил)цианоацетата (17). Безводный хлорид меди (1) (0,8 г, 8 ммоль) добавляют к охлажденному раствору алкилмагниййодида (полученному из магния (0,46 г, 19,2 ммоль) и йодометана (2,84 г, 20 ммоль в эфире(12 мл). Эту смесь перемешивают в инертной атмосфере в течение 5 мин и по каплям добавляют раствор этил(3,3,5,5-тетраметилциклогексилиден)цианоацетата (16) (2 г, 8 ммоль) в эфире (10 мл), поддерживая при этом температуру ниже -15 С. После завершения добавления кетона, реакционную смесь перемешивают в течение 3 ч и осторожно нейтрализуют насыщенным водным раствором NH4Cl. В результате традиционной обработки для реакций Гриньяра получают сырой материал, который разделяют на колонке с силикагелем, элюируя смесью петролейный эфир-этилацетат(0,05 г) и воды (0,15 мл) в ДМСО (2,5 мл) нагре 13 вают при 150-160 С в течение 4 ч. Раствор выливают в воду (70 мл) и экстрагируют эфиром (420 мл). Эфир промывают рассолом (250 мл),сушат над сульфатом натрия, фильтруют и упаривают. Сырой продукт очищают на колонке с силикагелем, элюируя смесью петролейный эфир-этилацетат (20:1), получая 0,66 г (94%) соединения 18 в виде масла. 1(3 Н, с, протоны кольца); 1,31 (3 Н, с, протоны кольца) и 2,31 (2 Н, с, CH2CN). ИК (чистый): CN=2242 см-1. Общий способ получения гидрохлоридов алкилциклогексанаминов 5-1 - 5-25. Раствор 4, 10 или 13-15, 18 в эфире добавляют по каплям к перемешиваемой суспензии литийалюминийгидрида (4 эквивалента) в эфире, который охлаждают на бане со льдом. Реакционную смесь перемешивают при комнатной температуре в случае соединений 4, 10, 13 или кипятят с обратным холодильником в случае 14,15, 18 до тех пор, пока не завершается превращение исходного материала (контроль с помощью ТСХ). Оставшийся литийалюминийгидрид разрушают водой, водный слой выделяют и дважды экстрагируют эфиром. Объединенные эфирные фазы промывают рассолом, сушат надNaOH, фильтруют и упаривают. Полученный амин обрабатывают НСl без характеризации. Приготавливают гидрохлорид амина, либо пропуская газообразный НСl через раствор амина в гексане, либо добавляя 1 н. раствор НСl в эфире к раствору амина. В обоих случаях растворитель удаляют после добавления НСl, остаток обрабатывают гексаном или ацетонитрилом, и кристаллический продукт отфильтровывают, получая соединения 5-1 - 5-25 превосходной степени чистоты. Физические свойства и выходы соединений 5-1 - 5-25 представлены в табл. 4. Результаты исследований 1H ЯМР соединений 5-1 - 5-25 представлены в табл. 5. Дополнительные 1-аминоалкилциклогексаны и их гидрохлориды получают таким же или аналогичным способом. Гидрохлориды можно превратить в свободные основания или в другие соли присоединения кислот, как раскрыто в "ACID ADDITION SALTS". 14 Получение гидрохлорида 3,3,5,5-тетраметилциклогексилметиламина (5-26). Раствор 1-нитрометил-3,3,5,5-тетраметилциклогекс-1-ена (6) (1,1 г, 5,63 ммоль) в смеси этанола (140 мл) и хлороформа (2,8 мл) гидрируют над 10% Pd/C (280 мг) при 5 атм в течение 20 ч, фильтруют и упаривают. Сырой продукт обрабатывают эфиром, фильтруют и промывают эфиром, получая 0,57 г (50%) амина 5-26. Физические свойства и выходы соединения 5-26 представлены в табл. 4. Результаты исследований 1H ЯМР соединения 5-26 представлены в табл. 5. Амин 5-27 получают известным специалистам способом [16]. Амин 5-28 [17] получают в соответствии с общим способом из соответствующего азида[18]. Все физические свойства находятся в хорошем соответствии с представленными данными [17]. Степень чистоты всех полученных соединений проверяли с помощью газовой хроматографии (MN-OV-1, 25 м 0,53 м, df=1,0 мкм, 50270 С (10 С/мин. Соли присоединения кислот В качестве кислот, пригодных для получения солей присоединения кислот в соответствии со способом настоящего изобретения, можно указать следующие из минеральных кислот: хлористо-водородную, бромисто-водородную,метансульфоновую, изотионовую, серную, фосфорную и сульфаминовую кислоты, а из органических кислот: уксусную, пропионовую, малеиновую, фумаровую, виннокаменную, лимонную, щавелевую и бензойную кислоты. Предпочтительными кислотами являются хлористоводородная, лимонная и малеиновая. При желании можно получить и другие фармацевтически приемлемые соли присоединения кислот, и одну соль присоединения кислоты можно превратить в другую, нейтрализуя одну соль, например хлористо-водородную, получая свободное основание, а затем снова окисляя другой выбранной минеральной или органической кислотой, получая другую фармацевтически приемлемую соль присоединения кислоты, как хорошо известно,специалистам. Спектры производных аминоциклогексана 5 Фармацевтические композиции Активные ингредиенты настоящего изобретения вместе с одним или более из обычных адъювантов, носителей или разбавителей, могут быть приготовлены в форме фармацевтических композиций и их единичных дозовых форм, и такие формы могут быть использованы в твердом виде, как таблетки в оболочке или без нее,или могут быть заполнены в капсулы, или могут быть в жидком виде, например в форме растворов, суспензий, эмульсий, элексиров, или в форме заполненных ими капсул, причем все предназначены для перорального введения; в форме суппозиториев или капсул для ректального введения, или в форме стерильных растворов, используемых для парентерального введения (включая внутривенное или подкожное). Такие фармацевтические композиции и их единичные дозовые формы могут включать обычные или новые ингредиенты в обычном или специальном количестве, с добавлением или без добавления дополнительных активных соединений или составных частей, и такие единичные дозовые формы могут содержать любое эффективное количество активного ингредиента, соответствующее предполагаемым интервалам дневной дозы. Таблетки, содержащие от двадцати (20) до ста (100) мг активного ингредиента или, в более общем случае, от десяти (10) до двухсот пятидесяти (250) мг в таблетке, могут служить подходящими примерами единичных дозовых форм. Способ лечения Благодаря своей высокой степени активности и низкой токсичности, наряду с наиболее благоприятными терапевтическими показателями, активные вещества настоящего изобретения можно вводить в организм нуждающегося в этом, например, животного (включая человека) для лечения улучшения, облегчения, временного облегчения, или исключения нежелательных симптомов или состояния, или представительных симптомов или состояний, указанных гделибо в этой заявке, предпочтительно параллельно, одновременно или вместе с одним или более из фармацевтически приемлемых эксципиентов, 25 носителей или разбавителей, особенно и предпочтительно в форме их фармацевтических композиций, любым из перорального, ректального или парентерального (включая внутривенный и подкожный) или в некоторых случаях даже поверхностного способа, в эффективном количестве. Подходящими дозовыми интервалами являются 1-1000 мг в день, предпочтительно 10-500 мг в день и особенно 50-500 мг в день, в зависимости от конкретного способа введения, вводимой формы, показаний, в связи с которыми назначен их прием, конкретного пациента и веса его тела, а также предпочтений и опыта врача или ветеринара. Примеры представительных фармацевтических композиций С помощью обычно используемых растворителей, вспомогательных агентов и носителей продукты реакции можно приготовить в виде таблеток, таблеток в оболочке, капсул, растворов в капельницах, суппозиториев, препаратов для инъекций и вливаний, и т.п., и можно использовать в терапии при пероральном, ректальном, парентеральном или других видах введения. Представительными фармацевтическими композициями являются следующие:a). Таблетки для перорального приема, которые содержат активный ингредиент, можно получить с помощью обычных методик таблетирования.b). Для получения суппозиториев можно использовать любое основание для суппозиториев для включения в них обычным способом активного ингредиента, такое основание, как полиэтиленгликоль, который является твердым веществом при нормальной комнатной температуре, но который расплавляется при температуре тела или около этого значения температуры.c). Для парентеральных (включая внутривенные и подкожные) стерильных растворов используют активные ингредиенты вместе с традиционными ингредиентами, в обычных количествах, такие как, например, хлорид натрия и дважды дистиллированную воду q.s., в соответствии с обычной процедурой, такой как фильтрование, заполнение в стерильных условиях в ампулы или флаконы для внутривенных вливаний, и обработка в автоклаве для стерилизации. Другие подходящие фармацевтические композиции будут очевидны специалистам. Нижеследующие примеры представлены только с целью иллюстрации, и никоим образом не являются ограничительными. Пример 1. Композиция для таблеток. Подходящей композицией для таблеток,содержащих 10 мг активного ингредиента, является следующая: Активный ингредиент Лактоза Микрокристаллическая целлюлоза Тальк 26 Стеарат магния Коллоидная двуокись кремния Пример 2. Композиция для таблеток. Другой подходящей композицией для таблеток, содержащих 100 мг активного ингредиента, является следующая: Активный ингредиент Картофельный крахмал Поливинилпирролидон Таблетки покрыты оболочкой и окрашены. Состав материала оболочки: Лактоза Микрокристаллическая целлюлоза Желатин Сшитый поливинилпирролидон Тальк Стеарат магния Коллоидная двуокись кремния Красящий пигмент Пример 3. Композиция для капсул. Подходящая композиция для капсул, содержащих 50 мг активного ингредиента, является следующей: Активный ингредиент Кукурузный крахмал Двухосновный фосфат кальция Тальк Коллоидная двуокись кремния Композицией заполняют желатиновые капсулы. Пример 4. Раствор для инъекций. Подходящей композицией для растворов для инъекций, содержащих 1% активного ингредиента, является следующая: Активный ингредиент Хлорид натрия Стерильная вода до 1 мл Пример 5. Жидкость для перорального приема. Подходящей композицией для 1 л жидкой смеси, содержащей 2 мг активного ингредиента в 1 мл смеси, является следующая: Активный ингредиент Сахароза Глюкоза Сорбит Оранжевый краситель Пример 6. Жидкость для перорального приема. Другой подходящей композицией для 1 л жидкой смеси, содержащей 20 мг активного ингредиента в 1 мл смеси, является следующая: Активный ингредиент Трагакант Глицерин Сахароза Метилпарабен 27 Пропилпарабен Вкусовой агент черной смородины Растворимый красный краситель Очищенная вода до Пример 7. Жидкость для перорального приема. Другой подходящей композицией для 1 л жидкой смеси, содержащей 2 мг активного ингредиента в 1 мл смеси, является следующая: Активный ингредиент 2 г Сахароза 400 г Горькая настойка апельсиновой кожуры 20 г Сладкая настойка апельсиновой кожуры 15 г Очищенная вода до 1000 мл Пример 8. Аэрозольная композиция 180 г аэрозольного раствора содержат: Активный ингредиент Олеиновая кислота Этанол Очищенная вода Тетрафторэтан 15 мл раствора заполняют в алюминиевые аэрозольные баллоны, закрывают дозирующим клапаном и создают давление 3,0 бар. Пример 9. 100 г раствора содержат: Активный ингредиент Этанол Пропиленгликоль Диметилсульфоксид Гидроксиэтилцеллюлоза Очищенная вода 1,8 мл раствора помещают на ткань с начесом, покрытую с обратной стороны липкой фольгой. Систему закрывают защитным слоем,который перед использованием удаляют. Пример 10. Композиция наночастиц. 10 г наночастиц полибутилцианоакрилата содержат: Активный ингредиент Полоксамер Бутилцианоакрилат Маннит Хлорид натрия Наночастицы полибутилцианоакрилата приготавливают эмульсионной полимеризацией в смеси вода/0,1 н. HCl/этанол в качестве полимеризационной среды. Затем наночастицы в суспензии лиофилизируют в вакууме. Фармакология - итоги Активные вещества настоящего изобретения, содержащие их фармацевтические композиции и способы лечения с их использованием,характеризуются уникальными преимуществами и непредсказуемыми свойствами, что делает"предмет изобретения в целом", как здесь заяв 28 лено, неочевидным. Соединения и их фармацевтические композиции продемонстрировали в стандартных принятых надежных тестовых процедурах следующие ценные свойства и характеристики. Они являются системно-активными, неконкурирующими антагонистами NMDA рецепторов с быстрой кинетикой блокирования/разблокирования и сильной зависимостью от напряжения и соответственно могут применяться для лечения, исключения, облегчения,временного облегчения, или улучшения реактивных состояний за счет нанесения или введения животному-хозяину для лечения широкого круга нарушений ЦНС, которые связаны с нарушением глутаматергической передачи. ФармакологияIn vitro Изучение связывания с рецепторами Самцов крыс штамма Sprague-Dawley (200250 г) обезглавливают, и их мозги быстро извлекают. Кору головного мозга отделяют и гомогенизируют в 20 объемах охлажденной льдом 0,32 М сахарозы, используя гомогенизатор, выполненный из стекла и тефлона. Гомогенат центрифугируют при 1000 г в течение 10 мин. Осадок удаляют, а надосадочную жидкость центрифугируют при 20000 г в течение 20 мин. Полученный осадок снова суспендируют в 20 объемах дистиллированной воды и центрифугируют в течение 20 мин при 8000 г. Затем надосадочную жидкость и желто-коричневую пленку центрифугируют трижды (48000 г в течение 20 мин) в присутствии 50 мМ Трис-HCl, рН 8,0. Все стадии центрифугирования осуществляют при 4 С. После нового суспендирования в 5 объемах 50 мМ Трис-HCl, рН 8,0 суспензию мембран быстро замораживают при -80 С. В день анализа мембраны оттаивают и промывают четыре раза путем нового суспендирования в 50 мМ Трис-HCl, рН 8,0 и центрифугирования при 48000 г в течение 20 мин. Последний осадок суспендируют в аналитическом буфере. Количество протеина в последнем препарате мембран определяют способом Lowry с некоторыми модификациями. Конечная концентрация протеина, которую используют для других исследований, составляет 250-500 мкг/мл. Мембраны снова суспендируют и инкубируют в 50 мМ Трис-HCl, рН 8,0. Инкубирование начинают, добавляя [3 Н]-(+)-МК-801 (23,9 Кюри/ммоль, 5 нМ) в ампулы, содержащие глицин(10 мкМ), глутамат (10 мкМ) и 0,1-0,25 мг протеина (полный объем 0,5 мл) и различные концентрации тестируемых агентов (10 концентраций с дублированием). Инкубирование продолжают при комнатной температуре в течение 120 мин, причем равновесие всегда достигается в условиях использования. Неспецифическое связывание определяют, добавляя немеченый МК 801 (10 мкМ). Инкубирование заканчивают, используя систему фильтра Millipore. Образцы 29 трижды промывают 2,5 мл охлажденного льдом аналитического буфера над фильтрами из стекловолокна, полученными от SchleicherSchuell. Фильтрование осуществляют насколько это возможно быстро. После выделения и промывки фильтры помещают в сцинтиллирующую жидкость (5 мл, Ultima Gold), и определяют удержанную на фильтрах радиоактивность с помощью обычного жидкостного сцинтилляционного счетчика (Hewlett Packard, Liquid Scincillation Analyser).Patch Clamp Гиппокамп получают из эмбрионов крыс(Е 20-Е 21), и затем переносят в буферированный солевой раствор Хенка, не содержащий кальция и магния (Gibco) на льду. Клетки механически диссоциируют в смеси 0,05% ДНКаза/0,3% овомукоид (Sigma) с последующим 8-минутным преинкубированием со смесью 0,66% трипсин/0,1% ДНКаза (Sigma). Диссоциированные клетки затем центрифугируют при 18 г в течение 10 мин, снова суспендируют в минимальной необходимой питательной среде(Gibco) и высевают при плотности 150000 кл/см 2 в пластиковые чашки Петри (Falcon) предварительно покрытые поли-L-лизиномNaHCO3/HEPES-бyфepиpoвaннoй минимальной необходимой среде, дополненной 5% фетальной телячьей сывороткой и 5% лошадиной сывороткой (Gibco), и инкубируют при 37 С и 95% влажности. Среду полностью заменяют с последующим ингибированием дальнейшего глиального митоза с помощью цитозинDарабинофуранозида (20 мкМ Sigma) после примерно 7 дней in vitro. После этого среду заменяют частично дважды в неделю. Регистрацию Patch Clamp осуществляют с этих нейронов с помощью полированных стеклянных электродов (4-6 m) по типу целых клеток при комнатной температуре (20-22 С) с помощью усилителя ЕРС-7 (List). Тестовые вещества наносят, переключая каналы традиционной системы быстрого Superfusion с обычным вытекающим потоком (время замены 10-20 мс). Содержание внутриклеточного раствора было следующим (мМ): CsCl (120), TEACI (20), EGTA(2), cAMP (0,25); рН устанавливают 7,3 с помощью CsOH или НСl. Внеклеточные растворы имели следующий основной состав (мМ): NaCl(10), сахароза (4,5), тетродотоксин (ТТХ 310-4). Во всех растворах присутствует глицин (1 мкМ): концентрация достаточная для того, чтобы вызвать примерно 80-85% активации рецепторов глицинаB. Для включения в конечный анализ принимали лишь значения для стабильных клеток, т.е. после проявления реакций наNMDA, по крайней мере, как 75% их подавления тестируемыми антагонистами. 30 Экситотоксичность. Кортикальные нейроны получают из коры мозга 17/18 дневных - фетальных крыс (Wistar),в основном в соответствии с процедурой диссоциации, описанной в [23]. После непродолжительной трипсинизации и осторожного тщательного растирания отполированными огнем пастеровскими пипетками, клеточную суспензию промывают центрифугированием. Клетки суспендируют в несодержащей сыворотки Neurobasal среде, дополненной В 27 (Gibco), перед высеванием на 96-ячеечные планшеты, покрытые поли-L-лизином (Sigma; 0,2 мг/мл, 20 ч,4 С) и ламинином (Sigma; 2 мкг/мл, 1 ч, 37 С)(Falcon, Primaria) при плотности 5104 клеток/ячейку. Кортикальные нейроны поддерживают при 37 С в увлажненной смеси 10% СO2/90% воздух. Через день после высева в каждую ячейку добавляют 5 мкм цитозинDарабинофуранозида (Sigma) для ингибирования пролиферации глиальных клеток. Среду заменяют вначале после 4 дней in vitro, а затем каждые 4 дня, заменяя 2/3 среды астроциткондиционированной средой. Кортикальные нейроны на 12-14 день культивирования используют для экспериментов. Астроциты новорожденных крыс выделяют не ферментативно в соответствии со способом [24]. Короче, обе полусферы иссекают у двухдневных крыс, пропускают через 80 мкм сетку и тщательно растирают пастеровскими пипетками. Клеточную суспензию приготавливают в модифицированной необходимой среде Дюльбекко (DMEM, Gibco), дополненной 10% фетальной телячьей сывороткой (FCS, Нуclone), 2 мМ глутамина (Gibco) и 50 мкг/мл гентамицина, и переносят в необработанные пластиковые культуральные колбы (Corning; 75 см 3). Через два дня после посева колбы встряхивают в течение 10 мин на вращающейся платформе (150 качаний/мин) для удаления микроглиальных клеток. Культуры выращивают до конфлюэнтности в течение 14 дней, а культуральную среду заменяют дважды в неделю. После этого глиальные монослои интенсивно промывают не содержащей сыворотки Neurobasal средой (Gibco) для удаления сыворотки. Затем колбы встряхивают несколько раз для удаления олигодендроцитов и нейронов. Для получения кондиционной среды для первичных астроцитов культуры инкубируют со свежей Neurobasal средой (Gibco), дополненной В 27 и глутамином. Каждые 2-3 дня кондиционную среду собирают и заменяют свежей вплоть до 4 раз. Экспонирование ЕАА осуществляют в не содержащей сыворотки Neurobasal среде(Gibco), содержащей 100 мкМ глутамата и подлежащее тестированию лекарство. После 20 ч инкубирования исследуют морфологически цитотоксическое действие с помощью микроскопа с контрастной фазой, и биохимически опреде 31 ляют количественно, измеряя жизнеспособность клеток с помощью МТТ теста (Promega). В этом колориметрическом анализе измеряют восстановление тетразолиевой компоненты (МТТ) в нерастворимый формазановый продукт миохондриями живых клеток, после инкубирования кортикальных нейронов с раствором красителя в течение примерно 1-4 ч, солюбилизационный раствор добавляют для осуществления лизиса клеток и солюбилизации окрашенного продукта(инкубирование в течение ночи при 37 С, 10%CO2, 90% относительная влажность). Затем эти образцы считывают, используя устройство для считывания с пластин (Elisa plate reader, Thermomax, MWG Biotech) на длине волны 570 нм. Интенсивность полученной в результате окраски прямо пропорциональна количеству жизнеспособных клеток.In vivo Противосудорожная активность. Самок мышей штамма NMR (18-28 г) помещают по 5 в клетку и используют в тестах максимального электрошока (MES) и ухудшения движения. Всем животным дают достаточно воды и пищи при 12 часовом цикле светтемнота (освещение включают в 6 утра) и при контролируемой температуре (200,5 С). Все эксперименты проводят между 10 и 17 ч. Тестируемые агенты инъектируют внутрибрюшинно за 30 мин до того, как вызывают конвульсии,если нет других указаний (см. далее). Все соединения растворяют в 0,9% физиологическом растворе. Тест MES проводят вместе с тестами для миорелаксантных действий (рефлекс сокращения мышц) и координации моторики (rоtarod). Для тестирования мышей в отношении рефлекса сокращения мышц их помещают передними лапами на горизонтальный брусок и требуют поместить все 4 лапы на проволоку в течение 10 с. Для тестирования анаксии (координация движений) мышей помещают на вращающийся брусок (5 об./мин) и необходимо, чтобы они оставались на бруске в течение 1 мин. Если только мышь не достигает этого критерия во всех трех повторах каждого теста, считают, что это проявление миорелаксации или атаксии,соответственно. После этих тестов проводятMES (100 Гц, 0,5 с длительность шока, 50 мА интенсивность тока, 0,9 мс длительность импульса, Ugo Basile), что осуществляют через электроды, расположенные в коре. Подсчитывают наличие тонических спазмов (тоническое удлинение задних лап при минимальном угле по отношению к телу 90). Целью является получение ED50 для всех оцениваемых параметровLitchfield Wicoxon для определения реакций на различные дозы. Отношение ED50 для побочных эффектов (атаксия или миорелаксация) к ED50 для антагонизма в отношении электрошоковых 32 судорог используют как терапевтический показатель (TI). Статистический анализ. ИК 50 для patch clamp рассчитывают в соответствии с четырехпараметрическим логистическим уравнением, используя компьютерную программу Grafit (Erithacus Software, England). Величину Ki для исследований связывания определяют затем в соответствии со способомCheng и Prusoff. Представленные значения связывания представляют собой среднее СКО(среднеквадратичная ошибка) для 3-5 измерений (каждое осуществляют дважды). 4-7 доз антагонистов тестируют в каждом из in vivo тестов (по 5-8 животных для одной дозы), чтобы обеспечить вычисление прогрессивных ED50 в соответствии с пробит-анализом(Litchfield и Wilcoxon) с поправкой для 0-100% эффектов. ED50 представлены с доверительными пределами 95% (ДП). Моментальный корреляционный анализ Pearson (Sigma Stat, Jandel Scientific) используют для сравнения in vitro эффективностей и in vivo противосудорожной активности. Результаты Связывание. Все циклогексаны демонстрируют [3 Н]-(+)МК-801 связывание с кортикальными мембранами крыс с ИК 50 от 4 до 150 мкМ, причем величины Кi по оценке с помощью уравненияPatch Clamp. Реакции равновесного направленного внутрь тока культивируемых нейронов гиппокампа на NMDA (200 мкМ с глицином 1 мкМ при 70 мВ) антагонизируют тестируемыми циклогексанами с ИК 50 1,3-99 мкМ (табл. 7). Пиковые и равновесные токи подвергались изменениям в некоторой степени, что делает маловероятным предположение, что их эффекты опосредствованы по сайту глицинаB. Значительная поддержка предположения о неконкурентном характере такого антагонизма обеспечивается отчетливой зависимостью их блокады от расхода и напряжения. Более слабые антагонисты демонстрируют более быструю кинетику и более сильную зависимость от напряжения. Экситотоксичность. Низкие мкМ концентрации большинства циклогексанов оказались эффективными нейропротекторами in vitro, причем Mrz 2/579, повидимому, является наиболее эффективным в этом отношении (см. табл. 7). Большинство соединений обеспечивают полную защиту при 20 мкМ.In vivo. Противосудорожная активность. Все производные циклогексана ингибируют MES-индуцированные судороги у мышей сED50 в интервале от 3,6 до 50 мг/кг внутрибрюшинно (табл. 7). Выбранные соединения тести 33 ровали также в отношении PTZ- и NMDAиндуцируемых судорог (см. [20, 21] относительно методик), и они демонстрируют сравнительную эффективность в MES тесте (например,Mrz 2/579 имеет ED50 в PTZ- и NMDA-тестах 5,5 и 3,7 мг/кг, соответственно). Их противосудорожная эффективность повышается после внутривенного введения (например, для Mrz 2/579ED50 составляет 2,5 мг/кг). Mrz 2/579 оказывается также эффективным в результате подкожных инъекций и несколько менее эффективным при пероральном введении (ED50 4,6 и 13,7 мг/кг,соответственно). При дозах в интервале значений, обеспечивающих противосудорожное действие, для некоторых циклогексанов наблюда 002254(тест с вращающимся бруском). Для большинства из них летальность не наблюдается вплоть до значений 50 мг/кг. Корреляционный анализ. Наблюдается хорошая перекрестная корреляция между всеми тремя in vitro анализами(все коэффициенты корреляции 0,70, р 0,001). Наблюдается также хорошая корреляция между эффективностями антагонизацииNMDAиндуцированных направленных внутрь токов и защитой против NMDA-индуцированной токсичности in vitro при противосудорожной активности in vivo (коэффициент корреляции 0,56, р 0,01). Таблица 7 35 Влияние производных циклогексана и стандартных неконкурирующих антагонистовNMDA рецепторов на [3H]-(+)-МК-801 связывание, NMDA индуцированные токи в Patch Clamp экспериментах, токсичность глутамата в культивируемых кортикальных нейронах и MESсудороги in vivo. Величины связывания Ki являются средними СКО для 3-5 экспериментов. ИК 50 (СКО) в экспериментах для Patch Clamp и глутаматной токсичности определяют из результатов для, по крайней мере, 3 концентраций, обеспечивающих 15-85% ингибирования,и, по крайней мере, 5 ячеек для каждой из концентраций. Для MES-индуцируемых судорог значениями являются ED50 в мг/кг (95% доверительные пределы указаны в скобках). Кроме того, благодаря, по крайней мере,частично, их аминному заместителю, соединения настоящего изобретения являются также эффективными при не-NMDA показаниях, демонстрируя иммуномодуляторную активность и активность против гепатита С. В заключение, из вышеизложенного очевидно следует, что в настоящем изобретении предложены новые, ценные и непредсказуемые применения и использования соединений настоящего изобретения, причем эти соединения включают активные агенты настоящего изобретения, а также их новые фармацевтические композиции и способы их получения и лечения ими, причем все они обладают вышеизложенными специфическими перечисленными характеристиками и преимуществами. Высокий порядок активности активного агента настоящего изобретения и его композиций, что доказано изложенными тестами, является показателем применимости, основанной на его ценной активности для людей, а также для низших животных. Однако клинические испытания для людей еще не завершены. Следует хорошо понимать, что распространение и маркетинг любого из соединений или композиций,попадающих в объем настоящего изобретения для использования на пациентах, должно быть основано на предварительном разрешении правительственных учреждений, таких как Федеральное управление пищевых и лекарственных продуктов США, которые отвечают за это и разрешают такие вопросы. Выводы. Представленные 1-аминоалкилциклогексаны представляют новый класс системноактивных неконкурирующих антагонистовNMDA рецепторов с быстрой кинетикой блокирования/разблокирования и сильной зависимостью от напряжения. С учетом их относительно низкой эффективности и соответствующей быстрой кинетики, их можно использовать как терапевтические агенты при широком круге нарушений ЦНС, которые включают нарушение глутаматергической передачи. 36 Соответственно, эти соединения находят применение для лечения следующих нарушений у животных, особенно у людей. 1. Острая экситотоксичность, такая как ишемия при ударе,травме, гипоксии, гипогликемии и гепатической энцефалопатии. 2. Хронические нейродегенеративные заболевания, такие как болезнь Aльцгеймера, сосудистая деменция, болезнь Паркинсона, болезнь Хантингтона, рассеянный склероз,боковой амиотрофический склероз, AIDSнейродегенерация,оливопонтоцеребелларная атрофия, синдром Тоуретта, двигательное нейронное заболевание, митохондриальная дисфункция,синдром Корсакова,болезньCreutzfeldt-Jakob. 3. Другие нарушения, связанные с длительными пластическими нарушениями центральной нервной системы, такими как хроническая боль, толерантность к лекарствам,зависимость и наркомания (например, опоиды,кокаин, бензодиазепины и спирт). 4. Эпилепсия,старческая дискинезия, шизофрения, беспокойство, депрессия, острая боль, спастичность и шум в ушах. 5. Кроме того, как уже было указано, благодаря, по крайней мере, частично, их аминному заместителю, соединения настоящего изобретения являются также эффективными при не-NMDA показаниях, демонстрируя иммуномодуляторную активность, противомалярийную эффективность, активность против вируса Воrnа, и активность против гепатита С. Следует понимать, что настоящее изобретение не следует ограничивать точными подробностями манипуляций, или конкретными композициями, способами, процедурами или представленными и описанными вариантами,так как очевидные модификации и эквиваленты будут ясны специалистам, и поэтому настоящее изобретение должно быть ограничено только полным объемом, который законно соответствует прилагаемым пунктам изобретения. Ссылки 1. R.L. Frank, H.K. Hall (1950) J. Am. Chem. где R представляет -(CH2)n-(CR6R7)m-NR8R9,где n+m=0, 1 или 2; где R1-R9 независимо выбирают из водорода,C1-6 алкила, причем, по крайней мере, R1, R4 и R5 представляют C1-6 алкил,и его фармацевтически приемлемых солей,при условии, что указанное соединение 1 аминоалкилциклогексана не является 1 метиламино-1,3,3,5-тетраметилциклогексаном. 2. Соединение по п.1, где R1-R5 представляют метил. 3. Соединение по п.1, где R1 представляет этил. 4. Соединение по п.1, где R2 представляет этил. 5. Соединение по п.1, где R3 представляет этил. 6. Соединение по п.1, где R4 представляет этил. 38 7. Соединение по п.1, где R5 представляет этил. 8. Соединение по п.1, где R5 представляет пропил. 9. Соединение по п.1, где R6 или R7 представляет метил. 10. Соединение по п.1, где R6 или R7 представляет этил. 11. Соединение по п.1, где соединение выбирают из группы, состоящей из 1-амино-1,3,3,5,5-пентаметилциклогексана,1-амино-1,3,5,5-тетраметил-3-этилциклогексана,1-амино-1,5,5-триметил-3,3-диэтилциклогексана,1-амино-1,5,5-триметил-цис-3-этилциклогексана,1-амино-1,5,5-триметил-транс-3-этилциклогексана,1-амино-1-этил-3,3,5,5-тетраметилциклогексана,1-амино-1-пропил-3,3,5,5-тетраметилциклогексана,N-метил-1-амино-1,3,3,5,5-пентаметилциклогексана иN-этил-1-амино-1,3,3,5,5-пентаметилциклогексана, и фармацевтически приемлемых солей любого из вышеперечисленных. 12. Способ облегчения состояний, которые могут быть улучшены введением антагонистаNMDA рецепторов, проявляющим, в частности иммуномодуляторную или противомалярийную активности, а также активность против вируса Воrnа или против гепатита С, включающий введение животному эффективного количества производного 1-аминоалкилциклогексана, выбранного из соединений формулы где R представляет -(CH2)n-(CR6R7)m-NR8R9,где n+m=0, 1 или 2; где R1-R9 независимо выбирают из водорода и С 1-6 алкила, и его фармацевтически приемлемых солей. 13. Способ по п.12, где R1-R5 представляют метил. 14. Способ по п.12, где R1 представляет этил. 15. Способ по п.12, где R2 представляет этил. 16. Способ по п.12, где R3 представляет этил. 17. Способ по п.12, где R4 представляет этил. 18. Способ по п.12, где R5 представляет этил. 19. Способ по п.12, где R5 представляет пропил. 20. Способ по п.12, где R6 или R7 представляет метил. 21. Способ по п.12, где R6 или R7 представляет этил. 22.Способ по п.12, где соединение выбирают из группы, состоящей из 1-амино-1,3,3,5,5-пентаметилциклогексана,1-амино-1,3,5,5-тетраметил-3-этилциклогексана,1-амино-1,5,5-триметил-3,3-диэтилциклогексана,1-амино-1,5,5-триметил-цис-3-этилциклогексана,1-амино-1,5,5-триметил-транс-3-этилциклогексана,1-амино-1-этил-3,3,5,5-тетраметилциклогексана,1-амино-1-пропил-3,3,5,5-тетраметилциклогексана,N-метил-1-амино-1,3,3,5,5-пентаметилциклогексана иN-этил-1-амино-1,3,3,5,5-пентаметилциклогексана, и фармацевтически приемлемых солей любого из вышеперечисленных. 23. Способ по п.12, при котором соединение вводят в форме фармацевтической композиции, включающей это соединение в комбинации с одним или более фармацевтически приемлемыми разбавителями, эксципиентами или носителями. 24. Фармацевтическая композиция, включающая антагонистически эффективное в отношении NMDA рецепторов или иммуномодуляторное, противомалярийное, противовирусное в отношении вируса Воrnа или гепатита С количество производного 1-аминоалкилциклогексана, выбранного из соединений формулы 40 где R1-R9 независимо выбирают из водорода и С 1-6 алкила, причем, по крайней мере, R1, R4 и R5 представляют С 1-6 алкил, и его фармацевтически приемлемых солей, в сочетании с одним или более фармацевтически приемлемыми разбавителями, эксципиентами или носителями. 25. Фармацевтическая композиция по п.24,где R1-R5 представляют метил. 26. Фармацевтическая композиция по п.24,где R1 представляет этил. 27. Фармацевтическая композиция по п.24,где R2 представляет этил. 28. Фармацевтическая композиция по п.24,где R3 представляет этил. 29. Фармацевтическая композиция по п.24,где R4 представляет этил. 30. Фармацевтическая композиция по п.24,где R5 представляет этил. 31. Фармацевтическая композиция по п.24,где R5 представляет пропил. 32. Фармацевтическая композиция по п.24,где R6 или R7 представляет метил. 33. Фармацевтическая композиция по п.24,где R6 или R7 представляет этил. 34. Фармацевтическая композиция по п.24,где соединение выбирают из группы, состоящей из 1-амино-1,3,3,5,5-пентаметилциклогексана,1-амино-1,3,5,5-тетраметил-3-этилциклогексана,1-амино-1,5,5-триметил-3,3-диэтилциклогексана,1-амино-1,5,5-триметил-цис-3-этилциклогексана,1-амино-1,5,5-триметил-транс-3-этилциклогексана,1-амино-1-этил-3,3,5,5-тетраметилциклогексана,1-амино-1-пропил-3,3,5,5-тетраметилциклогексана,N-метил-1-амино-1,3,3,5,5-пентаметилциклогексана иN-этил-1-амино-1,3,3,5,5-пентаметилциклогексана, и фармацевтически приемлемых солей любого из вышеперечисленных.
МПК / Метки
МПК: A61K 31/131, C07C 211/35, A61P 25/00
Метки: антагонисты, рецепторов, 1-аминоалкилциклогексановые
Код ссылки
<a href="https://eas.patents.su/21-2254-1-aminoalkilciklogeksanovye-antagonisty-receptorov-nmda.html" rel="bookmark" title="База патентов Евразийского Союза">1-аминоалкилциклогексановые антагонисты рецепторов nmda</a>
Предыдущий патент: Вагонные весы
Следующий патент: Водные аэрозольные препараты, содержащие биологически активные макромолекулы, и способ получения соответствующих аэрозолей
Случайный патент: Способ предстерилизации асептического танка и соединительных труб