Производные имидазола, композиции и их применение в терапии
Номер патента: 15783
Опубликовано: 30.12.2011
Авторы: Кимболл Дэвид С., Карсон Кеннет Г., Багданофф Джеффри, Оджери Дэвид Дж., Джессоп Теодор К., Ботеджу Лакмал У.
Формула / Реферат
1. Соединение формулы
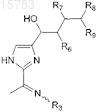
или его фармацевтически приемлемая соль, где R3является OR3a, NHC(O)R3a, NHSO2R3A или водородом; и каждый R3Aявляется независимо водородом или необязательно замещенным алкилом, арилом, алкиларилом, арилалкилом, гетероалкилом, гетероциклом, алкилгетероциклом или гетероциклоалкилом, где алкильный фрагмент включает 1-4 атома углерода, и термин "необязательно замещенный" означает один или более заместителей, выбранных из амино и галогена; R6является OR6Aили OC(O)R6A; R7является OR7a или OC(O)R7A; R8является OR8Aили OC(O)R8A;
R9 является водородом, CH2OR9A или СН2ОС(О)R9A; и каждый из R6A, R7A, R8A и R9a независимо друг от друга представляют собой водород или С1-4алкил.
2. Соединение по п.1, в котором R3 является OR3A.
3. Соединение по п.1, в котором R3 является NHC(O)R3A.
4. Соединение по п.1, в котором R3 является NHSO2R3A.
5. Соединение по пп.2, 3 или 4, в котором R3Aявляется водородом или С1-4алкилом.
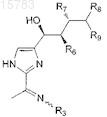
6. Соединение по п.1, которое имеет формулу

7. Соединение по п.1, которое имеет формулу
8. Соединение по п.7, которое имеет формулу
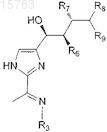
9. Соединение по п.7, в котором R3 является OR3A.
10. Соединение по п.7, в котором R3 является NHC(O)R3A.
11. Соединение по п.7, в котором R3 является NHSO2R3A.
12. Соединение по пп.9, 10 или 11, в котором R3a является водородом или С1-4алкилом.
13. Соединение формулы

или его фармацевтически приемлемая соль, где
R3 является водородом, OR3A, NHC(O)R3A или NHSO2R3A;
R9 является водородом или СН2ОН; и каждый R3A является независимо водородом или С1-4алкилом.
14. Соединение по п.13, которое имеет формулу
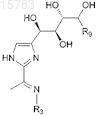
15. Соединение по п.13, в котором R3 является OR3A.
16. Соединение по п.15, в котором R3Aявляется водородом.
17. Соединение или его фармацевтически приемлемая соль, причем этим соединением является
(E)-1-(4-((1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1Н-имидазол-2-ил)этаноноксим.
18. Фармацевтическая композиция, содержащая соединение по пп.1, 13 или 17 и фармацевтически приемлемый эксципиент или разбавитель.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента Изобретение относится к производным имидазола и содержащим их фармацевтическим композициям. Соединения настоящего изобретения используют для лечения, предупреждения и контролирования воспалительных и аутоиммунных заболеваний и расстройств. Конкретные соединения имеют формулу (I). 015783 По данной заявке испрашивается приоритет на основании заявки на патент США 11/698253 от 25 января 2007 г. и предварительных заявок на патенты США 60/776473 от 24 февраля 2006 г. и 60/815221 от 20 июня 2006 г., которые включены сюда в качестве ссылок. 1. Область техники, к которой относится изобретение Это изобретение относится к соединениям на основе имидазола и способам их применения для лечения, предупреждения и контролирования различных заболеваний и расстройств. 2. Предпосылки создания изобретения Сфингозин-1-фосфат (S1P) является биоактивной молекулой с сильными эффектами в различных системах органов (Saba, J.D. и Н 1 а, Т. Circ. Res. 94:724-734 (2004. Хотя некоторые полагают, что это соединение является внутриклеточным вторичным мессенджером, способ его действия все еще остается предметом дискуссий (см. там же). Даже его метаболизм изучен недостаточно (Hla, Т., Science 309:16823 (2005. В настоящее время исследователи полагают, что S1P образуется при фосфорилировании сфингозина и разлагается посредством дефосфорилирования или расщепления. По опубликованным данным,его расщепление на этаноламин и длинноцепочечный альдегид катализирует S1P-лиаза (см. там же и уPynePyne, Biochem J. 349:385-402 (2000. Сфингозин-1-фосфат-лиаза является витамин-В 6-зависимым ферментом, локализованным в мембране эндоплазматической сети (Van Veldhoven и Mannaerts, J. Biol. Chem. 266:12502-12507 (1991); VanVeldhoven и Mannaerts, Adv. Lipid. Res. 26:69 (1993. Полинуклеотидная и аминокислотная последовательности человеческой S1P-лиазы и продукты ее гена описаны в РСТ-заявке на патентWO 99/16888. Недавно Schwab с сотрудниками пришли к выводу, что компонент III жженого сахара, 2-ацетил-4 тетрагидроксибутилимидазол (THI), ингибирует активность S1P-лиазы при введении мышам (Schwab, S.et al., Science 309:1735-1739 (2005. Хотя другие исследователи утверждали, что THI осуществляет свои эффекты по другому механизму (см., например, Pyne, S. G., ACGC Chem. Res. Comm. 11:108-112 (2000,ясно, что введение этого соединения крысам и мышам индуцирует лимфопению и является причиной накопления зрелых Т-клеток в тимусе. См., например, Schwab, вышеупомянутую публикацию; Pyne, S.Halweg, K. М. и Blchi, G., J. Org. Chem. 50:1134-1136 (1985); Патент США 4567194, выданный Kroeplien и Rosdorfer. Однако все еще не было сообщений о том, что THI вызывает иммунологический эффект и у других животных (кроме мышей и крыс). Хотя в патенте США 4567194 сообщается, что THI и некоторые родственные соединения могут быть полезными в качестве медицинских иммунодепрессантов, исследования этого соединения на людях не выявили никаких иммунологических эффектов. См.(9) :749-757 (1992). 3. Сущность изобретения Настоящее изобретение относится к соединениям формулы I или его фармацевтически приемлемая соль, где R3 является OR3A, NHC(O)R3A, NHSO2R3A или водородом; и каждый R3A является независимо водородом или необязательно замещенным алкилом, арилом,алкиларилом, арилалкилом, гетероалкилом, гетероциклом, алкилгетероциклом или гетероциклоалкилом,где алкильный фрагмент включает 1-4 атома углерода, и термин "необязательно замещенный" означает один или более заместителей, выбранных из амино и галогена;R9 является водородом, CH2OR9A или CH2OC(O)R9A; и каждый из R6A, R7A, R8A и R9A независимо друг от друга представляют собой водород или С 1-4 алкил. Это изобретение также охватывает фармацевтические композиции, содержащие соединение формулы I. 4. Краткое описание фигур Определенные аспекты этого изобретения могут быть поняты при обращении к следующим фигурам: фиг. 1 представляет типичную точечную диаграмму, полученную методом FACS (флуоресцентноактивированная сортировка клеток) и показывающую воздействие на состав Т-клеток (CD4+ и CD8+) тимуса в контрольном примере с наполнителем (VC), в случае соединения этого изобретения (соединение 1) и в случае THI, а также средние значения и стандартные отклонения для всех мышей (n = 3);-1 015783 фиг. 2 представляет типичную точечную диаграмму, показывающую воздействие на субпопуляцию клеток CD4+ (недавно вышедших из тимуса) у мышей в контрольном примере с наполнителем (VC), в случае соединения этого изобретения (соединение 1) и в случае THI; фиг. 3 представляет типичную точечную диаграмму, полученную методом FACS, показывающую воздействие на субпопуляцию клеток CD8+ (недавно вышедших из тимуса) у мышей в контрольном примере с наполнителем (VC), в случае соединения этого изобретения (соединение 1) и в случае THI; фиг. 4 показывает воздействие на содержание форменных элементов в цельной крови мышей в контрольном примере с наполнителем, в случае THI, в случае соединения 1 и соединение 2; фиг. 5 показывает действие однократной пероральной дозы соединения этого изобретения на артрит у мышей, индуцированный коллагеном; фиг. 6 показывает действие однократной пероральной дозы соединения этого изобретения на содержание лейкоцитов и лимфоцитов в крови яванских макак. 5. Подробное описание Настоящее изобретение является результатом исследований мышей с разрушенным геном S1Pлиазы и в основном относится к соединениям, предположительно полезным для лечения, предупреждения и контролирования аутоиммунных и воспалительных заболеваний и расстройств. 5.1. Определения. Если не указано иначе, термин "алкенил" означает углеводород с прямой или разветвленной цепью,или циклический углеводород, имеющий от 2 до 20 (например, от 2 до 10 или от 2 до 6) атомов углерода и по меньшей мере одну двойную углерод-углеродную связь. Репрезентативные алкенильные группы включают винил, аллил, 1-бутенил, 2-бутенил, изобутиленил, 1-пентенил, 2-пентенил, 3-метил-1 бутенил, 2-метил-2-бутенил, 2,3-диметил-2-бутенил, 1-гексенил, 2-гексенил, 3-гексенил, 1-гептенил, 2 гептенил, 3-гептенил, 1-октенил, 2-октенил, 3-октенил, 1-ноненил, 2-ноненил, 3-ноненил, 1-деценил, 2 деценил и 3-деценил. Если не указано иначе, термин "алкил" означает углеводород с прямой или разветвленной цепью,или циклический ("циклоалкил") углеводород, имеющий от 1 до 20 (например, от 1 до 10 или от 1 до 4) атомов углерода. Алкильные группы, имеющие от 1 до 4 атомов углерода, называют "низшим алкилом". Примеры алкильных групп включают, но не ограничиваются ими, метил, этил, пропил, изопропил, нбутил, трет-бутил, изобутил, пентил, гексил, изогексил, гептил, 4,4-диметилпентил, октил, 2,2,4 триметилпентил, нонил, децил, ундецил и додецил. Циклоалкильные группы могут быть моноциклическими или мультициклическими, а их примеры включают циклопропил, циклобутил, циклопентил, циклогексил и адамантил. Дополнительные примеры алкильных групп имеют линейные, разветвленные и/или циклические части (например, 1-этил-4-метил-циклогексил). Термин "алкил" включает насыщенные углеводороды, а также алкенильные и алкинильные группы. Если не указано иначе, термин "алкиларил" или "алкил-арил" означает алкильную группу, связанную с арильной группой. Если не указано иначе, термин "алкилгетероарил" или "алкилгетероарил" означает алкильную группу, связанную с гетероарильной группой. Если не указано иначе, термин "алкилгетероцикл" или "алкилгетероцикл" означает алкильную группу, связанную с гетероциклической группой. Если не указано иначе, термин "алкинил" означает углеводород с прямой или разветвленной цепью,или циклический углеводород, имеющий от 2 до 20 (например, от 2 до 20 или от 2 до 6) атомов углерода и включающий одну или более тройных углерод-углеродных связей. Репрезентативные алкинильные группы включают ацетиленил, пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1 бутинил, 4-пентинил, 1-гексинил, 2-гексинил, 5-гексинил, 1-гептинил, 2-гептинил, 6-гептинил, 1 октитил, 2-октинил, 7-октинил, 1-нонинил, 2-нонинил, 8-нонинил, 1-децинил, 2-децинил и 9-децинил. Если не указано иначе, термин "алкоксигруппа" означает -O-алкильную группу. Примеры алкоксигрупп включают, но не ограничиваются ими, -ОСН 3, -ОСН 2 СН 3, -О(СН 2)2 СН 3, -О(СН 2)3 СН 3,-О(СН 2)4 СН 3 и -О(СН 2)5 СН 3. Если не указано иначе, термин "арил" означает ароматическое кольцо или ароматическую или частично ароматическую кольцевую систему, составленную из атомов углерода и водорода. Арильная группа может включать множественные кольца, связанные или конденсированные друг с другом. Примеры арильных групп включают, но не ограничиваются ими, антраценил, азуленил, бифенил, флуоренил, индан, инденил, нафтил, фенантренил, фенил, 1,2,3,4-тетрагидронафталин и толил. Если не указано иначе, термин "арилалкил" или "арилалкил" означает арильную группу, связанную с алкильной группой. Если не указано иначе, термин "средство, снижающее уровень циркулирующих лейкоцитов", означает соединение, которое имеет CLRF больше чем примерно 20%. Если не указано иначе, термин "фактор снижения уровня циркулирующих лимфоцитов" или"CLRF" означает уменьшение количества циркулирующих лимфоцитов у мышей, вызванное пероральным введением соединения в однократной дозе 100 мг/кг, определенное способом, описанном ниже в примерах.-2 015783 Если не указано иначе, термин "галоген" и "гало" охватывает фтор, хлор, бром и иод. Если не указано иначе, термин "гетероалкил" означает алкильную группу (например, линейную,разветвленную или циклическую), где по крайней мере один из атомов углерода заменен гетероатомом(например, N, О или S). Если не указано иначе, термин "гетероалкил" означает арильную группу, где по крайней мере один из атомов углерода заменен гетероатомом (например, N, О или S). Примеры включают, но не ограничиваются ими, акридинил, бензимидазолил, бензофуранил, бензоизотиазолил, бензоизоксазолил, бензохиназолинил, бензотиазолил, бензоксазолил, фурил, имидазолил, индолил, изотиазолил, изоксазолил, оксадиазолил, оксазолил, фталазинил, пиразинил, пиразолил, пиридазинил, пиридил, пиримидинил, пиримидил, пирролил, хиназолинил, хинолинил, тетразолил, тиазолил и триазинил. Если не указано иначе, термин "гетероарилалкил" или "гетероарилалкил" означает гетероарильную группу, связанную с алкильной группой. Если не указано иначе, термин "гетероцикл" относится к ароматическому, частично ароматическому или неароматическому моноциклическому или полициклическому кольцу или кольцевой системе,состоящей из углерода, водорода и по крайней мере одного гетероатома (например, N, О или S). Гетероцикл может включать множественные кольца (например, два или более), конденсированные или связанные друг с другом. Гетероциклы включают гетероарилы. Примеры включают, но не ограничиваются ими, бензо[1,3]диоксолил, 2, 3-дигидро-бензо[1,4]диоксинил, циннолинил, фуранил, гидантоинил, морфолинил, оксетанил, оксиранил, пиперазинил, пиперидинил, пирролидинонил, пирролидинил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил,тетрагидротиопиранил и валеролактамил. Если не указано иначе, термин "гетероциклоалкил" или "гетероциклоалкил" означает гетероциклическую группу, связанную с алкильной группой. Если не указано иначе, термин "гетероциклоалкил" означает неароматический гетероцикл. Если не указано иначе, термин "гетероциклоалкилалкил" или "гетероциклоалкилалкил" означает гетероциклоалкильную группу, связанную с алкильной группой. Если не указано иначе, термины "контролировать", "контроль" и "контролирование" охватывают предотвращение рецидива конкретного заболевания или расстройства у пациента, который уже страдал от этого заболевания или расстройства, и/или продление времени, в течение которого пациент, страдавший от этой болезни или расстройства, остается в состоянии ремиссии. Эти термины охватывают изменение порога, развития и/или продолжительности заболевания или расстройства или изменение характера реакции пациента на это заболевание или расстройство. Если не указано иначе, термин "фармацевтически приемлемые соли" относится к солям, приготовленным из фармацевтически приемлемых нетоксичных кислот или оснований, включая неорганические кислоты и основания и органические кислоты и основания. Пригодные фармацевтически приемлемые соли присоединения оснований включают, но не ограничиваются ими, соли металлов, приготовленные из алюминия, кальция, лития, магния, калия, натрия и цинка, или органические соли, приготовленные из лизина, N,N'-дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, меглюмина (N-метилглюкамина) и прокаина. Пригодные нетоксичные кислоты включают, но не ограничиваются ими, неорганические и органические кислоты, такие как уксусная, альгиновая, антраниловая, бензолсульфоновая, бензойная, камфорсульфоновая, лимонная, этенсульфоновая, муравьиная, фумаровая, фуранкарбоновая, галактуроновая, глюконовая, глюкуроновая, глутаминовая, гликолевая, бромистоводородная, хлористо-водородная (соляная), изетионовая, молочная, малеиновая, яблочная, миндальная, метансульфоновая, муциновая (слизевая), азотная, памовая, пантотеновая, фенилуксусная, фосфорная, пропионовая, салициловая, стеариновая, янтарная, сульфаниловая, серная, винная кислота и птолуолсульфоновая кислота. Конкретные нетоксичные кислоты включают хлористо-водородную (соляную), бромисто-водородную, фосфорную, серную и метансульфоновую кислоты. Примеры конкретных солей включают гидрохлоридные и мезилатные соли. Другие соли хорошо известны в данной области. См., например, Remington's Pharmaceutical Sciences (18th ed., Mack Publishing, Easton PA.: 1990) и Remington: The Science and Practice of Pharmacy (19th ed., Mack Publishing, Easton PA.: 1995). Если не указано иначе, термины "предотвращать (предупреждать)", "предотвращающий (предупреждающий)" и "предотвращение (предупреждение)" предусматривают действие, которое проводят до того, как пациент начинает страдать от конкретного заболевания или расстройства и которое ингибирует или уменьшает тяжесть этого заболевания или расстройства. Другими словами, эти термины охватывают профилактику. Если не указано иначе, "профилактически эффективное количество" соединения - это количество,достаточное для предотвращения развития заболевания или болезненного состояния или одного или более симптомов, связанных с этим заболеванием или состоянием, или для предотвращения их рецидива. Профилактически эффективное количество соединения означает то количество терапевтического средства, одного или в комбинации с другими средствами, которое обеспечивает благоприятный профилактический эффект в предотвращении заболевания. Термин "профилактически эффективное количество" может охватывать количество, которое улучшает общую профилактику или повышает профилактическую-3 015783 эффективность другого профилактического средства. Если не указано иначе, термин "средство, повышающее уровень S1P", означает соединение, которое имеет SLEF не менее примерно 10-кратного. Если не указано иначе, термин "фактор, повышающий уровень S1P" или "SLEF" означает увеличение S1P в селезенке мышей, вызванный пероральным введением соединения в однократной дозе 100 мг/кг, определенное способом, описанным ниже в примерах. Если не указано иначе, термин "стереоизомерная смесь" охватывает рацемические смеси, а также стереомерно обогащенные смеси (например, R/S = 30/70, 35/65, 40/60, 45/55, 55/45, 60/40, 65/35 и 70/30). Если не указано иначе, термин "стереомерно чистый" означает композицию, которая содержит один стереоизомер соединения и является существенно свободной от других стереоизомеров этого соединения. Например, стереомерно чистая композиция соединения, имеющего один стереоцентр, будет существенно свободной от противоположного стереоизомера этого соединения. Стереомерно чистая композиция соединения, имеющего два стереоцентра, будет существенно свободной от других диастереомеров этого соединения. Типичное стереомерно чистое соединение содержит более примерно 80 мас.% одного стереоизомера этого соединения и менее примерно 20 мас.% других стереоизомеров этого соединения,более примерно 90 мас.% одного стереоизомера этого соединения и менее примерно 10 мас.% других стереоизомеров этого соединения, более примерно 95 мас.% одного стереоизомера этого соединения и менее примерно 5 мас.% других стереоизомеров этого соединения, более примерно 97 мас.% одного стереоизомера этого соединения и менее примерно 3 мас.% других стереоизомеров этого соединения или более примерно 99 мас.% одного стереоизомера этого соединения и менее примерно 1 мас.% других стереоизомеров этого соединения. Если не указано иначе, термин "замещенный", когда его используют для описания химической структуры или группы, относится к производному этой структуры или группы, в которой один или более водородных атомов замещены химической группой или функциональной группой, такими как следующие (но не ограничиваясь ими): спирт, альдегид, алкоксигруппа, алканоилоксигруппа, алкоксикарбонил,алкенил, алкил (например, метил, этил, пропил, трет-бутил), алкинил, алкилкарбонилоксигруппа-ОС(О)NH-алкил), карбамил (например, CONH2, а также CONH-алкил, CONH-арил и CONH-арилалкил),карбонил, карбоксил, карбоновая кислота, ангидрид карбоновой кислоты, хлорид карбоновой кислоты,цианогруппа, сложный эфир, эпоксид, простой эфир (например, метоксигруппа, этоксигруппа), гуанидиновая группа, галоген, галоалкил (например, -CCl3, -CF3, -С(CF3)3), гетероалкил, полуацеталь, имин (первичный и вторичный), изоцианат, изотиоцианат, кетон, нитрил, нитрогруппа, оксогруппа, сложный фосфодиэфир, сульфид, сульфонамидная группа (например, SO2NH2), сульфон, сульфонил (включая алкилсульфонил, арилсульфонил и арилалкилсульфонил), сульфоксид, тиол (например, сульфгидрил, тиоэфир) и мочевина (-NHCONH-алкил-). Если не указано иначе, "терапевтически эффективное количество" соединения - это количество,достаточное для обеспечения терапевтически благоприятного эффекта при лечении и контролировании заболевания или болезненного состояния или для замедления или минимизации одного или более симптомов, связанных с этим заболеванием или состоянием. Терапевтически эффективное количество соединения означает то количество терапевтического средства, одного или в комбинации с другими способами лечения, которое обеспечивает терапевтически благоприятный эффект при лечении или контролировании этого заболевания или состояния. Термин "терапевтически эффективное количество" может охватывать то количество, которое улучшает общую терапию, ослабляет симптомы или причины заболевания или болезненного состояния или предупреждает их появление или повышает терапевтическую эффективность другого терапевтического средства. Если не указано иначе, термины "лечит", "лечащий" и "лечение" предусматривают действие, которое совершают, когда пациент страдает от конкретного заболевания или расстройства, и которое уменьшает тяжесть этого заболевания или расстройства или задерживает или замедляет прогресс этого заболевания или расстройства. Если не указано иначе, термин "включать" имеет тот же смысл, что и выражение "включать, но не ограничиваться им(и)", а термин "включает" имеет тот же смысл, что и выражение "включает, но не ограничивается им(и)". Подобным же образом, термин "такой(ие) как" имеет тот же смысл, что и термин"такой(ие) как, но не ограничиваясь им(и)". Если не указано иначе, одно или более определений, непосредственно предшествующих ряду существительных, следует понимать как применяемые к каждому из этих существительных. Например, фраза"необязательно замещенный алкил, арил или гетероарил" имеет тот же смысл, что и "необязательно замещенный алкил, необязательно замещенный арил или необязательно замещенный гетероарил". Следует заметить, что химическая группа, образующая часть большего соединения, здесь может быть описана с использованием названия, принятого для нее, когда она существует как отдельная молекула, или названия, принятого для ее радикала. Например, термины "пиридин" и "пиридил" имеют один-4 015783 и тот же смысл, когда они использованы для описания группы, присоединенной к другим химическим группам. Так, обе фразы "ХОН, в котором X является пиридилом" и "ХОН, в котором X является пиридином" имеют одинаковый смысл и охватывают соединения пиридин-2-ол, пиридин-3-ол и пиридин-4 ол. Следует также отметить, что если стереохимия какой-либо структуры или части структуры не указана, например, жирными или пунктирными линиями, то эту структуру или часть этой структуры следует понимать как охватывающую все ее стереоизомеры. Более того, любой атом, показанный на чертеже с ненасыщенными валентностями, следует считать присоединенным к такому количеству атомов водорода, которое достаточно для насыщения этих валентностей. Кроме того, химические связи, изображенные одной сплошной линией, параллельной одной пунктирной линии, обозначают как одинарные, так и двойные (например, ароматические) связи, если позволяют валентности. 5.2. Соединения. Изобретение относится к соединениям формулы I или его фармацевтически приемлемая соль, гдеR3 является OR3A, NHC(O)R3A, NHSO2R3A или водородом; и каждый R3A является независимо водородом или необязательно замещенным алкилом, арилом, алкиларилом, арилалкилом, гетероалкилом, гетероциклом, алкилгетероциклом или гетероциклоалкилом,где алкильный фрагмент включает 1-4 атома углерода, и термин "необязательно замещенный" означает один или более заместителей, выбранных из амино и галогена;R9 является водородом, CH2OR9A или CH2OC(O)R9A; и каждый из R6A, R7A, R8A и R9A независимо друг от друга представляют собой водород или С 1-4 алкил. Предпочтительны соединения, в которых R3 является OR3A, или NHC(O)R3A, или NHSO2R3A. При этом наиболее предпочтительны соединения, в которых R3A является водородом или С 1-4 алкилом. В одном из вариантов настоящего изобретения соединение формулы I имеет формулу В более конкретном варианте воплощения настоящего изобретения соединение формулы I имеет формулу В ещ более конкретном варианте воплощения настоящего изобретения соединение формулы I имеет формулу При этом наиболее предпочтительны соединения, в которых R3 является OR3A, или NHC(O)R3A, илиNHSO2R3A. При этом наиболее предпочтительны соединения, в которых R3A является водородом или С 1-4 алкилом. В другом варианте настоящего изобретения предлагается соединение, которое имеет формулу или его фармацевтически приемлемая соль, где R3 является водородом, OR3A, NHC(О)R3A илиNHSO2R3A; R9 является водородом или СН 2 ОН; и каждый R3A является независимо водородом или С 1-4 алкилом. В одном из вариантов настоящего изобретения указанное выше соединение имеет формулу Предпочтительны соединения, в которых R3 является OR3A. Еще более предпочтительны соединения, в которых R3A является водородом. В одном из вариантов настоящего изобретения предлагается соединение или его фармацевтически приемлемая соль, причем этим соединением является (Е)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)1 Н-имидазол-2-ил)-этаноноксим. Соединения этого изобретения могут содержать один или более стереоцентров и могут существовать в виде рацемических смесей энантиомеров или смесей диастереомеров. Это изобретение охватывает стереомерно чистые формы таких соединений, а также смеси этих форм. Стереоизомеры можно асимметрично синтезировать или разделить, используя стандартную технику, такую как хиральные колонки или хиральные разделяющие агенты. См., например, Jacques, J., et al., Enantiomers, Racemates и Resolutions (Wiley Interscience, New York, 1981); Wilen, S. H., et al., Tetrahedron 33:2725 (1977); Eliel, E. L.,Stereochemistry of Carbon Compounds (McGraw Hill, N.Y., 1962); и Wilen, S. H., Tables of Resolving Agents и Optical Resolutions, p. 268 (E. L. Eliel, Ed., Univ. of Notre Dame Press, Notre Dame, IN., 1972). Кроме того, это изобретение охватывает стереоизомерные смеси соединений, раскрытых в настоящем описании. Оно также охватывает конфигурационные изомеры соединений, раскрытых в настоящем описании, как в качестве примесей или в чистой или существенно чистой форме, такой как цис- (Z) и транс- (Е) изомеры алкена и syn- и anti-изомеры оксима. Предпочтительные соединения этого изобретения представляют собой средства, снижающие количество циркулирующих лимфоцитов. Определенные соединения уменьшают количество циркулирующих лимфоцитов более чем на 20, 50, 75, 100, 150 или 200%, что определено с использованием способов,описанных в примерах. В этом отношении можно упомянуть, что было обнаружено, что хотя THI может снижать количество циркулирующих лимфоцитов у мышей, многие аналоги и производные THI, такие как 1-(4-метил-5-1S,2R,3R)-1,2,3,4-тетрагидроксибутил)тиазол-2-ил)этанон, имеют слабый эффект или не проявляют никакого эффекта на циркулирующие лимфоциты, несмотря на сообщения об обратном. См. WO 97/46543. Без ограничений какой-либо теории считают, что соединения этого изобретения влияют на пути метаболизма S1P и могут прямо или косвенно ингибировать S1P-лиазу in vivo. Конкретные соединения являются средствами, повышающими уровень S1P. Определенные соединения увеличивают количествоS1P более чем примерно в 10, 15, 20, 25 или 30 раз, что определено использованием способа, описанного в примерах. Соединения настоящего изобретения можно приготовить способами, известными в данной областиRes. Comm. 11:108-112 (2000); Halweg, К. М. and Buchi, G., J. Org. Chem. 50:1134-1136 (1985. Эти соединения можно также приготовить способами, раскрытыми ниже, и их вариантами, которые известны специалисту с обычной квалификацией в данной области. 5.3. Способы применения. Это изобретение охватывает способ регулирования (например, увеличения) количества S1P у пациента (например, у мыши, крысы, собаки, кота или человека), нуждающегося в этом, который включает введение этому пациенту эффективного количества соединения настоящего изобретения (т.е. соединения, раскрытого здесь).-6 015783 Другой вариант осуществления охватывает способ снижения числа Т-клеток в крови пациента, который включает введение этому пациенту эффективного количества соединения этого изобретения. Другой вариант осуществления охватывает способ лечения, контролирования или предупреждения заболевания, обусловленного (или симптомов, обусловленных) уровнями S1P, включающий введение пациенту, нуждающемуся в этом, терапевтически или профилактически эффективного количества соединения этого изобретения. Другой вариант осуществления охватывает способ подавления иммунной реакции у пациента, который включает введение этому пациенту эффективного количества соединения этого изобретения. Другой вариант осуществления охватывает способ лечения, контролирования или предупреждения аутоиммунного или воспалительного заболевания или расстройства, который включает введение пациенту, нуждающемуся в этом, терапевтически или профилактически эффективного количества соединения этого изобретения. Примеры заболеваний и расстройств включают анкилозирующий спондилоартрит,астму (например, бронхиальную астму), атопический дерматит, болезнь Бехчета, реакцию "трансплантат против хозяина", болезнь Кавасаки, красную волчанку, рассеянный склероз, тяжелую псевдопаралитическую миастению, поллиноз (сенную лихорадку), псориаз, псориатический артрит, ревматоидный артрит,склеродермию, отторжение трансплантата (например, органа, клетки или костного мозга), диабет первого типа и увеит. Дополнительные заболевания и расстройства включают болезнь Аддисона, антифосфолипидный синдром, аутоиммунный атрофический гастрит, аутоиммунную ахлоргидрию, глютеновую болезнь, болезнь Крона, синдром Иценко-Кушинга, дерматомиозит, синдром Гудпасчера, болезнь Грейвса (диффузный тиреотоксический зоб), тиреоидит Хашимото, идиопатическую атрофию надпочечников, идиопатическую тромбоцитопению, синдром Ламберта-Итона, пемфигоид, обыкновенную пузырчатку, пернициозную анемию, узелковый полиартериит, первичный билиарный цирроз, первичный склерозирующий холангит, болезнь Рейно, болезнь Рейтера, рецидивирующий полихондрит, синдром Шмидта, синдром Шегрена, симпатическую офтальмию, синдром Такаясу, височный артериит, тиреотоксикоз, язвенный колит и гранулематоз Вегенера. Количество, путь и схема (режим) введения соединения будет зависеть от таких факторов, как конкретные (специфические) показания к лечению, предупреждению или контролю, возраст, пол и состояние пациента. Значение таких факторов хорошо известно в данной области и может быть использовано в обычных экспериментах. В конкретном варианте осуществления соединение этого изобретения вводят пациенту-человеку в количестве примерно 0,5, 1, 2,5 или 5 мг на 1 кг массы тела. 5.4. Фармацевтические лекарственные формы. Изобретение охватывает фармацевтические композиции, содержащие одно или более соединений этого изобретения. Определенные фармацевтические композиции являются единичными стандартными формами, применимыми для перорального, чресслизистого (например, интраназального, сублингвального, интравагинального или ректального), парентерального (например, подкожного, внутривенного, болюсной инъекции, внутримышечного или внутриартериального) или трансдермального введения пациенту. Примеры лекарственных форм включают, но не ограничиваются ими: таблетки; таблетки в виде капсул; капсулы, такие как капсулы из мягкого эластичного желатина; капсулы (каше - cachet); пастилки; лепешки; дисперсии; суппозитории; мази; катаплазмы (припарки); пасты; порошки; перевязочные материалы; кремы; пластыри; растворы; салфетки; аэрозоли (например, интраназальные спреи и ингаляторы); гели; жидкие лекарственные формы, применимые для перорального или чресслизистого введения пациенту, включая суспензии (например, водные или неводные жидкие суспензии, эмульсии типа "масло в воде" или жидкие эмульсии типа "вода в масле"), растворы и эликсиры; жидкие лекарственные формы,применимые для парентерального введения пациенту; стерильные твердые вещества (например, кристаллические или аморфные твердые вещества), из которых можно приготовить жидкие лекарственные формы, пригодные для парентерального введения пациенту. Лекарственная форма должна соответствовать способу введения. Например, пероральное введение требует кишечных покрытий для защиты соединений этого изобретения от разложения в желудочнокишечном тракте. Сходным образом, лекарственная форма может содержать ингредиенты, которые облегчают доставку активного ингредиента(ов) к месту действия. Например, соединения можно вводить в липосомальных лекарственных формах для защиты от разрушающих ферментов, для облегчения транспорта в системе кровообращения и для доставки через клеточные мембраны к внутриклеточным сайтам. Аналогичным образом, малорастворимые соединения можно включить в жидкие лекарственные формы (и в лекарственные формы, пригодные для реконструкции in situ) с помощью солюбилизирующих средств, эмульгаторов, и поверхностно-активных веществ, таких как (но не ограничиваясь ими) циклодекстрины (например, -циклодекстрин, -циклодекстрин, Captisol, и Encapsin (см., например, Davis и Brewster, 2004, Nat. Rev. Drug Disc. 3:1023-1034), Labrasol, Labrafil, Labrafac, кремафор и неводных растворителей, таких как (но не ограничиваясь ими): этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, диметилсульфоксид (DMSO), биологически совместимые масла (например, хлопковое,-7 015783 арахисовое, кукурузное, зародышевое, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли, сложные эфиры жирных кислот и сорбитана и их смеси(например, DMSO с кукурузным маслом). Малорастворимые соединения можно также включить в суспензии, используя другие способы, известные в данной области. Например, наночастицы соединения можно суспендировать в жидкости с образованием наносуспензии (см., например, Rabinow, 2004, Nature Rev. Drug Disc. 3:785-796). Нанопорошковые формы соединений, описанные здесь, можно приготовить способами, описанными в публикациях патентов США 2004-0164194, 2004-0195413, 2004-0251332, 2005-0042177 А 1, 2005-0031691 А 1, и патентах США 5145684, 5510118, 5518187, 5534270, 5543133, 5662883, 5665331, 5718388, 5718919,5834025, 5862999, 6431478, 6742734, 6745962, каждый из которых полностью включен сюда в качестве ссылки. В одном варианте осуществления нанопрошковая форма содержит частицы, имеющие примерные средние размеры менее 2000 нм, менее 1000 нм или менее 500 нм. Состав, внешняя форма и тип лекарственной формы зависят от способа использования (области применения). Например, лекарственная форма, используемая для интенсивного лечения заболевания,может содержать большие количества одного или более активных ингредиентов, входящих в нее, чем лекарственная форма, используемая для длительного лечения того же заболевания. Сходным образом,парентеральная лекарственная форма может содержать меньшие количества одного или более активных ингредиентов, входящих в нее, чем пероральная лекарственная форма, используемая для лечения того же заболевания. Эти и другие пути введения, при которых конкретные лекарственные формы, охваченные этим изобретением, отличаются друг от друга, хорошо известны специалистам в данной области. См.,например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton Pa. (1990). 5.4.1. Пероральные лекарственные формы. Фармацевтические композиции этого изобретения, применимые для перорального введения, можно представить в лекарственных формах с дискретными дозами, такими как (но и не только) таблетки (например, жевательные таблетки), таблетки в виде капсул, капсулы и жидкости (например, ароматизированные сиропы). Такие лекарственные формы содержат предопределенные количества активных ингредиентов и могут быть приготовлены способами фармации, хорошо известными специалистам в данной области. См., например, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton Pa. (1990). Типичные пероральные лекарственные формы готовят, соединяя активный ингредиент(ы) в тонкой смеси по меньшей мере с одним эксципиентом согласно традиционным фармацевтическим техникам смешивания. Эксципиенты могут принимать множество форм в зависимости от формы препарата, требуемого для введения. Вследствие простоты введения таблетки и капсулы представляются наиболее удобными пероральными лекарственными формами с единичными дозами. Если желательно, таблетки можно покрыть с помощью стандартных водных и неводных процедур. Такие лекарственные формы можно приготовить традиционными способами фармации. Обычно фармацевтические композиции и лекарственные формы готовят, однородно и тонко смешивая активные ингредиенты с жидкими носителями, тонко распределенными твердыми носителями или носителями обоих типов, а затем при необходимости придавая им желаемую внешнюю форму. Для облегчения быстрого распада твердой лекарственной формы в нее можно включить дезинтегранты. Для облегчения изготовления лекарственных форм (например, таблеток) можно также включить смазывающие вещества. 5.4.2. Парентеральные лекарственные формы. Парентеральные лекарственные формы можно вводить пациентам различными путями, включая, но не ограничиваясь ими, подкожный, внутривенный (включая болюсную инъекцию), внутримышечный и внутриартериальный. Поскольку их введение обычно обходит естественную защиту пациента против загрязняющих веществ, парентеральные лекарственные формы являются стерильными или способными к стерилизации перед введением пациенту. Примеры парентеральных лекарственных форм включают, но не ограничиваются ими, растворы, готовые для инъекции, сухие продукты, готовые для растворения или суспендирования в фармацевтически приемлемом носителе для инъекции, суспензии, готовые для инъекции, и эмульсии. Подходящие наполнители, которые можно использовать для создания парентеральных лекарственных форм этого изобретения, хорошо известны специалистам в данной области. Примеры включают, но не ограничиваются ими: воду для инъекции по Фармакопее США; водные наполнители, такие как, но не ограничиваясь ими, хлорид натрия для инъекции, раствор Рингера для инъекции, декстроза для инъекций, декстроза и хлорид натрия для инъекции, и раствор Рингера с лактозой для инъекции; смешивающиеся с водой наполнители, такие как, но не ограничиваясь ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль; и неводные наполнители, такие как, но не ограничиваясь ими, кукурузное масло,хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат. 5.4.3. Трансдермальные, местные и чресслизистые лекарственные формы. Трансдермальные, местные и чресслизистые лекарственные формы включают, но не ограничиваются ими, глазные растворы, спреи, аэрозоли, кремы, лосьоны, мази, гели, растворы, эмульсии, суспензии или другие формы, известные специалисту в данной области. См., например, Remington's PharmaceuticalDosage Forms, 4th ed., LeaFebiger, Philadelphia (1985). Трансдермальные лекарственные формы включают салфетки (накладки) "резервуарного типа" или "матричного типа", которые можно накладывать на кожу и носить в течение определенного периода времени, чтобы позволить впитаться желаемому количеству активных ингредиентов. Подходящие эксципиенты (например, наполнители, носители и разбавители) и другие материалы,которые можно использовать для создания трансдермальных, местных и чресслизистых лекарственных форм, хорошо известны специалистам в фармацевтике; они зависят от конкретной ткани, на которую будут наносить данную фармацевтическую композицию или лекарственную форму. В зависимости от вида конкретной обрабатываемой ткани можно использовать дополнительные компоненты, применяемые до обработки активными ингредиентами этого изобретения, в сочетании с ними или после них. Например, можно использовать усилители проницаемости для содействия доставке активных ингредиентов к ткани. Для улучшения доставки одного или более активных ингредиентов можно регулировать величину рН фармацевтической композиции или лекарственной формы или ткани, на которую наносят эту фармацевтическую композицию или лекарственную форму. Сходным образом, для улучшения доставки можно регулировать полярность растворителя в наполнителе, его ионную силу или концентрацию. Для благоприятного изменения гидрофильности или липофильности одного или более активных ингредиентов,чтобы улучшить доставку, к фармацевтическим композициям или лекарственным формам можно добавлять такие соединения, как стеараты. При этом стеараты могут служить для лекарственной формы липидным наполнителем, эмульгатором или поверхностно-активным веществом и средством, повышающим доставку и усиливающим проникновение. Для дальнейшего регулирования свойств получаемой композиции можно также использовать различные соли, гидраты или сольваты активных ингредиентов. 6. Примеры Аспекты этого изобретения можно понять из следующих примеров, которые не ограничивают его объем. 6.1. Мыши с разрушенным геном S1P-лиазы."Улавливание генов" - это способ случайного инсерционного мутагенеза, который в качестве мутагена использует фрагмент ДНК, кодирующий репортерный ген или ген селектируемого маркера. Векторы улавливания гена сконструированы для интеграции в интроны или экзоны таким образом, чтобы позволить клеточному аппарату сплайсинга провести сплайсинг экзонов, закодированных вектором, с матричными РНК. Векторы улавливания гена обычно содержат последовательности селектируемых маркеров, предшествуемые последовательностями акцепторов сплайсинга и не предшествуемые промотором. Когда такой вектор интегрируется в ген, клеточный аппарат сплайсинга проводит сплайсинг экзонов уловленного гена с 5'-концом последовательности селектируемого маркера. Обычно такие гены селектируемых маркеров могут экспрессироваться только в том случае, если вектор, кодирующий этот ген, интегрировался в интрон. Случившееся улавливание гена затем идентифицируют путем селекции клеток,выживающих в селективной культуре. Эмбриональные стволовые клетки (производный мышиный штамм А 129) мутировали в процессе,включавшем вставку по меньшей мере части генетически сконструированной векторной последовательности в ген S1P-лиазы. Мутировавшие эмбриональные стволовые клетки микроинъекциями ввели в бластоцисты, которые затем ввели самкам с ложной беременностью и стандартными способами доводили до родов. В этом случае вирус, вставленный между экзонами 1 и 2, разрушал ген SlP-лиазы. Процедуры, применимые для разрушения гена в клетке, особенно в эмбриональной стволовой клетке, которая может уже иметь разрушенный ген, раскрыты в патентах США 613 65 66, 6139833 и 6207371 и в заявке на патент США сер.08/728963, каждый из которых во всей полноте включен сюда в качестве ссылки. 6.2. Гематологические эффекты разрушения гена SlP-лиазы. Цельную кровь собирали при ретроорбитальном кровотечении и помещали в пробирку для образцов капиллярной крови, содержащую EDTA. Кровь анализировали с использованием анализатора CellDyn 3500R (Abbott Diagnostics). Этот анализатор применяет двойные технологии для создания основы для пятичастной дифференциальной идентификации белых кровяных клеток (WBC). Измерения методом многоуглового поляризационного разделения пучка (multi-angle polarized scatter separation, MAPSS) дают первичный подсчет лейкоцитов и дифференциальную информацию, а импедансные измерения предоставляют дополнительную информацию в присутствии хрупких лимфоцитов и эритроцитов, устойчивых к гипотоническому лизису. Приблизительно 135 мкл цельной крови перистальтическим насосом всасывались в анализатор. Для получения гематологических параметров система Cell-Dyn 3500R (Abbott, IL.) использует четыре независимых способа измерений. Оптический подсчет WBC (WOC) и дифференциальные измерения WBC проводили в оптическом проточном канале, идентифицируя субпопуляции WBC (нейтрофилы, лимфоциты,моноциты, эозинофилы и базофилы) для пятичастного дифференциала WBC. Импедансный подсчет-9 015783 втором канале электрического сопротивления. Гемоглобин определяли в спектрофотометрическом канале. Образец всасывался, разбавлялся, перемешивался, и каждый параметр измерялся в течение каждого цикла прибора. Окончательными параметрами, получаемыми при гематологическом анализе, были общие концентрации лейкоцитов, нейтрофилов, лимфоцитов, моноцитов, эозинофилов, базофилов, эритроцитов, тромбоцитов, гемоглобина, гематокрита, ширина распределения эритроцитов по размерам, средний объем эритроцитов и средний объем тромбоцитов. Образцы крови получали от 16 мышей. Для сравнения использовали образцы крови семи мышей дикого типа, шести гетерозиготных мышей и трех гомозиготных мышей. Между мышами различных групп не было значительных генотипических различий в средних общих концентрациях эритроцитов(RBC), уровнях гемоглобина, среднем объеме эритроцитов, среднем количестве гемоглобина в эритроцитах, средней концентрации гемоглобина в эритроцитах, концентрации тромбоцитов и среднем объеме тромбоцитов. Различия были в гематокрите и в ширине распределения эритроцитов. Средний гематокрит у гомозиготных (-/-) мышей составлял 372,56%, у гетерозиготных (+/-) мышей 40,94% и у мышей дикого типа (+/+) 44,72,7%. Ширина распределения эритроцитов у гомозиготных (-/-) мышей составляла 25,24,2%, у гетерозиготных (+/-) мышей 17,61,9% и у мышей дикого типа (+/+) 17,22%. Сходным образом, общие концентрации лейкоцитов были одинаковыми у мышей, дефицитных поS1P-лиазе, гетерозиготных или дикого типа. Гомозиготные мыши (-/-) имели общую концентрацию лейкоцитов 7200700 кл/мкл. Гетерозиготные мыши (+/-) имели общую концентрацию лейкоцитов 62001800 кл/мкл, а мыши дикого типа имели общую концентрацию лейкоцитов 72 002600 кл/мкл. У мышей, которые были гомозиготными по разрушению S1P-лиазы, концентрация лейкоцитов была пониженной, хотя количество нейтрофилов, моноцитов, эозинофилов и базофилов увеличивалось. Концентрации лимфоцитов в крови мышей, гомозиготных (-/-) по разрушению гена S1P-лиазы, были сильно снижены. Средняя концентрация лимфоцитов у гомозиготных (-/-) мышей составляла 847139 кл/мкл, у гетерозиготных (+/-) мышей средняя концентрация лимфоцитов была 45822364 кл/мкл, в отличие от средней концентрации лимфоцитов у мышей дикого типа (+/+), которая составляла 61262151 кл/мкл. В отличие от этого, средняя концентрация нейтрофилов у гомозиготных (-/-) мышей была 5020612 кл/мкл, тогда как у гетерозиготных (+/-) мышей средняя концентрация нейтрофилов была 13801140 кл/мкл, а у мышей дикого типа (+/+) средняя концентрация нейтрофилов составляла только 886479 кл/мкл. Сходным образом, средняя концентрация моноцитов у гомозиготных (-/-) мышей была 950218 кл/мкл, тогда как у гетерозиготных (+/-) мышей средняя концентрация моноцитов была 250108 кл/мкл,а у мышей дикого типа (+/+) средняя концентрация моноцитов составляла только 14692 кл/мкл. Так же было и с эозинофилами: средняя концентрация эозинофилов у гомозиготных (-/-) мышей была 247297 кл/мкл, тогда как у гетерозиготных (+/-) мышей средняя концентрация эозинофилов была 88 кл/мкл, а у мышей дикого типа (+/+) средняя концентрация эозинофилов составляла только 1421 кл/мкл. То же справедливо и для базофилов. Средняя концентрация базофилов у гомозиготных (-/-) мышей была 13990 кл/мкл, у гетерозиготных (+/-) мышей средняя концентрация базофилов была 75 кл/мкл, а у мышей дикого типа (+/+) средняя концентрация базофилов составляла только 1611 кл/мкл. Сходным образом, средняя концентрация моноцитов у гомозиготных (-/-) мышей была 950218 кл/мкл, тогда как у гетерозиготных (+/-) мышей средняя концентрация моноцитов была 250108 кл/мкл,а у мышей дикого типа (+/+) средняя концентрация моноцитов составляла только 14692 кл/мкл. Так же было и с эозинофилами: средняя концентрация эозинофилов у гомозиготных (-/-) мышей была 247297 кл/мкл, тогда как у гетерозиготных (+/-) мышей средняя концентрация эозинофилов была 88 кл/мкл, а у мышей дикого типа (+/+) средняя концентрация эозинофилов составляла только 1421 кл/мкл. 6.3. Синтез (E/Z)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима. 1-[4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил]этанон (THI, приготовленный согласно Halweg, K. М. and Bchi, G., J. Org. Chem. 50:1134-1136 (1985 (350 мг, 1,52 ммоль) суспендировали в воде (10 мл). Добавляли гидроксиламингидрохлорид (126,8 мг, 1,82 ммоль, 1,2 экв) и ацетат натрия (247,3 мг, 3,04 ммоль, 2 экв), и суспензию перемешивали при 50 С. Спустя приблизительно 4 ч реакционная смесь становилась прозрачной. Перемешивание продолжали при 50 С в течение 16 ч. ЖХМСанализ показал образование продукта и отсутствие исходного материала. Реакционную смесь оставляли до установления комнатной температуры и пропускали через тонкопористый фильтр. Этот раствор использовали непосредственно для очистки продукта с помощью препаративной ВЭЖХ: колонка диоксида кремния Atlantis HILIC 30100 мм; 2-21% воды в ацетонитриле в течение 6 мин; 45 мл/мин; детектирование при 254 нм. Собирали фракции продукта и при пониженном давлении выпаривали ацетонитрил.- 10015783 Водный раствор лиофилизовали и получали продукт - смесь изомеров anti:syn (приблизительно 3:1), в виде белого твердого вещества: 284 мг (77%). ЖХМС: колонка Sunfire C-18, 4,650 мм; 0-17% МеОН (0,1% TFA) в воде (0,1% TFA) в течение 5 мин; скорость потока 3 мл/мин; детектирование при 220 нм; времена удержания: 0,56 мин (syn-изомер,246,0 (М+1 и 0,69 мин (anti-изомер, 246,0 (М+1. 1H-ЯМР (D2O и DCl)2,15 и 2,22 (синглеты, 3 Н), 3,53,72 (м, 4 Н), 4,7 6 (ушир., протоны ОН и Н 2 О), 4,95 и 4,97 (синглеты, 1 Н), 7,17 и 7,25 (синглеты, 1 Н). 13 СЯМР (D2O и DCl)10,80, 16,76, 63,06, 64,59, 64,75, 70,86, 72,75, 72,85, 117,22, 117,64, 135,32, 138,39,141,35, 144,12. 6.4. Синтез (E)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксима. Это соединение было приготовлено в две стадии, как показано ниже Во-первых, в колбу с THI (21,20 ммоль, 4,88 г) добавляли воду (25 мл) и 1 н. водную HCl (21,2 мл,21,2 ммоль). После растворения всего твердого вещества добавляли раствор тритилгидроксиламина(25,44 ммоль, 7,00 г) в диоксане (55 мл) и реакцию поддерживали при 50 С в течение 4 ч. После ее завершения смесь охлаждали до комнатной температуры и раствор доводили до рН 7 добавлением 1 н. водного NaOH. Нейтрализованный раствор затем концентрировали до состояния пластической массы, которую очищали флэш-хроматографией на силикагеле [10% МеОН/1% NH4OH (5 мас.% раствор в воде) вDCM] и получали тритиловый простой эфир в виде прозрачного пластика. Обработка этой пластической массы гексаном и концентрирование давали белый пенообразный материал, который можно было высушить в вакууме до хлопьевидного твердого состояния (10,00 г, выход 97%). Во-вторых, к интенсивно перемешиваемому при комнатной температуре раствору тритилового эфира оксима (4,8 г, 10 ммоль) в диоксане (90 мл) добавляли раствор HCl в диоксане (4 М, 60 мл). Через несколько минут наблюдали образование белого осадка, и перемешивание продолжали в общей сложности 30 мин, затем раствор фильтровали через притертый стеклянный фильтр и осадок на фильтре промывали диоксаном и эфиром. Осадок снова растворяли в воде (200 мл), обрабатывали ультразвуком в течение 5 минут, затем охлаждали до 0 С, обрабатывали целитом (5 г) и фильтровали через притертый стеклянный фильтр. Водный раствор концентрировали до сухого состояния, после чего Е-оксим перекристаллизовывали из смеси метанола (30 мл) с диэтиловым эфиром (60 мл) и получали аналитически чистый белый порошок (3,8 г, выход 80%). 6.5. Синтез Это соединение готовили, как описано выше в примере 6.3, используя метоксиламингидрохлорид вместо гидроксиламингидрохлорида, с выходом 74%. Продукт был белым рыхлым твердым веществом. ЖХМС: колонка Sunfire C-18, 4,650 мм; 0-17% МеОН (0,1% TFA) в воде (0,1% TFA) в течение 5 мин; скорость потока 3 мл/мин; детектирование при 220 нм; времена удержания: 1,59 мин (syn-изомер,260,1 (М+1 и 1,73 мин (anti-изомер, 260,1 (М+1. 1 Н-ЯМР D2O)2,18 и 2,22 (синглеты, 3 Н), 3,54-3,60 1-[4-1R,2S,3R)-1,2,3,4-Тетрагидроксибутил)-1 Н-имидазол-2-ил]этанон (160 мг, 0,70 ммоль) суспендировали в метаноле (3 мл) и воде (1 мл). Добавляли гидразид уксусной кислоты (56 мг, 0,75 ммоль,1,2 экв) и соляную кислоту (одну каплю, 12 н.), и суспензию 48 ч перемешивали при 50 С. ЖХМС-анализ показал образование продукта и отсутствие исходного материала. Реакционную смесь охлаждали до комнатной температуры и разбавляли тетрагидрофураном. Образовавшийся белый осадок собирали,промывали тетрагидрофураном и получали продукт-смесь с соотношением изомеров Е и Z, равным приблизительно 3:1, в виде белого твердого вещества: 129 мг (65%). ЖХМС: колонка Sunfire C-18, 4,650 мм; 2-20% в воде (10 мМ ацетат аммония) в течение 2,5 мин; скорость потока 3,5 мл/мин; детектирование при 220 нм; время удержания: 0,53 мин (287,1 (М+1) ). 1HЯМР (ДМСО-d6)2,2 (синглеты, 3 Н), 2,5 (синглеты, 3 Н под DMSO), 3,4-3,7 (м, 4 Н), 4,3 (ушир., 2 Н), 4,65,0 (ушир., 4 Н), 7,0 (ушир., 1 Н), 10,30 и 10,37 (синглеты, 1 Н). 6.9. Синтез (Е)-4-метил-N'-(1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этилиден)бензолсульфоногидразида 1-[4-1R,2S,3R)-1,2,3,4-Тетрагидроксибутил)-1 Н-имидазол-2-ил]-этанон (153 мг, 0,67 ммоль) суспендировали в метаноле (3 мл) и воде (1 мл). Добавляли п-толуолсульфонилгидразид (140 мг, 0,75 ммоль, 1,2 экв) и соляную кислоту (одну каплю, 12 н), и суспензию 24 ч перемешивали при 50 С. ЖХМС-анализ показал образование продукта и отсутствие исходного материала. Реакционную смесь охлаждали до комнатной температуры и наносили на сухой силикагель. Флэш-хроматография на силикагеле (10 г SiO2, 4:1 этилацетат: метанол) давала продукт - смесь с соотношением изомеров Е и Z, равным приблизительно 85:15, в виде белого твердого вещества: 142 мг (53%). ЖХМС: колонка Sunfire C-18, 4,650 мм; 10-90% в воде (10 мМ ацетат аммония) в течение 2,5 мин; скорость потока 3,5 мл/мин; детектирование при 220 нм; времена удержания: 0,50 мин (399,2 (М+1 и 0,66 мин (399,3 (М+1. 1 Н-ЯМР (метанол-d4)2,2 (синглеты, 3 Н), 2,41 и 2,45 (синглеты, 3 Н), 3,6-3,85 (м,4 Н), 4,99 и 5,05 (синглеты, 1 Н), 7,09 (ушир.с, 1 Н), 7,39 (д, 2 Н, j=8 Гц), 7,77 и 7,87 (д, 2 Н, j=8 Гц). 6.10. Синтез N'-(1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этилиден) бензогидразида. 1-[4-1R,2S,3R)-1,2,3,4-Тетрагидроксибутил)-1 Н-имидазол-2-ил]этанон (150 мг, 0,65 ммоль) суспендировали в метаноле (3 мл) и воде (1 мл). Добавляли гидразид бензойной кислоты (102 мг, 0,75 ммоль, 1,2 экв) и соляную кислоту (одну каплю, 12 н.), и суспензию 18 ч перемешивали при 50 С. ЖХМС-анализ показал образование продукта и отсутствие исходного материала. Гомогенную реакционную смесь охлаждали до комнатной температуры и концентрировали в вакууме. Обработка C-18 ReversePhase SPE (10 г Alltech Hi-load C18, градиент от 0 до 20% метанола в воде) позволила получить продукт смесь с соотношением изомеров Е и Z, равным приблизительно 1:1, в виде бесцветного твердого вещества: 193 мг (85%). ЖХМС: колонка Sunfire C-18, 4,650 мм; 10-90% в воде (10 мМ ацетат аммония) в течение 2,5 мин; скорость потока 3,5 мл/мин; детектирование при 220 нм; время удержания: 0,49 мин (349,2 (М+1) ). 1 Н- 12015783 ЯМР (метанол-d4)2,2 (синглеты, 3 Н), 2,42 и 2,45 (синглеты, 3 Н), 3,6-3,85 (м, 4 Н), 5,11 и 5,14 (синглеты,1 Н), 7,30 (ушир.с, 1 Н), 7,40-7,7 (м, 4 Н), 7,80 и 7,95 (м, 2 Н), 8,1 (ушир.с, 1 Н). 6.12. Синтез (Е)-N'-(1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этилиден)никотиногидразида. 1-[4-1R,2S,3R)-1,2,3,4-Тетрагидроксибутил)-1 Н-имидазол-2-ил]этанон (215 мг, 0,93 ммоль) суспендировали в метаноле (3 мл) и воде (1 мл). Добавляли гидразид никотиновой кислоты (137 мг, 1,0 ммоль, 1,1 экв) и соляную кислоту (одну каплю, 12 н.), и суспензию 48 ч перемешивали при 50 С. ЖХМС-анализ показал образование продукта и отсутствие исходного материала. Реакционную смесь охлаждали до комнатной температуры и частично концентрировали в вакууме. Образовавшийся белый осадок собирали, промывали водой и получали продукт - один изомер в виде белого твердого вещества: 311 мг (95%). ЖХМС: колонка Sunfire C-18, 4,650 мм; 10-90% в воде (10 мМ ацетат аммония) в течение 2,5 мин; скорость потока 3,5 мл/мин; детектирование при 220 нм; время удержания: 0,22 мин (350,27 (М+1. 1 НЯМР (ДМСО-d6)2,37 (с, 3 Н), 3,60-3,85 (м, 4 Н), 4,40 (м, 2 Н), 4,71 (м, 1 Н), 5,01 (м, 2 Н), 5,16 (м, 1 Н), 7,25 1-[4-1R,2S,3R)-1,2,3,4-Тетрагидроксибутил)-1 Н-имидазол-2-ил]этанон (194 мг, 0,84 ммоль) суспендировали в этаноле (4 мл) и воде (1 мл). Добавляли гидразид 3-хлорбензойной кислоты (170 мг, 1,0 ммоль, 1,2 экв) и соляную кислоту (одну каплю, 12 н.), и суспензию 48 ч перемешивали при 50 С. ЖХМС-анализ показал образование продукта и отсутствие исходного материала. Реакционную смесь охлаждали до комнатной температуры и частично концентрировали в вакууме. Образовавшийся белый осадок собирали, промывали этанолом и получали продукт - смесь Е- и Z-изомеров в соотношении приблизительно 3:1 в виде белого твердого вещества: 108 мг (33%). ЖХМС: колонка Sunfire C-18, 4,650 мм; 10-90% в воде (10 мМ ацетат аммония) в течение 2,5 мин; скорость потока 3,5 мл/мин; детектирование при 220 нм; время удержания: 0,63 мин (383,23 (М+1. 1 Н-ЯМР (метанол-d4) 5 2,44 (с, 3 Н), 3,60-3,90 1-[4-1R,2S,3R)-1,2,3,4-Тетрагидроксибутил)-1 Н-имидазол-2-ил]этанон (172 мг, 0,74 ммоль) суспендировали в этаноле (4 мл) и воде (1 мл). Добавляли гидразид 4-фторбензойной кислоты (131 мг, 0,85 ммоль, 1,1 экв) и соляную кислоту (одну каплю, 12 н.), и суспензию 48 ч перемешивали при 55 С. ЖХМС-анализ показал образование продукта и отсутствие исходного материала. Реакционную смесь охлаждали до комнатной температуры и частично концентрировали в вакууме. Образовавшийся белый осадок собирали, промывали этанолом и получали продукт - один изомер в виде твердого белого вещества: 97 мг (35%). ЖХМС: колонка Sunfire C-18, 4,650 мм; 10-90% в воде (10 мМ ацетат аммония) в течение 2,5 мин; скорость потока 3,5 мл/мин; детектирование при 220 нм; время удержания: 0,55 мин (367,24 (М+1. 1 Н- 13015783 ЯМР (метанол-d4, одна капля DCl)2,55 (с, 3 Н), 3,60-3,90 (м, 4 Н), 5,22 (с, 1 Н), 7,30 (м, 2 Н), 7,54 (с, 1 Н),8,08 (м, 2 Н). 6.15. Синтез (Е)-6-амино-N'-(1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил) этилиден) никотиногидразида. 1-[4-1R,2S,3R)-1,2,3,4-Тетрагидроксибутил)-1 Н-имидазол-2-ил]этанон (115 мг, 0,50 ммоль) суспендировали в этаноле (4 мл) и воде (1 мл). Добавляли замещенный гидразид (91 мг, 0,6 ммоль, 1,2 экв) и соляную кислоту (одну каплю, 12 н.), и суспензию 48 ч перемешивали при 55 С. ЖХМС-анализ показал образование продукта и отсутствие исходного материала. Реакционную смесь охлаждали до комнатной температуры и частично концентрировали в вакууме. Образовавшийся белый осадок собирали, промывали этанолом и получали продукт - один изомер в виде твердого белого вещества: 136 мг (75%). ЖХМС: колонка Sunfire C-18, 4,650 мм; 10-90% в воде (10 мМ ацетат аммония) в течение 2,5 мин; скорость потока 3,5 мл/мин; детектирование при 220 нм; время удержания: 0,15 мин (365,32 (M+1. 1 НЯМР (метанол-d4, одна капля DCl)2,58 (с, 3 Н), 3,60-3,90 (м, 4 Н), 5,22 (с, 1 Н), 7,17 (м, 1 Н), 7,54 (м, 1 Н),8,44 (м, 1 Н), 8,68 (м, 1 Н). 6.16. Синтез (Е)-N'-(1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидизол-2-ил)этилиден)изоникотиногидразида. 1-[4-1R,2S,3R)-1,2,3,4-Тетрагидроксибутил)-1 Н-имидазол-2-ил]этанон (168 мг, 0,73 ммоль) суспендировали в этаноле (4 мл) и воде (1 мл). Добавляли гидразид изоникотиновой кислоты (110 мг, 0,80 ммоль, 1,1 экв) и соляную кислоту (одну каплю, 12 н.), и суспензию 24 ч перемешивали при 55 С. ЖХМС-анализ показал образование продукта и отсутствие исходного материала. Реакционную смесь охлаждали до комнатной температуры и частично концентрировали в вакууме. Образовавшийся белый осадок собирали, промывали этанолом и получали продукт - один изомер в виде твердого белого вещества: 136 мг (75%). ЖХМС: колонка Sunfire C-18, 4,650 мм; 10-90% в воде (10 мМ ацетат аммония) в течение 2,5 мин; скорость потока 3,5 мл/мин; детектирование при 220 нм; время удержания: 0,15 мин (365,32 (М+1. 1 Н ЯМР (метанол-d4, одна капля DCl)2,63 (с, 3 Н), 3,60-3,90 (м, 4 Н), 5,12 (с, 1 Н), 7,58 (с, 1 Н), 8,63 (д, 2 Н,j=8 Гц), 9,14 (д, 2 Н, j=8 Гц). 6.17. Синтез (Е)-N'-(1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этилиден)бифенил-3-карбогидразида 1-[4-1R,2S,3R)-1,2,3,4-Тетрагидроксибутил)-1 Н-имидазол-2-ил]этанон (315 мг, 1,36 ммоль) и бифенил-3-карбогидразид (360 мг, 1,81 ммоль) суспендировали в DMSO (2 мл). Добавляли концентрированную соляную кислоту (две капли), и суспензию 5 часов перемешивали при 40 С. ЖХМС-анализ показал образование продукта и отсутствие исходного материала. Реакционную смесь охлаждали до комнатной температуры, разбавляли метанолом и очищали обращенно-фазовой ВЭЖХ (10 мМNH4OAc/ацетонитрил). Собирали и лиофилизовали отдельно две фракции (Е- и Z-изомеры) с желаемой массой. Первая фракция была белым твердым веществом, 95 мг (16%). Вторая фракция была белым твердым веществом, 82 мг (14%). Первая фракция: Аналитическая ВЭЖХ на колонке Zorbax C-8, 4,6150 мм; растворитель А - 10 мМ ацетат аммония/ растворитель В - MeCN; 0 мин - 5% В, 1 мин - 5% В, 3 мин - 90% В, 4 мин - стоп; ско- 14015783 рость потока 3 мл/мин; детектирование при 220 нм; время удержания: 2,9 мин (примечание: содержит 5% другого изомера). М+Н = 425,28, 1 Н-ЯМР (ДМСО-d6 и 2 капли D2O)2,3 (синглет, 3 Н), 3,3-3,7 (м,4 Н), 4,9 (м, 1 Н), 7,19 (с, 1 Н), 7,37 (м, 1 Н), 7,47 (м, 2 Н), 7,67 (м, 3 Н), 7,85-7,92 (м, 2 Н) и 8,15 (с, 1 Н). HSQC того же образца коррелировал сигнал протона при 2,3 (СН 3) с сигналом углерода при 20 ppm. Вторая фракция: Аналитическая ВЭЖХ на колонке Zorbax C-8, 4,6150 мм; растворитель А - 10 мМ ацетат аммония; растворитель В - MeCN; 0 мин - 5% В, 1 мин - 5% В, 3 мин - 90% В, 4 мин -стоп; скорость потока 3 мл/мин; детектирование при 220 нм; время удержания: 2,963 мин (примечание: содержит 6% другого изомера). М+Н = 425,28, 1 Н-ЯМР (ДМСО-d6 и 2 капли D2O)2,4 (синглет, 3 Н), 3,4-3,6 (м,4 Н), 4,77 и 4,86 (широкие синглеты, объединенные = 1 Н), 6,9 и 7,1 (широкие синглеты, объединенные = 1 Н), 7,40 (м, 1 Н) 7,50 (м, 2 Н), 7,61 (м, 1 Н), 7,73 (м, 2 Н), 7,87 (м, 2 Н) и 8,10 (с, 1 Н). HSQC того же образца коррелировал сигнал протона при 2,4 (СН 3) с сигналом углерода при 13 ppm. 6.19. Измерение воздействий на лимфоциты у мышей. Соединения вводили с помощью желудочного зонда или в питьевую воду. Для экспериментов с пероральными дозами соединения ресуспендировали из кристаллов в носителе (например, в воде) в концентрации 10 мг/мл. Мышам (F1-гибриды линии 129/В 6) через зонд вводили однократную дозу соединения 100 мг/кг (эквивалентную 100 мг/кг свободного основания каждого соединения) или контроль, содержавший только наполнитель, и мышей возвращали в их клетки. Через 18 ч после введения дозы мышей анестезировали изофлуораном и отбирали ткани для анализа, как описано ниже. Для исследований с питьевой водой соединения растворяли в концентрации 50 мг/мл в подкисленной воде (рН 2,8), содержавшей 10 г/л глюкозы. Мыши имели свободный доступ к воде, содержавшей соединение, (или к раствору глюкозы в качестве контроля) в течение 72 ч. По истечении 72 ч ткани отбирали для анализа. Клинический анализ крови проводили следующим образом. Мышей анестезировали изофлуораном и отбирали кровь из ретроорбитального сплетения в пробирки для образцов крови, содержавшие EDTA(Capiject-MQK, Terumo Medical Corp, Elkton, Md. ). Автоматический клинический анализ крови выполняли, используя приборы Cell-Dyn 3500 (Abbott Diagnostics, Abbott Park, 111.) или HemaVet 850 (Drew Scientific, Inc, Oxford, Conn.). Проточную цитометрию (FACS) выполняли следующим образом. Двадцать пять мкл цельной крови лизировали гипотоническим шоком, один раз промывали 2 мл FACS-промывочного буфера (FWB:PBS/0,1% BSA/0,1% NaN3/2 мМ EDTA) и в течение 30 мин при 4 С в темноте окрашивали смесью антител, конъюгированных с флуорохромом и разбавленных в 50 мкл FWB. После окрашивания клетки один раз промывали 2 мл FWB и ресуспендировали в 300 мкл FWB для анализа. Стандартные процедуры нестерильного извлечения селезенки и тимуса выполняли следующим образом. Органы диспергировали до одноклеточных суспензий, пропуская ткани через 70-мкм клеточный фильтр (Falcon, Becton Dickinson Labware, Bedford, Mass.). Для FACS-анализа эритроциты лизировали гипотонически, промывали и 1106 клеток инкубировали с 10 мкл анти-CD16/CD32 (Fc Block, BDPharMingen, San Diego, Calif.) (десятикратно разбавленными в FWB) в течение 15 мин при 4 С. Клетки окрашивали в течение 30 мин при 4 С в темноте смесью антител, конъюгированных с флуорохромом,разбавленных в 50-100 мкл FWB и добавленных прямо к клеткам в Fc-блоке. После окрашивания клетки один раз промывали 1 мл FWB и ресуспендировали в 300 мкл FWB для анализа. Все антитела были закуплены у BD-PharMingen, San Diego, Calif., если не указано иначе. Образцы анализировали, используя проточный цитометр FACSCalibur и программное обеспечение CellQuest Pro (Becton Dickinson Immunocytometry Systems, San Jose, Calif.). Для тимуса использовали следующие смеси антител: TCRb APC Су 7; CD4 APC; CD8 PerCP; CD69FITC; и CD62L РЕ 1. Для селезенки и крови использовали следующие смеси антител: В 220 PerCP; TCRbAPC; CD4 APC Cy7; CD8 РЕ Су 7; CD69 FITC; и CD62L РЕ. 6.20. Измерение воздействий на уровни S1P у мышей. Уровни S1P в селезенке мышей (Fl-гибриды линии 129/В 6) измеряли, используя адаптированный радиорецепторный анализ связывания, описанный в публикации Murata, N, et al, Anal. Biochem. 282:115120 (2000). Этот способ использует клетки HEK2 93F с гиперэкспрессией Edg-1, одного из подтипов рецепторов S1P; он основан на конкуренции меченого S1P с немеченым S1P в данном образце. Клетки HEK293F трансфецировали вектором pEFneo, определяющим экспрессию рецептора S1P(Edg-1), и отобрали клон 0418-резистентных клеток. Клетки HEK293F, экспрессирующие Edg-1, культивировали в 12 мультипланшетах в среде DMEM, содержавшей 5% (по объему) FBS, в атмосфере влажного воздуха с СО 2 (19:1). За 24 ч до эксперимента среду заменяли свежей средой DMEM (без сыворотки),содержавшей 0,1% (масса к объему) BSA. Через 18 ч после введения испытываемого соединения мышей забивали и извлекали и замораживали селезенки. S1P определяли в замороженной ткани, используя известные способы. См., например, Yatomi, Y, et al, FEBS Lett. 404:173-174 (1997). В частности, селезенки 10 мышей гомогенизовали на льду три раза с одноминутными интервалами в 1 мл ледяного 50 мМ фосфатного буфера (рН 7,5), содержавшего 1 мМ EGTA, 1 мМ DTT и полный комплект ингибиторов протеаз по Roche. Гомогенат центрифугировали 10 мин при 2500 об/мин и 4 С для удаления клеточного дебриса. Супернатант затем ультрацен- 15015783 трифугировали при 45000 об/мин и 4 С в 70Ti-роторе в течение 1 ч для осаждения белков, связанных с мембранами. Супернатант отбрасывали, а осадок ресуспендировали в минимальном объеме (1 мл) ледяного 50 мМ фосфатного буфера (рН 7,5), содержавшего 1 мМ EGTA, 1 мМ DTT, 33% глицерина и полный комплект ингибиторов протеаз по Roche. Общую концентрацию белка определяли способом Bradford.S1P экстрагировали смесью хлороформа, KCl и NH4OH (рН 12), сохраняя верхнюю водную фазу. Ее затем экстрагировали смесью хлороформа, метанола и НС 1 (рН 1), сохраняя нижнюю органическую фазу, из которой выпариванием выделяли S1P, который до использования хранили в холодильнике. Непосредственно перед анализом сухой образец растворяли с помощью ультразвука в буфере связывания, состоявшем из 20 мМ Tris-HCl (рН 7,5), 100 мМ NaCl, 15 мМ NaF и 0,4% (масса к объему) BSA. Содержание S1P в образце измеряли радиорецепторным анализом связывания, основанным на конкурентном связывании [33P]S1P с S1P, содержащимися в образце, с клетками, экспрессирующими Edg-1. Клетки HEK293F, экспрессирующие Edg-1, в конфлюэнтных 12 мультипланшетах дважды промывали ледяным буфером связывания и затем инкубировали в том же буфере, содержавшем 1 нМ [33P]S1P (примерно 18,00 распадов в минуту в каждой лунке) и увеличивающиеся дозы аутентичного S1P или испытываемого образца в конечном объеме 0,4 мл. Планшеты 30 мин выдерживали на льду, после чего клетки дважды промывали ледяным буфером связывания для удаления несвязанного лиганда. Клетки солюбилизировали в растворе, содержавшем 0,1% SDS, 0,4% NaOH и 2% Na2CO3, и просчитывали радиоактивность в жидкостном сцинтилляционном счетчике. Содержание S1P в анализируемой лунке определяли экстраполяцией стандартной кривой вытеснения. Содержание S1P в исходных испытываемых образцах рассчитывали, умножая значение, полученное из стандартной кривой, на степень экстракции S1P и коэффициент разбавления. 6.21. Воздействие соединений на лимфоциты у мышей. Действие различных соединений, проявляемые in vivo, определяли, используя методы, описанные выше. Как показано на фиг. 1-3, при введении мышам (F1-гибридам линии 129/В 6) с питьевой водой THI и типичного соединение этого изобретения (соединение 1) уменьшали выход лимфоцитов из тимуса. Фиг. 4 показывает воздействие на концентрации форменных элементов в цельной крови в контрольном примере с наполнителем (питьевой водой) в случае THI и в случае соединения 1 и соединение 2. Интересно, что эффекты, описанные Pyne (WO 97/46543), in vivo не наблюдались. 6.22. Модель артрита, индуцированного коллагеном. Артрит, индуцированный коллагеном (CIA), - это широко используемая модель ревматоидного артрита (RA), заболевания суставов, обусловленного аутоиммунными и воспалительными процессами. Для общей информации см. Wooley P. H. et al, J. Immunol. 135 (4) :2443-2451; A. Persidis, Nature Biotechnology 17:726-728; Current Protocols in Immunology (John WileySon, Inc. 1996). На ранних стадиях исследования этой проблемы была установлена иерархия восприимчивости кCIA, связанная с определенными гаплотипами Н-2. Позднее Campbell с сотрудниками провели повторное исследование CIA у мышей C57BL/129sv (H-2b) и обнаружили, что CIA может развиться у мышей, происходящих от С 57 В 6-предшественников (Campbell I. К, et al. Eur. J. Immunol. 30: 1568-1575 (2000. В настоящей работе коллаген для инъекций (куриный коллаген типа II (CII) (Sigma), 2 мг/мл) растворяли в 10 мМ уксусной кислоте, перемешивая в течение ночи при 4 С. Полный адъювант ФрейндаCFA в стеклянном шприце. Для иммунизации мышей использовали стеклянный шприц с иглой 26G,эмульсию CII/CFA инъецировали мышам внутрикожно в основание хвоста. Для каждой инъекции использовали CFA и 100 мкг куриного CII в общем объеме 50 мкл CFA. Повторную (бустерную) иммунизацию с введением 100 мкг CII, эмульгированного с CFA, проводили таким же путем через 3 недели после первичной иммунизации. Инъекция коллагена приводила к опуханию подушечек лап и суставов у мышей. Каждые 2-3 дня мышей проверяли на появление признаков артрита, которые оценивали по результатам измерений толщины подушечек задних лап и по визуальной оценке пораженных суставов задних ног. Течение CIA прослеживали в продолжение 10 недель после начала заболевания, после чего заболевание оценивали с помощью гистологического исследования суставов. Мыши признавались негативными по артриту, если за 150 дней после иммунизации коллагеном типа II у них не развивался CIA. Наличие или отсутствие артрита у мышей определяли по установленной системе визуальной оценки. При CIA у мышей может поражаться любая из четырех лап. На максимуме воспаления оно распространяется от голеностопного сустава до пальцев и характеризуется очень сильным опуханием и эритемой. После появления артрита каждую лапу обследовали 2-3 раза в неделю. Для оценки тяжести воспаления использовали широко применяемую систему баллов от 0 до 4, в которой 0 соответствует нормальному состоянию без признаков эритемы и опухания; 1 балл соответствует наличию эритемы и опуханию,ограниченному средним отделом стопы или голеностопным суставом или отдельными пальцами; 2 балла соответствуют эритеме и слабому опуханию, распространившемуся от голеностопного сустава до среднего отдела стопы или опуханию более одного пальца; 3 балла соответствуют эритеме и умеренному опуханию, распространившемуся от голеностопного до плюсневых суставов; и 4 балла соответствуют- 16015783 эритеме и тяжелому опуханию, охватывающему голеностоп, стопу и пальцы. 6.23. Действие на в модели артрита, индуцированного коллагеном. Эффект соединения этого изобретения в модели CIA определяли на 30 мышах (F1-гибридах линии 129/В 6), как описано выше. Мышей случайным образом разделяли на две группы, которые получали 0mpk (контроль с наполнителем) или 100 mpk этого соединения на кг массы тела. Наполнителем была стерильная дистиллированная вода. Контроль с наполнителем вводили в дозе 10 мкл/г массы тела. Дозы вводили один раз в день с помощью желудочного зонда. Курс начинали за три дня до начала эксперимента с CIA и продолжали в течение всей длительности эксперимента. Фиг. 5 показывает эффект соединения на CIA во времени, при этом кумулятивная оценка является суммой баллов для передней конечности и голеностопа. 6.24. Действие соединения у обезьян. Эффект соединения этого изобретения исследовали на двадцати испытанных (не-нативных) самцах яванских макак (cynomolgus monkeys) в Covance Research Products Inc. (Alice, Tex.). Каждое животное идентифицировали по индивидуальному татуированному номеру. Животных акклиматизировали в течение приблизительно 11 дней перед введением дозы. Во время введения дозы животные рассматривались либо как молодые зрелые, либо как старшие зрелые. В течение акклиматизации и периода испытаний животные помещались в индивидуальных клетках. Чтобы иметь возможность зарегистрировать любые эффекты, связанные с введением наполнителя или испытываемого вещества, животных держали по одиночке в течение не менее 48 ч после введения дозы. Животные имели свободный доступ к несертифицированному корму для приматов, за исключением времени введения дозы. В периоды свободного доступа к пище предоставлялись и фрукты и другие приемлемые лакомства. Доступ к воде был свободным. Испытываемое соединение хранили защищенным от света в закрытом контейнере с поглотителем влаги при условиях окружающей среды (приблизительно при комнатной температуре). Дистиллированную воду для перорального введения животным в группе с контролем с наполнителем получали у Covance. Препараты испытываемых соединений готовили в день введения. Для каждой группы отвешивали соответствующее количество испытываемого вещества и отмеряли необходимый объем дистиллированной воды. В течение ночи перед введением дозы и приблизительно в течение 4 ч после введения дозы животные не получали корма. Индивидуальные дозы рассчитывали, основываясь на массах тел, определенных в день введения дозы. Пероральную дозу вводили посредством назогастральной интубации. Перед удалением желудочного зонда его трубку промывали приблизительно 5 мл воды. Для гематологического анализа кровь (приблизительно 0,5 мл) отбирали у каждого животного до введения дозы (дни -7 и -3) и через 8, 16, 24, 32 и 48 ч после введения дозы. Гематологический анализ цельной крови проводили на свежих образцах, полученных в день забора крови. Как показано на фиг. 6, однократная пероральная доза этого соединения оказывает значительное влияние на концентрации лейкоцитов и лимфоцитов в крови обезьян, измеренные через 32 часа после введения. Все процитированные публикации, патенты и заявки на патенты в полном объеме включены сюда в качестве ссылок. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы или его фармацевтически приемлемая соль, где R3 является OR3A, NHC(O)R3A, NHSO2R3A или водородом; и каждый R3A является независимо водородом или необязательно замещенным алкилом, арилом,алкиларилом, арилалкилом, гетероалкилом, гетероциклом, алкилгетероциклом или гетероциклоалкилом,где алкильный фрагмент включает 1-4 атома углерода, и термин "необязательно замещенный" означает один или более заместителей, выбранных из амино и галогена; R6 является OR6A или OC(O)R6A; R7 является OR7A или OC(O)R7A; R8 является OR8A или OC(O)R8A;R9 является водородом, CH2OR9A или СН 2 ОС(О)R9A; и каждый из R6A, R7A, R8A и R9A независимо друг от друга представляют собой водород или С 1-4 алкил. 2. Соединение по п.1, в котором R3 является OR3A. 3. Соединение по п.1, в котором R3 является NHC(O)R3A.- 17015783 4. Соединение по п.1, в котором R3 является NHSO2R3A. 5. Соединение по пп.2, 3 или 4, в котором R3A является водородом или С 1-4 алкилом. 6. Соединение по п.1, которое имеет формулу 9. Соединение по п.7, в котором R3 является OR3A. 10. Соединение по п.7, в котором R3 является NHC(O)R3A. 11. Соединение по п.7, в котором R3 является NHSO2R3A. 12. Соединение по пп.9, 10 или 11, в котором R3A является водородом или С 1-4 алкилом. 13. Соединение формулы или его фармацевтически приемлемая соль, гдеR9 является водородом или СН 2 ОН; и каждый R3A является независимо водородом или С 1-4 алкилом. 14. Соединение по п.13, которое имеет формулу 15. Соединение по п.13, в котором R3 является OR3A. 16. Соединение по п.15, в котором R3A является водородом. 17. Соединение или его фармацевтически приемлемая соль, причем этим соединением является(E)-1-(4-1R,2S,3R)-1,2,3,4-тетрагидроксибутил)-1 Н-имидазол-2-ил)этаноноксим. 18. Фармацевтическая композиция, содержащая соединение по пп.1, 13 или 17 и фармацевтически приемлемый эксципиент или разбавитель.
МПК / Метки
МПК: A61K 31/4164, C07D 233/54, A61P 29/00
Метки: производные, терапии, применение, имидазола, композиции
Код ссылки
<a href="https://eas.patents.su/21-15783-proizvodnye-imidazola-kompozicii-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные имидазола, композиции и их применение в терапии</a>
Предыдущий патент: Выделенный связывающий белок, который связывается с her-3, и его применение
Следующий патент: Поддающийся растяжению нетканый материал, поглощающее изделие и способ получения поглощающего изделия
Случайный патент: Система и способ сортировки абсорбирующих изделий












