Четвертичные хелидониновые и алкалоидные производные, способ их получения и их применение в производстве лекарственных средств
Формула / Реферат
1. Способ получения продукта реакции алкалоидов, включающего по меньшей мере одно производное алкалоида, содержащее четвертичный азот, включающий:
a) получение реакционной смеси, содержащей органический растворитель и по меньшей мере один алкалоид, присутствующий в растении Chelidonium mаjus L. и предпочтительно выбранный из группы, состоящей из хелидонина, протопина, стилопина, аллокриптопина, гомохелидонина, хеламидина, хеламина, L-спартеина и оксихелидонина, и алкилирующий агент, и проведение реакции алкилирования путем взаимодействия по меньшей мере одного алкалоида с алкилирующим агентом в присутствии органического растворителя с образованием по меньшей мере одного производного алкалоида, содержащего четвертичный азот;
b) после прекращения реакции проведение по меньшей мере одной стадии промывания реакционной смеси водным растворителем или водой для удаления водорастворимых соединений, присутствующих в реакционной смеси; и
c) проведение обработки промытой реакционной смеси сильной кислотой в газообразной или жидкой форме предпочтительно газообразным хлористым водородом или раствором хлористого водорода для превращения по меньшей мере одного четвертичного производного алкалоида в водорастворимую форму, в частности в водорастворимую соль.
2. Способ по п.1, где на стадии с) продукт реакции выпадает в осадок во время или после обработки кислотой, после чего осадок отделяют от органического растворителя и, необязательно, дополнительно очищают, используя органические растворители.
3. Способ по п.1 или 2, где реакцию алкилирования осуществляют при повышенной температуре, в частности при температуре кипения растворителя.
4. Способ по любому из пп.1-3, где в качестве источника алкалоидов используют смесь нескольких или всех алкалоидов Chelidonium majus L.
5. Способ по любому из пп.1-4, где в качестве единственного источника алкалоидов используют хелидонин, оксихелидонин или метоксихелидонин.
6. Способ по любому из пп.1-5, где алкилирующий агент представляет собой физиологически активный агент, предпочтительно цитотоксический агент.
7. Способ по любому из пп.1-6, где алкилирующий агент является водорастворимым или разлагается на водорастворимые компоненты при контакте с водой.
8. Способ по любому из пп.1-7, где органический растворитель выбран из группы, состоящей из монохлорметана, дихлорметана, трихлорметана, монохлорэтана, дихлорэтана и трихлорэтана.
9. Способ по любому из пп.1-8, где алкилирующим агентом является трис-(1-азиридинил)фосфинсульфид (CAS 52-24-4).
10. Способ по любому из пп.1-9, где указанное производное алкалоида имеет четвертичный атом азота, с которым в качестве четвертого лиганда связан водородный остаток или остаток, происходящий из алкилирующего агента, и данный остаток предпочтительно выбран из группы, состоящей из метильного, этильного и трис-(1-азиридинил)фосфинсульфидного остатка.
11. Способ по любому из пп.1-9, где указанное производное алкалоида содержит четвертичный атом азота и продукт разложения, образованный в результате обработки кислотой, в качестве четвертого лиганда у указанного атома азота.
12. Продукт реакции алкалоидов, содержащий по меньшей мере одно алкалоидное производное, иное, чем сангвинарин и хлорид М-метилпротопина, имеющее четвертичный азот, причем алкалоид выбран из группы алкалоидов, присутствующих в растении Chelidonium majus L. и предпочтительно выбран из группы, состоящей из хелидонина, протопина, стилопина, аллокриптопина, гомохелидонина, хеламидина, хеламина, L-спартеина и оксихелидонина для применения в качестве лекарственного средства или лекарственного препарата.
13. Продукт реакции алкалоидов по п.12, полученный способом по пп.1-11.
14. Продукт реакции алкалоидов по п.13, полученный по реакции одного или более алкалоидов с алкилирующим агентом, где в производном первоначально третичный азот присутствует в четвертичной форме, с которым в качестве четвертого лиганда связан водородный остаток или остаток, происходящий из алкилирующего вещества, и данный остаток предпочтительно выбран из группы, состоящей из метильного, этильного и трис-(1-азиридинил)фосфинсульфидного остатка.
15. Продукт реакции алкалоидов по п.13 или 14, где по меньшей мере одно производное алкалоида присутствует в форме водорастворимой соли, предпочтительно в форме гидрохлорида.
16. Продукт реакции алкалоидов по любому из пп.13-15, причем хелидонин, оксихелидонин или метоксихелидонин присутствует в качестве единственного источника алкалоида.
17. Продукт реакции алкалоидов по любому из пп.13-16, где данный продукт дополнительно включает по меньшей мере одно соединение, выбранное из группы, состоящей из непрореагировавших третичных алкалоидов, непрореагировавшего алкилирующего агента и продуктов разложения алкилирующего агента.
18. Производное хелидонина, где природно существующий хелидонин присутствует в кватернизованной форме в соответствии со следующей формулой (I):
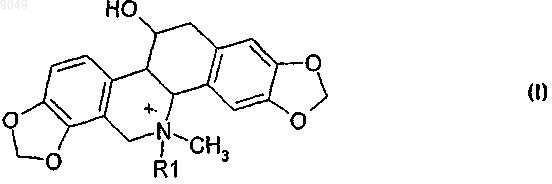
где в качестве четвертого лиганда R1 к четвертичному азоту присутствует водород или метильный или этильный остаток для применения в качестве лекарственного средства или лекарственного препарата.
19. Производное хелидонина по п.18 в водорастворимой форме, предпочтительно в виде соли с сильной кислотой, наиболее предпочтительно в форме гидрохлорида.
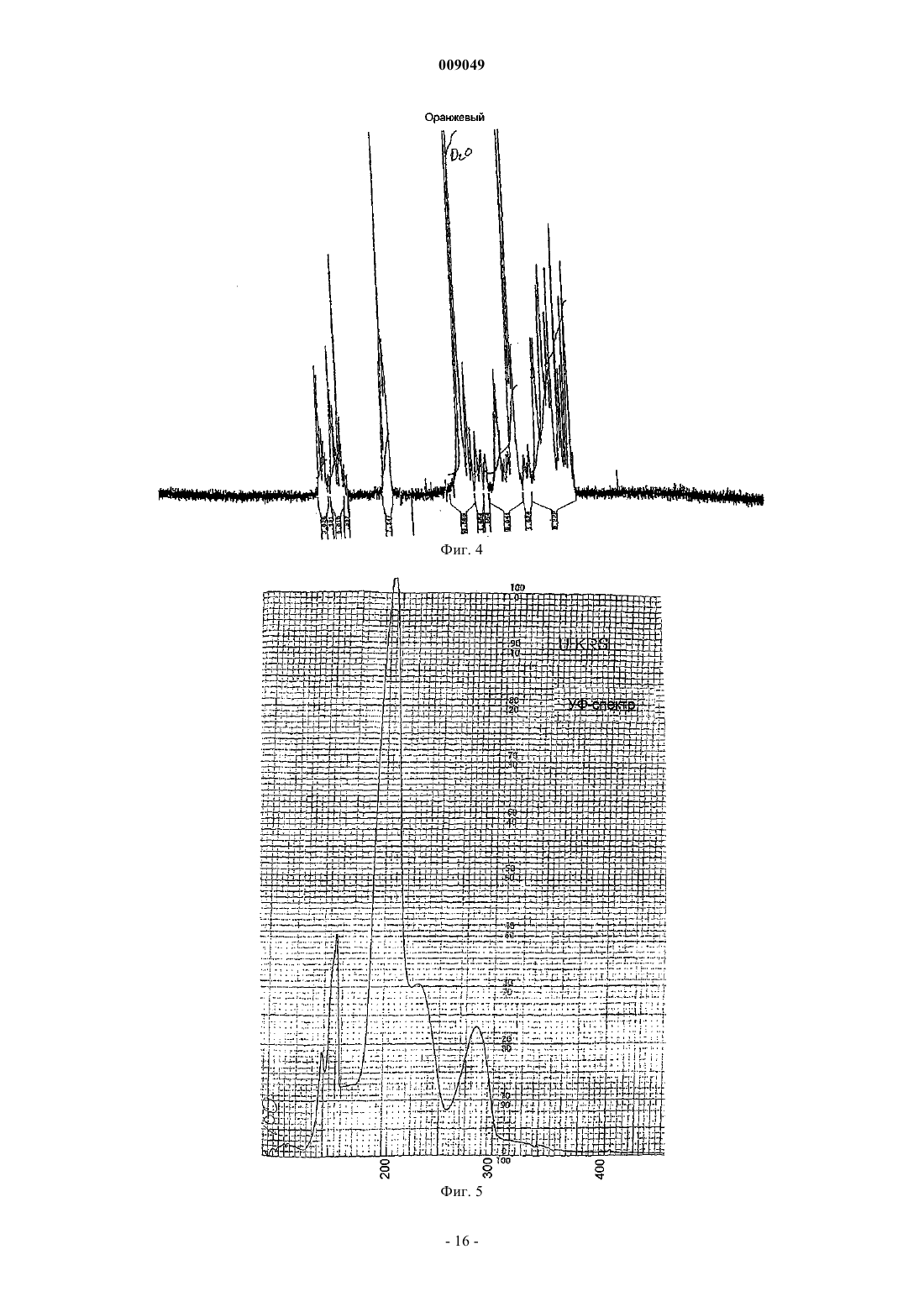
20. Производное хелидонина по п.18 или 19, которое характеризуется ЯМР-спектром по фиг. 4 и УФ-спектром по фиг. 5.
21. Применение продукта реакции алкалоидов, содержащего по меньшей мере одно алкалоидное производное, иное, чем сангвинарин и хлорид М-метилпротопина, имеющее четвертичный азот, причем алкалоид выбран из группы алкалоидов, присутствующих в растении Chelidonium majus L., и предпочтительно выбран из группы, состоящей из хелидонина, протопина, стилопина, аллокриптопина, гомохелидонина, хеламидина, хеламина, L-спартеина и оксихелидонина, для производства фармацевтической композиции для профилактики или лечения заболевания или патологического состояния организма, выбранного из группы, состоящей из вирусной инфекции, рака, иммунологической дисфункции, метаболической дисфункции и радиационного поражения.
22. Применение по п.21, где заболевание выбрано из группы, состоящей из аллергий, остеопороза, кожных опухолей, инфекций, вызванных вирусом гриппа, ревматических заболеваний, шрамов, послеоперационных ран, эпилепсии и рассеянного склероза.
23. Применение по п.21 или 22, где единственным алкалоидом является хелидонин и продукт реакции алкалоидов характеризуется ЯМР-спектром по фиг. 4 и УФ-спектром по фиг. 5.
24. Применение производного хелидонина по пп.18-20 для производства фармацевтической композиции для профилактики или лечения заболевания или патологического состояния организма, выбранного из группы, состоящей из вирусной инфекции, рака, иммунологической дисфункции, метаболической дисфункции и радиационного поражения.
25. Применение по п.24, где заболевание выбрано из группы, состоящей из аллергий, остеопороза, кожных опухолей, инфекций, вызванных вирусом гриппа, ревматических заболеваний, шрамов, послеоперационных ран, эпилепсии и рассеянного склероза.
Текст
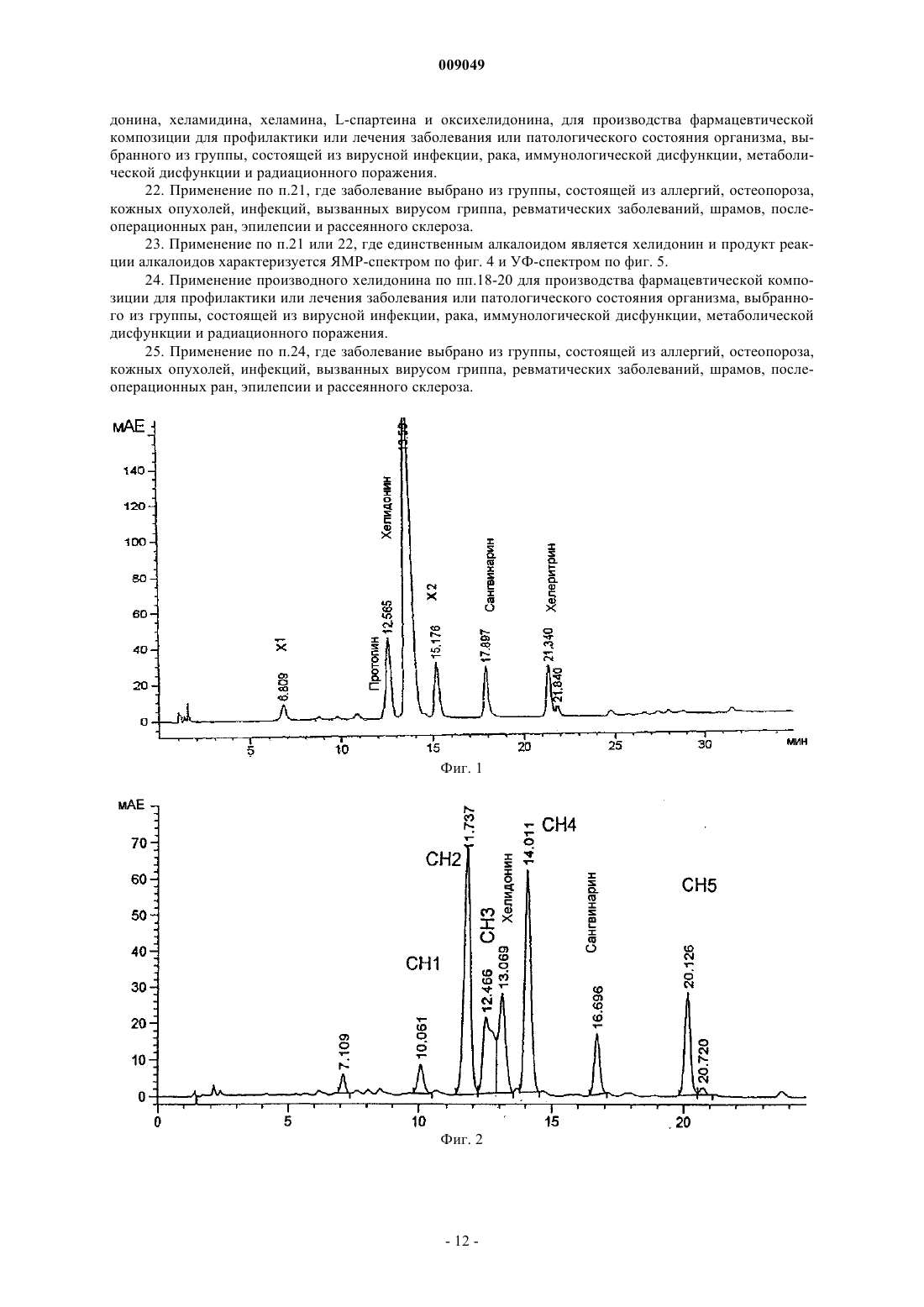
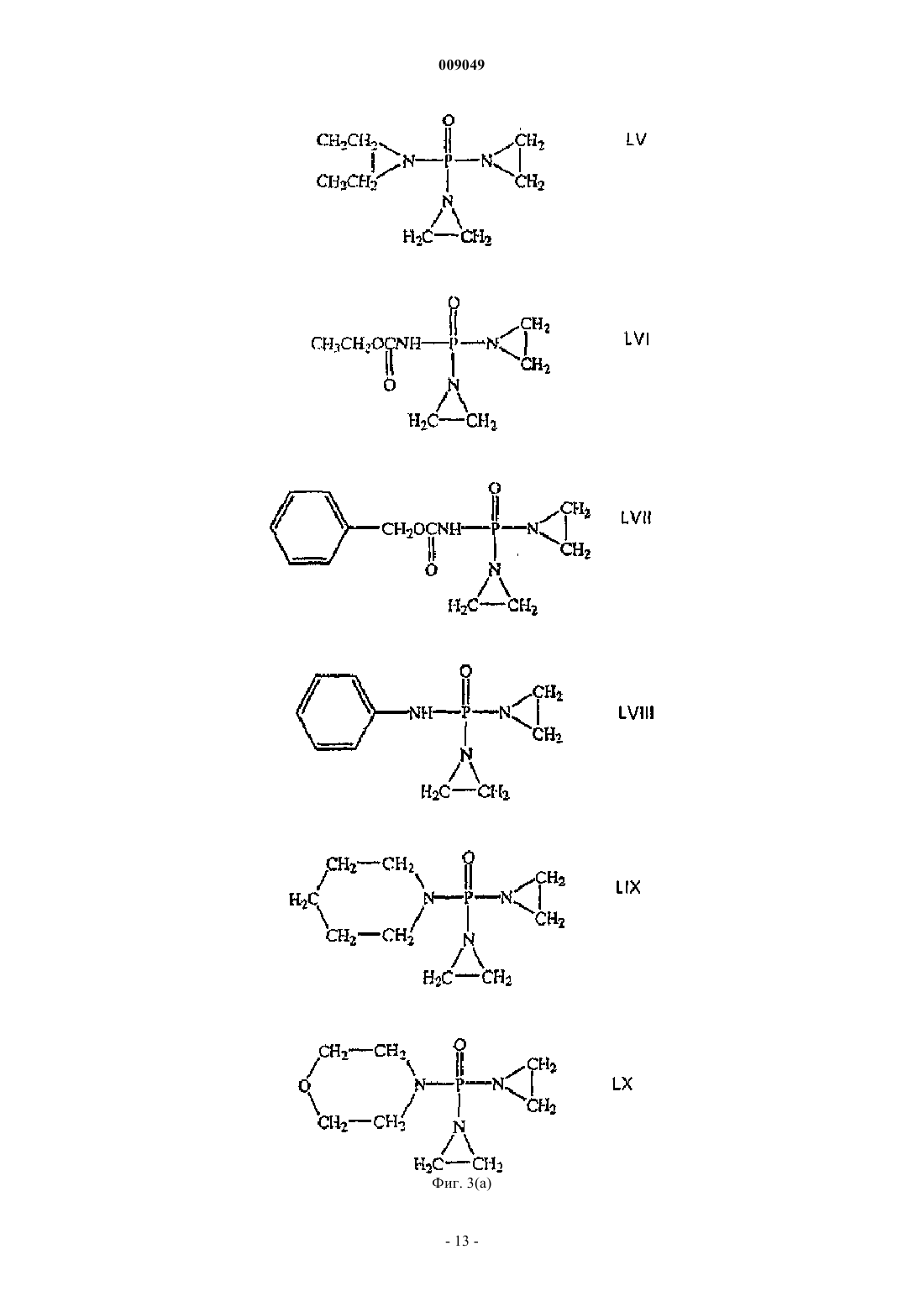
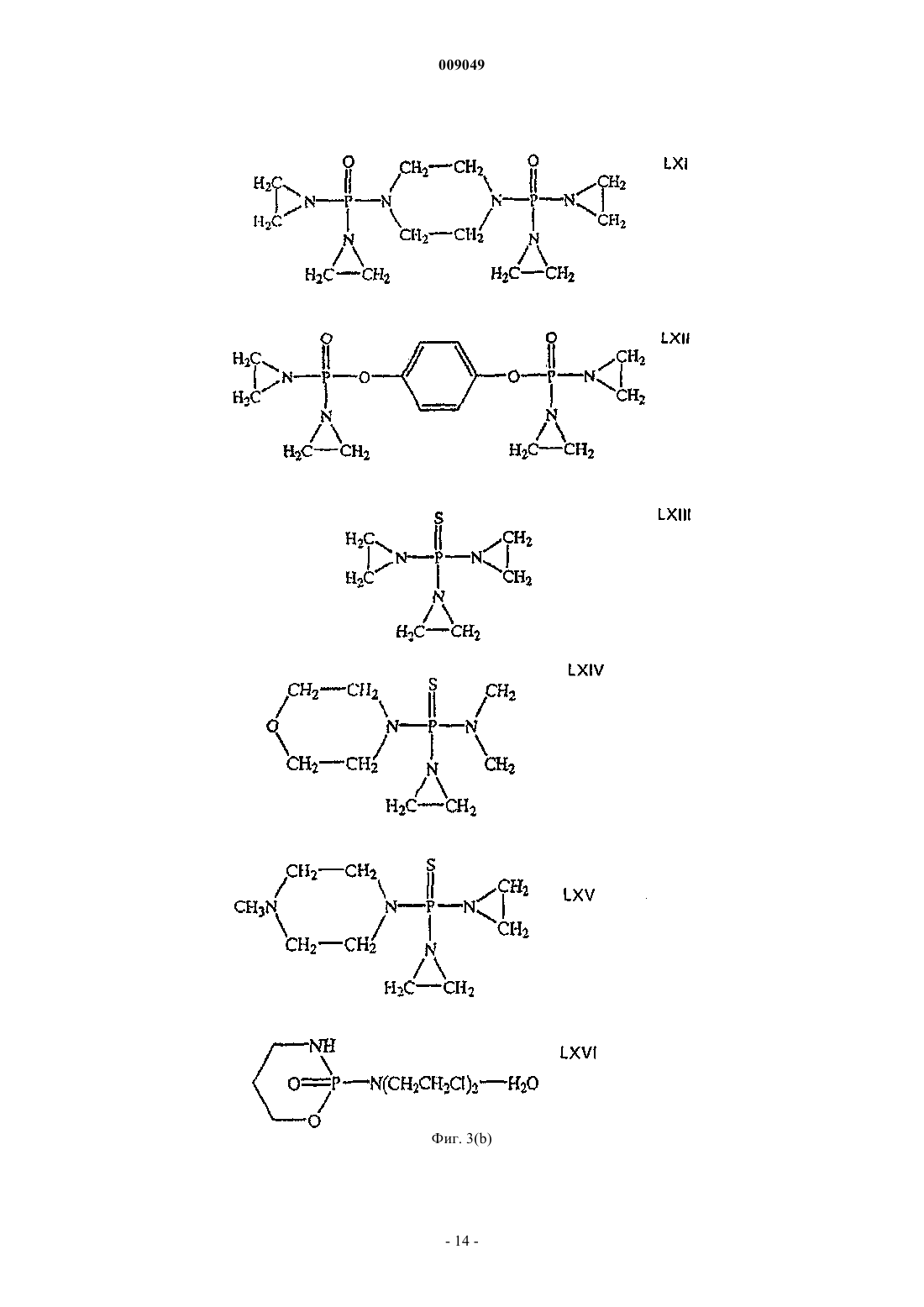
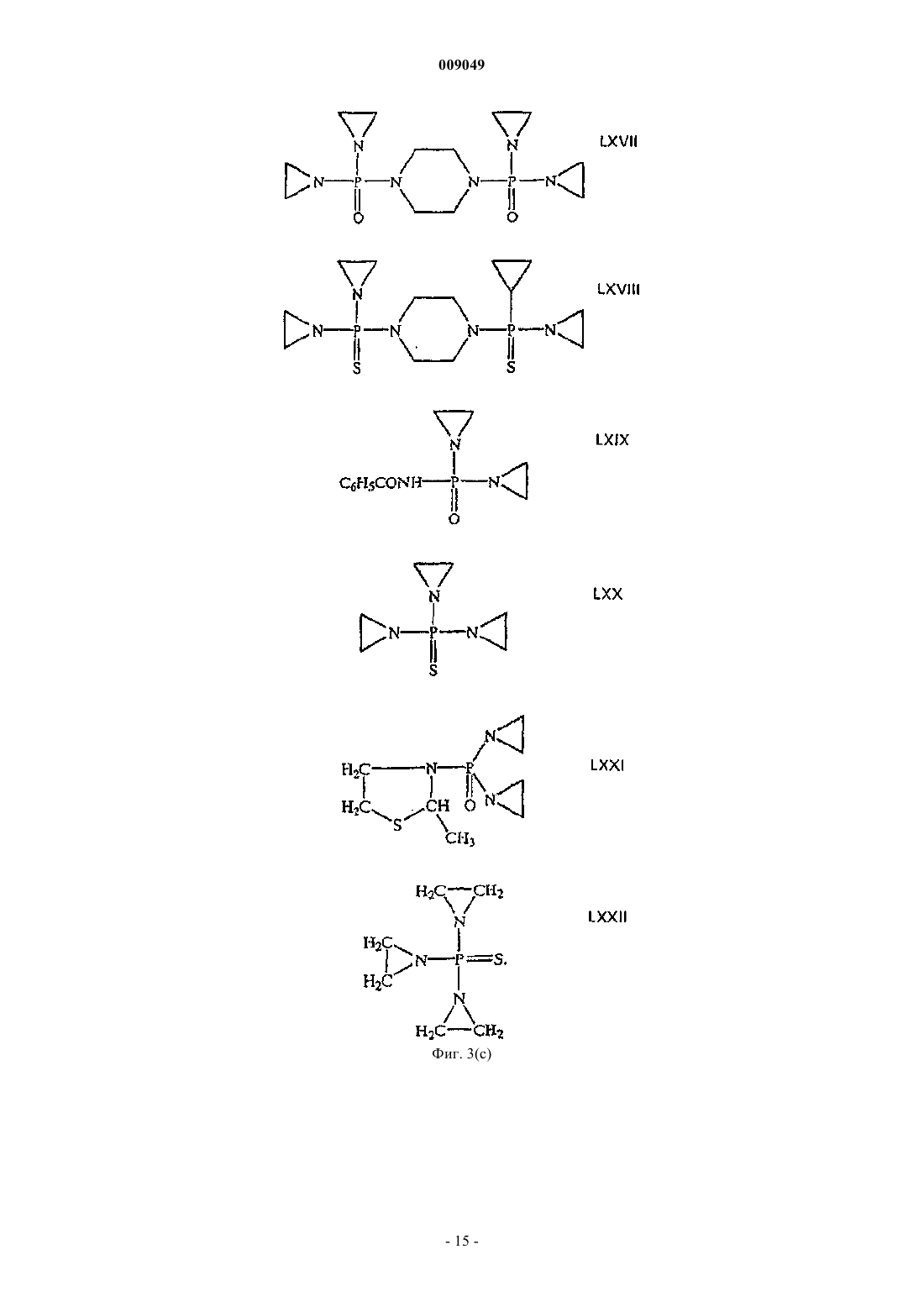
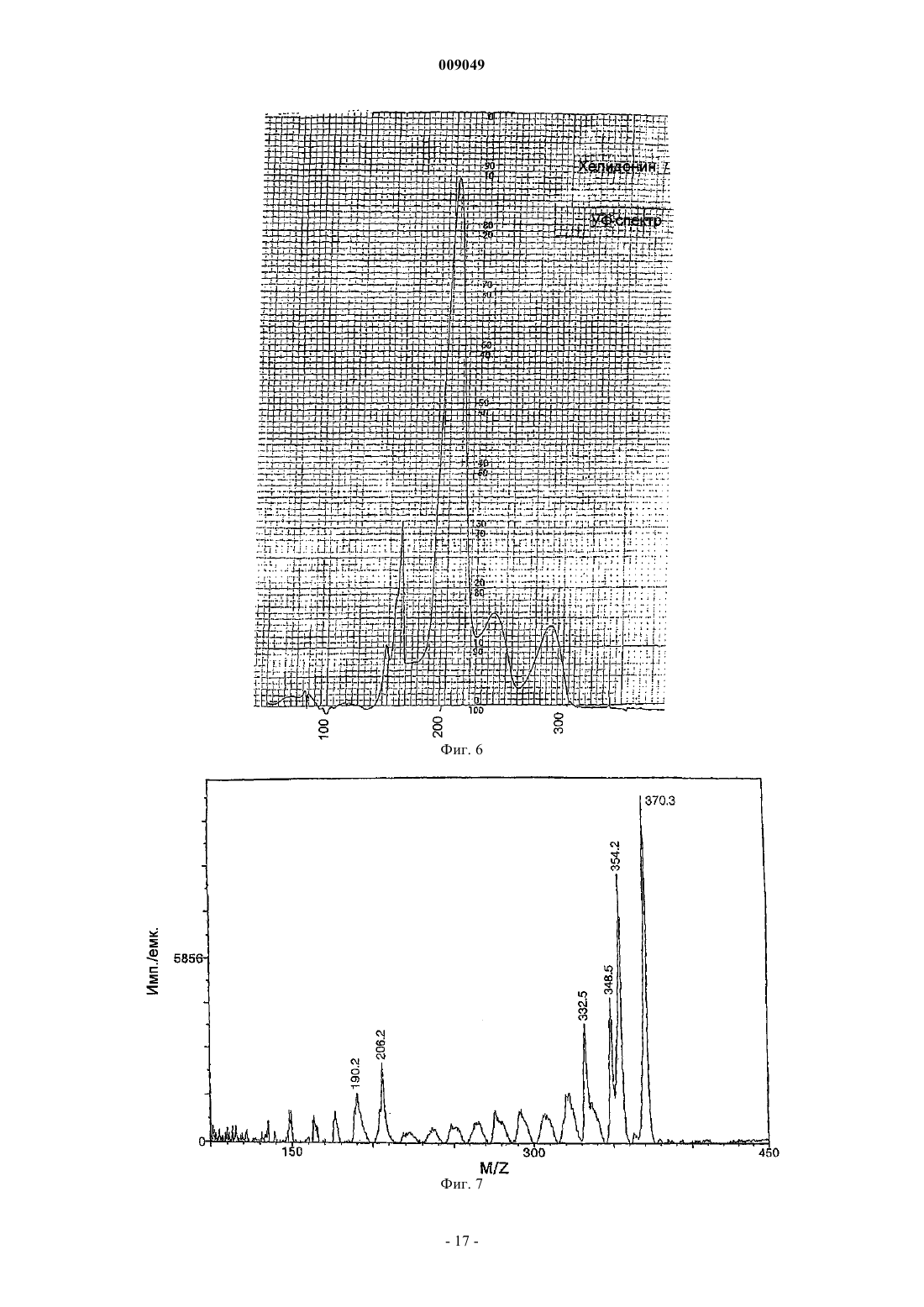
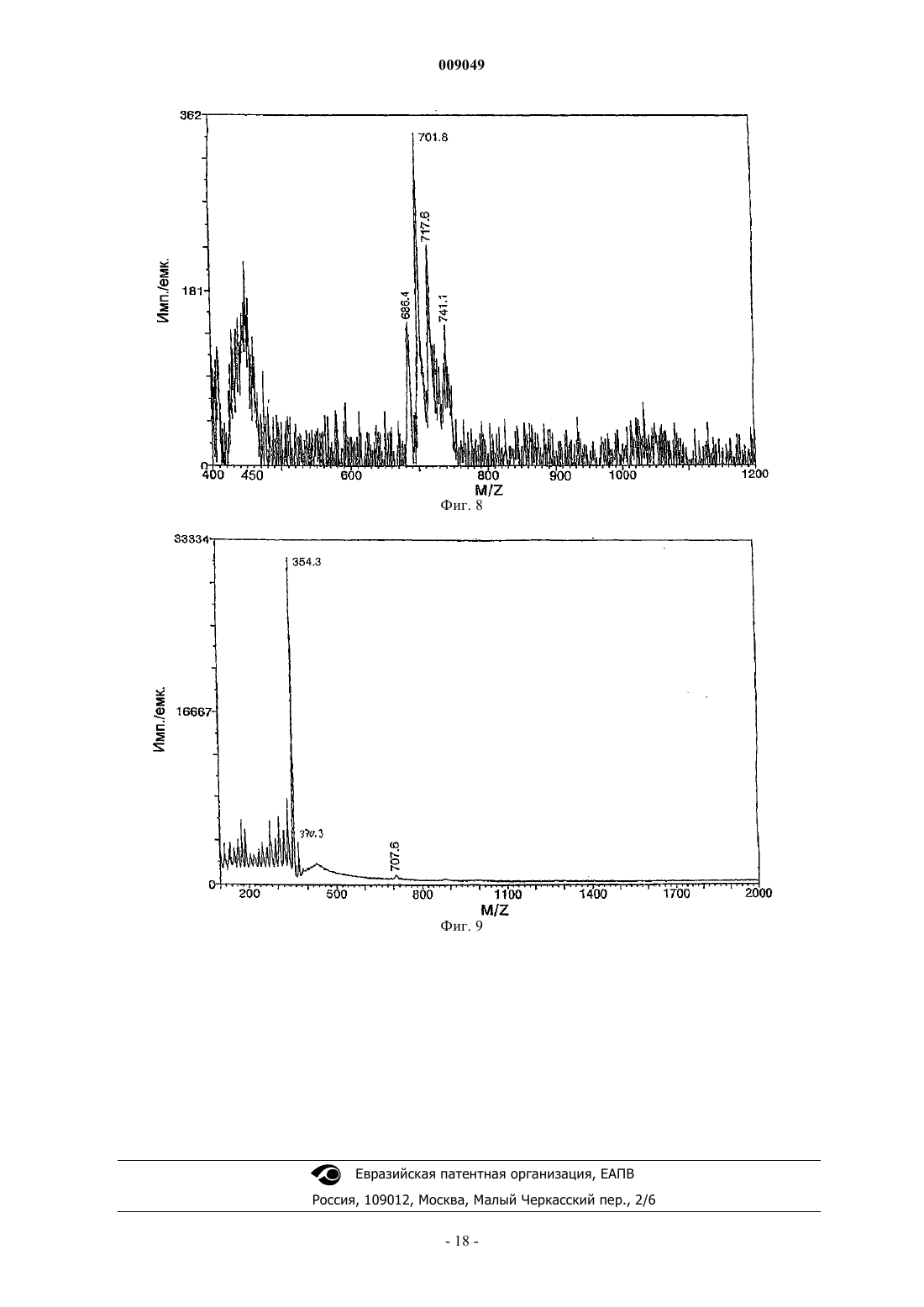
009049 Область техники Данное изобретение относится к области разработки лекарственных средств и здравоохранения и относится к алкалоиду хелидонину и его производным, причем азот в молекуле хелидонина является четвертичным азотом. Данное изобретение, кроме того, относится к способу получения этих соединений и к композициям, содержащим такие соединения, и к их применению для лечения разных заболеваний и патологических состояний организма. Уровень техники Специалистам в данной области известны алкалоид хелидонин и композиции, содержащие хелидонин,а также терапевтическое применение хелидонина или некоторых производных хелидонина для лечения разных патологических состояний организма и заболеваний, включая метаболические дисфункции и опухоли. В DE 2028330 и US 3865830 описано получение тиофосфорамидизохинолиновых аддуктов по реакции выбранных алкалоидов Chelidonium majus L. с трис(1-азиридинил)фосфинсульфидом в органическом растворителе. В AT 354644 и AT 377988 описаны способы получения фосфорных производных алкалоидов путем реакции с канцеростатическими фосфорными соединениями, которые представлены в водорастворимой форме путем превращения их в соли. Недостатком описанных способов является то, что превращение продуктов реакции в водорастворимую соль является неполным и преобладающая часть продуктов реакции остается нерастворимой в воде. В US 5981512 описано использование веществ, описанных в AT 377988 и AT 354644, для лечения радиационного повреждения. Соединения, описанные в названных патентах, обладают разной цитостатической и канцеростатической активностью. Как было доказано, особенно терапевтически обещающими являются смеси алкалоидов, в частности всех алкалоидов Chelidonium majus L., фармакологическая активность которых была показана в нескольких исследованиях по лечению рака. Непрореагировавший реагент удаляют из среды синтеза после завершения реакции. Так как трис(1-азиридинил)фосфинсульфид (здесь далее называемый также тиотепа) растворим в органических растворителях, таких как бензол, эфир или хлороформ, в предшествующих способах предлагается удалять непрореагировавший трис(1-азиридинил)фосфинсульфид из смеси для синтеза путем промывания продуктов реакции эфиром. Хотя вышеназванные известные способы производства фармакологически активных хелидониновых производных, в основном, являются такими, что необходима очистка конечного продукта с использованием воспламеняющихся или даже взрывоопасных растворителей, теперь обнаружено, что очистка могла бы также, и даже с лучшими результатами, выполняться с использованием водного растворителя. В Zhao Y. et al., Chinese Pharmaceutical Bulletin (Yaoxue Tongbao) 16 (1981) 7-10 и базе данныхChemical Abstracts (Online), Database accession no. 1982:173909 описано изучение возможного фармакологического воздействия хлорида N-метилпротопина на пациентов, страдающих от малярии. Из уровня техники известно, что алкалоид сангвинарин и его соли обладают широким спектром биологической активности. В Tanaka S. et al., Planta Med. 67 (2001) 108-113 описан противовоспалительный эффект хлорида сангвинарина. В Schmeller Т. et al., Phytochemistry 44 (1997) 257-266 раскрыта биохимическая активность сангвинарина по опосредованию химической защиты растений от микроорганизмов, вирусов и травоядных животных. В Walterova D. et al., Journal of Medicinal Chemistry 24 (1981) 1100-1103 описано ингибирующее воздействие сангвинарина на ферментативную активность аланиновой аминотрасферазы печени. В Ishii H. et al., Chemical and Pharmaceutical Bulletin 33 (1985) 4139-4151 и Nakanishi T. et al., Journalof Natural Products 62 (1999) 864-8 67 описана противоопухолевая активность сангвинарина. В Lombardini J.B. et al., Biochemical Pharmacology 51 (1996) 151-157 описано ингибирующее воздействие сангвинарина на ферментативную активность митохондриальной киназы из сердца крысы. В Ulrichova J. et al., Toxicology Letters 125 (2001) 125-132 описано цитотоксическое воздействие сангвинарина на гепатоциты в культуре клеток. Получение ряда производных алкалоидов, отличных от производных хелидонина, также известно из уровня техники. В Valpuesta M. et al., Tetrahedron 58 (2002) 5053-5059 раскрыт синтез нескольких производных алкалоидов - цис- и транс-N-метил-1-метоксистилопиниевых солей - из алкалоида культеропина, основного алкалоида Romneya coulteri, в органических растворителях. В Slavik J. et al., Collection of Czechoslovak Chemical Communications 41 (1976) 285-289 раскрыто выделение алкалоидных производных в форме йодидов и перхлоратов из корней Argemone platycerasLINK et OTTO. В Schmidt E., Achiv der Pharmazie 231 (1893) 168-183 раскрыто получение -гомохелидонинметилйодида путем нагревания чистого основания в избытке метилйодида и перекристаллизации продукта реакции из спирта. В Таkао N. et al., Chemical and Pharmaceutical Bulletin 21 (1973) 1096-1102 раскрыто получение 11 эпикоринолинйодметилата путем реакции алкалоида 11-эпикоринолина из Corydalis incisa с метилйоди-1 009049 дом в смеси органических растворителей и перекристаллизации продукта реакции из смеси органических растворителей. В Danckwortt P.W., Archiv der Pharmazie 250 (1912) 590-646 раскрыто получение протопинметилйодида путем реакции протопина, растворенного в ацетоне, с избытком метилйодида и перекристаллизации продукта реакции из спирта. В Manske R.H.F. et al., Journal of the American Chemical Society 64 (1942) 1659-1661 раскрыто получение метосульфата O-этилового эфира хуннеманина из алкалоида хуннеманина, выделенного из Hunnemanniafumariaefolia Sweet. В Redemann C.E. et al., Journal of the American Chemical Society 71 (1949) 1030-1034 раскрыто получение нескольких производных аллокриптопина, где алкалоид аллокриптопин извлекают из Faraga coco и реакции проводят в органическом растворителе. В Zhang G.-L. et al., Phytochemistry 40 (1995) 299-305 описана экстракция и структурный анализ алкалоида N-метилстилопиумхлорида из китайского лекарственного растения Dactylicapnos torulosa. Что касается производных хелидонина, то вышеупомянутые способы получения различных производных алкалоидов не включают и не предполагают проведение стадии промывки с использованием водного растворителя. Сущность изобретения В одном из аспектов данное изобретение относится к новому способу получения продукта реакции алкалоидов, в частности хелидонина, оксихелидонина или метоксихелидонина, с подходящими алкилирующими агентами, причем данный способ включает по меньшей мере одну стадию промывания водным растворителем, предпочтительно водой, после завершения реакции алкилирования. Данный способ включает также стадию превращения алкалоидных производных в водорастворимые соли для изготовления инъекционных фармацевтических препаратов с низкой токсичностью, и имеющих широкий спектр терапевтического действия. В другом аспекте данное изобретение относится к водорастворимым продуктам реакции, например,включающим хелидониновые производные, причем первоначально третичный азот в алкалоидной молекуле превращен в четвертичный азот и причем четвертый лиганд к четвертичному азоту является остатком низшего алкила, предпочтительно метильным или этильным остатком или замещенным метильным или этильным остатком, таким как, например, остаток тиотепа. В предпочтительном воплощении четвертичные хелидониновые производные имеют такую природу, что селективно накапливаются в тканяхмишенях, особенно в раковых тканях. В другом аспекте данное изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно из четвертичных алкалоидных производных, в частности четвертичных хелидониновых производных, получаемых способом по данному изобретению. Данное изобретение, кроме того, относится к применению продуктов реакции, включающих четвертичные алкалоидные производные, в качестве лекарственных средств для использования в терапии и к применению указанных производных для производства фармацевтических композиций для терапевтического лечения различных болезней и патологических состояний организма. Дополнительные воплощения данного изобретения изложены в формуле изобретения. Подробное описание изобретения Способ по данному изобретению включает реакцию алкалоида или смеси алкалоидов в органическом растворителе с алкилирующим агентом, предпочтительно с алкилирующим агентом, который сам обладает терапевтической активностью, таким, например, как цитотоксические фосфорамиды или производные фосфорной кислоты, содержащие по меньшей мере одну азиридиновую группу, а затем промывание продуктов реакции водой. Стадия промывания водой или эквивалентным водным растворителем,например мягким раствором соли, облегчает, среди прочего, последующую стадию превращения плохорастворимых или нерастворимых в воде продуктов реакции, т.е. четвертичных алкалоидных производных, в растворимые в воде соединения, например соли. Предпочтительно, чтобы в случае, когда алкилирующий агент является цитотоксическим веществом, он был также растворимым в воде или, по меньшей мере, разлагался при контакте с водой до водорастворимых компонентов, чтобы была возможность существенного удаления непрореагировавшего алкилирующего средства или его частей из реакционной смеси с помощью стадии промывания водой. Стадия промывания водой дает возможность существенно упростить процесс производства, так как больше нет необходимости предпринимать сложные меры безопасности, связанные с риском взрыва чистых органических растворителей, например диметилового эфира, что позволяет легко осуществлять масштабирование. Кроме того, нежелательные водорастворимые компоненты, присутствующие в реакционной смеси, тем самым отделяют от продуктов реакции и удаляют. Неожиданно было обнаружено,что стадия промывания оказывает положительное воздействие на структуру и состав продуктов реакции так, что эффективность последующей стадии превращения продуктов в водорастворимую форму увеличивается в 10-15 раз по сравнению со способом, где стадию промывания осуществляют, используя чисто органический растворитель, заметно улучшая, таким образом, выход конечного продукта. Данный способ можно использовать, например, для реакций алкилирования алкалоидов канцеро-2 009049 статическими фосфоросодержащими соединениями, названными в п.1 AT 377988, причем фосфорные соединения, представленные на фиг. 3 данной заявки, являются особенно подходящими, и наиболее предпочтительны, в частности, те, которые имеют азиридиновую группу. Термин хелидонин в соответствии с описанием должен относиться к соединениям, выбранным из группы, состоящей из хелидонина, оксихелидонина и метоксихелидонина, если иначе не указано или не следует из описания. Подходящим органическим растворителем по данному изобретению является любое вещество, в котором алкалоиды, предназначенные для реакции, растворяются. Эти алкалоиды могут быть, например,растворены в органическом растворителе, который облегчает реакцию или способствует реакции алкилирования, таком как растворитель, выбранный из группы, состоящей из монохлорметана, дихлорметана,трихлорметана, монохлорэтана, дихлорэтана и трихлорэтана. Реакция алкилирования алкалоидов происходит при повышенной температуре, предпочтительно при температуре кипения растворителя. Получающийся продукт реакции превращают в водорастворимую форму после промывания водой. Это может быть осуществлено способом, описанным в AT 377988 и AT 354644, превращением в водорастворимые соли, в частности в гидрохлориды, например, путем пропускания сильной кислоты в жидкой или газообразной форме, такой как газ НСl, или добавления раствора НСl в органический раствор промытого продукта реакции, в процессе чего и после чего гидрохлориды выпадают в осадок. По-видимому, при этой обработке кислотой большая часть алкилирующего агента отщепляется от промежуточного продукта реакции, образующегося между алкалоидами и алкилирующим агентом, образуя модифицированные алкалоидные производные, причем сначала третичные атомы азота превращаются в четвертичные атомы азота, где с четвертичным азотом связан водородный остаток или остаток, происходящий из алкилирующего агента, в качестве четвертого лиганда, причем остаток предпочтительно выбран из группы, состоящей из метила, этила и трис(1-азиридинил)фосфинсульфидного остатка или из части трис(1-азиридинил)фосфинсульфида. Для лучшего понимания, следующая формула (I) иллюстрирует типичный продукт реакции четвертичного алкалоида по изобретению, в качестве примера которого приведен хелидонин:R1 = метил, этил, трис(1-азиридинил)фосфинсульфид, метил-R2, этил-R2, причем R2 является частью трис(1-азиридинил)фосфинсульфида. По элементному анализу одного из продуктов реакции, осажденного по данному изобретению (см. пример 3), видно, вне связи с теорией, что по меньшей мере часть алкилирующего агента или продуктов разложения алкилирующего агента, полученных путем обработки кислотой реакционной смеси после прекращения алкилирования, например реакции образования четвертичного соединения, может быть заключена до некоторой степени в кристаллах осадка или как-то сильно связана с кристаллами, что препятствует очистке осадка промыванием органическими растворителями, такими как эфир и дихлорметан. Тем не менее, можно доказать, что продукт реакции является все еще полностью функциональным даже в присутствии таких сопровождающих веществ. Водорастворимая соль продукта реакции пригодна для применения в инъекционных растворах. В одном из воплощений реакцию осуществляют с помощью трис(1-азиридинил)фосфинсульфида(CAS52-24-4), который по фармакопее известен как тиотепа. Дополнительными синонимами являются ледертепа, онкотиотепа, TESPA, теспамин, тиофосфамид, тио-ТЕПА, тиотриэтиленфосфорамид, тифосил,триазиридинилфосфинсульфид, N,N',N-три-1,2-этандиилфосфоротиоина триамид; N,N',N-три-1,2-этандиилтиофосфорамид, три(этиленимино)тиофосфорамид; N,N',N-триэтилентиофосфорамид, триэтилентиофосфоротриамид, м-триэтилентиофосфорамид, м-трис(азиридин-1-ил)фосфинсульфид, триэтилентиофосфорамид, трис(1-азиридинил)фосфинсульфор, трис(этиленимино)тиофосфат, TSPA и WR 45312. В дополнительном воплощении данного изобретения экстракт алкалоидов, необязательно всех алкалоидов Chelidonium majus L., в органическом растворителе приводят во взаимодействие с трис(1-азиридинил)фосфинсульфидом (тиотепа) и получающийся продукт реакции, необязательно присутствующий в виде смеси соединений, затем промывают по меньшей мере 1 раз водой. Так как тиотепа разлагается в воде, непревращенный остаток тиотепа, присутствующий в избытке после реакции, может быть удален из органической фазы с помощью этой меры. Предпочтительно органический раствор, содержащий промежуточный продукт реакции, т.е. соединение, образованное из алкилирующего агента и алкалоида, промывают несколько раз и каждый раз насыщают водой. Особенно предпочтительно, когда промывание повторяют до тех пор, пока из продукта реакции не будет полностью удален избыток высокотоксичного тиотепа. Кроме того, некоторые водорастворимые токсические алкалоиды, которые способствуют побочным-3 009049 реакциям при медицинском применении и могут даже вызывать цирроз печени, удаляют с водной фазой из смеси после синтеза или снижают их концентрацию. С помощью испытания Ames показано, что продукт реакции данного воплощения, полученный по данному изобретению, не является мутагенным. Когда исходят из экстракта всех алкалоидов из Chelidonium majus L., конечный продукт реакции является смесью алкалоидов, содержащей продукты реакции тиотепа с алкалоидами с более высоким молекулярным весом. В результате процесса синтеза растворимость алкалоидов меняется. Третичные алкалоиды представляют основную часть исходных компонентов алкалоидного экстракта, получаемого из Chelidonium majus L. Например, в смеси для синтеза в качестве исходных компонентов могут содержаться следующие третичные алкалоиды: хелидонин, протопин, стилопин, аллокриптопин, -гомохелидонин, хеламидин, хеламин, L-спартеин, хелидимерин, дигидросангвинарин, оксисангварин, оксихелидонин и метоксихелидонин. После прекращения реакции алкилирования непрореагировавшие четвертичные алкалоиды (например, берберин), по существу, удаляются из реакционной смеси с помощью стадии промывания водой,тогда как непрореагировавшие нерастворимые в воде алкалоиды и продукты реакции в виде алкилированных алкалоидов остаются в органическом растворителе. В зависимости от природы органического растворителя и/или алкилирующего агента, используемых для реакции алкилирования, получающийся промежуточный продукт реакции может содержать связанные с тиотепа соединения, причем одна молекула тиотепа связана с одной молекулой, двумя или тремя молекулами хелидонина, оксихелидонина или метоксихелидонина. Кроме того, он может содержать алкилированные алкалоидные производные, причем молекула алкалоида, например молекула хелидонина, оксихелидонина или метоксихелидонина, связана по его четвертичному азоту с линейным алкильным остатком с короткой цепью, в частности с метильной или этильной группой. Еще дополнительные соединения реакции алкилирования могут быть представлены в реакционной смеси после прекращения реакции алкилирования. Продукт реакции, полученный по реакции алкалоидов Chelidonium majus L., в целом, с тиотепа в соответствии с данным изобретением, демонстрирует лучший спектр терапевтического действия, чем продукт реакции, полученный при аналогичном процессе, когда стадию промывания осуществляли с помощью органического растворителя, например диэтилового эфира. По меньшей мере, некоторые соединения, представленные в продукте реакции по данному изобретению, в частности четвертичные производные хелидонина, селективно накапливаются в раковых тканях и разрушают раковые клетки путем апоптоза, но, в противоположность наиболее известным цитостатическим средствам, без поражения также здоровых клеток. Это приводит к хорошей переносимости лечения этим препаратом и его общему удобству для терапевтического и профилактического использования у лиц с повышенным риском развития рака из-за, например, возрастной предрасположенности. Он прост в обращении и не дает значительных побочных реакций в терапевтических дозах. Продукт реакции, полученный по реакции алкалоидов Chelidonium majus L., в целом, с тиотепа,проявляет биологическую активность по регуляции метаболизма и пригоден для профилактики и терапии метаболических заболеваний, таких как остеопороз, но также ревматических заболеваний, аллергий,вирусных инфекций, эпилепсии, рассеянного склероза, шрамов, опухолей кожи, послеоперационных ран и радиационного поражения. Экстракт высушенных корней Chelidonium majus L. можно использовать в качестве исходного материала для синтеза. Корни имеют более высокое содержание алкалоидов, чем листья или стебель. Неожиданно совсем недавно было обнаружено, что, когда исходят из коммерчески доступного хелидонина, оксихелидонина или метоксихелидонина в качестве единственного источника алкалоида, продукт реакции, полученный по методу данного изобретения (см., например, пример 3, ниже), проявляет терапевтические свойства и действие, которые, по меньшей мере, сравнимы с этими показателями для продукта реакции, получающегося при реакции алкилирования алкалоидов Chelidonium majus L. по примеру 1. Обычные фармацевтические вспомогательные вещества, в частности, для растворов, например инъекционных или инфузионных растворов, или для основы мазей, компрессов или суппозиториев пригодны для лекарственных средств, которые содержат продукты реакции, полученные по данному изобретению. Краткое описание фигур Фиг. 1 показывает диаграмму ВЭЖХ с характерным составом алкалоидов, в целом, из корнейChelidonium majus L. Фиг. 2 показывает характерную картину ВЭЖХ препарата по примеру 1. Фиг. 3 представляет избранные фосфорные производные, пригодные в качестве реагентов. Фиг. 4 представляет спектр ядерного магнитного резонанса продукта реакции U-KRS. Фиг. 5 представляет УФ-спектр продукта реакции U-KRS. Фиг. 6 представляет УФ-спектр гидрохлорида хелидонина. Фиг. 7 представляет первый раздел масс-спектра продукта реакции U-KRS. Фиг. 8 представляет второй раздел масс-спектра продукта реакции U-KRS при высоком разрешении. Фиг. 9 представляет масс-спектр гидрохлорида хелидонина. Следующие примеры представлены для дополнительной иллюстрации данного изобретения.a. 25 г смеси солей алкалоидов суспендируют в воде и переносят в делительную воронку. После добавления 100 мл дихлорметана делительную воронку встряхивают. Затем органическую фазу отделяют и фильтруют в стеклянную бутыль.b. 1N NaOH (pH 8-9) добавляют к водной фазе до тех пор, пока не появится муть. После добавления 100 мл дихлорметана смесь встряхивают. Органическую фазу затем отделяют и объединяют с дихлорметановой фазой со стадии а. Этот процесс повторяют, например, 3 раза. Органические фазы фильтруют и объединяют.c. Водную фазу доводят до рН 10 добавлением NaOH. После добавления дихлорметана смесь встряхивают, фильтруют и смешивают с другими органическими фазами. Затем водную фазу доводят до рН 13 с помощью NaOH и повторяют экстрагирование дихлорметаном.d. Объединенные органические фазы выпаривают с получением маслянистого коричневого вещества.B) Реакция с трис(1-азиридинил)фосфинсульфидом. Алкалоидный остаток растворяют в дихлорметане и добавляют трис(1-азиридинил)фосфинсульфид. Смесь нагревают с обратным холодильником при 80 С в течение 2 ч. После охлаждения до комнатной температуры реакционную смесь осветляют. Затем проводят фильтрование и фильтрат несколько раз промывают, например 3 раза или более, 250 мл воды в разделительной воронке.C) Реакция с HCl. Промытый раствор переносят в стеклянный лабораторный стакан, перемешивают и насыщают газообразным НСl, причем гидрохлоридный комплекс выпадает в осадок. Осажденный продукт отфильтровывают и промывают диэтиловым эфиром, сушат и затем растворяют в воде. На крысах было определено значение LD50, равное 485 мг/кг для продукта реакции по примеру 1. Исследования на мышах и крысах показали, что продукт по данному изобретению модулирует гормональную регуляцию тимуса и вызывает синтез веществ, обладающих тимозиноподобной активностью у животных, у которых удален тимус. Этот эффект зависит от дозы. Препарат увеличивает число Т-лимфоцитов в периферической крови до 50% (4,040,43 х 109/л до лечения, 6,240,73 х 109/л после лечения), модулирует гуморальный иммунный ответ в отношении проникновения антигена и природную киллерную клеточную активность клеток селезенки (198,2017,69% по сравнению с 71,509,10% в контрольной группе) и повышает потенциал высвобождения интерферона из корпускул белых кровяных телец при экспериментах на животных. Результаты экспериментов на животных подтверждаются клиническими наблюдениями. Таким образом, у раковых пациентов также наблюдается улучшение иммунных параметров. Дозы, равные примерно 5 мг препарата из примера 1 на 70 кг веса тела, можно использовать для профилактического и иммунологического применения. Что касается лечения рака, предпочтительно вводят 5 мг препарата на 20 кг веса тела. Пример 2. Характеристические хроматограммы ВЭЖХ. Определение осуществляли ион-парной хроматографией с обращенной фазой в градиентном режиме и при спектральном измерении с использованием DAD детектора при 285 нм. В то же время хроматограммы получали с использованием стандартных алкалоидов. Кроме того, проводили анализ ВЭЖХМСД, который показал, что не было других пиков, кроме пиков алкалоидов. Диаграммы ВЭЖХ на фиг. 1 и 2 получали на основе следующих экспериментальных данных. Параметры хроматографии. Колонка: LiChrospher 60 RP Select В, 5 мкм, 125x24 мм ID. Элюент: А) 200 мл (ацетонитрил) + 800 мл (вода) + 1,5 г (гексансульфоновой кислоты) + 0,3 мл (85% фосфорной кислоты). В) 900 мл (ацетонитрил) + 100 мл (воды) + 1,5 г (гексансульфоновой кислоты) + 0,3 мл (85% фосфорной кислоты). Градиент: 5 мин изократично 100% А; до 40% В в течение 24 мин; до 100% В в течение 1 мин; 5 мин 100% В; 5 мин уравновешивания со 100% А. Определение: УФ-облучение при 285 нм. Скорость потока элюирования: 1 мл/мин, остановка после 35 мин. Объем инжекции: 10 мкл. Подготовка образца. Экстракт перед реакцией (фиг. 1): 25 мг алкалоидов растворяют в 40 мл метанола с помощью ультразвука, доводят до 50 мл и фильтруют через мембранный фильтр. Продукт реакции (фиг. 2): продукт реакции превращали в гидрохлоридную соль, растворяли в воде до концентрации 1 мг/мл и доводили до рН между 2,5 и 6,5.-5 009049 Пример 3. Коммерчески доступный очищенный хелидонин (Sigma) подвергали взаимодействию с трис(1-азаридинил)фосфинсульфидом (=тиотепа) в соответствии с условиями, описанными в примере 1. После прекращения реакции алкилирования, последующей стадии промывания и стадии превращения с использованием газообразного HCl конечный продукт дополнительно обрабатывали следующим образом. 340 г обработанного НСl, следовательно, водорастворимого продукта реакции растворяли в воде, и концентрировали до близости к насыщению, и оставляли в покое в холодильнике при 8 С. Через несколько часов происходило спонтанное выпадение осадка, и собирали 264 мг осадка (здесь далее называемого U-KRS). Осадок состоял из слегка желтоватых гигроскопичных кристаллов, имеющих довольно узкий интервал температуры плавления, представляющий 205-207 С (что указывает на довольно хороший кристаллический продукт) и дающий флуоресценцию голубым светом на облучение УФ-светом при 366 нм. Были также видны следы желтой, оранжевой и красной флуоресцентных полос. Продукт не двигался, когда его подвергали тонкослойной хроматографии, а оставался на старте (Rf=0), за исключением следов веществ, которые передвигались, по меньшей мере, с получением Rf0,1. Из спектра ядерного магнитного резонанса (ЯМР) (фиг. 4) становится ясным, что U-KRS содержит ароматические кольца,сравнимые с кольцами, содержащимися в молекуле хелидонина. УФ-спектр (фиг. 5) показывает максимумы поглощения при 148, 155, 160, 205, 230 и 282 нм, очень похожие на УФ-спектр хелидонина (фиг. 6),что отличается от него только тем, что пик U-KRS при 230 нм появляется при 240 нм для хелидонина. Это показывает, что азот в U-KRS является четвертичным, тогда как в хелидонине он является третичным. Следующие примеры показывают разное применение соединения U-KRS, получаемого по методике, описанной в примере 3. Пример 4. Селективное подавление роста клеток in vitro противоопухолевым лекарственным средством U-KRS. Материалы и методы. Культуру клеток получали в бутылях Roux при 37-37,5 С во влажной атмосфере, содержащей 8% СО 2. Слитные культуры снимали раствором из 0,01% трипсина и 0,2% ЭДТА в фосфатно-буферном физиологическом растворе (ФБФР) и разделяли в отношении от 1:5 до 1:25. Человеческие эндотелиальные клетки выделяли из пупочных вен с помощью обработки коллагеназой. Культуральной средой для эндотелиальных клеток была М 199, дополненная 15% инактивированной нагреванием фетальной телячьей сыворотки, 200 мкг/мл фактора роста эндотелиальных клеток и 90 мкг/мл гепарина. Флуоресцентная микроскопия. Клетки подращивали в 35 мм чашках и инкубировали с 100 мкг/мл U-KRS в течение 30-60 мин. Культуральную среду аспирировали, клетки промывали дважды ФБФР. На клетки помещали покровные стекла и флуоресценцию возбуждали с использованием конфокального лазерного сканирующего микроскопа, оборудованного аргоновым лазерным источником. Излучаемый свет проходил детекцию в канале фотоумножителя. Сигналы отображались на видеомониторе с использованием программного обеспечения для обработки изображения MRC 600. Результаты. 1. В интервале концентраций 20-40 мкг/мл U-KRS было определено 55% подавление роста эндотелиальных клеток. Эта концентрация убивала клетки линии человеческой остеосаркомы. Гибриды двух типов клеток показали примерно ту же чувствительность, что и нормальные клетки. 2. Благодаря его аутофлуоресценции U-KRS можно обнаружить внутри клеток. Лазерный сканирующий микроскоп показал высокое поглощение U-KRS злокачественными клетками. Пример 5. U-KRS в качестве противоракового агента - потребление кислорода. Материалы и методы. Эксперименты in vivo на мышах: от 2 до 5 из контрольных животных, которые были в 8-дневном возрасте, каждому вводили инъекцией в/б 50 мкл асцитной суспензии мышиной опухоли Эрлиха, свежезабранной у вполне взрослого животного-донора. Контрольная группа больше не получала какого-либо воздействия. Испытуемой группе делали инъекции 10 мг U-KRS/кг в абдоминальную область сразу после имплантации опухоли. Результаты. Мыши, которым имплантировали опухолевые асциты, или после внутрибрюшинного, или после подкожного введения U-KRS, демонстрировали более долгий срок выживания, чем животные с имплантатами, которых никак не лечили. Количественное определение потребления кислорода асцитной суспензии опухоли с помощью электрода in vitro давало краткое повышение потребления после добавления U-KRS с последующим, однако, быстрым снижением, в отличие от наблюдаемого у контрольной суспензии, не смешанной с U-KRS. Пример 6. Модификация антиноцицептивного действия морфина с помощью U-KRS у грызунов. Материалы и методы. Животные: эксперименты выполняли на самцах мышей Albino Swiss и самцах крыс Wistar. Лечение: U-KRS вводили в/б в дозах, исходя из 20 мг/кг для мышей и 25 мг/кг для крыс. Методики эксперимента: в каждом эксперименте четырем группам животных вводили инъекцией-6 009049 1) плацебо, 2) морфин, 3) U-KRS, 4) U-KRS и морфин. Результаты. Результаты показали, что одновременное введение U-KRS и морфина модифицировало действие наркотического анальгетического лекарственного средства. Оно давало антиноцицептивное действие при тесте отдергивания хвоста у крыс, наблюдаемое как повышение латентного периода. Данные результаты показывают, что U-KRS, вводимый одновременно с морфином, изменяет чувствительность экспериментальных животных к ноцицептивной реакции в описанных испытаниях. Данные испытания свидетельствуют о том, что U-KRS может взаимодействовать с анальгетическими лекарственными средствами, которые используют при раке. Пример 7. Индукция бимодальной программируемой гибели злокачественных клеток с помощью производного U-KRS. Материалы и методы. Использовали клеточную линию эритролейкемии K562 и U-KRS, полученный в чистой кристаллической форме и растворенный в воде до концентрации 1,2 мг/мл. Содержание ДНК в клетках K562, на которые воздействовали разными концентрациями U-KRS,анализировали, используя йодид пропидия и поточную цитометрию. Результаты. Результаты этого исследования показывают, что U-KRS индуцирует бимодальные программы гибели клеток, первая из которых, апоптоз, опосредуется чувствительными к хинидину, зависимыми от Са 2+ каналами K+; вторая модальность, блистерная гибель клеток, опосредуется предотвращением образования микроканальцев и индуцированием, таким образом, полиплоидии. Пример 8. Влияние U-KRS на ДНК, РНК и синтез белка в злокачественных клетках. Материалы и методы. Меченый 3 Н-тимидин, 0,5 мкКи в 20 мкл среды; уридин, 0,5 мкКи в 20 мкл среды, и лейцин, 1,0 мкКи в 20 мкл среды, помещали на 2-4 ч в четыре лунки с разными концентрациями U-KRS. Перед этим подращивали клеточные линии гепатоцитов морских свинок, гепатоцитов C1L, клеток человеческих миндалин, мышиных лимфом, мышиной миеломы, клеток Yoshida, двух штаммов HeLa, лимфом EsB-, ЕВ,ZAC/1, P815 24 ч при 37 С в 96 микротитровальных лунках. Клетки WiDr инкубировали по несколько другой схеме в течение 6 и 24 ч при концентрациях UKRS 1, 4, 8 и 14 мкг/мл U-KRS. Результаты. Флуорометрические оценки показывают более сильную аффинность U-KRS к элементам ядра раковых клеток, чем к другим частям раковой клетки. Явление флуоресценции может ясно показать сильное и быстрое связывание, проявляемое U-KRS в области опухоли и метастазов. Не наблюдалось токсического действия на нормальные клетки, обработанные дозами, которые являются 100-процентно подавляющими рост линий раковых клеток, испытанных к настоящему времени. Пример 9. Влияние U-KRS на человеческие ксенотрансплантаты. Материал и метод. Опухолевые клетки отбирали из ксенотрансплантатов человеческой опухоли и серийно трансплантировали голым мышам. Эти клетки использовали в исследовании образования колоний in vitro. Опухолевые клетки инкубировали непрерывно в течение по меньшей мере 1 недели с несколькими концентрациями лекарственного средства U-KRS. Это было выполнено с шестью разными типами, и образование колоний оценивали для каждой опухоли. Действие лекарственного средства регистрировали как процентное отношение И/К (испытание/контроль). Результаты. Много разных видов опухолей чувствительно к U-KRS, в корреляции с разнообразием испытанных с U-KRS. Опухолецидные эффекты зависят, по-видимому, от способности иммунного аппарата к регенерации, стимуляция и модуляция которой может быть выполнена с помощью U-KRS. Пример 10. Влияние U-KRS на линии человеческих злокачественных клеток. Материалы и методы. Использовали четыре разных линии злокачественных клеток: 1) мышиной саркомы; 2) карциномы молочной железы женщины; 3) карциномы толстого кишечника человека; 4) человеческой меланомы. В культуральную среду добавляли производные U-KRS и РР 9 АА 02. После облучения 200 клеток помещали на предметное стекло и инкубировали в течение 1 недели,затем окрашивали и подсчитывали. Результаты. Представленные здесь результаты показали, что производные U-KRS и РР 9 АА 02 действуют на линии человеческих злокачественных клеток синергидно как цитотоксические вещества. Пример 11. Индуцирование остановки роста G2/M и апоптоз у линий клеток человеческой эпидермоидной карциномы с помощью U-KRS. Материалы и методы. Первичные человеческие кератиноциты выделяли из образцов кожи новорожденных. Эпидермаль-7 009049 ные слои трипсинизировали и суспензии одиночных клеток собирали центрифугированием. Результаты.U-KRS подавляет развитие клеточного цикла зависимым от дозы образом. Обработка U-KRS действует на распределение в клеточном цикле и вызывает апоптоз у клеток А 431 и МЕ 180. Экспрессия циклинов, CDK и CDK ингибитора р 27 изменяется после воздействия U-KRS. Пример 12. Антиметастазное действие U-KRS и его влияние на кислородный и энергетический метаболизм у мышей с меланомой В-16. Материалы и методы. Эксперимент проводили на самцах мышей 133 С 57 В/6. Метастазирующую меланому В-16 трансплантировали в мышцу правой голени каждой мыши. На 10-й день после трансплантации опухоли животных делили на две группы. Первой группе вводили U-KRS в венозный синус глаза в дозе 1 мг/кг в объеме 0,05 мл: 5 инъекций 1 раз через 2 дня. Второй группе вводили стерильный физиологический раствор в венозный синус в том же режиме. Результаты. Исследование показало, что через день после первой внутривенной инъекции U-KRS индексы кислородного режима в мышечной ткани заметно улучшились. Степень уровня рО 2 повысилась до максимума во время вдыхания кислорода, а степень рО 2 снизилась с максимума до исходного уровня после прекращения ингаляции. У животных экспериментальной группы некоторые показатели окислительного фосфорилирования в митохондриях печени также улучшились через день после введения препарата. Известно, что при прогрессировании злокачественного процесса уровень кислорода и метаболизм снижаются. У мышей, которые получали 5 инъекций U-KRS, такое подавление менее выражено. У животных контрольной группы уровень кислородной напряженности в мышечной ткани и степень доставки кислорода в нее были статистически выше. Обобщая полученные данные, можно заключить, что U-KRS у мышей с меланомой В/16 улучшает доставку кислорода в ткани, а также подавляет деструктивный эффект злокачественного процесса на биоэнергетику организма. Последующие примеры иллюстрируют свойства иммуномодуляции и регуляции метаболизма UKRS, которые делают U-KRS особенно пригодным для терапевтического лечения аллергических реакций, вирусных заболеваний (ВИЧ, гепатит А, В и С, инфекции, вызванные Е. coli, грипп), остеопороза,полиартрита, псориаза и других заболеваний или патологических состояний организма. Пример 13. Усиление опухолецидной активности макрофагов U-KRS. Материалы и методы. Мышей BALB/c выдерживали со спариванием брат/сестра в лаборатории. Опухоль D1 DMBA/3 обычным образом трансплантировали мышам BALB/c путем п/к инъекции. Опухоль становилась видимой через 5 дней после имплантации. Лечение U-KRS in vivo начинали через 5 дней после подкожной имплантации опухоли. Применяли три пути введения, т.е. внутривенный, внутрибрюшинный и подкожный. Все три экспериментальные группы, из по меньшей мере 10 мышей каждая, получали 5,0 мкм U-KRS в 0,15 мл ФБФР. Эту дозировку выбрали на основе предварительных экспериментов. Результаты. Скорость роста опухоли у лечившихся мышей была значительно снижена. У мышей, получающихU-KRS, не было показано какого-либо повреждающего связанного с лекарственным веществом действия. Пример 14. Воздействия U-KRS in vitro на фенотип нормальных человеческих лимфоцитов. Материалы и методы. Данное исследование выполняли на лимфоцитах, выделенных из периферической крови 10 здоровых добровольцев. Клетки выделяли центрифугированием на градиенте плотности Ficoll-Paque. Жизнеспособность клеток определяли окрашиванием 0,1% трипановым синим, и обнаружено, что она составляла 95%. Субпопуляцию лимфоцитов подсчитывали с помощью иммунофлуоресценции, используя моноклональные антитела против суммы Т-клеток, Т-хелперных клеток и Т-супрессорных клеток. Потом клетки обрабатывали конъюгированными с ФИТЦ F/ab/2 фрагментами кроличьего противомышиного IgG, промывали ФБФР и помещали на предметные стекла, используя поливиниловый спирт и глицерин. В контрольных препаратах использовали ФБФР или нормальную мышиную сыворотку вместо моноклональных антител. Результаты. Данное исследование, показывающее возможность прямого влияния U-KRS на Т-клеточные субпопуляции, подтвердило более ранние наблюдения, что U-KRS мог быть хорошим стимулятором клеточного иммунитета у раковых больных. Пример 15. Митогенные свойства U-KRS в отношении моноцитов периферической крови человека. Материалы и методы. Мононуклеарные клетки периферической крови: кровь разбавляли равным объемом ФБФР, содержащего 1 мМ ЭДТА, рН 7,5, и наслаивали на Histopaque 1077. Пробирки центрифугировали при 2000 об./мин-8 009049 в течение 30 мин. Слои на поверхности раздела, содержащие лимфоциты, собирали и промывали 3 раза средой для культуры тканей RPMI. Результаты. Было обнаружено, что даже короткий период предварительной обработки клеток U-KRS оказывал сильный синергический эффект на ФГА митогенез, приводящий к значительно более высоким показателям стимуляции клеток, чем показатели только с ФГА. Более того, было обнаружено, что короткий период обработки клеток ФГА почти обязателен для проявления U-KRS его митогенного действия. Это исследование показывает значительное увеличение циркулирующих лимфоцитов у больных с развитыми стадиями злокачественных заболеваний, которых лечили U-KRS. Пример 16. Модулирование цитолитической активности иммунных эффекторных клеток и подавление роста опухоли с помощью U-KRS in vivo. Материалы и методы. Опухолевые клетки: линии клеток мастоцитомы Р 815 и AKR лейкемии AKIL поддерживали на среде DMEM, дополненной 9% фетальной бычьей сыворотки, содержащей пенициллин и стрептомицин. Результаты. Данное исследование in vivo демонстрирует, что U-KRS является эффективным модулятором биологического ответа, усиливающим до 48 раз литическую активность лимфоцитов селезенки, полученных от аллоиммунизированных мышей. Литическая активность клеток селезенки, обработанных IL-2, и лимфоцитов перитонеального эксудата была значительно повышена добавлением U-KRS к среде для опосредуемого клетками лизиса. Результаты, рассматриваемые вместе с тем, что U-KRS также увеличивает цитолитическую активность лимфоцитов селезенки, показывают, что терапевтический эффект U-KRS, наблюдаемый in vivo,опосредуется стимуляцией цитолитической активности иммунных эффекторных клеток. Пример 17. Влияние U-KRS на иммунологические параметры крови in vitro и in vivo. Материалы и методы. Для этого исследования использовали 96 крыс Wistar. Исходный возраст составлял 16 недель как для самцов, так и для самок крыс.U-KRS и ФГА испытывали в исследовании с 3 Н-тимидином на Т-лимфоцитах для оценки показателя стимуляции при дозах от 0,01 до 20 мкг/мл. Результаты.U-KRS стимулирует разные субпопуляции гематопоэтических и иммунологических систем. При этом эксперименте индуцировался ретикулоцитоз как возможный признак стимуляции некоторых стволовых клеток или общей активации эритропоэтической системы. Так как не могло быть продемонстрировано никаких изменений абсолютного числа лейкоцитов, можно утверждать, что при действии U-KRS в этом эксперименте проявлялись только сильные модулирующие свойства, например дислокация разных субпопуляций, происходящая в этом эксперименте. Стимуляцию, сравнимую со стимуляцией, получаемой при этих экспериментах, наблюдали in vitro,включая апоптоз у раковых клеток. Пример 18. Подавляющее действие U-KRS на антигенность овальбумина и антиовальбуминовыйIgE антительный ответ у мышей. Материалы и методы. Способность U-KRS подавлять вызванную овальбумином сенсибилизацию испытывали на мышахBALB/c и F1 (BALB/c x C57BI/6J). U-KRS, введенный мышам в смеси с антигеном (овальбумин) и адъювантом (квасцы), подавлял сенсибилизацию мышей, отражаемую в более низком анти-ОА IgE антительном ответе, и снижал вызываемое антигеном выделение гистамина тучными клетками, выделенными из перитонеальной полости сенсибилизированных мышей. Действие U-KRS на антигенность овальбумина(ОА) при анафилаксии испытывали при гетерологичной пассивной кожной анафилактической (ПКА) реакции у крыс. Результаты. Результаты показывают, что ОА, приготовленный в виде смеси с U-KRS, обладал сниженной способностью реагировать с анти-ОА IgE антителами, уровень которых к природному ОА у мышей повышался, и фиксировался на поверхности тучных клеток крыс при гетерологичных реакциях ПКА. Результаты говорят о том, что предварительная обработка U-KRS ОА может влиять на его антигенные свойства и на способность реагировать с анти-ОА IgE антителами, возникшими против природных молекул IgE. Пример 19. Эффект лечения U-KRS на ранний остеопороз. Материалы и методы.U-KRS вводили внутрибрюшинно в дозе 30 мг/кг через день в течение 6 месяцев самкам крыс с вызванным овариэктомией ранним остеопорозом. Введение U-KRS начинали на 2-й день после хирургической операции. В конце длительного лечения U-KRS у каждой крысы испытывали прочность обеих плечевых костей и определяли некоторые параметры бедренных костей крыс. Результаты. Результаты показывают, что снижение механической прочности плечевых костей и некоторые из-9 009049 менения в бедре, вызываемые овариэктомией, предотвращались шестимесячным лечением U-KRS. Пример 20. Влияние препарата U-KRS на вирусы гриппа и бактерии E. coli и S. Aureus. Материалы и методы. Вирусы гриппа штамма APR/HON1/34 культивировали на 10-дневных куриных эмбрионах. Использовали бактерии E. coli, полученные из свежего клинического материала, и штамм S. aureus 209P, препарат U-KRS серии 290614. Результаты. Это исследование подтверждает существование противоинфекционного действия препарата U-KRS в инфицированном макроорганизме. Это влияние проявляется через стимуляцию некоторых элементов иммунной системы хозяина в результате вторичной деструкции микроорганизмов или клеток, инфицированных этими микроорганизмами. Пример 21. Биологическая активность U-KRS в отношении вируса гриппа. Материалы и методы. Вирус типа А, культура Port-Chalmers 1/73, антигенная разновидность H3N2. Вирусом 1, 10 и 100EID50 инфицировали эмбрионы. U-KRS растворяли de novo в растворе Хэнкса. Результаты. Было подтверждено, что U-KRS обладает действием, препятствующим развитию инфекционного процесса. Пример 22. Действие U-KRS на эффекты облучения. Материалы и методы. Самцы мышей CBA/J весом 16/20 г. Производили кратковременное гамма-облучение всего тела мышей дозами в интервале от 6,0 до 7,5 Гр. Долговременное облучение совокупной дозой 8,75 Гр выполняли, используя устройство CEGO.U-KRS вводили внутрибрюшинно в дозах 0,1, 1,4 и 12 мг/кг веса тела. Результаты. Способность U-KRS модифицировать эффекты облучения изучали на мышах CBA/J, используя дозировку лекарственного средства от 0,1 до 12 мг/кг. U-KRS, как обнаружено, увеличивает степень выживания мышей на 50-60% при дозах облучения от 5,00 до 7 Гр с отсутствием эффекта при дозе 7,5 Гр. Изменение дозировки лекарственного средства не влияло на исход облучения. Основным итогом данного исследования является обнаружение того, что U-KRS способен к модификации эффектов облучения, когда применяется в профилактическом и лечебном режимах. Пример 23. Эффекты U-KRS против ионизирующего облучения. Материалы и методы. Карцинома молочных желез, колоректальная аденокарцинома, глиобластома и линии клеток аденокарциномы поджелудочной железы. Препарат U-KRS. Действие U-KRS на выживание клеток испытывали при концентрации от 0,2 мкг/мл. Время воздействия было равно 1, 3 и 24 ч, после чего клетки промывали фосфатно-буферным физиологическим раствором и добавляли свежую среду. Результаты. Лечение U-KRS давало в результате зависимое от времени и дозы снижение клоногенного выживания клеток. Все четыре испытанные линии человеческих опухолевых клеток показали разную чувствительность в отношении U-KRS с до 100-кратно более высоким снижением клоногенного выживания по сравнению с человеческими фибробластами в течение 24-часовой инкубации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения продукта реакции алкалоидов, включающего по меньшей мере одно производное алкалоида, содержащее четвертичный азот, включающий:a) получение реакционной смеси, содержащей органический растворитель и по меньшей мере один алкалоид, присутствующий в растении Chelidonium mаjus L. и предпочтительно выбранный из группы,состоящей из хелидонина, протопина, стилопина, аллокриптопина, гомохелидонина, хеламидина, хеламина, L-спартеина и оксихелидонина, и алкилирующий агент, и проведение реакции алкилирования путем взаимодействия по меньшей мере одного алкалоида с алкилирующим агентом в присутствии органического растворителя с образованием по меньшей мере одного производного алкалоида, содержащего четвертичный азот;b) после прекращения реакции проведение по меньшей мере одной стадии промывания реакционной смеси водным растворителем или водой для удаления водорастворимых соединений, присутствующих в реакционной смеси; иc) проведение обработки промытой реакционной смеси сильной кислотой в газообразной или жидкой форме предпочтительно газообразным хлористым водородом или раствором хлористого водорода для превращения по меньшей мере одного четвертичного производного алкалоида в водорастворимую форму, в частности в водорастворимую соль.- 10009049 2. Способ по п.1, где на стадии с) продукт реакции выпадает в осадок во время или после обработки кислотой, после чего осадок отделяют от органического растворителя и, необязательно, дополнительно очищают, используя органические растворители. 3. Способ по п.1 или 2, где реакцию алкилирования осуществляют при повышенной температуре, в частности при температуре кипения растворителя. 4. Способ по любому из пп.1-3, где в качестве источника алкалоидов используют смесь нескольких или всех алкалоидов Chelidonium majus L. 5. Способ по любому из пп.1-4, где в качестве единственного источника алкалоидов используют хелидонин, оксихелидонин или метоксихелидонин. 6. Способ по любому из пп.1-5, где алкилирующий агент представляет собой физиологически активный агент, предпочтительно цитотоксический агент. 7. Способ по любому из пп.1-6, где алкилирующий агент является водорастворимым или разлагается на водорастворимые компоненты при контакте с водой. 8. Способ по любому из пп.1-7, где органический растворитель выбран из группы, состоящей из монохлорметана, дихлорметана, трихлорметана, монохлорэтана, дихлорэтана и трихлорэтана. 9. Способ по любому из пп.1-8, где алкилирующим агентом является трис-(1-азиридинил) фосфинсульфид (CAS 52-24-4). 10. Способ по любому из пп.1-9, где указанное производное алкалоида имеет четвертичный атом азота, с которым в качестве четвертого лиганда связан водородный остаток или остаток, происходящий из алкилирующего агента, и данный остаток предпочтительно выбран из группы, состоящей из метильного, этильного и трис-(1-азиридинил)фосфинсульфидного остатка. 11. Способ по любому из пп.1-9, где указанное производное алкалоида содержит четвертичный атом азота и продукт разложения, образованный в результате обработки кислотой, в качестве четвертого лиганда у указанного атома азота. 12. Продукт реакции алкалоидов, содержащий по меньшей мере одно алкалоидное производное,иное, чем сангвинарин и хлорид М-метилпротопина, имеющее четвертичный азот, причем алкалоид выбран из группы алкалоидов, присутствующих в растении Chelidonium majus L. и предпочтительно выбран из группы, состоящей из хелидонина, протопина, стилопина, аллокриптопина, гомохелидонина,хеламидина, хеламина, L-спартеина и оксихелидонина для применения в качестве лекарственного средства или лекарственного препарата. 13. Продукт реакции алкалоидов по п.12, полученный способом по пп.1-11. 14. Продукт реакции алкалоидов по п.13, полученный по реакции одного или более алкалоидов с алкилирующим агентом, где в производном первоначально третичный азот присутствует в четвертичной форме, с которым в качестве четвертого лиганда связан водородный остаток или остаток, происходящий из алкилирующего вещества, и данный остаток предпочтительно выбран из группы, состоящей из метильного, этильного и трис-(1-азиридинил)фосфинсульфидного остатка. 15. Продукт реакции алкалоидов по п.13 или 14, где по меньшей мере одно производное алкалоида присутствует в форме водорастворимой соли, предпочтительно в форме гидрохлорида. 16. Продукт реакции алкалоидов по любому из пп.13-15, причем хелидонин, оксихелидонин или метоксихелидонин присутствует в качестве единственного источника алкалоида. 17. Продукт реакции алкалоидов по любому из пп.13-16, где данный продукт дополнительно включает по меньшей мере одно соединение, выбранное из группы, состоящей из непрореагировавших третичных алкалоидов, непрореагировавшего алкилирующего агента и продуктов разложения алкилирующего агента. 18. Производное хелидонина, где природно существующий хелидонин присутствует в кватернизованной форме в соответствии со следующей формулой (I): где в качестве четвертого лиганда R1 к четвертичному азоту присутствует водород или метильный или этильный остаток для применения в качестве лекарственного средства или лекарственного препарата. 19. Производное хелидонина по п.18 в водорастворимой форме, предпочтительно в виде соли с сильной кислотой, наиболее предпочтительно в форме гидрохлорида. 20. Производное хелидонина по п.18 или 19, которое характеризуется ЯМР-спектром по фиг. 4 и УФ-спектром по фиг. 5. 21. Применение продукта реакции алкалоидов, содержащего по меньшей мере одно алкалоидное производное, иное, чем сангвинарин и хлорид М-метилпротопина, имеющее четвертичный азот, причем алкалоид выбран из группы алкалоидов, присутствующих в растении Chelidonium majus L., и предпочтительно выбран из группы, состоящей из хелидонина, протопина, стилопина, аллокриптопина, гомохели- 11009049 донина, хеламидина, хеламина, L-спартеина и оксихелидонина, для производства фармацевтической композиции для профилактики или лечения заболевания или патологического состояния организма, выбранного из группы, состоящей из вирусной инфекции, рака, иммунологической дисфункции, метаболической дисфункции и радиационного поражения. 22. Применение по п.21, где заболевание выбрано из группы, состоящей из аллергий, остеопороза,кожных опухолей, инфекций, вызванных вирусом гриппа, ревматических заболеваний, шрамов, послеоперационных ран, эпилепсии и рассеянного склероза. 23. Применение по п.21 или 22, где единственным алкалоидом является хелидонин и продукт реакции алкалоидов характеризуется ЯМР-спектром по фиг. 4 и УФ-спектром по фиг. 5. 24. Применение производного хелидонина по пп.18-20 для производства фармацевтической композиции для профилактики или лечения заболевания или патологического состояния организма, выбранного из группы, состоящей из вирусной инфекции, рака, иммунологической дисфункции, метаболической дисфункции и радиационного поражения. 25. Применение по п.24, где заболевание выбрано из группы, состоящей из аллергий, остеопороза,кожных опухолей, инфекций, вызванных вирусом гриппа, ревматических заболеваний, шрамов, послеоперационных ран, эпилепсии и рассеянного склероза.
МПК / Метки
МПК: C07F 9/564, C07F 9/6509, C07F 9/6584, C07D 221/18, C07F 9/59, A61K 36/00, C07F 9/6539, C07F 9/6561, C07D 491/22, C07F 9/6533, A61K 31/14
Метки: получения, производные, средств, лекарственных, применение, способ, производстве, алкалоидные, четвертичные, хелидониновые
Код ссылки
<a href="https://eas.patents.su/20-9049-chetvertichnye-helidoninovye-i-alkaloidnye-proizvodnye-sposob-ih-polucheniya-i-ih-primenenie-v-proizvodstve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Четвертичные хелидониновые и алкалоидные производные, способ их получения и их применение в производстве лекарственных средств</a>
Предыдущий патент: Ингибитор белка резистентности рака молочной железы (bcrp)
Следующий патент: Способ переработки резиносодержащих отходов
Случайный патент: Замок для усиленной двери