Стереоселективный способ получения нуклеозидных аналогов
Формула / Реферат
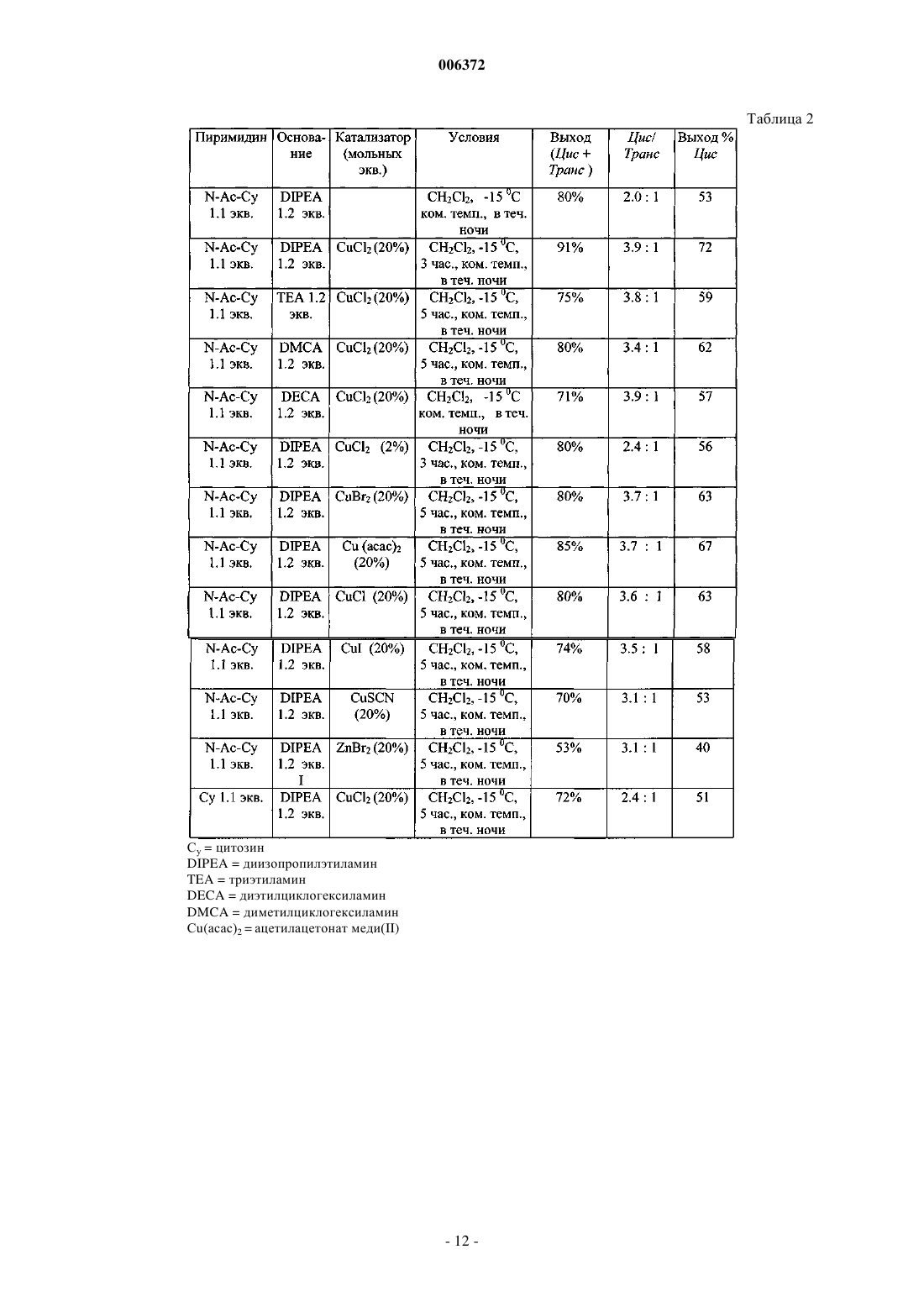
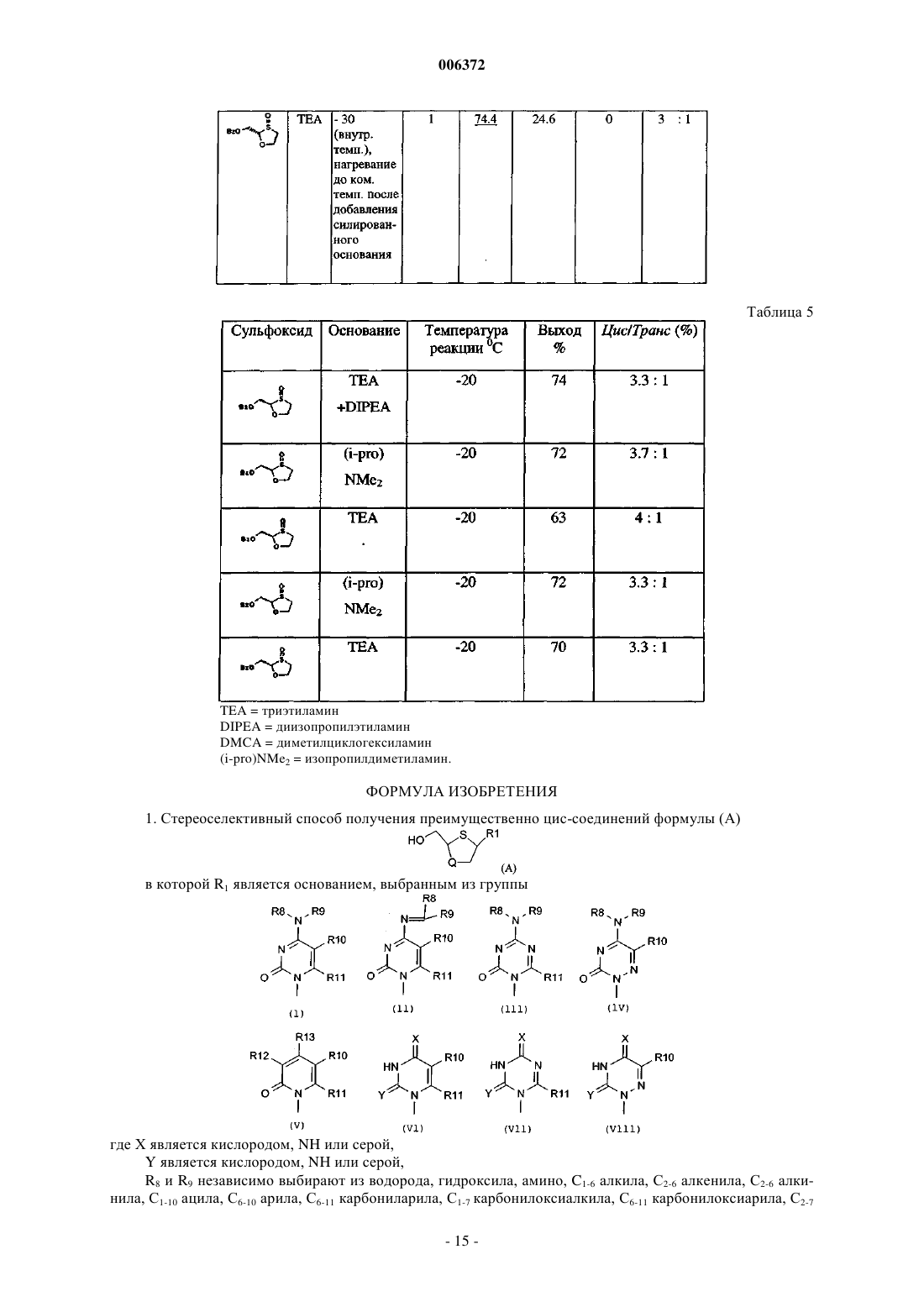
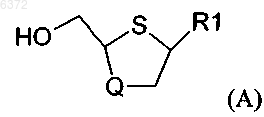
1. Стереоселективный способ получения преимущественно цис-соединений формулы (A)
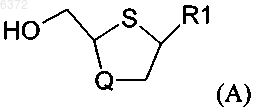
в которой R1 является основанием, выбранным из группы
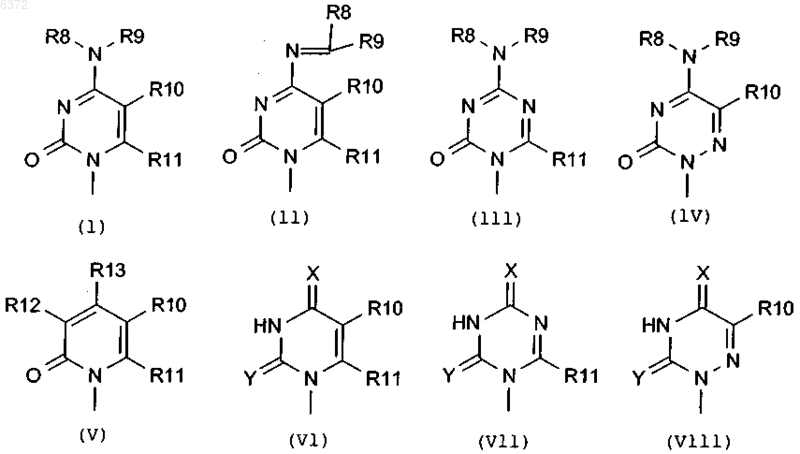
где X является кислородом, NH или серой,
Y является кислородом, NH или серой,
R8 и R9 независимо выбирают из водорода, гидроксила, амино, C1-6 алкила, C2-6 алкенила, C2-6 алкинила, C1-10 ацила, C6-10 арила, C6-11 карбониларила, C1-7 карбонилоксиалкила, C6-11 карбонилоксиарила, C2-7 карбониламиноалкила и аминокислот,
R8 также может быть насыщенным или ненасыщенным C3-8 карбоциклическим кольцом, необязательно замещенным COOH, C(O)NH2, OH, SH, NH2, NO2, C1-6 алкилом, C2-6 алкенилом, C2-6 алкинилом, галогеном, C(O)R14 или C(O)OR15, и
R9 выбирают из H, C1-6 алкила, C2-6 алкенила и C2-6 алкинила,
R8, R9 также могут быть вместе связаны с атомом азота с образованием насыщенного или ненасыщенного C3-8 гетероциклического кольца, необязательно замещенного C(O)OH, C(O)NH2, OH, SH, NH2, NO2, C1-6 алкилом, C2-6 алкенилом, C2-6 алкинилом, галогеном, C(O)R14 или C(O)OR15,
R14 является C1-6 алкилом, C2-6 алкенилом, C2-6 алкинилом,
R15 является C1-6 алкилом, C2-6 алкенилом, C2-6 алкинилом и
R10, R11, R12 и R13 независимо выбирают из водорода, галогена, гидроксила, амино, циано, карбоксила, карбамоила, C2-7 алкоксикарбонила, гидроксиметила, трифторметила, C6-10 арилтио, C1-6 алкила, C2-6 алкенила, замещенного или незамещенного галогеном или азидо, C2-6 алкинила, C1-6, ацилокси, тиокарбокси, тиокарбамоила, карбамата, уреидо, амидино или C6-10 арилокси, и
Q является кислородом или серой;
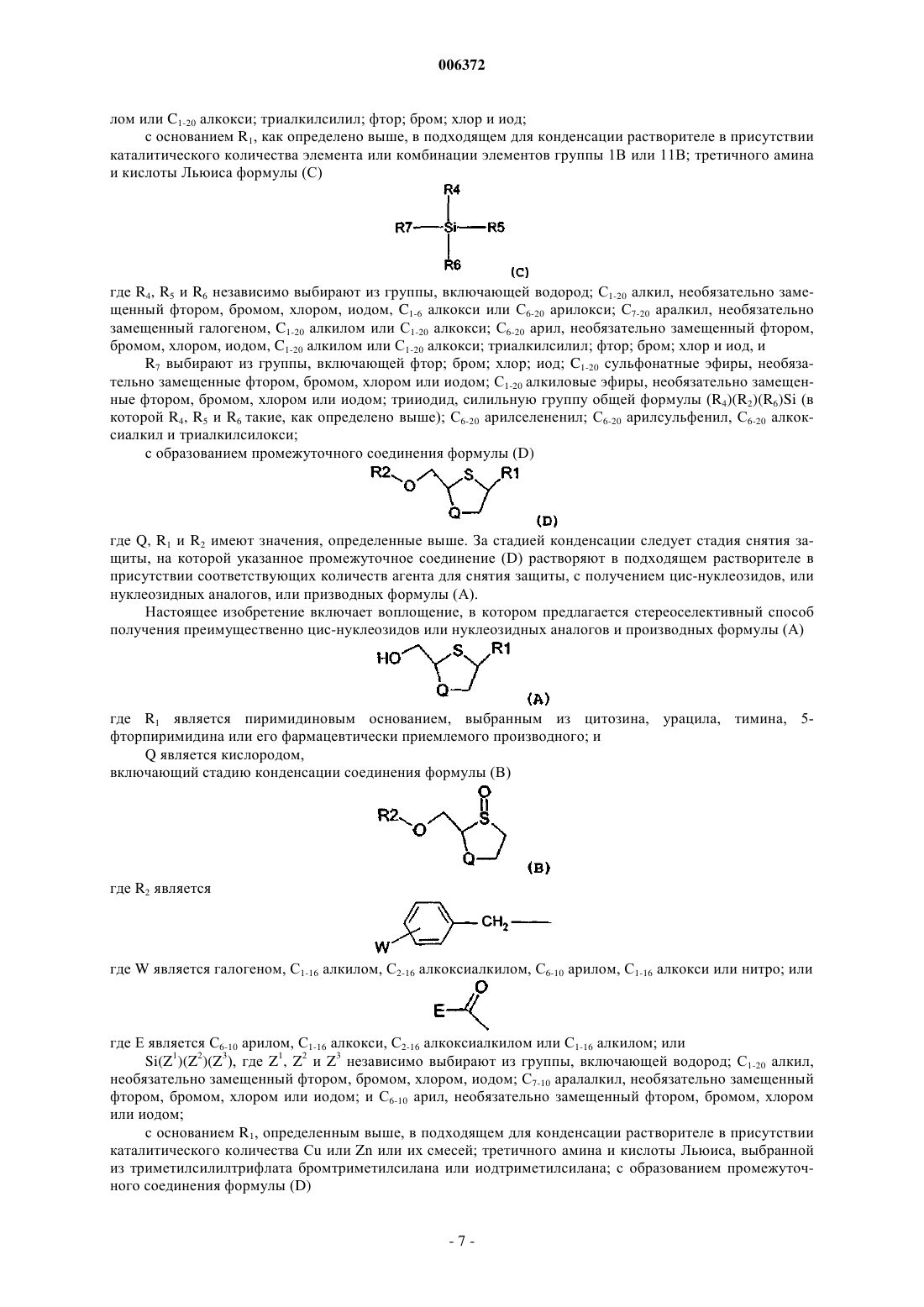
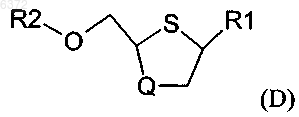
включающий стадию конденсации соединения формулы (B)
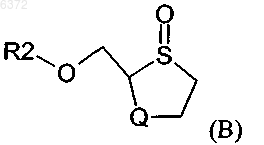
в которой R2 является C7-10 арилалкилом, C1-16 ацилом или Si(Z1) (Z2) (Z3) и Z1, Z2 и Z3 независимо выбирают из водорода; C1-20 алкила, необязательно замещенного фтором, бромом, хлором, иодом, C1-6 алкокси или C6-20 арилокси; C7-20 аралкила, необязательно замещенного галогеном, C1-20 алкилом или C1-20 алкокси; C6-20 арила, необязательно замещенного фтором, бромом, хлором, иодом, C1-20 алкилом или C1-20 алкокси; триалкилсилила; фтора; брома; хлора и иода; с основанием R1 в C1-10 растворителе для конденсации в присутствии каталитического количества Cu, Ag, Au, Zn, Cd или их комбинации, во всех случаях находящихся в окисленном состоянии, третичного амина и кислоты Льюиса формулы (C)
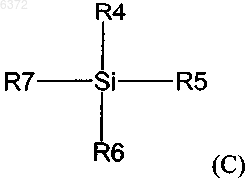
где R4, R5 и R6 независимо выбирают из группы, состоящей из водорода; C1-20 алкила, необязательно замещенного фтором, бромом, хлором, иодом; C1-6 алкокси или C6-20 арилокси; C7-20 аралкила, необязательно замещенного галогеном, C1-20 алкилом или C1-20 алкокси; C6-20 арила, необязательно замещенного фтором, бромом, хлором, иодом, C1-20 алкилом или C1-20 алкокси; триалкилсилила; фтора; брома; хлора и иода;
и R7 выбирают из группы, состоящей из фтора; брома; хлора; иода; C1-20 сульфонатных эфиров, необязательно замещенных фтором, бромом, хлором или иодом; C1-20 алкильных эфиров необязательно замещенных фтором, бромом, хлором или иодом; трииодида; силильной группы формулы (R4)(R5)(R6)Si; C6-20 арилселененила; C6-20 арилсульфенила; C6-20 алкоксиалкила; и триалкилсилокси с образованием промежуточного соединения формулы (D)
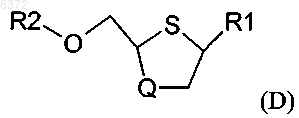
где R1, R2 и Q имеют значения, определенные выше; и снятие защиты с промежуточного соединения формулы (D) с получением цис-соединения формулы (A).
2. Способ по п.1, в котором третичный амин представляет собой амин формулы N(Z4) (Z5) (Z6), где (Z4), (Z5), (Z6) независимо выбирают из C1-6 алкила, необязательно замещенного C1-3 алкилом, C6-10 арилом или галогеном.
3. Способ по п.1, в котором органическим растворителем является C1-8 хлоралкил, C1-8 хлоралкенил, C6-10хлорарил, C1-8 алкилонитрил или их смеси.
4. Способ по п.3, в котором органический растворитель выбирают из группы, включающей хлорметаны, хлорэтаны, метанонитрилы и их смеси.
5. Способ по п.2, в котором третичный амин является триэтиламином, диэтилциклогексиламином, диэтилметиламином, диметилэтиламином, диметилизопропиламином, диметилбутиламином, диметилциклогексиламином, трибутиламином, диэтилметиламином, диметилизопропиламином, диизопропилэтиламином или их комбинациями.
6. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества Cu, Zn или их комбинации, во всех случаях находящихся в окисленном состоянии.
7. Способ по п.1, в котором Q является кислородом.
8. Способ по п.1, в котором стадию конденсации проводят при температуре, равной или меньшей чем 30шC.
9. Способ по п.1, в котором стадию снятия защиты проводят в присутствии агента снятия защиты и в растворителе для снятия защиты, который благоприятствует кристаллизации цис-соединений формулы (A).
10. Способ по п.9, в котором агентом снятия защиты является щелочной агент.
11. Способ по п.10, в котором агент для снятия защиты представляет собой гидроксид натрия, метилат натрия, гидроксид аммония, гидроксид калия, гидроксид лития, аммиак в метаноле или их смеси.
12. Способ по п.9, в котором растворитель для снятия защиты представляет собой воду, метанол, этанол, толуол, трет-бутилметиловый эфир или их смеси.
13. Способ по п.1, в котором R1 выбирают из: N4-алкилпиримидинов, N4-ацилпиримидинов, 4-галогенпиримидинов, N4-ацетиленилпиримидинов, 4-амино- и N4-ацилпиримидинов, 4-гидроксиалкилпиримидинов, 4-тиоалкилпиримидинов, тимина, цитозина, 6-азапиримидина, 2-меркаптопиримидина, 4-меркаптопиримидина, урацила, C5-алкилпиримидинов, C5-бензилпиримидинов, C5-галогенпиримидинов, C5-винилпиримидина, C5-ацетиленилпиримидина, C5-ацилпиримидина, C5-амидопиримидина, C5-цианопиримидина, C5-нитропиримидина, C5-аминопиримидина, 5-азацитидинила, 5-азаурацилила, триазолопиридинила, имидазолопиридинила, пирролопиримидинила, пиразолопиримидинила.
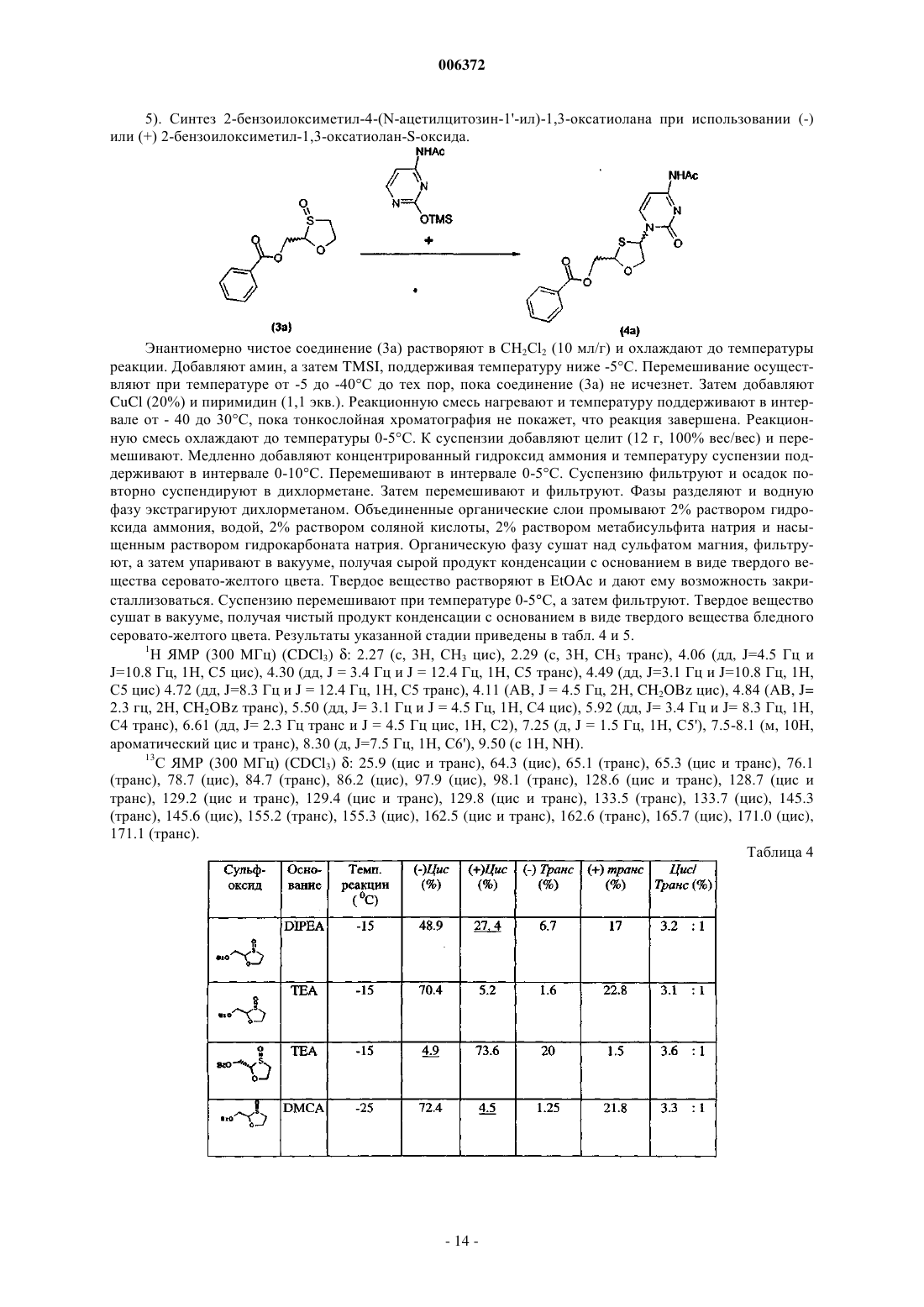
14. Способ по п.1, в котором R2 является
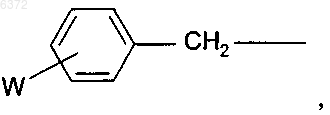
где W является галогеном, C1-16 алкилом, C2-16 алкоксиалкилом, C6-10 арилом, C1-16 алкокси или нитро; или
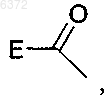
где E является C6-10 арилом, C1-16 алкокси, C2-16 алкоксиалкилом или C1-16 алкилом;
или Si(Z1) (Z2) (Z3), где Z1, Z2 и Z3 независимо выбирают из группы, включающей водород; C1-20 алкил, необязательно замещенный фтором, бромом, хлором, иодом; C7-10 аралалкил, необязательно замещенный фтором, бромом, хлором, иодом; ш C6-10 арил, необязательно замещенный фтором, бромом, хлором, иодом.
15. Стереоселективный способ получения преимущественно цис-соединений формулы (A)
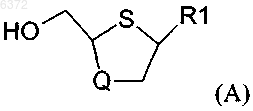
в которой R1 является основанием, выбранным из группы N4-алкилпиримидинов, N4-ацилпиримидинов, 4-галогенпиримидинов, N4-ацетиленилпиримидинов, 4-амино- и N4-ацилпиримидинов, 4-гидроксиалкилпиримидинов, 4-тиоалкилпиримидинов, тимина, цитозина, 6-азапиримидина, в том числе 6-азацитозина, 2- и/или 4-меркаптопиримидина, урацила, C5-алкилпиримидинов, C5-бензилпиримидинов, C5-галогенпиримидинов, C5-винилпиримидина, C5-ацетиленилпиримидина, C5-ацилпиримидина, C5-амидопиримидина, C5-цианопиримидина, C5-нитропиримидина, C5-аминопиримидина, 5-азацитидинила, 5-азаурацилила, триазолопиридинила, имидазолопиридинила, пирролопиримидинила, пиразолопиримидинила; и
Q является кислородом,
включающий стадию конденсации соединения формулы (B)

в которой R2 является C7-10 арилалкилом, C1-16 ацилом или Si(Z1) (Z2) (Z3) и Z1, Z2 и Z3 независимо выбирают из водорода; C1-20 алкила, необязательно замещенного фтором, бромом, хлором, иодом, C1-6 алкокси или C6-20 арилокси; C7-20 аралкила, необязательно замещенного галогеном, C1-20 алкилом или C1-20 алкокси; C6-20 арила, необязательно замещенного фтором, бромом, хлором, иодом, C1-20 алкилом или C1-20 алкокси; триалкилсилила; фтора; брома; хлора и иода; с основанием R1 в растворителе для конденсации в присутствии каталитического количества Cu, Ag, Au, Zn, Cd или их комбинации, во всех случаях находящихся в окисленном состоянии, третичного амина и кислоты Льюиса формулы (C)
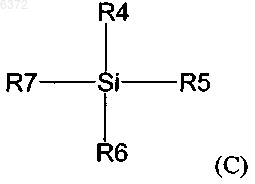
где R4, R5 и R6 независимо выбирают из группы, состоящей из водорода; C1-20 алкила, необязательно замещенного фтором, бромом, хлором, иодом, C1-6 алкокси или C6-20 арилокси; C7-20 аралкила, необязательно замещенного галогеном, C1-20 алкилом или C1-20 алкокси; C6-20 арила, необязательно замещенного фтором, бромом, хлором, иодом, C1-20 алкилом или C1-20 алкокси;
и R7 выбирают из группы, состоящей из фтора; брома; хлора; иода; C1-20 сульфонатных эфиров, необязательно замещенных фтором, бромом, хлором или иодом; C1-20 алкильных эфиров необязательно замещенных фтором, бромом, хлором или иодом; трииодида; силильной группы формулы (R4)(R5)(R6)Si; C6-20 арилселененила; C6-20 арилсульфенила; C6-20 алкоксиалкила; и триалкилсилокси
с образованием промежуточного соединения формулы (D)
и снятие защиты с промежуточного соединения формулы (D), где промежуточное соединение (D) растворяют в растворителе, который способствует кристаллизации цис-соединений формулы (A), в присутствии подходящего количества агента снятия защиты с получением цис-соединений формулы (A).
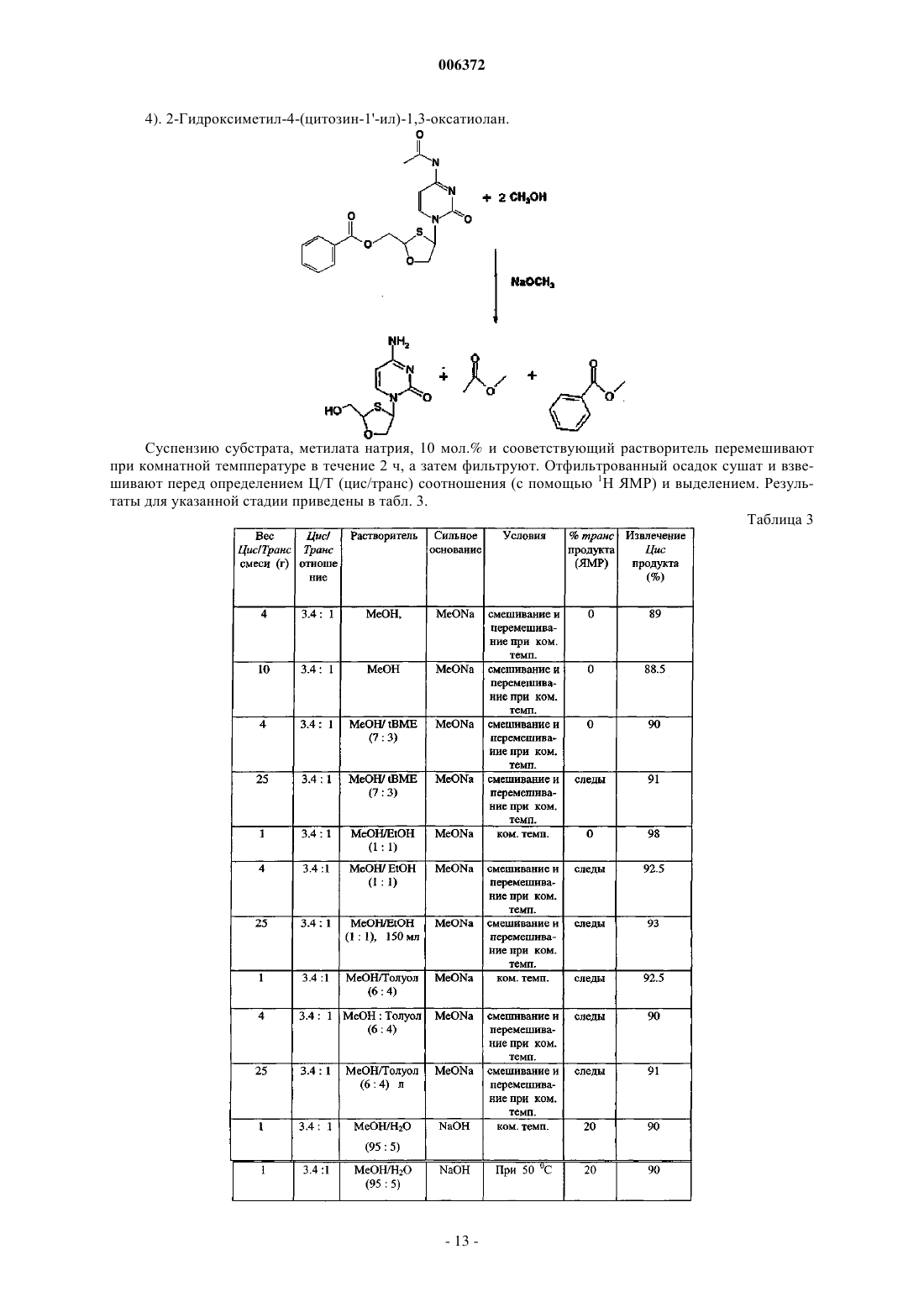
16. Стереоселективный способ получения преимущественно цис-нуклеозидов или аналогов и производных нуклеозидов формулы (A)
в которой R1 является основанием, выбранным из группы цитозина, урацила, тимина, и 5-фторпиримидина; и
Q является кислородом, включающий стадию конденсации соединения формулы (B)
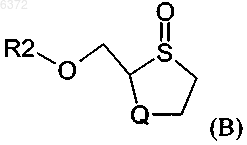
в которой R2 является
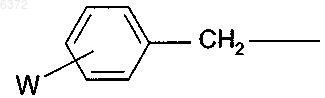
где W является галогеном, C1-16 алкилом, C2-16 алкоксиалкилом, C6-10 арилом, C1-16 алкокси или нитро;
или
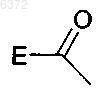
где E является C6-10 арилом, C1-16 алкокси, C2-16алкоксиалкилом или C1-16 алкилом;
или Si(Z1) (Z2) (Z3), где Z1, Z2 и Z3 независимо выбирают из группы, включающей водород; C1-20 алкил, необязательно замещенный фтором, бромом, хлором, иодом; C7-10 аралалкил, необязательно замещенный фтором, бромом, хлором, иодом; и C6-10 арил, необязательно замещенный фтором, бромом, хлором, иодом,
с основанием R1 в растворителе для конденсации в присутствии каталитического количества Cu или Zn, во всех случаях находящихся в окисленном состоянии, третичного амина и кислоты Льюиса, выбранной из группы, включающей триметилсилилтрифлат, бромтриметилсилан, иодтриметилсилан и их смеси;
с образованием промежуточного соединения формулы (D)
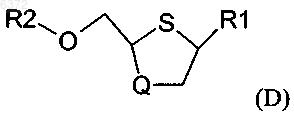
и снятие защиты с промежуточного соединения формулы (D), где промежуточное соединение (D) растворяют в растворителе в присутствии подходящего количества агента снятия защиты с получением цис-соединений формулы (A).
17. Способ по п.1, в котором указанное каталитическое количество Cu, Ag, Au, Zn, Cd или их комбинаций, во всех случаях находящихся в окисленном состоянии, составляет от 0,25 до 100 моль.%.
18. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества Cu+, Cu2+, Ag+, Au+, Au3+, Zn2+ или Cd2+.
19. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества Cu+, Cu2+ или Zn2+.
20. Способ по п.1, в котором количество третичного амина составляет от 1 до 4 эквивалентов.
21. Способ по п.1, в котором используемое количество растворителя для конденсации составляет от 5 мл на грамм сульфоксида до 50 мл на грамм сульфоксида.
22. Способ по п.21, в котором количество растворителя для конденсации составляет от 10 мл на грамм сульфоксида до 30 мл на грамм сульфоксида.
23. Способ по п.1, в котором стадию конденсации проводят при температуре от 40 до -50шC.
24. Способ по п.1, в котором стадию конденсации проводят при температуре от 30 до -40шC.
25. Способ по п.1, в котором стадию снятия защиты проводят в растворителе, выбираемом из воды, метанола, этанола, толуола, трет-бутилметилового эфира и их комбинаций.
26. Способ по п.1, в котором количество агента снятия защиты составляет от 0,1 до 50 моль.%.
27. Способ по п.26, в котором количество агента снятия защиты составляет от 5 до 20 моль.% агента снятия защиты.
28. Способ по п.26, в котором в том случае, когда функциональные кислородные и азотные группы присутствуют в R1, они защищены с использованием защитной группы, выбранной из триметилсилильной, диметилгексилсилильной, трет-бутилдиметилсилильной, трет-бутилдифенилсилильной, тритильной, C1-12 алкильной групп и C1-12 ацила.
29. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества CuCl2, CuCl, CuBr, CuI, CuSCN, ZnBr2, Cu(II)-ацетилацетоната или их комбинаций и R2 является ацилом, содержащим до 16 атомов C.
30. Способ по п.18, в котором указанный R2 является ацилом, содержащим до 16 атомов C.
31. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества CuCl2, CuCl, CuBr, CuI, CuSCN, ZnBr2, Cu(II)-ацетилацетоната или их комбинаций и R2 является ацилом, выбранным из группы, включающей ацетил, пропионил, изобутаноил, пивалоил, гексаношы, бутирил, пентаноил, 3-метилбутирил, гидросукцинат, мезилат, валерил, капроил, каприл, каприноил, лаурил, миристил, пальмитил, стеарил, олеил, 3-хлорбензоат, трифторацетил, хлорацетил, циклогексаноил, бензоил, метансульфонил и п-толуолсульфонил.
32. Способ по п.18, в котором указанный R2 является ацилом, выбранным из группы, включающей ацетил, пропионил, изобутаноил, пивалоил, гексаноил, бутирил, пентаноил, 3-метилбутирил, гидросукцинат, мезилат, валерил, капроил, каприл, каприноил, лаурил, миристил, пальмитил, стеарил, олеил, 3-хлорбензоат, трифторацетил, хлорацетил, циклогексаноил, бензоил, метансульфонил и п-толуолсульфонил.
33. Способ по п.31, в котором указанный R2 является ацетилом, пропионилом, бензоилом, метансульфонилом и п-толуолсульфонилом.
34. Способ по п.32, в котором указанный R2 является ацетилом, пропионилом, бензоилом, метансульфонилом и п-толуолсульфонилом.
35. Способ по п.33, в котором указанный R2 является бензоилом.
36. Способ по п.34, в котором указанный R2 является бензоилом.
37. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества хлорида, иодида, бромида, тиоцианата или ацетилацетоната Cu, Ag, Au, Zn или Cd или их комбинаций.
38. Способ по п.37, в котором указанный R2 является ацилом, содержащим до 16 атомов C.
39. Способ по п.37, в котором указанный R2 является ацилом, выбранным из группы, включающей ацетил, пропионил, изобутаноил, пивалоил, гексаноил, бутирил, пентаноил, 3-метилбутирил, гидросукцинат, мезилат, валерил, капроил, каприл, каприноил, лаурил, миристил, пальмитил, стеарил, олеил, 3-хлорбензоат, трифторацетил, хлорацетил, циклогексаноил, бензоил, метансульфонил и п-толуолсульфонил.
40. Способ по п.39, в котором указанный R2 является ацетилом, пропионилом, бензоилом, метансульфонилом и п-толуолсульфонилом.
41. Способ по п.40, в котором указанный R2 является бензоилом.
Текст
006372 Настоящее изобретение относится к новому способу получения цис-нуклеозидов или нуклеозидных аналогов и их производных формулы (А) в которой R1 является пиримидиновым основанием или его фармацевтически приемлемым производным,и Q является кислородом, углеродом или серой. Было найдено, что классы соединений формулы (А), в особенности 2-замещенные 4-замещенные 1,3-оксатиоланы, обладают высокой противовирусной активностью. В частности, было найдено, что эти соединения действуют как мощные ингибиторы репликации ВИЧ-1 в Т-лимфоцитах в течение длительного периода времени с меньшими цитотоксическими побочными эффектами, чем соединения, известные в данной области (см. Belleau et al. (1993) Bioorg. Med. Chem. Lett. Vol. 3, No. 8, pp. 1723-1728). Также было найдено, что эти соединения являются активными в отношении 3 ТС-резистентных ВИЧ штаммов (см. Taylor et al. (2000) Antiviral Chem. Chemother. Vol. 11, No. 4, pp. 291-301; Stoddart et al. (2000)Antimicrob. Agents Chemother. Vol. 44, No. 3, pp. 783-786). Эти соединения являются также полезными для профилактики и лечения вирусных инфекций гепатита В. Способы получения указанных соединений раскрыты в таких публикациях РСТ, как WO 92/08717 иChem. Vol. 38, No. 1, pp. 1-4 и Caputo et al. в Eur. J. Org. Chem. Vol. 6, pp. 1455-1458 (1999). Указанные процессы включают множество стадий, которые увеличивают стоимость производства и уменьшают выход целевых соединений. Раскрытие изобретения Способ согласно настоящему изобретению включает стадию конденсации промежуточного соединения формулы (В) где R2 является водородом или защитной группой гидроксила, такой как С 7-10 арилалкил, С 1-16 ацил илиSi(Z1)(Z2)(Z3), где Z1, Z2 и Z3 независимо выбраны из группы, состоящей из водорода; C1-20 алкила, необязательно замещенного фтором, бромом, хлором, иодом, C1-20 алкокси или С 6-20 арилокси; С 7-20 аралкила,необязательно замещенного галогеном, C1-20 алкилом или C1-20 алкокси; С 6-20 арила, необязательно замещенного фтором, бромом, хлором, иодом, C1-20 алкилом или C1-20 алкокси; триалкилсилила; фтора; брома; хлора и иода; иR1, который является пиримидиновым основанием или его фармацевтически приемлемым производным в присутствии каталитического количества элемента или комбинации элементов группы 1 В или 11 В, кислоты Льюиса и третичного амина. С полученного промежуточного соединения формулы (D) Соединение формулы (В) может иметь либо структуру(B1), либо (В 2), либо являться смесью двух энантиомеров. В случае альтернативного воплощения настоящего изобретения снятие защиты с промежуточного соединения формулы (D) осуществляют путем растворения указанного промежуточного соединения в подходящем растворителе в присутствии агента снятия защиты. В другом альтернативном воплощении настоящего изобретения предлагается простой двухстадийный способ получения цис-нуклеозидов формулы (А), в котором вторая стадия конденсации приводит к-1 006372 получению продукта, в котором соотношение изомеров цис к транс больше, чем 2 к 1. В еще одном воплощении изобретения отношение изомеров цис к транс промежуточного соединения формулы (D) является обратно пропорциональным температуре реакции стадии конденсации. В другом альтернативном воплощении настоящего изобретения стадия снятия защиты приводит к селективному осаждению цис-нуклеозида формулы (А) за счет подбора подходящего агента для снятия защиты и растворителя. Преимущество способов настоящего изобретения состоит в том, что они позволяют получать нуклеозид формулы (А), его аналоги или производные без использования дорогостоящих исходных материалов, трудоемких стадий введения и снятия защиты или стадий введения и удаления 2'- или 3'-заместителей. Способ согласно настоящему изобретению обеспечивает получение цис-нуклеозидов формулы (А) с высокими выходами, высокой степенью чистоты и высокой стреоселективностью. Кроме того, преимущество способов по настоящему изобретению состоит в том, что они позволяют получать нуклеозиды, стереохимическую конфигурацию которых можно легко контролировать путем подбора подходящих исходных условий. Подробное описание изобретения Настоящее изобретение раскрывает стереоселективный способ получения преимущественно циснуклеозидов или нуклеозидных аналогов и производных формулы (А)R1 является пиримидиновым основанием или его фармацевтически приемлемым производным иQ является атомом углерода, кислорода или серы, включающий стадию конденсации соединения формулы (В)R2 является водородом или защитной группой гидроксила, такой как С 7-10 арилалкил, С 1-16 ацил илиSi(Z1)(Z2)(Z3), где Z1, Z2 и Z3 независимо выбраны из группы, состоящей из водорода; С 1-20 алкила, необязательно замещенного фтором, бромом, хлором, иодом, C1-6 алкокси или С 6-20 арилокси; С 7-20 аралкила,необязательно замещенного галогеном, С 1-20 алкилом или С 1-20 алкокси; С 6-20 арила, необязательно замещенного фтором, бромом, хлором, иодом, C1-20 алкилом или C1-20 алкокси; триалкилсилила; фтора; брома; хлора и иода; с основанием R1, где R1 является пиримидиновым основанием или его фармацевтически приемлемым производным в подходящем для конденсации растворителе в присутствии каталитического количества элемента или комбинации элементов группы 1 В или 11 В; третичного амина и кислоты Льюиса формулы (С)R4, R5 и R6 независимо выбраны из группы, состоящей из водорода; C1-20 алкила, необязательно замещенного фтором, бромом, хлором, иодом, C1-6 алкокси или С 6-20 арилокси; С 7-20 аралкила, необязательно замещенного галогеном, C1-20 алкилом или С 1-20 алкокси; С 6-20 арила, необязательно замещенного фтором, бромом, хлором, иодом, C1-20 алкилом или С 1-20 алкокси; триалкилсилила; фтора; брома; хлора и иода; иR7 выбран из группы, состоящей из фтора; брома; хлора; иода; C1-20 сульфонатных эфиров, необязательно замещенных фтором, бромом, хлором или иодом; C1-20 алкиловых эфиров, необязательно замещенных фтором, бромом, хлором или иодом; трииодида; силильной группы общей формулы(R4)(R5)(R6)Si (в которой R4, R5, и R6 имеют такие значения, как определено выше); С 6-20 арилселенила; С 6-20 арилсульфенила; С 6-20 алкоксиалкила; и триалкилсилокси; с получением промежуточного соединения формулы (D) За стадией конденсации следует стадия снятия защиты, что приводит к образованию цис-нуклеозидов, или нуклеозидных аналогов, или призводных формулы (А). Одним из альтернативных воплощений настоящего изобретения является простой двухстадийный способ получения цис-нуклеозидов формулы (А), результатом которого является образование продукта формулы (А), в котором соотношение изомеров цис к транс больше, чем 2 к 1. Изобретение включает способ, в котором отношение изомеров цис к транс больше или равно 3 к 1. Термин "алкил", как его используют в настоящем изобретении, если не указано иное, относится к насыщенному линейному, разветвленному или циклическому, первичному, вторичному или третичному углеводороду С 1-30, в частности C1-6, незамещенному или необязательно моно- или дизамещенному гидрокси, N3, CN, SH, амино, галогеном (F, Сl, Вr, I), С 6-12 арилом, C1-6 алкилом, С 2-12 алкоксиалкилом или нитро. Более конкретно, этот термин включает метил, этил, циклопропил, пропил, изопропил, бутил,изобутил, трет-бутил, пентил, циклопентил, изопентил, неопентил, гексил, изогексил, циклогексил, циклогексилметил, 3-метилпентил, 2,2-диметилбутил и 2,3-диметилбутил. Термин "ацил", как его используют в настоящем изобретении, относится к функциональной группе,образованной от алифатической карбоновой кислоты, состоящей из от 1 до 30 атомов углерода, в частности от 1 до 6 атомов углерода, путем удаления ОН-группы. Аналогично кислоте, из которой он образован, алифатический ацильный радикал может быть замещен (гидрокси, N3, CN, галогеном (F, Cl, Вr, I),С 6-12 арилом, С 1-6 алкилом, С 2-12 алкоксиалкилом или нитро) или незамещен, и независимо от структуры остальной части молекулы свойства функциональной группы остаются, по существу, теми же самыми(например, ацетил, пропионил, изобутаноил, пивалоил, гексаноил, бутирил, пентаноил, 3-метилбутурил,гидросукцинат, мезилат, валерил, капроат, каприлат, капринат, лауринат, миристинат, пальмитат, стеарат, олеат, 3-хлорбензоат, трифторацетил, хлорацетил и циклогексаноил). Термины "алкенил" и "алкинил" относятся к замещенным (N3, CN, галогеном, гидроксилом или С 6-20 арилом) или незамещенным линейным, разветвленным или циклическим углеводородным цепям,содержащим от 2 до 30 атомов углерода, предпочтительно от 2 до 6 атомов углерода, и содержащим по крайней мере одну ненасыщенную группу (например, аллил). Термин "алкокси" относится к замещенной или незамещенной алкильной группе, содержащей от 1 до 30 атомов углерода, предпочтительно от 1 до 6 атомов углерода, при этом алкильная группа ковалентно связана с атомом кислорода (например, метокси и этокси). Термин "арил" относится к ароматическому остатку, который может быть моно-, би-, три-, тетраили пентазамещенным гидрокси, нитро, N3, CN, галогеном (F, Cl, Вr, I) или их комбинациями и содержит по крайней мере одно кольцо бензольного типа, причем данная группа может состоять из от 6 до 14 атомов углерода (например, фенил и нафтил), в частности от 6 до 10 атомов углерода. Термин "арилокси" относится к замещенному (галогеном, трифторметилом или C1-5 алкокси) или незамещенному арильному остатку, содержащему от 6 до 14 атомов углерода, ковалентно связанному через атом кислорода (например, бензилокси, фенокси). Термин "арилалкил" относится к заместителю, содержащему арильный остаток, присоединенный через алкильную цепь (например, бензил, фенилэтил), где общая сумма атомов углерода в арильном остатке и алкильной цепи составляет от 7 до 21. Арильная или алкильная части группы необязательно моно- или дизамещены ОН, SH, амино, галогеном или С 1-6 алкилом. Термин "тиол" относится к C1-6 алкильной, С 6-15 арильной, С 7-21 аралкильной, С 2-6 алкенильной или С 2-6 алкинильной группе, ковалентно связанной с соседним атомом серы, к которому присоединен атом водорода. Термины "алкилтио" (например, тиометил, тиоэтил) и "арилтио" (например, тиофенил, тиобензил) относятся к С 1-6 алкильной или С 6-10 арильной группам, незамещенным или необязательно моно- или дизамещенным гидрокси, галогеном (F, Сl, Вr, I), С 6-12 арилом, C1-6 алкилом, С 2-12 алкоксиалкилом или нитро, ковалентно связанным с соседним атомом серы. Термины "ацилокси" и "алкоксикарбонил" относятся к цепям, содержащим от 1 до 30 атомов углерода, в частности от 1 до 6 атомов углерода, которые являются либо насыщенными, либо ненасыщенными и могут также быть линейными или разветвленными (например, ацетилокси). Цепи могут быть незамещенными или необязательно моно- или дизамещенными гидрокси, N3, CN, SH, амино, галогеном (F, О,Вr, I), С 6-12 арилом, C1-6 алкилом, С 2-12 алкоксиалкилом или нитро. Термин "алкоксиалкил" относится к С 1-6 алкоксигруппе, присоединенной к соседней С 1-6 алкильной группе (например, метоксиметил, этоксиметил). Они могут быть незамещенными или необязательно моно- или дизамещенными гидрокси, N3, CN, SH, амино, галогеном (F, Cl, Вr, I), С 6-12 арилом, С 1-6 алкилом,С 2-12 алкоксиалкилом или нитро. Термин "гетероцикл" относится к насыщенному или ненасыщенному моно- или полициклическому-3 006372 Понятно, что гетероцикл может быть необязательно моно- или дизамещен ОН, SH, амино, галогеном,CF3, оксо или С 1-6 алкилом. Примеры подходящих моноциклических гетероциклов включают, но не ограничиваются, пиридин, пиперидин, пиразин, пиперазин, пиримидин, имидазол, тиазол, оксазол, фуран,пиран и тиофен. Примеры подходящих бициклических гетероциклов включают, но не ограничиваются,индол, бензимидазол, хинолин, изохинолин, пурин и карбазол. Термин "аралкил" относится к заместителю, содержащему С 6-10 арильный остаток, присоединенный через C1-6 алкильную цепь (например, бензил, фенэтил). Арильная или алкильная часть группы может быть незамещенной или необязательно моно- или дизамещенной гидрокси, N3, CN, SH, амино, галогеном(F, Cl, Вr, I), С 6-12 арилом, С 1-6 алкилом, С 2-12 алкоксиалкилом или нитро. Термин "амино" относится к C1-6 алкильной, С 6-10 арильной, С 2-6 алкенильной, С 2-6 алкинильной или С 7-12 аралкильной группам, незамещенным или необязательно моно- или дизамещенным гидрокси, N3,CN, SH, амино, галогеном (F, Cl, Вr, I), С 6-12 арилом, С 1-6 алкилом, С 2-12 алкоксиалкилом или нитро, где атомы углерода ковалентно связаны с соседним элементом через атом азота (например, пирролидин). Они включают первичные, вторичные и третичные амины и четвертичные аммонийные соли. Термин "защищенный", как его используют в настоящем изобретении, если не указано другое, относится к группе, которую присоединяют к атому кислорода, азота или фосфора, чтобы не допустить его вступление в дальнейшую реакцию или для других целей. Широкий выбор защитных групп кислорода и азота известен специалистам в области органического синтеза. Подходящие защитные группы описаны,например, в Greene, et al., "Protective Groups in Organic Synthesis," John Wiley и Sons, Second Edition, 1991,включенном сюда в качестве ссылки. Производное или аналог пиримидинового основания относится к пиримидиновому основанию,входящему в состав нуклеозида или в его аналог, который моделирует структуру (виды атомов и их расположение) этих оснований таким образом, что сохраняется сходство с нормальными основаниями, но при этом могут присутствовать дополнительные функциональные особенности или отсутствовать некоторые группы, характерные для нормальных оснований. Производные таких оснований или их аналоги включают полученные путем замещения СН остатка атомом азота (например, 5-азапиримидины, такие как 5-азацитозин), или их кольцо может быть замещено галогеном, гидроксилом, азидо, циано, амино,замещенным амино, тиолом, С 1-6 алкилом и С 6-10 арилом. Термин "фармацевтически приемлемое производное" пиримидина означает любое пиримидиновое основание, которое можно превратить в фармацевтически приемлемую соль, эфир или соль эфира соединения формулы (А), или любое другое соединение, из которого при введении пациенту может образоваться (прямо или косвенно) соединение формулы (А), или его метаболит, или остаток с антивирусной активностью. Специалисту в данной области будет понятно, что соединения формулы (А) могут быть модифицированы с целью образования их фармацевтически приемлемых производных по функциональным группам в составе основания. Соединение формулы (В) может иметь либо структуру(В 1), либо (В 2), либо являться смесью двух энантиомеров. Сульфоксид может быть либо единственным энантиомером, либо смесью энантиомеров, включая, без ограничения, рацемическую смесь. Стадия конденсации в способе, являющемся объектом настоящего изобретения, включает добавление одного или более элементов группы IB или IIВ. Используемый элемент или комбинация элементов может находиться в окисленном состоянии. Указанный элемент или комбинации элементов группы IB или IIВ катализируют стадию конденсации. Выбранный элемент или комбинация элементов группы IB или IIВ присутствует в количествах, находящихся в интервале от около 0,25 и до около 100 мол.%. В другом воплощении концентрация элемента или комбинации элементов группы IВ или IIВ может находится в интервале от около 5 до около 35%. Способ, являющийся объектом настоящего изобретения, включает стадию конденсации, в которой элемент или комбинация элементов группы IВ или IIВ выбраны из группы, содержащей Cu+, Cu2+, Ag+,Au+, Au3+, Zn2+ Cd2+ и их комбинации. Способ, являющийся объектом настоящего изобретения, включает стадию конденсации, в которой элемент или комбинация элементов группы IВ или IIВ выбирают из Cu+, Cu2+ или Zn2+. Термин третичный амин относится к третичным аминам с высокой основностью. Третичный амин представляет собой амин формулы N(Z4)(Z5)(Z6), где (Z4), (Z5), (Z6) независимо выбирают из группы, включающей C1-6 алкил, необязательно замещенный C1-3 алкилом, С 6-10 арилом, галогеном. Примеры третичных аминов включают триэтиламин, диэтилциклогексиламин, диэтилметиламин, диметилэтиламин, диметилизопропиламин, диметилбутиламин, диметилциклогексиламин, трибутиламин, диэтилметиламин, диметилизопропиламин и диизопропилэтиламин. Количество третичного амина может изменяться в интервале от около 1 до около 4 экв. Используемое количество третичного амина может изменяться в интервале от около 1 до 2 экв.-4 006372 Стадию конденсации способа, являющегося объектом настоящего изобретения, проводят в подходящем для конденсации растворителе. Подходящий для конденсации растворитель включает С 1-10 хлорированные органические растворители. Подходящие для конденсации растворители также включают C1-8 хлоралкилы, C1-8 хлоралкенилы, С 6-10 хлорарилы, C1-8 алкилнитрилы и их комбинации. Растворители для конденсации могут быть выбраны из хлорметанов, хлорэтанов, метанонитрилов или их смесей. Наиболее подходящие растворители для конденсации включают дихлорметан, хлороформ, ацетонитрил, дихлорэтан, хлорбензол и их комбинации. Количество используемого растворителя для конденсации может меняться в интервале от 5 мл на грамм сульфоксида до 50 мл на грамм сульфоксида. В случае альтернативного воплощения настоящего изобретения количество растворителя для конденсации составляет от 10 мл на грамм сульфоксида до 30 мл на грамм сульфоксида. На стадию конденсации в способе, являющемся объектом настоящего изобретения, влияет температура реакции. Соотношение изомеров цис к транс в продукте формулы (D) обратно пропорционально температуре реакции. Стадию конденсации проводят при температуре, находящейся в интервале от около 40 до около -40 С. В случае альтернативного воплощения температура реакции стадии конденсации находится в интервале от около 30 и до около -50 С. Вторая стадия способа, являющегося объектом настоящего изобретения, является стадией снятия защитной группы. Стадию снятия защитной группы путем кристаллизации проводят в подходящем растворителе. Особенный интерес представляют растворители, которые благоприятствуют кристаллизации продукта формулы (А). Подходящие растворители включают воду, метанол, этанол, толуол, третбутилметиловый эфир или их комбинации. Снятие защитных групп может проходить в присутствии сооветствующих количеств агента снятия защиты. Особенный интерес представляют собой агенты по снятию защиты, которые будут способствовать отделению цис-изомера продукта формулы (А). Подходящие агенты для снятия защиты выбирают в соответствии с видом используемой защитной группы промежуточного соединения формулы (D), как показано в Greene, et al., "Protective Groups in Organic Synthesis," John Wiley and Sons, Second Edition,1991. Агентами для снятия защиты могут быть щелочные агенты. Агенты снятия защиты включают гидроксид натрия, метилат натрия, гидроксид аммония, гидроксид калия, гидроксид лития и аммиак в метаноле. В другом воплощении настоящего изобретения агент снятия защиты присутствует в каталитических количествах. В этом случае агент для снятия защиты присутствует в концентрациях, находящихся в интервале от около 0,1 до около 50 мол.%. Альтернативное воплощение включает концентрации агента для снятия защиты, находящиеся в интервале от около 5 до около 20 мол.%. Обычно основание R1 выбирают из где X является кислородом, NH или серой,Y является кислородом, NH или серой,R8 и R9 независимо выбирают из водорода, гидроксила, амино, C1-6 алкила или С 2-6 алкенила, С 2-6 алкинила, С 1-10 ацила, С 6-10 арила, С 6-11 карбониларила, С 1-7 карбонилоксиалкила, С 6-11 карбонилоксиарила, С 2-7 карбониламиноалкила или аминокислот,R8 может быть насыщенным или ненасыщенным С 3-8 карбоциклическим кольцом, необязательно замещенным СООН, C(O)NH2, ОН, SH, NH2, NO2, C1-6 алкилом, С 2-6 алкенилом, С 2-6 алкинилом, галогеном, С(О)R14, в котором R14 является C1-6 алкилом, С 2-6 алкенилом, С 2-6 алкинилом и C(O)OR15, где R15 является C1-6 алкилом, С 2-6 алкенилом, С 2-6 алкинилом; и R9 выбирают из Н, C1-6 алкила, С 2-6 алкенила и С 2-6 алкинила,R8, R9 могут быть связаны также с атомом азота с образованием насыщенного или ненасыщенного-5 006372 С 3-8 гетероциклического кольца, необязательно замещенного С(О)ОН, C(O)NH2, ОН, SH, NH2, NO2, C1-6 алкилом, С 2-6 алкенилом, С 2-6 алкинилом, галогеном, C(O)R14, где R14 является C1-6 алкилом, С 2-6 алкенилом, С 2-6 алкинилом и C(O)OR15, где R15 является С 1-6 алкилом, С 2-6 алкенилом, С 2-6 алкинилом. Каждый из R10, R11, R12 и R13 независимо выбирают из водорода, галогена, гидроксила, амино, циано, карбоксила, карбамоила, С 2-7 алкоксикарбонила, гидроксиметила, трифторметила, С 6-10 арилтио, C1-6 алкила, С 2-6 алкенила, замещенного или незамещенного галогеном или азидо, С 2-6 алкинила, С 1-6 ацилокси, тиокарбокси, тиокарбамоила, карбамата, уреидо, амидино или С 6-10 арилокси. В другом воплощения настоящего изобретения R1 является или где R8 и R9 независимо выбирают из водорода, гидроксила, амино, С 1-10 алкила или С 2-10 алкенила,С 2-10 алкинила, С 1-10 ацила, С 6-10 арила, C6-16 карбониларила, С 1-10 карбонилоксиалкила, С 6-16 карбонилоксиарила, С 2-12 карбониламиноалкила или аминокислот; R10 и R11 независимо выбирают из водорода, галогена, гидроксила, гидроксиметила, трифторметила, C1-6 алкила, С 2-6 алкенила, замещенного или незамещенного галогеном, азидо, С 2-6 алкинила или С 6-10 арилокси, иX и Y независимо выбирают из О или S. В альтернативном воплощении R1 является пиримидиновым основанием, выбранным из N4 алкилпиримидинов, N4-ацилпиримидинов, 4-галогенпиримидинов, N4-ацетиленилпиримидинов, 4-амино и N4-ацилпиримидинов, 4-гидроксиалкилпиримидинов, 4-тиоалкилпиримидинов, тимина, цитозина, 6 азапиримидина, включая 6-азацитозин, 2- и/или 4-меркаптопиримидина, урацила, С 5-алкилпиримидинов,С 5-бензилпиримидинов, С 5-галогенпиримидинов, С 5-винилпиримидина, С 5-ацетиленилпиримидина, С 5 ацилпиримидина,С 5-амидопиримидина,С 5-цианопиримидина,С 5-нитропиримидина,С 5 аминопиримидина, 5-азацитидинила, 5-азаурацилила, триазолопиридинила, имидазолопиридинила, пирролопиримидинил или пиразолопиримидинила. Кислородные и азотные функциональные группы в составе R1 при необходимости или при желании могут быть защищены. Подходящие защитные группы хорошо известны специалистам в данной области и включают триметилсилил, диметилгексилсилил, трет-бутилдиметилсилил и трет-бутилдифенилсилил,тритил, C1-12 алкильные группы, С 1-12 ацильные группы, такие как ацетил и пропионил, бензоил, метансульфонил и п-толуолсульфонил. В дополнительном воплощении настоящего изобретения R1 выбирают из цитозина, урацила, тимина, 5-фторпиримидина или защищенных аналогов этих оснований. Другое воплощение настоящего изобретения включает стереоселективный способ получения преимущественно цис-нуклеозидов или нуклеозидных аналогов и производных формулы (А) где R1 является пиримидиновым основанием, выбранным из N4-алкилпиримидинов, N4-ацилпиримидинов, 4-галогенпиримидинов, N4-ацетиленилпиримидинов, 4-амино и N4-ацилпиримидинов, 4 гидроксиалкилпиримидинов, 4-тиоалкилпиримидинов, тимина, цитозина, 6-азапиримидина, включая 6 азацитозин, 2- и/или 4-меркаптопиримидинов, урацила, С 5-алкилпиримидинов, С 5-бензилпиримидинов,С 5-галогенпиримидинов, С 5-винилпиримидина, С 5-ацетиленилпиримидина, С 5-ацилпиримидина, С 5 амидопиримидина, С 5-цианопиримидина, С 5-нитропиримидина, С 5-аминопиримидина, 5-азацитидинила,5-азаурацилинила, триазолопиридинила, имидазолопиридинила, пирролопиримидинила, пиразолопиримидинила или его фармацевтически приемлемых производных; иQ является кислородом, включающий стадию конденсации соединения формулы (В),где R2 является С 7-10 аралалкилом, С 1-16 ацилом или Si(Z1)(Z2)(Z3), где Z1, Z2 и Z3 независимо выбраны из группы, включающий водород; C1-20 алкил, необязательно замещенный фтором, бромом, хлором,иодом, C1-6 алкокси или С 6-20 арилокси; С 7-20 аралкил, необязательно замещенный галогеном, C1-20 алкилом или С 1-20 алкокси; С 6-20 арил, необязательно замещенный фтором, бромом, хлором, иодом, C1-20 алки-6 006372 лом или C1-20 алкокси; триалкилсилил; фтор; бром; хлор и иод; с основанием R1, как определено выше, в подходящем для конденсации растворителе в присутствии каталитического количества элемента или комбинации элементов группы 1 В или 11 В; третичного амина и кислоты Льюиса формулы (С) где R4, R5 и R6 независимо выбирают из группы, включающей водород; С 1-20 алкил, необязательно замещенный фтором, бромом, хлором, иодом, C1-6 алкокси или С 6-20 арилокси; С 7-20 аралкил, необязательно замещенный галогеном, C1-20 алкилом или C1-20 алкокси; С 6-20 арил, необязательно замещенный фтором,бромом, хлором, иодом, C1-20 алкилом или C1-20 алкокси; триалкилсилил; фтор; бром; хлор и иод, иR7 выбирают из группы, включающей фтор; бром; хлор; иод; C1-20 сульфонатные эфиры, необязательно замещенные фтором, бромом, хлором или иодом; С 1-20 алкиловые эфиры, необязательно замещенные фтором, бромом, хлором или иодом; трииодид, силильную группу общей формулы (R4)(R2)(R6)Si (в которой R4, R5 и R6 такие, как определено выше); С 6-20 арилселененил; С 6-20 арилсульфенил, С 6-20 алкоксиалкил и триалкилсилокси; с образованием промежуточного соединения формулы (D) где Q, R1 и R2 имеют значения, определенные выше. За стадией конденсации следует стадия снятия защиты, на которой указанное промежуточное соединение (D) растворяют в подходящем растворителе в присутствии соответствующих количеств агента для снятия защиты, с получением цис-нуклеозидов, или нуклеозидных аналогов, или призводных формулы (А). Настоящее изобретение включает воплощение, в котором предлагается стереоселективный способ получения преимущественно цис-нуклеозидов или нуклеозидных аналогов и производных формулы (А) где R1 является пиримидиновым основанием, выбранным из цитозина, урацила, тимина, 5 фторпиримидина или его фармацевтически приемлемого производного; иQ является кислородом,включающий стадию конденсации соединения формулы (В)Si(Z1)(Z2)(Z3), где Z1, Z2 и Z3 независимо выбирают из группы, включающей водород; С 1-20 алкил,необязательно замещенный фтором, бромом, хлором, иодом; С 7-10 аралалкил, необязательно замещенный фтором, бромом, хлором или иодом; и С 6-10 арил, необязательно замещенный фтором, бромом, хлором или иодом; с основанием R1, определенным выше, в подходящем для конденсации растворителе в присутствии каталитического количества Сu или Zn или их смесей; третичного амина и кислоты Льюиса, выбранной из триметилсилилтрифлата бромтриметилсилана или иодтриметилсилана; с образованием промежуточного соединения формулы (D) где Q, R1 и R2 имеют значения, определенные выше. За стадией конденсации следует стадия снятия защиты, где указанное промежуточное соединение (D) растворяют в подходящем растворителе в присутствии сооветствующих количеств агента для снятия защиты с получением цис-нуклеозидов, или нуклеозидных аналогов, или призводных формулы (А). Способ, являющийся объектом настоящего изобретения, включает реакции, показанные на схеме 1. Схема 1 незащищенный цис-нуклеозид Различные сдадии, приведенные на схеме 1, могут быть кратко описаны следующим образом. Стадия 1. Сульфоксид формулы (В) может быть получен при использовании нескольких способов,включая те, которые раскрыты в публикациях РСТ, таких как WO 92/08717 и WO 95/29176, J. Med.(1993) and Eur. J. Org. Chem. 6:1455-1458 (1999). Сульфоксид может быть в виде единственного энантиомера или в виде смеси энантиомеров, включая, без ограничения, рацемическую смесь. Сульфоксид формулы (В) конденсируют с основанием R1. Основание R1 может быть предварительно защищено, например может быть использовано силилированное (или силилированное in situ) пиримидиновое основание или его фармацевтически приемлемое производное. Реакцию конденсации проводят в присутствии третичного амина, кислоты Льюиса формулы (С) и каталитических количеств элемента группы IВ или IIВ в подходящем для конденсации растворителе, что позволяет получить цис/транс пиримидиновый нуклеозид формулы (D). В полученном промежуточном соединении формулы (D) цисизомер преобладает над транс-изомером в соотношении, равном или больше, чем 2 к 1. Соотношение изомеров цис к транс обратно пропорционально температуре реакции. Реакция конденсации может быть проведена при комнатной или более низкой температуре. Температура стадии конденсации может находиться в интервале от около 0 до около -50 С. Если применяют силилированное основание, сооветствующий силилирующий агент может включать трет-бутилдиметилсилилтрифлат, 1,1,1,3,3,3-гексаметилдисилазан, TMSI, N, О, бис(TMS)ацетонид и триметилсилил трифлат. Дополнительные защитные агенты раскрыты в Greene, et al. "Protective Groupsin Organic Synthesis," John Wiley and Sons, Second Edition, 1991. Третичные амины, применяемые на первой стадии, включают триэтиламин, диэтилциклогексиламин, диэтилметиламин, диметилэтиламин, диметилизопропиламин, диметилбутиламин, диметилциклогексиламин, трибутиламин, диэтилметиламин, диметилизопропиламин и диизопропилэтиламин и их комбинации. Элемент или комбинации элементов группы IВ или IIВ, применяемые на первой стадии, включают Сu, Ag, Аu, Zn или Cd в окисленном состоянии. Подходящий растворитель для конденсации является органическим растворителем, содержащим от одного до десяти атомов углерода. Подходящие растворители для конденсации включают CH2Cl2,CH3CN и их смеси.-8 006372 Подходящие кислоты Льюиса включают триметилсилилтрифлат, бромтриметилсилан, иодтриметилсилан и их комбинации. Количество кислоты Льюиса может составлять от около 2 до около 5 экв. Стадия 2. Цис/транс-пиримидин-1,3-оксатиолановый нуклеозид формулы (D) растворяют в подходящем для снятия защиты растворителе в присутствии сооветствующего количества агента для снятия защиты с получением цис-нуклеозидов, или нуклеозидных аналогов, или производных формулы (А). Стадию снятия защиты проводят при температуре, находящейся ниже точки кипения подходящего для снятия защиты растворителя. Температура реакции стадии снятия защиты может находиться в интервале от -30 до 60 С. Реакция может быть проведена при температуре, находящейся в интервале от около 0 до около 35 С. Подходящий растворитель для снятия защиты способствует кристаллизации продукта формулы (А). Подходящие растворители включают воду, метанол, этанол, толуол, трет-бутилметиловый эфир или их комбинации. Подходящие агенты для снятия защиты включают гидроксид натрия, метилат натрия, гидроксид аммония, гидроксид калия, гидроксид лития и аммиак в метаноле. Особый интерес представляют агенты для снятия защиты, которые помогают отделению продукта формулы (А). Схема 1 а цис-нуклеозид Различные стадии, приведенные на схеме 1 а, могут быть кратко описаны следующим образом. Стадия 1. Сульфоксид 1,3-оксатиолана формулы (Вх) может быть получен при использовании различных способов, включая те, которые раскрыты в РСТ публикациях, таких как WO 92/08717 и WO 95/29176, J. Med. Chem. 38(1) 1-4 (1995), Tetrahedron Lett. 35(27) 4739-4742 (1994), Bioorg. Med. Chem.Lett. 3 (8) 1723-1728 (1993). Асимметричный синтез сульфоксида формулы (Вх) раскрыт у Caputo et al. inEur. J. Org. Chem. 6:1455-1458 (1999). Сульфоксид 1,3-оксатиолана формулы (Вх) конденсируют с основанием R1. Основание R1 может быть предварительно защищено, например, это может быть силилированное (или силилированное in situ) пиримидиновое основание или его фармацевтически приемлемое призводное. Реакцию конденсации проводят в присутствии третичного амина, кислоты Льюиса формулы (С) и каталитического количества элемента группы IВ или IIВ в подходящем для конденсации растворителе с получением цис/транспиримидин-1,3-оксатиоланового нуклеозида формулы (Dx). В полученном промежуточном соединении формулы (Dx) цис-изомер преобладает над транс-изомером, находясь в соотношении, равном или большем, чем 2 к 1. Соотношение изомеров цис к транс обратно пропорционально температуре реакции. Реакция может быть проведена при комнатной температуре или ниже комнатной температуры. Силилирующий агент, который может быть применен для защиты R1, включает третбутилдиметилсилилтрифлат; 1,1,3,3,3-гексаметилдисилазан, TMSI, N, О, бисТМSацетонит и триметилсилилтрифлат. Третичный амин, применяемый на стадии 1, включает триэтиламин, диэтилциклогексиламин, диэтилметиламин, диметилэтиламин, диметилизопропиламин, диметилбутиламин, диметилциклогексиламин, трибутиламин, диэтилметиламин, диметилизопропиламин и диизопропилэтиламин и их смеси. Элемент или комбинации элементов группы 1 В или 11 В, применяемые на стадии 1, включают Сu,Ag, Аu, Zn, или Cd в окисленном состоянии.-9 006372 Подходящий для конденсации растворитель является органическим растворителем. Подходящие для конденсации растворители включают CH2Cl2, CH3CN или их смеси. Кислота Льюиса, которая может быть применена на этой стадии, включает триметилсилилтрифлат,бромтриметилсилан, иодтриметилсилан и их смеси. Количество кислоты Льюиса может составлять от около 2 до около 5 экв. Стадия 2. Цис/транс-пиримидиновый нуклеозид формулы (Dx) растворяют в подходящем для снятия защиты растворителе в присутствии соответствующего количества агента снятия защиты с получением цис-нуклеозидов, или нуклеозидных аналогов, или призводных формулы (Ах). Подходящий растворитель для снятия защиты способствует кристаллизации продукта формулы (А). Подходящие растворители включают воду, метанол, этанол, толуол, трет-бутилметиловый эфир или их комбинации. Подходящие комбинации растворителей включают смеси метанола и воды, метанола и толуола, метанола и трет-бутилметилового эфира. Подходящие агенты для снятия защиты включают гидроксид натрия, метилат натрия, гидроксид аммония, гидроксид калия, гидроксид лития и аммиак в метаноле. Особый интерес представляют собой агенты для снятия защиты, которые способствуют отделению продукта формулы (А). Стадию снятия защиты проводят при температуре, которая ниже точки кипения подходящего растворителя для снятия защиты. Осуществление изобретения Следующие примеры иллюстрируют настоящее изобретение в том виде, в котором его можно осуществить на практике, но они не должны рассматриваться как ограничивающие общий объем способов по настоящему изобретению. 1). 2-Бензоилоксиметил-1,3-оксатиолан. Соединение (1) растворяют в толуоле и раствор нагревают до температуры 90-100 С. После добавления катализатора вводят меркаптоэтанол (порциями). Используют 5 мол.% катализатора. Реакции проводят в масштабе 15 г при 0,3 М концентрации соединения (1). Реакционную смесь нагревают до кипения, удаляя воду с помощью ловушки Дина-Старка. Результаты этой стадии приведены в табл. 1. Таблица 1 Охлажденный 30%-ный пероксид водорода (46 мл, 0,44 моль) добавляют к (2) (82 г, 0,366 моль) в толуоле (8 мл). Затем по каплям добавляют 10 М серную кислоту (4,5 мл, 0,044 моль, 10 мол.%) (время добавления приблизительно 1 мин). Реакционную смесь энергично перемешивают при температуре 25-30 С в течение 2 ч, а затем перемешивают еще час при температуре 30 С. Затем добавляют воду (100 мл), а после этого гидрокарбонат натрия (3,7 г, 0,044 моль) и, наконец, метабисульфит натрия (8 г). Органический слой отделяют и водную фазу экстрагируют дихлорметаном (320 мл). Объединенные органические экстракты сушат над сульфитом натрия, концентрируют досуха и растирают с гексаном, чтобы получить твердое вещество. Полу- 10006372 чают 83 г (94%) целевого соединения (3), т.пл.: 70-72 С. 1 Н-ЯМР:(част. на милл. в CDCl3) 8.05 (м, 2 Н, ароматический, цис-изомер), 7.95 (м, 2 Н, ароматический, транс-изомер), 7.56 (м, ароматический), 7.23 (м, ароматический), 4.77 (м,4 Н, С 2-Н, С 5-Н, и С 2 СН 2 ООСС 6 Н 5), 4.43 (м, 1 Н, C5-H, транс-изомер), 4.09 (м, 1 Н, С 5-Н, цис-изомер), 3.11 (м, 2 Н, С 4-Н, трансизомер), 2.75 (м, 2 Н, С 4-Н, цис-изомер),13 С-ЯМР:(частей на миллион в CDCl3) цис-изомер: 166.64, 134.02, 130.42, 129.88, 129.06, 96.16,68.83, 59.47 и 54.30, транс- изомер: 166.36, 134.12, 130.29, 129.68, 129.15, 108.07, 70.09, 61.83 и 53.47. 3). (+/-)-Цис, транс-2-бензоилоксиметил-4-(N-ацетилцитозин-1'-ил)-1,3-оксатиолан. Соединение (3) растворяют в СН 2 Сl2 (20 мл/г) и охлаждают до -15 С. Добавляют амин (между 1 и 2 экв.), а затем TMSI (между 2 и 5 экв.), поддерживая температуру внутри ниже -5 С. Перемешивание осуществляют в интервале температур от -5 до -10 С, пока соединение (3) не исчезнет. Затем добавляют CuCl (20%) и пиримидин (1,1 экв.). Реакционную смесь нагревают и поддерживают температуру в интервале между 5-10 С, пока тонкослойная хроматография не покажет,что реакция полностью завершена. Реакционную смесь выливают в 5% NH4OH и перемешивают в течение 10 мин, пока не исчезнет твердый осадок. Органический слой отделяют и водный слой экстрагируют с помощью СН 2 Сl2. Органический слой промывают водой, 2% НСl, разбавленным раствором Na2S2O3. Промытый органический слой упаривают, получая продукт, которым является соединение (4). Результаты данной стадии приведены в табл. 2. Продукт характеризуют с помощью 1 Н и 13 С-ЯМР. цис-изомер: 1 Н-ЯМР:(частей на миллион в CDCl3) 9.61 (м, 1 Н, C4'NHCOCH3), 8,29 (д, 1 Н, С 6-Н), 8.06 (м, 2 Н,ароматический), 7.65 (м, 1 Н, ароматический), 7.51 (м, 2 Н, ароматический), 7.25 (д, 1 Н, С 5-Н), 6.61 (д, 1 Н,С 4-Н), 5.50 (т, 1 Н, С 2-Н), 4.80 (м, 2 Н, С 2-СН 2 ООСС 6 Н 5), 4.48 (д, 1 Н, С 5-Н), 4.05 (дд, 1 Н, С 5-Н), 2.25 (с, 3 Н,СН 3) 13 С-ЯМР:(частей на миллион в CDCl3) 170.93, 166.28, 162.80, 155.76, 146.06, 133.91, 129.90,128.84, 97.45, 85.88, 78.25, 64.60, 63.53 и 24.71, транс-изомер: 1H-ЯМР:(частей на миллион в DMSO-d6) 10.88 (с, 1H, C4-NHCOCH3), 8.13 (д, 1 Н, С 6'-Н), 7.96 (м, 2 Н, ароматический), 7.68 (м, 1 Н, ароматический),7.52 (м, 2 Н, ароматический), 7.20 (д, 1 Н, С 5'-Н), 6.35 (д, 1 Н, С 4-Н), 5.96 (дд, 1 Н, С 2 -Н), 4.58 (дд, 1 Н, С 2 СН 2 ООСС 6 Н 5), 4.44 (д, 1H, С 5-Н), 4.29 (м, 2 Н, С 5-Н и СН 2 ООСС 6 Н 5), 2.07 (с, 3 Н, СН 3) 13 С-ЯМР:(частей на миллион в DMSO-d6) 171.53, 165.84, 162.76, 155.21, 146.59, 134.00, 129.64,129.23, 96.54, 83.78, 74.24, 64.58, 64.01 и 24.35. Суспензию субстрата, метилата натрия, 10 мол.% и сооветствующий растворитель перемешивают при комнатной темппературе в течение 2 ч, а затем фильтруют. Отфильтрованный осадок сушат и взвешивают перед определением Ц/Т (цис/транс) соотношения (с помощью 1 Н ЯМР) и выделением. Результаты для указанной стадии приведены в табл. 3. Таблица 3 Энантиомерно чистое соединение (3 а) растворяют в СН 2 Сl2 (10 мл/г) и охлаждают до температуры реакции. Добавляют амин, а затем TMSI, поддерживая температуру ниже -5 С. Перемешивание осуществляют при температуре от -5 до -40 С до тех пор, пока соединение (3 а) не исчезнет. Затем добавляютCuCl (20%) и пиримидин (1,1 экв.). Реакционную смесь нагревают и температуру поддерживают в интервале от - 40 до 30 С, пока тонкослойная хроматография не покажет, что реакция завершена. Реакционную смесь охлаждают до температуры 0-5 С. К суспензии добавляют целит (12 г, 100% вес/вес) и перемешивают. Медленно добавляют концентрированный гидроксид аммония и температуру суспензии поддерживают в интервале 0-10 С. Перемешивают в интервале 0-5 С. Суспензию фильтруют и осадок повторно суспендируют в дихлорметане. Затем перемешивают и фильтруют. Фазы разделяют и водную фазу экстрагируют дихлорметаном. Объединенные органические слои промывают 2% раствором гидроксида аммония, водой, 2% раствором соляной кислоты, 2% раствором метабисульфита натрия и насыщенным раствором гидрокарбоната натрия. Органическую фазу сушат над сульфатом магния, фильтруют, а затем упаривают в вакууме, получая сырой продукт конденсации с основанием в виде твердого вещества серовато-желтого цвета. Твердое вещество растворяют в ЕtOАс и дают ему возможность закристаллизоваться. Суспензию перемешивают при температуре 0-5 С, а затем фильтруют. Твердое вещество сушат в вакууме, получая чистый продукт конденсации с основанием в виде твердого вещества бледного серовато-желтого цвета. Результаты указанной стадии приведены в табл. 4 и 5. 1 Н ЯМР (300 МГц) (CDCl3) : 2.27 (с, 3 Н, СН 3 цис), 2.29 (с, 3 Н, СН 3 транс), 4.06 (дд, J=4.5 Гц и ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Стереоселективный способ получения преимущественно цис-соединений формулы (А) где X является кислородом, NH или серой,Y является кислородом, NH или серой,R8 и R9 независимо выбирают из водорода, гидроксила, амино, C1-6 алкила, С 2-6 алкенила, С 2-6 алкинила, С 1-10 ацила, С 6-10 арила, С 6-11 карбониларила, С 1-7 карбонилоксиалкила, С 6-11 карбонилоксиарила, С 2-7- 15006372 карбониламиноалкила и аминокислот,R8 также может быть насыщенным или ненасыщенным С 3-8 карбоциклическим кольцом, необязательно замещенным СООН, C(O)NH2, ОН, SH, NH2, NO2, С 1-6 алкилом, С 2-6 алкенилом, С 2-6 алкинилом,галогеном, C(O)R14 или C(O)OR15, иR9 выбирают из Н, С 1-6 алкила, С 2-6 алкенила и С 2-6 алкинила,R8, R9 также могут быть вместе связаны с атомом азота с образованием насыщенного или ненасыщенного С 3-8 гетероциклического кольца, необязательно замещенного С(О)ОН, C(O)NH2, ОН, SH, NH2,NO2, С 1-6 алкилом, С 2-6 алкенилом, C2-6 алкинилом, галогеном, C(O)R14 или C(O)OR15,R14 является С 1-6 алкилом, С 2-6 алкенилом, С 2-6 алкинилом,R15 является С 1-6 алкилом, С 2-6 алкенилом, С 2-6 алкинилом иR10, R11, R12 и R13 независимо выбирают из водорода, галогена, гидроксила, амино, циано, карбоксила, карбамоила, C2-7 алкоксикарбонила, гидроксиметила, трифторметила, С 6-10 арилтио, C1-6 алкила, С 2-6 алкенила, замещенного или незамещенного галогеном или азидо, С 2-6 алкинила, С 1-6, ацилокси, тиокарбокси, тиокарбамоила, карбамата, уреидо, амидино или С 6-10 арилокси, иQ является кислородом или серой,включающий стадию конденсации соединения формулы (В) в которой R2 является С 7-10 арилалкилом, С 1-16 ацилом или Si(Z1)(Z2)(Z3) и Z1, Z2 и Z3 независимо выбирают из водорода; С 1-20 алкила, необязательно замещенного фтором, бромом, хлором, иодом, C1-6 алкокси или С 6-20 арилокси; С 7-20 аралкила, необязательно замещенного галогеном, С 1-20 алкилом или С 1-20 алкокси; С 6-20 арила, необязательно замещенного фтором, бромом, хлором, иодом, C1-20 алкилом или С 1-20 алкокси; триалкилсилила; фтора; брома; хлора и иода; с основанием R1 в С 1-10 растворителе для конденсации в присутствии каталитического количества Сu, Ag, Аu, Zn, Cd или их комбинации, во всех случаях находящихся в окисленном состоянии, третичного амина и кислоты Льюиса формулы (С) где R4, R5 и R6 независимо выбирают из группы, состоящей из водорода; С 1-20 алкила, необязательно замещенного фтором, бромом, хлором, иодом; C1-6 алкокси или С 6-20 арилокси; С 7-20 аралкила, необязательно замещенного галогеном, C1-20 алкилом или С 1-20 алкокси; С 6-20 арила, необязательно замещенного фтором, бромом, хлором, иодом, С 1-20 алкилом или С 1-20 алкокси; триалкилсилила; фтора; брома; хлора и иода; иR7 выбирают из группы, состоящей из фтора; брома; хлора; иода; С 1-20 сульфонатных эфиров, необязательно замещенных фтором, бромом, хлором или иодом; С 1-20 алкильных эфиров необязательно замещенных фтором, бромом, хлором или иодом; трииодида; силильной группы формулы (R4)(R5)(R6)Si; С 6-20 арилселененила; С 6-20 арилсульфенила; С 6-20 алкоксиалкила; и триалкилсилокси с образованием промежуточного соединения формулы (D) где R1, R2 и Q имеют значения, определенные выше; и снятие защиты с промежуточного соединения формулы (D) с получением цис-соединения формулы (А). 2. Способ по п.1, в котором третичный амин представляет собой амин формулы N(Z4)(Z5)(Z6), где 4(Z ), (Z5), (Z6) независимо выбирают из С 1-6 алкила, необязательно замещенного C1-3 алкилом, С 6-10 арилом или галогеном. 3. Способ по п.1, в котором органическим растворителем является С 1-8 хлоралкил, С 1-8 хлоралкенил,С 6-10 хлорарил, C1-8 алкилонитрил или их смеси. 4. Способ по п.3, в котором органический растворитель выбирают из группы, включающей хлорметаны, хлорэтаны, метанонитрилы и их смеси. 5. Способ по п.2, в котором третичный амин является триэтиламином, диэтилциклогексиламином,диэтилметиламином, диметилэтиламином, диметилизопропиламином, диметилбутиламином, диметилциклогексиламином, трибутиламином, диэтилметиламином, диметилизопропиламином, диизопропилэтиламином или их комбинациями. 6. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества Сu, Zn или их комбинации, во всех случаях находящихся в окисленном состоянии. 7. Способ по п.1, в котором Q является кислородом.- 16006372 8. Способ по п.1, в котором стадию конденсации проводят при температуре, равной или меньшей чем 30 С. 9. Способ по п.1, в котором стадию снятия защиты проводят в присутствии агента снятия защиты и в растворителе для снятия защиты, который благоприятствует кристаллизации цис-соединений формулы(А). 10. Способ по п.9, в котором агентом снятия защиты является щелочной агент. 11. Способ по п.10, в котором агент для снятия защиты представляет собой гидроксид натрия, метилат натрия, гидроксид аммония, гидроксид калия, гидроксид лития, аммиак в метаноле или их смеси. 12. Способ по п.9, в котором растворитель для снятия защиты представляет собой воду, метанол,этанол, толуол, трет-бутилметиловый эфир или их смеси. 13. Способ по п.1, в котором R1 выбирают из N4-алкилпиримидинов, N4-ацилпиримидинов, 4-галогенпиримидинов, N4-ацетиленилпиримидинов, 4-амино- и N4-ацилпиримидинов, 4-гидроксиалкилпиримидинов, 4-тиоалкилпиримидинов, тимина, цитозина, 6-азапиримидина, 2-меркаптопиримидина, 4 меркаптопиримидина, урацила, С 5-алкилпиримидинов, С 5-бензилпиримидинов, С 5-галогенпиримидинов,С 5-винилпиримидина, С 5-ацетиленилпиримидина, С 5-ацилпиримидина, С 5-амидопиримидина, С 5 цианопиримидина, С 5-нитропиримидина, С 5-аминопиримидина, 5-азацитидинила, 5-азаурацилила, триазолопиридинила, имидазолопиридинила, пирролопиримидинила, пиразолопиримидинила. 14. Способ по п.1, в котором R2 является где Е является С 6-10 арилом, С 1-16 алкокси, С 2-16 алкоксиалкилом или С 1-16 алкилом; или Si(Z1)(Z2)(Z3), где Z1, Z2 и Z3 независимо выбирают из группы, включающей водород; С 1-20 алкил, необязательно замещенный фтором, бромом, хлором, иодом; С 7-10 аралалкил, необязательно замещенный фтором, бромом, хлором, иодом; и С 6-10 арил, необязательно замещенный фтором, бромом, хлором, иодом. 15. Стереоселективный способ получения преимущественно цис-соединений формулы (А) в которой R1 является основанием, выбранным из группы N4-алкилпиримидинов, N4-ацилпиримидинов,4-галогенпиримидинов, N4-ацетиленилпиримидинов, 4-амино- и N4-ацилпиримидинов, 4-гидроксиалкилпиримидинов, 4-тиоалкилпиримидинов, тимина, цитозина, 6-азапиримидина, в том числе 6 азацитозина, 2- и/или 4-меркаптопиримидина, урацила, С 5-алкилпиримидинов, С 5-бензилпиримидинов,С 5-галогенпиримидинов, С 5-винилпиримидина, С 5-ацетиленилпиримидина, С 5-ацилпиримидина, С 5 амидопиримидина, С 5-цианопиримидина, С 5-нитропиримидина, С 5-аминопиримидина, 5-азацитидинила,5-азаурацилила, триазолопиридинила, имидазолопиридинила, пирролопиримидинила, пиразолопиримидинила; иQ является кислородом,включающий стадию конденсации соединения формулы (В) в которой R2 является С 7-10 арилалкилом, С 1-16 ацилом или Si(Z1)(Z2)(Z3) и Z1, Z2 и Z3 независимо выбирают из водорода; C1-20 алкила, необязательно замещенного фтором, бромом, хлором, иодом, C1-6 алкокси или С 6-20 арилокси; С 7-20 аралкила, необязательно замещенного галогеном, С 1-20 алкилом или С 1-20 алкокси; С 6-20 арила, необязательно замещенного фтором, бромом, хлором, иодом, С 1-20 алкилом или С 1-20 алкокси; триалкилсилила; фтора; брома; хлора и иода; с основанием R1 в растворителе для конденсации в присутствии каталитического количества Сu, Ag, Аu, Zn, Cd или их комбинации, во всех случаях находящихся в окисленном состоянии, третичного амина и кислоты Льюиса формулы (С) где R4, R5 и R6 независимо выбирают из группы, состоящей из водорода; С 1-20 алкила, необязательно замещенного фтором, бромом, хлором, иодом, С 1-6 алкокси или С 6-20 арилокси; С 7-20 аралкила, необязатель- 17006372 но замещенного галогеном, C1-20 алкилом или C1-20 алкокси; С 6-20 арила, необязательно замещенного фтором, бромом, хлором, иодом, С 1-20 алкилом или C1-20 алкокси; и R7 выбирают из группы, состоящей из фтора; брома; хлора; иода; С 1-20 сульфонатных эфиров, необязательно замещенных фтором, бромом, хлором или иодом; С 1-20 алкильных эфиров необязательно замещенных фтором, бромом, хлором или иодом; трииодида; силильной группы формулы (R4)(R5)(R6)Si; С 6-20 арилселененила; С 6-20 арилсульфенила; С 6-20 алкоксиалкила; и триалкилсилокси с образованием промежуточного соединения формулы (D) и снятие защиты с промежуточного соединения формулы (D), где промежуточное соединение (D) растворяют в растворителе, который способствует кристаллизации цис-соединений формулы (А), в присутствии подходящего количества агента снятия защиты с получением цис-соединений формулы (А). 16. Стереоселективный способ получения преимущественно цис-нуклеозидов или аналогов и производных нуклеозидов формулы (А) в которой R1 является основанием, выбранным из группы цитозина, урацила, тимина, и 5 фторпиримидина; иQ является кислородом, включающий стадию конденсации соединения формулы (В) где Е является С 6-10 арилом, С 1-16 алкокси, С 2-16 алкоксиалкилом или С 1-16 алкилом; или Si(Z1)(Z2)(Z3), где Z1, Z2 и Z3 независимо выбирают из группы, включающей водород; С 1-20 алкил, необязательно замещенный фтором, бромом, хлором, иодом; С 7-10 аралалкил, необязательно замещенный фтором, бромом, хлором, иодом; и С 6-10 арил, необязательно замещенный фтором, бромом, хлором, иодом,с основанием R1 в растворителе для конденсации в присутствии каталитического количества Сu илиZn, во всех случаях находящихся в окисленном состоянии, третичного амина и кислоты Льюиса, выбранной из группы, включающей триметилсилилтрифлат, бромтриметилсилан, иодтриметилсилан и их смеси; с образованием промежуточного соединения формулы (D) и снятие защиты с промежуточного соединения формулы (D), где промежуточное соединение (D) растворяют в растворителе в присутствии подходящего количества агента снятия защиты с получением цис-соединений формулы (А). 17. Способ по п.1, в котором указанное каталитическое количество Сu, Ag, Аu, Zn, Cd или их комбинаций, во всех случаях находящихся в окисленном состоянии, составляет от 0,25 до 100 мол.%. 18. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества Cu+, Cu2+, Ag+, Au+, Au3+, Zn2+ или Cd2+. 19. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества Cu+, Cu2+ или Zn2+. 20. Способ по п.1, в котором количество третичного амина составляет от 1 до 4 эквивалентов. 21. Способ по п.1, в котором используемое количество растворителя для конденсации составляет от 5 мл на грамм сульфоксида до 50 мл на грамм сульфоксида. 22. Способ по п.21, в котором количество растворителя для конденсации составляет от 10 мл на грамм сульфоксида до 30 мл на грамм сульфоксида. 23. Способ по п.1, в котором стадию конденсации проводят при температуре от 40 до -50 С.- 18006372 24. Способ по п.1, в котором стадию конденсации проводят при температуре от 30 до -40 С. 25. Способ по п.1, в котором стадию снятия защиты проводят в растворителе, выбираемом из воды,метанола, этанола, толуола, трет-бутилметилового эфира и их комбинаций. 26. Способ по п.1, в котором количество агента снятия защиты составляет от 0,1 до 50 мол.%. 27. Способ по п.26, в котором количество агента снятия защиты составляет от 5 до 20 мол.% агента снятия защиты. 28. Способ по п.26, в котором в том случае, когда функциональные кислородные и азотные группы присутствуют в R1, они защищены с использованием защитной группы, выбранной из триметилсилильной, диметилгексилсилильной, трет-бутилдиметилсилильной, трет-бутилдифенилсилильной, тритильной, С 1-12 алкильной групп и С 1-12 ацила. 29. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества CuCl2, CuCl, CuBr, CuI, CuSCN, ZnBr2, Cu(II)-ацетилацетоната или их комбинаций и R2 является ацилом, содержащим до 16 атомов С. 30. Способ по п.18, в котором указанный R2 является ацилом, содержащим до 16 атомов С. 31. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества СиСl2, CuCl, CuBr, CuI, CuSCN, ZnBr2, Cu(II)-ацетилацетоната или их комбинаций и R2 является ацилом, выбранным из группы, включающей ацетил, пропионил, изобутаноил, пивалоил, гексаноил, бутирил, пентаноил, 3-метилбутирил, гидросукцинат, мезилат, валерил, капроил, каприл, каприноил, лаурил, миристил, пальмитил, стеарил, олеил, 3-хлорбензоат, трифторацетил, хлорацетил, циклогексаноил,бензоил, метансульфонил и п-толуолсульфонил. 32. Способ по п.18, в котором указанный R2 является ацилом, выбранным из группы, включающей ацетил, пропионил, изобутаноил, пивалоил, гексаноил, бутирил, пентаноил, 3-метилбутирил, гидросукцинат, мезилат, валерил, капроил, каприл, каприноил, лаурил, миристил, пальмитил, стеарил, олеил, 3 хлорбензоат, трифторацетил, хлорацетил, циклогексаноил, бензоил, метансульфонил и птолуолсульфонил. 33. Способ по п.31, в котором указанный R2 является ацетилом, пропионилом, бензоилом, метансульфонилом и п-толуолсульфонилом. 34. Способ по п.32, в котором указанный R2 является ацетилом, пропионилом, бензоилом, метансульфонилом и п-толуолсульфонилом. 35. Способ по п.33, в котором указанный R2 является бензоилом. 36. Способ по п.34, в котором указанный R2 является бензоилом. 37. Способ по п.1, в котором указанную конденсацию проводят в присутствии каталитического количества хлорида, иодида, бромида, тиоцианата или ацетилацетоната Сu, Ag, Аu, Zn или Cd или их комбинаций. 38. Способ по п.37, в котором указанный R2 является ацилом, содержащим до 16 атомов С. 39. Способ по п.37, в котором указанный R2 является ацилом, выбранным из группы, включающей ацетил, пропионил, изобутаноил, пивалоил, гексаноил, бутирил, пентаноил, 3-метилбутирил, гидросукцинат, мезилат, валерил, капроил, каприл, каприноил, лаурил, миристил, пальмитил, стеарил, олеил, 3 хлорбензоат, трифторацетил, хлорацетил, циклогексаноил, бензоил, метансульфонил и п-толуолсульфонил. 40. Способ по п.39, в котором указанный R2 является ацетилом, пропионилом, бензоилом, метансульфонилом и п-толуолсульфонилом. 41. Способ по п.40, в котором указанный R2 является бензоилом.
МПК / Метки
МПК: C07D 409/04
Метки: аналогов, получения, нуклеозидных, способ, стереоселективный
Код ссылки
<a href="https://eas.patents.su/20-6372-stereoselektivnyjj-sposob-polucheniya-nukleozidnyh-analogov.html" rel="bookmark" title="База патентов Евразийского Союза">Стереоселективный способ получения нуклеозидных аналогов</a>
Предыдущий патент: Противовоспалительные конденсированные пирролокарбазолы
Следующий патент: Способ и устройство ассоциирования слов
Случайный патент: Распорный вкладыш для путевого костыля