Фармацевтическая композиция антагониста рецептора серотонина и способ ее получения
Номер патента: 4502
Опубликовано: 29.04.2004
Авторы: Хэнли Стефен Дж., Комиски Стефен Дж., Кон Рэйчел С.
Формула / Реферат
1. Способ получения фармацевтической композиции, включающий стадии
a) смешения фармацевтически активного соединения формулы I
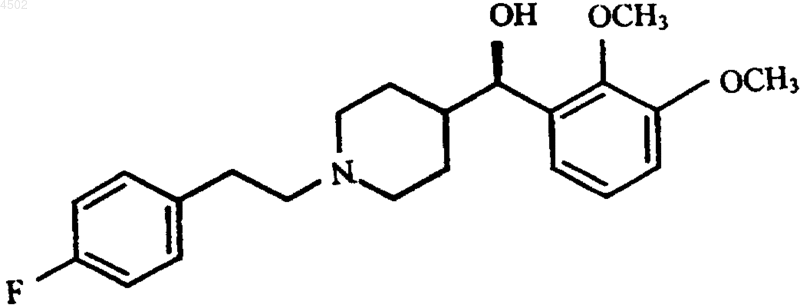
или его фармацевтически приемлемой соли с биоразлагаемым полимером с образованием сухой смеси, при этом биоразлагаемый полимер имеет температуру стеклования (Tc) ниже 60шC;
b) воздействия на сухую смесь сдвигового смешения таким образом, что полимер размягчается с образованием псевдоожиженной среды и фармацевтически активное соединение растворяется с образованием твердого раствора, имеющего, по существу, гомогенно диспергированную смесь фармацевтически активного соединения и полимера, далее гомогенная смесь формуется в стренгу;
c) гранулирования стренги и
d) измельчения гранул с образованием микрочастиц с пролонгированным высвобождением, которые имеют распределение по размеру в интервале от 10 до 200 мкм и являются пригодными для образования инъекционной лекарственной формы.
2. Способ по п.1, в котором фармацевтически активное соединение является антагонистом 5HT2A-рецептора.
3. Способ по п.1, в котором полимер выбран из группы, состоящей из сложного полиэфира, полиамида, полиангидридов, сложных полиортоэфиров, поликарбонатов, сложных полифосфоэфиров, полифосфазенов, полииминокарбонатов и их смесей.
4. Способ по п.1, в котором полимер выбран из группы, состоящей из полилактида, полигликолида, сополимера лактид-гликолид, полигидроксибутирата, поликапролактона, политартрата и их смесей.
5. Способ по п.1, в котором полимером является сополимер лактид-гликолид.
6. Способ по п.5, в котором сополимер лактид-гликолид имеет среднюю молекулярную массу от примерно 20000 до примерно 100000.
7. Способ по п.5, в котором сополимер лактид-гликолид имеет среднюю молекулярную массу от примерно 30000 до примерно 45000.
8. Способ по п.5, в котором сополимер лактид-гликолид содержит 45-90 мол.% лактидных звеньев и 10-55 мол.% гликолидных звеньев соответственно.
9. Способ по п.1, в котором смешивание на стадии (a) выполняется при температуре окружающей среды.
10. Способ по п.1, в котором смешивание на стадии (a) выполняется при температуре в интервале от примерно 20 до примерно 30шC.
11. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется с использованием экструдера.
12. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется с использованием одношнекового экструдера.
13. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется с использованием двухшнекового экструдера.
14. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется при температуре в интервале от примерно 60 до примерно 140шC.
15. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется при температуре в интервале от примерно 80 до примерно 120шC.
16. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется при температуре в интервале от примерно 95 до примерно 115шC.
17. Способ по п.1, в котором массовое соотношение фармацевтически активного соединения и полимера находится в интервале от примерно 5:95 до примерно 25:75.
18. Способ по п.1, в котором массовое соотношение фармацевтически активного соединения и полимера находится в интервале от примерно 10:90 до примерно 20:80.
19. Способ по п.1, в котором фармацевтически активное соединение растворяется в полимере, по меньшей мере, в степени примерно 50 мас.% по отношению к общей массе фармацевтически активного соединения, присутствующего в указанной композиции.
20. Способ по п.1, в котором фармацевтически активное соединение растворяется в полимере, по меньшей мере, в количестве примерно 90 мас.% от общей массы фармацевтически активного соединения, присутствующего в композиции.
21. Способ по п.1, в котором микрочастицы добавляют в фармацевтически приемлемый раствор с образованием инъецируемой суспензии.
22. Способ по п.21, в котором суспензия при введении пациенту высвобождает фармацевтически активное соединение в течение, по меньшей мере, примерно 2 недель в дозе, достаточной для антагонизации эффектов серотонина на 5HT2A-рецептор.
23. Способ по п.21, в котором суспензия при введении пациенту высвобождает фармацетически активное соединение в течение периода от примерно 2 недель до примерно 1 месяца в дозе, достаточной для антагонизации эффектов серотонина на 5HT2A-рецептор.
24. Способ получения фармацевтической композиции, включающий стадии
a) смешивания фармацевтически активного соединения формулы I

или его фармацевтически приемлемой соли и сополимера лактид-гликолида при температуре примерно 25шC и атмосферном давлении в течение времени, достаточного для образования сухой смеси, где массовое соотношение соединения и полимера находится в интервале от примерно 10:90 до примерно 15:85, при этом полимер имеет температуру стеклования (Tc) ниже 60шC;
b) сушки указанной смеси в вакууме при температуре примерно 25шC до достижения содержания влаги в смеси менее 0,02 мас.%;
c) пропускания указанной сухой смеси через нагретый двухшнековый экструдер, имеющий по меньшей мере один левосторонний элемент, при достаточной скорости сдвига и при температуре от примерно 95 до 115шC, в течение времени, достаточного для размягчения полимера с образованием псевдоожиженной среды, и растворения соединения в полимере с образованием твердого раствора, имеющего гомогенно диспергированную смесь соединения в полимерной матрице, экструдирования гомогенной смеси в стренгу, при этом условия сдвига поддерживаются таким образом, что менее 1 мас.% соединения взаимодействует с полимером;
d) гранулирования стренги и
e) измельчения и просеивания гранул с образованием инъецируемых микрочастиц фармацевтической композиции, имеющих распределение по размеру в интервале от примерно 10 до 100 мкм.
25. Фармацевтическая композиция, содержащая микрочастицы, имеющие распределение по размеру в интервале от примерно 10 до 100 мкм, образованные из
a) биоразлагаемого полимера в количестве от примерно 80 до 95 мас.%, имеющего температуру стеклования (Tc) ниже 60шC; и
b) фармацевтически активного соединения формулы I или его фармацевтически приемлемой соли в количестве от примерно 5 до 20 мас.%
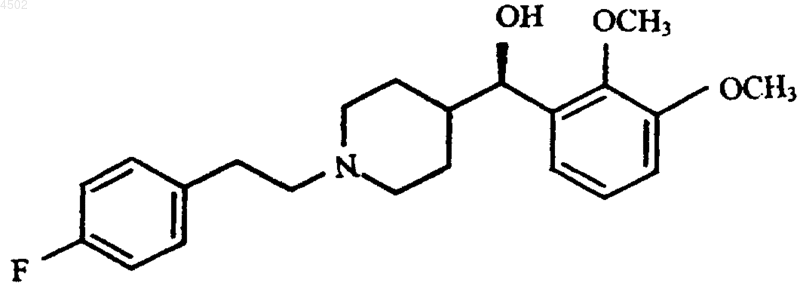
где соединение растворено и однородно диспергировано в полимере.
26. Композиция по п.25, в которой соединение является антагонистом 5HT2A-рецептора.
27. Композиция по п.25, в которой полимером является сополимер лактид-гликолид.
28. Композиция по п.25, в которой сополимер лактид-гликолид имеет среднюю молекулярную массу от примерно 20000 до примерно 100000.
29. Композиция по п.25, в которой сополимер лактид-гликолид имеет среднюю молекулярную массу от примерно 30000 до 45000.
30. Композиция по п.25, в которой сополимер лактид-гликолид содержит 45-90 мол.% лактидных звеньев и 10-55 мол.% гликолидных звеньев соответственно.
31. Композиция по п.25, в которой фармацевтически активное соединение растворяется в полимере, по меньшей мере, в количестве примерно 50 мас.% от общей массы фармацевтически активного вещества, присутствующего в композиции.
32. Композиция по п.25, в которой фармацевтически активное соединение растворяется в полимере, по меньшей мере, в количестве примерно 90 мас.% от общей массы указанного фармацевтически активного соединения, присутствующего в композиции.
33. Композиция по п.25, в которой микрочастицы вводятся в фармацевтически приемлемый раствор с образованием инъецируемой суспензии.
34. Композиция по п.33, в которой суспензия при введении пациенту высвобождает указанное фармацевтически активное соединение в течение, по меньшей мере, не менее примерно 2 недель в дозе, достаточной для антагонизации эффектов серотонина эр 5HT2A-рецептор.
35. Композиция по п.33, в которой суспензия при введении пациенту высвобождает фармацевтически активное соединение в течение периода от примерно 2 недель до примерно 1 месяца в дозе, достаточной для антагонизации эффектов серотонина на 5HT2A-рецептор.
36. Фармацевтическая композиция по п.25, используемая для антагонизации эффектов рецептора серотонина.
37. Фармацевтическая композиции по п.36, отличающаяся тем, что эффекты рецептора серотонина антагонизируются в течение периода от примерно 2 недель до примерно 1 месяца.
38. Фармацевтическая композиция по п.25, используемая для антагoнизации эффектов серотонина на 5HT2A-рецептор.
39. Фармацевтическая композиции по п.38, отличающаяся тем, что эффекты серотонина на 5HT2A-рецетор антагонизируются в течение периода от примерно 2 недель до примерно 1 месяца.
40. Фармацевтическая композиция по п.25, используемая в ингибировании психозов.
41. Фармацевтическая композиция по п.25, используемая в лечении депрессии и биполярного расстройства.
42. Фармацевтическая композиция по п.25, используемая в лечении состояния тревоги.
43. Фармацевтическая композиция по п.25, используемая в лечении навязчивого компульсивного расстройства.
44. Фармацевтическая композиция по п.25, используемая в лечении наркомании.
45. Фармацевтическая композиция по п.25, используемая в лечении коронарных вазоспазмов.
46. Фармацевтическая композиция по п.25, используемая в лечении стенокардии.
47. Фармацевтическая композиция по п.25, используемая в лечении тромботического заболевания.
48. Фармацевтическая композиция по п.25, используемая в лечении нарушения сна.
49. Фармацевтическая композиция, содержащая микрочастицы, имеющие распределение по размеру в интервале от примерно 10 до 100 мкм, состоящие из
a) сополимера лактид-гликолида в количестве от примерно 85 до 95 мас.%, где полимер имеет температуру стеклования (Tc) ниже 60шC; и
b) фармацевтически активного соединения формулы I или его фармацевтически приемлемой соли в количестве от примерно 5 до 15 мас.%
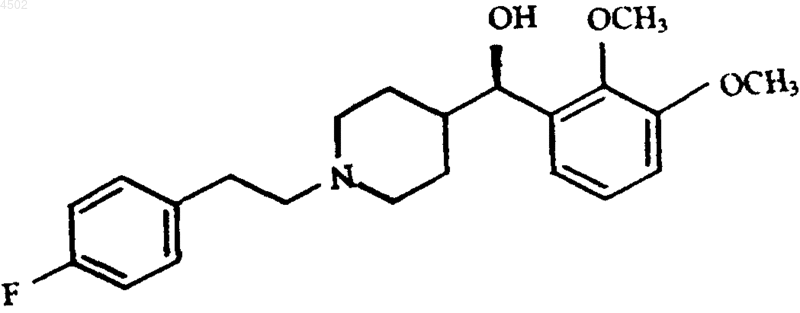
где соединение растворяется и однородно диспергируется в сополимере лактид-гликолид.
Текст
1 Предпосылки создания изобретения Область техники, к которой относится изобретение Данное изобретение относится к получению композиций с пролонгированным высвобождением, содержащих биоразлагаемый полимер и фармацевтически активную молекулу,которые используются при лечении различных заболеваний, включая некоторые психозы, такие как, например, шизофрения, навязчивое компульсивное расстройство, состояние тревоги и биполярные расстройства. Более конкретно,настоящее изобретение относится к композициям с пролонгированным высвобождением из биоразлагаемого сложного полиэфира и фармацевтически активной молекулы, способной проявлять активность антагониста рецептора серотонина при 5 НТ 2-рецепторе, способу их получения и способу лечения больных, нуждающихся в таких композициях. Описание прототипа Давно замечено, что непрерывное высвобождение некоторых лекарств в течение длительного периода, следующее за единственным введением, может иметь значительные практические преимущества в клинической практике. Также признано, что доставка лекарства к участку его терапевтического действия, такому как,например, центральная нервная система CNS)(ЦНС, может быть очень трудной задачей изза многочисленных химических и физических барьеров, которые должны быть преодолены для успешного осуществления такой доставки. Особенно трудной проблемой является пролонгированное введение лекарства больным, страдающим от заболеваний, относящихся к ЦНС. Это особенно справедливо для больных, страдающих от различных заболеваний, относящихся к ЦНС, таких как шизофрения, навязчивое компульсивное расстройство, нарушения сна,депрессия, состояние тревоги, анорексия и наркомания. Кроме того, требуется поддерживать стабильный уровень лекарства у больных, страдающих такими заболеваниями, с тем, чтобы обеспечить более эффективное лечение с низкими пиковыми концентрациями лекарства. В результате, разработано много способов эффективной доставки лекарств к ЦНС. Один такой способ включает получение рецептур с пролонгированным высвобождением. Рецептуры с постоянным высвобождением могут, однако, быть различных типов. Например, лекарство может быть химически модифицировано в форму, называемую пролекарством, которая способна медленно трансформироваться в его активную форму либо до, либо после преодоления гематоэнцефалического барьера. Пример такой системы доставки пролекарства состоит из нейропередающего допамина, присоединенного к молекулярной маске, полученной из жирорастворимого витамина ниацина. Модифицированный допамин поступает в головной мозг, где он 2 затем медленно отщепляется от его маски пролекарства с выходом свободного допамина. Другие общеизвестные способы, используемые для получения готовых форм с замедленным высвобождением, включают образование микрочастиц, в которых биоактивные агенты содержатся в совместимом биоразлагаемом полимере. В технике описан ряд способов, которые используют широкий ряд органических растворителей для получения таких микрочастиц. Например, патент США 4389330 описывает способ получения микрокапсул растворением или диспергированием активного агента одновременно с стенкообразующим материалом в растворителе. Растворители, используемые для получения таких микрокапсул, включают хлорированные углеводороды, в частности метиленхлорид, ацетон, спирты и т.п. Однако, благодаря экологическим и токсикологическим требованиям невозможно получить некоторые из этих лекарственных форм с использованием растворителей. В частности, имеется ряд регулирующих ограничений, касающихся удаления растворителя и твердых остатков, получаемых в процессе изготовления этих лекарственных форм. Кроме того, имеется много недостатков в способе получения микрочастиц лекарственных средств в растворителе. Во-первых, этот способ является неэкономичным для крупного промышленного масштаба. Во-вторых, имеются также требования к качеству, такие как воспроизводимость и совместимость распределения лекарства в полимерной матрице, вызывающие серьезные проблемы регулируемого введения. Наконец, способом с использованием растворителя обычно получают только микросферы в порошкообразной форме. Для преодоления некоторых из проблем способа получения микрочастиц с использованием растворителя существуют известные в технике способы экструдирования расплава твердой смеси молекул лекарственного средства и ряда полимерных связующих. Например, патент США 5439688 описывает способ получения фармацевтической композиции для пролонгированного высвобождения молекулы лекарственного средства. Однако все описанные в нем молекулы лекарственного средства являются синтетическими или природными пептидами. Патент США 5456923 описывает способ получения твердой дисперсии лекарственного средства, растворенного или диспергированного в полимере или разбавителе, с использованием двухшнекового экструдера. Однако ни одна из указанных ссылок не описывает формование фармацевтических композиций с пролонгированным высвобождением с использованием экструзионного расплавного способа, в котором такие композиции являются пригодными для лечения любого из описанных 3 выше заболеваний ЦНС. Кроме того, ни одна из ссылок не описывает способ формования микрочастиц, в котором молекулы лекарственного средства растворены в полимерной матрице и используются в формовании инъекционных рецептур для лечения заболеваний, относящихся к ЦНС. Следующие ссылки рассматриваются в качестве предпосылок создания изобретения. Патент США 4389330 описывает способ микрокапсулирования для формования микрокапсул, содержащих активный агент, включающий ряд стадий с использованием растворителя. Патент США 4801460 описывает способ получения твердых фармацевтических форм литьевым формованием или экструзионным способом. Патент США 5360610 описывает полимерные микросферы в качестве инъекционных систем для доставки при использовании для доставки биоактивных агентов к участкам центральной нервной системы. Патент США 5439688 и приведенные в нем ссылки описывают способы получения фармацевтических композиций для пролонгированного и/или регулируемого высвобождения лекарственного средства с использованием биоразлагаемого полимера и введением в качестве активного вещества солей природного или синтетического пептида. Патент США 5456917 описывает способ получения имплантируемого биоразрушаемого материала для пролонгированного высвобождения медикамента. Патент США 5456923 описывает способ получения твердой дисперсии, в котором лекарство растворяется или диспергируется в полимерном носителе или разбавителе. Твердые дисперсии формуются в двухшнековом экструдере. Патент США 5505963 описывает способ получения фармацевтической композиции, свободной от органических растворителей, используемой для перорального введения. В способе используют отвердевшие гранулы активного ингредиента в смеси с термоплавким вспомогательным веществом, которое является растворимым в активном ингредиенте при повышенных температурах.J.Controlled Release, 28(1994), 121-129, дает обзор систем доставки лекарственных средств, использующих различные виды биоразлагаемых полимеров.Pharmacy International (1986), 7(12), 316318, дает обзор регулируемого высвобождения лекарственных средств из монолитных биоразрушаемых полимерных устройств. Все приведенные публикации включены в описание изобретения в качестве ссылок. Краткое описание изобретения Соответственно, целью настоящего изобретения является создание способа формова 004502 4 ния микрочастиц методом экструзии из расплава, в котором молекулы лекарства по существу растворяются в полимерной матрице, образуя твердый раствор. Другой целью настоящего изобретения является создание микрочастиц,способных высвобождать молекулы лекарства с постоянной скоростью высвобождения в течение длительного периода времени. Наконец,целью настоящего изобретения также является создание инъекционных рецептур микрочастиц для лечения различных заболеваний ЦНС,включая заболевания или состояния, которые лечатся антагонизацией эффектов серотонина при 5 НТ 2-рецепторе, таких как шизофрения,навязчивые компульсивные расстройства, нарушения сна, депрессия, состояние тревоги,анорексия и наркомания. Неожиданно было найдено, что твердый раствор биоразлагаемого полимера и фармацевтически активной молекулы может быть получен методом экструзии из расплава. Некоторыми преимуществами, получаемыми при осуществлении способа настоящего изобретения, отдельно и/или в комбинациях, являются следующие: а) фармацевтически активное соединение по существу растворяется в биоразлагаемой полимерной матрице, образуя твердый раствор;b) композиции настоящего изобретения могут быть легко формованы в микрочастицы; и с) композиции настоящего изобретения могут быть введены в инъекционные лекарственные формы для пролонгированного высвобождения активного соединения. Преимущественно композиции настоящего изобретения используются для лечения различных заболеваний ЦНС. Таким образом, в соответствии с осуществлением настоящего изобретения предлагается способ получения фармацевтической композиции, включающий стадии а) смешения соответствующего количества фармацевтически активной молекулы, способной проявлять активность антагониста рецептора серотонина, с соответствующим количеством биоразлагаемого полимера в течение достаточного периода времени в подходящих условиях температуры и давления с получением сухой смеси указанной фармацевтически активной молекулы и указанного полимера, где указанный биоразлагаемый полимер имеет температуру стеклования Тg) (Тc) ) ниже примерно 60 С;b) воздействия на указанную сухую смесь сдвигового смешения в подходящих условиях температуры и давления в течение достаточного периода времени, таким образом, что указанный полимер размягчается с образованием разжиженной среды, и указанная фармацевтически активная молекула достаточно растворена для образования твердого раствора, имеющего по существу гомогенно диспергированную смесь указанной фармацевтически активной молекулы и указанного полимера, и указанная гомогенная смесь формуется в стренгу;d) измельчения указанных гранул с образованием микрочастиц с пролонгированным высвобождением из биоразлагаемого полимера и фармацевтической композиции, причем микрочастицы имеют распределение по размеру в интервале от примерно 10 до 200 мкм, так что микрочастицы являются пригодными для образования инъекционной лекарственной формы. В одном из предпочтительных вариантов биоразлагаемый сложный полиэфир используется в качестве матричного полимера для растворения фармацевтически активной молекулы,способной проявлять активность антагониста рецептора серотонина. В данном предпочтительном варианте микрочастицы с пролонгированным высвобождением формуются в двухшнековом экструдере. В более предпочтительном варианте данного изобретения двухшнековый экструдер выполнен по меньшей мере с одним левосторонним элементом, и экструзия осуществляется в предпочтительном температурном интервале от примерно 95 до примерно 115 С. В другом предпочтительном варианте твердый раствор образуется с использованием лактид-гликолидного сополимера(СПЛГ и фармацевтически активного соединения формулы 1 или фармацевтически приемлемых его солей. В данном предпочтительном варианте сухую смесь СПЛГ и соединения 1 сушат в вакуумной печи при температуре примерно 25 С, так что содержание влаги сухой смеси составляет менее примерно 0,02 мас.%. Экструзию расплава сухой смеси осуществляют в двухшнековом экструдере, оборудованном по меньшей мере одним левосторонним элементом, с получением гомогенной смеси, в которой соединение 1 по существу растворено в СПЛГ-матрице. В предпочтительном варианте гранулирование,измельчение и просеивание экструдированной расплавной смеси дает микрочастицы, имеющие распределение по размеру от примерно 10 до 100 мкм, которые пригодны для образования инъекционных рецептур. В другом аспекте данного изобретения также предусматривается фармацевтическая композиция для пролонгированного высвобождения медикаментозного вещества, содержащая микрочастицы, имеющие распределение по размеру в интервале от примерно 10 до 100 мкм,образованная из а) биоразлагаемого полимера в количестве от примерно 80 до 95 мас.%, где указанный по 004502 6 лимер имеет температуру стеклования (Тс) ниже примерно 60 С; иb) фармацевтически активного соединения формулы 1 или его фармацевтически приемлемой соли в количестве от примерно 5 до 20 мас.%, где указанное соединение по существу растворено и однородно диспергировано в указанном полимере. Подробное описание изобретения Используемые в описании следующие термины имеют определенные значения и/или определения."Биоразлагаемый", "биоабсорбируемый",биоресорбируемый" или "биоразрушаемый" полимер означает любой полимерный материал,способный подвергаться процессу разложения в биологическом окружении, такому как потребление организмом человека и превращение в продукты, которые могут быть легко удалены из организма."Лекарственное средство", "медикамент","фармацевтически активный" или "терапевтически активный" означают любое органическое соединение или вещество, имеющее биоактивность и предназначенное или используемое для терапевтической цели."микрокапсулы" означают любой свободносыпучий порошок, состоящий по существу из сферических частиц 500 мкм или менее в диаметре,обычно 200 мкм или менее в диаметре."Монолитная" означает композицию, в которой активный агент по существу гомогенно диспергирован по всей по существу терапевтически инертной матрице."Пациент" означает теплокровное животное, такое как, например, крысы, мыши, собаки,кошки, морские свинки и приматы, такие как люди. Термин "фармацевтически приемлемая соль" относится к тем солям, которые являются по существу нетоксичными при дозированном введении для достижения желаемого эффекта и не обладают независимо значительной фармакологической активностью. Солями, входящими в объем данного термина, являются соли кислот: бромисто-водородной,хлористоводородной, серной, фосфорной, азотной, муравьиной, уксусной, пропионовой, янтарной,гликолевой, молочной, яблочной, винной, лимонной, аскорбиновой, -кетоглутаровой, глутаминовой, аспарагиновой, малеиновой, гидроксималеиновой, пировиноградной, фенилуксусной, бензойной, парааминобензойной, антрани 7 ловой, парагидроксибензойной, салициловой,гидроксиэтансульфоновой, этиленсульфоновой,галогенбензолсульфоновой,толуолсульфоновой, нафталинсульфоновой, метансульфоновой,сульфаниловой и т.п."Фармацевтически приемлемым носителем" является растворитель, диспергирующий агент, наполнитель, адъювант или другой материал, имеющий приемлемую токсичность, который смешивается с композицией настоящего изобретения для образования фармацевтической композиции, т.е. дозированной формы, способной вводиться пациенту. Одним примером такого носителя является фармацевтически приемлемое масло, обычно используемое для парентерального введения."Твердый раствор" означает, что фармацевтически активная молекула по существу растворяется в полимере с образованием однофазной системы."Пролонгированное высвобождение" означает, что композиция при введении пациенту способна высвобождать активную молекулу с постоянной скоростью в течение периода не менее 2 недель, предпочтительно в течение периода примерно от 2 недель до 1 месяца или в течение более длительного периода, при необходимости."Терапевтически эффективное количество" означает количество соединения, которое является эффективным для лечения названного расстройства или состояния."Лечить" или "лечение" означает облегчение симптомов, исключение причины симптома либо на временной, либо на постоянной основе,или предотвращение или замедление появления названного расстройства или состояния. Одним из преимуществ настоящего способа изобретения является то, что могут быть получены микрочастицы вполне определенного распределения по размеру, в которых фармацевтически активная молекула растворяется в биоразлагаемой полимерной матрице, образуя твердый раствор. Это достигается масштабным способом экструзии расплава, таким образом избегая использования нежелательных растворителей, используемых в традиционных способах. Таким образом, способ настоящего изобретения не только обладает экологическими преимуществами (т.е. избегает удаления растворителей), но также обеспечивает экономичный путь получения лекарственных форм с пролонгированным высвобождением. Другим важным преимуществом способа настоящего изобретения является то, что при осуществлении данного изобретения могут быть получены вполне определенные микрочастицы узкого распределения по размеру, которые используются для образования ряда инъекционных форм. Еще одним преимуществом, получаемым при осуществлении данного изобретения, является то, что может быть легко получен твердый раствор 8 биоразлагаемого полимера и фармацевтически активной молекулы, в котором активной молекулой является нейроактивная непептидная небольшая молекула, которая может содержать функциональную группу, такую как гидроксильная группа. При практическом осуществлении способа настоящего изобретения формованные частицы являются по существу свободными от любых других продуктов взаимодействия фармацевтически активной молекулы и биоразлагаемого полимера. Неожиданно способ настоящего изобретения дает фармацевтические композиции, в которых биодоступность фармацевтически активной молекулы увеличена благодаря тому,что активная молекула является по существу растворенной в полимерной матрице. Таким образом, микрочастицы композиции настоящего изобретения являются по существу "монолитными". Т.е. активная молекула диспергируется однородно по всей полимерной матрице. Необходимо отметить, что многие из описанных характеристик не достигаются в большинстве традиционных способов, включая растворный и другие экструзионные расплавные способы. В соответствии с осуществлением настоящего изобретения предусматривается способ получения фармацевтических композиций, В способе настоящего изобретения первая стадия включает смешение соответствующего количества фармацевтически активной молекулы с соответствующим количеством биоразлагаемого полимера в течение достаточного периода времени в подходящих условиях температуры и давления с получением сухой смеси. Смешение полимера и фармацевтически активной молекулы может выполняться в окружающих атмосферных условиях, предпочтительно в температурном интервале от примерно 20 до 30 С и атмосферном давлении. Время,необходимое для смешения, зависит от используемых количеств полимера и активных молекул и может составлять от 30 мин до 2 ч или больше. Полимер и фармацевтически активная молекула могут использоваться в состоянии поставки из коммерческих источников, обычно в форме порошка или гранул. Однако, наблюдается, что полезным является измельчение порошка или гранул с образованием хорошо смешанной сухой смеси. Любые способы измельчения или помола, известные в технике, могут быть использованы для заданной цели, включая криогенные способы измельчения или помола. Также наблюдается, что сушка сухой смеси полимера и фармацевтически активной молекулы полезна для удаления любой остаточной влаги в полимере или активной молекуле. Среди нескольких преимуществ двумя ключевыми преимуществами сушки сухой смеси являются а) минимизация разложения полимера и b) минимизация любого возможного взаимодействия между полимером и фармацевтически активной 9 молекулой. Может быть использована любая из известных в технике технологий. Например,сушка смеси в вакууме приблизительно при комнатной температуре, т.е. 20-30 С, в течение периода от примерно 2 до 48 ч или более обеспечивает желаемые результаты. Как установлено выше, в данном изобретении может быть использован ширoкий ряд непептидных фармацевтически активных молекул, имеющих молекулярную массу менее примерно 600. Выражение "непептидные", как использовано здесь, означает молекулы, которые не являются пептидами, т.е. молекулы, которые не образуются при взаимодействии двух или более природных аминокислот. Широкий ряд биоразлагающихся полимеров может быть использован в данном изобретении, однако, особенно предпочтительными являются биоразлагающиеся полимеры, имеющие температуру стеклования (Тc) ниже примерно 60 С. Как использовано здесь, "температура стеклования" относится к температуре размягчения полимера,т.е. температуре перехода, выше которой некристаллический полимер имеет достаточную тепловую энергию, чтобы длинные сегменты каждой полимерной цепи двигались беспорядочно. Другими словами, при температуре выше температуры стеклования полимерные молекулы имеют достаточное движение, чтобы быть подвижными, и это называется здесь "разжиженной средой". На второй стадии способа настоящего изобретения сухая смесь, полученная на первой стадии, подвергается сдвиговому смешению в подходящих условиях температуры и давления в течение достаточного периода времени, так что полимер размягчается с образованием разжиженной среды. Как использовано здесь,"сдвиговое смешение" означает смешение сухой смеси при повышенной температуре, предпочтительно выше температуры стеклования полимера, при сдвиге с использованием любого из известных в технике способов. Предпочтительно, сдвиговое смешение осуществляется в смесительном цилиндре или экструзионном оборудовании, как описано. Условия поддерживаются таким образом, что позволяют фармацевтически активной молекуле раствориться в разжиженной полимерной среде и образовать по существу гомогенную смесь фармацевтически активной молекулы и полимера. Для получения наилучшей выгоды от данного изобретения критическим является то, что фармацевтически активная молекула достаточно смешивается или растворяется в полимерной матрице, как указано выше. Для определения степени растворения фармацевтически активной молекулы в полимерной матрице может быть использован ряд методов, хорошо известных в технике, в зависимости от используемого типа полимера и активной молекулы. В общем случае дифференциальная сканирующая калори 004502 10 метрия DSC) (ДСК может быть использована для определения уровня содержания активной молекулы, растворенной в полимере, если активная молекула имеет определенную точку плавления. По теплоте плавления, определенной по пику в точке плавления активной молекулы,можно рассчитать содержание растворенной активной молекулы. Так, когда больше активных молекул растворяется в полимере, размер пика плавления соответственно снижается. Пик плавления полностью отсутствует, когда вся активная молекула растворяется в полимере. Кроме того, температура стеклования (Тc) полимера снижается с увеличением растворимости активной молекулы. Другие методы, такие как сканирующая электронная микроскопия SEM)(СЭМ, могут также использоваться для определения гомогенности фармацевтической композиции настоящего изобретения. Т.е. нерастворенная фармацевтически активная молекула будет проявляться как отдельная фаза. На третьей стадии способа настоящего изобретения разжиженная смесь полимера и фармацевтически активной молекулы охлаждается с образованием стренги и гранулируется. Термин "грануляция" относится к формованию гранул из стренги, полученной согласно данному изобретению. Любой из известных в технике способов может быть использован для получения стренги и грануляции смеси полимера и фармацевтически активной молекулы. Например, струя расплава может быть экструдирована в стренгу при прохождении через отверстие. Затем стренга поступает на конвейерную ленту,которая продувается сухим азотом или воздухом. Стренга, наконец, подается в гранулятор для формованием гранул. На конечной стадии гранулы с третьей стадии измельчаются с образованием микрочастиц с пролонгированным высвобождением из биоразлагаемого полимера и фармацевтически активной молекулы. Термин "измельчение" относится к превращению гранул, полученных согласно данному изобретению, в микроизмельченную форму с использованием любого из известных в технике способов получения микрочастиц данного изобретения, таких как криогенный помол. Формованные таким образом частицы просеиваются таким образом, чтобы они имели распределение по размеру в интервале от примерно 10 до 200 мкм, более предпочтительно 10-100 мкм. Такие микрочастицы являются пригодными для образования инъекционной лекарственной формы. Как указано выше, предпочтительными фармацевтически активными молекулами для осуществления способа настоящего изобретения являются нейроактивные молекулы или агенты. Примерами нейроактивных молекул или агентов, которые могут быть микрокапсулированы и использованы согласно настоящему изобретению, являются нейротрансмиттеры и нейро 11 тропные факторы, включая такие агенты, как норэпинефрин, эпинефрин, серотонин, допамин,вещество Р, соматостатин и агонисты и антагонисты этих активных молекул или агентов. Предпочтительными фармацевтически активными молекулами являются такие, которые способны проявлять активность антагониста рецептора серотонина. Особенно предпочтительными фармацевтически активными молекулами для осуществления способа настоящего изобретения являются антагонисты 5 НТ 2Aрецептора. Наиболее предпочтительной фармацевтически активной молекулой является(+)-изомер -(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанола, соединение формулы 1 или его фармацевтически приемлемая соль. Любой известный биоразлагаемый полимер может быть использован в некоторых специальных условиях, как описано здесь. Например, полимер, имеющий температуру стеклования ниже 60 С, может быть использован в формовании микрочастиц настоящего изобретения при условии, что фармацевтически активные молекулы настоящего изобретения достаточно растворяются в такой полимерной матрице при осуществлении способа настоящего изобретения. Необходимо, кроме того, отметить, что такой биоразлагаемый полимер является пригодным в качестве исходного материала в получении фармацевтических продуктов, и его функция заметно не ухудшается стадией сдвигового смешения (т.е. стадией b) способа настоящего изобретения. Примерами таких полимеров являются сложные полиэфиры, полиамиды, полиангидриды, сложные полиортоэфиры,поликарбонаты, сложные полифосфоэфиры,полифосфазены, полииминокарбонаты и т.п. Необходимо отметить, что также может быть использована смесь, содержащая один или более таких полимеров. Такие полимеры легко получаются, как описано в ссылочной литературе, и они могут быть получены коммерчески от специализированных фирм, известных специалистам соответствующей области изготовления. Особенно предпочтительными полимерами, пригодными для способа настоящего изобретения, являются сложные полиэфиры. Конкретные примеры сложных полиэфиров включают полилактид, полигликолид, сополимер лактид-гликолида, полигидроксибутират, поликапролактон, политартрат и т.п. Могут также использоваться две или более смесей этих полимеров. Особенно предпочтительным слож 004502 12 ным полиэфиром является сополимер лактидгликолида PLGA) (СПЛГ. СПЛГ имеет ряд преимуществ, которые делают его уникальным в способе настоящего изобретения. Преимуществом СПЛГ является то, что он является подобным материалам, используемым в получении современных биорассасываемых швов. Другим преимуществом является то, что данный материал является биосовместимым с тканью ЦНС. Еще одним преимуществом является то, что данный материал является биоразлагаемым в тканях ЦНС без получения каких-либо токсичных побочных продуктов разложения. Важным преимуществом данного материала является способность модифицировать длительность высвобождения лекарственного средства изменением кинетики биоразложения полимера, т.е. модификацией соотношения лактида и гликолида в сополимере. Это является особенно важным, потому что способность доставлять нейроактивные молекулы с регулируемой скоростью в течение заданного периода времени является более эффективной и желаемой терапией по сравнению с современными методиками введения лекарств. Микрочастицы,выполненные с данным полимером, служат двум функциям: они защищают лекарства от разрушения, и они высвобождают лекарства с регулируемой скоростью в течение требуемого времени. Как установлено выше, хотя полимеры уже рассматривались для использования в микрокапсулировании лекарств, включая СПЛГ,физические, химические и медицинские параметры микрокапсулирующего полимера для фармацевтически активных молекул, используемых в соответствии с настоящим изобретением, являются узкими. Это особенно справедливо для формования инъекционных фармацевтических композиций с постоянным высвобождением для доставки активных по отношению к ЦНС лекарств согласно настоящему изобретению. Например, СПЛГ, который используется в способе настоящего изобретения, может иметь широкий интервал средней молекулярной массы при условии, что его температура стеклования является ниже 60 С. Однако предпочтительно средняя молекулярная масса СПЛГ находится в интервале от примерно 20000 до примерно 100000 и более предпочтительно между примерно 30000 и 45000. СПЛГ, кроме того, содержит 45-90 мол.% лактидных и 10-55 мол.% гликолидных звеньев соответственно. Сухое смешение полимера и фармацевтически активной молекулы на стадии (а) проводится при температуре окружающей среды, т.е. примерно при атмосферных температуре и давлении. Более предпочтительно, сухое смешение выполняется при температуре в интервале от примерно 20 до примерно 30 С при атмосферном давлении. 13 Сдвиговое смешение сухой смеси на стадии (b) способа настоящего изобретения может быть выполнено с использованием различных технологий, известных в технике. Например,может быть использован смесительный цилиндр, оборудованный нагревательным элементом и смесительными лопастями. Несколько различных типов смесительных цилиндров являются доступными из коммерческих источников. Другим предпочтительным способом выполнения сдвигового смешения является смешение с помощью экструдера. Как одношнековый, так и двухшнековый экструдеры могут быть использованы для выполнения сдвигового смешения на стадии (b) способа настоящего изобретения. Двухшнековый экструдер является особенно предпочтительным. Двухшнековый экструдер предпочтительно является нагнетающим экструдерным гранулятором, характеризующимся использованием пары шнеков, что отличает установку от одношнекового экструдера. Одношнековый экструдер имеет один шнек и часто использует предварительно изготовленный шнек, и, таким образом, элементы шнека не могут изменяться,как в двухшнековом экструдере, как описано дополнительно ниже. Чтобы быть более специализированным,двухшнековый экструдер содержит дозатор,барабан (цилиндр), шнеки, перемешивающее устройство, валы шнеков, устройство нагревания-охлаждения цилиндра, выпускные мундштуки (охлаждаемый мундштук нагреваемый мундштук, формующий мундштук) и нож для рубки экструдата и обеспечивает свободное изменение давления и температуры посредством выбора геометрии шнека, скорости вращения и элементов шнека, монтируемых на шнековых валах. Кроме того, при необходимости, цилиндр может быть использован в целом ряде комбинаций длины и типа согласно заданному использованию, и его температура может также регулироваться по желанию. Таким образом, двухшнековый экструдер производит подачу двумя шнеками и предусматривает изменение комбинации элементов валов шнеков, так что имеет многие определенные преимущества по сравнению с одношнековым экструдером, а именно:(1) По сравнению с одношнековым экструдером характеристики двухшнекового экструдера являются благоприятными для транспортирования материалов между шнеками, что обеспечивает более легкое компаундирование чувствительных к сдвигу или материалов с низкой вязкостью. Так, например, смешение несмешивающихся материалов, таких как масло и вода, может быть выполнено лучше в двухшнековом экструдере.(2) Также по сравнению с одношнековым экструдером двухшнековый экструдер является превосходящим по усилию сдвига, компаунди 004502 14 рующему эффекту и транспортирующей способности. Кроме того, необходимо отметить, что выбор шнековых элементов является критическим для получения желаемого результата. Полагают,что правильный выбор шнековых элементов может влиять на степень растворимости фармацевтически активной молекулы в полимерной матрице. Шнековые элементы, кроме того,влияют на гомогенность фармацевтической композиции. Например, наблюдается, что использование одного или более левосторонних элементов снижает до минимума разложение полимера и увеличивает растворимость фармацевтически активной молекулы в полимерной матрице. Кроме того, наблюдается, что надлежащий выбор перемешивающих элементов дополнительно улучшает однородное смешение и растворимость фармацевтически активной молекулы в полимерной матрице. Технологические параметры, такие как давление, температура, скорость подачи полимера и фармацевтически активной молекулы и количества и скорости подачи добавок (если используются какие-либо), зависят от типа фармацевтически активной молекулы и полимера и используемого сдвигового смесительного оборудования. Но важно выбрать комбинацию параметров таким образом, что фармацевтически активная молекула, полимер и т.д. будут поддерживаться при температуре ниже их точек разложения, и варьировать рабочие параметры в соответствии с желаемыми характеристиками продуктов. Таким образом, критическим является то, что температура стеклования (Тc) используемого полимера является, предпочтительно, ниже 60 С, так что сдвиговое смешение может выполняться при средних температурах,как описано ниже. В общем случае сдвиговое смешение на стадии (b) выполняется при температуре в интервале от примерно 60 до примерно 140 С,предпочтительно от примерно 80 до примерно 120 С и более предпочтительно от примерно 95 до примерно 115 С. Массовое соотношение фармацевтически активной молекулы и полимера при компаундировании варьируется в зависимости от типа фармацевтически активной молекулы и полимера и заданного использования фармацевтической композиции. Предпочтительно, массовое соотношение фармацевтически активной молекулы и полимера находится в интервале от примерно 5:95 до примерно 25:75, более предпочтительно от примерно 10:90 до примерно 20:80 и наиболее предпочтительно от примерно 10:90 до примерно 15:85. Как установлено выше, важным преимуществом настоящего изобретения является то,что фармацевтически активная молекула достаточно растворяется в полимерной матрице. Степень растворения фармацевтически активной 15 молекулы в полимерной матрице регулируется в зависимости от заданного конечного использования и заданной скорости высвобождения фармацевтически активной молекулы. Предпочтительно по меньшей мере 50 мас.% фармацевтически активной молекулы растворяется в полимере, более предпочтительно фармацевтически активная молекула растворяется в полимере, по меньшей мере, в степени примерно 90 мас.% от общей массы фармацевтически активной молекулы, присутствующей в фармацевтической композиции. Как установлено выше, фармацевтические композиции в форме микрочастиц являются особенно применимыми в инъекционных лекарственных формах, т.е. при парентеральном введении. Для парентерального введения микрочастицы могут быть диспергированы и/или растворены в физиологически приемлемом фармацевтическом носителе и введены либо в суспензии, либо в растворе. Типичными примерами подходящих фармацевтических носителей являются вода, физиологический раствор, растворы декстрозы, растворы фруктозы, этиловый спирт или масла животного, растительного или синтетического происхождения. Фармацевтический носитель может также содержать консерванты, такие как бензиловый спирт, буферные вещества и т.д., известные в данной области. Маслами, которые могут использоваться для внутримышечной инъекции, являются кунжутные, оливковое, арахисовое, кукурузное, миндальное, хлопковое, арахисовое и касторовое масла, из которых кунжутное масло является предпочтительным. Лекарственная форма с пролонгированным высвобождением предпочтительно вводится внутримышечно, подкожно или внутривенно с предпочтительным внутримышечным введением, хотя другие пути введения, такие как пероральный, чрезкожный, носовое впрыскивание и т.д., могут использоваться при соответствующей необходимости для пациента. Микрочастицы могут быть смешаны с любым инертным носителем и использованы в лабораторных анализах для определения концентрации фармацевтически активной молекулы,высвободившейся из микрочастиц, включая мочу, серозную жидкость и т.д. пациентов. Соответственно, суспензия или раствор,образованные в соответствии со способом настоящего изобретения, в случае введения пациенту высвобождают фармацевтически активную молекулу в течение периода времени по меньшей мере примерно 2 недели в дозе, достаточной для антагонизации эффектов серотонина при 5 НТ 2A-рецепторе, более предпочтительно в течение периода от примерно 2 недель до примерно 1 месяца. Однако, могут быть также получены суспензия или раствор, способные высвобождать фармацевтически активную молекулу более одного месяца, если имеется необхо 004502 16 димость вводить такие суспензию или раствор пациенту, нуждающемуся в этом. В одном из предпочтительных вариантов предусматривается способ получения фармацевтической композиции, который включает следующие стадии. На стадии (а) данного предпочтительного варианта соответствующее количество фармацевтически активной молекулы, способной проявлять активность антагониста рецептора серотонина, смешивается с соответствующим количеством биоразлагаемого сложного полиэфира в течение достаточного периода времени и при температуре в интервале от примерно 20 до 30 С и при атмосферном давлении с образованием хорошо смешанной сухой смеси фармацевтически активной молекулы и сложного полиэфира. Любой из описанных выше сложных полиэфиров может быть использован в данном варианте. Как описано выше, сложный полиэфир должен иметь температуру стеклования(Тc) ниже примерно 60 С. На стадии (b) данного предпочтительного варианта сухая смесь со стадии (а) подается в двухшнековый экструдер, оборудованный подходящими пластицирующими и смешивающими элементами в подходящих условиях температуры и давления в течение достаточного периода времени, так что указанный полимер размягчается с образованием разжиженной среды, и по меньшей мере 50 мас.% фармацевтически активной молекулы растворяется в разжиженной сложнополиэфирной среде с образованием по существу гомогенно диспергированной смеси фармацевтически активной молекулы и сложного полиэфира. Гомогенная смесь затем формуется в стренгу, как описано выше. В более предпочтительной форме данного варианта наблюдается, что использование по меньшей мере одного левостороннего элемента в конструкции шнека заметно улучшает качество формуемых микрочастиц. Микрочастицы данного варианта характеризуются большим содержанием фармацевтически активной молекулы, растворенной в сложнополиэфирной матрице, и, таким образом, являются более гомогенными. Кроме того, обнаружено, что использование узкого температурного интервала от примерно 95 до примерно 115 С дополнительно улучшает качество фармацевтических композиций. На стадии (с) данного предпочтительного варианта стренга фармацевтических композиций со стадии (b) гранулируется, как описано выше. Наконец, на стадии (d) данного предпочтительного варианта гранулы измельчаются с образованием инъекцируемых микрочастиц с пролонгированным высвобождением из фармацевтических композиций, как описано здесь. Микрочастицы затем просеиваются с получением однородных микрочастиц, имеющих распреде 17 ление по размеру в интервале от примерно 10 до 200 мкм. Еще в одном предпочтительном варианте способа настоящего изобретения образуется твердый раствор, содержащий СПЛГ и соединение 1, как описано выше. В данном предпочтительном варианте сухое смешение СПЛГ и соединения 1 проводится при температуре примерно 25 С. Предпочтительное массовое соотношение СПЛГ и соединения 1 находится в интервале от примерно 10:90 до 15:85. В данном варианте наблюдается, что сушка сухой смеси в вакууме при температуре примерно 25 С в течение примерно 16 ч улучшает качество микрочастиц. В частности, предпочтительно сушить смесь до такой степени, чтобы содержание влаги было менее примерно 0,02 мас.%. Содержание влаги сухой смеси может быть определено любым из известных в технике методов, например методом Карла Фишера. Сушка минимизирует любое разложение СПЛГ и значительно снижает образование какого-либо продукта переэтерификации между СПЛГ и соединением 1. Еще в одном аспекте данного изобретения также предусматривается фармацевтическая композиция для пролонгированного высвобождения медикаментозного вещества, содержащая микрочастицы, имеющие распределение по размеру в интервале от примерно 10 до 100 мкм,образованная из а) биоразлагаемого полимера, как описано выше, в количестве от примерно 80 до 95 мас.%,имеющего температуру стеклования (Тc) ниже примерно 60 С; иb) фармацевтически активного соединения 1, или его фармацевтически приемлемой соли в количестве от примерно 5 до 20 мас.%, причем соединение 1 по существу растворяется и однородно диспергируется в СПЛГ-матрице. В более предпочтительном варианте данного аспекта изобретения предпочтительным полимером является сополимер лактидгликолида (СПЛГ). Предпочтительное массовое соотношение соединения 1 и СПЛГ составляет от 15:85 до 5:95. Композиции настоящего изобретения могут быть смешаны с фармацевтически приемлемым носителем, способным вводиться предпочтительным путем для того, чтобы получить постоянное высвобождение соединения 1. Т.е. (+)-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]4-пиперидинметанол (формула 1) может вводиться пациенту в течение дней или недель. Предпочтительно, лекарственная форма с пролонгированным высвобождением содержит микрочастицы настоящего изобретения и фармацевтически активный носитель для парентерального введения в виде водной суспензии,масляного раствора, масляной суспензии или эмульсии, как описано выше. Более предпочтительно, фармацевтические композиции настоящего изобретения при введении пациенту вы 004502 18 свобождают соединение 1 в течение по меньшей мере примерно 2 недель и, наиболее предпочтительно, в течение периода от примерно 2 недель до примерно 1 месяца в дозе, достаточной для антагонизации эффектов серотонина при 5HT2Aрецепторе. Поскольку микрочастицы настоящего изобретения высвобождают (+)(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанол ("активный ингредиент") у пациента для терапевтического эффекта, микрочастицы настоящего изобретения используются для всех указаний применения, для которых используется активный ингредиент. Некоторые из этих указаний применений описаны в выданных патентах, охватывающих в общем плане активный ингредиент (патент США 4783471) или специально охватывающий активный ингредиент(патенты США 5134149, 5561144, 5618824,5700812, 5700813, 5721249 и PCT/US 97/02597),которые приводятся в качестве ссылки. Эти ссылки раскрывают применение для лечения психоза (включая шизофрению), устойчивого компульсивного расстройства, тромботического заболевания, коронарного вазоспазма, перемежающейся хромоты, нервно-психической анорексии, болезни Рейно, фибромиалгии, экстрапирамидальных побочных явлений, состояния тревоги, аритмии, депрессии и биполярного расстройства, нарушения сна или наркомании(например, кокаин, никотин и т.д.). Некоторые из этих указаний рассмотрены в патентах, описанных выше и в патентах США 4877798 и 5021428, которые все приводятся в качестве ссылки. Психозами являются состояния, когда пациент испытывает обширное психическое расстройство органического и/или эмоционального происхождения, характеризующееся психическим расстройством личности и потерей связи с реальностью, часто с бредом, галлюцинациями или иллюзиями. Характерными психотическими заболеваниями, подлежащими лечению композициями настоящего изобретения, являются шизофрения, шизофренияобразное расстройство, шизоаффективное расстройство, бред,краткое психотическое расстройство, раздвоение личности, неопределенное психотическое расстройство и индуцированное веществом психотическое расстройство. Смотри Diagnosticand Statistical Manual of Mental Disorders, 4th ed.,American Psychiatric Association, приведенное в качестве ссылки. Активный ингредиент используется в настоящее время в клинических исследованиях для лечения шизофрении. Активный ингредиент имеет профиль атипичного антипсихотика в многочисленных преклинических нейрохимических, электрофизиологических и поведенческих моделях антипсихотической активности. Эти эффекты включают снижение MDMA-индуцированного высвобождения допамина в неостриатум, селективные 19 эффекты на А 10 в сравнении с А 9 нейронную активность после длительного применения,блокаду амфетаминстимулированной lokomotia и восстановление 5 НТ 2-антагонистиндуцированных дефицитов в препульсивном ингибировании и скрытом ингибировании. Смотри Journal of Pharmacology and Experimental Therapeutics, 266:684-691 (1993), S.M. Sorensen et al.,"Characterization of the 5-HT2 receptor antagonistof schizophrenia"; причем все эти публикации приводятся в качестве ссылок. Пациенты с навязчивыми компульсивными расстройствами OCD) (НКР не в состоянии ингибировать или "управлять" инвазивными, тяжелыми расстройствами мышления и восприятия. Поскольку НКР характеризуется недостаточным "познавательным управлением" и искаженной метаболической активностью в круговом соединении орбитальной области коры головного мозга и стрейтума, было предсказано, что НКР-пациенты должны проявлять недостаточное препульсивное ингибирование(РР 1). Было установлено, что активный ингредиент восстанавливает нарушенное пульсивное ингибирование. Смотри Psychopharmacology 124: 107-116 (1996), R.A. Padich et al., "5HTinhibition produced by 5HT agonist in Wistar rats." Активный ингредиент является также эффективным в предотвращении острых тромбозов, особенно острых тромбозов коронарных артерий. Данное соединение снижает скорость,с которой агрегируются тромбоциты как результат незначительных изменений в эндотелиальной выстилке сосудистой сети и поэтому предотвращает образование острых патологических тромбов. Смотри описание в патенте США 5561144. Состояние тревоги, вариантная стенокардия, нервно-психическая анорексия, болезнь Рейно и коронарные вазоспазмы лечатся, как описано в The 27th edition of Dorland's illustratedMedical Dictionary, приведенном в качестве ссылки. Фибромиалгия является хроническим болезненным состоянием, в котором пациент страдает от многочисленных симптомов, таких как, например, обширные мышечно-скелетные боли, тупые боли, усталость, утренняя тугопо 004502 20 движность, нарушение сна, которое характеризуется неадекватностью сна 4-й стадии. Экстрапирамидальные побочные явления часто сопровождают введение нейролептических агентов, таких как галогенперидол и хлорпромазин. У пациентов часто проявляется синдром Паркинсона, в котором они показывают мышечную ригидность и тремор. Другие проявляют акатизию и острые дистонические реакции. Активный ингредиент увеличивает длительность потенциальной активности сердечной ткани с получением периода невосприимчивости этой ткани, которая по классификационной системе Вогана Уильямса показывает антиаритмическую активность класса III. Фармацевтическая композиция настоящего изобретения может быть использована для лечения наркомании у пациентов. Смотри T.F.Meert et al., European Journal of Pharmacology 183:1924, где 5 НТ 2-антагонист уничтожает тягу как к спирту, так и к кокаину в модели наркомании у грызунов. Другие животные модели,такие как модель самостимулирования грызунов, описанная в R.A. Frank et al., BehavioralNeuroscience 101: 546-559 (1987), могут быть использованы для показа способности композиции с пролонгированным высвобождением настоящего изобретения лечить наркоманию. Композиции настоящего изобретения используются в лечении пациентов с депрессивными расстройствами и биполярными расстройствами. В The Diagnostic and Statistical Manual ofMental Disorders (Third Edition-Revised) ("DSMIII-R"), приводимом в качестве ссылки, депрессивные расстройства определяются как обширная депрессия, дистимия и депрессивное расстройство NOS. Авторы изобретения также включают в данную категорию приступ обширной депрессии, включая хронический тип, меланхолию и сезонное обострение. Биполярные расстройства включают биполярное расстройство, циклотимию и биполярное расстройствоNOS. Признаком депрессивных расстройств является один или более периодов депрессии без предыстории либо маниакальных, либо гипоманиакальных приступов. Признаком биполярных расстройств является наличие одного или более маниакальных или гипоманиакальных приступов, обычно сопровождающихся одним или более обширных депрессивных приступов. Маниакальным или гипоманиакальным приступом является период, в течение которого доминирующее настроение либо улучшается, распространяется, либо легко возбуждается, и имеются связанные симптомы маниакального синдрома,как определено в DSM-III-R. Расстройство является довольно тяжелым, чтобы вызвать заметное снижение профессиональной или социальной деятельности. 21 Обширная депрессия имеет один или более обширных депрессивных приступов. Обширный депрессивный приступ характеризуется 1) по меньшей мере пятью моментами: подавленное настроение, потеря интереса к удовольствию(ангедония), значительная потеря веса или прибавка веса при несоблюдении диеты, бессонница и гиперсомния, психомоторное возбуждение или торможение, усталость или упадок сил,ощущение никчемности или избыточной или несоответствующей вины, снижение способности думать или концентрироваться или периодическое возвращение к мысли о смерти, включая самоубийство; 2) невозможно установить,какой органический фактор инициирует и поддерживает расстройство; 3) отсутствуют бред и галлюцинации в течение 2 недель при отсутствии симптомов известного настроения; и 4) он не накладывается на шизофрению, шизофренияподобное расстройство или психотическое расстройство NOS. Дистимия имеет предысторию подавленного настроения длительностью не более чем по меньшей мере 2 года, и в течение первых 2 лет расстройства состояние не отвечает показаниям обширного депрессивного приступа. Подавленное настроение у детей и подростков может быть выражено как раздражительность. Также присутствуют по меньшей мере два момента из следующих: плохой аппетит или переедание,бессонница или гиперсомния, упадок сил или усталость, низкая самооценка, плохая концентрация или трудность в принятии решения или чувство безысходности. Эти симптомы не накладываются на хроническое психотическое расстройство, такое как шизофрения или бредовое расстройство. Также невозможно определить, какой органический фактор инициирует и поддерживает расстройство. Имеется много путей показать, что композиция настоящего изобретения полезна при лечении депрессивных расстройств и биполярных расстройств, например на животных моделях. Смотри, например, работы "Animal Models asTher., 45: 425-455 (1990), которые обе приводятся в качестве ссылок. Одной такой моделью является хроническая легкострессовая модель депрессии ( ("CMS") (ХЛС. ХЛС использует легкие стресс-факторы,такие как лишение пищи и воды, наклоны клетки, замены напарника по клетке и т.д. После недель воздействия легких стресс-факторов животные постепенно снижают потребление наиболее предпочтительного раствора сахарозы,которое сохраняется (у необработанных животных) в течение нескольких недель вслед за прекращением стресса. Это сниженная чувствительность к награде (раствор сахарозы) отражает ангедонию, симптом обширного депрессив 004502Pharmacol., 5: Suppl.1, p. 86(1994), где литий,карбамазепин и кетоконазол оцениваются в ХЛС; Psychopharmacology 93:358-364 (1987), где трициклический антидепрессант оценивается в ХЛС; Behavioral Pharmacology: 5:344-350 (1994),где катехол-O-метилтрансферазный ингибитор оценивается в ХЛС. Следующее исследование ХЛС было осуществлено с использованием активного ингредиента композиций настоящего изобретения(далее "MDL 100907") в сравнении с известным антидепрессантным соединением имипрамином. Самцов крыс Вистара помещали в лабораторию за 2 месяца до начала эксперимента, когда они весили приблизительно 300 г. За исключением описанного ниже, животных помещают по одному со свободным доступом к пище и воде и выдерживают при 12-часовом цикле свет/темнота (свет до 8 утра) при температуре примерно 22 С. Животных сначала готовят к потреблению 1% раствора сахарозы; подготовка состоит из 1/8-часовых основных испытаний, в которых присутствует сахароза, в клетке с последующим 14-часовым лишением пищи и воды; потребление определяют взвешиванием предварительно взвешенных бутылей, содержащих раствор сахарозы, в конце испытания. Затем потребление сахарозы контролируют в аналогичных условиях с недельными интервалами в ходе всего эксперимента. На основе потребления сахарозы в конечном основном испытании животных делят на две подобранные группы. Одну группу животных подвергают воздействию хронического легкого стресса в течение 9 последующих недель. Каждую неделю режим стресса состоит из двух периодов лишения пищи и воды (12 и 14 ч), двух периодов наклона клетки под 45 (12 и 14 ч), двух периодов прерывистого ночного освещения (свет включают и выключают каждые 2 ч), двух 14-часовых периодов загрязненной клетки (200 мл воды в подстилке из опилок),двух 14-часовых периодов спаренного размещения, двух 14-часовых периодов стробоскопического освещения низкой интенсивности (150 вспышек/мин). Стресс-факторы применяют непрерывно днем и ночью и планово беспорядочно. Контрольных животных помещают в отдельную клетку и без контакта со стрессовыми животными. Их лишают пищи и воды в течение 14 ч, предшествующих каждому испытанию с сахарозой, но со свободным доступом к иной пище и воде в клетке. На основании результатов потребления ими сахарозы после 3 недель стресса как стрессовых, так и контрольных животных дополнительно делят на две подобранные подгруппы (n=8), и в течение последующих 5 недель они получают ежедневное введение наполнителя (1 мл/кг, внутрибрюшинно ip)(0,002, 0,02 и 0,2 мг/кг перорально). Все лекарственные инъекции составляют 1 мл/кг массы тела. Лекарства вводят в 10 утра, и испытания с сахарозой проводят через 24 ч после последнего введения лекарства. Через 5 недель лечение прекращают и через 1 неделю отмены проводят последнее испытание с сахарозой. Стресс применяют в течение периода лечения и отмены. Результаты анализируют с помощью многократного дисперсионного анализа с последующим LSD-испытанием Фишера для последующего сравнения средних значений. Хронический легкий стресс вызывает постепенное снижение потребления 1% раствора сахарозы, в конечном основном испытании потребление сахарозы составляет приблизительно 13 г в обеих группах. В последующие 3 недели стресса (неделя 0) потребление остается при 12,4 (0,4) г у контрольных животных, но падает до 7,2 (0,2) г у стрессовых животных(р 0,001). Такое различие между контрольными и стрессовыми животными, которым вводился наполнитель, остается на подобном уровне для остального эксперимента. Имипрамин не оказывает заметного влияния на потребление сахарозы у контрольных животных [F(1,84)=0,364; NS]. Однако лекарство вызывает постепенное увеличение потребления сахарозы у стрессовых животных[F(1,84)=16,776; р 0,001]. Потребление сахарозы у стрессовых животных, которым вводился имипрамин, значительно увеличивается от следов недели 0 через 4 недели лечения (р=0,05), а после 5 недель лечения нет заметного различия между стрессовыми животными, которым вводилось лекарство, и контрольными животными,которым вводилось лекарство и физиологический раствор. Возрастание потребления сахарозы у стрессовых животных, которым вводился имипрамин, сохраняется на том же уровне неделю спустя после отмены лекарства.MDL 100907 не оказывает заметного влияния на потребление сахарозы у контрольных животных [эффект лечения: F(3168)=0,821; NSлечение х недели взаимодействия: F(15168=0,499;NS]. У стрессовых животных MDL 100907 постепенно возвращает ЦНС-индуцированный дефицит в потреблении сахарозы, что дает в результате значительный эффект лечения [F(3168)=22,567; р 0,001] и лечение х недели взаимодействия[F(15158)=1,559; p=0,05]. У стрессовых животных, которым вводились две более высокие дозы MDL 100907 (0,02 и 0,2 мг/кг), потребление сахарозы значительно увеличивается от начальных следов (неделя 0) через 2 (0,02 мг/кг) и 3 (0,2 мг/кг) недели лечения (р=0,03 и р=0,04, соответственно). Указанный эффект увеличивается дальше в течение следующих недель, и в конце периода лечения 24 контрольными животными, которым вводился наполнитель, и значительно выше, чем у стрессовых животных, которым вводился наполнитель (0,02 мг/кг: р 0,001, 0,2 мг/кг: р-0,002). При самой низкой дозе 0,002 мг/кг MDL 100907 не имеет заметного влияния на потребление сахарозы во время всего периода лечения. Впоследствии через 5 недель лечения потребление сахарозы стрессовых животных, которым вводили указанную дозу, не отличается от потребления стрессовых животных, которым вводили наполнитель (р=0,860), и является значительно ниже потребления контрольных животных, которым вводили наполнитель (р 0,01). Через неделю после прекращения лечения потребление сахарозы заметно не изменяется у всех животных, которым вводили MDL 100907,как контрольных (0,002 мг/кг: р=0,2, 0,02 мг/кг: р=0,9, 0,2 мг/кг: р=0,4), так и стрессовых (0,002 мг/кг: р=0,6, 0,02 мг/кг: р=0,8, 0,2 мг/кг: р=0,6). Конечно, клинические испытания на людях могут также быть использованы для показа применимости композиций настоящего изобретения в лечении депрессии, такого как использование сокращенной Шкалы Гамильтона психиатрической оценки депрессии. Она содержит ряд из 17 категорий, по которым оценивается личность, например, подавленное настроение,комплекс вины, суицидные тенденции, бессонница, состояние тревоги и т.д., с достижением результата, который показывает клиницисту,обладает или нет пациент депрессией. Данное изобретение дополнительно иллюстрируется следующими примерами, которые приводятся в целях иллюстрации и никоим образом не ограничивают объем настоящего изобретения. Примеры (общая часть) В последующих примерах используются следующие сокращения: СПЛГ 50/50 (PLGA 50/50) - сополимер DLлактид-гликолида с мольным соотношением 50/50. ДСК (DSC) - дифференциальная сканирующая калориметрия. ГПХ (GPC) - гельпроникающая хроматография. ВЭЖХ (HPLC) - высокоэффективная жидкостная хроматография. ХВ (IV) - характеристическая вязкость. ВР (MV) - вязкость расплава. ЯМР(NMR) ядерно-магнитнорезонансная спектроскопия. СЭМ (SEM) - сканирующая электронная микроскопия. Тс (Тg) - температура стеклования. Тпл (Тm) - точка плавления - пиковая температура плавления. Общие аналитические методы, используемые для определения характеристик Для определения характеристик фармацевтических композиций настоящего изобретения 25 используют ряд аналитических методов, которые включают следующее: ЯМР: ЯМР-анализ проводят с использованием 200 МГц спектрометра для определения уровней содержания фармацевтически активных соединений, т.е. лекарств, используемых в настоящем изобретении. 500 МГц спектрометр используют для количественного определения уровней переэтерификации. Образцы готовят как 1 мас.% растворы в СDСl3. ДСК: Термические переходы определяют с использованием калориметра ТА Instruments модели 3200. Термические развертки от 0 до 200 С получают в атмосфере азота с использованием скорости сканирования 10/мин. Для анализа берут кривые ДСК, полученные при первом нагреве. ГПХ: Молекулярную массу полимера определяют с использованием прибора Waters 201,оборудованного детекторами показателя преломления и УФ. Для анализа готовят раствор 2,0 мг/мл полимера в ТГФ. ВЭЖХ: Содержание лекарства определяют методом ВЭЖХ с использованием системыHewlett-Packard 1090. Образцы получают в водном СН 3 СN растворе. ХВ: Характеристическую вязкость - вязкость раствора образцов полимера определяют при 25 С при концентрации 0,5 мас.% раствора полимера в хлороформе. ВР: Вязкость расплава СПЛГ определяют с использованием капиллярного пластометраKayeness'a. Температуру камеры пластометра поддерживают при 125 С, и расчеты вязкости проводят на основе измерения мундштука длиной 15,2 мм и диаметром 1 мм. СЭМ: Образцы для СЭМ получают разрушением при замораживании в жидком азоте с обнаружением внутренней структуры. СЭМмикрофотографии разрушенных образцов получают после покрытия золотом с увеличением от 5000 до 10000 Х. Пример 1. Данный пример 1 показывает, что превосходные дисперсии фармацевтически активной молекулы в полимерной матрице (т.е. твердый раствор) могут быть получены смешением в расплаве в расплавном смесителе системы Хаак 90. Полимером, используемым в данном примере, является СПЛГ 50/50, имеющий ХВ 0,7 дл/г. Фармацевтически активной молекулой, используемой в данном примере, является соединение 1-(+)(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4-пиперидинметанол (формула 1). Система Хаак 90 оборудована нагреваемым смесительным цилиндром, имеющим три зоны регулирования температуры. В смесительном цилиндре имеются две противовращающиеся смесительные лопасти, которые осуществляют подачу материала в цилиндр. Скорость вращения (об./мин) смесительных лопастей регулируется оператором в зависимости от тре 004502 26 буемого уровня смешения. Система Хаак 90 также оборудована компьютерной установкой контроля, которая регулирует температуру цилиндра и длительность пробега смешения. Поскольку накопление влаги происходит при хранении материалов, все материалы хранят в холодильнике с осушителем. Все транспортирование материалов осуществляют в эксикаторе. Все материалы взвешивают в боксе в перчатках в атмосфере сухого азота. Как только материалы взвешивают, сосуды закрывают,помещают в эксикатор и транспортируют в расплавный смеситель системы Хаак 90. В четырех отдельных опытах смешение СПЛГ 50/50 с соединением формулы 1 осуществляют следующим образом. 56 г СПЛГ и 14 г соединения 1 взвешивают в боксе с перчатками в каждом из этих опытов и герметизируют в отдельных контейнерах. Расплавный смеситель Хаака нагревают до нужной температуры, и смесительные лопасти устанавливают при требуемой скорости вращения. Сначала примерно половину полимера СПЛГ подают в смесительный цилиндр с последующей подачей половины соединения 1. Затем остаток СПЛГ подают в смесительный цилиндр с последующей подачей остатка соединения 1. Во время указанной стадии подачи материалов в смесительный цилиндр в последнем поддерживается азотная атмосфера для того, чтобы минимизировать какое-либо разложение СПЛГ-полимера влагой. Сразу после подачи всех материалов в смесительный цилиндр пускают таймер опыта. Обеспечивают полное завершение опыта. После завершения опыта цилиндр немедленно разбирают и удаляют материал с использованием медных ножей. Удаленный материал помещают в сосуд и герметизируют в атмосфере азота. Число опытов, соотношение СПЛГ:соединение формулы 1, время, требуемое для осуществления смешения, температура опыта и скорость вращения лопастей (об./мин) приводятся в табл. 1. Также в табл. 1 приводится контрольный опыт, в котором в опыте смешения используется только СПЛГ-полимер. Таблица 1 опыта Контрольный 1 2 3 4 Материалы, смешанные в расплаве, из всех опытов, как указано в табл. 1, анализируют методом ДСК. Все образцы из опытов 1-4,как указано в табл. 1, показывают единственную Тс примерно при 34-37 С, тогда как исходная Тс СПЛГ-полимера составляет примерно 47 С. Это ясно показывает, что значительные количества соединения формулы 1 растворены в СПЛГполимерной матрице. ДСК-анализ также показывает небольшой пик плавления благодаря плавлению соединения формулы 1 около 120 С. Данный пик плавления соответствует соединению формулы 1, которое не растворилось в СПЛГ. Количества соединения формулы 1, которые не растворились в СПЛГ, из опытов 3-5,показаны в табл. 2. В каждом из указанных опытов три образца из различных участков смеси анализируют методом ДСК. Таблица 2 опыта смеси Мас.% кристалл. лекарства во не полностью растворяется в расплаве полимера. Пример 2. Данный пример иллюстрирует получение фармацевтических композиций, содержащих биоразлагаемый полимер и фармацевтически активную молекулу, с использованием двухшнекового экструдера. Эксперименты по экструзии расплава в данном примере проводят с использованием 18 мм двухшнекового экструдера, изготовленного фирмой Leistritz, который работает в варианте совместного вращения. Полимером, используемым в данном примере, является СПЛГ 50/50,имеющий ХВ 0,76 дл/г. Фармацевтически активной молекулой, используемой в данном примере, является соединение формулы 1 -(+)-(2,3-диметоксифенил)-1-[2-(4-фторфенил)этил]-4 пиперидинметанол. Исходные материалы подаются в экструдер с использованием дозаторов Accurate 8000 для СПЛГ и К-Тrоn для соединения формулы 1. СПЛГ-полимер и соединение 1 сушат в течение 48 ч в вакууме перед компаундированием. В дозаторах создают оболочку азота в процессе переработки, чтобы минимизировать воздействие влаги на исходные материалы. Используют конфигурацию шнеков, чтобы обеспечить средний уровень смешения без чрезмерного сдвига. Экструдат выходит из мундштука на конвейерную ленту, и ему позволяют медленно охлаждаться перед гранулированием в грануляторе Конера. Экструдаты, полученные при различных температурах расплава и скорости вращения шнека, анализируют на массовое соотношение СПЛГ и соединения формулы 1 методами ВЭЖХ и ЯМР. Образцы экструдата, полученные при указанных различных условиях, также анализируют с определением средневесовой молекулярной массы (Мw), характеристической вязкости (ХВ) и термопереходов Тc и Тпл методом ДСК и мол.% переэтерификации методом ЯМР. Результаты обобщены в табл. 3. Смешанные в расплаве образцы анализируют методом ВЭЖХ с определением количества соединения формулы 1 в образце. Результаты показывают, что все образцы содержат 19 мас.% соединения формулы 1. Образцы из опытов 2-4 дополнительно анализируют методом СЭМ. СЭМ-микрофотографии показывают однородное распределение соединения формулы 1 в СПЛГ-полимерной матрице. ЯМР-анализ смешанных образцов показывает, что степень переэтерификации является ниже определяемых количественно пределов. Сравнительный пример 1. Сравнительный пример 1 показывает, что сухое смешение СПЛГ-полимера с соединением формулы 1 не ухудшает совместимость смеси молекулы лекарства с полимерной матрицей. Порошки соединения формулы 1 и СПЛГполимера при массовом соотношении 20:80 смешивают вместе вручную. Смешанные порошки затем анализируют методом ДСК. Кривая первого нагрева показывает пик плавления Тпл соединения 1 при 120 С и Тс полимера при 51 С, как ожидалось. Кривая второго нагрева после охлаждения от 130 С показывает две раздельных температуры стеклования лекарства и полимера при 47 и 23 С, соответственно. Если два компонента образуют совместимую смесь,ожидается только одна Тс. Поэтому данный результат показывает, что расплавленное лекарст Темп. Скорость образца плавл., С шнека, об./мин 150 138 200 160 135 300 170 138 400 180 138 200 190 116 300 200 113 200 Как показано в табл. 3, Тс фармацевтической композиции снижается с увеличением содержания Таблица 3 Температура ПереэтерифиТс Тпл кация, мол.% 37,3 112,9 5,1 36,6 4,7 36,1 7,4 41,9 9,5 40,4 4,7 43,0 5,5 СЭМ-анализом указанных образцов, который показывает однофазную систему. Образцы экструдата дополнительно измельчают в молотковой мельнице. Измельчение осуществляют при изменении различных технологических параметров, которые включают ско 29 рость вращения (варьирующуюся от 4500 до 7200 об./мин), размер сита и криогенные условия. Анализ размера частиц проводят либо с использованием лазерного анализатора Культера, либо оптической микроскопии в сочетании с анализатором изображения. Различные условия и результаты, полученные в указанных экспериментах по измельчению, обобщены в табл. 4. Таблица 4 образца 160 170 180 Размер сита, мм 0,51 0,3 0,3 Скорость вращения, об./мин 6000 4500 6000 Помощь азотаD10 размер частиц, мкм 55,9 42,3 50,6 Измельченные частицы затем классифицируют с использованием сит из нержавеющей стали, установленных в вибратор Фрича. Образцы с распределением по размеру в интервале от 45 до 106 мкм отделяют и испытывают на скорость высвобождения соединения формулы 1. Пример 3. Данный пример показывает, что снижение температуры расплава в экструдере снижает уровень переэтерификации. Данный пример дополнительно показывает, что использование соединения формулы 1 ниже 20 мас.% в СПЛГматрице дает композицию, в которой соединение формулы 1 полностью смешивается с СПЛГ-матрицей. Пример 2 по существу повторяют в примере 3, за исключением того, что используют СПЛГ 50/50, имеющий ХВ 0,44 дл/г, со следующими изменениями в экструзионном эксперименте. Получают гомогенную порошкообразную сухую смесь СПЛГ и соединения формулы 1 в массовом соотношении 85:15(СПЛГ:соединение 1). Перед сухим смешением соединение 1 измельчают в струйной мельнице до среднего размера частиц 18 мкм. Сухую смесь СПЛГ/соединение 1 галтуют около часа с использованием механического барабана. Сухую смесь затем сушат при комнатной температуре в вакууме в течение минимум примерно 16 ч. Высушенную сухую смесь подают в двухшнековый экструдер с использованием двухшнекового дозатора К-Тrоn. Температуры цилиндра двухшнекового экструдера Лейстрица регулируют с поддержанием температур расплава смеси между 104 и 116 С. Два образца экструдата расплавных смесей СПЛГ/соединение 1 получают при скоростях вращения шнеков 200 об./мин (образец 110) и 150 об./мин Характер. фикация, стеклов., кристалл. образца вязкость ВЭЖХ ЯМР мол.% Тс, С соед.1, % 110 0,30 14,9 15,3 1,3 38,0 0 120 0,31 15,2 14,7 1,5 39,5 0 Уровень переэтерификации определяют количественно интегрированием нового пика,появившегося при 6,0 м.д. в 1 Н-ЯМР-спектре. Как указано в табл. 5, уровень переэтерификации значительно снижается до 1,3-1,5 мол.%. Так же, как показано в табл. 5, в фармацевтической композиции отсутствует соединение 1, что предполагает, что соединение 1 полностью растворено в СПЛГ-полимерной матрице. Экструдаты композиций СПЛГ/соединение 1 измельчают с использованием струйной мельницы с псевдоожиженным слоем. Используемой для этой цели мельницей является струйная мельница с псевдоожиженным слоемAlpine AFG100. Поскольку измельчение в струйной мельнице с псевдоожиженным слоем имеет место при контакте частица-частица в большей степени, чем при ударе о лопасть, частицы имеют тенденцию быть более сферическими. Оптические микрофотографии подтверждают увеличенную сферическую форму частиц, измельченных в струйной мельнице, по отношению к частицам, измельченным в молотковой мельнице. Ряд условий используют для оценки влияния скорости классификатора и давления воздуха измельчения на распределение частиц по размеру. В табл. 6 обобщены условия измельчения и полученные размеры частиц. Размеры частиц определяют с использованием анализатора Култера LS230 в растворе дистиллированной воды и поверхностноактивного вещества TWEEN80. Образцы, компаундированные с низкомолекулярным СПЛГ,измельчают до меньших размеров частиц благодаря более хрупкой природе полимера. Использование сопел большего диаметра снижает давление воздуха в камере измельчения с получением более широкого распределения частиц по размеру. Таблица 6 опыта 1 2 3 4 Материал 110 120 120 120 Диаметр сопла, мм 48,3 48,3 76,2 76,2 Скорость классифи 7000 4500 3000 5000 катора, об./мин Давление воздуха 800 800 500 500 измельчения, кПа Средний размер 23 20 37 частиц, мкм Пример 4. Пример 3 по существу повторяют в данном примере, за исключением того, что используе 31 мый полимер СПЛГ 54/46 является немного более высокомолекулярным полимером, имеющим ХВ 0,66 дл/г и содержащим также количество остаточного мономера около 1 мол.%. Гранулы СПЛГ-полимера измельчают до размера частиц менее 125 мкм с использованием молотковой мельницы перед сухим смешением с соединением 1. Два образца экструдатов СПЛГ/соединение 1 формуют в соответствии с методиками примера 3 при скорости вращения шнека 200 об./мин и температурах расплава 113 С (образец 210) и 116 С (образец 2). Образцы анализируют, как в примере 3, с определением характеристической вязкости, мас.% соединения 1,уровня переэтерификации (мол.%), температуры стеклования (Тс, С) и фракции соединения 1 Характер. фикация, стеклов., кристалл. образца вязкость ВЭЖХ ЯМР мол.% Тс, С соед.1, % 210 0,35 15,0 15,0 3,7 35,0 0 220 0,38 14,1 14,9 2,6 35,0 0 Измельчение экструдатов выполняют, как указано в примере 3. В табл. 8 обобщены условия измельчения и полученные размеры частиц. Таблица 8 опыта 1 2 3 Материал 210 210 220 Диаметр сопла, мм 48,3 48,3 76,2 Скорость классификатора,3900 5000 5000 об./мин Давление воздуха 600 800 800 измельчения, кПа Средний размер частиц, мкм 38 32 38 Пример 5. Данный пример показывает медленное высвобождение фармацевтически активного соединения из фармацевтических композиций настоящего изобретения. Два образца СПЛГ/соединение 1 из примера 1, опыты 2 и 4 используют в данном исследовании растворения. Образцы из примера 1, опыты 2 и 4 измельчают и просеивают до распределения частиц по размеру от 50 до 150 мкм. Растворение полученных таким образом частиц проводят в USP-аппарате 2 при 37 С с использованием 900 мл 0,02 М фосфатного буфера при рН примерно 6,5. 500 мг микрочастиц из примера 1, опыты 2 и 4 используют в каждом из указанных сосудов. Количество соединения 1, растворенного в фосфатном буфере, определяют УФ-спектроскопией при 272 нм. Процент высвободившегося соединения 1 рассчитывают делением содержания соединения 1 в растворе на теоретическую концентрацию при высвободившихся 100% по отношению к 20 мас.% содержания соединения 1 в микро 004502 32 частицах из примера 1. Профиль растворения наблюдают в течение 5 дней. Результаты растворных исследований обобщены в табл. 9. Таблица 9% высвободившегося соединения 1 Время,ч Пример 1, опыт 2 Пример 1, опыт 4 4 2 2 24 15 23 48 28 33 72 37 40 96 42 45 120 46 52 Пример 6. Данный пример 6 показывает медленное высвобождение фармацевтически активного соединения из композиций настоящего изобретения с постоянной скоростью в течение 30 дней. Пример 5 по существу повторяют в данном примере, за исключением того, что используют микрочастицы, полученные из примера 2, образцы 170 и 180. Результаты исследований растворения показаны в табл. 10. Таблица 10% высвободившегося соединения 1 Время,Пример 2,Пример 2,сутки образец 170 образец 180 0,25 14 34 1 32 44 2 43 47 3 61 44 4 68 47 5 68 50 10 73 48 15 80 58 20 89 90 25 97 102 30 98 104 Пример 7. Данный пример показывает, что скорость высвобождения фармацевтически активного соединения зависит от размера микрочастиц,полученных в соответствии со способом настоящего изобретения. Пример 5 по существу повторяют в данном примере, за исключением следующего: в данном примере используют микрочастицы, полученные из примера 4, образец 210. Экструдаты из примера 4, образец 210 измельчают и просеивают с получением частиц, имеющих распределение по размеру в пределах от 37,37-53, 53-74, 74-150 и 150 мкм. Указанные частицы затем используют в растворных исследованиях в соответствии с методиками,приведенными в примере 5. Результаты растворных исследований показаны в табл. 11. Хотя изобретение было проиллюстрировано некоторыми предшествующими примерами,оно не должно истолковываться как ограниченное ими; изобретение скорее охватывает обобщенную область, как рассмотрено здесь ранее. Различные модификации и варианты могут быть сделаны без отступления от сущности и объема изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения фармацевтической композиции, включающий стадии а) смешения фармацевтически активного соединения формулы I или его фармацевтически приемлемой соли с биоразлагаемым полимером с образованием сухой смеси, при этом биоразлагаемый полимер имеет температуру стеклования (Тс) ниже 60 С;b) воздействия на сухую смесь сдвигового смешения таким образом, что полимер размягчается с образованием псевдоожиженной среды и фармацевтически активное соединение растворяется с образованием твердого раствора,имеющего, по существу, гомогенно диспергированную смесь фармацевтически активного соединения и полимера, далее гомогенная смесь формуется в стренгу;d) измельчения гранул с образованием микрочастиц с пролонгированным высвобождением, которые имеют распределение по размеру в интервале от 10 до 200 мкм и являются пригодными для образования инъекционной лекарственной формы. 2. Способ по п.1, в котором фармацевтически активное соединение является антагонистом 5 НТ 2 А-рецептора. 3. Способ по п.1, в котором полимер выбран из группы, состоящей из сложного полиэфира, полиамида, полиангидридов, сложных полиортоэфиров, поликарбонатов, сложных полифосфоэфиров, полифосфазенов, полииминокарбонатов и их смесей. 4. Способ по п.1, в котором полимер выбран из группы, состоящей из полилактида, по 34 лигликолида, сополимера лактид-гликолида,полигидроксибутирата, поликапролактона, политартрата и их смесей. 5. Способ по п.1, в котором полимером является сополимер лактид-гликолид. 6. Способ по п.5, в котором сополимер лактид-гликолид имеет среднюю молекулярную массу от примерно 20000 до примерно 100000. 7. Способ по п.5, в котором сополимер лактид-гликолид имеет среднюю молекулярную массу от примерно 30000 до примерно 45000. 8. Способ по п.5, в котором сополимер лактид-гликолид содержит 45-90 мол.% лактидных звеньев и 10-55 мол.% гликолидных звеньев соответственно. 9. Способ по п.1, в котором смешивание на стадии (а) выполняется при температуре окружающей среды. 10. Способ по п.1, в котором смешивание на стадии (а) выполняется при температуре в интервале от примерно 20 до примерно 30 С. 11. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется с использованием экструдера. 12. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется с использованием одношнекового экструдера. 13. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется с использованием двухшнекового экструдера. 14. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется при температуре в интервале от примерно 60 до примерно 140 С. 15. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется при температуре в интервале от примерно 80 до примерно 120 С. 16. Способ по п.1, в котором сдвиговое смешивание на стадии (b) выполняется при температуре в интервале от примерно 95 до примерно 115 С. 17. Способ по п.1, в котором массовое соотношение фармацевтически активного соединения и полимера находится в интервале от примерно 5:95 до примерно 25:75. 18. Способ по п.1, в котором массовое соотношение фармацевтически активного соединения и полимера находится в интервале от примерно 10:90 до примерно 20:80. 19. Способ по п.1, в котором фармацевтически активное соединение растворяется в полимере, по меньшей мере, в степени примерно 50 мас.% по отношению к общей массе фармацевтически активного соединения, присутствующего в указанной композиции. 20. Способ по п.1, в котором фармацевтически активное соединение растворяется в полимере, по меньшей мере, в количестве примерно 90 мас.% от общей массы фармацевтически активного соединения, присутствующего в композиции. 35 21. Способ по п.1, в котором микрочастицы добавляют в фармацевтически приемлемый раствор с образованием инъецируемой суспензии. 22. Способ по п.21, в котором суспензия при введении пациенту высвобождает фармацевтически активное соединение в течение, по меньшей мере, примерно 2 недель в дозе, достаточной для антагонизации эффектов серотонина на 5 НТ 2 А-рецептор. 23. Способ по п.21, в котором суспензия при введении пациенту высвобождает фармацетически активное соединение в течение периода от примерно 2 недель до примерно 1 месяца в дозе, достаточной для антагонизации эффектов серотонина на 5 НТ 2A-рецептор. 24. Способ получения фармацевтической композиции, включающий стадии а) смешивания фармацевтически активного соединения формулы I или его фармацевтически приемлемой соли и сополимера лактид-гликолида при температуре примерно 25 С и атмосферном давлении в течение времени, достаточного для образования сухой смеси, где массовое соотношение соединения и полимера находится в интервале от примерно 10:90 до примерно 15:85, при этом полимер имеет температуру стеклования (Тc) ниже 60 С;b) сушки указанной смеси в вакууме при температуре примерно 25 С до достижения содержания влаги в смеси менее 0,02 мас.%;c) пропускания указанной сухой смеси через нагретый двухшнековый экструдер, имеющий по меньшей мере один левосторонний элемент, при достаточной скорости сдвига и при температуре от примерно 95 до 115 С, в течение времени, достаточного для размягчения полимера с образованием псевдоожиженной среды, и растворения соединения в полимере с образованием твердого раствора, имеющего гомогенно диспергированную смесь соединения в полимерной матрице, экструдирования гомогенной смеси в стренгу, при этом условия сдвига поддерживаются таким образом, что менее 1 мас.% соединения взаимодействует с полимером;e) измельчения и просеивания гранул с образованием инъецируемых микрочастиц фармацевтической композиции, имеющих распределение по размеру в интервале от примерно 10 до 100 мкм. 25. Фармацевтическая композиция, содержащая микрочастицы, имеющие распределение по размеру в интервале от примерно 10 до 100 мкм, образованные из 36 а) биоразлагаемого полимера в количестве от примерно 80 до 95 мас.%, имеющего температуру стеклования (Тc) ниже 60 С; иb) фармацевтически активного соединения формулы I или его фармацевтически приемлемой соли в количестве от примерно 5 до 20 мас.% где соединение растворено и однородно диспергировано в полимере. 26. Композиция по п.25, в которой соединение является антагонистом 5 НТ 2 А-рецептора. 27. Композиция по п.25, в которой полимером является сополимер лактид-гликолид. 28. Композиция по п.25, в которой сополимер лактид-гликолид имеет среднюю молекулярную массу от примерно 20000 до примерно 100000. 29. Композиция по п.25, в которой сополимер лактид-гликолид имеет среднюю молекулярную массу от примерно 30000 до 45000. 30. Композиция по п.25, в которой сополимер лактид-гликолид содержит 45-90 мол.% лактидных звеньев и 10-55 мол.% гликолидных звеньев соответственно. 31. Композиция по п.25, в которой фармацевтически активное соединение растворяется в полимере, по меньшей мере, в количестве примерно 50 мас.% от общей массы фармацевтически активного вещества, присутствующего в композиции. 32. Композиция по п.25, в которой фармацевтически активное соединение растворяется в полимере, по меньшей мере, в количестве примерно 90 мас.% от общей массы указанного фармацевтически активного соединения, присутствующего в композиции. 33. Композиция по п.25, в которой микрочастицы вводятся в фармацевтически приемлемый раствор с образованием инъецируемой суспензии. 34. Композиция по п.33, в которой суспензия при введении пациенту высвобождает указанное фармацевтически активное соединение в течение, по меньшей мере, не менее примерно 2 недель в дозе, достаточной для антагонизации эффектов серотонина на 5 НТ 2 А-рецептор. 35. Композиция по п.33, в которой суспензия при введении пациенту высвобождает фармацевтически активное соединение в течение периода от примерно 2 недель до примерно 1 месяца в дозе, достаточной для антагонизации эффектов серотонина на 5 НТ 2 А-рецептор. 36. Фармацевтическая композиция по п.25,используемая для антагонизации эффектов рецептора серотонина. 37. Фармацевтическая композиции по п.36,отличающаяся тем, что эффекты рецептора се 37 ротонина антагонизируются в течение периода от примерно 2 недель до примерно 1 месяца. 38. Фармацевтическая композиция по п.25,используемая для антагонизации эффектов серотонина на 5 НТ 2 А-рецептор. 39. Фармацевтическая композиции по п.38,отличающаяся тем, что эффекты серотонина на 5 НТ 2 А-рецетор антагонизируются в течение периода от примерно 2 недель до примерно 1 месяца. 40. Фармацевтическая композиция по п.25,используемая в ингибировании психозов. 41. Фармацевтическая композиция по п.25,используемая в лечении депрессии и биполярного расстройства. 42. Фармацевтическая композиция по п.25,используемая в лечении состояния тревоги. 43. Фармацевтическая композиция по п.25,используемая в лечении навязчивого компульсивного расстройства. 44. Фармацевтическая композиция по п.25,используемая в лечении наркомании. 45. Фармацевтическая композиция по п.25,используемая в лечении коронарных вазоспазмов. 46. Фармацевтическая композиция по п.25,используемая в лечении стенокардии. 38 47. Фармацевтическая композиция по п.25,используемая в лечении тромботического заболевания. 48. Фармацевтическая композиция по п.25,используемая в лечении нарушения сна. 49. Фармацевтическая композиция, содержащая микрочастицы, имеющие распределение по размеру в интервале от примерно 10 до 100 мкм, состоящие из а) сополимера лактид-гликолида в количестве от примерно 85 до 95 мас.%, где полимер имеет температуру стеклования (Тc) ниже 60 С; иb) фармацевтически активного соединения формулы I или его фармацевтически приемлемой соли в количестве от примерно 5 до 15 мас.% где соединение растворяется и однородно диспергируется в сополимере лактид-гликолид.
МПК / Метки
МПК: A61K 9/16, A61P 25/18
Метки: антагониста, получения, фармацевтическая, рецептора, композиция, способ, серотонина
Код ссылки
<a href="https://eas.patents.su/20-4502-farmacevticheskaya-kompoziciya-antagonista-receptora-serotonina-i-sposob-ee-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтическая композиция антагониста рецептора серотонина и способ ее получения</a>
Предыдущий патент: Производные 2,4-дизамещенного триазина
Следующий патент: Фармацевтическая композиция леводопа/карбидопа/энтакапон
Случайный патент: Производные аминоалкилхроманов, обеспечивающие релаксацию мускулатуры дна желудка