Препарат 2-метилтиенобензодиазепина
Номер патента: 2825
Опубликовано: 31.10.2002
Авторы: Маскаренхас Снехлата Сингх, Брукс Норман Дейл, Шинкл Шарон Луиз, Декемпер Курт Дуглас, Баннелл Чарльз Артур, Аллен Дуглас Джеймс, Фергусон Томас Гарри, Гарвин Стюарт Джеймс, Таппер Дэвид Эдвард, Санчез-Феликс Мануэль Висенте, Мюррей Линда Камерон, Хендриксен Барри Арнольд
Формула / Реферат
1. Препарат, содержащий оланзапин, или его соль памовой кислоты, или сольват в качестве активного ингредиента, и один или более носителей, выбранных из группы, состоящей из маслянистого носителя или носителя в виде холестериновых микросфер, при условии, что, если носитель представляет собой маслянистый носитель, активным ингредиентом является памоат оланзапина или его сольват.
2. Препарат по п.1, отличающийся тем, что обладает длительным непрерывным выделением в течение периода более 7 дней и первоначальным выделением менее 15% активного ингредиента.
3. Препарат по п.1, отличающийся тем, что указанный носитель является маслянистым носителем.
4. Препарат по п.1, отличающийся тем, что указанный носитель выбирают из группы, состоящей из неионных поверхностно-активных веществ - блоксополимера пропиленоксида и этиленоксида, целлюлозных смол, полисахаридных смол, растительных масел, рафинированных фракционированных масел, диацетатгексаизобутирата сахарозы, хитозана, лецитина и поливинилпирролидона.
5. Препарат по п.4, отличающийся тем, что указанный носитель выбирают из группы, состоящей из неионных поверхностно-активных веществ - блоксополимера пропиленоксида и этиленоксида, целлюлозных смол, полисахаридных смол, растительных масел, рафинированных фракционированных масел.
6. Препарат по п.2, отличающийся тем, что дополнительно включает один или более фармацевтически приемлемых наполнителей.
7. Препарат по п.6, отличающийся тем, что фармацевтически приемлемый наполнитель выбирают из группы, состоящей из гелеобразующего агента и антигидратанта.
8. Препарат по п.7, отличающийся тем, что включает моногидрат оланзапин памоата, триглицериды фракционированных растительных жирных кислот и белый воск.
9. Препарат по п.1, отличающийся тем, что оланзапин представляет собой, по существу, чистую полиморфную форму II, имеющую типичную порошковую рентгенограмму как представлено следующими межплоскостными расстояниями:
d (Е)
10,2689
8,577
7,4721
7,125
6,1459
6,071
5,4849
5,2181
5,1251
4,9874
4,7665
4,7158
4,4787
4,3307
4,2294
4 ,141
3,9873
3,7206
3,5645
3,5366
3,3828
3,2516
3,134
3,0848
3,0638
3,0111
2,8739
2,8102
2,7217
2,6432
2,6007
10. Препарат по п.1, отличающийся тем, что носитель представляет собой холестериновую микрочастицу.
11. Препарат по п.10, отличающийся тем, что микрочастица является микросферой.
12. Препарат по п.10, отличающийся тем, что холестерин выбирают из группы, состоящей из холестерина, холестерин пальмитата, холестерин олеата, холестерин стеарата и холестерин гемисукцината.
13. Препарат по п.11, отличающийся тем, что микросферы имеют размер от 20 до 500 mм.
14. Препарат по п.13, отличающийся тем, что размер частиц составляет от 30 до 200 mм.
15. Препарат по п.14, отличающийся тем, что размер частиц составляет от 40 до 100 mм.
16. Препарат по п.11, отличающийся тем, что микросферы вводятся в маслянистом носителе.
17. Препарат по п.16, отличающийся тем, что маслянистый носитель выбирают из группы, состоящей из неионных поверхностно активных веществ - блоксополимера пропиленоксида и этиленоксида, целлюлозных смол, полисахаридных смол, растительных масел и рафинированных фракционированных масел.
18. Препарат по п.1 в виде пролонгированной дозированной формы.
19. Препарат по п.1 в виде быстро действующей дозированной формы для внутримышечного введения.
20. Препарат по п.1, отличающийся тем, что активный ингредиент выбирают из группы, состоящей из оланзапина, оланзапин дигидрата D, оланзапин памоата, диметанолата оланзапин памоата, моногидрата оланзапин памоата, ТГФ-сольвата оланзапин памоата, ацетонового сольвата бис(оланзапин)памоата и моногидрата бис(оланзапин)памоата.
21. Препарат по п.20, отличающийся тем, что активный ингредиент перемолот.
22. Препарат по п.21, отличающийся тем, что размер частиц составляет от 20 до 60 mм.
23. Препарат по п.21, отличающийся тем, что размер частиц составляет от 5 до 20 mм.
24. Препарат по п.21, отличающийся тем, что размер размолотых частиц составляет менее 5 mм.
25. Препарат по п.20, отличающийся тем, что активный ингредиент представляет собой моногидрат оланзапин памоата, имеющий порошковую рентгенограмму как представлено следующими межплоскостными расстояниями:
| d-расстояние | Интенсивность |
| 10,76 | 98 |
| 9,20 | 62 |
| 8,38 | 85 |
| 8,18 | 24 |
| 7,62 | 20 |
| 6,67 | 18 |
| 6,56 | 18 |
| 6,51 | 20 |
| 6,44 | 20 |
| 6,11 | 26 |
| 5,88 | 22 |
| 5,64 | 15 |
| 5,38 | 100 |
| 4,90 | 11 |
| 4,72 | 12 |
| 4,64 | 17 |
| 4,48 | 18 |
| 4,35 | 23 |
| 4,29 | 31 |
| 4,24 | 32 |
| 4,09 | 71 |
| 4,02 | 84 |
| 3,98 | 73 |
| 3,81 | 23 |
| 3,62 | 14 |
| 3,52 | 30 |
| 3,39 | 11 |
| 3,25 | 12 |
| 2,90 | 15 |
| 2,85 | 13 |
26. Препарат по п.20, отличающийся тем, что активный ингредиент представляет собой моногидрат бис(оланзапин)памоата, имеющий типичную порошковую рентгенограмму как представлено следующими межплоскостными расстояниями:
| d-расстояние | Интенсивность |
| 15,77 | 26 |
| 10,44 | 23 |
| 9,64 | 24 |
| 9,31 | 13 |
| 8,27 | 23 |
| 8,17 | 14 |
| 8,13 | 14 |
| 7,84 | 27 |
| 7,81 | 30 |
| 7,41 | 60 |
| 7,12 | 40 |
| 7,00 | 13 |
| 6,96 | 13 |
| 6,55 | 45 |
| 6,18 | 53 |
| 5,87 | 38 |
| 5,80 | 19 |
| 5,59 | 89 |
| 5,25 | 26 |
| 5,00 | 34 |
| 4,96 | 31 |
| 4,88 | 61 |
| 4,85 | 73 |
| 4,71 | 34 |
| 4,52 | 19 |
| 4,33 | 11 |
| 4,19 | 100 |
| 4,12 | 48 |
| 4,05 | 39 |
| 3,97 | 30 |
| 3,89 | 31 |
| 3,80 | 29 |
| 3,72 | 20 |
| 3,70 | 21 |
| 3,58 | 33 |
| 3,45 | 27 |
| 3,04 | 13 |
| 2,84 | 16 |
Текст
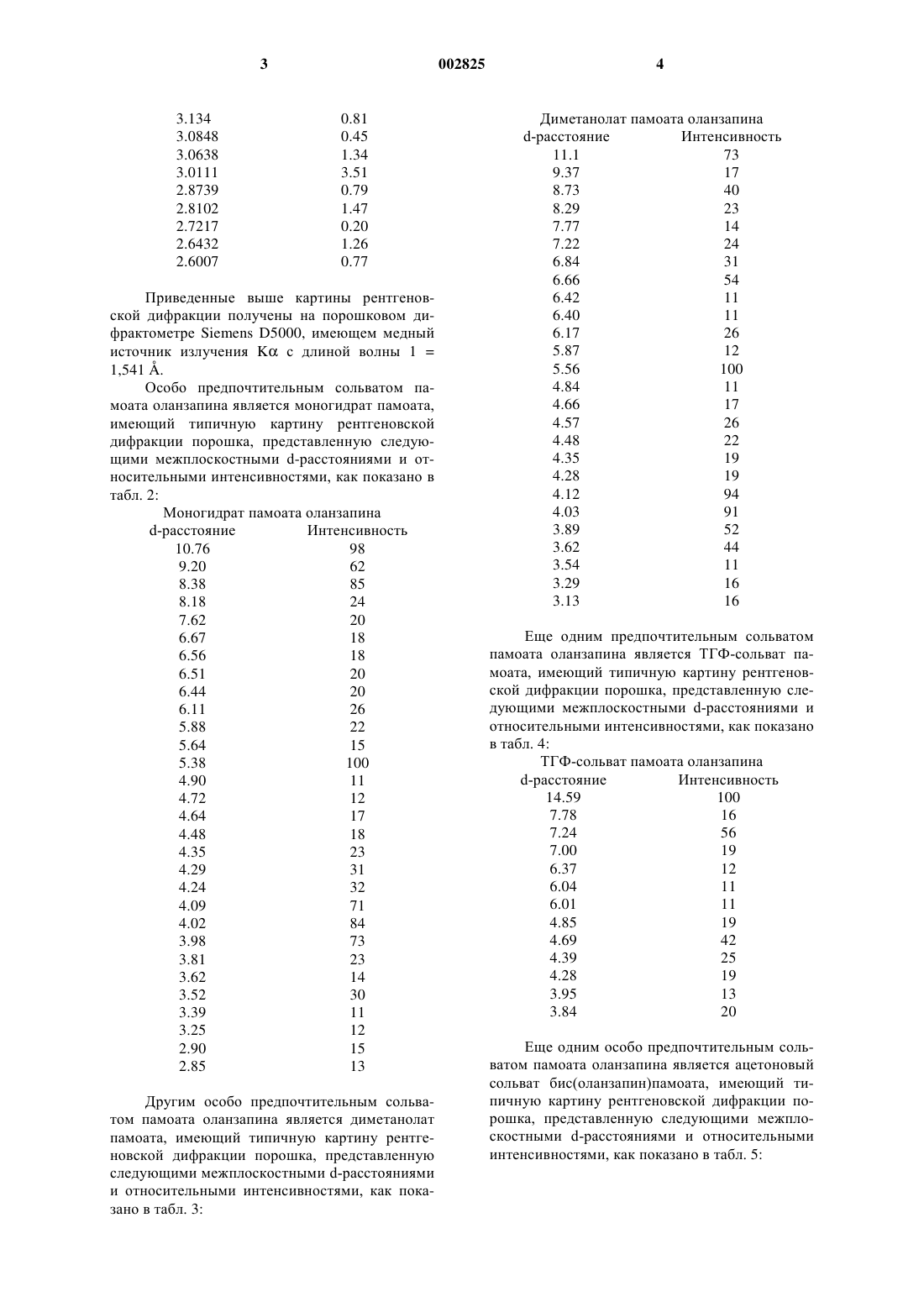
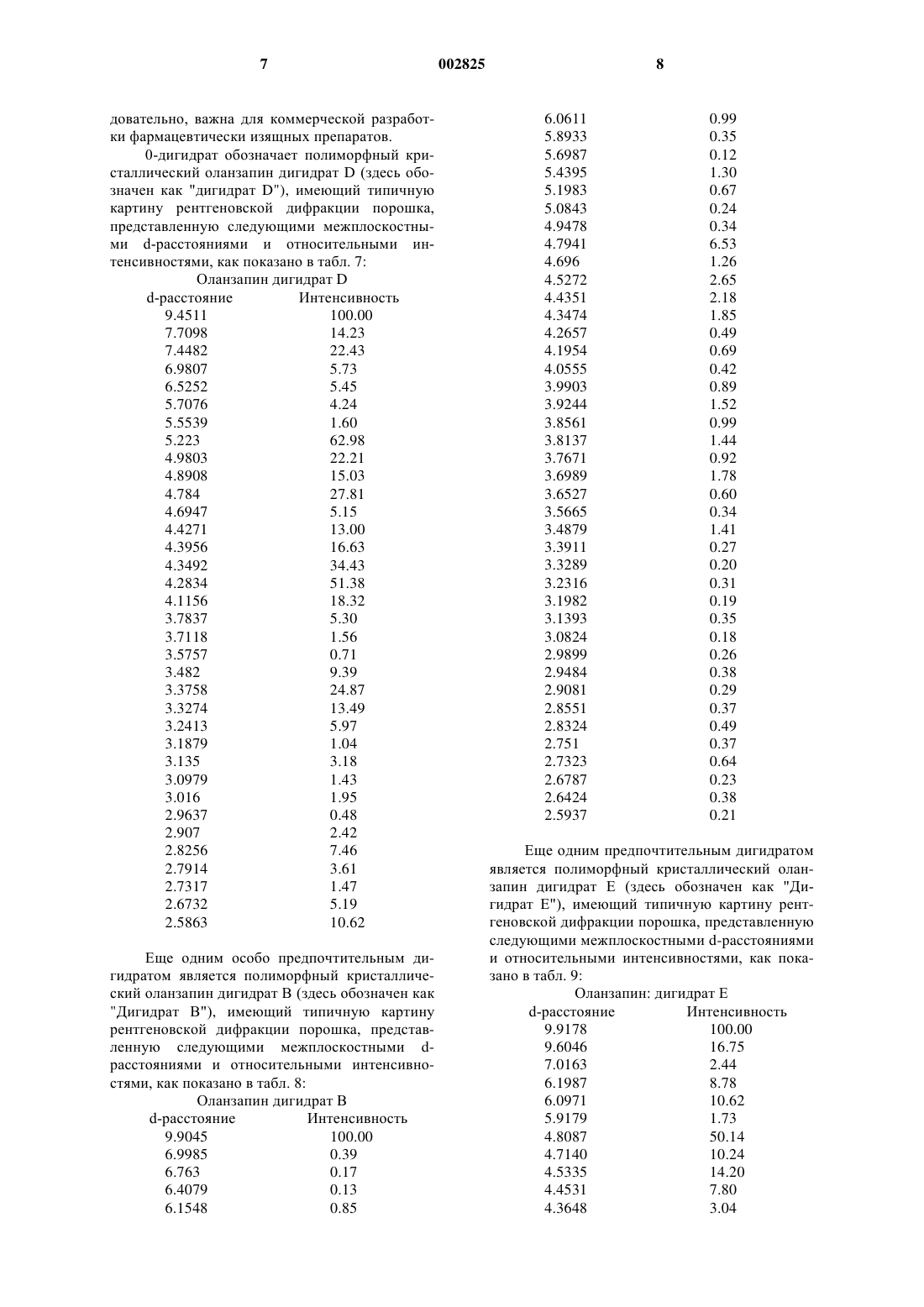
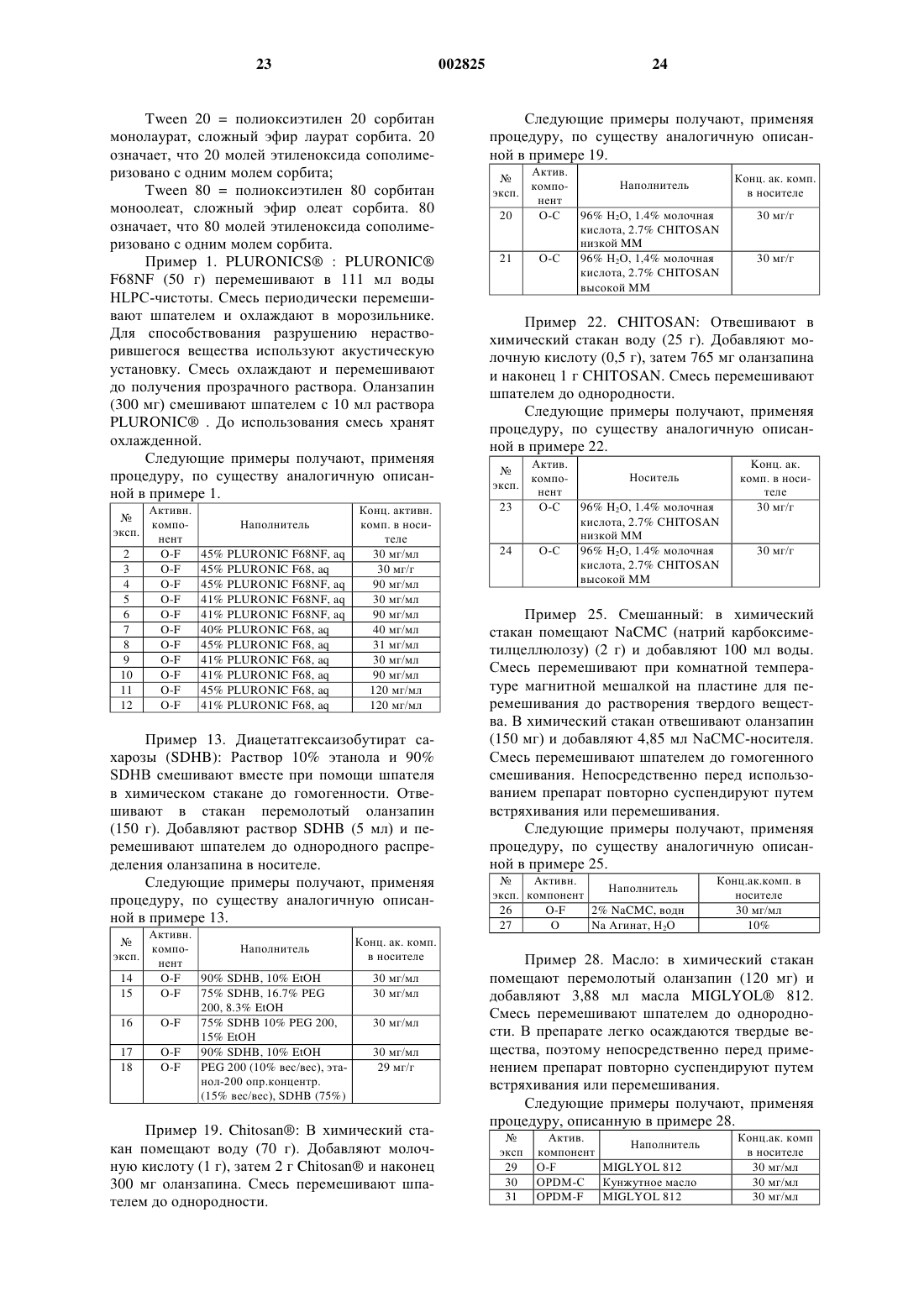
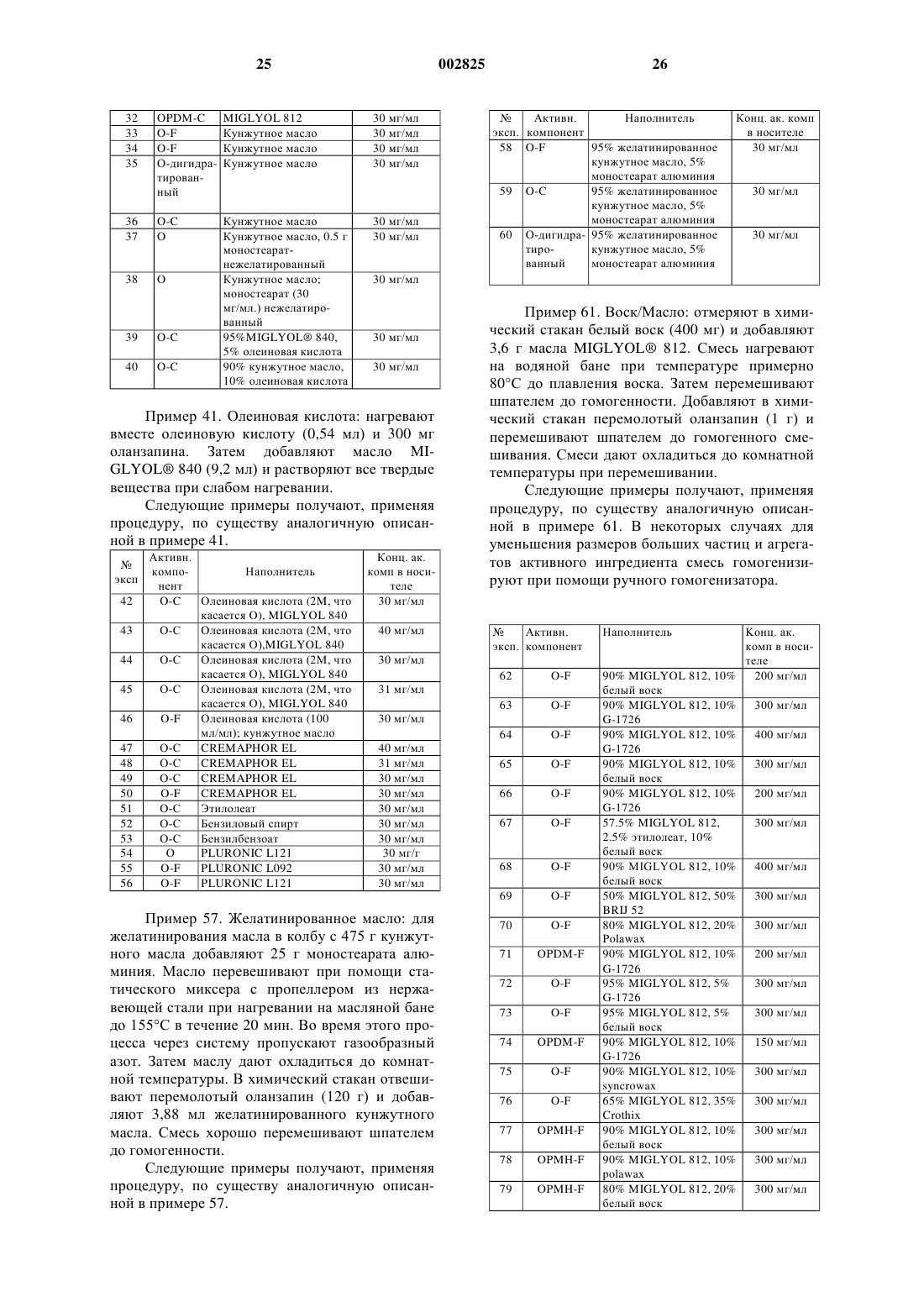
1 Указанная заявка демонстрирует преимущество предварительной заявки США 60/360493 от 30 сентября 1997 г. Данное изобретение обеспечивает фармацевтически изящный препарат 2-метил-4-(4 метил-1-пиперазинил)-10 Н-тиено[2,3-b][1,5]бензодиазепина (здесь далее обозначается как"оланзапин" (olanzapine или его памоата или сольвата. Показано, что оланзапин является перспективным при лечении психотических пациентов и в настоящее время продается для этой цели. Такие психотические пациенты часто не соблюдают режим, при этом трудно определить,принимал пациент надлежащую дозу лекарства или нет. Заявители обнаружили, что может быть особо желательно готовить оланзапин в виде пролонгируемого препарата (depot formulation) или в виде быстродействующего (quick) внутримышечного препарата, обеспечивая постоянную и необходимую дозу лекарственного вещества и предполагая соблюдение схемы лечения. Такой препарат должен быть тщательно составлен и выбран вследствие склонности оланзапина к метастабильности, фармацевтически нежелательному обесцвечиванию и удивительному сильнодействию оланзапина, что требует осторожности для гарантии гомогенности и стабильности конечного препарата. Обычно для обеспечения длительного выделения препарата специалист должен получить активное лекарственное вещество в виде сложного эфира. К сожалению, из молекулы оланзапина не удается получить сложноэфирный продукт. Кроме того, заявители обнаружили, что при контакте с некоторыми наполнителями,включая порошковые смеси, оланзапин подвержен нежелательному обесцвечиванию. Обесцвечивание усиливается на воздухе при комнатных условиях, при повышенной температуре и во влажной атмосфере. Хотя явление обесцвечивания не дает увеличения общего количества родственных веществ, изменение цвета обычно считают фармацевтически неприемлемым для коммерческих целей. Кроме того, известно, что рН мышечной ткани может меняться при физической нагрузке,стрессе и повреждении, что может влиять на растворимость лекарственного вещества и, таким образом, на скорость абсорбции вводимых лекарств. Следовательно, желательно найти препарат для инъекций длительного действия, в котором скорость выделения активного ингредиента минимально зависит от рН. Заявители обнаружили, что препарат,включающий в качестве активного ингредиента оланзапин или его памоат или его сольват и один или более носителей, может удовлетворить испытываемую в течение долгого времени потребность в таком стабильном, фармацевтически изящном препарате с регулируемой скоро 002825 2 стью выделения, который может быть полезен в качестве пролонгируемого препарата ила быстро действующего препарата для внутримышечного или подкожного применения. Настоящее изобретение обеспечивает препарат, включающий оланзапин или его памоат или сольват и маслянистый или холестериновый микросферический носитель. Настоящее изобретение обеспечивает также новые памоаты оланзапина. Такие соли особенно полезны при получении препаратов длительного действия, в которых скорость выделения минимально зависит от рН среды. Оланзапин можно применять. Однако заявители обнаружили, что памоаты оланзапина могут быть предпочтительны в смысле влияния на длительность выделения активного компонента из указанных выше композиций. Могут быть полезны также различные сольватные формы оланзапина и его памоатов, включая,например, дигидраты оланзапина D, Е и F, памоат оланзапина и моногидрат, диметанолат сольват памоата оланзапина, сольваты памоата оланзапина с ТГФ (тетрагидрофураном) и ацетоном. Бис(оланзапин)памоат и его сольваты также могут быть полезны в данном изобретении. Предпочтительной солью является моногидрат памоата оланзапина. А также моногидрат бис(оланзапин)памоата. Препарат может содержать наиболее стабильную безводную форму оланзапина, обозначенную здесь как форма II; однако, рассматриваются и другие формы оланзапина. Далее приведен типичный пример рентгеновской дифракционной картины для Формы II,где d представляет межплоскостное расстояние,а интенсивность представляет типичные относительные интенсивности, как показано далее в табл. 1: Приведенные выше картины рентгеновской дифракции получены на порошковом дифрактометре Siemens D5000, имеющем медный источник излучения K с длиной волны 1 = 1,541 . Особо предпочтительным сольватом памоата оланзапина является моногидрат памоата,имеющий типичную картину рентгеновской дифракции порошка, представленную следующими межплоскостными d-расстояниями и относительными интенсивностями, как показано в табл. 2: Моногидрат памоата оланзапинаd-расстояние Интенсивность 10.76 98 9.20 62 8.38 85 8.18 24 7.62 20 6.67 18 6.56 18 6.51 20 6.44 20 6.11 26 5.88 22 5.64 15 5.38 100 4.90 11 4.72 12 4.64 17 4.48 18 4.35 23 4.29 31 4.24 32 4.09 71 4.02 84 3.98 73 3.81 23 3.62 14 3.52 30 3.39 11 3.25 12 2.90 15 2.85 13 Другим особо предпочтительным сольватом памоата оланзапина является диметанолат памоата, имеющий типичную картину рентгеновской дифракции порошка, представленную следующими межплоскостными d-расстояниями и относительными интенсивностями, как показано в табл. 3:d-расстояние Интенсивность 11.1 73 9.37 17 8.73 40 8.29 23 7.77 14 7.22 24 6.84 31 6.66 54 6.42 11 6.40 11 6.17 26 5.87 12 5.56 100 4.84 11 4.66 17 4.57 26 4.48 22 4.35 19 4.28 19 4.12 94 4.03 91 3.89 52 3.62 44 3.54 11 3.29 16 3.13 16 Еще одним предпочтительным сольватом памоата оланзапина является ТГФ-сольват памоата, имеющий типичную картину рентгеновской дифракции порошка, представленную следующими межплоскостными d-расстояниями и относительными интенсивностями, как показано в табл. 4: ТГФ-сольват памоата оланзапинаd-расстояние Интенсивность 14.59 100 7.78 16 7.24 56 7.00 19 6.37 12 6.04 11 6.01 11 4.85 19 4.69 42 4.39 25 4.28 19 3.95 13 3.84 20 Еще одним особо предпочтительным сольватом памоата оланзапина является ацетоновый сольват бис(оланзапин)памоата, имеющий типичную картину рентгеновской дифракции порошка, представленную следующими межплоскостными d-расстояниями и относительными интенсивностями, как показано в табл. 5: 5 Ацетоновый сольват памоата оланзапинаd-расстояние Интенсивность 16.87 32 9.58 35 8.88 80 8.40 16 8.19 35 7.85 16 7.34 29 7.22 25 7.04 30 6.87 18 6.77 11 6.73 11 6.65 21 6.35 12 6.26 26 5.76 31 5.58 79 5.53 100 5.45 61 5.32 42 5.19 39 5.02 55 4.91 69 4.87 51 4.85 57 4.69 44 4.61 68 4.44 23 4.34 14 4.18 17 4.07 36 3.99 28 3.93 65 3.81 23 3.78 24 3.77 20 3.65 23 3.59 28 3.45 13 3.32 19 3.25 26 Еще одним особо предпочтительным сольватом памоата оланзапина является моногидрат бис(оланзапин)памоата, имеющий типичную картину рентгеновской дифракции порошка,представленную следующими межплоскостными d-расстояниями и относительными интенсивностями, как показано в табл. 6: Моногидрат бис(оланзапин)памоата Картины рентгеновской дифракции порошков солей памоатов и сольватов получают на дифрактометре Siemens D5000, применяя излучение Сu К с длиной волны 1,5406 . Приборные характеристики: шаг 0,01; скорость сканирования 1,0 с/шаг; диапазон 4-352; цель разброса (divergence slit) 0,6 мм; щель рассеянного излучения (scattered radiation slit) 1,0 мм; принимающая щель (receiving alit) 0,2 мм; 50solid state detector). Для анализа образцы крепят в держателях для образцов, имеющих полость. Препарат данного изобретения может содержать в качестве активного ингредиента, по существу, чистую форму II. Использованное здесь выражение "по существу чистая" обозначает форму II, содержащую менее 15% нежелательной полиморфной формы оланзапина (здесь обозначен как "нежелательная форма"), предпочтительно примерно менее 5% нежелательной формы, еще предпочтительнее примерно менее 2% нежелательной формы. Кроме того, "по существу чистая" форма II содержит примерно менее 5% нежелательных химических примесей или остаточного растворителя или воды. В частности, "по существу чистая" форма II предпочтительно содержит примерно менее 0,05% ацетонитрила, еще предпочтительнее примерно менее 0,005% ацетонитрила. Форма II является наиболее стабильной известной безводной формой оланзапина и, сле 7 довательно, важна для коммерческой разработки фармацевтически изящных препаратов. 0-дигидрат обозначает полиморфный кристаллический оланзапин дигидрат D (здесь обозначен как "дигидрат D"), имеющий типичную картину рентгеновской дифракции порошка,представленную следующими межплоскостными d-расстояниями и относительными интенсивностями, как показано в табл. 7: Оланзапин дигидрат Dd-расстояние Интенсивность 9.4511 100.00 7.7098 14.23 7.4482 22.43 6.9807 5.73 6.5252 5.45 5.7076 4.24 5.5539 1.60 5.223 62.98 4.9803 22.21 4.8908 15.03 4.784 27.81 4.6947 5.15 4.4271 13.00 4.3956 16.63 4.3492 34.43 4.2834 51.38 4.1156 18.32 3.7837 5.30 3.7118 1.56 3.5757 0.71 3.482 9.39 3.3758 24.87 3.3274 13.49 3.2413 5.97 3.1879 1.04 3.135 3.18 3.0979 1.43 3.016 1.95 2.9637 0.48 2.907 2.42 2.8256 7.46 2.7914 3.61 2.7317 1.47 2.6732 5.19 2.5863 10.62 Еще одним особо предпочтительным дигидратом является полиморфный кристаллический оланзапин дигидрат В (здесь обозначен как"Дигидрат В"), имеющий типичную картину рентгеновской дифракции порошка, представленную следующими межплоскостными dрасстояниями и относительными интенсивностями, как показано в табл. 8: Оланзaпин дигидрат В Еще одним предпочтительным дигидратом является полиморфный кристаллический оланзапин дигидрат Е (здесь обозначен как "Дигидрат Е"), имеющий типичную картину рентгеновской дифракции порошка, представленную следующими межплоскостными d-pacстояниями и относительными интенсивностями, как показано в табл. 9: Оланзапин: дигидрат Е Представленные здесь в табл. 7, 8 и 9 рентгеновские дифракционные картины порошков получены с применением излучения меди k с длиной волны 1,541 . Межплоскостные расстояния в колонке "d" даны в ангстремах. Детектор - кремний литиевый твердотельный детектор "Kevex silicon lithium solid state detector" . Оланзапин дигидрат D получают посредством длительного перемешивания технического оланзапина, как описано в получении 9, в водных условиях. Выражение "водные условия" обозначает водный растворитель, который может быть или водой, или смесью растворителей,включающей воду и органический растворитель, который в достаточной степени смешивается с водой, допуская присутствие в смеси растворителей необходимого количества воды. Если используют смесь растворителей, то органический растворитель можно удалить, оставляя превосходящее количество воды, или заменить водой. Выражение "продолжительное перемешивание" обозначает перемешивание в течение примерно четырех (4) - шести (6) дней; однако,специалист должен принимать во внимание, что это время зависит от условий проведения реакции, таких как температура, давление и растворитель. Предпочтительно, чтобы водные условия включали водный растворитель. Окончание реакции можно контролировать, применяя метод рентгеновской дифракции порошков и другие известные специалистам методы. Некоторые из таких методов описаны ниже. Методы, характеризующие соединения,включают, например, рентгеноструктурный анализ порошков, термогравиметрический анализ (TGA), характеристики смачивания, характеристики распыления, дифференциальную ска 10 нирующую калориметрию (DSC), титрометрический анализ на воду и Н 1 ЯМР-анализ на содержание растворителя. Для характеристики соединений можно также применять определения методом сканирующей электронной микроскопии (SEMs), пористость, остаточное содержание растворителей (высокоэффективная жидкостная хроматография = HPLC), возможность введения посредством шприца (syringeability), определенный при помощи оптического микроскопа размер частиц, площадь поверхности, максимум ИК-плотности (для сольвата/кристаллической формы), хрупкость. Дигидраты оланзапина, описанные здесь в получениях 9, 10 и 11, являются действительными дигидратами, которые содержат две молекулы воды на молекулу лекарственного вещества, причем молекулы воды включены в кристаллическую решетку дигидратного соединения. Носители, которые промотируют медленную абсорбцию оланзапина, включают водные и безводные композиции. Водные суспензии оланзапина, памоаты оланзапина или их сольваты включают соединения PLURONICS, такие как PLORONIC F68,который при подходящих концентрациях и при температуре тела образует гель. КонцентрацияPLURONIC в диапазоне 40-45% в присутствии оланзапина дает гель при температуре тела и должна соответствовать предпочтительной композиции для данного применения. По-другому, водные суспензии целлюлозных или полисахаридных смол, включающие натрий карбоксиметилцеллюлозу или альгинат натрия, могут обеспечить длительное выделение памоата оланзапина или его сольватов. Можно использовать другие природные или синтетические биополимеры, такие как хитозаны (chitosans), желатины, коллагены, халуроновые кислоты (haluronic acids) и подобные. Кроме того,можно добавлять до 30 вес.% агентов, влияющих на выделение активного компонента. Неводные композиции включают (но не ограничены этим) гидрофобные PLURONICS,пропиленгликоли, полиэтиленгликоли и маслянистые препараты. Гидрофобные PLURONICS содержат вещества с гидрофильным/липофильным балансом менее 8 и могут быть включены индивидуально вместе с оланзапином, памоатами оланзапина или их сольватами или в сочетании с другими агентами, модифицирующими выделение, которые замедляют абсорбцию в организме. Маслянистые композиции включают памоаты оланзапина или их сольваты, суспендированные или растворенные в маслах и маслах,сгущенных при помощи антигидратантов или гелеобразующих агентов. Эти антигидратанты или гелеобразующие агенты придают маслу большую вязкость (и, следовательно, большую структурную стабильность) и тем самым замед 11 ляют проникание жидкостей организма через масло, пролонгируя абсорбцию лекарства. Масло предпочтительно выбирают из масел, которые легко получать в достаточно чистом виде и которые физиологически и фармацевтически приемлемы. Конечно, масло должно быть очищено в достаточной степени, так, чтобы оно было стабильным при хранении, не давало при стоянии осадка, не имело наблюдаемых химических реакций и не давало физиологических реакций при введении в организм. Предпочтительными являются растительные масла, такие как соевое масло, оливковое масло,касторовое масло, пальмовое масло, миндальное масло, рафинированные фракционированные масла, такие как MIGLYOL 810, MIGLYOL 812 и подобные, и производные масла, такие какMIGLYOL 840 и подобные. Наиболее предпочтительным маслом является MIGLYOL 812,фракционированное кокосовое масло. Можно использовать другие масла, при условии, что они отвечают определенным выше требованиям. Примеры антигидратантов и гелеобразующих агентов включают различные соли органических кислот, например жирных кислот,имеющих примерно от 8 (предпочтительно, по крайней мере, 10) до 22 (предпочтительно примерно до 20) атомов углерода, например, соли алюминия, цинка, магния или кальция и лауриновой кислоты, пальмитиновой кислоты, стеариновой кислоты и подобных. Такие соли могут быть моно-, ди- или тризамещенными, в зависимости от валентности металла и степени окисления металла кислотой. Особенно полезны алюминиевые соли таких жирных кислот. Предпочтительными антигидратантами являются моностеарат и дистеарат алюминия. Другие соли, которые могут быть полезными, включают тристеарат алюминия, моно- и дистеарат кальция, моно- и дистеарат магния и соответствующие пальмитаты, лаураты и подобное. Концентрации этих антигидратантов обычно основаны на весе масла плюс вес лекарственного агента и обычно составляют 1-10%, наиболее типично 25% по весу. В некоторых случаях могут быть подходящими другие концентрации. Для сообщения вязкоупругих свойств или для эффектов ослабления абсорбции в масло можно также включать воски, природные или синтетические, лецитины, токоферолы и их сложные эфиры, такие как токоферолацетат или токоферолсукцинат, полиоксиэтиленовое производное касторового масла (например, CREMOPHOR EL), гидрированное полиоксиэтиленовое производное касторового масла (например, CREMOPHOR RH40, CREMOPHOR RH60),эфиры жирных кислот (например, этилолеат и метилолеат), холестерин и его производные. Воски предпочтительно выбирать из растительных, животных или синтетических источников. Предпочтительными источниками являются растительные или синтетические. Например, 002825 12 предпочтительные воски включают воск карнаубы и пчелиный воск. Доступен пчелиный воск различных степеней очистки, включая белый воск и желтый пчелиный воск. Можно использовать другие синтетические воски или производные, такие как CRODACOL CS-50,CROTHIX, POLAWAS, SYNCROWAX, полиоксиэтиленсорбиталевые производные пчелиного воска (например, G-1726) и подобные. В масла можно добавлять другие агенты,модифицирующие выделение, либо для ускорения выделения лекарственного вещества, либо для замедления выделения. Эти агенты включают (но не ограничены этим) олеиновую кислоту, эфиры олеиновой кислоты, такие как этилолеат, бензиловый спирт, бензилбензоат и подобные. Добавки композиций на основе лецитина, модифицирующие выделение, включают(но не ограничены этим) холестерин, этилцеллюлозу, токоферолы, поливинилпирролидон и полиэтиленгликоли. Для влияния на выделение лекарственного вещества эти добавки можно включать при различных концентрациях до 30 вес.%. Для обеспечения длительного выделения оланзапина используют биоразрушаемый материал диацетат гексаизобутарат сахарозы(SDHB) в растворе с фармацевтически приемлемым растворителем или растворителями, такими как этанол и полиэтиленгликоль. Для модификации выделения или длительного выделения оланзапина можно использовать другие композиции SDHB с агентами, модифицирующими выделение, при концентрациях примерно до 20 вес.%, такими как пропиленгликоль,PLURONICS, целлюлозы, лецитины, масла и подобные. Предпочтительный маслянистый препарат включает оланзапин или его памоаты или сольваты, масляный носитель и гелеобразующий агент или антигидратант. Еще более предпочтителен маслянистый препарат, включающий моногидрат оланзапин памоата, MIGLYOL 812 и белый воск. Использованный здесь термин "микрочастица" имеет общепринятое значение, известное специалистам. Таким образом, этот термин включает (но никоим образом не ограничен этим) микросферы, в которых активный ингредиент может быть равномерно распределен в носителе, или микрокапсулы, в которых активный ингредиент окружен четко обозначенной внешней оболочкой, и подобное. Микрочастицы можно получить, применяя такие приемы как комплексная коацервация, полимер/полимерная несмешиваемость, межфазная полимеризация,полимеризация на месте, выпаривание растворителя/экстракция, термическое или ионное гелеобразование, охлаждение распылением,псевдоожиженный слой, вращающийся диск,разделение суспензии при вращении, сушка 13 распылением и другие известные специалистам способы. Например, холестеринoвые микросферы можно получить, применяя процедуру выпаривания растворителя, при этом эффективно захватывается оланзапин или его памоат или сольват и обеспечивается длительное выделение оланзапина в организме. Процедура захвата включает эмульгирование органического раствора холестерина, диспергированной фазы и представляющего интерес активного ингредиента в обрабатываемой среде, водном растворе поверхностно-активного вещества. Водный раствор поверхностно-активного вещества допускает образование стабильной эмульсии и предотвращает агломерацию. Эмульгирование можно выполнить обычным известным специалистам способом, который включает (но не ограничивается этим) перемешивание при помощи магнитной мешалки,блендера, верхней мешалки, согласованного (inline) гомогенизатора, статического миксера и подобного. Примеры катионных, анионных и неионных соединений, которые можно использовать в качестве поверхностно-активных веществ,включают (но не ограничены этим) поливиниловый спирт (PVA), карбоксиметилцеллюлозу,желатин, поливинилпирролидон, TWEEN 80,TWEEN 20, натрий лаурилсульфат и подобное. Концентрация поверхностно-активного вещества должна быть достаточна для стабилизации эмульсии. Концентрация поверхностноактивного вещества будет влиять на конечный размер холестериновых микросфер. Обычно содержание поверхностно-активного вещества в водной среде составляет от 0,1 до примерно 20 вес.% в зависимости от поверхностноактивного вещества, используемого для растворения холестерина растворителя и используемой обрабатываемой смолы. По-другому, обрабатываемая среда может быть маслом, несмешивающимся с холестерином. Примеры подходящих масел включают (но не ограничены этим) минеральное масло и силиконовое масло. Подходящие поверхностноактивные вещества для масляной обрабатываемой среды подбирают с целью стабилизации эмульсии и оптимизации конечного размера получаемых холестериновых микросфер. Кроме того, с целью благотворного влияния на стабильность эмульсии, размер микросфер и клинический эффект можно добавлять поверхностно-активные вещества к диспергированной фазе или холестериновой фазе. Производные холестерина, используемые для влияния на продолжительности выделения активного компонента, включают холестерин ацетат, холестерин гемисукцинат, холестерин олеат, холестерин пальмитат, холестерин стеарат и подобные. Для дополнительного влияния на выделение можно применять совместимые с 14 холестерином добавки, такие как олеиновая кислота, этилолеат, метилолеат, тристеарин и подобные. Концентрация эмульгатора, длительность перемешивания, скорость перемешивания и температура перемешиваемой эмульсии будут влиять на скорость удаления растворителя, размер и качество получаемых холестериновых микросфер. Обычно обеспечение пригодных для инъекции микросфер требует контроля. Приемлемый диапазон размеров микрочастиц обычно составляет 1-5000 м. Предпочтительный для парентеральной инъекции диапазон размеров микрочастиц составляет 20-500 м. Наиболее предпочтительный диапазон составляет от 30 до 200 м. Еще более предпочтительный диапазон составляет от 40 до 100 м. Кратко говоря, водный раствор поверхностно-активного вещества - поливинилового спирта (PVA) готовят путем растворения PVA в деионизированной воде. Известно, что эффективны концентрации поливинилового спирта до 6%, но количество может быть лимитировано,если вязкость обрабатываемой среды слишком высока. Для этого изобретения предпочтительна концентрация поливинилового спирта 1% (5 гPVA добавляют к 500 мл деионизированной воды). Раствор поверхностно-активного вещества перемешивают при помощи магнитной мешалки и нагревают при 50-60 С в течение нескольких часов до тех пор, пока не растворитсяPVA. Раствору дают охладиться до комнатной температуры. Раствор поверхностно-активного вещества PVA выливают в плоский пластиковый контейнер и перемешивают посредством верхней мешалки при 450 об./мин. Растворяют оланзепин и холестерин в метиленхлориде. Диспергированную фазу выливают непосредственно и немедленно в раствор PVA при перемешиваний и оставляют перемешиваться в течение 18 ч при комнатной температуре, позволяя испаряться метиленхлориду и образовываться микросферам. Холестериновые микросферы можно собирать, отделяя их на стандартных ситах, промывать водой или другой подходящей средой и сушить на воздухе. Специалистам известны другие способы сбора и сушки и другое фармацевтически приемлемое оборудование, которое можно использовать. Размер частиц оланзапина, его памоатов или сольватов, используемых в препаратах данного изобретения, можно контролировать и достигать нужного размера известными специалистам способами уменьшения размера частиц,такими как воздухоструйное перемалывание. Измельчаемое лекарство можно варьировать по размеру частиц от грубого до мелкого в зависимости от типа используемого препарата и требуемых характеристик выделения лекарства. Грубые частицы имеют средний размер частиц 15 примерно от 20 до 60 м; средние частицы примерно от 5 по 20 м; и мелкие частицы менее 5 м. Использованный здесь термин млекопитающее обозначает класс млекопитающих высших позвоночных животных. Термин млекопитающее включает (но не ограничен) человека, использованное здесь выражение лечение включает профилактику обозначенного состояния или облегчение или ликвидацию установленного состояния. Оланзапин эффективен в широком диапазоне дозировки, фактически вводимая доза зависит от подлежащего лечению состояния. Например, при лечении взрослых людей можно применять дозировку примерно от 0,25 до 200 мг в день, предпочтительно от 1 до 30 мг в день и наиболее предпочтительно от 1 по 25 мг в день. Пролонгируемый запасаемый препарат можно составить таким образом, чтобы обеспечить требуемую ежедневную дозу в течение периода примерно от нескольких дней до одного месяца. Если предполагается мультидозовый препарат, могут потребоваться дополнительные наполнители, такие как консерванты. Можно использовать, например, такие консерванты (не ограничиваясь этим) как токоферол или пропилгаллат. Другие консерванты включают фенол,крезол, бензоат натрия и подобные. Наиболее предпочтительно, чтобы препарат оланзапина хранился в упаковочных материалах, которые защищают его от влаги и света. Подходящие упаковки включают, например,окрашенные в желтый цвет контейнеры из полиэтилена высокой плотности, окрашенные в желтый цвет стеклянные бутылочки, полипропиленовые шприцы и другие контейнеры,включая (но не ограничиваясь этим) прозрачная упаковка, снабженная саше, сделанным из материала, который препятствует прохождению света. Наиболее предпочтительно, чтобы упаковка включала осушающую обертку. Для обеспечения требуемой защиты и сохранения устойчивости продукта контейнер можно запаковать в упаковку из алюминиевой фольги. Материалы для настоящего изобретения можно покупать или получать различными хорошо известными специалистам способами. Оланзапин можно получить, как описано Chakrabarti в патенте США 5229382 ('382), который включен здесь во всей своей полноте в качестве ссылки. Памоаты и сольваты оланзапина можно получить путем смешивания оланзапина и памовой кислоты в подходящем растворителе с последующим промыванием и высушиванием полученного продукта. Для солей оланзапина и памовой кислоты (1:1) требуются эквимолярные количества памовой кислоты и оланзапина. Соли бис(оланзапин)памоата (2:1) требуют два 16 эквивалента оланзапина на каждый моль памовой кислоты. Заявители, к удивлению, обнаружили, что растворимость памоата и сольватов оланзапина не зависит от рН, в частности, в диапазоне от 4 до 8. Это делает такие соли особо подходящими для внутримышечных инъекций, так как рН мышц меняется в зависимости от физической нагрузки, стресса, метаболического состояния и подлежащей излечению раны, обычно в диапазонах от 7,4 до 4. Кроме того, бис (оланзапиновые) соли имеют дополнительное преимущество, улучшая активность лекарственного средства на единицу массы, допуская большую загрузку полученных микрочастиц и меньший объем инъекции на стандартную дозу. Предпочтительно, чтобы препарат характеризовался длительным непрерывным выделением фармацевтически эффективного количества оланзапина или его памоата или сольвата в течение периода более 7 дней, более предпочтительно, по крайней мере, 14 дней, наиболее предпочтительно до 30 дней с первоначальным выделением менее 15% активного ингредиента. Термин первоначальное выделение" специалисты понимают как немедленное выделение активного ингредиента. Кроме того, предпочтительный препарат допускает введение через иглу 21 размера или меньшую при вводимом объеме 2 мл или менее. Другие необходимые характеристики включают применение наполнителей,которые приемлемы токсикологически и фармацевтически. Желательно, чтобы препараты представляли собой стандартные дозированные формы, предпочтительно удобные для подкожного или внутримышечного введения. Заявленные здесь препараты можно применять по одному или в комбинации друг с другом. В зависимости от выбранного носителя заявленные здесь препараты могут быть особенно полезны для быстро действующего внутримышечного применения или как пролонгирующие препараты. Препараты оланзапина с маслянистым носителем полезны как в комбинации с холестериновыми микросферами (до 50 мас.% на единицу объема), так и сами по себе без использования микросфер. Холестериновые микросферы можно также смешивать с маслянистым носителем и водой в количестве до 50 мас.% включительно на стандартный объем инъекции в зависимости от типа используемых наполнителей. Приведенные далее примеры даны с целью иллюстрации и не ограничивают области заявленного изобретения. Получение 1. Оланзапин технической чистоты. 17 Промежуточный продукт 1 В подходящую трехгорлую колбу добавляют следующее: Диметилсульфоксид (аналитический): 6 объемов Промежуточный продукт 1 : 75 гN-Метилпиперазин (реагент) : 6 эквивалентов Промежуточный продукт 1 можно получить, применяя известные специалистам способы. Получение промежуточного продукта 1 представлено, например, в патенте '382. Для удаления образующегося в реакции аммиака добавляют находящийся под поверхностью трубопровод для барботирования азота. Реакционную смесь нагревают до 120 С и поддерживают такую температуру в течение реакции. Реакцию отслеживают методом высокоэффективной жидкостной хроматографии до тех пор, пока останется непрореагировавшим примерно 5% промежуточного продукта 1. По завершении реакции смеси дают медленно охладиться до 20 С (около 2 ч). Затем переносят реакционную смесь в подходящую трехгорлую круглодонную колбу и помещают на водяную баню. К этому раствору добавляют при перемешивании 10 объемов метанола реагентной чистоты и перемешивают реакционную смесь при 20 С в течение 30 мин. Медленно в течение примерно 30 мин добавляют три объема воды. Реакционную пасту охлаждают до 0-5 С и перемешивают в течение 30 мин. Продукт отфильтровывают и влажный остаток на фильтре промывают охлажденным метанолом. Влажный остаток на фильтре сушат в вакууме при 45 С в течение ночи. Продукт идентифицируют как технический оланзапин. Выход: 76,7%; активность 98,1%. Получение 2. Форма II. Образец весом 270 г 2-метил-4-(4-метил-1 пиперазинил)-10 Н-тиено[2,3-b][1,5]бензодиазепина технической степени чистоты суспендируют в безводном этилацетате (2,7 л). Смесь нагревают до 76 С и поддерживают эту температуру в течение 30 мин. Дают смеси охладиться до 25 С. Конечный продукт выделяют, применяя вакуумное фильтрование. Используя метод рентгенографического анализа порошка идентифицируют этот продукт как форму II. Выход: 197 г. Способ, описанный выше для получения формы II, обеспечивает фармацевтически изящный продукт с активностью 97%, общим содержанием относящихся к делу веществ 0,5% и выходом выделенного продукта 73%. Получение 3. Получение 2-метил-4-(4 метил-1-пиперазинил)-10 Н-тиено-[2,3-b][1,5] бензодиазепин памоата (оланзапин памоата). А. Оланзапин (3,12 г, 0,01 коль) растворяют при нагревании в тетрагидрофуране (50 мл). Памовую кислоту (3,88 г, 0,01 моль) растворяют 18 при нагревании в тетрагидрофуране (100 мл). Эти два раствора смешивают и фильтруют через слой целита, продолжая нагревание. Желтый раствор переносят в колбу Buchi и выпаривают при пониженном давлении (температура бани 50 С). После удаления примерно 50 мл растворителя в колбу вводят этанол (50 мл) и продолжают выпаривание. Собрав еще 50 мл растворителя, вводят еще 50 мл этанола. Выпаривание продолжают до начала кристаллизации. Желтые кристаллы собирают фильтрованием и сушат при высоком вакууме и температуре 120 С. Т. пл. 203-205 С. Идентифицируют методами 1H ЯМР, 13 С ЯМР и масс-спектроскопии. ВЭЖХ - чистота 99,61%. Спектр 1H ЯМР: 8,4, с, 2 Н; 8,2, д, 2 Н; 7,9,с, 1 Н; 7,8, д, 2 Н; 7,2, т, 2 Н; 7,1, т, 2 Н; 6,9, м, 2 Н; 6,7, м (т), 1 Н; 6,4, с, 1 Н; 4,8, с, 2 Н; 3,6, широкий,4 Н; 3,3, широкий, 4 Н; 2,8, с, 3H; 2,3, с, 3H. Спектр 13 С ЯМР: 171,4, 156,6, 154,6, 154,5,143,7, 138,2, 135,1, 129,5, 128,9, 128,0, 126,9,126,6, 125,8, 124,0, 123,1, 122,9, 121,8, 121,6,119,3, 118,5, 117,8, 115,9, 51,9, 43,6, 42,0, 19,3,14,4. Получение 4. Получение диметанолата 2 метил-4-(4-метил-1-пиперазинил)-10 Н-тиено[2,3-b][1,5]бензодиазепин памоата (диметанолата оланзапин памоата). В химический стакан на 250 мл, снабженный магнитной мешалкой, добавляют диметилсульфоксид (ДМСО) (10 мл, 0,636 моль), памовую кислоту (2,49 г, 6,41 моль) и оланзапин (2,0 г, 6,41 моль). Пасту перемешивают при 20-25 С для растворения. Этот раствор добавляют за 10 мин в трехгорлую колбу на 250 мл, снабженную механической мешалкой и содержащую метанол(100 мл) при 25 С. Вскоре после начала добавления к метанолу раствор становится мутным,так как начинают образовываться кристаллы. Количество твердого вещества увеличивается при продолжении добавления. По завершении добавления примерно за 15 мин доводят температуру до 5 С и перемешивают в течение 120 мин. Пасту фильтруют. Колбу и влажный остаток на фильтре промывают метанолом (25 мл). Продукт сушат в вакууме в течение ночи при 50 С, получая 4,61 г диметанолата оланзапин памоата, как идентифицировано способами рентгеновской дифракции порошка (XRPD),термогравиметрического анализа (TGA) (8,2%),газовой хроматографии (GC) (8,6% метанол) и ядерного магнитного резонанса (ЯМР) (1:1 соль). Получение 5. Получение ТГФ-сольвата 2 метил-4-(4-метил-1-пиперазинил)-10 Н-тиено[2,3-b][1,5]бензодиазепин памоата (ТГФ-сольвата оланзапин памоата). В трехгорлую колбу на 250 мл, снабженную магнитной мешалкой, добавляют тетрагидрофуран (ТГФ) (60 мл), памовую кислоту (2,49 г, 6,41 моль) и оланзапин (2,0 г, 6,40 моль). Эту 19 пасту перемешивают при 20-25 С для растворения (примерно 20 мин). К ТГФ-раствору добавляют за 10 мин метанол (30 мл). Как только добавление завершено, половину пасты фильтруют. Влажный остаток на фильтре (1) сушат в вакууме в течение ночи при 50 С, получая 2,07 г. Оставшуюся пасту перемешивают в течение 2 ч при комнатной температуре и фильтруют. Затем влажный остаток на фильтре (2) сушат в вакууме в течение ночи при 50 С, получая 2,16 г. В обоих случаях выделенный материал идентифицируют как ТГФ-сольват оланзапин памоата способами рентгеновской дифракции порошка (XRPD), термогравиметрического анализа(TGA) (12,7-13,5%) и ядерного магнитного резонанса (ЯМР) (12,1-12,9% ТГФ, 1:1 соль). Получение 6. Получение моногидрата 2 метил-4-(4-метил-1-пиперазинил)-10 Н-тиено[2,3-b][1,5]бензодиазепин памоата (моногидрата оланзапин памоата). В подходящий химический стакан, снабженный магнитной мешалкой, добавляют диметилсульфоксид (22 мл), памовую кислоту (2,49 г, 6,41 моль) и оланзапин (2,0 г, 6,40 моль). Эту пасту перемешивают при 20-25 С для растворения (примерно 20 мин). Раствор добавляют за 20 мин в трехгорлую колбу на 250 мл, снабженную механической мешалкой и содержащую воду(96 мл) при 40 С. По завершении добавления пасту перемешивают примерно 20 мин при 40 С, охлаждают примерно за 30 мин до 2025 С, фильтруют и промывают водой (25 мл). Продукт сушат в вакууме при 50 С, получая 4,55 г моногидрата оланзапин памоата, который идентифицируют способами рентгеновской дифракции порошка (XRPD), термогравиметрического анализа (TGA) (3,0%) и титрометрического анализа (KF=3,2%). Получение 7. А. Получение ацетонового сольвата бис(2-метил-4-(4-мeтил-1-пиперазинил)10 Н-тиено[2,3-b][1,5]бензодиазепин)памоата (ацетонового сольвата бис(оланзапин)памоата). В трехгорлую колбу на 100 мл, снабженную мешалкой, добавляют ацетон (10 мл), памовую кислоту (1,25 г, 3,22 моль) и оланзапин(2,0 г, 6,4 моль). Эту пасту перемешивают при 20-25 С примерно 60 мин и фильтруют. Влажный остаток на фильтре промывают ацетоном (5 мл). Продукт сушат в вакууме при 40 С, получая ацетоновый сольват бис(оланзапин)памоата(3,24 г), который идентифицируют способами рентгеновской дифракции порошка (XRPD),термогравиметрического анализа (TGA) (7,0%) и ЯМР (3,7% ацетон, 2:1 соль). В. Получение ацетонового сольвата бис(2 метил-4-(4-метил-1-пиперазинил)-10 Н-тиено[2,3b][1,5]бензодиазепин)памоата (ацетонового сольвата бис(оланзапин)памоата). В трехгорлую колбу на 100 мл, снабженную мешалкой, добавляют диметилсульфоксид(10,8 мл) и памовую кислоту (3,75 г, 9,65 моль). Эту пасту перемешивают при 20-25 С для рас 002825 20 творения. Раствор добавляют за 15-20 мин в трехгорлую колбу на 250 мл, снабженную механической мешалкой и содержащую ацетон (150 мл) и оланзапин (6,0 г, 19,2 моль) при 50 С. По завершении добавления пасту перемешивают примерно 20 мин при 50 С. Пасту охлаждают до 20-25 С примерно за 60 мин, перемешивают в течение 60 мин и фильтруют. Влажный остаток на фильтре промывают ацетоном (15 мл). Из половины влажного остатка в течение 2 ч при 20-25 С готовят пасту в ацетоне (54 мл), фильтруют и промывают ацетоном (10 мл). Продукт сушат в вакууме при 35-40 С, получая ацетоновый сольват бис(оланзапин)памоата (4,54 г),который идентифицируют способами рентгеновской дифракции порошка (XRPD), термогравиметрического анализа (TGA) (5,8%), газовой хроматографии (GC) (5,57% ацетон) и ЯМР (2:1 соль). Получение 8. Получение моногидрата бис[2,3-b][1,5]бензодиазепин)памоата(моногидрата бис(оланзапин)памоата). В трехгорлую колбу на 100 мл, снабженную мешалкой, добавляют диметилсульфоксид(10,8 мл) и памовую кислоту (3,75 г, 9,65 моль). Эту пасту перемешивают при 20-25 С для растворения. Раствор добавляют за 15-20 мин в трехгорлую колбу на 250 мл, снабженную механической мешалкой в содержащую ацетон (150 мл) и оланзапин (6,0 г, 19,2 моль) при 50 С. По завершении добавления пасту перемешивают примерно 20 мин при 50 С. Пасту охлаждают до 20-25 С примерно за 60 мин, перемешивают в течение 60 мин и фильтруют. Влажный остаток на фильтре промывают ацетоном (15 мл). Половину влажного остатка сушат в вакууме при 3540 С, получая моногидрат бис(оланзапин) памоата (5,01 г), который идентифицируют способами рентгеновской дифракции порошка(2:1 соль). Получение 9. Получение (2-метил-4-(4 метил-1-пиперазинил)-10 Н-тиено-[2,3-b][1,5] бензодиазепин)дигидрата D. Образец оланзапина технической чистоты весом 100 г (см. получение 1) суспендируют в воде (500 мл). Смесь перемешивают примерно при 25 С около 5 дней. Продукт выделяют,применяя вакуумное фильтрование, и идентифицируют как оланзапин дигидрат D, применяя способ рентгеновской дифракции порошка. Выход: 100 г. Потеря массы по данным термогравиметрического анализа составляет 10,2%. Получение 10. Получение (2-метил-4-(4 метил-1-пиперазинил)-10 Н-тиено-[2,3-b][1,5] бензодиазепин)дигидрата Е. Образец оланзапина технической чистоты весом 0,5 г суспендируют в этилацетате (10 мл) и толуоле (0,6 мл). Смесь нагревают до 80 С до 21 полного растворения твердого вещества. Раствор охлаждают до 60 С и медленно добавляют воду (1 мл). Когда раствор охлаждают до комнатной температуры, образуется кристаллическая паста. Продукт выделяют, применяя вакуумное фильтрование, и сушат при комнатных условиях. Этот продукт идентифицируют как Дигидрат Е, применяя способ рентгеновской дифракции порошка и 13 С ЯМР в твердом теле. Потеря массы по данным термогравиметрического анализа составляет 10,5%. Выход: 0,3 г. Получение 11. Получение (2-метил-4-(4 метил-1-пиперазинил)-10 Н-тиено-[2,3-b][1,5] бензодиазепин)дигидрата В. Образец оланзапина технической чистоты весом 10 г суспендируют в воде (88 мл). Смесь перемешивают при температуре примерно 25 С в течение 6 ч. Продукт выделяют, применяя вакуумное фильтрование. Этот продукт идентифицируют как оланзапин дигидрат Е, применяя способ рентгеновской дифракции порошка. Выход: 10,86 г. В примерах, приведенных ниже в таблицах, используют следующие сокращения: О = неопределенный размер частиц оланзапина;O-F = мелко размолотый оланзапин; размер частиц менее 5 м;OPDM-C = грубо размолотый диметанольный сольват оланзапин памоата; размер частиц 20-60 м;OPDM-F = мелко размолотый диметанольный сольват оланзапин памоата; размер частиц менее 5 м; ОРМН = моногидрат оланзапин памоата;OPMH-F = мелко размолотый моногидрат оланзапин памоата; размер частиц менее 5 м; ВОРМ или ВОРBOPM-F или BOP-F = мелко размолотый моногидрат бис-(оланзапин)памоата; размер частиц менее 5 м;PEG 200 = полиэтиленгликоль со средней молекулярной клеточной массой 200;NаСМС = натрий карбоксиметилцеллюлоза натриевая соль; 22 мер пропиленоксида и этиленоксида. Пропиленоксидный блок расположен между 2-я этиленоксидными блоками в чередующихся слоях. Полиоксиэтиленовые группы являются концевыми группами полипропиленовой цепи. НО(СН 2 CH2O)а(СНСН 3 СН 2 О)b(СН 2 СН 2 О)сН. Буквенное обозначение объясняет физическое состояние продукта: "L" для жидкостей,"Р" для паст, "F" для твердых форм. Первая цифра (две цифры в трехзначном номере) является числовым обозначением, которое при умножении на 300 показывает приблизительную молекулярную массу гидрофобного вещества. Последняя цифра, будучи умноженной на 10,указывает приблизительное содержание в молекуле этиленоксида.NF = National Formulary = удовлетворяет стандартам для полаксамеров (polaxamers), которые являются общим обозначением для PHIRONICS;MIGLYOL 810 = триглицериды фракционированных растительных жирных кислот С 8 и С 10 (каприловая/каприновая кислоты);MIGLYOL 812 = отличается от 810 только соотношением С 8/С 10. Имеет более высокое содержание С 10 и вязкость, и более высокую точку помутнения;MIGLYOL 840 = пропиленгликолевый диэфир насыщенных жирных кислот с длиной цепи С 8 и С 10 (каприловая/каприновая кислоты);CREMAPHOR EL = производное касторового масла и полиэтоксилированного этиленоксидом касторового масла. Смесь гидрофобной части, содержащей эфиры рицинолеиновой кислоты, эфиры глицерина и полигликолей и касторовое масло, и гидрофильной части, содержащей полиэтиленгликоль и этоксилированный глицерин;CREMAPHOR RH40 = 40 молей этиленоксида на моль гидрированного касторового масла;CREMAPHOR RH60 = 60 молей этиленоксида на моль гидрированного касторового масла;Tween 20 = полиоксиэтилен 20 сорбитан монолаурат, сложный эфир лаурат сорбита. 20 означает, что 20 молей этиленоксида сополимеризовано с одним молем сорбита;Tween 80 = полиоксиэтилен 80 сорбитан моноолеат, сложный эфир олеат сорбита. 80 означает, что 80 молей этиленоксида сополимеризовано с одним молем сорбита. Пример 1. PLURONICS : PLURONICHLPC-чистоты. Смесь периодически перемешивают шпателем и охлаждают в морозильнике. Для способствования разрушению нерастворившегося вещества используют акустическую установку. Смесь охлаждают и перемешивают до получения прозрачного раствора. ОланзапинPLURONIC . До использования смесь хранят охлажденной. Следующие примеры получают, применяя процедуру, по существу аналогичную описанной в примере 1. Активн.SDHВ смешивают вместе при помощи шпателя в химическом стакане до гомогенности. Отвешивают в стакан перемолотый оланзапин(150 г). Добавляют раствор SDHB (5 мл) и перемешивают шпателем до однородного распределения оланзапина в носителе. Следующие примеры получают, применяя процедуру, по существу аналогичную описанной в примере 13. Активн. Пример 19. Chitosan: В химический стакан помещают воду (70 г). Добавляют молочную кислоту (1 г), затем 2 г Chitosan и наконец 300 мг оланзапина. Смесь перемешивают шпателем до однородности. 24 Следующие примеры получают, применяя процедуру, по существу аналогичную описанной в примере 19. Актив. Пример 22. CHITOSAN: Отвешивают в химический стакан воду (25 г). Добавляют молочную кислоту (0,5 г), затем 765 мг оланзапина и наконец 1 г CHITOSAN. Смесь перемешивают шпателем до однородности. Следующие примеры получают, применяя процедуру, по существу аналогичную описанной в примере 22. Актив. Пример 25. Смешанный: в химический стакан помещают NaCMC (натрий карбоксиметилцеллюлозу) (2 г) и добавляют 100 мл воды. Смесь перемешивают при комнатной температуре магнитной мешалкой на пластине для перемешивания до растворения твердого вещества. В химический стакан отвешивают оланзапин(150 мг) и добавляют 4,85 мл NaCMC-носителя. Смесь перемешивают шпателем до гомогенного смешивания. Непосредственно перед использованием препарат повторно суспендируют путем встряхивания или перемешивания. Следующие примеры получают, применяя процедуру, по существу аналогичную описанной в примере 25. Пример 28. Масло: в химический стакан помещают перемолотый оланзапин (120 мг) и добавляют 3,88 мл масла MIGLYOL 812. Смесь перемешивают шпателем до однородности. В препарате легко осаждаются твердые вещества, поэтому непосредственно перед применением препарат повторно суспендируют путем встряхивания или перемешивания. Следующие примеры получают, применяя процедуру, описанную в примере 28.MIGLYOL 812 Кунжутное масло Кунжутное масло Кунжутное масло Кунжутное масло Кунжутное масло, 0.5 г моностеаратнежелатированный Кунжутное масло; моностеарат (30 мг/мл.) нежелатированный 95%MIGLYOL 840,5% олеиновая кислота 90% кунжутное масло,10% олеиновая кислота Пример 61. Воск/Масло: отмеряют в химический стакан белый воск (400 мг) и добавляют 3,6 г масла MIGLYOL 812. Смесь нагревают на водяной бане при температуре примерно 80 С до плавления воска. Затем перемешивают шпателем до гомогенности. Добавляют в химический стакан перемолотый оланзапин (1 г) и перемешивают шпателем до гомогенного смешивания. Смеси дают охладиться до комнатной температуры при перемешивании. Следующие примеры получают, применяя процедуру, по существу аналогичную описанной в примере 61. В некоторых случаях для уменьшения размеров больших частиц и агрегатов активного ингредиента смесь гомогенизируют при помощи ручного гомогенизатора. Пример 57. Желатинированное масло: для желатинирования масла в колбу с 475 г кунжутного масла добавляют 25 г моностеарата алюминия. Масло перевешивают при помощи статического миксера с пропеллером из нержавеющей стали при нагревании на масляной бане до 155 С в течение 20 мин. Во время этого процесса через систему пропускают газообразный азот. Затем маслу дают охладиться до комнатной температуры. В химический стакан отвешивают перемолотый оланзапин (120 г) и добавляют 3,88 мл желатинированного кунжутного масла. Смесь хорошо перемешивают шпателем до гомогенности. Следующие примеры получают, применяя процедуру, по существу аналогичную описанной в примере 57. Пример 41. Олеиновая кислота: нагревают вместе олеиновую кислоту (0,54 мл) и 300 мг оланзапина. Затем добавляют масло MIGLYOL 840 (9,2 мл) и растворяют все твердые вещества при слабом нагревании. Следующие примеры получают, применяя процедуру, по существу аналогичную описанной в примере 41.BOPM-F 90% MIGLYOL 812, 10% ацетоновый белый воск сольват(NMР). Затем добавляют лецитин (9 мл) и хорошо перемешивают шпателем в течение примерно 15 мин, получая гомогенную смесь. Пример 100. Холестерин/POVIDON USP(К-30)/этилцеллюлоза/NМР: Оланзапин (500 мг), этилцеллюлозу (0,062 г) и NMP (5 мл) хорошо перемешивают и слабо нагревают в течение 2-3-мин до получения прозрачного раствора. Затем добавляют POVIDON OSP (К-30)(К-30)/этилцеллюлоза/NMP: отвешивают в химический стакан на 25 мл холестерин (2,475 г),POVIDON OSP (К-30) (0,3098 г), 0,062 г этилцеллюлозы и 9,1686 г NMP. Содержащиеся в стакане вещества тщательно смешивают и слегка нагревают для растворения всех нераство 28 рившихся материалов. Предусмотрительно используют минимально продолжительное нагревание, необходимое для растворения. Прозрачный раствор охлаждают и добавляют к нему 500 мг оланзапина, который тщательно перемешивают, получая прозрачный светло-желтый раствор. Пример 102. Лецитин/Холестерин/POVIDON USP (К-30)/этилцеллюлоза/NMP: в химический стакан помещают 0,2511 г POVIDONUSP (К-30). Добавляют к нему 300,5 мг оланзапина грубого помола, 28,5 мг этилцеллюлозы и 2,008 г холестерина. Эту сухую смесь хорошо перемешивают. К сухой смеси добавляют 0,7463 г -токоферола и эту смесь хорошо перемешивают. Добавляют 3,3806 г лецитина, хорошо смешивают. Затем добавляют еще 3,0825 г лецитина и снова хорошо перемешивают смесь. Пример 103. Лецитин/холестерин/POVIDON USP (К-30)/этилцеллюлоза/NMP: оланзапин грубого помола (300,7 мг), 2,5821 г NMР и 25,4 мг этилцеллюлозы хорошо перемешивают. К этому добавляют 248,0 мг POVIDON USP (К 30), 2,0008 г холестерина и 2,6020 г лецитина. Препарат хорошо перемешивают. Разделившуюся на слои смесь нагревают в течение 5 мин на бане с температурой 37 С. Мягкий препарат в виде кома коагулирует в густом растворе. Добавляют лецитин (2,5074 г) и хорошо перемешивают. По-видимому, со временем препарат теряет гелеподобную коагуляцию и образует суспензию оланзапина. Следующие примеры получают, применяя процедуру, по существу аналогичную описанной выше в примерах 97-103. Пример 118. Оланзапин-холестериновая микрочастица. 5 г (1%) поливинилового спирта (PVA) добавляют к 500 мл деионизированной воды. Раствор перемешивают при помощи магнитной мешалки и нагревают в течение нескольких часов, пока не растворится весь PVA. Смеси дают охладиться до комнатной температуры. Раствор выливают в плоский пластиковый контейнер и перемешивают при помощи верхней мешалки при 450 об./мин. Растворяют 1,2 г оланзапина и 8,8 г холестерина в 100 мл метиленхлорида. Добавляют раствор PVA и смесь перемешивают в течение 18 ч. Сбор микрочастиц: Способ 1: раствор PVA/оланзапина выливают через сита 100 и 230 меш (стандарт США),соответственно. Фракции с крупными и мелкими частицами отбрасывают. Частицы смывают водой из сита 230 в воронку Бюхнера с фильтровальной бумагой Whatman 4 и проводят вакуумное фильтрование. Частицы переносят на чашу весов и оставляют их сохнуть на воздухе. Собирают частицы с размерами: 63 м - 150 м. 30 Способ 2: проводят вакуумное фильтрование раствора PVA/оланзапина на воронке Бюхнера через фильтровальную бумагу Whatman 4 и промывают остаток водой. Частицы переносят на чашу весов и оставляют их сохнуть на воздухе. Сухие частицы просеивают через сито 30 меш (стандарт США), удаляя все большие частицы. Способ 3: раствор PVA/оланзапина выливают через сито 230 меш (стандарт США). Частицы смывают из этого сита водой в воронку Бюхнера с фильтровальной бумагой Whatman 4 и проводят вакуумное фильтрование. Частицы переносят на чашу весов и оставляют их сохнуть на воздухе. Собирают частицы с размерами: 63 м. Способ 4: раствор PVA/оланзапина выливают через сито 230 меш (стандарт США). Частицы смывают из этого сита водой в воронку Бюхнера с фильтровальной бумагой Whatman 4 и проводят вакуумное фильтрование. Частицы переносят на чашу весов и оставляют их сохнуть на воздухе. Сухие частицы просеивают через сито 100 меш (стандарт США). Собирают частицы с размерами: 63 м - 150 м. Способ 5: раствор PVA/оланзапина выливают через сито 100 меш (стандарт США). Частицы смывают из этого сита водой в воронку Бюхнера с фильтровальной бумагой Whatman 4 и проводят вакуумное фильтрование. Частицы переносят на чашу весов и оставляют их сохнуть на воздухе. Собирают частицы с размерами: 150 м. Пропущенный через сито растворPVA/оланзапина центрифугируют и декантируют. Проводят вакуумное фильтрование частиц на воронке Бюхнера с фильтровальной бумагойWhatman 4, переносят их на чашу весов и сушат на воздухе. Собирают частицы с размерами: 150 м. Способ 6: проводят вакуумное фильтрование раствора PVA/оланзапина на воронке Бюхнера через фильтровальную бумагу Whatman 4 и промывают водой. Частицы переносят на чашу весов и оставляют их сохнуть на воздухе. Продукт исследуют на активность способом высокоэффективной жидкостной хроматографии. Время Сбор микроперечастиц меш., ч 18 Гравитац. фильтр, сушка на возд.,просеив. через 30 меш 4 Способ 2 Холест Холест Холест Холест Холест Холест Холест ацетат Холест ацетат Холест ацетат Холест гемисукцинат Холест гемисукцинат Холест гемисукцинат Холест гемисукцинат Холест гемисук цинат Холест гемасукцинат Холест гемисукцинат Холест гемисукцинат Холест олеат Холест олеат Холест пальмитат Холест пальмитат Холест пальмитат Можно оставить на ночь в PVA,Способ 1 Способ 1(13%) 40 мл CH2Cl2 250 мл 1% PVA 400 в течеСпособ 2 стеарат ние ночи"100230=(ХХХ%)" указано для просеянной массы с диапазоном размеров частиц менее 100 меш и более 230 меш. Этот порог просеивания исследован для приведенного процента активности."150= (ХХХ%)150= (ХХХ%)" указано для порога просеивания, отсекающего частицы больше 150 u= исследованная концентрация оланзапина, и для порога просеивания, отсекающего частицы, менее 150 u= исследованная концентрация оланзапина. 161(Kgf/cm3). Микрочастицы собирают на выходе в пробирку, просеивают, отделяя частицы с размерами 63150 м, и исследуют их на активность методом высокоэффективной жидкостной хроматографии. Следующие примеры получают, применяя процедуру, по существу, аналогичную описанной выше в примере 164.(0,5 г, размолотый) и 4,5 г холестерина растворяют в 50 мл метиленхлорида. Этот раствор сушат распылением, используя лабораторный осушитель Yamato для сушки распылением с осушительной колонкой 60 см длины. В осушителе устанавливают следующие условия: температура на входе = 50 С, температура на выходе = 33 С, объем воздуха = 55 м 3, объем распыляемого спрея (spray atomizing volume) = 0,55 кгС/см 3. Краткое содержание способов Препараты смешивают и загружают в шприцы на 5 мл. От имеющейся в распоряжении пластиковой пипетки отрезают кончик и прилаживают его на шприц. Трубки для диализа разрезают на части длиной 5-6 см и хранят влажными в химическом стакане с водой. Один конец трубок пережимают при помощи зажима. На весах определяют вес каждой трубки и распределяют в них из шприца по 1 мл препарата. Открытый конец трубки пережимают и определяют конечный вес. Заполненные трубки для диализа помещают в сосуды для растворения на 900 мл, заполненные физиологическим раствором Dulbecco с фосфатным буфером, рН 7,4 при 37 С. Сосуды помещают в аппарат Vankel для растворения с лопастями, вращающимися при 50 об./мин. Образцы вынимают рукой, останавливая вращение лопастей и отбирая пипеткой аликвотные образцы объемом 2 мл. Образцы отбирают через 2, 4, 8, 12, 24, 48 ч и затем с интервалами в 24 ч в течение периода от 48 ч до 4 недель. Для образцов, отобранных через 2, 4, 8 и 12 ч, среду заменяют на 2 мл свежего буфера. Каждые 24 ч весь объем среды заменяют на свежую среду, предварительно нагретую до 37 С. Образцы помещают прямо в пробирки для высокоэффективной жидкостной хроматографии (ВЭЖХ) и исследуют на активность методом ВЭЖХ. Препараты проверяли, применяя описанное выше исследование выделения активного компонента, и обнаружили, что они имеют приемлемую скорость длительного непрерывного выделения в течение периода от 48 ч до 4 недель. Исследование на кроликах Для оценки хранящихся препаратов выбирают новозеландских белых кроликов, потому что размер их ножных мышц облегчает введение дозы и оценку места инъекции. Для каждого препарата используют трех кроликов одного пола, выбор основан на доступности. Возраст кроликов, по крайней мере, 5 месяцев, а вес от 2,5 до 5 кг. Кроликам делают разовую инъекцию в двуглавую мышцу бедра(biceps femoris) иглой 20-ого или 21-ого размера. Объем дозы варьируется в зависимости от концентрации препарата, но не превышает 2 мл на инъекцию. Кроликам вводят 10 мг оланзапина/кг веса тела. В пробирки для сбора со сниженной свертываемостью крови (heparinized collection tubes) берут образцы крови из средней ушной артерии или шейной вены, один раз до введения дозы и через 4 ч после введения дозы, а затем раз в день через 1, 2, 7, 10 и 14 дней. Собирают плазму и определяют методом высокоэффективной жидкостной хромато-графии концентрацию оланзапина в плазме. Препараты этого изобретения проверены в исследовании на кроликаx, обнаружено, что они 35 показывают эффективные концентрации оланзапина до 14 дней. Исследование на собаках Выбирают гончую собаку, потому что многое известно о фармакокинетике оланзапина у собак. Поскольку фармакокинетика оланзапина не зависит от пола животных, то выбор делают независимо от пола. Для каждого препарата используют трех собак (самцов или самок). Собаки взрослые (возраст 6 месяцев), вес от 8 до 21 кг. Собакам делают разовую инъекцию в ягодичную мышцу или двуглавую мышцу бедра (biceps femoris) иглой 20-ого или 21 ого размера. Объем дозы варьируется в зависимости от концентрации препарата, но не превышает 2 мл на инъекцию. Собакам вводят 10 мг оланзапина/кг веса тела. В каждый момент времени берут образцы крови объемом 2 мл из шейной вены в пробирки для сбора со сниженной свертываемостью крови(heparinized collection tubes). Образцы берут один раз до введения дозы и в различные моменты времени после введения дозы в течение 28 дней. Обычно кровь берут через 0,5, 1, 2, 4, 8 и 24 ч после введения дозы и один раз в день через 2, 4, 7, 14, 21 и 28 дней. Собирают плазму и определяют методом высокоэффективной жидкостной хроматографии концентрацию оланзапина в плазме. Препараты настоящего изобретения проверены в исследовании на собаках, обнаружено,что они показывают эффективные концентрации оланзапина до 28 дней. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Препарат, содержащий оланзапин, или его соль памовой кислоты, или сольват в качестве активного ингредиента, и один или более носителей, выбранных из группы, состоящей из маслянистого носителя или носителя в виде холестериновых микросфер, при условии, что,если носитель представляет собой маслянистый носитель, активным ингредиентом является памоат оланзапина или его сольват. 2. Препарат по п.1, отличающийся тем, что обладает длительным непрерывным выделением в течение периода более 7 дней и первоначальным выделением менее 15% активного ингредиента. 3. Препарат по п.1, отличающийся тем, что указанный носитель является маслянистым носителем. 4. Препарат по п.1, отличающийся тем, что указанный носитель выбирают из группы, состоящей из неионных поверхностно-активных веществ - блоксополимера пропиленоксида и этиленоксида, целлюлозных смол, полисахаридных смол, растительных масел, рафинированных фракционированных масел, диацетатгексаизобутирата сахарозы, хитозана, лецитина и поливинилпирролидона. 5. Препарат по п.4, отличающийся тем, что указанный носитель выбирают из группы, со 002825 36 стоящей из неионных поверхностно-активных веществ - блоксополимера пропиленоксида и этиленоксида, целлюлозных смол, полисахаридных смол, растительных масел, рафинированных фракционированных масел. 6. Препарат по п.2, отличающийся тем, что дополнительно включает один или более фармацевтически приемлемых наполнителей. 7. Препарат по п.6, отличающийся тем, что фармацевтически приемлемый наполнитель выбирают из группы, состоящей из гелеобразующего агента и антигидратанта. 8. Препарат по п.7, отличающийся тем, что включает моногидрат оланзапин памоата, триглицериды фракционированных растительных жирных кислот и белый воск. 9. Препарат по п.1, отличающийся тем, что оланзапин представляет собой, по существу, чистую полиморфную форму II, имеющую типичную порошковую рентгенограмму как представлено следующими межплоскостными расстояниями:d10,2689 8,577 7,4721 7,125 6,1459 6,071 5,4849 5,2181 5,1251 4,9874 4,7665 4,7158 4,4787 4,3307 4,2294 4,141 3,9873 3,7206 3,5645 3,5366 3,3828 3,2516 3,134 3,0848 3,0638 3,0111 2,8739 2,8102 2,7217 2,6432 2,6007 10. Препарат по п.1, отличающийся тем,что носитель представляет собой холестериновую микрочастицу. 11. Препарат по п.10, отличающийся тем,что микрочастица является микросферой. 12. Препарат по п.10, отличающийся тем,что холестерин выбирают из группы, состоящей из холестерина, холестерин пальмитата, холе 37 стерин олеата, холестерин стеарата и холестерин гемисукцината. 13. Препарат по п.11, отличающийся тем,что микросферы имеют размер от 20 до 500 м. 14. Препарат по п.13, отличающийся тем,что размер частиц составляет от 30 до 200 м. 15. Препарат по п.14, отличающийся тем,что размер частиц составляет от 40 до 100 м. 16. Препарат по п.11, отличающийся тем, что микросферы вводятся в маслянистом носителе. 17. Препарат по п.16, отличающийся тем, что маслянистый носитель выбирают из группы, состоящей из неионных поверхностно активных веществ - блоксополимера пропиленоксида и этиленоксида, целлюлозных смол, полисахаридных смол,растительных масел и рафинированных фракционированных масел. 18. Препарат по п.1 в виде пролонгированной дозированной формы. 19. Препарат по п.1 в виде быстро действующей дозированной формы для внутримышечного введения. 20. Препарат по п.1, отличающийся тем, что активный ингредиент выбирают из группы, состоящей из оланзапина, оланзапин дигидрата D, оланзапин памоата, диметанолата оланзапин памоата, моногидрата оланзапин памоата, ТГФ-сольвата оланзапин памоата,ацетонового сольвата бис(оланзапин)памоата и моногидрата бис(оланзапин)памоата. 21. Препарат по п.20, отличающийся тем,что активный ингредиент перемолот. 22. Препарат по п.21, отличающийся тем,что размер частиц составляет от 20 до 60 м. 23. Препарат по п.21, отличающийся тем,что размер частиц составляет от 5 до 20 м. 24. Препарат по п.21, отличающийся тем, что размер размолотых частиц составляет менее 5 м. 25. Препарат по п.20, отличающийся тем,что активный ингредиент представляет собой моногидрат оланзапин памоата, имеющий порошковую рентгенограмму как представлено следующими межплоскостными расстояниями: 4,48 18 4,35 23 4,29 31 4,24 32 4,09 71 4,02 84 3,98 73 3,81 23 3,62 14 3,52 30 3,39 11 3,25 12 2,90 15 2,85 13 26. Препарат по п.20, отличающийся тем, что активный ингредиент представляет собой моногидрат бис(оланзапин)памоата, имеющий типичную порошковую рентгенограмму как представлено следующими межплоскостными расстояниями:
МПК / Метки
МПК: A01N 43/62, C07D 243/10, A61P 25/18
Метки: препарат, 2-метилтиенобензодиазепина
Код ссылки
<a href="https://eas.patents.su/20-2825-preparat-2-metiltienobenzodiazepina.html" rel="bookmark" title="База патентов Евразийского Союза">Препарат 2-метилтиенобензодиазепина</a>
Предыдущий патент: Замещенный 1, 2, 4 – триазоло[3, 4 - а] пиридазин
Следующий патент: Стабильные при хранении водные композиции на базе производных n-фенил-3,4,5,6-тетрагидрофталимидов
Случайный патент: Комбинация ципрофлоксацина и орнидазола в твердой лекарственной форме