Способы лечения аутоиммунных заболеваний с использованием слитой молекулы taci-ig
Номер патента: 15342
Опубликовано: 30.06.2011
Авторы: Несторов Иван, Басби Шарон, Гросс Джейн, Висич Дженнифер, Броли Эрве
Формула / Реферат
1. Способ лечения ревматоидного артрита у пациента, предусматривающий введение пациенту композиции, содержащей слитую молекулу, содержащую:
(i) внеклеточный домен TACI или его фрагмент, который связывает BlyS; и
(ii) константный домен иммуноглобулина человека,
где указанную композицию вводят в количестве от 0,01 до 10 мг/кг массы тела пациента и где указанную композицию вводят в указанном количестве
(i) 7 раз в течение двенадцатинедельного интервала, или
(ii) 3 раза в течение четырехнедельного интервала, или
(iii) каждую вторую неделю в течение 2-30 недель, или
(iv) один раз в неделю.
2. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент имеет аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотам 30-110 аминокислотной последовательности SEQ ID NO: l.
3. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент имеет аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 30-110 аминокислотной последовательности SEQ ID NO: l.
4. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент имеет аминокислотную последовательность, по меньшей мере на 95% идентичную аминокислотам 30-110 аминокислотной последовательности SEQ ID NO: l.
5. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент имеет аминокислотную последовательность, по меньшей мере на 99% идентичную аминокислотам 30-110 аминокислотной последовательности SEQ ID NO: l.
6. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент включает аминокислоты 30-110 аминокислотной последовательности SEQ ID NO: l.
7. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент состоит из аминокислот 30-110 аминокислотной последовательности SEQ ID NO: l.
8. Способ по любому из пп.1-7, где указанный константный домен иммуноглобулина включает модифицированную Fc-часть IgG человека, и указанная слитая молекула предпочтительно представляет собой слитую молекулу TACI-Fc5.
9. Способ по любому из пп.1-8, где указанную композицию вводят в указанном количестве 7 раз в течение двенадцатинедельного интервала.
10. Способ по п.9, где указанную композицию вводят в указанном количестве 7 раз в течение двенадцатинедельного интервала с последующими дополнительными введениями указанной композиции в указанном количестве.
11. Способ по любому из пп.1-8, где указанную композицию вводят в указанном количестве 3 раза в течение четырехнедельного интервала.
12. Способ по п.11, где указанную композицию вводят в указанном количестве 3 раза в течение четырехнедельного интервала с последующими дополнительными введениями указанной композиции в указанном количестве.
13. Способ по любому из пп.1-8, где указанную композицию вводят в указанном количестве каждую вторую неделю в течение 2-30 недель.
14. Способ по любому из пп.1-8, где указанную композицию вводят в указанном количестве один раз в неделю.
15. Способ по любому из пп.1-14, дополнительно предусматривающий одновременное введение пациенту второго лекарственного средства.
16. Способ по п.15, где указанное второе лекарственное средство выбрано из группы, состоящей из гидроксихлорохина, сульфасалазина, метотрексата, лефлуномида, ритуксимаба, инфликсимаба, азатиоприна, D-пеницилламина, золота (перорально или внутримышечно), миноциклина, циклоспорина, кортикостероида, нестероидного противовоспалительного лекарственного средства (NSAIDS), цитокина, антицитокина и интерферона.
17. Способ по любому из пп.1-16, где указанную композицию вводят подкожно, орально или внутривенно.
18. Способ по любому из пп.1-17, где пациентом является человек.
Текст
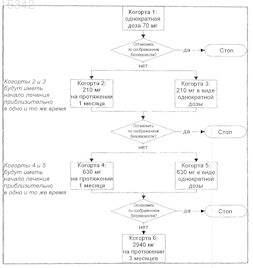
СПОСОБЫ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ С ИСПОЛЬЗОВАНИЕМ СЛИТОЙ МОЛЕКУЛЫ TACI-IG В различных вариантах осуществления настоящее изобретение обеспечивает способы и композиции для лечения аутоиммунных заболеваний, в том числе ревматоидного артрита, например,предусматривающие введение нуждающемуся в таком лечении пациенту слитой молекулы TACIIg. В одном варианте осуществления слитую молекулу TACI-Ig вводят в количестве, достаточном для замедления, супрессии или ингибирования индуцирующих пролиферацию функций BlyS и APRIL. 015342 Перекрестная ссылка на родственные заявки Настоящая заявка претендует на приоритет по предварительной заявке США 60/747270, поданной 15 мая 2006 г., содержание которой включено в настоящее описание в качестве ссылки. Область техники, к которой относится изобретение В различных вариантах осуществления настоящее изобретение относится к способам и композициям для лечения аутоиммунных заболеваний или нарушений иммунной системы, предусматривающим введение слитого белка TACI-Ig, который блокирует функции факторов роста семейства TNF. Уровень техники Семейство лигандов/рецепторов BlyS. Было идентифицировано три рецептора: TACI (трансмембранный активатор или кальциймодулирующий лиганд-взаимодействующий агент циклофилина), ВСМА (антиген созревания В-клеток) и BAFF-R (рецептор В-клеточного активирующего фактора, принадлежащий семейству TNF), которые имеют уникальную аффинность связывания двух факторов роста: BlyS (стимулятора В-лимфоцитов) иAPRIL (индуцирующего пролиферацию лиганда) (Marsters et al. Curr. Biol. 2000; 10(13): 785-788; Thompson et al. Science 2001; 293:2108-2111). TACI и ВСМА связывают как BlyS, так и APRIL, в то время какBAFF-R, по-видимому, способен связывать только BlyS с высокой аффинностью (Marsters et al. Curr.Biol. 2000; 10(13): 785-788; Thompson et al. Science 2001; 293: 2108-2111). В результате, BlyS способен передавать сигнал через все три рецептора, в то время как APRIL, по-видимому, способен передавать сигнал только через TACI и ВСМА. Кроме того, циркулирующие в кровотоке гетеротримерные комплексы BlyS и APRIL (группировки из трех белков, содержащие одну или две копии каждого из BlyS иAPRIL), были идентифицированы в пробах сыворотки, взятых у пациентов с системными иммунопатологическими ревматическими заболеваниями, и было показано, что они индуцируют пролиферацию Вклеток in vitro (Roschke et al. J. Immunol. 2002: 169: 4314-4321). Среди Ig-слитых белков для всех трех рецепторов, только TACI-Fc5 был способен блокировать биологическую активность указанных гетеротримерных комплексов (Roschke et al. J. Immunol. 2002; 169: 4314-4321). BlyS и APRIL являются сильными стимуляторами созревания, пролиферации и выживания В-клеток (Gross et al. Nature 2000; 404: 995999, Gross et al. Immunity 2001; 15(2): 289-302, Groom et al. J. Clin. Invest. 2002; 109(1): 59-68). BlyS иAPRIL могут быть необходимы для персистенции аутоиммунных заболеваний, в частности, заболеваний,в которых участвуют В-клетки. Трансгенные мыши, полученные генной инженерией для экспрессии высоких уровней BlyS, обнаруживают нарушения иммунных клеток и проявляют симптомы, сходные с симптомами, наблюдаемыми у пациентов с системной красной волчанкой (SLE) (Cheson et al. Revisedguidelines for diagnosis and treatment. Blood 1996; 87: 4990-4997, Cheema et al. Arthritis Rheum 2001; 44(6): 1313-1319). Подобным образом увеличенные уровни BlyS/APRIL были измерены в пробах сыворотки,взятых у пациентов с системной красной волчанкой (SLE) и других пациентов с различными аутоиммунными заболеваниями, такими как ревматоидный артрит (Roschke et al. J. Immunol. 2002; 169: 4314-4321;Mariette X., Ann. Rheum. Dis. 2003; 62(2): 168-171; Hahne et al. J. Exp. Med. 1998; 188(6): 1185-1190), что распространяет ассоциацию BlyS и/или APRIL и опосредованных В-клетками заболеваний от моделей животных к людям. Ревматоидный артрит. Ревматоидный артрит (RA) является хроническим воспалительным заболеванием, характеризующимся неспецифическим, обычно симметричным воспалением периферических суставов, потенциально приводящим к прогрессирующей деструкции суставных и околосуставных структур. Приблизительно 1% населения является пораженным, причем женщины поражаются в 2-3 раза чаще, чем мужчины. Хотя точная этиология указанного заболевания является невыясненной, сильное доказательство предполагает, чтоRA является аутоиммунным заболеванием. Несколько аутоантител ассоциированы с RA, в том числе ревматоидный фактор (RF), который часто ассоциируется с более тяжелым заболеванием, антинуклеарные факторы и антитела против нативного коллагена типа II и цитруллинированных пептидов. Заметные иммунологические отклонения от нормы, которые могут быть важными в патогенезе RA,включают в себя иммунные комплексы, обнаруженные в клетках синовиальной жидкости и в васкулите. Указанным комплексам способствуют антитела (такие как RF), продуцируемые плазматическими клетками и хелперными Т-клетками, которые инфильтрируют синовиальную ткань и которые продуцируют провоспалительные цитокины. Макрофаги и их цитокины (например, TNF, GMCS-F) также находятся в избытке в патологическом синовиуме. Повышенные уровни молекул адгезии способствуют миграции воспалительных клеток и их удерживанию в синовиальной ткани. Повышенные уровни происходящих из макрофагов клеток выстилки, а также уровни некоторых лимфоцитов тоже являются избыточными. Роль Т-клеток в патогенезе RA хорошо установлена, в то время как роль В-клеток является менее понятной. Тем не менее, В-клетки играют многочисленные роли в патогенезе RA, включающие в себя действие в качестве антигенпрезентирующих клеток, секрецию провоспалительных цитокинов, продуцирование аутоантител ревматоидного фактора и активацию Т-клеток. Потенциальная роль В-клеток дополнительно подтверждается положительными результатами клинических испытаний тестирования ритуксимаба, моноклонального антитела против CD20, у пациентов с RA, наиболее ясно при предоставлении в комбинации с метотрексатом или циклофосфамидом. Указанные открытия предполагают, что В-1 015342 клетки являются подходящей мишенью для терапевтического вмешательства в RA. Установленные способы лечения RA включают в себя модифицирующие заболевание антиревматические лекарственные средства (DMARD), такие как гидроксихлорохин, сульфасалазин, метотрексат,лефлуномид, ритуксимаб, инфликсимаб, азатиоприн, D-пеницилламин, золото (орально или внутримышечно), миноциклин и циклоспорин, кортикостероиды, такие как преднизон, и нестероидные противовоспалительные лекарственные средства (NSAIDS). Указанные способы лечения являются обычно неспецифическими, часто ассоциированы с серьезными побочными действиями и не влияют существенно на прогрессирование деструкции суставов. Таким образом, имеется давно ощутимая потребность в данной области в развитии новых способов для лечения RA. Сущность изобретения В различных вариантах осуществления настоящее изобретение относится к способам лечения аутоиммунных заболеваний. Иллюстративно, способы согласно изобретению включают в себя введение пациенту композиции, содержащей константный домен иммуноглобулина человека и внеклеточный доменTACI или его фрагмент, который связывает BlyS и/или APRIL. В другом варианте осуществления изобретение включает в себя способы лечения аутоиммунных заболеваний, в том числе RA, с использованием слитой молекулы TACI-Ig, которая содержит внеклеточный домен TACI или любой его фрагмент, который сохраняет способность связывать BlyS и/или APRIL. В другом варианте осуществления изобретение включает в себя способы лечения RA, предусматривающие введение нуждающемуся в этом пациенту эффективного количества слитой молекулы, содержащей константную цепь иммуноглобулина человека и внеклеточный домен TACI или фрагмент внеклеточного домена TACI, который связывает BlyS и/или APRIL. В одном варианте осуществления указанный фрагмент внеклеточного домена TACI содержит один или два повторяющихся мотивов цистеина. В другом варианте осуществления указанным фрагментом является фрагмент, содержащий аминокислоты 30-110 внеклеточного домена TACI. Еще в одном варианте осуществления указанным фрагментом является фрагмент, содержащий аминокислоты 1-154 внеклеточного домена TACI (SEQ ID NO: 1). В другом варианте осуществления изобретение включает в себя способы лечения RA введением пациенту композиции, содержащей слитый полипептид, TACI-Fc5, содержащий константный домен иммуноглобулина человека, Fc5, имеющий последовательность, представленную в виде SEQ ID NO: 2, и внеклеточный домен TACI, имеющий последовательность, представленную в виде SEQ ID NO: 1. Еще в одном варианте осуществления изобретение включает в себя способы лечения RA путем введения пациенту композиции, содержащей слитый полипептид, содержащий константный домен иммуноглобулина человека с последовательностью, представленной в виде SEQ ID NO: 2, и полипептид, который связывает BlyS и/или APRIL и который по меньшей мере на приблизительно 50%, по меньшей мере на приблизительно 60%, по меньшей мере на приблизительно 65%, по меньшей мере на приблизительно 70%, по меньшей мере на приблизительно 75%, по меньшей мере на приблизительно 80%, по меньшей мере на приблизительно 85%, по меньшей мере на приблизительно 90%, по меньшей мере на приблизительно 95% или по меньшей мере на приблизительно 99% идентичен SEQ ID NO: 1. Другие аутоиммунные заболевания можно лечить способами согласно изобретению посредством введения пациенту слитого полипептида, содержащего константную цепь иммуноглобулина человека и внеклеточный домен TACI или фрагмент внеклеточного домена TACI, который связывает BlyS и/илиAPRIL. Такие аутоиммунные заболевания включают в себя, но не ограничиваются ими, системную красную волчанку (SLE), болезнь Грейвса, диабет типа I и типа II, рассеянный склероз, синдром Шегрена,склеродермию, гломерулонефрит, отторжение трансплантата, например, аллотрансплантата органа или ткани или отторжения ксенотрансплантата и болезнь трансплантат против хозяина. В одном варианте осуществления способы согласно изобретению предусматривают введение пациенту с RA слитой молекулы TACI-Ig в количествах от приблизительно 0,01 до приблизительно 10 мг/кг массы тела пациента. Слитую молекулу TACI-Ig можно вводить многократно с заранее предусмотренными интервалами. Например, указанную молекулу можно вводить 7 или более раз во время 12 недельного интервала. За указанным начальным лечением слитым полипептидом TACI-Ig можно вводить указанный полипептид в режиме одного раза в две недели (каждую вторую неделю) в течение по меньшей мере еще 2 дополнительных недель, например указанный полипептид можно вводить по одному разу в неделю в течение дополнительных 2-30 недель. Альтернативно, указанный полипептид можно вводить на основе одного раза в неделю или одного раза в день. Согласно способам настоящего изобретения слитый полипептид TACI-Ig можно вводить пациенту с RA подкожно, орально или внутривенно и в комбинации с другими лекарственными средствами. Такие лекарственные средства включают в себя, но не ограничиваются ими, DMARD, такие как гидроксихлорохин, сульфасалазин, метотрексат, лефлуномид, ритуксимаб, инфликсимаб, азатиоприн, Dпеницилламин, золото (орально или внутримышечно), миноциклин и циклоспорин, кортикостероиды,такие как преднизон, NSAIDS, цитокины, антицитокины и интерфероны. Краткое описание фигур Фиг. 1 - дерево эскалации дозы для лечения TACI-Fc5,фиг. 2 - диаграмма зон тела пациента, которые могут быть использованы для подкожных инъекций-2 015342 молекулы TACI-Ig. Подробное описание изобретения В различных вариантах осуществления настоящее изобретение относится к способам лечения аутоиммунного заболевания у пациента путем ингибирования взаимодействия BlyS и/или APRIL с их рецепторами. Указанным пациентом может быть млекопитающее, например человек. В одном варианте осуществления указанные способы используют ингибитор, который содержит: 1) полипептид, который содержит домен, который, по меньшей мере, частично идентичен внеклеточному домену TACI, или его фрагмент, который связывает BlyS и/или APRIL; и 2) константную цепь иммуноглобулина человека. В одном варианте осуществления в способах согласно изобретению используют слитую молекулу, содержащую константную цепь иммуноглобулина человека и любой полипептид, имеющий по меньшей мере приблизительно 50%, по меньшей мере приблизительно 60%, по меньшей мере приблизительно 65%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95% или по меньшей мере приблизительно 99% идентичность последовательности с внеклеточным доменом TACI. В патентах США 5969102, 6316222 и 6500428 и заявках на патент США 09/569245 и 09/627206 (описания которых включены в настоящее описание в полном объеме в качестве ссылки) описаны последовательности для внеклеточного домена TACI, а также специфические фрагменты внеклеточного домена TACI, которые взаимодействуют с лигандами TACI, в том числе BlyS и APRIL. Один иллюстративный фрагмент внеклеточного домена TACI содержит один или два мотива повторяющегося цистеина. Другим иллюстративным фрагментом является фрагмент, содержащий аминокислоты 30-110 внеклеточного домена TACI или его фрагменты. Еще одним иллюстративным фрагментом является фрагмент, содержащий аминокислоты 1-154 внеклеточного домена TACI (SEQ ID NO: 1) или его фрагменты. Другие слитые молекулы, применимые для способов согласно изобретению, включают в себя слитый полипептид между константной цепью иммуноглобулина человека и полным внеклеточным доменом TACI или его ортологом или слитый полипептид между константной цепью иммуноглобулина человека и любым фрагментом внеклеточного домена TACI, который может связывать лиганды BlyS иAPRIL. Любая из слитых молекул, используемых в способах настоящего изобретения, может называться слитой молекулой TACI-Ig.TACI-Fc5 является одной из слитых молекул TACI-Ig, применимых для способов согласно изобретению. TACI-Fc5 является рекомбинантным слитым полипептидом, содержащим внеклеточную лигандсвязывающую часть рецептора TACI от приблизительно аминокислоты 1 до приблизительно аминокислоты 154 (SEQ ID NO: 1) и модифицированную Fc-часть иммуноглобулина человека, Fc5 (SEQ ID NO: 2). Другие молекулы TACI-Ig, применимые для способов согласно изобретению, включают в себя слитую молекулу, содержащую полипептид с SEQ ID NO: 2 и полипептид, который может связывать BlyS и который может быть по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%,по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95% или по меньшей мере приблизительно на 99% идетичным SEQ ID NO: l. Варианты осуществления настоящего изобретения включают в себя способы применения слитой молекулы TACI-Ig для лечения RA. Другие аутоиммунные заболевания, которые можно лечить способами согласно изобретению, включают в себя системную красную волчанку (SLE), болезнь Грейвса, диабет типа I и типа II, рассеянный склероз, синдром Шегрена, склеродермию, гломерулонефрит, отторжение трансплантата, например аллотрансплантата органа или ткани, и отторжение ксенотрансплантата, болезнь трансплантат против хозяина или любое другое аутоиммунное заболевание, которое можно лечить уменьшением количества циркулирующих зрелых В-клеток и секретирующих иммуноглобулин клеток и растворимых иммуноглобулинов, ассоциированных с такими заболеваниями. Варианты осуществления включают в себя также способы лечения введением пациенту слитой молекулы, содержащей константный домен иммуноглобулина человека и полипептид, содержащий любой фрагмент внеклеточного домена TACI, который может связывать BlyS и/или APRIL. Слитую молекулу TACI-Ig можно вводить пациенту в соответствии с любым подходящим способом введения, в том числе, но не только, орально, внутривенно или подкожно. Готовые формы TACI-Ig, применимые для способов согласно изобретению, можно готовить и хранить в виде замороженного, стерильного, изотонического раствора. Такие готовые формы могут включать в себя другие активные ингредиенты и эксципиенты, такие как, например, хлорид натрия, фосфатный буфер и гидроксид натрия или о-фосфорную кислоту (рН 6,0). Готовые формы TACI-Ig можно вводить пациенту в комбинации с другими лекарственными средствами. Такие лекарственные средства включают в себя, но не ограничиваются ими, DMARD, такие как гидроксихлорохин, сульфасалазин, метотрексат, лефлуномид, ритуксимаб, инфликсимаб, азатиоприн, D-пеницилламин, золото (орально или внутримышечно), миноциклин и циклоспорин, кортикостероиды, такие как преднизон, NSAIDS и лекарственные средства для уменьшения боли. Способы согласно изобретению могут быть использованы в-3 015342 комбинации с другими способами лечения аутоиммунных заболеваний. Такие другие способы лечения включают в себя, но не ограничиваются ими, хирургию, акупунктуру (иглоукалывание), физическую терапию и генную терапию. Готовые формы TACI-Ig могут вводиться до, одновременно или последовательно с другими способами лечения. Было показано, что TACI-Fc5 ингибирует активацию BlyS пролиферации В-клеток in vitro. Лечение мышей TACI-Fc5 приводит к частичному блокированию развития В-клеток, которое оказывает минимальное действие на предшественники В-клеток в костном мозге и линии дифференцировки других клеток, в том числе Т-клеток периферической крови, моноцитов и нейтрофилов. Трансгенные мыши, полученные генной инженерией, экспрессируют растворимую форму рецептора TACI в крови, продуцируют меньше В-клеток и обнаруживают уменьшенные уровни циркулирующего антитела. TACI-Fc5 трансгенные мыши имели нормальные количества клеток в тимусе, костном мозге и мезентериальном лимфатическом узле. Не было значимых различий в Т-клеточных популяциях в тимусе, лимфатическом узле и селезенке (Gross et al. Immunity 2001; 15(2): 289-302). Кроме того, TACI-Ig может ингибировать антигенспецифическое продуцирование антител в иммунной реакции у мышей, независимо от того, вводят ли его во время первичной реакции или вторичной реакции на антиген. В указанных исследованиях не наблюдали Т-клеточной реакции на антигенную стимуляцию ex vivo. В модели системной красной волчанки животного лечение слитыми белками TACI-Ig было эффективным в ограничении появления и прогрессирования указанного заболевания (Gross et al.Nature 2000; 404: 995-999). Подобным образом в рамках мышиной модели индуцированного коллагеном артрита TACI-Ig был способен ингибировать развитие коллагенспецифических антител и уменьшать как частоту возникновения воспаления, так и коэффициент появления заболевания (Gross et al. Immunity 2001; 15(2): 289-302). Композицию, содержащую слитую молекулу TACI-Ig, можно вводить пациенту один раз или многократно на протяжении некоторого периода. Например, пациент может получать одну подкожную инъекцию молекул TACI-Ig, после которой его или ее состояние может быть подвергнуто мониторингу. Пациентам, у которых наблюдается улучшение или, по меньшей мере, стабилизация их состояния, слитую молекулу TACI-Ig можно вводить многократно в течение дополнительного периода. Дополнительный период может составлять от приблизительно 2 недель до приблизительно 30 недель. Например, пациенту можно вводить три дозы слитой молекулы TACI-Ig во время четырехнедельного интервала. Альтернативно, пациенту можно водить дополнительно семь доз слитой молекулы TACI-Ig во время двенадцатинедельного интервала. Введение молекул TACI-Ig пациенту может выполняться один раз в день, один раз в два дня, один раз в неделю, один раз в две недели, один раз в месяц, один раз в два месяца и т.д. Слитую молекулу TACI-Ig вводят пациенту в количестве, эффективном для лечения состояния пациента. В одном варианте осуществления термин лечение в отношении конкретного заболевания или нарушения включает в себя, но не ограничивается ими, ингибирование указанного заболевания или нарушения, например остановку развития указанного заболевания или нарушения; ослабление указанного заболевания или нарушения, например индукцию регресса указанного заболевания или нарушения; или ослабление состояния, вызываемого или происходящего из указанного заболевания или нарушения, например ослабление, предупреждение или лечение симптомов указанного заболевания или нарушения. В другом варианте осуществления указанное количество может составлять от 0,01 мг на 1 кг массы тела пациента до 10 мг на 1 кг массы тела пациента. Оптимальная доза для лечения слитой молекулой TACIIg может быть получена с использованием диаграммы фиг. 1, описанной более подробно в примере 5. Слитая молекула TACI-Ig может доставляться любым подходящим способом. В одном варианте осуществления указанную молекулу доставляют перитонеальной инъекцией. В другом варианте осуществления указанная перитонеальная инъекция выполняется через подкожную инъекцию. В другом варианте осуществления перитонеальную инъекцию вводят в переднюю брюшную стенку. При необходимости более одной инъекции для введения дозы указанные инъекции могут вводиться на расстоянии нескольких сантиметров и относительно близко во времени, например так близко, как это кажется приемлемым. Для многократного введения лекарственного средства место введения на передней брюшной стенке может сменяться по очереди или чередоваться. Примерные зоны для подкожной инъекции в переднюю брюшную стенку изображены на фиг. 2 и включают в себя правую верхнюю внешнюю зону,правую нижнюю внешнюю зону, левую верхнюю внешнюю зону, среднюю нижнюю зону, а также правое и левое бедра и плечи (фиг. 2). Альтернативно, слитая молекула TACI-Ig настоящего изобретения может доставляться через внутривенные инъекции или орально в форме таблеток, капсул, жидких композиций или гелей и т.д. Пример 1. Тестирование фармакологии, токсикологии и фармакокинетики TACI-Fc5 в экспериментальной модели животного.TACI-Fc5 оценивали в модели резистентности (сопротивляемости) хозяина для прямой оценки функционального потенциала иммунной системы. Мышей стимулировали вирусом гриппа во время лечения TACI-Fc5. Дексаметазон, используемый в качестве положительного контроля, приводил к усиленной и пролонгированной вирусной инфекции. Введение однократной дозы TACI-Fc5 подкожным (SC) способом уменьшало способность животных выводить указанную вирусную инфекцию.-4 015342 Основные исследования безопасности фармакологии показали, что TACI-Fc5 не индуцировал больших изменений нервной, дыхательной и сердечно-сосудистой систем в мышах или обезьянах до SCдозы 80 мг/кг. Только в мышах наблюдали слегка увеличенную гипербдительность и локомоторную активность, которые предполагают малое и транзиторное (преходящее) стимулирующее действие, при 80 мг/кг, причем уровень ненаблюдаемого действия (NOEL) был равен 20 мг/кг. При введении мышам в виде однократной дозы внутривенным (IV) или подкожным (SC) способомTACI-Fc5 не индуцировал смертность или видимые общие или локальные патологические действия в животных до наивысшей технически возможной дозы: 1200 мг/кг. Введение обезьянам TACI-Fc5 в виде однократной дозы SC-способом при уровне дозы 240 мг/кг не приводил к смертности или к каким-либо большим токсичным действиям. На основании результатов, полученных после 2 или 4 недель введения TACI-Fc5 подкожным способом мышам при дозах 5, 20 и 80 мг/кг/каждый второй день, можно было сделать вывод, что указанное соединение хорошо переносилось в указанном виде при дозах до 80 мг/кг. При всех дозах были обнаружены связанные с лечением модификации, ограничивающиеся иммунной системой. Указанные изменения включают в себя уменьшения в общих количествах В-клеток и количествах зрелых В-клеток и уровнях сывороточных IgG и IgM. Иммуногистохимические тесты, выполняемые в селезенке и лимфатических узлах, подтверждали истощение, ограниченное В-клетками, причем количество Т-клеток является неизмененным. Все указанные изменения, связанные со временем и дозой в некоторых случаях, рассматривали как излишне увеличенные фармакологические действия, ожидаемые в чувствительных видах после введения очень высоких доз TACI-Fc5. В общем и целом, указанные действия наблюдали после 2 и 4 недель лечения без больших признаков прогрессирования во времени. По-видимому, они были почти полностью обратимыми после 4 недель после прекращения лечения, за исключением уменьшенных количеств В-клеток. Для выяснения обратимости модуляции В-клеток дополнительное исследование на мышах проводили при дозах 5 и 20 мг/кг в течение 4 недель каждый второй день с более продолжительными периодами восстановления. Нормализация общих и зрелых циркулирующих В-клеток достигалась после двух месяцев после прекращения лечения при 5 мг/кг и после 4 месяцев при 20 мг/кг. Кроме того, указанная инъекция индуцировала слабое увеличение в сравнении с контролями-носителями воспалительных изменений в местах инъекций при всех дозах. Подкожное введение TACI-Fc5 в обезьянах не индуцировало основных признаков токсичности при любой из испытанных доз: 5, 20 или 80 мг/кг/каждый третий день при введении в течение 4 последовательных недель. Локальную переносимость считали удовлетворительной до самой высокой испытанной дозы и при самой высокой испытанной дозе. Индуцировались зависимые от дозы и обратимые легкие или умеренные изменения воспалительного происхождения (в основном инфильтраты периваскулярных моноклональных и эозинофильных клеток), но авторы считали, что указанные изменения связаны с локальным присутствием экзогенных белков. Только при высокой дозе несколько животных обнаруживали слабое или умеренное подострое воспаление, ассоциированное с образованием кист в одном из них. Наблюдали уменьшения количества циркулирующих В-клеток при определениях субпопуляций лимфоцитов, а также гистологическое истощение маргинальной фолликулярной зоны селезенки (известной как зона, зависимая от В-клеток) и уменьшения общих уровней IgG и IgM в сыворотке. Они рассматривались как результат фармакологических свойств TACI-Fc5, как показано фармакологическими экспериментами in vitro и in vivo. Их степень была избыточно увеличенной, как и ожидалось, в исследованиях токсикологии, в которых животным целенаправленно вводили высокие дозы тест-соединения. Хотя низкие сывороточные уровни IgG и IgM и истощение лимфоцитов селезенки обнаруживали явную тенденцию в направлении нормализации в пределах допускаемого одного месяца после прекращения лечения, общие и зрелые циркулирующие В-клетки не обнаруживали сходного поведения, что указывало на необходимость более продолжительного времени для нормализации. В конце периода лечения (неделя 4) самцы и самки группы с высокой дозой (80 мг/кг) обнаруживали слабое, но статистически значимое уменьшение средних величин общего белка в сравнении с контролями. Слабую тенденцию в направлении уменьшения наблюдали также при той же самой дозе при неделе 2 и в конце периода восстановления. Модификации белка сыворотки в самках с высокой дозой в конце периода введения доз включают в себя уменьшение глобулина и увеличения процента альбумина и фракции -1-глобулина. Фракция -1 глобулина была также более высокой, чем контроли в самках группы 3 (20 мг/кг). Иммуногенность TACI-Fc5 была низкой как в мышах (только несколько самок обнаруживали уровни циркулирующих связывающих антител во время и после периода лечения), так и в обезьянах (низкие уровни обнаруживали после периода восстановления в небольшом числе животных); ни в одном из видов не обнаруживали нейтрализующих антител.TACI-Fc5 испытывали с использованием стандартного набора тестов in vivo для детектирования токсикологии репродукции и фертильности (тест фертильности на самцах и самках мышей, обработанных SC-способом при дозах 5, 20 и 80 мг/кг/каждый второй день до и во время спаривания и до периода-5 015342 имплантации) и эмбриофетального развития (эмбриофетального развития в самках мышей и кроликов,обработанных SC-способом при дозах 5, 20 и 80 мг/кг/каждый второй день во время периода органогенеза). Тест фертильности в мышах показал зависимое от дозы увеличение пре- и постимлантационных потерь после подвергания действию 20 и 80 мг/кг/каждый второй день TACI-Fc5 в сравнении с контрольной группой. Оценка данных, полученных в мышах эмбриофетального развития, показал, что не наблюдались токсические для эмбриона действия при любой дозе и не индуцировались связанные с соединением пороки развития плода. У кроликов исследование эмбриофетального развития показало, что лечение вызывало зависимое от дозы более низкое увеличение массы и более низкое потребление корма у беременных животных, обработанных 20 или 80 мг/кг/каждый второй день. Вышеописанные материнские изменения были ассоциированы с увеличенной скоростью резорбций и более низкой массой тела плода при указанных двух более высоких дозах. Полученные результаты предполагают возможное действие TACI-Fc5 на имплантацию мышиной бластоцисты в матку. Наблюдаемые действия TACI-Fc5 на увеличение материнской массы и потребление корма были, по-видимому, ответственными за наблюдаемые действия на жизнеспособность помета в кроликах, подвергаемых действию 20 или 80 мг/кг/каждый второй день во время органогенеза, и за то,что не было прямой токсичности TACI-Fc5 в отношении плода. Не было пороков развития, связанных с лечением TACI-Fc5, в указанных двух видах животных. Кроме того, гистологическое исследование мужских и женских гонад и вспомогательных половых органов проводили в 2-недельных и 1-месячных исследованиях токсичности, при SC-способе в мышах и обезьянах, в которых TACI-Fc5 вводили каждый второй или каждый третий день соответственно, без получения связанных с лечением действий. Исследование локальной переносимости у кроликов показало, что композиция TACI-Fc5 хорошо переносилась локально при инъекции подкожным способом кроликам при дозе 70 мг/мл. Фармакокинетическое исследование с однократной дозой у самцов мышей при введении IV и SC проводили у мышей либо внутривенным способом при дозе 1 мг/кг, либо подкожным способом при дозах 1, 5 и 15 мг/кг. Время до максимальной абсорбции (tмакс) было определено между 4 и 16 ч, причем было рассчитано, что величина t1/2 была равна 40-50 ч. Наблюдали подобный инфузии профиль во время первых 30 мин после IV-болюсного введения, после чего TACI-Fc5 элиминировался из тела с полупериодом элиминации 44 ч. После подкожного введения отношение между AUC (площади под кривой), полученной при 3 дозах 1, 5 и 15 мг/кг, было 1:5:8 в сравнении с отношением доз 1:5:15, предполагающим потерю дозовой пропорциональности при высокой дозе. Биодоступность TACI-Fc5 в мышах при подкожном способе введения была равна 76 и 89% при дозах 1 и 5 мг/кг, но была более низкой, чем ожидалось, при 15 мг/кг (0,42; как рассчитано против внутривенной дозы 1 мг/кг). Поскольку видимый полупериод элиминации не изменялся, более низкая биодоступность, наблюдаемая при указанной высокой дозе, могла бы объясняться увеличением как клиренса,так и объема распределения или более вероятно уменьшенной абсорбцией вследствие образования отложения в месте инъекции. Фармацевтическое исследование с однократной дозой у самцов обезьян при введении IV и SC проводили у самцов собакоподобных обезьян, инъецированных либо внутривенным способом при дозе 1 мг/кг, либо подкожным способом при дозах 1, 5 и 15 мг/кг. Шесть самцов обезьян распределяли на 2 группы из 3 животных каждая, и они получали 2 введения, разделенных 2-недельным периодом вымывания. Обработками периода 1 были 1 мг/кг IV (группа 1) и 1 мг/кг SC (группа 2) и обработками периода 2 были 5 мг/кг SC (группа 1) и 15 мг/кг (группа 2). Время до максимальной абсорбции (tмакс) было определено между 6 и 8 ч, причем было рассчитано,что величина t1/2 была равна приблизительно 120-190 ч. Наблюдали подобный инфузии профиль у 2 из 3 обезьян во время первых 15 мин после IVболюсного введения, после чего TACI-Fc5 элиминировался из тела с полупериодом элиминации 17929 ч. Объем распределения в стационарном состоянии, Vss, был равен 38282 мл/кг, т.е. объему, близкому к внутриклеточному объему жидкости. После подкожного введения пропорциональность AUC относительно дозы была хорошей, т.е. 216,1182 и 2732 ч мкг/мл для доз SC 1, 5 и 15 мг/кг. Биодоступность TACI-Fc5 при подкожном способе (рассчитанная относительно дозы IV 1 мг/кг) была равна 0,92, 1,02 и 0,77 при низкой, промежуточной и высокой дозах. Таким образом, TACI-Fc5 почти полностью абсорбировался подкожным способом. Низкие уровни TACI-Fc5 обнаруживали в пробах перед введением доз в течение периода 2 (между дозами 1 мг/кг посредством IV- или SC-способов, период 1, и дозами 5 или 15 мг/кг, соответственно, в периоде 2) для всех шести обезьян, так как во время 2-недельного периода вымывания истекали только 2 периода полувыведения, что является недостаточным для полной элиминации введенного соединения(которая требует 5 периодов полувыведения). Однако удалось оценить, что вклад AUC ранней дозы представлял только приблизительно 2% общей AUC в периоде 2. Уровни IgG в сыворотке показали уменьшение 10,2% после IV-введения доз. Доза 15 мг/кг SC показала слегка более высокое действие, хотя не наблюдали различий между дозами 1 и 5 мг/кг (уменьшения 8,6, 8,4 и 12,3% после доз 1, 5 и 15 мг/кг соответственно). Уровни IgM в сыворотке показали уменьшение 18,0% после IV-введения доз. Не наблюдали различий между 3 дозами SC (уменьшения 23,5, 23,0 и 24,2% после доз 1, 5 и 15 мг/кг соответственно). Пример 2. Определение переносимой дозы TACI-Fc5 у здоровых волонтеров. В настоящее время завершается первое исследование фазы I TACI-Fc5. Это двойное слепое, контролируемое плацебо, проводимое с эскалацией доз исследование для определения безопасности, фармакокинетики и фармакодинамики однократных доз TACI-Fc5, вводимых подкожно здоровым волонтерам мужского пола. Ниже представлено описание плана исследования вместе с суммированием доступных данных.TACI-Fc5 вводили здоровым волонтерам в двойном слепом, контролируемом плацебо, проводимом с эскалацией доз исследование для определения безопасности, фармакокинетики и фармакодинамики однократных доз TACI-Fc5, вводимых подкожно здоровым волонтерам мужского пола. В исследование были включены четыре группы субъектов. В каждой группе введения доз один субъект был рандомизирован для получения инъекции плацебо, причем все другие получали TACI-Fc5. После выписки из места исследования при 24 ч после введения дозы субъекты приходили на прием в качестве амбулаторных больных в течение семи недель запланированных обследований. Системную и локальную переносимость TACI-Fc5 подвергали мониторингу в отношении показателей физического обследования, боли в месте инъекции, реакций локальной переносимости в месте инъекции (инъекций)(покраснения, опухания, гематом и зуда), показателей жизненно важных функций, ЭКГ (электрокардиограмм) с 12 отведениями, лабораторных оценок безопасности и регистрации вредных побочных действий. Фармакокинетические и фармакодинамические маркеры подвергали мониторингу на протяжении семинедельного периода после введения доз. Фармакодинамическое действие TACI-Fc5 подвергали мониторингу с использованием ряда маркеров, включающих в себя: субпопуляции лимфоцитов при помощи FACS-анализа (плазматические клетки (CD138+), незрелые В-клетки (CD19+, IgD-), зрелые В-клетки(CD19+, IgD+), Т-хелперные клетки (CD5+, CD4+), цитотоксические Т-клетки (CD5+, CD8+), общие Тклетки (CD5+), свободный BlyS, комплекс BlyS/TACI-Fc5, IgG, IgM, анти-TACI-Fc5-антитела. Эскалация (увеличение) доз определялась алгоритмом в протоколе исследования на основе обзора данных через три недели после введения доз. Использовали четыре группы введения доз: группа 1 получала 2,1 мг; группа 2 получала 70 мг; группа 3 получала 210 мг, и группа 4 получала 630 мг. Результаты: здоровым волонтерам мужского пола вводили однократные подкожные дозы TACI-Fc5 при дозах от 0,03 до 9 мг/кг. Данные безопасности и переносимости использовали вместе с анализомFACS субпопуляций лимфоцитов при неделе 3 для ориентации эскалации доз между когортами. Исследовали четыре когорты, как показано в табл. 1. Таблица 1 Распределение волонтеров При каждом уровне дозы предполагалась номинальная масса 70 кг, причем субъекты получали стандартизованную дозу.b Вследствие ошибки разведения доза, введенная когорте 1, была в 10 раз более низкой,чем это было запланировано (0,3 мг/кг). Указанная ошибка была обнаружена после рассмотрения фармакокинетических данных из когорты 1, но после введения доз когорты 2. с В том числе 1 субъект, получающий плацебо.d Один волонтер прекратил прием доз перед инъекцией. Демографические фоновые характеристики суммированы для указанной популяции по когортам и представлены в целом и показаны в табл. 2. В целом возраст (среднееSD) составлял 30,77,4 года, а индекс массы тела составлял 24,8 кг/м 2. Все волонтеры были белыми индивидами мужского пола.TACI-Fc5 хорошо переносился во всех группах. Не было видимых действий после определения показателей физического обследования, показателей жизненно важных функций или ЭКГ с 12 отведениями. Таблица 3 Перечень вызванных лечением вредных побочных действий, сообщенных до настоящего времени Временное покраснение и опухание наблюдали в месте введения у некоторых субъектов, причем покраснение наблюдали у всех субъектов в когортах 3 и 4. Хотя частота встречаемости реакций места инъекции, по-видимому, увеличивается в группах более высоких доз, авторы считают, что это связано с увеличенным объемом (или числом) инъекций.-8 015342 Сорок восемь (48) возникающих вследствие лечения побочных реакций сообщались через семь недель после введения доз. Большинство из них (44 реакции, 91,7%) были слабыми, а остальные были умеренными (4 реакции, 8,3%). Не было тяжелых побочных реакций и не было серьезных побочных реакций во время указанного периода. Не было видимой взаимосвязи между дозами введенного TACI-Fc5 и частотой встречаемости, интенсивностью или определенной взаимосвязью вредных побочных реакций. Сообщенные до сих пор побочные реакции суммированы в табл. 3. Считается, что TACI-Fc5 показал хорошую переносимость при дозах до 630 мг без вызывания значительных проблем, связанных с безопасностью. Полученные данные подтверждают предполагаемые дозы предложенных исследований субъектов. Выполняли несистемный анализ концентраций TACI в сыворотке. Указанный предварительный анализ выполняли с использованием номинальных временных точек взятия проб. Субъекты 2, 6 и 13 имели измеримые концентрации перед введением дозы, и, следовательно, фоновые концентрации вычитали из всех измерений после введения дозы перед анализом. Фармакокинетические параметры после однократных подкожных доз 2,1, 70, 210 и 630 мг суммированы в табл. 4. Концентрации лекарственных средств были близкими к пределу количественного определения указанного анализа после дозы 2,1 мг TACI-Fc5, ограничивая ценность данных при указанном уровне дозы. При дозах 70 мг и выше, Тмакс (время до максимальной абсорбции) было в диапазоне 16-36 ч и общая медиана t1/2 (рассчитанная из терминальной части указанной кривой) была равна 303 ч. Кроме того, AUC (экстраполированная до бесконечности) и Смакс увеличивались более, чем пропорционально дозе. Таблица 4 Фармакокинетические (ФК) параметры Фармакодинамические анализы показали уменьшения фоновых уровней IgM через 7 недель после однократных доз 70, 210 или 630 мг. Хотя не удалось установить ясной взаимосвязи доза-ответ с пробами малого размера, степень уменьшения IgM была наивысшей в группе с наивысшей дозой. Субъекты в группе с дозой 70 мг обнаруживают, по-видимому, возврат уровней IgM к фону через 7 недель после введения дозы. Уровни в группах с более высокими дозами оставались подавленными в указанной временной точке. Не было видимых действий на уровни IgG или на субпопуляции лимфоцитов, которые измеряли при помощи FACS. Имелось пропорциональное увеличение уровней комплексов BlyS/TACI-Fc5 во время указанного периода взятия проб, достигающее плато при приблизительно 600 ч после введения дозы. Вывод: данные для человека, полученные на здоровых волонтерах мужского пола, показали, что TACI-Fc5 является-9 015342 безопасным и хорошо переносится субъектами при дозах до 630 мг. Характер, частота встречаемости и тяжесть побочных реакций были сравнимы между группами обработки TACI-Fc5 и плацебо. Не было клинически значимых изменений в показателях физического обследования, показателях жизненно важных функций, ЭКГ с 12 отведениями или лабораторных параметрах безопасности. Локальная переносимость в месте введения была хорошей. Полученные данные поддерживают предложенные дозы в субъектах с ВСМ. После однократных доз в здоровых субъектах мужского пола TACI-Fc5 достигал Тмакс между 16 и 20 ч, AUC увеличивалась пропорциональным дозе образом, хотя увеличения Смакс были большими, чем пропорциональные дозе показатели. Медианный полупериод существования TACI-Fc5 был равен приблизительно 300 ч. Фармакодинамическое действие отмечали на уровнях IgM при дозах 70, 210 и 630 мг. Не было видимого действия лечения на IgG или субпопуляциях лимфоцитов после однократной дозыTACI-Fc5. Нет известных или ожидаемых рисков особой тяжести или серьезности, которые не были уже учтены в предложенных протоколах исследования. Пример 3. Лечение пациентов с RA композициями TACI-Fc5. Пациентов с RA клинически оценивали перед введением TACI-Fc5. Оценки фона определяли как оценки, выполняемые непосредственно перед первым введением TACI-Fc5. Первый день введения TACIFc5 обозначали как день 1. Следующие процедуры выполняли перед введением пациенту первой дозы лекарственной терапии TACI-Fc5: ЭКГ; измерение показателя жизненно важных функций (VS); физическое обследование; оценка активности заболевания (см. пример 6); измерение роста и массы (только при первой дозе и при визите во время последующего наблюдения); рутинные лабораторные тесты (см. табл. 5); расчет отношения гидроксипиридинолин/лизилпиридинолин (HP/LP); фармакокинетическое (ФК) и фармакодинамическое (ФД) измерение концентрации свободного TACI-Fc5 и общей концентрацииTACI-Fc5 в сыворотке, сывороточных уровней свободных APRIL и BlyS, комплекса BlyS/TACI-Fc5, измерение количества клеток проточной цитометрией и измерение анти-TACI-антител (только при первой дозе) и измерение биомаркеров в крови, включающих в себя субпопуляции лимфоцитов (крови, распределенной в три пробирки и фенотипированной анализом FACS в соответствии с табл. 6), IgA, IgM, IgG (в том числе субтипирование), аутоантитела против цитруллинированных пептидов, ревматоидные факторы (IgA-RF, IgM-RF, IgG-RF), С-реактивный белок (CRP), TNF-, IFN-, IL-6, IL-1, IL-12 и IL-8. В одной субпопуляции пациентов выполняют артроскопически направляемую синовиальную биопсию или взятие синовиальной жидкости пункцией с использованием иглы и выполняют оценки ФК, ФД и оценки биомаркеров в указанной синовиальной жидкости. В когортах с повторяемыми введениями доз многие или все указанные измерения выполняют непосредственно перед последующими введениями TACI-Fc5. 1. Пациенты должны голодать в течение приблизительно 10 ч перед определением триглицеридов. 2. Количество лейкоцитов должно включать в себя определение лейкоцитарной формулы. 3. Если присутствуют белок, эритроциты или лейкоциты (RBC или WBC), должно выполняться микроскопическое исследование пробы. Таблица 6 Субпопуляции лимфоцитов% и Ab CD45+/CD4-/CD8+ (Т-цитотоксические/супрессорные клетки) Пробирка 3: обратно рассчитанные Ab с использованием общего количества В-клеток (CD19+)% и Ab CD19+/CD27+/CD38+ (секретирующие Ig клетки) Через приблизительно 6 ч после введения дозы, за исключением когорты 6, выполняли следующие оценки: ЭКГ; VS; и взятие проб для ФК и ФД (только для когорт с однократной дозой). Лечение с использованием TACI-Fc5 следует по плану когорт с последовательной эскалацией дозы,очерченной на фиг. 1. Первая когорта получает однократную дозу 70 мг TACI-Fc5 в день 1. Последующие когорты получают дозы на основе алгоритма эскалации дозы до максимальной дозы 2940 мг. Вторая когорта получает три дозы 70 мг TACI-Fc5 во время одномесячного периода. Третья когорта получает однократную дозу 210 мг TACI-Fc5. Четвертая когорта получает три дозы 210 мг TACI-Fc5 во время од- 11015342 номесячного периода. Пятая когорта получает однократную дозу 630 мг TACI-Fc5. Шестая когорта получает семь доз 420 мг TACI-Fc5 во время трехмесячного периода. Оценки после введения доз, в том числе сбор проб для оценки ФК, ФД и биомаркеров и безопасности и активности заболевания, выполняют из всех когорт при заранее определенных интервалах до 14 недель после введения доз (в когортах с однократной дозой), до 18 недель после введения доз (в когортах 2 и 4 с повторяемыми дозами) и до 26 недель после введения доз (в когорте 6 с повторяемыми дозами). Табл. 7 описывает схему оценки после введения доз, начинающуюся со дня 2, когорт 1, 3 и 5 (когорт с однократными дозами). Табл. 8 описывает схему оценки после введения доз, начинающуюся с первого дня после конечной дозы (день 30) когорт 2 и 4. Табл. 9 описывает схему оценки после введения доз,начинающуюся в день введения второй дозы (день 15) когорты 6. Реакции места инъекции, побочные реакции и сопутствующие лекарственные средства и процедуры измеряют на протяжении указанного исследования для всех когорт. Данные побочных действий получают при запланированных или незапланированных визитах после физического обследования, на основе информации, спонтанно обеспечиваемой пациентом и посредством опроса пациента. Побочная реакция определяется как любое неблагоприятное медицинское явление в форме признаков, симптомов, ненормальных лабораторных показателей или заболеваний, которые возникают или ухудшаются относительно фона (т.е. начального визита), независимо от причинной взаимосвязи и даже,если не вводился исследуемый продукт. Тяжесть побочной реакции может оцениваться с использованием следующих определений: (1) легкая - пациент знает о побочной реакции или побочном симптоме, но указанная побочная реакция или побочный симптом легко переносится; (2) умеренная (средняя) - пациент испытывает достаточный дискомфорт для того, чтобы препятствовать его или ее обычному уровню активности или уменьшать его или ее обычный уровень активности; (3) тяжелая - значительное ухудшение функционирования, когда указанный пациент неспособен выполнять обычные активности; и (4) очень тяжелая - жизнь пациента находится в опасности вследствие указанной побочной реакции. Связь указанной побочной реакции с введением TACI-Fc5 может оцениваться с использованием следующих определений: (1) вероятная - причинная связь является клинически/биологически высоковероятной, и имеется вероятная временная последовательность между появлением побочной реакции и введениемTACI-Fc5; (2) возможная - причинная связь является клинически/биологически вероятной, и имеется вероятная временная последовательность между появлением побочной реакции и введением TACI-Fc5; (3) маловероятная - причинная связь является невероятной и другая документированная причина указанной побочной реакции является более вероятной; и (4) не имеющая отношения - причинная связь может быть определенно исключена, и другая документированная причина указанной побочной реакции является наиболее вероятной. Медицинские состояния, присутствующие при фоне, которые не ухудшаются по тяжести или частоте встречаемости во время введения TACI-Fc5, не считаются побочными реакциями. Обострение RA рассматривается как часть оценки указанного заболевания и не считается побочной реакцией, если оно не является возможно или вероятно связанным с введением TACI-Fc5. Таблица 7 Схема оценки после введения дозы когорт 1, 3 и 5 А: вызванное жалобой физическое обследование В: ADA = оценка активности заболевания, измеренная по CRP в сыворотке, ESR и отношению- 12015342 Таблица 8 Схема оценки после введения дозы когорт 2 и 4 А: вызванное жалобой физическое обследование В: ADA = оценка активности заболевания, измеренная по CRP в сыворотке, ESR и отношениюHP/LP в моче С: VIS = состояние вакцинной иммунизации Таблица 9 Схема оценки после введения дозы когорты 6 А: вызванное жалобой физическое обследование В: ADA = оценка активности заболевания, измеренная по CRP в сыворотке, ESR и отношениюHP/LP в моче С: VIS = состояние вакцинной иммунизации Доза, схема введения и способ введения TACI-Fc5 представлены в табл. 10. Вкратце, в исследование включены 72 пациента с RA мужского и женского пола в возрасте между 18 и 70 годами. Указанные пациенты имеют установленный диагноз активного, умеренного - тяжелого RA в течение по меньшей мере 6 месяцев, они не имели успеха при лечении не более чем пятью DMARD и не использовалиDMARD иной, чем метотрексат, в течение 4 или более недель перед днем 1. Кроме того, указанные пациенты являются RF-положительными и не являются беременными во время исследования и до 3 месяцев после последнего введения TACI-Fc5. Указанных пациентов разделяют на 6 когорт. Три из указанных когорт имеют 8 пациентов, две из указанных когорт имеют 12 пациентов, и одна когорта имеет 24 пациента. Пример 4. Процедура инъекции TACI-Fc5. Если выбирают подкожный способ введения для доставки TACI-Fc5, то указанную молекулу инъецируют подкожно в брюшную стенку, и места чередуют согласно диаграмме ниже (фиг. 2). Соблюдается осторожность, чтобы не произошла инъекция в кровеносный сосуд. Крайне важно чередовать места введения для сохранения здоровой кожи. Повторяемые инъекции в одно и то же место могут вызывать рубцевание и затвердение жировой ткани. Следующие зоны должны использоваться для инъекции и чередоваться следующим образом (фиг. 2): первая инъекция в левую верхнюю внешнюю зону (фиг. 2, положение 1); вторая инъекция в правую нижнюю внешнюю зону (фиг. 2, положение 2); третья инъекция в левую нижнюю внешнюю зону (фиг. 2, положение 4) и пятая инъекция в среднюю нижнюю зону (фиг. 2,положение 5). Вышеупомянутая схема чередования повторяется для дополнительных инъекций. Для пациентов, требующих более одной инъекции на дозу, инъекция начинается в положении 12 часов для зоны места, обозначенного для указанной инъекции (как на фиг. 2, места 1-5), и они чередуются последовательно по часовой стрелке, положение 2, 4, 6, 8 и/или 10 часов по мере необходимости для требуемого количества инъекций на дозу. Инъекции должны находиться на расстоянии по меньшей мере 2,5 см (1 дюйма) одна от другой и инъецироваться как можно ближе во времени. Не допускается инъекция более 1,5 мл в одно место инъекции. Если пациент испытывает трудность с инъекциями в живот,другими зонами, которые могут быть инъецированы, являются передние части бедер и плечи. Обычные симптомы реакций мест инъекции включают в себя зуд, болезненность, местное повышение температуры и/или покраснение в месте инъекции. Пример 5. Протокол эскалации дозы для введения молекулы TACI-Fc5. Настоящий протокол эскалации дозы для оценки TACI-Fc5 в RA позволяет вводить дозы шести пациентам в первой когорте. Первая когорта получает однократную дозу 70 мг с последующими 4 неделями наблюдения. Safety Review Board (SRB) рассматривает данные по безопасности, собранные в течение четырех недель после введения дозы, и в рекомендации SRB, указанная доза увеличивается до 210 мг,вводимых на протяжении 1 месяца (вторая когорта) или в виде однократной дозы (третья когорта). Девяти пациентам вводят дозу во второй когорте и шести пациентам вводят дозу в третьей когорте. ЗатемSRB рассматривает данные по безопасности, собранные из третьей когорты через семь недель после введения дозы, и в рекомендации SRB указанная доза увеличивается до 630 мг, вводимых на протяжении 1 месяца (четвертая когорта) или в виде однократной дозы (пятая когорта). Девяти пациентам вводят дозу в четвертой когорте и шести пациентам вводят дозу в пятой когорте. Затем SRB рассматривает данные по безопасности, собранные из пятой когорты через шесть недель после введения дозы, и в рекомендации SRB, когорта шесть получает 2940 мг на протяжении 3-месячного периода. Восемнадцати пациентам вводят дозу в шестой когорте. Выбранные дозы основаны рационально на повторяемых исследованиях SC-токсикологии в собакоподобных обезьянах и мышах, которые показали, что TACI-Fc5 хорошо переносился при 5, 20 и 80 мг/кг. Кроме действий на иммунные клетки, которые являются ожидаемыми результатами фармакодинамической активности TACI-Fc5, единственными показателями были значимое уменьшение общего белка плазмы и легкая подкожная реакция с наивысшей дозой SC 80 мг/кг в обезьянах и временная (преходящая) гиперактивность в тесте Ирвина в мышах при дозе 80 мг/кг. Таким образом, 20 мг/кг является наивысшей дозой, не ассоциированной с побочными реакциями в обоих видах.- 14015342 Кроме того, дозы 2,1, 70, 210 и 630 мг вводили в виде однократных подкожных доз здоровым волонтерам. Не было проблем в отношении безопасности или переносимости, индуцированных при указанных дозах. На основании преклинических данных и предварительных результатов в здоровых волонтерах доза 70 мг была выбрана как подходящая начальная доза для пациентов с RA. Дозы и схемы введения доз, предвиденные у пациентов с RA в настоящем исследовании, находятся в диапазоне от 1 до 9 мг/кг два раза в месяц (при нормализации для субъекта с массой тела 70 кг), что хорошо согласуется с диапазоном доз, исследованным в обезьянах. Повторяемое введение у обезьян показало зависимость доза-реакция. Пример 6. Оценка прогрессирования заболевания. Прогрессирование заболевания измеряют по оценке активности заболевания, глобальной оценке врачом активности заболевания, глобальной оценке пациентом активности заболевания, утренней тугоподвижности и оценке пациентом боли, активности заболевания и физической функции. Оценка активности заболевания (DAS) является комбинированным индексом, который был развит для измерения активности заболевания у пациентов с RA. Он был экстенсивно валидизирован для его применения в клинических испытаниях в комбинации с критериями реакции EULAR (Европейской лиги ревматологов). Исходный DAS включал в себя суставной индекс Ритчи, число опухших суставов 44,оценку скорости осаждения эритроцитов (ESR) и общего здоровья на VAS. После валидизации числа 28 для неранжированных чисел суставов в отношении болезненности и опухания, был разработан DAS28,включающий в себя числа суставов 28. Результаты DAS и DAS28 не являются непосредственно взаимозаменяемыми. С использованием DAS были разработаны несколько порогов для высокой активности заболевания,низкой активности заболевания или даже ремиссии. Кроме того, были разработаны критерии реакции на основе DAS, так что, когда DAS пациента измеряют в двух временных точках, может быть оценена клиническая реакция. Переменными показателями заболевания, необходимыми для расчета DAS28, являются число опухших суставов (28 суставов); число болезненных суставов (28 суставов); ESR (мм после 1 ч); общее здоровье пациентов (GH) или глобальная активность заболевания (визуальная шкала аналогов (VAS) 100 мм) - в настоящем исследовании, названном глобальной оценкой активности заболевания пациентом. Оценки двадцати восьми болезненных и опухших суставов включают в себя следующие суставы: плечи,локти, кисти, пястно-фаланговые суставы, проксимальные межфаланговые суставы и колени. Для расчета DAS используют следующую формулу:DAS28=0,56sqrt (болезненные 28)+0,28sqrt (опухшие 28)+0,70+ln (ESR)+0,014GH Указанный DAS обеспечивает число на шкале от 0 до 10, указывающее существующую активность ревматоидного артрита. DAS28 выше 5,1 обозначает высокую активность заболевания, а DAS28 ниже 3,2 обозначает низкую активность заболевания. Ремиссия достигается, когда DAS28 ниже 2,6. Посредством сравнения DAS28 из одного пациента в двух разных временных точках можно определить улучшение или реакцию. Оценка боли пациентом и глобальная оценка активности заболевания пациентом выполняются с использованием горизонтальной визуальной шкалы аналогов (VAS). Глобальная оценка врачом активности заболевания измеряет имеющуюся активность заболевания пациента с использованием 5-балльной ступенчатой шкалы (шкалы Ликерта), где 0=бессимптомное,1=слабое, 2=умеренное, 3=тяжелое и 4=очень тяжелое. Оценка пациентом физической функции измеряется на основе реакции пациента на опросник для оценки состояния здоровья и качества жизни (HAQ), который задает вопросы пациенту в отношении способности пациента на протяжении предыдущей недели выполнять повседневные задачи, такие как одевание и уход за собой, прием еды, ходьба (гуляние), и в отношении того, требуется ли пациенту помощь (вспомогательные средства) или оснащение для выполнения какой-либо из вышеупомянутых задач. Присутствие утренней тугоподвижности оценивается посредством беседы с пациентом, и, если она имеется, регистрируется ее продолжительность. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения ревматоидного артрита у пациента, предусматривающий введение пациенту композиции, содержащей слитую молекулу, содержащую:(ii) константный домен иммуноглобулина человека,где указанную композицию вводят в количестве от 0,01 до 10 мг/кг массы тела пациента и где указанную композицию вводят в указанном количестве(iii) каждую вторую неделю в течение 2-30 недель, или(iv) один раз в неделю. 2. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент имеет аминокислотную последовательность, по меньшей мере на 80% идентичную аминокислотам 30-110 аминокислотной последовательности SEQ ID NO: l. 3. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент имеет аминокислотную последовательность, по меньшей мере на 90% идентичную аминокислотам 30-110 аминокислотной последовательности SEQ ID NO: l. 4. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент имеет аминокислотную последовательность, по меньшей мере на 95% идентичную аминокислотам 30-110 аминокислотной последовательности SEQ ID NO: l. 5. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент имеет аминокислотную последовательность, по меньшей мере на 99% идентичную аминокислотам 30-110 аминокислотной последовательности SEQ ID NO: l. 6. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент включает аминокислоты 30-110 аминокислотной последовательности SEQ ID NO: l. 7. Способ по п.1, где указанный внеклеточный домен TACI или его фрагмент состоит из аминокислот 30-110 аминокислотной последовательности SEQ ID NO: l. 8. Способ по любому из пп.1-7, где указанный константный домен иммуноглобулина включает модифицированную Fc-часть IgG человека, и указанная слитая молекула предпочтительно представляет собой слитую молекулу TACI-Fc5. 9. Способ по любому из пп.1-8, где указанную композицию вводят в указанном количестве 7 раз в течение двенадцатинедельного интервала. 10. Способ по п.9, где указанную композицию вводят в указанном количестве 7 раз в течение двенадцатинедельного интервала с последующими дополнительными введениями указанной композиции в указанном количестве. 11. Способ по любому из пп.1-8, где указанную композицию вводят в указанном количестве 3 раза в течение четырехнедельного интервала. 12. Способ по п.11, где указанную композицию вводят в указанном количестве 3 раза в течение четырехнедельного интервала с последующими дополнительными введениями указанной композиции в указанном количестве. 13. Способ по любому из пп.1-8, где указанную композицию вводят в указанном количестве каждую вторую неделю в течение 2-30 недель. 14. Способ по любому из пп.1-8, где указанную композицию вводят в указанном количестве один раз в неделю. 15. Способ по любому из пп.1-14, дополнительно предусматривающий одновременное введение пациенту второго лекарственного средства. 16. Способ по п.15, где указанное второе лекарственное средство выбрано из группы, состоящей из гидроксихлорохина, сульфасалазина, метотрексата, лефлуномида, ритуксимаба, инфликсимаба, азатиоприна, D-пеницилламина, золота (перорально или внутримышечно), миноциклина, циклоспорина, кортикостероида, нестероидного противовоспалительного лекарственного средства (NSAIDS), цитокина, антицитокина и интерферона. 17. Способ по любому из пп.1-16, где указанную композицию вводят подкожно, орально или внутривенно. 18. Способ по любому из пп.1-17, где пациентом является человек. Фиг. 2 Зоны для подкожной инъекции молекулы TACI-Ig
МПК / Метки
МПК: A61P 19/02, A61K 38/00
Метки: taci-ig, использованием, лечения, слитой, способы, молекулы, заболеваний, аутоиммунных
Код ссылки
<a href="https://eas.patents.su/20-15342-sposoby-lecheniya-autoimmunnyh-zabolevanijj-s-ispolzovaniem-slitojj-molekuly-taci-ig.html" rel="bookmark" title="База патентов Евразийского Союза">Способы лечения аутоиммунных заболеваний с использованием слитой молекулы taci-ig</a>
Предыдущий патент: Новые композиции нематоцидов
Следующий патент: Модуляторы метаболизма и лечение связанных с ним расстройств
Случайный патент: Производные n-(арилалкил)-1н-пирролопиридин-2-карбоксамидов, их получение и их применение в терапии