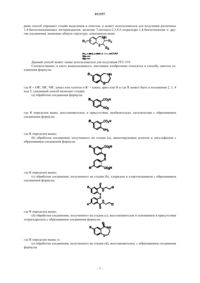
Способ синтеза бензотиазепиновых соединений
Номер патента: 11357
Опубликовано: 27.02.2009
Авторы: Маркс Эндрю Роберт, Дэн Ши Сянь, Чэн Чжэн Чжуан, Лэндри Дональд В.
Формула / Реферат
1. Способ синтеза соединения формулы
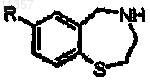
где R = OR', SR', NR'2, алкил или галоген и R' = алкил, арил или Н, и где R может находится в положении 2, 3, 4 или 5, включающий стадии:
(а) обработки соединения формулы

где R определен выше, диазотирующим агентом и дисульфидом с образованием соединения формулы
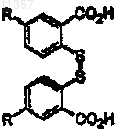
где R определен выше;
(b) обработки соединения, полученного на стадии (а), хлоридом и хлорэтиламином с получением соединения формулы
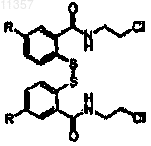
где R определен выше;
(с) обработки соединения, полученного на стадии (b), восстановителем и основанием в присутствии тетрагидролата с образованием соединения формулы

где R определен выше;
(d) обработки соединения, полученного на стадии (с), восстановителем с образованием соединения формулы
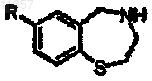
где R определен выше.
2. Способ по п.1, в котором диазотирующий агент на стадии (а) представляет собой NaNO2.
3. Способ по п.1, в котором дисульфид на стадии (а) представляет собой Na2S2.
4. Способ по п.1, в котором хлорид на стадии (b) представляет собой SOCl2.
5. Способ по п.1, в котором восстановитель на стадии (с) представляет собой триметилфосфин (РМе3).
6. Способ по п.1, в котором основание на стадии (с) представляет собой триэтиламин.
7. Способ по п.1, в котором восстановитель на стадии (d) представляет собой LiAlH4.
8. Способ по п.1, в котором соединение на стадии (а), имеющее формулу
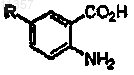
где R = OR', SR', NR'2, алкил или галоген и R' = алкил, арил или Н, и где R может находиться в положении 2, 3, 4 или 5, синтезируют способом, включающим стадию
(е) обработки соединения формулы
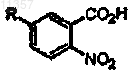
где R определен выше, восстановителем, необязательно в присутствии катализатора, с образованием соединения формулы
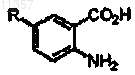
где R определен выше.
9. Способ синтеза соединения формулы
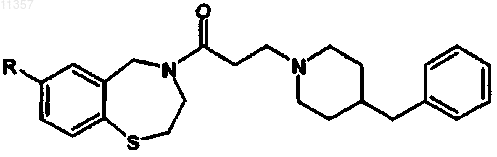
где R = OR', SR', NR'2, алкил или галоген и R' = алкил, арил или Н, и где R находится в положении 2, 3, 4 или 5, включающий стадии:
(а) обработки соединения формулы
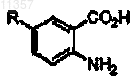
где R определен выше, диазотирующим агентом и дисульфидом с образованием соединения формулы
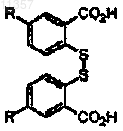
где R определен выше;
(b) обработки соединения, полученного на стадии (а), хлоридом и хлорэтиламином с получением соединения формулы
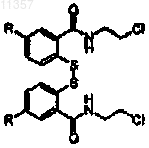
где R определен выше;
(с) обработки соединения, полученного на стадии (b), восстановителем и основанием в присутствии тетрагидролата с образованием соединения формулы
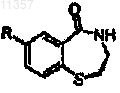
где R определен выше;
(d) обработки соединения, полученного на стадии (с), восстановителем, с образованием соединения формулы

где R определен выше;
(е) обработки соединения, полученного на стадии (d), хлорангидридом 3-бромпропионовой кислоты и соединением формулы

с получением соединения формулы
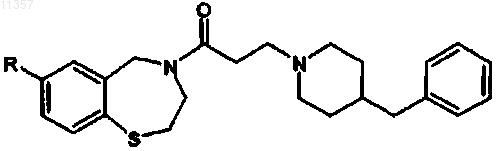
где R определен выше.
10. Способ по п.1, в котором соединение, которое синтезируют, имеет формулу
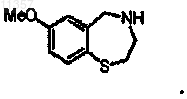
11. Способ по п.1, в котором соединение на стадии (а), имеющее формулу
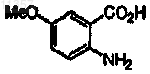
синтезируют способом, включающим стадию
(е) обработки соединения формулы
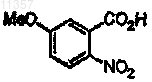
восстановителем, необязательно в присутствии катализатора, с получением соединения формулы
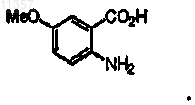
12. Способ по п.9, в котором соединение, которое синтезируют, имеет формулу
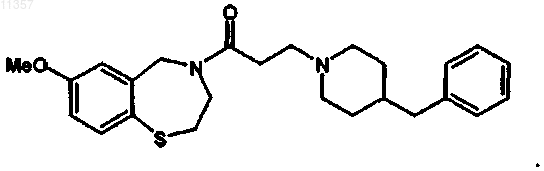
Текст
011357 Родственные заявки Настоящая заявка является частичным продолжением заявки на патент США, серийный 10/608723, поданной 26 июня 2003 г., которая представляет собой частичное продолжение заявки на патент США, серийный 10/288606, поданной 5 ноября 2002 г., которая является продолжением заявки на патент США, серийный 09/568474, поданной 10 мая 2000 г., и которая в настоящее время представляет собой патент США 6489125 В 1, о публикованный 3 декабря 2002 г., полное содержание которого включено в настоящее описание в качестве ссылки. Заявление об интересах правительства Настоящее изобретение было осуществлено при правительственной поддержке в рамках гранта NIHNo. PO1 HL 67849-01. В этой связи, правительство Соединенных Штатов имеет определенные права на настоящее изобретение. Уровень техники Сердечная недостаточность является главной причиной смертности и заболеваемости во всем мире. В случае более серьезных проявлений сердечной недостаточности (класс IV по классификации New YorkHeart Association) двухлетний уровень смертности достигает свыше 50% (Braunwald, E.B., Heart Disease,4th ed. (Philadelphia: W.B. Saunders Co., 1992. Сердечная аритмия, как общая особенность проявления сердечной недостаточности, приводит во многих случаях к смертельному исходу от этого заболевания. В частности, примерно 50% всех пациентов с болезнью сердца умирают от летальных сердечных аритмий. Некоторые желудочковые аритмии сердца приводят к быстрому летальному исходу, это явление известно как внезапная сердечная смерть (SCD). При этом летальные желудочковые аритмии могут случаться у молодых, в остальном здоровых людей, которые не знали о наличии у них структурных изменений,связанных с сердечным заболеванием. Фактически, желудочковая аритмия является самой распространенной причиной внезапной смерти у здоровых во всех других отношениях индивидуумов. Катехоламинергическая полиморфная желудочковая тахикардия (CPVT) представляет собой наследственное расстройство у людей, имеющих структурно нормальное сердце. Она характеризуется вызываемой стрессом желудочковой тахикардией, которая представляет собой летальную аритмию, способную вызвать внезапную сердечную смерть. У пациентов с CPVT физическая нагрузка и/или стресс индуцируют двунаправленную и/или полиморфную желудочковую тахикардию, которая ведет к SCD, в отсутствие выраженной структурной патологии сердца (Laitinen et al., Mutations of the cardiac ryanodineCPVT в основном наследуется по аутосомно-доминантному типу. Индивидуумы с CPVT имеют желудочковую тахикардию в случае физических нагрузок, но у них не развивается аритмия в спокойном состоянии. Исследования связи и непосредственных последствий таких процессов выявили наличие мутаций в гене человеческого RyR2, в хромосоме 1q42-q43 у индивидуумов с CPVT (Laitinen et al., Mutations of the cardiac ryanodine receptor (RyR2) gene in familial polymorphic ventricular tachycardia. Circulation, 103:485-90, 2001; Priori et al., Mutations in the cardiac ryanodine receptor gene (hRyR2) underlie catecholaminergic polymorphic ventricular tachycardia. Circulation, 103:196-200,2001; Swan et al., Arrhythmic disorder mapped to chromosome 1q42-q43 causes malignant polymorphic ventricular tachycardia in structurally normal 'hearts. J. Am. Coll. Cardiol., 34: 2035-42, 1999). Сердечная недостаточность характеризуется прогрессирующим снижением сократительной способности сердечной мышцы, которая ведет к снижению перфузии важных органов. Сокращение сердечной мышцы и другой поперечно-полосатой мышцы инициируется при высвобождении кальция (Са 2+) из саркоплазматического ретикулума (SR) в окружающую цитоплазму. Каналы высвобождения кальция наSR, включая рецепторы рианодина (RyR), необходимы для сопряжения процесса возбуждениясокращения (ЕС) (то есть для сопряжения потенциала действия с сокращением мышечной клетки). Имеются три типа рецепторов рианодина, которые тесно связаны с каналами Са 2+: RyR1, RyR2 и RyR3. RyR1 обнаружен в скелетной мышце, RyR2 обнаружен в сердце и RyR3 локализуется в мозге. Рецептор рианодина типа 2 (RyR2) представляет собой основной канал высвобождения Са 2+, необходимый для сопряжения ЕС и мышечного сокращения мышцы, в случае сердечной поперечнополосатой мышцы. Каналы RyR2 сгруппированы в плотные массивы на специализированных участках SR, которые высвобождают внутриклеточные запасы Са 2+ и тем самым запускают мышечное сокращение (Marx et al.,Coupled gating between individual skeletal muscle Ca2+ release channels (ryanodine receptors). Science, 281: 818-21, 1998). При сопряжении ЕС деполяризация клеточной мембраны в сердечной мышце в нулевой фазе потенциала действия активизирует потенциалозависимые Са 2+ каналы. В свою очередь, поток Са 2+ через эти каналы инициирует высвобождение Са 2+ из SR через RyR2 в ходе процесса, известного как Са 2+-индуцированное высвобождение Са 2+ (Fabiato, A., Calcium-induced release of calcium from the cardiacgated by calcium current, not gating charge, in cardiac myocytes. Science, 244: 800-03, 1989). RyR2 опосредованное Са 2+-индуцированное высвобождение Са 2+ активирует сократительные белки, которые ответственны за сокращение сердечной мышцы.RyR2 представляет собой белковый комплекс, включающий четыре полипептида RyR2 по 565000 Да, ассоциированных с четырьмя связывающими белками FK506 по 12000 Да (FKBP), в частности, с белками FKBP12.6. FKBP представляют cis-trans пептидил-пролилизомеразы, которые экспрессируются достаточно широко и выполняют множество клеточных функций (Marks, A. R., Cellular Functions of immunophilins. Physiol. Rev., 76:631-49, 1996). Белки FKBP12 прочно связаны со скелетным рецептором рианодина, RyR1 (Brillantes et al., Stabilization of calcium release channel (ryanodine receptor) function byFK506-binding protein. Cell, 11: 513-23, 1994; Jayaraman et al., FK506 binding protein associated with the calcium release channel (ryanodine receptor). J. Biol. Chem., 267: 9474-77, 1992); сердечным рецептором рианодина RyR2 (Kaftan et al., Effects of rapamycin on ryanodine receptor/Ca(2+)-release channels from cardiacmuscle. Circ. Res., 78: 990-97, 1996), родственным внутриклеточным каналом высвобождения Са 2+, известным как рецептор инозитол-1,4,5-трифосфата типа 1 (IP3R1) (Cameron et al., FKBP12 binds the inositol 1,4,5-triphosphate receptor at leucine-proline (1400-1401) and anchor calcineurin to this FK506-like domain, J.Biol. Chem., 272: 27582-88, 1997); a также рецептором трансформирующего ростового факторатипа I(TGF) (TRI) (Chen et al., Mechanism of TGF receptor inhibition by FKBP12. EMBO J, 16: 38 66-76, 1997) регулируют их функции. FKBP12.6 связывается с каналом RyR2 (по одной молекуле на субъединицуRyR2), стабилизирует функцию канала RyR2 (Brillantes et al., Stabilization of calcium release channel (ryanodine receptor) function by FK506-binding protein. Cell, 77: 513-23, 1994) и облегчает синхронизацию открывания соседних RyR2 каналов (Marx et al., Coupled gating between individual skeletal muscle Ca2+release channels (ryanodine receptors). Science, 281: 818-21, 1998), что предотвращает аберрантную активацию каналов в фазе покоя сердечного цикла. Сердца в состоянии сердечной недостаточности (например, у пациентов с сердечной недостаточностью и на моделях животных с сердечной недостаточностью) характеризуются нарушением адаптивной реакции, которая включает хроническую гиперадренергическую стимуляцию (Bristow et al., Decreasedcatecholamine sensitivity and -adrenergic-receptor density in failing human hearts. N. Engl. J. Med., 307: 20511, 1982). Патогенетическая значимость такой стимуляции при сердечной недостаточности подтверждается действенностью терапевтических подходов, направленных на снижение -адренергической стимуляции и напряжения в стенке левого желудочка миокарда и в особенности связанных с обратным ремоделированием желудочка (Barbone et al., Comparison of right and left ventricular responses to left ventricularbiological properties of the chronically failing heart. A new era in the treatment of heart failure. Circulation, 94: 2285-96, 1996). В состоянии сердечной недостаточности хроническая -адренергическая стимуляция ассоциирована с активацией -адренергических рецепторов в сердце, которые при сопряжении с Gбелками активируют аденилилциклазу и, тем самым, повышают концентрацию внутриклеточного цАМФ. цАМФ активирует цАМФ-зависимую протеинкиназу (РКА), которая, как было показано, индуцирует гиперфосфорилирование RyR2. Было высказано предположение о том, что гиперфосфорилирование RyR2 вносит вклад в снижение сократительной функции и является аритмогенным фактором при сердечной недостаточности (Marks etfactor Circulation, 105: 272-75, 2002; Marx et al., PKA phosphorylation dissociates FKBP12.6 from the calcium release channel (ryanodine receptor): defective regulation in failing hearts. Cell, 101: 365-76, 2000). Данную гипотезу поддерживает тот факт, что гиперфосфорилирование RyR2 под действием РКА при сердечной недостаточности в сердце выявлено in vivo как на животных моделях, так и у пациентов с сердечной недостаточностью, подвергавшихся сердечной трансплантации (Antos et al., Dilated cardiomyophathy and sudden death resulting from constitutive activation of protein kinase A. Circ. Res., 89: 997-1004,2001; Marx et al., PKA phosphorylation dissociates FKBP12.6 from the calcium release channel (ryanodine receptor): defective regulation in failing hearts. Cell, 101: 365-76, 2000); Ono et al., Altered interaction ofCa(2+) leak through ryanodine receptor in heart failure. Circulation, 102: 2131-36, 2000). В случае сердец в состоянии сердечной недостаточности гиперфосфорилирование RyR2 под действием РКА индуцирует диссоциацию регуляторной субъединицы FKBP12.6 от RyR2 канала (Marx et al.,РКА phosphorylation dissociates FKBP12.6 from the calcium release channel (ryanodine receptor): defectiveregulation in failing hearts. Cell, 101: 365-76, 2000). Это вызывает выраженные изменения биофизических-2 011357 свойств канала RyR2. Такие изменения проявляются в повышенной вероятности открывания (Ро), связанной с повышенной чувствительностью к Са 2+-зависимой активации (Brillantes et al., Stabilization ofet al., Effects of rapamycin on ryanodine receptor/Ca(2+)-release channel from cardiac muscle. Circ. Res., 78: 990-97, 1996), в дестабилизации канала, которая приводит к состояниям субпроводимости; а также в нарушении сопряжения открытия каналов, что вызывает дефекты в процессе ЕС сопряжения и сердечную дисфункцию (Marx et al., Coupled gating between individual skeletal muscle Ca2+ release channels (ryanodinereceptors). Science, 281: 818-21, 1998). Таким образом, гиперфосфорилирование RyR2 под действием РКА очень чувствительно к стимуляции низкими уровнями Са 2+, что проявляется в виде проникновения Са 2+ вSR через гиперфосфорилированный канал. В структурно нормальных сердцах также может иметь место аналогичное явление. В частности, известно, что физическая нагрузка и стресс индуцируют высвобождение катехоламинов, которые активируют -адренергические рецепторы в сердце. Активация -адренергических рецепторов ведет к гиперфосфорилированию каналов RyR2. Кроме того, имеющиеся данные позволяют предположить, что гиперфосфорилирование RyR2, возникающее в результате активации -адренергического рецептора, повышает вероятность открытия мутированных каналов RyR2 в фазе релаксации сердечного цикла, повышая вероятность развития аритмий. Известно, что сердечные аритмии ассоциированы с проникновением Са 2+ в SR в структурно нормальных сердцах. В таких случаях самым распространенным механизмом индукции и поддержания желудочковой тахикардии является аномальный автоматизм. Одна форма аномального автоматизма, известная как стимулированная аритмия, ассоциирована с аберрантным высвобождением Са 2+ в SR, которое инициирует задержанную постдеполяризацию (DAD) (Fozzard H.A., Afterdepolarizations and triggeredactivity. Basic Res. Cardiol., 87: 105-13, 1992; Wit and Rosen, Pathophysiologic mechanisms of cardiac arrhythmias. Am. Heart J., 106: 798-811, 1983). DAD, которые могут запускать летальные желудочковые аритмии, представляют собой аномальную деполяризацию кардиомиоцитов, которая происходит после реполяризации потенциала действия сердца. Молекулярные основы аномального высвобождения Са 2+ вSR, которые приводят к DAD, полностью не изучены. Однако известно, что DAD блокируется рианодином, что свидетельствует о том, что RyR2 может играть определенную ключевую роль в патогенезе такого аберрантного высвобождения Са 2+ (Marban et al., Mechanisms of arrhythmogenic delayed and early afterdepolarization in ferret ventricular muscle. J. Clin. Invest., 78: 1185-92, 1986; Song and Belardinelli, ATP promotes development of afterdepolarizations and triggered activity in cardiac myocytes. Am. J. Physiol., 267:H2005-11, 1994). В связи с вышесказанным, понятно, что просачивание в каналы RyR2 ассоциировано с большим числом патологических состояний, как в случае больного сердца, так и структурно нормального сердца. Соответственно способы устранения просачивания в RyR2 могут предотвращать летальные аритмии у миллионов пациентов.JTV-519 (моногидрохлорид 4-[3-(4-бензилпиперидин-1-ил)пропионил]-7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина, также известный, как k201), как производное 1,4-бензотиазепина, представляет собой новый модулятор кальциевых ионных каналов. Дополнительно к регуляции уровня Са 2+ в клетках миокарда, JTV-519 также модулирует поток ионов Na+ и направленный внутрь стабилизирующий поток K+ в клетки желудочков морских свинок и ингибирует задержанный стабилизирующий поток K+ в клетки предсердия морской свинки. Исследования показали, что JTV-519 оказывает мощное кардиопротекторное действие, направленное против катехоламин-индуцированного повреждения миокарда, индуцированного повреждением миокарда миофибриллярного сердцебиения и ишемии/реперфузионного повреждения. На моделях с экспериментальным миофибриллярным сердцебиением, JTV-519 демонстрировал более высокий кардиопротекторный эффект, чем пропранолол, верапамил и дилтиазем. Экспериментальные данные также указывают на то, что JTV-519 эффективно предотвращает желудочковую ишемию/реперфузию за счет снижения уровня внутриклеточного избытка Са 2+ на моделях животных. Сущность изобретения Авторы изобретения разработали новый способ синтеза JTV-519, а также получили радиоактивно меченый вариант данного лекарственного средства. Таким образом, настоящее изобретение относится к способам синтеза JTV-519, а также интермедиатов и производных 1,4-бензотиазепина, которые включают где R = OR', SR', NR'2, алкил или галоген и R' = алкил, арил или Н и где R может находиться в положении 2, 3, 4 или 5; где R = OR', SR', NR'2, алкил или галоген и R' = алкил, арил или Н и где R может находиться в положении 2, 3, 4 или 5; где R1 = n-MeO, n-MeS или n-алкил, n = 6, 7, 8 или 9; где R2 = алкил и где R3 = алкил. В еще одном аспекте настоящее изобретение относится к способу синтеза радиоактивно меченогоJTV-519. Дополнительные аспекты настоящего изобретения станут очевидными после ознакомления с приведенным ниже описанием. Краткое описание чертежей На фиг. 1 показано, что JTV-519 препятствует развитию индуцированных физической нагрузкой желудочковых аритмий у мышей FKBP12.6+/-. (А) Репрезентативные амбулаторные электрокардиограммы необработанной мыши FKBP12.6+/- и мыши FKBP12.6+/-, обработанной JTV-519, и мыши FKBP12.6-/-,обработанной JTV-519. He отмечается значительных различий по частоте сердечных сокращений и по любому из измеренных параметров ЭКГ. (В) Верхний график: пример длительной полиморфной желудочковой тахикардии, зарегистрированной для необработанной мыши FKBP12.6+/-, которая была подвергнута физической нагрузке и инъекции 1,0 мг/кг эпинефрина. Средний график: электрокардиограмма мыши FKBP12.6+/- после введения JTV-519 по тому же протоколу; аритмия не выявлена. Нижний график: индуцированная физической нагрузкой желудочковая тахикардия (VT) у мыши FKBP12.6-/- при введенииJTV-519. Прерывистая линия обозначает точку 16,31 с для VT, которая не показана на чертеже. Р обозначает зубец Р, который показателен для синусового ритма после желудочковой тахикардии. (С) Диаграмма, указывающая число случаев внезапной сердечной смерти (слева), длительной желудочковой тахикардии (10 ударов, в середине чертежа) и преходящей желудочковой тахикардии (3-10 аномальных удара, справа), у мышей FKBP12.6+/- и FKBP12.6-/-, при введении или без введения JTV-519 соответственно. Следует отметить, что введение JTV-519 полностью предотвращает развитие индуцированных физической нагрузкой и эпинефрином аритмий у мышей FKBP12.6+/-, при введении им JTV-519 (n=9), в сравнении с необработанными мышами FKBP12.6+/- (n=10) или мышами FKBP12.6-/-, обработаннымиJTV-519 (n=5), что дает основание полагать, что JTV-519 препятствует развитию аритмий и предотвращает внезапную сердечную смерть у мышей FKBP12.6+/- за счет повторного связывания FKBP12.6 сRyR2. На фиг. 2 показано, что JTV-519 предотвращает вызванную физической нагрузкой внезапную сердечную смерть (SCD) за счет повышения аффинности FKBP12.6 к RyR2 у мышей FKBP12.6+/-. (A-B) Рецепторы рианодина в сердце (RyR2) подвергают иммунопреципитации с использованием антитела RyR25029. Показаны иммуноблоты (А) и диаграммы (В), отражающие количества FlyR2, РКАфосфорилированного RyR2 (антитело RyR2-pSer2809) и FKBP12.6 у мышей дикого типа (FKBP12.6+/+),мышей FKBP12.6+/- и FKBP12.6-/- в состоянии покоя с последующей физической нагрузкой, в отсутствие или при наличии JTV-519 соответственно. В состоянии покоя 70% FKBP12.6 ассоциировано с RyR2 у-4 011357 мышей FKBP12.6+/-. После тестирования с физической нагрузкой выявляется, что количество FKBP12.6,ассоциированного с комплексом RyR2, резко снижается у мышей FKBP12.6+/-, но в случае введения JTV519 такого снижения удается избежать. (С) Отдельные каналы RyR2 были выделены из сердец, полученных после тестирования с физической нагрузкой и с инъекцией эпинефрина. Показаны каналы, выделенные из мышей FKBP12.6+/-, при проведении и без проведения предварительной обработки с использованием JTV-519, и каналы, выделенные из мышей FKBP12.6-/- после их предварительной обработки JTV519. Следует отметить, что функция RyR2 канала нормализуется у мыши FKBP12.6+/-, подвергнутой физической нагрузке, при введении JTV-519. Репрезентативный отдельный канал, выделенный из мышиFKBP12. 6-/-, подвергнутой физической нагрузке, после введения JTV-519, указывает на то, что в сердце необходимо наличие FKBP12.6 для действия JTV-519. Прерывистые линии указывают неполное открытие канала или открытие по типу субпроводимости, что является показательным для каналов RyR2 при недостатке FKBP12.6. Линии слева обозначают точку 5,0 с, тогда как линии справа обозначают точку 500 мс. На чертеже Ро = вероятность открытия; То = среднее время в открытом состоянии; Тс = среднее время в закрытом состоянии и с = канал в закрытом состоянии. (D) Суммарная диаграмма, показывающая среднее значение вероятности открытия отдельных каналов RyR2 (см. выше). JTV-519 резко снижает вероятность открытия RyR2 у мышей FKBP12.6+/- в условиях тестирования после физической нагрузки при диастолических концентрациях кальция (150 нМ). Фиг. 3 иллюстрирует нормализованную JTV-519 синхронизацию открытия канала RyR2 за счет повышения связывающей аффинности FKBP12.6 к PKA-фосфорилированным каналам RyR2. (А, В) Мембраны из сердца собаки в SR (А) и рекомбинантно экспрессированные каналы RyR2 (В) получают по описанной ранее методике (Kaftan et al., Effects of rapamycin on ryanodine receptor/Ca(2+)-release channelsfrom cardiac muscle. Circ. Res., 78:990-97, 1996). (A) Рецепторы рианодина (RyR2) подвергают фосфорилированию каталитической субъединицей PKA (40 Ед.; Sigma Chemical Co., St. Louis, МО) в присутствии или в отсутствие ингибитора PKA, PKI5-24, в буфере для фосфорилирования (8 мМ MgCl2, 10 мМ EGTA и 50 мМ Трис/PIPES; рН 6,8). Образцы центрифугируют при 100000g в течение 10 мин и промывают три раза в имидазольном буфере (10 мМ имидазола; рН 7). К образцам добавляют рекомбинантно экспрессированный FKBP12.6 (конечная концентрация = 250 нМ), в отсутствие или при наличии варьирующих концентраций JTV-519. После инкубации в течение 60 мин образцы центрифугируют при 100000g в течение 10 мин и промывают два раза в имидазольном буфере. Образцы нагревают до температуры 95 С и фракционируют по размеру с использованием ДСН-ПААГ. Проводят иммуноблоттинг микросом из SR по описанной ранее методике (Jayaraman et al., FK506 binding protein associated with the calcium release channel (ryanodine receptor). J. Biol. Chem., 267:9474-77, 1992) с использованием антитела против FKBP12.6 (1:1000) и антитела против RyR2-5029 (1:3000). На чертеже показано, что JTV-519 создает возможность для связывания FKBP12.6 с (А) PKA-фосфорилированным RyR2 (частичное связывание при 100 нМ; полное связывание при 1000 нМ) или (В) мутантными каналами RyR2-S2809D, которые представляют собой конститутивно PKA-фосфорилированные RyR2 каналы. (С-Е) Исследования отдельных каналов, показывающие повышенную вероятность открытия RyR2 после фосфорилирования под действием PKA (D), в сравнении с PKA-фосфорилированием, в присутствии специфического ингибитора PKA, PKI5-24 (С). Функцию отдельного канала нормализуют в PKA-фосфорилированном RyR2, при инкубировании сFKBP12.6 в присутствии JTV-519 (E). Открытие каналов показано сверху, прерывистая линия обозначает уровень полного открытия (4 рА), а буква с указывает на закрытое состояние. Каналы показаны по сжатой (5 с, верхний график) и расширенной (500 мс, нижний график) временной шкале и регистрация проведена при 0 мВ. Значения амплитуды на гистограммах (справа) демонстрируют повышенную активность и открытие по типу субпроводимости в PKA-фосфорилированном RyR2, но не после введенияJTV-519 и FKBP12.6. (F) Нормализованный график вероятности открытия как функции концентрации[Са 2+] в цитозоле. Инкубация PKA-фосфорилированного RyR2 с FKBP12.6 в присутствии JTV-519 сдвигает Са 2+-зависимую активацию RyR2 вправо, делая ее похожей на Са 2+-зависимость в случае нефосфорилированных каналов. Подробное описание изобретения Как указывалось выше, катехоламинергическая полиморфная желудочковая тахикардия (CPVT) представляет собой наследственное нарушение у людей со структурно нормальным сердцем. Оно характеризуется желудочковой тахикардией, индуцируемой стрессом, которая представляет собой летальную аритмию, способную вызвать внезапную сердечную смерть (SCD). Мутации в RyR2 каналах, локализованных в саркоплазматическом ретикулуме (SR), связаны с CPVT. Для определения молекулярного механизма, лежащего в основе летальной сердечной аритмии при CPVT, авторы изобретения исследовали мутантные RyR2 каналы, ассоциированные с CPVT (например, S2246L, R2474S, N4104K, R4497C). Все индивидуумы с CPVT имеют сердечные аритмии, индуцированные физической нагрузкой. Ранее авторы настоящего изобретения показали, что индуцированные физической нагрузкой аритмии и внезапная смерть (у пациентов с CPVT) являются результатом сниженной аффинности FKBP12.6 к RyR2. В настоящей работе авторы показали, что физическая нагрузка активирует RyR2 в результате фосфори-5 011357 лирования аденозин-3',5'-монофосфата (цАМФ)-зависимой протеинкиназой (РКА). Мутантные RyR2 каналы, которые нормально функционируют в планарных липидных бислоях в обычных условиях, становятся более чувствительными к активации под действием PKA-фосфорилирования, демонстрируя повышенную активность (вероятность открытия) и пролонгированное пребывание в открытом состоянии, в сравнении с каналами дикого типа. Дополнительно мутантные PKA-фосфорилированные RyR2 каналы устойчивы к ингибированию под действием Mg2+ физиологического ингибитора канала и демонстрируют сниженную способность связываться с FKBP12.6 (который стабилизирует канал в закрытом состоянии). Данные результаты указывают на то, что в ходе физической нагрузки, когда RyR2 фосфорилируются под действием PKA, мутантные CPVT каналы с большей вероятностью открываются в фазе релаксации сердечного цикла (диастоле), что повышает вероятность аритмий, стимулируемых проникновением Са 2+ вSR. Поскольку сердечная недостаточность является основной причиной смерти во всем мире, способы устранения такого просачивания в RyR2 могут предотвращать развитие летальных аритмий у миллионов пациентов по всему миру. Авторы изобретения также показали, что JTV-519, как производное бензотиазепина, препятствует развитию летальных желудочковых аритмий у мышей, гетерозиготных по гену FKBP12.6. JTV-519 снижает вероятность открытия RyR2, выделенного из мышей FKBP12.6+/-, которые умерли после физической нагрузки, за счет повышения аффинности FKBP12.6 к PKA-фосфорилированному RyR2. Кроме того, JTV-519 нормализует синхронизацию открытия CPVT-ассоциированных мутантных каналов RyR2 за счет повышения их аффинности по связыванию с FKBP12.6. Приведенные данные указывают на то, чтоJTV-519 может предотвращать развитие летальных желудочковых аритмий за счет повышения связывающей аффинности FKBP12.6-RyR2. Возможно разработать и/или провести скрининг соединений, которые были бы родственны таким соединениям, но обладали противоположным действием. Новые пути химического синтеза Производные 1,4-бензотиазепина представляют собой важные строительные блоки для получения биологически активных молекул, включая JTV-519. Авторы разработали новый способ получения промежуточных соединений на основе 1,4-бензотиазепина, таких как 7-метокси-2,3,4,5-тетрагидро-1,4 бензотиазепин. Разработанный авторами способ, в котором используются легко доступные и недорогие исходные материалы, дает высокий выход ключевых 1,4-бензотиазепиновых интермедиатов. В начале 90-х годов Канеко с соавт. (Kaneko et al., патент США 5416066; WO 92/12148; JP 4230681) показали, что JTV-519 может быть получен при взаимодействии 7-метокси-2,3,4,5-тетрагидро-1,4 бензотиазепина (1,4-бензотиазепинового интермедиата) с акрилоилхлоридом, с проведением впоследствии реакции полученного продукта с 1,4-бензилпиперидином. Два способа получения 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина и исходных соединений ранее были описаны в литературе. Первый способ, описанный Канеко с соавт. (Kaneko et al., патент США 5416066), включает процесс синтеза из шести стадий, который начинается с 2,5 дигидроксибензойной кислоты. В данном способе 2,5-дигидроксибензойную кислоту подвергают избирательному метилированию диметилсульфатом. Полученное соединение подвергают реакции с диметилтиокарбамоилхлоридом в течение 20 ч и затем подвергают воздействию высокой температуры (270 С) в течение 9 ч. Полученный на данной стадии продукт кипятят с обратным холодильником с использованием метоксида натрия в метаноле в течение 20 ч. Продукт, полученный на стадии кипячения с обратным холодильником, подвергают далее реакции с 2-хлорэтиламином в щелочных условиях при высокой температуре с получением циклизованного амида. Циклизованный амид восстанавливают с использованиемLiAlH4, получая 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепин (1,4-бензотиазепиновый интермедиат). Второй способ получения 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина описан Хитоши(Hitoshi) в патенте Японии (JP 10045706). Данный процесс начинают с 2-бром-5-метоксибензальдегида. Бромид замещают NaSMe и полученный продукт окисляют хлором, затем кипятят с обратным холодильником в воде с получением дисульфидного диальдегида. Диальдегид обрабатывают 2-хлорэтиламином и полученный продукт восстанавливают восстановителем, таким как NaBH4. Полученное соединение циклизуют с образованием 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина. Вначале авторы изобретения попытались получить 1,4-бензотиазепиновый интермедиат, 7-метокси 2,3,4,5-тетрагидро-1,4-бензотиазепин с использованием описанных выше методов. Однако они обнаружили, что первый способ, описанный Канеко с соавт. (Kaneko et al., патент США 5416066), включает стадии синтеза, которые требуют высокой температуры и длительного времени реакции. Дополнительно авторы показали, что тиогруппа в третьем тиолированном интермедиате легко окисляется на воздухе до дисульфидного соединения, что делает невозможным синтез следующего циклизованного продукта. Авторы изобретения также показали, что способ, описанный Хитоши (Hitoshi) в патенте Японии (JP 10045706), включает использованием Cl2 и что следует использовать другой запатентованный способ получения первого интермедиата, в котором не требуется замещение брома NaSMe. Для преодоления указанных выше проблем авторы разработали способ получения 7-метокси 2,3,4,5-тетрагидро-1,4-бензотиазепина из легко доступных и недорогих материалов. Разработанный авто-6 011357 рами способ упрощает стадии выделения и очистки, и может использоваться для получения различных 1,4-бензотиазепиновых интермедиатов, включая 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепин и другие соединения, имеющие общую структуру, показанную ниже Данный способ может также использоваться для получения JTV-519. Соответственно, в свете вышесказанного, настоящее изобретение относится к способу синтеза соединения формулы где R = OR', SR', NR', алкил или галоген и R' = алкил, арил или Н и где R может быть в положении 2, 3, 4 или 5, указанный способ включает стадии:(b) обработки соединения, полученного на стадии (а), диазотирующим агентом и дисульфидом с образованием соединения формулы(с) обработки соединения, полученного на стадии (b), хлоридом и хлорэтиламином с образованием соединения формулы(d) обработки соединения, полученного на стадии (с), восстановителем и основанием в присутствии тетрагидролата с образованием соединения формулы(е) обработки соединения, полученного на стадии (d), восстановителем, с образованием соединения формулы где R определен выше. В соответствии со способом настоящего изобретения восстановителем на стадии (а) может быть Н 2. Дополнительно диазотирующим агентом на стадии (b) может быть NaNO2 и дисульфидом на стадии (b) может быть Na2S2. Кроме того, хлорид на стадии (с) может представлять собой SOCl2. Восстановителем на стадии (d) может быть триметилфосфин (РМе 3), тогда как основанием на стадии (d) является триэтиламин. В другом варианте восстановителем на стадии (е) является LiAlH4. Настоящее изобретение также относится к способу синтеза соединения формулы где R = OR', SR', NR'2, алкил или галогенид и R' = алкил, арил или Н и где R может быть в положении 2,3, 4 или 5, и тогда указанный способ включает стадии: где R определен выше. В качестве примера можно указать, что соединение формулы где R = OR', SR', NR'2, алкил или галоген и R' = алкил, арил или Н, и в том случае, когда R находится в положении 2, 3, 4 или 5, может быть синтезировано следующим образом: Способ по настоящему изобретению также включает способ синтеза соединения формулы где указанный способ включает стадии: восстановителем в присутствии необязательно катализатора с образованием соединения формулы(b) обработки соединения, полученного на стадии (а), диазотирующим агентом и дисульфидом с образованием соединения формулы(с) обработки соединения, полученного на стадии (b), хлоридом и хлорэтиламином с образованием соединения формулы(d) обработки соединения, полученного на стадии (с), восстановителем и основанием в присутствии тетрагидролата с образованием соединения формулы(е) обработки соединения, полученного на стадии (d), восстановителем с образованием соединения формулы Настоящее изобретение также относится к способу синтеза соединения формулы где указанный способ включает стадии: В качестве примера в соответствии с приведенными ниже примером 7 и схемой 1 можно отметить,что 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепин может быть получен из 2-нитро-5-метоксибензойной кислоты следующим образом. Нитрогруппу в 2-нитро-5-метоксибензойной кислоте восстанавливают с использованием Н 2 и Pd/C в качестве катализатора с получением 2-амино-5-метоксибензойной кислоты. 2-Амино-5-метоксибензойная кислота может быть далее диазотирована с использованием NaNO2 и затем обработана Na2S2 с получением стабильного дисульфидного соединения. Без дополнительной очистки указанное стабильное дисульфидное соединение может быть обработано SOCl2, после чего его подвергают реакции с 2 хлорэтиламином в присутствии Et3N с получением амида. Далее амидное соединение преобразуют в циклизованное соединение в ходе однореакторной процедуры следующим образом. Восстановитель (такой как триметилфосфин или трифенилфосфин) и основание (такое как триэтиламин) добавляют к раствору амидного соединении в ТГФ (тетрагидрофоляте). Полученная реакционная смесь может быть подвержена кипячению с обратным холодильником в течение 3 ч. Восстановитель (триметилфосфин или трифенилфосфин) расщепляет дисульфид (S-S) до моносульфида (-S), который in situ подвергается внутримолекулярной циклизации с хлоридом с образованием циклизованного амида. Циклизованный амид может быть затем восстановлен LiAlH4 с образованием 1,4-бензотиазепинового интермедиата, 7 метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина. JTV-519 может быть получен из 7-метокси-2,3,4,5 тетрагидро-1,4-бензотиазепина путем взаимодействия 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина с хлорангидридом 3-бромпропионовой кислоты с последующим взаимодействием полученного соединения с 4-бензилпиперидином. В качестве примера и в соответствии с процедурой, показанной в примере 8 и на схеме 2, можно показать, что радиоактивно меченный JTV-519 получают следующим образом. JTV-519 подвергают деметилированию по фенильному кольцу с помощью BBr3. Полученное фенольное соединение может быть повторно метилировано с использованием радиоактивно меченого метилирующего агента (такого как 3 Ндиметилсульфат) в присутствии основания (такого как NaH) с получением 3 Н-меченого JTV-519. Настоящее изобретение также относится к композиции, включающей радиоактивно меченый JTV519. Мечение JTV-519 может быть осуществлено с использованием любой из множества радиоактивных меток, известных в данной области. Радиоактивной меткой по настоящему изобретению может быть,например, радиоизотоп. Радиоизотоп может представлять собой любой изотоп, который испускает выявляемое излучение, включающий, без ограничения, 35S, 32P, 125I, 3 Н или 14 С. Радиоактивность, испускаемая радиоизотопом, может быть обнаружена по методикам, известным в данной области. Например, гаммаизлучение от радиоизотопа может быть выявлено по способу визуализации гамма-излучения, в частности сцинтиграфической визуализации.- 10011357 Настоящее изобретение далее описывается приведенными ниже примерами, которые даны для пояснения изобретения и не должны трактоваться, как ограничивающие каким-либо образом настоящее изобретение, которое определяется приведенной в описании формулой изобретения. Примеры Пример 1. Мыши, дефицитные по FKBP12.6. Получают дефицитных по FKBP12.6 мышей по описанной ранее методике (Wehrens et al., FKBP12.6-фага для мышиного ортолога человеческого FK506-связывающего белка 12.6 (FKBP12.6) выделяют из библиотеки DBA/llacJ с использованием в качестве зонда кДНК мыши полной длины. Конструируют вектор-мишень с делецией экзонов 3 и 4, который содержит полные кодирующие последовательности для мышиного FKBP12.6 (Bennett et al., Identification and characterization of the murine FK506 binding protein (FKBP)12.6 gene. Mamm. Genome, 9: 1069-71, 1998), путем замещения 3,5 кбайт геномной ДНК мыши селектируемого маркером PGK-neo. 5'-фрагмент размером 5,0 Кбайт и 3'-фрагмент размером 1,9 кбайт клонируют в pJNS2, скелетном векторе, с использованием PGK-neo и PGK-TK кассет. Эмбриональные стволовые клетки (ES) DBA/lacJ выращивают и трансфицируют с использованием известных процедур. Целевые ES клетки вначале подвергают скринингу по методу саузерн-блоттинга с последующим анализом пяти позитивных клеточных линий ES по методике ПЦР для подтверждения гомологичной рекомбинации. Химерные формы самцов мышей скрещивают с самками DBS/llacJ, и гаметическое потомство идентифицируют по коричневой окраске шерсти. Проводят генотипический анализ гаметического потомства с использованием 5'-саузерн-блоттинга. Скрещивают позитивных FKBP12.6+/- самцов и самок, что приводит к получению у потомства формы FKBP12.6-/- с частотой примерно 25%. МышиFKBP12.6-/- были фертильны. Все исследования проводят на мышах FKBP12.6-/- с использованием в качестве контроля мышейFKBP12.6+/+, отобранных в соответствии с возрастом и полом. Никаких различий не было обнаружено между мышами FKBP12.6-/- в уровнях превышения над следующими фоновыми формами: смешанная форма DBA/C57BL6, чистая форма DBA и чистая форма C57BL6. Пример 2. Телеметрическая регистрация и тестирование с физической нагрузкой на мышах. Мышей FKBP12.6+/+ и FKBP12.6-/- поддерживают в соответствующем состоянии и исследуют по методикам, утвержденным Комитетом по работе с животными и их использованию Колумбийского Университета (Institutional Animal Care and Use Committee of Columbia University). Мышей подергают анестезии путем ингаляции 2,5% изофлурана. Спустя 7 дней после внутрибрюшинной имплантации проводят радиотелеметрическую регистрацию ЭКГ у амбулаторных животных (Data Sciences International, St. Paul,MN) (Wehrens et al., FKBP12.6 deficiency and defective calcium release channel (ryanodine receptor) functionlinked to exercise-induced sudden cardiac death. Cell, 113: 829-40, 2003). Для тестирования в условиях стресса мышей подвергают физической нагрузке на наклонной бегущей дорожке до истощения и затем вводят внутрибрюшинно эпинефрин (0,5-2,0 мг/кг) (Wehrens et al., FKBP12.6 deficiency and defective calcium release channel (ryanodine receptor) function linked to exercise-induced sudden cardiac death. Cell, 113: 829-40, 2003). Частоту сердцебиения в состоянии покоя у амбулаторных животных оценивали в среднем в течение 4 ч. Пример 3. Экспрессия дикого типа и мутантов RyR2-S2809D. Мутагенез сайта воздействия PKA на RyR2 (RyR2-S2809D) проводят по описанной ранее методикеlinked to exercise-induced sudden cardiac death. Cell, 113: 829-40, 2003). Клетки HEK293 подвергают совместной трансфекции с использованием 20 мкг кДНК для RyR2 дикого типа (WT) или мутантной формы и 5 мкг кДНК FKBP12.6, в соответствии с методикой, включающей осаждение фосфатом Са 2+. Получают везикулы, содержащие каналы RyR2, по описанной ранее методике (Wehreqs et al., FKBP12.6 deficiency and defective calcium release channel (ryanodine receptor) function linked to exercise-induced suddencardiac death. Cell, 113: 829-40, 2003). Пример 4. PKA-фосфолирирование RyR2 и связывание FKBP12.6. Получают мембраны из SR сердца по описанной ранее методике (Marx et al., PKA phosphorylationfrom cardiac muscle. Circ. Res., 78: 990-97, 1996). Получают 35S-меченый FKBP12.6 с использованием системы транскрипции/трансляции TNT (TNT Quick Coupled Transcription/Translation system) от компании Промега (Promega) (Madison, WI). Для оценки уровней RyR2 используют показатель степени связывания [3 Н]-рианодина. 100 мкг микросом разбавляют в 100 мкл 10 мМ имидазольного буфера (рН 6,8),инкубируют с 250 нМ (конечная концентрация) [35S]-FKBP12.6 при температуре 37 С в течение 60 мин и затем гасят реакцию добавлением 500 мкл охлажденного льдом имидазольного буфера. Образцы центрифугируют при 100000 g в течение 10 мин и промывают три раза в имидазольном буфере. Количество связанного [35S]-FKBP12.6 определяют по методу жидкого сцинтилляционного счета в осадке.- 11011357 Пример 5. Иммуноблоты. Иммуноблотинг микросом (50 мкг) проводят по описанной выше методике с использованием aнтиFKBP12/12.6 (1:1000), анти-RyR (5029; 1:3000) (Jayaraman et al., FK506 binding protein associated with the(P2809; 1:5000) в течение 1 ч при комнатной температуре (Reiken et al., -blockers restore calcium releasechannel function and improve cardiac muscle performance in human heart failure. Circulation, 107: 2459-66,2003). Р 2809-фосфоэпитопспецифичное антитело против RyR2 представляет собой очищенное аффинным способом поликлональное антитело кролика, изготовленное компанией Zymed Laboratories (SanTransduction Laboratories, Lexington, KY) блоты обрабатывают с использованием ECL (Amersham Pharmacia, Piscataway, NJ). Пример 6. Регистрация по отдельному каналу. Регистрацию по отдельному каналу нативного RyR2 из мышиных сердец или рекомбинантногоRyR2 проводят в условиях фиксации напряжения при 0 мВ по описанной ранее методике (Marx et al.,PKA phosphorylation dissociates FKBP12.6 from the calcium release channel (ryanodine receptor): defectiveregulation in failing hearts. Cell, 101: 365-76, 2000). Для регистрации активности канала используют симметричные растворы: транс-компартмент - HEPES - 250 ммоль/л; Ва(ОН)2 - 53 ммоль/л (в некоторых экспериментах Ва(ОН)2 заменяют на Са(ОН)2); рН 7,35; и цис-компартмент - HEPES - 250 ммоль/л; Трисоснование - 125 ммоль/л; EGTA - 1,0 ммоль/л; и CaCl2 - 0,5 ммоль/л; рН 7,35. Если особо не указано иное, регистрацию отдельных каналов проводят в присутствии 150 нМ [Са 2+] и 0,1 мМ [Mg2+] в цискомпартменте. Добавляют рианодин (5 мМ) к цис-компартменту для подтверждения идентичности всех каналов. Данные анализируют на основе записей цифровых показателей тока с использованием программного обеспечения Fetchan (Axon Instruments, Union City, CA). Все данные выражают в виде среднего значения СКО. Используют непарный критерий Стьюдента для статистического сравнения средних значений, полученных в экспериментах. Значение р 0,05 рассматривается как статистически значимое. Эффекты JTV-519 на каналы RyR2 проиллюстрированы на фиг. 1-3 и в таблице (ниже). Как показано на фиг. 3, исследования отдельных каналов указывают на повышение вероятности открытия RyR2 после PKA-фосфорилирования (D) в сравнении с PKA-фосфорилированием в присутствии специфического ингибитора PKA -PKI5-24 (С). Функцию отдельного канала нормализуют относительно PKAфосфорилированного RyR2, инкубированного с FKBP12.6 в присутствии JTV-519 (E). Гистограмма амплитуд (справа) указывает на повышенную активность и открытие в состоянии субпроводимости в PKAфосфорилированном RyR2, но не после обработки JTV-519 и FKBP12.6. На фиг. 3F показано, что инкубирование PKA-фосфорилированного RyR2 с FKBP12.6 в присутствии JTV-519 сдвигает Са 2+-зависимую активацию RyR2 вправо, делая ее похожей на зависимость от Са 2+ в случае нефосфорилированных каналов. Таблица Амбулаторные данные ЭКГ, полученные до физической нагрузки, во время физической нагрузки и после физической нагрузки и инъекции эпинефрина Краткое описание результатов амбулаторной ЭКГ у мышей FKBP12.6+/- после обработки JTV-519 (n = 8) или у контрольных мышей (n = 6) и мышей FKBP12.6-/- при введении JTV-519 (n = 5). SCL = длина синусового цикла; HR = частота сердечных сокращений; ms = мс; bpm = количество ударов в минуту;FKBP12.6+/- = мыши, гетерозиготные по FKBP12.6; FKBP12.6-/- = мыши, дефицитные по FKBP12.6. Пример 7. Синтез 1,4-бензотиазепинового интермедиата и JTV-519. Для экспериментов in vivo авторам потребовался JTV-519 в граммовых количествах. Однако перво- 12011357 начальные попытки получить данное соединение через описанный ранее 1,4-бензотиазепиновый интермедиат, 7-метокси-2,3,4,5-тетрагидро-1,4-бензотиазепин (соединение 6, показанное на схеме 1 ниже), не дали результатов. Тиогруппа в этом интермедиате быстро окисляется на воздухе до дисульфидного соединения, делая невозможным синтез циклизованного продукта (5). Для преодоления данной проблемы авторы разработали новый способ, который начинается с легко доступной и недорогой 2-нитро-5 метоксибензойной кислоты (1). Этот способ показан на схеме 1 ниже. Восстановление нитрогруппы в соединении (1) с использованием Н 2 и Pd/C в качестве катализатора привело к получению 2-амино-5-метоксибензойной кислоты (2) с количественным выходом. Соединение(2) подвергают диазотированию с использованием NaNO2 и затем обрабатывают Na2S2 с получением стабильного дисульфидного соединения (3) с 80% выходом. Без дальнейшей очистки указанный стабильный дисульфид (3) обрабатывают SOCl2 и затем подвергают реакции с 2-хлорэтиламином в присутствии Et3N с образованием амида (4) с 90% выходом. Соединение (4) преобразуют в циклизованное соединение (5) в ходе однореакторной процедуры при кипячении с обратным холодильником с использованием триметилфосфина и Et3N в ТГФ. Затем циклизованный амин (5) восстанавливают LiAlH4 с получением 7 метокси-2,3,4,5-тетрагидро-1,4-бензотиазепина (6). Схема 1JTV-519 получают при взаимодействии соединения (6) с хлорангидридом 3-бромпропионовой кислоты и затем проводят реакцию полученного продукта с 4-бензилпиперидином. Структуру JTV-519 подтверждают методом 1 Н-ЯМР. Пример 8. Синтез радиоактивно меченого JTV-519. Разработанный авторами настоящего изобретения новый способ синтеза радиоактивно меченногоJTV-519 проиллюстрирован ниже на схеме 2. Для получения радиоактивно меченного JTV-519 исходныйJTV-519 подвергают деметилированию по фенильному кольцу с использованием BBr3 с получением фенольного соединения (21). Фенольное соединение (21) подвергают повторному метилированию радиоактивным метилирующим агентом (3 Н-диметилсульфатом) в присутствии основания (NaH), получая 3 Нмеченный JTV-519 (схема 2). Схема 2 Несмотря на то, что изобретение было описано достаточно подробно с целью его пояснения и лучшего понимания, каждому специалисту в данной области понятно, что в настоящее изобретение при ознакомлении с его содержанием могут быть внесены различные изменения в форме и в деталях, без отступления от области настоящего изобретения, определенной в прилагаемой формуле изобретения.- 13011357 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ синтеза соединения формулы где R = OR', SR', NR'2, алкил или галоген и R' = алкил, арил или Н, и где R может находится в положении 2, 3, 4 или 5, включающий стадии:(b) обработки соединения, полученного на стадии (а), хлоридом и хлорэтиламином с получением соединения формулы(с) обработки соединения, полученного на стадии (b), восстановителем и основанием в присутствии тетрагидролата с образованием соединения формулы(d) обработки соединения, полученного на стадии (с), восстановителем с образованием соединения формулы где R определен выше. 2. Способ по п.1, в котором диазотирующий агент на стадии (а) представляет собой NaNO2. 3. Способ по п.1, в котором дисульфид на стадии (а) представляет собой Na2S2. 4. Способ по п.1, в котором хлорид на стадии (b) представляет собой SOCl2. 5. Способ по п.1, в котором восстановитель на стадии (с) представляет собой триметилфосфин(РМе 3). 6. Способ по п.1, в котором основание на стадии (с) представляет собой триэтиламин. 7. Способ по п.1, в котором восстановитель на стадии (d) представляет собой LiAlH4. 8. Способ по п.1, в котором соединение на стадии (а), имеющее формулу где R = OR', SR', NR'2, алкил или галоген и R' = алкил, арил или Н, и где R может находиться в положении 2, 3, 4 или 5, синтезируют способом, включающим стадию где R определен выше. 9. Способ синтеза соединения формулы где R = OR', SR', NR'2, алкил или галоген и R' = алкил, арил или Н, и где R находится в положении 2, 3, 4 или 5, включающий стадии:(b) обработки соединения, полученного на стадии (а), хлоридом и хлорэтиламином с получением соединения формулы(с) обработки соединения, полученного на стадии (b), восстановителем и основанием в присутствии тетрагидролата с образованием соединения формулы(d) обработки соединения, полученного на стадии (с), восстановителем, с образованием соединения формулы(е) обработки соединения, полученного на стадии (d), хлорангидридом 3-бромпропионовой кислоты и соединением формулы 11. Способ по п.1, в котором соединение на стадии (а), имеющее формулу
МПК / Метки
МПК: G01N 33/53, A61K 31/00
Метки: соединений, синтеза, бензотиазепиновых, способ
Код ссылки
<a href="https://eas.patents.su/20-11357-sposob-sinteza-benzotiazepinovyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способ синтеза бензотиазепиновых соединений</a>