Новые уретаны, их тио- и дитиоаналоги, их соли, содержащие эти соединения лекарственные средства и их применение, а также способ их получения
Номер патента: 3298
Опубликовано: 24.04.2003
Авторы: Марк Михаэль, Хурнаус Рудольф, Айзеле Бернхард, Мюллер Петер, Майер Роланд, Адельгосс Гебхард, Шилхер Гебхард
Формула / Реферат
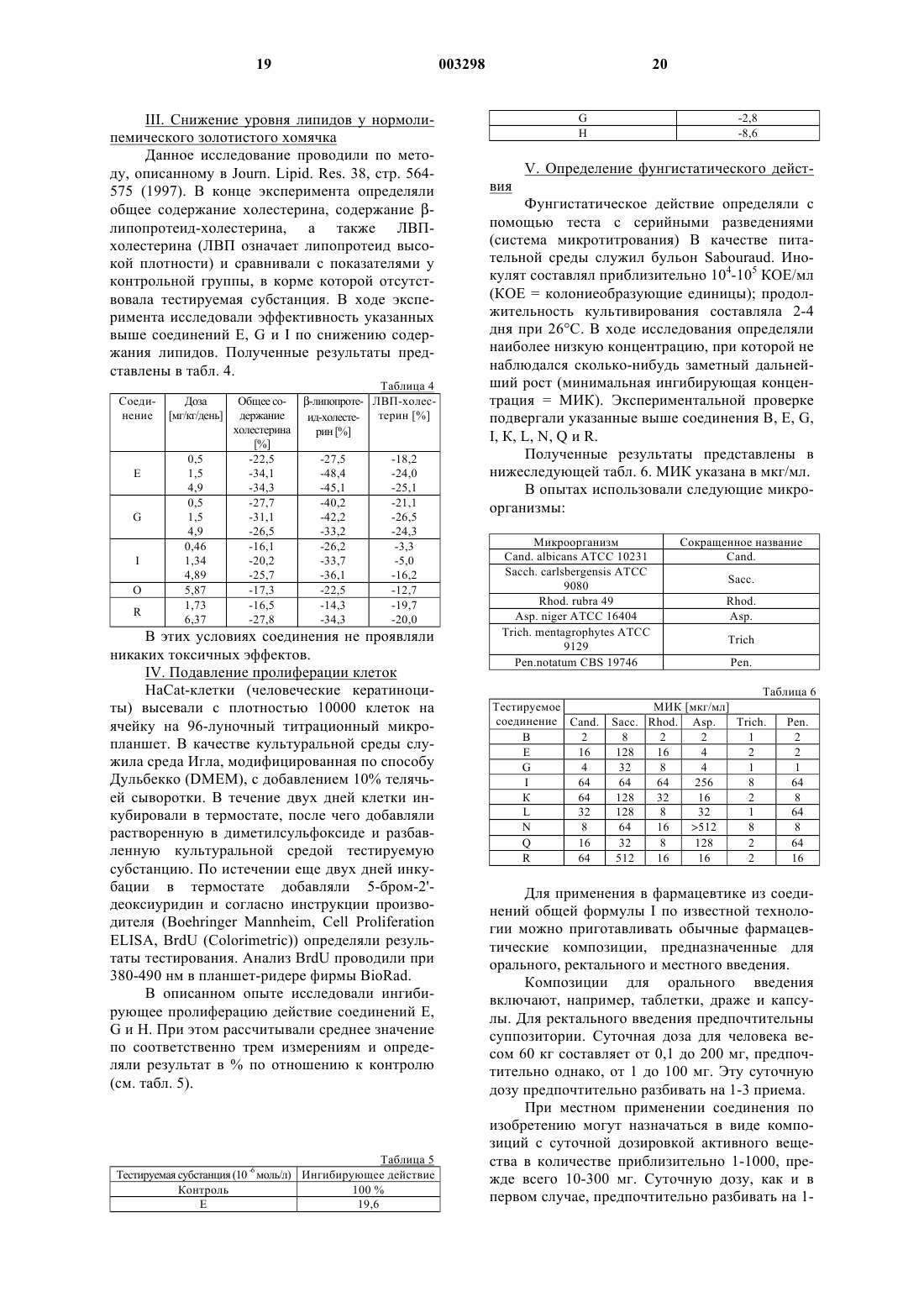
1. Уретаны и их тио- и дитиоаналоги общей формулы
в которой
m обозначает 0 или 1,
n обозначает 1 или 2,
A обозначает простую связь, прямоцепочечную либо разветвленную C1-C8алкиленовую группу, C2-C8алкениленовую или C2-C8алкиниленовую группу, причем ненасыщенная группа не связана непосредственно с остатком Y,
X обозначает атом кислорода или серы,
Y обозначает атом кислорода или серы,
R1 обозначает прямоцепочечную либо разветвленную C1-C8алкильную группу, C1-C6алкенильную или C1-C6алкинильную группу, при этом кратная связь отделена от азот-углеродной связи,
R2 обозначает атом водорода, прямоцепочечную либо разветвленную C1-C8алкильную группу, которая может быть замещена гидрокси- либо алкоксигруппой, C1-C6алкенильную или C1-C6алкинильную группу, при этом гидрокси- и алкоксизаместитель не связан в положении 1 и кратная связь отделена от азот-углеродной связи, или
R1 и R2 вместе с атомом азота образуют 5-7-членное насыщенное гетероциклическое кольцо, в котором одна из метиленовых групп, которая связана с атомом азота не прямо, а через атом кислорода или серы, может быть заменена на -NH- или -N(алкильную) группу,
R3-R6, которые могут быть идентичными либо разными, обозначают атомы водорода или алкильные группы,
R7 обозначает прямоцепочечную либо разветвленную C1-C6алкильную группу, C1-C6алкенильную или C1-C6алкинильную группу, при этом кратная связь отделена от азот-углеродной связи, и
R8 обозначает C3-C7циклоалкильную группу, необязательно замещенную одним или двумя атомами галогена, алкильной, алкокси-, трифторметильной либо цианогруппой фенильную или нафтильную группу, или, если A не представляет собой простую связь, обозначает также атом водорода, при этом, если не указано иное, содержащиеся в представленных выше остатках алкильные группы могут содержать в каждом случае 1-3 атома углерода, а вышеназванный атом галогена может обозначать атом фтора, хлора либо брома, за исключением того, что A и R8 вместе не означают трет-бутильную группу, если X и Y в каждом случае означают атом кислорода,
их энантиомеры, диастереомеры, их смеси и их соли.
2. Соединения общей формулы I по п.1, в которой
m обозначает 1,
n обозначает 1,
A обозначает простую связь, прямоцепочечную либо разветвленную C1-C6алкиленовую группу,
X обозначает атом кислорода или серы,
Y обозначает атом кислорода или серы,
R1 обозначает прямоцепочечную либо разветвленную C1-C6алкильную группу,
R2 обозначает атом водорода, прямоцепочечную либо разветвленную C1-C6алкильную группу, которая может быть замещена гидроксигруппой, C1-C4алкенильную или C1-C4алкинильную группу, при этом гидроксигруппа не связана в положении 1 и кратная связь отделена от азот-углеродной связи, или
R1 и R2 вместе с атомом азота образуют 5-7-членное насыщенное гетероциклическое кольцо, в котором связанная с атомом азота метиленовая группа может быть заменена на атом кислорода,
R3-R6, которые могут быть идентичными либо разными, обозначают атомы водорода или метильные группы,
R7 обозначает прямоцепочечную либо разветвленную C1-C6алкильную группу или C1-C4алкенильную группу, при этом кратная связь отделена от азот-углеродной связи, и
R8 обозначает C3-C6циклоалкильную группу, необязательно замещенную одним или двумя атомами галогена, алкильной, алкокси-, трифторметильной либо цианогруппой фенильную или нафтильную группу, или, если А не представляет собой простую связь, обозначает также атом водорода,
при этом, если не указано иное, содержащиеся в представленых выше остатках алкильные группы могут содержать в каждом случае 1-3 атома углерода, а вышеназванный атом галогена может обозначать атом фтора, хлора либо брома, за исключением того, что A и R8 вместе не означают трет-бутильную группу, если X и Y в каждом случае означают атом кислорода,
и их энантиомеры, диастереомеры, их смеси и их соли.
3. Соединения общей формулы I по п.1, в которой
m обозначает 1,
n обозначает 1,
A обозначает простую связь или метиленовую группу,
X обозначает атом кислорода или серы,
Y обозначает атом кислорода или серы,
R1 обозначает метильную или этильную группу,
R2 обозначает метильную, этильную, аллильную либо пропаргильную группу или
R1 и R2 вместе с атомом азота образуют пирролидиновое или пиперидиновое кольцо,
R3-R6 обозначают атомы водорода,
R7 обозначает метильную группу и
R8 обозначает необязательно замещенную атомом хлора или фтора либо метильной группой фенильную группу,
их смеси и их соли.
4. Следующие соединения общей формулы I по п. 1:
(1) транс-S-(4-хлорфенил)-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метилдитиокарбамат,
(2) транс-S-(3-фторбензил)-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метилдитиокарбамат,
(3) транс-S-(4-фторбензил)-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метилдитиокарбамат,
(4) транс-S-(4-хлорбензил)-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метилдитиокарбамат,
(5) транс-O-(4-хлорфенил)-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метилкарбамат,
(6) цис-S-бензил-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метилдитиокарбамат,
(7) транс-O-(4-хлорфенил)-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метилтиокарбамат,
(8) транс-S-(4-хлорфенил)-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метилтиокарбамат,
(9) транс-O-(4-хлорфенил)-N-метил-N-4-[4-(пиперидинометил)фенил]циклогексилкарбамат,
(10) транс-O-(4-хлорфенил)-N-метил-N-4-[4-(пирролидинометил)фенил]циклогексилкарбамат,
(11) транс-O-(4-хлорфенил)-N-4-[4-(диэтиламинометил)фенил]циклогексил-N-метилкарбамат,
(12) транс-O-(4-хлорфенил)-N-метил-N-4-[4-(N-метил-N-аллиламинометил)фенил]циклогексилкарбамат,
(13) транс-O-(4-хлорфенил)-N-метил-N-4-[4-(N-метил-N-пропаргиламинометил)фенил]циклогексилкарбамат,
(14) транс-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метил-O-(4-метилфенил)карбамат,
(15) транс-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метил-O-(4-метилфенил)тиокарбамат,
(16) транс-N-метил-O-(4-метилфенил)-N-4-[4-(пиперидинометил)фенил]циклогексилтиокарбамат и
(17) транс-N-4-[4-(диметиламинометил)фенил]циклогексил-O-(4-фторфенил)-N-метилкарбамат,
их смеси и их соли.
5. Физиологически приемлемые соли соединений по любому из пп.1-4 с неорганическими или органическими кислотами.
6. Лекарственные средства, содержащие в своем составе соединение по любому из пп.1-4 или физиологически приемлемую соль по п.5 наряду с необязательно одним либо несколькими инертными носителями и/или разбавителями.
7. Лекарственные средства по п.6, пригодные для лечения заболеваний, при которых биосинтез холестерина играет важную роль.
8. Лекарственные средства по п.7, содержащие в своем составе соединение по любому из пп.1-4 или физиологически приемлемую соль по п.5 в сочетании с одним либо несколькими другими биологически активными веществами, способными снижать содержание холестерина или липидов.
9. Лекарственные средства по п.8, отличающиеся тем, что вышеназванные другие биологически активные вещества выбраны из группы, включающей связывающие желчную кислоту смолы, соединения, подавляющие резорбцшю холестерина, соединения, воздействующие на биосинтез холестерина по другому механизму, чем подавление 2,3-эпоксискваленланостеринциклазы, фибраты, никотиновую кислоту, ее производные и аналоги, а также пробукол.
10. Лекарственные средства по пп.7, 8 или 9, пригодные для лечения или предупреждения гиперхолестеринемии, гиперлипопротеинемии, гиперглицеридемии и обусловленных ими атеросклеротических изменений сосудов, приводящих к таким заболеваниям, как коронарная болезнь сердца, церебральная ишемия, перемежающаяся хромота и гангрена, для лечения заболеваний, связанных со значительным повышением пролиферации клеток, для предупреждения и лечения желчно-каменной болезни или для лечения микозов.
11. Применение соединения по любому из пп.1-5 для изготовления лекарственного средства по любому из пп.7-10.
12. Корма для кур-несушек, содержащие в своем составе соединение по любому из пп.1-4 или физиологически приемлемую соль по п.5.
13. Применение соединения по любому из пп.1-5 для получения корма для кур-несушек с целью производства бедных холестерином яиц.
14. Способ получения лекарственного средства по п.6, заключающийся в смешении соединения по любому из пп.1-5 с одним или несколькими инертными носителями и/или разбавителями.
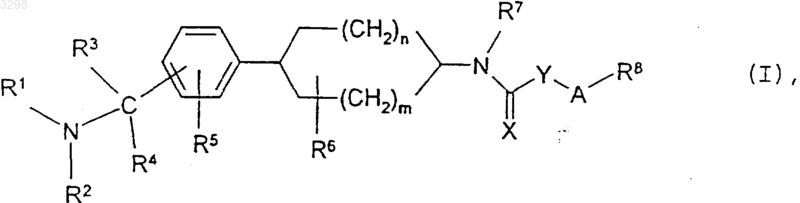
15. Способ получения соединений общей формулы I по любому из пп.1-5, отличающийся тем, что соединение общей формулы
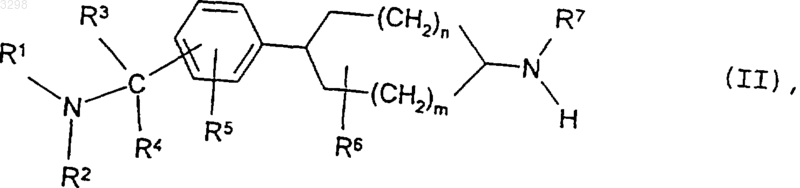
в которой m, n и R1-R7 имеют значения, указанные в пп.1-4, подвергают взаимодействию с соединением общей формулы
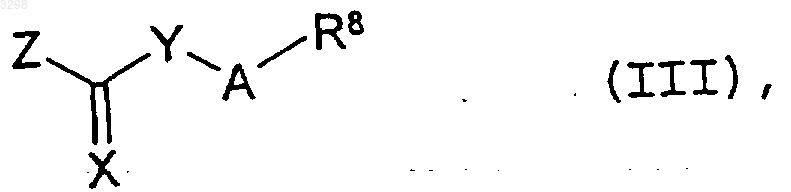
в которой A, X, Y и R8 имеют значения, указанные в пп. 1-4, a Z обозначает уходящую группу, и затем отщепляют необязательно используемые защитные группы, полученную в результате смесь геометрических изомеров соединения общей формулы I разделяют на его энантиомеры и диастереомеры или полученное соединение формулы I переводят в его соль с неорганической или органической кислотой, предпочтительно в физиологически приемлемые соли.
16. Способ получения соединений формулы I, в которой X и Y каждый обозначает атом серы, а m, n, A и R1-R8 имеют значения, указанные в пп.1-4, при условии, что R8 не представляет собой необязательно замещенную фенильную или нафтильную группу, если A обозначает простую связь, соединение общей формулы II, в которой m, n и R1-R7 имеют значения, указанные в пп.1-4, подвергают взаимодействию с сероуглеродом, а затем с алкилирующим агентом общей формулы

в которой A и R8 имеют значения, указанные в пп.1-4, при условии, что R8 не представляет собой необязательно замещенную фенильную или нафтильную группу, если A обозначает простую связь, и Z1 обозначает уходящую группу, и затем отщепляют необязательно используемые защитные группы и при необходимости полученную таким путем смесь геометрических изомеров соединения общей формулы I разделяют на его энантиомеры и диастереомеры или полученное таким путем соединение общей формулы I переводят в его соль с неорганической либо органической кислотой, предпочтительно в его физиологически приемлемые соли.
Текст
1 Настоящее изобретение относится к новым уретанам, их тио- и дитиоаналогам, их солям с физиологически приемлемыми органическими и неорганическими кислотами, к способу получения этих соединений и к содержащим их лекарственным средствам. Предлагаемые в изобретении соединения представляют собой ингибиторы биосинтеза холестерина, прежде всего ингибиторы фермента 2,3-эпоксискваленланостеринциклазы, одного из ключевых ферментов биосинтеза холестерина. Соединения по изобретению могут применяться для лечения и профилактики гиперлипидемии, гиперхолестеринемии и атеросклероза. Другие возможные области применения включают лечение гиперпролиферативных кожных заболеваний и заболеваний сосудов, опухолей,желчно-каменной болезни, а также микозов. Соединения, оказывающие воздействие на биосинтез холестерина, имеют большое значение для лечения целого ряда заболеваний. В первую очередь следует назвать гиперхолестеринемию и гиперлипидемию, которые представляют собой факторы риска для возникновения атеросклеротических изменений сосудов и вызываемых ими осложнений, соответственно являющихся причиной последующих заболеваний, таких например, как коронарная болезнь сердца, церебральная ишемия, перемежающаяся хромота (Claudicatio intermittens) и гангрена. Значение повышенного уровня сывороточного холестерина как главного фактора риска возникновения атеросклеротических изменений сосудов общепризнано. Всесторонние клинические исследования позволили сделать вывод о том, что благодаря снижению содержания сывороточного холестерина можно существенно снизить риск коронарных заболеваний сердца[1991]; Exp. Opin. Ther. Patents 7 (5), стр. 441455 [1997]). Поскольку большая часть холестерина синтезируется в самом организме и лишь незначительная его часть поступает с пищей,подавление биосинтеза представляется, как очевидно, особенно перспективным путем для снижения уровня холестерина. Наряду с этим в качестве других возможных областей применения ингибиторов биосинтеза холестерина в литературе описываются лечение гиперпролиферативных кожных заболеваний и заболеваний сосудов, опухолевых заболеваний, а также лечение и предупреждение желчно-каменной болезни и микозов. При этом в последнем случае речь идет об активном воздействии на биосинтез эргостерина (провитамина D2) в грибах, который протекает практически аналогично биосинтезу холестерина в клетках млекопитающих. Биосинтез холестерина, соответственно эргостерина протекает, исходя из уксусной кислоты, через ряд стадий. Этот многостадийный процесс предоставляет целый ряд возможностей 2 для активного воздействия на него, из которых в качестве примеров можно назвать следующие: Для подавления фермента 3-гидрокси-3 метилглутарил-кофермент А(НМG-СоА)синтазы указывается на возможность использования -лактонов и -лактамов с потенциальным противогиперхолестеринемическим действием (см. Journ. Antibiotics 40, стр. 1356 [1987],US 4751237, EP-A 0462667, US 4983597). Примерами ингибиторов фермента HMGCoA-редуктазы служат 3,5-дигидроксикарбоновые кислоты мевинолинового типа и их лактоны, представители которых ловастатин,симвастатин, правастатин, флувастатин, аторвастатин, а также церивастатин находят применение в терапии гиперхолестеринемии. Другими возможными областями применения этих соединений являются грибковые инфекциии (см.US 4375475, ЕР-А 0113881, US 5106992), кожные заболевания (см. ЕР-А 0369263), а также желчно-каменная болезнь и опухолевые заболевания (см. US 5106992; Lancet 339, стр. 11541156 [1992]). Подавление пролиферации гладкомышечных клеток ловастатином описано вCardiovasc. Drugs Ther. 5, приложение 3, стр. 354 [1991]). Токотриенол, ненасыщенный аналог витамина Е, и его аналоги представляют собой еще один класс веществ, воздействующих на HMG-CoA-редуктазу (см. Exp. Opin. Ther.Patents 7 (5), стр. 446 [1997]). Ингибиторами фермента скваленсинтетазы являются, например, изопреноид(фосфинилметил)фосфонаты, пригодность которых для лечения гиперхолестеринемии, желчно-каменной болезни и опухолевых заболеваний описана в заявке ЕР-А 0409181, а также в Journ. Med.Chemistry 34, стр. 1912 [1991], кроме названных,к этой группе относятся -фосфоносульфинатные соединения (см. ЕР-А 0698609), соединения J-104118 и J-104123 (см. Tetrahedron 52, стр. 13881-13894 [1996]) и производные циклобутана (см. WO 96/33159). Обзор ингибиторов скваленсинтетазы опубликован в Exp.Opin. Patents 7 (5), стр. 446-448 [1997]. В качестве ингибиторов фермента скваленэпоксидазы известны аллиламины, такие как нафтидин и тербинафин, применяющиеся в терапии в качестве средств против грибковых заболеваний, равно как и аллиламин NB-598 с противогиперхолестеринемическим действием[1990] и производные флуорсквалена с гипохолестеринемическим действием (см. US 5011859). Далее имеется описание пиперидинов и азадекалинов с потенциальным гипохолестеринемическим и/или противогрибковым действием, механизм действия которых до настоящего времени точно не выяснен и которые представляют собой ингибиторы скваленэпоксидазы и/или 2,3 эпоксискваленланостеринциклазы (см. ЕР-А 0420116, ЕР-А 0468434, US 5084461 и ЕР-А 3 0468457. Другие представители этой группы описаны в Ехр. Opin. Ther. Patents 7 (5), стр. 448-449 [1997]. Примерами ингибиторов фермента 2,3 эпоксискваленланостеринциклазы являются дифенильные производные (см. ЕР-А 0464465),аминоалкоксибензольные производные (см. ЕРА 0410359, Journ. Lipid. Res. 38, стр. 373-390[1997]), а также производные пиперидина (см.Journ. Org. Chem. 57, стр. 2794-2903 [1992]),обладающие противогрибковым действием. Кроме того, этот фермент в клетках млекопитающих ингибируется декалинами, азадекалинами и производными индана (см. WO 89/08450;[1985]), виниловым эфиром скваленоидэпоксида (см. Journ. Chem. Soc. Perkin Trans. I,стр. 461 [1988]) и 29-метилиден-2,3-оксидоскваленом (см. Journ. Amer. Soc. 113, стр. 96739674 [1991]). В качестве дальнейших примеров следует назвать производные пиридина, соответственно пиримидина (см. WO 97/06802), гетеробициклические алкиламины (см. WO 96/11201), производные имидазола (см. ЕР-А 0757988), а также производные изохинолина[1996]). Наряду с указанными описаны мочевины (см. DE-A 4438021), оксимы (см. DE-A 4412692), целый ряд амидов (см. DE-A 4407134,DE-A 4407135, DE-А 4407136, DE-A 4407138,DE-A 4407139, DE-A 4412691, DE-A 4437999,DE-A 4438000, DE-A 4438020, DE-A 4438082,DE-A 4438029, DE-A 4438054, DE-A 4438055,DE-A 4438082, DE-A 4438083, ЕР-А 0599203,ЕР-А 0596326), а также сложные эфиры (см. WO 95/29148). Ряд других примеров описан в Ехр.Opin. Ther. Patents 7 (5), стр. 448-449 [1997]. В заключение в качестве ингибиторов фермента ланостерин-14-диметилазы следует назвать еще и стероидные производные с потенциальным противогиперлипидемическим действием, воздействующие одновременно и на фермент HMG-CoA-редуктазу (см. US 5041431;[1991]; US 5034548). Кроме того, указанный фермент подавляется противогрибковыми средствами азольного типа, представляющими собойN-замещенные имидазолы и триазолы. К этому классу относятся среди прочих коммерчески доступные противогрибковые средства кетоконазол и флуконазол. Соединения нижеприведенной общей формулы I являются новыми и, как неожиданным образом было установлено, они представляют собой в высшей степени эффективные ингибиторы фермента 2,3-эпоксискваленланостеринциклазы (согласно Международной классификации: К.Ф. 5. 4. 99. 7). 4 Фермент 2,3-эпоксискваленланостеринциклаза катализует одну из ключевых стадий биосинтеза холестерина, соответственно эргостерина, а именно, превращение 2,3-эпоксисквалена в ланостерин, первое соединение стероидной структуры в "каскаде" биосинтеза. Ингибиторы этого фермента в отличие от ингибиторов более ранних стадий биосинтеза, таких например, как HMG-CoA-синтаза и HMG-CoAредуктаза, позволяют надеяться на более высокую степень избирательности, что является безусловным преимуществом, поскольку ингибирование этих ранних стадий биосинтеза приводит к снижению количества образующейся биосинтетическим путем мевалоновой кислоты и тем самым дает возможность негативно влиять также и на биосинтез зависящих от наличия мевалоновой кислоты субстанций, каковыми являются долихол, убихинон и изопентил - тРНК[1990]. При ингибировании стадий биосинтеза после превращения 2,3-эпоксисквалена в ланостерин существует опасность накопления в организме промежуточных продуктов со стероидной структурой и, как следствие, опасность инициирования обусловленных этим токсичных эффектов. Такая возможность описана, в частности, в случае трипаранола, ингибитора десмостеролредуктазы. Эту субстанцию по причине образования при ее использовании катаракты, ихтиозиса и алопеции пришлось снять с продажи (более подробно см. Journ. Biol. Chemistry 265, стр. 18075-18078 [1990]). Как уже указывалось выше, ингибиторы 2,3-эпоксискваленланостеринциклазы описаны в соответствующей литературе, однако ни в одной из публикаций ничего не говорится об уретанах, равно как и об их тио- или дитиоаналогах как ингибиторах 2,3-эпоксискваленланостеринциклазы. С учетом вышеизложенного в основу изобретения была положена задача получить противогиперхолестеринемические субстанции,которые были бы пригодны для лечения и предупреждения атеросклероза и которые по сравнению с известными активными веществами отличались бы более эффективным противогриперхолестеринемическим действием при повышении степени селективности и тем самым повышением надежности и безопасности. Поскольку предлагаемые в изобретении соединения благодаря их высокой эффективности в качестве ингибиторов фермента 2,3-эпоксискваленланостеринциклазы обладают также способностью ингибировать биосинтез эргостерина в грибковом организме, они могут применяться и для лечения микозов. Настоящее изобретение относится к новым уретанам, а также к их тио- и дитиоаналогам общей формулыm обозначает 0 или 1,n обозначает 1 или 2,А обозначает простую связь, прямоцепочечную либо разветвленную C1-С 8 алкиленовую группу, С 2-С 8 алкениленовую или С 2-С 8 алкиниленовую группу, причем ненасыщенная группа не связана непосредственно с остатком Y,X обозначает атом кислорода или серы,Y обозначает атом кислорода или серы,R1 обозначает прямоцепочечную либо разветвленную С 1-С 8 алкильную группу, С 1-С 6 алкенильную или С 1-С 6 алкинильную группу, при этом кратная связь отделена от азот-углеродной связи,R2 обозначает атом водорода, прямоцепочечную либо разветвленную С 1-С 8 алкильную группу, которая может быть замещена гидрокси- либо алкоксигруппой, С 1-С 6 алкенильную или С 1-С 6 алкинильную группу, при этом гидрокси- и алкоксизаместитель не связан в положении 1 и кратная связь отделена от азотуглеродной связи, илиR1 и R2 вместе с атомом азота образуют 5-7-членное насыщенное гетероциклическое кольцо, в котором отделенная от атома азота метиленовая группа может быть заменена на атом кислорода или серы либо на -NH- или-N(алкильную) группу,R3-R6, которые могут быть идентичными либо разными, обозначают атомы водорода или алкильные группы,R7 обозначает прямоцепочечную либо разветвленную С 1-С 6 алкильную группу, С 1-С 6 алкенильную или С 1-С 6 алкинильную группу, при этом кратная связь отделена от азот-углеродной связи, иR8 обозначает С 3-С 7 циклоалкильную группу, необязательно замещенную одним или двумя атомами галогена, алкильной, алкокси-,трифторметильной либо цианогруппой, фенильную или нафтильную группу, или, если А не представляет собой простую связь, обозначает также атом водорода,при этом, если не указано иное, содержащиеся в представленных выше остатках алкильные группы могут содержать в каждом случае 13 атома углерода, а вышеназванный атом галогена может обозначать атом фтора, хлора либо брома,и их энантиомеры, диастереомеры, их смеси и их соли, прежде всего их физиологически приемлемые кислотно-аддитивным соли. Предпочтительными являются соединения общей формулы I,в которой 6 А обозначает простую связь, прямоцепочечную либо разветвленную С 1-С 6 алкиленовую группу,X обозначает атом кислорода или серы,Y обозначает атом кислорода или серы,R1 обозначает прямоцепочечную либо разветвленную С 1-С 6 алкильную группу,R2 обозначает атом водорода, прямоцепочечную либо разветвленную С 1-С 6 алкильную группу, которая может быть замещена гидроксигруппой, C1-С 4 алкенильную или С 1-С 4 алкинильную группу, при этом гидроксигруппа не связана в положении 1 и кратная связь отделена от азот-углеродной связи, илиR1 и R2 вместе с атомом азота образуют 57-членное насыщенное гетероциклическое кольцо, в котором отделенная от атома азота метиленовая группа может быть заменена на атом кислорода,R3-R6, которые могут быть идентичными либо разными, обозначают атомы водорода или метильные группы,R7 обозначает прямоцепочечную либо разветвленную С 1-С 6 алкильную группу или С 1 С 4 алкенильную группу, при этом кратная связь отделена от азот-углеродной связи, иR8 обозначает С 3-С 6 циклоалкильную группу, необязательно замещенную одним или двумя атомами галогена, алкильной, алкокси-,трифторметильной либо цианогруппой фенильную или нафтильную группу, или, если А не представляет собой простую связь, обозначает также атом водорода,при этом, если не указано иное, содержащиеся в представленых выше остатках алкильные группы могут содержать в каждом случае 13 атома углерода, а вышеназванный атом галогена может обозначать атом фтора, хлора либо брома, и их энантиомеры, диастереомеры, их смеси и их соли, прежде всего физиологически приемлемые кислотно-аддитивные соли. К особенно предпочтительным относятся соединения общей формулы I, в которойm обозначает 1,n обозначает 1,А обозначает простую связь или метиленовую группу,X обозначает атом кислорода или серы,Y обозначает атом кислорода или серы,R1 обозначает метильную или этильную группу,R2 обозначает метильную, этильную, аллильную либо пропаргильную группу илиR1 и R2 вместе с атомом азота образуют пирролидиновое или пиперидиновое кольцо,R3-R6 обозначают атомы водорода,R7 обозначает метильную группу иR8 обозначает необязательно замещенную атомом хлора или фтора либо метильной группой фенильную группу, 7 их смеси и их соли, прежде всего физиологически приемлемые кислотно-аддитивные соли, наиболее предпочтительны, однако, следующие соединения:(17) транс-N-4-[4-(диметиламинометил)фенил]циклогексил-О-(4-фторфенил)-N-метилкарбамат,их смеси и их соли, прежде всего их физиологически приемлемые кислотно-аддитивные соли, например их гидрохлориды, метансульфонаты или тартраты. Соединения общей формулы I можно получать, например, с помощью следующих методов: а) В этом методе предусмотрено ваимодействие соединения общей формулыm, n и R1-R7 имеют указанные выше значения, с соединением общей формулы в которой А, X, Y и R8 имеют указанные выше значения, a Z обозначает уходящую группу, например атом галогена, такой как атом хлора, брома или иода, и при необходимости последующее отщепление защитных групп. Это взаимодействие осуществляют по реакции Шоттена-Баумана или по реакции Эйнхорна, т.е. компоненты подвергают взаимодействию друг с другом в присутствии, по меньшей мере, одного эквивалента вспомогательного основания при температурах в интервале от -50 до +120 С, предпочтительно от -10 до + 30 С, и необязательно в присутствии растворителей. В качестве вспомогательных оснований могут использоваться предпочтительно гидроксиды щелочных и щелочно-земельных металлов, такие как гидроксид натрия, гидроксид калия или гидроксид бария, карбонаты щелочных металлов, например карбонат натрия, карбонат калия или карбонат цезия, ацетаты щелочных металлов, например ацетат натрия или калия, а также третичные амины, например пиридин, 2,4,6 триметилпиридин, хинолин, триэтиламин, Nэтилдиизопропиламин, N-этилдициклогексиламин, 1,4-диазабицикло[2,2,2]октан или 1,8 диазабицикло[5,4,0]ундец-7-ен, а в качестве растворителей приемлемы среди прочих диэтиловый эфир, метиленхлорид, дихлорметан,этилацетат, толуол, тетрагидрофуран, 1,4 диоксан, ацетонитрил, диметилформамид, диметилацетамид, N-метилпирролидон или же смеси этих растворителей; в случае использования в качестве вспомогательных оснований гидроксидов щелочных или щелочно-земельных металлов, карбонатов или ацетатов щелочных металлов в реакционную смесь можно также добавлять воду в качестве сорастворителя. Если R2 представляет собой атом водорода, то реакцию целесообразно осуществлять таким образом, чтобы сначала вводить в реакцию соединение общей формулы II, в которойR2 представляет собой защитную группу, такую например, как трет-бутилоксикарбонил, а по завершении реакции эту защитную группу отщеплять по обычным методам, например воздействием трифторуксусной кислотой или хлористым водородом в диоксане. б) В этом методе для получения соединений общей формулы I, в которой X и Y каждый обозначает атом серы, а m, n, А и R1-R8 имеют указанные выше значения, но при условии, чтоR8 не представляет собой необязательно заме 9 щенную фенильную или нафтильную группу,если А обозначает простую связь, - взаимодействие соединений общей формулы II, в которойm, n и R1 -R7 имеют указанные выше значения, с сероуглеродом и затем с алкилирующим агентом общей формулы в которой А и R8 имеют указанные выше значения, но при условии, что R8 не представляет собой необязательно замещенную фенильную или нафтильную группу, если А обозначает простую связь, и Z1 обозначает уходящую группу, например атом галогена, такой как атом хлора, брома или иода, алкилсульфонилоксигруппу с 1-10 атомами углерода в алкильном фрагменте, необязательно замещенную атомами хлора либо брома, метильными или нитрогруппами одно-, дву- либо тризамещенную фенилсульфонилокси- или нафтилсульфонилоксигруппу, при этом заместители могут быть идентичными либо разными, и при необходимости последующее отщепление защитных групп. Если R2 представляет собой атом водорода, то целесообразно сначала вводить в реакцию соединение общей формулы II, в которой R2 представляет собой защитную группу, например трет-бутоксикарбонил, после чего эту защитную группу отщеплять по обычным методам, например, с помощью трифторуксусной кислоты или хлористого водорода в диоксане. Если же R2 представляет собой алкильную группу, замещенную гидроксигруппой, то рекомендуется эту гидроксигруппу защищать от превращения, например, тетрагидропиранильной группой, и по завершении реакции снова отщеплять последнюю, например, с помощью трифторуксусной кислоты или хлористого водорода в диоксане. Указанную реакцию целесообразно осуществлять таким образом, чтобы соединение общей формулы II в соответствующем растворителе, например в тетрагидрофуране, сначала переводить в литиевую соль, используя в этих целях, например, н-бутиллитий, при температуре в интервале от -20 до -10 С, а затем подвергать взаимодействию с сероуглеродом, после чего добавлять соединение общей формулы IV в соответствующем растворителе, например в тетрагидрофуране, диметилформамиде либо в смеси обоих этих растворителей, и продолжать реакцию при 20-60 С. При осуществлении вышеописанных обменных реакций необязательно имеющиеся реакционноспособные группы, такие как гидрокси, амино или алкиламино, необходимо защищать обычными защитными группами, которые по завершении реакции снова отщепляют. Так,например, для защиты гидроксигруппы приемлемы триметилсилильная, ацетильная, бензоильная, трет-бутильная, тритильная, бензильная 10 или тетрагидропиранильная группа, а для защиты амино- или алкиламиногруппы можно использовать ацетильную, трифторацетильную,бензоильную, этоксикарбонильную, трет-бутоксикарбонильную,бензилоксикарбонильную,бензильную, метоксибензильную или 2,4 диметоксибензильную группу и для аминогруппы в дополнение к названным - фталильную группу. Предусмотренное при определенных условиях последующее отщепление используемой защитной группы осуществляют, например, путем гидролиза в водном растворителе, в частности в воде, изопропаноле/воде, тетрагидрофуране/воде или диоксане/воде, в присутствии кислоты, такой как трифторуксусная кислота, соляная кислота или серная кислота, либо в присутствии щелочного основания, такого как гидроксид лития, гидроксид натрия или гидроксид калия, либо за счет отщепления эфира, например, в присутствии иодтриметилсилана, при температурах в интервале от 0 до 100 С, предпочтительно при температурах в интервале от 10 до 50 С. Отщепление же бензильной, метоксибензильной или бензилоксикарбонильной группы осуществляют, например, путем гидрогенолиза с помощью водорода в присутствии катализатора, такого как палладий на угле, в растворителе,таком как метанол, этанол, этиловый эфир уксусной кислоты, диметилформамид, диметилформамид/ацетон или ледяная уксусная кислота, необязательно с добавлением кислоты, такой как соляная кислота, при температурах в интервале от 0 до 50 С, предпочтительно, однако, при комнатной температуре, и при давлении водорода 1-7 бар, предпочтительно, однако, 3-5 бар. Отщепление метоксибензильной группы можно осуществлять также в присутствии окислителя, такого как церий(IV)-аммонийнитрат, в растворителе, таком как метиленхлорид, ацетонитрил или смесь ацетонитрила и воды, при температурах в интервале от 0 до 50 С, предпочтительно, однако, при комнатной температуре. Отщепление 2,4-диметоксибензильной группы предпочтительно осуществлять в трифторуксусной кислоте в присутствии анизола. Отщепление трет-бутильной или третбутилоксикарбонильной группы предпочтительно осуществлять путем обработки кислотой,такой как трифторуксусная кислота или соляная кислота, необязательно с использованием растворителя, такого как метиленхлорид, диоксан или простой эфир. Отщепление фталильной группы осуществляют предпочтительно в присутствии гидразина либо первичного амина, такого как метиламин, этиламин или н-бутиламин, в растворителе, таком как метанол, этанол, изопропанол,смесь толуола и воды или диоксан, при температурах в интервале от 20 до 50 С. 11 Полученные по описанным выше способам соединения общей формулы I можно очищать и выделять с помощью известных методов, например путем кристаллизации, перегонки либо посредством хроматографии. Кроме того, полученные соединения общей формулы I при необходимости можно разделять на их энантиомеры и/или диастереомеры. Так, в частности, полученные соединения общей формулы I, представленные в виде рацематов, по известным методам (см. Allinger N.L. иEliel E.L. в "Topics in Stereochemistry", том 6,изд-во Wiley Interscience (1971 можно разделять на их оптические антиподы, а соединения общей формулы I, по меньшей мере, с двумя асимметричными атомами углерода благодаря их физико-химическим различиям также с помощью известных методов, например посредством хроматографии и/или фракционированной кристаллизации, можно разделять на их диастереомеры, которые затем в случае их получения в рацемической форме могут разделяться описанным выше путем на энантиомеры. Разделение на энантиомеры предпочтительно осуществлять посредством колоночной хроматографии хиральных фаз, либо перекристаллизацией из оптически активного растворителя, либо взаимодействием с образующей с рацемическим соединением соли или дериваты,такие например, как сложные эфиры или амиды,оптически активной субстанцией, прежде всего кислотами и их активированными производными или же спиртами, и разделением полученной таким путем диастереомерной солевой смеси или деривата, используя, например, различную степень их растворимости, при этом из чистых диастереомерных солей или дериватов благодаря действию соответствующих агентов могут высвобождаться свободные антиподы. К наиболее часто используемым в указанных целях оптически активным кислотам относятся среди прочих D- и L-формы винной кислоты либо дибензоилвинной кислоты, ди-о-толилвинная кислота, яблочная кислота, миндальная кислота,камфорсульфоновая кислота, глутаминовая кислота, аспарагиновая кислота и хинная кислота. В качестве оптически активного спирта приемлемы, например, ( + )- или (-)-ментол, а в качестве оптически активного ацильного остатка в амидах например, ( + )- или (-)-ментилоксикарбонил. Далее, полученные соединения общей формулы I можно переводить в их соли, прежде всего, имея в виду применение в фармацевтике,в их физиологически приемлемые соли с неорганическими или органическими кислотами. В качестве таких кислот могут рассматриваться среди прочих соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота, фумаровая кислота, янтарная кислота,молочная кислота, лимонная кислота, винная кислота и малеиновая кислота. 12 В соединениях общей формулы I по изобретению связанный с циклоалкильным кольцом арильный остаток, равно как и атом азота могут занимать либо экваториальное, либо аксиальное положение. Изобретение включает как чистые изомеры, так и смеси различных изомеров. Исходные соединения общей формулы II известны и могут быть получены по методам,описанным в DE-A 4438020 и ЕР-А 0599203. Другая возможность получения соединений общей формулы II, в которых R3-R5 обозначают атомы водорода, а фенильный остаток замещен в положении 1,4, состоит в том, что соединение общей формулы V в которой m, n и R6 имеют указанные выше значения, по методам, описанным в DE-A 4438020 и ЕР-А 0599203, переводят в соединение формулы VI которое затем, предпочтительно после введения защитной группы у атома азота, например трифторацетильной группы или 2,2,2-трихлорэтоксикарбонильной группы, переводят путем хлорметилирования в соединение формулы VII, в которой m, n и R7 имеют указанные выше значения, а Т представляет собой защитную группу, например 2,2,2-трихлорэтоксикарбонильную или трифторацетильную группу, и затем соединение формулы VII подвергают взаимодействию с амином формулы H-NR1R2, где R1 и R2 имеют указанные выше значения, а после отщепления защитной группы переводят с помощью известных методов в соединение формулы II. Соединения общей формулы I обладают ценными биологическими свойствами. Они представляют собой ингибиторы биосинтеза холестерина, прежде всего ингибиторы фермента 2,3-эпоксискваленланостеринциклазы. Благодаря 15 их биологическим свойствам они могут применяться для лечения болезней, при которых биосинтез холестерина играет важную роль,прежде всего для лечения и предупреждения гиперхолестеринемии, гиперлипопротеинемии и гипертриглицеридемии, а также обусловленных ими атеросклеротических изменений сосудов,являющихся причиной последующих осложнений или заболеваний, таких как коронарная болезнь сердца, церебральная ишемия, перемежающаяся хромота, гангрена и другие. 13 Для лечения этих заболеваний соединения общей формулы I могут в таких случаях применяться либо как таковые при монотерапии, либо их можно использовать в сочетании с другими субстанциями, снижающими содержание холестерина или липидов в организме, при этом соединения по изобретению могут назначаться предпочтительно в виде оральной композиции,а при необходимости также в виде суппозиториев в качестверектальной композиции. В качестве таких сокомпонентов приемлемы среди прочих следующие:- связывающие желчную кислоту смолы,как например холестирамин, холестипол и другие,- соединения, подавляющие резорбцию холестерина, как например ситостерин и неомицин,- соединения, воздействующие на биосинтез холестерина по другому механизму, чем подавление 2,3-эпоксискваленланостеринциклазы, как например ингибиторы HMG-CoAредуктазы, такие как ловастатин, симвастатин,правастатин, флувастатин, аторвастатин, церивастатин и другие,- ингибиторы скваленэпоксидазы, такие например, как NB 598 и аналогичные соединения, а также- ингибиторы скваленсинтетазы, такие например, как представители класса изопреноид(фосфинилметил)фосфонатов и сквалестатин. В качестве других возможных сокомпонентов для комбинированных композиций можно назвать еще и представителей класса фибратов, такие как клофибрат, безафибрат, гемфиброзил и прочие, никотиновую кислоту, ее производные и аналоги, такие например, как аципимокс, а также пробукол. Соединения общей формулы I пригодны,кроме того, для лечения заболеваний, связанных с повышенной пролиферацией клеток. Холестерин является незаменимой составной частью клеток и для пролиферации последних, т.е. их деления, необходимо его наличие в достаточном количестве. Подавление пролиферации клеток благодаря ингибированию биосинтеза холестерина подробно описано на примере гладкомышечных клеток, подвергаемых воздействию ингибитора HMG-CoA-редуктазы мевинолинового типа - ловастатина, как об этом говорилось выше. В качестве примеров заболеваний, связанных со значительным повышением пролиферации клеток, в первую очередь следует назвать опухолевые заболевания. Эксперименты с клеточными культурами и in vivo подтвердили, что в результате снижения содержания сывороточного холестерина или активного воздействия на биосинтез холестерина ингибиторами HMGCoA-редуктазы удается уменьшить рост опухолей (см. Lancet 339, стр. 1154-1156 [1992]). Поэтому предлагаемые в изобретении соединения 14 формулы I благодаря их ингибирующему биосинтез холестерина действию потенциально пригодны для лечения опухолевых заболеваний. Они могут при этом найти применение как таковые или как дополнительные средства для известных терапевтических методов. В качестве дальнейших примеров можно назвать гиперпролиферативные кожные заболевания, такие например, как псориаз, базалиома,плоскоклеточный рак, кератоз и нарушения кератинизации. Под используемым в данном контексте выражением "псориаз" имеется в виду обусловленное гиперпролиферативными причинами воспалительное заболевание кожи, которое изменяет механизм регуляции ее свойств. Это проявляется прежде всего в образовании пораженных участков, характеризующихся первичными и вторичными изменениями пролиферации в эпидермисе, воспалительными реакциями на коже и экспрессией регуляторных молекул, таких как лимфокины, а также воспалительными факторами. Для пораженной псориазом кожи характерны в морфологическом отношении усиление превращения клеток эпидермиса, утолщение эпидермиса, аномальная кератинизация воспалительных клеточных инфильтратов, просачивающихся в кожный слой, и полиморфно-ядерная инфильтрация лейкоцитов в эпидермис, обусловливающая увеличение цикла образования базальных клеток. В дополнение к сказанному наблюдается и наличие гиперкератотических и паракератотических клеток. Понятия "кератоз", "базалиома", "плоскоклеточный рак" и "нарушения кератинизации" относятся к гиперпролиферативным заболеваниям кожи, при которых нарушен механизм регуляции пролиферации и дифференциации кожных клеток. Соединения формулы I эффективны в качестве антагонистов кожной гиперпролиферации, т.е. в качестве средств, подавляющих гиперпролиферацию кератиноцитов человека. Благодаря этому соединения по изобретению пригодны, как указывалось выше, в качестве средств для лечения гиперпролиферативных заболеваний кожи, таких как псориаз, базалиома, нарушения кератинизации и кератоз. Для лечения этих болезней соединения формулы I могут назначаться либо для орального, либо местного введения, при этом, как отмечалось выше, они могут применяться либо как таковые в монотерапии, либо в сочетании с известными активными веществами. Далее следует назвать провоцируемые хирургическим вмешательством, таким как ЧТКА(чрескожная транслюминальная коронарная ангиопластика) или наложения байпаса, гиперпролиферативные заболевания сосудов, такие как стеноз и закупорка сосудов, в основе которых лежит пролиферация гладкомышечных клеток. Выше уже указывалось, что эту пролиферацию клеток можно, как известно, подавлять ин 15 гибиторами HMG-CoA-редуктазы мевинолинового типа, в частности ловастатином. Благодаря их ингибирующему воздействию на биосинтез холестерина соединения общей формулы I пригодны для лечения и профилактики также и этих болезней, при этом они могут применяться либо индивидуально, либо в сочетании с другими активными веществами, как например вводимый внутривенно гепарин, предпочтительно для орального введения. Еще одной возможностью применения соединений общей формулы I согласно изобретению является предупреждение и лечение желчно-каменной болезни. Образование желчных камней (конкрементов) обусловлено тем, что концентрация холестерина в желчи превышает максимальную растворимость холестерина в желчной жидкости, вследствие чего происходит осаждение холестерина в виде желчных камней. Средства из класса фибратов, понижающие уровень липидов в крови, приводят к усиленному выделению нейтральных стероидов по отношению к желчному пузырю и повышают предрасположение к образованию желчных камней. В отличие от этого ингибиторы биосинтеза холестерина, такие как ловастатин и правасатин,не только никоим образом не приводят к повышенному образованию желчных камней, но и более того, они могут способствовать уменьшению концентрации холестерина в желчи и снижать тем самым так называемый литогенный показатель - меру вероятности образования желчных камней. Более подробно это описано в публикации Gut 31, стр. 348-350 и в журналеGastroenterol. 29, стр. 242-245 [1991]). Кроме того, в журнале Gastroenterology 102,4, часть 2, А 319 [1992] описано эффективное действие ловастатина при растворении желчных камней, прежде всего в сочетании с урсодеоксихолевой кислотой. Исходя из этого,соединения общей формулы I благодаря механизму их действия пригодны также для предупреждения и лечения желчно-каменной болезни. При этом они могут найти применение либо индивидуально, либо в сочетании с известными терапевтическими методами, такими например,как лечение с помощью урсодеоксихолевой кислоты или литотрипсия с использованием импульсного излучения, предпочтительно при оральном введении. В заключение следует назвать еще одну возможность применения соединений общей формулы I, а именно, для лечения инфекций,вызываемых патогенными грибами, такими например, как Candida albicans, Aspergillus niger,Trichophyton mentagrophytes, Penicillium sp.,Cladosporium sp. и другие. Как уже указывалось выше, конечным продуктом биосинтеза стерина в организме грибов является не холестерин, а незаменимый для интеграции и функции клеточных мембран грибов эргостерин. Ингибирование биосинтеза эргостерина приводит поэто 003298 16 му к нарушениям роста и при определенных условиях к отмиранию грибных организмов. Для лечения микозов соединения общей формулы I могут назначаться либо для орального, либо местного введения. При этом их можно применять либо индивидуально, либо в сочетании с известными противогрибковыми активными веществами, прежде всего с такими, которые активно воздействуют на другие стадии биосинтеза стерина, например с ингибиторами скваленэпоксидазы тербинафином и натрифином, или с ингибиторами ланостерин-14 диметилазы азольного типа, такими в частности,как кетоконазол и флуконазол. Еще одна возможность применения соединений общей формулы I относится к птицеводству. Снижение содержания холестерина в яйцах за счет введения ингибитора HMG-CoAредуктазы ловастатина курам-несушкам описано в журнале FASEB Journal 4, A 533, Abstracts 1543 [1991]. Производство бедных холестерином яиц представляет безусловный интерес,поскольку благодаря таким яйцам с невысоким содержанием холестерина можно снизить нагрузку на организм, связанную с его избыточным накоплением, не изменяя при этом обычных привычек в питании. Таким образом, ингибирующее действие соединений общей формулы I, оказываемое ими на биосинтез холестерина, позволяет применять эти соединения и в птицеводстве для производства яиц, бедных холестерином, при этом указанные субстанции могут использоваться в качестве добавок к кормам. Биологическую эффективность соединений общей формулы I выявляли по следующим методам:I. Определение подавления встраивания 14 С-ацетата в осаждаемые с помощью дигитонина стероиды Исследование ингибирующей эффективности проводили по описанному в Journ. Lipid.Res. 37, стр. 148-157 [1996] методу при концентрациях испытуемых субстанций 10-8 и 10-9 моль/л. Ниже в качестве примеров представлены результаты тестирования следующих соединений (A)-(R) общей формулы I, а также сравнительных соединений (U), (V) и (W) при вышеуказанных концентрациях:(W) транс-О-(п-толилацетил)-4-(4-диметиламинометилфенил)циклогексанол (WO 95/ 29148, стр. 28, соединение I). Процентные показатели, согласно которым вышеуказанные соединения подавляют встраивание 14 С-ацетата, представлены в табл. 1. Соединение Данные в табл. 2 однозначно подтверждают заметное преимущество соединений по изобретению перед описанными выше сравнительными субстанциями.II. Определение in vivo эффективности соединений формулы I в опытах на крысах после орального введения Ингибирование фермента 2,3-эпоксискваленланостеринциклазы способствует повышению уровня 2,3-эпоксисквалена в печени и плазме. Количество образовавшегося 2,3 эпоксисквалена служит поэтому непосредственным показателем эффективности в организме животного в целом. Определение этого показателя проводили по описанному в Journ. Lipid.t = 3, соответственно 8 ч после введения субстанций в концентрациях с = 0,01, 0,03, 0,1, 0,3 и 1,0 мг/кг. В нижеследующей табл. 3 выборочно представлены результаты, полученные при тестировании указанных выше соединений А, В,С, Е, G, Н, О и R. Таблица 3. Концентрация 2,3-эпоксисквалена [мкг/г] в печени крысы с [мг/кг] 0,01 0,03 0,1 0,3 1,0 У контрольных животных при этих условиях не наблюдалось сколько-нибудь заметного уровня 2,3-эпоксисквалена.III. Снижение уровня липидов у нормолипемического золотистого хомячка Данное исследование проводили по методу, описанному в Journ. Lipid. Res. 38, стр. 564575 (1997). В конце эксперимента определяли общее содержание холестерина, содержание липопротеид-холестерина, а также ЛВПхолестерина (ЛВП означает липопротеид высокой плотности) и сравнивали с показателями у контрольной группы, в корме которой отсутствовала тестируемая субстанция. В ходе эксперимента исследовали эффективность указанных выше соединений Е, G и I по снижению содержания липидов. Полученные результаты представлены в табл. 4. Соединение В этих условиях соединения не проявляли никаких токсичных эффектов.HaCat-клетки (человеческие кератиноциты) высевали с плотностью 10000 клеток на ячейку на 96-луночный титрационный микропланшет. В качестве культуральной среды служила среда Игла, модифицированная по способу Дульбекко (DMEM), с добавлением 10% телячьей сыворотки. В течение двух дней клетки инкубировали в термостате, после чего добавляли растворенную в диметилсульфоксиде и разбавленную культуральной средой тестируемую субстанцию. По истечении еще двух дней инкубации в термостате добавляли 5-бром-2'деоксиуридин и согласно инструкции производителя (Boehringer Mannheim, Cell ProliferationELISA, BrdU (Colorimetric определяли результаты тестирования. Анализ BrdU проводили при 380-490 нм в планшет-ридере фирмы BioRad. В описанном опыте исследовали ингибирующее пролиферацию действие соединений Е,G и Н. При этом рассчитывали среднее значение по соответственно трем измерениям и определяли результат в % по отношению к контролю Таблица 5 Тестируемая субстанция (10 -6 моль/л) Ингибирующее действие Контроль 100 % Е 19,6V. Определение фунгистатического действия Фунгистатическое действие определяли с помощью теста с серийными разведениями(система микротитрования) В качестве питательной среды служил бульон Sabouraud. Инокулят составлял приблизительно 104-105 КОЕ/мл(КОЕ = колониеобразующие единицы); продолжительность культивирования составляла 2-4 дня при 26 С. В ходе исследования определяли наиболее низкую концентрацию, при которой не наблюдался сколько-нибудь заметный дальнейший рост (минимальная ингибирующая концентрация = МИК). Экспериментальной проверке подвергали указанные выше соединения В, Е, G,I, К, L, N, Q и R. Полученные результаты представлены в нижеследующей табл. 6. МИК указана в мкг/мл. В опытах использовали следующие микроорганизмы: Микроорганизм Для применения в фармацевтике из соединений общей формулы I по известной технологии можно приготавливать обычные фармацевтические композиции, предназначенные для орального, ректального и местного введения. Композиции для орального введения включают, например, таблетки, драже и капсулы. Для ректального введения предпочтительны суппозитории. Суточная доза для человека весом 60 кг составляет от 0,1 до 200 мг, предпочтительно однако, от 1 до 100 мг. Эту суточную дозу предпочтительно разбивать на 1-3 приема. При местном применении соединения по изобретению могут назначаться в виде композиций с суточной дозировкой активного вещества в количестве приблизительно 1-1000, прежде всего 10-300 мг. Суточную дозу, как и в первом случае, предпочтительно разбивать на 1 21 3 разовые дозы. Предназначенные для местного применения композиции включают гели, кремы,лосьоны, мази, пудру, аэрозоли и другие обычные составы, которые используют в качестве лечебных средств для кожи. Количество активных веществ для местного применения составляет 1-50 мг/г композиции, предпочтительно,однако, 5-20 мг/г. Наряду с использованием в качестве лечебных средств для кожи композиции согласно настоящему изобретению, предназначенные для местного применения, могут применяться также для лечения слизистых оболочек, доступных для такой терапии. Так, например, указанные композиции можно наносить на слизистые оболочки ротовой полости, нижней части толстой (ободочной) кишки и другие. Для применения в птицеводстве с целью производства бедных холестерином яиц биологически активные вещества общей формулы I вводят животным с помощью обычных методов в виде добавок к соответствующим кормам. Концентрация активных веществ в готовых кормах составляет при этом в норме 0,01-1%,предпочтительно, однако, 0,05-0,5%. Активные вещества могут добавляться к кормам как таковые. В этих случаях предлагаемые в изобретении корма для кур-несушек наряду с активными веществами и необязательно наряду с обычной смесью из витаминов и минеральных веществ содержат, например, кукурузу, соевую муку,мясную муку, кормовой жир и соевое масло. К этим кормам примешивают в качестве активного компонента одно из вышеуказанных соединений формулы I в концентрации от 0,01 до 1%,предпочтительно, однако, от 0,05 до 0,5%. Ниже изобретение более подробно поясняется на примерах. Указанные Rf-значения определяли на готовых пластинах фирмы E.Merck,Darmstadt, a именно, на а) оксиде алюминия F-254 (тип Е) б) силикагеле 60 F-254. Примеры получения исходных материалов Пример А. Транс-N-метил-4-[4-(пиперидинометил)фенил]циклогексиламин 26 г (0,15 моля) 4-фенилциклогексанона перемешивают в течение ночи в закрытой колбе со 160 мл 6%-ного раствора метиламина в толуоле в присутствии 30 г молекулярного сита 3. После фильтрации и концентрирования остаток растворяют в 200 мл метанола и при -20 С к раствору примешивают порциями 7,8 г борогидрида натрия. По завершении процесса добавления перемешивают в течение ночи при комнатной температуре. После выпаривания метанола растворяют с помощью 150 мл ледяной воды и сильно подкисляют концентрированной соляной кислотой. После насыщения поваренной солью выпавший гидрохлорид отфильтровывают на нутче, маточный раствор сильно подщелачивают 6 н. едким натром, экстрагируют этиловым эфиром уксусной кислоты, 003298 22 сушат и упаривают. Отфильтрованный на нутче гидрохлорид суспендируют в смеси воды и этилового эфира уксусной кислоты и при охлаждении сильно подщелачивают 6 н. едким натром. Уксусно-кислую этилэфирную фазу промывают водой и насыщенным раствором поваренной соли, сушат и упаривают. После кристаллизации остатка из петролейного эфира получают 15,1 г транс-N-метил-4-фенилциклогексиламина(бесцветные кристаллы). Содержащий петролейный эфир маточный раствор упаривают и объединяют с остатком от упаривания осажденного гидрохлорида. После разделения на оксиде алюминия (стадия активации III, этиловый эфир уксусной кислоты/петролейный эфир в объемном соотношении 1:1-2:1) получают 2,4 г цис-Nметил-4-фенилциклогексиламина, 4,4 г транссоединения и 5,1 г смеси из цис- и транс-Nметил-4-фенилциклогексиламина. Общий выход транс-N-метил-4-фенилциклогексиламина: 19,5 г (68,6% от теории), бесцветные кристаллы. 19,5 г (0,143 моля) транс-N-метил-4 фенилциклогексиламина и 12,1 г (0,12 моля) триэтиламина растворяют в 200 мл этилового эфира уксусной кислоты. Затем при охлаждении льдом добавляют по каплям 24 г (0,113 моля) 2,2,2-трихлорэтилового эфира хлормуравьиной кислоты в 50 мл этилового эфира уксусной кислоты и перемешивают в течение 2 ч. После выдержки в течение ночи при комнатной температуре разбавляют этиловым эфиром уксусной кислоты и промывают водой, разбавленной соляной кислотой, повторно водой и в завершение насыщенным раствором поваренной соли. Полученный после сушки (сульфатом магния) и упаривания остаток при высоком нагреве растворяют в смеси из петролейного эфира и этилового эфира уксусной кислоты (объемное соотношение 10:1). После медленного охлаждения, в завершение при 0 С, получают 34,3 г(91,3% от теории) транс-N-метил-N-2,2,2 трихлорэтоксикарбонил-4-фенилциклогексиламина в виде бесцветных кристаллов с температурой плавления 84-86 С. Кроме того, после упаривания маточного раствора и очистки остатка на силикагеле (петролейный эфир/ этиловый эфир уксусной кислоты в объемном соотношении 10:1-5:1) получают еще 1,1 г (2,9% от теории) указанного продукта. Далее 35,4 г (0,097 моля) этого соединения растворяют в 950 мл дихлорметана. После добавления 30,7 г (0,345 моля) параформальдегида и 30,7 г (0,226 моля) хлорида цинка подают хлористый водород (в течение 2 ч при комнатной температуре) и перемешивают в течение ночи при комнатной температуре. Избыток хлористого водорода удаляют в токе азота и реакционную смесь сливают в охлажденный водный раствор гидрофосфата динатрия. Органическую фазу отделяют, водную фазу дважды экстрагируют метиленхлоридом, органические фазы объединяют, промывают водой, сушат с помо 23 щью сульфата магния и упаривают. Остаток очищают посредством хроматографии на силикагеле (петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 20:115:1). Наряду с 14 г (39,5% от теории) непрореагировавшего исходного материала получают 19 г (47,4% от теории) транс-4-(4-хлорметилфенил)-N-метил-N-2,2,2-трихлорэтоксикарбонилциклогексиламина в виде бесцветных кристаллов с Rf-значением 0,38 (силикагель, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 10:1). 830 мг (2 ммоля) этого соединения растворяют в смеси из соответственно 10 мл тетрагидрофурана и этанола, к раствору добавляют 510 мг (6 ммолей) пиперидина, перемешивают сначала в течение ночи при комнатной температуре, а затем в течение 3 ч при 50 С. После охлаждения сливают на воду и трижды экстрагируют этиловым эфиром уксусной кислоты. Органическую фазу промывают водой и насыщенным раствором поваренной соли, сушат (сульфатом магния) и упаривают. После очистки остатка посредством хроматографии (оксид алюминия, стадия активации III, петролейный эфир/этиловый эфир уксусной кислоты в соотношении 10:1) получают 750 мг (81,2% от теории) транс-N-метил-N-2,2,2-трихлорэтоксикарбонил-4-[4-(пиперидинометил)фенил]-циклогексиламина (кристаллы, слегка окрашенные в желтоватый цвет), Rf-значение 0,52 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в соотношении 5:1). 730 мг (1,58 ммоля) этого соединения растворяют в 1 мл ледяной уксусной кислоты и 5 мл воды. Затем при комнатной температуре одной порцией добавляют 1,5 г цинкового порошка (по истечении короткого промежутка времени - сильное вспенивание). В течение 30 мин перемешивают при комнатной температуре, а затем в течение 1 ч при 50 С, после чего охлаждают, добавляют воду и этиловый эфир уксусной кислоты и сильно подщелачивают 6 н. едким натром. После фильтрации органическую фазу отделяют, промывают водой и насыщенным раствором поваренной соли, сушат (сульфатом магния) и упаривают. В результате получают 340 мг (75,1% от теории) транс-N-метил-4-[4(пиперидинометил)фенил]циклогексиламина(1) транс-N-метил-4-[4-(пирролидинометил)фенил]циклогексиламин из 4-фенилциклогексанона и пирролидина, бесцветные кристаллы, Rf-значение 0,44 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1);(2) транс-4-[4-(диэтиламинометил)фенил]N-метилциклогексиламин из 4-фенилциклогексанона и диэтиламина, бесцветное твердое ве 003298(8) цис/транс-N-метил-4-[4-(морфолинометил)фенил]циклогексиламин из 4-фенилциклогексанона и морфолина, бесцветное твердое вещество, Rf-значения 0,23 и 0,48 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1). Примеры получения конечных продуктов Пример 1. Гидрохлорид транс-О-(4-хлорфенил)-N-4[4-(диметиламинометил)фенил]циклогексил-Nметилкарбамата 250 мг (1 ммоль) транс-4-[4-(диметиламинометил)фенил]-N-метилциклогексиламина и 0,3 мл триэтиламина помещают в 20 мл метиленхлорида и добавляют по каплям 210 мг(1,1 ммоля) 4-хлорфенилового эфира хлормуравьиной кислоты в небольшом количестве метиленхлорида. Далее перемешивают в течение ночи и затем разбавляют метиленхлоридом,промывают водой и насыщенным раствором поваренной соли, сушат и упаривают. Остаток очищают посредством колоночной хроматографии (силикагель, метиленхлорид/-метанол в объемном соотношении 9:1). Полученный продукт растворяют в метиленхлориде, затем примешивают соляную кислоту в простом эфире и гидрохлорид осаждают, добавляя простой эфир. 25 После промывки простым эфиром и сушки получили 276 мг (63,1% от теории) указанного в заголовке соединения в виде бесцветного аморфного порошка; Rf-значение свободного основания: 0,62 (силикагель, метиленхлорид/метанол в объемном соотношении 9:1); 1(1) транс-О-бензил-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метилкарбамат из транс-4-[4-(диметиламинометил)фенил]-N-метилциклогексиламина и бензилового эфира хлормуравьиной кислоты, бесцветное масло (после очистки посредством колоночной хроматографии на оксиде алюминия (этиловый эфир уксусной кислоты/петролейный эфир в объемном соотношении 3:1, Rf-значение: 0,44(оксид алюминия, этиловый эфир уксусной кислоты/петролейный эфир в соотношении 3:1);(2) транс-О-циклогексил-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метилкарбамат из транс-4-[4-(диметиламинометил)фенил]-N-метилциклогексиламина и циклогексилового эфира хлормуравьиной кислоты, температура плавления 72 С (после колоночной хроматографии на оксиде алюминия (петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 3:1;(получение из 4-хлортиофенола и тиофосгена),бесцветные кристаллы (после очистки посредством колоночной хроматографии на силикагеле(6) гидрохлорид цис/транс-О-(4 хлорфенил)-N-метил-N-4-[4-(морфолинометил) фенил] циклогексилкарбамата из цис/транс-N-метил-N-4-[4-(морфолинометил)фенил]циклогексиламина и 4-хлорфенилового эфира хлормуравьиной кислоты, бесцветный порошок, Rf-значение свободного основания: 0,35 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1);(7) гидрохлорид транс-О-(4-хлорфенил)-Nметил-N-4-[4-(пиперидинометил)фенил]циклогексилкарбамата из транс-N-метил-N-4-[4-(пиперидинометил)фенил]циклогексиламина и 4-хлорфенилового эфира хлормуравьиной кислоты, бесцветный порошок, Rf-значение свободного основания: 0,48 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 10:1);(8) гидрохлорид транс-О-(4-хлорфенил)-Nметил-N-4-[4-(пирролидинометил)фенил]циклогексилкарбамата из транс-N-метил-N-4-[4-(пирролидинометил)фенил]циклогексиламина и 4-хлорфенилового эфира хлормуравьиной кислоты, бесцветный порошок, Rf-значение свободного основания: 0,32 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1);(9) гидрохлорид транс-O-(4-хлорфенил)-N4-[4-(диэтиламинометил)фенил]циклогексил-Nметилкарбамата из транс-N-4-[4-(диэтиламинометил)фенил]-N-метилциклогексиламина и 4-хлорфенилового эфира хлормуравьиной кислоты, бесцветный порошок, Rf-значение свободного основания: 0,48 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1);(10) гидрохлорид транс-О-(4-хлорфенил)N-4-[4-[(2-гидроксиэтил)метиламинометил]фенил]циклогексил-N-метилкарбамата из транс-N-4-[4-[(2-гидроксиэтил)метиламинометил]фенил]-N-метилциклогексиламина и 4-хлорфенилового эфира хлормуравьиной кислоты, бесцветный порошок, Rf-значение свободного основания: 0,19 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 1:1);(11) гидрохлорид транс-O-(4-хлорфенил)N-4-[4-(ди-н-гексиламинометил)фенил]циклогексил-N-метилкарбамата из тpaнс-N-4-[4-(ди-н-гексиламинометил)фенил]-N-метилциклогексиламина и 4-хлорфенилового эфира хлормуравьиной кислоты, бесцветный порошок, Rf-значение свободного основания: 0,58 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 10:1);(12) гидрохлорид транс-N-4-[4-(ди-вторбутиламинометил)фенил]-циклогексил-О-(4 хлорфенил)-N-метилкарбамата из транс-N-4-[4-(ди-втор-бутиламинометил)фенил]-N-метилциклогексиламина и 4 хлорфенилового эфира хлормуравьиной кислоты, бесцветный порошок, Rf-значение свободного основания: 0,60 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 10:1);(13) транс-О-(4-хлорфенил)-N-метил-N-4[4-(N-метил-N-аллиламинометил)фенил]циклогексилкарбамат из транс-N-метил-N-4-[4-(N-метил-N-аллиламинометил)фенил]циклогексиламина и 4 хлорфенилового эфира хлормуравьиной кислоты, бесцветный порошок, Rf-значение: 0,58 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1);(оксид алюминия,петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1);(15) гидрохлорид транс-О-(4-хлорфенил)N-метил-N-4-[4-(метиламинометил)фенил]циклогексилкарбамата из транс-N-4-[4-(трет-бутилоксикарбонилметиламинометил)фенил]-N-метилциклогексиламина и 4-хлорфенилового эфира хлормуравьиной кислоты с последующим отщеплением трет-бутилоксикарбонильной группы с помощью соляной кислоты в простом эфире, бесцветный порошок, Rf-значение свободного основания: 0,5 (оксид алюминия, метиленхлорид/метанол в объемном соотношении 40:1);(16) транс-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метил-О-(4-метилфенил)карбамат из N-4-[4-(диметиламинометил)фенил]-Nметилциклогексиламина и 4-метилфенилового эфира хлормуравьиной кислоты, Rf-значение свободного основания: 0,47 (оксид алюминия,петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1), температура плавления свободного основания 93 С; за счет обработки соляной кислотой получили гидрохлорид в виде бесцветного порошка с температурой плавления 260 С; за счет обработки свободного основания метансульфокислотой в смеси из этилового эфира уксусной кислоты и простого эфира получили метансульфонат в виде бесцветного порошка с температурой плавления 165 С; за счет обработки свободного основания Lвинной кислотой в смеси из метанола и этило 003298 28 вого эфира уксусной кислоты получили тартрат в виде бесцветного порошка с температурой плавления 135 С;(17) гидрохлорид транс-N-метил-O-(4 метилфенил)-N-4-[4-(пиперидинометил)фенил] циклогексилтиокарбамата из транс-N-метил-N-4-[4-(пиперидинометил)фенил]циклогексиламина и О-4-метилфенилового эфира хлортиомуравьиной кислоты, бесцветный порошок, Rf-значение свободного основания: 0,35 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 10:1);(18) гидрохлорид транс-N-метил-О-(4 метилфенил)-N-4-[4-(пиперидинометил)фенил] циклогексилкарбамата из тpaнс-N-метил-N-4-[4-(пиперидинометил)фенил]циклогексиламина и 4-метилфенилового эфира хлормуравьиной кислоты, бесцветный порошок, Rf-значение свободного основания: 0,43 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 10:1);(19) гидрохлорид транс-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метил-О-(4 метилфенил)тиокарбамата из транс-N-4-[4-(диметиламинометил)фенил]-N-метилциклогексиламина и О-4-метилфенилового эфира хлортиомуравьиной кислоты,бесцветный порошок, Rf-значение свободного основания: 0,29 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1);(20) транс-N-4-[4-(диметиламинометил)фенил]циклогексил-О-4-фторфенил-N-метилкарбамат из транс-N-4-[4-(диметиламинометил)фенил]-N-метилциклогексиламина и О-4-фторфенилового эфира хлормуравьиной кислоты, Rfзначение свободного основания: 0,34 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1), температура плавления свободного основания 85 С; за счет обработки соляной кислотой получили гидрохлорид в виде бесцветного порошка с температурой плавления 250 С; за счет обработки свободного основания метансульфокислотой в смеси из этилового эфира уксусной кислоты и простого эфира получили метансульфонат в виде бесцветного порошка с температурой плавления 190 С; за счет обработки свободного основания Lвинной кислотой в смеси из метанола и этилового эфира уксусной кислоты получили тартрат в виде бесцветного порошка с температурой плавления 165 С; 29 эфира хлормуравьиной кислоты, бесцветный порошок, Rf-значение свободного основания: 0,49 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1);(22) гидрохлорид транс-N-метил-O-фенилN-4-[4-(пиперидинометил)фенил]циклогексилкарбамата из транс-N-метил-N-4-[4-(пиперидинометил)фенил]циклогексиламина и фенилового эфира хлормуравьиной кислоты, бесцветный порошок, температура плавления 218-223 С. Пример 2. Гидрохлорид транс-О-(4-хлорфенил)-N-4[4-(диметиламинометил)фенил]циклогексил-Nметилтиокарбамата К раствору из 8,6 г (35 ммолей) транс-4-[4(диметиламинометил)фенил]-N-метилциклогексиламина в 100 мл хлороформа при охлаждении льдом примешивают 35 мл 1 н. едкого натра и 70 мл воды. Далее при интенсовном перемешивании и при охлаждении льдом добавляют по каплям в течение 20 мин 7,4 г O-4 хлорфенилового эфира хлортиомуравьиной кислоты в 50 мл хлороформа, после чего перемешивают в течение 30 мин при 0 С, а затем в течение 1 ч при комнатной температуре. Органическую фазу отделяют, промывают водой, сушат с помощью сульфата магния и упаривают. Полученный после очистки посредством колоночной хроматографии (силикагель, метиленхлорид/метанол в объемном соотношении 5:1) продукт растворяют в 50 мл метиленхлорида и смешивают с соляной кислотой в простом эфире и затем с простым эфиром. Выход: 11,3 г (71,2% от теории) указанного в заголовке соединения в виде бесцветного порошка с температурой плавления 257-259 С(2m, 1 Н), 7,1-7,5 (m, 8 Н). Пример 3. Транс-S-бензил-N-4-[4-(диметиламинометил)фенил]циклогексил-N-метилдитиокарбамат К 500 мг (2 ммоля) транс-N-4-[4(диметиламинометил)фенил]-N-метилциклогексиламина, растворенных в 12 мл тетрагидрофурана, при температуре в интервале от -15 до 10 С добавляют по каплям 1,25 мл 6-молярного раствора н-бутиллития в н-гексане. Далее в течение 1 ч перемешивают при -15 С и затем добавляют 182 мг (2,4 ммоля) сероуглерода в 1 мл тетрагидрофурана. После выдержки в течение 1 ч при -10 С по каплям добавляют при 0 С 340 мг (2 ммоля) бензилбромида в 2 мл тетрагидрофурана и затем перемешивают в течение ночи при комнатной температуре. После добавления воды экстрагируют простым эфиром, органическую фазу сушат с помощью сульфата магния и упаривают. После очистки посредством коло 003298 30 ночной хроматографии (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1) получают 280 мг (33,9% от теории) указанного в заголовке соединения в виде бесцветных кристаллов.Rf-значение: 0,46 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1). 1(1) транс-S-циклогексилметил-N-4-[4-(диметиламинометил)фенил]-циклогексил-N-метилдитиокарбамат из тpaнс-N-4-[4-(диметиламинометил)фенил]-N-метилциклогексиламина и (бромметил)циклогексана, бесцветные кристаллы, Rfзначение: 0,5 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1);(2) транс-S-циклогексил-N-4-[4-(диметиламинометил)фенил]-циклогексил-N-метилдитиокарбамат из транс-N-4-[4-(диметиламинометил)фенил]-N-метилциклогексиламина и циклогексилбромида, бесцветные кристаллы, Rf-значение: 0,53 (оксид алюминия, петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1);(3) гидрохлорид транс-S-(н-бутил)-N-4-[4(диметиламинометил)фенил]-циклогексил-Nметилдитиокарбамата из транс-N-4-[4-(диметиламинометил)фенил]-N-метилциклогексиламина и н-бутилбромида, бесцветный порошок, Rf-значение свободного основания: 0,48 (оксид алюминия,петролейный эфир/этиловый эфир уксусной кислоты в объемном соотношении 5:1);m обозначает 0 или 1,n обозначает 1 или 2,А обозначает простую связь, прямоцепочечную либо разветвленную C1-С 8 алкиленовую или С 2 группу,С 2-С 8 алкениленовую С 8 алкиниленовую группу, причем ненасыщенная группа не связана непосредственно с остатком Y,X обозначает атом кислорода или серы,Y обозначает атом кислорода или серы,R1 обозначает прямоцепочечную либо разветвленную С 1-С 8 алкильную группу, С 1 С 6 алкенильную или С 1-С 6 алкинильную группу,при этом кратная связь отделена от азотуглеродной связи,R2 обозначает атом водорода, прямоцепочечную либо разветвленную C1-С 8 алкильную группу, которая может быть замещена гидрокси- либо алкоксигруппой, С 1-С 6 алкенильную или С 1-С 6 алкинильную группу, при этом гидрокси- и алкоксизаместитель не связан в положении 1 и кратная связь отделена от азотуглеродной связи, илиR1 и R2 вместе с атомом азота образуют 57-членное насыщенное гетероциклическое кольцо, в котором одна из метиленовых групп,которая связана с атомом азота не прямо, а через атом кислорода или серы, может быть заменена на -NH- или -N(алкильную) группу,R3-R6, которые могут быть идентичными либо разными, обозначают атомы водорода или алкильные группы,R7 обозначает прямоцепочечную либо разветвленную С 1-С 6 алкильную группу, С 1 С 6 алкенильную или С 1-С 6 алкинильную группу,при этом кратная связь отделена от азотуглеродной связи, иR8 обозначает С 3-С 7 циклоалкильную группу, необязательно замещенную одним или двумя атомами галогена, алкильной, алкокси-,трифторметильной либо цианогруппой, фенильную или нафтильную группу, или, если А не представляет собой простую связь, обозначает также атом водорода, при этом, если не указано иное, содержащиеся в представленных выше остатках алкильные группы могут содержать в каждом случае 1-3 атома углерода, а вышеназванный атом галогена может обозначать атом фтора, хлора либо брома, за исключением того,что А и R8 вместе не означают трет-бутильную группу, если X и Y в каждом случае означают атом кислорода, их энантиомеры, диастереомеры, их смеси и их соли. 2. Соединения общей формулы I по п.1, в которойn обозначает 1,А обозначает простую связь, прямоцепочечную либо разветвленную C1-С 6 алкиленовую группу,X обозначает атом кислорода или серы,Y обозначает атом кислорода или серы,R1 обозначает прямоцепочечную либо разветвленную С 1-С 6 алкильную группу,R2 обозначает атом водорода, прямоцепочечную либо разветвленную C1-С 6 алкильную группу, которая может быть замещена гидроили С 1 ксигруппой,C1-С 4 алкенильную С 4 алкинильную группу, при этом гидроксигруппа не связана в положении 1 и кратная связь отделена от азот-углеродной связи, илиR1 и R2 вместе с атомом азота образуют 57-членное насыщенное гетероциклическое кольцо, в котором связанная с атомом азота метиленовая группа может быть заменена на атом кислорода,R3-R6, которые могут быть идентичными либо разными, обозначают атомы водорода или метильные группы,R7 обозначает прямоцепочечную либо разветвленную С 1-С 6 алкильную группу или С 1 С 4 алкенильную группу, при этом кратная связь отделена от азот-углеродной связи, иR8 обозначает С 3-С 6 циклоалкильную группу, необязательно замещенную одним или двумя атомами галогена, алкильной, алкокси-,трифторметильной либо цианогруппой фенильную или нафтильную группу, или, если А не представляет собой простую связь, обозначает также атом водорода,при этом, если не указано иное, содержащиеся в представленых выше остатках алкильные группы могут содержать в каждом случае 13 атома углерода, а вышеназванный атом галогена может обозначать атом фтора, хлора либо брома, за исключением того, что А и R8 вместе не означают трет-бутильную группу, если X и Y в каждом случае означают атом кислорода,и их энантиомеры, диастереомеры, их смеси и их соли. 3. Соединения общей формулы I по п.1, в которойm обозначает 1,n обозначает 1,А обозначает простую связь или метиленовую группу,X обозначает атом кислорода или серы,Y обозначает атом кислорода или серы,R1 обозначает метильную или этильную группу,R2 обозначает метильную, этильную, аллильную либо пропаргильную группу илиR1 и R2 вместе с атомом азота образуют пирролидиновое или пиперидиновое кольцо,R3-R6 обозначают атомы водорода,R7 обозначает метильную группу иR8 обозначает необязательно замещенную атомом хлора или фтора либо метильной группой фенильную группу,их смеси и их соли. 4. Следующие соединения общей формулы(17) транс-N-4-[4-(диметиламинометил)фенил]циклогексил-О-(4-фторфенил)-N-метилкарбамат,их смеси и их соли. 5. Физиологически приемлемые соли соединений по любому из пп.1-4 с неорганическими или органическими кислотами. 6. Лекарственные средства, содержащие в своем составе соединение по любому из пп.1-4 или физиологически приемлемую соль по п.5 наряду с необязательно одним либо несколькими инертными носителями и/или разбавителями. 7. Лекарственные средства по п.6, пригодные для лечения заболеваний, при которых биосинтез холестерина играет важную роль. 8. Лекарственные средства по п.7, содержащие в своем составе соединение по любому из пп.1-4 или физиологически приемлемую соль по п.5 в сочетании с одним либо несколькими другими биологически активными веществами,способными снижать содержание холестерина или липидов. 9. Лекарственные средства по п.8, отличающиеся тем, что вышеназванные другие биологически активные вещества выбраны из группы, включающей связывающие желчную кислоту смолы, соединения, подавляющие резорбцию холестерина, соединения, воздействующие на биосинтез холестерина по другому механизму,чем подавление 2,3-эпоксискваленланостеринциклазы, фибраты, никотиновую кислоту,ее производные и аналоги, а также пробукол. 10. Лекарственные средства по пп.7, 8 или 9, пригодные для лечения или предупреждения гиперхолестеринемии, гиперлипопротеинемии,гиперглицеридемии и обусловленных ими атеросклеротических изменений сосудов, приводящих к таким заболеваниям, как коронарная болезнь сердца, церебральная ишемия, перемежающаяся хромота и гангрена, для лечения заболеваний, связанных со значительным повышением пролиферации клеток, для предупреждения и лечения желчно-каменной болезни или для лечения микозов. 11. Применение соединения по любому из пп.1-5 для изготовления лекарственного средства по любому из пп.7-10. 12. Корма для кур-несушек, содержащие в своем составе соединение по любому из пп.1-4 или физиологически приемлемую соль по п.5. 13. Применение соединения по любому из пп.1-5 для получения корма для кур-несушек с целью производства бедных холестерином яиц. 14. Способ получения лекарственного средства по п.6, заключающийся в смешении соединения по любому из пп.1-5 с одним или несколькими инертными носителями и/или разбавителями. 36 15. Способ получения соединений общей формулы I по любому из пп.1-5, отличающийся тем, что соединение общей формулы в которой А, X, Y и R8 имеют значения,указанные в пп. 1-4, a Z обозначает уходящую группу, и затем отщепляют необязательно используемые защитные группы, полученную в результате смесь геометрических изомеров соединения общей формулы I разделяют на его энантиомеры и диастереомеры или полученное соединение формулы I переводят в его соль с неорганической или органической кислотой,предпочтительно в физиологически приемлемые соли. 16. Способ получения соединений формулы I, в которой X и Y каждый обозначает атом серы, а m, n, А и R1-R8 имеют значения, указанные в пп.1-4, при условии, что R8 не представляет собой необязательно замещенную фенильную или нафтильную группу, если А обозначает простую связь, соединение общей формулы II, в которой m, n и R1-R7 имеют значения, указанные в пп.1-4, подвергают взаимодействию с сероуглеродом, а затем с алкилирующим агентом общей формулы в которой А и R8 имеют значения, указанные в пп.1-4, при условии, что R8 не представляет собой необязательно замещенную фенильную или нафтильную группу, если А обозначает простую связь, и Z1 обозначает уходящую группу, и затем отщепляют необязательно используемые защитные группы и при необходимости полученную таким путем смесь геометрических изомеров соединения общей формулы I разделяют на его энантиомеры и диастереомеры или полученное таким путем соединение общей формулы I переводят в его соль с неорганической либо органической кислотой, предпочтительно в его физиологически приемлемые соли.
МПК / Метки
МПК: A23K 1/16, A61K 31/325, C07C 271/56
Метки: соединения, получения, соли, способ, лекарственные, применение, эти, средства, тио, дитиоаналоги, новые, уретаны, содержащие, также
Код ссылки
<a href="https://eas.patents.su/19-3298-novye-uretany-ih-tio-i-ditioanalogi-ih-soli-soderzhashhie-eti-soedineniya-lekarstvennye-sredstva-i-ih-primenenie-a-takzhe-sposob-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые уретаны, их тио- и дитиоаналоги, их соли, содержащие эти соединения лекарственные средства и их применение, а также способ их получения</a>
Следующий патент: Нестероидные ингибиторы воспалений