Соединения дигидрооксазолобензодиазепинона, способ их получения и фармацевтические композиции, их содержащие
Номер патента: 21125
Опубликовано: 30.04.2015
Авторы: Спеддинг Майкл, Антони Ференц, Баркоци Йожеф, Линг Иштван, Гачаи Иштван, Леваи Дьёрдь, Харсинг Ласло
Формула / Реферат
1. Соединения формулы (I)
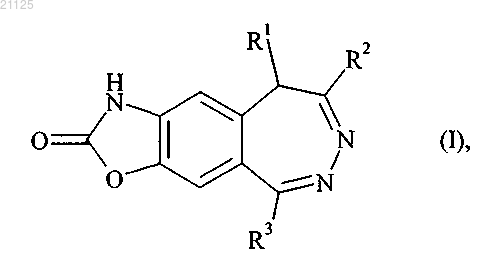
в которой R1 означает атом водорода или линейную или разветвленную (C1-C4)алкильную группу;
R2 означает линейную или разветвленную (C1-C4)алкильную группу;
R3 означает арильную или гетероарильную группу;
и их соли присоединения с фармацевтически приемлемой кислотой,
где под арильной группой понимают нафтильную группу, под гетероарильной группой понимают бициклическую или трициклическую группу, в которой по меньшей мере одно из колец является ароматическим кольцом, содержащим от 1 до 3 одинаковых или разных гетероатомов, выбранных из азота, кислорода и серы, необязательно замещенным одной или несколькими одинаковыми или разными группами, выбранными из атома галогена; линейной или разветвленной (С1-С6)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов; или цианогруппы.
2. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R1 означает атом водорода.
3. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R2 означает метильную группу.
4. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает гетероарильную группу.
5. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает бициклическую ароматическую группу, содержащую от 1 до 3 одинаковых или разных гетероатомов, выбранных из азота, кислорода и серы, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена; линейной или разветвленной (С1-С6)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов; или цианогруппы.
6. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает бензотиенильную или хинолильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена и линейной или разветвленной (С1-С4)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов.
7. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает 1-бензотиенильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена и линейной или разветвленной (C1-C4)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов.
8. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает 1-бензотиен-2-ильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена и линейной или разветвленной (C1-C4)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов.
9. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает 1-бензотиен-2-ильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома фтора, атома хлора, трифторметильной группы и метильной группы.
10. Соединения формулы (I) в соответствии с п.1, которые представляют собой

11. Способ получения соединений формулы (I) в соответствии с п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (II)
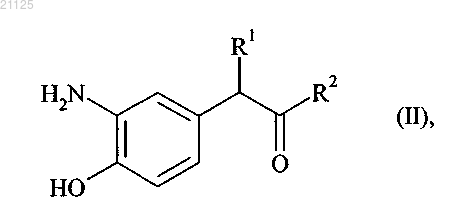
где R1 и R2 принимают значения, определенные для формулы (I),
причем соединение формулы (II) в свободной форме или в форме соли подвергают реакции циклизации в присутствии 1,1'-карбонилдиимидазола с получением соединения формулы (III)
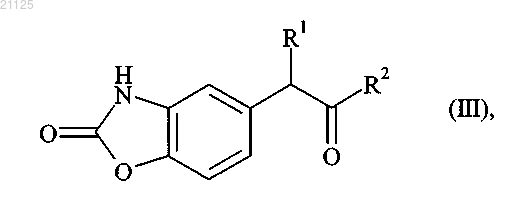
где R1 и R2 принимают значения, определенные для формулы (I),
которое вводят в реакцию с восстанавливающим агентом с получением соединения формулы (IV)

где R1 и R2 принимают значения, определенные для формулы (I),
которое затем подвергают действию соединения формулы (V)
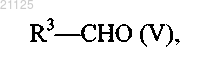
где R3 принимает значения, определенные для формулы (I),
с получением соединения формулы (VI)
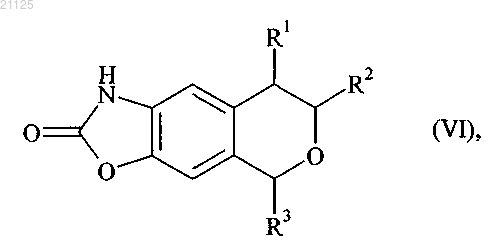
где R1, R2 и R3 принимают значения, определенные для формулы (I),
которое затем подвергают действию окислителя, с последующим образованием соли, получая соединение формулы (VII)
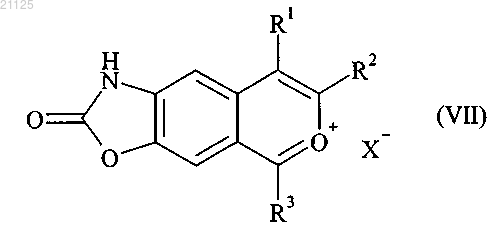
где R1, R2 и R3 принимают значения, определенные для формулы (I), и X означает противоион, такой как ClO4-, Cl-, Br-, HSO4-,
которое затем подвергают действию гидразина с получением соединения формулы (I), причем соединение формулы (I) затем может быть очищено в соответствии с обычными методами разделения, превращено, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой и разделено, в требуемых случаях, на его изомеры, если они существуют, в соответствии с обычными методами разделения.
12. Способ получения соединений формулы (I) в соответствии с п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (VIII)
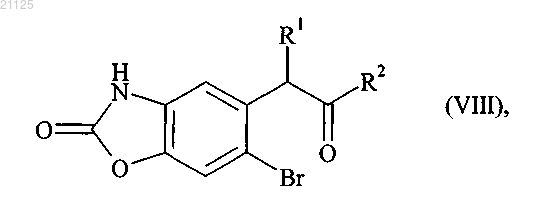
где R1 и R2 принимают значения, определенные для формулы (I),
которое подвергают стадии защиты карбонильной группы с получением соединения формулы (IX)
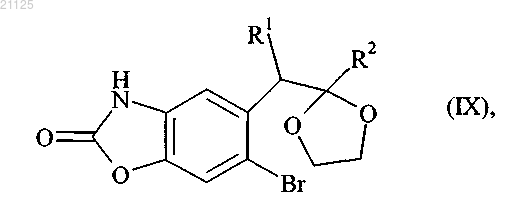
где R1 и R2 принимают значения, определенные выше,
которое затем подвергают действию соединения формулы (X)
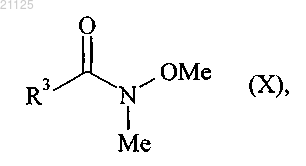
где R3 принимает значения, определенные для формулы (I),
с получением соединения формулы (XI)
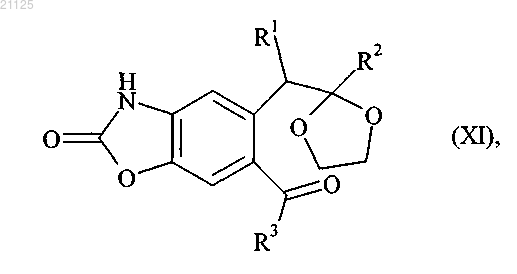
где R1, R2 и R3 принимают значения, определенные для формулы (I),
которое затем подвергают реакции циклизации с получением соединения формулы (VII)
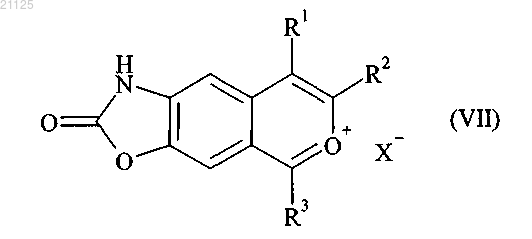
где R1, R2 и R3 принимают значения, определенные для формулы (I), и X означает противоион, такой как ClO4-, Cl-, Br-, HSO4-,
которое затем подвергают действию гидразина с получением соединения формулы (I), причем соединение формулы (I) затем может быть очищено в соответствии с обычными методами разделения, превращено, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой и разделено, в требуемых случаях, на его изомеры, если они существуют, в соответствии с обычными методами разделения.
13. Фармацевтическая композиция для лечения или предотвращения психических и неврологических нарушений, включающая в качестве активного ингредиента соединение в соответствии с любым из пп.1-10 в комбинации с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми носителями.
14. Фармацевтические композиции в соответствии с п.13 для лечения или предотвращения шизофрении, униполярной депрессии, болезни Альцгеймера, сосудистой деменции, расстройств аутестического спектра, болезни Дауна, синдрома ломкой Х-хромосомы, болезни Паркинсона, болезни Хантингтона, генерализованной тревоги, панического расстройства с или без агорафобии, обсессивно-компульсивных расстройств, посттравматических стрессовых расстройств, биполярных расстройств, последствий острого церебрального сосудистого расстройства и последствий травмы головного мозга, спинного мозга или продолговатого мозга.
15. Применение соединений формулы (I) в соответствии с любым из пп.1-10 для изготовления лекарственных средств для лечения или предотвращения шизофрении, униполярной депрессии, болезни Альцгеймера, сосудистой деменции, расстройств аутистического спектра, болезни Дауна, синдрома ломкой X-хромосомы, болезни Паркинсона, болезни Хантингтона, генерализованной тревоги, панического расстройства с или без агорафобии, обсессивно-компульсивных расстройств, посттравматических стрессовых расстройств, биполярных расстройств, последствий острого церебрального сосудистого расстройства и последствий травмы головного мозга, спинного мозга или продолговатого мозга.
Текст
СОЕДИНЕНИЯ ДИГИДРООКСАЗОЛОБЕНЗОДИАЗЕПИНОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ИХ СОДЕРЖАЩИЕ в которой R1 означает атом водорода или алкильную группу; R2 означает алкильную группу; R3 означает арильную или гетероарильную группу. Лекарственные средства.(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR); ЭГИШ ДЬДЬСЕРДЬЯР НИРТ (HU) Настоящее изобретение относится к новым соединениям 1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-она, к способу их получения и к фармацевтическим композициям, их содержащим.-Аминомасляная кислота (или ГАМК) является основным ингибирующим нейротрансмиттером в центральной нервной системе млекопитающего. В прозэнцефалоне ГАМК главным образом синтезируется промежуточными нейронами, которые координируют комплексные нейронные цепи посредством ГАМКА и ГАМКВ рецепторов. ГАМКА рецепторы представляют собой ионотропные гетеропентамерные хлоридные каналы, включающие субъединичные белки(6 генов),(3 гена) и(3 гена) в соотношении 2:2:1. Бензодиазепины усиливают действие ГАМК на ГАМКА рецепторы путем взаимодействия на модуляторных сайтах связывания. Неселективные бензодиазепиновые агонисты вызывают седативное, снотворное, анксиолитическое, противосудорожное, амнезирующее, антиноцицептивное и миорелаксантное действия. Генетические "knock-in" эксперименты показали, что 1 субъединица отвечает за седативные действия, в то время как 2 и возможно 3 субъединицы отвечают за анксиолитические действия бензодиазепиновых агонистов. Лиганды бензодиазепиновых сайтов связывания, которые оказывают противоположные действия посредством уменьшения активации ГАМКА рецептора, вызванной ГАМК, называют"обратными агонистами". Такие соединения демонстрируют выгодную активность в отношении когнитивных расстройств; тем не менее, нежелательные проконвульсантное и анксиогенное действия препятствовали выполнению дальнейших, более подробных клинических исследований этих соединений. Функции ГАМКА рецептора, содержащего 5 субъединицу, определены менее четко. У мыши делецию или уменьшение количества ГАМКА рецепторов, содержащих 5 субъединицу, связывают с улучшением когнитивных функций. Кроме того, лечение селективным 5 обратным агонистом вызывает улучшенное прокогнитивное действие у некоторых моделей грызунов, в то время как у людей наблюдалось прокогнитивное действие на нарушение памяти, вызванное алкоголем. Существует большая, неудовлетворенная потребность в лечении когнитивных расстройств, связанных с различными возрастными расстройствами, нейродегенеративными или сосудистыми расстройствами, и также шизофренией. Общепринятые методы лечения болезни Альцгеймера, патологии с наибольшей распространенностью, основываются либо на ингибировании холинэстеразы (например, донепезилом), либо на NMDA антагонизме (мемантином). Тем не менее, ингибиторы холинэстеразы обладают большим числом нежелательных действий относительно их механизма действия, в то время как истинная эффективность мемантина является ограниченной. Следовательно, было бы особенно полезно иметь в распоряжении новые методы лечения, характеризующиеся большей эффективностью и лучшей переносимостью. Помимо факта, что соединения настоящего изобретения являются новыми, они обладают особенно ценными свойствами в результате селективного связывания с подтипом рецептора ГАМКА и уменьшения действий ГАМК. Более конкретно, настоящее изобретение относится к соединениям формулы (I) в которой R1 означает атом водорода или линейную или разветвленную (C1-C4)алкильную группу;R2 означает линейную или разветвленную (C1-C4)алкильную группу;R3 означает арильную или гетероарильную группу; и их солям присоединения с фармацевтически приемлемой кислотой. Среди фармацевтически приемлемых кислот могут быть упомянуты, без ограничения перечисленным, соляная кислота, бромисто-водородная кислота, серная кислота, уксусная кислота, трифторуксусная кислота, молочная кислота, малоновая кислота, янтарная кислота, глутаминовая кислота, фумаровая кислота, малеиновая кислота, фосфорная кислота, лимонная кислота, щавелевая кислота, метансульфокислота, бензолсульфокислота, паратолуолсульфокислота, камфорная кислота и т.д. Под арильной группой понимают нафтильную группу. Под гетероарильной группой понимают бициклическую или трициклическую группу, в которой по меньшей мере одно из колец является ароматическим кольцом, содержащим от 1 до 3 одинаковых или разных гетероатомов, выбранных из азота, кислорода и серы, необязательно замещенным одной или несколькими одинаковыми или разными группами, выбранными из атома галогена; линейной или разветвленной (C1-C6)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов; или цианогруппы. В соединениях формулы (I) R1 предпочтительно означает атом водорода.R3 группа предпочтительно означает гетероарильную группу. Более предпочтительно соединения формулы (I), которым отдают предпочтение, представляют собой соединения, в которых R3 означает бициклическую ароматическую группу, содержащую от 1 до 3 одинаковых или разных гетероатомов, выбранных из азота, кислорода и серы, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена; линейной или разветвленной (C1-C6)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов; или цианогруппы. Соединения формулы (I), которым отдают предпочтение, представляют собой соединения, в которых R3 означает бензотиенильную, бензофурильную или хинолильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена и линейной или разветвленной (C1-C4)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов. Другие соединения согласно изобретению, которым отдают предпочтение, представляют собой соединения, в которых R3 означает 1-бензотиенильную или 6-хинолильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена и линейной или разветвленной (C1-C4)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов. Другая выгодная возможность представлена соединениями, в которых R3 представляет 1 бензотиенильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена и линейной или разветвленной (C1-C4)алкильной группы,которая незамещена или замещена одним или несколькими атомами галогенов.R3 группа означает 1-бензотиен-2-ильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена и линейной или разветвленной (C1-C4)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов. Замещения гетероарильной группы, которым отдают предпочтение, представляют собой замещения атомом галогена, таким как фтор, хлор, бром или йод, более предпочтительно фтор или хлор; трифторметильной группой или метильной группой. Предпочтительными соединениями согласно изобретению являются Соли присоединения с фармацевтически приемлемой кислотой предпочтительных соединений согласно изобретению образуют неотъемлемую часть изобретения. Изобретение также относится к способу получения соединений формулы (I), который отличается тем, что в качестве исходного вещества используют соединение формулы (II) где R1 и R2 принимают значения, определенные для формулы (I),причем соединение формулы (II), в свободной форме или в форме соли, затем подвергают реакции циклизации в присутствии 1,1'-карбонилдиимидазола с получением соединения формулы (III) где R1 и R2 принимают значения, определенные для формулы (I),которое вводят в реакцию с восстанавливающим агентом с получением соединения формулы (IV) где R1 и R2 принимают значения, определенные для формулы (I),которое затем подвергают действию соединения формулы (V) где R3 принимает значения, определенные для формулы (I),с получением соединения формулы (VI) где R1, R2 и R3 принимают значения, определенные для формулы (I),которое затем подвергают действию окислителя, с последующим образованием соли, получая соединение формулы (VII) где R1, R2 и R3 принимают значения, определенные для формулы (I), и X означает противоион, такой как ClO4-, Cl-, Br-, HSO4-,которое затем подвергают действию гидразина с получением соединения формулы (I), причем соединение формулы (I) затем может быть очищено в соответствии с обычными методами разделения, превращено, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой и разделено, в требуемых случаях, на его изомеры, если они существуют, в соответствии с обычными методами разделения. Предпочтительный вариант относится к способу получения соединений формулы (I), который отличается тем, что в качестве исходного вещества используют соединение формулы (III)-3 021125 где R1 и R2 принимают значения, определенные для формулы (I),которое подвергают реакции бромирования с получением соединения формулы (VIII) где R1 и R2 принимают значения, определенные для формулы (I),которое подвергают стадии защиты карбонильной группы с получением соединения формулы (IX) где R1 и R2 принимают значения, определенные для формулы (I),которое затем подвергают действию соединения формулы (X) где R3 принимает значения, определенные для формулы (I),с получением соединения формулы (XI) где R1, R2 и R3 принимают значения, определенные для формулы (I),которое затем подвергают реакции циклизации с получением соединения формулы (VII) где R1, R2 и R3 принимают значения, определенные для формулы (I), и X означает противоион, такой как ClO4-, Cl-, Br-, HSO4-,которое затем подвергают действию гидразина с получением соединения формулы (I), причем соединение формулы (I) затем может быть очищено в соответствии с обычными методами разделения, превращено, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой и разделено, в требуемых случаях, на его изомеры, если они существуют, в соответствии с обычными методами разделения. Соединения формул (II), (V) и (X) имеются в продаже или без труда доступны специалисту в данной области техники с использованием обычных химических реакций или химических реакций, описанных в литературе. Соединения согласно настоящему изобретению являются селективными в отношении 5 субъединицы ГАМКА рецептора и ослабляют действие нейротрансмиттера ГАМК, что делает их пригодными для лечения или предотвращения психических и неврологических нарушений, характеризующихся когнитивными расстройствами, таких как шизофрения, униполярная депрессия, болезнь Альцгеймера, сосудистая деменция, расстройства аутистического спектра, болезнь Дауна, синдром ломкой X-хромосомы,болезнь Паркинсона, болезнь Хантингтона. Другие возможные показания к применению относятся к различным состояниям тревоги, таким как генерализованная тревога, панические расстройства с или без агорафобии, обсессивно-компульсивных расстройства, посттравматические стрессовые расстройства и биполярные расстройства. Соединения согласно изобретению могут применяться для лечения последствий острого церебрального сосудистого расстройства и последствий травмы головного мозга, спинного мозга или продолговатого мозга. Соединения предпочтительно могут применяться для лечения или предотвращения болезни Альцгеймера, сосудистой деменции, такой как деменция на почве последствий острого церебрального сосудистого расстройства, болезни Хантингтона и болезни Дауна. Изобретение также относится к фармацевтическим композициям, включающим в качестве активного ингредиента по меньшей мере одно соединение формулы (I) само по себе или в комбинации с одним или несколькими инертными, нетоксичными вспомогательными веществами или носителями. Среди фармацевтических композиций в соответствии с изобретением могут быть упомянуты более предпочтительно те, которые пригодны для перорального, парентерального (внутривенного или подкожного) или назального введения, таблетки или драже, сублингвальные таблетки, капсулы, пастилки, суппозитории,кремы, мази, гели для кожи, инъекционные препараты и пригодные для питья суспензии. Пригодная дозировка изменяется в зависимости от возраста и веса пациента и природы и тяжести расстройства, а также пути введения препарата, который может быть назальным, ректальным, парентеральным или пероральным. Как правило, стандартная доза для лечения изменяется в диапазоне от 0.1 до 1000 мг в течение 24 ч за 1-3 введения. Примеры, которые следуют ниже, иллюстрируют изобретение, но не ограничивают его каким бы то ни было образом. Структуры описанных соединений подтверждали обычными методами спектроскопии(включая протонный ЯМР: ls = большой синглет; s = синглет; d = дублет; t = триплет; dd = дублет дублетов; m = мультиплет). Методики получения, описанные ниже, приводят к исходным соединениям, которые используются в синтезе соединений настоящего изобретения. Методика получения 1: 5-(2-гидроксипропил)-1,3-бензоксазол-2(3H)-он. Стадия А: 5-(2-оксопропил)-1,3-бензоксазол-2(3H)-он. К раствору гидрохлорида (3-амино-4-гидроксифенил)ацетона (полученного в соответствии с ЕР 101223; Chemistry Letters 1980, 1, 85-88; или J. Org. Chem. 1951, 16, 221-224) (250 ммоль) в тетрагидрофуране (509 мл) добавляют 1,1'-карбонилдиимидазол (48.25 г; 290 ммоль) и смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения до температуры окружающей среды осадок отфильтровывают и фильтрат упаривают в вакууме. Остаток растворяют в этилацетате (400 мл), раствор промывают 5% водным раствором HCl (2200 мл) и соляным раствором (2200 мл), затем органическую фазу концентрируют в вакууме с получением указанного в заголовке продукта в виде твердого вещества. Температура плавления: 115-116C. Стадия В: 5-(2-гидроксипропил)-1,3-бензоксазол-2(3H)-он. К раствору продукта вышеприведенной стадии (180 ммоль) в этилацетате (352 мл) и воде (120 мл) добавляют, за несколько раз, борогидрид натрия (2.1 г; 550 ммоль) в течение 20 мин при 0-10C. Реакционную смесь перемешивают при температуре окружающей среды до завершения реакции. Смесь затем обрабатывают 10% водным раствором HCl до значения рН равного 2 и после разделения фаз водную фазу экстрагируют этилацетатом (390 мл). Органические фазы собирают, сушат над сульфат натрия и концентрируют в вакууме. Сухой остаток суспендируют в диизопропиловом эфире и затем отфильтровывают с получением указанного в заголовке продукта в виде твердого вещества. Температура плавления: 133-134C. Методика получения 2: 5-(1-этил-2-гидроксипропил)-1,3-бензоксазол-2(3H)-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в методике получения 1, с использованием в качестве исходного реагента гидрохлорида 3-(3-амино-4-гидроксифенил)-2 пентанона взамен гидрохлорида 1-(3-амино-4-гидроксифенил)ацетона. Температура плавления: 107-109C. Методика получения 3: 5-[1-(1-гидроксиэтил)бутил]-1,3-бензоксазол-2(3 Н)-он. Указанный в заголовке продукт получают в виде масла в соответствии с методикой, описанной в методике получения 1, с использованием в качестве исходного реагента гидрохлорида 2-амино-4-[1-(1 гидроксиэтил)бутил]фенола взамен гидрохлорида 1-(3-амино-4-гидроксифенил)ацетона. Методика получения 4: 5-(2-гидроксибутил)-1,3-бензоксазол-2(3H)-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в методике получения 1, с использованием в качестве исходного реагента гидрохлорида 1-(3-амино-4-гидроксифенил)-2 бутанона взамен гидрохлорида 1-(3-амино-4-гидроксифенил)ацетона. Температура плавления: 117-119C. Пример 1: 8-метил-5-(2-нафтил)-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он. Стадия А: 7-метил-5-(2-нафтил)-1,5,7,8-тетрагидро-2 Н-изохромено[6,7-d][1,3]оксазол-2-он. К суспензии соединения методики получения 1 (97.0 ммоль) и 2-нафтальдегида (94.3 ммоль) в этилацетате (180 мл) добавляют 15% безводный раствор HCl в этилацетате (90 мл). Реакционную смесь перемешивают в течение 20 ч при температуре окружающей среды. Наблюдают выпадение осадка и ожидаемый продукт в виде порошка собирают путем фильтрования. Температура плавления: 220-222C. Стадия В: перхлорат 7-метил-5-(2-нафтил)-2-оксо-1 Н,2 Н-изохромено[6,7-d][1,3]оксазол-6-ия. К раствору продукта вышеприведенной стадии (67.5 ммоль) в ацетоне (490 мл) при 0-10C в течение 40 мин по каплям добавляют реактив Джонса (88.63 мл; 236 ммоль). Смесь перемешивают при температуре окружающей среды до прекращения реакции и затем выливают в воду со льдом (2200 мл). Осадок отфильтровывают, промывают водой (550 мл), сушат и затем непосредственно вводят в реакцию следующей стадии. К суспензии сухого продукт в этилацетате (460 мл) при кипячении с обратным холодильником добавляют перхлорную кислоту 70% (5.87 мл; 67.5 ммоль). Кипячение с обратным холодильником поддерживают в течение дополнительных 60 мин при энергичном перемешивании. После охлаждения до температуры окружающей среды полученные кристаллы отфильтровывают и сушат с получением ожидаемого продукта. Температура плавления: 304-307C. Стадия С: 8-метил-5-(2-нафтил)-1,9-дигидро-2 Н-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он. К раствору продукта вышеприведенной стадии (51 ммоль) в 2-пропаноле (468 мл) при энергичном перемешивании при температуре окружающей среды добавляют гидразингидрат (6.68 мл; 133 ммоль). Реакционную смесь перемешивают в течение 20 ч при температуре окружающей среды. Полученные кристаллы затем отфильтровывают и перемешивают в теплой воде (1900 мл) в течение 30 мин. После фильтрования и сушки твердое вещество очищают в ацетонитриле при кипячении с обратным холодильником. Температура плавления: 304-306C. Пример 2: 5-(1-бензофуран-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2 он. Стадия А: 6-бром-5-(2-оксопропил)-1,3-бензоксазол-2(3H)-он. К раствору соединения методики получения 1 (52 ммоль) в метаноле (150 мл) небольшими порциями при 0-10C добавляют N-бромсукцинимид (9.8 г; 55 ммоль). Смесь перемешивают еще 1 ч и затем упаривают в вакууме. Полученный остаток растворяют в этилацетате (250 мл) и органическую фазу промывают 5% водным раствором гидрокарбоната натрия (450 мл), сушат над MgSO4 и упаривают в вакууме с получением ожидаемого продукта в виде твердого вещества. Температура плавления: 160-162C. Стадия В: 6-бром-5-[(2-метил-1,3-диоксолан-2-ил)метил]-1,3-бензоксазол-2(3H)-он. Смесь продукта вышеприведенной стадии (14.7 г; 54 ммоль), этиленгликоля (13.6 мл; 243 ммоль),паратолуолсульфокислоты (1 г; 5 ммоль) и толуола (300 мл) в течение 6 ч кипятят с обратным холодильником с использованием устройства Дина-Старка. Раствор охлаждают до температуры окружающей среды и затем выливают в этилацетат (300 мл). Органическую фазу промывают 5% водным раствором гидрокарбоната натрия (100 мл), соляным раствором (100 мл) и затем сушат над MgSO4 и упаривают в вакууме. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюант: дихлорметан/этилацетат) с получением указанного в заголовке продукта в твердой форме. Температура плавления: 117-119C. Стадия С: 6-(1-бензофуран-2-илкарбонил)-5-[(2-метил-1,3-диоксолан-2-ил)метил]-1,3-бензоксазол 2(3H)-он. 2.5 М раствор н-бутиллития в гексане (10.5 мл; 2.6 ммоль) добавляют по каплям к раствору продукта вышеприведенной стадии (3.1 г; 10 ммоль) в тетрагидрофуране (120 мл) при -78C. Реакционную смесь затем нагревают до -35C, перемешивают в течение 30 мин и затем добавляют N-метокси-N-метил 1-бензофуран-2-карбоксамид (16.5 ммоль). Реакционную смесь затем перемешивают при -35C в течение еще 1.5 ч и затем выливают в насыщенный раствор хлорида аммония (150 мл). После добавления этилацетата (150 мл) органическую фазу промывают соляным раствором (100 мл), сушат над MgSO4 и упаривают в вакууме. Остаток очищают с помощью хроматографии на колонке с силикагелем (элюант: гексан/этилацетат) с получением указанного в заголовке продукта. Температура плавления: 213-215C. Стадия D: перхлорат 5-(1-бензофуран-2-ил)-7-метил-2-оксо-1H,2 Н-изохромено[6,7-d][1,3]оксазол-6 ия. К суспензии продукта вышеприведенной стадии в этилацетате (460 мл) при кипячении с обратным холодильником добавляют перхлорную кислоту 70% (5.87 мл; 67.5 ммоль). Кипячение с обратным холодильником при энергичном перемешивании поддерживают в течение еще 60 мин. После охлаждения до температуры окружающей среды полученные кристаллы отфильтровывают и сушат с получением ожидаемого продукта. Температура плавления: 318-320C. Стадия Е: 5-(1-бензофуран-2-ил)-8-метил-1,9-дигидро-2 Н-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2 он. К раствору продукта вышеприведенной стадии (51 ммоль) в 2-пропаноле (468 мл) при энергичном перемешивании при температуре окружающей среды добавляют гидразингидрат (6.68 мл; 133 ммоль). Реакционную смесь перемешивают в течение 20 ч при температуре окружающей среды. Полученные кристаллы затем отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 мин. После фильтрования и сушки твердое вещество очищают в ацетонитриле при кипячении с обратным холодильником. Температура плавления: 290-292C. Пример 3: 5-(5-хлор-3-метил-1-бензофуран-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 2, с использованием 5-хлор-N-метокси-N,3-диметил-1-бензофуран-2-карбоксамида взамен N-метокси-Nметил-1-бензофуран-2-карбоксамида. Температура плавления: 297-298C. Пример 4: 8-метил-5-(2-хинолил)-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он. К раствору перхлората 7-метил-2-оксо-5-(2-хинолил)-1 Н,2 Н-изохромено[6,7-d][1,3]оксазол-6-ия (51 ммоль) (полученного на стадиях А-D, описанных в примере 2, с использованием N-метокси-N-метил-2 хинолинкарбоксамида взамен N-метокси-N-метил-1-бензофуран-2-карбоксамида) в 2-пропаноле (468 мл) при энергичном перемешивании при температуре окружающей среды добавляют гидразингидрат (6.68 мл; 133 ммоль). Реакционную смесь перемешивают в течение 20 ч при температуре окружающей среды. Полученные кристаллы затем отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 мин. После фильтрования и сушки твердое вещество очищают с помощью хроматографии на колонке с силикагелем (элюант: дихлорметан/метанол) с получением указанного в заголовке продукта. Температура плавления: 304-306C. Пример 5: 8-метил-5-(6-хинолил)-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он. К суспензии перхлората 7-метил-2-оксо-5-(6-хинолил)-1H,2H-изохромено[6,7-d][1,3]оксазол-6-ия(51 ммоль) (полученного в соответствии со стадиями А-D, описанными в примере 2, с использованиемN-метокси-N-метил-6-хинолинкарбоксамида взамен N-метокси-N-метил-1-бензофуран-2-карбоксамида) в 2-пропаноле (468 мл) при энергичном перемешивании при температуре окружающей среды добавляют гидразингидрат (6.68 мл; 133 ммоль). Реакционную смесь перемешивают в течение 20 ч при температуре окружающей среды. Полученные кристаллы затем отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 мин. После фильтрования и сушки твердое вещество очищают с помощью кристаллизации из смеси диметилформамид/метанол. Температура плавления: 302-304C. 1H ЯМР спектроскопический анализ (500 МГц, ДМСО,в м.д.) 12.05 (ls, 1 Н); 8.95 (dd, 1H, J=4.2 и 1.7 Гц); 8.44 (dd, 1H, J=8.3 и 1.7 Гц); 8.09 (m, 3H); 7.57 (dd, 1H, J=8.3 и 4.2 Гц); 7.29 (s, 1 Н); 7.24 (s, 1H); 3.64 (d, 1H, J=12.3 Гц); 2.89 (d, 1H, J=12.2 Гц); 2.10 (s, 3H). Пример 6: 5-(1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2 он. К раствору 5-(1-бензотиен-2-ил)-7-метил-1,5,7,8-тетрагидро-2H-изохромено[6,7-d][1,3]оксазол-2 она (67.5 ммоль), полученного в соответствии со стадией А, описанной в примере 1, с использованием 1 бензотиофен-2-карбальдегида взамен 2-нафтальдегида в ацетоне (490 мл) при 0-10C в течение 40 мин по каплям добавляют реактив Джонса (88.63 мл; 236 ммоль). Смесь перемешивают при температуре окружающей среды до прекращения реакции и затем выливают в воду со льдом (2200 мл). Осадок отфильтровывают, промывают водой (550 мл), сушат и затем непосредственно вводят в реакцию следующей стадии. К суспензии сухого продукт в этилацетате (460 мл) при кипячении с обратным холодильником добавляют перхлорную кислоту 70% (5.87 мл; 67.5 ммоль). Кипячение с обратным холодильником поддерживают в течение дополнительных 60 мин при энергичном перемешивании. После охлаждения до температуры окружающей среды сырой продукт отделяют и затем суспендируют в 2-пропаноле (434 мл),затем при энергичном перемешивании при температуре окружающей среды добавляют гидразингидрат(6.17 мл; 127 ммоль). Реакционную смесь перемешивают в течение 20 ч при температуре окружающей среды. Полученные кристаллы затем отфильтровывают и перемешивают в теплой воде (1900 мл) в течение 30 мин. После фильтрования и сушки твердое вещество кипятят с обратным холодильником в ацетонитриле в течение 30 мин. После выделения и сушки получают указанный в заголовке продукт. Температура плавления: 338-340C. 1H ЯМР спектроскопический анализ (500 МГц, ДМСО,в м.д.): 12.10 (ls, 1H); 7.99 (m, 1H); 7.86 (m,1H); 7.69 (s, 1 Н); 7.53 (s, 1H); 7.39 (m, 2 Н); 7.28 (s, 1H); 3.61 (d, 1H, J=12.3 Гц); 2.86 (d, 1H, J=12.2 Гц); 2.08 (s, 3H). Пример 7: 5-(3-хлор-4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 3-хлор-4-фтор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 295-297C. Пример 8: 5-(3-хлор-6-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. К суспензии перхлората 5-(3-хлор-6-фтор-1-бензотиен-2-ил)-7-метил-2-оксо-1H,2H-изохромено[6,7d][1,3]оксазол-6-ия (51 ммоль) (полученного в соответствии со стадиями А и В, описанными в примере 1,с использованием 3-хлор-6-фтор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида) в 2-пропаноле(468 мл) при энергичном перемешивании при температуре окружающей среды добавляют гидразингидрат (6.68 мл; 133 ммоль). Реакционную смесь перемешивают в течение 20 ч при температуре окружающей среды. Полученные кристаллы затем отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 мин. После фильтрования и сушки твердое вещество очищают с помощью кристаллизации из смеси диметилформамид/метанол. Температура плавления: 276-278C. Пример 9: 5-[3-хлор-4-(трифторметил)-1-бензотиен-2-ил]-8-метил-1,9-дигидро-2H[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 3-хлор-4-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 322-323C. 1H ЯМР спектроскопический анализ (500 МГц, ДМСО,в м.д.): 12.02 (ls, 1H); 8.52 (d, 1H, J=8.1 Гц); 7.99 (d, 1H, J=7.5 Гц); 7.72 (t, 1H, J=7.9 Гц); 7.31 (s, 1H); 7.30 (s, 1H); 3.77 (d, 1H, J=12.5 Гц); 2.85 (d,1H, J=12.3 Гц); 2.13 (s, 3H). Пример 10: 8-метил-5-(3-метил-1-бензотиен-2-ил)-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 3-метил-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 301-303C. Пример 11: 8-метил-5-[3-метил-4-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 3-метил-4-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 313-315C. Пример 12: 8-метил-5-[3-метил-5-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 3-метил-5-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 301-303C. Пример 13: 8-метил-5-[3-метил-6-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 3-метил-6-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 303-305C. Пример 14: 8-метил-5-[3-метил-7-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 3-метил-7-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 292-294C. Пример 15: 5-(3-этил-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[13]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 3-этил-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 293-295C. Пример 16: 5-(3-этил-4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. К суспензии перхлората 5-(3-этил-4-фтор-1-бензотиен-2-ил)-7-метил-2-оксо-1H,2H-изохромено[6,7d][1,3]оксазол-6-ия (51 ммоль) (полученного в соответствии со стадиями А и В, описанными в примере 1 с использованием 3-этил-4-фтор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида) в 2-пропаноле(468 мл) при энергичном перемешивании при температуре окружающей среды добавляют гидразингидрат (6.68 мл; 133 ммоль). Реакционную смесь перемешивают в течение 20 ч при температуре окружающей среды. Полученные кристаллы затем отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 мин. После фильтрования и сушки твердое вещество очищают с помощью хроматографии на колонке с силикагелем (элюант: дихлорметан/ацетонитрил) с получением указанного в заголовке продукта. Температура плавления: 297-299C. Пример 17: 5-(3-этил-4,7-дифтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-8 021125h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 8, с использованием 3-этил-4,7-дифтор-1-бензотиофен-2-карбальдегида взамен 3-хлор-6-фтор-1 бензотиофен-2-карбальдегида. Температура плавления: 270-272C. Пример 18: 8-метил-5-(3-пропил-1-бензотиен-2-ил)-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. К суспензии перхлората 5-(3-пропил-1-бензотиен-2-ил)-7-метил-2-оксо-1H,2H-изохромено[6,7d][1,3]оксазол-6-ия (51 ммоль) (полученного в соответствии со стадиями А и В, описанными в примере 1,с использованием 3-пропил-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида) в 2-пропаноле (468 мл) при энергичном перемешивании при температуре окружающей среды добавляют гидразингидрат(6.68 мл; 133 ммоль). Реакционную смесь перемешивают в течение 20 ч при температуре окружающей среды. Полученные кристаллы затем отфильтровывают и затем перемешивают в теплой воде (1900 мл) в течение 30 мин. После фильтрования и сушки твердое вещество очищают с помощью хроматографии на колонке с силикагелем (элюант: дихлорметан/этилацетат) с получением указанного в заголовке продукта. Температура плавления: 307-308C. Пример 19: 5-(3-бутил-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 18, с использованием 3-бутил-1-бензотиофен-2-карбальдегида взамен 3-пропил-1-бензотиофен-2 карбальдегида. Температура плавления: 278-280C. Пример 20: 8-метил-5-[3-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 3-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 260-262C. Пример 21: 5-(4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Стадия А: перхлорат 5-(4-фтор-1-бензотиен-2-ил)-7-метил-2-оксо-1H,2H-изохромено[6,7d][1,3]оксазол-6-ия. Ожидаемый продукт получают в соответствии с методикой, описанной для стадий А и В примера 1 с использованием 4-фтор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида, или в соответствии с методикой, описанной для стадий А-D примера 2 с использованием 4-фтор-N-метокси-N-метил-1 бензотиофен-2-карбоксамида взамен N-метокси-N-метил-1-бензофуран-2-карбоксамида. Температура плавления: 278-280C. Стадия В: 5-(4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2 Н-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Ожидаемый продукт получают, исходя из соединения вышеприведенной стадии, в соответствии с методикой, описанной для стадии С примера 1. Температура плавления: 394-396C. 1H ЯМР спектроскопический анализ (500 МГц, ДМСО,в м.д.): 12.06 (ls, 1H); 7.86 (d, 1H, J=8.1 Гц); 7.74 (s, 1H); 7.45 (m, 1H); 7.45 (s, 1H); 7.28 (s, 1 Н); 7.21 (dd, 1 Н, J1=8.1 Гц, J2=10.4 Гц); 3.62 (d, 1H,J=12.3 Гц); 2.85 (d, 1H, J=12.2 Гц); 2.08 (s, 3H). Пример 22: 5-(4-фтор-3-метил-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 4-фтор-3-метил-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 321-323C. Пример 23: 9-этил-5-(4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2 Н-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 4-фтор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида и соединения методики получения 2 взамен соединения методики получения 1. Температура плавления: 291-292C. Пример 24: 5-(4-фтор-1-бензотиен-2-ил)-8-метил-9-пропил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной для стадий А и В примера 1, с использованием 4-фтор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида и соединения методики получения 3 взамен соединения методики получения 1 и, далее, по методике, описанной в примере 18. Температура плавления: 299-300C. Пример 25: 5-(4-фтор-3-метил-1-бензотиен-2-ил)-8-метил-9-пропил-1,9-дигидро-2H[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 4-фтор-3-метил-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида и соединения методики получения 3 взамен соединения методики получения 1. Температура плавления: 269-271C. Пример 26: 5-(4-фтор-7-йод-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 4-фтор-7-йод-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 324-326C. Пример 27: 5-(4-хлор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 6, с использованием 4-хлор-1-бензотиофен-2-карбальдегида взамен 1-бензотиофен-2-карбальдегида. Температура давления: 333-335C. Пример 28: 5-(4-хлор-3-метил-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 4-хлор-3-метил-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 305-307C. Пример 29: 5-(4-бром-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 4-бром-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 336-338C. Пример 30: 5-(4-йод-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 4-йод-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 326-328C. Пример 31: 8-метил-5-[4-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 4-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 343-345C. 1H ЯМР спектроскопический анализ (500 МГц, ДМСО,в м.д.): 12.12 (ls, 1H); 8.38 (d, 1H, J=8,1 Гц); 7.80 (d, 1H, J=7.4 Гц); 7.70 (s, 1H); 7.61 (t, 1H, J=7.8 Гц); 7.45 (s, 1H); 7.29 (s, 1H); 3.64 (d, 1H, J=12.3 Гц); 2.88 (d, 1H, J=12.3 Гц); 2.09 (s, 3H). Пример 32: 5-(5-хлор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 6, с использованием 5-хлор-1-бензотиофен-2-карбальдегида взамен 1-бензотиофен-2-карбальдегида. Температура плавления: 322-324C. 1H ЯМР спектроскопический анализ (500 МГц, ДМСО,в м.д.): 12.11 (ls, 1H); 8.03 (d, 1H, J=8.7 Гц); 7.95 (d, 1H, J=2.1 Гц); 7.68 (s, 1H); 7.52 (s, 1H); 7.44 (dd, 1H, J1=2.1 Гц, J2=8.5 Гц); 7.38 (s, 1H); 3.62(d, 1H, J=12.5 Гц); 2.86 (d, 1H, J=12.2 Гц); 2.08 (s, 3H). Пример 33: 5-(5-хлор-3-метил-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 6, с использованием 5-хлор-3-метил-1-бензотиофен-2-карбальдегида взамен 1-бензотиофен-2-карбальдегида. Температура плавления: 310-312C. Пример 34: 5-(5-фтор-3-метил-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 6, с использованием 5-фтор-3-метил-1-бензотиофен-2-карбальдегида взамен 1-бензотиофен-2-карбальдегида. Температура плавления: 291-292C. Пример 35: 8-метил-5-[5-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 5-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 282-284C. Пример 36: 5-(6-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 6, с использованием 6-фтор-1-бензотиофен-2-карбальдегида взамен 1-бензотиофен-2-карбальдегида. Температура плавления: 345-347C. Пример 37: 5-(6-фтор-3-метил-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2 Н-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 6-фтор-3-метил-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 286-288C. Пример 38: 8-метил-5-[6-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 6, с использованием 6-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 1-бензотиофен-2 карбальдегида. Температура плавления: 329-331C. Пример 39: 2-(8-метил-2-оксо-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-5-ил)-1 бензотиофен-6-карбонитрил. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 6, с использованием 2-формил-1-бензофуран-6-карбонитрила взамен 1-бензотиофен-2-карбальдегида. Температура плавления: 388-390C. Пример 40: 5-(7-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 7-фтор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 324-326C. 1H ЯМР спектроскопический анализ (500 МГц, ДМСО,в м.д.): 12.09 (bs, 1 Н); 7.73 (m, 1H); 7.70 (s,1 Н); 7.63 (d, 1 Н, J=3.7 Гц); 7.42 (m, 1H); 7.29 (m, 1 Н); 7.27 (s, 1 Н); 3.62 (d, 1H, J=12.5 Гц); 2.86 (d, 1H,J=12.3 Гц); 2.08 (s, 3H). Пример 41: 5-(7-фтор-3-метил-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 7-фтор-3-метил-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 307-309C. Пример 42: 5-(7-хлор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 7-хлор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 333-335C. Пример 43: 5-(7-хлор-4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 7-хлор-4-фтор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 364-366C. Пример 44: 5-(7-хлор-4-фтор-3-метил-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2 Н-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 8, с использованием 7-хлор-4-фтор-3-метил-1-бензотиофен-2-карбальдегида взамен 3-хлор-6-фтор-1 бензотиофен-2-карбальдегида. Температура плавления: 319-320C. Пример 45: 5-[7-хлор-4-(трифторметил)-1-бензотиен-2-ил]-8-метил-1,9-дигидро-2H[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 7-хлор-4-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 340-342C. Пример 46: 5-(7-бром-4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 7-бром-4-фтор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 345-347C. Пример 47: 8-метил-5-[7-(трифторметил)-1-бензотиен-2-ил]-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 7-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 336-338C. Пример 48: 8-метил-5-(1-метилнафто[2,1-b]тиен-2-ил)-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 8, с использованием 1-метилнафто[2,1-b]тиофен-2-карбальдегида взамен 3-хлор-6-фтор-1-бензотиофен-2 карбальдегида. Температура плавления: 318-320C. Пример 49: 8-этил-5-(4-фтор-1-бензотиен-2-ил)-1,5-дигидро-2 Н-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 4-фтор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида и соединения методики получения 4 взамен соединения методики получения 1. Температура плавления: 295-297C. Пример 50: 8-этил-5-[4-(трифторметил)-1-бензотиен-2-ил]-1,5-дигидро-2 Н-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 4-(трифторметил)-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида и соединения методики получения 4 взамен соединения методики получения 1. Температура плавления: 301-303C. Пример 51: 8-этил-5-[4-фтор-3-метил-1-бензотиен-2-ил]-1,5-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 4-фтор-3-метил-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида и соединения методики получения 4 взамен соединения методики получения 1. Температура плавления: 289-291C. Пример 52: 5-(5-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5h][2,3]бензодиазепин-2-он. Указанный в заголовке продукт получают в соответствии с методикой, описанной в примере 1, с использованием 5-фтор-1-бензотиофен-2-карбальдегида взамен 2-нафтальдегида. Температура плавления: 291-293C. Фармакологическое исследование Пример А. Исследование активности ГАМКА рецепторов. Соединения исследуют на НЕК-293 (человеческие эмбриональные почечные) клетках, стабильно экспрессирующих субъединицу 5 человеческого ГАМКА рецептора, а также субъединицы бета 2 (короткую) и гамма 2 (длинную). Клетки содержат в присутствии набора из трех антибиотиков - неомицина,зеоцина и пуромицина - в среде Дульбекко (DMEM), содержащей 10% (об./об.) фетальной бычьей сыворотки. В день перед экспериментом клетки переносят в 96-луночные планшеты (при плотности 50000 клеток/лунку). Клетки затем предварительно инкубируют в течение 40 мин с исследуемыми соединениями и обрабатывают ГАМК. Потенциал мембраны измеряют с использованием синего FMP маркера (Molecular Devices), следуя инструкциям изготовителя. Ответы записывают в течение 120 с на планшетридере FlexStation3 (Molecular Devices, США). Значения IC50 исследуемых соединений определяют регулировкой кривой, полученной с помощью нелинейной регрессии с использованием программного обеспечения SoftMax Pro (Molecular Devices, США). Соединения согласно изобретению таким образом демонстрируют превосходное сродство и являются селективными в отношении альфа 5 рецептора. Пример В. Исследование на узнавание новых предметов на мыши. Это исследование оценивает непространственную кратковременную память у грызуна. Исследование основано на естественном стремлении животного тратить больше времени на изучение нового предмета, чем на изучение знакомого предмета. Желание исследовать новый предмет демонстрирует использование обучения и опознающей памяти. На 0 день (ознакомительная фаза), самцов NMRI мышей помещают в черную ПВХ коробку(324527 см) без предмета на срок 2.5 мин. На первый день мышам предоставляют возможность изучать два одинаковых предмета в течение 3 мин (фаза приобретения). На второй день один из предметов заменяют новым предметом и продолжительность изучения определяют для каждого предмета на протяжении 4 мин (фаза удержания (в памяти. Предварительное лечение соединениями согласно изобретению проводят и/п путем в день фазы приобретения. Продолжительность изучения определяют с помощью программного обеспечения TSE System (TSE System GmbH, Бэд-Хомбург, Германия). Результаты. См. фиг. 1-3. Результаты доказывают, что соединения согласно изобретению демонстрируют прокогнитивное действие в модели узнавания предмета у мыши. В частности, соединение примера 21 обладает значительным прокогнитивным действием при дозировках 0.01, 0.03 и 0.1 мг/кг, и/п. Кроме того, соединение примера 31 обладает значительным прокогнитивным действием при дозировке 1 мг/кг, и/п, а соединение примера 36 обладает значительным прокогнитивным действием при дозировке 10 мг/кг, и/п. Пример С. Исследование на крысе в радиальном лабиринте. Это исследование широко используют для оценивания кратковременной и референтной памяти у грызуна. Прибор состоит из небольшой центральной восьмиугольной платформы, из которой расходятся лучами восемь разных, равномерно расположенных проходов. В конце каждого прохода находится пища,которую не видно из центральной платформы. В эксперименте все проходы содержат "поощрение" и животному надлежит посетить каждый из проходов только один раз. Каждое дополнительное посещение считают ошибкой. На первый день эксперимента крыс лишают пищи на 24 ч. Формирование навыков начинают на следующий день. Крыс помещают на центральной платформе лабиринта, каждый из восьми проходов которого обеспечен пищей. Животным обеспечивают свободный доступ к поеданию пищи в восьми проходах. Если крыса не съедает всю пищу в течение 20 мин, ее удаляют из лабиринта. Эксперименты продолжают один раз в день до тех пор, пока животные не достигнут установленной цели, а именно до достижения общего числа ошибок - другими словами, любого дополнительного посещения одного прохода - менее 3. Этих животных включают в остальную часть исследования. В последний день отобранным крысам вводят кетамин (10 мг/кг и/п.) совместно с п/о введением либо носителя,либо соединения согласно изобретению. Исследования начинают через 120 мин после введения. Каждое исследование продолжается максимум 5 мин. Результаты. См. фиг. 4. Результаты доказывают, что соединения согласно изобретению демонстрируют значительное улучшение памяти у исследуемых животных. В частности, соединение примера 21 значительно реверсирует вызванный кетамином дефицит референтной памяти зависимым от дозировки образом (от 0.3 до 3 мг/кг п/о). Пример D. Окклюзия средней мозговой артерии (СМА) у мыши. Перманентную фокальную церебральную ишемию вызывают электрокоагуляцией левой СМА (в соответствии с методом Welsh F.A. и др., J. Neurochem. 1987, 49, 846-851). Самцов NMRI мышей анестезируют с использованием 2,2,2-трибромэтанола (500 мг/кг и/п., 20 мл/кг). Разрез выполняют в левой височно-теменной области головы между глазной впадиной и ухом. Височную мышцу затем рассекают и отгибают для того, чтобы обнажить череп. Небольшое трепанационное отверстие сверлят в наружной боковой части черепа точно к уровню СМА и ствол СМА затем подвергают окклюзии путем электрокоагуляции. Соединения согласно изобретению вводят и/п путем 30 мин после окклюзии СМА. Через два дня животных глубоко анестезируют с использованием пентобарбитала натрия (60 мг/кг и/п., 10 мл/кг), перфузируемого через сердце с 4% раствором хлорида 2,3,5-трифенилтетразолия. Животных в заключение обезглавливают и мозг каждого извлекают и помещают по меньшей мере на 24 ч в солевой раствор, содержащий 8% формальдегида. Определение площади некротической поверхности выполняют с использованием системы анализа изображений (DigiCell для Windows 4.0). Результаты. См. фиг. 5. Результаты доказывают, что соединения согласно изобретению демонстрируют значительное нейропротективное действие. В частности, соединение примера 21 значительно ингибирует повреждение мозга при дозировках 1, 3 и 10 мг/кг и/п в модели окклюзии СМА у мыши. Пример Е. Фармацевтическая композиция. Состав лекарственного средства для получения 1000 таблеток, каждая из которых содержит 10 мг 5(4-фтор-1-бензотиен-2-ил)-8-метил-1,9-дигидро-2H-[1,3]оксазоло[4,5-h][2,3]бензодиазепин-2-она в которой R1 означает атом водорода или линейную или разветвленную (C1-C4)алкильную группу;R2 означает линейную или разветвленную (C1-C4)алкильную группу;R3 означает арильную или гетероарильную группу; и их соли присоединения с фармацевтически приемлемой кислотой,где под арильной группой понимают нафтильную группу, под гетероарильной группой понимают бициклическую или трициклическую группу, в которой по меньшей мере одно из колец является ароматическим кольцом, содержащим от 1 до 3 одинаковых или разных гетероатомов, выбранных из азота,кислорода и серы, необязательно замещенным одной или несколькими одинаковыми или разными группами, выбранными из атома галогена; линейной или разветвленной (С 1-С 6)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов; или цианогруппы. 2. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R1 означает атом водорода. 3. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R2 означает метильную группу. 4. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает гетероарильную группу. 5. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает бициклическую ароматическую группу, содержащую от 1 до 3 одинаковых или разных гетероатомов, выбранных из азота, кислорода и серы, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена; линейной или разветвленной (С 1-С 6)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов; или цианогруппы. 6. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает бензотиенильную или хинолильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена и линейной или разветвленной (С 1-С 4)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов. 7. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает 1 бензотиенильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена и линейной или разветвленной (C1-C4)алкильной группы,которая незамещена или замещена одним или несколькими атомами галогенов. 8. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает 1-бензотиен-2 ильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома галогена и линейной или разветвленной (C1-C4)алкильной группы, которая незамещена или замещена одним или несколькими атомами галогенов. 9. Соединения формулы (I) в соответствии с п.1, отличающиеся тем, что R3 означает 1-бензотиен-2 ильную группу, необязательно замещенную одной или несколькими одинаковыми или разными группами, выбранными из атома фтора, атома хлора, трифторметильной группы и метильной группы. 10. Соединения формулы (I) в соответствии с п.1, которые представляют собой 11. Способ получения соединений формулы (I) в соответствии с п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (II) где R1 и R2 принимают значения, определенные для формулы (I),причем соединение формулы (II) в свободной форме или в форме соли подвергают реакции циклизации в присутствии 1,1'-карбонилдиимидазола с получением соединения формулы (III) где R1 и R2 принимают значения, определенные для формулы (I),которое вводят в реакцию с восстанавливающим агентом с получением соединения формулы (IV) где R1 и R2 принимают значения, определенные для формулы (I),которое затем подвергают действию соединения формулы (V) где R3 принимает значения, определенные для формулы (I),с получением соединения формулы (VI) где R1, R2 и R3 принимают значения, определенные для формулы (I),которое затем подвергают действию окислителя, с последующим образованием соли, получая со- 15021125 где R1, R2 и R3 принимают значения, определенные для формулы (I), и X означает противоион, такой как ClO4-, Cl-, Br-, HSO4-,которое затем подвергают действию гидразина с получением соединения формулы (I), причем соединение формулы (I) затем может быть очищено в соответствии с обычными методами разделения, превращено, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой и разделено, в требуемых случаях, на его изомеры, если они существуют, в соответствии с обычными методами разделения. 12. Способ получения соединений формулы (I) в соответствии с п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (VIII) где R1 и R2 принимают значения, определенные для формулы (I),которое подвергают стадии защиты карбонильной группы с получением соединения формулы (IX) где R1 и R2 принимают значения, определенные выше,которое затем подвергают действию соединения формулы (X) где R3 принимает значения, определенные для формулы (I),с получением соединения формулы (XI) где R1, R2 и R3 принимают значения, определенные для формулы (I),которое затем подвергают реакции циклизации с получением соединения формулы (VII) где R1, R2 и R3 принимают значения, определенные для формулы (I), и X означает противоион, такой как ClO4-, Cl-, Br-, HSO4-,которое затем подвергают действию гидразина с получением соединения формулы (I), причем соединение формулы (I) затем может быть очищено в соответствии с обычными методами разделения, превращено, при необходимости, в его соли присоединения с фармацевтически приемлемой кислотой и раз- 16021125 делено, в требуемых случаях, на его изомеры, если они существуют, в соответствии с обычными методами разделения. 13. Фармацевтическая композиция для лечения или предотвращения психических и неврологических нарушений, включающая в качестве активного ингредиента соединение в соответствии с любым из пп.1-10 в комбинации с одним или несколькими инертными, нетоксичными, фармацевтически приемлемыми носителями. 14. Фармацевтические композиции в соответствии с п.13 для лечения или предотвращения шизофрении, униполярной депрессии, болезни Альцгеймера, сосудистой деменции, расстройств аутестического спектра, болезни Дауна, синдрома ломкой Х-хромосомы, болезни Паркинсона, болезни Хантингтона,генерализованной тревоги, панического расстройства с или без агорафобии, обсессивно-компульсивных расстройств, посттравматических стрессовых расстройств, биполярных расстройств, последствий острого церебрального сосудистого расстройства и последствий травмы головного мозга, спинного мозга или продолговатого мозга. 15. Применение соединений формулы (I) в соответствии с любым из пп.1-10 для изготовления лекарственных средств для лечения или предотвращения шизофрении, униполярной депрессии, болезни Альцгеймера, сосудистой деменции, расстройств аутистического спектра, болезни Дауна, синдрома ломкой X-хромосомы, болезни Паркинсона, болезни Хантингтона, генерализованной тревоги, панического расстройства с или без агорафобии, обсессивно-компульсивных расстройств, посттравматических стрессовых расстройств, биполярных расстройств, последствий острого церебрального сосудистого расстройства и последствий травмы головного мозга, спинного мозга или продолговатого мозга. Пример 21 Прокогнитивное действие соединения примера 21 в модели узнавания предмета у мыши после и/п введения (прибл. на пике концентрации). Средние значенияСОС (n=20-22/группу); тест Даннетта после ANOVA Пример 31 Прокогнитивное действие соединения примера 31 в модели узнавания предмета у мыши после и/п введения (прибл. на пике концентрации). Средние значенияСОС (n=12/группу); тест Даннетта после ANOVA Пример 36 Прокогнитивное действие соединения примера 36 в модели узнавания предмета у мыши после и/п введения (прибл. на пике концентрации). Средние значенияСОС (n=12/группу); тест Даннетта после ANOVA Снижение вызванного кетамином дефицита кратковременной памяти с помощью соединения примера 21 у крысы после п/о введения Средние значенияСОС (n=9-10); U-критерий Манна-Уитни ( р 0.01, контроль против контроля, получавшего носитель); тест Данна после Крускала-Валлиса ANOVA ( р 0.01,р 0.001 против контроля, получавшего кетамин). Фиг. 4 Нейропротективные действия соединения примера 21 в модели перманентной окклюзии СМА у мыши после и/п введения Средние значенияСОС (n=6-8/группа); тест Данна после ANOVA ( р 0.01, р 0.001 против контроля); МЦ: 0.4% метилцеллюлоза. Фиг. 5
МПК / Метки
МПК: C07D 498/02, A61P 25/28, A61K 31/551, A61P 25/24, A61P 25/18
Метки: получения, дигидрооксазолобензодиазепинона, содержащие, фармацевтические, способ, соединения, композиции
Код ссылки
<a href="https://eas.patents.su/19-21125-soedineniya-digidrooksazolobenzodiazepinona-sposob-ih-polucheniya-i-farmacevticheskie-kompozicii-ih-soderzhashhie.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения дигидрооксазолобензодиазепинона, способ их получения и фармацевтические композиции, их содержащие</a>
Предыдущий патент: Система и способ обеспечения кратчайшего маршрута соединения
Следующий патент: Замещенные изохинолиноны и хинализолиноны
Случайный патент: Ингибиторы гистондеацетилазы, вызывающие дифференцировку клеток, и их применение












