Пероральные лекарственные формы бендамустина
Формула / Реферат
1. Фармацевтическая композиция для перорального введения, содержащая бендамустин или его фармацевтически приемлемые сложный эфир, соль или сольват в качестве активного ингредиента и фармацевтически приемлемый эксципиент, который представляет собой фармацевтически приемлемое неионное поверхностно-активное вещество, выбранное из группы, состоящей из макрогол глицерилгидроксистеарата, полиоксил-35-касторового масла и блок-сополимера этиленоксид/пропиленоксид (Pluronic® L44 NF или Poloxamer® 124).
2. Фармацевтическая композиция по п.1, характеризующаяся тем, что активный ингредиент представляет собой гидрохлорид бендамустина.
3. Фармацевтическая композиция по п.1 или 2, характеризующаяся тем, что она содержит от 10 до 1000 мг, предпочтительно от 25 до 600 мг, более предпочтительно от 50 до 200 мг и наиболее предпочтительно около 100 мг активного ингредиента.
4. Фармацевтическая композиция по любому из пп.1-3, характеризующаяся тем, что она дополнительно содержит коллоидный диоксид кремния.
5. Фармацевтическая композиция по любому из пп.1-4, характеризующаяся тем, что она дополнительно содержит лауроилмакрогол глицериды (Gelucire® 44/14).
6. Фармацевтическая композиция по любому из пп.1-5, характеризующаяся тем, что она находится в твердой желатиновой капсуле.
7. Фармацевтическая композиция по любому из пп.1-6, характеризующаяся тем, что она демонстрирует растворение бендамустина, составляющее по меньшей мере 60% за 20 мин, 70% за 40 мин и 80% за 60 мин при измерении с использованием лопастного аппарата при 50 об/мин в соответствии с Европейской Фармакопеей в 500 мл среды растворения при pH 1,5.
8. Фармацевтическая композиция по п.7, характеризующаяся тем, что она демонстрирует растворение, составляющее по меньшей мере 60% за 10 мин, 70% за 20 мин и 80% за 30 мин.
9. Фармацевтическая композиция по любому из пп.1-8, характеризующаяся тем, что она используется для лечения медицинского состояния, выбранного из хронического лимфолейкоза, острого лимфолейкоза, хронического миелоидного лейкоза, острого миелоидного лейкоза, болезни Ходжкина, неходжкинской лимфомы, множественной миеломы, рака молочной железы, рака яичника, мелкоклеточного рака легкого, немелкоклеточного рака легкого и аутоиммунного заболевания.
10. Фармацевтическая композиция по любому из пп.1-8, характеризующаяся тем, что она содержит по меньшей мере один дополнительный активный агент, выбранный из группы, состоящей из антитела, специфичного к CD20, производного антрациклина, алкалоида барвинка или производного платины.
11. Фармацевтическая композиция по п.10, характеризующаяся тем, что антитело, специфичное к CD20, представляет собой ритуксимаб; производное антрациклина представляет собой доксорубицин или даунорубицин; алкалоид барвинка представляет собой винкристин и производное платины представляет собой цисплатин или карбоплатин.
12. Фармацевтическая композиция по любому из пп.1-8 или 10, 11, дополнительно содержащая кортикостероид.
13. Фармацевтическая композиция по п.12, характеризующаяся тем, что кортикостероид представляет собой преднизон или преднизолон.
Текст
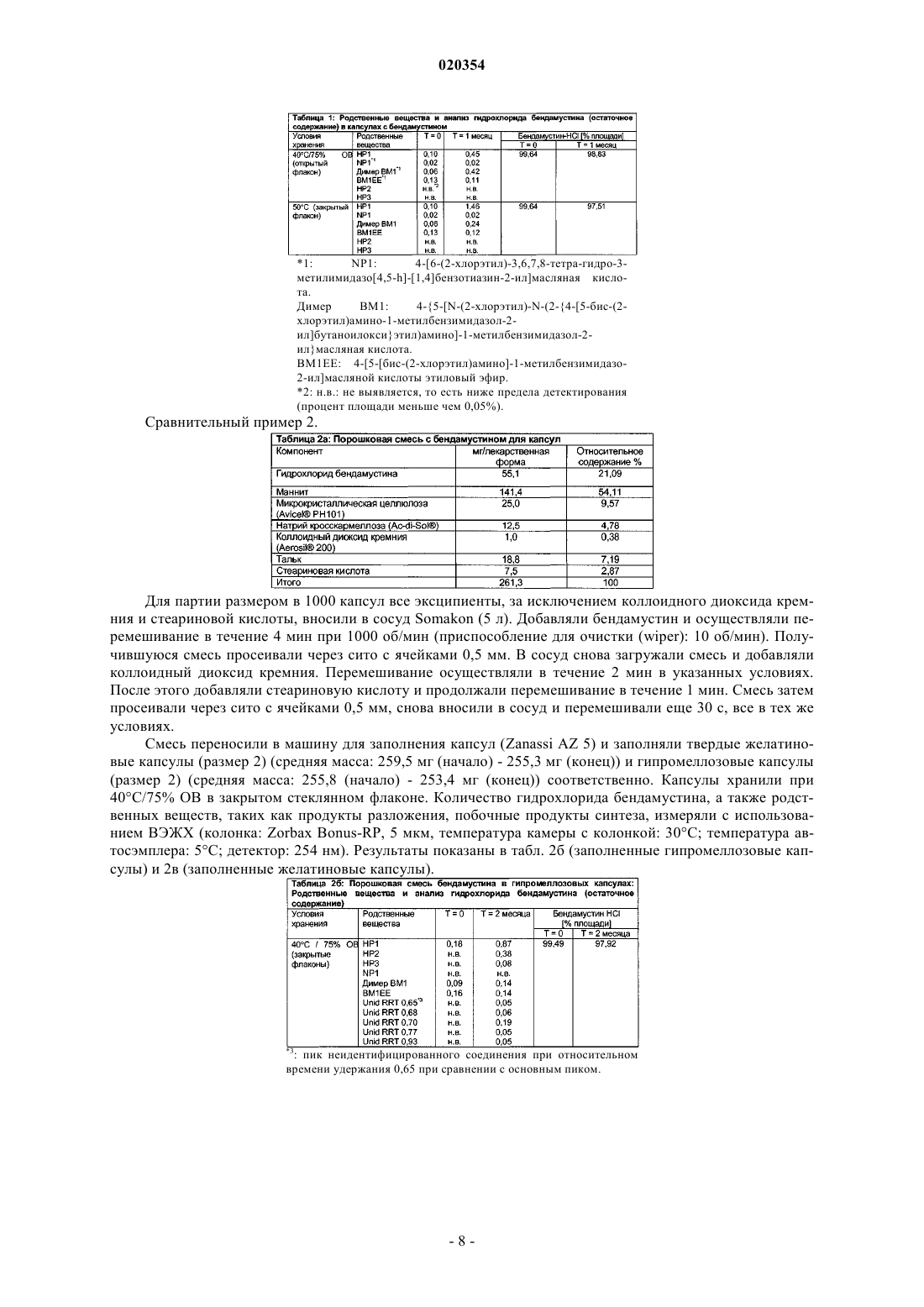
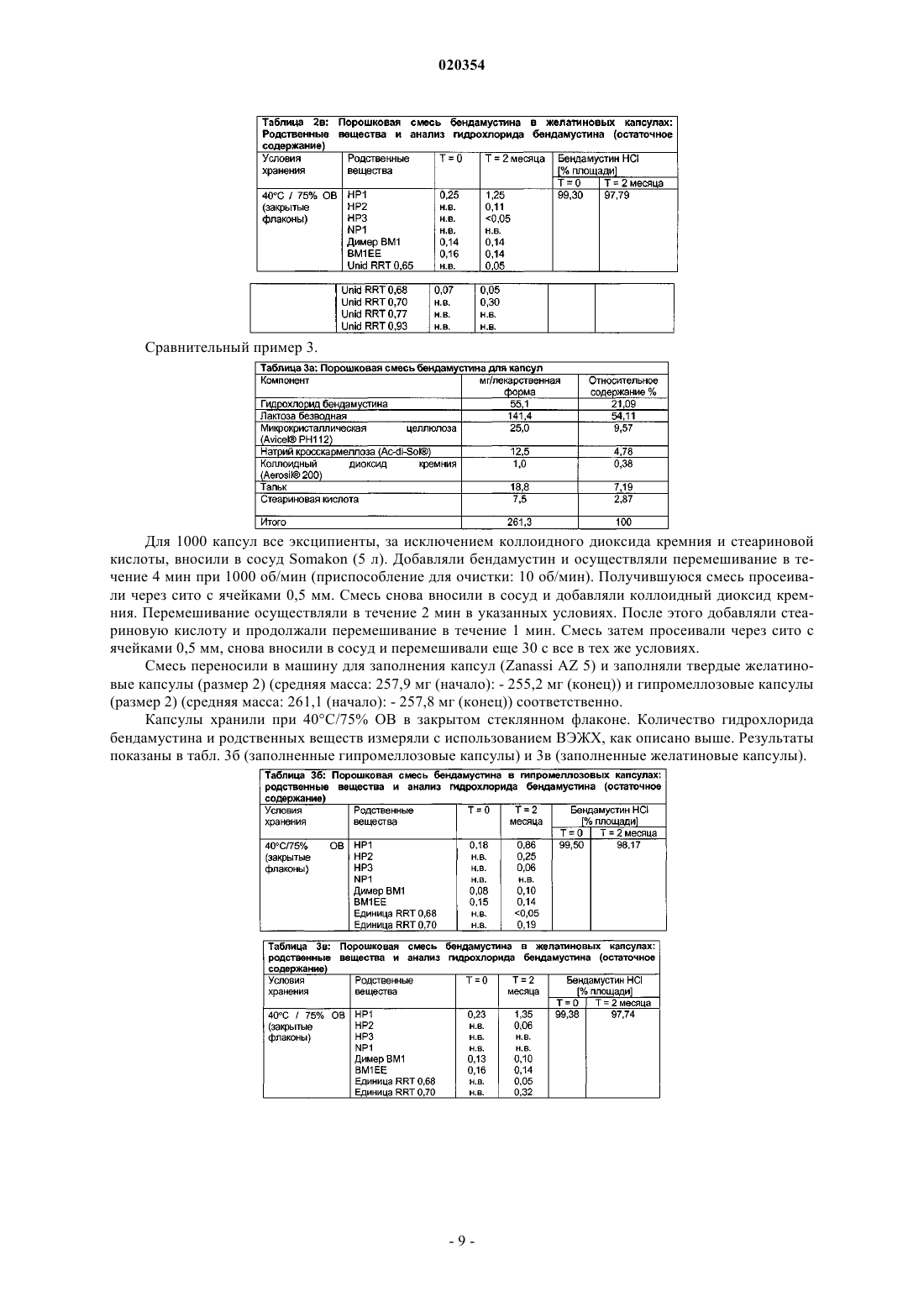
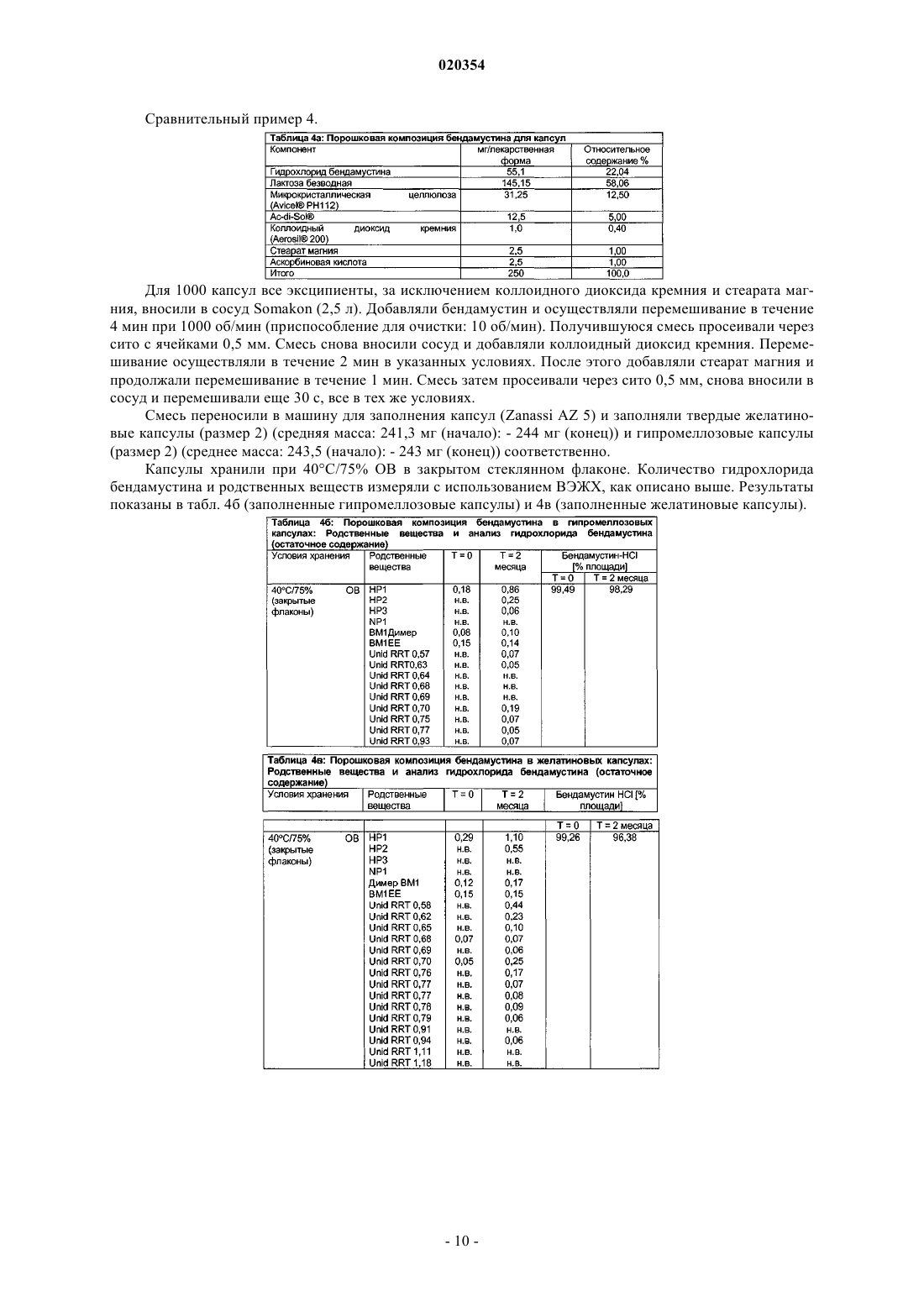
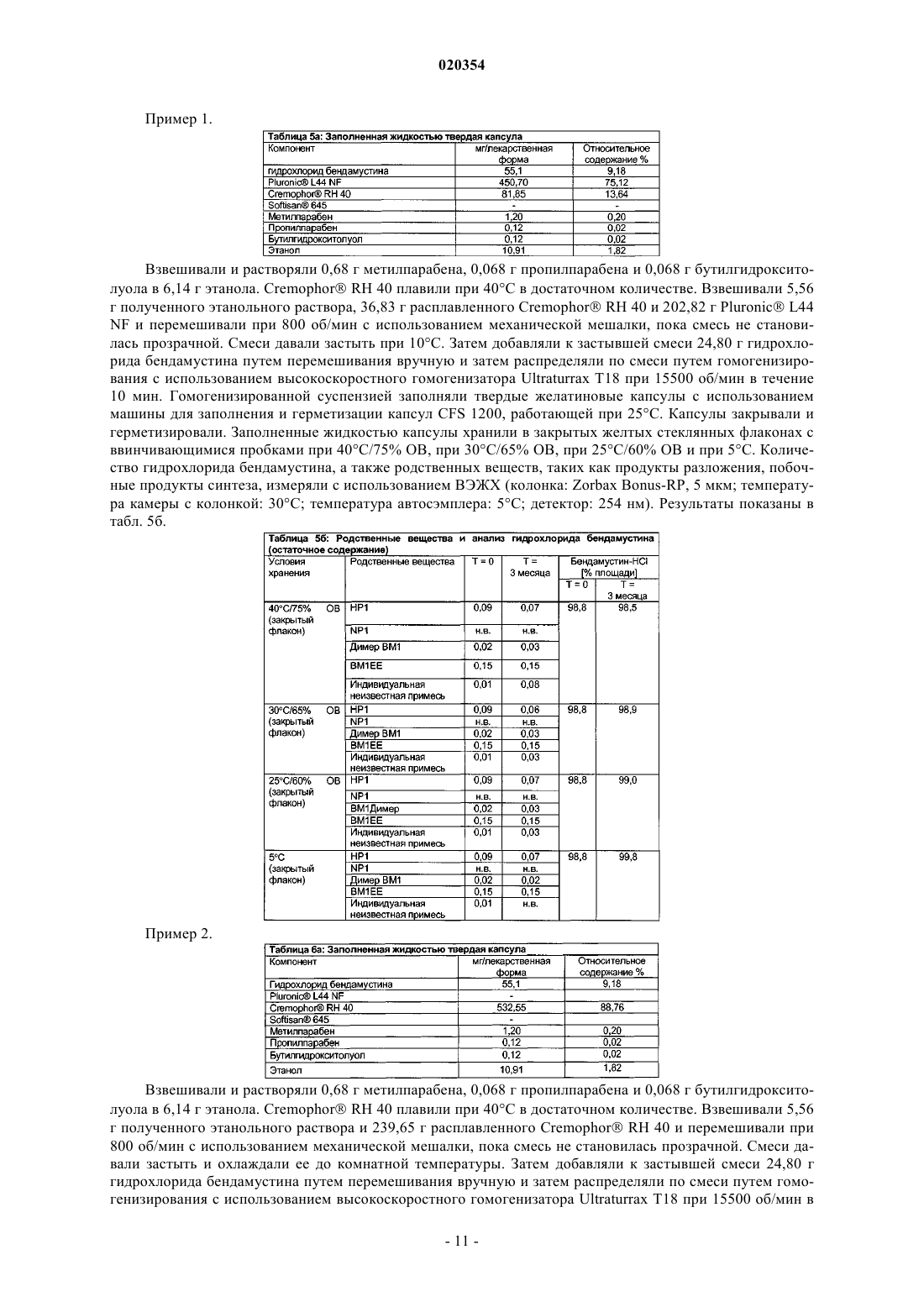
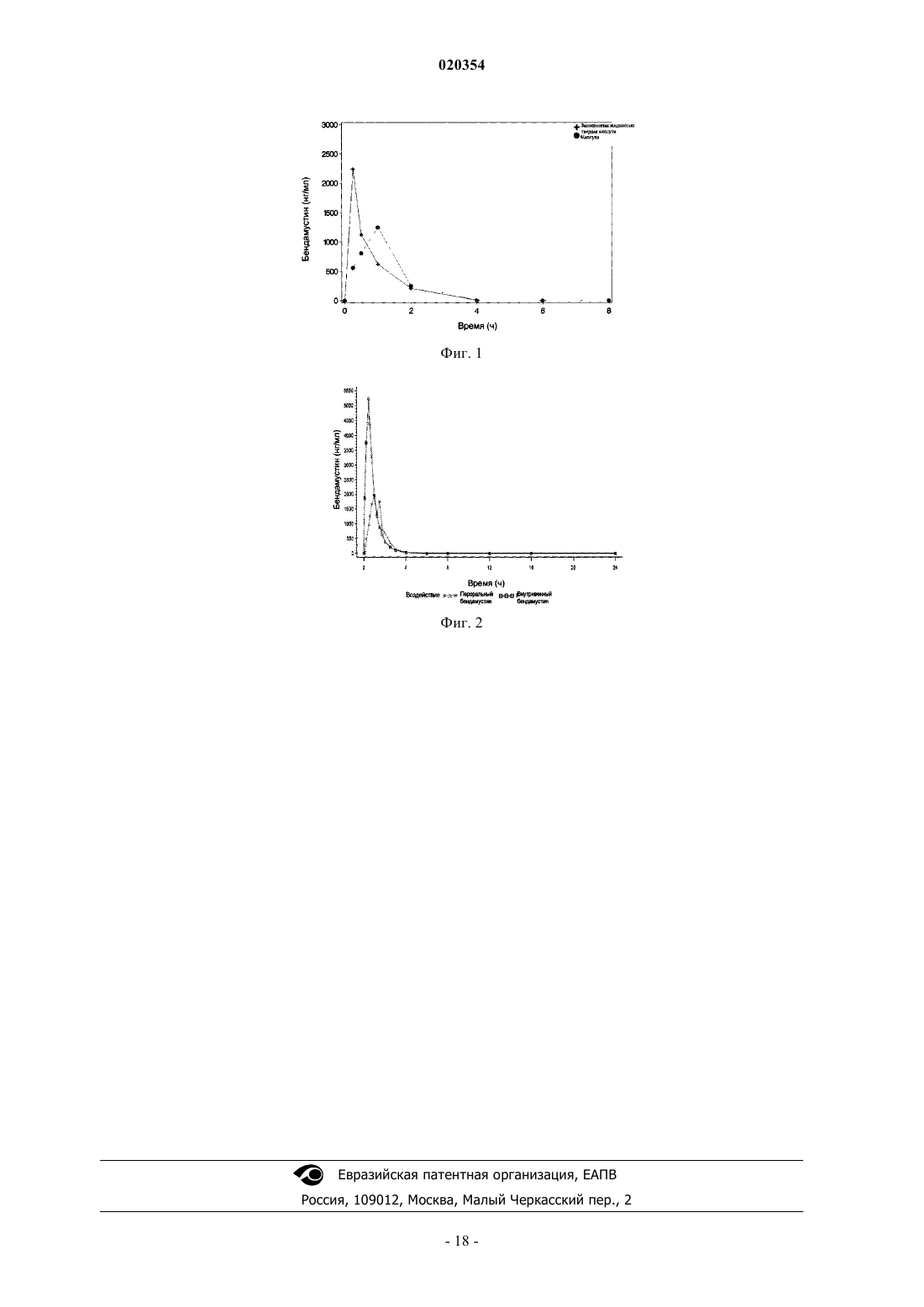
ПЕРОРАЛЬНЫЕ ЛЕКАРСТВЕННЫЕ ФОРМЫ БЕНДАМУСТИНА В изобретении предложена пероральная фармацевтическая композиция, содержащая бендамустин или его фармацевтически приемлемые сложный эфир, соль или сольват в качестве активного ингредиента и фармацевтически приемлемый эксципиент, который представляет собой фармацевтически приемлемое неионное поверхностно-активное вещество, выбранное из группы,состоящей из полиэтоксилированного касторового масла или его производного и блок-сополимера этиленоксида и пропиленоксида.(71)(73) Заявитель и патентовладелец: АСТЕЛЛАС ДОЙЧЛАНД ГМБХ (DE) Настоящее изобретение относится к пероральным лекарственным формам, содержащим бендамустин или его фармацевтически приемлемые сложный эфир, соль или сольват. Предшествующий уровень техники Бендамустин (4-[5-[бис-(2-хлорэтил)амино]-1-метилбензимидазо-2-ил]бутановая кислота, азотистый иприт) представляет собой алкилирующий агент с бифункциональной алкилирующей активностью. Он соответствует следующей формуле I: Бендамустин, по-видимому, не обладает какой-либо перекрестной резистентностью с другими алкилирующими агентами, что обеспечивает преимущества с точки зрения химиотерапии для пациентов,уже получавших ранее лечение алкилирующим агентом. Изначально бендамустин был синтезирован в Германской Демократической Республике (ГДР). Соль гидрохлорид бендамустина представляла собой активный ингредиент в коммерческом продукте,имевшемся на рынке с 1971 по 1992 гг. под торговым наименованием Cytostasan. С тех пор он продается в Германии под торговым наименованием Ribomustin и широко применяется для лечения хронического лимфолейкоза, неходжкинской лимфомы и множественной миеломы. Имеющийся в продаже продукт содержит лиофилизированный порошок гидрохлорида бендамустина, который разводят водой для инъекций, получая концентрат. Затем его разбавляют водным 0,9%-ным раствором хлорида натрия, получая конечный раствор для инфузии. Этот конечный раствор вводят пациенту путем внутривенной (в/в) инфузии в течение периода времени примерно 30-60 мин. Гидролиз бис-2-хлорэтиламиногруппы бендамустина в воде приводит к снижению активности и к образованию примесей (В. Maas и соавт. (1994) в Pharmazie 49: 775-777). Поэтому введение, обычно в стационаре или, по меньшей мере, под медицинским наблюдением, должно производиться незамедлительно после разведения лиофилизированного порошка. Кроме того, разведение представляет собой трудный процесс. На это может потребоваться более 30 мин. Вдобавок разведение является процессом обременительным и занимает много времени у работников здравоохранения, отвечающих за разведение продукта способом, состоящим из двух стадий.Preiss et al. (1985) в Pharmazie 40: 782-784 сравнивали фармакокинетику гидрохлорида бендамустина в плазме у 7 пациентов после внутривенного и перорального введения соответственно в дозе, меняющейся в диапазоне 4,2-5,5 мг/кг. Внутривенную инфузию на основе имеющегося в продаже продуктаCytostasan проводили в течение 3 мин, тогда как пероральное лекарственное средство в эквивалентной дозе давали в форме капсул, содержащих 25 мг гидрохлорида бендамустина. Количество капсул, принимаемых пациентом, варьировало от 10 до 14. После перорального введения максимальные уровни в плазме крови определяли в течение 1 ч. Рассчитанная средняя пероральная биодоступность составила 57% с изменением в диапазоне от 25 до 94%, что указывает на большую индивидуальную изменчивость.Weber (1991) (Pharmazie 46(8): 589-591) исследовал биодоступность гидрохлорида бендамустина наB6D2F1-мышах и обнаружил, что всасывание лекарственного средства из желудочно-кишечного тракта не является полным и приводит к биодоступности, составляющей только примерно 40%. В US 2006/0128777 А 1 в общем виде описаны способы лечения видов рака, характеризующихся клетками с резистентностью к гибели, и бендамустинсодержащие композиции. Среди этих композиций имеются пероральные твердые лекарственные формы, представляющие собой капсулы, таблетки, пилюли, порошки или гранулы, где активное соединение может находиться в смеси по меньшей мере с одним инертным эксципиентом, таким как сахароза, лактоза или крахмал. Однако примеры конкретных композиций не приведены. Гидрохлорид бендамустина лишь слаборастворим в воде при рН 2,0 и слегка или слаборастворим в ряде органических растворителей. Однако хорошую растворимость наблюдали в этаноле и метаноле. Поэтому неудивительно, что пероральные композиции бендамустина, как это исследовали Preiss et al. иWeber, приводили к относительно плохой биологической доступности и большой вариабельности между индивидами. Ввиду наличия проблем, связанных со стабильностью имеющегося в продаже в/в препарата после разведения его водой, и с целью улучшения соблюдения больным режима и схемы лечения давно существует необходимость в стабильной лекарственной форме, содержащей бендамустин, которую легко ввести пациенту и которая обеспечивает хорошую биодоступность с незначительной изменчивостью у разных индивидуумов и у одного индивидуума. Краткое описание изобретения С целью решения вышеупомянутых проблем авторы настоящего изобретения проводили тщательные исследования. В конечном итоге им удалось получить стабильные фармацевтические композиции по изобретению. Эти композиции подходят для перорального введения и содержат бендамустин или его фармацевтически приемлемые сложный эфир, соль или сольват в качестве активного ингредиента и по меньшей мере один фармацевтически приемлемый эксципиент, при этом данные композиции, кроме хорошей стабильности, имеют улучшенный профиль растворения. Краткое описание графических материалов На фиг. 1 представлена кривая зависимости средней концентрации в плазме крови от времени, полученная после введения собакам гидрохлорида бендамустина в форме капсул, известных из уровня техники (пример сравнения 1), и препарата, представляющего собой наполненную жидкостью твердую капсулу, по примеру 2. На фиг. 1 видно, что препарат, представляющий собой заполненную жидкостью твердую капсулу, дает более высокую максимальную концентрацию бендамустина по сравнению с известным препаратом сравнения в виде капсулы. На фиг. 2 представлен средний профиль в плазме крови в зависимости от времени, полученный после введения гидрохлорида бендамустина в форме внутривенного препарата, который продается в Германии под товарным знаком Ribomustin, и препарата, представляющего собой заполненную жидкостью твердую капсулу по примеру 2, у пациентов с раковым заболеванием. Подробное описание изобретения Настоящее изобретение относится к фармацевтической композиции для перорального введения, содержащей бендамустин или его фармацевтически приемлемые сложный эфир, соль или сольват в качестве активного ингредиента и фармацевтически приемлемый эксципиент, который представляет собой неионное поверхностно-активное вещество, выбранное из группы, состоящей из полиэтоксилированного касторового масла или его производного и блок-сополимера этиленоксида и пропиленоксида. В одном из воплощений настоящее изобретение относится к фармацевтической композиции, содержащей бендамустин или его фармацевтически приемлемые сложный эфир, соль или сольват и фармацевтически приемлемый эксципиент, который представляет собой неионное поверхностно-активное вещество, выбранное из группы, состоящей из полиэтоксилированного касторового масло или его производного и блок-сополимера этиленоксида и пропиленоксида, где композиция является подходящей для перорального введения тем, что включена в твердую желатиновую капсулу. Дополнительное воплощение представляет собой фармацевтическую композицию для перорального введения в твердой лекарственной форме, представляющей собой твердую желатиновую капсулу, где композиция содержит бендамустин или его фармацевтически приемлемые сложный эфир, соль или сольват и фармацевтически приемлемый эксципиент, выбранный из группы, состоящей из полиэтоксилированного касторового масла или его производного и блок-сополимера этиленоксида и пропиленоксида, и предпочтительно выбранный из группы, состоящей из макрогол глицерилгидроксистеарата, полиоксил 35-касторового масла и блок-сополимера этиленоксид/пропиленоксид (Pluronic L44 NF или Poloxamer 124), причем применение этого конкретного неионного поверхностно-активного вещества приводит к такому профилю растворения, при котором по меньшей мере 60% бендамустина растворяется через 20 мин, 70% растворяется через 40 мин и 80% растворяется через 60 мин при измерении с использованием лопастного аппарата при 50 об/мин в соответствии с Европейской Фармакопеей в 500 мл среды растворения при рН 1,5, и предпочтительно это приводит к растворению по меньшей мере 60% бендамустина через 10 мин, 70% через 20 мин и 80% через 30 мин. Предпочтительное воплощение представляет собой фармацевтическую композицию для перорального введения в твердой лекарственной форме, представляющей собой твердую желатиновую капсулу,причем эта композиция содержит гидрохлорид бендамустина и фармацевтически приемлемый эксципиент, который представляет собой макрогол глицерилгидроксистеарат, где применение этого конкретного неионного поверхностно-активного вещества приводит к растворению по меньшей мере 60% бендамустина через 10 мин, 70% через 20 мин и 80% через 30 мин при измерении с использованием лопастного аппарата при 50 об/мин в соответствии с Европейской Фармакопеей в 500 мл среды растворения при рН 1,5. Настоящее изобретение основано на том неожиданном открытии, что стабильную композицию бендамустина, имеющую конкретный и желательный профиль растворения, можно получать путем включения в композицию определенных неионных поверхностно-активных веществ. Было обнаружено, что если фармацевтически приемлемое неионное поверхностно-активное вещество, выбранное из группы, состоящей из полиэтоксилированного касторового масла или его производного и блок-сополимера этиленоксида и пропиленоксида, и предпочтительно выбранное из группы, состоящей из макрогола глицерилгидроксистеарата, полиоксил-35-касторового масла и блок-сополимера этиленоксид/пропиленоксид (Pluronic L44 NF или Poloxamer 124), используют в качестве эксципиента в фармацевтической композиции, содержащей бендамустин или его фармацевтически приемлемые сложный эфир, соль или сольват в качестве активного ингредиента, то достигают особенно благоприятного профиля композиции в отношении стабильности и продуктов разложения, растворения, биологической доступности и снижения вариабельности по биологической доступности. Введение указанных неионных поверхностно-активных веществ в бендамустинсодержащие композиции приводит к профилю растворения, при котором по меньшей мере 60% бендамустина растворяется через 20 мин, 70% растворяется через 40 мин и 80% растворя-2 020354 ется через 60 мин при измерении с использованием лопастного аппарата при 50 об/мин в соответствии с Европейской Фармакопеей в 500 мл среды растворения при рН 1,5, и предпочтительно это приводит к растворению по меньшей мере 60% бендамустина через 10 мин, 70% через 20 мин и 80% через 30 мин. Ниже приведены дополнительные подробности этого изобретения. Выражение "его фармацевтически приемлемый сложный эфир" описывает любой фармацевтически приемлемый сложный эфир бендамустина, такой как сложные эфиры с алкиловыми спиртами и сахарными спиртами. Примерами алкиловых спиртов являются C1-6-алкиловые спирты, такие как метанол,этанол, пропанол, изопропанол, бутанол и трет-бутанол. Примерами сахарных спиртов являются маннит,мальтит, сорбит, эритрит, гликоль, глицерин, арабит, ксилит и лактит. Предпочтительными примерами сложных эфиров бендамустина являются этиловый эфир, изопропиловый эфир, эфир с маннитом и эфир с сорбитом, наиболее предпочтительным является его этиловый сложный эфир. Выражение "его фармацевтически приемлемая соль" описывает любую фармацевтически приемлемую соль бендамустина, которая при введении пациенту (прямо или опосредованно) позволяет получить бендамустин. Этот термин дополнительно включает фармацевтически приемлемую соль сложного эфира бендамустина. Тем не менее, следует считать, что фармацевтически неприемлемые соли также включены в объем этого изобретения, поскольку эти соединения могут быть полезными в получение фармацевтически приемлемых солей. Например, фармацевтически приемлемые соли бендамустина синтезируют из соответствующих соединений, которые содержат кислотную или основную группу, общепринятыми химическими способами. Обычно эти соли получают, например, взаимодействием свободных кислотных или основных форм этих соединений в стехиометрическом количестве с соответствующим основанием или кислотой в воде или органическом растворителе или их смеси. Неводные среды, такие как эфир, этилацетат, изопропанол или ацетонитрил, обычно являются предпочтительными. Примеры кислот, которые можно использовать для получения фармацевтически приемлемой соли бендамустина, включают неорганические кислоты, такие как хлористо-водородная, бромисто-водородная, йодисто-водородная, серная,азотная и фосфорная кислоты, и органические кислоты, такие как уксусная, малеиновая, фумаровая, лимонная, щавелевая, янтарная, винная, яблочная, молочная, метилсульфоновая и паратолуолсульфоновая кислоты. Фармацевтически приемлемые соли бендамустина можно получать либо из неорганических либо из органических оснований с получением солей аммония, солей щелочных металлов (лития, натрия,калия и т.д.), солей щелочно-земельных металлов, таких как кальций или магний, солей алюминия, солей низших алкиламинов, таких как соли метиламина или этиламина, солей низших алкилдиаминов, таких как соли этилендиамина, этаноламина, N,N-диалкиленэтаноламина, триэтаноламина, и солей глюкаминов, а также основных солей аминокислот. Особенно предпочтительными являются кислые соли, получаемые из хлористо-водородной, бромисто-водородной и йодисто-водородной кислот, причем соль гидрохлорид представляет собой наиболее предпочтительную фармацевтически приемлемую соль бендамустина. Фармацевтически приемлемые соли получают общепринятыми методиками, хорошо известными в данной области. Выражение "его фармацевтически приемлемый сольват" описывает любой фармацевтически приемлемый сольват, который при введении пациенту (прямо или опосредованно) позволяет получить бендамустин. Этот термин дополнительно включает в себя фармацевтически приемлемый сольват сложного эфира бендамустина. Предпочтительно сольват представляет собой гидрат, сольват со спиртом, таким как метанол, этанол, пропанол или изопропанол, сольват со сложным эфиром, таким как этилацетат,сольват с простым эфиром, таким как метиловый эфир, этиловый эфир или THF (тетрагидрофуран), или сольват с DMF (диметилформамид), из которых гидрат или сольват со спиртом, таким как этанол, является более предпочтительным. Растворитель для образования сольвата предпочтительно является фармацевтически приемлемым растворителем. Особенно предпочтительно активный ингредиент в композициях по этому изобретению представляет собой бендамустин или его фармацевтически приемлемую соль. Наиболее предпочтительно активный ингредиент представляет собой гидрохлорид бендамустина. Дозу активного ингредиента в фармацевтической композиции может легко определить специалист в зависимости от состояния, пола, массы тела, поверхности тела или возраста пациента, особенно в зависимости от массы и поверхности тела пациента. Предпочтительно суточная дозировка находится в диапазоне от примерно 50 до примерно 1000 мг, предпочтительно от примерно 100 до примерно 500 мг активного ингредиента. Суточную дозировку можно принимать в виде разовой дозы или в виде множественных доз, таких как двукратные или трехкратные суточные дозы, наиболее предпочтительно в виде разовой суточной дозы. Суточную дозу можно принимать один раз в неделю или несколько раз в неделю. Лекарственная форма может содержать количество разовой суточной дозы или его части. Предпочтительно лекарственная форма по настоящему изобретению содержит от примерно 10 до примерно 1000 мг, предпочтительно от примерно 25 до примерно 600 мг, более предпочтительно от примерно 50 до примерно 200 мг и наиболее предпочтительно примерно 100 мг активного ингредиента. При использовании здесь термин "неионное поверхностно-активное вещество" относится к амфифильному соединению, имеющему полярную гидрофильную группу и неполярную липофильную группу или цепь, причем гидрофильные и липофильные свойства соединения характеризуются величиной так называемого гидрофильно-липофильного баланса (HLB). Неионное поверхностно-активное вещество для использования в изготовлении композиций по настоящему изобретению предпочтительно имеет величину HLB между 10 и 20 и предпочтительно между 12 и 18. Неионное поверхностно-активное вещество дополнительно имеет точку плавления, точку текучести или диапазон плавления между 5C и температурой тела (37C) и предпочтительно между значением чуть ниже комнатной температуры (20C) и температурой тела. Вещество при комнатной температуре может быть в жидком или полутвердом состоянии. Амфифильное вещество является носителем для бендамустинового активного ингредиента, который может присутствовать в растворенной форме, суспендированной форме или частично растворенной и частично суспендированной форме. Неионные поверхностно-активные вещества, которые преимущественно используют для получения композиций в соответствии с настоящим изобретением, выбраны из группы, состоящей из полиэтоксилированного касторового масло или его производного и блок-сополимера этиленоксида/пропиленоксида,при условии, что эти вещества имеют указанную величину HLB и точку плавления, точку текучести или диапазон плавления. В одном из воплощений неионное поверхностно-активное вещество представляет собой полиэтоксилированное касторовое масло. Один пример полиэтоксилированного касторового масла имеется в продаже под товарным знаком Cremophor. Продукты Cremophor производятся с различными уровнями очистки и вязкости, и их можно использовать в настоящем изобретении. В частности, можно использовать макрогол глицерилгидроксистеарат (Cremophor RH 40) и полиоксил-35 касторового масла (Cremophor EL или Cremophor ELP). Cremophor ELP и Cremophor EL, известные как неионные солюбилизаторы и эмульгаторы, получают взаимодействием касторового масла с этиленоксидом в молярном соотношении 1 к 35. Они имеют величину HLB 12-14 и точку плавления 26C. В зависимости от температуры окружающей среды эти продукты можно охарактеризовать либо как полутвердые, либо как жидкости со средней вязкостью. Макрогол глицерилгидроксистеарат (имеющийся в продаже как Cremophor RH 40) представляет собой при 25C полутвердое вещество, имеющее при той же температуре диапазон вязкости 20-40 сП (в виде 30%-ного водного раствора). Он известен как неионный солюбилизатор и эмульгатор. Его получают взаимодействием касторового масла с этиленоксидом в молярном соотношении от 1 до 45. Его величина HLB находится в диапазоне 14-16, и его диапазон плавления представляет собой 20-28C. В экспериментах было показано, что макрогол глицерилгидроксистеарат может предпочтительно быть использован сам по себе для изготовления композиции в соответствии с настоящим изобретением. Блок-сополимеры Pluronic состоят из блоков этиленоксида и пропиленоксида. Этиленоксидные компоненты имеют гидрофильный характер, тогда как пропиленоксидные компоненты имеют липофильный характер. Изменение количества гидрофильных этиленоксидных компонентов и липофильных пропиленоксидных компонентов приводят к сополимерам с разной молекулярной массой и разным гидрофильно-липофильным балансом (HLB). Примеры блочных сополимеров пропиленоксида ("РЕО")полипропиленоксида ("РРО"), отвечающие требованиям к величине HLB и точке плавления или точке текучести либо диапазону плавления для получения композиций в соответствии с настоящим изобретением, включают в себя имеющиеся в продаже типы Pluronic L35, Pluronic L44, Pluronic L64, Pluronic P85 и Pluronic P105. Pluronic L44 или Poloxamer 124, но не Pluronic 68, или Poloxamer 188 и Pluronic 127, или Poloxamer 407. Pluronic L44 является предпочтительным неионным поверхностно-активным веществом. За исключением макрогола глицерилгидроксистеарата, все указанные выше неионные поверхностно-активные вещества являются жидкостями, имеющими величину вязкости, которая может быть слишком низкой для того, чтобы избежать осаждения гидрохлорида бендамустина. Дополнительная проблема,подлежащая решению, состояла в том, чтобы найти эксципиент или комбинацию эксципиентов для обеспечения суммарной величины вязкости смеси, которая должна быть достаточно высокой, чтобы избежать отделения хлорида бендамустина при его добавлении к смеси. Поэтому композиции в соответствии с настоящим изобретением, которые содержат жидкое неионное поверхностно-активное вещество, предпочтительно дополнительно содержат агент улучшения вязкости. Подходящие агенты улучшения вязкости включают порошок, такой как коллоидный диоксид кремния (имеющийся в продаже под торговой маркой Aerosil) или полутвердое восковое вещество,такое как лауроилмакрогол глицериды (имеющиеся в продаже под торговой маркой Gelucire 44/14). Количество порошка или полутвердого вещества для добавления к жидкому неионному поверхностноактивному веществу зависит от вязкости жидкого неионного поверхностно-активного вещества. Разные концентрации были проверены для того, чтобы найти минимальное подходящее количество агента улучшения вязкости, которое нужно добавить, чтобы избежать видимого осаждения активного ингредиента. Типичные относительные концентрации коллоидного диоксида кремния для добавления находятся в диапазоне от примерно 1 до примерно 8%, но предпочтительно не превышают 1,7 или 2,0%, чтобы не оказывать отрицательного влияния на характеристики растворения активного ингредиента. Типичные относительные концентрации лауроилмакрогола глицеридов находятся в диапазоне от 5 до 50% и пред-4 020354 почтительно представляют собой примерно 10 и примерно 45%. Предпочтительные композиции в соответствии с настоящим изобретением раскрыты в примере 4 и содержат гидрохлорид бендамустина в комбинации со следующим: макрогол глицерилгидроксистеарат; блок-сополимер этиленоксид/пропиленоксид (Pluronic L44 NF или Poloxamer 124), возможно в комбинации с коллоидным диоксидом кремния или лауроилмакрогола глицеридами (Gelucire 44/14); и полиоксил-35-касторовое масло, возможно в комбинации с лауроилмакрогола глицеридами (Gelucire 44/14). Дополнительно, композиции по настоящему изобретению включают дополнительные эксципиенты,в частности защитные агенты, такие как антиоксиданты и антимикробные консерванты, например метил-, этил- и пропилпарабен, как проиллюстрировано в примерах 1-3. Антиоксидантом может быть dальфа-токоферола ацетат, dl-альфа-токоферол, аскорбилпальмитат, бутилированный гидроксианидол,аскорбиновая кислота, бутилированный гидроксианизол, бутилированный гидроксихинон, бутилгидроксианизол, гидроксикумарин, бутилированный гидрокситолуол, этилгаллат, пропилгаллат, октилгаллат,лаурилгаллат или их смеси. Антиоксидант предпочтительно добавляют к композиции, содержащей макрогол глицерилгидроксистеарат или полиоксил-35-касторовое масло. Фармацевтические композиции в соответствии с настоящим изобретением предпочтительно помещают в капсулу, которую затем может легко принять пациент. Обычно используют два типа капсул и классифицируют их в соответствии с природой и гибкостью оболочки капсулы: мягкие и твердые капсулы. Мягкие капсулы представляют собой единичные твердые лекарственные формы, содержащие наполнитель, представляющий собой жидкость или полутвердое вещество. Их формируют, заполняют и герметизируют в одной операции с использованием ротационно-штамповочного способа. Их используют в качестве единичных дозовых контейнеров для жидкостей в течение многих лет, тогда как твердые капсулы обычно используют для доставки твердых веществ в форме порошков, гранулятов и пилюль. Твердые капсулы представляют собой единичные стандартные лекарственные формы, состоящие из крышки и тела, которые изготавливаются отдельно и поставляются пустыми для заполнения. Мягкие капсулы наиболее часто изготовлены из желатина, к которому добавляют пластификатор,обычно глицерин или сорбит, в дополнение к воде. Для твердых капсул наиболее обычно используемым полимером также является желатин. Дополнительным компонентом является вода, которая действует в качестве пластификатора. Однако этот компонент может быть причиной деградации активных ингредиентов, таких как гидрохлорид бендамустина. Поэтому в качестве альтернативы твердые капсулы можно изготавливать из гидроксипропилметилцеллюлозы. Как мягкие, так и твердые капсулы дополнительно включают красители и агенты, придающие матовость. Предпочтительным типом капсулы для композиции в соответствии с настоящим изобретением является твердая капсула и особенно твердая желатиновая капсула. В идеале, вещество для заполнения капсулы является жидким при комнатной температуре, что поможет избежать нагревания во время операции заполнения. Обычно нагревание приводит к быстрому разложению активного компонента. В принципе, для заполнения твердых капсул доступны многочисленные эксципиенты, но, кроме биофармацевтических соображений, также важно учитывать химическую и физическую стабильность готовых лекарственных форм, а также профиль растворения для получения безопасной, эффективной и стабильной лекарственной формы. В общем, композиции для заполнения твердых капсул могут представлять собой ньютоновские жидкости, такие как масла, тиксотропные или разжижающиеся при сдвиге гели или полутвердые матричные продукты, которыми заполняют при повышенных температурах и в которых активный ингредиент либо растворен, либо суспендирован в виде тонкой дисперсии. В принципе, можно использовать любой эксципиент или смесь эксципиентов при условии, что вязкость заполняющего материала соответствует требованиям способа заполнения. Важной является равномерность массы композиции для заполнения капсулы. Далее, композиции для заполнения не должны демонстрировать сцепления и должны обеспечивать чистое отделение от дозирующего сопла. Неожиданно обнаружено, что композиции в соответствии с настоящим изобретением можно преимущественно вводить в виде твердых желатиновых капсул. Конкретные неионные поверхностноактивные вещества, выбранные из группы, состоящей из полиэтоксилированного касторового масла или его производных и блок-сополимера этиленоксида/пропиленоксида и, в частности, из группы, состоящей из макрогол глицерилгидроксистеарата, полиоксил-35-касторового масла и Pluronic L44 или Poloxamer 124, если вводить в них бендамустин или его фармацевтически приемлемые сложный эфир, соль или сольват, после включения в твердые желатиновые капсулы приводят к достижению хорошей стабильности, хорошего профиля растворения и хорошей биологической доступности. Напротив, если макрогол глицерилгидроксистеарат используют в комбинации с жидкостью, такой как бисдиглицерилполиацил-адипат-1 (имеющийся в продаже как Softisan 645) и блок-сополимер этиленокси-5 020354 да/пропиленоксида (имеющийся в продаже под названиями Pluronic L44 NF или Poloxamer 124), профиль растворения бендамустина является ухудшенным по сравнению с композицией, содержащей только макрогол глицерилгидроксистеарат. Дополнительно следует отметить, что Cremophor A25 (цетеарет-25 или макрогол-(25)-цетостеариловый эфир) и Cremophor A6 (цетеарет-6 и стеариловый спирт или макрогол-(6)-цетостеариловый эфир) нельзя использовать в качестве неионного поверхностно-активного вещества. Также было показано, что другие обычно используемые эксципиенты для получения препаратов, представляющих собой заполненную жидкостью капсулу, не дают удовлетворительных результатов. На стабильность водного раствора бендамустина сильно влияет pH. Значительное гидролитическое разложение этого соединения наблюдают при величинах pH выше чем примерно 5. При pH выше 5 разложение происходит быстро, и в этом диапазоне pH результирующее содержание побочных продуктов является высоким. Основными продуктами гидролиза являются 4-[5-[(2-хлорэтил)-(2-гидроксиэтил)амино]-1-метилбензимидазо-2-ил]масляная кислота (НР 1), 4-[5-[бис-(2-гидроксиэтил)амино]-1 метилбензимидазо-2-ил]масляная кислота (НР 2) и 4-(5-морфолино-1-метилбензимидазол-2-ил)масляная кислота (НР 3) Абсорбция перорально вводимого лекарственного средства обычно происходит из желудка, тонкого кишечника и/или толстого кишечника. Значение pH в желудке составляет примерно от 1 до 3,5, в тонком кишечнике примерно от 6,5 до 7,6 и в толстом кишечнике примерно от 7,5 до 8,0. Соответственно для соединения, подобного бендамустину, который подвергается разложению в водных средах при pH выше 5, весьма предпочтительным является то, что он абсорбируется в желудке и не доходит до тонкого или даже толстого кишечника, с тем, чтобы избежать разложения. Следовательно, имеется необходимость в фармацевтической композиции, из которой бендамустин абсорбируется полностью или, по меньшей мере, в высокой степени в желудке, что позволяет избежать разложения или снизить разложение бендамустина в тонком или толстом кишечнике. Неожиданно было обнаружено, что эту проблему можно решить путем использования настоящих фармацевтических композиций. Эти композиции, содержащие гидрохлорид бендамустина в фармацевтически приемлемом эксципиенте, который представляет собой неионное поверхностно-активное вещество, выбранное из группы, состоящей из полиэтоксилированного касторового масла или его производного и блок-сополимера этиленоксида и пропиленоксида, неожиданно демонстрируют быстрое растворение, в частности растворение бендамустина, составляющее по меньшей мере 60% за 20 мин, 70% за 40 мин и 80% за 60 мин и предпочтительно по меньшей мере 60% за 10 мин, 70% за 20 мин и 80% за 30 мин при измерении с использованием лопастного аппарата при 50 об/мин в соответствии с Европейской Фармакопеей в искусственной желудочной жидкости. Искусственная желудочная жидкость с использованием здесь относится к раствору, полученному растворением 2 г хлорида натрия в 1000 мл воды и затем доведением pH до 1,50,05 5 н. соляной кислотой. Дополнительно было показано, что они стабильны в условиях ускоренного тестирования стабильности. Это является неожиданным, поскольку было показано, что в сравнительной композиции в препаратах в виде капсул (см. сравнительный пример 1), содержащей гидрохлорид бендамустина только в твердой желатиновой капсуле, при хранении при 40C/75% относительной влажности (ОВ) (стеклянный флакон открыт) и 50C, продукты разложения образовывались в пределах одного месяца хранения. В случае открытых флаконов при 40C/75% ОВ количество продукта гидролиза НР 1 увеличивалось в 4 раза через один месяц хранения. В закрытых флаконах содержание НР 1 было даже выше; в препаратах в виде капсул по сравнительным примерам 2-4 при хранении при 40C/75% ОВ (закрытый стеклянный флакон) продукты разложения образовывались в пределах одного месяца хранения и увеличивались при дальнейшем хранении. Суммарное время прохождения лекарственного средства через желудок к тонкому кишечнику составляет от примерно 20 мин до 5 ч, обычно от примерно 30 мин до 3 ч. Таким образом, фармацевтические композиции в соответствии с этим изобретение предпочтительно должны снижать разложение бендамустина в организме пациента, поскольку бендамустин высвобождается и растворяется главным обра-6 020354 зом, пока находится в желудке. Таким образом, можно ожидать даже улучшенной биологической доступности содержащих бендамустин композиций в соответствии с этим изобретением. В дополнительном аспекте этого изобретения пероральные фармацевтические композиции можно использовать для леченияили предупреждения рецидива медицинского состояния у человека или животного, предпочтительно человека, причем это медицинское состояние выбрано из хронического лимфолейкоза (сокращенно CLL), острого лимфолейкоза (сокращенно ALL), хронического миелоидного лейкоза (сокращенно CML), острого миелоидного лейкоза (сокращенно AML), болезни Ходжкина, неходжкинской лимфомы (сокращенно NHL), множественной миеломы, рака молочной железы, рака яичника, мелкоклеточного рака легкого, немелкоклеточного рака легкого и аутоиммунного заболевания. В настоящем изобретении также предложен способ лечения или предупреждения рецидива медицинского состояния, выбранного из хронического лимфолейкоза, острого лимфолейкоза, хронического миелоидного лейкоза, острого миелоидного лейкоза, болезни Ходжкина, неходжкинской лимфомы,множественной миеломы, рака молочной железы, рака яичника, мелкоклеточного рака легкого, немелкоклеточного рака легкого и аутоиммунного заболевания в организме человека или животного, включающий введение в организм человека или животного, нуждающегося в этом, эффективного количества фармацевтического препарата по этому изобретению. Медицинское состояние предпочтительно представляет собой неходжкинскую лимфому. В другом аспекте этого изобретения фармацевтическую композицию можно вводить в комбинации по меньшей мере с одним дополнительным активным агентом, причем указанный дополнительный активный агент вводят перед введением фармацевтической композиции, одновременно с ним или после него. Этот по меньшей мере один дополнительный активный агент предпочтительно представляет собой антитело, специфичное к CD20 (примерами являются ритуксимаб или офатумумаб), производное антрациклина (примерами являются доксорубицин или даунорубицин), алкалоид барвинка (примером является винкристин), производное платины (примерами являются цисплатин или карбоплатин), дапоринад(примером является бортезумиб). Фармацевтическую композицию по этому изобретению можно также вводить в комбинации по меньшей мере с одним кортикостероидом, причем указанный кортикостероид вводят перед введением фармацевтической композиции, одновременно с ним или после него. Примерами кортикостероидов являются преднизон, преднизолон и дексаметазон. Преимуществом композиций в соответствии с настоящим изобретением дополнительно является то,что активный(е) ингредиент(ы), возможно в смеси с одним или более чем одним эксципиентом, нет необходимости обеспечивать оболочкой для дополнительной маскировки вкуса таких ингредиентов и/или их защиты против возможных вредных эффектов света и/или влаги, таких как окисление, разложение,или для предотвращения повреждения слизистой оболочки рта субъекта по причине взаимодействия с активным ингредиентом. Следующие примеры дополнительно иллюстрируют это изобретение. Специалистам будет очевидно, что эти примеры даны исключительно в иллюстративных целях и не должны считаться ограничивающими это изобретение. Примеры 1. Композиции в виде капсулы. Сравнительный пример 1. Композиция бендамустина в виде капсулы (по предшествующему уровню техники). Взвешивали 20,01 мг гидрохлорида бендамустина в тело пустой твердой желатиновой капсулы и помещали в прозрачный стеклянный флакон для ВЭЖХ (6 мл) от Agilent. Капсулу закрывали, помещая крышку наверх тела и слегка надавливая на нее. Капсулы хранили при 40C/75% ОВ (стеклянный флакон открыт) или 50C (стеклянный флакон закрыт). Количество гидрохлорида бендамустина или родственных веществ измеряли с использованием ВЭЖХ (колонка: Zorbax Bonus-RP, 5 мкм; температура камеры с колонкой: 30C; температура автосэмплера: 5C; детектор: 254 нм). Результаты показаны в табл. 1NP1: 4-[6-(2-хлорэтил)-3,6,7,8-тетра-гидро-3 метилимидазо[4,5-h]-[1,4]бензотиазин-2-ил]масляная кислота. Димер ВМ 1: 4-5-[N-(2-хлорэтил)-N-(2-4-[5-бис-(2 хлорэтил)амино-1-метилбензимидазол-2 ил]бутаноилоксиэтил)амино]-1-метилбензимидазол-2 илмасляная кислота. ВМ 1 ЕЕ: 4-[5-[бис-(2-хлорэтил)амино]-1-метилбензимидазо 2-ил]масляной кислоты этиловый эфир. 2: н.в.: не выявляется, то есть ниже предела детектирования(процент площади меньше чем 0,05%). Для партии размером в 1000 капсул все эксципиенты, за исключением коллоидного диоксида кремния и стеариновой кислоты, вносили в сосуд Somakon (5 л). Добавляли бендамустин и осуществляли перемешивание в течение 4 мин при 1000 об/мин (приспособление для очистки (wiper): 10 об/мин). Получившуюся смесь просеивали через сито с ячейками 0,5 мм. В сосуд снова загружали смесь и добавляли коллоидный диоксид кремния. Перемешивание осуществляли в течение 2 мин в указанных условиях. После этого добавляли стеариновую кислоту и продолжали перемешивание в течение 1 мин. Смесь затем просеивали через сито с ячейками 0,5 мм, снова вносили в сосуд и перемешивали еще 30 с, все в тех же условиях. Смесь переносили в машину для заполнения капсул (Zanassi AZ 5) и заполняли твердые желатиновые капсулы (размер 2) (средняя масса: 259,5 мг (начало) - 255,3 мг (конец и гипромеллозовые капсулы(размер 2) (средняя масса: 255,8 (начало) - 253,4 мг (конец соответственно. Капсулы хранили при 40C/75% ОВ в закрытом стеклянном флаконе. Количество гидрохлорида бендамустина, а также родственных веществ, таких как продукты разложения, побочные продукты синтеза, измеряли с использованием ВЭЖХ (колонка: Zorbax Bonus-RP, 5 мкм, температура камеры с колонкой: 30C; температура автосэмплера: 5C; детектор: 254 нм). Результаты показаны в табл. 2 б (заполненные гипромеллозовые капсулы) и 2 в (заполненные желатиновые капсулы).: пик неидентифицированного соединения при относительном времени удержания 0,65 при сравнении с основным пиком. Для 1000 капсул все эксципиенты, за исключением коллоидного диоксида кремния и стеариновой кислоты, вносили в сосуд Somakon (5 л). Добавляли бендамустин и осуществляли перемешивание в течение 4 мин при 1000 об/мин (приспособление для очистки: 10 об/мин). Получившуюся смесь просеивали через сито с ячейками 0,5 мм. Смесь снова вносили в сосуд и добавляли коллоидный диоксид кремния. Перемешивание осуществляли в течение 2 мин в указанных условиях. После этого добавляли стеариновую кислоту и продолжали перемешивание в течение 1 мин. Смесь затем просеивали через сито с ячейками 0,5 мм, снова вносили в сосуд и перемешивали еще 30 с все в тех же условиях. Смесь переносили в машину для заполнения капсул (Zanassi AZ 5) и заполняли твердые желатиновые капсулы (размер 2) (средняя масса: 257,9 мг (начало): - 255,2 мг (конец и гипромеллозовые капсулы(размер 2) (средняя масса: 261,1 (начало): - 257,8 мг (конец соответственно. Капсулы хранили при 40C/75% ОВ в закрытом стеклянном флаконе. Количество гидрохлорида бендамустина и родственных веществ измеряли с использованием ВЭЖХ, как описано выше. Результаты показаны в табл. 3 б (заполненные гипромеллозовые капсулы) и 3 в (заполненные желатиновые капсулы). Для 1000 капсул все эксципиенты, за исключением коллоидного диоксида кремния и стеарата магния, вносили в сосуд Somakon (2,5 л). Добавляли бендамустин и осуществляли перемешивание в течение 4 мин при 1000 об/мин (приспособление для очистки: 10 об/мин). Получившуюся смесь просеивали через сито с ячейками 0,5 мм. Смесь снова вносили сосуд и добавляли коллоидный диоксид кремния. Перемешивание осуществляли в течение 2 мин в указанных условиях. После этого добавляли стеарат магния и продолжали перемешивание в течение 1 мин. Смесь затем просеивали через сито 0,5 мм, снова вносили в сосуд и перемешивали еще 30 с, все в тех же условиях. Смесь переносили в машину для заполнения капсул (Zanassi AZ 5) и заполняли твердые желатиновые капсулы (размер 2) (средняя масса: 241,3 мг (начало): - 244 мг (конец и гипромеллозовые капсулы(размер 2) (среднее масса: 243,5 (начало): - 243 мг (конец соответственно. Капсулы хранили при 40C/75% ОВ в закрытом стеклянном флаконе. Количество гидрохлорида бендамустина и родственных веществ измеряли с использованием ВЭЖХ, как описано выше. Результаты показаны в табл. 4 б (заполненные гипромеллозовые капсулы) и 4 в (заполненные желатиновые капсулы).NF и перемешивали при 800 об/мин с использованием механической мешалки, пока смесь не становилась прозрачной. Смеси давали застыть при 10C. Затем добавляли к застывшей смеси 24,80 г гидрохлорида бендамустина путем перемешивания вручную и затем распределяли по смеси путем гомогенизирования с использованием высокоскоростного гомогенизатора Ultraturrax T18 при 15500 об/мин в течение 10 мин. Гомогенизированной суспензией заполняли твердые желатиновые капсулы с использованием машины для заполнения и герметизации капсул CFS 1200, работающей при 25C. Капсулы закрывали и герметизировали. Заполненные жидкостью капсулы хранили в закрытых желтых стеклянных флаконах с ввинчивающимися пробками при 40C/75% ОВ, при 30C/65% ОВ, при 25C/60% ОВ и при 5C. Количество гидрохлорида бендамустина, а также родственных веществ, таких как продукты разложения, побочные продукты синтеза, измеряли с использованием ВЭЖХ (колонка: Zorbax Bonus-RP, 5 мкм; температура камеры с колонкой: 30C; температура автосэмплера: 5C; детектор: 254 нм). Результаты показаны в табл. 5 б. Взвешивали и растворяли 0,68 г метилпарабена, 0,068 г пропилпарабена и 0,068 г бутилгидрокситолуола в 6,14 г этанола. Cremophor RH 40 плавили при 40C в достаточном количестве. Взвешивали 5,56 г полученного этанольного раствора и 239,65 г расплавленного Cremophor RH 40 и перемешивали при 800 об/мин с использованием механической мешалки, пока смесь не становилась прозрачной. Смеси давали застыть и охлаждали ее до комнатной температуры. Затем добавляли к застывшей смеси 24,80 г гидрохлорида бендамустина путем перемешивания вручную и затем распределяли по смеси путем гомогенизирования с использованием высокоскоростного гомогенизатора Ultraturrax T18 при 15500 об/мин в течение 10 мин. Гомогенизированной суспензией заполняли твердые желатиновые капсулы с использованием машины для заполнения и герметизации капсул CFS 1200, работающей при 40C. Капсулы закрывали и герметизировали. Полученные, таким образом, заполненные жидкостью капсулы хранили в закрытых желтых стеклянных флаконах с ввинчивающимися пробками при 40C/75% ОВ, при 30C/65% ОВ, при 25C/60% ОВ и при 5C. Количество гидрохлорида бендамустина, а также родственных веществ, таких как продукты разложения, побочные продукты синтеза, измеряли с использованием ВЭЖХ, как описано выше. Результаты показаны в табл. 6 б. Взвешивали и растворяли 0,68 г метилпарабена, 0,068 г пропилпарабена и 0,068 г бутилгидрокситолуола в 6,14 г этанола. Cremophor RH 40 плавили при 40C в достаточном количестве. Взвешивали 5,56 г полученного этанольного раствора, 36,83 г расплавленного Cremophor RH 40 и 202,82 г Softisan 645 и перемешивали при 800 об/мин с использованием механической мешалки, пока смесь не становилась прозрачной. Смеси давали застыть при 10C. Затем добавляли к застывшей смеси 24,80 г гидрохлорида бендамустина путем перемешивания вручную и затем распределяли по смеси путем гомогенизирования с использованием высокоскоростного гомогенизатора Ultraturrax T18 при 15500 об/мин в течение 10 мин. Гомогенизированной суспензией заполняли твердые желатиновые капсулы с использованием машины для заполнения и герметизации капсул CFS 1200, работающей при 30C. Капсулы закрывали и герметизировали. Заполненные жидкостью капсулы хранили в закрытых желтых стеклянных флаконах с ввинчивающимися пробками при 40C/75% ОВ, при 30C/65% ОВ, при 25C/60% ОВ и при 5C. Количество гидрохлорида бендамустина, а также родственных веществ, таких как продукты разложения, побочные продукты синтеза, измеряли с использованием ВЭЖХ, как описано выше. Результаты показаны в табл. 7 б. 2. Тесты на распадаемость и растворение. Пример 5. Тесты на распадаемость для препаратов заполненной жидкостью капсулы по примерам 1-3 осуществляли в 1000,0 мл буферного раствора pH 1,00,05 с использованием аппарата А для распадаемости,работающего при 37,00,5C. Результаты перечислены в табл. 8 а, 8 б и 8 в. Пример 6. Тесты на растворение для препаратов заполненной жидкостью капсулы по примерам 1-3 осуществляли в растворе искусственной желудочной кислоты при pH 1,5 (см. Европейскую Фармакопею: 2.9.3. Тест на растворение для твердых лекарственных форм в рекомендуемой среде растворения (Dissolutiontest for solid dosage forms in Recommended Dissolution Media. Пробы для растворения тестировали для анализа с использованием ВЭЖХ (колонка: Zorbax BonusRP, 5 мкм; температура камеры с колонкой: 30C; температура автосэмплера: 5C; детектор: 254 нм). Искусственную желудочную жидкость при pH 1,5 получали добавлением 250,0 мл 0,2 М хлорида калия в 1000-мл мерную колбу, добавлением 207,0 мл 0,2 М соляной кислоты, затем разбавлением до 1000 мл водой Milli-Q. Измеряли pH и доводили, если необходимо, 2 н. соляной кислотой или 2 н. гидроксидом калия до pH 1,50,05. Тест на растворение осуществляли в соответствии с главой 2.9.3. Европейской Фармакопеи 6.0 с использованием аппарата 2 (лопастной аппарат). Скорость вращения лопасти составляла 50 об/мин, температура была 370,5C, количество среды для растворения было 500 мл. Результаты для заполненных жидкостью твердых капсул по примерам 1-3 показаны в табл. 9 а, 9 б и 9 в: Как можно заключить из указанных табл. 9 а, 9 б и 9 в, только композиция заполненной жидкостью твердой капсулы по примеру 2 в соответствии с этим изобретением показывает предпочтительный быстрый профиль растворения бендамустина, который составляет по меньшей мере 60% за 10 мин, 70% за 20 мин и 80 % за 30 мин, при измерении с использованием лопастного аппарата при 50 об/мин в соответствии с Европейской Фармакопеей в 500 мл искусственной желудочной жидкости. Пример 7. 3. Тесты in vivo. Пример 8. Заполненные жидкостью твердые капсулы по примеру 2, содержащие 50 мг бендамустина, перорально вводили самцам и самкам собак породы бигль в сравнении с капсулами сравнительного примера 1 для определения биологической доступности 1 дозы (то есть 50 мг) бендамустина (площадь под кривой концентрации AUC и Смакс) и для определения уровня вариабельности биодоступности этих композиций капсулы (то есть %CV у AUC и Смакс). Дополнительный препарат (препарат X) также включен в тест, но поскольку этот препарат не входит в объем настоящего изобретения, подробности не приведены. Суммарное требуемое число животных было 16. Основной схемой исследования был перекрестный дизайн с 8 животными в каждой группе. Период 1 (одна доза капсул, день 1) Период вымывания длился одну неделю. Период 2 (1 неделя после периода 1, одна доза одного из следующих препаратов, день 8) Средние профили в плазме в зависимости от времени как для композиции капсулы (сравнительный пример 1), так и композиции заполненной жидкостью капсулы по примеру 2 показаны на фиг. 1. Пример 9. Открытое рандомизированное двухстороннее перекрестное исследование для оценки абсолютной биодоступности перорального бендамустина у пациентов с раковым заболеванием проводили для оценки абсолютной биологической доступности бендамустина, вводимого в виде перорального препарата (пример 2). Кроме оценки фармакокинетики бендамустина в плазме после перорального и внутривенного введения, дополнительной целью была оценка безопасности и переносимости бендамустина после внутривенного и особенно перорального введения препарата по примеру 2. 6 пациентов находились в больнице в течение 2 периодов; от дня 1 до дня 2 (период 1) и в дни 7-9(период 2). Пациентов отбирали в случайном порядке одного из двух следующих схем лечения в дни 1 и 8: разовая пероральная доза 110,2 мг (255,1 мг) гидрохлорида бендамустина (HCl), эквивалентная дозе примерно 100 мг свободного основания бендамустина; разовая внутривенная доза 100 мг гидрохлорида бендамустина, эквивалентная дозе 90,7 мг свободного основания бендамустина. Доза гидрохлорида бендамустина (100 мг внутривенно, 110,2 мг перорально) была выбрана на основании безопасности перорального препарата в доклиническом исследовании и на основании безопасности зарегистрированного внутривенного препарата. Пробы крови брали в дни 1 и 2 и 8 и 9 для определения фармакокинетики бендамустина и его метаболитов в плазме после перорального и внутривенного введения бендамустина. Точки времени после внутривенного введения бендамустина были выбраны на основании данных из литературы (Preiss 1985).Preiss и соавт. сообщили о средней биологической доступности бендамустина, составляющей 57% (диапазон: 25-94%; %CV = 44%), после перорального введения бендамустина в виде капсулы в дозах 250-350 мг пациентам с раковым заболеванием. Бендамустин вводили в дни 1 и 8 утром либо перорально, либо внутривенно разовой дозой (в виде гидрохлорида бендамустина, 100 мг внутривенно или 110,2 мг перорально). Бендамустин вводили перорально в виде двух заполненных жидкостью имеющих твердую оболочку капсул с 250 мл воды или в виде внутривенной инфузии на протяжении 30 мин. Пациенты должны были не принимать еду в течение ночи по меньшей мере в течение 8 ч перед пероральным или внутривенным введением бендамустина утром, за исключением питьевой воды, которую давали за 2 ч до введения исследуемого лекарства. Пациентам давали легкий завтрак через 2 ч после каждого введения. Суммарный срок в больнице составлял 6 суток (дни от -1 до 2 и дни 7-9), за исключением визитов для скрининга и после исследования. Определенные лекарства были запрещены с 2 недель перед первым введением первого исследуемого лекарственного средства. Кривые зависимости концентрации в крови от времени, полученные после исследования 6 пациентов, показаны на фиг. 2. Средняя величина абсолютной биодоступности, вычисленная как (AUC перорально/доза)/(AUC внутривенно/доза)100%, составляла 58,5% при стандартном отклонении 9,3 и варьированием между индивидами (выраженном как %CV), равном 15,9. Как было обнаружено, биодоступность гидрохлорида бендамустина из пероральной композиции по примеру 2 соответствовала данным, о которых сообщалось ранее в литературе (Preiss) для бендамустинсодержащих капсул, но варьирование между пациентами было гораздо ниже. Промышленная применимость Композиции по настоящему изобретению демонстрируют много преимуществ. Их может легко использовать пациент без помощи контролирующего медицинского персонала. Следовательно, отнимающие время поездки в больницу могут перестать быть необходимыми, что улучшит соблюдение режима лечения пациентом. Дополнительное преимущество заключается в том, что персонал больницы меньше подвергается контактам с цитотоксическим веществом, что снижает производственную вредность. Также имеет место меньший вред для окружающей среды, поскольку не надо выбрасывать флаконы, содержащие цитотоксическое соединение. Эти лекарственные формы можно глотать как таковые, что означает, что пациенту не нужно ждать,когда произойдет растворение активного ингредиента. Более того, глотание лекарства представляет собой предпочтительный способ приема для того, чтобы избегать любого контакта активного ингредиента со слизистой оболочкой полости рта. Дополнительно, благодаря хорошей стабильности этих лекарственных форм их можно легко хранить при комнатной температуре без необходимости в каких-либо особых условиях хранения. Используя лекарственные формы по настоящему изобретению, можно достичь значительного уменьшения объема лекарственной формы. Уменьшенный размер является желательным с точки зрения как изготовления и манипулирования, так и соблюдения пациентом режима и схемы лечения. Эти фармацевтические композиции демонстрируют высокую степень растворения in vitro, что должно снижать разложение бендамустина in vivo. Таким образом, композиции по изобретению могут показывать улучшенный профиль биодоступности бендамустина in vivo по сравнению с пероральными композициями из уровня техники. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция для перорального введения, содержащая бендамустин или его фармацевтически приемлемые сложный эфир, соль или сольват в качестве активного ингредиента и фармацевтически приемлемый эксципиент, который представляет собой фармацевтически приемлемое неионное поверхностно-активное вещество, выбранное из группы, состоящей из макрогол глицерилгидроксистеарата, полиоксил-35-касторового масла и блок-сополимера этиленоксид/пропиленоксид (Pluronic L44 NF или Poloxamer 124). 2. Фармацевтическая композиция по п.1, характеризующаяся тем, что активный ингредиент представляет собой гидрохлорид бендамустина. 3. Фармацевтическая композиция по п.1 или 2, характеризующаяся тем, что она содержит от 10 до 1000 мг, предпочтительно от 25 до 600 мг, более предпочтительно от 50 до 200 мг и наиболее предпочтительно около 100 мг активного ингредиента. 4. Фармацевтическая композиция по любому из пп.1-3, характеризующаяся тем, что она дополнительно содержит коллоидный диоксид кремния. 5. Фармацевтическая композиция по любому из пп.1-4, характеризующаяся тем, что она дополнительно содержит лауроилмакрогол глицериды (Gelucire 44/14). 6. Фармацевтическая композиция по любому из пп.1-5, характеризующаяся тем, что она находится в твердой желатиновой капсуле. 7. Фармацевтическая композиция по любому из пп.1-6, характеризующаяся тем, что она демонстрирует растворение бендамустина, составляющее по меньшей мере 60% за 20 мин, 70% за 40 мин и 80% за 60 мин при измерении с использованием лопастного аппарата при 50 об/мин в соответствии с Европейской Фармакопеей в 500 мл среды растворения при pH 1,5. 8. Фармацевтическая композиция по п.7, характеризующаяся тем, что она демонстрирует растворение, составляющее по меньшей мере 60% за 10 мин, 70% за 20 мин и 80% за 30 мин. 9. Фармацевтическая композиция по любому из пп.1-8, характеризующаяся тем, что она используется для лечения медицинского состояния, выбранного из хронического лимфолейкоза, острого лимфолейкоза, хронического миелоидного лейкоза, острого миелоидного лейкоза, болезни Ходжкина, неходжкинской лимфомы, множественной миеломы, рака молочной железы, рака яичника, мелкоклеточного рака легкого, немелкоклеточного рака легкого и аутоиммунного заболевания. 10. Фармацевтическая композиция по любому из пп.1-8, характеризующаяся тем, что она содержит по меньшей мере один дополнительный активный агент, выбранный из группы, состоящей из антитела,специфичного к CD20, производного антрациклина, алкалоида барвинка или производного платины. 11. Фармацевтическая композиция по п.10, характеризующаяся тем, что антитело, специфичное кCD20, представляет собой ритуксимаб; производное антрациклина представляет собой доксорубицин или даунорубицин; алкалоид барвинка представляет собой винкристин и производное платины представляет собой цисплатин или карбоплатин. 12. Фармацевтическая композиция по любому из пп.1-8 или 10, 11, дополнительно содержащая кортикостероид. 13. Фармацевтическая композиция по п.12, характеризующаяся тем, что кортикостероид представляет собой преднизон или преднизолон.
МПК / Метки
МПК: A61K 31/4184, A61K 9/14, A61K 9/48
Метки: бендамустина, лекарственные, пероральные, формы
Код ссылки
<a href="https://eas.patents.su/19-20354-peroralnye-lekarstvennye-formy-bendamustina.html" rel="bookmark" title="База патентов Евразийского Союза">Пероральные лекарственные формы бендамустина</a>
Предыдущий патент: Способ замедленного коксования
Следующий патент: Открытый реактор повышенного давления с перемешиванием и способ смешивания газа и шлама друг с другом
Случайный патент: Замещенные имидазопиримидины для предупреждения и лечения рака