Пероральные лекарственные самоэмульгирующиеся композиции ингибиторов протеазы из класса пиранонов
Формула / Реферат
1. Фармацевтическая композиция, содержащая менее чем 0,5% этанола и пропиленгликоля, включающая:
(а) пиранон формулы I в качестве обладающего фармацевтической активностью агента
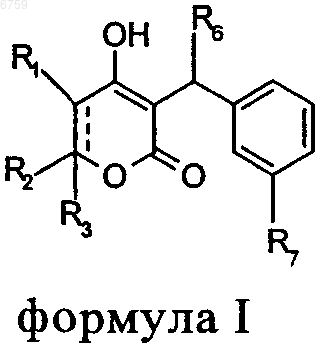
где R1 обозначает Н-;
R2 обозначает С3-С5алкил, фенил(СН2)2-, het-SO2NH-(СН2)2-, циклопропил(СН2)2-, F-фенил(СН2)2-, hеt-SO2NН-фенил-, или F3С-(СН2)2-; или
R1 и R2 вместе обозначают двойную связь;
R3 обозначает R4-(СН2)n-СН(R5)-, Н3С-[O(СН2)2]2-СН2-, С3-С5алкил, фенил(СН2)2-, het-SO2NH-(СН2)2-, (HOCH2)3C-NH-C(O)-NH-(CH2)3-, (HO2C)(H2N)CH-(СН2)2-С(O)-NН-(СН2)3-, пиперазин-1-ил-С(O)-NН-(СН2)3, НО3S(СН2)2-N(СН3)-С(O)-(СН2)6-С(O)-NН-(СН2)3-, циклопропил(СН2)2-, F-фенил-(СН2)2-, het-SO2NH-фенил или F3С-(СН2)2-;
n равно 0, 1 или 2;
R4 обозначает фенил, het, циклопропил, Н3С-[O(СН2)2]2-, het-SO2NH-, Вr-, N3- или НО3S(СН2)2-N(СН3)-C(O)-(CH2)6-C(O)-NH-;
R5 обозначает -СН2-СН3 или -СН2-циклопропил;
R6 обозначает циклопропил, СН3-СН2- или трет-бутил;
R7 обозначает -NR8SO2-het, -NR8SO2-фeнил, необязательно замещенный R9, -СН2-SO2-фенил, необязательно замещенный R9 или -CH2-SO2-het;
R8 обозначает -Н или -СН3;
R9 обозначает -CN, -F, -ОН или -NO2;
het обозначает 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее 1-3 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы;
и включает любую бициклическую группу, в которой любое из указанных выше гетероциклических колец сконденсировано с бензольным кольцом или другим гетероциклом, необязательно замещенным
-СН3, -CN, -ОН, -С(O)ОС2Н5, -СF3, -NH2 или -C(O)-NH2;
или его фармацевтически приемлемую соль;
(б) одно или несколько фармацевтически приемлемых поверхностно-активных веществ; и
(с) полиэтиленгликоль, имеющий среднюю молекулярную массу более 300, но менее 600, в качестве растворителя.
2. Фармацевтическая композиция по п.1, где соединение формулы I присутствует в количестве от приблизительно 1 до приблизительно 40% в пересчете на массу всей композиции.
3. Фармацевтическая композиция по п.1, дополнительно содержащая основный амин в количестве от приблизительно 0,1 до приблизительно 10% в пересчете на массу всей композиции.
4. Фармацевтическая композиция по п.3, где основный амин представляет собой (низш.)алкиламин, основную аминокислоту или гидроксид холина.
5. Фармацевтическая композиция по п.4, где (низш.)алкиламин выбирают из группы, включающей этаноламин, диэтаноламин, триэтаноламин, этилендиамин, диметиламиноэтанол или трис(гидрокси-метил)аминометан.
6. Фармацевтическая композиция по п.1, дополнительно содержащая смесь диглицерида и моноглицеридов в количестве от приблизительно 5 до приблизительно 35% в пересчете на массу всей композиции.
7. Фармацевтическая композиция по п.6, где диглицериды и моноглицериды имеют среднюю длину цепи.
8. Фармацевтическая композиция по п.6, где смесь диглицерида и моноглицеридов представляет собой Capmul MCM.
9. Фармацевтическая композиция по п.6, где диглицерид и моноглицериды представляют собой эфиры моно- или динасыщенных жирных кислот и глицерина, имеющие цепь, содержащую от 8 до 10 атомов углерода.
10. Фармацевтическая композиция по п.1, где пиранон формулы I представляет собой соединение формулы IV
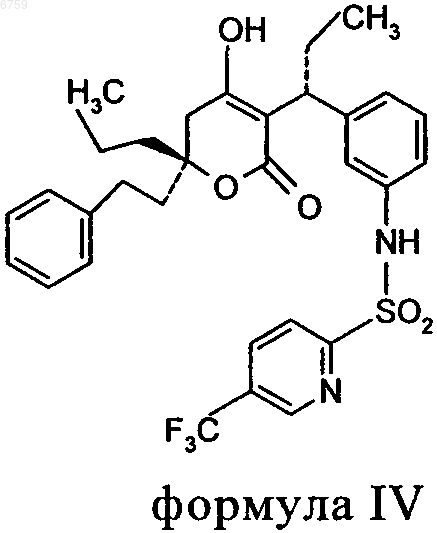
11. Фармацевтическая композиция по п.1, где полиэтиленгликоль присутствует в количестве от приблизительно 10 до приблизительно 40% в пересчете на массу всей композиции.
12. Фармацевтическая композиция по п.11, где полиэтиленгликоль имеет среднюю молекулярную массу приблизительно 400.
13. Фармацевтическая композиция по п.1, где поверхностно-активное вещество присутствует в количестве от приблизительно 20 до приблизительно 60% в пересчете на массу всей композиции.
14. Фармацевтическая композиция по п.13, где поверхностно-активное вещество представляет собой полиоксил(40)-гидрогенизированное касторовое масло, полиоксил(35)-касторовое масло, Solutol HS-15, Tagat TO, пегликоль 6-олеат, полиоксиэтиленстеараты, полоксамеры, полисорбаты или насыщенные полигликолизированные глицериды.
15. Фармацевтическая композиция по п.14, где полиоксил(35)-гидрогенизированное касторовое масло представляет собой Cremophor EL или Cremophor EL-P.
16. Фармацевтическая композиция, содержащая менее чем 0,5% этанола и пропиленгликоля, включающая:
(а) пиранон формулы IV
в количестве от приблизительно 1 до приблизительно 40% в пересчете на массу всей композиции;
(б) липофильную фазу, составляющую от приблизительно 5 до приблизительно 35% в пересчете на массу всей композиции;
(в) полиэтиленгликоль со средней молекулярной массой более приблизительно 300, но менее приблизительно 600 в количестве от приблизительно 10 до приблизительно 40% в пересчете на массу всей композиции;
(г) поверхностно-активное вещество, выбранное из группы, включающей полиоксилированное касторовое масло, полиоксиэтиленглицеринтририцинолеат и насыщенный полигликолизированный каприловый-каприновый глицерид, в количестве от приблизительно 20 до приблизительно 60% в пересчете на массу всей композиции; и
(д) основной амин, выбранный из группы, включающей (низш.)алкиламин, основную аминокислоту или гидроксид холина, где указанный основный амин присутствует в количестве от приблизительно 0,1 до приблизительно 10% в пересчете на массу всей композиции.
17. Фармацевтическая композиция по п.16, где липофильная фаза представляет собой смесь диглицеридов и моноглицеридов.
18. Фармацевтическая композиция по п.16, где липофильная фаза представляет собой смесь диглицеридов и моноглицеридов со средней длиной цепи.
19. Фармацевтическая композиция, содержащая менее чем 0,5% этанола и пропиленгликоля, включающая пиранон формулы IV
в количестве от приблизительно 1 до приблизительно 40% в пересчете на массу всей композиции;
(б) липофильную фазу, выбранную из группы, включающей Capmul МСМ, Labrafil М-1944 CS, Myglol-812 и их смеси, где липофильная фаза присутствует в количестве от приблизительно 5 до приблизительно 35% в пересчете на массу всей композиции;
(в) полиэтиленгликоль со средней молекулярной массой более приблизительно 300, но менее приблизительно 600 в количестве от приблизительно 10 до приблизительно 40% в пересчете на массу всей композиции;
(г) поверхностно-активное вещество, выбранное из группы, включающей полиоксилированное касторовое масло, полиоксиэтиленглицеринтририциноолеат и насыщенный полигликолизированный каприловый-каприновый глицерид, в количестве от приблизительно 20 до приблизительно 60% в пересчете на массу всей композиции.
20. Композиция по п.19, дополнительэю содержащая основный амин, выбранный из группы, включающей (низш.)алкиламин, основную аминокислоту или гидроксид холина, где указанный основный амин присутствует в количестве от приблизительно 0,1 до приблизительно 10% в пересчете на массу всей композиции.
21. Композиция по п.19, находящаяся в жидкой форме, которой можно заполнять мягкие эластичные капсулы.
22. Композиция по п.19, находящаяся в жидкой форме, которой можно заполнять твердые желатиновые или нежелатиновые капсулы.
Текст
006759 Данная заявка является частичным продолжением предварительной заявки на патент US60/244434,поданной 31 октября 2000 г. Предпосылки создания изобретения Область техники, к которой относится изобретение Настоящее изобретение относится к новым лекарственным композициям для перорального введения, содержащим 5,6-дигидро-4-гидрокси-2-пироны. В частности, настоящее изобретение относится к практически не содержащей спирта и пропиленгликоля композиции в виде микроэмульсии, включающей ингибиторы протеазы из класса 5,6-дигидро-4-гидрокси-2-пиронов, которая обладает существенно более высокой биологической доступностью и стабильностью при комнатной температуре. Прототипы изобретения После открытия синдрома приобретенного иммунодефицита (СПИД) в начале 1980-х годов проблема СПИДа и обусловленных им губительных последствий стала предметом интенсивного обсуждения в прессе и научных исследований. Широко известно, что этот синдром обусловлен заражением ретровирусом, обычно называемым вирусом иммунодефицита человека (ВИЧ). С момента его выявления почти 20 лет назад и до настоящего времени проблема СПИДа превратилась из экзотической медицинской проблемы, касающейся лишь незначительной части населения, в проблему, имеющую первостепенное значение. Предполагается,что только в Соединенных Штатах миллионы людей являются сероположительными в отношении ВИЧ. Первым лекарственным средством, разрешенным 20 марта 1987 г. для лечения инфицированных ВИЧ людей, был зидовудин (АЗТ). Зидовудин или АЗТ был разрешен для лечения больных СПИДом пациентов, у которых незадолго перед этим наблюдались первые признаки пневмокистозной каринипневмонии (вызванной вирусом carinii), карини-пневмонии, или пациентов, инфицированных вирусом, у которых абсолютное количество антигенных маркеров хелперных Т-лимфоцитов CD4 в периферической крови составляет менее 200/мм 3. Предполагается, что действие АЗТ обусловлено ингибированием вирусной обратной транскриптазы, фермента, необходимого для репликации вируса иммунодефицита. В течение очень непродолжительного периода времени количество разрешенных к применению антиретровирусных лекарственных средств возросло от одного лекарственного средства, обладающего умеренной активностью, до двенадцати лекарственных средств, обладающих значительной эффективностью. Разрешенные к применению антиретровирусные лекарственные средства разделяют на три класса: нуклеозидные аналоги ингибиторов обратной транскриптазы; ненуклеозидные аналоги ингибиторов обратной транскриптазы; и ингибиторы протеазы. Высокоэффективная антиретровирусная терапия (называемая ВЭАРТ) практически всегда заключается в применении ингибитора протеазы в сочетании с одним или несколькими лекарственными средствами других классов. Класс ингибиторов протеазы обладает высокой антиретровирусной активностью. Первый ингибитор протеазы был разрешен к применению Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств США (US PDA) в 1995 г., и следует отметить, что этот класс лекарственных средств произвел революцию в области лечения ВИЧ-инфекции. Ингибиторы протеазы можно охарактеризовать тем, что они обладают способностью превращать первоначально безнадежное (фатальное) состояние заболевания в хроническое инфекционное заболевание, которое в большей степени поддается лечению. В настоящее время существует пять разрешенных к применению U.S. PDA ингибиторов протеазы: ампренавир, индинавир, нелфинавир, ритонавир и саквинавир. Ретровирусные протеазы представляют собой ферменты, необходимые для созревания вирусных частиц до тех стадий, когда они могут осуществлять заражение. Ингибирование протеаз, или их отсутствие, или нарушение их функции приводит к тому, что вирус теряет способность эффективно реплицироваться, что препятствует продуцированию способных осуществлять заражение вирусных частиц. Например, ретровирусная протеаза "gag-протеаза", которая, как установлено в настоящее время, представляет собой один из имеющих наименьший размер ферментов (содержащий только 99 аминокислот и обладающий гомологией с аспартилпротеазами, такими как пепсин и ренин), обеспечивает правильное протеолитическое расщепление протеинов-предшественников, продуцируемых из областей генома, кодирующих "специфические для группы антигены" (gag). Предполагается, что протеаза кодируется областью "роl" вирусного генома, которая содержит также области обратной транскриптазы и интегразы.Gag-протеазы расщепляют основной капсидный протеин р 24 ВИЧ-1 и ВИЧ -2 предпочтительно в области N-конца остатков пролина; например, с образованием двухвалентных фрагментов Phe-Pro, Leu-Pro или Туr-Рrо. В процессе расщепления высвобождаются структурные протеины вирусного ядра. Таким образом, gag-протеаза необходима для процессирования предшественников ВИЧ-слитого полипептида,что позволяет осуществлять созревание полипептидов gag и слитых полипептидов gag/pol, включая капсидные и способные к репликации ферменты (такие, например, как обратная транскриптаза, интеграза). В литературе имеется описание высокоэффективных ингибиторов протеазы ВИЧ. Понятие "ингибиторы протеазы" относится к группе соединений, которые ингибируют аспартатпротеазы вирусного происхождения и которые можно применять для профилактики или лечения вирусных инфекций, вызываемых у млекопитающих ретровирусами, такими как ВИЧ. Можно считать, что ингибиторы протеазы произвели революцию в лечении ВИЧ-инфекции, заключающуюся в том, что совместная терапия с использованием таких соединений в сочетании с ингибиторами обратной транскриптазы вирусной ДНК-1 006759 полимеразы может приводить к почти полному подавлению репликации вируса. Устойчивость к ингибиторам протеазы, по-видимому, является следствием мутаций в кодирующей области ретровирусной протеазы. К сожалению, данные исследований пяти ингибиторов протеаз, разрешенных к применению в настоящее время в Соединенных Штатах, свидетельствуют о том, что эти мутации могут вызывать перекрестную устойчивость (Swanstrom и др., Pharmacol. Ther., 86(2): 145-170(2000. Ингибиторы протеазы ВИЧ по своей природе могут представлять собой пептидомиметики или быть отличными от них. Соединения, имеющие малое сходство с пептидами или отличные от них, как правило, обладают более высокими фармакокинетическими профилями по сравнению с их пептидными аналогами. Пептидные ингибиторы протеазы ВИЧ часто обладают низкой биологической доступностью и быстрой экскрецией вследствие быстрого разложения в желудочно-кишечном тракте. В целом, соединения, отличные от пептидов, обладают более высокой биологической доступностью и меньшей скоростью экскреции. Доступные в настоящее время ингибиторы протеиназы, отличные от пептидов, могут обладать как гидрофобными, так и/или липофильными свойствами. Вследствие указанных характеристик растворимости,т.е. слабой растворимости в воде, общепринятые твердые и жидкие фармацевтические композиции, содержащие такие ингибиторы, не обладают удовлетворительной способностью к абсорбции. Среди различных факторов, которые могут влиять на биологическую доступность лекарственного средства при его пероральном введении (которые включают растворимость в воде, абсорбцию лекарственного средства в желудочнокишечном тракте, величину дозы и эффект первого прохождения), как правило, растворимость в воде относится к наиболее важным факторам. Слабая растворимость соединений в воде часто обусловливает неправильную или неполную абсорбцию и тем самым приводит к меньшей ответной реакции, чем требуется. Известно, что 5,6-дигидро-4-гидрокси-2-пироны являются сильными ингибиторами ретровирусных протеаз. Вследствие этого их можно применять для ингибирования репликации вируса иммунодефицита человека (штаммов ВИЧ-1 или ВИЧ-2 и/или Т-лимфотропных вирусов человека HTLV-I (Т-лимфотропный вирус человека типа I) или HTLV-II (Т-лимфотропный вирус человека типа II и для предупреждения СПИДа. Однако такие ингибиторы протеазы, как правило, обладают очень слабой растворимостью в воде. Например, типранавир, представляющий собой 5,6-дигидро-4-гидрокси-2-пиронсульфонамид в форме свободной кислоты, характеризуется очень слабой растворимостью в воде, составляющей приблизительно 10 мкг/мл при рН от приблизительно 6 до приблизительно 7. Для достижения терапевтического уровня лекарства требуется принимать дозу, состоящую примерно из 15 капсул, содержащих динатриевую соль (4,5 г), дважды в день. Попытки выявить другие соли таких соединений в твердых формах, обладающие существенно более высокой растворимостью в воде, не увенчались успехом. Композиции солей таких соединений, как правило, характеризуются тенденцией к осаждению исходной свободной кислоты в желудочно-кишечном тракте. Было предпринято много попыток увеличить биологическую доступность непептидных ингибиторов протеазы в целом, и в частности ингибиторов пептидазы из класса 5,6-дигидро-4-гидрокси-2 пиронов. В данной области техники существует необходимость в разработке улучшенных пероральныхкомпозиций ингибиторов протеазы ВИЧ, обладающих приемлемыми профилями биологической доступности при пероральном введении, стабильности и побочных действий. Принимая во внимание слабую растворимость многих непептидных ингибиторов протеазы в свободной форме и в форме соли, было приложено много усилий для введения лекарства в состав так называемых эмульгирующихся композиций, т.е. композиций, содержащих лекарство, гидрофильную фазу и липофильную фазу. Такую стратегию можно заимствовать из аналогичной стратегии, разработанной для солюбилизации циклических поли-N-метилированных ундекапептидов из класса циклоспоринов, биологическая доступность которых была значительно увеличена путем смешения их с эмульсией, содержащей липофильную фазу, которая представляет собой триглицериды жирных кислот со средней длиной цепи, гидрофильное поверхностноактивное вещество, такое как Cremophor RH40 (фирма BASF Corp.), и пропиленгликоль (см. патент ЕР 0539319 В 1). Так называемые СЭСВЛ-композиции (самоэмульгирующиеся системы введения лекарства) имеют высокое содержание липидов и поверхностно-активных веществ для соответствующего диспергирования лекарства при смешивании с водной средой. В международной заявке на патентPCT/US97/20794 (WO 98/22106) на имя фирмы Abbott Laboratories описана жидкая фармацевтическая композиция СЭСВЛ для перорального введения, обеспечивающая при пероральном введении более высокую биологическую доступность ингибиторов протеазы ВИЧ,включая определенные ингибиторы протеазы из класса 5,6-дигидро-4-гидрокси-2-пиронов. Такая композиция представляет собой фармацевтически приемлемую эмульгирующуюся композицию, содержащую жирные кислоты с длинной цепью или смесь фармацевтически приемлемой жирной кислоты с длинной цепью и фармацевтически приемлемого спирта и необязательно поверхностно-активного вещества (такого как Cremophor EL, фирма BASF Corp.). В состав предпочтительных композиций входят этанол, или пропиленгликоль, или оба указанных соединения. В заявке указано, что содержание жирных кислот с длинной цепью составляет от приблизительно 40 до приблизительно 70% в пересчете на массу всего раствора, содержание поверхностно-активного вещества составляет от приблизительно 5 до приблизительно 10% в пересчете на массу всего раствора, а этанола или пропиленгликоля - от приблизительно 1 до при-2 006759 близительно 15% в пересчете на массу всего раствора. Исследования на собаках породы бигль и человеке позволили установить, что в этом случае по меньшей мере для пяти ингибиторов протеазы ВИЧ достигается более высокая средняя биологическая доступность по сравнению с биологической доступностью ингибитора протеазы ВИЧ ритонавира как в форме свободного основания, так и в форме бистозилата. В патенте US5484801 на имя фирмы Abbott Laboratories заявлена фармацевтическая композиция,содержащая ингибирующее протеазу ВИЧ соединение в фармацевтически приемлемом органическом растворителе, которая включает: (а) растворитель, выбранный из пропиленгликоля и полиэтиленгликоля(в количестве от приблизительно 10 до приблизительно 50% в пересчете на массу всего раствора), или(б) растворитель, выбранный из полиоксиэтиленглицерина, тририцинолеата, эфира полиэтиленгликоля(40) и гидрогенизированного касторового масла, фракционированного кокосового масла, полиоксиэтиленсорбитанмоноолеата и 2-(2-этоксиэтокси)этанола (в количестве от приблизительно 5 до приблизительно 35% в пересчете на массу всего раствора), или (в) смесь указанных соединений и этанола или пропиленгликоля (в количестве от приблизительно 5 до приблизительно 45% в пересчете на массу всего раствора). В международной заявке на патент РСТ/ЕР 96/02431 (WO 96/39142) и в патенте US6008228 на имя фирмы F. Hoffmann-La Roche AG описана фармацевтическая композиция, которая также позволяет увеличить биологическую доступность ингибиторов протеазы. Композиция содержит фармацевтически приемлемый носитель, включающий моноглицериды жирных кислот со средней длиной цепи, которые предпочтительно представляют собой моноглицериды насыщенных С 6-С 12 жирных кислот и имеют кислотное число, не превышающее или равное приблизительно 2,5. Указано, что предпочтительное соотношение моноглицеридов со средней длиной цепи и ингибитора протеазы составляет приблизительно по меньшей мере 1,5. В международной заявке на патент PCT/US95/0529 на имя фирмы UpJohn, в которой описано применение 5,6-дигидро-4-гидрокси-2-пиронов для лечения ретровирусных инфекций, не обсуждается проблема биологической доступности, присущая таким соединениям. В патенте содержатся сведения о том,что такие соединения в виде динатриевой соли можно включать в состав обычных спрессованных таблеток (смешивая соединения с общепринятыми ингредиентами, такими как тальк, стеарат магния и т.д.) или приготавливать на их основе общепринятым методом сиропы и элексиры. В международных заявках на патент PCT/US98/14816 (WO 99/06043), PCT/US98/14817 (WO 99/06044), PCT/US98/14818 (WO 99/06024) и патенте US6121313 на имя фирмы PharmaciaUpJohnCompany описаны самоэмульгирующиеся композиции, содержащие щелочные соли действующих веществ, которые обеспечивают более высокую биологическую доступность таких соединений при пероральном введении. В патентах описаны композиции, включающие смесь диглицерида и моноглицеридов или основных аминов и одного или нескольких фармацевтически приемлемых поверхностно-активных веществ и растворителей, которые позволяют повысить абсолютную биологическую доступность при пероральном введении. Предпочтительным поверхностно-активным веществом является Cremophor EL или Cremophor RH40, а предпочтительным растворителем является пропиленгликоль или смесь, содержащая пропиленгликоль и 95 об.% этанол. В отношении ингибиторов протеазы из класса 5,6-дигидро-4-гидрокси-2-пиронов в PCT/US98/14816 указывается, что в качестве растворителя можно применять полипропиленгликоль, пропиленгликоль,полиэтиленгликоль, глицерин, этанол, триацетин, диметилизосорбид, гликольфурол, пропиленкарбонат,воду, диметилацетамид или смеси указанных соединений. Указано, что предпочтительным растворителем для таких соединений является пропиленгликоль или смесь, содержащая пропиленгликоль и 95 об.% этанол. Указано, что содержание пропиленгликоля в смеси пропиленгликоля и этанола составляет от приблизительно 50 до приблизительно 95%. Отмечается, что к поверхностно-активным веществам, которые можно применять в сочетании с указанными в заявке соединениями, относятся неионогенные поверхностноактивные вещества, включая полиоксил(40)-гидрогенизированное касторовое масло (например, CremophorRH40), полиоксил(35)-касторовое масло (например, Cremophor EL или Cremophor EL-P), полисорбаты,Solutol HS-15, Tagat TO, пегликоль 6-олеат, полиоксиэтиленстеараты, насыщенные полигликолизированные глицериды или полоксамеры. Отмечается, что предпочтительными поверхностно-активными веществами для таких эмульгирующихся композиций являются Cremophor RH40 или Cremophor EL. Если в состав композиции входят амины, то в заявке указано, что их выбирают из группы, включающей(низш.)алкиламины, такие как этаноламин, диэтаноламин, триэтаноламин, диметиламиноэтанол,трис(гидроксиметил)аминоэтан или этилендиамин; производные четвертичного аммония, такие как гидроксид холина; и основные аминокислоты, такие как аргинин, лизин или гуанидин. Предпочтительным(низш.)алкиламином является диметиламиноэтанол или трис(гидроксиметил)аминометан. Если в состав композиции входит смесь диглицерида и моноглицерида, то такая смесь предпочтительно имеет массовое соотношение диглицерид:моноглицерид от приблизительно 9:1 до приблизительно 6:4, где диглицерид и моноглицерид представляют собой эфиры глицерина и моно- или диненасыщенных жирных кислот, с длиной цепи от 16 до 22 атомов углерода. Отмечается, что, как правило, пираноновая композиция по изобретению содержит от 1 до 40 мас.% лекарственного средства, от приблизительно 5 до 35 мас.% смеси диглицерида и моноглицерида и от приблизительно 10 до приблизительно 50 мас.% фармацевтически приемлемого растворителя. В состав композиции необязательно можно добавлять основой амин в количестве от приблизительно 0,1 до приблизительно 10% в пересчете на массу всей композиции.-3 006759 Было установлено, что среди 5,6-дигидро-4-гидрокси-2-пиронов, обладающих ингибирующей активностью в отношении протеазы, класс 5,6-дигидро-4-гидрокси-2-пиронсульфонамидов обладает наиболее высокой ингибирующей активностью в отношении протеазы (Turner и др., J. Med. Chem., 41(3): 3467-3476 (1998. Установлено, в частности, что одно из соединений, а именно непептидный ингибитор протеазы ВИЧ типранаваир, т.е. (6R)-3-(1R)-1-[3-([5-(трифторметил)(2-пиридил)]сульфониламино) фенил]пропил-4-гидрокси-6-(2-фенилэтил)-6-пропил-5,6-дигидро-2 Н-пиран-2-он (также известный из литературы под названиями U-140690 и PNU-140690) обладает очень высокой активностью в отношении вирусных аспартатпротеаз различных лабораторных штаммов и клинических изолятов ВИЧ типа 1, включая те, которые являются устойчивыми к ингибиторам обратной транскриптазы зидовудину и делавирдину. Известно, что типранавир (формула IV) (ММ=602,98) обладает очень высокой активностью в отношении вариантов ВИЧ-1, устойчивых к ингибиторам протеазы из класса пептидомиметиков (Рорре и др.,Antimicrob. Agents Chemother., 41(5): 1058-1063 (1997. В опытах in vitro было установлено, что значениеKi для лекарства составляет приблизительно 8 пМ (т.е. оно обладает высокой ингибирующей активностью в отношении фермента) и значение IC90 в антивирусной клеточной культуре составляет приблизительно 100 нМ (Turner и др., J. Med. Chem., 41(18): 3467-3476 (1998. Оно характеризуется величинойLog P приблизительно 6,1 и рKа при 6,2 и 8,2. Предполагается, что связывание типранавира с активным центром протеазы является гибким, что обусловливает его более высокие ингибирующие способности по сравнению с другими доступными в настоящее время ингибиторами протеаз (Larder и др., 3-е заседание международной рабочей группы по проблеме устойчивости ВИЧ к лекарственным средствам и стратегии лечения (IAPAC 3-rd International Workshop on HIV Drug Resistance and Treatment Strategies), 23-26 июня 1999). В результате проведения исследований in vitro культур 134 полученных в клинических условиях изолятов с широким спектром устойчивости к доступным в настоящее время ингибиторам протеазы из класса пептидомиметиков было установлено, что 90% из 105 вирусов, обладающих более чем десятикратной устойчивостью к трем или четырем ингибиторам протеиназы и имеющих в среднем 6,1 мутаций в гене фермента протеазы, были чувствительны к типранавиру (Larder и др., AIDS, 14(13): 1943-1948 (2000. В другом исследовании было установлено, что типранавир сохраняет длительную активность в отношении изолятов, устойчивых к индинавиру, ритонавиру и нелфинавиру, трем доступным в настоящее время ингибиторам протеазы (Rusconi и др., Antimicrob. Agents Chemother., 44(5): 1328-1332 (2000. Аналогичная длительная активность была выявлена также по отношению к изолятам, устойчивым к саквинавиру (Larder и др., IAPAC 3-rd International Workshop on HIV Drug Resistance and Treatment Strategies, 23-26 июня 1999). Было установлено, что ингибиторы протеазы из класса 5,6-дигидро-4-гидрокси-2-пиронов, прежде всего ингибиторы из класса 5,б-дигидро-4-гидрокси-2-пиронсульфонамидов, такие как типранавир,очень трудно включать в состав композиций для перорального введения. Были предприняты многочисленные попытки изготовления композиций, содержащих такие лекарства, которые обладали бы приемлемой биологической доступностью при пероральном введении. Типранавир, например, образует высокогигроскопичные соли, что уменьшает стабильность лекарства. Фирма-создатель типранавира после многих лет попыток разработки оптимальной композиции для перорального введения в настоящее время производит эмульгирующуюся композицию, содержащую лекарство, липофильную фазу, представляющую собой смесь диглицеридов и моноглицеридов, поверхностно-активное вещество, основной амин и водную фазу, содержащую пропиленгликоль и спирт, где всеми указанными компонентами заполняют мягкие желатиновые капсулы. Такая композиция, хотя и обеспечивает хорошую биологическую доступность лекарственного средства при пероральном введении, имеет ряд недостатков, которые включают тенденцию капсул к размягчению и слипанию с течением времени; значительное уменьшение биологической доступности после капсулирования в мягкую желатиновую капсулу; необходимость хранения композиции в охлажденном состоянии до применения для предотвращения изменения композиции капсулы; и необходимость применения сложных производственных процессов для приготовления стабильных наполнителей капсул, что обусловлено, в первую очередь, высокой летучестью этанола. Таким образом, существует необходимость в создании улучшенных композиций для перорального введения ингибиторов протеазы в целом, более предпочтительно ингибиторов протеазы из класса 5,6-4 006759 дигидро-4-гидрокси-2-пиронов и еще более предпочтительно ингибиторов протеазы из класса 5,6 дигидро-4-гидрокси-2-пиронсульфонамидов, таких как типранавир. Краткое изложение сущности изобретения Настоящее изобретение направлено на создание улучшенных композиций для перорального введения ингибиторов протеазы из класса пиранонов. Такие композиции обеспечивают повышенную солюбилизацию, стабильность и/или биологическую доступность содержащих пиранон лекарственных средств,а также дают возможность применять менее трудоемкие технологические процессы для заполнения капсул и позволяют хранить капсулы при комнатной температуре. В частности, объектом настоящего изобретения является фармацевтическая композиция, содержащая менее чем 0,5% этанола и пропиленгликоля, включающая:(а) пиранон формулы I в качестве обладающего фармацевтической активностью агентаR1 и R2 вместе обозначают двойную связь;het обозначает 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее 1-3 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы; и включает любую бициклическую группу, в которой любое из указанных выше гетероциклических колец сконденсировано с бензольным кольцом или другим гетероциклом, необязательно замещенным-СН 3, -CN, -ОН, -С(O)ОС 2 Н 5, -СF3, -NH2 или -C(O)-NH2; или его фармацевтически приемлемую соль;(б) одно или несколько фармацевтически приемлемых поверхностно-активных веществ; и(в) полиэтиленгликоль, имеющий среднюю молекулярную массу более 300, но менее 600, в качестве растворителя. В контексте данного описания понятие "соединения из класса пиранонов" кроме охарактеризованного выше соединения формулы I обозначает также соединения формулы II и формулы IIIR11 обозначает циклопропил или -СН 2-СН(СН 3)2;het обозначает 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее 1 -3 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы; и включает любую бициклическую группу, в которой любое из указанных выше гетероциклических колец сконденсировано с бензольным кольцом или другим гетероциклом, необязательно замещенным-СН 3, -CN, -ОН, -(O)ОС 2 Н 5, -СF3, -NH2, или -C(O)-NH2; или его фармацевтически приемлемую соль. Было установлено, что основная трудность, связанная с созданием композиций для перорального введения, содержащих известные в настоящее время ингибиторы протеазы из класса пиранонов, обусловлена применением этанола и пропиленгликоля. Как отмечалось выше при обсуждении прототипов,хотя для приготовления микроэмульсии ингибитора протеазы из класса пиранонов предлагались другие растворители, в течение долгого времени считалось, что предпочтительным является включение этанола и пропиленгликоля в такие микроэмульсионные композиции, благодаря чему можно создать оптимальную композицию. Было установлено, что такие растворители, хотя они и являются эффективными с точки зрения получения эмульсий ингибиторов протеазы из класса пиранонов, проникают в желатиновые оболочки, окружающие такие микроэмульсионные композиции, приводя тем самым к изменению состава фаз композиции, растворимости лекарства и оказывая вредное воздействие на структурную целостность капсулы. В результате этого капсулы становятся липкими при комнатной температуре, и поэтому их необходимо хранить в охлажденном состоянии. При создании настоящего изобретения решалась задача разработать новые самоэмульгирующиеся композиции, для приготовлении которых не требуется включать этанол или пропиленгликоль в состав композиции. Такие композиции позволяют пациентам, принимающим ингибиторы протеазы из класса пиранонов, работать вне мест, где имеется возможность доступа к устройствам, обеспечивающим необходимый уровень охлаждения. Кроме того, такие композиции обладают существенно более постоянным профилем биологической доступности, чем существующие в настоящее время композиции, содержащие значительные количества этанола или пропиленгликоля. Композиция согласно настоящему изобретению практически не содержит значительных количеств этанола и пропиленгликоля (содержание одного из указанных соединений или их комбинации составляет менее приблизительно 0,5%, предпочтительно менее приблизительно 0,1%), что позволяет создать существенно более стабильную композицию, содержащую ингибиторы протеазы из класса пиранонов, и,прежде всего, ингибиторы протеазы из класса сульфонамидов пиранонов, таких как типранавир. Такие композиции содержат от приблизительно 1 до приблизительно 40% ингибитора протеазы из класса пиранонов в пересчете на массу всей композиции, от приблизительно 5 до приблизительно 35% липофильной фазы, предпочтительно представляющей собой смесь диглицеридов и моноглицеридов, в пересчете на массу всей композиции, от приблизительно 20 до приблизительно 60% поверхностно-активного вещества в пересчете на массу всей композиции, и от приблизительно 10 до приблизительно 40% полиэтиленгликоля со средней молекулярной массой более 300, но менее 600 в пересчете на массу всей композиции, и от приблизительно 0,1 до приблизительно 10% одного или нескольких основных аминов в пересчете на массу всей композиции. При создании настоящего изобретения неожиданно было установлено, что при приготовлении самоэмульгирующейся композиции для солюбилизации ингибиторов протеазы из класса пиранонов, прежде всего ингибиторов протеазы из класса сульфонамидов пиранонов, можно применять полиэтиленгликоли со средней молекулярной массой более приблизительно 300, но менее 600 (предпочтительно приблизительно 400) без использования спирта или пропиленгликоля, причем такие полимеры не обладают способностью проникать в желатиновые капсулы или иным образом оказывать негативное влияние на их характеристики. С учетом большого количества альтернативных возможностей создания композиций, включающих ингибиторы протеазы из класса пиранонов, которые не содержат спирта или пропиленгликоля, были проведены многочисленные исследования микроэмульсионной фазы, создаваемой с использованием различных комбинаций материалов, для выявления пригодных композиций, обеспечивающих клинически значимые уровни биологической доступности. После многочисленных неудачных попыток было установлено, что для замены пропиленгликоля и/или этанола, входящих в состав применяемых в настоящее время композиций, содержащих ингибитор протеазы из класса пиранонов, можно с успехом использовать некоторые полиэтиленгликоли с определенной молекулярной массой. Такая замена является сравнительно дешевой и эффективной, и неожиданно было установлено, что это позволяет существенно повысить биологическую доступность и стабильность. В этой связи наряду с охарактеризованной выше фармацевтической композицией были изучены фармацевтические композиции, практически не содержащие спирта и пропиленгликоля, которые включают в качестве действующего вещества пиранон формулы II или III, одно или несколько фармацевтиче-6 006759 ски приемлемых поверхностно-активных веществ; и полиэтиленгликоль со средней молекулярной массой более 300, но менее 600. Фармацевтическая композиция предпочтительно содержит соединение формулы I, II или III в количестве от приблизительно 1 до приблизительно 40% в пересчете на массу всей композиции и, кроме того, содержит основной амин в количестве от приблизительно 0,1 до приблизительно 10% в пересчете на массу всей композиции. В качестве основного амина предпочтительно применяют (низш.)алкиламин, основную аминокислоту или гидроксид холина, причем (низш.)алкиламин предпочтительно выбирают из ряда, включающего этаноламин, диэтаноламин, триэтаноламин, этилендиамин, диметиламиноэтанол или трис(гидроксиметил)аминометан. Кроме того, фармацевтическая композиция может содержать смесь моноглицеридов и диглицеридов в количестве от приблизительно 5 до приблизительно 35% в пересчете на массу всей композиции, причем смесь предпочтительно представляет собой Capmul МСМ. Наибольшей эффективностью композиция обладает при включении в ее состав типранавира, соединения формулы IV. Кроме того, предпочтительно, чтобы количество полиэтиленгликоля составляло от приблизительно 10 до приблизительно 40% в пересчете на массу всей композиции. Наиболее предпочтительно, чтобы полиэтиленгликоль имел молекулярную массу приблизительно 400. Количество поверхностно-активного вещества предпочтительно составляет от приблизительно 20 до приблизительно 60% в пересчете на массу всей композиции, при этом поверхностно-активное вещество выбирают из группы, включающей полиоксил(40)-гидрогенизированное касторовое масло, полиоксил(35)-касторовое масло, Solutol HS-15, Tagat TO, пегликоль 6-олеат, полиоксиэтиленстеараты, полоксамеры, полисорбаты или насыщенные полигликолизированные глицериды. Предпочтительным полиоксил(35)-гидрогенизированным касторовым маслом является Cremophor EL или Cremophor EL-P. Другим объектом настоящего изобретения является фармацевтическая композиция, содержащая менее чем 0,5% этанола и пропиленгликоля, включающая: в количестве от приблизительно 1 до приблизительно 40% в пересчете на массу всей композиции;(б) липофильную фазу, составляющую от приблизительно 5 до приблизительно 35% в пересчете на массу всей композиции;(в) полиэтиленгликоль со средней молекулярной массой более приблизительно 300, но менее приблизительно 600 в количестве от приблизительно 10 до приблизительно 40% в пересчете на массу всей композиции;(г) поверхностно-активное вещество, выбранное из группы, включающей полиоксилированное касторовое масло, полиоксиэтиленглицеринтририцинолеат и насыщенный полигликолизированный каприловый-каприновый глицерид, в количестве от приблизительно 20 до приблизительно 60% в пересчете на массу всей композиции; и(д) основной амин, выбранный из группы, включающей (низш.)алкиламин, основную аминокислоту или гидроксид холина, где указанный основный амин присутствует в количестве от приблизительно 0,1 до приблизительно 10% в пересчете на массу всей композиции. Предпочтительно липофильная фаза содержит смесь моноглицеридов и диглицеридов со средней длиной цепи, такую как Capmul MCM. Еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая менее чем 0,5% этанола и пропиленгликоля, включающая пиранон формулы IV в количестве от приблизительно 1 до приблизительно 40% в пересчете на массу всей композиции;Myglol-812 и их смеси, где липофильная фаза присутствует в количестве от приблизительно 5 до приблизительно 35% в пересчете на массу всей композиции;(в) полиэтиленгликоль со средней молекулярной массой более приблизительно 300, но менее приблизительно 600 в количестве от приблизительно 10 до приблизительно 40% в пересчете на массу всей композиции;(г) поверхностно-активное вещество, выбранное из группы, включающей полиоксилированное касторовое масло, полиоксиэтиленглицеринтририциноолеат и насыщенный полигликолизированный каприловый-каприновый глицерид, в количестве от приблизительно 20 до приблизительно 60% в пересчете на массу всей композиции. Предпочтительно, чтобы такая композиция содержала, кроме того, основной амин, предпочтительно выбранный из группы, включающей (низш.)алкиламин, основную аминокислоту или гидроксид холина,где указанный основной амин присутствует в количестве от приблизительно 0,1 до приблизительно 10% в пересчете на массу всей композиции. Предпочтительно композиция находится в жидкой форме, которой можно заполнять мягкие эластичные капсулы или твердые желатиновые или нежелатиновые капсулы. Краткое описание чертежей Другие задачи и преимущества изобретения более подробно рассмотрены ниже со ссылкой на прилагаемые чертежи, на которых показано на фиг. 1 - фазовая диаграмма микроэмульсии, содержащей Cremophor EL в качестве поверхностноактивного вещества, пропиленгликоль в качестве гидрофильной фазы и Capmul MCM в качестве липофильной фазы, построенная в зависимости от различных взаимных соотношений концентраций указанных соединений; на фиг. 2 - фазовая диаграмма микроэмульсии, содержащей Cremophor EL в качестве поверхностноактивного вещества, ПЭГ 400 в качестве гидрофильной фазы и Capmul MCM в качестве липофильной фазы, построенная в зависимости от различных взаимных соотношений концентраций указанных соединений; на фиг. 3 - фазовая диаграмма микроэмульсии, содержащей Cremophor EL в качестве поверхностно-активного вещества, ПЭГ 400 в качестве гидрофильной фазы и Labrafil М-1944 CS в качестве липофильной фазы, построенная в зависимости от различных взаимных соотношений концентраций указанных соединений; на фиг. 4 - фазовая диаграмма микроэмульсии, содержащей Labrasol в качестве поверхностно-активного вещества, ПЭГ 400 в качестве гидрофильной фазы и Capmul MCM в качестве липофильной фазы,построенная в зависимости от различных взаимных соотношений концентраций указанных соединений; на фиг. 5 - график растворения in vitro типранавира из двух микроэмульсионных композиций, представленных в табл. 1 и 2; на фиг. 6 - график растворения in vitro типранавира из самоэмульгирующейся композиции, представленной в табл. 2, заключенной в гидрофильную мягкую желатиновую капсулу, после хранения в течение 3 месяцев при различных температурах и/или значениях относительной влажности; на фиг. 7 - график растворения in vitro типранавира из самоэмульгирующейся композиции, представленной в табл. 2, заключенной в липофильную мягкую желатиновую капсулу, после хранения в течение 3 месяцев при различных температурах и/или значениях относительной влажности. Подробное описание изобретения Настоящее изобретение позволяет преодолеть многие проблемы, связанные с неудовлетворительной стабильностью и приготовлением композиций, содержащих ингибиторы протеазы из класса пиранонов. В настоящем изобретении предложены новые композиции, содержащие ингибиторы протеазы из класса пиранонов, которые позволяют существенно увеличить растворимость и биологическую доступность таких ингибиторов протеазы при введении пероральных лекарственных средств. Растворимость является важным фактором для любой композиции, предназначенной для перорального введения. Однако при создании композиции следует учитывать необходимость использования эффективных с экономической точки зрения методов, позволяющих приготавливать широкое разнообразие лекарственных средств для перорального введения, которые являются стабильными в отношении их физиохимических характеристик. Кроме того, необходимо, чтобы компоненты любой композиции легко поддавались технологической обработке. В настоящем изобретении предложен способ эффективного с экономической точки зрения производства и обработки стабильных в отношении их физиохимических характеристик пероральных лекарственных средств, содержащих ингибиторы протеазы из класса пиранонов, которые обладают повышенной биологической доступностью. Соединения формул I, II, III и IV, указанные в настоящем описании, приведены и заявлены в международной заявке на патентPCT/US95/05219, и их можно получать согласно методам, описанным в международной заявке на патентWO 95/30670, содержание которых включено в настоящее описание во всей их полноте в качестве ссылки. Понятие "ингибитор протеазы из класса пиранонов" обозначает любое соединение формул I, II, III и IV, которое обладает способностью ингибировать ретровирусную протеазу. Понятие "самоэмульгирующаяся композиция" по настоящему изобретению относится к композиции, содержащей ингибитор протеазы из класса пиранонов, липофильную фазу, гидрофильную фазу,предпочтительно включающую полиэтиленгликоль, одно или несколько фармацевтически приемлемых-8 006759 поверхностно-активных веществ и основной амин в количестве от 0,1 до приблизительно 10% в пересчете на массу всей композиции. Понятие "самоэмульгирующаяся композиция" обозначает концентрированную композицию, способную образовывать эмульсии или микроэмульсии при смешении с достаточным количеством водных сред. Эмульсии или микроэмульсии, получаемые согласно настоящему изобретению, представляют собой растворы, которые содержат гидрофильную фазу и липофильную фазу. Микроэмульсии характеризуются также своей термодинамической стабильностью и малым средним размером капель, который, как правило, составляет менее приблизительно 0,15 мкм. Понятие "основной амин" обозначает (низш.)алкиламины, такие, например, как этаноламин, диэтаноламин, триэтаноламин, диметиламиноэтанол, трис(гидроксиметил)аминометан или этилендиамин; производные четвертичного аммония, такие, например, как гидроксид холина; и основные аминокислоты, такие, например, как аргинин, лизин или гуанидин. Предпочтительным (низш.)алкиламином является диметиламиноэтанол или трис(гидроксиметил)аминометан. Понятие "фармацевтически приемлемое поверхностно-активное вещество" относится к неионогенным поверхностно-активным веществам, включая полиоксил(40)-гидрогенизированное касторовое масло,поставляемое в продажу среди прочего под товарным знаком Cremophor RH40; полиоксил(35)-касторовое масло, поставляемое в продажу среди прочего под товарным знаком Cremophor EL или CremophorEL-P (фирма BASF Corp.); полисорбаты; Solutol HS-15, Tagat TO, пегликоль 6-олеат, полиоксиэтиленстеараты, насыщенные полигликолизированные каприловые-каприновые глицериды, поставляемые в продажу среди прочего под товарным знаком Labrasol (фирма Gattefosse, Вествуд, штат Нью-Джерси); насыщенные полигликолизированные глицериды; или полоксамеры, причем все соединения имеются в продаже. Предпочтительным поверхностно-активным веществом является Cremophor EL. Понятие "липофильный компонент" или "липофильная фаза" включает любое количество компонентов, обладающих характерными для липидов свойствами и высокой растворимостью в липидах, и оно относится к триглицеридам каприловой/каприновой кислоты, поставляемых в продажу среди прочего под товарным знаком Captex 300 (фирма Abitec, Колумбус, штат Огайо), продуктам трансэтерификации косточкового масла и ПЭГ (или ненасыщенным полигликолизированным глицеридам, получаемым путем частичного алкоголиза косточкового абрикосового масла, содержащим глицериды и сложные эфиры ПЭГ), известным, среди прочего, под товарным знаком Labrafil M 1944 CS (фирма Gattefosse, Вествуд,штат Нью-Джерси); моно- и диглицериды каприловой/каприновой кислоты в глицерине, поставляемые в продажу среди прочего под товарными знаками Capmul MCM (фирма Abitec, Колумбус, штат Огайо); и фракционированное масло (такое, как кокосовое масло), содержащее триглицериды каприловой/каприновой кислоты, поставляемое в продажу среди прочего под товарным знаком Miglyol 812. Понятие "моноглицерид" обозначает эфир жирной кислоты и глицерина, имеющий структурную формулу HOCH2-CH(OH)-CH2(O2CR) или НОСН 2-CH(O2CR)-CH2OH, где R обозначает мононасыщенную или динасыщенную алкильную группу, несущую от 8 до 10 атомов углерода. Понятие "диглицерид" обозначает эфир жирной кислоты и глицерина, имеющий структурную формулу HOCH2-CH(O2CR)CH2(O2CR)- или (RCO2)CH2-CH(OH)-CH2(O2CR), где R обозначает мононасыщенную или динасыщенную алкильную группу, несущую от 8 до 10 атомов углерода. Смесь диглицерида и моноглицерида можно получать путем смешения в соответствующей пропорции полученных по отдельности диглицерида и моноглицерида и/или путем частичного гидролиза триглицерида, или с помощью реакции трансэтерификации триглицеридов, диглицеридов с глицерином."Полиэтиленгликоль" или "ПЭГ" обозначает полимер, имеющий общую формулу НОСН 2 СН 2)СН 2)mСН 2OН, где m обозначает среднее количество оксиэтиленовых звеньев. Число, указанное после ПЭГ, обозначает среднюю молекулярную массу полимера. ПЭГ поставляется в продажу различными фирмами, в том числе фирмой Union Carbide Corp. В наиболее предпочтительной композиции по настоящему изобретению, содержащей соединение формулы IV (типранавир), используется самоэмульгирующийся носитель на основе ПЭГ, содержащий от приблизительно 10 до приблизительно 40% ПЭГ 400 (более предпочтительно от приблизительно 15 до приблизительно 30% ПЭГ 400), от приблизительно 20 до приблизительно 60% Cremophor EL (более предпочтительно от приблизительно 35 до приблизительно 50% Cremophor EL), от приблизительно 5 до приблизительно 35% Capmul MCM (более предпочтительно от приблизительно 7 до приблизительно 15%Capmul MCM) и от приблизительно 0,1 до приблизительно 10% основного амина. Следует отметить, что общепринятые самоэмульгирующиеся композиции ингибиторов протеазы из класса пиранонов, содержащие пропиленгликоль и/или спирт, в виде мягких желатиновых капсул после хранения в течение определенного периода времени характеризуются более медленной и менее полной диспергируемостью в водной среде и их растворимость уменьшается приблизительно на 40% по сравнению с растворимостью свежеприготовленных композиций. Следует отметить также, что биологическая доступность таких лекарственных средств в организме человека ниже, чем исходного раствора такого же состава, которым заполняют желатиновые капсулы, непосредственно перед их введением. Было выдвинуто предположение, что эти явления обусловлены тем, что растворитель проникает в капсулу. Был проведен первый цикл исследований, направленных на изменение состава желатиновой капсулы с целью предотвращения проникновения растворителей из эмульгирующейся композиции в капсулу.-9 006759 Эти попытки не имели успеха. После этого были проведены исследования с целью определения, можно ли используемые в качестве растворителей пропиленгликоль и спирт в применяемых в настоящее время композициях заменить полностью или частично другим растворителем. Для систем, содержащих различные липофильные фазы, гидрофильные фазы и поверхностно-активные вещества, были построены фазовые диаграммы микроэмульсий. На основе обширных исследований было установлено, что определенные ингибиторы протеазы из класса пиранонов, включая типранавир, растворимы в полиэтиленгликолях со средней молекулярной массой, находящейся в определенном диапазоне, и их можно применять для замены пропиленгликоля и этанола, используемых в обычных микроэмульсионных композициях таких лекарственных средств. На фиг. 1 показана диаграмма микроэмульсии, содержащей Cremophor EL в качестве поверхностноактивного вещества, Capmul MCM в качестве липофильной фазы и пропиленгликоль, используемый в обычных композициях, содержащих ингибиторы протеазы из класса пиранонов, в качестве гидрофильной фазы, построенная в виде зависимости от различных взаимных соотношений концентраций указанных соединений. Приведенные данные свидетельствуют о том, что при использовании указанных компонентов можно получать стабильную эмульсию в широком диапазоне концентраций каждого из компонентов. Однако поскольку пропиленгликоль растворим в капсуле, содержащей композицию, то положение характеризующей композицию точки на фазовой диаграмме может существенно изменяться с течением времени в зависимости от количества пропиленгликоля, выделившегося из эмульсии. Поэтому с течением времени может значительно изменяться растворимость лекарственного средства, присутствующего в композиции. На фиг. 2 показана фазовая диаграмма микроэмульсии, содержащей Cremophor EL в качестве поверхностно-активного вещества, Capmul MCM в качестве липофильной фазы и ПЭГ-400 в качестве гидрофильной фазы, также построенная в виде зависимости от различных взаимных соотношений концентраций указанных соединений. Можно считать, что фазовая диаграмма для композиции, содержащей ПЭГ 400 (а не пропиленгликоль, как на фиг. 1), является сходной с диаграммой, приведенной на фиг. 1. Результаты исследований, предпринятых с целью определения влияния липофильной фазы на фазовую стабильность микроэмульсии, представленные на фиг. 2, позволяют предположить, что предпочтительной является липофильная фаза, представляющая собой смесь моно- и диглицеридов со средней длиной цепи, таких, которые присутствуют в Capmul MCM. На фиг. 3 показана фазовая диаграмма микроэмульсии, содержащей Cremophor EL в качестве поверхностно-активного вещества, ПЭГ 400 в качестве гидрофильной фазы и Labrafil-M-1944 CS в качестве липофильной фазы, построенная в виде зависимости от различных взаимных соотношений концентраций указанных соединений. Labrafil-M-1944 представляет собой продукт трансэтерификации косточкового масла и ПЭГ, а именно ненасыщенные полигликолизированные глицериды, полученные частичным гидролизом абрикосового косточкового масла,содержащего глицериды, и сложных эфиров ПЭГ. При исследовании стабильности микроэмульсии в широком диапазоне концентраций компонентов было установлено, что она имеет место в более узком диапазоне, чем для микроэмульсионной системы, представленной на фиг. 2, в которой в качестве липофильной фазы используется Capmul MCM. Capmul MCM представляет собой смесь моно- и диглицеридов каприловой/каприновой кислоты в глицерине. При использовании в качестве поверхностно-активного вещества Labrasol вместо Cremophor EL было обнаружено небольшое увеличение стабильности микроэмульсии, диаграмма которой приведена на фиг. 2. На фиг. 4 показана фазовая диаграмма микроэмульсии, содержащей Labrasol в качестве поверхностно-активного вещества, ПЭГ 400 в качестве гидрофильной фазы и Capmul MCM в качестве липофильной фазы, построенная в виде зависимости от различных взаимных соотношений концентраций указанных соединений. Хотя применение Labrasol повышает стабильность, Labrasol имеет недостаток, связанный с тем, что до настоящего времени не изучена на людях его безопасность при продолжительном применении пероральным путем. На фиг. 5 показан график растворения in vitro типранавира из двух самоэмульгирующихся композиций, представленных ниже в табл. 1 и 2. Композиция, представленная в табл. 2, отличается от композиции, представленной в табл. 1, тем, что вместо спирта и пропиленгликоля в ней используется ПЭГ 400. Таблица 1 В опытах in vitro было установлено, что растворимость композиции, представленной в табл. 2 (в которой в качестве гидрофильного растворителя используется ПЭГ 400 вместо спирта и пропиленгликоля,входящих в состав композиции, представленной в табл. 1), практически идентична растворимости композиции, представленной в табл. 1, в том случае, когда такой композицией только что заполняют мягкие желатиновые капсулы. С другой стороны, было установлено, что время растворимости in vitro композиции, представленной в табл. 2, существенно меньше, чем композиции, представленной в табл. 1, если композицию, представленную в табл. 1, хранили в мягких желатиновых капсулах в холодильнике при 4 С в течение 14 месяцев. Было установлено, что самоэмульгирующаяся композиция, представленная в табл. 2, обладает очень высокой стабильностью при комнатной температуре, а также при охлаждении, при хранении в гидрофильных или липофильных мягких желатиновых капсулах в запечатанных под вакуумом пузырьках из ПЭВП (полиэтилен высокой плотности). На фиг. 6 показан график растворения in vitro типранавира из композиции, состав которой представлен табл. 2, заключенной в гидрофильные мягкие желатиновые капсулы, которые находилась в запечатанных под вакуумом пузырьках из ПЭВП, после хранения в течение различных периодов времени при различных температурах и/или значениях относительной влажности. Все три композиции, результаты исследований которых представлены на графике, а именно композиция, которую хранили в течение 3 месяцев при 5 С, композиция, которую хранили при комнатной температуре (25 С) в течение 3 месяцев при относительной влажности 60%, и композиция, которую хранили при 30 С в течение 3 месяцев и относительной влажности 70%, имели практически идентичные профили растворимости. На фиг. 7 показан график растворения in vitro типранавира из композиции, состав которой представлен табл. 2, заключенной в липофильную мягкую желатиновую капсулу, после хранения в течение различных периодов времени при различных температурах и/или значениях относительной влажности. Видно, что приведенные графики практически идентичны графикам, полученным для композиции, заключенной в гидрофильные мягкие желатиновые капсулы. Композиция, представленная в табл. 2, заключенная в липофильные мягкие желатиновые капсулы, имела очень высокую стабильность профиля растворимости при хранении в запечатанных под вакуумом пузырьках из ПЭВП в течение 3 месяцев при 5 или при 30 С при относительной влажности 70%. Пример 1. Получение содержащей типранавир СЭСВЛ-композиции на основе ПЭГ. В смеситель вносили 455 мг Cremophor EL, 75 мг Capmul MCM и 173 мг ПЭГ 400 и смешивали друг с другом (700 об/мин), добавляя при этом 2 мг пропилгаллата в качестве антиоксиданта. Смешение продолжали до тех пор, пока раствор не становился прозрачным, после чего добавляли 15 мг Трис (предварительно растворенного в воде в соотношении 1:2). После добавления типранавира (250 мг) к раствору смешение продолжали при высокой скорости (1600 об/мин). После полного растворения типранавира процесс смешения прекращали и раствору давали выстояться для дегазирования. Пример 2. Биологическая доступность содержащей типранавир самоэмульгируюшейся композиции на основе ПЭГ. Для изучения in vivo биологической доступности при пероральном введении использовали кобелей собак породы бигль. Содержащую типранавир композицию на основе ПЭГ, представленную в табл. 2,после внесения в мягкие желатиновые капсулы сравнивали в опытах на собаках с содержащей пропиленгликоль/этанол композицией, представленной в табл. 1. Было установлено, что биологическая доступность обеих композиций является одинаковой с точки зрения статистики. Были проведены дополнительные исследования стабильности композиции, представленной в табл. 2,заключенной в стандартные мягкие желатиновые капсулы. Результаты этих исследований свидетельствуют о том, что композиция по настоящему изобретению содержит меньшее количество примесей и, повидимому, в результате этого является более стабильной, чем композиция, представленная в табл. 1, в том случае, если они находятся в стандартных мягких желатиновых капсулах. Кроме того, было установлено, что мягкие желатиновые капсулы, содержащие самоэмульгирующуюся композицию по настоящему изобретению, не становятся липкими после хранения в течение 6 месяцев при 30 С и относительной влажности 70%.- 11006759 Хотя изобретение описано со ссылкой на предпочтительные варианты осуществления, специалистам в данной области должно быть очевидно, что можно осуществлять различные изменения и/или модификации изобретения без отклонения от сущности и объема изобретения, которые определяются приведенной ниже формулой изобретения. Все процитированные документы включены во всей их полноте в настоящее описание в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция, содержащая менее чем 0,5% этанола и пропиленгликоля, включающая:(а) пиранон формулы I в качестве обладающего фармацевтической активностью агентаR1 и R2 вместе обозначают двойную связь;het обозначает 5-, 6- или 7-членное насыщенное или ненасыщенное кольцо, содержащее 1-3 гетероатома, выбранных из группы, состоящей из азота, кислорода и серы; и включает любую бициклическую группу, в которой любое из указанных выше гетероциклических колец сконденсировано с бензольным кольцом или другим гетероциклом, необязательно замещенным-СН 3, -CN, -ОН, -С(O)ОС 2 Н 5, -СF3, -NH2 или -C(O)-NH2; или его фармацевтически приемлемую соль;(б) одно или несколько фармацевтически приемлемых поверхностно-активных веществ; и(с) полиэтиленгликоль, имеющий среднюю молекулярную массу более 300, но менее 600, в качестве растворителя. 2. Фармацевтическая композиция по п.1, где соединение формулы I присутствует в количестве от приблизительно 1 до приблизительно 40% в пересчете на массу всей композиции. 3. Фармацевтическая композиция по п.1, дополнительно содержащая основный амин в количестве от приблизительно 0,1 до приблизительно 10% в пересчете на массу всей композиции. 4. Фармацевтическая композиция по п.3, где основный амин представляет собой (низш.)алкиламин,основную аминокислоту или гидроксид холина. 5. Фармацевтическая композиция по п.4, где (низш.)алкиламин выбирают из группы, включающей этаноламин, диэтаноламин, триэтаноламин, этилендиамин, диметиламиноэтанол или трис(гидроксиметил)аминометан. 6. Фармацевтическая композиция по п.1, дополнительно содержащая смесь диглицерида и моноглицеридов в количестве от приблизительно 5 до приблизительно 35% в пересчете на массу всей композиции. 7. Фармацевтическая композиция по п.6, где диглицериды и моноглицериды имеют среднюю длину цепи. 8. Фармацевтическая композиция по п.6, где смесь диглицерида и моноглицеридов представляет собой Capmul MCM. 9. Фармацевтическая композиция по п.6, где диглицерид и моноглицериды представляют собой эфиры моно- или динасыщенных жирных кислот и глицерина, имеющие цепь, содержащую от 8 до 10 атомов углерода. 10. Фармацевтическая композиция по п.1, где пиранон формулы I представляет собой соединение формулы IV 11. Фармацевтическая композиция по п.1, где полиэтиленгликоль присутствует в количестве от приблизительно 10 до приблизительно 40% в пересчете на массу всей композиции. 12. Фармацевтическая композиция по п.11, где полиэтиленгликоль имеет среднюю молекулярную массу приблизительно 400. 13. Фармацевтическая композиция по п.1, где поверхностно-активное вещество присутствует в количестве от приблизительно 20 до приблизительно 60% в пересчете на массу всей композиции. 14. Фармацевтическая композиция по п.13, где поверхностно-активное вещество представляет собой полиоксил(40)-гидрогенизированное касторовое масло, полиоксил(35)-касторовое масло, Solutol HS-15,Tagat TO, пегликоль 6-олеат, полиоксиэтиленстеараты, полоксамеры, полисорбаты или насыщенные полигликолизированные глицериды. 15. Фармацевтическая композиция по п.14, где полиоксил(35)-гидрогенизированное касторовое масло представляет собой Cremophor EL или Cremophor EL-P. 16. Фармацевтическая композиция, содержащая менее чем 0,5% этанола и пропиленгликоля, включающая: в количестве от приблизительно 1 до приблизительно 40% в пересчете на массу всей композиции;(б) липофильную фазу, составляющую от приблизительно 5 до приблизительно 35% в пересчете на массу всей композиции;(в) полиэтиленгликоль со средней молекулярной массой более приблизительно 300, но менее приблизительно 600 в количестве от приблизительно 10 до приблизительно 40% в пересчете на массу всей композиции;(г) поверхностно-активное вещество, выбранное из группы, включающей полиоксилированное касторовое масло, полиоксиэтиленглицеринтририцинолеат и насыщенный полигликолизированный каприловый-каприновый глицерид, в количестве от приблизительно 20 до приблизительно 60% в пересчете на массу всей композиции; и(д) основной амин, выбранный из группы, включающей (низш.)алкиламин, основную аминокислоту или гидроксид холина, где указанный основный амин присутствует в количестве от приблизительно 0,1 до приблизительно 10% в пересчете на массу всей композиции. 17. Фармацевтическая композиция по п.16, где липофильная фаза представляет собой смесь диглицеридов и моноглицеридов. 18. Фармацевтическая композиция по п.16, где липофильная фаза представляет собой смесь диглицеридов и моноглицеридов со средней длиной цепи. 19. Фармацевтическая композиция, содержащая менее чем 0,5% этанола и пропиленгликоля, включающая пиранон формулы IV в количестве от приблизительно 1 до приблизительно 40% в пересчете на массу всей композиции;(б) липофильную фазу, выбранную из группы, включающей Capmul МСМ, Labrafil М-1944 CS, Myglol-812 и их смеси, где липофильная фаза присутствует в количестве от приблизительно 5 до приблизительно 35% в пересчете на массу всей композиции;(в) полиэтиленгликоль со средней молекулярной массой более приблизительно 300, но менее приблизительно 600 в количестве от приблизительно 10 до приблизительно 40% в пересчете на массу всей композиции;(г) поверхностно-активное вещество, выбранное из группы, включающей полиоксилированное касторовое масло, полиоксиэтиленглицеринтририциноолеат и насыщенный полигликолизированный каприловый-каприновый глицерид, в количестве от приблизительно 20 до приблизительно 60% в пересчете на массу всей композиции. 20. Композиция по п.19, дополнительно содержащая основный амин, выбранный из группы, включающей (низш.)алкиламин, основную аминокислоту или гидроксид холина, где указанный основный амин присутствует в количестве от приблизительно 0,1 до приблизительно 10% в пересчете на массу всей композиции. 21. Композиция по п.19, находящаяся в жидкой форме, которой можно заполнять мягкие эластичные капсулы. 22. Композиция по п.19, находящаяся в жидкой форме, которой можно заполнять твердые желатиновые или нежелатиновые капсулы.
МПК / Метки
МПК: A61K 31/366, A61K 31/4433, A61P 31/18, A61K 9/107
Метки: протеазы, композиции, класса, лекарственные, пиранонов, ингибиторов, самоэмульгирующиеся, пероральные
Код ссылки
<a href="https://eas.patents.su/17-6759-peroralnye-lekarstvennye-samoemulgiruyushhiesya-kompozicii-ingibitorov-proteazy-iz-klassa-piranonov.html" rel="bookmark" title="База патентов Евразийского Союза">Пероральные лекарственные самоэмульгирующиеся композиции ингибиторов протеазы из класса пиранонов</a>
Предыдущий патент: Каталитическое лигноцеллюлозное топливо
Следующий патент: Фармацевтическая форма, ее применение и способ изготовления
Случайный патент: Модульное устройство для хранения, собираемое на месте












